Nama : Muhammad Luthfi
Tempat, Tanggal Lahir : Lhokseumawe, 5 November 1994
Agama : Islam
Alamat : Jln. Dr. Hamzah No. 4
(Samping Mesjid Dakwah Kampus USU) Medan Baru, Medan – 20154
Riwayat Pendidikan :
1. TK RA Nurul Hilal Bireuen (1998-2000)
2. SD Negeri 21 Bireuen (2000-2003 & 2004-2006) 3. SD Sekolah Indonesia Bangkok (2003-2004) 4. SMP Negeri 1 Bireuen (2006-2009)
5. SMAS Fatih Bilingual School Banda Aceh (2009-2012) 6. Fakultas Kedokteran USU Medan (2012-sekarang)
1. Aspirin
Dosis aspirin yang digunakan pada manusia adalah 80 mg per hari. Adapun konversi dosis pada manusia dengan berat 70 kg ke mencit 20 gram adalah 0,0026 (Laurence & Bacharach, 1964).
Perhitungan dosis konversi:
80 mg/hari x 0,0026 : 20 x 1000 = 10,4 mg/kgBB mencit/hari
Dosis aspirin untuk mencit : 10,4 mg/kgBB mencit/hari.
2. Propolis
Dosis propolis yang digunakan pada manusia adalah 500 mg per hari. Adapun konversi dosis pada manusia dengan berat 70 kg ke mencit 20 gram adalah 0,0026 (Laurence & Bacharach, 1964).
Perhitungan dosis konversi:
500 mg x 0,0026 : 20 x 1000 = 65 mg/kgBB mencit/hari
(Laurence & Bacharach, 1964). Perhitungan dosis konversi:
520 mg/hari x 0,0026 : 20 x 1000 = 68 mg/kgBB mencit/hari
Dosis bee pollen untuk mencit : 68 mg/kgBB mencit/hari.
DAFTAR PUSTAKA
Baigent, C., Sudlow, C., Collins, R. & Peto, R., 2002. Collaborative Meta-Analysis of Randomised Trials of Antiplatelet Therapy for Prevention of Death, Myocardial Infarction, and Stroke in High Risk Patients. British Medical Journal, Volume 324, pp. 71-86.
Bankova, V. S., Castro, S. L. D. & Marcucci, M. C., 2000. Propolis: Recent Advances in Chemistry and Plant Origin. Apidologie, Volume 31, pp. 3-15.
Barrett, K. E., Boitano, S., Barman, S. M. & Brooks, H. L., 2012. Ganong's Review of Medical Physiology. 24th ed. New York: McGraw-Hill.
Burdock, G. A., 1998. Review of the Biological Properties and Toxicity of Bee Propolis (Propolis). Food and Chemical Toxicology, Volume 36, pp. 347-363.
Castro, S. L. D., 2001. Propolis: Biological and Pharmacological Activities. Therapeutic Uses of this Bee-product. ARBS Annual Review of Biomedical Sciences, Volume 3, pp. 49-83.
Chen, T.-G.et al., 2007. Antiplatelet Activity of Caffeic Acid Phenethyl Ester is Mediated through a Cyclic GMP-Dependent Pathway in Human Platalets. Chinese Journal of Physiology, 50(3), pp. 121-126.
Colvin, B., 2004. Physiology of Haemostasis. Vox Sanguinis, 87(Suppl. 1), pp. 43-46. Corazzi, T. et al., 2005. Direct and Irreversible Inhibition of Cyclooxygenase-1 by Nitroaspirin (NCX 4016). The Journal of Pharmacology and Experimental Therapeutics, 315(3), pp. 1331-1337.
Doutremepuich, C., Aguejouf, O., Desplat, V. & Eizayaga, F. X., 2011. Paradoxical Effect of Aspirin. Thrombosis, Volume 2012.
Farnesi, A. P. et al., 2009. Effects of Stingless Bee and Honey Bee Propolis on Four Species of Bacteria. Genetics and Molecular Research, 8(2), pp. 635-640.
Ganong, W. F., 2008. Buku Ajar Fisiologi Kedokteran. 22 ed. Jakarta: Penerbit Buku Kedokteran EGC.
Ghoshal, K. & Bhattacharyya, M., 2014. Overview of Platelet Physiology: Its Hemostatic and Nonhemostatic Role in Disease Pathogenesis. The Scientific World Journal, pp. 1- 16.
Gryglewski, R. J., Botting, R. M. & Vane, J. R., 1988. Mediators Produced by the Endothelial Cell. Hypertension, Volume 12, pp. 530-548.
Guyton, A. C. & Hall, J. E., 2006. Textbook of Medical Physiology. 11th ed. Philadelphia: Elsevier Inc.
Hsiao, G. et al., 2007. Vharacterization of a Novel and Potent Collagen Antagonist, Caffeic Acid Phenethyl Ester, in Human Platelets: in vitro and in vivo Studies. Cardiovascular Research, Volume 75, pp. 782-792.
Katzung, B. G. ed., 2012. In: Farmakologi Dasar & Klinik. Jakarta: Penerbit Buku Kedokteran EGC.
Liu, Y., Jennings, N. L., Dart, A. M. & Du, X.-J., 2012. Standardizing a simpler, more sensitive and accurate tail bleeding assay in mice. World Journal of Experimental Medicine, 2(2), pp. 30-36.
Munnix, I. C., Cosemans, J. M., Auger, J. M. & Heemskerk, J. W., 2009. Platelet Response Heterogenity in Thrombus Formation. Thromb Haemost, Volume 102, pp. 1149-1156. Palta, S., Saroa, R. & Palta, A., 2014. Overview of the Coagulation System. Indian Journal of Anaesthesia, 58(5), pp. 515-523.
Patrono, C. et al., 2004. Platelet-Active Drugs: The Relationships Among Dose, Effectiveness, and Side Effects. CHEST, Volume 126, pp. 234S-264S.
Peters, R. J. et al., 2003. Effects of Aspirin Dose When Used Alone or in Combination with Clopidogrel in Patients with Acute Coronary Syndromes. Circulation, Volume 108, pp. 1682-1687.
Purohit, A., Joshi, K., Kotru, B. & Kotru, S., 2013. Effect of Indian Propolis on Hematological Parameters in Experimentally Induced Hyperlipidemic Male Albino Rabbits. Asian Journal of Pharmaceutical and Clinical Research, 6(1), pp. 17-19. Rodvien, R. & Mielke, Jr., C. H., 1976. Role of Platelets in Hemostasis and Thrombosis. The Western Journal of Medicine, Volume 125, pp. 181-186.
Sheu, J. R. et al., 2004. Mechanisms involved in the antiplatelet activity of rutin, a glycoside of the flavonol quercetin, in human platelets. Journal of Agricultural and Food Chemistry , 52(14), pp. 4414-4418.
Szczesna, T., 2006. Long-Chain Fatty Acids Composition of Honeybee-Collected Pollen. Journal of Apicultural Science, 50(2), pp. 65-79.
Thornton, P. & Douglas, J., 2010. Coagulation in Pregnancy. Best Practice and Research. Clinical Obstetrics & Gynaecology, 24(3), pp. 339-352.
Vane, J. R., 1971. Inhibition of prostaglandin synthesis as a mechanism of action for aspirin- like drugs. Nature New Biology, 231(25), pp. 232-235.
Verkerk, R., 2009. Can The Failing Western Medical Paradigm be Shifted Using the Principle of Sustainability. ACNEM Journal, Volume 28, pp. 4-10.
Wagh, V. D., 2013. Propolis: A Wonder Bees Product and Its Parmacological Potentials. Advances in Pharmacological Sciences, pp. 1-11.
BAB 3
KERANGKA KONSEP DAN DEFINISI OPERASIONAL
3.1. Kerangka Konsep Penelitian
Berdasarkan tujuan penelitian yang telah dipaparkan sebelumnya, maka kerangka konsep dalam penelitian ini adalah :
Variabel Independen Variabel dependen
3.2. Definisi Operasional 3.2.1. Definisi
Aspirin adalah obat dalam kelompok salisilat dan merupakan salah satu jenis
dari obat antiplatelet.
Propolis adalah produk resin sarang lebah yang mengandung cairan
tumbuhan yang bercampur dengan lilin yang dihasilkan oleh lebah dan oleh lebah digunakan sebagai perekat.
Bee Pollen adalah serbuk sari bunga jantan yang diambil oleh lebah dan
digunakan sebagai makanan pokok dari seluruh koloni lebah madu.
Waktu perdarahan pada mencit diukur dengan menggunakan Metode Tail
Bleeding. Ekor mencit dipotong menggunakan pisau bedah, kemudian
dihitung waktu mulai dari darah pertama menetes hingga tetesan darah berhenti. Darah diisap menggunakan kertas saring/kertas tissue dengan tanpa menyentuh bagian ekor yang terluka.
Pemberian Aspirin, Propolis, dan Bee Pollen sebagai antiplatelet
3.2.2. Cara Ukur
Menggunakan Metode Tail Bleeding
3.2.3. Alat Ukur
Pisau bedah (scalpel)
Kapas alkohol
Kertas saring/kertas tissue
Stopwatch
3.2.4. Skala Pengukuran Rasio
3.3. Hipotesis
1. Waktu perdarahan pada ekor mencit dengan pemberian Propolis lebih panjang atau sama dengan pemberian Aspirin
BAB 4
METODE PENELITIAN
4.1. Jenis dan Rancangan Penelitian
Penelitian ini merupakan penelitian eksperimental dengan desain penelitian randomized post test only control group design dengan teknik single-blind. Penelitian
menggunakan hewan coba yang dibagi menjadi 4 kelompok.
K2 = Kelompok perlakuan dengan pemberian Aspirin per oral selama 12 hari K3 = Kelompok perlakuan dengan pemberian Propolis per oral selama 12 hari K4 = Kelompok perlakuan dengan pemberian Bee Pollen per oral selama 12 hari O1 = Hasil pengamatan kelompok kontrol (-)
O2 = Hasil pengamatan kelompok perlakuan dengan pemberian Aspirin O3 = Hasil pengamatan kelompok perlakuan dengan pemberian Propolis O4 = Hasil pengamatan kelompok perlakuan dengan pemberian bee pollen
4.2. Waktu dan Lokasi Penelitian
Penelitian ini akan dilakukan di Laboratorium Farmakologi Departemen Farmakologi dan Terapetik Fakultas Kedokteran Universitas Sumatera Utara. Penelitian direncanakan dimulai pada September – Desember 2015. Penelitian akan dilakukan setelah mendapat persetujuan Ethical Clearance dari Komisi Etik Fakultas Kedokteran Universitas Sumatera Utara.
4.3. Populasi dan Sampel Penelitian
Pada penelitian ini akan digunakan mencit jantan (mus musculus), galur Double Distsch Webster umur : 2-3 bulan (dewasa), berat badan 20-30 gram, sehat, belum pernah digunakan untuk penelitian lain. Mencit diperoleh dari Laboratorium FMIPA Biologi USU Medan. Jumlah hewan coba perkelompok ditentukan dengan rumus menurut Federer (1963), sebagai berikut:
Keterangan : n = besar sampel
t = jumlah kelompok hewan coba
Maka besar sampel yang dibutuhkan adalah :
Berdasarkan rumus Federer tersebut, dibutuhkan sampel sebanyak minimal 6 ekor hewan coba pada masing-masing kelompok. Dengan penambahan perkiraan drop out sebesar 10%, maka besar sampel minimal yang diperlukan untuk tiap kelompok
adalah 7 hewan coba.
(t-1)(n-1) ≥ 15
Berdasarkan jumlah sampel minimal yang diperbolehkan secara statistik dan tidak melanggar prinsip 3 R ( Reduction, Replacement, Refinement ) dalam penelitian hewan coba, maka jumlah sampel yang diambil menjadi 8 ekor untuk tiap-tiap kelompok. Jadi jumlah seluruh hewan coba yang dibutuhkan sebanyak 32 ekor.
Pemilihan sampel dan pengelompokannya dilakukan menggunakan randomisasi sederhana (simple random sampling), dimana pada setiap 32 ekor sampel yang memenuhi kriteria inklusi yang telah ditentukan akan diberi nomor, untuk kemudian dibagi menjadi 4 kelompok yang sama besar dengan bantuan program komputer (https://www.randomizer.org/)
4.4. Kriteria Inklusi, Eksklusi dan Drop Out 4.4.1. Kriteria Inklusi :
1. Mencit (mus musculus) galur Double Distsch Webster, jantan, umur : 2-3 bulan, berat badan : 20-30 gram.
2. Mencit sehat, bergerak aktif, dan berasal dari kelompok yang sama.
4.4.2. Kriteria Eksklusi
1. Mencit sebelumnya telah mendapatkan intervensi obat.
4.4.3. Kriteria Drop Out
1. Mencit mati dalam periode penelitian.
4.5. Cara Kerja dan Alur Penelitan 4.5.1. Pengambilan Bahan
Pada Penlitian ini bahan-bahan produk perlebahan yang digunakan adalah :
Aspirin (@ BAYER)
Propolis (@ High Desert Indonesia - HDI)
4.5.2. Persiapan dan Pemeliharaan hewan Coba
Sebelum penelitian dilakukan, adaptasi hewan di lokasi dengan cahaya 12 jam siklus jadwal gelap, diet yang standar yaitu makan dan minum ad libitum. Makanan yang dikonsumsi berasal dari Charoen Pokhpand. Hewan coba dipelihara dalam suhu 25 ± 10 º C, kelembaban relatif 60 %. Mencit dipelihara selama masa penelitian, berat badan ditimbang sebelum dan sesudah percobaan.
4.5.3. Cara Kerja
Mencit jantan (mus musculus) jantan, galur DDW, sehat ,badan : 20-30 gram, dibagi menjadi 4 kelompok :
1. Mencit normal sebagai kontrol (-)
2. Mencit dengan pemberian Aspirin namun tidak diberi intervensi (kontrol +) 3. Mencit dengan pemberian Propolis per oral selama 12 hari
4. Mencit dengan pemberian Bee Pollen per oral selama 12 hari
Dilakukan pemberian pada mencit mulai hari pertama penelitian pendahuluan selama 12 hari menurut Tabel Dosis Konversi.
Dosis pemberian :
1. Aspirin : 10,4 mg/kgBB mencit/hari 2. Propolis : 65 mg/kgBB mencit/hari 3. Bee Pollen : 68 mg/kgBB mencit/hari
Setelah 12 hari, seluruh hewan coba mencit dilakukan pengukuran dengan Metode Tail Bleeding sebagai berikut :
1. Bersihkan daerah yang akan dilakukan insisi (ekor mencit) dengan kapas alkohol.
4.6. Analisis Data
Data yang didapat akan dianalisis dengan ANOVA searah menggunakan program komputer bila data parametrik terdistribusi normal. Apabila data tidak terdistribusi normal maka data yang diambil non parametrik dan diuji dengan Kruskall-Wallis. Suatu perbedaan dinyatakan signifikan bila p < 0.05.
BAB 5
HASIL PENELITIAN DAN PEMBAHASAN
5.1. Hasil Penelitian
5.1.1.Deskripsi Lokasi Penelitian
Penelitian dilakukan di Laboratorium Farmakologi, Departemen Farmakologi dan Terapeutik Fakultas Kedokteran Universitas Sumatera Utara (FK USU), Medan. Lokasi ini dipilih dengan mempertimbangkan kelengkapan sarana dan fasilitas pendukung yang cukup baik untuk menunjang keberhasilan dari penelitian ini. Penelitian dilaksanakan di ruang Laboratorium Farmakologi yang terletak di lantai 1 gedung Farmakologi Fakultas Kedokteran Universitas Sumatera Utara. Gedung Farmakologi Universitas Sumatera Utara berada di Jalan Universitas No. 1, Kampus Universitas Sumatera Utara, Kelurahan Padang Bulan, Kecamatan Medan Baru, Medan dengan batas wilayah :
Batas Utara : Gedung Abdul Hakim Fakultas Kedokteran Universitas Sumatera Utara. Batas Selatan : Departemen Ilmu Gizi Fakultas Kedokteran Universitas Sumatera Utara Batas Timur : Jalan Universitas, Kampus Universitas Sumatera Utara.
Batas Barat : Fakultas Keperawatan Universitas Sumatera Utara.
5.1.2.Karakteristik Sampel dan Analisa Deskriptif Hasil Penelitian
Dalam penelitian ini, sampel yang digunakan adalah 32 ekor mencit jantan galur Double Distsch Webster (DDW). Kemudian sampel dibagi menjadi 4 kelompok secara
kelompok dengan pemberian propolis, dan kelompok dengan pemberian bee pollen dapat dilihat pada Tabel 5.1 di bawah ini.
Tabel 5.1. Rerata Waktu Perdarahan pada Empat Kelompok Sampel dalam waktu perdarahan terpanjang adalah kelompok dengan pemberian Aspirin, yaitu 442,9±171,9 detik. Sedangkan kelompok dengan rerata waktu perdarahan terpendek adalah kelompok plasebo atau kelompok dengan tanpa pemberian, yaitu 106,1±33,6 detik.
Gambar 5.1. Grafik Waktu Perdarahan Berdasarkan Kelompok Pemberian
5.1.3.Uji Normalitas Data
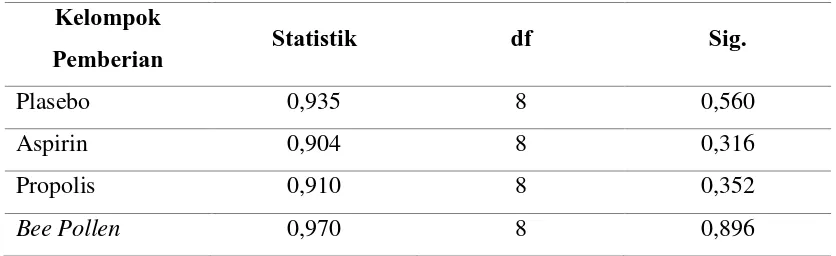
Pada penelitian ini, uji normalitas yang digunakan adalah uji Shapiro-Wilk. Data dinyatakan terdistribusi normal jika p value > 0,05 dan dinyatakan tidak terdistribusi normal jika p value < 0,05. Hasil komputasi uji normalitas pada penelitian ini dapat dilihat pada tabel 5.2 di bawah.
Tabel 5.2. Normalitas Data pada Empat Kelompok Pemberian dengan Uji
Shapiro-Wilk
Kelompok
Pemberian Statistik df Sig.
Plasebo 0,935 8 0,560
Aspirin 0,904 8 0,316
Propolis 0,910 8 0,352
Bee Pollen 0,970 8 0,896
Berdasarkan hasil komputasi uji normalitas pada Tabel 5.2, diperoleh nilai signifikansi untuk kelompok plasebo sebesar 0,560, untuk kelompok dengan pemberian Aspirin sebesar 0,316, untuk kelompok dengan pemberian Propolis sebesar 0,352, dan untuk kelompok Bee Pollen sebesar 0,896. Karena nilai signifikansi pada keempat kelompok pemberian lebih besar dari 0,05, maka dapat disimpulkan bahwa data terdistribusi normal.
5.1.4.Uji Homogenitas Data
adalah sama (homogen). Hasil komputasi uji homogenitas pada penelitian ini dapat dilihat pada Tabel 5.3 di bawah.
Tabel 5.3. Homogenitas Data pada Empat Kelompok Pemberian Levene
Statistic df1 df2 Sig.
2,805 3 28 0,058
Berdasarkan hasil komputasi uji homogenitas pada tabel di atas, diperoleh p value sebesar 0,058, dimana 0,058 > 0,05. Dari hasil tersebut dapat diketahui bahwa empat kelompok populasi data pada penelitian ini memiliki varian yang sama (homogen) sehingga memenuhi asumsi yang mendasari ANOVA.
5.1.5.Uji Komparabilitas
Uji komparabilitas bertujuan membandingkan rerata waktu perdarahan pada kelompok plasebo, kelompok dengan pemberian Aspirin, kelompok dengan pemberian Propolis, dan kelompok dengan pemberian Bee Pollen. Berdasarkan hasil uji normalitas dan homogenitas, data pada penelitian ini diketahui terdistribusi normal dan memiliki varian yang sama (homogen), maka analisis komparatif yang digunakan adalah uji untuk data parametrik yaitu One Way ANOVA. Hasil analisis dengan uji One Way ANOVA disajikan pada Tabel 5.4 di bawah.
Tabel 5.4. Uji One Way ANOVA Rerata Waktu Perdarahan Kelompok
Subjek df F Sig.
Antara kelompok 3
15,397 0,000
Berdasarkan hasil pada tabel di atas, didapatkan nilai p value sebesar 0,000. Oleh karena itu, maka dapat disimpulkan bahwa terdapat perbedaan rerata waktu perdarahan pada keempat kelompok pemberian (p<0,05).
5.1.6.Uji Lanjutan (Post Hoc Test)
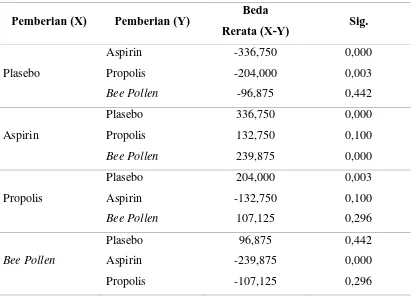
Karena hasil uji ANOVA menunjukkan adanya perbedaan yang bermakna, maka selanjutnya dilakukan uji untuk melihat kelompok mana saja yang berbeda. Berdasarkan uji homogenitas yang telah dilakukan sebelumnya dapat diketahui bahwa kelompok populasi data pada penelitian ini memiliki varian yang sama, sehingga uji lanjutan (Post Hoc Test) yang digunakan adalah uji Bonferroni. Hasil komputasi uji lanjutan pada penelitian ini disajikan pada Tabel 5.5 di bawah.
Tabel 5.5. Uji Lanjutan Bonferroni
Pemberian (X) Pemberian (Y) Beda
Hasil komputasi uji lanjutan di atas menunjukkan bahwa :
1. Rerata waktu perdarahan kelompok plasebo berbeda secara bermakna dengan kelompok Aspirin (p<0,05) dengan rerata kelompok Aspirin lebih tinggi daripada rerata kelompok plasebo.
2. Rerata waktu perdarahan kelompok plasebo berbeda secara bermakna dengan kelompok Propolis (p<0,05) dengan rerata kelompok Propolis lebih tinggi daripada rerata kelompok plasebo.
3. Rerata waktu perdarahan kelompok plasebo tidak berbeda dengan kelompok Bee Pollen (p>0,05) tetapi rerata kelompok Bee Pollen lebih tinggi daripada
rerata kelompok plasebo.
4. Rerata waktu perdarahan kelompok Aspirin tidak berbeda dengan kelompok Propolis (p>0,05) tetapi rerata kelompok Aspirin lebih tinggi daripada rerata kelompok Propolis.
5. Rerata waktu perdarahan kelompok Aspirin berbeda secara bermakna dengan kelompok Bee Pollen (p<0,05) dengan rerata kelompok Aspirin lebih tinggi daripada rerata kelompok Bee Pollen.
6. Rerata waktu perdarahan kelompok Propolis tidak berbeda dengan kelompok Bee Pollen (p>0,05) tetapi rerata kelompok Propolis lebih tinggi daripada
rerata kelompok Bee Pollen.
5.2. Pembahasan
Pada kelompok dengan pemberian Aspirin selama 12 hari sebelum perlakuan, rerata waktu perdarahan adalah 442,9±171,9 detik dan merupakan rerata yang tertinggi dibandingkan ketiga kelompok lainnya. Hasil ini sejalan dengan penelitian yang dilakukan oleh Doutremepuich, et al. (2011), dimana rerata waktu perdarahan pada mencit dengan pemberian aspirin juga mengalami pemanjangan yang signifikan secara statistik, yaitu 363,3±93,3 detik. Pemanjangan ini diakibatkan oleh mekanisme kerja Aspirin yaitu menyebabkan inhibisi COX1 secara ireversibel, yang selanjutnya menyebabkan penurunan produksi TXA2 di dalam platelet. Efek ini akan bertahan selama 10 hari (Vane, 1971). Pada tabel 5.5 juga terlihat bahwa terdapat perbedaan yang bermakna antara kelompok Aspirin dengan kelompok plasebo (p<0,05) dimana terdapat pemanjangan rerata waktu perdarahan pada kelompok Aspirin. Hal ini membuktikan efektivitas dari Aspirin sebagai agen antiagregasi platelet standar.
Rerata waktu perdarahan kelompok dengan pemberian Propolis berdasarkan Tabel 5.1 adalah 310,1±91 detik. Dibandingkan kelompok plasebo, rerata waktu perdarahan kelompok Propolis ini mengalami pemanjangan secara signifikan (p<0,05) dengan beda rerata 204 detik. Selain itu juga tidak terdapat perbedaan yang bermakna antara rerata waktu perdarahan kelompok Propolis dan rerata kelompok Aspirin sebagai antiagregasi platelet standar (p>0,05) dengan perbedaan rerata 132,8 detik seperti yang terlihat pada tabel 5.5. Hal ini menunjukkan bahwa pada penelitian ini, pemberian Propolis dengan dosis 65 mg/kgBB mencit/hari terbukti secara statistik dapat memperpanjang waktu perdarahan pada mencit.
kolagen pada reseptornya di membran platelet, pada akhirnya akan memperpanjang waktu terbentuknya sumbatan platelet (Hsiao, et al., 2007). Karena keterlibatan CAPE dalam inhibisi proses agregasi platelet menurut beberapa penelitian memiliki mekanisme yang bervariasi, Propolis diperkirakan memiliki aktivitas antiagregasi platelet yang cukup menjanjikan (Purohit, et al., 2013).
Hasil uji lanjutan pada Tabel 5.5 menunjukkan bahwa rerata waktu perdarahan pada kelompok Bee Pollen ternyata tidak mengalami perbedaan yang bermakna secara statistik dibandingkan dengan kelompok plasebo (p>0,05), walaupun rerata waktu perdarahan pada kelompok Bee Pollen (203±67 detik) masih lebih panjang dibandingkan rerata kelompok plasebo (106,1±33,6 detik) dengan beda rerata 96,9 detik. Namun demikian, dari hasil uji secara statistik tetap dapat disimpulkan bahwa pemberian Bee Pollen tidak mempunyai efek terhadap pemanjangan waktu perdarahan. Hal ini juga sejalan dengan hasil komputasi yang menunjukkan terdapatnya perbedaan rerata waktu perdarahan kelompok Bee Pollen dan rerata kelompok Aspirin (p<0,05) sebagai agen antiagregasi platelet standar dengan rerata kelompok Aspirin lebih tinggi 239,9 detik.
protein kinase C dan pembentukan tromboksan A2 yang selanjutnya akan menghambat fosforilasi P47 dan mobilisasi Ca2+ intraseluler, sehingga pada akhirnya menghasilkan efek inhibisi terhadap agregasi platelet (Sheu, et al., 2004). Namun menurut Komosinska-Vassev, et al. (2015), kandungan rutin bersama dengan asam-asam lainnya : pantotenat, nikotinat dan folat, biotin, serta inositol secara total hanya menyusun sekitar 0,7% dari komposisi Bee Pollen.
Pada penelitian ini, dosis Bee Pollen yang diberikan adalah 68 mg/kgBB mencit/hari. Dengan komposisi rutin yang relatif sedikit, mungkin dibutuhkan dosis pemberian Bee Pollen yang lebih tinggi untuk dapat mencapai efek antiagregasi platelet seperti yang diharapkan yaitu terdapat perbedaan rerata waktu perdarahan yang signifikan saat dibandingkan dengan kelompok plasebo.
BAB 6
KESIMPULAN DAN SARAN
6.1. Kesimpulan
Berdasarkan hasil penelitian yang dilakukan mengenai perbandingan efektivitas Aspirin, Propolis, dan Bee Pollen sebagai antiplatelet berdasarkan waktu perdarahan pada mencit, dapat ditarik beberapa kesimpulan sebagai berikut :
1. Terdapat perbedaan yang signifikan antara rerata waktu perdarahan pada kelompok pemberian Propolis dan kelompok plasebo (p=0,003, p<0,05) dengan rerata kelompok Propolis lebih tinggi 204 detik. Hal ini menunjukkan bahwa secara statistik dapat dibuktikan adanya pemanjangan waktu perdarahan pada ekor mencit setelah pemberian Propolis.
2. Rerata waktu perdarahan pada kelompok pemberian Propolis adalah 310,1±91 detik, sementara rerata waktu perdarahan pada kelompok pemberian Aspirin adalah 442,9±171,9 detik. Tidak terdapat perbedaan yang signifikan antara rerata waktu perdarahan pada kedua kelompok (p=0,100, p>0,05). Berdasarkan
hal ini, hipotesis peneliti yang menyatakan bahwa “waktu perdarahan pada ekor
mencit dengan pemberian propolis lebih panjang atau sama dengan pemberian aspirin” dapat diterima.
3. Rerata waktu perdarahan pada kelompok pemberian Bee Pollen adalah 203±67 detik, sementara rerata waktu perdarahan pada kelompok plasebo adalah 106,1±33,6 detik. Tidak terdapat perbedaan yang signifikan antara rerata waktu perdarahan pada kedua kelompok (p=0,442, p>0,05). Berdasarkan hal ini,
hipotesis peneliti yang menyatakan bahwa “Waktu perdarahan pada ekor
mencit dengan pemberian Bee Pollen lebih panjang dibandingkan dengan
secara statistik, namun rerata waktu perdarahan pada kelompok pemberian Bee Pollen lebih panjang 96,9 detik dibandingkan rerata kelompok plasebo.
6.2. Saran
Beberapa hal yang dapat disarankan berdasarkan hasil penelitian yang telah dilakukan antara lain :
1. Melihat hasil penelitian ini yang membuktikan adanya efek antiplatelet dari Propolis terhadap memanjangnya waktu perdarahan pada mencit, diharapakan supaya penelitian ini dapat terus dikembangkan untuk dapat digunakan sebagai agen antiagregasi platelet pada manusia dengan didukung oleh bukti-bukti ilmiah yang valid.
2. Untuk efek antiagregasi platelet dari Bee Pollen, diharapkan adanya penelitian lebih lanjut pada hewan coba dengan jumlah sampel hewa coba yang lebih besar dan dosis yang lebih tinggi untuk dapat mencapai hasil yang diharapkan. 3. Secara keseluruhan, untuk penelitian selanjutnya agar dapat menggunakan
BAB 2
TINJAUAN PUSTAKA
2.1. Hemostasis dan Platelet 2.1.1. Hemostasis
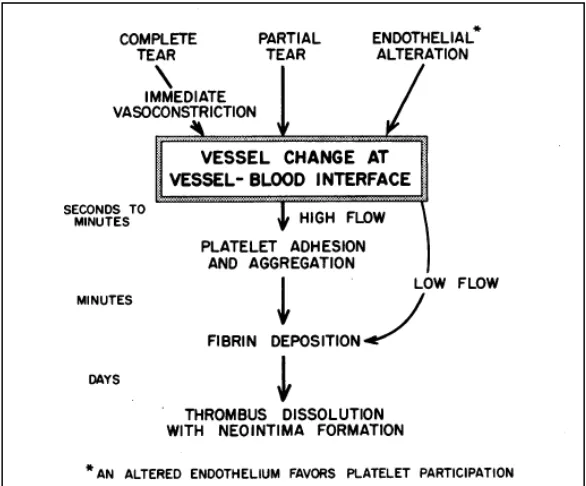
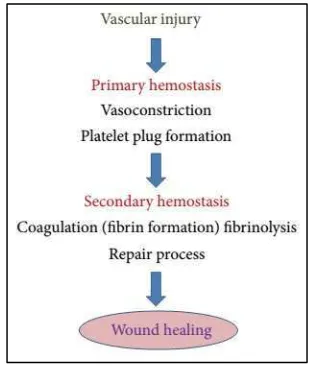
Istilah hemostasis berarti mencegah terjadinya kehilangan darah (Guyton & Hall, 2006). Secara lebih spesifik, hemostasis merupakan proses pembentukan gumpalan darah (blood clot) pada dinding pembuluh darah yang mengalami kerusakan dan berguna untuk mencegah terjadinya kehilangan darah sementara tetap mempertahankan darah dalam kondisi cair di dalam sistem vaskuler. Sekumpulan mekanisme kompleks yang saling berhubungan bekerja untuk menjaga keseimbangan antara proses koagulasi dan antikoagulasi (Barrett, et al., 2012).
Proses hemostasis terjadi dengan melibatkan interaksi yang kompleks dari dinding pembuluh darah, platelet, sistem koagulasi, dan fibrinolisis (Thornton & Douglas, 2010). Hemostasis dapat dicapai dengan beberapa cara : konstriksi pembuluh darah, pembentukan sumbatan platelet, pembentukan blood clot akibat terjadinya penggumpalan darah, dan yang terakhir terbentuknya jaringan fibrosa pada gumpalan darah tadi untuk menutup daerah yang rusak pada pembuluh secara permanen (Guyton & Hall, 2006). Walaupun terkesan rumit dan seolah bertahap, interaksi komponen hemostasis ini sebenarnya saling berpaut dan berkerja secara efisien untuk menghentikan perdarahan (Rodvien & Mielke, Jr., 1976).
diphosphate) dan menyebabkan platelet-platelet yang lain ikut melepaskan lebih
banyak ADP, sehingga terjadilah agregasi platelet yang pada akhirnya membentuk sumbatan platelet (Rodvien & Mielke, Jr., 1976). Sumbatan platelet ini sangat efektif untuk mencegah terjadinya kehilangan darah pada pembuluh darah dengan diameter yang relatif kecil. Terbentuknya benang-benang fibrin pada tahapan pengumpalan darah selanjutnya akan membuat sumbatan platelet ini menjadi lebih kuat. Sumbatan platelet sendiri dapat menghentikan perdarahan secara sempurna jika kerusakan yang terjadi pada pembuluh darah tidak mencakup area yang terlalu luas (Tortora, 2009).
Selanjutnya, proses pembentukan gumpalan atau sumbatanan sekunder secara definitif dilakukan oleh suatu proses yang disebut jalur koagulasi. Pada jalur ini, interaksi sejumlah protein yang dikenal sebagai faktor penggumpalan bersama dengan platelet dan jaringan berkerja untuk membentuk jaring (benang-benang) fibrin yang menstabilkan gumpalan darah. Secara klasik, proses ini terjadi dalam dua jalur yaitu intrinsik dan ekstrinsik dimana terdapat perbedaan pada inisiasinya walaupun sebenarnya kedua jalur ini berkerja secara paralel (Palta, et al., 2014).
Ketika proses perbaikan dinding pembuluh darah selesai dan pada akhirnya digantikan oleh jaringan fibrosa, gumpalan yang telah terbentuk juga akan menghilang. Proses pembersihan gumpalan ini berlangsung paralel dengan pembentukannya sehingga berfungsi juga untuk membatasi ukuran gumpalan. Plasminogen yang terjebak dalam gumpalan darah nantinya akan diaktifkan oleh aktivatornya (tPA atau u-PA) menjadi plasmin yang memiliki kemampuan untuk mengurai bekuan fibrin menjadi FDP (fibrin degradation product) dan D-dimer (Colvin, 2004).
Sebagai kesimpulan, hemostasis adalah suatu proses fisiologis yang kompleks untuk mempertahankan tingkat fluiditas darah melalui mekanisme koagulasi dan antikoagulasi yang ada dalam tubuh. Ketidakseimbangan dari dua komponen ini merupakan penyebab terjadinya perdarahan atau trombosis. Proses ini perlu dimengerti untuk dapat memperkirakan konsekuensi patologis dan klinis sebelum diimplementasikannya suatu intervensi farmakologis (Palta, et al., 2014).
Gambar 2.1. Respon alami darah terhadap perubahan pada dinding pembuluh darah
2.1.2. Platelet
Platelet, atau juga dikenal dengan trombosit, adalah sel-sel bergranula yang bersirkulasi dan merupakan mediator penting pada proses hemostasis karena membentuk agregat di tempat cedera pembuluh darah. Sel ini tidak memiliki nukleus dan berdiameter 2-4 µm. Jumlahnya sekitar 300.000/µ L darah dan pada keadaan normal mempunyai waktu-paruh sekitar 4 hari. Megakariosit, yaitu sel raksasa di sumsum tulang, membentuk platelet dengan cara mengeluarkan secuil sitoplasma ke dalam sirkulasi. Antara 60% dan 75% platelet yang telah dilepas dari sumsum tulang berada di dalam peredaran darah, sedangkan sisanya sebagian besar terdapat di dalam limpa. Pengangkatan limpa (splenektomi) menyebabkan peningkatan hitung platelet (trombositosis).
kolagen, ADP, faktor dinding pembuluh von Willebrand, dan fibrinogen. Sitoplasmanya mengandung aktin, miosin, glikogen, lisosom, dan dua macam granula : (1) granula padat, mengandung senyawa-senyawa nonprotein yang akan disekresikan sebagai respons terhadap aktivasi platelet, mencakup serotonin, ADP, serta nukleotida
adenine lainnya, dan (2) granula α, yang mengandung protein sekresi selain hidrolase
lisosom. Protein tersebut meliputi faktor-faktor penggumpalan dan platelet-derived growth factor (PDGF). PDGF juga dibentuk oleh makrofag dan sel endotel. Senyawa
ini merupakan dimer yang tersusun dari polipeptida subunit A dan B. PDGF ditemukan baik sebagai senyawa bentuk homodimer (AA dan BB) maupun heterodimer (AB). PDGF merangsang penyembuhan luka dan merupakan mitogen kuat bagi otot polos vaskular. Platelet maupun dinding pembuluh darah mengandung faktor von Willebrand yang berperan pada proses adhesi dan mengendalikan kadar faktor VIII dalam sirkulasi.
Pembentukan platelet diatur oleh berbagai faktor perangsang koloni (CSF) yang mengontrol produksi megakariosit, serta trombopoietin, yakni suatu faktor protein yang beredar di dalam darah. Faktor ini, yang mempermudah pematangan megakariosit, dibentuk secara konstan oleh hati dan ginjal, dan platelet memiliki reseptor untuk trombopoietin. Akibatnya, bila jumlah platelet rendah, trombopoietin yang terikat akan berkurang dan lebih banyak tersedia untuk merangsang pembentukan platelet. Sebaliknya, bila jumlah platelet tinggi, lebih banyak trombopoietin yang terikat dan hanya sedikit yang bebas. Hal ini merupakan suatu bentuk kontrol umpan-balik pada pembentukan platelet. Bagian terminal-amino pada molekul trombopoietin memiliki kemampuan untuk merangsang platelet, sedangkan bagian terminal-karboksil mengandung banyak residu karbohidrat dan berperan pada ketersediaan trombopoietin (Ganong, 2008).
2.1.3. Peran Platelet dalam Proses Hemostasis
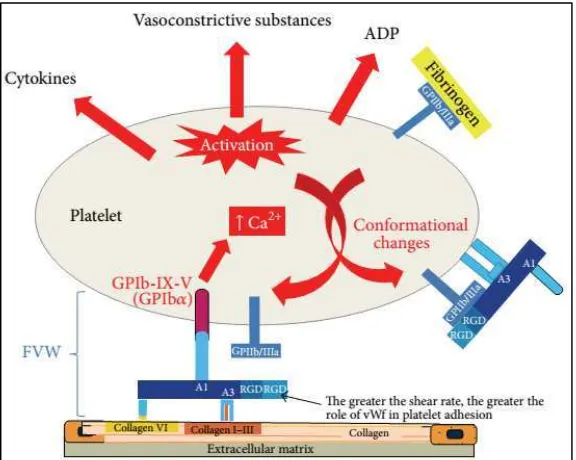
Adanya kerusakan pada dinding pembuluh darah mengaktivasi platelet untuk memulai proses penggumpalan, atau seperti yang telah diuraikan sebelumnya, proses hemostasis. Platelet yang bersifat dinamis dapat segera diaktifkan atau dihambat oleh beberapa stimulus endogen maupun eksogen, dan memulai proses hemostasis primer dengan melengketkan dirinya pada dinding pembuluh darah yang mengalami kerusakan. Reseptor GPIb-V-IX dan GPIa-IIa dan komponen-komponen subndotel seperti vWf dan kolagen saling berinteraksi untuk memediasi proses ini (Gambar 2.2.). Pengikatan ligan pada reseptor GP mengubah bentuk platelet dan memicu pelepasan granul-granulnya, yang pada akhirnya membentuk agregarasi yang juga dikenal dengan “sumbatan platelet” atau “trombus putih” (Gambar 2.3.).
Gambar 2.2. Ilustrasi fungsi vWf pada proses perlekatan platelet
Gambar 2.3. Proses aktivasi platelet
tidak bisa berikatan dengan fibrinogen. Jalur tromboksan asam arakidonat adalah jalur yang penting dalam aktivasi platelet (Gambar 2.4.).
Gambar 2.4. Jalur biosintesis tromboksan
platelet. Tromboksan A2, ADP, dan substansi-substansi lain seperti serotonin dilepaskan dari platelet yang teraktivasi, dan menyediakan umpan balik positif yang penting dan memperkuat gumpalan kaya-platelet untuk menginisiasi proses agregasi sekunder yang bersifat ireversibel (Gambar 2.5.). (Ghoshal & Bhattacharyya, 2014) .
Gambar 2.5. Ilustrasi jalur hemostasis
Jalur/kaskade penggumpalan darah dan pembentukan thrombin serta fibrin memperpanjang hemostasis sekunder. Selama proses aktivasi platelet, lapisan fosfolipid membran platelet menjadi bermuatan negatif, sehingga memfasilitasi aktivasi proses penggumpalan (mis. FV, FVIIIa, FIXa, dan FX). Pengikatan kompleks protrombinase (FXa, FVa, Ca2+, dan protrombin) pada membrane platelet terjadi pada tahap ini. Proses aktivasi platelet selanjutnya diinisiasi oleh pembentukan trombin.
Kaskade ini pada akhirnya akan membentuk “trombus merah” yang akan memperkuat
gumpalan darah (Munnix, et al., 2009).
Lapisan endotel pembuluh darah yang utuh melepaskan dua antiagregasi utama, yaitu prostasiklin (PGI2) dan nitric oxide (NO). Kedua substansi ini mencegah terbentuknya trombus di dalam pembuluh darah (Gryglewski, et al., 1988).
2.2. Aspirin
Aspirin telah dievaluasi secara teliti penggunaannya sebagai obat antiplatelet. Dalam sebuah penelitian meta-analisis dengan lebih dari 100 percobaan secara random pada pasien dengan risiko tinggi, aspirin telah terbukti dapat mencegah kematian akibat penyakit vaskuler hingga 15% dan mencegah kejadian vaskuler yang tidak fatal hingga mencapai 30% (Patrono, et al., 2004).
2.2.1. Farmakokinetik
dosis salisilat meningkatkan konsentrasi salisilat secara tidak proporsional. Seiring meningkatnya dosis aspirin, waktu-paruh eliminasi salisilat meningkat dari 3-5 jam (untuk dosis 600 mg/hari) menjadi 12-16 jam (dosis >3,6 g/hari). Alkalinisasi urine meningkatkan laju ekskresi salisilat bebas dan konjugatnya yang larut dalam air (Katzung, 2012).
2.2.2. Mekanisme Kerja 2.2.2.1.Efek antiplatelet
Aspirin menghambat agregasi platelet melalui asetilasi reversibel dan inaktivasi COX, menyebabkan penghambatan produksi TxA2 (Corazzi, et al., 2005). Platelet dewasa normal pada manusia hanya mengekspresikan COX-1 karena platelet tidak memiliki nukleus, sehingga tidak mampu mensintesis enzim secara de novo. Hal ini menyebabkan efek aspirin pada platelet bersifat permanen. Dengan demikian, efek kardioprotektif aspirin dicapai melalui gangguan terhadap fungsi platelet yang bergantung pada tromboksan A2 secara permanen dan ireversibel, sehingga dapat menurunkan tingkat kejadian trombosis arteri akut.
2.2.2.2.Efek Lainnya
Aspirin dalam penggunaan klinis tidak hanya digunakan sebagai antiplatelet,namun juga sebagai antiinflamasi, analgesik, dan juga antipiretik.
Sebagai antiinflamasi, aspirin merupakan penghambat nonselektif untuk kedua isoform COX, tapi salisilat lebih tidak efektif dalam menghambat isoform tersebut. Salisilat nonterasetilasi dapat bekerja sebagai penangkap radikal oksigen. Aspirin secara ireversibel menghambat COX dan menghambat agregasi platelet, sementara salisilat non-terasetilasi tidak.
Sedangkan efek antipiretik aspirin mungkin diperantarai baik oleh inhibisi COX di susunan saraf pusat maupun oleh inhibisi interleukin-1 (yang dilepaskan dari makrofag selama episode inflamasi) (Katzung, 2012).
2.2.3.Efek Simpang
Pada dosis biasa, efek simpang aspirin yang utama adalah gangguan lambung (intoleransi) dan ulkus lambung serta duodenum. Hepatotoksisitas, asma, ruam, dan toksisitas ginjal lebih jarang terjadi. Peningkatan perdarahan fekal yang berhubungan dengan sosis, rutin disebabkan oleh pemberian aspirin, meskipunt terjadi beberapa adaptasi mukosa pada banyak pasien sehingga perdarahan kembali ke nilai dasar dalam waktu 4-6 minggu.
Pada dosis yang lebih tinggi, pasien dapat mengalami salisilisme seperti muntah, tinnitus, pendengaran berkurang, dan vertigo, yang dapat dipulihkan dengan menurunkan dosis. Dosis salisilat yang besar tetap menyebabkan hiperpnea melalui efek langsung pada medula oblongata. Pada kadar salisilat yang toksik, alkalosis respiratorik diikuti oleh asidosis metabolic (akumulasi salisilat), depresi pernapasan, dan bahkan dapat terjadi kardiotoksisitas dan intoleransi glukosa. Penggunaan aspirin dikontraindikasikan pada pasien hemophilia.
Overdosis salisilat merupakan suatu kegawatdaruratan medis dan membutuhkan tindakan rawat inap (Katzung, 2012).
2.3. Propolis
Propolis merupakan suatu campuran alami yang dihasilkan oleh lebah Apis mellifera dari zat-zat yang dikumpulkan dari beberapa bagian tumbuhan, tunas, dan
eksudat. Kata propolis berasal dari bahasa Yunani, dimana kata pro berarti ‘tempat masuk’ dan polis berarti ‘komunitas’ atau ‘kota’, dimana artinya produk alami ini
Apis mellifera menggunakan propolis untuk mengonstruksi dan memperbaiki sarang
mereka, misalnya untuk menutup celah dan retakan serta merapikan dinding sarang bagian dalam (Burdock, 1998) dan sebagai sawar pelindung daripada pemangsa eksternal seperti ular, cicak, dan sebagainya, atau untuk melindungi dari angin dan hujan. Lebah Apis mellifera mengumpulkan propolis dari tumbuh-tumbuhan yang berbeda pada zona dengan iklim dan temperatur yang berbeda.
Sejak masa lalu, propolis telah digunakan secara luas oleh manusia, terutama dalam pengobatan tradisional untuk menyembuhkan beberapa penyakit. Penduduk Mesir Kuno menggunakan propolis untuk membalsami mayat-mayat mereka. Suku Inca menggunakan propolis sebagai agen antipiretik. Tabib-tabib Romawi dan Yunani menggunakannya sebagai desinfektan mulut dan sebagai antiseptik dan obat penyembuh pada penanganan luka, diresepkan untuk terapi topikal pada luka permukaan kulit maupun mukosa (Bankova, et al., 2000). Karena aktivitas antibakterinya, propolis menjadi sangat popular di Eropa antara abad ke-17 dan abad ke-20.
Penelitian ilmiah pertama terhadap propolis dipublikasikan pada tahun 1908 termasuk kandungan kimia dan komposisinya. Karena efeknya sebagai antiplatelet, antimikrobial, antiviral, dan antioksidan, propolis digunakan secara luas pada obat-obatan untuk manusia dan hewan, farmakologi, dan kosmetik (Wagh, 2013).
2.3.1.Karakteristik dan Komposisi 2.3.1.1.Karakteristik
2.3.1.2.Komposisi
Propolis memiliki komposisi yang kompleks. Pada umumnya propolis mentah mengandung sekitar 50% resin, 30% lilin, 10% minyak esensial, 5% serbuk sari, dan 5% komponen organik yang bervariasi. Lebih dari 300 unsur telah diidentifikasi dari sampel propolis yang berbeda-beda. Proporsi dari unsur-unsur yang terkandung di dalam propolis bergantung pada tempat dan waktu dari pengumpulannya.
Banyak metode analisis yang telah digunakan untuk memisahkan dan mengidentifikasi unsur-unsur yang menyusun propolis. Unsur-unsur yang telah diidentifikasi ternyata memiliki kesamaan secara kimia : polifenol, asam benzoat dan turunannya, alkohol sinamik dan asam sinamik beserta turunannya, hidrokarbon seskuiterpena dan triterpena, turunan benzaldehida, asam-asam lain beserta turunannya, alkohol, keton, dan komponen heteroaromatik, alkohol terpena dan seskuiterpena beserta turunannya, hidrokarbon alifatik, mineral, hidrokarbon sterol dan steroid, gula dan asam amino (Walker & Crane, 1987). Dan seperti yang diharapkan, komponen volatile hanya terdapat dalam jumlah yang relative rendah (Castro, 2001). Beberapa komponen terdapat dalam semua sampel propolis sehingga menentukan karakteristik kandungannya.
Propolis dari sumber yang berbeda mengandung unsur-unsur yang berbeda. Beberapa unsur terdapat dalam banyak sampel dari daerah yang berbeda. Sementara beberapa lainnya hanya ditemukan pada sampel dari daerah yang spesifik.
2.3.2. Bioaktivitas
2.3.3.1.Aktivitas Antiplatelet
Penelitian menunjukkan bahwa propolis memiliki efek antiplatelet. CAPE (Caffeic acid phenethyl ester), salah satu komponen penyusun propolis, terbukti memiliki efek ini. CAPE secara spesifik menghambat aktivasi platelet yang diinduksi oleh kolagen dengan cara mengganggu proses pengikatan kolagen pada reseptornya
(mis. integrin α2β1 dan GP VI) pada membran platelet, sehingga memperpanjang waktu terbetuknya sumbatan platelet. Namun demikian, daya afinitas ikatan dan jumlah tempat pengikatan antara CAPE dengan reseptor kolagen ini masih belum diketahui, sehingga masih perlu diteliti lebih jauh (Hsiao, et al., 2007).
Mekanisme lain yang menjelaskan bagaimana CAPE bisa menghambat agregasi platelet yang diinduksi oleh kolagen juga pernah diteleiti. Menurut penelitian ini, CAPE meningkatkan pembentukan siklik-GMP. Hal ini lalu menyebabkan terjadinya pengaktifan fosforilasi VASP (Vasodilator-stimulated phosphoprotein) Ser157 tergantung siklik-GMP, yang selanjutnya menghambat aktivitas PKC (Protein Kinase C) dan menghasilkan penghambatan fosforilasi P47, akhirnya menghambat proses agregasi platelet (Chen, et al., 2007)
Temuan-temuan ini mengindikasikan bahwa CAPE yang terkandung dalam propolis bisa menjadi agen yang poten dan efektif untuk penanganan kelainan yang terkait dengan tromboembolik.
2.3.2.2.Aktivitas Antibakteri
Sifat antibaketeri dari propolis yang diambil dari daerah Gujarat terbukti dengan metode difusi agar terhadap Staphylococcus aureus, Bacillus subtilis, Pseudomonas aerugiosa, Escherichia coli, Candida albicans, dan Aspergillus niger.
menunjukkan aktivitas apa-apa. Namun demikian, A. niger diuji coba dengan ekstrak metanol 40% (Kumar, et al., 2008).
2.3.2.3.Aktivitas Antijamur
Propolis telah menunjukkan efek fungisidal pada jamur yang menyebabkan pembusukan jus Candida famata, C, glabrata, C. kefyr, C. pelliculosa, C, parapsilosis, dan Pichia ohmeri. Efek fungisidal tersebut diasosiasikan dengan adanya komponen flavonoid (Farnesi, et al., 2009). Propolis adalah produk perlebahan dengan aktivitas antijamur paling tinggi sebagaimana yang telah diujicobakan pada 40 yeast strains dari C. albicans, C. glabrata, C. krusei, dan Trichosporan spp. (Koç, et al., 2007).
Selain aktivitas-aktivitas yang telah disebutkan di atas, propolis juga masih memiliki beragam bioaktivitas lainnya, diantaranya antivitas antiprotozoal, antioksidan, antiinflamasi, antitumor, dll (Wagh, 2013)
2.4. Bee Pollen
Bee Pollen berasal dari kata Bee (lebah) dan Pollen (serbuk sari bunga jantan). Jadi Bee Pollen berarti serbuk sari bunga jantan yang diambil oleh lebah dan digunakan
sebagai bahan pembuatan “roti lebah”. Roti lebah sendiri adalah makanan pokok dari
2.4.1. Karakteristik dan Komposisi 2.4.1.1.Karakteristik
Bee pollen berbentuk biji-bijian yang berukuran 2,5-250 µm. Bentuk, warna, ukuran, dan berat dari pollen ini berbeda-beda tergantung pada spsies tumbuhan yang digunakan sebagai sumber. Variasi dari bentuk pollen mencakup bundar, silinder, seperti lonceng, segitiga, ataupun berduri-duri. Beratnya sekitar beberapa puluh mikrogram dan warna dari pollen juga bervariasi muali dari kuning cerah hingga kehitaman.
2.4.2.1.Komposisi
Bee pollen mengandung rata-rata 22,7% protein, termasuk 10,4% darinya adalah asam amino esensial seperti methionine, lysine, threonine, histidine, leucine, isoleucine, valine, phenylalanine, dan tryptophan. Selain itu, di dalam pollen juga terkandung asam nukleat dalam jumlah yang signifikan, terutama ribonukleat. Karbohidrat yang dapat dicerna memiliki kadar sekitar 30,8%. Bentuk-bentuk gula lainnya, terutama fruktosa dan glukosa, terkandung dengan kadar kira-kira 25,7% Kandungan lipid pada bee pollen berkisar 5,1% (Szczesna, 2006). Selain itu juga terdapat komponen phenolic sekitar 1,6%, serta juga vitamin dan bioelemen-bioelemen yang juga merupakan kandungan yang bernilai.
2.4.2.2.Bioaktivitas
Belum pernah ditemukan adanya jurnal-jurnal ilmiah ataupun sumber lainnya yang membahas efek antiplatelet dari bee pollen. Namun bila ditilik dari segi komposisi, bee pollen sedikit banyak memiliki komposisi utama yang mirip produk-produk perlebahan lainnya seperti propolis dan madu yang telah terbukti memiliki efek antiplatelet, sehingga diperkirakan bahwa bee pollen juga memiliki aktivitas antiplatelet.
pollen mempunyai aktivitas hypolipidemic yang dapat menurunkan kadar lipid total dan trigliserida plasma. Penelitian klinis telah mengonfirmasi aktivitas hypolipidemic ini. Bee Pollen mampu menurunkan kadar lipid-lipid di atas 20 hingga 35%.
Penelitian juga telah menunjukkan bahwa Bee Pollen memiliki efek detoksifikasi. Mencit yang diberikan racun seperti karbon tetraklorida dan trikloroetilena. Bee Pollen terbukti menurunkan kadar dari zat-zat racun ini di dalam darah bahkan kembali ke tingkat fisiologis. Pada proses detoksifikasi ini, unsur-unsur yang berperan penting antara lain polifenol, terutama flavonoid dan asam fenolat (Komosinska-Vassev, et al., 2015).
Bee Pollen juga memiliki efek antiinflamasi. Mekanisme efek antiinflamasi ini diperkirakan dengan penghambatan dari aktivitas enzim siklooksigenase dan lipoksigenase. Unsur yang berperan penting di sini adalah flavonoid dan asam fenolat selain juga asam lemak dan fistosterol (Choi, 2007).
BAB 1 PENDAHULUAN
1.1. Latar Belakang
Hemostasis adalah urutan kejadian dari respon tubuh untuk menghentikan suatu perdarahan. Ketika pembuluh darah mengalami kerusakan atau pecah, respon hemostasis harus bersifat segera, terlokalisir pada area yang mengalami kerusakan, dan terkontrol secara teliti agar respon tersebut menjadi efektif. Terdapat tiga mekanisme utama pada proses hemostasis : vascular spasm (spasme pembuluh darah), platelet plug formation (agregasi platelet), dan blood clotting (penggumpalan darah). Jika ketiga mekanisme ini berhasil dengan sempurna, maka hemostasis dapat menghentikan perdarahan yang terjadi (Tortora, 2009).
Hemostasis secara umum ikut berperan penting dalam membantu menjaga keadaan homeostasis cairan tubuh, terutama untuk mencegah terjadinya kehilangan darah dalam jumlah yang besar pada saat terjadi kerusakan maupun ruptur dari pembuluh darah. Namun, jika terjadi secara abnormal, proses hemostasis terutama mekanisme blood clotting (penggumpalan darah) dapat menyebabkan gangguan yang bersifat fatal. Gumpalan darah terkadang dapat terbentuk di dalam sistem kardiovaskuler tanpa adanya kerusakan pembuluh darah (biasanya pada vena). Kondisi ini disebut thrombosis. Gumpalan itu sendiri, disebut dengan thrombus, dapat menghambat aliran darah yang menuju pembuluh darah dengan diameter lebih kecil. Hal ini akan berakibat fatal jika aliran yang terhambat adalah pembuluh darah yang menuju organ vital (Tortora, 2009).
Di Indonesia sendiri, tingkat kematian akibat CVD mencapai 371 kematian per 100.000 jiwa pada tahun 2012 (WHO, 2012).
Pemberian terapi antiplatelet efektif terhadap penanganan pasien dengan CVD baik pada pemberian jangka pendek maupun jangka panjang (Peters et al, 2003). Selain itu, pemberian terapi antiplatelet bisa mengurangi angka kejadian CVD hingga 25% pada pasien yang berisiko tinggi (Baigent, et al., 2002).
Aspirin sebagai salah satu obat antiplatelet telah disetujui oleh FDA untuk digunakan sebagai profilaksis primer CVD (Katzung, 2012). Menurut penelitian, pemberian aspirin per oral dengan dosis 100 mg dalam dosis tunggal cukup untuk menghambat terjadinya agregasi platelet (Peters, et al., 2003). Aspirin, atau Acetylsalicylic acid (ASA) bekerja menghambat sintesis tromboxan A2 (TXA2) dengan
cara menghambat secara ireversibel enzim siklooksigenase (COX). Penghambatan sintesis TXA2 ini mengakibatkan terjadinya pengurangan agregasi platelet. Namun, aspirin ditengarai memiliki banyak efek samping. Pada dosis biasa, efek samping aspirin yang utama adalah gangguan lambung (intoleransi) dan ulkus lambung serta duodenum (Katzung, 2012).
1.2. Rumusan Masalah
Trombosis yang sering terjadi terutama pada pasien dengan penyakit jantung dan pembuluh darah sangat berisiko untuk menimbulkan kematian. Selama ini Aspirin adalah agen antiplatelet yang digunakan sebagai profilaksis untuk mencegah kejadian trombosis. Namun seperti obat-obat kimiawi lainnya, Aspirin diketahui memiliki banyak efek samping. Pada saat yang bersamaan, banyak penelitian yang telah membuktikan bahwa beberapa produk alami seperti propolis juga menganduk efek antiplatelet dengan efek samping yang lebih minimal. Dengan demikian, masalah dalam penelitian ini adalah :
1. Benarkah terdapat efek antiplatelet pada produk perlebahan terutama propolis dan bee pollen
2. Bagaimanakah perbandingan efektivitas propolis dan bee pollen sebagai alternatif agen antiplatelet dengan aspirin sebagai antiplatelet standar
1.3. Tujuan Penelitian 1.3.1.Tujuan Umum
Untuk mengetahui efektivitas propolis dan bee pollen sebagai agen antiplatelet pada ekor mencit
1.3.2.Tujuan Khusus
Dibuktikan adanya pemanjangan waktu perdarahan pada ekor mencit
setelah pemberian propolis
Dibuktikan adanya pemanjangan waktu perdarahan pada ekor mencit
setelah pemberian bee pollen
Diketahuinya perbandingan rerata waktu perdarahan pada ekor mencit
dengan pemberian propolis dan aspirin
Diketahuinya perbandingan rerata waktu perdarahan pada ekor mencit
1.4. Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan manfaat sebagai berikut.
Bagi Peneliti
Dapat memberikan pengetahuan dan informasi tentang efektivitas propolis dan bee pollen sebagai antiplatelet dan menjadi suatu pengalaman dalam mengembangkan kemampuan peneliti di bidang penelitian kesehatan.
Bagi Ilmu Pengetahuan
Sebagai bahan acuan atau dasar perkembangan informasi bagi peneliti lain khususnya tentang efektifitas propolis dan bee pollen sebagai obat antiplatelet alternatif pada mencit. Selain itu juga sebagai pelopor untuk nantinya mungkin akan diteliti lebih lanjut pada manusia.
Bagi Masyarakat
ABSTRAK
Latar Belakang: Penggunaan agen antiplatelet standar sebagai profilaksis primer pada penderita penyakit kardiovaskuler memiliki banyak efek samping. Penggunaan agen antiplatelet herbal merupakan salah satu alternatif yang masih belum banyak diteliti. Penelitian ini bertujuan untuk mengetahui efektivitas dari Propolis dan Bee Pollen, suatu produk perlebahan, sebagai antiplatelet dan perbandingannya dengan Aspirin. Metode: Penelitian ini merupakan penelitian eksperimental desain posttest dengan kelompok kontrol. Sampel adalah 32 ekor mencit galur Double Distsch Webster, berat 20-30 gram dan usia 2-3 bulan. Sampel dibagi menjadi 4 kelompok : plasebo, pemberian Aspirin (10,4 mg/kgBB/hari), Propolis (65 mg/kgBB/hari), dan Bee Pollen (68 mg/kgBB/hari). Penelitian dilakukan selama 12 hari dengan pemberian suspensi peroral. Selanjutnya dilakukan pengukuran waktu perdarahan menggunakan teknik tail bleeding. Data yang diperoleh adalah waktu perdarahan dalam satuan detik.
Hasil: Seluruh sampel menyelesaikan penelitian. Rerata waktu perdarahan pada kelompok plasebo, Aspirin, Propolis, dan Bee Pollen adalah 106,1, 442,9, 310,1, dan 203 dalam satuan detik secara berurutan. Uji ANOVA dan Bonferroni menunjukkan perbedaan yang signifikan antara kelompok Propolis dan plasebo (p=0,003), tidak ada perbedaan antara kelompok Propolis dan Aspirin (p=0,100), tidak terdapat perbedaan antara kelompok Bee Pollen dengan plasebo (p=0,442) dan perbedaan yang signifikan antara kelompok Bee Pollen dengan Aspirin (p=0,000).
Kesimpulan: Pemberian Propolis terbukti dapat memanjangkan waktu perdarahan pada mencit, sedangkan pemberian Bee Pollen tidak terbukti memiliki efek antiplatelet. Perlu dilakukan penelitian lebih lanjut mengenai penggunaan kedua produk ini sebagai agen antiplatelet alternatif.
ABSTRACT
Background: The use of standard antiplatelet therapy for cardiovascular disease patients has many side effects. Herbal antiplatelet agent is the alternative which still has not been widely studied. This study aims to determine the effectiveness of Propolis and Bee Pollen, two bee products, as antiplatelet and in comparison with Aspirin. Method: This is an experimental study with posttest only control group design. Samples were 32 mice, Double Distsch Webster strain, weight of 20-30 grams, and age of 2-3 months. The samples were divided into 4 groups: placebo, administration of aspirin (10.4 bw/day), Propolis (65 bw/day), and Bee Pollen (68 mg/kg-bw/day). The study was conducted for 12 days and the suspensions were given orally. The bleeding time then masured using tail-bleeding technique. The data collected was bleeding time in seconds.
Results: All samples completed the study. The mean bleeding time for placebo, Aspirin, Propolis and Bee Pollen groups were 106.1, 442.9, 310.1, and 203 in seconds respectively. ANOVA and Bonferroni tests showed a significant difference between Propolis and placebo groups (p=0.003), no difference between Propolis and Aspirin groups (p=0.100), no difference between Bee Pollen and placebo groups (p=0.442), and a significant difference between Bee Pollen and Aspirin groups (p=0.000). Conclusions: Administration of Propolis in mice showed prolongation of bleeding time. Meanwhile, the administration of Bee Pollen did not prove to have antiplatelet effects. Further research needs to be done regarding the use of these products as an alternative antiplatelet agent.
Oleh :
MUHAMMAD LUTHFI 120100145
FAKULTAS KEDOKTERAN UNIVERSITAS SUMATERA UTARA
ABSTRAK
Latar Belakang: Penggunaan agen antiplatelet standar sebagai profilaksis primer pada penderita penyakit kardiovaskuler memiliki banyak efek samping. Penggunaan agen antiplatelet herbal merupakan salah satu alternatif yang masih belum banyak diteliti. Penelitian ini bertujuan untuk mengetahui efektivitas dari Propolis dan Bee Pollen, suatu produk perlebahan, sebagai antiplatelet dan perbandingannya dengan Aspirin. Metode: Penelitian ini merupakan penelitian eksperimental desain posttest dengan kelompok kontrol. Sampel adalah 32 ekor mencit galur Double Distsch Webster, berat 20-30 gram dan usia 2-3 bulan. Sampel dibagi menjadi 4 kelompok : plasebo, pemberian Aspirin (10,4 mg/kgBB/hari), Propolis (65 mg/kgBB/hari), dan Bee Pollen (68 mg/kgBB/hari). Penelitian dilakukan selama 12 hari dengan pemberian suspensi peroral. Selanjutnya dilakukan pengukuran waktu perdarahan menggunakan teknik tail bleeding. Data yang diperoleh adalah waktu perdarahan dalam satuan detik.
Hasil: Seluruh sampel menyelesaikan penelitian. Rerata waktu perdarahan pada kelompok plasebo, Aspirin, Propolis, dan Bee Pollen adalah 106,1, 442,9, 310,1, dan 203 dalam satuan detik secara berurutan. Uji ANOVA dan Bonferroni menunjukkan perbedaan yang signifikan antara kelompok Propolis dan plasebo (p=0,003), tidak ada perbedaan antara kelompok Propolis dan Aspirin (p=0,100), tidak terdapat perbedaan antara kelompok Bee Pollen dengan plasebo (p=0,442) dan perbedaan yang signifikan antara kelompok Bee Pollen dengan Aspirin (p=0,000).
Kesimpulan: Pemberian Propolis terbukti dapat memanjangkan waktu perdarahan pada mencit, sedangkan pemberian Bee Pollen tidak terbukti memiliki efek antiplatelet. Perlu dilakukan penelitian lebih lanjut mengenai penggunaan kedua produk ini sebagai agen antiplatelet alternatif.
ABSTRACT
Background: The use of standard antiplatelet therapy for cardiovascular disease patients has many side effects. Herbal antiplatelet agent is the alternative which still has not been widely studied. This study aims to determine the effectiveness of Propolis and Bee Pollen, two bee products, as antiplatelet and in comparison with Aspirin. Method: This is an experimental study with posttest only control group design. Samples were 32 mice, Double Distsch Webster strain, weight of 20-30 grams, and age of 2-3 months. The samples were divided into 4 groups: placebo, administration of aspirin (10.4 bw/day), Propolis (65 bw/day), and Bee Pollen (68 mg/kg-bw/day). The study was conducted for 12 days and the suspensions were given orally. The bleeding time then masured using tail-bleeding technique. The data collected was bleeding time in seconds.
Results: All samples completed the study. The mean bleeding time for placebo, Aspirin, Propolis and Bee Pollen groups were 106.1, 442.9, 310.1, and 203 in seconds respectively. ANOVA and Bonferroni tests showed a significant difference between Propolis and placebo groups (p=0.003), no difference between Propolis and Aspirin groups (p=0.100), no difference between Bee Pollen and placebo groups (p=0.442), and a significant difference between Bee Pollen and Aspirin groups (p=0.000). Conclusions: Administration of Propolis in mice showed prolongation of bleeding time. Meanwhile, the administration of Bee Pollen did not prove to have antiplatelet effects. Further research needs to be done regarding the use of these products as an alternative antiplatelet agent.
KATA PENGANTAR
Puji dan syukur penulis ucapkan kepada Tuhan Yang Maha Esa karena atas segala rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan laporan hasil penelitian ini, sebagai salah satu syarat untuk menyelesaikan pendidikan di Fakultas Kedokteran Universitas Sumatera Utara. Penelitian yang telah dilaksanakan ini berjudul “Perbandingan Efektivitas Aspirin, Propolis, dan Bee Pollen sebagai Antiplatelet Berdasarkan Waktu Perdarahan pada Mencit”.
Dalam penyelesaian laporan hasil penelitian ini, penulis banyak menerima bantuan dari berbagai pihak. Untuk itu penulis ingin menyampaikan ucapan terima kasih dan penghargaan setinggi-tingginya kepada :
1. Prof. Dr. dr. Gontar Alamsyah Siregar, Sp.PD-KGEH, selaku Dekan Fakultas Kedokteran Universitas Sumatera Utara
2. dr. Sake Juli Martina, Sp.FK, selaku dosen pembimbing, terima kasih banyak atas arahan, ilmu, dan waktu yang telah diluangkan untuk membimbing penulis 3. dr. Wulan Fadine, M.Ked (An), Sp.An selaku dosen penguji I ujian proposal KTI, dr. Jelita Siregar, M.Ked(PK), Sp.PK selaku dosen penguji I seminar hasil KTI, dan dr. Ronald Sitohang, Sp.B selaku penguji II, yang telah bersedia menjadi penguji dan memberi pengarahan dan masukan dalam penelitian ini 4. Kak Zuwanna, Bang Anto, Ibu Walda, terima kasih atas bantuannya selama
melakukan penelitian ini
5. Ibunda Mursyidah A. Lathief dan Ayahnda Nurdin A. Birton, serta ketiga adinda, terima kasih atas kasih sayang, doa, dan dukungannya selama ini 6. Lathifa Annada Rahma, terima kasih atas semangat, dukungan, dan
kepercayaanya kepada penulis untuk menyelesaikan penelitian ini
8. Sahabat-sahabat seangkatan penulis yang telah memberikan dukungan, saran, dan bantuan selama menyelesaikan karya tulis ilmiah ini. Maaf penulis tidak bisa menuliskan kalian satu persatu.
9. Seluruh staf pengajar dan civitas akademika Fakultas Kedokteran Universitas Sumatera Utara atas bimbingan selama perkuliahan dan penulisan karya tulis ilmiah ini
Penulis menyadari bahwa penulisan laporan hasil penelitian ini masih jauh dari sempurna, baik dari segi materi maupun tata cara penulisannya. Penulis bersedia menerima kritik dan saran yang membangun agar dapat memperbaiki ke arah sempurna. Akhir kata, semoga karya tulis ilmiah ini bermanfaat bagi semua pihak.
Medan, 7 Desember 2015
DAFTAR ISI
Halaman
Lembar Pengesahan …...………i
Abstrak ………..ii
Abstract ………iii
Kata Pengantar ……….iv
Daftar Isi ………...vi Daftar Tabel ……….…………ix
Daftar Gambar ………..……….………x
Daftar Singkatan ………...xi
Daftar Lampiran ……….xiii BAB 1 PENDAHULUAN 1.1. Latar Belakang ………...1
1.2. Rumusan Masalah ………..3
1.3. Tujuan Penelitian ………3
1.4. Manfaat Penelitian ………..4
BAB 2 TINJAUAN PUSTAKA 2.1. Hemostasis dan Platelet ………..5
2.1.1. Hemostasis ……….5
2.1.2. Platelet ………7
2.1.3. Peran Platelet dalam Proses Hemostasis ……….9
2.2. Aspirin ………12
2.2.1. Farmakokinetik ……….12
2.2.3. Efek Simpang ………..……….14
2.3. Propolis ………14
2.3.1. Karakteristik dan Komposisi ………15
2.3.2. Bioaktivitas ………...17
2.4. Bee Pollen ……….18
2.4.1. Karakteristik dan Komposisi ………..18
2.4.2. Bioaktivitas ………...19
BAB 3 KERANGKA KONSEP DAN DEFINISI OPERASIONAL 3.1. Kerangka Konsep ……….21 4.1. Jenis dan Rancangan Penelitian ………23
4.2. Waktu dan Lokasi Penelitian ………24
4.3. Populasi dan Sampel Penelitian ………24
4.4. Kriteria Inklusi, Eksklusi, dan Drop Out ………...25
4.5. Cara Kerja dan Alur Penelitian ……….25
4.6. Analisa Data ……….28
BAB 5 HASIL PENELITIAN DAN PEMBAHASAN 5.1. Hasil Penelitian ………29
5.1.1. Deskripsi Lokasi Penelitian ………..29
5.1.3. Uji Normalitas Data ………..31
5.1.4. Uji Homogenitas Data ………..31
5.1.5. Uji Komparabilitas ………...32
5.1.6. Uji Lanjutan (Post Hoc Test) ………33
5.2. Pembahasan ………...34
BAB 6 KESIMPULAN DAN SARAN 6.1. Kesimpulan ………...38
6.2. Saran ……….39
DAFTAR PUSTAKA ………40
DAFTAR TABEL
Nomor Keterangan Tabel Halaman Tabel 4.1. Konversi perhitungan dosis (Laurence & Bacharach, 1964) 27
secara per oral
Tabel 5.1. Rerata Waktu Perdarahan pada Empat Kelompok Sampel 30 dalam Satuan Detik
Tabel 5.2. Normalitas Data pada Empat Kelompok Perlakuan dengan 31 Uji Shapiro-Wilk
Tabel 5.3. Homogenitas Data pada Empat Kelompok Perlakuan 32 Tabel 5.4. Uji One Way ANOVA Rerata Waktu Perdarahan 32
Tabel 5.5. Uji Lanjutan Bonferroni 33
DAFTAR GAMBAR
Nomor Keterangan Gambar Halaman
Gambar 2.1. Respon alami darah terhadap perubahan pada dinding 7 Pembuluh darah
Gambar 2.2. Ilustrasi fungsi vWf pada proses perlekatan platelet 10
Gambar 2.3. Proses aktivasi platelet 10
Gambar 2.4. Jalur biosintesis tromboksan 11
Gambar 2.5. Ilustrasi jalur hemostasis 11
Gambar 5.1. Grafik Waktu Perdarahan Berdasarkan Kelompok 30 Pemberian Obat
DAFTAR SINGKATAN
ADP : Adenosine Diphosphate ANOVA : Analysis of Variance ASA : Acetylsalicylic acid BMJ : British Medical Journal
C75BL/6 : C57 Black 6 – Salah satu galur mencit yang sering digunakan di laboratorium
CAPE : Caffeic Acid Phenethyl Ester CSF : Colony Stimulating Factor COX : Cyclooxygenase
CVD : Cardiovascular Disease DDW : Double Distsch Webster FDA : Food and Drug Administration FDP : Fibrin Degradation Product
FMIPA : Fakultas Matematika dan Ilmu Pengetahuan Alam cGMP : Cyclic Guanosine Monophosphate
GP : Glikoprotein
HSD : Honestly Significant Difference NO : Nitric Oxide
OAINS : Obat Anti-Inflamasi Nonsteroid PAF : Platelet-Activating Factor PDGF : Platelet-Derived Growth Factor PGI2 : Prostasiklin
PJK : Penyakit Jantung Koroner PKC : Protein Kinase C
PTM : Penyakit Tidak Menular
TXA2 : Tromboxan A2
tPA : Tissue Plasminogen Activator u-PA : U-Plasminogen Activator vWf : von Willebrand factor
DAFTAR LAMPIRAN
Lampiran 1. Dosis Konversi Lampiran 2. Data Penelitian
Lampiran 3. Hasil Analisa Data SPSS