Lampiran 3. Gambar Karakteristik Tumbuhan Temu Giring
Lampiran 3. (lanjutan)
Lampiran 3. (lanjutan)
Simplisia Rimpang Temu Giring
Lampiran 4. Bagan alur penelitian
Serbuk simplisia (500 g)
Ampas Perkolat
Diperkolasi menggunakanetanol 96%yang telah didestilasi
Ekstrak kental 95,32 g
Diuapkan menggunakan rotavapour
Karakterisasi ekstrak
• Penetapan kadar air • Penetapan kadar abu
total
• Penetapan kadar abu tidak larut asam Pengujian aktivitas hepatoprotektor
Pengukuran parameter biokimia ALT dan AST
Pemeriksaan kerusakan organ
hepar
• Makroskopik
Lampiran 5. Gambar mikroskopik serbuk simplisia rimpang temu giring pada perbesaran 10 x 40
Mikroskopik serbuk simplisia rimpang temu giring pada perbesaran 10 x 40
Keterangan : 1 = fragmen jaringan gabus 2 = butir pati (diperbesar) 3 = rambut penutup
4 = fragmen pembuluh kayu 5 = butir minyak atsiri 6 = fragmen parenkim
1
2
3
4
5
Lampiran 6. Perhitungan karakterisasi simplisia rimpang temu giring
Perhitungan Penetapan Kadar Air dari Serbuk Simplisia rimpang temu giring
% Kadar Air = Volume air
Berat Sampel x 100%
1. % Kadar Air I = 0,4
5,094x100% = 7,85%
2. % Kadar Air II = 0,5
5,075x100% = 9,85%
3. % Kadar Air III = 0,5
5,148x100% = 9,71%
% Kadar Air Rata-Rata = 7,85+ 9,85 + 9,71
3 = 9,14%
No Berat Sampel (g) Volume Air (ml) 1.
2. 3.
5,094 5,075 5,148
Lampiran 6. (lanjutan)
Perhitungan Penetapan Kadar Sari Larut Air dari Serbuk Simplisia rimpang temu giring (Lanjutan)
% Kadar Sari Larut Etanol Rata-Rata = 16,95%+ 17,18% + 11,38% 3
Lampiran 6. (lanjutan)
Lampiran 6. (lanjutan)
Perhitungan Penetapan Kadar Abu Total dari Serbuk Simplisia rimpang temu giring (Lanjutan)
No Berat Sampel (g) Berat Abu (g) 1.
2. 3.
2,0116 2,0069 2,0104
0,0920 0,0910 0,0909
% Kadar Abu Total = Berat Abu
Berat Sampel x100%
1. % Kadar Abu Total I = 0,0902
2,0116 x100% = 4,57%
2. % Kadar Abu Total II = 0,0910
2,0069 x100% = 4,53%
3. % Kadar Abu Total I = 0,0909
2,0104x100% = 4,52%
% Kadar Abu Total Rata-Rata = 4,57%+ 4,53% +4,52%
Lampiran 6. (lanjutan)
Perhitungan Penetapan Kadar Abu tidak Larut Asam dari Serbuk Simplisia rimpang temu giring (Lanjutan)
No Berat Sampel (g) Berat Abu (g) 1.
2. 3.
2,0116 2,0069 2,0104
0,0335 0,0352 0,0316
% Kadar Abu tidak Larut Asam = Berat Abu
Berat Sampel x100%
1. % Kadar Abu Total I = 0,0335
2,0116 x100% = 1,67%
2. % Kadar Abu Total II = 0,0352
2,0069 x100% = 1,75%
3. % Kadar Abu Total I = 0,0316
2,0104 x100% = 1,57% % Kadar Abu tidak Larut Asam Rata-Rata
= 1,67%+ 1,75% + 1,57%
Lampiran 7. Perhitungan karakterisasi EERTG Perhitungan Penetapan Kadar Air dari EERTG
No Berat Sampel (g) Volume Air (ml) 1.
2. 3.
5,007 5,018 5,012
0,2 0,2 0,2
% Kadar Air = Volume air
Berat Sampel x 100%
1. % Kadar Air I = 0,2
5,007x100% = 3,94%
2. % Kadar Air II = 0,2
5,018x100% = 3,99%
3. % Kadar Air III = 0,2
5,012x100% = 3,99%
% Kadar Air Rata-Rata = 3,94+ 3,99 + 3,99
Lampiran 7. (lanjutan)
Perhitungan Penetapan Kadar Abu Total dari EERTG (Lanjutan)
No Berat Sampel (g) Berat Abu (g) 1.
2. 3.
2,0003 2,0004 2,0004
0,0080 0,0081 0,0088
% Kadar Abu Total = Berat Abu
Berat Sampel x100%
1. % Kadar Abu Total I = 0,0080
2,0003 x100% = 0,40%
2. % Kadar Abu Total II = 0,0081
2,0004 x100% = 0,41%
3. % Kadar Abu Total I = 0,0088
2,0004x100% = 0,44%
% Kadar Abu Total Rata-Rata = 0,40%+0,41% +0,44%
Lampiran 7. (lanjutan)
Perhitungan Penetapan Kadar Abu tidak Larut Asam dari EERTG (Lanjutan)
No Berat Sampel (g) Berat Abu (g) 1.
2. 3.
2,0003 2,0004 2,0004
0,0020 0,0022 0,0020
% Kadar Abu tidak Larut Asam = Berat Abu
Berat Sampel x100%
1. % Kadar Abu Total I = 0,0020
2,0003 x100% = 0,10%
2. % Kadar Abu Total II = 0,0022
2,0004 x100% = 0,11%
3. % Kadar Abu Total I = 0,0020
2,0004 x100% = 0,10% % Kadar Abu tidak Larut Asam Rata-Rata
= 0,10%+0,11% + 0,10%
Lampiran 8. Gambar proses pengambilan sampel darah
Pengambilan darah melalui ekor
Lampiran 8. (lanjutan).
Serum setelah sentrifuge
Lampiran 9. Volume maksimum sesuai jalur pemberian dan konversi dosis. 1. Tabel volume maksimum larutan sediaan uji yang dapat diberikan pada hewan
uji (Harmita dan Radji, 2008)
Jenis hewan uji
Volume maksimal (ml) sesuai jalur pemberian
Lampiran 10. Perhitungan volume pemberian EERTG dosis 5 mg/kg bb, 25 mg/kg bb, 125 mg/kg bb dan 625 mg/kg bb serta parasetamol dosis 2 g/kg bb (serbuk), dan katekin dosis 2 mg/kg bb.
1. EERTG dosis 5 mg/kg bb Berat badan tikus = 200 g
Dosis pemberian = 200 g � 5 mg
1000 = 1 mg Konsentrasi ekstrak = 10 mg/ml
Volume pemberian = 1 mg
10 mg x 1 ml = 0,1 ml.
2. EERTG dosis 25 mg/kg bb Berat badan tikus = 200 g
Dosis pemberian = 200 g � 25 mg
1000 = 5 mg Konsentrasi ekstrak = 10 mg/ml
Volume pemberian = 5 mg
10 mg x 1 ml = 0,5 ml. 3. EERTG dosis 125 mg/kg bb
Berat badan tikus = 200 g
Dosis pemberian = 200 g � 125 mg
1000 = 25 mg Konsentrasi ekstrak = 10 mg/ml
Volume pemberian = 25 mg
10 mg x 1 ml = 2,5 ml.
Dosis pemberian = 200 g � 625 mg
1000 = 125 mg Konsentrasi ekstrak = 50 mg/ml
Volume pemberian = 125 mg
50mg x 1 ml = 2,5 ml.
5. Dosis parasetamol yang digunakan 2 g/kg bb, maka volume pemberiannya adalah:
Dosis untuk 200 g tikus = 2000 mg
1000 x 200 g = 400 mg Konsentrasi parasetamol = 200 mg/ml
Volume pemberian = 400mg
200mg x 1 ml = 2 ml
6. Dosis katekin yang digunakan 2 mg/kg bb, maka volume pemberiannya adalah:
Dosis untuk 200 g tikus = 2 mg
1000 x 200 g = 0,4 mg Konsentrasi lar. katekin = 1 mg/ml
Volume pemberian = 0,4 mg
1 mg x 1 ml = 0,4 ml
7. Konversi dosis efektif EERTG 25 mg/kg bb pada manusia 25 mg/kg bb 25 mg/1000 g bb
25 mg/1000g bb 5 mg/200 g tikus
Lampiran 15. Data analisis statistik SPSS
Test of Homogeneity of Variances
KADAR_SGPT
Lampiran 15. (lanjutan)
KADAR_SGPT
Tukey HSD
(I) KELOMPOK (J) KELOMPOK
tanpa perlakuan 3.600 52.470 1.000 -162.84 170.04
tanpa perlakuan dosis 5 mg/kg
bb -47.000 52.470 .970 -213.44 119.44
dosis 25 mg/kg
KADAR_SGPT
Tukey HSD
KELOMPOK N
Subset for alpha = 0.05
1 2
dosis 625 mg/kg bb 5 35.80
katekin 2 mg/kg bb 5 42.60
tanpa perlakuan 5 46.00
dosis 125 mg/kg bb 5 49.60
dosis 25 mg/kg bb 5 62.40
dosis 5 mg/kg bb 5 93.00
cmc Na 0,5% 5 334.40
Sig. .926 1.000
Means for groups in homogeneous subsets are displayed. dosis 125 mg/kg
bb -3.600 52.470 1.000 -170.04 162.84
dosis 625 mg/kg
bb 10.200 52.470 1.000 -156.24 176.64
cmc Na 0,5% -288.400* 52.470 .000 -454.84 -121.96
katekin 2 mg/kg
bb 3.400 52.470 1.000 -163.04 169.84
*. The mean difference is significant at the 0.05
Lampiran 15. (lanjutan).
Test of Homogeneity of Variances
KADAR_SGOT
Levene Statistic df1 df2 Sig.
ANOVA
KADAR_SGOT
Sum of
Squares df Mean Square F Sig.
Between Groups 254301.486 6 42383.581 32.994 .000
Within Groups 35968.400 28 1284.586
Total 290269.886 32
tanpa
*. The mean difference is significant at
Homogeneous Subsets
KADAR_SGOT
KELOMPOK N
Subset for alpha = 0.05
1 2 3
Tukey HSDa tanpa perlakuan 5 35.20
dosis 625 mg/kg bb 5 45.60
katekin 2 mg/kg bb 5 52.00 52.00
dosis 125 mg/kg bb 5 59.60 59.60
dosis 25 mg/kg bb 5 75.60 75.60
dosis 5 mg/kg bb 5 121.60
cmc Na 0.5% 5 296.80
Sig. .570 .063 1.000
Means for groups in homogeneous subsets are displayed.
DAFTAR PUSTAKA
Aggarwal, B.B., Sundaram, C., dan Malani, N. (2006). Curcumin: The Indian Solid Gold. J. Sciences. Vacte. 5(1): 332.
Aluko, B.T., Oloyede, O.I., dan Afolayan, A.J. (2013). Hepatoprotective Activity Of Ocimum americanum L Leaves Against Paracetamol-Induced Liver Damage In Rats.American Journal of the Sciences. 1(2): 37-42.
Anyasor, G.H., Matthew, O.T., dan Fadairo, O. (2013). Costus Afer Stem Extracs Protected Aganist Paracetamol Induced Oxidative Stress And Liver Damage In Rats.Spatula DD. 3(4): 147-154.
Arhoghro, E.M., Ekpo, K.E., Anosike, E.O., dan Ibeh, G.O. (2009). Effect of Aqueos Extract of Bitter Leaf (Vernonia amygdalina Del) on Carbon Tetrachlorida (CCl4) Induced Liver Damaged in Albino Wistar Rats.
European J. ScientificRes. 26(1): 122 – 130.
Armansyah, T.R., Sutriana, A., Aliza, D., Vanda, H.,dan Rahmi, E. (2010). Aktivitas Hepatoprotektif Ekstrak Etanol Daun Kucing-kucingan (Acalypha indica L.) pada Tikus Putih (Rattus novergicus) yang Diinduksi Parasetamol.Jurnal Ilmiah Ilmu-Ilmu Peternakan. 13(6): 292 – 297.
Baron, D.N. (1992). Kapita Selekta Patologi Klinik. Edisi Keempat. Penerjemah. Pilur Andrianto, dan Joko Gunawan. Terjemahan dari: A Short Textbook of Chemical Pathology. Jakarta: Penerbit Buku Kedokteran EGC. Hal. 113-231.
Blum, A.L., Dolle, W., dan Kortum, K. (1977). Treatment of Acute Viral Hepatitis with (+)-cyanidol 3. Lancet. 2(12): 1153 – 1155.
Citrosupomo, G. (1991). Taksonomi Tumbuhan (Spermatophyta). Cetakan 3. Yogyakarta: Gadjah Mada University Press. Hal. 444-445.
Damjanov, I. (2000). Buku Teks dan Atlas Berwarna Histologi. Alih Bahasa Valen Brahm. Jakarta: Penerbit Widya Medika. Hal. 213 – 217.
Departemen Kesehatan dan Kesejahteraan Sosial RI. (2001). Inventaris Tanaman Obat Indonesia. Jilid I. Jakarta: Departemen Kesehatan dan Kesejahteraan Sosial RI. Hal. 105 – 106.
Depkes R.I. (1979). Farmakope Indonesia. Edisi Ketiga. Jakarta: Departemen Kesehatan Republik Indonesia. Hal. 9- 33.
Ditjen POM. (1995). Materia Medika Indonesia. Edisi VI. Jakarta: Departemen Kesehatan Republik Indonesia. Hal. 323-325.
Ditjen POM. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Cetakan pertama. Jakarta: Departemen Kesehatan RI. Hal. 5, 10-11.
Donatus, I.A., Suyjipto, N.S.,dan Wahyono, D. (1983). Pengaruh Cairan Yang Keluar Dari Batang Bambusa vulgaris Schard Terhadap Regenerasi Sel-Sel Hepar Tikus Putih Jantan. Risalah Simposium Penelitian Tumbuhan Obat III. Skripsi. Yogyakarta: Fakultas Farmasi Universitas Gadjah Mada.
Edward, Z. (2009). The Function Utilization of Gambier (Uncaria gambir) as The Hepatoprotector. Riset Kimia. 1(14): 25 – 28.
Eroschenko, V.P. (2004). Atlas Histologi. Edisi ke-9. Jakarta: Penerbit Buku Kedokteran EGC. Hal. 249 – 253.
Fawceet, D.W. (2002). Buku Ajar Histologi. Edisi VII. Alih BahasaJaren Tambayong. Jakarta: Penerbit Buku Kedokteran EGC. Hal. 145 – 151.
Flore, M.S.H. (1998). Atlas of Human Histology. Edisi V. Philadelphia: Lea and Febiger. Hal. 93 – 100.
Gaze, D.C. (2007). The Role of Existing and Novel Cardiac Biomarkers for Cardioprotection. Curr Opin Invest Drugs. 8(9): 711 – 712.
Goodman, A., dan Gilman, H. (2007). Dasar Farmakologi Terapi. Edisi kesepuluh. Volume 1. Jakarta: Penerbit Buku Kedokteran EGC. Hal. 682 – 684.
Hartono, Nurwati, I., Ikasari, F., dan Wiryanto. (2005). Pengaruh Ekstrak Rimpang Kunyit (Curcuma domestica Val) Terhadap Peningkatan Kadar AST dan ALT Tikus Putih (Rattus novergicus) Akibat Pemberian Parasetamol. Biofarmasi. 3(2): 57 – 60.
Hurkadale, P.J., Shelar, P.A., Palled, S.G., Mandavkar, Y.D., dan Khedkar, A.S. (2012). Hepatoprotevtive Activity Of Amorphophallus Paeoniifolius Tubers Against Paracetamol-Induced Liver Damage In Rats. Asian Pacific Journal of Tropical Biomedicine. 21(2): S238-S242.
Husadha, Y. (1996). Fisiologi dan Pemeriksaan Hepar. Dalam: Buku Ajar Ilmu Penyakit Dalam. Jilid 1. Edisi ketiga. Jakarta: Balai Penerbit FKUI. Hal. 224 – 226.
Ibrahim, M., Khaja, M.N.,dan Aara, A. (2008).Hepatoprotective Activity of
Sapindus mukorossi and Rheum emodi extracts: In Vitro and In VivoStudies.
Jaeschke, H., dan Bajt, M.L. (2006). Intracelluler Signaling Mechanism Of Acetaminophen-Induced Liver Cell Death. Toxicology Sciences. 89(1): 31-41.
James, L.P., Mayenix, P.R., dan Hinson, J.A. (2003). Acetaminophen-Induced Hepatotoxicity. Journal Of Drug Metabolism and Dispotition. 13(12): 1499-1506.
Junqueira, L.C.J., dan Kelley, R.O. (1992). Histologi Dasar. Edisi III. Alih bahasa Jack Tambayong. Jakarta: Penerbit Buku Kedokteran EGC. Hal. 85 – 99. Katzung, B.G. (2014). Farmakologi Dasar dan Klinik. Penerjemah dan Editor:
Bagian Farmakologi Fakultas Kedokteran Universitas Erlangga. Edisi XII. Jakarta: Penerbit Salemba Medika. Hal.53 - 64.
Kristina, N.N., Noveriza, R., Syahid, S.F., dan Rizal, M. (2006). Peluang Peningkatan Kadar Kurkumin Pada Tanaman Kunyit dan Temulawak. Jakarta. Dalam
Lin, S.C., Chung, T.C., Ueng, T.H., Lin, Y.H., Hsu, L., Chiang, C.L., dan Lin, C.C. (2000). The Hepatoprotective Effects of Solanum alatum Moench. on Acetaminophen-Induced Hepatotoxicity in Mice. World Scientific. 15(149): 123- 126.
Diakses tanggal 1November 2009.
Lu, F.C. (1994). Toksikologi Dasar Asas, Organ Sasaran, dan Penilaian Risiko. Edisi ke-2. Jakarta: UIP. Hal. 206 – 217.
Luft, R. (1995). The Development of Mitochondrial Medicine Biochimia et Biophysica Acta. Clinical Pathology. 9(1271): 1-6.
Muhlisah, F. (1999). Temu-temuan dan Empon-empon: Budi Daya dan Manfaatnya. Yogyakarta: Penerbit Kanisius. Hal. 53 – 54.
Mursito, B. (2003). Ramuan Tradisional Untuk Pelangsing Tubuh. Jakarta: Penerbit Penebar Swadaya. Hal. 82-83.
Mycek, M.J., Haevery, R.A., dan Champe, P.C. (2001). Farmakologi: Ulasan Bergambar. Penerjemah: Amru Agoes. Edisi II. Jakarta: Penerbit Widya Medika. Hal. 209.
National Agency of Drug and Food Control The Republic of Indonesia. (2004).
Monograph of Indonesian Medisinal Plant Extracts. Volume 1. Jakarta: NADFC RI. Hal. 29 – 31.
Pal, D., dan Nindhi, M. (2005). CNS Activities of Celesia coromandeliane Vahl. in Mice. Acta Poloniae Pharmaceutica. 62(5): 355-261.
Parmar, N.S., dan Prakash, S. (2006). Screening Methods in Pharmacology. Ahmedadab: Alpha Science International. Hal. 297.
Pradita, D. (2010). Uji Efek Ekstrak Rimpang Temu Giring (Curcuma heyneana
Valeton & Zijp.) Sebagai Penurun Kadar Kolesterol Darah Marmot Jantan (Cavia porcellus). Skripsi. Medan:Fakultas Farmasi Universitas Sumatera Utara.
Prasetya, R.B. (2011). Pengaruh Ekstrak Rimpang Temu Giring (Curcuma heyneana Valeton & zijp.) Terhadap Aktivitas Fagositosis pada mencit Jantan. Skripsi. Medan: Fakultas Farmasi Universitas Sumatera Utara.
Price, S.A., dan Wilson, L.M. (1997). Patofisiologi Konsep Klinis Proses-proses Penyakit. Jakarta: Penerbit Buku Kedokteran EGC. Hal. 426 – 433.
Rahmi, E.P. (2011). Efek Immunodulator Ekstrak Rimpang Temu Giring (Curcuma
heyneana Valeton & Zijp.) Terhadap Respon Hipersensitivitas Tipe Lambat DAN Titer Antibodi Sel Imun Mencit Jantan. Skripsi. Medan: Fakultas Farmasi Universitas Sumatera Utara.
Sacher, L., dan Person, M. (2002). Tinjauan Klinis atas Hasil Pemeriksaan Laboratorium. Edisi 11. Jakarta: Penerbit Buku Kedokteran EGC. Hal. 369 – 370.
Sherlock, S. (1990). Diseases of The Liver and Biliary System. London: Blackwell Scientific Publication. Hal. 380.
Sodsai, A. (2006). Study of Immunomodulatory Effect of Curcuma comosa Roxb. Thesis for the Degree of Doctor of Philosophy. Bangkok: Mahidol University.
Sudiana, K. (2005). Teknologi Ilmu Jaringan dan Immunohistokimia. Jakarta: CV. Sagung Seto. Hal. 2.
Suyatna, F.D., Syamsudin, G.S., dan Sadikin, M. (2010). Efek Kurkumin Terhadap Aktivitas Enzim Glutation Peroksidase Mitokondria Hati Tikus Yang Diinduksi Dengan Butilhidroksiperoksida-Tersier. Sains Medika. 1(1): 16 – 23.
Underwood, J.C.E. (1997). Patologi Umum dan Sistemik. Vol II. Edisi 2. Jakarta: Penerbit Buku Kedokteran EGC. Hal. 224 – 230.
Vandivu, R., Krithika, A., Biplab, C., Dedeepya, P., Shoeb, N., dan Lakshmi, K.S. (2008). Evaluation of Hepatoprotective Activity of the Fruits of Coccinia grandis Linn. International Journal of Health Research. 1(3): 163-168. Widmann. (1995). Tinjauan Klinis atas Hasil Pemeriksaan Laboratorium.
Jakarta: Penerbit Buku Kedokteran EGC. Hal. 325 – 400.
Wijayakusuma, H.M. (2006). Sehat Bersama Temu Giring. Dalam http://suarakarya-online.com. Diakses tanggal 13 Agustus 2008.
Wijayakusuma,H.M. (2005). Kunyit dan Temulawak Untuk Mencegah Flu Burung.Dikutip tanggal 01 Juli 2008.
Wilmana, P.F. (1995). Analgesik-antipiretik Analgesik Anti-inflamasi Nonsteroid dan Obat Pirai. Dalam: Farmakologi dan Terapi. Edisi keempat. Jakarta: FK UI Press. Hal. 214 – 215.
Windono, T., Bos, R., Woerdenbag, H.J., Boersma, Y.L., Koulman, A., dan Kayser, O. (2007). HPLC - Photodiode Array Detection Analysis of Curcuminoids in Curcuma Species Indigenous to Indonesia. Department of Pharmaceutical Biology, Groningen Research Institute of Pharmacy. Belanda:University of Groningen.
Woodhead, J.L., Howell, B.A., Yang, Y., Harril, A.H., Clewell, H.J., Andersen, M.E., Siler, S.Q., dan Watkins, P.B. (2012). An Analysis of N-Acetylcystein Treatment for Acetaminophen Overdose Using a Systems Model of Drug-Induced liver Injury. The Journal of Pharmacology and Experimental Theurapeutics. 342(2): 529 – 540.
Yellia, M. (2003). Cara Bijak Menaklukan Kanker. Jakarta: Agromedia Pustaka. Hal. 25 – 31.
BAB III
METODE PENELITIAN
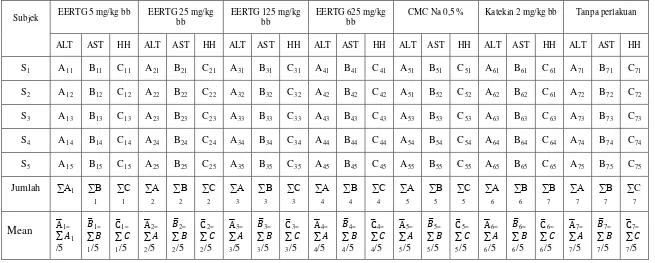
Tabel 3.1 Matriks penelitian uji aktivitas hepatoprotektor (AH) EERTG terhadap aktivitas katalisatoralanin aminotransferase (ALT), aspartat aminotransferase(AST) dan histopatologi hepar tikus putih jantan yang diinduksi parasetamol.
Subjek EERTG 5 mg/kg bb EERTG 25 mg/kg bb EERTG 125 mg/kg bb EERTG 625 mg/kg bb CMC Na 0,5 % Katekin 2 mg/kg bb Tanpa perlakuan
A : Aktivitas katalisator ALT serum darah tikus HH : Histopatologi Hepar tikus B : Aktivitaskatalisator AST serum darah tikus
C :Gambaran histopatologi hepar tikus
A B C xy yaitu AH tikus dari kelompok x subjek y
3.1 Alat-alat
Timbangan hewan, neraca analitik, lemari pengering, perkolator, rotary evaporator, alat-alat gelas laboratorium (pyrex), aluminium foil, micropipette (thermoscientific), spuit injeksi (terumo), sonde lambung, centrifuge(velocity),
incubator (thermoscientific), mikroskop cahaya (boeco), objek glass, tabung reaksi (pyrex), rak tabung reaksi, spektrofotometer UV (Thermoscientific).
3.2 Bahan-bahan
Sampel yang digunakan dalam penelitian ini adalah serbuk simplisia rimpang temu giring (Curcuma heyneana). Bahan-bahan kimia yang digunakan adalah etanol 96%, air suling, CMC Na 0,5%, parasetamol, katekin, reagen kit ALT Dyasis®, reagen kit AST Dyasis®, buffer formalin 10%, dan zat warna (hematoksilin dan eosin).
3.3Hewan Percobaan
Hewan percobaan yang digunakan dalam penelitian ini adalah tikus putih jantan (Rattus novergicus)galur Wistar, berat badan 150-200 gram sebanyak 35 ekor dengan kondisi sehat. Hewan diaklimatisasi selama 1 minggu dengan tujuan untuk menyeragamkan makanan dan hidupnya dengan kondisi yang serba sama sehingga dianggap memenuhi syarat penelitian.
3.4Pengambilan sampel
3.5 Pemeriksaan Karakterisasi Simplisia
Pemeriksaan karakteristik simplisia meliputi pemeriksaan organoleptik, makroskopik dan mikroskopik, penetapan kadar air, penetapan kadar abu total, penetapan kadar abu tidak larut asam, penetapan kadar sari larut dalam air, dan penetapan kadar sari larut dalam etanol (Ditjen POM, 1989).
3.5.1 Pemeriksaan Organoleptis dan Makroskopik
Pemeriksaan organoleptis dilakukan terhadap simplisia meliputi pemeriksaan warna, bau, dan rasa. Pemeriksaan makroskopik terhadap simplisia meliputi pemeriksaan bentuk, diameter, ketebalan, dan tekstur.
3.5.2 Pemeriksaan Mikroskopik
Pemeriksaan mikroskopik terhadap serbuk simplisia dilakukan dengan cara meneteskan larutan kloralhidrat di atas kaca objek, kemudian di atasnya diletakkan serbuk simplisia, lalu ditutup dengan kaca penutup dan dilihat di bawah mikroskop.
3.5.3 Penetapan Kadar Air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen). Alat terdiri dari labu alas bulat 500 ml, alat penampung, pendingin, tabung penyambung, dan tabung penerima 5 ml.
didestilasi dengan kecepatan 2 tetes tiap detik hingga sebagian besar air terdestilasi, kemudian kecepatan destilasi ditingkatkan hingga 4 tetes tiap detik. Setelah semua air terdestilasi, bilas bagian dalam pendingin dengan toluen. Destilasi dilanjutkan selama 5 menit, kemudian labu penerima dibiarkan mendingin pada suhu kamar dan dibersihkan tetesan air yang mungkin masih terdapat pada dinding tabung penerima. Setelah air dan toluen memisah sempurna, dibaca volume air dengan ketelitian 0,05 ml (Volume I). Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa, dan destilasi dilanjutkan lagi sebagi volume II.Lakukan pengulangan sekali lagi (Volume III). Hitung kadar air dalam persen.
3.5.4 Penetapan Kadar Abu Total
Caranya: sebanyak 2 g serbuk yang telah digerus dan ditimbang seksama dimasukkan dalam krus porselin yang telah dipijar dan ditara, kemudian diratakan. Krus porselin dipijar perlahan-lahan sampai arang habis, pemijaran dilakukan pada suhu 600°C selama 3 jam kemudian didinginkan dan ditimbang sampai diperolehbobot tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan di udara (Ditjen POM, 1989).
3.5.5 Penetapan Kadar Abu Tidak Larut Dalam Asam
3.5.6 Penetapan Kadar Sari Larut Air
Caranya: sebanyak 5 g serbuk yang telah dikeringkan di udara, dimaserasi selama 24 jam dalam 100 ml air-kloroform (2,5 ml kloroform dalam air suling sampai 1 liter) dalam labu bersumbat sambil sesekali dikocok selama 6 jam pertama, kemudiam dibiarkan selama 18 jam, kemudian disaring. Sejumlah 20 ml filtratpertama diuapkan sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105°C sampai bobot tetap. Kadar dalam persen sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan di udara (Ditjen POM, 1989).
3.5.7 Penetapan Kadar Sari Larut Etanol
3.6 Skrining Fitokimia
3.6.1 Pemeriksaan Alkaloida
Serbuk simplisia ditimbang sebanyak 0,5 g kemudian ditambah 1 ml asam klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama 2 menit. Dingin dan disaring. Filtrat digunakan untuk percobaan berikut:
a. Filtrat sebanyak 3 tetes ditamabah dengan 2 tetes larutan peraksi Mayer, akan terbentuk endapan menggumpal berwarna putih atau kuning
b. Filtrat sebanyak 3 tetes ditambah pereaksi Bouchardat, akan terbentuk endapan berwarna coklat sampai hitam.
c. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes pereaksi Dragendorff, akan terbentuk warna merah atau jingga.
Alkaloida positif jika terjadi endapan atau kekeruhan paling sedikit dua dari ketiga percobaan di atas (Ditjen POM, 1989).
3.6.2 Pemeriksaan Flavonoida
Sebanyak 0,5 g simplisia disari dengan 10 ml metanol, lau direfluks selama 10 menit. Kemudian disaring panas-panas melalui kertas saring kecil berlipat. Filtrat diencerkan dengan 10 ml air. Setelah dingin ditambahkan 5 ml eter, dikocok hati-hati dan didiamkan. Lapisan methanol diambil, lalu diuapkan pada suhu 40°C, sisanya dilarutkan dalam 5 ml etil asetat, disaring. Filtrat digunakan untuk uji flavonoida dengan cara berikut:
waktu 2 sampai 5 menit terjadi warna merah intensif, menunjukkan adanya flavonoida.
b. Sebanyak 1 ml larutan percobaan diuapkan hingga kering, sisa dilarutkan dalam 1 ml etanol 95%, lalu ditambahkan 0,1 g serbuk magnesium dan 10 ml HCl (p)
3.6.3 Pemeriksaan Saponin
, terjadi warna merah jingga, menunjukkan adanya flavonoida (Ditjen POM, 1989).
Sebanyak 0,5 g serbuk simplisia, dimasukkan ke dalam tabung reaksi. Ditambahkan air panas, didinginkan kemudian dikocok kuat-kuat selama 10 detik. Jika terbentuk buih yang mantap setinggi 1 sampai 10 cm, tidak kurang dari 10 menit dan tidak hilang dengan penambahan asam klorida 2 N menunjukkan adanya saponin (Ditjen POM, 1989).
3.6.4 Pemeriksaan Glikosida
3.6.5 Pemeriksaan Tanin
Sebanyak 0,5 g serbuk simplisia, disari dengan 10 ml air suling lalu dipanaskan, disaring. Filtratnya diencerkan dengan air sampai ridak berwarna. Larutan diambil sebanyak 2ml dan ditambahkan 1-2 tetes pereaksi besi (III) klorida 1%. Jika terjadi warna biru atau hijau kehitaman, menunjukkan adanya tannin (Ditjen POM, 1989).
3.6.6 Pemeriksaan Steroida dan Triterpenoida
Sejumlah 1 g serbuk dimaserasi dengan 20 ml eter selama 2 jam, disaring, filtrat diuapkan di cawan penguap. Sisanya ditambahkan asam asetat anhidrat dan asam sulfat pekat (Pereaksi Liebermann-Burchard). Apabila terbentuk warna ungu atau merah yang berubah menjadi biru ungu atau biru hijau menunjukkan adanya steroida/triterpenoida (Ditjen POM, 1989).
3.7 Pembuatan Ekstrak Etanol Rimpang Temu giring (EERTG)
dengan alat penguap vakum putar (rotary evaporator) sampai sebagian besar pelarutnya menguap, dan dilanjutkan proses penguapan di atas penangas air sampai diperoleh ekstrak kental.
3.8Pemeriksaan Karakterisasi Ekstrak
Pemeriksaan karakterisasi ekstrak meliputi penetapan kadar air, penetapan kadar abu total, penetapan kadar abu tidak larut dalam asam (Ditjen POM, 2000).
3.8.1 Penetapan kadar air
Penetapan kadar air dilakukan menurut metode Azeotropi (destilasi toluen). Alat terdiri dari labu alas bulat 500 ml, pendingin, tabung penyambung dan tabung penerima 5 ml berskala 0,05 ml, alat penampung dan pemanas listrik. Cara kerja:
volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen (Ditjen POM, 1995).
3.8.2 Penetapan kadar abu total
Sebanyak 2 g ekstrak dimasukkan dalam krus porselin yang telah dipijar dan ditara, kemudian diratakan. Krus dipijar perlahan-lahan sampai arang habis, jika arang masih tidak dapat dihilangkan, ditambahkan air panas, saring melalui kertas saring bebas abu. Pijarkan sisa dan kertas saring dalam krus yang sama. Masukkan filtrat ke dalam krus, uapkan, pijarkan hingga bobot tetap, timbang. Kadar abu dihitung terhadap bahan yang telah dikeringkan (Ditjen POM, 1995).
3.8.3 Penetapan kadar abu tidak larut dalam asam
Abu yang diperoleh dalam penetapan kadar abu dididihkan dalam 25 ml asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan, disaring melalui kertas saring bebas abu, cuci dengan air panas, dipijarkan, kemudian didinginkan dan ditimbang sampai bobot tetap. Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang telah dikeringkan.
3.9Pembuatan CMC 0,5%
3.10 Pembuatan suspensi Ekstrak Etanol Rimpang Temu Giring (EERTG)
Pembuatan suspensi EERTG 5% (b/v) dilakukan dengan cara sebagai berikut: sebanyak 1,25 gram EERTG dimasukkan kedalam lumpang, kemudian ditambahkan sedikit demi sedikit CMC 0,5% sambil digerus sampai homogen. Masukkan suspensi EERTG kedalam labu tentukur, tambahkan CMC 0,5% sampai 25 ml.
3.11 Pembuatan Suspensi dan Penentuan Dosis Parasetamol 20%
Suspensi parasetamol dalam CMC 0,5% dibuat dengan cara melarutkan 10 gram serbuk parasetamol yang telah ditimbang ke dalam CMC 0,5% di dalam lumpang, digerus hingga homogen, kemudian di encerkan dengan sebagian larutan CMC 0,5%. Masukkan ke dalam labu tentukur 50 ml, cukupkan volumenya dengan larutan CMC 0,5% sampai garis tanda. Dosis parasetamol dipilih berdasarkan dosis hepatotoksiknya terhadap tikus yaitu 2g/kg bb (Donatus et al., 1983; Parmar, 2006).
3.12 Pembuatan Larutan Katekin 0,01%
3.13Pembuatan Larutan Buffer Formalin 10%
Pembuatan larutan buffer formalin 10% dilakukan dengan cara sebagai berikut: sebanyak 4,0 gram sodium hidrogen fosfat mono basik (NaH2PO4), 6,5 gram sodium hidrogen fosfat dibasik (Na2HPO4) dilarutkan dalam 900 ml akuadest. Setelah larut, tambahkan 100 ml formaldehyde 37-40%, aduk sampai homogen (Sudiana, 2005).
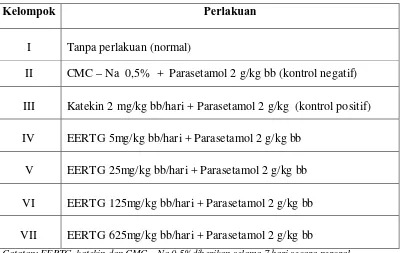
3.14 Pengujian Aktivitas Hepatoprotektor
Tabel 2.2 Pengujian aktivitas hepatoprotektor
Kelompok Perlakuan
I Tanpa perlakuan (normal)
II CMC – Na 0,5% + Parasetamol 2 g/kg bb (kontrol negatif)
III Katekin 2 mg/kg bb/hari + Parasetamol 2 g/kg (kontrol positif)
IV EERTG 5mg/kg bb/hari + Parasetamol 2 g/kg bb
V EERTG 25mg/kg bb/hari + Parasetamol 2 g/kg bb
VI EERTG 125mg/kg bb/hari + Parasetamol 2 g/kg bb
VII EERTG 625mg/kg bb/hari + Parasetamol 2 g/kg bb
Catatan: EERTG, katekin,dan CMC – Na 0,5%diberikan selama 7 hari secara peroral
3.15 Pengukuran Parameter Biokimia ALT dan AST
aktivitas hepatoprotektor apabila aktivitas katalisatorALT dan AST dari EERTG lebih rendah dibandingkan kelompok kontrol negatif (CMC Na 0,5% + parasetamol). Pemeriksaan ALT dan AST dilakukan di Laboratorium Kesehatan, Dinas Kesehatan Provinsi Sumatera Utara.
3.16 Pemeriksaan Kerusakan Organ Hepar
3.16.1 Pemeriksaan Makroskopik Organ Hepar
Tikus dibedah kemudian diambil organ hepar, kemudian dicuci dengan larutan NaCl 0,9% untuk membersihkan dari sisa darah yang menempel. Pengamatan dilakukan dengan mengamati warna dan tekstur permukaan hepar tikus.
3.16.2 Pemeriksaan Mikroskopik Organ Hepar (Histopatologi Hepar)
Hepar hewan percobaan diambil dan dimasukkan ke dalam larutan buffer formalin 10%. Lalu dibuat preparat dengan ketebalan 4-6 mm, diwarnai dengan hekmatosilin dan eosin dan dilihat di bawah mikroskop.
hematoksilin-eosin (HE). Pemeriksaan histopatologi dilakukan dan berdasarkan prosedur kerja yang diterapkan di laboratorium patologi anatomi Fakultas Kedokteran Universitas Sumatera Utara.
3.17Analisis Data
BAB IV
HASIL DAN PEMBAHASAN
4.1 Pemeriksaan Bahan Tumbuhan
Sampel yang digunakan berupa serbuk simplisia tumbuhan rimpang temu giring (Curcuma heyneana Val) yang diperoleh dari PT. Sumatera Busan (Lampiran 1 halaman 70).
4.1.1 Karakterisasi simplisia dan ekstrak
Hasil pemeriksaan makroskopik simplisia rimpang temu giring diperoleh bentuk keping pipih, ringan, diameter 2-4 cm dan ketebalan 1-4 mm, bagian tepi berombak atau keriput, warna kuning terang, bau khas aromatik, rasa sedikit pedas dan lama kelamaan menimbulkan rasa tebal (Lampiran 3 halaman 72). Hasil pemeriksaan mikroskopik serbuk simplisia rimpang temu giring terlihat adanya butir pati, tetes minyak atsiri, parenkim, rambut penutup, pembuluh kayu dan fragmen gabus(Lampiran 5 halaman 76).
Tabel 4.1 Hasil karakterisasi serbuk simplisiarimpang temu giring
Hasil karakterisasi serbuk simplisia memenuhi syarat berdasarkan persyaratan pada (MMI) Materia Medika Indonesia (1989), karena kadar air tidak lebih dari 10%, sedangkan kadar air simplisia yang diperoleh adalah 9,14%.
Penetapan kadar sari larut air untuk mengetahui banyaknya sari larut dalam pelarut air. Senyawa yang dapat larut dalam air adalah glikosida, gula, gom, protein, enzim, zat warna, dan asam organik. Kadar sari larut air diperoleh 17,18%. Kadar sari larut etanol yang diperoleh 24,87%, kadar tersebut sesuai dengan persyaratan yang tercantum di dalam MMI.Penetapan kadar sari dilakukan untuk mengetahui kandungan senyawa kimia yang larut dalam air maupun dalam etanol. Senyawa yang dapat larut dalam etanol adalah glikosida, antrakinon, steroida, flavonoida, klorofil, dan dalam jumlah sedikit yaitu lemak dan saponin (Depkes, 1979). Penetapan kadar abu total bertujuan untuk mengetahui kadar senyawa-senyawa anorganik seperti oksida logam Mg, Ca, Pb, dan Si. Pada penetapan kadar abu tidak larut asam, senyawa anorganik yang tidak larut adalah silika. Besarnya kandungan logam tersebut, dapat membahayakan kesehatan. Hasil yang didapat untuk kadar abu total adalah 4,54% dan kadar abu tidak larut asam adalah 1,4%, kadar tersebut juga memenuhi persyaratan yang tercantum di dalam MMI.Hasil pemeriksaan karakterisasi ekstrak etanol rimpang temu giringdapat dilihat pada Tabel 4.2.
No Karakteristik serbuk simplisia Simplisia
Kadar (%) Persy. MMI
1 Kadar air 9,14 < 10
2 Kadar sari larut dalam air 17,18 > 16 3 Kadar sari larut dalam etanol 24,87 > 6
4 Kadar abu total 4,54 < 9
Tabel 4.2 Hasil karakterisasi ekstrak etanol rimpang temu giring (EERTG)
Hasil karakterisasi ekstrak etanol rimpang temu giring memenuhi syarat berdasarkan persyaratan pada Materia Medika Indonesia. Kadar air yang diperoleh pada hasil karakterisasi ekstrak adalah 3,97% sehingga ekstrak yang diperoleh merupakan ekstrak kental karena masih mengandung sedikit air.
Hasil penyarian 500 gram serbuk simplisia rimpang temu giring dengan pelarut etanol 96% diperoleh ekstrak kental 95,32 gram (rendemen 19,06%).
4.1.2 Skrining fitokimia serbuk simplisia dan ekstrak rimpang temu giring
Hasil skrining fitokimia serbuk simplisia dan ekstrak etanol rimpang temu giring menunjukan hasil yang sama, dapat dilihat pada Tabel 4.3 berikut ini.
Tabel 4.3 Hasil skrining fitokimia serbuk simplisia dan ekstrak rimpang temu giring
4.2 Hasil pengukuran Parameter biokimia ALT dan AST
4.2.1 Aktivitas Alanin Aminotransferase (ALT)
Pengukuran aktivitas katalisator ALT dilakukan pada hari ke-8 setelah 24 jam penginduksian parasetamol. Pada pengukuran, aktivitas enzim ALT mengkatalisis reaksi alanin + 2-oxoglutarat glutamat + piruvat, menunjukkan
No Karakteristik ekstrak Simplisia
Kadar (%) Persy. MMI
1 Kadar air 3,97 < 9,6
2 Kadar abu total 0,42 < 0,5
3 Kadar abu yang tidak larut dalam asam 0,10 < 0,2
No Pemeriksaan Serbuk simplisia Ekstrak
46
kadar enzim tersebut di dalam darah. Hasil pengukuran secara rinci dapat dilihat pada Tabel 4.4 dan Gambar 4.1.
Tabel 4.4 AktivitasALT tikus putih yang diinduksi parasetamol pada pengukuran hari ke-8 (Mean ± SD)
Ket : a berbeda signifikan dengan kelompok perlakuan lain (p < 0,05)
Hasil orientasi pada tikus jantan yang diberi EERTG dosis 5, 25, dan 125 mg/kg bb menunjukkan penghambatan peningkatan aktivitas ALT dibandingkan dengan CMC-Na 0,5% sebagai kontrol negatif. Pada perlakuan, dosis EERTG ditingkatkan menjadi 625 mg/kg bb sehingga ada 4 variasi dosis yang digunakan yaitu: 5, 25, 125, dan 625 mg/kg bb (Gambar 4.1).
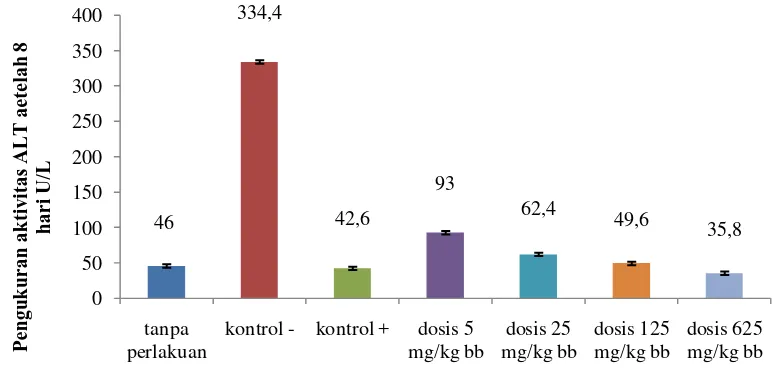
Gambar 4.1 Grafik pengukuran aktivitas ALT
Kelompok Perlakuan Jumlah
Berdasarkan Gambar 4.1 di atas, menunjukkan bahwa aktivitasALT pada kelompok tanpa perlakuan adalah 46 U/L, pada kelompok kontrol positif (katekin 2 mg/kg bb) ditemukan aktivitas ALT adalah 42,6 U/L. Dengan nilai tersebut menunjukkan bahwa aktivitas ALT yang diperoleh sesuai dengan aktivitasnormal ALT pada tikus yaitu berkisar antara 19,3 – 68,9 U/L (Baron, 1992). Sedangkan yang diperoleh pada kelompok kontrol negatif (CMC-Na 0,5%) dan suspensi parasetamol dosis 2 g/kg bb adalah 334,4 U/L; ini jauh lebih tinggi dibandingkan kelompok tanpa perlakuan dan menunjukkan perbedaan yang signifikan antar kelompok perlakuan ekstrak uji (p < 0,05). Peningkatan aktivitas enzim ALT ini menjadi petunjuk bahwa telah terjadi kerusakan hepar, karena sangat sedikit kondisi selain hepar yang berpengaruh terhadap kadar enzim ini dalam serum (Widmann, 1995). Hal ini mengisyaratkan bahwa pemberian suspensi parasetamol dosis 2 g/kg bb menyebabkan kerusakan hepar yang ditandai dengan peningkatan aktivitasALT dan sesuai dengan hasil penelitian Aluko, et al., (1999) tentang aktivitas hepatoprotektor Ocimum americanum L pada tikus putih jantan yang diinduksi parasetamol; Anyasor, et al., (2013) tentang aktivitas hepatoprotektor
Costus afer S pada tikus putih jantan yang diinduksi parasetamol; dan Lin,et al., (2000) tentang aktivitas hepatoprotektor Solanum alatum M pada mencit yang diinduksi parasetamol.
diberikan terlalu kecil. Aktivitas ALT yang tidak berbeda signifikan (p > 0,05) dengan kelompok tanpa perlakuan dan kontrol positif, namun berbeda signifikan (p < 0,05) dengan kontrol negatifmulai terlihat pada dosis 25, 125 dan 625 mg/kg bb. Secara keseluruhan dapat dilihat adanya penghambatan peningkatan aktivitasALT menuju normal seiring dengan peningkatan dosis EERTG, jadi fenomena ini petunjuk terjadinya hubungan dosis-daya hambat peningkatan. Hasil pengujian aktivitas hepatoprotektor kemudian dianalisis dengan uji perbedaan rata-rata antar kelompok (Uji ANAVA) dan hasil analisis data dilanjutkan dengan ujipost hoc dengan Tukey HSD.
Berdasarkan hasil analisis statistik diperoleh F hitung aktivitas ALT (8.365) > F Tabel (2,71); ini menunjukkan adanya hubungan yang bermakna (P<0,05) berarti terdapat perbedaan rata-rata antara variabel yang diuji.
4.2.2 Aktivitas Aspartat Aminotransferase (AST)
Pengukuran aktivitasAST dilakukan pada hari ke-8 setelah 24 jam penginduksian dengan parasetamol. Pada pengukuran, aktivitas enzim AST mengakatalisis reaksi aspartat + 2-oxoglutarat glutamat + oxaloacetic,
Tabel 4.5 Aktivitas AST tikus putih yang diinduksi parasetamol pada pengukuran hari ke-8 (Mean ± SD)
Kelompok Perlakuan Jumlah
Subjek
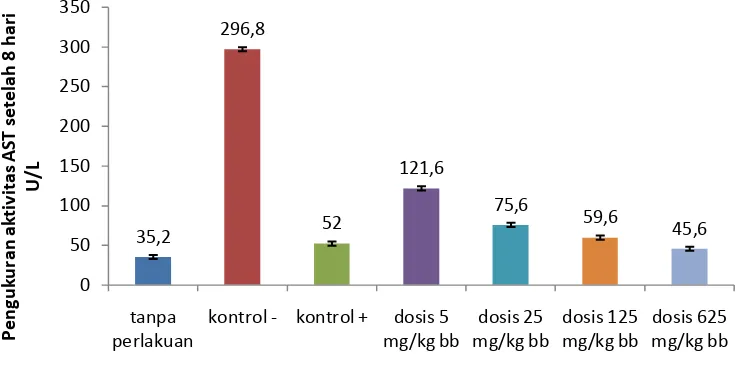
Hasil orientasi yang dilakukan pada tikus jantan yang diberikan EERTG dosis 5, 25, dan 125 mg/kg bb menunjukkan penghambatan peningkatan aktivitas AST dibandingkan dengan CMC-Na 0,5% sebagai kontrol negatif. Hal ini menunjukkan bahwa semakin tinggi dosis EERTG semakin besar aktivitas hepatoprotektor yang dihasilkan. Pada perlakuan, dosis EERTG ditingkatkan menjadi 625 mg/kg bb sehingga ada 4 variasi dosis yang digunakan yaitu 5, 25, 125, dan 625 mg/kg bb (Gambar 4.2).
Berdasarkan Gambar 4.2 di atas, aktivitas AST pada kelompok normal adalah 35,2 U/L, pada kelompok kontrol positif (katekin 2 mg/kg bb) ditemukan aktivitas AST adalah 52 U/L. Dengan nilai tersebut menunjukkan bahwa aktivitas AST yang diperoleh sesuai dengan aktivitas normal pada tikus, yaitu berkisar antara 29,8 – 77,0 U/L (Baron, 1992). Sedangkan yang diperoleh pada kelompok kontrol negatif (CMC Na 0,5%) dan suspensi parasetamol dosis 2 g/kg bb adalah 296,8 U/L; ini jauh lebih tinggi dibandingkan kelompok tanpa perlakuan dan menunjukkan perbedaan yang signifikan (p < 0,05) antar kelompok perlakuan EERTG. Dengan demikian disimpulkan bahwa pemberian suspensi parasetamol dosis 2 g/kg bb dapat merusak hepar yang ditandai dengan peningkatan aktivitasAST dan ini sesuai dengan hasil penelitian Aluko, et al., (1999) tentang aktivitas hepatoprotektor Ocimum americanum L pada tikus putih jantan yang diinduksi parasetamol; Anyasor, et al., (2013) tentang aktivitas hepatoprotektor
Costus afer S pada tikus putih jantan yang diinduksi parasetamol; dan Lin,et al., (2000) tentang aktivitas hepatoprotektor Solanum alatum M pada mencit yang diinduksi parasetamol.
Ini menunjukkan adanya aktivitas kurkumin sebagai antioksidan yang terkandung di dalam EERTG, sehingga mampu menghambat pembentukan metabolit NAPQIdari parasetamol dengan cara meningkatkan aktivitas glutation untuk mengkonjugasi metabolit NAPQI tersebut, yang dapat dilihat dari penghambatan peningkatan aktivitas enzim ALT dan AST menuju aktivitas normal seiring dengan peningkatan dosis EERTG yang diberikan. Pada enzim AST, aktivitas normal sedikit lebih tinggi dibandingkan enzim ALT, hal ini disebabkan karena peningkatan enzim AST bukan merupakan indikasi utama kerusakan hepar. AST banyak terdapat di jantung, otot rangka, ginjal dan pankreas (Husadha, 1996). Hal tersebut yang menyebabkan AST bukan parameter utama pada kerusakan hepar tanpa didukung pemeriksaan ALT yang lebih spesifik untuk kerusakan hepar. Beberapa enzim lain juga dapat dijadikan parameter pada kerusakan hepar, seperti alkalin pospatase (AP) yang lebih dominan bila terjadinya obstruksi pada saluran empedu dan meningkat bila ada gangguan pada tulang, gamma glutamil transpeptidase (GGT) yang meningkat pada obtruksi pada saluran empedu dan hepatitis, 5 – nukleotidase yang interpretasinya sama dengan alkali pospatase, hanya saja enzim ini lebih spesifik pada obstruksi bilier. Enzim-enzim tersebut merupakan parameter pendukung pada kerusakan hepar (Baron, 1992).
Hasil pengujian aktivitas hepatoprotektor kemudian dianalisis dengan uji perbedaan rata-rata antar kelompok (Uji ANAVA) dan hasil analisis data dilanjutkan dengan ujipost hoc menggunakan Tukey HSD.
P1
P2
P3
P4
P5
P6
P7
4.3 Gambaran Kerusakan Organ Hepar
4.3.1 Gambaran makroskopik organ hepar
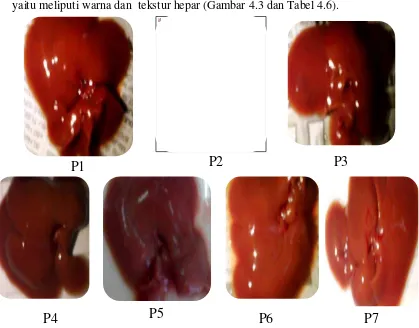
Setelah pembedahan dan pengamatan organ hepar, secara makroskopik dapat dilihat perbedaan organ hepar antara kelompok tanpa perlakuan, kontrol negatif, kontrol positif dan kelompok EERTG dosis 5, 25, 125, dan 625 mg/kg bb yaitu meliputi warna dan tekstur hepar (Gambar 4.3 dan Tabel 4.6).
Gambar 4.3 Makroskopik hepar tikus Keterangan :
P1 : Hepar tikus kelompok normal
P2 : Hepar tikus kelompok kontrol negatif P3 : Hepar tikus kelompok kontrol positif
Tabel 4.6 Pengamatan secara morfologi organ hepar tikus padahari ke-8
4.3.2 Gambaran mikroskopik hepar (Histopatologi hepar)
Pengamatan histopatologi dilakukan pada hari ke-8 setelah 24 jam pemberian parasetamol. Tikus yang masih hidup dikorbankan dengan cara dislokasi leher kemudian dibedah untuk diambil heparnya. Hasil pengamatan ini digunakan untuk menentukan derajat kerusakan sel-sel hepar akibat pemberian parasetamol dan efek hepatoprotektor dari ekstrak uji yang diberikan yaitu EERTG. Melalui pengamatan histopatologi ini dapat dilihat kerusakan organ pada tingkat yang tidak terlihat bila hanya diamati secara makroskopik (Tabel 4.7).
Tabel 4.7 Hasil histopatologi jaringan hepar tikus pada hari ke-8 berdasarkan kerusakan hepatosit
Kelompok Jenis Kerusakan Hepatosit Degenerasi Hidropik Nekrosis
P1 - -
Kontrol negatif (P2) Merah pucat sekali, bercak hitam
Licin, bintik-bintik hitam
Kontrol positif (P3) Merah pekat Licin
Dosis 5 mg/kg bb (P4) Merah pekat Licin, bintik-bintik coklat kehitaman Dosis 25 mg/kg bb (P5) Merah pekat Licin, bintik-bintik
merah Dosis 125 mg/kg bb (P6) Merah Licin
P4 - -
P5 - -
P6 - -
P7 - -
Keterangan : P=perlakuan; 1=tanpa perlakuan;2=kontrol negatif;3=kontrol positif;4,5, 6, dan 7 = dosis 5, 25, 125, dan 625 mg/kg bb; (-) = normal;(+) = terjadi kerusakan.
Pada Tabel 4.7 terlihat pada kelompok tanpa perlakuan, kontrol positif, EERTG dosis 5, 25, 125, dan 625 mg/kg bb tidak terjadi kerusakan hepatosit, sedang pada kelompok kontrol negatif terjadi kerusakan hepatosit yaitu degenerasi hidropik dan nekrosis.
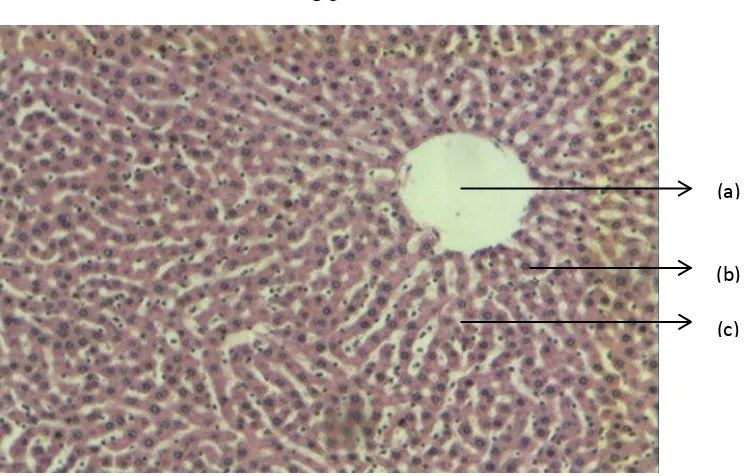
Gambar 4.4 Histopatologi jaringan hepar tikus (perbesaran 10x10)
Keterangan : (a) vena sentralis normal; (b) hepatosit normal; (c) sinusoid normal P1 : Hepar tikus kelompok normal
P2 : Hepar tikus kelompok kontrol negatif P3 : Hepar tikus kelompok kontrol positif
P4 : Hepar tikus kelompok EERTG dosis5 mg/kg bb P5 : Hepar tikus kelompok EERTG dosis 25 mg/kg bb P6 : Hepar tikus kelompok EERTG dosis 125 mg/kg bb P7 : Hepar tikus kelompok EERTG dosis 625 mg/kg bb
(b)
(c) (a)
Gambar 4.4 (lanjutan)
Keterangan : (a) vena sentralis yang mengalami kongesti; (b) hepatosit yang mengalami nekrosis yang dilihat dari inti sel piknotik, karyolisis dan karyoreksis; terjadi degenerasi hidropik pada hepatosit; (c) sinusoid tidak teratur; (d) terjadi infiltrasi sel radang; (e) terjadi hemorrage
(b) (e)
(d)
(a)
P2a
(c)
P2a
Keterangan: (a) vena sentralis normal; (b) hepatosit normal, namun beberapa mengalami piknotik; (c) sinusoid normal.
Gambar 4.4 (lanjutan)
Keterangan: (a) vena sentralis normal; (b) hepatosit normal; (c) sinusoid normal.
(c)
(a)
(b)
P3
P4
(a)
Keterangan: (a) vena sentralis normal; (b) hepatosit normal; (c) sinusoid normal
Gambar 4.4 (lanjutan)
Keterangan : (a) vena sentralis normal; (b) hepatosit normal; (c) sinusoid normal P5
(a)
(b)
(c)
P6
(c)
(b)
c
Gambar 4.4 (lanjutan)
Keterangan : (a) vena sentralis normal; (b) hepatosit normal; (c) sinusoid normal
Berdasarkan Gambar 4.4 di atas, pada keadaan normal (P1), vena sentralis merupakan sebuah pembuluh vena yang dikelilingi oleh sel endothelium yang tersusun rapat (Flore, 1981) dan terletak pada pusat lobulus dengan hepatosit tersusun secara teratur ke arah vena sentralis (Price, 1997). Di dalam hepatosit terdapat sitoplasma yang masih utuh dengan nukleus yang bulat. Di sepanjang hepatosit terdapat sinusoid tempat mengalirkan darah yang akan ditampung oleh vena sentralis (Junqueira, 1992; Fawcett, 2002). Pada kelompok kontrol negatif (P2) terlihat adanya indikasi kerusakan struktur hepar yang ditandai dengan kongesti vena sentralis yang diakibatkan oleh lisisnya sel endothelium sehingga lingkaran tidak utuh dan akhirnya lingkaran menjadi tidak jelas. Vena sentralis menerima darah dari sinusoid sebanyak 25% yang berasal dari arteri hepatika,
P7
sedangkan 75% berasal dari vena porta yang mengalirkan darah dari saluran cerna hasil absorbsi usus. Jadi, vena sentralis akan banyak menampung zat-zat hasil metabolisme yang dapat bersifat toksik maupun nontoksik. Banyaknya darah yang ditampung oleh vena sentralis akan menyebabkan konsentrasi zat yang bersifat toksik jauh lebih besar sehingga hal inilah yang memperjelas kerusakan vena sentralis (Price dan Wilson, 1997; Underwood, 1997). Pada inti sel hepatosit nampak sel hepar juga mengalami nekrosis ditandai dengan inti sel mengecil dan berwarna kehitaman (inti piknotik), inti sel pecah (karyoreksis) dan inti sel menghilang (karyolisis) (Price dan Wilson, 1997). Pada gambar (P2) menunjukkan adanya sel yang mengalami degenerasi hidropik. Di sini terlihat sel membengkak dan vakuola membesar. Hal ini sesuai dengan teori yang menyatakan bahwa degenerasi hidropik merupakan pertanda awal kerusakan sel akibat terganggunya permeabilitas membran sel akibat penurunan jumlah ATP, sehingga memudahkan molekul air masuk dari ekstrasel ke intrasel secara berlebihan akibatnya terjadi pembengkakan sel dan vakuola membesar (Underwood, 1997). Adanya infiltrasi sel radang berupa monosit dan limfosit akibat peradangan sel hepar sebagai respon imun sel kuppfer yang terdapat di sepanjang sinusoid.
parasetamol dengan cara peningkatan glutation di hepar sehingga mampu mengkonjugasi metabolit NAPQI yang terbentuk akibat pemberian parasetamol.
Berdasarkan uraian diatas, pemberian parasetamol dosis tinggi dapat menyebabkan kerusakan hepar dengan cara penurunan proses konjugasi dengan asam glukoronat dan asam sulfat hepar sehingga menigkatkan oksidasi yang dikatalisis Sitokrom P-450 sehingga terjadi peningkatan pembentukan NAPQI dan simpanan glutation hepar menjadi berkurang (James, et al., 2003).Terbentuknya metabolit NAPQI dalam jumlah banyak dan penurunan jumlah glutathion hepar, akan berakibat terbentuknya ikatan kovalen antara metabolit dengan makromolekul sel-sel hepar sehingga terjadi nekrosis atau kerusakan hepar (Husadha, 1996). Nekrosis dapat dilihat dengan berkurangnya jumlah inti pada sel atau hilangnya inti sama sekali dan pengeruhan pada sitoplasma (Thomas, 1998). Hepatosit yang rusak melepaskan faktor-faktor penarik yang mengaktivasi makrofag hepar, menyebabkan nekrosis dengan melepaskan enzim proteolitik dan oksigen reaktif. Sel-sel hepar yang rusak akan melepaskan enzim-enzim yang menandai kerusakan tersebut di antaranya peningkatan aktivitas ALT dan AST (Damjanov, 2000).
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Kesimpulan di dalam penelitian ini adalah:
a. Pemberian EERTG dapat mengurangi efek hepatotoksik dari parasetamol yang diinduksi, dengan menghambat peningkatan aktivitasALT dan AST. AktivitasALT pada kelompok kontrol negatif 334,4 U/L, AST 296,80 U/L.Aktivitas tersebut berbeda signifikan (P < 0,05) dengan kelompok EERTG dosis 5, 25, 125, dan 625 mg/kg bb pada serum tikus yang diperiksa.
b. Dosis efektif dari EERTG sebagai hepatoprotektor adalah pada dosis 25 mg/kg bb, dengan aktivitasALT = 62,4 U/L, AST = 75,6 U/L yang mencapai kadar normal dan menunjukkan perbedaan yang signifikan (P < 0,05) dari kontrol negatif dan tidak berbeda signifikan (P > 0,05)dari kontrol positif dan kelompok tanpa perlakuan.
c. Pemberian EERTG dosis 5, 25, 125, dan 625 mg/kg bb tidak menunjukkan adanya kerusakan jaringan hepar pada pemeriksaan histopatologi jaringan.
5.2 Saran
Saran di dalam penelitian ini adalah:
a. Kepada peneliti selanjutnya dengan memeriksa parameter lain kerusakan hepar seperti ALP, GGT, 5-nukleotidase dan bilirubin.
c. Kepada peneliti selanjutnya dengan meneliti toksisitas dari EERTG dan terhadap organ lain.
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Temu giring banyak ditemukan tumbuh liar di hutan-hutan kecil atau peladangan dekat rumah penduduk, terutama di kawasan Jawa Timur. Kini, temu giring sudah banyak dibudidayakan oleh masyarakat sebagai tanaman apotik hidup, terutama di pulau Jawa. Penduduk Jawa Tengah, Jawa Timur, dan Jawa Barat sudah membudidayakannya sebagai bahan jamu atau obat tradisional yang relatif menguntungkan (Muhlisah, 1999).
2.1.1 Sistematika Tumbuhan
Berdasarkan taksonomi tumbuhan temu giring diklasifikasikan sebagai berikut (Citrosupomo, 1991):
Divisi : Spermatophyta Sub divisi: Angiospermae Kelas : Monocotyledonae Bangsa : Zingiberales Suku : Zingiberaceae Marga : Curcuma
Jenis : Curcuma heyneana Valeton dan Zijp.
2.1.2 Nama Daerah
Jawa: Temu giring (Ditjen POM, 1989)
2.1.3 Morfologi Tumbuhan
secara memanjang sehingga terlihat kurus atau membengkok ke bawah. Secara kesuluruhan, rimpang temu giring umumnya tumbuh mengarah ke bawah dengan percabangan berbentuk persegi. Apabila rimpang dibelah, akan terlihat daging rimpang berwarna kuning, berbau khas temu giring. Rimpang bagian samping umumnya memiliki rasa lebih pahit (Muhlisah, 1999).
Tanaman ini tumbuh pada daerah hingga ketinggian 75cm di atas permukaan tanah. Temu giring dijumpai sebagai tanaman liar di hutan jati atau di halaman rumah, terutama di tempat yang teduh. Perbanyakan dilakukan dengan stek rimpang induk atau rimpang cabang yang bertunas (Mursito, 2003).
2.1.4 Kandungan Kimia
Kandungan kimia rimpang temu giring antara lain minyak atsiri dengan komponen utama 8(17),12-labdadiene-15,16-dial, tanin dan kurkuminoid yang terdiri dari kurkumin, desmetoksi-kurkumin dan bis-desmetoksi-kurkumin (Ditjen POM, 1989; NADFC RI, 2004), pati, saponin, dan flavonoid (Depkes dan kessos RI. 2001).
2.1.5 Kurkuminoid
Kurkuminoid adalah suatu campuran yang kompleks berwarna kuning oranye yang diisolasi dari tanaman dan mempunyai efek terapeutik. Kurkuminoid terdiri dari kurkumin (deferuloil metan), desmetoksi-kurkumin ( feruloil-p-hidroksi-sinnamoiletan) dan bis-desmetoksi-kurkumin (bis-(p-hidroksisinnamoil
Gambar 2.1 Struktur Kurkuminoid (Bermawie, dkk., 2007)
Keterangan : A = Struktur kurkumin B = Struktur desmetoksi-kurkumin C = Struktur bis-desmetoksi-kurkumin
Kurkumin (C21H2OO6
Kurkumin akan terdegradasi oleh sinar ultra violet. Oleh sebab itu, pada proses pengeringan menggunakan sinar matahari perlu diperhatikan, agar efikasi kurkumin tetap terjamin. Daya serap tubuh terhadap kurkumin rendah sampai menengah. Di dalam tubuh kurkumin diabsorpsi ke dalam darah, dengan cepat dimetabolisme di dalam hati dan disekresi bersama feses. Penggunaan jangka pendek dan menengah cukup aman (Kristina, dkk., 2006).
) pertama kali diisolasi pada tahun 1815, kemudian tahun 1910 didapatkan dalam bentuk kristal dan dilarutkan pada tahun 1913. Kurkumin tidak dapat larut dalam air, tetapi larut dalam etanol, dan aceton (Kristina, dkk., 2006).
2.1.6 Manfaat
rematik, menambah nafsu makan, meningkatkan stamina, menghaluskan kulit, obat jerawat, obat cacar air, dan obat batuk (Wijayakusuma, 2006).
2.2 Ekstraksi
Ekstrak adalah sediaan kental yang diperoleh dengan mengekstraksi senyawa aktif dari simplisia nabati, atau simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian hingga memenuhi baku yang telah ditetapkan. Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair (Ditjen POM, 2000).
Adapun metode ekstraksi dengan menggunakan pelarut, terdiri dari: a. Cara dingin
i. Maserasi
Maserasi adalah proses pengekstrakan simplisia dengan menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur kamar. Remaserasi berarti dilakukan pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama dan seterusnya.
ii. Perkolasi
b. Cara Panas i. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur pada titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik. Umumnya dilakukan pengulangan proses pada residu pertama sampai 3-5 kali sehingga proses ekstraksi sempurna. ii. Sokletasi
Sokletasi adalah ekstraksi yang umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontiniu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik.
iii. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinyu) pada temperatur yang lebih tinggi dari temperatur kamar, secara umum dilakukan pada temperatur 40-50o
iv. Infus
C.
Infus adalah ekstraksi dengan pelarut air pada temperatur 96-98o
2.3 Parasetamol
C selama waktu 15-20 menit di penangas air, dapat berupa bejana infus tercelup dalam penangas air mendidih (Ditjen POM, 2000).
2.3.1 Uraian kimia
151,16 (DITJEN POM, 1995). Struktur kimia parasetamol ditunjukkan pada Gambar 2.2.
Gambar 2.2 Struktur parasetamol (Goodman dan Gilman, 2007)
Parasetamol (asetaminofen) merupakan metabolit fenasetin yang memiliki efek antipiretik yang ditemuka n di Jerman dan telah lama digunakan sejak tahun 1873 (Wilmana, 2007; Katzung, 2014). Obat ini adalah penghambat prostaglandin lemah pada jaringan perifer dan tidak memiliki efek antiinflamasi yang bermakna (Katzung, 2014). Efek antipiretik ditimbulkan oleh gugus aminobenzen (Wilmana, 2007). Obat ini cukup aman untuk dosis terapi (1,5 gram/hari untuk dewasa) (Katzung, 2014) atau tidak lebih dari 5 hari untuk anak-anak dengan dosis 125 – 250 mg dan tidak lebih dari 10 hari untuk orang dewasa dengan dosis 500 – 1500 mg (Katzung, 2014).
2.3.2 Farmakokinetik Parasetamol
(Wilmana,2007). Pada kondisi normal, parasetamol mengalami glukoronidasi dan sulfasi, dimana 80% dikonjugasi dengan asam glukoronat dan sebagian kecilnya dengan asam sulfat menjadi bentuk tidak aktif yang larut dalam air (Katzung, 2014; Wilmana, 2007; Myeck et al., 2001). Selain itu, sebagian kecil, kurang dari 5% dimetabolisme oleh sitokrom P450 menjadi metabolit reaktif N-asetil-p-benzoquinonimin (NAPQI) (Katzung, 2014). Pada dosis normal parasetamol, NAPQI bereaksi dengan gugus sulfihidril glutation membentuk substrat non toksik yaitu asam merkapturat yang dieksresikan melalui urin (Mycek, et al., 2001). Pada dosis toksik atau adanya penyakit hati, waktu paruhnya meningkat mejadi dua kali lipat atau lebih (Katzung, 2014).Jalur metabolisme parasetamol dapat dilihat pada Gambar 2.3.
2.3.3 Farmakodinamik Parasetamol
Parasetamol digunakan sebagai analgesik dan antipiretik. Meskipun efek analgesik dan antipiretiknya setara dengan aspirin, parasetamol berbeda karena efek antiinflamasinya hampir tidak ada. Parasetamol dapat digunakan untuk pasien yang dikontraindikasikan menggunakan aspirin untuk penggunaan analgesik dan antipiretiknya (Katzung, 2014).
Efek analgesik parasetamol yaitu menghilangkan atau mengurangi nyeri ringan sampai sedang. Parasetamol mengurangi produksi prostaglandin yaitu suatu senyawa proinflamasi, tetapi parasetamol tidak mempunyai sifat antiinflamasi seperti halnya aspirin. Sebagai antipiretik, parasetamol bekerja mengembalikan suhu tubuh dalam keadaan demam menjadi normal berdasarkan rangsangannya terhadap pusat pengatur panas di hipotalamus yang menyebabkan terjadinya vasodilatasi perifer (kulit) ditandai dengan bertambahnya pengeluaran panas dengan keluarnya banyak keringat (Katzung, 2014).
2.3.4 Toksisitas Parasetamol
sehingga metabolit tersebut bereaksi dengan sel-sel hepar dan timbullah nekrosis sentro-lobuler (Katzung, 2002). Oleh karena itu pada penanggulangan keracunan Parasetamol ditujukan untuk menstimulasi sintesa glutation. Keracunan parasetamol biasanya terbagi dalam 4 fase, yaitu:
a. Fase I (0 – 24 jam)
Asimptomatis atau gangguan sistim pencernaan berupa mual, muntah, pucat, berkeringat.
b. Fase II (24 – 48 jam)
Gejala sistim pencernaan hilang dan muncul ikterus, nyeri perut kanan atas, meningkatnya bilirubin dan konsentrasi enzim hepatik serta meningkatnya waktu protrombin. Terjadi juga gangguan faal ginjal berupa oliguria, disuria, hematuria atau proteinuria.
c. Fase III ( 72 – 96 jam)
Merupakan puncak gangguan faal hepar, mual dan muntah muncul kembali, ikterus dan terjadi penurunan kesadaran, ensefalopati hepatikum.
d. Fase IV (7 – 10 hari)
Gambar 2.4 Jalur toksisitas parasetamol (Sherlock, 2006)
2.4 Katekin
Katekin merupakan metabolit sekunder dari tanaman Uncaria gambir
tikus selama 8 hari berturut-turut dan pada hari ke-9 diinduksi dengan CCl4 2
mg/kg bb, secara bermakna dapat menurunkan kadar malondialdehid (MDA). Dari uji tersebut dapat disimpulkan bahwa pemberian ekstrak gambir dapat memproteksi kerusakan hepar dari radikal bebas CCl4 dengan bekerja sebagai
antioksidan (Edward, 2009). Hasil penelitian ini didukung oleh penelitian sebelumnya yang menyimpulkan bahwa pemberian katekin 1% dengan dosis 2 mg/kg bb selama 8 hari berturut-turut dapat memproteksi sel hepar tikus setelah pemaparan dengan CCl4, dimana katekin merupakan komponen nomor 2 terbesar
dalam gambir (Yerizel, 2002).
2.5 Metabolisme Obat
Metabolisme obat memiliki dua fungsi penting, yaitu:
a. Obat menjadi lebih hidrofilik, hal ini mempercepat ekskresinya melalui ginjal. b. Metabolit umumnya kurang reaktif daripada obat asli.
Hepar merupakan organ utama untuk metabolisme obat dan terlibat dalam dua tipe reaksi umum (Neal, 2006) yaitu:
a. Reaksi fase I
Reaksi ini meliputi biotransformasi suatu obat menjadi metabolit yang lebih polar melalui pemasukan atau pembukaan suatu gugus fungsional (misalnya-OH, -NH2, -SH). Oksidasi merupakan reaksi yang paling umum dan reaksi ini
b. Reaksi fase II
Obat atau metabolit fase I yang tidak cukup polar untuk bisa dieksresi dengan cepat oleh ginjal dibuat menjadi lebih hidrofilik melalui konjugasi dengan senyawa endogen hepar.
2.6Hepar
2.6.1 Anatomi Hepar
Hepar adalah organ tubuh terbesar dan mempunyai fungsi yang sangat kompleks. Berat rata-rata sekitar 1,5 kg atau 2,5% dari berat badan pada orang dewasa normal. Dalam keadaan segar warnanya merah tua atau merah coklat, warna merah tersebut terutama disebabkan oleh adanya darah yang amat banyak (Price dan Wilson, 1997).
Hati tersusun oleh beberapa tipe sel, yaitu: a. Hepatosit
Sel-sel ini merupakan 70% dari semua sel di hati dan 90% dari berat hati total. Hepatosit tersusun dalam unit-unit fungsional yang disebut asinus atau lobulus. Setiap lobulus memiliki sebuah vena sentral (vena terminalis) dan traktus portal yang terletak di perifer.
b. Sel duktus biliaris
Sel-sel duktulus biliaris membentuk duktus dalam traktus portal lobulus hepar. Duktus dari lobulus-lobulus yang berdekatan menyatu berjalan menuju hilus hepar, dengan ukuran dan garis tengahnya secara bertahap membesar. c. Sel vaskular
porta hepatis lalu bercabang menjadi pembuluh yang lebih halus berjalan sejajar sampai mencapai vena sentralis.
d. Sinusoid
Sinusoid hepar adalah saluran darah yang melebar dan berliku-liku, sinusoid hepardipisahkan dari hepatosit dibawahnya oleh spatium perisinusoideum (disse) subendotelial. Akibatnya, zat makanan yang mengalir di dalam sinusoid memiliki akses langsung melalui dinding endotelial yang tidak utuh dengan hepatosit. Struktur dan jalur sinusoid yang berliku di hepar memungkinkan pertukaran zat yang efisien antara hepatosit dan darah. Selain sel endotel, sinusoid hepar juga mengandung makrofag, yang disebut sel kuppfer (macrophagocytus stellatus), terletak di sepanjang sinusoid.
e. Kandung Empedu
Kandung empedu adalah organ kecil berongga yang melekat pada permukaan bawah hepar. Empedu diproduksi oleh hepatosit dan kemudian mengalir melalui kanalikuli dan disimpan di dalam kandung empedu (Eroschenko, 2004).
2.6.2 Fungsi Hepar
Hepar memiliki fungsi yang banyak dan kompleks yang penting untuk mempertahankan hidup, yaitu:
a. Fungsi pembentukan dan sekresi empedu
b. Fungsi metabolik
Hepar berperan penting dalam metabolisme karbohidrat, lemak, protein, vitamin dan juga memproduksi energi. Hepar mengubah amonia menjadi urea untuk dikeluarkan melalui ginjal.
c. Fungsi pertahanan tubuh
Hepar mempunyai fungsi detoksifikasi dan fungsi perlindungan. Fungsi detoksifikasi dilakukan oleh enzim-enzim hepar yang melakukan oksidasi, reduksi, hidrolisis, dan konjugasi zat yang kemungkinan membahayakan dan mengubahnya menjadi zat yang secara fisiologis tidak aktif. Fungsi perlindungan dilakukan oleh sel kuppfer yang terdapat di dinding sinusoid yang dapat meningkatkan aktivitas fagositosis makrofag dengan menghasilkan imnunoglobulin. Selain itu hepar juga menghasilkan antibodi tertentu yang timbul pada berbagai kelainan hepar.
d. Fungsi vaskuler hepar
Pada orang dewasa, jumlah aliran darah ke hati diperkirakan mencapai 1500 cc tiap menit. Hepar berfungsi sebagai ruang penampung dan bekerja sebagai filter karena letaknya antara usus dan sirkulasi umum (Husadha, 1996).
2.6.3 Biokimia Hepar
Hepar mampu mengsekresikan enzim-enzim transaminase saat selnya mengalami gangguan. Transaminase merupakan indikator yang peka pada kerusakan sel-sel hepar (Husadha, 1996). Enzim-enzim tersebut adalah:
a. ALT (alanin aminotransferase)
Terdapat banyak di hepatosit dan konsentrasinya relatif rendah di jaringan lain. Aktivitas normal dalam darah 5 – 35 U/L pada manusia (Husadha, 1996), pada tikus 16,3 - 68,9 (Baron, 1992). ALT lebih sensitif dibandingkan AST (Sacher dan Person, 2002).
b. AST (asparat aminotranferase)
Enzim ini berfungsi sebagai katalisator reaksi antara asam aspartat dan asan α- ketoglutarat menjadi glutamat dan oksalasetat yang bersifat reversibel. AST terdapat lebih banyak dijantung dibandingkan di hati , selain itu enzim ini juga terdapat di otot rangka, otak dan ginjal. Aktivitas normal dalam darah 10 – 40 U/L, pada tikus 29,8 – 77,0 U/L (Baron, 1992). Meningkat tajam ketika terjadi infark miokardium (Husadha, 1996). Enzim ini kurang spesifik untuk penyakit hati (Gaze, 2007).
Ketika sel hati mengalami kerusakan, enzim transaminase tersebut berada di dalam darah, sehingga dapat diukur aktivitasnya. Hal ini disebabkan karena terjadi kerusakan pada struktur dan fungsi membran sel hati, aktivitas ALT lebih dini dan lebih cepat meningkat dari aktivitas AST (Widmann, 1995).
Beberapa enzim hepar yang dapat dijadikan parameter untuk pemeriksaan fungsi hepar yaitu:
a. Laktat dehidrogenase (LDH)