ABSTRAK
PENGARUH Trichoderma viride dan Pseudomonas fluorescens TERHADAP PERTUMBUHAN Phytophthora palmivora Butl.
PADA BERBAGAI MEDIA TUMBUH dapat menginfeksi akar, batang, daun, bunga, dan buah kakao. Cara pengendalian yang dicobakan yaitu penggunaan agens hayati seperti Trichoderma viride dan Pseudomonas fluorescens. Sebagai langkah awal penggunaan agens hayati perlu dilakukan pengujian antagonism secara in vitro. Penelitian ini bertujuan mengetahui kemampuan T. viride dan P.fluorescens, dan senyawa kimia metalaksil untuk menghambat pertumbuhan P.palmivora pada berbagai media biakan secara in vitro. Percobaan disusun secara faktorial dalam rancangan acak lengkap yang terdiri dari dua faktor yaitu jenis agens pengendali berupa T. viride dan P. fluorescens, dan metalaksil serta faktor kedua berupa jenis media biakan yaitu PDA, V8 dan King’s B. Uji antagonisme dilakukan dengan metode kultur ganda yang dilakukan di Laboratorium Penyakit Tumbuhan Fakultas Pertanian Universitas Lampung pada Juli sampai dengan September 2011. Hasil penelitian menunjukkan T.viride, P.fluorescens, dan metalaksil dapat menghambat pertumbuhan P.palmivora secara in vitro pada media PDA, V8, dan King’s B. Pada hari ke enam setelah infestasi, jenis media PDA dan V8 memberikan pengaruh yang lebih baik dibandingkan dengan media King’s B terhadap kemampuan P. fuorescens dan T. viride dalam menghambat P. palmivora, terdapat interaksi antara jenis agens pengendalian (T.viride, P.fluorescens, dan metalaksil) dan jenis media tumbuh (PDA, V8, dan King’s B) dalam menghambat pertumbuhan P. palmivora secara in vitro.
Kata kunci : P.palmivora, T. viride, P.fluorescens, media tumbuh
ABSTRACT
THE EFFECT OF Trichoderma viride and Pseudomonas fluorescens AGAINST THE GROWTH OF Phytophthora palmivora Butl.
ON VARIOUS CULTURE MEDIUM infect root, steam, leaf, flower, and pod of cocoa. To controlling pod rot disease we use biocontrol agents (Trichoderma viride and Pseudomonas fluorescens). In the first step to use biocontrol agents need antagonism test in vitro. The research aim to know the ability T. viride, P. fluorescens, and metalaxyl to inhibit P.palmivora in various medium culture in vitro. The experiment arranged in a completely randomized design with two factors are the kind of control agents (T.viride, P. fluorescens, and metalaxyl), and the kind of medium culture (PDA, V8, and King’s B). The research is done in Plant Disease Laboratory Agriculture Faculty Lampung University in July to September 2011. The research results showed T. viride, P. fluorescens, and metalaxyl can inhibit P. palmivora on medium culture (PDA, V8, and King’s B). On the sixth day after infestation, the medium PDA and V8 give higher inhibit than King’s B, there is interactions the kind control agents (T. viride,P. fluorescens, and metalaxyl) and the kind medium culture (PDA, V8, dan King’s B) to inhibit P. palmivora.
Key word: P.palmivora, T. viride, P.fluorescens, medium culture
PENGARUH Trichoderma viride dan Pseudomonas fluorescens TERHADAP PERTUMBUHAN Phytophthora palmivora Butl.
PADA BERBAGAI MEDIA TUMBUH (Skripsi)
Oleh
YANI KURNIAWATI
FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
I. PENDAHULUAN
1.1. Latar Belakang Masalah
Kakao (Theobroma cacao L.) merupakan salah satu komoditas ekspor
penyumbang devisa sektor non migas yang penting bagi Indonesia. Perkebunan
kakao di Indonesia didominasi oleh perkebunan rakyat yaitu perkebunan yang
dimiliki masyarakat. Kepemilikan perkebunan ini rata-rata per petani sangat kecil
yaitu 1 Ha per petani. Luas perkebunan kakao yang dimiliki masyarakat sekitar
92,7% dari luas total perkebunan kakao di Indonesia pada tahun 2009 yang
mencapai 1.592.982 Ha. Di beberapa daerah seperti Provinsi Lampung, kakao
merupakan sumber pendapatan utama bagi banyak petani (perkebunan rakyat).
Luas perkebunan kakao Provinsi Lampung mencapai 26.306 Ha yang merupakan
perkebunan rakyat. Di Provinsi Lampung sentra pengembangan kakao terdapat di
Kabupaten Lampung Tengah, Lampung Timur, Lampung Selatan, dan
Tanggamus (Dinas Perkebunan Provinsi Lampung, 2007).
Indonesia memiliki potensi untuk menjadi produsen utama kakao dunia, jika
berbagai masalah yang dihadapi oleh perkebunan kakao dapat diatasi dan dikelola
dengan baik. Beberapa hambatan pada budidaya tanaman kakao yang
penyakit. Dari beberapa hambatan tersebut, yang sering menjadi masalah utama
yaitu penyakit. Salah satu penyakit yang menyerang tanaman kakao adalah busuk
buah yang disebabkan oleh Phytophthora palmivora. Di Indonesia, kerugian
produksi kakao yang ditimbulkan oleh penyakit busuk buah berkisar antara
26%-40% (Semangun, 2000). Produksi kakao Lampung di sejumlah sentra penghasil
kakao turun drastis hingga lebih dari 75% dalam setahun terakhir akibat serangan
jamur P. palmivora(Kompas, 2010). Bagian tanaman kakao dapat terinfeksi
patogen mulai dari akar, batang, bunga, buah dan daun. Kerugian yang sangat
tinggi disebabkan serangan pada buah. Apabila patogen berhasil menginfeksi
buah, maka tidak ada perlakuan apapun yang mampu mencegah perkembangan
penyakit di dalam buah. Buah yang busuk akan menjadi sumber penularan
penyakit yang sangat potensial. Oleh karena itu, upaya yang bertujuan untuk
memperkecil peluang terjadinya infeksi merupakan tindakan utama yang harus
dilakukan.
Selama ini, pengendalian penyakit busuk buah kakao menggunakan fungisida
kimiawi sintetik. Namun pengendalian secara kimiawi meninggalkan residu
pestisida pada biji kakao. Disamping itu, penggunaan fungisida kimiawi
mengakibatkan penurunan populasi mikroorganisme tanah yang menguntungkan
(Rismansyah, 2009).
Dalam lima tahun terakhir ini pengendalian penyakit tanaman beralih pada
penggunaan agens hayati. Agens hayati yang telah banyak dikembangkan dan
dimanfaatkan untuk pengendalian penyakit tular tanah (soil-borne) adalah jamur
pengembangan agensia hayati adalah pengujian antagonisme antara patogen
dengan agens hayati secara in vitro dalam media biakan. Menurut Borowicz dan
Oomer (2000), perbedaan kandungan nutrisi dalam media biakan mengakibatkan
perbedaan produksi metabolit yang dihasilkan oleh mikroorganisme yang tumbuh
di dalam media tersebut. Oleh karena itu, penting mengetahui hasil pengujian
antagonisme antara agens hayati dan patogen dalam berbagai media biakan.
1.2. Tujuan Penelitian
Penelitian ini bertujuan untuk menguji kemampuan T. viride dan P. fluorescens
dalam menghambat pertumbuhan P. palmivora pada berbagai media tumbuh.
1.3. Kerangka Pemikiran
Penyakit busuk buah kakao disebabkan oleh P. palmivora, merupakan salah satu
faktor pembatas yang cukup penting dalam peningkatan produksi kakao. Salah
satu cara pengendalian busuk buah kakao yang dapat dilakukan yaitu
pengendalian secara hayati dengan memanfaatkan agens antagonis. Menurut
Hasanuddin (2003), mikroorganisme antagonis mempunyai kemampuan melawan
mikroorganisme patogenik sehingga dapat dimanfaatkan sebagai suatu komponen
dalam upaya pengendalian.
Salah satu jamur yang dapat digunakan untuk pengendalian hayati yaitu T. viride.
T. viride merupakan mikroorganisme tanah yang bersifat antagonis terhadap
jamur lain. Antagonisme adalah peristiwa penghambatan perkembangan atau
dapat terjadi dengan beberapa cara yaitu kompetisi ruang dan makanan, antibiosis,
dan parasitisme (Djafarudin, 2004). T. viride menghasilkan antibiotik serta
berbagai enzim seperti eksoglukonase, endoglukonase, selobiase dan kitinase
yang dapat menghancurkan dinding sel jamur patogen pada tanaman (Papavizas,
1985).
Lien dkk. (1994 dalam Suwahyono, 2010) menginformasikan bahwa T. viride
mengeluarkan substansi aktif yang berperan dalam mekanisme antibiosis yang
disebut trikolin. Senyawa tersebut merusak dan menyebabkan hilangnya formasi
organ liposom yang terdapat didalam sel. Liposom ini berperan untuk
pembentukan protein pada jamur patogen Rizoctonia solanii sehingga proses
sintesis protein terganggu dan mengakibatkan pertumbuhannya terhambat.
Rachmawati dkk.(1995) melaporkan bahwa T. viride efektif untuk
mengendalikan penyakit busuk batang vanili. Selain itu, Desfina (2008)
menyatakan bahwa T. viride dapat menekan pertumbuhan jamur P. palmivora
penyebab busuk buah kakao secara in vitro meskipun terdapat perbedaan
kemampuan menghambat antar isolat T. viride yang diperoleh dari beberapa
daerah di Lampung.
Selain jamur antagonis, terdapat juga bakteri yang memiliki kemampuan
antagonisme yang dapat menekan perkembangan beberapa jamur dan bakteri
patogen tanaman. Bakteri antagonis tersebut adalah P. fluorescens yang bertindak
sebagai agens hayati terhadap Sclerotium rolfsii penyebab penyakit dumping-off
Xanthomonas axonopodis pv. glycines penyebab pustul kedelai (Kadam, 2003;
Efri, 1996; Yulianti, 2006). Selain itu, Mayasari (2011) melaporkan bahwa
Pseudomonas berfluorescens dapat digunakan sebagai antagonis terhadap bakteri
penyebab penyakit layu pisang secara in vitro.
P. fluorescens dapat menghasilkan antibiotik, siderofor dan metabolik sekunder
yang sifatnya dapat menghambat aktivitas mikroorganisme lain (Hanudin dkk.,
2007).
Menurut Borowicz dan Oomer (2000), media biakan mikroorganisme
mengandung nutrisi yang dibutuhkan oleh mikroorganisme tersebut untuk
pertumbuhannya. Perbedaan kandungan nutrisi pada media dapat mengakibatkan
produksi metabolit yang berbeda dari mikroorganisme yang ditumbuhkan pada
media tersebut. Menurut Ibrahim dkk.(2002), media kultur mempengaruhi
pertumbuhan konidia dan miselium dari jamur. Kandungan nutrisi pada suatu
media berkaitan dengan kemampuan pertumbuhan jamur maupun bakteri dalam
pengujian secara in vitro.
1.4. Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah :
1. T. viride dan P. fluorescens dapat menghambat pertumbuhan P. palmivora
secara in vitro.
2. Jenis media tumbuh dapat mempengaruhi T. viride dan P. fluorescens dalam
3. Terdapat interaksi antara jenis agens hayati dan jenis media tumbuh dalam
II. TINJAUAN PUSTAKA
2.1. Tanaman Kakao
Kakao berasal dari hutan hujan tropis di Amerika Tengah, yaitu daerah Meksiko
sampai ke Bolivia dan Brazil (Siregardkk.,2009). Di Indonesia, tanaman kakao
sudah ditanam di Minahasa pada akhir abad ke 18. Pada tahun 1880 kakao
ditanam sebagai perkebunan besar di Jawa Tengah. Penanaman kakao di daerah
tersebut menggantikan tanaman kopi arabika yang rusak akibat penyakit karat
(Hemileia vastatrix) (Semangun, 2000).
Adapun sistematika tanaman kakao menurut klasifikasi botanis adalah sebagai
berikut:
Divisio : Spermatophyta
Kelas : Dicotyledon
Ordo : Malvales
Famili : Sterculiceae
Genus : Theobroma
Spesies : Theobroma cacao L.
Kakao merupakan salah satu tanaman yang menghasilkan bunga dari batang atau
caulifloris. Warna buah kakao sangat beragam, tetapi pada dasarnya hanya ada
dua macam warna. Buah yang ketika muda berwarna hijau atau hijau agak putih
jika sudah masak akan berwarna kuning. Sementara itu, buah yang ketika muda
berwarna merah, setelah masak berwarna jingga (orange) (Siregar dkk., 2009).
Kulit buah kakao memiliki 10 alur dalam dan dangkal yang letaknya
berselang-seling. Pada tipe criollo dan trinitario alur buah kelihatan jelas. Kulit buah tebal
tetapi lunak dan permukaannya kasar. Sebaliknya, pada tipe forasterom
permukaan kulit buah pada umumnya halus (rata), kulitnya tipis, tetapi keras dan
liat. Buah akan masak setelah berumur enam bulan. Pada saat itu ukurannya
beragam, dari panjang 10 hingga 30 cm, bergantung pada kultivar dan
faktor-faktor lingkungan selama perkembangan buah (Siregar dkk.,2009).
Biji kakao tersusun dalam lima baris mengelilingi poros buah. Jumlahnya
beragam, yaitu 20 – 50 butir per buah. Jika dipotong melintang, tampak bahwa
biji disusun oleh dua kotiledon yang saling melipat dan bagian pangkalnya
menempel pada poros lembaga (embrio axis). Warna kotiledon putih untuk tipe
criollo dan ungu untuk tipe forastero. Biji dibungkus oleh daging buah (pulpa)
yang berwarna putih, rasanya asam manis dan diduga mengandung zat
penghambat perkecambahan. Di sebelah dalam daging buah terdapat kulit biji
(testa) yang membungkus dua kotiledon dan poros embrio. Biji kakao tidak
memiliki masa dorman. Meskipun daging buahnya mengandung zat penghambat
perkecambahan, tetapi kadang-kadang biji berkecambah di dalam buah yang
terlambat dipanen karena daging buahnya telah kering. Pada saat berkecambah,
permukaan tanah. Fase ini disebut fase serdadu. Fase kedua ditandai dengan
membukanya kotiledon diikuti dengan memanjangnya epikotil dan tumbuhnya
empat lembar daun pertama. Keempat daun tersebut sebetulnya tumbuh dari
setiap ruasnya, tetapi buku-bukunya sangat pendek sehingga tampak tumbuh dari
satu ruas. Pertumbuhan berikutnya berlangsung secara periodik dengan interval
waktu tertentu (Siregar dkk., 2009). Gambar 1 menunjukkan tanaman kakao
dengan buah yang sehat dan belum matang.
Gambar 1. Tanaman Kakao dengan buah (Theobroma cacao L.)
2.2. Penyakit Busuk Buah Kakao
Busuk buah (pod rot) merupakan penyakit terpenting dalam budidaya kakao di
Indonesia dan menjadi masalah utama di negara-negara penghasil kakao lainnya.
karena kehilangan hasil di beberapa kebun dapat mencapai di atas 40%
(Sulistyowati, 2003).
Busuk buah kakao yang disebabkan oleh Phytophthora palmivora merupakan
penyakit paling penting karena menyebabkan kerugian yang berkisar antara 10
sampai 30% di seluruh dunia, dan kerugian yang jauh lebih tinggi terjadi di daerah
endemis, terutama di daerah basah pada musim hujan (Umaya dan Purwantara,
2006).
2.2.1. Penyebab Penyakit
Terdapat empat spesies jamur penyebab penyakit busuk buah kakao, yaitu
Phytopthora palmivora, P. megakarya, P. capsici dan P. citrophthora (Evan dan
Priori, 1987 dalam Darmono dkk., 2006 ). Jamur ini dapat menyerang daun (leaf
blight), bunga, batang (kanker batang), akar tanaman (busuk akar) dan buah
(busuk buah) (Pawirosoemardjo dan Purwantara, 1992 dalam Darmono dkk.,
2006), tetapi kerugian terbesar terjadi apabila jamur ini menyerang bagian buah.
P. megakarya dilaporkan terdapat di beberapa negara di Afrika Barat seperti
Ghana dan Kamerun (Ndoumbe-Nkeng dkk., 2003), P. capsici tersebar di daerah
Amerika Selatan, Amerika Tengah dan Indies Barat, P. citrophthora tersebar di
daerah Bahia, Brazil, sedangkan P. palmivora tersebar luas di sebagian besar
pertanaman kakao di dunia. Purwantara dkk. (2004) dan Semangun (2000)
melaporkan bahwa jamur yang menyerang pertanaman kakao di Indonesia adalah
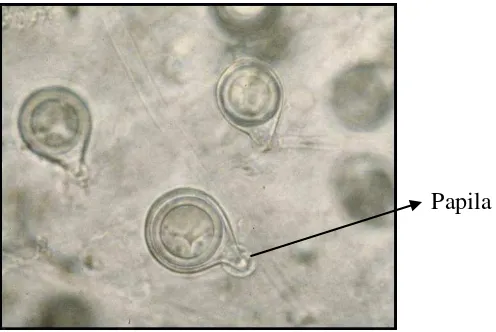
P. palmivora. Spora jamur P.palmivora mempunyai bentuk yang khas yaitu bulat
Papila
Gambar 2. Spora jamur Phytophthora palmivora dengan tonjolan papila disalah satu ujungnya (Sumber: Anonim, 2008)
Menurut Hawksworth (1995) dalam Anaf (2009), jamur P. palmivora tergolong
dalam :
Kingdom : Stramenophiles
Kelas : Oomycetes
Ordo : Peronosporales
Famili : Pythiaceae
Genus : Phytophthora
Spesies : Phytophtora palmivora Butler
2.2.2. Gejala Penyakit
Gejala busuk buah kakao dapat terjadi pada berbagai umur buah, sejak buah
masih kecil sampai menjelang masak. Gejala pertama dari penyakit busuk buah
pada umumnya dimulai dari titik pertemuan antara tangkai buah dengan buah
buah atau bagian tengah buah. Warna buah berubah umumnya mulai dari ujung
buah atau dekat tangkai dengan cepat meluas ke seluruh buah. Jamur juga dapat
mengkolonisasi isi buah dan menyebabkan busuknya biji kakao, tetapi apabila
penyakit terjadi pada buah yang hampir masak maka biji yang berada didalamnya
masih dapat dimanfaatkan.
Menurut Purwantara (1992) dalam Semangun (2000), buah menjadi busuk dalam
waktu 14-22 hari. Pada permukaan buah yang sakit tersebut timbul lapisan
berwarna putih bertepung, yang terdiri atas jamur-jamur sekunder yang banyak
membentuk spora. Pada lapisan tersebut terdapat juga sporangiofor dan
sporangium jamur Phytophthora, yang menjadi penyebab penyakit ini.
2.2.3. Daur Penyakit
Jamur yang dapat mengadakan infeksi pada buah kakao dapat bersumber dari
tanah, batang yang sakit kanker batang, buah yang sakit, dan tumbuhan inang lain.
Jamur P. palmivora terutama bertahan dalam tanah, jamur dapat terbawa oleh
percikan air hujan ke buah-buah dekat tanah. Setelah mengadakan infeksi, dalam
waktu beberapa hari jamur pada buah akan menghasilkan banyak sporangium.
Sporangium ini dapat terbawa oleh percikan air hujan atau angin dan mencapai
buah-buah lainnya yang berada di tempat yang lebih tinggi. Jamur yang berada
dalam tanah dapat juga terbawa oleh serangga seperti semut, sehingga dapat
mencapai buah yang berada di dahan tertinggi pada pohon kakao. Dari buah yang
tinggi sporangium dapat terbawa oleh air ke buah-buah di bawahnya. Jamur dapat
kemudian dapat berkembang terus sehingga menyebabkan terjadinya penyakit
kanker batang dan pada akhirnya jamur dapat kembali menyerang buah
(Semangun, 2000).
Jamur P. palmivora dapat menyerang berbagai macam tanaman. Meskipun
demikian, belum diketahui dengan pasti apakah jamur dari berbagai tanaman
tersebut dapat menimbulkan penyakit pada kakao. Dengan demkian, dapat
dikatakan bahwa sumber inokulum selalu ada. Namun yang dianggap sebagai
sumber inokulum yang paling penting adalah tanah. Griffin (1981) dalam
Semangun (2000) mengatakan bahwa jamur bertahan dalam akar kakao meskipun
akar tidak menunjukkan gejala penyakit.
2.2.4. Faktor-faktor yang mempengaruhi penyakit busuk buah kakao
Faktor-faktor yang mempengaruhi perkembangan penyakit busuk buah kakao
antara lain kelembapan udara, curah hujan, cara bercocok tanam, banyaknya buah
pada pohon, dan varietas kakao (Semangun, 2000). Kelembapan yang tinggi
dapat membantu pembentukan spora dan meningkatkan infeksi. Infeksi hanya
dapat terjadi apabila pada permukaan buah terdapat lapisan air. Lapisan air yang
dimaksud bukan hanya air hujan, tetapi bisa juga air yang terjadi karena
pengembunan uap air pada permukaan buah. Disamping meningkatkan
kelembapan kebun, air hujan juga dapat membantu penyebaran spora. Fluktuasi
intensitas penyakit cenderung sama dengan fluktuasi curah hujan harian. Puncak
intensitas penyakit terjadi 1-3 minggu setelah curah hujan (Semangun, 2000).
terjadi pada kisaran suhu 20-300C. Pelepasan, perkecambahan, dan infeksi
memerlukan adanya air bebas paling sedikit selama 3-4 jam (Purwanta 1990
dalam Semangun, 2000). Suhu minimum jamur masih dapat hidup adalah 110C,
sedangkan suhu optimum pertumbuhannya adalah 27,5-300C, dan suhu
maksimumnya adalah 350C (Erwin dan Rebeiro, 1996). Pemangkasan, kerapatan
tanaman, pemberian mulsa, drainase, pemupukan, dan pemungutan hasil menjadi
faktor-faktor yang sangat mempengaruhi penyakit.
2.3. Jamur Trichoderma viride sebagai agens antagonis
Salah satu spesies Trichoderma yang digunakan sebagai agens hayati adalah
Trichoderma viride. T. viride termasuk dalam filum Ascomycota, kelas
Deuteromycetes, sub kelas Hypomicetidae, ordo Moniliales, famili Moniliaceae
dan genus Trichoderma (Agrios, 2005). Jamur ini terdapat pada hampir semua
jenis tanah dan sisa-sisa tanaman yang telah mati dan dapat menekan beberapa
jamur tular tanah. Mekanisme antagonisme terjadi dengan beberapa cara yaitu
kompetisi (ruang dan makanan), antibiosis (pembentukan antibiotik), dan
parasititisme (Djafarudin, 2004).
Trichoderma viride memiliki bentuk konidia hampir bulat seperti bola, diameter
pertumbuhan koloni 4,5-7,5 cm dalam 5 hari pada suhu 200C. Konidianya
berwarna hijau cerah bergerombol membentuk menjadi seperti bola dan berkas
hifa terlihat menonjol jelas diantara konidia spora (Frazier dan Westhoff, 1981).
Apabila diidentifikasi menggunakan mikroskop, jamur ini memiliki bagian yang
dan konidiofornya bercabang membentuk verticillate, cabang yang pendek terjadi
dekat ujung pada percabangan yang penjang. Pada bagian ujung konidiofor
tumbuh sel yang berbentuk menyerupai botol (fialida), sel ini dapat berbentuk
tunggal maupun berkelompok. Fialid tersusun dalam kelompok yang terpisah
antara 2-4, ramping dengan arah yang tak beraturan (Domsch dkk., 1993).
Jamur T. viride memiliki benang-benang halus yang disebut hifa. Hifa pada
T. viride berbentuk pipih, bersekat, dan bercabang-cabang membentuk anyaman
yang disebut miselium. Dalam pertumbuhannya, bagian permukaan T. viride akan
terlihat putih bersih dan bermiselium kusam. Setelah dewasa, miselium T. viride
berwarna hijau kekuningan (Larry, 1977). Miseliumnya dapat tumbuh dengan
cepat dan dapat memproduksi berjuta-juta spora, karena sifatnya inilah T. viride
dikatakan memiliki daya kompetisi yang tinggi (Alexopoulu dan Mims, 1979).
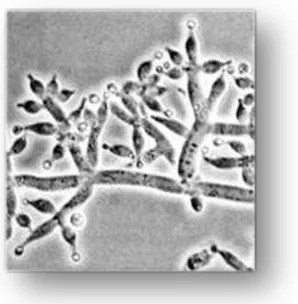
Koloni muda T. viride tumbuh sangat cepat, bisa mencapai 5-8 cm selama 7 hari
dalam media PDA, tipis seperti kapas yang menjadi semakin hijau saat koloni
berkembang. Sporodokia kasar berbentuk piramid, dengan cabang panjang dekat
pangkal dan cabang yang lebih pendek diatasnya. Cabang disudut poros utama
Gambar 3. Sporodokia Trichoderma viride (Sumber: Anonim, 2010)
T. viride memiliki kemampuan produksi antibiotik gliotoksin dan piridin serta
enzim β-1-3 glukanase, β-1-4 glukanase, kitinase, dan selulase. Mekanisme
T. viride sebagai agens hayati yang lain adalah mikoparasitisme dengan cara
pertumbuhan miselium T. viride yang panjang akan melingkari hifa jamur inang
dan menyebabkan jamur inang menjadi hancur. Agrios (1988), juga menyatakan
bahwa mekanisme pengendalian hayati T. viride dapat melalui antibiosis dan lisis.
Sifat-sifat yang mendukung aktivitas antagonisme Trichoderma adalah tumbuh
cepat dan memproduksi antibiotik seperti trichodermin, suzukalicin, dan
alamethicin. Selain itu, Trichoderma juga memproduksi antibiotik volatil yang
memiliki aktivitas metabolit tinggi, dan toleran terhadap zat metabolit yang
diproduksi oleh jamur lainnya (Djafarudin, 2000).
2.4. Pseudomonas fluorescens sebagai agens antagonis
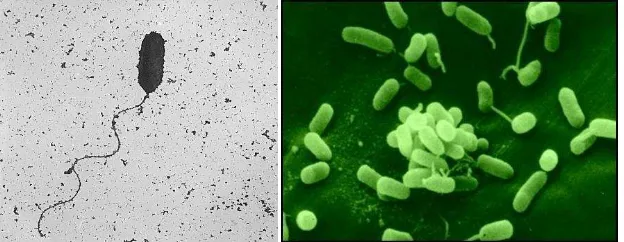
Bakteri Pseudomonas fluorescens berbentuk batang lurus atau tegak lengkung,
berukuran (0,5 – 1,0) x (1,5 – 5,0) µm, tidak spiral, bergerak dengan satu atau
P. fluorescens hidup secara aerob, mempunyai tipe pernapasan secara tegas dari
metabolisme, dengan oksigen sebagai penerima elektron akhir (terminal),
mempunyai tipe metabolisme respirasi tidak fermentatif, dan menggunakan
denitrifikasi sebagai pilihan. Beberapa bakteri adalah kemolitotrof fakultatif,
yang menggunakan H2 sebagai sumber energi, sedangkan mekanisme respirasinya
bersifat aerob (Soesanto, 2008).
P. fluorescens termasuk ke dalam bakteri yang dapat hidup pada bagian tanaman
(permukaan daun dan akar) dan sisa tanaman yang membusuk, tanah dan air
sisa-sisa makanan yang membusuk, serta kotoran hewan (Supriadi, 2006). Sebagian
besar P. fluorescens adalah penghuni rizosfer, secara agresif mengkoloni akar dan
biasa disebut dengan rizobacteria. P. fluorescens mengeluarkan pigmen kuning
kehijauan pada medium yang kekurangan unsur besi. P. fluorescens membentuk
pigmen berpendar (fluorescein). Fluorescein disebut juga dengan
resorcinolphthalein yangberbeda dengan antibiotik pyoverdin (Soesanto, 2008).
Klasifikasi Pseudomonas berdasarkan Muray(1948) dalam Bergey’s Manual of
Systematic Bacteriology (1984) adalah sebagai berikut:
Kerajaan : Prokariota
Divisi : Gracilicutes
Kelas : Proteobacteria
Bangsa : Pseudomobadaceae
Marga : Pseudomonas
Spesies : Pseudomonas fluorescens
Koloni bakteri berbentuk bulat, tepi rata, fluidal dan mengeluarkan pigmen
berwarna kuning kehijauan pada medium King’s B. Pigmen tersebut
membedakan bakteri yang termasuk ke dalam kelompok P. fluorescens dengan
kelompok lain (Arwiyanto dkk., 2007).
Brock dan Madigan (1988) melaporkan bahwa bakteri Pseudomonas bisa
menekan pertumbuhan patogen dalam tanah secara alamiah. Kemampuan
P. fluorescens sebagai agens pengendalian hayati adalah karena kemampuannya
bersaing untuk mendapatkan zat makanan, atau karena hasil-hasil metabolit
seperti siderofor, hidrogen sianida, antibiotik, atau enzim ekstraseluler yang
bersifat antagonis melawan patogen (Kloepper dan Schroth, 1978 dalam Septiana,
2009).
Secara umum, metabolit sekunder yang dihasilkan oleh P. fluorescens memegang
peranan penting dalam pengendalian hayati penyakit tanaman. Metabolit
pterin, pirol, fenazin, dan aneka senyawa antibiotika. Metabolit sekunder tertentu
berperan di dalam membunuh secara langsung atau hanya menghambat patogen.
Produksi metabolit sekunder antimikroba dan pengaruhnya terhadap patogen
tanaman sangat tergantung pada faktor lingkungan, seperti kimia tanah, suhu, dan
potensi air (Soesanto, 2008).
Siderofor adalah senyawa organik selain antibiotik yang dapat berperan dalam
pengendalian hayati penyakit tumbuhan. Siderofor diproduksi secara ekstrasel,
senyawa ini memiliki berat molekul rendah dengan afinitas yang sangat kuat
terhadap besi (III). Dengan demikian, senyawa siderofor merupakan pesaing
terhadap mikroorganisme lain (Fravel, 1988). Selain peranannya sebagai agen
pengangkutan besi (III), siderofor juga aktif sebagai faktor pertumbuhan, dan
beberapa diantaranya berpotensi sebagai antibiotik (Neilands, 1981 dalam
Septiana, 2009).
2.5 Media Tumbuh
Menurut Borowicz dan Oomer (2000), media biakan mikroorganisme
mengandung nutrisi yang dibutuhkan oleh mikroorganisme tersebut untuk
pertumbuhannya. Perbedaan kandungan nutrisi pada media dapat mengakibatkan
produksi metabolit yang berbeda dari mikroorganisme yang ditumbuhkan pada
media tersebut.
Kandungan nutrisi media biakan berpengaruh terhadap pertumbuhan jamur
maupun bakteri yang hidup pada media tersebut. Pertumbuhan dan sporulasi
T. viride baik apabila natrium sitrat, xilosa, arabinosa, laktosa, pektin, PGA,
ribosa dan asam malat dilengkapi dalam media tumbuh. T. viride memiliki
kemampuan untuk memanfaatkan beragam faktor gizi serta memiliki toleransi
terhadap pH dan suhu untuk pertumbuhannya. T. viride tidak mampu tumbuh
pada pH diatas 9,0 (Jayaswal dkk., 2003).
Media biakan juga berpengaruh terhadap mekanisme P. fluorescens dalam
menghambat mikroorganisme penyebab penyakit tumbuhan antara lain melalui
produksi siderofor, hidrogen sianida, antibiotik pirolnitrin, pyoluteorin serta
2,4diasetilfluoroglusinol. Antibiotik 2,4diasetilfluoroglusinol diproduksi
P. fluorescens pada medium yang mengandung glukosa (Rodriguez dan Pfender,
III. METODE PENELITIAN
3.1. Waktu dan Tempat
Penelitian dilaksanakan pada bulan Juli sampai September 2011 di Laboratorium
Penyakit Tumbuhan Jurusan Proteksi Tanaman Fakultas Pertanian Universitas
Lampung.
3.2. Alat dan Bahan
Alat yang digunakan dalam penelitian ini antara lain cawan petri, tabung reaksi,
erlenmeyer, mikroskop, gelas ukur, bor gabus, otoklaf, timbangan elektrik,
nampan plastik, alumunium foil, plastik tahan panas, laminar air flow hood,
pinset, pipetmikro 1000 µl, cutter, kaca preparat, cover glass, spidol permanen,
tabung reaksi, gelas penyebar driglaski, lampu spirtus, jarus oze, kertas tisu, kertas
label, karet, kertas saring steril, rotamixer.
Bahan yang digunakan dalam penelitian ini antara lain isolat Phytophthora
palmivora,Trichoderma viride, Pseudomonas fluorescens, alkohol 70%, NaOCl
0,5%, aquades steril, spirtus, media kultur jamur (V8 dan PDA), serta media
3.3. Rancangan Percobaan
Percobaan disusun secara faktorial dalam Rancangan Acak Lengkap (RAL)
dengan lima ulangan. Faktor pertama adalah penggunaan agens pengendali yaitu
isolat T. viride, suspensi P. fluorescens dengan pengenceran 10-6 per ml air,
kontrol air, dan kontrol metalaksil dengan konsentrasi 1%. Faktor kedua meliputi
penggunaan media tumbuh berupa PDA, V8 dan King’s B. Data yang diperoleh
merupakan ukuran jari-jari koloni jamur P. palmivora yang menjauhi dan
mendekati perlakuan kemudian dihitung persentase penghambatan pertumbuhan
jamur P.palmivora. Persentase penghambatan tersebut diolah dengan sidik ragam
(ANOVA) dan dianalisis menggunakan uji beda nyata terkecil (BNT) pada taraf
5%.
3.4. Pelaksanaan Penelitian
3.4.1. Penyiapan Media PDA, V8 dan King’s B
a. Media PDA (Potato Dextrose Agar)
Untuk membuat media PDA sebanyak 1 liter, dibutuhkan 20 gram agar batang
yang telah dipotong-potong, 20 gram dextrosa, dan 200 gram kentang. Kentang
dipotong kecil – kecil lalu direbus di dalam 1 liter air sambil diaduk, setelah itu
rebusan bahan – bahan disaring dengan saringan ke dalam tabung erlenmeyer
ukuran 1 liter. Selanjutnya tabung erlenmeyer berisikan PDA tersebut disterilkan
b. Media V8 (Vegetable Eight)
Untuk membuat media V8 sebanyak 1 liter, dibutuhkan suspensi sari sayuran V8
sebanyak 200 ml, yang disaring menggunakan saringan kasa sebanyak 3 kali
penyaringan. Selanjutnya suspensi sari sayuran V8 tersebut dimasukkan ke dalam
tabung erlenmeyer ukuran 1 liter dan ditambahkan 800 ml air steril, 15 gram agar
batangan yang telah dipotong-potong, dan 3 gram CaCO3, lalu diaduk sehingga
menjadi homogen dan direbus. Setelah direbus, tabung erlenmeyer disterilkan
dengan otoklafpada suhu 121oC dan tekanan 1 atm selama ± 120 menit.
c. Media King’s B
Untuk membuat media King’s B dibutuhkan 20 gr protease peptone, 10 ml
glyserol, 1,5 gr K2HPO4, 1,5 gr MgSO4.7H2O dan 15 gr agar. Bahan tersebut
dimasukkan kedalam erlenmeyer ukuran 1 liter dan ditambahkan 1000 ml air
steril, lalu diaduk sehingga menjadi homogen dan direbus. Setelah direbus,
tabung erlenmeyer disterilkan dengan otoklafpada suhu 121oC dan tekanan 1 atm
selama ± 120 menit. Setelah proses sterilisasi selesai, media King’s B
didinginkan hingga 500C, lalu dituang ke dalam cawan petri.
3.4.2. Penyiapan biakan murni P. palmivora sebagai sumber inokulum
Isolat jamur P. palmivora diisolasi dari jaringan buah kakao yang sakit di lapang.
Buah pada tanaman kakao sakit pada umumnya bagian kulit buah berbercak
berwarna coklat. Metode isolasi jamur P. palmivora yaitu dengan membuat
beberapa potongan segi empat ukuran 5 sampai 10 mm yang dipotong dari
jaringan sehat. Potongan jaringan tersebut didesinfeksi dengan cara direndam
dalam larutan NaOCl 0,525% selama 30 sampai 60 detik lalu dibilas dengan
aquades steril dalam tiga air steril yang berbeda dan ditiriskan menggunakan tisu
di laminar air flow. Potongan kakao tersebut ditanam pada media PDA dan
diikubasikan selama ± 3 hari. Jamur P. palmivora yang tumbuh pada media PDA
tersebut selanjutnya dimurnikan pada media V8 dan diremajakan lagi
menggunakan media V8 yang baru untuk pengujian lebih lanjut.
3.4.3. Perbanyakan biakan T. viride
Isolat T. viride diperoleh dari koleksi Klinik Tanaman Jurusan Proteksi Tanaman
Fakultas Pertanian Universitas Lampung dan diperbanyak pada cawan petri
menggunakan media PDA.
3.4.4. Perbanyakan biakan P. fluorescens
Isolat P. fluorescens berasal dari koleksi Balai Penelitian Gading Rejo yang
diperoleh dari tanah sekitar tanaman pisang milik Balai Penelitian Solok,
Sumatera Barat. Isolat P. fluorescens tersebut diperbanyak menggunakan media
King’s B dengan metode penggoresan.
3.4.5. Uji antagonisme Trichoderma viride dan Pseudomonas fluorescens terhadap Phytophthora palmivora pada 3 macam media yang berbeda
Uji antagonisme dilakukan dengan metode kultur ganda yaitu pada satu cawan
petri ditumbuhkan dua patogen secara berlawanan. Pengujian antagonisme ini
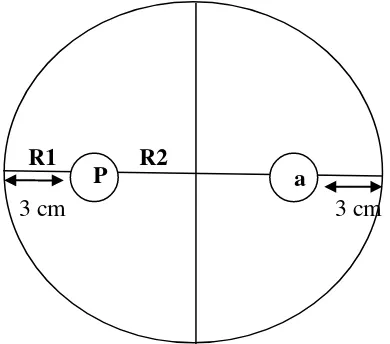
Cawan petri yang telah berisi media padat dibalik dan pada bagian belakangnya
dibuat garis saling berpotongan pada tengah cawan petri menggunakan spidol
permanen. Kemudian pada garis tersebut ditentukan dua titik yang berjarak 3 cm
dari tepi cawan secara berlawanan. Titik-titik tersebut digunakan sebagai tempat
infestasi P. palmivora dan agens pengendali.
a. Uji antagonisme T. viride dan P. palmivora
Uji antagonisme ini dilakukan dengan menggunakan biakan isolat T. viride dan
biakan murni isolat P. palmivora yang masing-masing berumur 3 hari.
Masing-masing isolat jamur diambil dengan menggunakan bor gabus dan diinfestasikan
pada titik-titik yang telah ditentukan pada cawan petri.
b. Uji antagonisme P. fluorescens dan P. palmivora
Uji antagonisme dengan menggunakan biakan isolat P. fluorescens terlebih
dahulu dibuat suspensi. Koloni bakteri P. fluorescens yang berumur 3 hari
ditambahkan air steril 10 ml ke dalam cawan petri. Suspensi tersebut dimasukkan
ke dalam tabung reaksi dan dihomogenkan menggunakan rotamixer. Kemudian
diambil 1 ml dari 10 ml suspensi P. fluorescens dan dicampurkan pada tabung
reaksi lain yang telah berisi 9 ml air steril. Hal ini terus dilakukan sampai 6 kali
sehingga didapatkan pengenceran P. fluorescens 10-6 per ml air. Selanjutnya,
potongan kertas saring steril berbentuk cakram berdiameter 0,5 mm dicelupkan
dalam suspensi P. fluorescens dan diinfestasikan pada cawan berisi media
c. Uji antagonisme kontrolmetalaksil dan P. palmivora
Untuk uji antagonisme kontrol metalaksil 1% terlebih dahulu dibuat suspensi.
Perlakuan kontrol metalaksil menggunakan konsentrasi 1% dengan cara sebanyak
0,01 ml fungisida metalaksil ditambahkan kedalam tabung reaksi yang berisi 9 ml
air steril dan dihomogenkan menggunakan rotamixer. Selanjutnya, potongan
kertas saring steril berbentuk cakram berdiameter 0,5 mm dicelupkan dalam
suspensi metalaksil tersebut dan diinfestasikan pada cawan berisi media
bersamaan dengan isolat P. palmivora pada titik yang telah ditentukan.
Untuk uji antagonisme menggunakan kontrol air dengan cara mencelupkan
potongan kertas saring steril berbentuk cakram berdiameter 0,5 mm dalam air
steril dan diinfestasikan pada cawan berisi media bersamaan dengan isolat
P. palmivora pada titik yang telah ditentukan.
Gambar 5. Skema letak jamur P. palmivora dan agens pengendali pada uji antagonisme dalam cawan petri.
Keterangan : P = biakan P.palmivora; a= pengujian berupa T.viride, P.fluorescens, kontrol berupa air dan fungisida metalaksil 1%
3 cm R1
P R2
3.5. Pengamatan
Pengamatan dilakukan setiap hari setelah inokulasi untuk mengukur jari-jari
koloni P. palmivora yang terpanjang dan yang terpendek/mendekati perlakuan
berupa T. viride, P. fluorescens, kontrol air serta kontrol metalaksil. Pengukuran
jari-jari dimaksudkan untuk mengetahui pertumbuhan jamur P. palmivora pada
hasil infestasi yang telah dilakukan, sehingga diketahui kemampuan T. viride dan
P. fluorescens dalam menghambat pertumbuhan P .palmivora secara in vitro.
Pengamatan dihentikan apabila koloni jamur P. palmivora pada kontrol air sudah
mengenai tepi cawan petri.
Data yang diperoleh berupa jari-jari koloni P. palmivora kemudian dihitung
persentase penghambatan menggunakan rumus (Mahadtanapuk dkk., 2007) :
Keterangan :
PR = Persen penghambatan pertumbuhan jamur.
R1 = Jari-jari koloni P. palmivora terpanjang/menjauhi perlakuan
berupa T. viride, P. fluorescens, kontrol air serta kontrol
metalaksil.
R2 = Jari-jari koloni P. palmivora terpendek/mendekati perlakuan
berupa T. viride, P. fluorescens, kontrol air serta kontrol
V. KESIMPULAN DAN SARAN
5.1. Kesimpulan
Dari hasil penelitian yang telah dilakukan dapat disimpulkan bahwa :
1. T. viride dan P. fluorescens dapat menghambat pertumbuhan P. palmivora
secara in vitro.
2. P. fluorescens dapat menghambat pertumbuhan P. palmivora lebih tinggi
dibandingkan T. viride.
3. Jenis media tumbuh dapat mempengaruhi T. viride dan P. fluorescens dalam
menghambat pertumbuhan P. palmivora secara in vitro.
4. Media yang paling baik untuk uji antagonisme T. viride dan P. fluorescens
terhadap pertumbuhan P. palmivora adalah media PDA.
5.2. Saran
Dari penelitian ini, perlu dilakukan penelitian lanjutan yang diaplikasikan ke buah
kakao di laboratorium untuk melihat keefektifan agens pengendali berupa
Trichoderma viride dan Pseudomonas fluorescens dalam menekan pertumbuhan
PENGARUH Trichoderma viride dan Pseudomonas fluorescens TERHADAP PERTUMBUHAN Phytophthora palmivora Butl.
PADA BERBAGAI MEDIA TUMBUH
Oleh
YANI KURNIAWATI
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA PERTANIAN
Pada
Program Studi Agroteknologi Fakultas Pertanian Universitas Lampung
FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
DAFTAR GAMBAR
Gambar Halaman
1. Tanaman kakao dengan buah (Theobroma cacao L.) ... 9
2. Spora jamur Phytophthora palmivora dengan tonjolan papila Disalah satu ujungnya ... 11
3. Sporodokia Trichoderma viride ... 16
4. Sel Pseudomonas fluorescens ... 17
5. Skema Letak jamur P. palmivora dan agens pengendali pada uji antagonisme dalam cawan petri ... 26
6. Buah Kakao yang terserang jamur P. palmivora ... 28
7. A. Bentuk koloni P. palmivora ... 29
B. Bentuk sporangia P. palmivora seperti buah pir ... 29
8. Pertumbuhan koloni P. palmivora dengan T. viride, P. fluorescens, Metalaksil dan kontrol (air) dalam kultur ganda media PDA (6hsi) ... 32
9. Pertumbuhan koloni P. palmivora dengan T. viride, P. fluorescens, Metalaksil dan kontrol (air) dalam kultur ganda media V8 (6hsi) ... 33
10.Pertumbuhan koloni P. palmivora dengan T. viride, P. fluorescens, Metalaksil dan kontrol (air) dalam kultur ganda media King’s B (6hsi) ... 33
B. Zona penghambatan T. viride terhadap P. palmivora ditandai dengan warna kuning pada bagian bawah cawan
petri ... 36
13.Grafik pengaruh media terhadap persentase penghambatan P. palmivora ... 38
14.Isolat Trichoderma viride ... 58
15.Isolat Pseudomonas fluorescens ... 58
16.Biakan P. fluorescens diamati dibawah lampu ultraviolet ... 59
17.A. Formulasi fungisida metalaksil konsentrasi 1% ... 59
B. Pengenceran Pseudomonas fluorescens 10-6 per ml air ... 59
DAFTAR ISI
Halaman
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xiii
I. PENDAHULUAN 1.1Latar Belakang Masalah ... 1
1.2Tujuan Penelitian ... 3
1.3Kerangka Pemikiran... 3
1.4Hipotesis ... 5
II. TINJAUAN PUSTAKA 2.1Tanaman Kakao ... 7
2.2Penyakit Busuk Buah Kakao ... 9
2.2.1 Penyebab Penyakit ... 10
2.2.2 Gejala Penyakit ... 11
2.2.3 Daur Penyakit ... 12
2.2.4 Faktor-faktor yang mempengaruhi penyebab penyakit ... 13
2.3Jamur Trichoderma viride sebagai agens antagonis ... 14
2.4Pseudomonas fluorescens sebagai agens antagonis ... 16
2.5Media tumbuh ... 19
III.METODE PENELITIAN 3.1Waktu dan Tempat Penelitian ... 21
3.2Alat dan Bahan ... 21
a. Media PDA (Potato Dextrose Agar) ... 22
b. Media V8 (Vegetable Eight) ... 23
c. Media King’s B ... 23
3.4.2 Penyiapan biakan murni P. palmivora sebagai sumber inokulum ... 23
3.4.3 Perbanyakan biakan T. viride ... 24
3.4.4 perbanyakan biakan P. fluorescens ... 24
3.4.5 Uji Antagonisme Trichoderma viride dan Pseudomonas fluorescens terhadap Phytophthora palmivora pada 3 macam media yang berbeda ... 24
DAFTAR PUSTAKA
Achmad. 1997. Mekanisme Serangan patogen dan Pertahanan Inang serta Pengendalian Hayati Penyakit Londoh Pada Pinus merkusii.Disertasi. Program Pasca Sarjana IPB. Bogor.
Agrios, G. N. 1988. Plant Pathology. Professor and Chairman Dept. of Plant Pathology University of Florida. Academic Press Inc. Guinesville. hlm: 359.
Agrios, G., N. 2005. Plant Patology. Fifth Edition. Elsevier Academic Press. New York.
Alexopoulus, C. J. dan C. W. Mims. 1979. Introductory Mycology. Jhon Willey and Sons. New York. 386 pp.
Anonim. 2000. Pseudomonas fluorescens.
http://prospect.rsc.org/blogs/cw/2009/12/18/chemistry-worlds-weekly round-up-of-money-and-molecules-98/. Diakses tanggal 25 Mei 2011.
______. 2008. Phytophthora palmivora.
http://www.forestryimages.org/browse/detail.cfm?imgnum=5338009. Diakses tanggal 25 Mei 2011.
______. 2010. Trichoderma viride. http://www.emlab.com/s/sampling/env report-04-2010.html. Diakses tanggal 25 Mei 2011.
_______. 2011. Ekspor Kakao Meningkat. http://bataviase.co.id/node/560015.
Diakses tanggal 12 Mei 2011.
Arwiyanto, T., YMS Maryudani, dan Nining Nurul Azizah. 2007. Sifat-Sifat Fenotipik Pseudomonas fluorescens, Agensia Pengendalian Hayati Penyakit Lincat pada Tembakau Temanggung. Biodiversitas Volume 8 No 2.
Universitas Gadjah Mada. Yogyakarta.
Desfina, Imelda. 2008. Uji Antagonisme Trichoderma viride terhadap Phytophthora palmivora Penyebab Busuk Buah Kakao secara in vitro. Skripsi. Fakultas Pertanian Universitas Lampung. Bandar Lampung. 26 hlm.
Dinas Perkebunan Propinsi Lampung. 2007. Perkembangan Luas Area dan
Produksi 7 (tujuh) Komoditi Utama Tanaman Perkebunan Tahun 2003-2004 dalam www.Disbunlampung.go.id.
Dirmawati, S. R. 2004. Kajian Keefektifan Beberapa Komponen Pengendalian Ramah Lingkungan terhadap Penyakit Pustul Bakteri Kedelai. Disertasi. Bogor. Institut Pertanian Bogor.
Djafarudin. 2000. Dasar-dasar Pengendalian Penyakit Tanaman. Jakarta: Bumi Aksara.
Djafarudin. 2004. Dasar-Dasar Pengendalian Penyakit Tanaman. Jakarta: Bumi Aksara. 170 hlm.
Domsch, K., H., Troute, W., G. dan Anderson, H. 1993. Compendium of Soil Fungi. Volume 1. IHW-Verlag. Eching. 859 hlm.
Drenth, A. and Guest, D.I., ed. 2004. Diversity and management of Phytophthora in Southeast Asia. ACIAR Monograph No. 114, 238p.
http://aciar.gov.au/files/node/598/mn114-part1.pdf.
Efri, 1996. Analisis aplikasi Pseudomonas kelompok flouresen Trichoderma viride pers Ex gray untuk Pengendalian Penyakit Layu Fusarium pada tomat. Jurnal Jurusan BPD Fakultas Pertanian Unila. Bandar Lampung.
Hanudin, E. Sutarya, S. Mihardja, I. Sanusie. 2007. Mikroba Antagonis Sebagai Agens Hayati Pengendali Tanaman Penyakit. Tersedia pada
http://www.pustaka-deptan.go.id/publikasi/wr262044.pdf. Diakses tanggal 2 Oktober 2011.
Res.106:705-715.
Jayaswal R.K., Rajesh Singh dan Youn Su Lee. 2003. Influence of Physiological and Environmental Factors on Growth and Sporulation of an Antagonistic Strain of Trichoderma viride RSR 7. Korean. Jurnal Mycobiology.
31(1):36-41.
Kadam, Nathan, K. 2003. Pengaruh Formula dan Waktu Aplikasi Beberapa Strain Pseudomonas Kelompok fluorescens dalam Pengendalian Sclerotium rolfsii Penyebab Penyakit damping- off pada Semai Paraserianthes falcataria L. Nielsen. Skripsi. Fakultas Kehutanan Universitas Papua. 28 hlm.
Kompas. 2010. Produksi Kakao di Lampung Turun Drastis.
http://bisniskeuangan.kompas.com/read/2010/12/09/03470010/.Produksi.K kao.di.Lampung.Turun.Drastis. Diakses tanggal 3 Maret 2011.
Mahadtanapuk.S., M. Sanguansermsri, R.W. Cutler, V. Sardsud dan S.Anuntalabhochai. 2007. Control of Anthtacnose Caused by Colletotrichm musae on Curcuma alismatifolia Gagnep. Using Antagonistic Basillus spp. American Journal of Agricultural and Biological Sciences. 2:54-61.
Mayasari, S.R., 2011. Isolasi dan Pengujian Antagonisme Pseudomonas Berfluoresen Isolat Lokal Lampung Terhadap Blood Disease Bacterium (BDB) Penyebab Penyakit Layu Bakteri Pisang Secara In Vitro. Skripsi. Universitas Lampung. Bandar Lampung. 56 hlm.
Megasari, S., C. 2006. Pengaruh Beberapa Media Starter sebagai Bahan Perbanyakan Jamur Antagonis Trichoderma viride Pers, ex. Gray. Skripsi. Universitas Lampung. Bandar Lampung. 40 hlm.
Muray, Patrick, R. 1978. Growth of Clinical Isolates of Anaerobic Bacteria on Agar Media:Effects of Media Composition, Storange Conditions, and Reduction Under Anaerobic Conditions. Journal of Clinical Microbiology. Vol 8 No 6. University School of Medicine St. Louis. Missouri. Hlm 708 714.
Ndoumbe-Nkeng, M., C. Cilas, I. Sache. 2003. Impact of removing diseased pods on cocoa black pod caused by Phytophthora megakarya and on cocoa production in Cameroon. Crop Protection 23 (2004). 415–424.
Purwantara, A., D. Manohara, J.S. Warokka. 2004. Phytophthora diseases in Indonesia. In Drenth A. & D.I. Guest (eds.). Diversity and Management of Phytophthora in Southeast Asia. ACIAR Monograph No. 114, p. 70-76.
Rachid D. dan Bensoltane A. 2005. Effect of iron and growth inhibitors on siderophores production by Pseudomonas fluorescens. African Journal of Biotechnology Vol. 4 (7), pp. 697-702.
Rachmawati, A., A. Harsoyo, T. Martoredjo. 1995. Kajian Pengendalian Penyakit Busuk Batang Vanili dengan Trichoderma viride. Risalah Kongres Nasional XIII dan Seminar Ilmiah Perhimpunan Fitopatologi Indonesia. Mataram. Gadjah Mada University Press. Yogyakarta.
Rudolph K., Roy, M.A., and Sasser, M., Stead, D.E., 1990. Methods in Phytobacteriology. Akademiai ki ado. Budapest.
Schaad, N. W. 1988. Laboratory Guide for Identification of Plant Pathogen Bacteria. Second Edition. APS Press. St. Paul Minnessota 55121, USA.
Semangun, H. 2000. Penyakit-Penyakit Tanaman Perkebunan di Indonesia. Yogyakarta: Gadjah Mada University Press. 476 hlm.
Septiana. 2009. Uji Aplikasi Pseudomonas fluorescens Migula yang Terdaptasi di Filosfer Jagung untuk Pencegahan Penyakit Bulai pada Jagung (Zea Mays L.). Skripsi. Universitas Lampung. Bandar Lampung.
Siregar, Tumpal, H., S., Slamet, Riyadi, Laeli, Nuraeni. 2009. Pembudidayaan Pengolahan dan Pemasaran Cokelat. Jakarta: Penebar Swadaya. 168 hlm.
Soesanto, L. 2008. Pengantar Pengendalian Hayati Penyakit Tanaman. Suplemen ke Gulma dan Nematoda. PT Raja Grafindo Persada. Jakarta. 573 hlm.
Sukamto,S., Qithfirul, A. Dan Supandi. 1994. Teknik Perbanyakandan Aplikasi Jamur Trichoderma spp. Pusat Penelitian Kopi dan Kakau Indonesia. Jember. P.7.
Sulistyowati, E. 2003. Analisis Status Penelitian dan Pengembangan PHT pada Pertanaman Kakao.
http://seasia.ipmnetwork.net/main/upload/MU_71.pdf.
SANWACANA
Bismillahirrahmanirrahim.
Alhamdulillah, puji syukur kehadirat Allah SWT atas segala limpahan
nikmat-Nya sehingga penulis dapat menyelesaikan skripsi ini yang berjudul “Pengaruh
Trichoderma viride dan Pseudomonas fluorescens Terhadap Pertumbuhan
Phytophthora palmivora Butl. Pada Berbagai Media Tumbuh”.
Dalam menyelesaikan penelitian maupun penulisan skripsi ini, penulis banyak
mendapat bantuan baik berupa tenaga, pikiran, waktu, maupun materil dari
berbagai pihak. Oleh karena itu pada kesempatan ini penulis ingin menyampaikan
ucapan terima kasih kepada:
1. Ibu Dr. Ir. Suskandini Ratih D., M.P., selaku pembimbing utama atas ide
penelitian, arahan, bimbingan serta saran yang diberikan selama pelaksanaan
penelitian hingga proses penulisan skripsi.
2. Bapak Ir. Sudiono, M.Si., selaku pembimbing kedua atas saran dan
bimbingan yang diberikan dalam proses penyelesaian skripsi ini.
3. Ibu Ir. Titik Nur Aeny, M.Sc., selaku pembahas atas saran dan kritik yang
diberikan selama penulisan skripsi.
4. Bapak Prof. Dr. Ir. Wan Abbas Zakaria, M.S., selaku Dekan Fakultas
6. Bapak Prof. Dr. Ir. Purnomo, M.S., selaku pembimbing akademik.
7. Dosen pengajar di lingkungan Fakultas Pertanian, khususnya Jurusan Proteksi
Tanaman atas ilmu yang telah diberikan tanpa pamrih.
8. Staf tata usaha di lingkungan Fakultas Pertanian, khususnya Jurusan Proteksi
Tanaman terima kasih atas bantuannya selama penulis menjadi mahasiswa.
9. Papa dan mama tercinta yang telah memberikan limpahan kasih sayang dan
doa, kedua adikku Icha dan Andre, serta keluarga besarku dimanapun berada
atas motivasi secara moril, spiritual dan materil.
10. Rekan sepenilitianku: Siti Juariyah (Riyut) dan Ahmad Bazawi A., atas
bantuan dan semangatnya selama melakukan penelitian hingga terselesainya
skripsi ini.
11. Sahabatku: Septya Eka P.R., Stenia R.Y., rekan-rekan HPT 2005-2007, Mario
Gunawan serta kawan-kawan Agroteknologi 2008 yang tidak dapat
disebutkan satu persatu terima kasih untuk canda tawa, dukungan dan
kebersamaannya selama ini.
Semoga Allah SWT membalas semua kebaikan yang telah diberikan. Akhirnya,
penulis berharap semoga skripsi ini memberikan informasi berguna dan
bermanfaat bagi semua pihak. Amien.
Bandar Lampung, Januari 2012
Judul Skripsi : PENGARUH Trichoderma viride dan
Pseudomonas fluorescens TERHADAP
PERTUMBUHAN Phytophthora palmivora Butl. PADA BERBAGAIMEDIA TUMBUH
Nama Mahasiswa : YANI KURNIAWATI
No. Pokok Mahasiswa : 0714041060
Program Studi : Agroteknologi
Fakultas : Pertanian
MENYETUJUI, 1. Komisi Pembimbing
Dr. Ir. Suskandini Ratih D., M.P. Ir. Sudiono, M.Si.
NIP 196105021987072001 NIP 196509271994021001
2. Ketua Program Studi
MENGESAHKAN
1. Tim Penguji
Ketua : Dr. Ir. Suskandini Ratih D., M. P. …...
Sekretaris : Ir. Sudiono, M. Si. …...
Penguji
Bukan Pembimbing : Ir. Titik Nur Aeny, M.Sc. …...
2. Dekan Fakultas Pertanian
Prof. Dr. Ir. Wan Abbas Zakaria, M.S. NIP 196108261987021001
RIWAYAT HIDUP
Penulis dilahirkan di Metro pada tanggal 19 Januari 1990, sebagai anak pertama
dari tiga bersaudara pasangan Bapak M. Syukur dan Ibu Rukayati. Penulis
menyelesaikan Pendidikan Taman Kanak-Kanak Pertiwi Pekalongan pada tahun
1993. Pada tahun 2001, penulis menyelesaikan Pendidikan Sekolah Dasar di
SDN 2 Tulus Rejo, Kecamatan Pekalongan Kabupaten Lampung Timur. Sekolah
Menengah Pertama di SMPN 4 Metro, diselesaikan pada tahun 2004. Sekolah
Menengah Atas di SMA Kartikatama Metro, diselesaikan pada tahun 2007.
Sejak 2007, penulis terdaftar sebagai Mahasiswa Program Studi Ilmu Hama dan
Penyakit Tumbuhan Jurusan Proteksi Tanaman Fakultas Pertanian Universitas
Lampung melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB) yang
kemudian pada tahun 2008 jurusan tersebut dilebur menjadi satu dengan Jurusan
Agronomi dan Ilmu Tanah sehingga menjadi Program Studi Agroteknologi.
Penulis melaksanakan Praktik Umum (PU) di Balai Penelitian Tanaman Obat dan
Aromatik (BALITTRO) Bogor, Provinsi Jawa Barat. Selama menjadi mahasiswa,
penulis pernah menjadi asisten praktikum Penyakit Penting Tanaman pada tahun