ISOLASI SENYAWA ALKALOIDA
DARI BIJI BUAH PALA
(Myristica fragrans Houtt)
SKRIPSI
JHON FRANTA PELAWI NIM : 070822005
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMA PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
ISOLASI SENYAWA ALKALOIDA
DARI BIJI BUAH PALA
(Myristica fragrans Houtt)
SKRIPSI
Diajukan unuk melengkapi skripsi dan memenuhi syarat mencapai gelar sarjana
JHON FRANTA PELAWI 070822005
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMA PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : ISOLASI SENYAWA ALKALOIDA DARI BIJI
BUAH PALA (Myristica Fragrans Houtt)
Kategori : SKRIPSI
Nama : JHON FRANTA PELAWI
Nomor Induk Mahasiswa : 070822005
Program Studi : SARJANA (S1) KIMIA EKSTENSI
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Diluluskan di Medan, Juni 2009
Komisi Pembimbing
Pembimbing 2 Pembimbing 1
( Sovia Lenny,SSi, MSi ) ( Drs. Phillipus H. Siregar, MSi )
NIP 132258139 NIP 130353142
Diketahui / Disetujui oleh
Departemen Kimia FMIPA USU Ketua
PERNYATAAN
ISOLASI SENYAWA ALKALOIDA
DARI BIJI BUAH PALA
(Myristica fragrans Houtt)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Juni 2009
JHON FRANTA PELAWI
PENGHARGAAN
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas limpahan rahmat dan karunia-Nya sehingga kertas kajian ini berhasil diselesaikan dalam waktu yang telah ditetapkan.
Ucapan terima kasih saya sampaikan kepada Bapak Ds. Phillipus H Siregar, MSi dan Ibu Sovia Lenny, SSi, MSi selaku dosen pembimbing pada penyelesaian skripsi ini yang telah memberikan panduan dan penuh kepercayaan kepada saya untuk menyempurnakan kajian ini. Ucapan terima kasih juga saya sampaikan kepada Ketua dan Sekretaris Departemen Kimia Dr. Rumondang Bulan Nst, MS dan Drs. Firman Sebayang, MS. Dekan dan Pembantu Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara, para dosen pada departemen Kimia FMIPA USU khususnya pada dosen Kimia Bahan Alam, pegawai di FMIPA USU, serta kepada teman-teman stambuk 2007 Kimia Ekstensi, Rianto sebagai teman yang terus mendukung saya, Asisten Laboratorium Kimia Bahan Alam. Akhirnya ucapan
terima kasih yang sebesar-besarnya saya sampaikan kepada orang tua saya Bapak Johan Pelawi, Sp.d dan Ibu Serta Ulina br Sitepu serta adik-adik saya yang
ISOLASI SENYAWA ALKALOID DARI BIJI BUAH PALA ( Myristica fragrans Houtt)
INTI SARI
THE ISOLATION OF ALKALOIDA COMPOUNDS WHICH CONTAINED NUTMEG SEED
( Myristica fragrans Houtt )
ABSTRACT
The isolation of alkaloida compound which contained nutmeg seed ( Myristica
fragrans Houtt ) has been done with maceration tehnique with ethanol solvent.
DAFTAR ISI
1.3.Tujuan Penelitian 11
1.4.Manfaat Penelitian 11
1.5.Lokasi Penelitian 11
1.6.Metode Penelitian 11
BAB II Tinjauan Pustaka
2.1. Tanaman Pala 13
2.1.1. Morfologi Tanaman Pala 13
2.1.2. Nama Daerah 13
2.1.3. Khasiat dan kegunaan 13
2.1.4. Sistematika Tanaman Pala 14
2.1.5. Kandungan Kimia 14
2.2. Senyawa alkaloida 14
2.2.1. Sifat-Sifat Senyawa Alkaloida 15
2.2.2. Klasifikasi Senyawa Alkaloida 15
2.2.3. Biosintesis Senyawa Alkaloida 17
2.3. Identifikasi, Isolasi dan Pemurnian senyawa Alkaloida 18
2.3.1. Identifikasi Senyawa Alkaloida 18
2.3.2. Isolasi Senyawa Alkaloida 18
2.3.3. Pemurnian Senyawa Alkaloida 18
2.4. Tahapan-Tahapan Pengerjaan sampel dari Tumbuh-Tumbuhan 19
2.4.1. Isolasi 19
2.4.2. Pemekatan Larutan 20
2.4.3. Jumlah Komponen Senyawa 21
2.4.4. Pemisahan Komponen Kimia 21
2.4.5. Fraksi-fraksi 21
2.4.6. Penguapan Pelarut 22
2.4.7. Rekristalisasi 22
2.4.8. Identifikasi Senyawa dan Penentuan Struktur 22
2.5. Kromatografi 22
2.5.1. Kromatografi Lapis Tipis (KLT) 23
2.5.2. Kromatografi Kolom 24
2.6. Tehnik Spektroskopi 25
2.6.1.1. Vibrasi Regang N-H 26 2.6.1.2. Kegunaan Spektroskopi Infra Merah (FT-IR) 27 2.6.2. Spektrofotometer Resonansi Inti Proton (1H-NMR) 27
2.6.2.1. Efek Perisai 28
2.6.2.2. Pergeseran Kimia 28
BAB III Metodologi Penelitian
3.1. Alat 30
3.2. Bahan 30
3.3. Prosedur Penelitian 31
3.3.1. Penyediaan sampel 31
3.3.2. Uji Pendahuluan 31
3.3.2.1. Uji Skrining Fitokimia 31
3.3.2.2. Uji Pendahuluan Kromatografi Lapis Tipis 31 3.3.3. Prosedur untuk Memperoleh Senyawa Kimia
Ekstrak Biji Buah Pala 32
3.3.4. Pemisahan Senyawa Alkaloida dengan menggunakan
Kromatografi Kolom 32
3.3.5. Pemurnian Kristal 33
3.3.6. Analisis Kristal Hasil Isolasi 33
3.3.6.1. Analisis Kromatografi Lapis Tipis 33 3.3.6.2. Uji Reaksi Warna Terhadap Kristal Hasil Isolasi
Pereaksi Alkaloida 33
3.3.6.3. Penentuan Titik Lebur 34
3.3.6.4. Analisis Spektroskopi kristal 34
3.4. Bagan Penelitian 35
BAB IV Hasil dan Pembahasan
4.1. Hasil Penelitian 36
4.2. Pembahasan 37
BAB V Kesimpulan dan Saran
5.1. Kesimpulan 39
5.2. Saran 39
DAFTAR LAMPIRAN
LAMPIRAN A Determinasi Tanaman Pala
LAMPIRAN B Hasil Kromatografi Lapis Tipis Ekstrak Etanol Biji Buah Pala LAMPIRAN C Hasil Kromatografi Lapis Tipis Hasil Isolasi
LAMPIRAN D Hasil KLT Ekstrak Etanol Biji Buah Pala dan Hasil Isolasi LAMPIRAN E Spektrum FT-IR Hasil Isolasi Senyawa Alkaloida
BAB I PENDAHULUAN
1.1. Latar Belakang
Indonesia dikaruniai kekayaan alam yang penuh dengan keanekaragaman hayati yang bisa dimanfaatkan, antara lain tumbuh-tumbuhan sebagai sumber senyawa-senyawa baru yang perlu diselidiki, baik strukturnya maupun khasiat dari senyawa tersebut (Djauhariyah,E.2004).
Tumbuhan merupakan gudang berbagai jenis senyawa kimia dan merupakan sumber senyawa Kimia Organik Bahan Alam Hayati dan lebih dikenal dengan “ Natural Product Chemistry”. Senyawa ini penting peranannya dalam rangka pemanfaatan zat-zat kimia berkhasiat yang terkandung bahan alam hayati.
Pemanfaatan tumbuhan sebagai obat merupakan warisan nenek moyang sejak dahulu kala dan telah digunakan dalam kurun waktu dalam yang cukup lama.
Kebutuhan akan obat-obatan dalam hubungan mensukseskan program kesehatan adalah mendorong kita untuk mencari senyawa-senyawa kimia yang terkandung pada tumbuhan berkhasiat yang dapat digunakan untuk maksud tertentu. Sejalan dengan program pemerintah dibidang kesehatan, maka permasalahan obat-obatan tradisional kini semakin mendapat perhatian.Hal ini merangsang adanya suatu usaha untuk meneliti secara ilmiah terhadap tumbuh-tumbuhan yang diperkirakan berkhasiat. Salah satu diantara tanaman berkhasiat tersebut adalah tanaman pala, dimana tanaman ini berguna untuk bahan obat-obatan (James B.Hendrikson,1965).
Dari hal-hal tersebut diatas peneliti ingin mengisolasi senyawa bahan alam yang terkandung pada buah pala antara lain senyawa piperin.
Senyawa piperin ini adalah merupakan sumber dari asam methilenedioxybenzoat dan juga sebagai sumber dari pada piperidin apabila piperin dioksida.
Dimana senyawa piperin ini banyak dijumpai pada rempah-rempah antara lain lada putih, lada hitam dan juga buah pala (Setiawan,D.1999).
1.2. Permasalahan
1.3. Tujuan Penelitian
Untuk mengisolasi senyawa Alkaloida yang terdapat pada buah pala ( Myrystica fragrans Houtt )
1.4. Manfaat Penelitian
Hasil dari penelitian ini diharapkan dapat memberikan suatu sumber informasi ilmiah dalam bidang kimia bahan alam dengan penggunaan senyawa alkaloida dari buah pala ( Myristica fragrans Houtt )
1.5. Lokasi penelitian
Sampel yang digunakan diambil secara acak yang diperoleh dari Pajak Pancur Batu. Penelitian akan dilaksanakan di Laboratorium Kimia Bahan Alam FMIPA USU dan identifikasi kristal akan dilakukan di Laboratorium Dasar Bersama FMIPA UNAIR, Surabaya.
1.6. Metodologi Penelitian
Pengambilan sampel buah pala dilakukan secara acak random di pajak Pancur Batu dan sampel dalam penelitian ini digunakan sebanyak 2000 gr kering dan halus. Langkah awal yang dilakukan adalah skrining fitokimia terhadap sampel buah pala dengan menggunakan pereaksi-pereaksi alkaloida.Buah pala yang kering dan halus dimasukkan sebanyak 100 gr kedalam beaker glass ditambahkan pelarut etanol sampai sampel tersebut terendam. Sampel dibiarkan terendam selama 24 jam lalu disaring untuk mendapatkan larutan ekstrak dari buah Pala ( Myristica fragrans Houtt ). Kemudian larutan ekstrak ditest dengan pereaksi-pereaksi fitokimia untuk senyawa-senyawa alkaloida. Amati hasil reaksi yang terbentuk.
Tahap isolasi yang dilakukan adalah : - Ekstraksi Maserasi
- Ekstraksi Partisi
BAB II
I.TINJAUAN PUSTAKA
2.1 Tanaman Pala ( Myristica fragrans Houtt )
Tanaman pala (Myristica fragrans Houtt) merupakan jenis tanaman yang dapat tumbuh baik di daerah tropis.
2.1.1. Morfologi Tanaman Pala
Tanaman ini jika pertumbuhannya baik dan tumbuh dilingkungan terbuka, tajuknya akan rindang dan ketinggiannya dapat mencapai 15-18 meter. Tajuk pohon ini bentuknya meruncing keatas dan puncak tajuknya tumpul. Daunnya berwarna hijau mengkilap dengan ukuran 10-15 cm dan panjang tangkai daun sekitar 1-1,5 cm. Buahnya berbentuk bulat, berwarna kuning, jika sudah masak secara otomatis akan terbelah menjadi dua bagian karena mempunyai alur pembelahan seperti buah durian. Garis tengah atau diameter buah jika sudah tua mencapai sekitar 9 cm. Daging buah tebal dan rasanya asam. Biji buah berbentuk agak bulat dengan diameter sekitar 2,5 cm. Kulit biji berwarna coklat agak kehitam-hitaman dan mengkilat. Selaput biji atau sering disebut fuli atau bunga pala berwarna merah menyala atau merah agak gelap tetapi ada juga yang berwarna putih kekuning-kuningan. Sedangkan kernel (endosperm) biji berwarna putih keabu-abuan (Hatta Sunanta,1993).
2.1.2. Nama Daerah
Nias : Falo, Minangkabau : Palo, Sangir dan Talaud : Palang, Lampung : Pahalo, Bima : Kapala, Sulawesi Utara : Para, Timor : Pal, Halmahera : Gosora
2.1.3. Khasiat dan Penggunaannya
atau kaleng. Minyak fuli juga dapat dipakai sebagai obat rubefacien dan minyak gosok dan balsem untuk penghangat kulit. Dikalangan pemakai jamu tradisional, fuli yang tidak memenuhi standart kualitas karena tidak utuh dan cacat, dikeringkan untuk dibuat teh.
Teh dari fuli ini merupakan jamu mujarab bagi penderita sesak didaerah lambung dan rasa kembung dalam perut.Rumphius mengatakan bahwa pala itu sesungguhnya dapat meringankan semua rasa sakit dan rasa nyeri yang disebabkan oleh kedinginan dan masuk angin dalam lambung dan usus. Disamping itu, biji pala sangat baik untuk obat pencernaan yang terganggu, obat muntah-muntah. Dikalangan peracik jamu tradisional, biji pala digunakan dengan bijaksana sebagai analgesik pencegah nyeri perut mulas yang bisa timbul karena masuk angin (Setiawan,D.1999).
2.1.4. Sistematika Tanaman Pala (Myristica fragrans Houtt) Kingdom : Plantae
Spesies : Myristica fragrans Houtt
2.1.5. Kandungan Kimia Tanaman Pala
Buah pala mengandung zat-zat : minyak terbang (myristin, pinen, kamfen (zat membius), dipenten, pinen safrol, eugenol, iso-eugenol, alkohol), gliseda (asam-miristinat, asam- oleat, borneol, giraniol), protein, lemak, pati gula, vitamin A, B1 dan C. Minyak tetap mengandung trimyristin.
2.2. Senyawa Alkaloida
banyaknya senyawa alkaloida serta keterkaitannya dengan bidang lain seperti Farmasi, sebenarnya dunia alkaloida memerlukan satu bidang tersendiri.
Hampir semua alkaloida mengandung paling sedikit sebuah atom nitrogen yang merupakan bagian dari cincin heterosiklik. Hampir semua alkaloida yang ditemukan dialam mempunyai keaktifan fisiologis tertentu.
Ada yang sangat beracun dan ada pula yang berguna dalam pengobatan, misalnya kuinin, morfin dan striknin adalah alkaloida yang terkenal dan mempunyai efek fisiologis dan psikologis (Rangke,L.Tobing,1989).
Alkaloida dapat dibedakan dari beberapa sebagian besar komponen tumbuhan lain berdasarkan sifat basanya dan biasanya terdapat dalam tumbuhan sebagai garam dengan berbagai asam organik. Garam ini merupakan senyawa padat berbentuk kristal tanpa warna, meskipun ada juga yang berwarna, contohnya berberina dan serpentina berwarna kuning (Trevor,1995).
2.2.1. Sifat-sifat Senyawa Alkaloida
Secara umum, golongan senyawa alkaloida mempunyai sifat-sifat sebagai berikut : 1.Biasanya merupakan kristal tak berwarna, tidak mudah menguap, tidak larut dalam air, larut dalam pelarut-pelarut organik seperti etanol, eter dan kloroform. Beberapa alkaloida ( seperti koniin dan nikotin ) berwujud cair dan larut dalam air. Ada juga alkaloida yang berwarna, misalnya berberin ( kuning ).
2.Bersifat basa, pada umunya berasa pahit, bersifat racun, mempunyai efek fisiologis serta optik aktif.
3.Dapat membentuk endapan dengan larutan asam fosfowolframat, asam fosfomolibdat, asam pikrat, kalium merkuriiodida dan lain sebagainya.
Dari endapan ini, banyak juga yang memiliki bentuk kristal yang khusus sehingga sangat bermanfaat dalam identifikasinya.
2.2.2. Klasifikasi Senyawa Alkaloida
A. Senyawa- senyawa alkaloida berdasarkan Gugus Fungsi
Pengklasifikasian senyawa alkaloida berdasarkan gugus fungsi adalah yang paling umum dan praktis. Berdasarkan gugus fungsi dapat dibagi menjadi :
2. Alkaloida Pirolidin, misalnya higrin dan koka 3. Alkaloida Piridin, misalnya nikotinat
4. Alkaloida perpaduan Pirolidin dan Piridin, misalnya nikotin 5. Alkaloida Kuinolin, misalnya kuinin
6. Alkaloida Isokuinolin, misalnya papaverin 7. Alkaloida Fenantren, misalnya emerin
8. Alkaloida Indole yang dapat digolongkan menjadi : a. Alkaloida sederhana, misalnya Triptamin b. Alkaloida Ergot, misalnya Serotonin c. Alkaloida Harmala, misalnya -karbolin d. Alkaloida Yohimbe, misalnya reserpin
e. Alkaloida Strichnos, misalnya brusin dan strknin (Rangke,L.Tobing,1989).
B. senyawa- senyawa Alkaloida berdasarkan biogenetiknya
Berdasarkan biogenetiknya, senyawa-senyawa alkaloida dapat diklasifikasikan menjadi :
1. Alisiklik alkaloida terdiri dari : - Lupinin Alkaloida - Pirolizidin Alkaloida - Tropane Alkaloida
2. Fenilalamin Alkaloida terdiri dari : - Papaverin
- Morfin
- Amarillis Alkaloida 3. Indole Alkaloida terdiri dari :
- Strychinine (James.B.H.1965).
Dari klasifikasi diatas dapat disimpulkan bahwa belum ada keseragaman dalam pengklasifikasian senyawa alkaloida.
Sistem klasifikasi alkaloida dapat dikelompokkan sebagai berikut :
Banyak usaha untuk mengklasifikasi alkaloida. Sistem klasifikasi yang paling banyak diterima, menurut Hegnauer, alkaloida dikelompokkan sebagai :
1. Alkaloida sesungguhnya merupakan kelompok alkaloida yang bersifat racun, memiliki aktivitas psikologis yang luas, bersifat basa; mengandung atom nitrogen pada cincin heterosikliknya dan diturunkan dari prekursor asam amino. Contohnya ; kolkhisin, asam aristolokhat.
2. Protoalkaloida merupakan amina yang relatif sederhana dimana pada cincin heterosikliknya tidak mengandung atom nitrogen. Contoh; meskalin, ephedrin.
3. Pseudoalkaloida merupakan alkaloida yang tidak diturunkan dari prekursor asam amino, bersifat basa. Ada dua seri alkaloida yang penting dalam kelas ini, yaitu alkaloida steroidal (contoh konessin) dan alkaloida purin (contoh kaffein) (Sastrohamidjoo.1996).
2.2.3. Biosentesis Senyawa Alkaloida
Prekusor alkaloida yang paling umum adalah asam amino, meskipun sebenarnya, biosintesis alkaloida lebih rumit. Secara kimia, alkaloida merupakan suatu golongan heterogen. Ia berkisar dari senyawa sederhana seperti koniin yaitu alkaloida utama. Conium maculatum, sampai ke struktur pentasiklik seperti strikhnina yaitu racun kulit strychnos. Amina tumbuhan ( misalnya meskalina) dan basa purina dan pirimidina (misalnya kafeina) kadang-kadang digolongkan sebagai alkaloida dalam arti umum (Manito,1992).
2.3. Identifiksi, Isolasi dan Pemurnian Senyawa Alkaloida 2.3.1. Identifikasi Senyawa Alkaloida
Metode yang banyak digunakan untuk mendeteksi tanaman yang mengandung alkaloida yaitu prosedur Wall, yang meliputi ekstraksi sekitar 20 gram bahan kering yang direfluks dengan etanol 80 %. Kumpulan filtrat diuapkan, residunya dilarutkan dengan air, disaring kemudian diasamkan dengan HCl 1 %.Lalu diuji dengan pereaksi Meyer atau dengan silikotungstat. Bila hasil positif, larutan tersebut dibasakan dan diekstraski dengan pelarut organik dan diekstraksi kembali kedalam larutan asam. Jika larutan asam ini menghasilkan endapan dengan pereaksi alkaloida berarti tanaman ini mengandung alkaloida. Fasa berair juga halus diteliti untuk menentukan adanya alkaloida kuartener.
Sebagai basa, alkaloida biasanya diekstraksi dari tumbuhan dengan pelarut alkaloida yang bersifat asam encer (HCL 1M atau asam asetat 10 % yang kemudian diendapkan dalam amonium pekat). Pemisahan pendahuluan demikian dari bahan tumbuhan lainnya dapat diulangi atau pemurnian selanjutnya dilaksanakan dengan ekstraksi pelarut. Adanya alkaloida pada ekstrak nisbi kasar yang kemudian dapat diuji dengan menggunakan berbagai pereaksi alkalida (Harbone,1987).
2.3.2. Isolasi Senyawa Alkaloida
Ekstraksi jaringan tumbuhan ( daun, bunga, buah, kulit dan akar ) yang telah dikeringkan dan dihaluskan secara maserasi dengan asam asetat 5% sampai pH 2( 15-20 bagian), lalu saring ekstrak itu. Panaskan sampai 700C dan tambahkan amonia pekat tetes demi tetes sampai pH 10-12. Aduk ekstrak, didiamkan hingga terbentuk endapan lalu saring, larutan bening dibuang. Endapan dicuci dengan NH4OH 1% dan aduk lagi. Kumpulkan, keringkan dan timbang alkaloida kasar yang diperoleh. Alkaloida yang diperoleh direkristalisasi berulang-ulang dengan metanol mendidih hingga diperoleh kristal murni (Harbone, J.B. 1987 ).
2.3.3. Pemurnian Senyawa Alkaloida
- Kristalisasi langsung
Meskipun cara ini cukup sederhana, tetapi jarang memberikan hasil yang memuaskan untuk pemisahan alkaloida murni, kecuali bila suatu alkaloida yang terdapat dalam bahan tidak larut. Beberapa kombinasi pelarut yang sering digunakan untuk kristalisasi alkaloida meliputi metanol, etanol berair, metanol- kloroform, metanol- eter, metanol- aseton dan etanol- aseton.
- Metode gradien pH
Metode ini ditemukan oleh Svodoba untuk mengisolasi alkaloida anti leukimia Catharantus roseus. Cara ini didasarkan pada kenyataan bahwa alkaloida indol dengan struktur yang bervariasi yang terdapat pada tanaman mempunyai sifat basa yang berbeda. Campuran alkaloida kotor dilarutkan dalam larutan asam tartarat 2% dan diekstraksi dengan benzena atau etil asetat. Fraksi I akan mengandung alkaloida netral atau bersifat basa lemah. Kemudian pH larutan dinaikkan dengan bilangan 0,5 lalu pH dinaikkan hingga 9,0 dan diekstraksi dengan pelarut organik. Perbedaan pH memungkinkan pemisahan secara bertahap antara alkaloida basa lemah dan alkaloida basa kuat dari media basa. Alkaloida yang bersifat basa kuat diekstraksi terakhir kali.
2.4. Tahapan- Tahapan Pengerjaan Sampel Dari Tumbuh- Tumbuhan 2.4.1. Isolasi
Beberapa metode isolasi senyawa organik bahan alam yang dikenal dapt dibagi atas proses industri dan proses laboratorium yang berbeda dalam penerapannya.
1. Pengempaan
Metode ini digunakan banyak dalam proses industri seperti pada isolasi CPO dari buah kelapa sawit dimana proses ini tidak menggunakan pelarut organik.
2. Perkolasi
3. Destilasi Uap
Proses destilasi lebih banyak digunakan untuk senyawa organik yang tahan pada suhu yang cukup tinggi, yang lebih tinggi dari titik didih pelarut yang digunakan. Pada umumnya lebih banyak digunakan untuk minyak atsiri.
4. Ekstraksi Kontinue
Menggunakan soklet dengan pemanasan dan pelarut akan dapat dihemat karena terjadinya sirkulasi yang selalu membasahi sampel. Proses ini sangat baik untuk senyawa-senyawa yang tidak terpengaruh oleh panas.
5. Maserasi
Perendaman sampel dengan pelarut organik yang digunakan pada temperatur kamar. Proses ini sangat menguntungkan dalam isolasi senyawa bahan alam, karena dengan perendaman sampel tumbuhan akan terjadi pemecahan dinding dan membran sel akibat perbedaan tekanan antara didalam dan diluar sel dan ekstraksi senyawa akan sempurna karena dapat diatur lama perendaman yang dilakukan. Pemilihan pelarut yang digunakan untuk proses maserasi akan memberikan efektivitas yang tinggi dengan memperhatikan kelarutan senyawa bahan alam dalam pelarut tersebut. Secara umum pelarut metanol merupakan pelarut yang paling banyak digunakan dalam proses isolasi senyawa bahan alam.
2.4.2. Pemekatan Larutan
Hasil isolasi dalam jumlah pelarut yang cukup banyak didapat, dipekatkan dengan menggunakan evaporator rotari dan penggunaan metode tersebut adalah untuk menghindari penggunaan temperatur pada proses pemekatan yaitu dapat digunakan pompa vakum dengan pengaliran air, sehingga dalam alat akan terjadi pengurangan tekanan dan pelarut akan menguap pada temperatur dibawah titik didihnya.
Keuntungan dengan menggunakan kondisi vakum adalah untuk menghindari agar senyawa metabolit sekunder tidak akan terdegradasi selama proses pemekatan atau pengurangan pelarut karena tidak menggunakan panas.
Setelah pemekatan akan dipisahkan berdasarkan kepolaran komponen dengan menggunakan corong pisah, yang ekstrak dengan menambahkan pelarut non polar, semipolar atau menambahkan kepolaran dengan aquadest, dan perlu diperhatikan ekstraksi banyak kali (n kali) dengan jumlah pelarut sedikit akan lebih baik dibandingkan dengan ekstraksi 1 kali dengan penambahan pelarut dengan jumlah yang besar (jumlah pelarut = n kali ekstraksi yang dilakukan).
2.4.3. Jumlah Komponen Senyawa
Penentuan sejumlah komponen senyawa dapat dideteksi dengan mengunakan kromatografi lapis tipis (KLT/TLC) dengan menggunakan plat KLT yang sudah siap pakai dan pada umumnya digunakan plat KLT lapisan silika gel.
Pemilihan eluen yang cocok sebagai pengelusi maka akan terdeteksi jumlah komponen yang berbeda dalam ekstrak kasar, yang terpisah berdasarkan Rf dari masing-masing senyawa.
Pemilihan eluen sebaiknya dimulai dari pelarut organik yang tidak polar seperti heksana dan peningkatan kepolaran dengan etil asetat atau pelarut yang lebih polar lainnya tergantung perbandingan dari kedua pelarut tersebut. Perlu diperhatikan bahwa penggunaan pelarut organik untuk eluen harus bebas air, karena dengan adanya air akan mengganggu kepolaran masing-masing pelarut, dan untuk itu akan lebih baik menggunakan pelarut organik yang telah didestilasi.
2.4.4. Pemisahan Komponen Kimia
Terjadinya pemisahan komponen-komponen pada KLT dengan Rf tertentu dapat dijadikan sebagai panduan untuk memisahkan komponen-komponen kimia tersebut dengan menggunakan kolom kromatografi dan sebagai fase diam dapat digunakan silika gel dan eluen yang digunakan berdasarkan hasil yang diperoleh pada KLT.
2.4.5. Fraksi-Fraksi
2.4.6. Penguapan Pelarut
Penguapan pelarut dari masing-masing fraksi akan diperoleh komponen yang murni baik dalam bentuk padatan ataupun tidak dalam bentuk padatan yang kemurniannya dapat diuji kembali dengan menggunakan KLT dengan bermacam-macam eluen. Terdeteksi satu noda pada KLT menandakan komponen yang telah diisolasi mempunyai kemurnian yang tinggi.
2.4.7. Rekristalisasi
Prinsip kemurnian dari senyawa, dimana komponen pengganggu tidak larut dalam pelarut organik yang digunakan sedangkan komponen kimia utama akan terlarut dalam keadaan panas. Dengan penyaringan maka komponen utama akan terpisah dari komponen pengganggu yang tidak larut dan tertinggal diatas kertas saring.Dan dalam masa pendinginan larutan akan muncul kembali kristal yang jauh lebih murni.
2.4.8. Identifikasi Senyawa dan Penentuan Struktur
Suatu senyawa bahan alam hasil isolasi akan diidentifikasi berdasarkan sifat kimia, fisika dan identifikasi dengan spektroskopi ( UV, 1H-NMR, FT-IR dan MS ) (Sanusi Ibrahim,2000).
2.5. Kromatografi
Kromatografi adalah suatu tehnik pemisahan tertentu dengan menggunakan dua fasa yaitu fasa diam dan fasa gerak. Pemisahan tergantung pada gerakan relatif dari dua fasa ini. Cara-cara kromatografi dapat digolongkan sesuai dengan sifat-sifat dari fasa gerak, yang dapat berupa zat padat atau zat cair.Jika fasa tetap berupa zat padat maka cara tersebut dikenal sebagai kromatografi serapan dan jika zat cair maka kromatografi tersebut dikenal dengan kromatografi partisi.
Pada dasarnya semua cara kromatografi menggunakan dua fasa yaitu satu fasa tetap (Stationary) dan yang lain fasa bergerak ( Mobile ), pemisahan-pemisahan tergantung pada gerakan relatif dari dua fasa ini ( sastrohamidjojo, 1985 ).
2.5.1. Kromatografi Lapis Tipis (KLT)
Kromatografi Lapis Tipis merupakan salah satu metode pemisahan yang cukup sederhana yaitu dengan menggunakan plat-plat kaca yang dilapisi silika gel dan menggunakan pelarut tertentu (Harbone,J.B,1987).
Kromatografi Lapis Tipis (KLT) dapat dipakai dengan dua tujuan. Yang pertama, dipakai selayaknya sebagai metode untuk mencapai hasil kualitatif, kuantitatif dan preparatif. Kedua, dipakai untuk menjajaki sistem pelarut dan sistem penyangga yang akan dipakai dalam kromatografi kolom atau kromatografi cair kinerja tinggi.
Ini merupakan pemisahan komponen-komponen berdasarkan adsorbsi atau partisi oleh fasa diam dibawah gerakan pelarut pengembang atau pelarut pengembang campuran. Pemilihan pelarut pengembang atau pelarut pengembang campuran sangat dipengaruhi oleh macam polaritas zat-zat kimia yang dipisahkan. Fasa diam yang umum dan banyak dipakai adalah silika gel yag dicampur dengan CaSO4 untuk menambah daya lengket partikel silika gel.
Ada tidaknya air dalam penyerap kromatografi atau penyangga sangat penting. Lapisan silika gel atau alumina yang akan dipakai untuk penyerapan harus sesedikit mungkin mengandung air. Jika tidak air kan menempati semua titik penyerapan sehingga tidak ada linarut yang melekat. Lapisan yang mengandung air itu akan diaktifkan dan dilakukan pemanasan pada suhu 1000C. Jika pemanasan jauh diatas 1000C, akan terjadi dehidrasi yang tak bolak balik pada penyerapan dan menyebabkan pemisahan yang kurang efektif.
Beberapa contoh penyerap yang digunakan untuk pemisahan-pemisahan dalam kromatografi Lapis Tipis adalah sebagai berikut :
Zat padat Digunakan untuk memisahkan
- Alumina
kieselguhr
- bubuk selulosa
- pati
- alkaloida, zat warna, fenol,steroid, vitaminn-vitamin, karoten, asam-asam amino
- gula, asam dan basa-basa, asam-asam lemak, steroid, asam-asam-asam-asam amino - asam-asam amino, alkaloida, nukleotida
- asam-asam amino
2.5.2. Kromatografi Kolom
Kromatografi kolom dapat berupa pipa gelas yang dilengkapi dengan kran dan gelas penyaring didalamnya. Meskipun kolom-kolom dapat dibuat secara sederhana dari tabung gelas, kadang-kadang buretpun digunakan. Ukuran kolom tergantug pada banyaknya zat yang akan dipisahkan. Untuk menahan penyerap yang diletakkan didalam kolom dapat digunakan gelas wool atau kapas (Gritter,1992).
Pada kromatografi kolom, campuran yang akan dipisahkan diletakkan berupa pita bagian atas kolom penyerap yang berada dalam tabung kaca. Kolom kromatografi atau tabung untuk pengaliran karena gaya tarik bumi atau sistem bertekanan rendah.
Pemilihan pertama dari pelarut untuk kromatografi kolom ialah bagaimana sifat kelarutannya. Tetapi lebih baik untuk memilih suatu pelarut yang bergantung pada kekuatan elusinya sehingga zat-zat elusi yang lebih kuat dapat dicoba. Yang dimaksud dengan kekuatan elusi ialah daya penyerapan pada penyerap dalam kolom. Biasanya pada penyerap-penyerap yang polar seperti alumina dan silika gel, maka kekuatan penyerap baik dengan naiknya polaritas zat yang diserap. Menurut TRAPPE, kekuatan elusi dari deret-deret pelarut untuk senyawa-senyawa elusi dalam kolom dengan menggunakan silika gel akan diturunkan dalam urutan sebagai berikut:
2.6. Teknik Spektroskopi
Teknik spektroskopi adalah salah satu teknik analisa kimia-fisika yang mengamati tentang interaksi atom atau molekul dengan radiasi elektromagnetik. Ada dua macam instrumen pada tehnik spektroskopi yaitu spektrometer dan spektrofotometer. Instrumen yang memakai monokromator celah tetap pada bidang fokus disebut sebagai spektrometer. Apabila spektrometer tersebut dilengkapi dengan detektor yang bersifat fotoelektrik maka disebut spektrofotometer (Muldja,1995).
Informasi Spektroskopi Inframerah menunjukkan tipe-tipe dari adanya gugus fungsi dalam satu molekul. Resonansi Magnet Inti yang memberikan informasi tentang bilangan dari setiap tipe dari atom hidrogen. Ini juga memberikan informasi yang menyatakan tentang alam serta lingkungan dari setiap tipe dari atom hidrogen. Kombinasinya dan data yang kadang-kadang menentukan struktur yang lengkap dari molekul yang tidak diketahui (Pavia,1979).
2.6.1. Spektrofotometer Infra Merah (FT-IR)
Spektrum infra merah suatu senyawa memberikan gambaran mengenai berbagai gugus fungsional dalam sebuah molekul organik, tetapi hanya memberikan petunjuk mengenai bagian hidrokarbon molekul.
Sinar Infra Merah ialah bagian spektrum elektromagnet yang berada diantara daerah tampak dan daerah makro. Bagi kimiawan organik, sebagian besar kegunaanya terbatas pada frekwensi antara 4000 dan 666 cm-1. Daerah radiasi spektroskopi infra merah atau infra red spektroscopy (IR) berkisar pada bilangan gelombang 12800-10 cm-1 atau pada panjang gelombang 0,78-1000 m.
Umumnya daerah radiasi IR terbagi dalam daerah :
- IR dekat (12800-4000 cm-1; 3,8-1,2 x 1014 Hz; 0,78-2,5 m) - IR tengah (4000-200 cm-1; 0,0121-6 x 104 Hz; 2,5-50 m) - IR jauh (200-10 cm -1; 3 x 1011 Hz; 50-1000 m)
tunggal selalu disertai dengan sejumlah perubahan energi putaran. Pita energi putaran yang penting terletak antara 4000-600 cm-1.
Untuk menganalisa suatu senyawa yang belum diketahui, perhatian harus dipusatkan pada penentuan ada atau tidaknya beberapa gugus fungsional utama seperti C=O, C-H, C-O, C=C dan NO2.
Beberapa syarat yang harus dipenuhi dalam menafsirkan sebuah spektrum infra merah :
a. Spektrum haruslah cukup terpisah dan mempunyai kuat puncak yang memadai
b. Spektrum harus dibuat dari senyawa yang cukup rumit
c. Spektrofotometer harus dikalibrasi sebagai pita akan teramati pada kerapatan atau panjang gelombang yang semestinya. Kalibrasi yang benar dapat dilakukan dengan baku-baku yang dapat dipercaya, misalnya polistiren.
d. Metode penanganan cuplikan (Silverstein,1984).
2.6.1.1. Vibrasi Regang N-H
Vibrasi regangan N – H juga dipengaruhi oleh ikatan hidrogen, tetapi pengaruhnya terhadap pergeseran frekuensi vibrasi lebih kecil. Pada amin tersier, tidak mungkin terjadi ikatan hidrogen. Pada amin primer puncak serapan berupa doublet yang disebabkan regang N – H tak simetris dan regang N – H simetris. Kedua doublet ini terpisah satu sama lain sebesar 100 cm-1 dan besarnya pemisahan ini tidak tergantung pada konsentrasi.
2.6.1.2. Kegunaan Spektroskopi Infra Merah ( FT-IR)
Ada dua kegunaan dari spektroskopi infra merah sebagai peralatan analitik, yaitu : a. Pengenalan gugus fungsi secara umum
Identifikasi senyawa melalui perbandingan spektrum dengan spektrum sampel asli.
Banyak senyawa yang bentuk spektrum infra merahnya unik, khususnya pada daerah 1350 – 750 cm-1, yang kadang-kadang disebut “daerah sidik jari (fingerprint region)” dan banyak laboratorium organik mempunyai katalog-katalog spektrum referensi.
Kesamaannya, gugus fungsi dalam isolasi atau dalam kombinasi memberikan serapan karakteristik dalam spektrum dari senyawa yang tidak diketahui dan sebagainya sehingga dapat dikenali, walaupun mungkin membedakannya, seperti aldehid dan keton atau antara amin atau amida, yang data referensinya diperoleh dari senyawa contoh. Bagaimanapun spektrum infra merah dari senyawa yang paling sederhana pun sangat kompleks.
2.6.2. Spektrometri Resonansi Magnetik Inti (1H-NMR)
Spektrometri Resonansi Magnetik Inti (Nuclear Magnetik Resonance-NMR) merupakan alat yang berguna pada penentuan struktur molekul organik. Tehnik ini memberikan informasi mengenai berbagai jenis atom hidrogen dalam molekul. Struktur NMR memberikan informasi mengenai lingkungan kimia atom hidrogen, jumlah atom hidrogen dalam setiap lingkungan dan struktur gugusan yang berdekatan dengan setiap atom hidrogen (Cresswell,1982).
Spektrum NMR suatu senyawa dapat dibuat secara langsung dari senyawa bentuk cairan murni. Namun apabila senyawa dalam bentuk padatan, maka spektrum ditentukan dalam bentuk larutan.
2.6.2.1. Efek Perisai (Shielding Effect)
Proton yang akan ditentukan dengan spektrometer RMI berada didalam lingkungan atom-atom yang lain. Momen magnet setiap inti didalam atom berbeda-beda besarnya. Sebagai contoh µH > µF > µP. Agar terjadi resonansi pada ketiga atom tersbut maka atom P memerlukan Ho yang lebih besar. Demikian juga pengaruh elektron yang mengelilingi inti akan menghasilkan medan magnet sekunder yang menentang Ho. Seolah-olah elektron yang mengelilingi inti akan bertindak seperti perisai yang melindungi medan magnet inti terhadap pengaruh Ho. Sebagai contoh CH4 yang keempat protonnya lebih terlindungi oleh awan elektron, sedangkan H -tidak mempunyai awan elektron.
Karena setiap proton didalam molekul zat organik beranekaragam, maka setiap proton didalam molekul zat organik memberikan tetapan perisai ( ) yang berbeda. Ada dua hal yang sangat berpengaruh terhadap tetapan perisai ( ) yang menunjukan kerapatan elektron terhadap proton yaitu adanya efek polar dan efek induksi.
2.6.2.2. Pegeseran Kimia
Spektroskopi NMR dalam kimia tidak didasarkan pada kemampuannya untuk membeda-bedakan unsur dalam suatu senyawa, tetapi didasarkan pada kemampuan untuk mengetahui inti tertentu dengan memperlihatkan lingkungannya dalam molekul. Frekuensi resonansi individu inti dipengaruhi oleh distribusi elektron pada ikatan kimia dalam molekul, dengan demikian harga frekuensi resonansi suatu inti tertentu tergantung pada struktur molekul.
Untuk memberikan gambaran NMR sebagai gambaran inti adalah proton, sebagai benzil asetat akan menghasilkan tiga sinyal NMR yang berbeda yaitu masing-masing untuk satu proton fenil, metilen dan gugus metil. Hal ini dihasilkan oleh pengaruh lingkungan kimia yang berbeda-beda pada suatu proton tersebut dalam molekul, keadaan ini dikenal dengan pergeseran kimia frekuensi resonansi atau lebih sederhana sebagai pergeseran kimia.
Tetrametilsilan (TMS) merupakan senyawa yang memenuhi persyaratan yang dimaksud. Sinyal TMS sengat jelas dan pergeseran kimianya berbeda terhadap kebanyakan resonansi proton lain. Sehingga sinyal resonansi cuplikan jarang teramati saling tindih dengan TMS. Senyawa TMS memiliki sifat inert, mudah menguap, merupakan pelarut yang baik untuk senyawa organik sehingga mudah dipisahkan setelah cuplikan selesai dibuat spektrum. Jadi skala resonansi magnetik proton didasarkan pada standart ini (TMS).
Resonansi Magnetik Inti memiliki kegunaan yang besar karena tidak setiap proton dalam molekul beresonansi pada frekuensi yang identik sama. Ini disebabkan oleh kenyataan bahwa berbagai proton dalam molekul dikelilingi elektron dan menunjukkan sedikit perbedaan lingkungan elektronik dari satu proton dengan proton lainnya. Proton-proton ini dilindungi oleh elektron-elektron yang mengelilinginya.
BAB III
ALAT, BAHAN, DAN PROSEDUR PERCOBAAN
3.3. Prosedur Penelitian 3.3.1. Penyediaan Sampel
Sampel yang diteliti adalah biji buah pala ( Myristica Fragrans Houtt ). Biji buah pala dibersihkan dari pengotor kemudian dihaluskan sampai diperoleh serbuk biji buah pala sebanyak 2000 gram.
3.3.2. Uji Pendahuluan
3.3.2.1. Uji Skrining fitokimia
Pengujian pendahuluan terhadap biji buah pala ( Myristica Fragrans Houtt ). Apakah mengandung suatu senyawa alkaloida dilakukan dengan uji skrining fitokimia yaitu serbuk biji buah pala ditimbang sebanyak 100 gram, dimaserasi dengan 200 ml etanol, disaring dan filtrate yang diperoleh dibagi menjadi 4 bagian, yaitu :
Filtrat I : Ditambahkan 2 tetes pereaksi Mayer ternyata terbentuk endapan warna putih kekuningan, hal ini menunjukkan adanya senyawa alkaloid.
Filtrat II : Ditambahkan 2 tetes pereaksi Dragendorf ternyata terbentuk endapan warna jingga, hal ini menunjukkan adanya senyawa alkaloida.
Filtrat III : Ditambahkan 2 tetes pereaksi Wagner ternyata terbentuk endapan warna coklat, hal ini menunjukkan adanya senyawa alkaloida.
Filtrat IV : Ditambahkan 2 tetes pereaksi Bouchardat ternyata terbentuk endapan warna coklat, hal ini menunjukkan adanya senyawa alkaloida.
3.3.2.2. Uji Pendahuluan Kromatografi Lapis Tipis ( KLT )
Kloroform : Etil Asetat dengan perbandingan ( 9:1 v/v, 8:2 v/v, 7:3 v/v, 6:4v/v ), Kemudian diamati dibawah lampu UV.
Prosedur :
Kedalam bejana kromatografi dimasukkan 10 ml larutan fasa gerak Kloroform 100%. Ekstrak pekat etanol biji buah pala ditotolkan pada plat KLT. Plat dimasukkan kedalam bejana yang berisi pelarut-pelarut yang telah dijenuhkan, kemudian ditutup rapat dan dielusi. Plat yang telah dielusi dikeluarkan dari bejana dan dikeringkan. Warna bercak yang timbul diamati dibawah lampu UV dan harga Rf-nya dihitung. Perlakuan yang sama dilakukan terhadap ampuran Kloroform-Etil Asetat dengan perbandingan ( 9:1 v/v, 8:2 v/v, 7:3 v/v, 6:4v/v ). Kemudian diamati dibawah lampu UV dan hasil yang lebih baik diberikan pada fase gerak Kloroform:Etil Asetat (7:3 v/v).
3.3.3. Prosedur Untuk Memperoleh Senyawa Kimia Ekstrak Biji Buah Pala Isolasi senyawa alkaloida yang terkandung pada biji buah pala ( Myristica
fragrans Houtt) dilakukan dengan tehnik maserasi dengan pelarut etanol. Ekstrak
etanol yang dihasilkan dipekatkan dengan rotary evaporator lalu diekstraksi partisi dengan n-heksana kemudian diasamkan dengan asam asetat glasial sampai pH 4. Dibasakan dengan amoniak pekat sampai pH 10-12. kemudian diekstraksi partisi dengan kloroform. Lapisan kloroform dipekatkan dengan rotary evaporator.
Ekstrak kloroform pekat mengandung alkaloida yang dihasilkan dianalisa dengan kromatografi lapis tipis kemudian dipisahkan dengan kromatografi kolom dengan silika gel 60 G. dielusi dengan Kloroform : Etil Asetat (70:30 v/v) yang menghasilkan kristal berwarna kuning sebanyak 73 mg.
3.3.4. Pemisahan Senyawa Alkaloida Dengan Menggunakan Komatografi Kolom
Terhadap 73 mg ekstrak alkaloid kasar dilakukan isolasi senyawa alkaloida dengan kromatografi kolom. Fasa diamnya silika gel 60 G (E.Merk Art. 7734) dan fasa geraknya adalah Kloroform : Etil Asetat (70:30 v/v ).
Prosedur :
dan dimasukkan kedalam kromatografi kolom, lalu dielusi dengan Kloroform 100% hingga bubur silika gel padat dan homogen. Ekstrak alkaloid kasar biji buah pala sebanyak 73 mg dibuburkan dengan silika gel sebanyak 10 gram dan dimasukkan kedalam kromatografi kolom yang telah berisi silika gel. Sampel dibiarkan turun dan terserap dengan baik pada silika gel dipuncak kolom. Kemudian fasa gerak Kloroform 100% ditambahkan secara berlahan-lahan. Eluan ditampung dengan botol vial lalu diuapkan. Selanjutnya fasa gerak dinaikkan kepolarannya dengan fasa gerak Kloroform : Etil Asetat (70:30 v/v). Hasil yang diperoleh, pelarutnya diuapkan sampai terbentuk Kristal alkaloida.
3.3.5. Pemurnian Kristal
Kristal yang diperoleh dari hasil 3.3.4. direkristalisasi sebagai berikut :
Kristal yang diperoleh dilarutkan dalam pelarut Kloroform dan dipanaskan sampai kristal tersebut larut dan pekat. Diamkan selama 1 malam. Dari hasil pendiaman 1 malam ini sebagian pelarut menguap dan terbentuk kristal jarum berwarna kuning.
3.3.6. Analisis Kristal Hasil Isolasi
3.3.6.1. Analisis Kromatografi Lapis Tipis (KLT)
Terhadap Kristal yang diperoleh dilakukan analisis secara kromatografi lapis tipis dengan menggunakan plat kromatografi lapis tipis dan fasa gerak yang digunakan adalah Kloroform 100% dan campuran Kloroform : Etil Asetat ( 70:30 v/v ).
Prosedur :
Kedalam bejana kromatografi dimasukkan 10 ml larutan fasa gerak Kloroform 100%. Kristal yang telah dilarutkan dengan etanol ditotolkan pada plat KLT. Plat dimasukkan kedalam bejana yang berisi pelarut-pelarut yang telah dijenuhkan, kemudian ditutup rapat dan dielusi. Plat yang telah dielusi dikeluarkan dari bejana dan dikeringkan. Warna bercak yang timbul diamati dibawah lampu UV dan harga Rf-nya dihitung.
Filtrat I : Ditambahkan 2 tetes pereaksi mayer ternyata terbentuk endapan warna putih kekuningan, hal ini menunjukkan adanya senyawa alkaloid.
Filtrat II : Ditambahkan 2 tetes pereaksi dragendorf ternyata terbentuk endapan warna jingga, hal ini menunjukkan adanya senyawa alkaloida.
Filtrat III : Ditambahkan 2 tetes pereaksi wagner ternyata terbentuk endapan warna coklat, hal ini menunjukkan adanya senyawa alkaloida.
Filtrat IV : Ditambahkan 2 tetes pereaksi bouchardat ternyata terbentuk endapan warna coklat, hal ini menunjukkan adanya senyawa alkaloida.
3.3.6.3. Penentuan Titik Lebur
Kristal hasil isolasi yang telah murni diletakkan diatas plat melting point apparatus, dihidupkan dan diatur temperaturnya. Lalu diamati temperature sampai Kristal melebur. Titik lebur Kristal yang diperoleh 80-82 oC.
3.3.6.4. Analisis Spektroskopi Kristal Hasil Isolasi
3.4. Bagan Penelitian
diasamkan dengan Asam Asetat glasial sampai pH 2
dibasakan dengan Amoniak pekat Sampai pH 10-12
digabung franksi dengan Rf yang sama
diskrining dihitung harga Rf diskrining 2 kg Serbuk kering biji buah pala
Ekstrak Kasar Etanol
Ekstrak pekat Etanol
Ekstrak Etanol-Asam pH 2
BAB IV
HASIL DAN PEMBAHASAN
4.1. Hasil
Hasil skrining fitokimia terhadap ekstrak etanol dari biji buah pala dengan menggunakan pereaksi-pereaksi alkaloida, menunjukkan bahwa dalam biji buah pala mengandung senyawa alkaloida.
Hasil analisa kromatografi Lapis Tipis dengan menggunakan silika gel 60 G sebagai absorben, dapat diketahui bahwa fasa gerak yang baik untuk mengisolasi senyawa
alkaloida dari biji buah pala adalah pada perbandingan Kloroform : Etil Asetat ( 70:30 v/v).
Hasil isolasi biji buah pala dengan pengasaman untuk menggaramkan senyawa alkaloid kemudian membasakannya untuk membebaskan kembali senyawa alkaloida yang kemudian dipisahkan dengan kloroform, diperoleh Kristal kuning berbentuk jarum sebanyak 73 mg dengan titik lebur 80 – 82 oC.
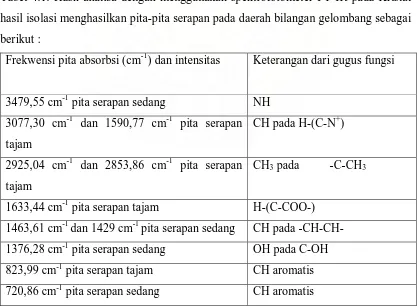
Tabel 4.1. Hasil analisa dengan menggunakan spektrofotometer FT-IR pada Kristal hasil isolasi menghasilkan pita-pita serapan pada daerah bilangan gelombang sebagai berikut :
Frekwensi pita absorbsi (cm-1) dan intensitas Keterangan dari gugus fungsi
3479,55 cm-1 pita serapan sedang NH
Hasil analisis spektroskopi resonansi magnetic inti proton (1H-NMR) senyawa hasil isolasi dengan menggunakan pelarut CDCl3 dan TMS sebagai standart memberikan signal-signal pergeseran kimia sebagai beikut :
Pergeseran kimia (1H-NMR) senyawa hasil isolasi ( ppm ) :
• 0,879 menunjukkan puncak singlet
• 1,264 menunjukkan puncak singlet
• 2,299 menunjukkan puncak singlet
• 3,803 – 3,834 menunjukkan puncak doublet
• 5,853 menunjukkan puncak singlet
• 5,123 – 5,135 menunjukkan puncak doublet
• 6,331 – 6,761 menunjukkan puncak multiplet
Spektrum magnetic inti proton komponen senyawa hasil isolasi dapat dilihat pada lampiran F.
4.2. Pembahasan
Isolasi pemisahan dan pemurnian kristal untuk senyawa-senyawa alkaloida sudah banyak dilakukan terhadap ekstrak tumbuh-tumbuhan. Dari hasil penelitian yang kami lakukan terhadap isolasi senyawa alkaloida dari biji buah pala dengan menggunakan metode J.B Harbone dengan menggunakan absorben silika gel 60 G dan dielusi dengan Kloroform : Etil Asetat (70:30 v/v ). Kemudian dipekatkan dan residu yang diperoleh direkristalisasi dengan kloroform murni sehingga kristal berbentuk jarum, mempunyai titik lebur 80-82oC.
Elusidasi struktur dengan data spektrofotometer infra merah pada daerah bilangan tertentu dan spesifik serta data spektrum magnetik inti proton (1H-NMR) dengan menggunakan pelarut CDCl3 dan standart TMS bahwa pergeseran-pergeseran kimia dari kristal yang spesifik adalah sebagai berikut :
1. Pada pergeseran kimia 0,879 ppm terdapat puncak singlet yang menunjukkan adanya gugus -CH dari gugus -CH-CH-. Ini didukung oleh data spektrum FT-IR pada bilangan gelombang 1463,61 cm-1 dan 1429,02 cm-1 yang menunjukkan karakteristik molekul CH.
FT-IR pada bilangan gelombanog 2853,86 cm-1 dan 2925,09 cm-1 yang menunjukkan karakteristik molekul CH3.
3. Pada pergeseran kimia 2,299 ppm terdapat puncak multiplet yang menunjukkan adanya gugus -CH dari gugus H-(C-COO-). Ini didukung oleh data spektrum FT-IR pada bilangan gelombang 1633,44 cm-1 yang menunjukkan karakteristik molekul CH.
4. Pada pergeseran kimia 3,803 – 3,834 ppm terdapat puncak doublet yang menunjukkan adanya gugus -CH yang terikat pada gugus H-(C-N+). Ini didukung oleh data spektrum FT-IR pada bilangan gelombang 1590,77 cm-1 dan 3077,30 cm-1 yang menunjukkan karakteristik molekul N+H.
5. Pada pergeseran kimia 5,853 ppm terdapat puncak singlet yang menunjukkan adanya gugus –OH dari gugus C-OH. Ini didukung oleh data spektrum FT-IR pada bilangan gelombang 1376,28 cm-1 yang menunjukkan karakteristik molekul OH.
6. Pada pergeseran kimia 5,123 – 5,135 ppm terdapat puncak doublet yang menunjukkan adanya gugus =CH dari gugus CH=CH. Ini didukung oleh data FT-IR pada bilangan gelombang 720,86 cm-1 dan 823,99 cm-1 yang menunjukkan karakteristik molekul CH
7. Pada pergeseran kimia 6,331 – 6,761 ppm terdapat puncak multiplet yang menunjukkan adanya gugus -CH yang terikat pada -NH-CH. Ini didukung oleh data spektrum FT-IR pada bilangan gelombang 3479,55 cm-1 yang menunjukkan karakteristik molekul NH.
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Hasil isolasi yang diperoleh dari 2000 gram biji buah pala (Myristica fragrans Houtt) adalah kristal berwarna kuning berbentuk jarum dengan titik lebur 80-82 oC sebanyak 73 mg yang merupakan senyawa alkaloida.
5.2. Saran
DAFTAR PUSTAKA
Alan, S. W., (1981), Organic Chemistry, New York : Harper & Row Publisher. Cresswell, C. J. dan Runguist dan Campbell., (1982), Analisis Spektrum Senyawa
Organik, Edisi kedua, Bandung, Penerbit ITB.Hal. 100-101
Dalimunthe Setiawan., (1999), Atlas Tumbuhan Obat Indonesia, Jilid I, Trubus Agriwidya, Jakarta.
Djauhariyah E., (2004), Tumbuhan Sebagai Obat, Seri Agrisehat, Penebar Swadaya, Jakarta.Hal 7-8
Gritter,, R. J., (1992), Pengantar Kromatografi, Terjemahan Kosasih Padmawinata, Edisi kedua, Itb, Bandung.Hal.110
Harbone, J. B., (1987), Metode Fitokimia, Penuntun Cara Modern Menganalisa Tumbuhan, Terbitan kedua, Terjemahan Kosasih Padmawinata dan Iwang Soediro, Bandung: penerbit ITB.Hal.238-240
Hendrikson, J. N., (1965), The Molecular of Nature, W. A. Benjamin, Inc. New York.Hal.143-177
Ir. Hatta Sunanta, BSC. MS., Budidaya Pala, Cetakan Pertama, Penerbit Konisius, Yogyakarta.
James B. Hendrikson., (1965), The Molecules Of Nature, W. A. Benjamin Inc. New York. Hal. 37-129
Manito, P., (1992), Biosintesis Produk Alami, Semarang ; Cetakan Pertama-IKIP. Muldja, M. H., (1955), Analisis Instrumental, Surabaya : Airlangga Universitas
Press.Hal.223-228
Noerdin., (1999), Elusidasi Struktur Senyawa Organik, Bandung : Penerbit Angkasa.Hal.111-112
Pavia, L. D., (1979), Introduction to Spektroscopy A Guide for Students of Organic Chemistry, Philladelphia, Sounder College.
Sanusi Ibrahim., (2000), Workshop Pengembangan SDM Kimia Organik Bahan Alam Hayati, Padang.
Sastrohamidjojo, H., (1985), Kromatografi, Yogyakarta : Penerbit Liberty. Hal.15-30
Silverstein, R. M., (1984), Penyidikan Spektrometri Senyawa Organik, Terjemahan A. J. Hartomo dan Amny Victor Purba, Edisi keempat, Penerbit Erlangga, Jakarta.Hal.94-96
Tobing, L. Rangke. MSc., (1989), Kimia Bahan Alam, Departemen Pendidikan dan kebudayaan, Direktorat Jendral Pendidikan Tinggi, Proyek Pembangunan Lembaga Pendidikan Tenaga Kependidikan, Jakarta.
LAMPIRAN B. Hasil Kromatografi Lapis Tipis Ekstrak Etanol Biji Buah Pala
No Fase Gerak Jumlah Noda Warna Noda Rf
1 Kloroform 100 % 1 Biru 0,95
2 Kloroform : Ethyl asetat (90:10 v/v)
1 Biru 0,70
3 Kloroform : Ethyl asetat (80:20 v/v)
1 Biru 0,74
4 Kloroform : Ethyl asetat (70:30 v/v)
1 Biru 0,88
5 Kloroform : Ethyl asetat (60:40 v/v)
LAMPIRAN C. Hasil Kromatografi Lapis Tipis Hasil Isolasi
No Fase Gerak Jumlah Noda Warna Noda Rf
1 Kloroform : Ethyl asetat (70:30 v/v)
LAMPIRAN D. Kromatografi Lapis Tipis Ekstrak Etanol dan Hasil Isolasi Biji Buah Pala
1 2 3 4 5 6
E E E E E H
Keterangan :
E : Ekstrak Etanol Biji Buah Pala dengan fasa diam silika gel 60 G H : Hasil Isolasi Ekstrak Etanol dengan fasa diam silika gel 60 G 1 : Hasil KLT Ektsrak Etanol dengan fasa gerak Kloroform 100%
LAMPIRAN E
S
LAMPIRAN F
LAMPIRAN G