Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010. PERBANDINGAN MUTU TABLET METRONIDAZOL GENERIK
DENGAN MEREK DAGANG SECARA IN VITRO
SKRIPSI
Oleh : WINDA 050804074
PROGRAM REGULER SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010. PERBANDINGAN MUTU TABLET METRONIDAZOL GENERIK
DENGAN MEREK DAGANG SECARA IN VITRO
SKRIPSI
Diajukan untuk Melengkapi Salah Satu Syarat untuk Mencapai Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH : WINDA 050804074
PROGRAM REGULER FAKULTAS FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010. Pengesahan Skripsi
PERBANDINGAN MUTU TABLET METRONIDAZOL GENERIK DENGAN MEREK DAGANG SECARA IN VITRO
Oleh:
WINDA 050804074
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal : Juli 2009
Disetujui Oleh:
Pembimbing I, Panitia Penguji,
Dra. Fat Aminah, M.Sc., Apt. Dra. Juanita Tanuwijaya, Apt. NIP 130 809 706 NIP 130 672 239
Pembimbing II, Dra. Fat Aminah, M.Sc., Apt.
NIP 130 809 706
Drs. Suryanto, M.Si., Apt. Dra. Sudarmi, M.Si., Apt. NIP 131 945 348 NIP 131 283 719
Drs. Agusmal Dalimunthe, M.S., Apt. NIP 131 286 002
Dekan,
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010. KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Tuhan YME yang telah
memberikan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan
skripsi ini yang berjudul “Perbandingan Mutu Tablet Metronidazol Generik
dengan Merek Dagang Secara In Vitro”. Skripsi ini diajukan sebagai salah satu
syarat dalam memperoleh gelar sarjana farmasi pada Fakultas Farmasi Universitas
Sumatera Utara.
Pemakaian tablet semakin populer dimana sediaannya banyak diproduksi
dan merupakan salah satu sediaan yang banyak mengalami perkembangan baik
formulasinya maupun cara pemakaiannya. Tujuan penelitian ini adalah untuk
membandingkan mutu dari tablet Metronidazol generik dan merek dagang secara
in vitro. Hendaknya hasil penelitian ini dapat digunakan sebagai informasi kepada
masyarakat tentang mutu tablet Metronidazol generik dan merek dagang.
Terima kasih yang tak terhingga dan penghargaan yang setinggi-tingginya
penulis sampaikan kepada Ayah dan Ibu tercinta, kakak-kakak serta adik atas
segala perhatian, doa, kasih sayang, dan dukungan moril serta materil yang telah
diberikan kepada penulis.
Terima kasih penulis sampaikan kepada Ibu Dra. Fat Aminah, M.Sc., Apt.
dan Bapak Drs. Suryanto, M.Si., Apt. atas waktu dan kesabarannya membimbing
penulis selama penelitian hingga penulisan skripsi ini.
Penulis juga menyampaikan terima kasih kepada Bapak Dekan Fakultas
Farmasi Prof. Dr. Sumadio Hadisahputra, Apt., Bapak/Ibu staf pengajar Fakultas
Farmasi USU yang telah mendidik penulis selama perkuliahan serta penasehat
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010.
memberikan bimbingan kepada penulis selama ini. Selanjutnya ucapan terima
kasih penulis sampaikan kepada Bapak Drs. Agusmal Dalimunthe, M.S., Apt.,
selaku Kepala Laboratorium Teknologi Formulasi Sediaan Padat.
Penulis juga menyampaikan terima kasih kepada Ibu Dra. Juanita
Tanuwijaya, Apt., Ibu Dra. Fat Aminah, M.Sc., Apt., Ibu Dra. Sudarmi, M.Si.,
Apt., dan Bapak Drs. Agusmal Dalimunthe, M.S., Apt., selaku dosen penguji yang
telah memberikan bimbingan dan masukan kepada penulis.
Terakhir penulis mengucapkan terima kasih kepada rekan-rekan yang
membantu penulis secara langsung dalam penelitian ini Kak Butet, Kak Reni,
Kistia, Silvia, Maria, Finnie, Juliana, Johan, Victor, dan teman-teman penulis
Stambuk 2005, serta seluruh rekan yang tidak dapat disebutkan satu-persatu.
Tidak lupa juga kepada pegawai Fakultas Farmasi Universitas Sumatera Utara
yang telah banyak membantu penulis selama ini.
Akhirnya penulis berharap semoga skripsi ini berguna bagi ilmu
pengetahuan pada umumnya dan bagi ilmu farmasi khususnya. Penulis juga
menyadari penulisan ini masih jauh dari sempurna oleh karena keterbatasan
kemampuan penulis. Atas kekurangan dan kelemahan ini penulis mohon maaf.
Medan, Juli 2009
Penulis,
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010. PERBANDINGAN MUTU TABLET METRONIDAZOL GENERIK
DENGAN MEREK DAGANG SECARA IN VITRO
ABSTRAK
Tablet merupakan salah satu sediaan Farmasi yang dapat dibuat dengan
bentuk yang bermacam-macam, sesuai dengan keinginan produsen. Dewasa ini
pemakaian tablet semakin populer dimana sediaannya banyak diproduksi dan
merupakan salah satu sediaan yang banyak mengalami perkembangan baik
formulasinya maupun cara pemakaiannya. Tujuan penelitian ini adalah untuk
membandingkan mutu dari tablet Metronidazol generik dan merek dagang secara
in vitro.
Teknik pengambilan sampel dilakukan dengan secara purposif dengan cara
mengambil sampel dari salah satu apotik yang ada di Jalan Gatot Subroto Medan.
Parameter-parameter pengujian mutu tablet yang dilakukan yaitu kekerasan,
friabilitas, waktu hancur, kadar zat aktif, keragaman bobot dan disolusi. Pengujian
kekerasan dan friabilitas merujuk pada persyaratan mutu farmasi industri. Pada uji
penetapan kadar zat aktif, keragaman bobot dan disolusi digunakan larutan HCl
0,1 N sebagai media dan serapannya diukur dengan menggunakan
spektrofotometer ultraviolet dengan panjang gelombang 277 nm dan pengujian
waktu hancur yang merujuk pada Farmakope Indonesia Edisi IV.
Hasil penelitian menunjukkan bahwa tablet Metronidazol generik dan
merek dagang memenuhi persyaratan farmasi industri kecuali uji kekerasan pada
tablet Metronidazol generik PT. Kimia Farma, tablet salut selaput Velazol®, tablet
salut selaput Trichodazol® dan kaplet salut selaput Metrolet® dan uji friabilitas
pada kaplet Grafazol® dan sebaliknya pengujian parameter menurut Farmakope
Indonesia Edisi IV yaitu waktu hancur, kadar zat aktif, keragaman bobot dan
disolusi memenuhi persyaratan untuk semua tablet Metronidazol generik dan
merek dagang.
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010. QUALITY COMPARISON OF GENERIC AND BRANDED
METRONIDAZOLE TABLETS AS IN VITRO
ABSTRACT
Tablet is one of the forms in pharmacy that can be made into various
forms, depends on the drug company. These days the usage of tablet becomes
popular where many companies produce tablets and tablet is one of the forms that
has developed well in the formulation and the usage. The purpose to this research
is to compare the quality of generic Metronidazole and branded Metronidazole
tablets by using in vitro test.
The technique of getting the samples is done purposively by getting the
samples from one of the drugstores at Gatot Subroto Street in Medan. The
parameters to test the quality are hardness, friability analysis, disintegration time,
determining the Metronidazole value, uniformity preparations and dissolution test.
Hardness and friability tests are made in reference to the requirements of
industrial pharmacy. In the determining the Metronidazole value, uniformity
preparations and dissolution test were used HCl 0.1 N as the medium and the
absorption was measured by using ultraviolet spectrophotometer at wave length of
277 nm and the disintegration time test are made in reference to the Indonesian
Pharmacopoeia the fourth editions.
The result of the study showed that generic and branded Metronidazole
tablets have fulfilled the requirements of pharmacy industry except the hardness
test of generic Metronidazole tablets PT. Kimia Farma, Velazol® film-coated
tablets, Trichodazol® film-coated tablets and Metrolet® film-coated caplets and
friability analysis of Grafazol® caplets. But for the parameters from Indonesian
Pharmacopoeia the fourth editions which are disintegration time, determining the
Metronidazole value, uniformity preparations and dissolution test have fulfilled
the requirements for all generic and branded Metronidazole tablets.
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010. DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Metronidazol ... 5
2.1.1 Tinjauan Umum Tentang Metronidazol ... 5
2.1.2 Farmakologi ... 5
2.1.3 Efek Samping, Indikasi dan Sediaan ... 6
2.2 Uraian Tablet ... 7
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010.
2.2.2 Evaluasi Tablet ... 7
2.2.2.1 Kadar Zat Berkhasiat ... 7
2.2.2.2 Keseragaman Sediaan ... 7
2.2.2.3 Waktu Hancur ... 8
2.2.2.4 Kekerasan ... 9
2.2.2.5 Friabilitas (Kerapuhan) ... 9
2.2.2.6 Disolusi ... 10
2.3 Pembagian Tablet ... 11
2.4 Obat Generik dan Obat Merek Dagang ... 12
2.5 Spektrofotometri Ultraviolet ... 13
2.6 Hukum Lambert-Beer ... 14
BAB III METODOLOGI PENELITIAN ... 16
3.1 Lokasi dan Waktu Penelitian ... 16
3.2 Alat-alat ... 16
3.3 Bahan-bahan ... 16
3.4 Metode Penelitian ... 17
3.4.1 Teknik Pengambilan Sampel ... 17
3.4.2 Pembuatan Pereaksi ... 17
3.4.2.1 Asam Klorida 0,1 N ... 17
3.4.2.2 Cairan Lambung Buatan ... 17
3.5 Penentuan Kurva Serapan dan Linieritas Kurva Kalibrasi Metronidazol dalam Larutan HCl 0,1 N ... 17
3.5.1 Pembuatan Larutan Induk Baku I ... 17
3.5.2 Pembuatan Larutan Induk Baku II ... 18
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010.
3.5.4 Penentuan Linieritas Kurva Kalibrasi Metronidazol
dalam Larutan HCl 0,1 N ... 18
3.6 Evaluasi Tablet ... 18
3.6.1 Penetapan Kadar Metronidazol dalam Tablet ... 18
3.6.2 Uji Keseragaman Sediaan ... 19
3.6.3 Uji Kekerasan Tablet ... 20
3.6.4 Uji Friabilitas ... 20
3.6.5 Uji Waktu Hancur ... 21
3.6.5.1 Tablet Tidak Bersalut ... 21
3.6.5.2 Tablet Bersalut Bukan Enterik ... 21
3.6.6 Uji Disolusi Tablet ... 22
3.7 Analisis Data Secara Statistik ... 23
BAB IV HASIL DAN PEMBAHASAN ... 25
4.1 Hasil Penentuan Kurva Serapan dan Linieritas Kurva Kalibrasi Metronidazol BPFI dalam Larutan HCl 0,1 N ... 25
4.2 Hasil Evaluasi Tablet Metronidazol Generik dan Merek Dagang ... 27
4.2.1 Hasil Penetapan Kadar ... 27
4.2.2 Hasil Uji Keragaman Bobot ... 29
4.2.3 Hasil Uji Kekerasan Tablet ... 30
4.2.4 Hasil Uji Friabilitas ... 31
4.2.5 Hasil Uji Waktu Hancur ... 33
4.2.6 Hasil Uji Evaluasi Kekerasan, Friabilitas, Waktu Hancur dan Waktu Disolusi (Q+5%) ... 34
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010.
BAB V KESIMPULAN DAN SARAN ... 40
5.1 Kesimpulan ... 40
5.2 Saran ... 40
DAFTAR PUSTAKA ... 41
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010. DAFTAR TABEL
Halaman
Tabel 1. Kriteria Penerimaan Zat Aktif yang Larut
dengan Disolusi ... 23
Tabel 2. Data Hasil Kadar Tablet Metronidazol Generik
dan Merek Dagang ... 28
Tabel 3. Hasil Uji Keragaman Bobot Tablet Metronidazol
Generik dan Merek Dagang ... 29
Tabel 4. Data Kekerasan Tablet Metronidazol Generik dan
Merek Dagang ... 31
Tabel 5. Data Friabilitas Tablet Metronidazol Generik dan
Merek Dagang ... 32
Tabel 6. Data Waktu Hancur Tablet Metronidazol Generik dan
Merek Dagang ... 33
Tabel 7. Data Uji Kekerasan, Friabilitas, Waktu Hancur dan Waktu
Disolusi (Q+5%) ... 34
Tabel 8. Data Uji Disolusi Tablet Metronidazol Generik dan
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010. DAFTAR GAMBAR
Halaman
Gambar 1. Kurva Serapan Metronidazol BPFI dengan Konsentrasi
12 mcg/ml dalam Larutan HCl 0,1 N ... 25
Gambar 2. Hasil Penentuan Serapan Metronidazol BPFI dengan
Konsentrasi 12 mcg/ml dalam Larutan HCl 0,1 N ... 26
Gambar 3. Kurva Kalibrasi Metronidazol BPFI dalam Larutan HCl 0,1 N
pada Panjang Gelombang 277 nm ... 27
Gambar 4. Grafik Persen Kumulatif Rata-Rata Dari Hasil Uji
Disolusi Tablet Metronidazol Generik dan Merek
Dagang dalam Medium HCl 0,1 N ... 38
Gambar 5. Hasil Penentuan Serapan Kurva Kalibrasi Metronidazol
BPFI pada Panjang Gelombang Maksimum 277 nm
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010. DAFTAR LAMPIRAN
Halaman
Lampiran 1. Sediaan Tablet yang Diperiksa ... 43
Lampiran 2. Hasil Penentuan Kurva Kalibrasi Metronidazol BPFI pada
Panjang Gelombang Serapan Maksimum 277 nm
dengan Larutan HCl 0,1 N Sebagai Blanko ... 44
Lampiran 3. Data Kurva Kalibrasi Metronidazol BPFI Secara
Spektrofotometri Ultraviolet dalam Larutan
HCl 0,1 N pada Panjang Gelombang 277 nm ... 45
Lampiran 4. Contoh Perhitungan Penetapan Kadar Tablet Metronidazol
Generik dan Merek Dagang ... 47
Lampiran 5. Hasil Penetapan Kadar Tablet Metronidazol Generik
dan Merek Dagang ... 49
Lampiran 6. Perhitungan Statistik Penetapan Kadar Metronidazol
pada Tablet Generik (PT. Kimia Farma) ... 51
Lampiran 7. Perhitungan Statistik Penetapan Kadar Metronidazol
pada Tablet Generik (PT. Phyto Kemo Agung) ... 53
Lampiran 8. Perhitungan Statistik Penetapan Kadar Metronidazol
pada Tablet Omenizol® (PT. Mutifa) ... 55
Lampiran 9. Perhitungan Statistik Penetapan Kadar Metronidazol
pada Tablet Fladex® Forte (PT. Dexa Medica) ... 57
Lampiran 10. Perhitungan Statistik Penetapan Kadar Metronidazol
pada Tablet Salut Selaput Velazol® (PT. Novell) ... 59
Lampiran 11. Perhitungan Statistik Penetapan Kadar Metronidazol
pada Tablet Salut Selaput Trichodazol®
(PT. Sanbe Farma) ... 61
Lampiran 12. Perhitungan Statistik Penetapan Kadar Metronidazol
pada Kaplet Grafazol® (PT. Graha Farma) ... 63
Lampiran 13. Perhitungan Statistik Penetapan Kadar Metronidazol
pada Kaplet Salut Selaput Metrolet® (PT. Graha Farma) ... 65
Lampiran 14. Hasil Uji Waktu Hancur Tablet Metronidazol Generik
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010. Lampiran 15. Contoh Perhitungan Persentase (%) Metronidazol yang
Terlarut dalam Medium Disolusi pada Interval Waktu
Tertentu ... 69
Lampiran 16. Rata-Rata Hasil Uji Disolusi Tablet Metronidazol Generik
dan Merek Dagang ... 70
Lampiran 17. Contoh Perhitungan Keragaman Bobot Tablet
Metronidazol Generik dan Merek Dagang ... 73
Lampiran 18. Hasil Uji Keragaman Bobot Tablet Metronidazol
Generik dan Merek Dagang ... 77
Lampiran 19. Hasil Uji Kekerasan Tablet Metronidazol Generik
dan Merek Dagang ... 79
Lampiran 20. Hasil Uji Friabilitas Tablet Metronidazol Generik
dan Merek Dagang ... 80
Lampiran 21. Sertifikat Baku Pembanding Metronidazol ... 82
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010. BAB I
PENDAHULUAN
1.1Latar Belakang
Obat sering dipandang sebagai produk yang mahal dan harganya terus
naik. Sesungguhnya produk obat tidak bisa dilepaskan dari aspek komersial yang
menginginkan laba. Produsen obat mengajukan alasan bahwa mahalnya harga
obat terkait dengan masalah tingginya biaya penelitian/penemuan dan promosi.
Ditambah lagi oleh keyakinan sebagian masyarakat bahwa obat yang baik adalah
obat yang mahal, membuat para dokter kadang terdorong meresepkan obat mahal
karena khawatir dianggap meresepkan obat-obat kurang bermutu. Keadaan ini
semakin mendorong produsen obat menaikkan harga produknya (Widodo, 2004).
Melihat masalah mahalnya harga obat, pemerintah membuat kebijakan
mengenai Obat Esensial Nasional, yaitu memberikan pemilihan obat yang
bermutu, aman dan relatif murah. Obat-obat terpilih tersebut kemudian disusun
dalam Daftar Obat Esensial Nasional (DOEN). Setiap unit kesehatan pemerintah
diperintahkan untuk menggunakan Obat Esensial Nasional, dengan
mengedepankan penggunaan obat generik (Widodo, 2004).
Obat dengan harga tinggi tidak selalu menunjukkan kualitas yang lebih
baik. Kenyataannya obat-obat dengan isi sama, antar merek obat bisa berbeda
harga hingga 3 kali lipat bahkan lebih. Produsen obat berlomba membuat iklan
yang memikat dan biaya iklan yang tinggi ini akan dibebankan kepada harga
produk obat tersebut. Salah satu cara mendapatkan obat yang bermutu relatif lebih
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010.
bermutu. Perbandingan harga antara obat generik dan obat paten/bermerek bisa
1:5 atau lebih (Widodo, 2004).
Berdasarkan Permenkes No. 085/MenKes/Per/I/1989, obat generik adalah
obat dengan nama resmi yang ditetapkan dalam Farmakope Indonesia untuk zat
berkhasiat yang dikandungnya (Ditjen POM., 1989).
Obat dengan merek dagang atau spesialité adalah obat milik suatu
perusahaan dengan nama khas yang dilindungi hukum, yaitu merek terdaftar atau
proprietary name. Banyaknya obat merek dagang dengan beraneka-ragam nama
yang setiap tahun dikeluarkan oleh farmasi industri dan kekacauan yang
diakibatkan telah mendorong WHO untuk menyusun Daftar Obat dengan
nama-nama resmi. Official atau generic name (nama-nama generik) ini dapat digunakan di
semua negara tanpa melanggar hak paten obat bersangkutan (Tan, 2002).
Metronidazol merupakan senyawa kemoterapi dengan spektrum luas,
selektif terhadap mikroorganisme anaerob, termasuk bakteri dan protozoa.
Metronidazol adalah obat pilihan terhadap amubiasis usus dan sistemik,
trikomoniasis dan giardiasis. Penyerapan obat dalam saluran cerna cepat dan
sempurna, kadar serum tinggi dicapai dalam 1-2 jam setelah pemberian secara
oral, dengan waktu paro plasma ± 8 jam (Siswandono, 1995).
Dalam menanggapi perbedaan harga dari obat-obat yang mempunyai zat
berkhasiat yang sama, perlu dilakukan suatu pembuktian ilmiah terhadap mutu
dari obat-obat dengan kandungan zat berkhasiat yang banyak digunakan di
masyarakat. Berdasarkan hal itu dan untuk meluruskan pemahaman masyarakat
tentang obat generik dan merek dagang, maka penulis tertarik untuk melakukan
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010.
melakukan pembuktian dari segi kekerasan dan friabilitas yang merujuk pada
persyaratan mutu farmasi industri serta waktu hancur, kadar zat aktif, keragaman
bobot, dan disolusi yang merujuk pada Farmakope Indonesia Edisi IV.
1.2Perumusan Masalah
1. Apakah tablet Metronidazol generik dengan merek dagang mempunyai mutu
yang sama secara in vitro dengan paramater waktu hancur, kadar zat aktif,
keragaman bobot dan disolusi sesuai dengan persyaratan yang tercantum
dalam Farmakope Indonesia Edisi IV?
2. Apakah tablet Metronidazol generik dengan merek dagang mempunyai mutu
yang sama secara in vitro dengan paramater kekerasan dan friabilitas sesuai
dengan persyaratan mutu farmasi industri?
1.3Hipotesis
1. Tablet Metronidazol generik dengan merek dagang mempunyai mutu yang
sama secara in vitro dengan paramater waktu hancur, kadar zat aktif,
keragaman bobot dan disolusi sesuai dengan persyaratan yang tercantum
dalam Farmakope Indonesia Edisi IV.
2. Tablet Metronidazol generik dengan merek dagang mempunyai mutu yang
sama secara in vitro dengan paramater kekerasan dan friabilitas sesuai dengan
persyaratan mutu farmasi industri.
1.4Tujuan Penelitian
1. Untuk membandingkan mutu tablet Metronidazol generik dengan merek
dagang secara in vitro dengan parameter waktu hancur, kadar zat aktif,
keragaman bobot dan disolusi sesuai dengan persyaratan yang tercantum
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010.
2. Untuk membandingkan mutu tablet Metronidazol generik dengan merek
dagang secara in vitro dengan parameter kekerasan dan friabilitas sesuai
dengan persyaratan mutu farmasi industri.
1.5Manfaat Penelitian
Hasil penelitian ini dapat digunakan sebagai informasi kepada masyarakat
bahwa masyarakat tidak perlu ragu untuk menggunakan obat generik sebagai
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010. BAB II
TINJAUAN PUSTAKA
2.1 Metronidazol
2.1.1 Tinjauan Umum Tentang Metronidazol
Rumus Bangun :
N
N CH2 -CH2 -OH
CH3 NO2
Nama Kimia : 2-Metil-5-nitroimidazol-1-etanol
Rumus Molekul : C6H9N3O3
Berat Molekul : 171,16
Metronidazol mengandung tidak kurang dari 99,0% dan tidak lebih dari 101,0%
C6H9N3O3, dihitung terhadap zat yang telah dikeringkan.
Pemerian : hablur atau serbuk hablur, putih hingga kuning pucat;
tidak berbau; stabil di udara, tetapi lebih gelap bila terpapar
oleh cahaya
Kelarutan : sukar larut dalam eter; agak sukar larut dalam air, dalam
metanol dan dalam kloroform
(Ditjen POM., 1995)
Pengukuran UV : Asam – 277 nm ( A11 = 377 a )
Basa – 319 nm ( A11 = 520 b ) (Moffat, 1986)
2.1.2 Farmakologi
Metronidazol ialah 2-Metil-5-nitroimidazol-1-etanol yang berbentuk
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010.
trikomoniasid, metronidazol juga berefek amubisid dan efektif terhadap Giardia
lamblia (Sjarif, 1995).
Absorpsi metronidazol berlangsung dengan baik sesudah pemberian oral.
Satu jam setelah pemberian dosis tunggal 500 mg per oral diperoleh kadar plasma
kira-kira 10 g/ml. Umumnya untuk kebanyakan protozoa dan bakteri sensitif,
rata-rata diperlukan kadar tidak lebih dari 8 g/ml. Waktu paruhnya berkisar
antara 8-10 jam (Sjarif, 1995).
Metronidazol terutama digunakan untuk amubiasis, trikomoniasis dan
infeksi bakteri anaerob. Metronidazol efektif untuk amubiasis intestinal maupun
ekstraintestinal. Namun efeknya lebih jelas pada jaringan, sebab sebagian besar
metronidazol mengalami penyerapan di usus halus (Sjarif, 1995).
2.1.3 Efek Samping, Indikasi dan Sediaan
Efek sampingnya ringan dan berupa gangguan saluran cerna, mulut kering
dan rasa logam, pusing atau sakit kepala, rash kulit, dan sewaktu-waktu
leukopenia. Air kemih dapat menjadi coklat kemerah-merahan disebabkan oleh
zat warna yang terbentuk (Tan, 2002).
Obat yang digunakan untuk membunuh/membasmi amuba yaitu Entamuba
histolytica, suatu protozoa (organisme bersel tunggal). Amuba menimbulkan
penyakit dysentri, ialah infeksi usus yang mengakibatkan radang usus dengan
ciri-ciri mulas dan buang air berlendir dan berdarah (Anief, 1996).
Metronidazol tersedia dalam bentuk tablet 250 mg dan 500 mg dan tablet
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010. 2.2 Uraian Tablet
2.2.1 Pengertian Tablet
Tablet adalah sediaan padat kompak, dibuat secara kempa cetak, dalam
bentuk tabung pipih atau sirkuler, kedua permukaannya rata atau cembung,
mengandung satu jenis obat atau lebih dengan atau tanpa zat tambahan. Zat
tambahan yang digunakan dapat berfungsi sebagai zat pengisi, zat pengembang,
zat pengikat, zat pelicin, zat pembasah atau zat lain yang cocok (Ditjen POM.,
1979).
Tablet merupakan bahan obat dalam bentuk sediaan padat yang biasanya
dibuat dengan penambahan bahan tambahan farmasetika yang sesuai.
Tablet-tablet dapat berbeda-beda dalam ukuran, bentuk, berat, kekerasan, ketebalan, daya
hancurnya, dan dalam aspek lainnya tergantung pada cara pemakaian tabet dan
metode pembuatannya. Kebanyakan tablet digunakan pada pemberian obat-obat
secara oral dan kebanyakan dari tablet ini dibuat dengan penambahan zat warna
atau zat pemberi rasa (Ansel, 1989).
2.2.2 Evaluasi Tablet
2.2.2.1 Kadar Zat Berkhasiat
Tablet Metronidazol mengandung Metronidazol, C6H9N3O3, tidak kurang
dari 90,0% dan tidak lebih dari 110,0% dari jumlah yang tertera pada etiket
(Ditjen POM., 1995).
2.2.2.2 Keseragaman Sediaan
Keseragaman sediaan dapat ditetapkan dengan dua metode yaitu:
− Keragaman bobot dilakukan terhadap tablet yang mengandung zat aktif 50
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010.
− Keseragaman kandungan dilakukan terhadap tablet yang mengandung zat
aktif kurang dari 50 mg atau kurang dari 50% dari bobot satuan sediaan
(Ditjen POM., 1995).
Faktor-faktor yang dapat menimbulkan masalah keseragaman isi tablet
yaitu tidak seragamnya distribusi bahan obat pada pencampuran bubuk atau
granulasi, pemisahan dari campuran bubuk atau selama berbagai proses
pembuatan, dan penyimpangan berat tablet (Lachman, dkk., 1994).
2.2.2.3 Waktu Hancur
Waktu hancur adalah waktu yang diperlukan tablet untuk hancur di bawah
kondisi yang ditetapkan dan lewatnya seluruh partikel melalui saringan berukuran
mesh-10. Uji ini tidak memberi jaminan bahwa partikel-partikel itu akan melepas
bahan obat dalam larutan dengan kecepatan yang seharusnya (Lachman, dkk.,
1994).
Faktor-faktor yang mempengaruhi waktu hancur dari tablet adalah sifat
kimia dan fisis dari granulat, kekerasan dan porositasnya. Tablet biasanya
diformulasi dengan bahan pengembang atau bahan penghancur yang
menyebabkan tablet hancur di dalam air atau cairan lambung. Hancurnya tablet
tidak berarti sempurna larutnya bahan obat dalam tablet. Kebanyakan bahan
pelicin bersifat hidrofob, bahan pelicin yang berlebihan akan memperlambat
waktu hancur. Tablet dengan rongga-rongga yang besar akan mudah dimasuki air
sehingga hancur lebih cepat dari pada tablet yang keras dengan rongga-rongga
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010. 2.2.2.4 Kekerasan
Kekerasan diartikan sebagai kekuatan untuk menghancurkan tablet.
Kekerasan tablet ditentukan oleh besarnya tenaga yang diperlukan untuk
memecah tablet. Tablet harus mempunyai kekuatan atau kekerasan tertentu agar
dapat bertahan terhadap berbagai guncangan mekanik pada saat pembuatan,
pengepakan dan pengangkutan. Selain itu tablet juga harus dapat bertahan
terhadap perlakuan berlebihan oleh konsumen (Lachman, dkk., 1994).
Ketahanan dari tablet terhadap goncangan pada waktu pengangkutan,
pengemasan dan peredaran bergantung pada kekerasan tablet. Kekerasan
dinyatakan dalam satuan kg dari tenaga yang dibutuhkan untuk memecahkan
tablet. Kekerasan yang umum untuk tablet adalah 4 – 8 kg. Untuk tablet hisap dan
tablet sustained release kekerasannya 10 – 20 kg. Tablet kunyah mempunyai
kekerasan yang lebih kecil dari 3 kg. Walaupun kekerasan yang lebih tinggi
menghasilkan tablet yang bagus, tidak rapuh tetapi ini mengakibatkan
berkurangnya porositas dari tablet sehingga sukar dimasuki cairan yang
menyebabkan lamanya waktu hancur. Alat-alat yang dipergunakan untuk menguji
kekerasan tablet antara lain: Stokes Monsanto, Strong Cobb dan Pfizer (Soekemi,
dkk., 1987).
2.2.2.5 Friabilitas (Kerapuhan)
Kerapuhan ditandai sebagai massa seluruh partikel yang berjatuhan dari
tablet melalui beban pengujian mekanis. Kerapuhan diberikan dalam persen yang
ditarik dari massa tablet sebelum pengujian (Voight, 1994).
Kerapuhan dapat dipengaruhi oleh kandungan air dari granul dan produk
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010.
yang dapat diterima dapat berfungsi sebagai pengikat. Granul yang sangat kering
dan hanya mengandung sedikit sekali persentase kelembapan, sering
menghasilkan lebih banyak tablet renyah daripada granul yang kadar
kelembapannya 2 sampai 4%. Karena itulah sangat sukar membuat tablet yang
mengandung sejumlah zat yang dapat dihidrolisis tetap stabil secara kimia
(Lachman, dkk., 1994).
2.2.2.6 Disolusi
Disolusi adalah proses melarutnya obat (Ansel, 1989). Dua sasaran dalam
mengembangkan uji disolusi in vitro yaitu untuk menunjukkan pelepasan obat
dari tablet kalau dapat mendekati 100% dan laju pelepasan obat seragam pada
setiap batch dan harus sama dengan laju pelepasan dari batch yang telah
dibuktikan mempunyai bioavailabilitas dan efektif secara klinis (Lachman, dkk.,
1994).
Faktor-faktor yang mempengaruhi laju disolusi yaitu:
1. faktor yang berkaitan dengan sifat fisikokimia obat
Sifat-sifat fisikokimia dari obat yang mempengaruhi laju disolusi meliputi
kelarutan, bentuk kristal, bentuk hidrat solvasi dan kompleksasi serta
ukuran partikel.
2. faktor yang berkaitan dengan formulasi sediaan
Formulasi sediaan berkaitan dengan bentuk sediaan, bahan pembantu dan
cara pengolahan. Pengaruh bentuk sediaan pada laju disolusi tergantung
pada kecepatan pelepasan bahan aktif yang terkandung didalamnya.
Penggunaan bahan pembantu sebagai bahan pengisi, pengikat, penghancur
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010.
mempercepat laju disolusi tergantung pada bahan pembantu yang dipakai.
Cara pengolahan dari bahan baku, bahan pembantu dan prosedur yang
dilaksanakan dalam formulasi sediaan padat peroral juga akan
berpengaruh pada laju disolusi.
3. faktor yang berkaitan dengan alat uji disolusi dan parameter uji
Faktor ini sangat dipengaruhi oleh lingkungan selama percobaan yang
meliputi kecepatan pengadukan, suhu medium, pH medium dan metoda uji
yang dipakai (Syukri, 2002).
2.3 Pembagian Tablet
Berdasarkan pembuatannya tablet dibagi menjadi:
1. Tablet cetak (Compressed tablet)
Tablet ini dibuat dengan cara mengempa dan tidak mengandung penyalut
yang khusus. Tablet cetak dibuat dari bahan-bahan berupa serbuk atau
kristal dengan atau tanpa penambahan bahan pengisi, pengikat,
pengembang, pelicin dan bahan-bahan tambahan lainnya.
2. Tablet bersalut (Coated tablet)
a. Tablet bersalut gula (Sugar Coated tablet) yaitu tablet yang disalut
dengan lapisan yang terdiri dari gula dengan bahan-bahan yang sesuai
dengan atau tanpa pemberian warna.
b. Tablet bersalut selaput (Film coated tablet) yaitu tablet yang disalut
dengan lapisan tipis yang dibuat dari bahan sintetis atau
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010.
c. Tablet bersalut enterik (Enteric Coated tablet) yaitu tablet yang disalut
dengan bahan-bahan yang tahan terhadap cairan lambung tetapi hancur
dalam cairan usus.
3. Mutiple Compressed tablet yaitu tablet yang dicetak lebih dari sekali
dengan menggunakan mesin pencetak tablet khusus.
a. Layered tablet yaitu tablet yang dibuat dengan mencetak granul-granul
yang telah dicetak terlebih dahulu. Pencetakan dapat dilakukan
beberapa kali untuk mendapatkan tablet dengan 2 atau 3 lapisan.
b. Press Coated tablet (Dry Coated tablet) dibuat dengan mengisikan
tablet-tablet yang telah dicetak pada mesin pencetak tablet yang
khusus, kemudian dicetakkan granul-granul tambahan di sekeliling
tablet (Soekemi, dkk., 1987).
2.4 Obat Generik dan Obat Merek Dagang
Mahalnya harga obat di pasaran telah menyebabkan Pemerintah melalui
Menteri Kesehatan, mengeluarkan Peraturan Menteri Kesehatan No.
085/MenKes/Per/I/1989 tentang kewajiban menuliskan resep dan menggunakan
obat generik di fasilitas pelayanan kesehatan pemerintah (Ditjen POM., 1989).
Adapun pertimbangan yang digunakan untuk merumuskan peraturan
tersebut adalah sebagai berikut:
- Harga obat generik lebih rendah daripada harga obat paten yang mempunyai
terapetik yang sama
- Penulisan resep/penggunaan obat generik di fasilitas pelayanan kesehatan
akan mempermudah perluasan cakupan pelayanan kesehatan kepada
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010.
Surat Keputusan Menteri Kesehatan Republik Indonesia No.
193/Kab/B.VIII/71 memberikan definisi berikut untuk obat: ”Obat ialah suatu
bahan atau bahan-bahan yang dimaksudkan untuk digunakan dalam menetapkan
diagnosis, mencegah, mengurangi, menghilangkan, menyembuhkan penyakit atau
gejala penyakit, luka atau kelainan badaniah dan rohaniah pada manusia atau
hewan dan untuk memperelok atau memperindah badan atau bagian badan
manusia (Joenoes, 1995).
Obat dengan merek dagang atau spesialité adalah obat milik suatu
perusahaan dengan nama khas yang dilindungi hukum, yaitu merek terdaftar atau
proprietary name. Banyaknya obat merek dagang dengan beraneka-ragam nama
yang setiap tahun dikeluarkan oleh farmasi industri dan kekacauan yang
diakibatkan telah mendorong WHO untuk menyusun Daftar Obat dengan
nama-nama resmi. Official atau generic name (nama-nama generik) ini dapat digunakan di
semua negara tanpa melanggar hak paten obat bersangkutan (Tan, 2002).
Berdasarkan Permenkes No. 085/MenKes/Per/I/1989, obat generik adalah
obat dengan nama resmi yang ditetapkan dalam Farmakope Indonesia untuk zat
berkhasiat yang dikandungnya (Ditjen POM., 1989).
2.5 Spektrofotometri Ultraviolet
Spektrofotometri serapan merupakan pengukuran suatu interaksi antara
radiasi elektromagnetik dan molekul atau atom dari suatu zat kimia. Daerah
spektrum ultraviolet membentang dari 190 nm – 380 nm (Ditjen POM.,1995).
Radiasi elektromagnetik dapat dianggap sebagai energi yang merambat
dalam bentuk gelombang. Dalam aspek kuantitatif, suatu berkas radiasi dikenakan
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010.
besarnya. Radiasi yang diserap oleh cuplikan ditentukan dengan membandingkan
intensitas sinar yang diteruskan dengan intensitas sinar yang diserap. Serapan
dapat terjadi jika radiasi yang mengenai cuplikan memiliki energi yang sama
dengan energi yang dibutuhkan untuk menyebabkan terjadinya perubahan tenaga
(Gandjar, dkk., 2007).
2.6 Hukum Lambert-Beer
Hukum Lambert-Beer menyatakan bahwa intensitas yang diteruskan oleh
larutan zat penyerap berbanding lurus dengan tebal dan konsentrasi larutan.
Dalam hukum Lambert-Beer tersebut ada beberapa pembatasan yaitu:
1. Sinar yang digunakan dianggap monokromatis
2. Penyerapan terjadi dalam suatu volume yang mempunyai penampang luas
yang sama
3. Senyawa yang menyerap dalam larutan tersebut tidak tergantung terhadap
yang lain dalam larutan tersebut
4. Tidak terjadi peristiwa fluoresensi atau fosforisensi
5. Indeks bisa tidak tergantung pada konsentrasi larutan (Gandjar, dkk.,2007)
Jika absorbansi suatu seri konsentrasi larutan diukur pada panjang
gelombang, suhu, kondisi pelarut yang sama; dan absorbansi masing-masing
larutan diplotkan terhadap konsentrasinya maka suatu garis lurus akan teramati
sesuai dengan persamaan A = abc. Grafik ini disebut dengan plot hukum
Lambert-Beer dan jika garis yang dihasilkan merupakan suatu garis lurus maka dapat
dikatakan bahwa hukum Lambert-Beer dipenuhi pada kisaran konsentrasi yang
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010.
Hukum Lambert-Beer adalah:
A = abc
Dimana: A = absorban
a = absorptivitas
b = tebal kuvet (cm)
c = konsentrasi (Gandjar, dkk., 2007)
Absorptivitas (a) merupakan suatu konstanta yang tidak tergantung pada
konsentrasi, tebal kuvet, dan intensitas radiasi yang mengenai larutan sampel.
Absorptivitas tergantung pada suhu, pelarut, struktur molekul, dan panjang
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010. BAB III
METODOLOGI PENELITIAN
Penelitian ini menggunakan metode deskriptif yang bertujuan untuk
menggambarkan sifat dari suatu keadaan sampel dalam hal ini dilakukan
perbandingan mutu tablet Metronidazol generik dengan merek dagang secara in
vitro.
3.1 Lokasi dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Formulasi Sediaan Solid Fakultas
Farmasi Universitas Sumatera Utara pada bulan Maret 2009 – Mei 2009.
3.2 Alat
Alat – alat yang digunakan dalam penelitian ini adalah Disintegration
Tester (Erweka), Dissolution Tester (Erweka DT), Strong Cobb Hardness Tester
(Erweka), Roche Friabilator (Erweka), Spektrofotometer Ultraviolet (UV Mini
1240 Shimadzu), Stopwatch, Neraca listrik, alat-alat gelas dan alat laboratorium
lainnya.
3.3 Bahan
Bahan – bahan yang digunakan dalam penelitian ini adalah air suling,
Asam Klorida pekat (E. Merck), Metronidazol BPFI (Badan POM), Tablet
Metronidazol generik (PT. Kimia Farma), Tablet Metronidazol generik (PT. Phyto
Kemo Agung Farma), Tablet Omenizol® (PT. Mutifa), Tablet Fladex® Forte (PT.
Dexa Medica), Tablet salut selaput Velazol® (PT. Novell), Kaplet Grafazol® (PT.
Graha Farma), Tablet salut selaput Trichodazol® (PT. Sanbe Farma), dan Kaplet
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010. 3.4 Metode Penelitian
3.4.1 Teknik Pengambilan Sampel
Sampel yang digunakan adalah tablet Metronidazol generik, tablet
Metronidazol merek dagang, tablet salut selaput Metronidazol merek dagang,
kaplet Metronidazol merek dagang dan kaplet salut selaput Metronidazol merek
dagang dengan jumlah zat aktif 500 mg per tablet.
Teknik pengambilan sampel dilakukan dengan secara purposif dengan cara
mengambil sampel dari salah satu apotik yang ada di Jalan Gatot Subroto Medan.
3.4.2 Pembuatan Pereaksi
3.4.2.1 Asam Klorida 0,1 N
Encerkan 8,5 ml asam klorida P dengan air suling hingga 1000 ml (Ditjen
POM., 1995).
3.3.2.2 Cairan Lambung Buatan
Larutkan 2,0 g natrium klorida P dalam 7,0 ml asam klorida P dan air
secukupnya hingga 1000 ml. Larutan mempunyai pH lebih kurang 1,2 (Ditjen
POM., 1995).
3.5 Penentuan Kurva Serapan dan Linieritas Kurva Kalibrasi Metronidazol
dalam Larutan HCl 0,1 N
3.5.1 Pembuatan Larutan Induk Baku I
Ditimbang seksama 50 mg Metronidazol BPFI, dimasukkan ke dalam labu
tentukur 100 ml. Dilarutkan dengan HCl 0,1 N dan dicukupkan sampai garis
tanda, lalu dikocok homogen maka diperoleh larutan induk baku dengan
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010. 3.5.2 Pembuatan Larutan Induk Baku II
Dari LIB I dipipet sebanyak 10 ml lalu dimasukkan ke dalam labu tentukur
50 ml dan dicukupkan dengan HCl 0,1 N sampai garis tanda sehingga diperoleh
konsentrasi 100 mcg/ml.
3.5.3 Penentuan Kurva Serapan Metronidazol
Dari LIB II dipipet sebanyak 6 ml dan dimasukkan ke dalam labu tentukur
50 ml, dicukupkan dengan HCl 0,1 N sampai garis tanda. Dikocok homogen maka
akan diperoleh larutan konsentrasi 12 mcg/ml. Diukur serapannya pada panjang
gelombang 200-400 nm dan sebagai blanko digunakan HCl 0,1 N. Kurva serapan
Metronidazol dapat dilihat pada Gambar 1 halaman 25.
3.5.4 Penentuan Linieritas Kurva Kalibrasi Metronidazol dalam Larutan
HCl 0,1 N
Dari LIB II dipipet masing-masing 3 ml; 4,5 ml; 6 ml; 7,5 ml; dan 9 ml,
dimasukkan ke dalam labu tentukur 50 ml, kemudian dicukupkan volumenya
dengan HCl 0,1 N sampai garis tanda, sehingga diperoleh konsentrasi
Metronidazol masing-masing 6 mcg/ml; 9 mcg/ml; 12 mcg/ml; 15 mcg/ml; dan 18
mcg/ml. Diukur serapannya pada panjang gelombang maksimum dengan
menggunakan HCl 0,1 N sebagai blanko. Hasil penentuan kurva kalibrasi
Metronidazol dapat dilihat pada Lampiran 2 halaman 44.
3.6 Evaluasi Tablet
3.6.1 Penetapan Kadar Metronidazol dalam Tablet
Ditimbang seksama 20 tablet, dicatat beratnya, kemudian digerus sampai
homogen. Ditimbang sejumlah serbuk yang setara dengan 50 mg Metronidazol
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010.
kemudian dilarutkan dengan HCl 0,1 N dan dicukupkan sampai garis tanda,
dikocok homogen maka diperoleh larutan dengan konsentrasi 500 mcg/ml.
Disaring dan lebih kurang 25 ml filtrat pertama dibuang dan filtrat selanjutnya
ditampung. Dari larutan tersebut dipipet sebanyak 10 ml, dimasukkan ke dalam
labu tentukur 50 ml dan dicukupkan dengan HCl 0,1 N sampai garis tanda, maka
diperoleh larutan dengan konsentrasi 100 mcg/ml. Selanjutnya dipipet sebanyak 6
ml filtrat, dimasukkan ke dalam labu tentukur 50 ml dan dicukupkan dengan HCl
0,1 N sampai garis tanda, maka diperoleh larutan dengan konsentrasi 12 mcg/ml.
Kemudian diukur serapannya pada panjang gelombang 277 nm dengan
menggunakan HCl 0,1 N sebagai blanko.
Persyaratan: Tablet Metronidazol mengandung Metronidazol, C6H9N3O3, tidak
kurang dari 90,0% dan tidak lebih dari 110,0% dari jumlah yang tertera pada
etiket (Ditjen POM., 1995).
Data kadar tablet pada Lampiran 5 halaman 49 dan contoh perhitungan
pada Lampiran 4 halaman 47.
3.6.2 Uji Keseragaman Sediaan
Menurut Farmakope Indonesia edisi IV bahwa kadar zat aktif 50 mg atau
lebih besar dari 50 mg yang merupakan 50% atau lebih dari bobot satuan sediaan,
maka uji keseragaman sediaan dilakukan dengan cara keragaman bobot.
Penetapan keragaman bobot dilakukan dengan cara:
Ditimbang seksama 10 tablet, satu persatu dan dihitung bobot rata-rata. Kemudian
ditentukan kadarnya secara spektrofotometri ultraviolet. Dari hasil penetapan
kadar dihitung jumlah zat aktif dari masing-masing 10 tablet dengan anggapan zat
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010. Persyaratan: Keragaman bobot terletak antara 85,0% sampai 115,0% dari yang
tertera pada etiket dan simpangan baku relatif kurang atau sama dengan 6,0%
(Ditjen POM., 1995).
Perhitungan keragaman bobot dapat dilihat pada Lampiran 17 halaman 73
dan hasil uji keragaman bobot pada Lampiran 18 halaman 77.
3.6.3 Uji Kekerasan Tablet
Alat: Strong Cobb Hardness Tester (Erweka)
Cara:
Sebuah tablet diletakkan tegak lurus diantara anvil dan punch, tablet
dijepit dengan memutar skrup pengatur hingga tanda lampu “stop” menyala, knop
ditekan dan dicatat angka yang ditunjukkan jarum penunjuk skala pada saat tablet
pecah. Percobaan ini dilakukan untuk 5 tablet.
Ketentuan umum: Kekerasan tablet 4-8 kg (Parrot, 1970).
Data uji kekerasan dapat dilihat pada Lampiran 19 halaman 79.
3.6.4 Uji Friabilitas
Alat: Roche Friabilator (Erweka)
Cara:
Ditimbang 20 tablet yang telah dibersihkan dari debu, dicatat beratnya (a
gram). Tablet dimasukkan ke dalam alat friabilator, lalu alat dijalankan selama 4
menit (100 kali putaran). Setelah batas waktu yang ditentukan tablet dikeluarkan
dan dibersihkan dari debu, lalu ditimbang beratnya (b gram).
Friabilitas (F) = (a – b) / a x 100%
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010.
Data uji friabilitas dan perhitungan dapat dilihat pada Lampiran 20
halaman 80.
3.6.5 Uji Waktu Hancur
Alat: Disintegration Tester (Erweka)
3.6.5.1 Tablet Tidak Bersalut
Pengujian dilakukan terhadap 6 tablet. Dimasukkan 1 tablet pada
masing-masing tabung dari keranjang, dimasukkan satu cakram pada tiap tabung,
kemudian alat dijalankan. Digunakan air dengan suhu 37º ± 2º C sebagai media.
Pada akhir batas waktu seperti yang tertera pada monografi, angkat keranjang dan
amati keenam tablet. Semua tablet harus hancur sempurna. Bila 1 atau 2 tablet
tidak hancur sempurna ulangi pengujian dengan 12 tablet lainnya, tidak kurang
dari 16 tablet dari 18 tablet yang diuji harus hancur sempurna.
Persyaratan: Waktu yang diperlukan untuk menghancurkan tablet tidak lebih
dari 15 menit untuk tablet tidak bersalut (Ditjen POM., 1979).
3.6.5.2 Tablet Bersalut Bukan Enterik
Pengujian dilakukan terhadap 6 tablet. Dimasukkan 1 tablet pada
masing-masing tabung dari keranjang, dimasukkan satu cakram pada tiap tabung,
kemudian alat dijalankan. Digunakan cairan lambung buatan LP dengan suhu 37º
± 2º C sebagai media. Pada akhir batas waktu seperti yang tertera pada monografi,
angkat keranjang dan amati keenam tablet. Semua tablet harus hancur sempurna.
Bila 1 atau 2 tablet tidak hancur sempurna ulangi pengujian dengan 12 tablet
lainnya, tidak kurang dari 16 tablet dari 18 tablet yang diuji harus hancur
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010. Persyaratan: Waktu yang diperlukan untuk menghancurkan tablet tidak lebih
dari 60 menit untuk tablet bersalut gula dan bersalut selaput (Ditjen POM., 1979).
Data uji waktu hancur dapat dilihat pada Lampiran 14 halaman 67.
3.6.6 Uji Disolusi Tablet
Untuk menguji laju disolusi tablet dilakukan dengan menggunakan alat
Dissolution Tester.
Medium : 900 ml HCl 0,1 N
Alat : tipe 1 (metode keranjang)
Kecepatan putaran : 100 rpm
Waktu : 60 menit
Cara:
Satu tablet dimasukkan ke dalam wadah disolusi yang telah berisi 900 ml
medium disolusi yang bersuhu 37º ± 0,5º C. Kemudian keranjang diputar dengan
kecepatan 100 rpm. Pada interval waktu 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55
dan 60 menit larutan dipipet sebanyak 0,5 ml dan dimasukkan ke dalam labu
tentukur 25 ml, lalu diencerkan dengan HCl 0,1 N sampai garis tanda. Serapan
diukur pada panjang gelombang 277 nm dan sebagai blanko digunakan HCl 0,1
N. Volume medium diusahakan tetap dengan menambahkan medium HCl 0,1 N
sebanyak 0,5 ml setelah pemipetan. Pengujian dilakukan terhadap 6 tablet.
Persyaratan: Dalam waktu 60 menit harus larut tidak kurang dari 85% (Q)
C6H9N3O3 dari jumlah yang tertera pada etiket (Ditjen POM., 1995).
Interpretasi: Persyaratan dipenuhi bila jumlah zat aktif yang terlarut dari sediaan
yang diuji sesuai dengan tabel penerimaan. Apabila tidak memenuhi persyaratan
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010.
memenuhi tahap S1 atau S2. Harga Q adalah jumlah zat aktif yang terlarut seperti
yang tertera dalam masing-masing monografi, dinyatakan dalam persentase kadar
pada etiket, angka 5% dan 15% dalam tabel adalah persentase kadar pada etiket,
dengan demikian mempunyai arti yang sama dengan Q.
Data uji disolusi dapat dilihat pada Lampiran 16 halaman 71 dan contoh
perhitungan pada Lampiran 15 halaman 69.
Tabel 1. Kriteria Penerimaan Zat Aktif yang Larut dengan Disolusi
Tahap Jumlah
yang diuji
Kriteria penerimaan
S1 6 Tiap unit sediaan tidak kurang dari Q + 5 %
S2 6 Rata-rata dari 12 unit (S1 + S2) adalah sama dengan
atau lebih besar dari Q dan tidak 1 unit sediaan yang
lebih kecil dari Q - 15 %
S3 12 Rata-rata dari 24 unit (S1 + S2 + S3) adalah sama
dengan atau lebih besar dari Q, tidak lebih dari 2 unit
sediaan yang lebih kecil dari Q – 15 % dan tidak 1 unit
pun yang lebih kecil dari Q – 25 %
(Ditjen POM., 1995)
3.7 Analisis Data Secara Statistik
Kadar zat aktif sebenarnya yang terkandung dalam sampel dapat diketahui
menggunakan uji distribusi t. Data diterima atau ditolak dihitung dengan
menggunakan metode standar deviasi dengan rumus:
1
2
− −
=
∑
n X X
SD i
Keterangan: Xi = nilai dari masing-masing pengukuran
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010.
n = jumlah perlakuan (Gandjar, dkk., 2007)
Untuk mencari thitung digunakan rumus:
t hitung =
n SD
X
X −
Sebagai dasar penolakan data hasil uji analisis adalah t hitung≥ t tabel atau t hitung≤ - t
tabel. Untuk menentukan kadar zat aktif dalam sampel dengan taraf kepercayaan
99%, = 0,01, dk= n-1, dapat digunakan rumus:
Kadar sebenarnya: µ = X ± t ( /2,dk)x (SD/ n )
Keterangan:
X = Interval kepercayaan kadar sampel
X = Kadar rata-rata sampel
SD = Standar Deviasi
dk = derajat kebebasan (dk = n-1)
= taraf kepercayaan
n = jumlah perlakuan (Wibisono, 2005)
Hasil perhitungan statistik kadar zat aktif sebenarnya pada sampel dapat dilihat
pada Lampiran 6 halaman 51 sampai dengan Lampiran 13 halaman 65.
Untuk mencari koefisien variasi atau Relative Standard Deviation (RSD)
ditentukan dengan rumus:
RSD = X SD
x 100%
Keterangan : SD = Standar Deviasi
X = rata-rata kadar zat berkhasiat (Gandjar, dkk., 2007)
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010. BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Penentuan Kurva Serapan dan Linieritas Kurva Kalibrasi
Metronidazol BPFI dalam Larutan HCl 0,1 N
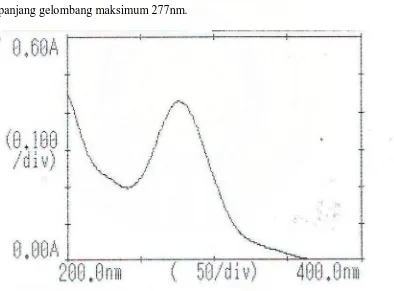
Metronidazol memberikan serapan maksimum pada panjang gelombang
277 nm dengan A11 = 377a dalam pelarut asam (Moffat, 1986). Dari penelitian ini,
pengukuran serapan maksimum Metronidazol BPFI diperoleh 277 nm. Hasil
pengukuran yang diperoleh menunjukkan panjang gelombang serapan maksimum
yang sama dengan literatur dan penetapan kadar selanjutnya dilakukan pada
panjang gelombang maksimum 277nm.
Gambar 1. Kurva Serapan Metronidazol BPFI dengan Konsentrasi 12 mcg/ml
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010.
Dari hasil identifikasi spektrum ultraviolet larutan Metronidazol BPFI dalam
larutan HCl 0,1 N pada panjang gelombang maksimum 277 nm diperoleh serapan
0,4282.
Gambar 2. Hasil Penentuan Serapan Metronidazol BPFI dengan Konsentrasi 12
mcg/ml dalam Larutan HCl 0,1 N
Hal ini sesuai dengan pernyataan dalam Farmakope Indonesia Edisi IV
yang menyatakan bahwa suatu penetapan atau pengujian mengenai panjang
gelombang, serapan maksimum mengandung implikasi bahwa serapan maksimum
tersebut tepat pada atau dalam batas 2 nm dari panjang gelombang yang
ditentukan.
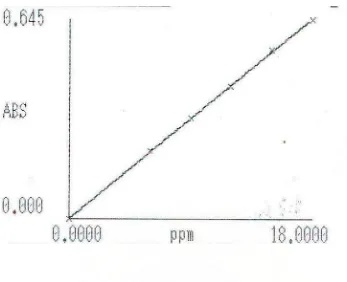
Pada penentuan kurva kalibrasi, larutan Metronidazol BPFI dibuat dengan
konsentrasi berturut-turut: 6 mcg/ml; 9 mcg/ml; 12 mcg/ml; 15 mcg/ml; dan 18
mcg/ml, diperoleh hubungan linier antara serapan dengan konsentrasi dimana
koefisien korelasi (r) = 0,9995 dan persamaan garis regresi Y = 0,0359 X +
0,0038 (Data Perhitungan pada Lampiran 3 halaman 45) serta dapat juga dilihat
hubungan antara variasi konsentrasi dengan serapan membentuk suatu garis lurus
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010. Gambar 3. Kurva Kalibrasi Metronidazol BPFI dalam Larutan HCl 0,1 N pada
Panjang Gelombang 277 nm
4.2 Hasil Evaluasi Tablet Metronidazol Generik dan Merek Dagang
4.2.1 Hasil Penetapan Kadar
Menurut Farmakope Indonesia Edisi IV, tablet Metronidazol mengandung
tidak kurang dari 90,0% dan tidak lebih dari 110,0% dari jumlah yang tertera pada
etiket. Dari hasil penetapan kadar pada Tabel 2 dapat dilihat bahwa semua tablet
Metronidazol baik generik maupun merek dagang memenuhi persyaratan
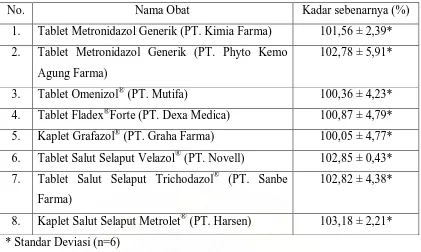
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010. Tabel 2. Data Hasil Kadar Tablet Metronidazol Generik dan Merek Dagang
No. Nama Obat Kadar sebenarnya (%)
1. Tablet Metronidazol Generik (PT. Kimia Farma) 101,56 ± 2,39*
2. Tablet Metronidazol Generik (PT. Phyto Kemo
Agung Farma)
102,78 ± 5,91*
3. Tablet Omenizol® (PT. Mutifa) 100,36 ± 4,23*
4. Tablet Fladex®Forte (PT. Dexa Medica) 100,87 ± 4,79*
5. Kaplet Grafazol® (PT. Graha Farma) 100,05 ± 4,77*
6. Tablet Salut Selaput Velazol® (PT. Novell) 102,85 ± 0,43*
7. Tablet Salut Selaput Trichodazol® (PT. Sanbe
Farma)
102,82 ± 4,38*
8. Kaplet Salut Selaput Metrolet® (PT. Harsen) 103,18 ± 2,21*
* Standar Deviasi (n=6)
Kadar Tablet Metronidazol pada tablet Metronidazol generik (PT. Kimia
Farma) yaitu 101,56 ± 2,39%, tablet Metronidazol generik (PT. Phyto Kemo
Agung Farma) 102,78 ± 5,91%, tablet Omenizol® (PT. Mutifa) 100,36 ± 4,23%,
tablet Fladex® Forte (PT. Dexa Medica) 100,87 ± 4,79%, kaplet Grafazol® (PT.
Graha Farma) 100,05 ± 4,77%, tablet salut selaput Velazol® (PT. Novell) 102,85
± 0,43%; tablet salut selaput Trichodazol® (PT. Sanbe Farma) 102,82 ± 4,38%
dan tablet salut selaput Metrolet® (PT. Harsen) 103,18 ± 2,21%. Dari Tabel 2
terlihat bahwa kadar Metronidazol dalam tablet berkisar antara 100,05% sampai
103,18% dimana kadar terendah diperoleh pada tablet Grafazol® (PT. Graha
Farma) dan kadar tertinggi pada tablet salut selaput Metrolet® (PT. Harsen). Data
kadar tablet pada Lampiran 5 halaman 49 dan contoh perhitungan dapat dilihat
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010. 4.2.2 Hasil Uji Keragaman Bobot
Menurut Farmakope Indonesia Edisi IV (1995) bahwa persyaratan
keragaman bobot dipenuhi jika jumlah zat aktif dalam masing-masing dari 10
satuan sediaan terletak antara 85,0% – 115,0% dari jumlah yang tertera pada
etiket dan simpangan baku relatif kurang dari atau sama dengan 6,0%.
Tabel 3. Hasil Uji Keragaman Bobot Tablet Metronidazol Generik dan Merek
Dagang
No. Nama Obat Bobot
Rata-Rata (mg)
Kadar
Rata-Rata (%)
Standar Deviasi
Relatif
1. Tablet Metronidazol
Generik (PT. Kimia
Farma)
659,7 105,14 0,38
2. Tablet Metronidazol
Generik (PT. Phyto
Kemo Agung Farma)
601,8 103,37 0,49
3. Tablet Omenizol®
(PT. Mutifa)
672,5 103,87 0,47
4. Tablet Fladex® Forte
(PT. Dexa Medica)
703,7 102,93 0,21
5. Kaplet Grafazol®
(PT. Graha Farma)
744,2 101,17 0,37
6. Tablet Salut Selaput
Velazol®
(PT. Novell)
630 105,23 0,42
7. Tablet Salut Selaput
Trichodazol® (PT. Sanbe
Farma)
789,2 101,92 0,28
8. Kaplet Salut Selaput
Metrolet® (PT. Harsen)
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010.
Dari Tabel 3 dapat dilihat hasil uji keragaman bobot tablet Metronidazol
generik (PT. Kimia Farma) 105,14% dengan standar deviasi relatif 0,38, tablet
Metronidazol generik (PT. Phyto Kemo Agung Farma) 103,37% dengan standar
deviasi relatif 0,49, tablet Omenizol® 103,87% dengan standar deviasi relatif 0,47,
tablet Fladex® Forte 102,93% dengan standar deviasi relatif 0,21, kaplet
Grafazol® 101,17% dengan standar deviasi relatif 0,37, tablet salut selaput
Velazol® 105,23% dengan standar deviasi relatif 0,42, tablet salut selaput
Trichodazol® 101,92% dengan standar deviasi relatif 0,28 dan kaplet salut selaput
Metrolet® 105,45% dengan standar deviasi relatif 0,35. Hal ini berarti bahwa baik
tablet Metronidazol generik maupun merek dagang memenuhi persyaratan
keragaman bobot berdasarkan Farmakope Indonesia edisi IV. Perhitungan
keragaman bobot dapat dilihat pada Lampiran 17 halaman 73 dan hasil uji
keragaman bobot pada Lampiran 18 halaman 77.
Keseragaman isi tablet dapat dipengaruhi oleh 3 faktor yaitu tidak
seragamnya distribusi bahan obat pada pencampuran bubuk atau granulasi,
pemisahan dari campuran bubuk atau granulasi selama berbagai proses pembuatan
dan penyimpangan berat tablet (Lachman dkk., 1994).
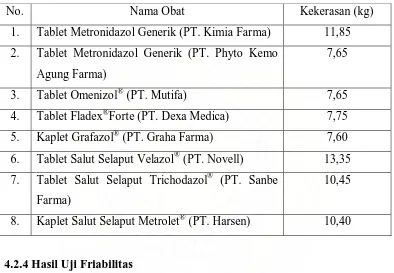
4.2.3 Hasil Uji Kekerasan Tablet
Berdasarkan Tablel 4 menunjukkan bahwa setiap tablet yang diuji
mempunyai kekerasan yang berbeda-beda mulai dari 7,60 kg sampai 11,85 kg
untuk tablet tidak bersalut dan 10,40 kg sampai 13,35 kg untuk tablet bersalut.
Data uji kekerasan dapat dilihat pada Lampiran 19 halaman 79.
Menurut Lachman dkk. (1994), perbedaan kekerasan dapat terjadi karena
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010.
perbedaan massa granul yang mengisi die pada saat pencetakan tablet. Selain itu,
berbedanya nilai kekerasan juga dapat diakibatkan oleh variasi jenis dan jumlah
bahan tambahan yang digunakan pada formulasi. Bahan pengikat adalah contoh
bahan tambahan yang bisa menyebabkan meningkatnya kekerasan tablet bila
digunakan terlalu banyak.
Tabel 4. Data Kekerasan Tablet Metronidazol Generik dan Merek Dagang
No. Nama Obat Kekerasan (kg)
1. Tablet Metronidazol Generik (PT. Kimia Farma) 11,85
2. Tablet Metronidazol Generik (PT. Phyto Kemo
Agung Farma)
7,65
3. Tablet Omenizol® (PT. Mutifa) 7,65
4. Tablet Fladex®Forte (PT. Dexa Medica) 7,75
5. Kaplet Grafazol® (PT. Graha Farma) 7,60
6. Tablet Salut Selaput Velazol® (PT. Novell) 13,35
7. Tablet Salut Selaput Trichodazol® (PT. Sanbe
Farma)
10,45
8. Kaplet Salut Selaput Metrolet® (PT. Harsen) 10,40
4.2.4 Hasil Uji Friabilitas
Menurut Voight (1994) bahwa friabilitas atau kehilangan berat yang
dialami setiap jenis tablet tidak melebihi 0,8%. Dengan terpenuhinya syarat uji
friabilitas, maka keutuhan tablet sampai ke tangan konsumen dapat terjamin. Data
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010. Tabel 5. Data Friabilitas Tablet Metronidazol Generik dan Merek Dagang
No. Nama Obat Friabilitas (%)
1. Tablet Metronidazol Generik (PT. Kimia Farma) 0,25
2. Tablet Metronidazol Generik (PT. Phyto Kemo
Agung Farma)
0,4
3. Tablet Omenizol® (PT. Mutifa) 0,45
4. Tablet Fladex®Forte (PT. Dexa Medica) 0,13
5. Kaplet Grafazol® (PT. Graha Farma) 2,69
6. Tablet Salut Selaput Velazol® (PT. Novell) 0,06
7. Tablet Salut Selaput Trichodazol® (PT. Sanbe
Farma)
0,04
8. Kaplet Salut Selaput Metrolet® (PT. Harsen) 0,06
Dari Tabel 5 dapat dilihat bahwa setiap tablet yang diuji memiliki tingkat
kerapuhan yang baik. Dari hasil uji friabilitas tablet mempunyai friabilitas yang
relatif kecil yaitu mulai dari 0,04% sampai 0,06% untuk tablet salut dan 0,13%
sampai 2,69% untuk tablet tidak bersalut. Pada tablet salut mempunyai friabilitas
yang lebih kecil daripada tablet tak bersalut karena tablet salut relatif kuat
daripada tablet tidak bersalut dan permukaan tablet salut yang halus menyebabkan
gesekan antar tablet hampir tidak ada. Pada kaplet Grafazol® friabilitasnya adalah
2,69% dan tidak memenuhi persyaratan yaitu tidak melebihi 0,8%. Hal ini
disebabkan kaplet Grafazol® sangat rapuh sehingga pada saat tablet diputar di
friabilator tablet pecah. Ini dapat disebabkan jumlah penambahan bahan pengikat
yang tidak cukup atau pada saat pencampuran dengan bahan pengikat yang tidak
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010. 4.2.5 Hasil Uji Waktu Hancur
Menurut Farmakope Indonesia Edisi III menyatakan bahwa waktu hancur
untuk tablet tidak bersalut adalah tidak lebih dari 15 menit dan untuk tablet
bersalut gula dan bersalut selaput adalah tidak lebih dari 60 menit.
Tabel 6. Data Waktu Hancur Tablet Metronidazol Generik dan Merek Dagang
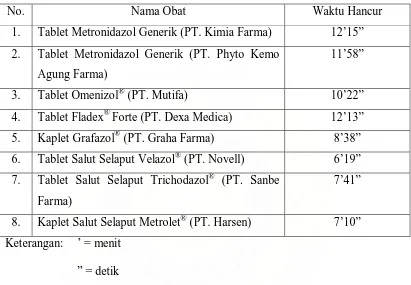
No. Nama Obat Waktu Hancur
1. Tablet Metronidazol Generik (PT. Kimia Farma) 12’15”
2. Tablet Metronidazol Generik (PT. Phyto Kemo
Agung Farma)
11’58”
3. Tablet Omenizol® (PT. Mutifa) 10’22”
4. Tablet Fladex® Forte (PT. Dexa Medica) 12’13”
5. Kaplet Grafazol® (PT. Graha Farma) 8’38”
6. Tablet Salut Selaput Velazol® (PT. Novell) 6’19”
7. Tablet Salut Selaput Trichodazol® (PT. Sanbe
Farma)
7’41”
8. Kaplet Salut Selaput Metrolet® (PT. Harsen) 7’10”
Keterangan: ’ = menit
” = detik
Pada tabel 6 dapat dilihat bahwa waktu hancur untuk tablet Metronidazol
generik (PT. Kimia Farma) yaitu 12 menit 15 detik, tablet Metronidazol generik
(PT. Phyto Kemo Agung Farma) 11 menit 58 detik, tablet Omenizol® 10 menit 22
detik, tablet Fladex® Forte 12 menit 13 detik, kaplet Grafazol® 8 menit 38 detik,
tablet salut selaput Velazol® 6 menit 19 detik, tablet salut selaput Trichodazol® 7
menit 41 detik dan kaplet salut selaput Metrolet® 7 menit 10 detik. Semua tablet
baik tidak bersalut maupun bersalut memenuhi syarat. Data uji waktu hancur
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010.
Menurut Lachman dkk. (1994), jika dikaitkan dengan disolusi maka waktu
hancur merupakan faktor penentu dalam pelarutan obat. Sebelum obat larut dalam
media pelarut maka tablet terlebih dahulu pecah menjadi partikel-partikel kecil
sehingga daerah permukaan partikel menjadi lebih luas. Namun uji ini tidak
memberi jaminan bahwa partikel-partikel akan melepaskan bahan obat dalam
larutan dengan kecepatan yang seharusnya, karena uji waktu hancur hanya
menyatakan waktu yang diperlukan tablet untuk hancur di bawah kondisi yang
ditetapkan dan lewatnya seluruh partikel melalui saringan berukuran mesh-10.
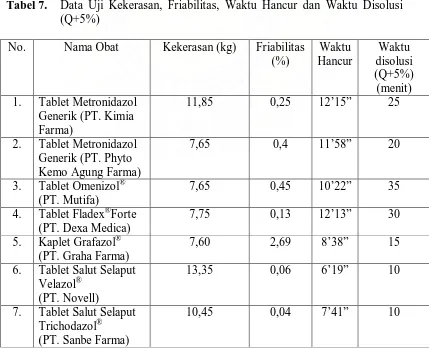
4.2.6 Hasil Uji Evaluasi Kekerasan, Friabilitas, Waktu Hancur dan Waktu Disolusi (Q+5%)
Data hasil uji evaluasi Tablet Metronidazol generik dan merek dagang
dapat dilihat pada Tabel 7 di bawah ini:
Tabel 7. Data Uji Kekerasan, Friabilitas, Waktu Hancur dan Waktu Disolusi
(Q+5%)
No. Nama Obat Kekerasan (kg) Friabilitas
(%)
Waktu Hancur
Waktu disolusi (Q+5%) (menit) 1. Tablet Metronidazol
Generik (PT. Kimia Farma)
11,85 0,25 12’15” 25
2. Tablet Metronidazol Generik (PT. Phyto Kemo Agung Farma)
7,65 0,4 11’58” 20
3. Tablet Omenizol® (PT. Mutifa)
7,65 0,45 10’22” 35
4. Tablet Fladex®Forte (PT. Dexa Medica)
7,75 0,13 12’13” 30
5. Kaplet Grafazol® (PT. Graha Farma)
7,60 2,69 8’38” 15
6. Tablet Salut Selaput Velazol®
(PT. Novell)
13,35 0,06 6’19” 10
7. Tablet Salut Selaput Trichodazol® (PT. Sanbe Farma)
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010. Tabel 7, lanjutan
8. Kaplet Salut Selaput Metrolet®
(PT. Harsen)
10,40 0,06 7’10” 20
Dari Tabel 7 dapat dilihat bahwa semakin keras sebuah tablet maka
friabilitas juga akan semakin kecil dan demikian juga waktu hancur tablet akan
lebih lama dan sebaliknya. Bila kekerasan suatu tablet menurun maka friabilitas
akan semakin tinggi dan waktu hancur tablet akan cepat. Dilihat dari tablet
Metronidazol generik (PT. Kimia Farma) mempunyai kekerasan 11,85 kg,
friabilitas 0,25% dan waktu hancur 12 menit 15 detik dan tablet Metronidazol
Generik (PT. Phtyo Kemo Agung Farma) mempunyai kekerasan 7,65 kg,
friabilitas 0,4% dan waktu hancur 11 menit 58 detik. Sama halnya juga dengan
tablet Omenizol® dan tablet Fladex® Forte yang hampir sama dengan tablet
Metronidazol generik (PT. Phyto Kemo Agung Farma). Untuk kaplet Grafazol®
dengan kekerasan 7,60 kg memiliki friabilitas yang sangat tinggi yaitu 2,69%
dengan waktu hancur yang sangat cepat yaitu 8 menit 38 detik. Untuk tablet salut
diperoleh kekerasan yang jauh lebih tinggi dari tablet tidak bersalut sehingga
friabilitas yang diperoleh pun lebih kecil dengan waktu hancur yang lebih cepat.
Dilihat dari tablet salut selaput Velazol® dengan kekerasan 13,35 kg, friabilitas
0,06% dan waktu hancur 6 menit 19 detik. Hal ini disebabkan karena tablet salut
telah dilapisi permukaan tabletnya sehingga akan lebih tahan terhadap guncangan
sedangkan waktu hancur tablet salut lebih cepat dikarenakan salut tablet akan
Winda : Perbandingan Mutu Tablet Metronidazol Generik Dengan Merek Dagang Secara In Vitro, 2010. 4.2.7 Hasil Uji Disolusi
Tabel 8. Data Uji Disolusi Tablet Metronidazol Generik dan Merek Dagang
Waktu (menit)
Jumlah Kumulatif Metronidazol Yang Terlepas (%) Generik
(PT. Kimia Farma)
Generik (PT. Phyto Kemo)
Omenizol® (PT. Mutifa)
Fladex® Forte
(PT. Dexa Medica)
Grafazol® (PT. Graha Farma)
Velazol® (PT. Novell)
Trichodazol® (PT. Sanbe
Farma)
Metrolet (PT. Harsen)
0 0 0 0 0 0 0 0 0
5 30,91 30,27 14,94 17,38 60,69 24,12 63,63 26,84
10 51,18 61,17 30,04 43,19 86,82 93,02 90,13 63,18
15 66,08 81,34 51,09 54,39 91,11 93,87 90,76 85,75
20 86,97 91,98 61,59 66,53 91,55 94,35 90,99 90,13
25 98,37 94,35 75,81 80,24 91,79 94,62 92,01 90,29
30 100,07 95,79 82,44 90,95 91,97 94,98 92,33 90,48
35 101,74 96,98 96,66 91,60 92,76 95,21 92,52 91,23
40 102,45 98,04 98,36 92,52 93,51 95,55 92,79 91,49
45 102,96 99,03 99,24 93,71 94,60 95,92 93,66 92,21
50 103,55 100,63 99,87 94,38 94,72 96,32 94,21 92,65
55 103,67 101,95 100,86 95,86 96,51 96,69 95,42 92,77