EVALUASI KUALITAS TABLET GLIBENKLAMIDA GENERIK A DAN MEREK DAGANG B
(EVALUATION QUALITY OF GLIBENCLAMIDE TABLETS GENERIC A AND BRANDED B)
Sartika Dewi, Liza Pratiwi, Siti Nani Nurbaeti
Program Studi Farmasi, Fakultas Kedokteran, Universitas Tanjungpura, Pontianak ABSTRAK
Obat merupakan salah satu aspek penting dalam upaya
penyelenggaraan kesehatan. Umumnya masyarakat lebih menyukai
menggunakan obat dengan merek dagang dibandingkan obat generik. Pemerintah telah menganjurkan penggunaan obat generik sebagaimana tercantum dalam Peraturan Menteri Kesehatan Republik Indonesia Nomor HK. 02.02/MENKES/0688/I/2010 tentang Kewajiban menggunakan Obat Generik di Fasilitas Pelayanan Kesehatan Pemerintah. Glibenklamida adalah hipoglikemik oral yang memiliki bioavaibilitas yang rendah. Obat ini tersedia dengan nama generik maupun merek dagang. Penelitian ini dilakukan untuk mengevaluasi kualitas tablet glibenklamida generik pabrik A dan merek dagang pabrik B.
Teknik pengambilan sampel penelitian ini adalah purposive sampling, dengan
kriteria inklusi nomor batch yang sama dan harga. Parameter pengujian kualitas tablet yang dilakukan adalah keseragaman bobot, keseragaman ukuran, kekerasan, kerapuhan, waktu hancur, keseragaman kadar, penetapan kadar, dan disolusi. Hasil penelitian seluruh parameter menunjukkan bahwa baik tablet glibenklamida generik pabrik A maupun merek dagang pabrik B memiliki kualitas tablet yang baik. Berdasarkan hasil analisis statistik menunjukkan bahwa tablet glibenklamida generik pabrik A dan merek dagang pabrik B memiliki kekerasan, waktu hancur, dan disolusi yang tidak berbeda signifikan, tetapi memiliki bobot, ukuran, kerapuhan, dan kadar zat aktif yang berbeda signifikan.
Kata kunci : tablet glibenklamida, evaluasi, generik, merek dagang. ABSTRACT
Drugs is one of important things of efforts to create health. Generally, people prefer to use branded drugs than generic drugs. The government has recommend to use generic drugs as listed in Minister of Health of the Republic of Indonesia Number HK.02.02/MENKES/0688/I/2010 concerning to use of Generic Drugs in Government Healthcare Facilities. Glibenclamide is an oral hypoglycemic which had a low bioavaibillity. This medicine is available by generic and branded name. The study was aim to evaluate the quality of generic factory A and branded factory B glibenclamide tablets. The sampling technique was purposive sampling, with inklusi criteria were the same batch number and price. Parameters of tablet quality testing is done is the uniformity
of weight, uniformity of size, hardness, friability analysis, disintegration time, uniformity preparations, determining the glibenclamide value, and dissolution test. The results showed that all parameters of both generic tablet glibenclamide factory A and branded factory B has good quality tablet. Based on the results of statistical analysis showed that the tablet generic glibenclamide factory A and branded factory B has hardness, disintegration, and dissolution are not significantly different, but it has a weight, size, friability, and the levels of active substances that different significantly.
Keyword : glybenclamide tablets, evaluation, generic, branded. PENDAHULUAN
Obat merupakan salah satu aspek
penting dalam upaya
penyelenggaraan kesehatan. Istilah obat generik dan obat dengan merek dagang sudah dikenal masyarakat. Umumnya masyarakat lebih menyukai menggunakan obat dengan merek dagang dibandingkan obat generik, karena adanya anggapan bahwa obat dengan merek dagang lebih manjur daripada obat generik, meskipun faktanya kedua obat tersebut memiliki zat berkhasiat yang sama.
Departemen Kesehatan Republik
Indonesia telah menganjurkan
penggunaan obat-obat generik yang harganya lebih murah daripada
obat-obat dengan merek dagang(6). Hal ini
tercantum dalam Peraturan Menteri Kesehatan Republik Indonesia Nomor
HK. 02.02/MENKES/068/I/2010
tentang Kewajiban menggunakan
Obat Generik di Fasilitas Pelayanan Kesehatan Pemerintah.
Berdasarkan Peraturan Menteri Kesehatan Republik Indonesia Nomor HK.02.02/MENKES/068/I/2010, yang dimaksud dengan obat generik adalah obat dengan nama resmi International Non Prorietary Names (INN) yang
ditetapkan dalam Farmakope
Indonesia atau buku standar lainnya
untuk zat berkhasiat yang
dikandungnya. Sedangkan obat
generik bermerek/ bernama dagang adalah obat generik dengan nama dagang yang menggunakan nama
milik produsen obat yang
bersangkutan, dan obat paten adalah obat yang masih memliki hak paten.
Obat generik maupun obat dengan
merek dagang yang banyak
digunakan adalah sediaan tablet.
Tablet harus merupakan produk
menarik yang mempunyai
identitasnya sendiri serta bebas dari
serpihan, keretakan,
pelunturan/pemucatan, kontaminasi, harus sanggup menahan guncangan
mekanik selama produksi,
pengepakkan, serta harus
mempunyai kestabilan kimia dan
fisika untuk mempertahankan
kelengkapan fisiknya sepanjang
waktu(3).
Pengawasan kualitas produk obat dapat dilakukan dengan evaluasi yakni dengan penetapan sifat kimia, fisika, dan bioavailabilitas tablet.
Pengujian tablet dilakukan tidak
hanya untuk menguji kualitas, tetapi
juga digunakan untuk
mengembangkan formulasi tablet
secara optimal(7). Pengujian tersebut
keseragaman ukuran, uji kekerasan, uji kerapuhan, uji waktu hancur, uji keseragaman kandungan, penetapan kadar, dan uji disolusi.
Keseragaman bobot tablet
ditentukan untuk menyimpulkan
ketepatan takaran, kandungan bahan aktif setiap tablet. Penyimpangan bobot tablet dapat mempengaruhi
takaran/dosis bahan obat(7). Ukuran
dan bentuk tablet berhubungan
dengan acceptabilitas/ kemudahan
tablet digunakan, dan kekerasan serta
kerapuhan(4). Tablet dari hasil
produksi yang sama dimana
ukurannya bervariasi tidak saja akan membingungkan pasien tapi juga akan menimbulkan masalah dalam
pengemasannya(1).
Kekerasan adalah parameter yang menggambarkan ketahanan tablet dalam melawan tekanan mekanik
seperti goncangan, kikisan dan
terjadinya keretakan tablet selama pembungkusan, pengangkutan dan pemakaian. Kekerasan ini dipakai
sebagai ukuran dari tekanan
pengempaan. Sedangkan kerapuhan adalah parameter lain dari ketahanan
tablet dalam pengikisan dan
guncangan. Faktor-faktor yang
mempengaruhi kerapuhan antara lain
banyaknya kandungan serbuk
(fines)(4).
Waktu hancur tablet adalah waktu yang diperlukan tablet untuk hancur
menjadi banyak partikel(7). Supaya
komponen obat sepenuhnya tersedia untuk diabsorpsi dalam saluran cerna,
maka tablet harus hancur dan
melepaskan zat aktifnya ke dalam
cairan tubuh untuk dilarutkan(1).
Setelah tablet hancur selanjutnya
terjadi proses disolusi. Disolusi adalah proses suatu zat padat masuk ke dalam pelarut sehingga terlarut pada medium disolusi. Sifat disolusi suatu obat berhubungan langsung dengan
aktivitas farmakologinya(5).
Salah satu sediaan tablet generik yang juga memiliki berbagai merek
dagang adalah glibenklamida.
Glibenklamida adalah hipoglikemik oral dari golongan sulfonilurea, yang
digunakan dalam pengobatan NIDDM
(Non-insulin Dependent Diabetes
Mellitus). Obat ini merupakan obat pertama dari antidiabetika generasi ke-2 dengan khasiat hipoglikemianya yang kira-kira 100 kali lebih kuat
daripada tolbutamida(6). Gianotto
(2007) menyatakan bahwa
glibenklamida memiliki bioavaibilitas rendah yang dikaitkan dengan sifat
disolusinya yang jelek(2). Oleh karena
itu perbedaan metode pabrikasi dan formulasi produk generik dan merek
dagang yang dilakukan dapat
mempengaruhi bioavaibilitas obat ini.
Penelitian ini bertujuan untuk
mengetahui evaluasi kualitas tablet glibenklamida generik pabrik A dan
merek dagang pabrik B, serta
mengetahui perbandingan evaluasi kualitas tablet glibenklamida generik pabrik A dan merek dagang pabrik B. BAHAN DAN METODE
Bahan yang digunakan dalam penelitian ini adalah glibenklamida BPFI, tablet glibenklamida generik pabrik A, tablet glibenklamida merek
dagang pabrik B, KH2PO4 p.a., NaOH
p.a., HCl p.a., metanol p.a. dan aquades.
1. Uji Keseragaman Bobot
Sebanyak 20 tablet diambil
kemudian ditimbang dan dihitung bobot rata-ratanya. Selanjutnya tablet tersebut ditimbang satu per satu dan dihitung persentase masing-masing dengan syarat, tidak boleh lebih dari 2 tablet yang bobotnya menyimpang lebih dari 7,5% bobot rata-ratanya dan tidak satu tablet pun yang bobotnya menyimpang lebih dari 15%
bobot rata-ratanya. Dilakukan
replikasi sebanyak 3 kali. 2. Uji Keseragaman Ukuran
Sebanyak 10 tablet diambil,
kemudian diukur diameter dan
tebalnya satu per satu menggunakan jangka sorong. Selanjutnya dihitung rata-ratanya. Kecuali dinyatakan lain garis tengah tablet tidak lebih dari 3
kali dan tidak kurang dari 11/3 kali
tebal tablet. Dilakukan replikasi
sebanyak 3 kali. 3. Uji Kekerasan
Sebanyak 1 tablet diletakkan
dengan posisi tegak lurus pada alat Hardness tester. Selanjutnya diputar penekan alat pelan-pelan sampai tablet pecah. Dibaca skala alat yang menunjukkan kekerasan tablet dalam satuan kilogram. Dilakukan replikasi sebanyak 3 kali . Kekerasan tablet yang baik sebesar 4-8 kg.
4. Uji Kerapuhan
Sebanyak 20 tablet yang sudah dibebasdebukan ditimbang, kemudian
dimasukkan ke dalam friability tester,
diputar selama 4 menit dengan kecepatan 25 rpm atau 100 kali
putaran. Tablet dibebasdebukan
kembali dari fines yang menempel
dan dihitung persen kehilangan
bobotnya. Dilakukan replikasi
sebanyak 3 kali. Kehilangan berat lebih kecil dari 0,5% sampai 1% masih dapat dibenarkan.
5. Uji Waktu Hancur
Sebanyak 5 tablet dimasukkan ke dalam keranjang uji disintegrasi yang
berisi air suhu 36o-38oC kira-kira 1000
ml. Alat diturun-naikkan secara teratur 30 kali tiap menit. Tablet dinyatakan hancur, jika tidak ada bagian tablet yang tertinggal di atas kasa, kecuali fragmen dari zat penyalut. Dilakukan replikasi sebanyak 3 kali. Bila tidak
dinyatakan waktu untuk
menghancurkan kelima tablet tidak lebih dari 15 menit untuk tablet tidak bersalut.
6. Penetapan Kadar Tablet a. Validasi Metode
1) Linearitas dan Presisi
Larutan glibenklamida dibuat
dengan beberapa seri konsentrasi. Penyerapan dari setiap larutan diukur pada panjang gelombang maksimum glibenklamida dan diambil data yang
nilai absorbansinya 0,2-0,8 Å.
Kemudian dibuat kurva baku yang
diperoleh dari beberapa seri
konsentrasi glibenklamida.
Pengukuran dilakukan sebanyak tiga kali. Kurva tersebut dianalisis dengan menggunakan metode regresi linear sehingga diperoleh persamaan y = bx + a.
2) Akurasi
Uji akurasi dilakukan dengan
metode penambahan baku (Standard Addition Method), yaitu dengan mengambil 5 mL larutan sampel (25 µg/mL) dan dimasukkan ke dalam tiga gelas beker 25 mL yang masing-masing mengandung 3 mL, 5 mL dan
7 mL dari larutan standar glibenklamida (25 µg/mL). Larutan ini diencerkan dengan larutan bufer fosfat pH 8,0. Sehingga larutan akhir memiliki konsentrasi 8 µg/mL, 10 µg/mL, dan 12 µg/mL. Pengukuran dilakukan sebanyak tiga kali dan dianalisa.
b. Pembuatan Larutan Dapar Fosfat pH 8
Larutan dapar fosfat pH 8 dibuat dengan mencampur 50,0 mL kalium dihidrogen fosfat 0,2 M dengan 46, 1 mL natrium hidroksida 0,2 N yang tertera pada daftar di bawah dan
diencerkan dengan air bebas
karbondioksida P secukupnya hingga 200 mL.
c. Penentuan Panjang Gelombang Maksimum dan Pembuatan Kurva Baku Glibenklamida dalam Bufer Fosfat pH 8
Sebanyak 10 mg glibenklamida dilarutkan ke dalam larutan buffer fosfat pH 8 pada labu 100 mL. Dibuat beberapa seri konsentrasi larutan glibenklamida. Penyerapan dari setiap
larutan diukur pada panjang
gelombang maksimum glibenklamida
dan diambil data yang nilai
absorbansinya 0,2-0,8 Å. d. Uji Disolusi
Tablet dimasukkan ke dalam alat disolusi tipe 2 (tipe dayung) yang berisi medium dapar fosfat pH 8,0 sebanyak 500 ml pada suhu 37 ± 0.5
o
C dengan kecepatan pengadukan 75 rpm selama 60 menit. Diambil 5 ml sampel pada menit ke-5, 10, 15, 30, 45 dan 60. Setiap pengambilan
sampel diganti dengan medium
disolusi dengan volume dan suhu yang sama. Kadar glibenklamida
terdisolusi pada masing-masing waktu
diukur dengan menggunakan
spektrofotometer UV pada panjang
gelombang maksimum. Dilakukan
replikasi sebanyak 3 kali. 7. Penetapan Kadar Tablet
a. Penentuan Panjang Gelombang Maksimum dan Pembuatan Kurva Baku Glibenklamida dalam Asam Klorida Metanol 0,1 M
Sebanyak 10 mg glibenklamida dilarutkan ke dalam larutan asam klorida metanol 0,1 M pada labu 100 mL. Dibuat beberapa seri konsentrasi. Penyerapan dari setiap larutan diukur pada panjang gelombang maksimum glibenklamida dan diambil data yang nilai absorbansinya 0,2-0,8 Å.
b. Keseragaman Kandungan
Satu tablet diserbukkan,
dihangatkan dengan 10 mL asam klorida metanol 0,1 M, dan disentrifus. Diulangi ekstraksi tiga kali, tiap kali dengan 10 mL asam klorida metanol 0,1 M. Didinginkan kumpulan ekstrak, ditambahkan asam klorida metanol 0,1 M hingga 50 mL. Diukur serapan pada panjang gelombang maksimum lebih kurang 300 nm. Dilakukan replikasi sebanyak tiga kali.
c. Penetapan Kadar Tablet
Sebanyak 20 tablet ditimbang dan
diserbukkan. Ditimbang saksama
sejumlah serbuk tablet setara dengan lebih kurang 20 mg glibenklamida, dikocok dengan 40 mL asam klorida metanol 0,1 M, dipanaskan
perlahan-lahan dan disentrifus. Diulangi
ekstraksi tiga kali, tiap kali dengan 20 mL asam klorida metanol 0,1 M, diencerkan kumpulan ekstrak dengan asam klorida metanol 0,1 M hingga
panjang gelombang serapan maksimum lebih kurang 300 nm. Dilakukan replikasi sebanyak tiga kali. HASIL DAN PEMBAHASAN
1. Penampilan Fisik Tablet
Tablet glibenklamida yang
digunakan dalam penelitian ini
berwarna putih, yang dikemas dalam bentuk blister. Pada permukaan tablet terdapat ukiran huruf yang menjadi identitas khusus dari masing-masing
tablet. Pada penelitian ini juga
dilakukan uji mutu fisik tablet, yakni
dengan melihat ada tidaknya
kerusakan fisik pada tablet.
Kerusakan ini dapat terjadi
dikarenakan masalah formulasi
maupun peralatan pencetakan.
Tabel 1. Hasil Evaluasi Penampilan Fisik Tablet
Kerusakan Generik Dagang Merek
Capping - -
Laminating - -
Cracking - -
Sticking - -
Picking - -
Hasil penelitian ini menunjukkan bahwa tidak ditemukan kerusakan fisik pada tablet glibenklamida generik pabrik A maupun merek dagang pabrik B. Sehingga dapat diketahui bahwa tablet glibenklamida generik pabrik A dan merek dagang pabrik B memiliki penampilan fisik yang baik. 2. Uji Keseragaman Bobot
Pengujian keseragaman bobot
tablet menjadi suatu hal yang harus
diperhatikan karena keseragaman
bobot menunjukkan bahwa setiap tablet mengandung sejumlah obat yang tepat, sehingga keseragaman
bobot dapat digunakan sebagai
indikator awal keseragaman kadar zat aktif. Penyimpangan bobot tablet dapat terjadi karena formulasi atau
peralatan yang digunakan.
Tabel 2. Persyaratan Penyimpangan Bobot Tablet
Bobot rata-rata (mg)
Penyimpangan bobot rata-rata dalam % A B ≤ 25 15% 30% 26 – 150 10% 20% 151 – 300 7,5% 15% > 300 mg 5% 10%
Tablet glibenklamida generik dan merek dagang memiliki bobot
rata-rata 151 – 300 mg maka syaratnya
adalah tidak boleh lebih dari dua tablet yang masing-masing bobotnya menyimpang lebih besar dari 7,5% bobot rata-ratanya, dan tidak satu tabletpun yang bobotnya menyimpang lebih dari 15% bobot rata-ratanya.
Tabel 3. Hasil Uji Keseragaman Bobot Sampel Rep Bobot Rata2 (g) Syarat 7,5% 15% Generik I 0,2033 0,2185 0,2338 II 0,2035 0,2188 0,2340 III 0,2031 0,2183 0,2336 Merek Dagang I 0,1614 0,1735 0,1856 II 0,1616 0,1737 0,1858 III 0,1620 0,1742 0,1563 Berdasarkan hasil penelitian ini
dapat diketahui bahwa tablet
glibenklamida generik pabrik A dan merek dagang pabrik B masing-masing memiliki bobot yang seragam
sesuai dengan persyaratan
Farmakope Indonesia dan
perhitungan nilai persen CV. Hasil uji
keseragaman bobot ini dapat
dijadikan indikator awal bahwa tablet glibenklamida generik pabrik A dan merek dagang pabrik B memiliki
kadar zat aktif yang seragam.
Meskipun kedua sampel ini
sama-sama seragam tetapi apabila
dibandingkan secara statistik, tablet glibenklamida generik pabrik A dan merek dagang pabrik B memiliki bobot yang berbeda signifikan.
3. Uji Keseragaman Ukuran
Uji keseragaman ukuran tablet perlu dilakukan karena keseragaman
ukuran menjadi parameter
acceptabilitas atau kemudahan tablet untuk digunakan. Ketidakseragaman ukuran tablet secara kasat mata
dapat membuat pasien menjadi
bingung dengan obat tersebut serta menimbulkan permasalahan dalam pengemasan.
Tabel 4. Hasil Uji Keseragaman Ukuran Sampel Rep D
rata-rata T rata-rata Generik I 0,510 0,331 II 0,511 0,339 III 0,513 0,335 Merek Dagang I 0,512 0,286 II 0,510 0,287 III 0,510 0,287
Berdasarkan hasil pengukuran
diameter dan tebal tablet, dapat
diketahui bahwa baik tablet
glibenklamida generik pabrik A
maupun merek dagang pabrik B memiliki ukuran yang seragam sesuai
persyaratan Farmakope Indonesia dan memiliki kualitas ukuran yang baik. Analisis statistik menujukkan bahwa tablet glibenklamida generik
pabrik A memiliki ukuran yang
berbeda signifikan dengan tablet glibenklamida merek dagang pabrik B.
4. Uji Kekerasan
Kekerasan merupakan parameter ketahanan tablet terhadap guncangan mekanik yang terjadi selama proses
produksi, pengepakan,
pendistribusian, hingga perlakuan
berlebih dari konsumen. Tablet yang terlalu keras menyebabkan waktu hancurnya menjadi lebih lambat dan disolusinya rendah.
Tabel 5. Hasil Uji Kekerasan Sampel Replikasi Kekerasan Rata-Rata (gram) Generik I 5,83 II 5,83 III 5,86 Merek Dagang I 7,51 II 7,50 III 7,80
Berdasarkan penelitian ini dapat
diketahui bahwa baik tablet
glibenklamida generik pabrik A
maupun merek dagang pabrik B memiliki kekerasan tablet yang baik. Secara statistik diketahui bahwa kekerasan tablet generik pabrik A dan merek dagang pabrik B tidak berbeda signifikan atau dapat dinyatakan bahwa kedua jenis tablet ini memiliki
kualitas kekerasan yang sama
5. Uji Kerapuhan
Kerapuhan menunjukkan nilai
minimal dari kekerasan tablet. Jika tablet yang terlalu keras tidak dapat hancur dan terdisolusi dalam tubuh, maka sebaliknya tablet yang terlalu rapuh mudah menjadi serpihan atau pecah pada saat produksi, distribusi, atau bahkan saat akan digunakan pasien sehingga tablet yang rapuh akan kehilangan keindahannya dan
mempengaruhi nilai acceptabilitas
dari konsumen. Selain itu tablet yang rapuh dapat menimbulkan variasi pada berat dan keseragaman isi tablet yang pada akhirnya dapat mempengaruhi jumlah atau kadar zat aktifnya.
Tabel 6. Hasil Uji Kerapuhan
Sampel Replikasi % Kerapuhan
Generik I 0,179 II 0,113 III 0,182 Merek Dagang I 0,034 II 0,012 III 0,006
Berdasarkan penelitian ini dapat diketahui bahwa tablet glibenklamida generik pabrik A dan merek dagang pabrik B memiliki kualitas kerapuhan yang baik. Secara statistik, terlihat bahwa terdapat perbedaan signifikan antara kerapuhan tablet glibenklamida generik pabrik A dan merek dagang pabrik B.
6. Uji Waktu Hancur
Waktu hancur merupakan salah satu faktor yang menentukan cepat atau lambatnya obat diabsorpsi dan menimbulkan efek terapi, karena
waktu hancur merupakan proses awal nasib tablet di dalam tubuh.
Tabel 7. Hasil Uji Waktu Hancur
Sampel Replikasi Waktu Hancur rata-rata (detik) Generik I 16,8 II 15 III 14,2 Merek Dagang I 14 II 14,6 III 12,2
Berdasarkan hasil penelitian ini
diketahui bahwa baik tablet
glibenklamida generik pabrik A
maupun merek dagang pabrik B memenuhi persyaratan waktu hancur (disintegrasi) sesuai dengan yang
tercantum dalam Farmakope
Indonesia edisi III. Berdasarkan hasil
analisis parametrik t test
menunjukkan bahwa tidak terdapat perbedaan signifikan antara waktu hancur tablet glibenklamida generik pabrik A dan merek dagang pabrik B atau kedua jenis tablet ini memiliki kualitas waktu hancur yang sama baiknya.
7. Validasi Metode
Spektrofotometri
Pada penelitian ini dilakukan
validasi metode analisa adopsi, hal ini
dikarenakan sebelumnya telah
dilakukan pengukuran kadar tablet glibenklamida dengan menggunakan metode spektrofotometri. Oleh karena itu, parameter yang digunakan adalah linearitas, presisi, dan akurasi.
Tabel 8. Hasil Uji Linearitas No Konsentrasi (µg/mL) Absorbansi (Å) 1 4 0,338 2 6 0,401 3 8 0,461 4 12 0,602
Berdasarkan hasil penelitian ini diperoleh persamaan kuva baku y = 0,033 x + 0,203, dengan nilai
linearitas sebesar 0,99929.
Sedangkan presisi sebesar 0,0977. Berdasarkan hasil di atas terlihat
bahwa peningkatan konsentrasi
mengakibatkan nilai absorbansi
semakin besar. Hal ini diperjelas dengan kurva berikut ini.
0 0,5 1
4 6 8 12
Gambar 1. Kurva Linearitas
Glibenklamida dalam Larutan Buffer Fosfat pH 8
Akurasi (ketelitian) menunjukkan nilai hasil pengukuran memiliki nilai yang sama atau hampir sama dengan nilai sebenarnya. Nilai ini dinyatakan
dengan % perolehan kembali
(recovery). Syarat akurasi yang baik
adalah sebesar 98 – 102%. Hasil
pengujian perolehan kembali
ditunjukkan pada tabel berikut ini:
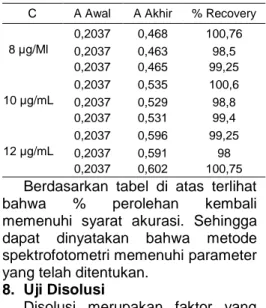
Tabel 9. Hasil Perolehan Kembali
C A Awal A Akhir % Recovery 8 µg/Ml 0,2037 0,468 100,76 0,2037 0,463 98,5 0,2037 0,465 99,25 10 µg/mL 0,2037 0,535 100,6 0,2037 0,529 98,8 0,2037 0,531 99,4 12 µg/mL 0,2037 0,596 99,25 0,2037 0,591 98 0,2037 0,602 100,75 Berdasarkan tabel di atas terlihat
bahwa % perolehan kembali
memenuhi syarat akurasi. Sehingga dapat dinyatakan bahwa metode spektrofotometri memenuhi parameter yang telah ditentukan.
8. Uji Disolusi
Disolusi merupakan faktor yang sangat penting dalam kontrol kualitas tablet, karena kecepatan melarut obat
berhubungan langsung dengan
kemanjuran (efikasi). Uji disolusi tablet glibenklamida menggunakan larutan buffer fosfat pH 8 karena glibenklamida diresorpsi lengkap di
usus, khususnya ileum yang
merupakan bagian terakhir dari usus halus yang memiliki pH 7-8.
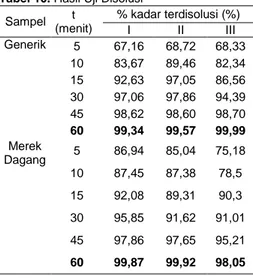
Tabel 10. Hasil Uji Disolusi Sampel t (menit) % kadar terdisolusi (%) I II III Generik 5 67,16 68,72 68,33 10 83,67 89,46 82,34 15 92,63 97,05 86,56 30 97,06 97,86 94,39 45 98,62 98,60 98,70 60 99,34 99,57 99,99 Merek Dagang 5 86,94 85,04 75,18 10 87,45 87,38 78,5 15 92,08 89,31 90,3 30 95,85 91,62 91,01 45 97,86 97,65 95,21 60 99,87 99,92 98,05
Hasil penelitian menunjukkan
bahwa tablet glibenklamida generik pabrik A dan merek dagang pabrik B memiliki kualitas disolusi yang baik. Berdasarkan analisis statistik dapat diketahui bahwa tablet glibenklamida generik pabrik A dan merek dagang pabrik B memiliki kualitas disolusi yang sama baiknya.
9. Uji Keseragaman Kandungan Kurva kalibrasi untuk keseragaman
kadar dan penetapan kadar
digunakan dengan melarutkan
glibenklamida dalam larutan asam
klorida metanol 0,1 M. Hasil
pengukuran seri konsentrasi
glibenklamida dalam asam klorida metanol 0,1 M ditunjukkan pada tabel berikut ini:
Tabel 11. Hasil Pengukuran Seri Kadar Glibenklamida dalam Asam Klorida Metanol 0,1 M No Konsentrasi (µg/mL) Absorbansi (Å) 1 40 0,276 2 50 0,333 3 60 0,408 4 70 0,480
Berdasarkan hasil di atas
diperoleh nilai regresi linear y = 0,00687 x–00036. Kurva linearitas glibenklamida dalam larutan asam klorida metanol 0,1 M ditunjukkan pada gambar berikut:
0 0,2 0,4 0,6
40 50 60 70
Gambar 2. Kurva Linearitas Glibenklamida dalam Larutan Asam Klorida Metanol 0,1 M
Pengujian keseragaman
kandungan perlu dilakukan untuk
memastikan bahwa tiap tablet
mengandung sejumlah zat aktif yang sama. Ketidakseragaman kandungan dapat mengakibatkan adanya variasi efek yang ditimbulkan.
Tabel 12. Hasil Uji Keseragaman Kandungan
Sampel Rep A % Kadar
Generik I 0,65341 95,63 II 0,66178 96,85 III 0,64931 95,04 Merek Dagang I 0,68190 99,78 II 0,66865 97,85 III 0,67543 98,84
Berdasarkan hasil uji
keseragaman kadar yang ditunjukkan pada tabel di atas diketahui bahwa tablet glibenklamida generik pabrik A dan merek dagang pabrik B memiliki kandungan yang seragam. Hal ini
berkorelasi positif dengan
keseragaman bobot yang dilakukan
sebelumnya. Sehingga dalam
penelitian ini, keseragaman bobot tablet glibenklamida dapat digunakan sebagai indikator awal keseragaman
kandungan zat aktifnya.
Perbandingan kadar zat aktif tablet glibenklamida generik pabrik A dan merek dagang pabrik B menunjukkan bahwa terdapat perbedaan signifikan antara kedua produk ini.
10. Penetapan Kadar Tablet
Penetapan kadar zat aktif perlu dilakukan untuk memastikan bahwa tiap tablet mengandung zat aktif sesuai dengan persyaratan yang
tercantum dalam Farmakope
Indonesia. Setiap tablet memiliki persyaratan masing-masing kadar zat
aktif yang dikandungnya.
Berdasarkan Farmakope Indonesia
edisi IV, tablet glibenklamida
mengandung glibenklamida, tidak
kurang dari 95,0% dan tidak lebih dari jumlah yang tertera pada etiket.
Tabel 13. Hasil Uji Penetapan Kadar Tablet
Sampel Rep A % Kadar
Generik I 0,65459 95,81 II 0,65573 95,97 III 0,66189 96,87 Merek Dagang I 0,67040 98,11 II 0,68110 99,67 III 0,67226 98,38
Berdasarkan hasil penetapan
kadar di atas, terlihat bahwa baik tablet glibenklamida generik pabrik A maupun merek dagang pabrik B
masing-masing memenuhi
persyaratan Farmakope Indonesia
edisi IV. Hasil analisis statistik
menunjukkan bahwa meskipun tablet glibenklamida generik pabrik A dan merek dagang pabrik B sama-sama memenuhi persyaratan Farmakope Indonesia tetapi keduanya memiliki kualitas yang tidak sama.
11. Evaluasi Uji Kekerasan, Kerapuhan, Waktu Hancur dan Disolusi
Kekerasan, kerapuhan, waktu
hancur dan disolusi merupakan
parameter evaluasi kualitas tablet yang memiliki keterkaitan satu sama lain. Tablet yang keras memiliki kerapuhan yang rendah sehingga tidak mudah menjadi serpihan, begitu pula sebaliknya.
Tabel 14. Evaluasi Uji Kekerasan, Kerapuhan, Waktu Hancur dan Disolusi Sampel Kekerasan (kg) Kerapuhan (%) Waktu Hancur (detik) Disolusi (%) Generik 5,83 0,179 16,8 99,34 5,83 0,113 15 99,57 5,86 0,182 14,2 99,99 Merek Dagang 7,51 0,034 14 98,05 7,50 0,012 14,6 99,92 7,80 0,006 12,2 95,96
Berdasarkan hasil di atas dapat dilihat korelasi antara kekerasan,
kerapuhan, waktu hancur dan
disolusi. Tablet glibenklamida generik pabrik A memiliki nilai kekerasan yang kecil maka nilai kerapuhannya besar, sebaliknya tablet glibenklamida merek
dagang pabrik B memiliki nilai
kekerasan yang besar maka nilai
kerapuhannya kecil. Berdasarkan
tabel di atas juga dapat dilihat bahwa
tidak terdapat hubungan antara
kekerasan terhadap waktu hancur dan disolusi tablet. Meskipun tablet glibenklamida generik pabrik A dan merek dagang pabrik B memiliki perbedaan kekerasan tetapi waktu hancur dan kadar disolusinya tidak berbeda signifikan.
12.Evaluasi Keseragaman Bobot dan Keseragaman Ukuran
Keseragaman bobot tablet dapat menjadi indikator awal keseragaman
kadar/kandungan zat aktif5. Tiap
tablet mengandung sejumlah zat aktif yang telah dicampur dengan eksipien lainnya hingga homogen. Perbedaan bobot tablet dapat menyebabkan
variasi kandungan zat aktifnya
sehingga mempengaruhi efek yang ditimbulkan.
Tabel 15. Evaluasi Koefisien Variasi Keseragaman Bobot dan Kadar
Sampel Bobot (%CV) Kadar (%CV) Generik 1,41 0,78 Merek Dagang 1,2 0,8
Berdasarkan tabel di atas terlihat bahwa tablet glibenklamida generik pabrik A dan merek dagang pabrik B memiliki bobot dan kadar yang seragam karena nilai % koefisien variasi tidak lebih dari 5%. Hal ini
menujukkan adanya korelasi positif diantara keduanya. Oleh karena itu,
dapat dinyatakan bahwa
keseragaman bobot merupakan
indikator awal keseragaman kadar tablet glibenklamida.
KESIMPULAN
1. Hasil evaluasi kualitas tablet
glibenklamida generik pabrik A dan
merek dagang pabrik B
menunjukkan bahwa baik
glibenklamida generik pabrik A maupun merek dagang pabrik B memiliki kualitas yang baik.
2. Hasil analisis statistik
menunjukkan bahwa tablet
glibenklamida generik pabrik A dan merek dagang pabrik B memiliki kekerasan, waktu hancur, dan disolusi yang sama baiknya, tetapi memiliki bobot, ukuran, kerapuhan, dan kadar zat aktif yang berbeda. DAFTAR PUSTAKA
1. Ansel, Howard C. 2005.
Pengantar Bentuk Sediaan Farmasi, edisi keempat. Jakarta: Penerbit Universitas Indonesia.
2. Gianotto, Elisabeth A. dos S.,
Arantes, R.P., Filho, Maurilio J.L., Filho, Alexandre C.S.C.,
Nery, Marlene M.F., 2007.
Dissolution Test for
Glibenclamide Tabltes. Quim,
Nova, Vol. 30, No. 5.
http://quimicanova.sbq.org.br/qn/
qnol/2007/vol30n5/30-AR06316.pdf (diakses pada
tanggal 30 Oktober 2011).
3. Lachman, Leon., Lieberman,
Herbert A., dan Kanig, Joseph. 2008. Teori dan Praktek Farmasi
Industri II, edisi ketiga. Siti Suyatmi (Alih Bahasa). Jakarta: Penerbit Universitas Indonesia.
4. Parrot, E.L., 1971,
Pharmaceutical Technology Fundamental Pharmaceutics, 3rd
Ed, Minneapolis: Burger
Publishing Company.
5. Sulaiman, Teuku Nanda
Saifullah. 2007. Teknologi &
Formulasi Sediaan Tablet.
Yogyakarta: Lab. Teknologi
Farmasi Fakultas Farmasi UGM.
6. Tjay, Tan Hoan dan Rahardja,
Kirana. 2007. Obat-Obat Penting,
edisi Keenam. Jakarta:
Gramedia.
7. Voigt, Rudolf. 1995. Buku
Pelajaran Teknologi Farmasi. Soewandhi, Soendani Noerono
(Alih Bahasa). Yogyakarta:
Gadjah Mada University Press.
8. Sulaiman, Teuku Nanda
Saifullah. 2007. Teknologi & Formulasi Sediaan Tablet.
Yogyakarta: Lab. Teknologi