Invitro
Admar Jas
Staf Pengajar pada Departemen Farmakologi FK-USU Medan
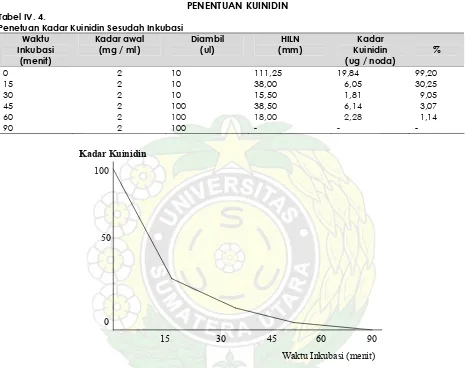
dalam media larutan isotonis dan buffer kalium fosfat, pH 7,4. Pemisahan terhadap metabolit diperoleh dengan metode ekstraksi (Extraction Method) dengan pelarut organic (Chloroform) dalam suasana basa, sehingga kuinidin base dan metabolit total akan terekstraksi ke dalam pelarut organic, kemudian dipisahkan. Pemisahan dilakukan secara Kromatografi Lapisan Tipis (KLT) dan hasil pemisahan ditentukan secara kualitatif maupun kuantitatif secara spektrofotodensitometri. Hasil pemeriksaan dari 7 sampel, ternyata pada waktu 90 menit semua Kuinidin telah termetabolisme secara sempurna. Pada waktu 60 menit tersisa Kuinidin 1,14%, 45 menit tersisa 3,07%, pada 30 menit 9,05%, 15 menit 30,25% dan 0 menit 99,20%.
Kata kunci: mendapatkan metabolit kuinidin secara invitro
Abstract: The examinations of metabolite quinidine by used supernatant fraction of rabbit hepar adult with Quinidin sulphate 0,25 % in buffer K-phosphate and isotoni solutions media, pH 7,4. Isolations to quinidin metabolite as product aplicated by Extraction methode with organic solvent such as Chloroform influence base until quinidin base and metabolite total will to extraction in organic solvent after that to isolations. Isolation to application by Chromato graphi Thin Layer next quinidine metabolite were assayed as qualitative and quantitative by spectrophotodensitometri method. The results showed that 7 samples contains samples. No samples were contaminated by supernatant factions rabbit hepar on 90“ all quinidine result showed readly to be metabolite as proximate. At 60” restand Quinidine 1,14%, 45” restand 3,07%, at 30” restand 9,05%, 15” restand 30,25% and 0” 99,20%.
Keywords: run up to metabolite quinidine as invitro
PENDAHULUAN
Metabolit kuinidin merupakan hasil metabolisme kuinidin di dalam tubuh, diduga mempunyai efek farmakologi hampir sama dengan kuinidin. Kuinidin adalah salah satu alkaloida kina yang digunakan sebagai obat antiaritmia, pemakainnya terbatas mengingat ada efek samping hipotensi. Efek hipotensi yang ditimbulkan cukup lama yaitu lebih kurang 6 jam. Karena ada metabolit kuinidin diduga juga aktif menurunkan tekanan darah.1
Peneliti ingin mengembangkan penggunaan kuinidin disamping sebagai obat anti-aritmia juga digunakan sebagai obat antihipertensi. Metabolit kuinidin didapatkan secara invitro, yaitu melakukan inkubasi larutan kuinidin sulfat dengan fraksi supernatant dari homogenate hati kelinci dalam media larutan isotonis kalium klorida 1,15 % - buffer kalium
fosfat pH 7,4. Cara ini dilakukan karena lebih 80% kuinidin dimetabolisme di hati dan dieliminasi lewat urin, t ½ lebih kurang 6 jam dan metabolit utama adalah hidrokuinidin.1. 4
METODE PENELITIAN
I. Mendapatkan Metabolit Kuinidin Secara Invitro
A. Cara memperoleh fraksi supernatant. 5. 6
1. Menyiapkan hewan percobaan 2. Menyiapkan homogenat kasar 12,5
% w/v
3. Menyiapkan fraksi supernatan 10.000 x g
B. Inkubasi
Larutan kuinidin sulfat diinkubasi dengan fraksi supernatan 10.000 x g dalam shaking incubator selama 6 priode waktu pada suhu 37 0
C. Mencari kondisi optimum
Untuk mengetahui waktu optimum inkubasi, dilaksanakan prosedur inkubasi enam priode waktu, yaitu: 0’; 15’ ; 30 ’ ; 45’ ; 60’ ; 90 menit dan setiap priode dilakukan analisis.
D. Teknik mendapatkan metabolit kuinidin.7
Mengorbankan sejumlah hewan percobaan untuk mendapatkan homogenat hati, kemudian disentrifus pada 5˚C, diperoleh fr. supernatan, dilakukan inkubasi dengan larutan kuinidin sulfat 10% dalam media larutan isotoni kalium klorida - buffer kalium fosfat pH 7,4.
II. Analisis terhadap Metabolit Kuinidin Analisis dilakukan tiga tahap:
1. Ekstraksi
Campuran yang telah diinkubasi diekstraksi dengan pelarut khloroform dalam suasana basa (amonia) pH 10, Kuinidin base dan metabolit total dari Kuinidin akan terekstraksi ke dalam pelarut organik tersebut, kemudian dipisahkan.3
2. Pemisahan
Pemisahan dilakukan dengan kromatografi lapisan tipis (KLT), noda (bercak) yang terjadi ditandai, kemudian ditentukan secara kualitatif dan kuantitatif. 8
III. Alat dan Bahan 1. Alat-alat:
- Alat gelas yang umum dipakai di laboratorium analisis
- Gelas Potter-elvehyem dan homogenizer - Ultrasentrifus (Beckman)
- Shaker incubator
- Digital melting point apparatus electrothermal (IA-9100)
- Spectrofotometer infra red (Becman IR-33)
- Bejana kromatografi dan pelat lap. tipis silika gel GF 254
- Spektrofotdensitometer (Beckman DB- GT)
2. Bahan-bahan:
- Kuinidin sulfat (PT. Kimia Farma) - Kalium dihidrofosfat
- Kalium klorida dan Natrium klorida
- Alkohol absolut (etanol 96%) dan metanol
- Aceton, Kloroform, dan Amonium pekat
3. Hewan percobaan:
Kelinci jantan : New Zealand white
Berat badan : 2,25 – 3,00 kg, jumlah: 6 (enam) ekor
IV. Percobaan dan Hasil Percobaan 2. 3. 9
1. Pemeriksaan bahan baku Kuinidin sulfat Pemeriksaan dilakukan berdasarkan United States Pharmacopoea Ed. XXII tahun 1990, dan Farmakope Indonesia Edisi III tahun 1979. Pemeriksaan tersebut meliputi kelarutan, identifikasi, spektra serapan, titik lebur dan penentuan kadar zat aktif. Disimpulkan bahan baku Kuinidin sulfat yang dipergunakan memenuhi syarat.
2. Mendapatkan metabolit kuinidin secara invitro.5
Pertama hewan percobaan disiapkan, kemudian hewan ditimbang, disuntik dengan larutan Fenobarbital Natrium 5% secara intraperitoneal selama tiga hari berturut-turut dengan dosis: 90 mg/kg BB/hari. Sesudah itu pada hari ke tiga hewan dipuasakan, hanya diberi air minum selama 24 jam sebelum dikorbankan.
3. Homogenat kasar 12,5 % w/v. 8. 5
Kelinci (BB. 2,25 kg) yang telah disuntik dengan Fenobarbital, pada hari ke empat dikorbankan. Operasi dilakukan segera, lalu diangkat hatinya dan ditimbang (Berat hati: 54,40 g). Homogenat kasar 12,5 % w/v, yaitu: 1g hati + 7 ml larutan media yang dibutuhkan: 54,40 x 7 ml = 381 ml =Î 400 ml.
V. Mencari Waktu Inkubasi Optimal
1. Langkah pertama, yaitu mencari kondisi optimum:
Larutan Konidin sulfat diinkubasi dengan fraksi supernatan dalam shaking incubator selama 6 (enam) priode waktu pada suhu 37 ºC.
Periode waktu (menit) 0’ 15’ 30’ 45’ 60’ 90’ Total
Sampel (S) Kontrol (K)
2 fl 1 fl
2 fl 1 fl
2 fl 1 fl
2 fl 1 fl
2 fl 1 fl
2 fl 1 fl
12 6 Keterangan: S = Sampel : Fraksi supernatan + substrat (K-Sulfat)
K = Kontrol : Fraksi supernatan tanpa substrat ; Fl = Gelas erlenmeyer 100 ml
2. Teknik pelaksanaan:
Ke dalam erlenmeyer 100 ml dimasukkan: 8 ml lautan buffer Kalium fosfat pH 7,4 8 ml larutan Kuinidin sulfat 0,25 % (= 20 mg) 20 ml fraksi supernatan 10.000 x g
Penambahan bahan
No. Kelompok Flesh
Lar. K S 0,25 % Aquadest Buffer Fr. S
1. Sampel 1 - 12 8 ml - 8 ml 20 ml
2. Kontrol 1 - 6 - 8 ml 8 ml 20 ml
Keterangan: KS = Kuinidin sulfat Fr. S = Fraksi supernatan
Fl. = Gelas erlenmeyer 100 ml Inkubasi:
- Inkubasi dalam shaking incubator selama 6 priode waktu: 0; 15; 30; 45; 60; 90 menit pada suhu 30 ºC. Setiap priode waktu erlenmeyer diangkat dan langsung di ekstraksi.
VI. Analisis terhadap Metabolit Kuinidin 1. Tahap ekstraksi
Cara kerja:
- Ke dalam corong pisah (vol. 100 ml) dimasukkan cairan yang telah diinkubasi, ditambahkan amonia pekat sampai pH 10. Ekstraksi dengan kloroform sebanyak 50 ml.
- Hasil ekstraksi dimasukkan ke dalam labu takar 50 ml, cukupkan sampai garis tanda dengan kloroform.
- Uapkan di atas penangas air sampai vol. 10 ml ( Kuinidin sulfat awal 20 mg / 10 ml.)
2. Tahap pemisahan
Pemisahan senyawa Kuinidin dan metabolitnya dilakukan:
Metode: Kromatografi Lapisan Tipis (KLT) Lapisan (fase diam): Silica gel GF 254
Pengembang (fase gerak): Kloroform-metanol-aseton (Perbandingan 6:2:2)
Penampak noda (kontras bercak): Lampu ultraviolet L= 254 nm dan 365 nm
Larutan cuplikan: Kloroform dan metanol
Pembanding (Larutan Zat Bahan Baku) 3. 10
a. Larutan Kuinidin sulfat 0,25 % sebanyak 4 ml (10 mg), diekstraksi dengan kloroform dalam suasana basa (amonia) pH sp 10. Diekstraksi dengan 25 ml kloroform, masukkan ke dalam labu takar volume 25 ml sampai garis tanda. Kuinidin: 10 mg/25 ml = 0,4 ug /ml.
b. Larutan Kuinidin sulfat 0,25 % sebanyak 5 ml diekstraksi dengan 25 ml kloroform, dimasukkan ke dalam labu takar 25 ml sp garis tanda. Kuinidin 12,5 mg /25 ml = 0,5 ug /ml.
Cara kerja:
- Pipetir lar. baku Kuinidin sulfat (sampel) dalam kloroform dengan berbagai volume, dengan jumlah semakin meningkat pada pelat lapisan tipis silika gel GF 254 siap pakai. - Setelah totolan kering, pelat dimasukkan
campuran pengembang yang telah dijenuhkan dengan uap amonia. Setelah pengembang mencapai jarak 15 cm, pelat diangkat, dikeringkan pada suhu kamar. Noda yang terjadi diidentifikasi dengan lampu UV pada spektrofotodensitometri, memakai pereaksi Dragendorf. 11. 12
3. Tahap penentuan batas kepekaan
a. Penentuan kepekaan KLT dan panjang gelombang, sebagai berikut: 10. 11. 12
Cara kerja:
Larutan baku Kuinidin sulfat dalam kloroform (0,5 ug /ul) ditotolkan dengan berbagai volume tertentu dengan jumlah
semakin meningkat pada pelat KLT GF 254 siap pakai. Setelah totolan kering, dikembangkan dalam bejana kromatografi, noda yang terjadi dikeringkan, dilihat dengan lampu UV pada spektrofotodensitometer. Ternyata menunjukkan batas kepekaan pada 1 ug/noda. ditentukan λ absorpsi maksimum diantara bercak yang lebih jelas disinari dengan lampu uv-spektrodensiometer, ternyata absorpsi maksimum pada λ = 330 nm. Hasil pengamatan kepekaan lihat Tabel IV.1 dan hasil pengamatan penentuan λ absorpsi maksimum pada Gambar IV.1.
Tabel IV. 1
Penentuan batas kepekaan kromatografi lapis tipis kuinidin secara visual
No. Larutan Induk Diambil (ul) Kadar (ug) Noda
1. 0,50 1 0,5 -
2. 0,50 2 1,0 +
3. 0,50 3 1,5 +
4. 0,50 4 2,0 ++
5. 0,50 5 2,5 ++
6. 0,50 6 3,0 +++
7. 0,50 7 3,5 +++
8. 0,50 8 4,0 +++
Keterangan:
_ = Noda tidak jelas + = Noda terlihat ++ = Noda jelas +++ = Noda sangat jelas Adsorben = Silika gel GF 254
Cairan pengembang = Kloroform-metanol-aseton (6:2:2)
Penampak noda = lampu ultraviolet, λ 365 nm dan pereaksi Dragendorf
PENETAPAN PANJANG GELOMBANG MAKSIMUM Serapan
330
350 270
λ - Panjang Gelombang maksimum (nm)
b. Penetuan linieritas senyawa pembanding Cara kerja:
- Larutan baku Kuinidin dalam
kloroform (5 ug/ul) ditotolkan pada pelat lapisan tipis silika gel GF-254 siap pakai sebanyak 6 titik: 4 ul; 8 ul; 16 ul; 24 ul; 32 ul; 40 ul setelah totolan kering, dikembangkan dalam bejana kromatografi, kemudian diangkat dan dikeringkan pada suhu kamar.
- Noda yang telah dikeringkan dilihat
dengan lampu UV, kelihatan noda berfluoresensi biru pada λ pendek dan noda berwarna biru tua λ 365 nm, lalu ditandai dengan pensil.
- Diukur integrasi luas noda dengan spektrofotodensitometer pada λ 365 nm. Hasil Integrasi Luas Noda dengan konsentrasi senyawa yang ditotolkan dibuat kurva kalibrasi menggunakan persamaan regresi. Hasil lihat pada, Tabel IV. 2 dan Gambar IV. 2.
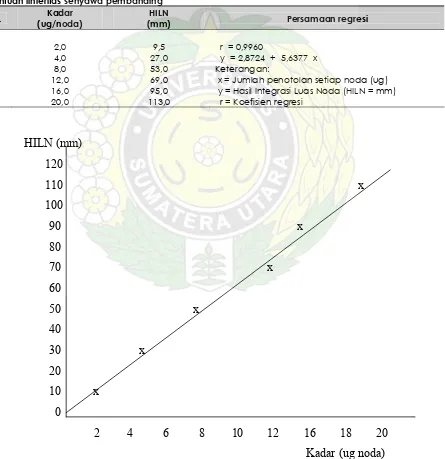
Tabel IV.2
Penentuan linieritas senyawa pembanding
No. Kadar
(ug/noda)
HILN
(mm) Persamaan regresi
1 2 3 4 5 6
2,0 4,0 8,0 12,0 16,0 20,0
9,5 27,0 53,0 69,0 95,0 113,0
r = 0,9960
y = 2,8724 + 5,6377 x Keterangan:
x = Jumlah penotolan setiap noda (ug) y = Hasil Integrasi Luas Noda (HILN = mm) r = Koefisien regresi
HILN (mm)
120
110 x
100
90 x
80
70 x
60
50 x
40
30 x
20
10 x
0
2 4 6 8 10 12 16 18 20
Kadar (ug noda)
PEMBUATAN KURVA KALIBRASI
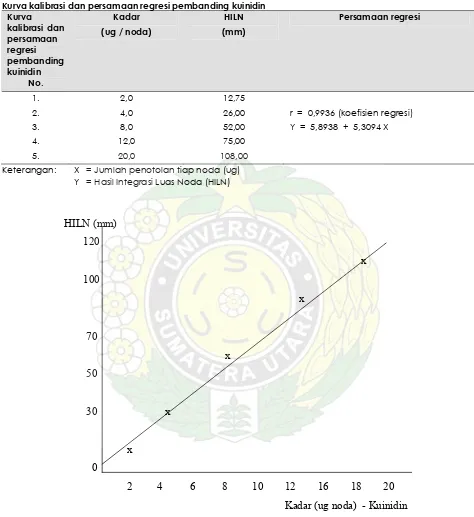
Tabel IV.3
Kurva kalibrasi dan persamaan regresi pembanding kuinidin Kurva
kalibrasi dan persamaan regresi pembanding kuinidin
No.
Kadar (ug / noda)
HILN (mm)
Persamaan regresi
1. 2. 3. 4. 5.
2,0 4,0 8,0 12,0 20,0
12,75 26,00 52,00 75,00 108,00
r = 0,9936 (koefisien regresi) Y = 5,8938 + 5,3094 X
Keterangan: X = Jumlah penotolan tiap noda (ug) Y = Hasil Integrasi Luas Noda (HILN)
HILN (mm)
120
x
100
x
70
x
50
30 x
x
0
2 4 6 8 10 12 16 18 20
Kadar (ug noda) - Kuinidin
Gambar IV. 3. Kurva kalibrasi pembanding kuinidin c. Penetuan waktu inkubasi optimum
Cara kerja:
- Pipetir larutan zat dalam kloroform (2
ug/ul = hasil inkubasi) dengan mikro pipet sebanyak beberapa kali menurut priode waktu inkubasi, ditotolkan ke pelat silika gel 60 F 254 siap pakai. disertai penotolan larutan pembanding Kuinidin (0,4 ug/ul) enam konsentrasi untuk mendapatkan kurva kalibrasi.
- Masukkan ke dalam bejana kromatografi berisi pengembang campuran: kloroform-metanol – aceton (6 : 2 : 2) yang telah dijenuhkan dengan amonia. - Biarkan 50 menit, setelah pengembang
Periode waktu (menit) 0’ 15’ 30’ 45’ 60’ 90’ Ket.
О
О
О
О
ОО О О ◦◦ _ A. Sampel (S)2 ug/ul dalam kloroform
10 ul
Kuinidin dlm kloroform 0,4 ug/ul
5 ul 10 ul 20 ul 30 ul 40 ul 50 ul
20 ug
d. Penentuan kualitatif kuinidin dan metabolitnya:
No. Pemeriksaan Metabolit Kuinidin Kuinidin
1. - noda pada pelat
sililika-gel GF-254.
Absorpsi maksimum dgn lampu uv
Pereaksi kristal:
- Dragendorff -mikroskop
Harga Rf Titik lebur
Spektrum infra red
Hablur halus, berwarna putih kekuningan, rasa sangat pahit.
Sangat sukar larut
Kristal pendek seperti cacing
38
239-240 ºC
Lihat – gambar IV. 1
Hablur kasar seperti kristal putih sangat pahit.
Kristal panjang seprti lidi
50
172-173,5 ºC Lihat - Gb. IV. 2
e. Penentuan kuantitatif:
Secara tidak langsung Kuinidin yang tidak termetabolisme secara spektrofotodensio-metri.
Cara kerja:
- Noda yang terjadi setelah dikeringkan dilihat dengan lampu UV, ditandai dengan pensil.
- Masing-masing noda ditentukan secara spektrofotometri dengan lampu UV pada 330 nm.
Kadar Kuinidin sisa dihitung dengan bantuan kurva kalibrasi dan persamaan regresi.
Teknik pengukuran noda:
Tinggi garis tegak lurus pada grafik tersebut sebagai Hasil Integrasi Luas Noda (HILN). Hasil ILN nol dapat dilihat dengan mengukur pelat lapisan tipis yang baru. Setelah HILN setiap noda zat pembanding diukur dan kurva kalibrasi diperoleh dengan cara membuat persamaan garis antara senyawa dalam noda (sumbu X) dengan HILN masing-masing noda (sumbu Y). Kurva kalibrasi dinyatakan
dengan persamaan: Y = A + BX B = n
∑
xy -∑
x∑
yA = ¹/n (
∑
y – B∑
x) = y - B x n = Jumlah noda zat pembanding yang diukur.Ternyata pada waktu ke 90 menit semua Kuinidin telah termetabolisme dengan
sempurna. Hasil penentuan secara kuantitatif dilihat pada Tabel IV. 4, Gambar IV. 4.
PENENTUAN KUINIDIN Tabel IV. 4.
Penetuan Kadar Kuinidin Sesudah Inkubasi Waktu
Gambar IV.4. Kadar Kuinidin setelah inkubasi selama enam periode waktu
VII. Mendapatkan Metabolit Kuinidin secara Kolektif
1. Menyiapkan hewan percobaan Hewan ditimbang:
a. Berat badan hewan I = 2.250 kg b. Berat badan hewan II = 2.500 kg c. Berat badan hewan III = 3000 kg
Masing-masing hewan disuntik dengan larutan Fenobarbital natrium 5 % dalam larutan Natrium klorida fisiologis secara intraperitoneal, selama 3 hari berturut-turut dosis 90 mg/Kg BB/hari. Pada hari ketiga sesudah penyuntikan hewan dipuasakan dan hanya diberi air selama 24 jam sebelum dikorbankan.
2. Penyiapan homogenate kasar 12,5% b/v. Yaitu: Hati kelinci 1 g,
Media (campuran lar. KCl 1,15% dengan buffer K-fosfat pH 7,4) 7 ml.
Cara kerja:
Kelinci yang telah diperlakukan seperti tersebut di atas pada hari keempat dikorbankan.
Segera dilakukan operasi dan diangkat hatinya dan ditimbang:
a. Berat hati kelinci I = 55 gram b. Berat hati kelinci I = 60 gram
c. Berat hati kelinci I = 54 gram Berat total = 169 g
3. Penyiapan fraksi supernatan 10.000 x g Homogenat yang diperoleh disentrifus dengan kecepatan 10.000 x g dengan alat ultrasentrifus pada suhu 5˚C selama 15 menit. Kemudian dituang dan diambil fraksi sebelah atasnya, disebut fraksi supernatan 10.000 x g.
4. Pelaksanaan inkubasi:
Larutan Kuinidin sulfat diinkubasi dengan fraksi supernatan 10.000 x g dalam larutan media pH 7,4 dalam shaking inkubator (shaker 124) selama 90 menit pada suhu 37˚C sehingga seluruh Kuinidin akan berubah menjadi metabolit, diekstraksi dan dipisahkan:
Cara kerja:
Ke dalam 6 buah labu erlenmeyer 500 ml masing-masing dimasukkan:
Larutan buffer K-fosfat pH 7,4 80 ml
Larutan Kuinidin sulfat 0,25 % (=200 mg) 80 ml
Fraksi supernatan 10.000 x g 200 ml Lakukan inkubasi dalam shaking incubator selama 90 menit pada suhu 37 ˚C (shaker 124), 10 menit pertama sebagai pra inkubasi. Reaksi dimulai dengan menambahkan fraksi super natant dan dihentikan setelah 90 menit, lalu diekstraksi dengan pelarut kloroform sama banyak dalam suasana basa dengan ammonia pH > 10.
Analisis 5. 6. 7. 8
Larutan hasil ektraksi mengandung metabolit Kuinidin, dipekatkan dengan evavorator, dilakukan pemisahan dengan Kromatografi Lapisan Tipis (KLT) secara preparative dengan pelat silica gel GF 254 dibuat sendiri dan diaktifkan pada suhu 105 ˚C selama 1 jam dalam lemari pengering. Masukkan pelat tersebut ke dalam bejana kromatografi telah berisi pengembang campuran kloroform-metanol-aseton (6:2:2) yang telah dijenuhkan dengan uap ammonia. Setelah pengembang naik mencapai 15 cm, pelat diangkat dan dikeringkan pada suhu kamar. Lapisan metabolit dilihat dengan bantuan lampu UV pada
λ
(254 nm) danλ
panjang (365 nm) dan ditandai. Lapisan metabolit dikerok, dimasukkan ke dalam beker gelas 100 ml dan dilarutkan dalam metanol, aduk dan dibiarkan selama 30”. Larutan metabolit dalam metanol disentrifus,kemudian dipisahkan dari silikagelnya. Larutan metabolit ini ditotolkan kembali ke pelat silika gel GF 254 siap pakai, kemudian dikembangkan dalam kromatografi. Ternyata menunjukkan hanya satu noda. Noda tersebut dilihat absorpsi maksimumnya dengan lampu UV pada spekrofotodensitometer, menunjukkan
λ
350 nm. Metabolit tersebut benar-benar sudah terpisah dari senyawa lain. larutan metabolit dalam metanol tersebut diuapkan sampai kering pada suhu 105-110, hingga didapat berat tetap, kemudian ditimbang. Metabolit yang diperoleh sebanyak 340,50 mg. Dilakukan identifikasi terhadap metabolit kuinidin.
Pembahasan 1. 9. 11. 13. 14
metabolit 38, sedangkan Kuinidin 50. dilihat dengan sinar uv-spektrofotodensitometer pada
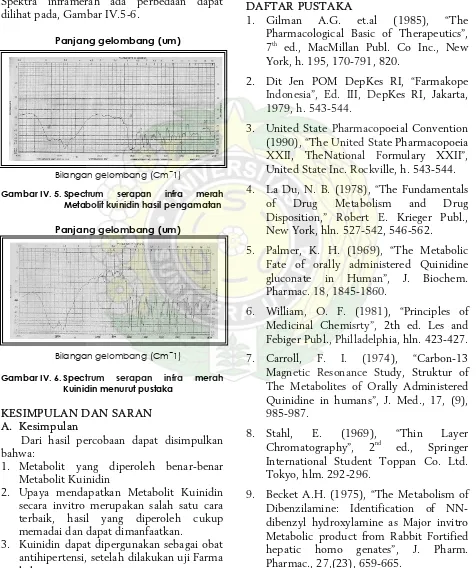
λ254 nm bercak metabolit berfluoresensi biru tua, sedangkan Kuinidin biru muda. Pada λ 365 nm bercak metabolit biru violet dan Kuinidin biru muda. Titik lebur metabolit Kuinidin 239-240 ˚C, Kuinidin 172-174 ˚C. Spektra inframerah ada perbedaan dapat dilihat pada, Gambar IV.5-6.
Panjang gelombang (um)
Bilangan gelombang (Cm¯1)
Gambar IV. 5. Spectrum serapan infra merah
Metabolit kuinidin hasil pengamatan
Panjang gelombang (um)
Bilangan gelombang (Cm¯1)
Gambar IV. 6. Spectrum serapan infra merah
Kuinidin menurut pustaka
KESIMPULAN DAN SARAN A. Kesimpulan
Dari hasil percobaan dapat disimpulkan bahwa:
1. Metabolit yang diperoleh benar-benar Metabolit Kuinidin
2. Upaya mendapatkan Metabolit Kuinidin secara invitro merupakan salah satu cara terbaik, hasil yang diperoleh cukup memadai dan dapat dimanfaatkan.
3. Kuinidin dapat dipergunakan sebagai obat antihipertensi, setelah dilakukan uji Farma kologi secara invivo.
B. Saran
Perlu dilakukan penelitian mengenai:
1. Percobaan yang sama menggunakan hewan sejenis
2. Perlu dilakukan percobaan secara invivo.
DAFTAR PUSTAKA
1. Gilman A.G. et.al (1985), “The Pharmacological Basic of Therapeutics”, 7th
ed., MacMillan Publ. Co Inc., New York, h. 195, 170-791, 820.
2. Dit Jen POM DepKes RI, “Farmakope Indonesia”, Ed. III, DepKes RI, Jakarta, 1979, h. 543-544.
3. United State Pharmacopoeial Convention (1990), “The United State Pharmacopoeia XXII, TheNational Formulary XXII”, United State Inc. Rockville, h. 543-544.
4. La Du, N. B. (1978), “The Fundamentals of Drug Metabolism and Drug Disposition,” Robert E. Krieger Publ., New York, hln. 527-542, 546-562.
5. Palmer, K. H. (1969), “The Metabolic Fate of orally administered Quinidine gluconate in Human”, J. Biochem. Pharmac. 18, 1845-1860.
6. William, O. F. (1981), “Principles of Medicinal Chemisrty”, 2th ed. Les and Febiger Publ., Philladelphia, hln. 423-427.
7. Carroll, F. I. (1974), “Carbon-13 Magnetic Resonance Study, Struktur of The Metabolites of Orally Administered Quinidine in humans”, J. Med., 17, (9), 985-987.
8. Stahl, E. (1969), “Thin Layer Chromatography”, 2nd
ed., Springer International Student Toppan Co. Ltd. Tokyo, hlm. 292-296.
10. Windolz, M. et al (1983), “The Merc Index”, 10th
Ed., Merc and Co. Inc. New Yersey, hlm. 1164.
11. Hand, S and W. Dibbern (1980), “UV and IR Spectra of Some Inportant Drugs”, Ed. Cantor, Aulendorf, hlm. 1403.
12. Auteroff, H. (1987), “Identifikasi Obat”, Terbitan ke IV, Terjemahan N. C Sugiarso, Penerbit, ITB, Bandung, 61, 138, 252.
13. Carroll, F. I. (1974), “Carbon-13 Magnetic Resonance Study, Struktur of The Metabolites of Orally Administered Quinidine in humans”, J. Med., 17, (9), 985-987.