PISANG KEPOK UNTI SAYANG
PADA BEBERAPA KOMPOSISI MEDIA
COKORDA ISTRI MEYGA SEMARAYANI
A24070005
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
ABSTRACT
COKORDA ISTRI MEYGA SEMARAYANI. (Repeated Subculture of Kepok Unti Sayang Banana Shoots In Vitro on Several Medium Compositions)
COKORDA ISTRI MEYGA SEMARAYANI. Subkultur Berulang Tunas In Vitro Pisang Kepok Unti Sayang pada Beberapa Komposisi Media. (Dibimbing oleh DINY DINARTI).
Penelitian ini bertujuan untuk mempelajari pengaruh subkultur berulang terhadap pertumbuhan dan perbanyakan tunas in vitro pisang Kepok Unti Sayang pada beberapa komposisi media. Media dasar yang digunakan yaitu media Murashige dan Skoog dengan modifikasi vitamin B5. Penelitian ini dilaksanakan di Laboratorium Kultur Jaringan Tanaman, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor pada bulan Februari sampai dengan September 2011.
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) yang disusun dalam faktor tunggal, yaitu komposisi media. Terdapat 4 perlakuan komposisi media, yaitu media MS dengan penambahan 2 mg/l BAP + 0.8 mg/l thidiazuron (M1), media MS dengan penambahan 2 mg/l BAP (M2), media MS
dengan penambahan 5 mg/l BAP (M3) dan media MS dengan penambahan 7 mg/l kinetin (M4). Setiap perlakuan diulang sebanyak 2 kali sehingga terdapat 8 satuan percobaan. Setiap satu satuan percobaan terdiri atas 20 botol kultur. Setiap botol kultur ditanamn satu tunas mikro. Setelah tanaman berumur 3 minggu, dilakukan subkultur ke media yang sama. Subkultur dilakukan sebanyak 6 kali. Setiap 3 minggu sekali, satu satuan pengamatan diakarkan pada media ½ MS dengan penambahan 0.5 mg/l IBA.
Peningkatan jumlah kultur bermultiplikasi berbanding lurus dengan jumlah tunas yang dihasilkan. Total jumlah tunas pada perlakuan media MS + 2 mg/l BAP hingga subkultur ke-6 sebanyak 410 tunas dengan 131 tunas yang bermultiplikasi. Pada perlakuan media MS + 7 mg/l kinetin, total jumlah tunas hingga subkultur ke-6 sebanyak 314 tunas dengan 91 tunas yang bermultiplikasi. Rata-rata jumlah tunas tertinggi dihasilkan pada perlakuan media MS + 2 mg/l BAP sebanyak 39.8 tunas pada subkultur ke-6. Laju mutiplikasi tertinggi terjadi pada perlakuan media MS + 2 mg/l BAP sebesar 7.5 pada subkultur ke-4.
Pengamatan jumlah daun sebelum subkultur pada perlakuan media MS + 2 mg/l BAP dan media MS + 7 mg/l kinetin menunjukkan perbedaan jumlah daun yang dihasilkan. Sedangkan setelah subkultur hingga akhir pengamatan pertambahan jumlah daun pada kedua perlakuan sama. Pada parameter tinggi tunas, dari awal hingga akhir pengamatan pada semua periode subkultur perlakuan media MS + 2 mg/l BAP dan media MS + 7 mg/l kinetin mengalami pertambahan tinggi tunas yang sama.
Akar paling cepat muncul pada 1.5 minggu setelah tanam pada perlakuan media MS + 7 mg/l kinetin. Jumlah akar tertinggi pada perlakuan media MS + 2 mg/l BAP sebanyak 9.03 pada subkultur ke-6.
SUBKULTUR BERULANG TUNAS
IN VITRO
PISANG KEPOK UNTI SAYANG
PADA BEBERAPA KOMPOSISI MEDIA
Skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Fakultas Pertanian Institut Pertanian Bogor
COKORDA ISTRI MEYGA SEMARAYANI
A24070005
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
Judul
:
SUBKULTUR BERULANG TUNAS
IN VITRO
PISANG
KEPOK
UNTI
SAYANG
PADA
BEBERAPA KOMPOSISI MEDIA
Nama
:
COKORDA ISTRI MEYGA SEMARAYANI
NIM
: A24070005
Menyetujui, Pembimbing
Ir. Diny Dinarti, MSi. NIP 19660408 199203 2 003
Mengetahui,
Ketua Departemen Agronomi dan Hortikultura Fakultas Pertanian IPB
Dr. Ir. Agus Purwito, MSc. Agr. NIP 19611101 198703 1 003
RIWAYAT HIDUP
Penulis dilahirkan di Denpasar, Bali pada tanggal 5 Mei 1989. Penulis merupakan anak kedua dari Bapak Cokorda Gede Alit Semarajaya dan Ibu Ni Putu Mariani.
Tahun 2001 penulis lulus dari SD Saraswati 1, kemudian pada tahun 2004 penulis menyelesaikan studi di SMP Negeri 5 Denpasar. Selanjutnya penulis lulus dari SMA Negeri 1 Denpasar pada tahun 2007. Tahun 2007 penulis diterima di IPB melalui USMI. Selanjutnya tahun 2008 penulis diterima sebagai mahasiswa di Departemen Agronomi dan Hortikultura, Fakultas Pertanian IPB.
Selama masa pendidikan penulis aktif dalam organisasi mahasiswa. Tahun 2008-2009 penulis menjadi pengurus Himpunan Mahasiswa Agronomi (Himagron) sebagai staff Club Tanaman Hias dan Buah, kemudian dilanjutkan pada tahun 2009-2010 penulis menjadi staff Kewirausahaan. Tahun 2008-2009 penulis menjadi pengurus Kesatuan Mahasiswa Hindu Dharma IPB (KMHD IPB) sebagai ketua divisi Pengembangan Sumberdaya Manusia. Selain itu, penulis juga aktif dalam organisasi Brahmacarya, yaitu suatu organisasi mahasiswa yang respect dan cinta terhadap Bali.
KATA PENGANTAR
Puji syukur penulis panjatkan kehadapan Tuhan Yang Maha Esa atas rahmat dan karunia-Nya sehingga penelitian yang berjudul ”Subkultur Berulang Tunas In Vitro Pisang Kepok Unti Sayang pada Beberapa Komposisi Media” ini dapat diselesaikan dengan baik.
Penulis menyampaikan terima kasih kepada:
1. Ir. Diny Dinarti, MSi, selaku dosen pembimbing skripsi yang telah memberikan arahan dan bimbingan dalam penelitian.
2. Dr. Ani Kurniawati, SP, MSi dan Dr. Ir. Iskandar Lubis, MS, selaku dosen penguji, atas saran dan masukan untuk perbaikan skripsi ini.
3. Alm. Prof. Dr. Ir. Sriani Sujiprihati, MS, selaku dosen pembimbing akademik atas bimbingan, kesabaran, dan motivasi yang telah diberikan. 4. Dr. Ir. M. Rahmad Suhartanto, MSi dan seluruh staff Pusat Kajian
Buah-buahan Tropika, yang telah memberikan arahan selama penelitian.
5. Dr. Ir. Ni Made Armini Wiendi, MS, atas nasehat dan dorongan yang telah diberikan selama ini.
6. Papa, Mama, Bayu dan keluarga besar yang telah memberikan doa, dukungan dan semangat selama menjalankan studi.
7. Keluarga Lab. Biotek : Neneng, Rara, Fia, Indah, Yudia, Tika, Koko Limas, Teh Eneng, Kak Yudi, Mba Ai, dan Pak Arifin, atas bantuan dan dukungan kepada penulis selama menjalankan penelitian.
8. Feni, Galuh, Lilis, Nazima, Moyi, Cutrisni, Chissy, Riska, Lilik, Mita, Kartika, Made Ayu, Ayus, Debby, Mayun, atas bantuan, pengertian dan semangat kepada penulis.
9. Teman-teman Agronomi dan Hortikultura angkatan 44, KMHD IPB dan Keluarga Besar Brahmacarya Bogor.
10. Pihak-pihak yang tidak dapat disebutkan satu per satu atas perhatian, dukungan, doa, dan bantuan kepada penulis selama ini.
Semoga hasil penelitian ini dapat berguna bagi pihak yang memerlukan.
DAFTAR ISI
Halaman
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN Latar Belakang. ... 1
Tujuan. ... 2
Hipotesis. ... 2
TINJAUAN PUSTAKA Tanaman Pisang. ... 3
Teknik Kultur Jaringan ... 4
Zat Pengatur Tumbuh ... 6
BAHAN DAN METODE Tempat dan Waktu ... 8
Bahan dan Alat ... 8
Metode Penelitian... 8
Pelaksanaan Penelitian. ... 9
Pengamatan ... 12
HASIL DAN PEMBAHASAN Kontaminasi. ... 14
Jumlah Tunas ... 18
Jumlah Daun... 24
Tinggi Tunas ... 25
Jumlah Akar ... 27
Media Pengakaran. ... 29
Aklimatisasi... 31
Pembahasan Umum ... 32
KESIMPULAN DAN SARAN Kesimpulan. ... 36
Saran ... 36
DAFTAR PUSTAKA ... 37
DAFTAR TABEL
Nomor Halaman
1. Persentase Rata-rata Kultur Pisang Kepok Unti Sayang Terkontaminasi Cendawan ... 16 2. Persentase Rata-rata Kultur Pisang Kepok Unti Sayang
Terkontaminasi Bakteri ... 17
3. Persentase Kultur Bermultiplikasi pada Pisang Kepok Unti Sayang hingga Subkultur ke-6 ... 18
4. Rata-rata Jumlah Tunas pada Pisang Kepok Unti Sayang hingga Subkultur ke-6. ... 21
5. Rata-rata Laju Multiplikasi pada Pisang Kepok Unti Sayang hingga Subkultur ke-6 ... 22 6. Rata-rata Jumlah Daun pada Pisang Kepok Unti Sayang hingga
Subkultur ke-6. ... 25 7. Rata-rata Tinggi Tunas pada Pisang Kepok Unti Sayang hingga
Subkultur ke-6. ... 26 8. Pengaruh Komposisi Media terhadap Waktu Munculnya Akar
pada Pisang Kepok Unti Sayang Secara In Vitro. ... 28 9. Persentase Kultur Berakar pada Pisang Kepok Unti Sayang
hingga Subkultur ke-6 ... 28 10. Rata-rata Jumlah Akar pada Pisang Kepok Unti Sayang hingga
Subkultur ke-6 ... 29
11. Pengaruh Media Pengakaran terhadap Waktu Munculnya Akar pada Pisang Kepok Unti Sayang Secara In Vitro ... 30
12. Rata-rata Jumlah Akar pada Media Pengakaran Kultur Pisang Kepok Unti Sayang Secara In Vitro ... 31
13. Persentase Tunas yang Tumbuh Setelah Aklimatisasi. ... 32 14. Biaya Perbanyakan Pisang secara Kultur Jaringan. ... 34 15. Perbandingan Perbanyakan Tunas secara Konvensional dan
DAFTAR GAMBAR
Nomor Halaman
1. Kontaminasi pada Kultur Pisang Kepok Unti Sayang : (A) dan (B) Kontaminasi Cendawan (Tanda Panah) ... 15 2. Kontaminasi pada Kultur Pisang Kepok Unti Sayang : (A) dan
(B) Kontaminasi Bakteri (Tanda Panah) ... 16
3. Multiplikasi Tunas : (A) Tunas yang Tidak Berkembang pada Media 2 mg/l BAP + 0.8 mg/l TDZ dan (B) Tunas yang Berkembang pada Media Perlakuan 2 mg/l BAP ... 20 4. Laju Multiplikasi pada Media Perlakuan MS + 2 mg/l BAP
sampai Subkultur ke-6 ... 23
5. Laju Multiplikasi pada Media Perlakuan MS + 7 mg/l Kinetin sampai Subkultur ke-6 ... 24
DAFTAR LAMPIRAN
Nomor Halaman
1. Komposisi Media Murashige-Skoog dengan Modifikasi Vitamin B5 ... 41 2. Deskripsi Pisang Kepok Varietas Unti Sayang ... 42
PENDAHULUAN
Latar Belakang
Pisang merupakan komoditi hortikultura yang digemari oleh masyarakat dunia. Rasa buah pisang yang lezat, kandungan gizi yang tinggi dan harganya yang relatif murah menjadi alasan banyak orang yang menyukainya. Peminat buah pisang berasal dari semua kalangan dan semua jenis umur. Buah pisang selain dapat dimakan langsung, dapat juga diolah menjadi berbagai jenis makanan.
Sistem agribisnis buah tropika Indonesia perlu digerakkan agar buah tropika Indonesia dapat memberikan kontribusi dalam pemulihan ekonomi rakyat, dapat memenuhi kebutuhan dalam negeri dan menjadi andalan ekspor. Pisang merupakan salah satu buah yang mempunyai prospek untuk dikembangkan (Megia et al., 2002). Pada beberapa tahun terakhir produksi buah pisang Indonesia mengalami penurunan sebesar 618 460 ton. Produksi buah pisang pada tahun 2009 sebesar 6 373 533 ton dan pada tahun 2010 menjadi 5 755 073 ton (BPS, 2010). Permasalahan utama dalam penurunan produksi pisang adalah tingginya serangan penyakit serta belum diterapkannya prinsip Good Agricultural Practicess (GAP).
Berdasarkan penelitian hasil kerjasama antara PKBT IPB dengan Dinas Pertanian Tanaman Pangan dan Hortikultura serta UPTD BPSBTPH Propinsi Sulawesi Selatan, pada tahun 2009 telah dilepas varietas unggul pisang kepok tanpa bunga jantan dengan nama pisang Unti Sayang. Pisang ini memiliki keunggulan, yaitu terhindar dari penyakit layu bakteri (Blood Disease Bacterial) dan berpotensi sebagai salah satu bahan pangan alternatif. (Suhartanto et al., 2010). Produktivitas pisang Unti Sayang cukup tinggi sebesar 40 ton/ha/tahun (Suhartanto et al., 2010) bila dibandingkan dengan produktivitas pisang kepok pada umumnya sebesar 22 ton/ha/pohon (Redaksi AgroMedia, 2010).
2
kurang efisien karena dalam hidupnya tanaman pisang hanya menghasilkan 5-10 anakan/rumpun/tahun. Alternatif penyediaan bibit dalam waktu singkat, jumlah yang besar dan seragam dapat dilakukan melalui teknik kultur jaringan.
Perbanyakan mikro merupakan contoh dari penerapan kultur jaringan, terutama untuk beberapa jenis tanaman yang biasa diperbanyak secara vegetatif. Perbanyakan mikro, secara umum dapat diartikan sebagai usaha menumbuhkan bagian tanaman dalam media aseptik dan memperbanyaknya hingga menghasilkan tanaman sempurna. Tujuan pokok dari penerapan perbanyakan mikro adalah produksi tanaman dalam jumlah besar dalam waktu yang singkat, terutama untuk varietas-varietas unggul yang baru dihasilkan (Gunawan, 1992).
Subkultur berulang perlu dilakukan untuk mendapatkan bibit yang banyak dalam kurun waktu tertentu. Dengan subkultur juga akan diketahui waktu yang tepat untuk menginisiasi tunas baru. Pada beberapa tanaman yang telah disubkultur beberapa kali, ternyata tidak terjadi penurunan daya tumbuh atau perubahan karakteristik yang diamati (Wetherell, 1982). Daya multiplikasi tunas setelah dilakukan subkultur berulang perlu diketahui bila ingin memproduksi bibit dalam jumlah besar dan kualitas tunasnya terjamin (Wiendi, 1992).
Tujuan
Penelitian ini bertujuan untuk mempelajari pengaruh komposisi media terhadap pertumbuhan tunas in vitro pisang Kepok Unti Sayang dengan subkultur berulang. Dari penelitian ini diharapkan diperoleh komposisi media yang terbaik dan waktu subkultur yang tepat dalam perbanyakan pisang Kepok Unti Sayang.
Hipotesis
1. Terdapat satu komposisi media yang menginduksi multiplikasi tunas in vitro pisang Kepok Unti Sayang terbanyak.
TINJAUAN PUSTAKA
Tanaman Pisang
Pisang termasuk ke dalam famili Musaceae. Famili Musaceae terdiri dari dua genera, yaitu genus Musa dan Ensete. Genus Musa terbagi atas empat kelompok, yaitu Australimusa, Callimusa, Eumusa, dan Rhodochlamys. Kelompok Australimusa dan Eumusa banyak dimanfaatkan untuk buah, serat, dan sayuran sedangkan Callimusa dan Rhodochlamys banyak digunakan sebagai tanaman hias (Simmonds, 1970).
Tanaman pisang merupakan tanaman monokotil herba yang tumbuh di daerah yang beriklim tropis basah, lembab dan panas dengan curah hujan optimum 1 520 - 3 800 mm/tahun (6 bulan basah). Variasi curah hujan harus diimbangi dengan drainase yang baik agar tanah tidak tergenang, karena bisa mematikan tanaman pisang. Pisang juga dapat tumbuh di daerah subtropis. Pada kondisi tanpa air, pisang masih tetap tumbuh karena air disuplai dari bagian batang. Namun, produktivitas pisang tidak optimal (Redaksi AgroMedia, 2010).
Pisang berdasarkan cara makannya dibagi menjadi dua kelompok besar, yaitu pisang meja (banana) yang dapat langsung dimakan dan pisang plantain yang harus diolah terlebih dahulu. Kedua pisang tersebut berasal dari nenek moyang yang berbeda. Pisang meja (banana) turunan dari pisang liar Musa acuminata, sedangkan pisang plantain berasal dari Musa balbisiana. Kultivar
yang sekarang banyak dikenal umumnya merupakan hasil persilangan antara kedua varietas pisang tersebut sehingga bersifat triploid dan tidak menghasilkan biji (partenokarpi). Oleh karena itu perbanyakan pisang dilakukan secara vegetatif, baik dengan anakan maupun dengan mata tunas bonggol atau bit (Samson, 1986).
4
Pertanian Tanaman Pangan dan Hortikultura serta UPTD BPSBTPH Propinsi Sulawesi Selatan. Pisang Kepok Unti Sayang (Lampiran 2.) ini memiliki keunggulan, yaitu terhindar dari penyakit layu bakteri (Blood Disease Bacterial) (Suhartanto et al., 2010).
Teknik Kultur Jaringan
Teknik kultur jaringan adalah teknik mengisolasi bagian-bagian tanaman (sel, protoplasma, tepung sari, ovari, dan sebagainya), ditumbuhkan secara tersendiri, dipacu untuk memperbanyak diri, akhirnya diregenerasikan kembali menjadi tanaman lengkap dalam suatu lingkungan yang aseptik dan terkendali dalam medium padat atau cair dan dapat menghasilkan tanaman baru dalam jumlah yang banyak dalam waktu yang relatif singkat serta dapat memproduksi tanaman bebas penyakit (Hartmann et al., 1990; Gunawan, 1992; Hendaryono dan Wijayani, 1994; George et al., 2008). Konsep yang mendasari kultur jaringan adalah teori totipotensi. Totipotensi merupakan kemampuan sel untuk membentuk tanaman lengkap bila berada dalam lingkungan yang sesuai, karena di dalam masing-masing sel tumbuhan mengandung informasi genetik yang lengkap (Wetherell, 1982).
Planlet in vitro dalam perkembangannya dapat dibagi menjadi tiga tahap utama. Tahap I disebut tahap persiapan eksplan. Pada tahap I, dilakukan pemilihan bagian tanaman yang cocok kemudian ditanam pada media kultur. Hampir semua jaringan atau organ tanaman dapat digunakan sebagai eksplan, namun tingkat keberhasilan yang diperoleh tergantung pada sistem kultur yang digunakan, spesies yang digunakan, dan sterilisasi eksplan (Wetherell, 1982; Torres, 1989; George et al., 2008).
dan kondisi pertumbuhan. Beberapa macam kultur umumnya dapat disubkultur setiap 4-8 minggu. Subkultur yang dianjurkan paling banyak 3-6 kali. Aturan yang dapat dipakai untuk menghentikan subkultur adalah setelah terjadi perubahan-perubahan morfologis yang tidak dikehendaki atau setelah kekuatan tumbuh kultur menurun (Wetherell, 1982). Daya multiplikasi tunas setelah dilakukan subkultur berulang perlu diketahui bila ingin memproduksi bibit dalam jumlah besar dan kualitas tunasnya terjamin. Daya multiplikasi tunas pisang Tanduk saat disubkultur cenderung meningkat sampai subkultur kedua (Wiendi, 1992). Kasutjianingati (2004) melaporkan, pada pisang Mas, Ambon Kuning, Tanduk, Rajabulu dan Kepok Kuning total tunas meningkat setelah subkultur kedua. Selanjutnya dilaporkan, pada pisang Rajabulu dan Tanduk total tunas meningkat setelah enam kali subkultur (Kasutjianingati, 2011).
Planlet yang dihasilkan setelah beberapa kali subkultur dapat ditransfer ke tahap III. Tahap III adalah tahap pendewasaan. Planlet dirangsang untuk membentuk akar dan mempersiapkan planlet untuk tumbuh secara in vivo. Respon tunas dan pembentukan akar terhadap auksin berbeda-beda pada setiap spesies (Wetherell, 1982; Torres, 1989).
6
Zat Pengatur Tumbuh
Dalam kultur jaringan, dua golongan zat pengatur tumbuh yang sangat penting adalah sitokinin dan auksin. Zat pengatur tumbuh ini mempengaruhi pertumbuhan dan morfogenesis dalam kultur sel, jaringan dan organ (Torres, 1989; Gunawan, 1992; George et al., 2008). Interaksi dan perimbangan antara zat pengatur tumbuh yang diberikan dalam media dan yang diproduksi oleh sel secara endogen serta jenis spesies dan kultivar, menentukan arah perkembangan suatu kultur (Torres, 1989; Gunawan, 1992).
Golongan sitokinin adalah turunan dari adenin. Golongan ini sangat penting dalam pengaturan pembelahan sel, proliferasi tunas ketiak, morfogenesis dan menghambat pembentukan akar (Torres, 1989; Wattimena, 1988; Gunawan,
1992). Jenis sitokinin yang sering digunakan adalah BAP (6-benzyl amino purine), kinetin, dan TDZ (thidiazuron). Pada Musa spp.
sitokinin tinggi merangsang pembelahan sel, mendorong proliferasi tunas dan diferensiasi tunas adventif (Shirani et al., 2009).
Pada pisang Mas, pisang Ambon Kuning, dan pisang Tanduk berturut-turtut menghasilkan 10.1, 13 dan 4 tunas per eksplan dengan pemberian 2 mg/l BAP pada subkultur kedua. Pada pisang Kepok Kuning dan pisang Rajabulu, laju multiplikasi mencapai 8.3 dan 5.5 tunas per eksplan dengan pemberian 5 mg/l BAP pada subkultur kedua (Kasutjianingati, 2004). Pemberian 0.09 mg/l thidiazuron pada pisang Rajabulu menghasilkan 18.3 tunas per eksplan
dibandingkan dengan tanpa thidiazuron hanya 11.1 tunas per eksplan pada subkultur ke-6, sedangkan pada pisang Tanduk 109.3 tunas per eksplan dibandingkan dengan tanpa thidiazuron hanya 30.1 tunas per eksplan (Kasutjianingati, 2011). Pada pisang Abaca, pemberian 7 ppm kinetin memberi pengaruh paling baik terhadap jumlah dan tinggi tunas berturut-turut 9 tunas per eksplan dan 2.76 cm (Avivi dan Ikrarwati, 2004). Pada pisang Dwarf Cavendish kultivar Basrai, pemberian 5 mg/l BAP menghasilkan 124 tunas per eksplan setelah lima kali subkultur (Muhammad et al., 2004).
merangsang pertumbuhan akar (Wattimena, 1988; Gunawan, 1992; Wiendi et al., 1992; George et al., 2008). Pemilihan jenis auksin dan konsentrasinya, tergantung dari tipe pertumbuhan yang dikehendaki, level auksin endogen, kemampuan jaringan mensintesa auksin dan interaksi golongan zat pengatur tumbuh lain yang ditambahkan akar (Gunawan, 1992; George et al., 2008).
Jenis auksin yang sering digunakan adalah IAA ( Indole-3-acetic acid);
IBA (Indole-3-butyric acid); NAA (1-naphthylacetic acid) dan 2,4-D (2,4-dichlorophenoxyacetic acid) (Wattimena, 1988; Torres, 1989; Gunawan,
BAHAN DAN METODE
Tempat dan Waktu
Penelitian dilaksanakan di Laboratorium Kultur Jaringan Tanaman, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian berlangsung dari bulan Februari sampai dengan September 2011.
Bahan dan Alat
Bahan tanam yang digunakan adalah tunas mikro pisang Kepok varietas Unti Sayang. Media dasar yang digunakan yaitu dari komposisi Murashige dan Skoog (MS) dengan modifikasi vitamin B5 (Lampiran 1.). Bahan pemadat yang digunakan adalah agar-agar. Zat pengatur tumbuh yang digunakan antara lain sitokinin (BAP, thidiazuron, dan kinetin) dan auksin (IBA). Bahan untuk mengatur pH yaitu larutan HCl 1 N dan KOH 1 N. Bahan-bahan yang digunakan untuk sterilisasi antara lain natrium hipoklorit dan alkohol. Bahan penutup botol yaitu plastik dan karet gelang. Bahan-bahan lain yang digunakan antara lain spiritus, tisu, korek api dan aquadestilata.
Alat-alat yang digunakan dalam membuat media yaitu labu takar, gelas ukur, pipet, timbangan, magnetic stirrer, dan pH meter. Alat untuk sterilisasi botol dan media yaitu autoclave. Alat-alat yang digunakan ketika menanam antara lain pinset, gunting, scalpel, bunsen, botol semprot, cawan petri, dan Laminar Air Flow Cabinet (LAFC).
Metode Penelitian
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) yang disusun dalam faktor tunggal, yaitu komposisi media. Terdapat 4 perlakuan komposisi media, yaitu media MS dengan penambahan 2 mg/l BAP + 0.8 mg/l thidiazuron (M1), media MS dengan penambahan 2 mg/l BAP (M2), media MS
percobaan. Setiap satu satuan percobaan terdiri atas 20 botol kultur. Setiap botol kultur ditanamn satu tunas mikro.
Setelah tanaman berumur 3 minggu, dilakukan subkultur ke media yang sama. Subkultur dilakukan sebanyak 6 kali. Setiap 3 minggu sekali, satu satuan pengamatan diakarkan pada media ½ MS dengan penambahan 0.5 mg/l IBA.
Model aditif linier yang digunakan sebagai berikut : Yij= μ + τi +εij
Keterangan :
Yij = nilai pengamatan pengaruh faktor komposisi media ke-i, dan ulangan ke-j μ = rataan umum
τi = pengaruh komposisi media ke-i
εij = pengaruh acak pada perlakuan komposisi media ke-i dan ulangan ke-j Pengolahan data untuk setiap peubah yang diamati dilakukan dengan menggunakan uji F pada sistem SAS (Statistical Analysis System). Perlakuan yang berpengaruh nyata pada uji F dilakukan uji lanjut menggunakan Beda Nyata Jujur (BNJ) pada taraf 5 %.
Pelaksanaan Penelitian
Persiapan Alat
Alat yang digunakan dalam pembuatan media dan penanaman eksplan harus dalam keadaan steril. Semua peralatan yang digunakan dalam pembuatan media dan penanaman dicuci dengan deterjen sampai bersih. Alat tanam seperti pinset, gunting, cawan petri, dan gagang scalpel dibungkus dengan kertas terlebih dahulu, kemudian bersama dengan botol kultur disterilkan ke dalam autoclave pada suhu 121° C dengan tekanan 17.5 psi (pound per square inch) selama 60 menit.
Pembuatan Media
10
tumbuh sesuai dengan perlakuan. Larutan media tersebut ditambah aquades hingga mencapai satu liter. Selanjutnya, dilakukan pengukuran pH media dengan pH meter hingga mencapai pH 5.9 menggunakan HCl 1 N dan KOH 1 N. Selanjutnya media ditambahkan 7 g/l agar-agar dan dimasak hingga mendidih. Setelah mendidih media dimasukkan ke dalam botol kultur steril sebanyak 25 ml/botol. Botol kultur ditutup dengan plastik bening dan karet. Botol kultur yang telah berisi media dan ditutup rapat di autoclave selama 20 menit. Media yang sudah di autoclave disimpan di ruang penyimpanan media.
Persiapan Bahan Tanam
Bahan tanam yang digunakan adalah tunas in vitro pisang Kepok Unti Sayang. Tunas pisang diperoleh dari Laboratorium Kultur Jaringan Pusat Kajian Buah-buahan Tropika. Pada saat inisiasi eksplan ditanam pada media MS dengan penambahan 2 mg/l BAP + 0.8 mg/l thidiazuron. Planlet kemudian di subkultur pada media MS tanpa penambahan zat pengatur tumbuh selama 2 bulan untuk menghilangkan pengaruh perlakuan zat pengatur tumbuh sebelumnya.
Penanaman
Penanaman eksplan dilakukan di dalam Laminar Air Flow Cabinet (LAFC) yang telah disterilkan dengan menyalakan lampu UV (ultra violet) selama satu jam dan menyemprot dinding LAFC menggunakan alkohol 70% sebelum digunakan. Semua alat yang digunakan dalam penanaman disemprot dengan alkohol 70% terlebih dulu sebelum masuk ke dalam LAFC.
Subkultur
Pada tahap ini semua tunas yang telah terbentuk baik yang bermultiplikasi ataupun yang tidak dipisah-pisahkan satu-satu dan ditanam satu botol satu tunas. Subkultur dilakukan setiap 3 minggu sekali sebanyak 6 kali. Tunas yang terbentuk pada semua satuan pengamatan disubkultur ke media yang sama dengan media sebelumnya. Setiap kali subkultur dilakukan pengukuran tinggi tunas. Tunas yang berasal dari setiap satuan pengamatan yang sama diberi kode untuk mengetahui pertumbuhan tunas pada masing-masing botol.
Pengakaran
Setiap 3 minggu sekali, satu satuan pengamatan dari semua media perlakuan diakarkan pada media ½ MS dengan penambahan 0.5 mg/l IBA. Selama 6 kali subkultur, jumlah tunas yang diakarkan sebanyak 48 satuan pengamatan. Tunas yang diakarkan adalah tunas yang tidak berproliferasi dan yang mengalami kontaminasi. Pengakaran ini berlangsung selama 3 minggu.
Aklimatisasi
Tanaman sempurna (planlet) yang diperoleh setelah diakarkan pada media pengakaran selanjutnya diaklimatisasi. Aklimatisasi dilakukan pada medium arang sekam dan cocopeat dengan perbandingan 1:1 (v/v). Planlet dikeluarkan dari botol kultur kemudian dicuci bersih dengan air matang. Pencucian berfungsi untuk menghilangkan agar-agar yang menempel. Sebelum ditanam, tanaman direndam dalam larutan fungisida (2 g/l) untuk menghindari serangan cendawan.
Tanaman ditanam pada kotak plastik yang telah terisi media yang sebelumnya telah dilembabkan. Kotak plastik ditutup dengan plastik transparan yang bertujuan untuk menjaga kelembaban sehingga tanaman tidak banyak kehilangan air akibat transpirasi.
12
Pengamatan
Pengamatan dilakukan setiap minggu selama 7 bulan dengan peubah yang diamati antara lain :
1. Jumlah tunas
Jumlah tunas dihitung dari banyaknya tunas yang tumbuh pada setiap eksplan.
2. Persentase kultur yang bermultiplikasi
Persentase kultur yang bermultiplikasi dihitung dengan cara membandingkan jumlah kultur yang bermultiplikasi dengan jumlah kultur yang ditanam dikalikan 100%.
3. Laju multiplikasi
Laju multiplikasi dihitung dengan melihat pertambahan tunas yang terjadi setiap subkultur.
4. Warna tunas
Warna tunas diamati dengan cara membandingkan warna pada setiap tunas dengan indikator warna yang dibuat menyerupai bagan warna daun pada padi dengan menggunakan cat air.
5. Jumlah daun
Jumlah daun yang dihitung adalah daun yang telah terbuka penuh, dihitung dari daun paling bawah sampai dengan daun paling atas.
6. Tinggi tunas
Tinggi tunas diukur dengan mengeluarkan tanaman dari botol. Kemudian diletakkan pada cawan petri. Agar yang menempel pada tunas dibersihkan. Tinggi tunas diukur hingga ujung daun terpanjang. Pengukuran tinggi tunas dilakukan setiap tiga minggu sekali.
7. Waktu terbentuknya akar
Waktu terbentuknya akar dicatat saat pertama kali kultur membentuk akar. 8. Persentase kultur berakar
9. Jumlah akar
Jumlah akar yang dihitung adalah seluruh akar yang muncul dari tunas, dari akar yang baru muncul sampai dengan akar yang sudah tua.
10.Persentase planlet yang berhasil diaklimatisasi
Persentase planlet yang berhasil diaklimatisasi dihitung dengan cara membandingkan jumlah planlet yang hidup atau tetap tumbuh dengan jumlah planlet yang diaklimatisasi dikalikan 100%.
11.Persentase kontaminasi
HASIL DAN PEMBAHASAN
Keadaan kultur pada minggu pertama setelah tanam secara keseluruhan dapat tumbuh dengan baik dilihat adanya tunas yang bermultiplikasi pada semua media perlakuan. Setiap tiga minggu sekali eksplan disubkultur. Eksplan yang berproliferasi maupun yang tidak, dipindahkan pada media baru yang konsentrasinya sama dengan media sebelumnya.
Kontaminasi terjadi mulai dari minggu pertama setelah tanam. Pada 1 MST (minggu sebelum subkultur), kontaminasi terbesar disebabkan oleh cendawan. Setelah 4 MST (setelah subkultur ke-1), kontaminasi terbesar disebabkan oleh bakteri. Kontaminasi terjadi pada semua perlakuan. Kontaminasi yang terjadi tidak berpengaruh terhadap daya proliferasi eksplan. Hal ini dilihat dari peningkatan jumlah tunas yang dihasilkan setiap kali subkultur. Jumlah kultur yang dihasilkan setelah 6 kali subkultur sebanyak 1095 satuan pengamatan.
Perkembangan kultur adalah terjadinya multiplikasi tunas pada semua perlakuan. Tunas membentuk akar pada beberapa media perlakuan. Tunas pada media pengakaran dapat membentuk akar pada perlakuan media MS + 2 mg/l BAP, media MS + 5 mg/l BAP, dan media MS + 7 mg/l kinetin. Respon pertumbuhan tunas pada tahap aklimatisasi dengan persentase tumbuh mencapai 96.67% hingga akhir pengamatan.
Kontaminasi
Kontaminasi pada kultur jaringan dapat berasal dari eksplan (baik eksternal maupun internal), organisme kecil yang masuk ke dalam media, botol kultur atau alat-alat tanam yang kurang steril, lingkungan kerja dan ruang kultur yang kotor serta kecerobohan dalam pelaksanaan (Gunawan, 1992). Pada kultur in vitro, eksplan sangat rentan terserang cendawan maupun bakteri. Kontaminasi
Pada Gambar 1(A) hifa cendawan mulai tumbuh dari pinggir botol, diduga cendawan berkembang akibat botol kultur yang tidak tercuci dengan baik. Eksplan pada Gambar 1(A) belum terkena cendawan, eksplan tersebut dapat diselamatkan dengan memindahkan ke media yang baru dengan terlebih dahulu eksplan disterilisasi dengan natrium hipoklorit dengan konsentrasi 5 % selama 5 menit. Pada Gambar 1(B) hifa telah menutupi eksplan. Sterilisasi eksplan dapat dilakukan namun, pada 1 MST cendawan akan muncul kembali, pada kasus ini eksplan tidak dapat diselamatkan.
Gambar 1. Kontaminasi pada Kultur Pisang Kepok Unti Sayang : (A) dan (B) Kontaminasi oleh Cendawan (Tanda Panah).
Persentase rata-rata eksplan terkontaminasi cendawan tertinggi pada minggu sebelum subkultur terjadi pada perlakuan media MS + 5 mg/l BAP sebesar 6.28 %. Perlakuan yang paling banyak terkontaminasi cendawan pada subkultur ke-1, ke-2 dan ke-3, adalah perlakuan media MS + 2 mg/l BAP + 0.8 mg/l thidiazuron bila dibandingkan dengan perlakuan lainnya. Kontaminasi cendawan hingga akhir subkultur masih tetap terjadi. Pada subkultur ke-5 dan ke-6 tingkat kontaminasi cendawan berkurang (Tabel 1).
Kontaminan yang dominan menyerang eksplan adalah bakteri. Bakteri tersebut diduga berasal dari eksplan itu sendiri atau berasal dari alat tanam yang tidak steril. Pada Gambar 2(A) menunjukkan bahwa bakteri berkembang disekeliling botol dan tidak mengenai eksplan. Penyelamatan eksplan dilakukan dengan memindahkan eksplan ke media baru.
16
Tabel 1. Persentase Rata-rata Kultur Pisang Kepok Unti Sayang Terkontaminasi Cendawan.
Subkultur ke- Perlakuan
M1 M2 M3 M4
………%……….
0 0.84 0 6.28 0
1 6.59 0.64 0 1.08
2 6.16 1.32 0.96 3.91
3 7.15 0.77 4.85 3.13
4 0 1.86 2.64 1.45
5 0.49 3.11 1.19 0.75
6 0 2.71 4.5 3.63
Keterangan: M1 = 2 mg/l BAP + 0.8 mg/l TDZ; M2 = 2 mg/l BAP M3 = 5 mg/l BAP; M4 = 7 mg/l kinetin
Bakteri pada Gambar 2(B) telah menutupi permukaan media, terlihat pada gambar bahwa bakteri berasal dari bawah eksplan. Sterilisasi yang dilakukan pada eksplan yang terkontaminasi bakteri tidak benar-benar menghilangkan bakteri. Eksplan yang telah disterilisasi, saat 1 MST bakteri akan muncul kembali. Bakteri tidak sepenuhnya dapat dihilangkan karena berasal dari jaringan eksplan. Kontaminasi bakteri biasanya terbawa dari eksplan dengan karakteristik seperti lapisan lendir dan memiliki beberapa warna seperti putih, pink, kuning, dan cream (Wattimena et al., 1986; Evans et al., 2003).
Gambar 2. Kontaminasi pada Kultur Pisang Kepok Unti Sayang : (A) dan (B) Kontaminasi oleh Bakteri (Tanda Panah).
Pada subkultur ke-6 terjadi peningkatan jumlah eksplan yang terkontaminasi pada semua perlakuan. Menurut Wetherell (1982), kontaminasi cenderung muncul setelah dilakukan subkultur. Pada perlakuan media MS + 2 mg/l BAP + 0.8 mg/l thidiazuron jumlah eksplan yang terkontaminasi sebesar 35.56%, pada perlakuan media MS + 2 mg/l BAP sebesar 60.2%, pada perlakuan media MS + 5 mg/l BAP sebesar 29.39% dan yang tertinggi pada perlakuan media MS + 7 mg/l kinetin sebesar 87.6% pada subkultur ke-6 (Tabel 2.). Peningkatan eksplan yang tekontaminasi bakteri diduga akibat alat tanam yang tidak steril. Beberapa bakteri tahan terhadap panas. Proses sterilisasi alat tanam dengan autoclave tidak menghilangkan bakteri. Pada saat penanaman, kontaminan berupa
bakteri berpindah ke eksplan. Media kultur jaringan kaya akan nutrisi yang merupakan sumber makanan yang baik untuk bakteri dan fungi (Wetherell, 1982). Sumber kontaminasi bakteri yang terjadi merupakan kontaminasi laten. Kontaminasi laten berasal dari bakteri endogenous pada jaringan eksplan yang tumbuh dan berkembang selama inisiasi kultur. Bakteri laten mudah berpindah saat proses subkultur tanaman in vitro (Evans et al., 2003). Semakin lama periode subkultur, akumulasi nutrisi pada eksplan tinggi sehingga bakteri tumbuh dengan lebih cepat.
Tabel 2. Persentase Rata-rata Kultur Pisang Kepok Unti Sayang Terkontaminasi Bakteri.
Subkultur ke- Perlakuan
M1 M2 M3 M4
………%……….
0 2.5 3.34 0 0
1 8.17 13.75 7.69 14.52
2 10.28 18.71 18.44 15.01
3 11.13 25.03 14.51 17.14
4 5.27 18.89 12.14 16.04
5 5.84 14.5 7.31 14.33
6 35.56 60.2 29.39 87.6
18
Jumlah Tunas
Multiplikasi tunas terjadi pada semua media perlakuan. Multiplikasi tunas terjadi secara langsung tanpa melalui tahap kalus. Hal yang sama juga terjadi pada multiplikasi tunas pada pisang tanduk (Wiendi, 1992).
Pada perlakuan media MS + 2 mg/l BAP dan media MS + 7 mg/l kinetin terjadi peningkatan jumlah kultur yang bermultiplikasi setiap periode subkultur (Tabel 3.). Peningkatan jumlah kultur bermultiplikasi berbanding lurus dengan jumlah tunas yang dihasilkan. Semakin meningkatnya periode subkultur, sitokinin yang terkandung dalam eksplan semakin tinggi. Akumulasi sitokinin yang tinggi merangsang kultur bermultiplikasi. Jumlah kultur bermultiplikasi meningkat seiring dengan meningkatnya periode subkultur. Jumlah kultur bermultiplikasi tertinggi adalah perlakuan media MS + 2 mg/l BAP sebanyak 131 kultur pada subkultur ke-6 (Tabel 3.). Pada pisang Tanduk, pemberian 5, 10, 20, 25 g/l zeolit ditambahkan 20% air kelapa dan 5, 10 g/l zeolit ditambahkan 30% air kelapa meningkatkan jumlah kultur bermultiplikasi setelah dua kali subkultur (Wiendi, 1992).
Tabel 3. Persentase Kultur Bermultiplikasi pada Pisang Kepok Unti Sayang sampai Subkultur ke-6.
Subkultur ke- Perlakuan
M1 M2 M3 M4
.…….………%………
(x/y) (x/y) (x/y) (x/y)
0 10 (4/40) 25.64 (10/39) 27.27 (9/33) 25 (10/40) 1 15.79 (6/38) 16.48 (16/48) 43.4 (23/53) 48.28 (28/58) 2 3.33 (1/30) 45.83 (33/72) 26.44 (23/87) 30.19 (32/106) 3 30 (6/20) 52.89 (64/121) 41.11 (37/90) 39.2 (49/125) 4 23.33 (7/30) 37.72 (86/228) 37.69 (49/130) 34.46 (61/177) 5 40.91 (18/44) 30.14 (104/345) 39.78 (72/181) 30.94 (82/265) 6 11.43 (8/70) 31.95 (131/410) 20.78 (64/308) 26.68 (91/341)
Keterangan: M1 = 2 mg/l BAP + 0.8 mg/l TDZ; M2 = 2 mg/l BAP M3 = 5 mg/l BAP; M4 = 7 mg/l kinetin
x : jumlah kultur yang bermultiplikasi; y : jumlah tanaman yang ditanam
[image:30.595.86.522.73.823.2]pemberian 1, 2, 3, 4 mg/l BAP tidak meningkatkan rata-rata jumlah tunas setelah tujuh kali subkultur (Andriana, 2005).
Semakin lama periode subkultur, pada semua perlakuan menunjukkan rata-rata jumlah tunas semakin meningkat (Tabel 4.). Hal ini akibat dari akumulasi sitokinin. Daya multiplikasi pada 5 kultivar pisang meningkat secara bertahap sesuai dengan tingkatan subkultur, walaupun terdapat variasi dalam proliferasi di antara kultivar pisang (Kasutjianingati, 2004). Peningkatan jumlah tunas juga terjadi pada pisang Dwarf Cavendish kultivar Basrai setelah lima kali subkultur (Muhammad et al., 2004). Pada pisang Rajabulu dan Tanduk terjadi peningkatan total tunas setelah enam kali subkultur (Kasutjianingati, 2011).
Hasil Pengamatan pada subkultur ke-6 rata-rata jumlah tunas terendah terjadi pada perlakuan media MS + 2 mg/l BAP + 0.8 mg/l thidiazuron sebanyak 5.98 tunas (Tabel 4.). Eksplan yang ditanam pada media MS + 2 mg/l BAP + 0.8 mg/l thidiazuron, pada perkembangannya lebih banyak membentuk bulatan-bulatan putih seperti yang terlihat pada Gambar 3(A). Hal yang sama juga dilaporkan oleh Wiendi (1992). Kasutjianingati (2004) melaporkan bahwa, dari 5 kultivar pisang yang telah diteliti, ternyata hanya pisang Tanduk yang membentuk bulatan-bulatan putih. Semakin tinggi BAP yang diberikan jumlah bulatan-bulatan putih yang dihasilkan semakin meningkat. Hingga akhir pengamatan, bulatan-bulatan putih tersebut tidak berkembang menjadi tunas yang sempurna. Hal ini berbeda dengan penelitian Wiendi (1992) bahwa multiplikasi tunas yang diawali dengan terbentuknya bulatan-bulatan putih, selanjutnya akan membentuk daun dari masing-masing bulatan sehingga terbentuk tunas yang sempurna. Semakin meningkatnya konsentrasi thidiazuron yang diberikan akan menghambat pemanjangan tunas pada pisang kultivar Kibuzi, Bwara dan Ndiziwemiti (Arinaitwe et al., 2000). Pada pisang Cavendish, pemberian 0.2 mg/l thidiazuron menghambat pemanjangan tunas dan pemberian 2 mg/l thidiazuron
pertumbuhan tunas terhambat dan terbentuk bulatan-bulatan pada dasar tunas. Pertumbuhan tunas akan kembali normal setelah dilakukan satu atau dua kali subkultur ke media dengan penambahan BA (Sin, 2005).
20
menghasilkan tunas yang sempurna. Rata-rata jumlah tunas tertinggi dihasilkan pada perlakuan media MS + 2 mg/l BAP sebanyak 39.8 tunas pada subkultur ke-6 (Tabel 4.). Pada pisang Kepok Kuning, pemberian 2 mg/l BAP menghasilkan total tunas sebanyak 12.6 tunas pada subkultur ke-2. Bila dibandingkan rata-rata jumlah tunas pada pisang Kepok Unti Sayang dengan pisang Kepok Kuning, dalam satu tahun rata-rata jumlah tunas yang dihasilkan pisang Unti Sayang sebanyak 115 tunas dan pisang Kepok Kuning sebanyak 81.9 tunas. Rata-rata jumlah tunas yang dihasilkan pisang Kepok Unti Sayang dalam satu tahun lebih banyak dari pisang Kepok kuning.
Pada subkultur ke-2 pisang Kepok Kuning menghasilkan rata-rata tunas sebanyak 12.6 sedangkan pada pisang Kepok Unti Sayang hanya menghasilkan rata-rata tunas sebanyak 3.5 tunas. Diduga rendahnya jumlah tunas yang dihasilkan pisang Kepok Unti Sayang pada subkultur ke-2 akibat perbedaan waktu dilakukannya subkultur. Pada pisang Kepok Unti Sayang, subkultur dilakukan setiap 3 minggu sekali sedangkan pada pisang Kepok Kuning setiap 4-8 minggu sekali. Perbedaan waktu satu minggu sangat membedakan jumlah tunas yang dihasilkan. Apabila dengan waktu subkultur yang sama, sangat mungkin rata-rata jumlah tunas yang dihasilkan antara kedua jenis pisang Kepok tersebut sama.
Gambar 3. Multiplikasi Tunas : (A) Tunas yang Tidak Berkembang pada Media Perlakuan 2 mg/l BAP + 0.8 mg/l TDZ dan (B) Tunas yang Berkembang pada Media Perlakuan 2 mg/l BAP.
Multiplikasi pisang Kepok Kuning tertinggi terjadi pada pemberian 8 mg/l BAP, tetapi umumnya menunjukkan pertumbuhan dan perkembangan tunas yang kurang normal, daun roset dan berwarna kuning (Kasutjianingati,
2004). Pemberian BAP dengan konsentrasi yang tinggi menyebabkan tunas tumbuh tidak normal (Jafari et al., 2011).
Perlakuan media MS + 5 mg/l BAP menghasilkan rata-rata 21.6 tunas pada subkultur ke-6 (Tabel 4.). Pemberian 5 mg/l BAP pada pisang Kepok Kuning menghasilkan total tunas 14.8 tunas pada subkultur kedua (Kasutjianingati, 2004). Perlakuan media MS + 7 mg/l kinetin menghasilkan rata-rata jumlah tunas sebanyak 22.2 tunas pada subkultur ke-6 (Tabel 4.). Berdasarkan laporan hasil penelitian, pemberian 7 mg/l kinetin pada pisang Abaca mampu menghasilkan total tunas 9 tunas (Avivi dan Ikrarwati, 2004). Peningkatan konsentrasi kinetin akan meningkatkan jumlah tunas hingga level tertentu pada pisang Basrai, apabila melebihi level tersebut penggandaan tunas akan menurun. Hal tersebut mengindikasikan terjadi kejenuhan konsentrasi kinetin (Muhammad et al., 2007).
Tabel 4. Rata-rata Jumlah Tunas pada Pisang Kepok Unti Sayang sampai Subkultur ke-6.
Perlakuan Jumlah Tunas
Sk0 Sk1 Sk2 Sk3 Sk4 Sk5 Sk6
M1 1.1 1.3b 1.4 1.6 2.5 4.1 6
M2 1.2 2ab 3.5 7.1 14.2 18.6 39.8 M3 1.5 2.6ab 4.2 5.9 10.1 17 21.6
M4 1.3 2.9a 4.2 6 11 15.6 22.2
Uji F tn * tn tn tn tn tn
KK (%) 8.85 17.11 34.88 50.17 62.74 60.51 58.52
Keterangan : Angka yang diikuti dengan huruf yang sama pada kolom yang sama menunjukan tidak berbeda nyata menurut uji BNJ taraf 5%.
tn = Tidak berbeda nyata pada uji F dengan taraf 5% * = Berbeda nyata pada uji F dengan taraf 5 % KK = Koefisien Keragaman; Sk = Subkultur
M1 = 2 mg/l BAP + 0.8 mg/l TDZ; M2 = 2 mg/l BAP M3 = 5 mg/l BAP; M4 = 7 mg/l kinetin
[image:33.595.82.515.47.838.2]22
dimana semakin meningkatnya frekuensi subkultur laju multiplikasi tunas semakin meningkat. Pada perlakuan media MS + 2 mg/l BAP terjadi penurunan laju multiplikasi setelah subkultur ke-4. Penurunan laju multiplikasi diduga akibat akumulasi sitokinin. Tingginya sitokinin yang diberikan menghambat proliferasi tunas. Penentu utama proliferasi adalah level auksin dan sitokinin endogen dari masing-masing jenis eksplan (Zaffari et al., 2000; Shirani et al. 2009). Pemberian BAP melebihi 6 mg/l akan menurunkan multiplikasi tunas pada pisang Basrai (Muhammad et al., 2007). Multiplikasi tunas akan menurun dengan pemberian sitokinin dalam konsentrasi tinggi 10-15 mg/l pada 8 kultivar pisang (Wong, 1986). BAP dengan konsentrasi yang tinggi menyebabkan tunas tumbuh tidak normal. Penurunan konsentrasi BAP pada tahap proliferasi akan menurunkan jumlah tunas yang tidak berkembang (Jafari et al., 2011).
Tabel 5. Rata-rata Laju Multiplikasi Tunas pada Pisang Kepok Unti Sayang sampai Subkultur ke-6.
Perlakuan Laju Multiplikasi
Sk1 Sk2 Sk3 Sk4 Sk5 Sk6
M1 0.3c 0 0.6 1 1.7 2
M2 0.6bc 1.9 4.3 7.5 3.5 5.5
M3 1.5ab 1.8 2 4.2 6.2 4.3
M4 1.8a 1.2 1.6 5.9 5.8 6.2
Uji F * tn tn tn tn tn
KK (%) 26.12 85.75 75.86 87.88 75.85 123.71
Keterangan : Angka yang diikuti dengan huruf yang sama pada kolom yang sama menunjukan tidak berbeda nyata menurut uji BNJ taraf 5%.
tn = Tidak berbeda nyata pada uji F dengan taraf 5% * = Berbeda nyata pada uji F dengan taraf 5 % KK = Koefisien Keragaman; Sk = Subkultur
M1 = 2 mg/l BAP + 0.8 mg/l TDZ; M2 = 2 mg/l BAP M3 = 5 mg/l BAP; M4 = 7 mg/l kinetin
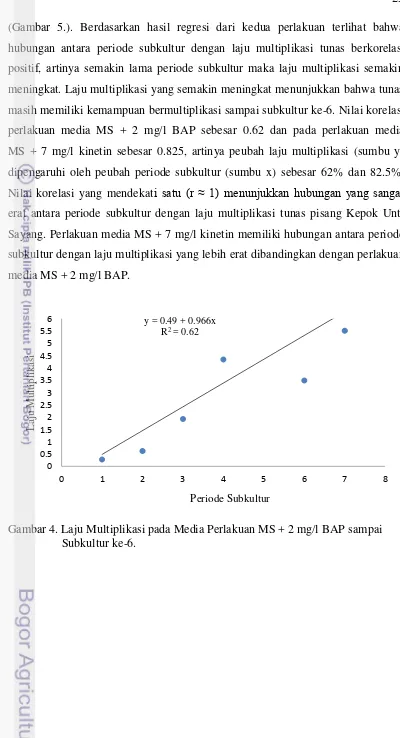
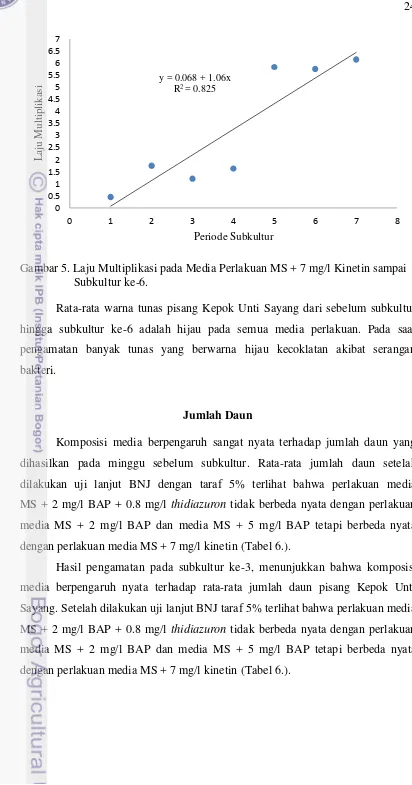
(Gambar 5.). Berdasarkan hasil regresi dari kedua perlakuan terlihat bahwa hubungan antara periode subkultur dengan laju multiplikasi tunas berkorelasi positif, artinya semakin lama periode subkultur maka laju multiplikasi semakin meningkat. Laju multiplikasi yang semakin meningkat menunjukkan bahwa tunas masih memiliki kemampuan bermultiplikasi sampai subkultur ke-6. Nilai korelasi perlakuan media MS + 2 mg/l BAP sebesar 0.62 dan pada perlakuan media MS + 7 mg/l kinetin sebesar 0.825, artinya peubah laju multiplikasi (sumbu y) dipengaruhi oleh peubah periode subkultur (sumbu x) sebesar 62% dan 82.5%. Nilai korelasi yang mendekati satu (r ≈ 1) menunjukkan hubungan yang sangat erat antara periode subkultur dengan laju multiplikasi tunas pisang Kepok Unti Sayang. Perlakuan media MS + 7 mg/l kinetin memiliki hubungan antara periode subkultur dengan laju multiplikasi yang lebih erat dibandingkan dengan perlakuan media MS + 2 mg/l BAP.
Gambar 4. Laju Multiplikasi pada Media Perlakuan MS + 2 mg/l BAP sampai Subkultur ke-6.
0 0.5 1 1.5 2 2.5
3
3.5 4 4.5 5 5.5 6
0 1 2 3 4 5 6 7 8
L
aj
u
Mu
lt
ip
li
k
as
i
Periode Subkultur
24
Gambar 5. Laju Multiplikasi pada Media Perlakuan MS + 7 mg/l Kinetin sampai Subkultur ke-6.
Rata-rata warna tunas pisang Kepok Unti Sayang dari sebelum subkultur hingga subkultur ke-6 adalah hijau pada semua media perlakuan. Pada saat pengamatan banyak tunas yang berwarna hijau kecoklatan akibat serangan bakteri.
Jumlah Daun
Komposisi media berpengaruh sangat nyata terhadap jumlah daun yang dihasilkan pada minggu sebelum subkultur. Rata-rata jumlah daun setelah dilakukan uji lanjut BNJ dengan taraf 5% terlihat bahwa perlakuan media MS + 2 mg/l BAP + 0.8 mg/l thidiazuron tidak berbeda nyata dengan perlakuan media MS + 2 mg/l BAP dan media MS + 5 mg/l BAP tetapi berbeda nyata dengan perlakuan media MS + 7 mg/l kinetin (Tabel 6.).
Hasil pengamatan pada subkultur ke-3, menunjukkan bahwa komposisi media berpengaruh nyata terhadap rata-rata jumlah daun pisang Kepok Unti Sayang. Setelah dilakukan uji lanjut BNJ taraf 5% terlihat bahwa perlakuan media MS + 2 mg/l BAP + 0.8 mg/l thidiazuron tidak berbeda nyata dengan perlakuan media MS + 2 mg/l BAP dan media MS + 5 mg/l BAP tetapi berbeda nyata dengan perlakuan media MS + 7 mg/l kinetin (Tabel 6.).
0 0.5 1 1.5 2 2.5 3 3.5 4 4.5 5 5.5 6 6.5 7
0 1 2 3 4 5 6 7 8
L aj u Mu lt ip li k as i Periode Subkultur
Tabel 6. Rata-Rata Jumlah Daun pada Pisang Kepok Unti Sayang sampai Subkultur ke-6.
Perlakuan Jumlah Daun
Sk0 Sk1 Sk2 Sk3 Sk4 Sk5 Sk6 ……….helai……….
M1 0.1b 0.2 0.1 0b 0.1 0.02 0.1
M2 0.3b 1.4 2.1 2.2ab 4.9 9.2 12.9
M3 0.5ab 1.8 2.2 2.7ab 4 6.2 9
M4 0.9a 2.6 3.8 5.3a 8.7 13.6 18.9
Uji F ** tn tn * tn tn tn
KK (%) 27.57 38.11 51.18 35.33 46.76 63.43 73.65
Keterangan : Angka yang diikuti dengan huruf yang sama pada kolom yang sama menunjukan tidak berbeda nyata menurut uji BNJ taraf 5%.
tn = Tidak berbeda nyata pada uji F dengan taraf 5% * = Berbeda nyata pada uji F dengan taraf 5 % ** = Berbeda sangat nyata pada uji F dengan taraf 5% KK = Koefisien Keragaman; Sk = Subkultur
M1 = 2 mg/l BAP + 0.8 mg/l TDZ; M2 = 2 mg/l BAP M3 = 5 mg/l BAP; M4 = 7 mg/l kinetin
Rata-rata jumlah daun semakin meningkat pada perlakuan media MS + 2 mg/l BAP, media MS + 5 mg/l BAP dan media MS + 7 mg/l kinetin, dengan semakin lama periode subkultur. Pada perlakuan media MS + 2 mg/l BAP + 0.8 mg/l thidiazuron, pada subkultur ke-3 tunas tidak membentuk daun atau daun belum terbuka sempurna.
Dari awal hingga akhir pengamatan, perlakuan media MS + 7 mg/l kinetin menghasilkan rata-rata jumlah daun tertinggi pada semua periode subkultur. Rata-rata jumlah daun yang dihasilkan perlakuan media MS + 7 mg/l kinetin tidak berbeda nyata dengan perlakuan media MS + 2 mg/l BAP pada semua periode subkultur. Pada kedua perlakuan menunjukkan pertambahan rata-rata jumlah daun yang sama.
Tinggi Tunas
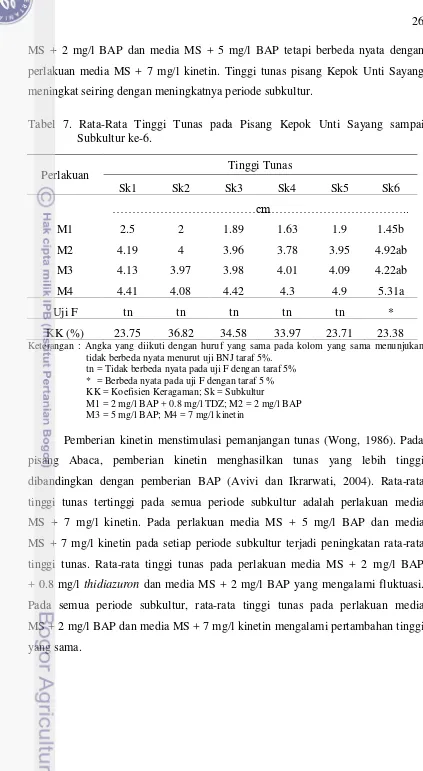
Komposisi media berpengaruh nyata terhadap tinggi tunas pisang Kepok Unti Sayang pada subkultur ke-6 (Tabel 7.). Berdasarkan uji lanjut dengan BNJ
[image:37.595.75.510.41.842.2]26
MS + 2 mg/l BAP dan media MS + 5 mg/l BAP tetapi berbeda nyata dengan perlakuan media MS + 7 mg/l kinetin. Tinggi tunas pisang Kepok Unti Sayang meningkat seiring dengan meningkatnya periode subkultur.
Tabel 7. Rata-Rata Tinggi Tunas pada Pisang Kepok Unti Sayang sampai Subkultur ke-6.
Perlakuan Tinggi Tunas
Sk1 Sk2 Sk3 Sk4 Sk5 Sk6
………cm………..
M1 2.5 2 1.89 1.63 1.9 1.45b
M2 4.19 4 3.96 3.78 3.95 4.92ab
M3 4.13 3.97 3.98 4.01 4.09 4.22ab
M4 4.41 4.08 4.42 4.3 4.9 5.31a
Uji F tn tn tn tn tn *
KK (%) 23.75 36.82 34.58 33.97 23.71 23.38
Keterangan : Angka yang diikuti dengan huruf yang sama pada kolom yang sama menunjukan tidak berbeda nyata menurut uji BNJ taraf 5%.
tn = Tidak berbeda nyata pada uji F dengan taraf 5% * = Berbeda nyata pada uji F dengan taraf 5 % KK = Koefisien Keragaman; Sk = Subkultur
M1 = 2 mg/l BAP + 0.8 mg/l TDZ; M2 = 2 mg/l BAP M3 = 5 mg/l BAP; M4 = 7 mg/l kinetin
[image:38.595.86.509.42.813.2]Jumlah Akar
Media perlakuan yang digunakan adalah media dengan penambahan sitokinin tanpa penambahan auksin. Pada media perlakuan, akar terbentuk diduga
karena adanya auksin endogen. Jenis auksin endogen adalah IAA (indole-3- acetic acid) (Torres, 1989; Gunawan, 1992; Wiendi et al., 1992;
George et al., 2008). Konsentrasi IAA endogen tergantung dari tanaman induk asal eksplan, usia tanaman induk saat eksplan diambil, kondisi pertumbuhan tanaman induk dan musim saat eksplan diambil (Gunawan, 1992; George et al., 2008). Konsentrasi IAA endogen tertinggi pada daun muda, organ yang sedang tumbuh dan menurun karena usia serta disebabkan oleh faktor eksternal seperti cahaya (lama penyinaran, intensitas penyinaran dan fotoperiodisasi) (George et al., 2008).
Akar tidak terbentuk hingga akhir pengamatan pada perlakuan media MS + 2 mg/l BAP + 0.8 mg/l thidiazuron. Isnaeni (2008) melaporkan bahwa pemberian 0.1 mg/l thidiazuron ke dalam media mengakibatkan penurunan jumlah akar pada pisang Rajabulu Juara hingga seperempatnya dibandingkan dengan kontrol (MS0).
28
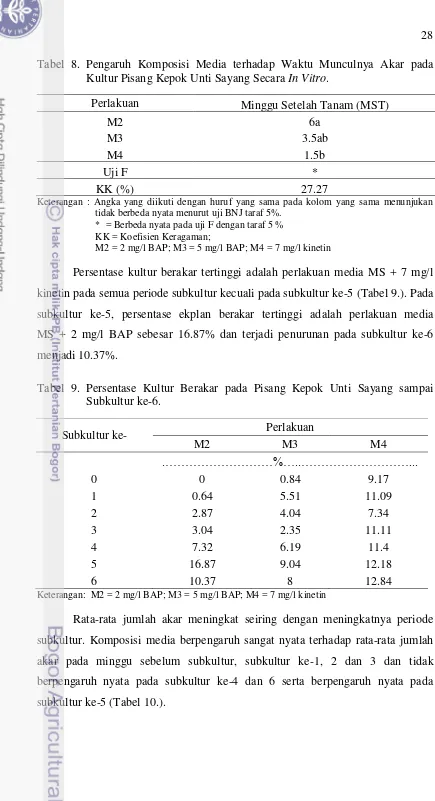
Tabel 8. Pengaruh Komposisi Media terhadap Waktu Munculnya Akar pada Kultur Pisang Kepok Unti Sayang Secara In Vitro.
Perlakuan Minggu Setelah Tanam (MST)
M2 6a
M3 3.5ab
M4 1.5b
Uji F *
KK (%) 27.27
Keterangan : Angka yang diikuti dengan huruf yang sama pada kolom yang sama menunjukan tidak berbeda nyata menurut uji BNJ taraf 5%.
* = Berbeda nyata pada uji F dengan taraf 5 % KK = Koefisien Keragaman;
M2 = 2 mg/l BAP; M3 = 5 mg/l BAP; M4 = 7 mg/l kinetin
Persentase kultur berakar tertinggi adalah perlakuan media MS + 7 mg/l kinetin pada semua periode subkultur kecuali pada subkultur ke-5 (Tabel 9.). Pada subkultur ke-5, persentase ekplan berakar tertinggi adalah perlakuan media MS + 2 mg/l BAP sebesar 16.87% dan terjadi penurunan pada subkultur ke-6 menjadi 10.37%.
Tabel 9. Persentase Kultur Berakar pada Pisang Kepok Unti Sayang sampai Subkultur ke-6.
Subkultur ke- Perlakuan
M2 M3 M4
.………%…..………...
0 0 0.84 9.17
1 0.64 5.51 11.09
2 2.87 4.04 7.34
3 3.04 2.35 11.11
4 7.32 6.19 11.4
5 16.87 9.04 12.18
6 10.37 8 12.84
Keterangan: M2 = 2 mg/l BAP; M3 = 5 mg/l BAP; M4 = 7 mg/l kinetin
[image:40.595.77.512.28.829.2]Tabel 10. Rata-Rata Jumlah Akar pada Pisang Kepok Unti Sayang sampai Subkultur ke-6.
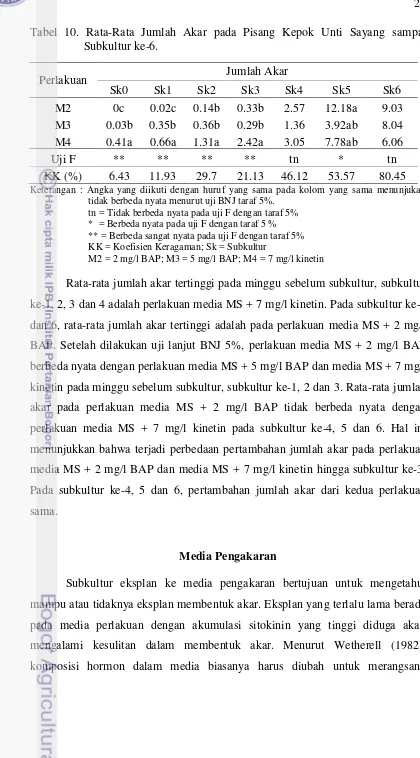
Perlakuan Jumlah Akar
Sk0 Sk1 Sk2 Sk3 Sk4 Sk5 Sk6 M2 0c 0.02c 0.14b 0.33b 2.57 12.18a 9.03 M3 0.03b 0.35b 0.36b 0.29b 1.36 3.92ab 8.04 M4 0.41a 0.66a 1.31a 2.42a 3.05 7.78ab 6.06
Uji F ** ** ** ** tn * tn
KK (%) 6.43 11.93 29.7 21.13 46.12 53.57 80.45
Keterangan : Angka yang diikuti dengan huruf yang sama pada kolom yang sama menunjukan tidak berbeda nyata menurut uji BNJ taraf 5%.
tn = Tidak berbeda nyata pada uji F dengan taraf 5% * = Berbeda nyata pada uji F dengan taraf 5 % ** = Berbeda sangat nyata pada uji F dengan taraf 5% KK = Koefisien Keragaman; Sk = Subkultur
M2 = 2 mg/l BAP; M3 = 5 mg/l BAP; M4 = 7 mg/l kinetin
Rata-rata jumlah akar tertinggi pada minggu sebelum subkultur, subkultur ke-1. 2, 3 dan 4 adalah perlakuan media MS + 7 mg/l kinetin. Pada subkultur ke-5 dan 6, rata-rata jumlah akar tertinggi adalah pada perlakuan media MS + 2 mg/l BAP. Setelah dilakukan uji lanjut BNJ 5%, perlakuan media MS + 2 mg/l BAP berbeda nyata dengan perlakuan media MS + 5 mg/l BAP dan media MS + 7 mg/l kinetin pada minggu sebelum subkultur, subkultur ke-1, 2 dan 3. Rata-rata jumlah akar pada perlakuan media MS + 2 mg/l BAP tidak berbeda nyata dengan perlakuan media MS + 7 mg/l kinetin pada subkultur ke-4, 5 dan 6. Hal ini menunjukkan bahwa terjadi perbedaan pertambahan jumlah akar pada perlakuan media MS + 2 mg/l BAP dan media MS + 7 mg/l kinetin hingga subkultur ke-3. Pada subkultur ke-4, 5 dan 6, pertambahan jumlah akar dari kedua perlakuan sama.
Media Pengakaran
[image:41.595.84.504.60.818.2]30
pertumbuhan akar. Hormon sitokinin harus dikurangi kadarnya atau dihilangkan sedangkan auksin berperan penting sebagai inisiator pertumbuhan akar.
Kemampuan eksplan dalam membentuk akar berbeda-beda. Pada pisang Ambon Kuning dan pisang Mas menunjukkan kemampuan membentuk akar yang lebih mudah dan lebih banyak. Pada pisang Raja Bulu dan pisang Kepok Kuning mempunyai kemampuan berakar yang lebih rendah (Kasutjianingati, 2004).
Periode subkultur dan jenis media asal tidak berpengaruh nyata terhadap waktu munculnya akar pada media pengakaran (Tabel 11.). Semua eksplan dari semua periode subkultur dan jenis media asal memiliki kemampuan membentuk akar yang sama. Perlakuan media MS + 2 mg/l BAP pada semua periode
subkultur paling awal membentuk akar. Pada perlakuan media MS + 2 mg/l BAP + 0.8 mg/l thidiazuron tidak dilakukan pengujian karena
hingga akhir pengamatan, akar tidak terbentuk.
Tabel 11. Pengaruh Media Pengakaran terhadap Waktu Munculnya Akar Kultur Pisang Kepok Unti Sayang Secara In Vitro.
Perlakuan Sk1 Sk2 Sk3 Sk4 Sk5 Sk6
Minggu Setelah Tanam (MST)
M2 0 1 1 1.5 1 0.5
M3 1 1 1.5 1.5 2 1.5
M4 1.5 1 1 2 1 1
Uji F tn tn tn tn tn tn
KK (%) 48.99 115.47 126.17 60 61.24 57.74
Keterangan : Angka yang diikuti dengan huruf yang sama pada kolom yang sama menunjukan tidak berbeda nyata menurut uji BNJ taraf 5%.
tn = Tidak berbeda nyata pada uji F dengan taraf 5% KK = Koefisien Keragaman; Sk = Subkultur
M2 = 2 mg/l BAP; M3 = 5 mg/l BAP; M4 = 7 mg/l kinetin
subkultur ke-6, rata-rata jumlah akar tertinggi adalah perlakuan media MS + 5 mg/l BAP sebesar 3.42.
Tabel 12. Rata-rata Jumlah Akar pada Media Pengakaran Kultur Pisang Kepok Unti Sayang Secara In Vitro.
Perlakuan Jumlah Akar
Sk1 Sk2 Sk3 Sk4 Sk5 Sk6
M2 0 0.17 0.84 4 1.59 2
M3 1.75 0.67 0.25 1.33 0.58 3.42 M4 1.59 3.09 5.25 2.59 1.92 1.42
Uji F tn tn tn tn tn tn
KK (%) 43.37 80.29 64.42 131.6 66.91 107.93
Keterangan : tn = Tidak berbeda nyata pada uji F dengan taraf 5% KK = Koefisien Keragaman; Sk = Subkultur
M2 = 2 mg/l BAP; M3 = 5 mg/l BAP; M4 = 7 mg/l kinetin
Aklimatisasi
Tanaman sempurna (planlet) pada kultur in vitro merupakan eksplan yang telah mengalami morfogenesis (Gambar 6(A)). Eksplan yang pada awal pananaman berupa potongan tunas kemudian berkembang membentuk daun dan akar. Syarat utama dilakukannya aklimatisasi adalah eksplan telah membentuk akar. Aklimatisasi merupakan masa adaptasi dari kultur heterotropik menjadi autotropik (Gunawan, 1992).
[image:43.595.96.514.82.815.2]32
Gambar 6. Planlet Pisang Kepok Unti Sayang sebagai Bahan Aklimatisasi (A), Kultur Pisang Kepok Unti Sayang yang Telah di Aklimatisasi pada Media Arang Sekam dan Cocopeat (B).
Perlakuan media MS + 5 mg/l BAP pada 3 MST mengalami penurunan jumlah tunas yang tumbuh (Tabel 13.). Hal ini diduga akibat planlet belum siap melakukan fotosintesis sendiri. Tanaman memerlukan suatu periode transisi untuk dapat melakukan proses fotosintesis untuk memenuhi kebutuhan karbohidratnya sendiri (Wattimena et al., 1992). Wiendi (1992) melaporkan bahwa pisang Tanduk yang diaklimatisasi pada media pasir dicampur kompos dengan perbandingan 1:1 (v/v) tetap hidup selama satu bulan pengamatan.
Tabel 13. Persentase Tunas yang Tumbuh Setelah Aklimatisasi.
Pelakuan
Persentase Tumbuh
1 MST 2 MST 3 MST
………%……….
M2 100 (9/9) 100 (9/9) 100 (9/9)
M3 100 (12/12) 100 (12/12) 91.67 (11/12)
M4 100 (9/9) 100 (9/9) 100 (9/9)
Keterangan : M2 = 2 mg/l BAP; M3 = 5 mg/l BAP; M4 = 7 mg/l kinetin
Pembahasan Umum
Pengamatan yang dilakukan pada semua variabel pengamatan menunjukkan perbedaan kemampuan tunas berproliferasi pada setiap perlakuan
dan periode subkultur. Pada pengamatan jumlah daun, perlakuan media MS + 2 mg/l BAP dan media MS + 7 mg/l kinetin pada minggu sebelum
[image:44.595.96.507.53.842.2]subkultur menunjukkan perbedaan jumlah daun yang dihasilkan. Setelah subkultur hingga akhir pengamatan pertambahan jumlah daun pada kedua perlakuan sama. Pada parameter tinggi tunas, dari awal hingga akhir pengamatan pada semua periode subkultur perlakuan media MS + 2 mg/l BAP dan media MS + 7 mg/l kinetin mengalami pertambahan tinggi tunas yang sama.
Total jumlah tunas pada perlakuan media MS + 2 mg/l BAP hingga subkultur ke-6 sebanyak 410 tunas dengan 131 tunas yang bermultiplikasi. Pada perlakuan media MS + 7 mg/l kinetin, total jumlah tunas hingga subkultur ke-6 sebanyak 314 tunas dengan 91 tunas yang bermultiplikasi (Tabel 3.).
Akar paling cepat muncul pada 1.5 minggu setelah tanam pada perlakuan media MS + 7 mg/l kinetin (Tabel 8.). Kinetin tanpa penambahan auksin dapat menginduksi pertumbuhan akar dengan lebih cepat dibandingka BAP (Wong, 1986). Akar muncul pertama kali pada perlakuan media MS + 2 mg/l BAP pada 6 minggu setelah tanam (Tabel 8.). Pemberian BAP menghambat pembentukan akar pada kultur pisang Tanduk (Ernawati et al., 1992). Persentase eksplan berakar pada minggu sebelum subkultur hingga subkultur ke-4 dan subkultur ke-6 tertinggi adalah perlakuan media MS + 7 mg/l kinetin (Tabel 9.).
34
Pada media pengakaran, perlakuan media MS + 2 mg/l BAP lebih awal membentuk akar pada semua periode subkultur. Eksplan yang mampu membentuk akar pada media pengakaran yang terbaik adalah perlakuan media MS + 2 mg/l BAP.
Konsentrasi zat pengatur tumbuh yang digunakan dikonversi ke µM untuk membandingkan aktivitas dari zat pengatur tumbuh yang sejenis (Wiendi et al., 1992). Setelah dikonversi, konsentrasi M2 sebesar 8.88 µM BAP dan M4 sebesar 32.52 µM kinetin. Aktivitas 2 mg/l BAP kurang lebih empat kali lebih aktif dari 7 mg/l kinetin.
BAP merupakan sitokinin yang efektif menstimulir proliferasi tunas dibandingkan dengan kinetin. Kegunaannya telah direkomendasikan untuk media multiplikasi pada beberapa komoditi pisang. Walaupun pada beberapa kultivar yang berbeda menunjukkan adanya variasi proliferasi tunas yang dihasilkan (Wong, 1986).
Secara ekonomi, perbanyakan pisang Kepok Unti Sayang dengan media MS + 2 mg/l BAP lebih murah dibandingkan dengan media MS + 7 mg/l kinetin (Tabel 14.). Biaya yang dikeluarkan untuk perbanyakan satu tunas pisang sebesar Rp 242.94 dengan media MS + 2 mg/l BAP dan Rp 272.60 dengan media MS + 7 mg/l kinetin. Biaya yang dikeluarkan untuk penggunaan BAP lebih murah dibandingkan dengan penggunaan kinetin.
Tabel 14. Biaya Perbanyakan Pisang secara Kultur Jaringan. Zat Pengatur
Tumbuh
Biaya Sitokinin (per liter media)*
Biaya Media (per liter media)*
Biaya per Tunas
……….Rp……….
2 mg/l BAP 87.55 9 717.55 242.94
7 mg/l kinetin 1 274.11 10 904.11 272.60
Keterangan : * harga berasal dari PhytoTechnology Laboratories 2011 (www.phytotechlab.com)
Tabel 15. Perbandingan Perbanyakan Tunas secara Konvensional dan Kultur Jaringan.
No Parameter Konvensional Kultur Jaringan 1 Tunas yang dihasilkan dalam 1 tahun
dari 1 tunas yang ditanam
5 - 10 tunas 90 tunas
2 Biaya per tunas Rp 15 570.19 Rp 27 938.10
[image:47.595.56.512.57.823.2]KESIMPULAN DAN SARAN
Kesimpulan
Komposisi media terbaik untuk perbanyakan mikro pisang Kepok Unti Sayang adalah media MS + 2 mg/l BAP, yang menghasilkan total tunas 410 tunas dengan 131 tunas yang bermultiplikasi dan jumlah akar sebanyak 9.03 sampai subkultur ke-6.
Daya multiplikasi tunas saat disubkultur cenderung meningkat hingga subkultur ke-6, dengan rata-rata jumlah tunas yang dihasilkan sampai subkultur ke-6 sebanyak 39.8 tunas pada media MS + 2 mg/l BAP.
Saran
DAFTAR PUSTAKA
Andriana, D. 2005. Pengaruh Konsentrasi BAP Terhadap Multiplikasi Tunas dan Giberelin Terhadap Kualitas Pisang FHIA-7 In Vitro. Skripsi. Program Studi Hortikultura. Fakultas Pertanian. Institut Pertanian Bogor. Bogor. 36 hal.
Arinaitwe, G., P.R. Rubaihayo, and M.J.S. Magambo. 2000. Proliferation rate effects of cytokinins on banana (Musa spp.) cultivars. Sci. Hort. 86: 13-21. Avivi, S. dan Ikrarwati. 2004. Mikropropagasi pisang abaca (Musa textillis nee)
melalui teknik kultur jaringan. Ilmu Pertanian 11 (2): 27-34.
BPS. 2010. Produksi buah-buahan Indonesia. www.bps.go.id. [17 September 2011].
Ernawati, A., R.M. Imron, dan L.W. Gunawan. 1992. Penyediaan bibit pisang tanduk (Musa 37cuminate37al L. AAB Grup) secara kultur jaringan. Bul. Agron. 21(1): 27-35.
Evans, D.E., J.O.D. Coleman, and A. Kearns. 2003. Plant Cell Culture. BIOS Scientific Publishers. New York. 194 p.
George, E.F., M.A. Hall, and G.J.D Klerk. 2008. Plant Propagation by Tissue Culture 3rd Edition. Springer. Netherlands. 501 p.
Gomez, K.A. dan A.A. Gomez. 1995. Prosedur Statistika untuk Penelitian Pertanian (diterjemahkan dari : Statistical Procedures for Agricultural Research, penerjemah : E. Sjamsudin dan J.S. Baharsjah). Penerbit Universitas Indonesia. Jakarta. 698 hal.
Gunawan, L.W. 1992. Teknik Kultur Jaringan Tumbuhan. Pusat Antar Universitas Institut Pertanian Bogor. Bogor. 158 hal.
Hartmann, H.T., D.E. Kester, and F.T. Davies. 1990. Plant Propagation, Principles and Practices Fifth Edition. Prentice-Hall Inc. Englewood Cliffs, New Jersey. 647 p.
Hendaryono, D.P.S. dan A. Wijayani. 1994. Teknik Kultur Jaringan. Penerbit Kanisius. Yogyakarta. 139 hal.
38
Jafari, N., R.Y. Othman, and N. Khalid. 2011. Effect of benzylaminopurine (BAP) pulsing on in vitro shoot multiplication of Musa 38cuminate (banana) cv. Berangan. African Journal of Biotechnology 10(13): 2446-2450.
Kasutjianingati. 2004. Pembiakan Mikro Berbagai Genotipe Pisang (Musa spp.) dan Potensi Bakteri Endofitik terhadap Layu Fusarium (Fusarium oxysporum f. sp. Cubense). Tesis Program Pasca Sarjana IPB. Bogor. 88 hal.
Kasutjianingati. 2011. Kokultur Rizobakteri secara In Vitro pada Planlet Pisang untuk Meningkatkan Mutu Planlet Pisang serta Pengendalian Penyakit Layu Fusarium. Disertasi Sekolah Pascasarjana IPB. Bogor. 159 hal.
Megia, R., Purnomo, Kasutjianingati, I.P. Handayani, H. Rohmah, dan Widodo. 2002. Riset Unggulan Strategis Nasional Pengembangan Buah-buahan Unggulan Indonesia. Laporan Akhir. Kementrian Negara Riset dan Teknologi Republik Indonesia. 18 hal.
Muhammad, A., I. Hussain, S.M.S. Naqvi, and H. Rashid. 2004. Banana plantlet production through tissue culture. Pak. J. Bot. 36(3): 617-620.
Muhammad, A., H. Rashid, I. Hussain, and S.M.S. Naqvi. 2007. Proliferation-rate effects of BAP and kinetin on banana (Musa spp. AAA group) basrai. HortScience. 42(5):1253–1255.
PhytoTechnology Laboratories. 2011. Plant growth regulators and media. www.phytotechlab.com [09 November 2011].
Redaksi AgroMedia. 2010. Buku Pintar Budi Daya Tanaman Buah Unggul Indonesia. PT Agromedia Pustaka. Jakarta. 296 hal.
Samson, J.A. 1986. Tropical Fruits Second Edition. Longman Singapore Publisher (Pte) Ltd. Singapore. 336 p.
Shirani, S., F. Mahdavi and, M. Maziah. 2009. Morphological abnormality among regenerated shoots of banana and plantain (Musa spp.) after in vitro multiplication with TDZ and BAP from excised shoot tips. Af. J. Biotech. 8(21): 5755-5761.
Simmonds, N.W. 1970. Bananas. Second Impression. T. & A. Constable Ltd Edinburgh. Great Britain. 512 p.
Sin, W.L. 2005. Thidiazuron in the improvement of banana micropropagation. Acta Hort 692.
Torres, K.C. 1989. Tissue Culture Techniques for Horticultural Crops. Chapman and Hall. New York. 285 p.
Wattimena, G.A., L.V. Gunawan, A. Makmur, R. Suseno, dan S.H. Sutjahjo. 1986. Kultur Jaringan Tanaman Pembiakan Mikro dan Manipulasi Genetika pada Beberapa Tanaman Budidaya (laporan penelitian). Fakultas Pertanian IPB. Bogor. 73 hal.
Wattimena, G.A. 1988. Zat Pengatur Tumbuh Tanaman. Pusat Antar Universitas. IPB. Bogor. 145 hal.
Wattimena, G.A., L.W. Gunawan, N.A. Mattjik, E. Syamsudin, N.M.A. Wiendi, dan A. Ermawati. 1992. Bioteknologi Tanaman. Laboratorium Kultur jaringan Tanaman. Departemen Pendidikan dan Kebudayaan. Direktorat Jendral Pendidikan Tinggi. PAU Bioteknologi. IPB. Bogor. 309 hal.
Wetherell, D.F. 1982. Pengantar Propagasi Tanaman secara In Vitro (diterjemahkan dari : Introduction to In Vitro Propagation, penerjemah : Koensoemardiyah dan D. Gunawan). IKIP Semarang Press. Semarang. 110 hal.
Wiendi, N.M.A. 1992. Pengaruh Air Kelapa, Zeolit dan Subkultur Beruntun Terhadap Daya Multiplikasi Tunas Pisang Tanduk secara In Vitro. Tesis Program Pascasarjana IPB. 66 hal.
Wiendi, N.M.A., G.A. Wattimena, dan L.W. Gunawan. 1992. Perbanyakan tanaman, hal. 12-101. Dalam A.S. Abidin (Ed.). Bioteknologi Tanaman. Departemen Pendidikan dan Kebudayaan, Direktorat Jenderal Pendidikan Tinggi, Pusat Antar Universitas Bioteknologi, Institut Pertanian Bogor. Bogor.
Wong, W.C. 1986. In vitro propagation of banana (Musa sp) initiation, proliferation and development of shoot-tip cultures on defined media. Plant. Cell. Tiss. Org. Cult. 6:156-166.
1. Komposisi Media Murashige-Skoog dengan Modifikasi Vitamin B5.
Stok Bahan Konsentrasi Larutan (g/l)
Pemakaian
ml/l media mg/l
A NH4NO3 82.500 20 1.650.000
B KNO3 95.000 20 1.900.000
C KH2PO4 34.000
5
170.000
H3BO3 1.240 6.200
KI 0.166 0.830
NaMoO4.2H2O 0.050 0.2500
CoCl2.6H2O 0.005 0.025
D CaCl.2H2O 88.000 5 440.000