POTENSI KAPANG ASAL SERASAH TANAMAN HUTAN
SEBAGAI PENGHASIL ASAM INDOL ASETAT DAN
TOLERANSINYA TERHADAP KONDISI ASAM
YOSI KUSTIAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
Dengan ini saya menyatakan bahwa tesis Potensi Kapang Asal Serasah Tanaman Hutan sebagai Penghasil Asam Indol Asetat dan Toleransinya terhadap Kondisi Asam adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2011
YOSI KUSTIAN. The Potential of Forest Litter Molds as Indole-3-Acetic Acid Producers and Their Tolerance to Acid Conditions. Under supervision of GAYUH RAHAYU and NISA RACHMANIA MUBARIK.
Microorganism in soil and forest litter plays an important role in maintaining the health of the soil such as decomposer, nutrient transformation agent, mineral solubilizer, and also as hormones producer. One of the hormones produced by microorganism including molds is indole-3-acetic acid (IAA). Utilization of IAA producer molds that tolerance to acid conditions may increase the production of industrial forest in acid soil and improve the vigour of plantling stock material originated from stem cutting. This study was aimed to assess the potential of forest litter molds of IPBCC (Institut Pertanian Bogor Culture Collection) collection as IAA producers and their tolerance to acid conditions. The ability of fifty-one forest litter molds from Katingan and Tarakan to produce IAA was screened in Czapek Dox medium and was determined by Patten and Glick method using Salkowski reagent. According to Patten and Glick method, the forest litter molds from Katingan produced IAA (1.92±0.26 ppm) were higher than those of Tarakan (1.08 ± 0.14 ppm). The production of IAA by static incubation (2.72±0.89 ppm) was higher than those of shaking incubation (1.92 ± 0.26 ppm). The production of IAA on the forest litter molds from Katingan (63.16%) were not influenced by the storage process. Four out of fifty Katingan’s molds were selected for IAA production, those were Acremonium sp. IPBCC 07.548 (3.52±0.46 ppm), Aspergillus ornatus IPBCC 07.554 (4.50±0.92 ppm), Gliocladium deliquescens IPBCC 07.543 (2.23±0.38 ppm), and Penicillium notatum IPBCC 07.555 (5.06±0.46 ppm). IAA and its biomass productions were influenced by pH of the medium. These forest litter molds were considered to be acid tolerance. The pH optimum for their growth and IAA production were 5.5. These molds showed no antagonistic response to each other. The IAA production from these molds in consortium (7.22±1.33 ppm) were better than its single culture (4.43±1.53 ppm). High performance liquid chromatography assay indicated that there was only one type of IAA with retention time 7.1.
YOSI KUSTIAN. Potensi Kapang Asal Serasah Tanaman Hutan sebagai Penghasil Asam Indol Asetat dan Toleransinya terhadap Kondisi Asam. Dibimbing oleh GAYUH RAHAYU dan NISA RACHMANIA MUBARIK.
Mikroorganisme tanah dan serasah hutan merupakan komponen yang sangat penting dalam menjaga kesehatan tanah seperti proses dekomposisi, transformasi nutrien, mineralisasi, dan juga sebagai penghasil hormon asam indol asetat (AIA). Salah satu mikroorganisme yang dapat memproduksi AIA ialah kapang. Pemanfaatan kapang yang berpotensi sebagai penghasil AIA dan memiliki toleransi terhadap kondisi asam dapat diterapkan untuk peningkatan produksi hutan tanaman industri yang ditanam di lahan masam mengingat lahan masam di Indonesia cukup luas yaitu sekitar 102,8 juta hektar. Selain itu, pemanfaatan kapang yang berpotensi sebagai penghasil AIA dan toleran terhadap kondisi asam dapat juga diterapkan untuk peningkatan kualitas bibit tanaman hutan.
Penelitian ini dilakukan untuk mengkaji potensi kapang asal serasah tanaman hutan koleksi simpanan IPBCC (Institut Pertanian Bogor Culture Collection) sebagai penghasil asam indol asetat (AIA) dan toleran terhadap kondisi asam. Penelitian ini dilakukan dalam enam tahap yaitu penapisan kapang berdasarkan asal dan cara inkubasi dalam memproduksi AIA, uji pengaruh penyimpanan dari isolat terpilih dalam memproduksi AIA, uji toleransi terhadap pH asam dari isolat terpilih dalam memproduksi AIA, uji antagonistik antar kapang terpilih, uji produksi AIA pada beberapa konsorsium kapang terpilih, dan konfirmasi produksi AIA dengan menggunakan high performance liquid chromatography (HPLC). Produksi AIA dilakukan dengan menggunakan media Czapek Dox cair. AIA diukur dengan menggunakan metode Patten dan Glick yaitu dengan menggunakan pereaksi Salkowski.
Sebanyak 19 kapang asal serasah tanaman hutan dari Katingan dan 32 dari Tarakan mampu menghasilkan AIA dengan kadar yang sangat bervariasi. Secara umum, kapang-kapang asal Katingan memproduksi AIA (1,92±0,26 ppm) lebih tinggi dibandingkan dengan kapang-kapang asal Tarakan (1,08±0,14 ppm).
Produksi AIA dengan cara inkubasi statis (2,72±0,89 ppm) lebih tinggi dibandingkan dengan cara digoyang (1,92±0,26 ppm). Pada inkubasi statis, kapang tumbuh di permukaan medium dan bersporulasi, sedangkan pada inkubasi digoyang tumbuh membentuk butiran (pelet) dan tidak bersporulasi. Miselium yang berbentuk pelet dan tidak bersporulasi diduga berhubungan dengan pembentukan metabolit sekunder. Cara inkubasi digoyang dapat menyebabkan struktur AIA rusak oleh oksigen karena proses dekarboksilasi yang mengakibatkan hilangnya gugus karboksil.
Sebagian besar (63,16%) isolat kapang asal Katingan tidak dipengaruhi oleh proses penyimpanan dalam produksi AIA, sehingga penurunan biosintesis AIA tersebut diduga tidak berhubungan dengan proses penyimpanan. Penurunan produksi AIA oleh sebagian kecil kapang asal Katingan ini diduga disebabkan oleh subkultur berulang.
kapang terpilih dipengaruhi oleh pH medium. Secara umum, produksi AIA mencapai maksimum pada pH 5,5. Walaupun medium kultur dalam kondisi ekstrem masam (pH 4,5), masam sangat kuat (pH 5,0), dan sangat masam (pH 5,5)
Produksi AIA oleh kapang-kapang terpilih pada berbagai pH awal medium tidak berkorelasi nyata terhadap bobot kering biomasa miselium. Pertumbuhan miselium (bobot kering biomasa) menunjukkan pertumbuhan yang baik pada pH asam. Bobot kering biomasa miselium A. ornatus IPBCC 07.554, G. deliquescens IPBCC 07.543, dan P. notatum IPBCC 07.555 cenderung menurun dengan meningkatnya pH medium kultur. Sebaliknya, bobot kering biomasa miselium Acremonium sp. IPBCC 07.548 cenderung meningkat.
setiap kapang terpilih masih mampu memproduksi AIA. Hal ini menunjukkan bahwa kapang-kapang tersebut toleran terhadap kondisi asam.
Interaksi antagonistik antar isolat kapang terpilih tidak menunjukkan respon antagonis. Nilai persentase hambatan pertumbuhan dari setiap kapang yang diuji sangat rendah yaitu berkisar antara 0,00-0,65%.
Kemampuan produksi AIA pada beberapa konsorsium kapang secara umum lebih tinggi dibandingkan dengan bentuk kultur tunggal. AIA yang diproduksi bervariasi tergantung kepada bentuk konsorsium, yaitu berkisar 3,28±0,07 ppm hingga 10,51±1,25 ppm.
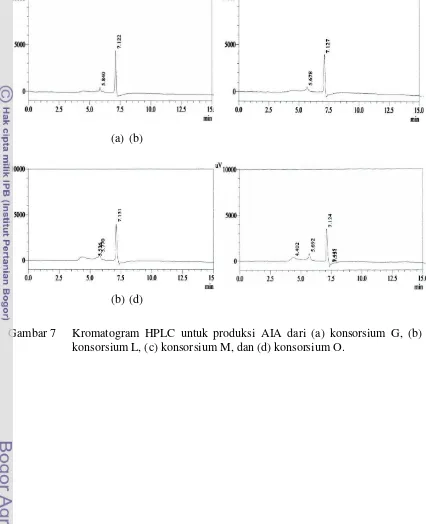
Konfirmasi produksi AIA dengan menggunakan HPLC menunjukkan bahwa AIA dari konsorsium G (IPBCC 07.543 + IPBCC 07.555), konsorsium L (IPBCC 07.543 + IPBCC 07.548 + IPBCC 07.555), konsorsium M (IPBCC 07.543 + IPBCC 07.554 + IPBCC 07.555), dan konsorsium O (IPBCC 07.543 + IPBCC 07.548 + IPBCC 07.554 + IPBCC 07.555) memiliki profil puncak waktu retensi yang sama dengan waktu retensi pada standar AIA komersial yaitu 7,1. Dengan demikian, senyawa indol yang dihasilkan oleh konsorsium terpilih merupakan jenis AIA.
Produksi AIA tertinggi diperoleh oleh konsorsium M yaitu sebesar 38,66 ppm diikuti oleh konsorsium O (23,58 ppm), G (23,13 ppm), dan L (21,57 ppm). Kadar AIA pada konsorsium kapang terpilih yang terdeteksi oleh HPLC lebih tinggi daripada hasil uji dengan menggunakan pereaksi Salkowski. Hal ini disebabkan oleh sensitivitas dan akurasi HPLC jauh lebih tinggi dibandingkan dengan menggunakan pereaksi Salkowski.
© Hak Cipta milik IPB, tahun 2011 Hak Cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar IPB.
POTENSI KAPANG ASAL SERASAH TANAMAN
HUTAN SEBAGAI PENGHASIL ASAM INDOL
ASETAT DAN TOLERANSINYA TERHADAP
KONDISI ASAM
YOSI KUSTIAN
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Mayor Mikrobiologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Kondisi Asam
Nama : Yosi Kustian
NRP : G351090041
Mayor : Mikrobiologi
Disetujui Komisi Pembimbing
Ketua
Dr. Ir. Gayuh Rahayu
Anggota
Dr. Nisa Rachmania Mubarik, M.Si.
Diketahui
Ketua Mayor Mikrobiologi Dekan Sekolah Pascasarjana IPB
Dr. Ir. Gayuh Rahayu Dr. Ir. Dahrul Syah, M.Sc.Agr
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tesis ini berjudul Potensi Kapang Asal Serasah Tanaman Hutan sebagai Penghasil Asam Indol Asetat dan Toleransinya terhadap Kondisi Asam. Penelitian ini dilakukan di Laboratorium Mikologi Departemen Biologi, FMIPA, IPB, dan berlangsung mulai bulan Juli 2010 hingga April 2011.
Penulis mengucapkan terima kasih kepada ibu Dr. Ir. Gayuh Rahayu dan ibu Dr. Nisa Rachmania Mubarik, M.Si. yang telah membimbing penulis dengan penuh kesabaran dalam penulisan tesis ini. Ucapan terima kasih disampaikan pula kepada bapak Prof. Dr. Ir. Bambang S. Purwoko sebagai dosen penguji dalam ujian tesis atas saran dan masukan yang diberikan.
Dalam kesempatan ini penulis menyampaikan terima kasih dan penghargaan pula kepada istri tercinta, anak-anak tersayang atas segala pengorbanan, motivasi, dan kasih sayangnya, serta kepada Kementerian Agama RI, kepala Madrasah dan rekan-rekan guru MAN 1 Kota Sukabumi, para teknisi dan rekan-rekan sesama peneliti di Laboratorium Mikologi, Departemen Biologi, FMIPA, IPB.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2011
Nono Suryana dan ibu Surtini. Penulis merupakan putra ketiga dari lima bersaudara.
Tahun 1988 penulis lulus dari SMA Negeri Leles Kabupaten Garut. Pada tahun yang sama, penulis diterima masuk di Institut Keguruan dan Ilmu Pendidikan Bandung (sekarang Universitas Pendidikan Indonesia) melalui jalur UMPTN pada program D-3. Penulis memilih program studi Pendidikan Biologi pada Fakultas Pendidikan Matematika dan Ilmu Pengetahuan Alam. Setelah mengikuti perkuliahan selama enam semester, pada bulan Juli 1991 penulis dinyatakan lulus. Pada tahun 1993 penulis melanjutkan studi pada program S-1 di perguruan tinggi dan fakultas yang sama hingga dinyatakan lulus pada bulan Juli 1995.
Pada periode tahun 1997 sampai 2009, penulis bekerja sebagai guru tetap di Madrasah Aliyah Negeri 1 Kota Sukabumi. Saat ini penulis mendapat Beasiswa Utusan Daerah (BUD) dari Kementerian Agama RI untuk melanjutkan pendidikan pada Sekolah Pascasarjana, Mayor Mikrobiologi, Departemen Biologi, Institut Pertanian Bogor.
Selama mengikuti perkuliahan, pada tanggal 21-26 September 2010 penulis berkesempatan mengikuti Summer Courses Program on Tropical Agricultural
Sustainability di Institut Pertanian Bogor, dan pada tanggal 4-12 Desember 2010
mengikuti Winter Courses on Practical Agricultural Program for Regional
Sustainability di universitas Ibaraki, Jepang. Keikutsertaan penulis pada kedua
program tersebut didukung oleh dana I-MHERE (Indonesia-managing higher
education for relevance and efficiency) Institut Pertanian Bogor.
Halaman
Manfaat Penelitian ... 3
Hipotesis ... 3
TINJAUAN PUSTAKA Metabolit Sekunder yang Dihasilkan oleh Kapang ... 5
Biosintesis dan Fungsi Asam Indol Asetat... 5
Potensi Cendawan Penghasil AIA ... 7
Tanah Masam ... 9
BAHAN DAN METODE Bahan ... 11
Metode ... 13
Peremajaan Biakan ... 14
Penapisan Kapang yang Berpotensi dalam Produksi AIA ... 14
Toleransi Kapang terhadap pH Asam ... 14
Uji Antagonistik ... 15
Potensi Produksi AIA pada Beberapa Konsorsium Kapang ... 15
Konfirmasi Produksi AIA ... 16
HASIL Penapisan Kapang yang Berpotensi dalam Produksi AIA ... 17
Toleransi Kapang terhadap pH Asam ... 19
Sifat Antagonistik ... 20
Produksi AIA pada Beberapa Konsorsium Kapang ... 21
Konfirmasi Produksi AIA ... 22
PEMBAHASAN Penapisan Kapang yang Berpotensi dalam Produksi AIA ... 25
Toleransi Kapang terhadap pH Asam ... 27
Sifat Antagonistik ... 29
Produksi AIA pada Beberapa Konsorsium Kapang ... 30
Konfirmasi Produksi AIA ... 30
SIMPULAN DAN SARAN Simpulan ... 33
Halaman
1 Kapang asal serasah tanaman hutan dari Katingan ... 11 2 Kapang asal serasah tanaman hutan dari Tarakan ... 12 3 Produksi AIA dari isolat asal Katingan sebelum dan setelah proses
penyimpanan selama tiga bulan pada suhu 10°C ... 18 4 pH awal dan pH akhir dalam produksi AIA pada kapang terpilih ... 20 5 Interaksi penghambatan pertumbuhan antar dua isolat kapang terpilih... 21 6 Konfirmasi produksi AIA dari konsorsium terpilih dengan menggunakan
1 Skema lintasan pembentukan AIA: lintasan bergantung triptofan dan
lintasan tidak bergantung triptofan... 6 2 Alur Penelitian ... 13 3 Rataan kadar AIA yang dihasilkan oleh isolat kapang asal Katingan dan
Tarakan dengan inkubasi digoyang; Rataan kadar AIA yang dihasilkan oleh isolat kapang asal Katingan dengan inkubasi statis dan digoyang
... 17 4 Koloni kapang pada media PDA dan ciri mikroskopis dari Acremonium
sp. IPBCC 07.548, A. ornatus IPBCC 07.554, G. deliquescens IPBCC
07.543, dan P. notatum IPBCC 07.555 ... 18 5 Kadar AIA dan bobot kering biomasa dari Acremonium sp. IPBCC
07.548, A. ornatus IPBCC 07.554, G. deliquescens IPBCC 07.543, dan
P. notatum IPBCC 07.555 ... 19 6 Produksi AIA dari kultur tunggal dan beberapa konsorsium kapang
... 21 7 Kromatogram HPLC untuk produksi AIA dari konsorsium G,
Halaman
1 Komposisi media Czapek Dox cair dengan modifikasi sumber N (pepton
1%) ... 39 2 Komposisi pereaksi Salkowski ... 39 3 Produksi AIA pada kapang asal serasah tanaman hutan dari Katingan
dan Tarakan ... 40 4 Kromatogram standar AIA, kontrol, dan perlakuan dengan menggunakan
PENDAHULUAN
LatarBelakang
Mikroorganisme tanah dan serasah hutan merupakan komponen yang sangat
penting dalam menjaga kesehatan tanah seperti proses dekomposisi, transformasi
nutrien, mineralisasi (Rousk 2009), dan juga sebagai penghasil hormon (Roco &
Perez 2001; Hasan 2002; Patten & Glick 2002). Hormon yang diproduksi oleh
mikroorganisme di antaranya ialah giberelin, auksin, dan sitokinin. Salah satu jenis
hormon auksin yaitu asam indol asetat (AIA). AIA secara fisiologi merupakan
hormon yang aktif berpengaruh terhadap pertumbuhan dan perkembangan
tumbuhan(Taiz&Zeiger 2002; Davies 2004).
Setelah penemuan AIA pada tumbuhan tinggi, aktivitasAIA juga ditemukan
pada beberapa mikroorganisme yang salah satunya ialah cendawan (Bau 1981; Tuomi
et al. 1995; Roco & Perez 2001; Hasan 2002).Cendawan dalam serasah dapat
berperan sebagai pendegradasi, agen pengendali organisme pengganggu, dan sebagai
penghasil hormon. Imaningsih (2010) mengemukakan bahwa cendawan asal serasah
hutan yaitu Aspergillus sp. IPBCC 09.619, Penicilium sp. IPBCC 09.620, Penicilium
sp. IPBCC 09.621, danTrichoderma sp. IPBCC 09.622 selain berpotensi sebagai
dekomposer tetapi juga berpotensi sebagai penghasil AIA.
Cendawanlainnya yang mampu memproduksi hormondi antaranya ialah
Aspergillusflavus, A. niger, Fusariumoxysporum, Penicillium corylophillum,P.
cyclopium, P. funiculosum, Rhizopusstolonifer,Saccharomyces cerevisiae,dan
Trichoderma harzianum (Bau 1981; Tuomi et al. 1995;
Lahan tanah masam di Indonesia sekitar 102,8 juta hektar (Mulyani et al.
2004).Tanah masam merupakan tanah yang masih memiliki potensiuntuk pertanian, perkebunan, maupuntanaman hutan. Kesuburantanah masam tergolong rendah.Hal iniditunjukkan dengan rendahnya unsur hara, kejenuhan basa yang sangat
Roco & Perez 2001; Hasan
2002).Pemanfaatan cendawan sebagai penghasil hormon selain untuk aplikasi di
bidang pertanian di tanah masam (Isminarniet al.2007)dapat pula diterapkan untuk
rendah,kejenuhan aluminium tinggi(Suharta 2010).Tanah lahan masam mempunyai karakteristik pH yang rendah yaitu pada tanah masam kuat (5,5-4,5) sampai pada
tanah yang ekstrem masam (<4,5), kemampuan tukar kation rendah dan kejenuhan
basa rendah (Shen et al. 2006). Lahan-lahan seperti ini memiliki produktivitas yang
rendah (Suharta 2010).
Selainpemanfaatan cendawan sebagai penghasil hormon untuk peningkatan
produksi hutan tanaman industri (HTI)di lahan masam, cendawan
penghasilhormonini juga dapat digunakan untuk peningkatan kualitasbibit tanaman
hutan. Salah satu faktor yang menunjang dalam pertumbuhan suatu bibit tanaman
ialah akar. Kecepatanpembentukanakar pada awal pertumbuhan suatu tanaman (bibit
muda) baik pada pemanjanganakarprimermaupunproliferasi akar lateraldan adventif
akan menguntungkan. Hal ini disebabkan oleh meningkatnyakemampuan tanaman
tersebut untukmemperolehairdannutrisidaridalam tanah, sehinggameningkatkan
peluang merekauntukbertahan hidup (Patten & Glick 2002).Pembentukan
akarlateraldanadventifdapat puladisebabkanoleh AIAeksogen baik yang
bersifatalamimaupunsintetik (Alvarez et al. 1989).
Penelitian tentang pemanfaatan cendawan khususnya kapang yang berpotensi
sebagai penghasil AIAyang bersifat alami dan memiliki toleransi terhadap kondisi
asam perlu dilakukan. Walaupun penelitian tentang kapang sebagai penghasil AIA
sudah banyak dilakukan, namun potensi kapangasal serasah tanaman hutansebagai
penghasil AIAdan toleran terhadap kondisi asam terutama biakankapang telah
menjalani proses penyimpanan belum pernah dilaporkan.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengkaji potensi kapangasal serasah tanaman
hutan koleksi simpanan IPBCC (Institut Pertanian Bogor Culture Collection) sebagai
Manfaat Penelitian
Penelitian ini bermanfaat untuk memperoleh galur-galurkapang asal serasah
tanaman hutan yang potensial dalam memproduksi AIAdan toleran terhadap kondisi
asam setelah kultur menjalani penyimpanan. Informasi yang diperoleh dari penelitian
ini diharapkan dapat menjadi landasan pengetahuan dalam manipulasi lingkungan
pertanaman dengan menggunakan mikroorganisme untuk peningkatan produktivitas
HTI di Indonesiapada lahan masam,pemanfaatan potensi mikroorganisme sebagai
penghasil AIAuntuk skala industri, dan cara penyimpanan yang dapat menjamin
terjaganya potensi produksi AIA.
Hipotesis
1. Kapang asal serasah tanaman hutan berpotensi dalam menghasilkan AIA.
2. Penyimpanan berpengaruh terhadap kemampuan kapang untuk memproduksi
AIA.
3. Produksi AIA oleh kapang dipengaruhi oleh pH medium produksi.
4. Kapang dalam konsorsium bersinergi dalam hidupnya.
5. Kapang dalam bentuk konsorsium berpotensi untuk memproduksi AIA dalam
TINJAUAN PUSTAKA
Metabolit Sekunder yang Dihasilkan oleh Kapang
Beberapa cendawan berfilamen menghasilkan metabolit sekunder (Calvoet al.
2002). Cendawan hanya disaingi oleh Actinomycetes dan tanaman dalam
memproduksi berbagai metabolit sekunder.
Metabolitsekundermerupakanmetabolit yang biasanyamemiliki
strukturkimia yang unik dantidak berperan dalam pertumbuhan somatik, tetapi
berperan untuk bertahan hidup (Demain 1986). Metabolit sekunder yang diproduksi
oleh cendawan sebagian besar dibentuk pada fase stasioner (Griffin 1994; Calvoet al.
2002). Produk metabolit pada fase ini sering berhubungan dengan diferensiasi dan
sporulasi (Kavanagh 2005). Faktorlingkungandangenetik sangat
mempengaruhiproduksimetabolitsekunder ini (Calvoet al. 2002; Fox & Howlett
2008). Beberapa metabolit memiliki aktivitas biologis, sehingga di antara metabolit
ini sering dieksploitasi secara komersial (Kavanagh 2005).
Senyawa metabolit sekunder dapat tergolong sebagai antibiotik, biopestisida,
mikotoksin, pigmen, terpenoid, steroid, flavonoid, alkaloid, fitohormon, dan enzim
(Demain 1986; Calvo et al. 2002). Di antara metabolit sekunder ini, beberapa
memiliki manfaat penting dalam pertanian, perkebunan, dan kehutanan seperti
senyawa antifungi, antibiotik, asam amino, asam organik, serta fitohormon
(Kavanagh 2005). Salah satu fitohormon yang tergolong metabolit sekunder dari
cendawan ialah AIA (Bau 1981; Tuomi et al. 1995; Roco & Perez 2001; Hasan
2002). AIA merupakan salah satu jenis dari auksin (Taiz&Zeiger 2002; Davies 2004).
Biosintesis dan Fungsi Asam Indol Asetat
Asam indol asetat merupakan salah satu hormon auksin yang aktif
berpengaruh terhadap pertumbuhan dan perkembangan tumbuhan. Setelah penemuan
AIA pada tumbuhan tinggi, aktivitas AIA juga ditemukan pada beberapa cendawan
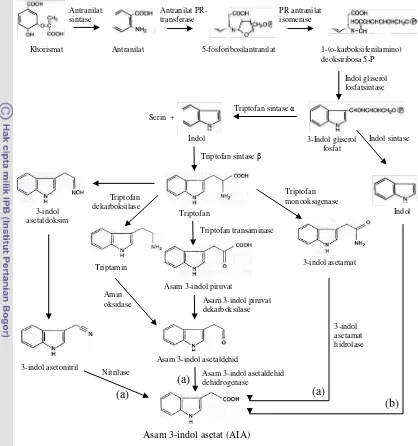
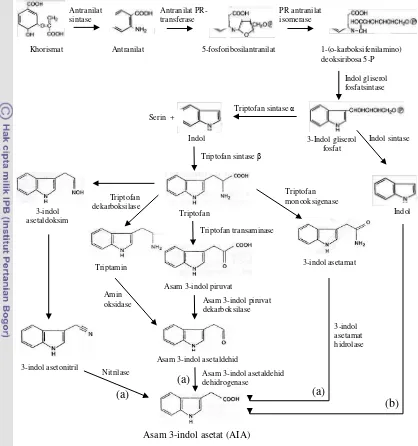
Gambar 1 Skema lintasan pembentukan AIA: (a) lintasan bergantung triptofan (b) lintasan tidak bergantung triptofan (Taiz&Zeiger 2002; Davies 2004; Woodward &Bartel 2005).
Ada dua jalur pembentukan AIA (Taiz&Zeiger 2002; Davies 2004;
Woodward &Bartel 2005; Saupe et al. 2007) yaitu lintasan bergantung triptofan dan
lintasan tidak bergantung triptofan (Gambar 1). Lintasan bergantung triptofan
prekursornya. Perubahan konfigurasi triptofan menjadi AIA dapat terjadi melalui
proses: (1) transaminasi yang kemudian diikuti oleh dekarboksilasi; (2)
dekarboksilasi yang kemudian diikuti oleh transaminasi; (3) pembentukan AIA
melalui oxime (C=NOH) dan nitril (CN). Lintasan tidak bergantung triptofan
merupakan lintasan biosintesis AIA yang tidak secara langsung menggunakan asam
amino triptofan sebagai prekursor. Pembentukan AIA menggunakan
senyawa-senyawa antara dalam lintasan pembentukan auksin (Taiz&Zeiger 2002; Davies
2004; Woodward &Bartel 2005; Saupe et al. 2007).
Auksin (AIA) berfungsi dalam proses: (1) perpanjangan sel dan pelenturan
dinding sel; (2) diferensiasi sel, misalnya merangsang diferensiasi pada jaringan
berkas pengangkut (xilem dan floem); (3) merangsang pembentukan gas etilen; (4)
menghambat perpanjanganakar jika diberikan dengan konsentrasi AIA lebih dari 10-6
M; (5) merangsang pertumbuhan akar lateral, dan akar adventif; (6) merangsang
pembungaan pada tanaman nenas dan cucurbitaceae; dan (7) mempengaruhi
dominasi apikal(Taiz&Zeiger 2002; Davies 2004; Woodward &Bartel 2005; Saupe et
al. 2007). AIA yang dihasilkan oleh meristem apikal baik yang di ujung batang
maupun di ujung akar akan menghambat pertumbuhan tunas ketiak dan pembentukan
akar. Penerapan auksin alami dan sintetis meningkatkan pertumbuhan akar lateral dan
akar adventif(Patten & Glick 2002; Bao et al. 2004; Cornejo et al. 2009).
Tanamanumumnyamemilikisatuataulebihakarprimerdengan akarlateral yang
munculdenganpembelahanselperisikeltertentu (Patten & Glick 2002).
PertumbuhanakardirangsangolehAIA pada konsentrasiyang relatifrendah (10-12dan10 -9
M)dan dihambatolehkonsentrasiAIAyang lebih tinggi (Alvarez et al. 1989).
Potensi Cendawan Penghasil AIA
Asam indol asetatmemegang perananpenting dalam pengendalian proses
fisiologis pada tumbuhan. SintesisAIAtidakhanyaterbataspadatanamantinggi saja,
tetapi juga disintesis oleh khamir dancendawan berfilamen.Produksi AIA oleh
cendawan telah diketahui lebih tinggidibandingkan dengan tumbuhan tinggi,
Produksi AIAolehL. sajor-caju menurun jika medium kultur tidak
mengandung sumber nitrogen (N) eksogen dan diinkubasi dengan paparan
cahaya(Yurekliet al. 2003). Produksi AIA menjadi meningkat jika medium
kulturmengandung sumber N eksogen, pada pH 7,5, dan diinkubasi dalam kondisi
gelap, pada mesin penggoyang, serta pada suhu kamar. Dengan demikian,
konsentrasiAIApada mediumkultur L. sajor-caju sangat bergantungpada cara
inkubasi, suhu, kondisi kultur, pH, dan cahaya(Yurekliet al. 2003).
Cendawan lain sebagai penghasil AIA ialah Saccharomyces
cerevisiae,Aspergillus nigerdanColletotrichumgloeosporioides. AIAdiproduksi oleh
S. cerevisiae dan A. niger pada medium Czapek dengan penambahan triptofan, dalam
kondisi asam (pH 4,0), pada suhu kamar, dan diinkubasi pada mesin penggoyang
selama 10 hari di ruang gelap (Bau 1981). Prusty et al.(2004) menyatakan bahwa
AIAmempengaruhi pengembangan morfogenetik S. cerevisiae.Pada konsentrasi
tinggi, AIAmenghambat pertumbuhan sel-sel S. cerevisiae, sedangkan pada
konsentrasi yang lebih rendah menginduksi pembentukan filamen dan adhesi.
Penambahan triptofan ke dalam medium umumnya dilakukan karena triptofan
merupakan prekursor untuk pembentukan AIA(Taiz & Zeiger 2002; Davies 2004;
Woodward &Bartel 2005; Saupe et al. 2007). Penambahan triptofan eksogen ke
dalam medium kultur
ColletotricumgloeosporioidesdapatmeningkatkanbiosintesisAIA hingga 2,7kali
(Moar et al. 2004). Penelitian Moar et al. (2004) menunjukkan bahwa enzim untuk
sintesis AIA pada tingkatbasal tetap dipertahankanoleh cendawanbahkantanpa adanya
triptofan. Namun demikian, triptofanendogen dari cendawantidakmendukung dalam
produksi AIA. AktivitasenzimatikmeningkatdanAIA dapat diproduksi
ketikatriptofaneksogentelah tersediauntuk cendawan. Hasil inimenunjukkan
bahwaC.gloeosporioides memproduksiAIA di dalam tumbuhan
mampumemanfaatkantriptofan eksogen dari tumbuhan. Dengan demikian, tanaman
yang terinfeksi oleh C.gloeosporioidesmengandungkadarAIA yang lebih tinggi
Subbarayan et al. (2010) telah melakukan penelitian terhadap Colletotricum
sp. dalam memproduksi AIA. AIA asal Colletotricum sp. berpengaruh terhadap
pembentukan kalus pada kultur jaringan Alternanthera sessilis. AIA yang dihasilkan
sebesar 25 ppm dengan penambahan triptofan pada medium Czapek yang diinkubasi
di ruang gelap dengan suhu 26°C selama 5 hari.
Potensi produksi AIA asal cendawan juga dilaporkan oleh Tuomi et al.(1995).
Tuomi et al. (1995) menyatakan bahwa sebanyak 59% kapang yang diisolasi dari
kecambah gandum diantaranya ialah Fusarium sp., Alternaria infectoria, Aspergillus
flavus, Penicillium chrysogenum, Penicillium corylophilum, Epicoccum nigrum, dan
Hypocrea pulvinata mampu memproduksi AIA.AIA diproduksi oleh kapang-kapang
tersebut pada kultur dengan sumber karbon yang terbatas (glukosa), sumber nitrogen
berupa amonium tartrat, pH 5,8, dan kemudian diinkubasi di atas mesin penggoyang
(190 rpm) selama 9 hari pada suhu 27°C di ruang gelap (Tuomi et al. 1995).
Sebaliknya, menurut Hasan (2002), hanya F. oxysporum yang mampu memproduksi
AIA, sedangkan A. flavus, P. chrysogenum, dan P. corylophilum tidak dapat
memproduksi AIA. F. oxysporum yang dikulturkan di dalam 50 ml medium Czapek
dengan penambahan pepton 1% sebagai sumber N, dan 1% glukosa sebagai sumber
C, dan diinkubasi selama 15 hari pada suhu 28°C dapat menghasilkan AIA(Hasan
2002).
Trichoderma virens mampu menghasilkan senyawa kompleks indolik seperti
AIA, asam indol asetaldehid (AIAld), dan indol etanol (iet). Senyawa-senyawa ini
diduga berperan dalam pertumbuhan tanaman (Cornejo et al. 2009).
Trichodermasp.IPBCC 09.622 asal serasah tanaman hutan meranti dapat
memproduksi AIA hingga 12,42 kali lipat dari kontrol setelah penambahan pepton
1% dan 3 kali lipat dari kontrol setelah penambahan triptofan (Imaningsih 2010).
Tanah Masam
Tanahasam adalah tanah yang memiliki nilai pHkurangdari7,0. Setengah
daritanahsuburdi seluruh dunia, khususnyadi daerah yang
selalumengandungprotonbebaspadakonsentrasilebih besar dari1mmol m-3.Misalnya
tanahdidaerah hutan tropislembab dantanahdilahan basah, tanahnya sangat
dipengaruhi olehreaksi oksidasi serta aktivitas biota (Sposito 2008).
pH tanah sering disebut sebagai variabel utama dan sangat berpengaruh dalam
proses dan reaksi kimia di dalam tanah. Semua asam mengandung ion hidrogen dan
kekuatan asamnya tergantung kepada derajat ionisasi (pelepasan ion hidrogen) dari
suatu senyawaasam (Sparks2003).Berdasarkan derajat kemasamannya, Sparks (2003)
menggolongkan tanah menjadi beberapa kelompok yaitu kemasaman tanah:(1)
ekstrem masam (pH tanah <4,5); (2) masam sangat kuat (pH tanah antara 4,5-5,0); (3)
sangat masam (pH tanah antara 5,1-5,5); (4) moderat masam (pH tanah antara
5,6-6,0); (5) masam ringan hingga netral(pH tanah antara 6,1-7,3); dan (6) basa ringan
(pH tanah antara 7,4-7,8).
pH tanah yang masam berpengaruh nyata terhadap mikroorganisme dan
kelarutan nutrisi tanaman di dalam tanah (Sparks 2003). pH tanah yang terlalu rendah
menyebabkan tidak tersedianya unsur hara tanaman di dalam tanah, seperti hara P, K,
Ca, Mg dan unsur mikro yang menyebabkan tanaman kekurangan unsur hara
sehingga pertumbuhan dan hasil tanaman tidak optimal (Ispandi& Munip 2005).
Hujanasammemilikiefekyang signifikantidak
hanyapadapohontetapijugapadakimiatanah.Pengapuranhutanjarang
dilakukandanhujanasamdapatmenyebabkanpencuciankationnutriensepertiCa2+, K+,
Mg2+, di dalam tanah, mengakibatkanpH rendahdanlogamberacunsepertiAl3+danMn2+
Lahan tanah masammasih memiliki potensi untuk pengembangan pertanian, baik tanaman pangan,perkebunan, maupun tanaman hutan. Secara alami, tanah ini mempunyai kesuburan yang rendah dan peka terhadaperosi.Wilayah lahan masam denganrelief datar hingga berombak dapat dimanfaatkan untuk tanaman pangan semusim, sedangkanrelief berbukit dapat dikembangkan dengan tanaman tahunanatau perkebunan dan hutan tanaman industri. Teknologi pengelolaanlahan seperti pemupukan untuk memperbaiki kandungan hara tanah, pengapuran untuk
meningkatkan pH tanahdan menurunkan reaktivitas Al3+, serta tindakan konservasi tanah sangat disarankan(Suharta 2010).
BAHAN DAN METODE
Bahan
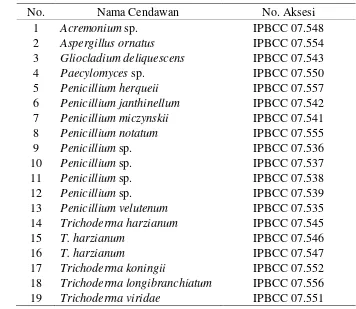
Bahanyang digunakan dalam penelitian ini ialah sebanyak 51biakan kapang
asal serasah tanaman hutan koleksi IPBCC yaitu 19 kapang asal Katingan,
Kalimantan Tengah (Tabel 1) dan 32 kapang asal Tarakan, Kalimantan Timur (Tabel
2), media potato dextrose agar (PDA), media Czapek Dox cair, pereaksi Salkowski,
pepton, kertas saring Whatman No.1.
Tabel 1 Kapang asal serasah tanaman hutan dari Katingan
No. Nama Cendawan No. Aksesi
1 Acremonium sp. IPBCC 07.548
2 Aspergillus ornatus IPBCC 07.554 3 Gliocladium deliquescens IPBCC 07.543
4 Paecylomyces sp. IPBCC 07.550
5 Penicillium herqueii IPBCC 07.557 6 Penicillium janthinellum IPBCC 07.542 7 Penicillium miczynskii IPBCC 07.541 8 Penicillium notatum IPBCC 07.555
9 Penicillium sp. IPBCC 07.536
10 Penicillium sp. IPBCC 07.537
11 Penicillium sp. IPBCC 07.538
12 Penicillium sp. IPBCC 07.539
13 Penicillium velutenum IPBCC 07.535 14 Trichoderma harzianum IPBCC 07.545
15 T. harzianum IPBCC 07.546
16 T. harzianum IPBCC 07.547
Tabel 2 Kapang asal serasah tanaman hutan dari Tarakan
No. Nama Cendawan No. Aksesi
1 Acremonium sp. IPBCC 08.574
2 Acremonium sp. IPBCC 08.600
3 Acremonium sp. IPBCC 08.601
4 Aspergillus foetidus IPBCC 08.575 5 Aspergillus japanicum IPBCC 08.576
6 A. japonicum IPBCC 08.608
7 A. japonicum IPBCC 08.609
8 Aspergillus niger IPBCC 08.610
9 Aspergillus Ochraceus IPBCC 08.577 10 Aspergillus parasiticus IPBCC 08.611
11 Diplodina sp. IPBCC 08.579
12 Gliocladium roseum IPBCC 08.614
13 Gliocladium sp. IPBCC 08.584
14 Gliocladium sp. IPBCC 08.585
15 Gliocladium sp. IPBCC 08.607
16 Penicillium aurantiocandidum IPBCC 08.587
17 P. aurantiocandidum IPBCC 08.588
18 Penicillium citrinum IPBCC 08.589 19 Penicillium corylophilum IPBCC 08.590
20 P. corylophilum IPBCC 08.591
21 P. corylophilum IPBCC 08.592
22 Penicillium decumbens IPBCC 08.616 23 Penicillium piscarium IPBCC 08.593 24 Penicillium roseopurpureum IPBCC 08.594
25 P. roseopurpureum IPBCC 08.595
26 P. roseopurpureum IPBCC 08.596
27 P. roseopurpureum IPBCC 08.603
28 Penicillium steckii IPBCC 08.597
29 P. steckii IPBCC 08.598
30 Trichoderma harzianum IPBCC 08.605
31 Trichoderma sp. IPBCC 08.599
Metode
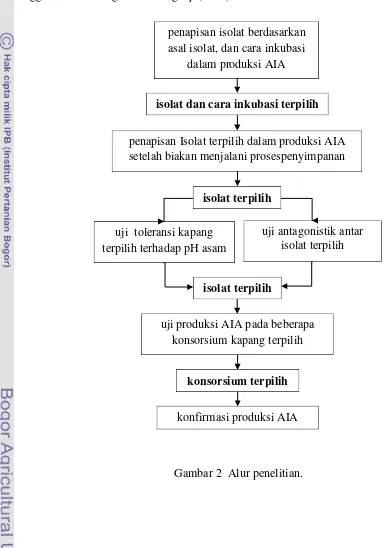
Penelitian ini dilakukan secara bertahap mengikuti alur penelitian pada
Gambar 2. Data yang diperoleh selanjutnya dianalisis secara statistik dengan
menggunakan rancangan acak lengkap (RAL).
Gambar 2 Alur penelitian. penapisan isolat berdasarkan asal isolat, dan cara inkubasi
dalam produksi AIA
penapisan Isolat terpilih dalam produksi AIA setelah biakan menjalani prosespenyimpanan
uji toleransi kapang terpilih terhadap pH asam
uji produksi AIA pada beberapa konsorsium kapang terpilih
uji antagonistik antar isolat terpilih
konfirmasi produksi AIA
isolat dan cara inkubasi terpilih
isolat terpilih
isolat terpilih
Peremajaan Biakan
Kultur stok diremajakan pada media PDA selama 7-10 hari dan digunakan
sebagai sumber biakan kerja.
Penapisan Kapang yang Berpotensi dalam Produksi AIA
Potensi kapang dalam produksi AIA diukur sebelum dan setelah kapang
disimpan selama tiga bulan di dalam lemari pendingin pada suhu 10°C.
Sebanyak tiga potong biakan kerja (masing-masing berdiameter 5 mm)
diinokulasikan ke dalam 50 ml media Czapek Dox cair (Lampiran 1) dengan
ditambahkan sumber N berupa pepton 1% (Hasan 2002). Kultur diinkubasi dalam
keadaan statis dan di atas mesin penggoyang pada suhu ruang dengan kondisi
gelapselama 9 hari.
Pada akhir masa inkubasi, kadar AIA ditetapkan berdasarkan metode Patten
dan Glick (2002) yang dimodifikasi. Sebanyak 5 ml filtrat disentrifugasi pada
kecepatan 1.957 x g selama 5 menit. Sebanyak 1 ml supernatan ditambahkan dengan
4 ml pereaksi Salkowski (Lampiran 2). Selanjutnya supernatan dikocok dengan
vorteks dan didiamkan di ruang gelap pada suhu ruang selama 20 menit untuk
pengembangan warna.Perubahan warna menjadi merah muda menandakan adanya
AIA.Absorbansi supernatandibaca dengan menggunakan spektrofotometer
Thermospectronic Genesys20 pada panjang gelombang 530 nm. Konsentrasi AIA
(ppm) yang dihasilkan diperoleh melalui konversi absorbansi dengan menggunakan
kurva standar AIA.
Kapang-kapang dengan potensi produksi AIA tertinggi dipilih untuk
digunakan dalam penelitian selanjutnya. Cara inkubasi yang menghasilkan kadar AIA
tertinggi dipilih sebagai metode inkubasi.
Toleransi Kapang terhadap pH Asam
Sebanyak tiga potong biakan kerja kapang terpilih (masing-masing
berdiameter 5 mm) diinokulasikan ke dalam 50 ml media Czapek Dox cair dengan
hari dengan cara inkubasi terpilih pada suhu ruang dengan beberapa tingkat pH yang
berbeda (4,5; 5,0; dan 5,5). Tingkat keasaman diatur dengan menggunakan bufer
sitrat (0,1 M, pH 3,0-6,2) sebagai pelarut. Pada akhir masa inkubasi, sebanyak 5 ml
filtrat disentrifugasi pada kecepatan 1.957 x g selama 5 menit. Kadar AIA pada
supernatan ditetapkan dengan metode Patten dan Glick (2002). Pertumbuhanyang
dinyatakan dalam berat kering biomasa dan pH akhir medium juga diamati. Kapang
yang menghasilkan AIA dengan kadar AIA tertinggi dan toleran terhadap kondisi
asam digunakan dalam uji produksi AIA selanjutnya. pH medium yang menunjukkan
produksi AIA maksimum digunakan untuk penelitian selanjutnya.
Uji Antagonistik
Sebelum produksi AIA dalam bentuk konsorsium, kapang terpilih terlebih
dahulu diuji potensi antagonistiknya. Uji antagonistik dilakukan dengan
menggunakan uji konfrontasi langsung dua koloni secara in vitro(Abdel-Sater 2001)
antar isolat kapang terpilih. Interaksi antagonistik antar isolat kapang terpilih
dilakukan dengan menumbuhkan kedua kapang tersebut pada satu media PDA cawan
petri 10 cm secara berdampingan dengan jarak antar koloni 2 cm. Pertumbuhan kedua
kapang diukur setiap hari hingga hari kesembilan. Sifat antagonistik ditetapkan
berdasarkan persentase penghambatan. Persentase penghambatan pertumbuhan
diukur berdasarkan persamaan (r1-r2)/r1 x100%, dengan r1 adalah jari-jari dalam dari
kapang kontrol, dan r2
Sebanyak tiga potong biakan kerja kapangterpilih (masing-masing
berdiameter 5 mm) diinokulasikan ke dalam 50 ml media Czapek Dox cair dengan
ditambahkan sumber N berupa pepton 1% (Hasan 2002). Kultur diinkubasi selama 9 adalah jari-jari dalam dari kapang yang sama pada
perlakuan(Abdel-Sater 2001). Masing-masing perlakuan dan kontrol dilakukan
sebanyak tiga ulangan. Kapang-kapang yang tidak menunjukkan sifat antagonis
dijadikan sebagai sumber inokulum dalam uji produksi AIA dengan bentuk
konsorsium.
hari dengan cara inkubasi terpilih dan pH optimum pada suhu ruang dengan beberapa
bentuk konsorsiumdua biakan, tiga biakan, dan empat biakan kapang terpilih. Pada
akhir masa inkubasi, sebanyak 5 ml filtrat disentrifugasi pada kecepatan 1.957 x g
selama 5 menit. Kadar AIA pada supernatan ditetapkan dengan metode Patten dan
Glick (2002).
Konfirmasi Produksi AIA
Konsorsium terpilih diproduksi ulang untuk pengujian konfirmasi produksi
AIA dengan menggunakan high performance liquid chromatography (HPLC).
Analisis HPLC dilakukan di Laboratorium Residu Bahan Agrokimia, Balai Penelitian
Lingkungan Pertanian, Departemen Pertanian, Bogor dengan berdasarkan pada
prosedur analisis dari lembaga tersebut (Lampiran 6). Sebanyak 1 ml sampel
ditambahkan dengan 1 ml eter, kemudian dikocok dengan vorteks selama 1 menit.
Pembilasan dengan eter tersebut dilakukan sebanyak tiga kali. Filtrat eter ditampung
dan dikeringkan, kemudian dilarutkan dengan 2 ml metanol 60% dan dikocok dengan
vorteks. Selanjutnya filtrat disaring dengan milifor 0,45 µm, kemudian sebanyak 10
µL filtrat disuntikkan ke HPLC. HPLC yang digunakan yaitu merk Shimadzu
L20344700989 35 Mpa, dengan kolom C18, detektor SPD-M 20, fase
gerakmenggunakan metanol 60%, kecepatan aliran 0,5 ml/menit, waktu 15
menit,suhu 40°C, dan pada panjang gelombang 530 nm. Konsentrasi AIA (ppm)
ditentukan melalui konversi luas daerah serapan sampel terhadap kurva standar AIA
HASIL
Penapisan Kapang yang Berpotensi dalam Produksi AIA
Sebanyak 51 kapang asal serasah tanaman hutan yaitu 19 dari Katingan (Tabel
1) dan 32 dari Tarakan (Tabel 2) telah diuji potensinya dalam memproduksi AIA.
Kapang-kapang yang berasal dari dua daerah ini seluruhnya mampu menghasilkan
AIA dengan kadar yang sangat bervariasi (Lampiran 3). Secara umum,
kapang-kapang asal Katingan memproduksi AIA (1,92±0,26 ppm) lebih tinggi dibanding
kapang-kapang asal Tarakan (1,08±0,14 ppm) (Gambar 3a). Isolat kapang asal
Katingan merupakan isolat kapang terpilih dalam memproduksi AIA.
Produksi AIA dengan cara inkubasi statis (2,72±0,89 ppm) lebih tinggi
dibandingkan dengan cara digoyang (1,92±0,26 ppm) (Gambar 3b). Cara inkubasi
statis merupakan cara inkubasi yang dipilih dalam produksi AIA.
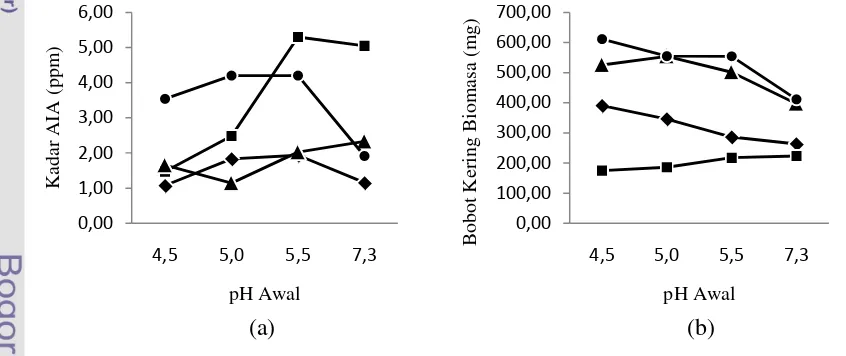
Gambar 3 (a)Rataan kadar AIA yang dihasilkan oleh isolat kapang asal Katingan dan Tarakan dengan inkubasi digoyang;(b) Rataan kadar AIA yang dihasilkan oleh isolat kapang asal Katingan dengan inkubasi statis dan digoyang.
Pengaruh penyimpanan terhadap produksi AIA dari 19 isolat kapang asal
Katingan bervariasi tergantung kepada jenis kapangnya. Sebesar 36,84% isolat
kapang asal Katingan dipengaruhi oleh proses penyimpanan dalam produksi AIA.
Produksi AIA pada kapang yang lainnya (63,16%) tidak dipengaruhi oleh proses
penyimpanan. Jika produksi AIA dipengaruhi oleh proses penyimpanan, maka
sebanyak 31,58% mengalami penurunan produksi AIA secara nyata dan sebaliknya
sebanyak 5,26% mengalami kenaikan produksi AIA secara nyata (Tabel 3).
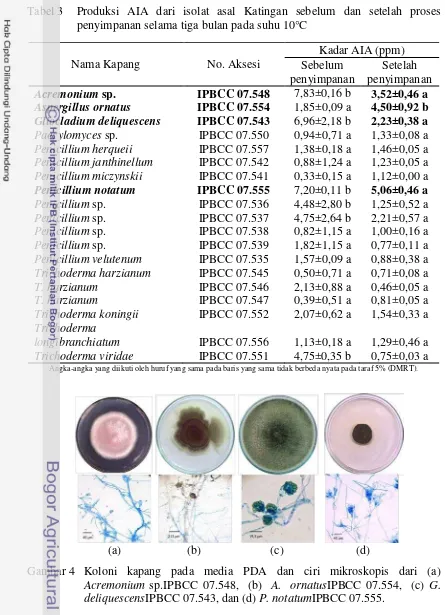
Tabel 3 Produksi AIA dari isolat asal Katingan sebelum dan setelah proses penyimpanan selama tiga bulan pada suhu 10°C
Nama Kapang No. Aksesi
Kadar AIA (ppm) Sebelum
penyimpanan
Setelah penyimpanan
Acremonium sp. IPBCC 07.548 7,83±0,16 b 3,52±0,46 a
Aspergillus ornatus IPBCC 07.554 1,85±0,09 a 4,50±0,92 b
Gliocladium deliquescens IPBCC 07.543 6,96±2,18 b 2,23±0,38 a
Paecylomyces sp. IPBCC 07.550 0,94±0,71 a 1,33±0,08 a Penicillium herqueii IPBCC 07.557 1,38±0,18 a 1,46±0,05 a Penicillium janthinellum IPBCC 07.542 0,88±1,24 a 1,23±0,05 a Penicillium miczynskii IPBCC 07.541 0,33±0,15 a 1,12±0,00 a
Penicillium notatum IPBCC 07.555 7,20±0,11 b 5,06±0,46 a
Penicillium sp. IPBCC 07.536 4,48±2,80 b 1,25±0,52 a Penicillium sp. IPBCC 07.537 4,75±2,64 b 2,21±0,57 a Penicillium sp. IPBCC 07.538 0,82±1,15 a 1,00±0,16 a Penicillium sp. IPBCC 07.539 1,82±1,15 a 0,77±0,11 a Penicillium velutenum IPBCC 07.535 1,57±0,09 a 0,88±0,38 a Trichoderma harzianum IPBCC 07.545 0,50±0,71 a 0,71±0,08 a T. harzianum IPBCC 07.546 2,13±0,88 a 0,46±0,05 a T. harzianum IPBCC 07.547 0,39±0,51 a 0,81±0,05 a Trichoderma koningii IPBCC 07.552 2,07±0,62 a 1,54±0,33 a Trichoderma
longibranchiatum IPBCC 07.556 1,13±0,18 a 1,29±0,46 a Trichoderma viridae IPBCC 07.551 4,75±0,35 b 0,75±0,03 a
Angka-angka yang diikuti oleh huruf yang sama pada baris yang sama tidak berbeda nyata pada taraf 5% (DMRT).
(a) (b) (c) (d)
Empat isolat kapang yang menghasilkan AIA tertinggi dijadikan sebagai
sumber inokulum pada uji selanjutnya. Empat isolat kapang tersebut diambil dari
hasil uji produksi AIA setelah penyimpanan ialah Acremonium sp.IPBCC
07.548(Gambar 4a) memproduksi AIA sebesar 3,52±0,46 ppm, A. ornatusIPBCC
07.554 (Gambar 4b)memproduksi AIA sebesar 4,50±0,92 ppm, G.
deliquescensIPBCC 07.543 (Gambar 4c)memproduksi AIA sebesar 2,23±0,38 ppm,
dan P. notatumIPBCC 07.555(Gambar 4d) memproduksi AIA sebesar 5,06±0,46
ppm.
Toleransi Kapang terhadap pH Asam
Produksi AIA dari keempat kapang terpilih dipengaruhi oleh pH medium. pH
optimum untuk produksi AIA bervariasi tergantung kepada jenis kapangnya (Gambar
5a). Namun secara umum, produksi AIA mencapai maksimum pada pH 5,5. pH
medium pada akhir masa produksi AIA berubah (meningkat atau menurun) dari pH
awalnya (Tabel 4).
Gambar 5 (a) Kadar AIA dan (b) bobot kering biomasa dari (
■
) Acremonium sp.IPBCC 07.548, (▲) A. ornatusIPBCC 07.554, (♦
) G. deliquescensIPBCC 07.543, dan (●
) P. notatumIPBCC 07.555.Bobot kering biomasa tidak berkorelasi nyata terhadap produksi AIA pada
berbagai pH awal medium.Pertumbuhan miselium (bobot kering
biomasa)menunjukkan pertumbuhan yang baik pada pH asam. Bobot kering biomasa
miselium A. ornatus IPBCC 07.554, G. deliquescens IPBCC 07.543,dan P. notatum
IPBCC 07.555 cenderung menurun dengan kenaikan pH media kultur. Sebaliknya,
bobot kering biomasa miselium Acremonium sp.IPBCC 07.548 cenderung
meningkat(Gambar 5b).
Tabel 4 pH awal dan pH akhir dalam produksi AIA pada kapang terpilih
pH awal
Angka-angka yang diikuti oleh huruf yang sama pada baris yang sama tidak berbeda nyata pada taraf 5% (DMRT).
Produksi AIA oleh Acremonium sp.IPBCC 07.548 optimum pada pH 5,5
(Gambar 5a), tumbuh optimum pada pH 7,3 (Gambar 5b), dan pH awal medium
cenderung tidak berubah kecuali pada pH awal medium 7,3menurun menjadi
5,85±0,07(Tabel 4).A. ornatus IPBCC 07.554sangat menurunkan pH mediumawalnya
(Tabel 4). A. ornatus IPBCC 07.554menunjukkan toleransi yang kuat terhadap asam
karena A. ornatus IPBCC 07.554tumbuh baik di pH asam dan tumbuh optimum pada
pH 5,0 (Gambar 5b). Namun demikian, produksi AIA dari A. ornatus IPBCC 07.554
sangat rendah pada pH asam tetapi optimum pada pH 7,3 (Gambar 5a), padahal pada
pH 7,3 tumbuhnya relatif terhambat (Gambar 5b).Pada akhir produksi AIA, pH akhir
medium G. deliquescens IPBCC 07.543 relatif tidak berubah dari pH awalnya (Tabel
4). Produksi AIA oleh G. deliquescens IPBCC 07.543 mencapai maksimum pada pH
5,5 dan tumbuh optimum pada pH 4,5 (Gambar 5b), tetapi pada pH ini produksi AIA
relatif rendah (Gambar 5a). pH akhir medium P. notatum IPBCC 07.555 cenderung
menurun (Tabel 4) dan menunjukkan toleransi terhadap kondisi asam. Hal ini
ditunjukkan oleh pertumbuhannya yang baik di pH asam dan optimum pada pH 4,5
(Gambar 5b).P. notatum IPBCC 07.555 selain menunjukkan pertumbuhan yang baik
asam (Gambar 5a). Produksi AIA dari P. notatum IPBCC 07.555 optimum pada pH
5,0 dan 5,5 (Gambar 5a).
Sifat Antagonistik
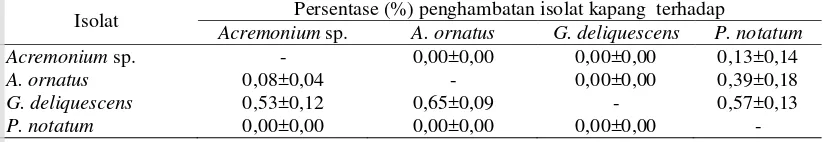
Uji antagonistik menunjukkan bahwa isolat-isolat kapang terpilih tidak
bersifat antagonis. Hal ini ditunjukkan oleh nilai persentase hambatan dari setiap
kapang yang diuji sangat rendah yaitu berkisar antara 0,00-0,65% (Tabel 5). Dengan
demikian, semua isolat kapang terpilih digunakan dalam uji produksi AIA dalam
bentuk konsorsium.
Tabel 5 Interaksi penghambatan pertumbuhan antara dua isolat kapang terpilih
Isolat Persentase (%) penghambatan isolat kapang terhadap
Acremonium sp. A. ornatus G. deliquescens P. notatum
Acremonium sp. - 0,00±0,00 0,00±0,00 0,13±0,14
A. ornatus 0,08±0,04 - 0,00±0,00 0,39±0,18
G. deliquescens 0,53±0,12 0,65±0,09 - 0,57±0,13
P. notatum 0,00±0,00 0,00±0,00 0,00±0,00 -
Produksi AIApada Beberapa Konsorsium Kapang
Secara umum, produksi AIA pada beberapa konsorsium kapang lebih tinggi
dibandingkan dengan bentuk kultur tunggal. Produksi AIAP. notatum IPBCC 07.555
dalam bentuk kultur tunggal menghasilkan AIA tertinggi. Kehadiran P. notatum
IPBCC 07.555 pada bentuk konsorsium apapun selalu menghasilkan kadar AIA yang
tinggi (Gambar 6).
Gambar 6 Produksi AIA dari kultur tunggal dan beberapa konsorsiumkapang. Keterangan: (A)Acremonium sp.IPBCC 07.548, (B)A. ornatusIPBCC 07.554, (C) G.
deliquescensIPBCC 07.543, (D)P. notatumIPBCC 07.555, (E)IPBCC 07.543+548, (F)IPBCC 07.543+554,(G) IPBCC 07.543+555, (H)IPBCC
07.548+554, (I)IPBCC 07.548+555, (J)IPBCC 07.554+555, (K)IPBCC 07.543+548+554, (L)IPBCC 07.543+548+555, (M)IPBCC 07.543+554+555, (N)IPBCC 07.548+554+555, (O)IPBCC 07.543+548+554+555.
Kemampuan kapang dalam produksi AIA bervariasi menurut bentuk
konsorsiumnya, yaitu berkisar 3,28±0,07 ppm hingga 10,51±1,25 ppm. Produksi AIA
tertinggi diperoleh oleh konsorsium G yaitu antara G. deliquescens IPBCC 07.543
denganP. notatum IPBCC 07.555 yang diikuti oleh konsorsium M, L, dan O
(Gambar 6). Produksi AIA tertinggi dari setiap bentuk konsorsium dikultur ulang
untuk uji konfirmasi produksi AIA dengan menggunakan HPLC.
Konfirmasi Produksi AIA
Uji konfirmasi produksi AIA dengan menggunakan HPLC dari konsorsium
terpilih (G, L, M dan O) menunjukkan bahwa produksi AIAtertinggi diperoleh oleh
konsorsium M yaitu sebesar 38,66 ppm diikuti oleh konsorsium O (23,58 ppm), G
(23,13 ppm), dan L (21,57 ppm) (Tabel 6).
Tabel 6 Konfirmasi produksi AIA dari konsorsium terpilih dengan menggunakan HPLC
Kode Sampel Kadar AIA (ppm)
kontrol 0,00
G 23,13
L 21,57
M 38,66
O 23,58
Kromatogram HPLC untuk produksi AIA dari setiap bentuk konsorsium
terpilih menunjukkan profil puncak dengan waktu retensi 7,1 (Gambar7). Waktu
retensi ini sama dengan waktu retensi pada kromatogram standar AIA dengan
konsentrasi 1 ppm, 5 ppm, 10 ppm, 15 ppm, dan 20 ppm (Lampiran 4). Profil puncak
dengan waktu retensi selain 7,1 (Gambar 7) diduga sebagai profil puncak untuk
(a) (b)
(b) (d)
PEMBAHASAN
Penapisan Kapang yang Berpotensi dalam Produksi AIA
Sebanyak 19 kapang asal serasah tanaman hutan dari Katingan dan 32 dari
Tarakan seluruhnya berpotensi menghasilkan AIA dengan kadar yang sangat
bervariasi. Secara umum, potensi produksi AIA oleh kapang-kapang asal Katingan
(1,92±0,26 ppm) lebih tinggi dibanding kapang-kapang asal Tarakan (1,08±0,14
ppm). Hal ini menunjukkan bahwa AIA selain disintesis oleh tumbuhan tinggi, tetapi
dapat juga disintesis oleh cendawan berfilamen AIA(Yurekliet al. 2003).
Medium kultur pada produksi AIA dari kapang asal kedua daerah tersebut
ditambahkan pepton 1%sebagai sumber nitrogen eksogen (Hasan 2002). Yurekliet
al. (2003) mengemukakan bahwa produksi AIApada L.
sajor-Produksi AIA dipengaruhi oleh suhu, cahaya, waktu inkubasi, maupun
sumber karbon yang tepat. Sumber karbon yang digunakan ialah sukrosa3%. Sukrosa
digunakan selain sebagai komponen standar dari media Czapek dox, juga merupakan
disakarida
caju menurun jika
medium kultur tidak mengandung sumber nitrogen eksogen. Namun, penambahan
0,015 ppm triptofan relatif tidak memberikan peningkatan produksi AIA pada
Penicillium sp. IPBCC 09.620, tetapi produksi AIAmeningkat hingga 27,78 kali dari
kontrol setelah penambahan pepton 1%ke dalam medium kultur (Imaningsih 2010).
Hasil penelitian pendahuluan terhadap beberapa kapang simpanan IPBCC
menunjukkan bahwa penambahan triptofan 0,0015-0,015 ppm ke dalam medium
kultur tidak menunjukkan adanya produksi AIA (data tidak dipublikasikan).
Penambahan triptofan eksogen pada konsentrasi tertentu menyebabkan kejenuhan dan
hambatan balik pada biosintesis AIA (Zhao et al. 2001). Kapang-kapang asal
Katingan dan Tarakan diduga mampu mensintesis triptofan endogen sebagai
prekursor AIA dengan menggunakan sumber N dari pepton.
yang seringdigunakanuntukproduksi metabolitsekunder (Adrio & Demain
2003). Glukosamerupakansumberkarbonyang pertama kali digunakanuntuk
memproduksisel dalam pertumbuhan somatis,sehingga berpengaruh terhadap
Produksi AIA juga dipengaruhi oleh cara inkubasi. Kapang yang diinkubasi
dalam keadaan statis (2,72±0,89 ppm) menghasilkan AIA dengan konsentrasi yang
lebih tinggi dibandingkan dengan cara digoyang (1,92±0,26 ppm). Hal ini berbeda
dengan laporanYurekliet al. (2003) yang mengemukakan bahwa produksi
AIAmenjadi meningkat jika kapang diinkubasi pada mesin penggoyang.
Pada inkubasi statis, miselium kapang tumbuh di permukaan medium dan
bersporulasi, sedangkan pada inkubasi digoyangkapang tumbuh membentuk butiran
(pelet) dan tidak bersporulasi. Miselium yang berbentuk pelet dan tidak bersporulasi
diduga berhubungan dengan pembentukan metabolit sekunder pada fase stasioner.
Fase stasioner berhubungan dengan diferensiasi, sporulasi, dan produksi metabolit
sekunder yang memiliki aktivitas biologi (Kavanagh 2005). Cara inkubasi digoyang
dapat menyebabkan struktur AIA rusak oleh oksigen karena proses dekarboksilasi
yang mengakibatkan hilangnya gugus karboksil (Taiz & Zeiger 2002).
Inkubasi kapang dalam produksi AIA dilakukan dalam kondisi gelap selama 9
hari. Kondisi gelap diharapkan dapat meningkatkan produksi AIA karena menurut
Yurekliet al. (2003) bahwa produksi AIApada L.
sajor-Berdasarkan hasil penapisan di atas, maka isolat asal Katingan dan cara
inkubasi statis dipilih untuk uji pengaruh proses penyimpanan terhadap produksi
AIA. Sebagian besar (63,16%) isolat kapang asal Katingan tidak dipengaruhi oleh
proses penyimpanan dalam memproduksi AIA. Jika dipengaruhi oleh penyimpanan,
hanya sebanyak 31,58% mengalami penurunan dan 5,26% mengalami kenaikan
dalam produksi AIA. Penurunan produksi AIA oleh sebagian kecil kapang asal
Katingan ini diduga disebabkan oleh subkultur berulang (Hall 1980;Qu et al.2006).
Subkultur berulang pada media agar-agaryang berbeda mengakibatkan (1) perubahan caju meningkat jika kultur
diinkubasi dalam keadaan gelap. Inkubasi selama 9 hari dilakukan untuk meyakinkan
bahwa fase pertumbuhan kapang benar-benar sudah berada pada fase stasioner. Pada
umumnya kapang mulai memasuki fase stasioner pada hari ketujuh (Griffin 1994).
Selain itu, waktu inkubasi dalam produksi AIA yang pernah dilakukan oleh peneliti
sebelumnya berkisar antara 5-15 hari (Bau 1981; Tuomi et al. 1995; Hasan 2002;
karakteristik morfologi dan fisiologi dari kultur murni sebelumnya;
(2)ketidakstabilanbiosintesismetabolitsekunder, hasil
metabolitberfluktuasi,danmenurunsecara drastisselamasiklussubkultur; dan
(3)ukuraninokulummemilikidampakbesarterhadap stabilitasbiosintesis metabolit
sekunder (Hall 1980; Qu et al.2006).
Penurunan aktivitas biosintesis AIA sebagai metabolit sekunder oleh kapang
asal serasah tanaman hutan diduga tidak ada hubungannya dengan proses
penyimpanan. Hal ini ditunjukkan oleh adanya ketidakkonsistenan produksi AIA dari
setiap kapang yang diuji. Ketidakkonsistenan respon ini setidaknya untuk beberapa
jenis tidak menunjukkan hubungan secara langsung terhadap lama penyimpanan
(Hwang 1976). Arabiet al. (2007) melaporkanbahwapenyimpanan dan
pengawetanCochliobolussativus menimbulkan masalah,yaitu kelangsungan hidup
yang rendah danakibat kontaminasiketika cendawan disimpandimedia PDA
Produksi AIA pada berbagai pH awal medium tidak berkorelasi nyata
terhadap bobot kering biomasa miselium. Pertumbuhan miselium (bobot kering
biomasa) menunjukkan pertumbuhan yang baik pada pH asam. Bobot kering biomasa
miselium A. ornatus IPBCC 07.554, G. deliquescens IPBCC 07.543, dan P. notatum .
Toleransi Kapang terhadap pH Asam
Kemampuan produksi AIA dari keempat kapang terpilih dipengaruhi oleh pH
medium. pH optimum untuk produksi AIA bervariasi tergantung pada jenis kapang.
Namun secara umum, produksi AIA mencapai maksimum pada pH 5,5. Walaupun
medium kultur dalam kondisi ekstrem masam (pH 4,5), masam sangat kuat(pH 5,0),
dan sangat masam (pH 5,5) (Sparks 2003)setiap kapang terpilih masihmampu
memproduksi AIA. Hal ini membuktikan bahwa kapang-kapang tersebut toleran
terhadap kondisi asam. Organisme toleran asam adalah organisme yangsecara genetik
toleran atau organisme yang telah mengalami prosesadaptasi fisiologi sehingga
menjadi toleran terhadap kondisi asam (Keyser & Munns 1979). Selain itu, Bau
(1981) menyatakan bahwa S.cerevisiae dan A. niger mampu memproduksi AIA pada
IPBCC 07.555 cenderung menurun dengan kenaikan pH medium kultur. Sebaliknya,
bobot kering biomasa miselium Acremonium sp.IPBCC 07.548 cenderung meningkat.
Rousk et al. (2009) mengemukakan bahwa pengaruh pH terhadap pertumbuhan
kapang dapat meningkat hingga lima kali jika kapang ditumbuhkan pada pH yang
lebih rendah (4,5-5,5).
Produksi AIA oleh Acremonium sp.IPBCC 07.548 optimum pada pH 5,5.
Acremonium sp.IPBCC 07.548 tumbuh optimum pada pH 7,3 dengan produksi AIA
relatif tinggi walaupun pH awal 7,3 menurun menjadi 5,85±0,07 pada akhir masa
inkubasi. Hal ini sejalan dengan pendapat Yunasfi (2008) yang menyatakan bahwa
pada umumnya Acremonium sp. tumbuh optimum pada pH 6 atau yang mendekati pH
netral walaupun belum ada laporanAcremonium sp. mampu memproduksi AIA.
Kemampuan Acremonium sp.IPBCC 07.548 memproduksi AIA pada pH sangat
masam (5,5) menunjukkan bahwa kapang ini toleran terhadap kondisi asam. Selain
itu, produksi AIA oleh Acremonium sp. IPBCC 07.548 pada pH awal 7,3 menurun
menjadi 5,85±0,07 mendekati pH optimum dalam produksi AIA. Kecilnya bobot
kering biomasa Acremonium sp. IPBCC 07.548 diduga disebabkan oleh kecepatan
pertumbuhan Acremonium sp. yanglambat(Yunasfi 2008).
Aspergillus ornatus IPBCC 07.554 menunjukkan toleransi yang kuat terhadap
kondisi asam karenaA. ornatus IPBCC 07.554 tumbuh baik di pH asam dan optimum
pada pH 5,0 serta sangat menurunkan pH awal medium. Namun demikian, produksi
AIA dari A. ornatus IPBCC 07.554 tergolong sangat rendah pada pH asam tetapi
optimum pada pH 7,3, padahal pada pH 7,3 tumbuh relatif terhambat. pH akhir yang
sangat rendah ini diduga disebabkan banyaknya asam-asam organik yang lain selain
AIA seperti asam oksalat, asam sitrat, dan asam glukonat yang dapat menurunkan pH
medium kultur (Santi et al. 2000).
Pada akhir masa inkubasi produksi AIA, pH akhir medium G. deliquescens
IPBCC 07.543 relatif tidak berubah dari pH awalnya. Produksi AIA oleh G.
deliquescens IPBCC 07.543 mencapai maksimum pada pH 5,5, tumbuh optimum
pada pH 4,5 dan cenderung menurun dengan meningkatnya pH medium kultur, tetapi
menunjukkan toleran terhadap kondisi asam. Selain itu, G. deliquescens IPBCC
07.543 mengindikasikan memiliki kemampuan tumbuh pada kisaran pH yang cukup
luas. Hal ini berbeda dengan G. roseum yang tumbuh optimum pada kisaran 6,4-8,0
(Isaac 1954).
Penicillium notatum IPBCC 07.555 selain menunjukkan pertumbuhan yang
baik di pH asam juga mampu memproduksi AIA dengan kadar yang cukup tinggi
pada pH asam. Produksi AIA dari P. notatum IPBCC 07.555 optimum pada pH 5,0
dan 5,5. pH akhir medium P. notatum IPBCC 07.555 cenderung menurun dan
menunjukkan toleran terhadap kondisi asam. Hal ini ditunjukkan oleh pertumbuhan
yang baik di pH asam dan optimum pada pH 4,5. Kapang P. notatum IPBCC 07.555
menunjukkan produksi AIA, pertumbuhan, dan toleran terhadap kondisi asam yang
lebih baik dibandingkan dengan kapang terpilih lainnya. Imaningsih (2010)
menyatakan bahwa Penicilliumsp. 09.620 asal serasah tanaman hutan meranti dapat
memproduksi AIA hingga 27,78 kali lipat dari kontrol setelah penambahan pepton
1%.
Sifat Antagonistik
Interaksi antagonistik pada isolat kapang terpilih tidak menunjukkan sifat
antagonis. Nilai persentase hambatan pertumbuhan dari setiap kapang yang diuji
sangat rendah yaitu berkisar antara 0,00-0,65%. Nilai penghambatan ini sangat kecil
jika dibandingkan dengan penghambatan oleh A. niger
Gliocladium deliquescens IPBCC 07.543 sama sekali tidak menunjukkan
adanya respon penghambatan dalam pertumbuhan dari setiap lawan antagonis kapang
terpilih. G. deliquescens dikenal sebagai kapang antagonis yang dapat menghambat
pertumbuhan kapang patogen (Abou-Zeid et al. 2008).G.deliquescens secara
signifikan menghambat pertumbuhan radial dari semua koloni patogen yang diuji bila
dibandingkan dengan kontrol. Sebesar 63,33% G. deliquescens menghambat terhadapFusarium solani yaitu
sebesar 75% (Madhanraj2010) danPleospora herbarum yaitu sebesar 55,4%
pertumbuhan P. chrysogenum dan 29,75% terhadap Cephalosporiummadurae(
Hasil uji konfirmasi produksi AIA dengan menggunakan HPLC menunjukkan
bahwa kapang-kapang dari konsorsium terpilih (G, L, M dan O) memproduksi AIA.
Hal ini ditunjukkan oleh profil puncak waktu retensi yang sama dengan waktu retensi
pada standar AIA komersial yaitu 7,1. Dengan demikian, senyawa indol yang
dihasilkan oleh konsorsium terpilih merupakan jenis AIA.Produksi AIAtertinggi
didapat oleh konsorsium M yaitu sebesar 38,66 ppm diikuti oleh konsorsium O
(23,58 ppm), G (23,13 ppm), dan L (21,57 ppm). Hasil uji kadar AIA pada
konsorsium kapang terpilih dengan menggunakan HPLC lebih tinggi dibanding hasil
pengujian dengan menggunakan pereaksi Salkowski. Hal ini menunjukkan
Abou-Zeidet al. 2008).
Produksi AIApada Beberapa Konsorsium Kapang
Produksi AIA pada beberapa konsorsium kapang secara umum lebih tinggi
dibandingkan dengan bentuk kultur tunggal. AIA yang diproduksi bervariasi
tergantung kepada bentuk konsorsiumnya, yaitu berkisar 3,28±0,07 ppm hingga
10,51±1,25 ppm. Mittal et al. (2008) melaporkan bahwa kadar AIA yang dihasilkan
oleh dua galurA.awamori dan empat galurP.citrinum dalam bentuk konsorsium yaitu
sebesar 2,5 ppm sampai dengan 9,8 ppm. Dengan demikian, kadar AIA yang
dihasilkan oleh kapang terpilih asal Katingan dalam bentuk konsorsium tersebut tidak
jauh berbeda dengan kadar AIA yang dilaporkan oleh Mittal et al. (2008), bahkan
sedikit lebih tinggi.
Produksi AIAP. notatum IPBCC 07.555 dalam bentuk kultur tunggal
menghasilkan AIA tertinggi. Kehadiran P. notatum IPBCC 07.555 pada bentuk
konsorsium cenderung selalu menghasilkan kadar AIA yang tinggi. Produksi AIA
tertinggi didapat oleh konsorsium G. deliquescens IPBCC 07.543 dengan P. notatum
IPBCC 07.555. Pandya dan Saraf (2010)mengemukakan bahwa Gliocladium dan
Penicilliummerupakan cendawan yang toleran terhadap cekaman dan mampu
membentuk asosiasi mutualistik yang mengakibatkan peningkatan biomasa.
sensitivitas dan akurasi HPLC jauh lebih tinggi dibanding pengukuran dengan
menggunakan pereaksi Salkowski (Guinn et al. 1986). HPLC memiliki sensitivitas
yang tinggi pada jalur detektor sehingga memungkinkan selektivitas yang tinggi
terhadap fraksi-fraksi yang diuji (Guinn et al. 1986).
Pengujian AIA dengan menggunakan HPLC biasanya tidak menggunakan
panjang gelombang 530 nm tetapi pada panjang gelombang 254 nm (Guinn et al.
1986). Panjang gelombang yang digunakan untuk uji konfirmasi AIA dengan HPLC
dari konsorsium kapang terpilih ialah sama dengan panjang gelombang pada uji AIA
dengan menggunakan pereaksi Salkowski yaitu 530 nm. Dengan menggunakan
panjang gelombang 530 nm ini, dihasilkan kromatogram dengan satu profil puncak
pada waktu retensi 7,1. Kenyataan ini mengindikasikan bahwa panjang gelombang
530 nm lebih spesifik untuk mendeteksi AIA. Menurut Guinn et al. (1986), pengujian
AIA dengan menggunakan panjang gelombang 254 nm kurang spesifik untuk AIA,
tetapi panjang gelombang ini dapat digunakan untuk uji AIA jika sampel sudah
dimurnikan dengan baik.
Berdasarkan hasil penelitian di atas, pengkajian lebih lanjut dari isolat-isolat
terpilih dalam penggunaan sumber glukosa, sumber nitrogen, suhu, dan waktu
inkubasi yang tepat untuk produksi AIA secara optimum perlu dilakukan. Selain itu,
pengkajian tentang aplikasi isolat terpilih baik pada skala laboratorium (bioasai)
maupun pada skala lapangan dalam kondisi asam, serta potensi isolat dalam produksi
SIMPULAN DAN SARAN
Simpulan
Kapang asal serasah tanaman hutan dari Katingan dan Tarakanseluruhnya
berpotensi sebagai penghasilAIAdengan kadar yang sangat bervariasi. Potensi
produksi AIAoleh kapang-kapang asal Katingan (1,92±0,26 ppm) lebih tinggi
dibanding kapang-kapang asal Tarakan (1,08±0,14 ppm). Produksi AIA dengan cara
inkubasi statis (2,72±0,89 ppm) lebih tinggi dibandingkan dengan cara digoyang
(1,92±0,26 ppm). Sebagian besar produksi AIA pada kapang asal Katingan (63,16%)
tidak dipengaruhi oleh proses penyimpanan pada suhu dingin (10°C) selama tiga
bulan. Produksi AIA dari empat isolat kapang asal Katingan terpilih yaitu
Acremonium sp.IPBCC 07.548(3,52±0,46 ppm),Aspergillus ornatusIPBCC
07.554(4,50±0,92 ppm),Gliocladium deliquescensIPBCC 07.543(2,23±0,38 ppm),
dan Penicillium notatumIPBCC 07.555(5,06±0,46 ppm) dipengaruhi oleh pH
medium.Kapang-kapang tersebut toleran terhadap asam pada pH optimum 5,5.
Pertumbuhan kapang dalam bentuk konsorsium tidak menunjukkan adanya
respon antagonistik antar isolat terpilih yang satu dengan yang lainnya. Produksi AIA
dari kapang-kapang terpilih dalam bentuk konsorsium lebih tinggi dibandingkan
dengan kultur tunggal.
Saran
Isolat kapang-kapang terpilih sebelum dijadikan sebagai agen produksi AIA
secara in vitro, informasi kinetika produksi dalam sistem fermentasi perlu dipelajari.
Jika isolat kapang-kapang terpilih ini dijadikan agen produksi AIA secara in planta,
DAFTAR PUSTAKA
Abdel-Sater MA. 2001. Antagonistic interactions between fungal pathogen and leaf surface fungi on onion (Allium cepa L). Pak J Biol Sci 29:29-34.
Abou-Zeid AM, Altalhi AD, El-Fattah ARI. 2008. Fungal control of pathogenic fungi isolated from somewild plants in Taif Governorate, Saudi Arabia.MalJ Microbiol4:30-39.
Adrio JL, Demain AL. 2003. Fungal biotechnology. Int Microbiol 6:191-199.
AlvarezR, Nissen SJ, Sutter EG. 1989. Relationship betweenindole-3-acetic acid levels in apple (Malus pumila Mill.) rootstocks culturedin vitro and adventitious root formation in the presence of indole-3-butyricacid. Plant Physiol 89:439–443.
ArabiMIE, Jawhar M, Al-Daoude A. 2007. Viability of Cochliobolus sativus cultures after storageunder different conditions.JPlant Pathol 89:79-83.
Bao Fet al. 2004. Brassinosteroids interact with auxin to promotelateral root development in Arabidopsis. Plant Physiol 134:1624–1631.
Bau YS. 1981. Indole compounds in Saccharomyces cerevisiae and Aspergillus niger. Bot Bull Acad Sinica 22:123-130.
Bilkay IS, Karakoc S, Aksoz N. 2010. Indole-3-acetic acid and gibberellic acid production in Aspergillus niger. Turk J Biol 34:313-318.
Calvo AM, Wilson RA,Bok JW,Keller NP. 2002.Relationship between secondary metabolism and fungal development. Microbiol Mol Biol Rev 66:447-459.
Chung KR, Tzeng DD. 2004. Biosynthesis of indole-3-acetic acid by gall-inducing fungus Ustilago esculenta. J Biol Sci 4:744-750.
Cornejo HAC, Rodríguez LM, Penagos CC, Bucio JL. 2009. Trichoderma virens, a plant beneficial fungus, enhances biomass production and promotes lateral root growth through an auxin. PlantPhysiol149:1579–1592.
Fox EM, Howlett BJ. 2008. Secondary metabolism: regulation and role in fungal biology. Microbiol 11:481-487.
Davies PJ. 2004. Plant Hormones: Biosynthesis, Signal Tranduction, Action. Ed. ke-3. Dordrecht: Kluwer Academic Publisher.