1
1.
PENDAHULUAN
1.1. Latar Belakang
Kebutuhan minyak bumi Indonesia terus mengalami peningkatan seiring dengan pertumbuhan dan pembangunan ekonomi nasional. Pada tahun 2011, kebutuhan Bahan Bakar Minyak (BBM) Indonesia mencapai 56 juta kiloliter per tahun dan terus meningkat dengan laju konsumsi rata-rata 4 persen per tahun. Sebaliknya, produksi Bahan Bakar Minyak (BBM) yang mampu diproduksi adalah 41 juta kiloliter per tahun yang terdiri atas premium 12 juta kiloliter, solar 18.3 juta kiloliter, kerosene 7 juta kiloliter, dan avtur sejumlah 3.3 juta kiloliter (Karyuliarto, 2011). Ketidakseimbangan antara kebutuhan dan produksi ini diperkirakan dapat menimbulkan krisis energi (BBM), sehingga upaya penyediaan bahan bakar alternatif menjadi sangat penting diantaranya, melalui bahan bakar nabati.
Saat ini upaya pengembangan bahan baku telah dilakukan seperti crude palm oil (CPO) dari kelapa sawit, corn, soybean, canola, jatropha, coconut, dan mikroalga dengan kapasitas produksi tanaman adalah jagung 172 liter per hektar, kedelai 446 liter per hektar, minyak zaitun 1190 liter per hektar, jarak 1892 liter per hektar, kacang-kacangan 2689 liter per hektar, kelapa sawit 5950 liter per hektar, dan mikroalga 58700 liter per hektar (Chisti, 2007).
2
contoh, setiap 1 ton minyak kelapa sawit yang diproduksi diperkirakan akan dihasilkan 33 ton CO2 akibat konversi hutan (Kardono, 2008). Oleh karena itu, pemakaian suatu bahan bakar terbarukan yang lebih aman bagi lingkungan perlu dilakukan.
Salah satu bahan baku yang memiliki potensi dan aman bagi lingkungan adalah mikroalga. Mikroalga dapat diekstraksi secara besar-besaran dalam menghasilkan biofuel. Penghasil bahan bakar nabati ini dapat diproduksi dalam waktu yang sangat singkat serta proses produksinya dapat dikatakan ramah lingkungan. Selain itu mikroalga juga berpotensi untuk menyerap gas buang CO2 yang dihasilkan oleh proses pembakaran baik kendaraan, industri, respirasi, dan dekomposisi (Wiyarno, 2009). Indonesia memiliki wilayah perairan yang sangat luas yang berpotensi untuk kultur mikroalga, Sehingga budidaya mikroalga untuk ekstraksi biofuel sesuai untuk dilakukan di Indonesia.
3
1.2. Tujuan
Tujuan dari Penelitian ini untuk :
- Membandingkan kandungan lipid tiga spesies diatom (Chaetoceros gracilis, Skeletonema costatum, dan Thalassiosira sp.).
4
2. TINJAUAN PUSTAKA
2.1. Biologi, Morfologi, dan Habitat Diatom
Diatom merupakan mikroalga uniseluler yang distribusinya sangat universal di semua tipe perairan. Disebut diatom karena selnya terdiri dari 2 bagian (2 atom), dimana yang satu menutupi yang lain seperti layaknya kaleng pastiles (Basmi, 1999). Diatom diklasifikasikan kedalam dua order berdasarkan bentuk selnya yaitu diatom pennate (Pennales) dengan bentuk bilateral simetris dan diatom centris (Centrales) dengan bentuk radial simetris (lingkaran) apabila dilihat dari atas (Pandey dan Trivedi, 2005; Basmi, 1999). Pada Centrales hiasan valvanya berbentuk jari-jari lingkaran, sedangkan pada Pennales secara bilateral. Pergerakan tidak pernah dijumpaipada jenis-jenis anggota Centrales, namun hanya pada pennales yang valvanya berbentuk memanjang (Basmi, 1999). Diatom mempunyai keunikan yang sangat spesifik, karena arsitektur dan anatomi dinding selnya tersusun dari silika, sehingga dapat tersimpan dalam kurun waktu yang sangat lama di dalam sedimen (Soeprobowati dan Suwarno, 2009). Diatom Centrales akan lebih sering kita temui pada air laut dan payau dibandingkan air tawar (Darley, 1982), sedangkan diatom pennate menempel pada tanaman, hewan, batuan atau butir pasir dengan sebuah lapisan getah atau tangkai (Darley, 1982).
5
2.1.1. Skeletonema costatum
Klasifikasi Skeletonema costatum menurut Bougis (1979) in Tjahjo et al. (2002) dan Edhy et al. (2003) adalah sebagai berikut :
Divisi : Chrysophyta Clasis : Bacillariophyceae Ordo : Centrales
Family : Skeletonemoidae Genus : Skeletonema
Spesies : Skeletonema costatum
Skeletonema costatum memiliki sel yang dipenuhi oleh sitoplasma,
membentuk untaian rantai yang terdiri dari epiteka pada bagian atas dan hipoteka pada bagian bawah (Isnansetyo dan Kurniastuty, 1995). Dinding sel Skeletonema costatum mempunyai frustula yang menghasilkan skeletal external berbentuk silindris (cembung) dan mempunyai duri-duri yang berfungsi sebagai penghubung antar frustula sehingga membentuk filamen (Kamat 1976 in Tjahjo et al., 2002). Bentuk sel Skeletonema costatum dapat dilihat pada Gambar 1.
Skeletonema costatum merupakan diatom yang bersifat eurytermal yaitu mampu tumbuh pada kisaran suhu 3–30 oC dan temperatur optimal adalah 25-27 o
C (Susetyowati, 1994 in Tjahjo et al., 2002). Daerah penyebarannya meliputi daerah tropis dan subtropis mulai dari pantai sampai lautan, sebagai meroplankton dan benthos. Diatom laut, Skeletonema costatum memiliki kandungan
6
. Sumber : planktonnet.awi.de (2010)
Gambar 1. Bentuk sel Skeletonema costatum 2.1.2. Thalassiosira sp.
Klasifikasi Thallassiosira sp. menurut (Edhy et al., 2003) adalah sebagai berikut :
Divisi : Chrysophyta Kelas : Bacillariophyceae Ordo : Centrales
Famili : Coscinodiscineae Genus : Thalassiosira Spesies : Thallassiosira sp.
Sel Thalassiosira sp. menempel dalam sebuah massa mukus. Pori-pori sentral mukus ini disebut dengan single apikulus, benang mukus ini
7
Thalassiosira sp. merupakan diatom yang bersifat eurytermal yaitu mampu tumbuh pada kisaran suhu 10–30 oC dan temperatur optimal sekitar 21 oC. Daerah penyebarannya meliputi perairan tawar dan payau habitat pesisir (Kipp, 2007). Diatom laut, Thalasiossira sp. pada kondisi medium N:P:Si= 11:1:6 memberikan biomassa sebesar 0.067 g/mL, dengan kandungan karbohidrat sebesar 7.7%, kandungan protein sebesar 0.93% dan kandungan lemak sebesar 9.69% (Purba, 2008).
Sumber : Becerril et al. (2009)
Gambar 2. Bentuk sel Thalassiosira delicatula
2.1.3. Chaetoceros gracilis
Klasifikasi Chaetoceros gracilis menurut (Zipcodezoo, 2009 dan Edhy et al., 2003)adalah sebagai berikut :
Divisi : Chrysophyta Classis : Bacillariophyceae Ordo : Centrales
8
Genus : Chaetoceros
Spesies : Chaetoceros gracilis
Chaetoceros gracilis memiliki sel yang tidak berantai, dan bercangkang cembung. Setai muncul pada sudut-sudutnya, membentuk kurva dan kemudian menjadi parallel bentuknya, spora terdapat di tengah-tengah sel induk dan bercangkang kasar, panjang apikal axisnya 6-10 µm (Suantika et al., 2009). Chaetoceros gracilis adalah spesies yang non motil, bercangkang simetris, sitoplasmanya memiliki sejumlah kecil kromatofora, dan akan berwarna kuning keemasan hingga coklat pada kultur buatan (Gambar 3) (Isnansetyo dan
Kurniastuty, 1995).
Chaetoceros gracilis dapat hidup pada temperatur 25-30 oC, pada suhu 40oC masih dapat bertahan hidup namun tidak berkembang, sehingga Chaetoceros gracilis merupakan diatom yang bersifat eurytermal. Daerah penyebarannya meliputi muara sungai, pantai, dan laut pada daerah tropis dan subtropis
(Isnansetyo dan Kurniastuty, 1995). Bentuk sel Chaetoceros gracilis dapat dilihat pada Gambar 3. Diatom laut, Chaetoceros gracilis memiliki kandungan
9
Sumber : iats.csic.es (2009)
Gambar 3. Bentuk sel Chaetoceros gracilis 2.2. Lipid dan Fatty Acids pada Mikroalga
Lipid adalah senyawa yang tidak larut dalam air tapi larut dalam pelarut organik seperti kloroform, heksan, toulen, dan aseton. Lipid bisa membentuk kombinasi dengan senyawa sederhana lainnya, seperti ester lilin, trigliserida, dan fosfolipid (McSween et al., 2003). Lipid disintesis dari karbohidrat dan protein, karena dalam metabolisme ketiga zat tersebut bertemu di dalam daur Krebs. Pertemuan di dalam daur krebs berlangsung melalui pintu gerbang utama siklus (daur) Krebs, yaitu Asetil Ko-enzim A, akibatnya senyawa lipid, karbihidrat, dan protein dapat saling mengisi sebagai bahan pembentuk semua zat tersebut. Lipid dapat dibentuk dari protein dan karbohidrat, karbohidrat dapat dibentuk dari lemak dan protein dan seterusnya.
10
gula fosfat kemudian menjadi asetil ko-A sehingga menghasilkan asam lemak. Gliserol dan asam lemak jika digabungkan akan menghasilkan lipid (Campbell et al., 2002). Sintesis lipid dari protein diawali dengan perubahan protein menjadi asam amino dengan bantuan enzim protease, sebelum terbentuk lemak asam amino mengalami deaminasi terlebih dahulu, setelah itu memasuki daur Krebs. Banyak jenis asam amino yang langsung ke asam piruvat sehingga menghasilkan asetil ko-A. Asam amino serin, alanin, valin, leusin, isoleusin dapat terurai menjadi asam piruvat, selanjutnya asam piruvat menjadi gliserol sehingga menghasilkan fosfogliseroldehid. Fosfogliseroldehid dengan asam lemak akan mengalami esterifikasi membentuk lipid (Campbell et al., 2002). Gambar 4 menunjukan proses sintesa lipid dari glukosa dan asam piruvat.
Sumber : pancreaticdiseasecenter.org (2010) Gambar 4. Diagram proses sintesa lipid
11
pertumbuhan dan kondisi lingkungan yang bervariasi, sehingga mempengaruhi proporsi kedua komponen tersebut secara relatif (Borowitzka, 1988). Jumlah kandungan lipid pada mikroalga berkisar kira-kira 1-70 % dari berat kering (Borowitzka, 1988).
Lipid dalam mikroalga merupakan komponen yang tersusun dari neutral lipid dan polar lipid. Neutral lipid terdiri dari trigliserida, waxe ester,
hidrokarbon, free fatty acids, dan sterol, sedangkan polar lipid tersusun atas komponen seperti phospholipids, glikolipid, dan karotenoids (Wiyarno, 2009). Gambar struktur molekul dari komponen-komponen lipid dapat dilihat pada Tabel 1.
Bentuk lemak terbesar yang terkandung dalam sel mikroalga adalah triglycerides (TAGs) yang dapat mencapai 80% dari total keseluruhan lemak. Lemak ini merupakan yang terpenting dari mikroalga karena merupakan jenis minyak yang baik untuk memproduksi biodiesel. Lemak mikroalga biasanya merupakan ester yang terdiri dari gliserol dan asam lemak dengan panjang rantai C14 sampai C22. Komposisi asam lemak pada mikroalga yaitu berupa
12
Tabel 1. Struktul molekul komponen-komponen lipid
Kategori Struktur Molekul
Trigliserida
Fatty Acids
Sterol
Gliserolphospolipid
Karotenoids
Sumber : (Jakubowski, 2012)
13
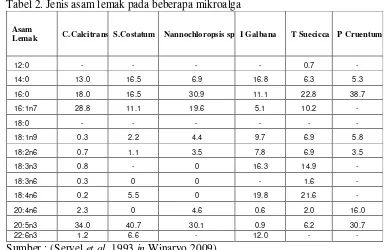
bernilai seperti asam lemak omega 3 yaitu asam docosahexanoic (DHA) (Borowitzka, 1988).
Tabel 2. Jenis asam lemak pada beberapa mikroalga
Asam
Lemak C.Calcitrans S.Costatum Nannochloropsis sp. I Galbana T Suecicca P Cruentum
12:0 - - - - 0.7 -
14:0 13.0 16.5 6.9 16.8 6.3 5.3
16:0 18.0 16.5 30.9 11.1 22.8 38.7
16:1n7 28.8 11.1 19.6 5.1 10.2 -
18:0 - - - -
18:1n9 0.3 2.2 4.4 9.7 6.9 5.8
18:2n6 0.7 1.1 3.5 7.8 6.9 3.5
18:3n3 0.8 - 0 16.3 14.9 -
18:3n6 0.3 0 0 - 1.6 -
18:4n6 0.2 5.5 0 19.8 21.6 -
20:4n6 2.3 0 4.6 0.6 2.0 16.0
20:5n3 34.0 40.7 30.1 0.9 6.2 30.7
22:6n3 1.2 6.6 - 12.0 - -
Sumber : (Servel et al. 1993 in Winaryo 2009) 2.3. Mikroalga Untuk Produksi Biodiesel
Biodiesel adalah bahan bakar yang tersusun dari monoalkil ester rantai panjang fatty acids yang merupakan turunan dari minyak tumbuhan dan lemak hewani. Biodiesel dapat diperoleh melalui reaksi transesterifikasi trigliserida atau reaksi esterifikasi asam lemak bebas tergantung dari kualitas minyak nabati yang digunakan sebagai bahan baku. Transesterifikasi adalah proses yang mereaksikan trigliserida dalam minyak nabati atau lemak hewani dengan alkohol rantai pendek seperti methanol menghasilkan metil ester asam lemak (Fatty Acids Methyl Esters/ FAME) atau biodiesel dan gliserol (Ma et al., 1999).
Berdasarkan kandungan FFA dalam minyak nabati maka proses pembuatan biodiesel dibedakan menjadi 2 yaitu, transesterifikasi dengan katalis basa
14
atau minyak nabati dengan kandungan FFA rendah (<5%) dan esterifikasi dengan katalis asam (umumnya menggunakan asam sulfat) untuk minyak nabati dengan kandungan FFA tinggi (>5%) (Ma et al., 1999).
Biodiesel dan bioetanol diproduksi dari tanaman pertanian misalnya kelapa sawit, jarak, kelapa, jagung, ubi kayu, dan tanaman yang menghasilkan minyak nabati yang tinggi. Akan tetapi tanaman - tanaman tersebut jika diolah menjadi biodiesel akan berbenturan dengan kebutuhan pangan dan lahan. Oleh karena itu dibutuhkan penemuan baru bahan baku yang cocok untuk produksi bahan bakar yang tidak mengurangi ketersediaan minyak nabati.
Mikroalga lebih memiliki potensi untuk dijadikan biodiesel dibandingkan biofuel (Chisti, 2008). Minyak dari mikroalga mengandung lipid yang cocok untuk esterifikasi atau transesterifikasi (Umdu et al., 2008). Diantara berbagai jenis alga, mikroalga tampak menjanjikan sebab :
1. Memiliki laju pertumbuhan yang tinggi
2. Kandungan lipid dapat disesuaikan dengan mengubah komposisi media untuk tumbuh (Kawaroe et al., 2010)
3. Dapat dipanen lebih dari sekali dalam satu tahun (Kawaroe et al., 2010) 4. Dapat menggunakan air laut atau air limbah (Kawaroe et al., 2010) 5. Karbon dioksida di atmosfer ,merupakan sumber untuk pertumbuhan
mikroalga (Kawaroe et al., 2010)
6. Biodiesel dari lemak alga merupakan non toksik dan bersifat biodegradable secara cepat
15
2.4. Kromatografi Gas-Mass Spektrometri (GC-MS)
Kromatografi merupakan suatu istilah yang menggambarkan teknik pemisahan komponen – komponen dari suatu campuran / sampel berdasarkan perbedaan kecepatan migrasi komponen – komponen penyusunnya (Mahan et al., 2008).
Dalam kromatografi, gas (yang biasa disebut carrier gas) digunakan untuk membawa sampel melewati lapisan (bed) material. Karena gas yang bergerak, maka disebut mobile phase (fasa bergerak), sebaliknya lapisan material yang diam disebut stationary phase (fasa diam). Ketika mobile phase membawa sampel melewati stationary phase, sebagian komponen sampel akan lebih cenderung menempel pada stationary phase dan bergerak lebih lama dari komponen lainnya, sehingga masing – masing komponen akan keluar dari stationary phase pada saat yang berbeda. Dengan cara ini komponen – komponen sampel dipisahkan (Mahan et al., 2008)
Data yang dihasilkan oleh GC – MS akan ditampilkan dengan
kromatogram (GC) dan spektrum massa (MS) dimana sumbu x menunjukkan waktu penyimpanan (retention time) dan sumbu y menunjukkan intensitas. Masing-masing puncak (peak) pada kromatogram menunjukkan satu senyawa. Spektrum massa memiliki base peak (m/z) dan dapat memberikan informasi tentang berat molekul dan struktur kimia (Shimadzu, 2002).
16
3. METODE PENELITIAN
3.1 Waktu dan Lokasi Penelitian
Penelitian ini dilakukan pada bulan Mei-Agustus 2011 di Laboratorium Surfactant and Bioenergy Research Center (SBRC) Lembaga Penelitian dan Pengabdian Masyarakat (LPPM), IPB. Analisis sampel dilanjutkan pada bulan Oktober-November di Pusat Laboratorium Terpadu Universitas Islam Negeri (UIN) Syarif Hidayatullah, Jakarta.
3.2 Alat dan Bahan
Alat dan bahan yang digunakan pada penelitian disajikan pada Tabel 3. Tabel 3. Alat dan bahan yang digunakan pada penelitian
Alat Bahan
Nama Spesifikasi Nama Spesifikasi
Blender Miyako BL 151 GF Kapas Bebas Lemak Cotton Walls Balls
Labu Didih Pyrex 300 ml NaOH PA
Labu Didih Pyrex 500 ml Tawas (NaOH) Teknis Labu Didih Pyrex 250 ml Kain Saten 40×40 cm Ekstraktor
Soxhlet - Kertas saring Whatman 44
Botol Gelas 1 l BF3 Schuchardt OHG
Boks Stirofom
Garuda Approved 73 x
42 x28.5 Alkohol 100% 1 l
Erlenmeyer Schott Duran 250 ml Methanol Brataco PA Erlenmeyer Schott Duran 500 ml Toples Plastik 5 l Gelas Beker Schott Duran 150 ml Wadah Alumunium 75 ml
Gelas Ukur Pyrex 50 ml Batu Es -
Gelas Ukur Pyrex 100 ml N-hexane KGaA PA
Gelas Ukur Pyrex 1 l Chloroform KGaA PA
Hotplate Labinco L-32 Akuades 10 l
Botol Gelas 140 ml Alumunium foil
Pipet mohr Pyrex 1 ml
Bubuk Chaetoceros
gracilis
Pipet mohr Pyrex 5 ml
Bubuk Skeletonema
costatum
Pipet tetes - Bubuk Thalasiossira sp.
17
Tabel 3. (lanjutan)
3.3 Pengambilan Contoh Mikroalga
Contoh mikroalga pada fase pertumbuhan diambil dari kolam budidaya perusahaan pembenihan PT Suritani Pemuka di Gerogak, Bali Barat. Pemanenan dilakukan dengan penambahan tawas (NaOH) dengan konsentrasi 150 ppm untuk mengendapkan atau mengumpulkan mikroalga dari media cairnya di dasar kolom. Selanjutnya media ditambahkan air tawar dengan perbandingan 3:1 (tawar : biomasa mikroalga) untuk menurunkan kadar garam agar memudahkan dalam penyaringan mikroalga. Penyaringan menggunakan kain saten 3 µm (lebih kecil dari ukuran mikroalga).
Mikroalga selanjutnya dikeringkan dengan dipaparkan pada sinar matahari selama kurang lebih 6 jam, kemudian tahap kedua dimasukan ke dalam oven dengan suhu 400 C kurang lebih 3 jam sampai kondisi stabil. Mikroalga yang telah dikeringkan dihaluskan dengan cara ditumbuk dan diblender sampai benar-benar berbentuk powder.
Alat Bahan
Nama Spesifikasi Nama Spesifikasi
Pipet
Volumetrik Pyrex 3 ml
Pipet Mikro Gilson
Spatula -
Vortek
Thermolyne MAXI
MIX
Tabung reaksi Pyrex 16 x 150 ml
Oven Memmert
Timbangan
18
3.4 Analisis Fatty Acids 3.4.1 Ekstraksi Soxhlet
Sampel mikroalga sebanyak 15 gram ditimbang dan dibungkus dengan kertas saring dan ditutup dengan kapas bebas lemak. Sample diextraksi dengan 200 ml n-hexana selama 6-7 jam dalam tabung soxhlet. Extrak lemak diuapkan dengan rotoevaporator dan dikeringkan dalam oven bersuhu 50-60 0C selama kurang lebih 1 jam dan selanjutnya ditimbang untuk mendapatkan kadar lipid.
3.4.2 Esterifikasi
Esterifikasi bertujuan menurunkan titik uap asam lemak dengan cara merubah gugus fungsional lemak menjadi ester yang relatif mudah dalam analisis GC-MS. 0.5 – 1 gram sampel lemak yang telah diekstrak disaponifikasi dengan 4.5 ml NaOH 0.5 N, kemudian dimasukkan ke dalam tabung reaksi dan
direaksikan dengan BF3 dalam metanol. Dikocok dan dipanaskan selama 15 menit. Didiamkan sampai terbentuk dua lapisan. Lapisan atas dipisahkan dengan sentrifugasi dan dipurifikasi lebih lanjut dengan menambahkan Na2SO4 untuk menghilangkan kadar airnya. Hasil esterifikasi selanjutnya dimasukkan ke dalam vial untuk dianalisa dengan alat GC-MS (Hermanto et al. 2008).
3.4.3 Analisis Kromatografi gas – Spektrometri Massa (GC-MS)
Analisis kromatografi gas – spektrometri massa (Gas Chromatography-Mass Spectrometry/ GC-MS) menggunakan kromatografi gas Shimadzu QP2010 yang dilengkapi dengan kolom silika DB-5 ms (panjang 30 m; 0.25 mm diameter
dalam; dan 0.25 µm ketebalan lapis film) serta helium sebagai gas pendorong.
19
menggunakan mode injeksi split dengan rasio 1 : 200. Suhu oven kromatografi gas di program dari 800C dibiarkan konstan selama 2 menit, kemudian dinaikkan 2100C dengan kecepatan 100/menit dibiarkan konstan selama 1 menit, kemudian dinaikkan lagi 2800C dengan kecepatan 60/menit dibiarkan konstan selama 5 menit. Kondisi GC-MS adalah ionisasi potensial/ electron energy 70eV, ion source temperature 2500C dan interface temperature 2800C. Full mass data dicatat antara 50-400 Dalton setiap detik. Waktu retensi dari 0-32.67 menit. Data dicatat dan dianalisis dengan perangkat lunak GC-MS Real Time Analysis dan GCMS Postrun Analysis.
3.4.4 Identifikasi Asam Lemak Diatom
Identifikasi asam lemak diatom menggunakan kromatografi gas dan kromatografi gas-spektrometri massa. Identifikasi metil esters asam lemak dilakukan dengan membandingkan mass spectra dengan data literatur. Penentuan nomor karbon pada senyawa metil esters asam lemak adalah dengan menghitung bobot molekul yang muncul pada spectra massa (lampiran ). Karakteristik metil ester asam lemak memberikan puncak yang kuat pada m/z = 74 yang merupakan puncak dasar rantai lurus metil ester. Peak terluas pada tiap kelompok
merepresentasikan fragmen CnH2n-1O2 dan m/z = 14 (n -2) + 74. Secara sederhana dituliskan dengan persamaan:
20
dimana:
x = nomor karbon (FAME)
m = bobot molekul yang muncul pada peak spektra massa 14 = berat molekul CH2
3.5 Analisis Data
Analisis data dilakukan dengan cara membandingkan kandungan lemak dan komponen-komponen fatty acids pada ketiga spesies diatom (Chaetoceros gracilis, Skeletonema costatum, dan Thalassiosira sp.). Perbandingan tersebut digambarkan dengan menggunakan tabel dan grafik. Selanjutnya dilakukan penarikan kesimpulan dari perbandingan data dengan melakukan studi literatur.
21
4. HASIL DAN PEMBAHASAN
4.1 Ekstraksi Mikroalga
Mikroalga diekstrak dengan menggunakan metode ekstraksi soxhlet. Prinsip
soxhlet adalah ekstraksi menggunakan pelarut yang selalu baru sehingga terjadi
ekstraksi kontinyu dengan jumlah pelarut konstan dan pendingin balik. Pelarut yang
digunakan adalah pelarut yang memiliki titik didih yang rendah agar cepat menguap
sehingga tidak menyebabkan kerusakan pada alat dan bahan dan juga tidak
membutuhkan waktu yang lama untuk melakukan satu sirkulasi ekstraksi (Ketaren,
1986).
Faktor – faktor yang mempengaruhi hasil ekstraksi adalah luas permukaan
singgung zat pelarut dengan bahan yang akan diekstrak, lama proses ekstraksi,
jumlah bahan yang akan diekstrak, dan sifat zat pelarut maupun bahan (Maryanto,
1997). Pada penelitian ini bahan yang diekstrak dihaluskan untuk memperluas
permukaan singgung antara pelarut dengan bahan yang diekstrak. Berkaitan dengan
lama proses ekstraksi, maka proses ekstraksi dihentikan pada saat pelarut dalam
thimble
berwarna bening dimana ini sebagai tanda lemak yang terdapat pada
mikroalga tersebut telah terekstrak seluruhnya. Karena lemak yang akan diekstrak
bersifat non polar maka pelarut yang digunakan harus memiliki polaritas yang sama
dengan lemak dan minyak tersebut sehingga lemak tersebut dapat larut. Lemak yang
dihasilkan adalah lemak kotor yaitu lemak yang terdiri dari natural lipid dan polar
22
dan
sterol.
Sedangkan polar lipid terdiri dari komponen seperti
phospholipids
,
glicolipid
,
chlorophyll
, dan
carotenoids
(Winaryo, 2009).
4.2 Persentase Kadar Lemak Diatom
Hasil penelitian menunjukan bahwa ketiga spesies diatom yang diekstrak
lemaknya memiliki kadar lemak yang berbeda. Perbedaan jenis pelarut juga
memberikan perbedaan kadar lemak pada ketiga spesies diatom. Data kadar lemak
dari ketiga spesies diatom menunjukan bahwa spesies
Chaetoceros gracilis
memiliki
kadar lemak tertinggi yaitu 10.17 % diekstrak dengan menggunakan pelarut
n-Heksan dan 12.36 % diekstrak dengan menggunakan pelarut kloroform. Spesies
Skeletonema costatum
memiliki kadar lemak paling rendah yaitu 6.45 % diekstrak
dengan menggunakan pelarut n-Heksan dan 9.25 % menggunakan pelarut kloroform.
Kadar lemak dari spesies
Thalassiosira
sp. adalah 7.80 % menggunakan pelarut
n-Heksan dan 10.43 % menggunakan pelarut kloroform.
Skeletonema costatum
memiliki laju pertumbuhan spesifik yang lebih tinggi
dibandingkan dua spesies lainnya yaitu 0.51 sedangkan
Chaetoceros gracilis
memiliki laju pertumbuhan spesifik 0.27 (Triswanto, 2010). Lemak dari mikroalga
cenderung berbanding terbalik dengan laju pertumbuhan, dan berbagai faktor
lingkungan juga dapat mempengaruhi proporsi relatif asam lemak dan total
kandungan lipid (Borowitzka, 1987). Jadi semakin tinggi laju pertumbuhan maka
semakin rendah kadar lemak dari mikroalga tersebut. Hal ini diduga pada saat laju
pertumbuhan kecil maka energi yang digunakan untuk tumbuh dikonversi untuk
23
Berdasarkan hasil persentase kadar lemak dari pelarut n-Heksan dan
kloroform menujukan hasil yang berbeda, dimana pelarut kloroform lebih banyak
melarutkan lemak mikroalga. Ketika mikroalga diekstrak, maka semua lipid pada
mikroalga akan terikut sehingga beberapa jenis alga akan memperlihatkan ekstraksi
yang berwarna kehijauan pekat (Winaryo, 2009). Hasil ekstraksi pada penelitian ini
menunjukan alga yang diekstrak dengan menggunakan klorofom memperlihatkan
hasil ekstraksi yang berwarna hijau pekat. Hal ini disebabkan sifat kloroform yang
lebih polar dari n-Heksan sehingga komponen polar lipid seperti chlorophyll dan
phospolipid ikut terekstrak (Winaryo, 2009). Hasil dari persentase kadar lemak
ketiga spesies diatom dapat dilihat pada Tabel 4.
Tabel 4. Persentase kadar lemak (%) ketiga spesies diatom dengan pelarut n-Heksan
dan klorofom
Pelarut
Skeletonema
costatum
Thalassiosira
sp.
Chaetoceros
gracilis
Ulangan
n-Heksan
5.99
7.34
10.39
1
6.61
7.92
10.11
2
6.75
8.14
9.99
3
6.45
7.80
10.17
Rata-rata
0.33
0.34
0.16
St. Dev
Kloroform
9.22
10.58
12.20
1
9.19
10.02
12.34
2
9.34
10.68
12.53
3
9.25
10.43
12.36
Rata-rata
24
4.3 Esterifikasi
Sebelum esterifikasi, dilakukan saponifikasi dengan alkali NaOH untuk
membentuk free fatty acids. Setelah itu esterifikasi dilakukan dengan mereaksikan
trigliserida dengan BF3 methanol menghasilkan fatty acids methyl esters (biodiesel)
dengan BF3 sebagai katalis. Katalis digunakan untuk meningkatkan laju reaksi dan
rendemen. Proses ini berlangsung pada suhu 60
0C dengan pengadukan
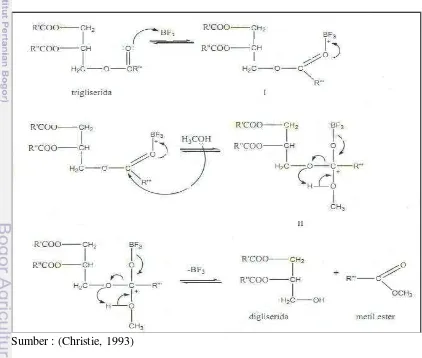
menggunakan vortek, untuk meningkatkan frekuensi tumbukan reaktan (Christie,
1993). Proses ini merupakan reaksi dua arah, dimana trigliserida secara bertahap
diubah menjadi digliserida, dan kemudian metil esters (Gambar 5).
Sumber : (Christie, 1993)
25
4.4 Identifikasi
Fatty Acids Methyl Esters
(FAME) Mikroalga
Identifikasi fatty acids methyl esters mikroalga dilakukan dengan melihat
kromatogram senyawa metil ester asam lemak yang telah direkam selama 30 menit.
Karakteristik metil esters asam lemak yang muncul pada spectra massa dicirikan
dengan
mass to charge ratio
(m/z) 74. Selain itu juga dilihat berdasarkan molecular
peak yang menunjukan nilai bobot molekul senyawa metil esters asam lemak untuk
menentukan nomor karbon pada senyawa metil esters asam lemak.
Beberapa metil esters asam lemak yang paling dominan terdeteksi pada
diatom adalah metil palmitic (C
16:0), metil myristic (C
14:0), dan metil palmitoleic
(C16:1 ). Karakteristik metil palmitic (C16:0 ) pada diatom dideteksi berdasarkan base
peak (m/z) 270 (Gambar 6), selanjutnya diidentifikasi spectra massanya. Berbeda
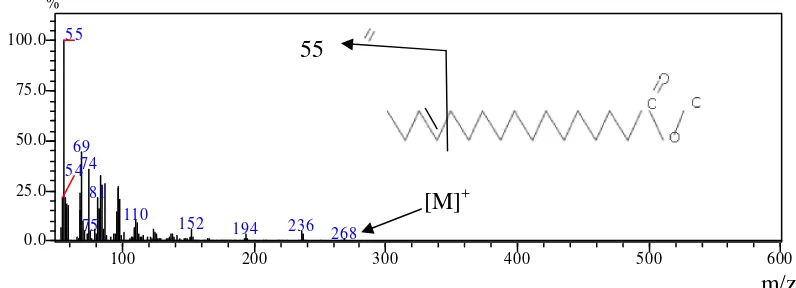
dengan spectrum metil esters asam lemak jenuh, pada metil palmitoleic (C16:1 )
dideteksi berdasarkan base peak (m/z) 268 (Gambar 7). Terjadi pengurangan bobot
molekul dari 270 pada metil palmitic (C
16:0) menjadi 268 pada metil palmitoleic
(C16:1 ). Hal ini menandakan adanya penambahan 1 ikatan rangkap, setiap
penambahan 1 ikatan rangkap terjadi pengurangan bobot molekul sebanyak 2 atom
dari bobot ikatan asam lemak jenuh sebelumnya (Christie, 2012). Perbedaan juga
terjadi pada ion molekul yang mendominasi pada spektra massa, pada asam lemak
jenuh puncak dasar dicirikan dengan
mass to charge ratio
(m/z) 74 sedangkan asam
lemak tak jenuh dengan satu ikatan rangkap memiliki puncak dasar dengan
mass to
26
Gambar 6. Spektra massa senyawa metil palmitic (C16:0 ) pada diatom.
Gambar 7. Spektra massa senyawa metil palmitoleic (C16:1 ) pada diatom.
4.4.1
Fatty Acids Methyl Esters
(FAME) Mikroalga
Chaetoceros gracilis
Karakteristik metil esters asam lemak dari mikroalga
Chaetoceros gracilis
yang diekstrak dengan menggunakan pelarut klorofom terdeteksi berkisar antara C14
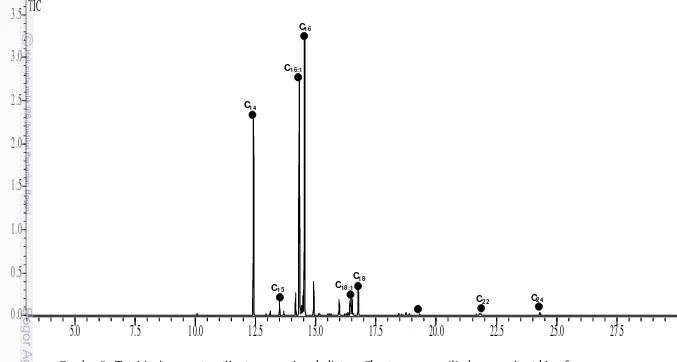
sampai C24 (Gambar 8). Metil esters ini terdiri atas 3 golongan asam lemak, yaitu
SAFA (Saturated fatty acids) 63.05 %, MUFA (Monounsaturated fatty acids) 34.01
%, dan PUFA (Polyunsaturated fatty acids) 2.94%. Kandungan metil esters asam
lemak SAFA terdiri atas metil myristic (C
14) 20.66 %, metil pentadecanoic (C
15)
1.61 %, metil palmitic (C16 ) 33.29 %, metil stearic (C18 ) 4.64 %, metil arachidic
(C20 ) 0.30 %, metil behenic (C22 ) 0.43 %, dan metil lignoceric (C24 ) 0.69 %,
100 200 300 400 500 600
0.0 25.0 50.0 75.0 100.0 % 74 87 55 75 143
8397 171 227 270
53
100 200 300 400 500 600
0.0 25.0 50.0 75.0 100.0 % 55 69 74 81 54 110 152 236
75 194 268
27
dengan demikian kandungan SAFA terbesar adalah C
16dan C
14. Kandungan metil
ester asam lemak MUFA terdiri atas metil palmitoleic (C16:1) 31.00 %, dan metil
oleic (C18:1) 2.63 %.
Karakteristik metil esters asam lemak dari mikroalga
Chaetoceros gracilis
yang diekstrak dengan menggunakan pelarut heksan terdeteksi berkisar antara C13
sampai C
24(Gambar 9). Metil esters ini terdiri atas 2 golongan asam lemak, yaitu
SAFA 44.44 %, dan MUFA 56.42 %. Kandungan metil esters asam lemak SAFA
terdiri atas metil tridecylic (C13) 0.32 %, metil myristic (C14) 10.39 %, metil
pentadecylic (C
15) 3.57 %, metil palmitic (C
16) 15.44 %, metil margaric (C
17) 0.71
%, metil stearic (C18 ) 9.09 %, metil arachidic (C20 ) 0.69 %, metil behenic (C22 )
1.83 %, dan metil lignoceric (C
24) 1.52 %, dengan demikian kandungan SAFA
terbesar adalah C16 dan C14. Kandungan metil ester asam lemak MUFA terdiri atas
metil palmitoleic (C16:1) 49.42 %, dan metil oleic (C18:1) 6.14 %.
Berdasarkan penelitian Renaud
et al.
(2002)
in
Hu
et al.
(2008) kandungan
asam lemak
Chaetoceros
sp. terdiri atas asam myristic (C14) 23.60 %, asam palmitic
(C
16) 9.20 %, asam palmitoleic (C
16:1) 36.50 %, asam hexadecadienoic (C
16:2) 6.9 %,
asam hexadecatrienoic (C16:3) 2.60 %, asam margaric (C17 ) 2 %, dan asam oleic
(C18:1) 3 %. Kandungan asam lemak paling dominan pada
Chaetoceros gracilis
yang
dipanen pada fase stasioner adalah asam palmitic (C
16) 32.83 %, asam myristic (C
14)
20.32 %, dan asam oleic (C18:1) 31.05 % (Pratiwi
et al.,
2009).
Mikroalga yang diekstrak dengan pelarut heksan menunjukan perbedaan
28
pada pelarut heksan terdeteksi metil tridecyclic dan metil margaric sedangkan pada
pelarut klorofom tidak terdeteksi kedua metil asam lemak tersebut. Perbedaan juga
terjadi pada kadar SAFA dan MUFA mikroalga
Chaetoceros gracilis,
pada pelarut
klorofom kadar SAFA dan MUFA berturut-turut 63.05 % dan 34.01 %, sedangkan
pada pelarut heksan kadar SAFA dan MUFA adalah sebesar 44.44 % dan 56.42 %.
4.4.2
Fatty Acids Methyl Esters
(FAME) Mikroalga
Skeletonema costatum
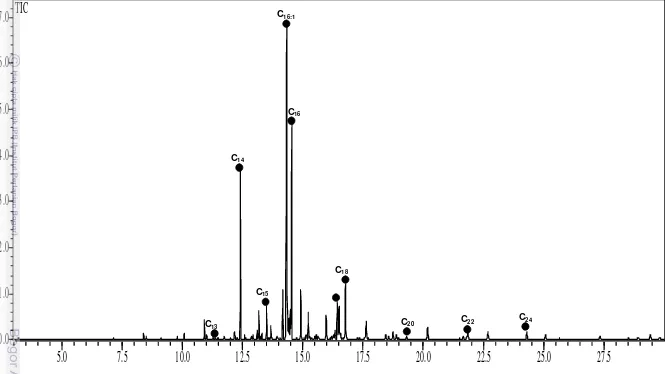
Karakteristik metil esters asam lemak dari mikroalga
Skeletonema costatum
yang diekstrak dengan menggunakan pelarut klorofom terdeteksi berkisar antara C
13sampai C24 (Gambar 10). Metil esters ini terdiri atas 3 golongan asam lemak, yaitu
SAFA 68.31 %, MUFA 29.59 %, dan PUFA 2.10 %. Kandungan metil esters asam
lemak SAFA terdiri atas metil tridecylic (C
13) 0.52 %, metil myristic (C
14) 41.46 %,
metil pentadecylic (C15 ) 2.27 %, metil palmitic (C16 ) 22.36 %, metil margaric (C17 )
0.28 %, metil stearic (C
18) 0.88 %, metil behenic (C
22) 0.16 %, dan metil lignoceric
(C24 ) 0.38 %, dengan demikian kandungan SAFA terbesar adalah C14 dan C16.
Kandungan metil ester asam lemak MUFA terdiri atas metil palmitoleic (C16:1) 26.68
%, dan metil oleic (C
18:1) 2.91 %. Kandungan metil ester asam lemak PUFA terdiri
atas metil hexadecadienoic (C16:2) 2.10 %.
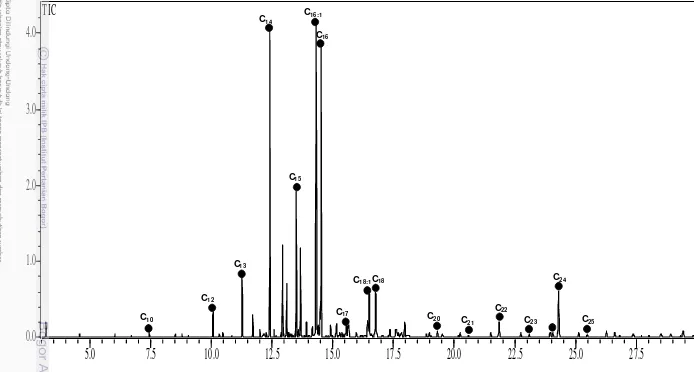
Karakteristik metil esters asam lemak dari mikroalga
Skeletonema costatum
yang diekstrak dengan menggunakan pelarut heksan terdeteksi berkisar antara C10
29
5.0
7.5
10.0
12.5
15.0
17.5
20.0
22.5
25.0
27.5
0.0
0.5
1.0
1.5
2.0
2.5
3.0
3.5
(x10,000,000)
TIC
Gambar 8. Total ionic current metil esters asam lemak diatom
Chaetoceros gracilis
dengan pelarut klorofom
C24
C22
C18
C18:1
C16
C16:1
C15
30
5.0
7.5
10.0
12.5
15.0
17.5
20.0
22.5
25.0
27.5
0.0
1.0
2.0
3.0
4.0
5.0
6.0
7.0
[image:30.792.71.736.94.468.2](x10,000,000)
TIC
Gambar 9. Total ionic current metil esters asam lemak diatom
Chaetoceros gracilis
dengan pelarut heksan
C24
C22
C20
C18
C16
C16:1
C14
C15
31
SAFA 63.40 %, dan MUFA 36.60 %. Kandungan metil esters asam lemak SAFA
terdiri atas metil capric (C10) 0.40 %, metil lauric (C12) 1.97 %, metil tridecylic (C13)
4.20 %, metil myristic (C14) 14.37 %, metil pentadecylic (C15 ) 11.38 %, metil
palmitic (C
16) 12.83 %, metil margaric (C
17) 1.65 %, metil stearic (C
18) 6.63 %,
metil arachidic (C20 ) 0.92 %, metil behenic (C22 ) 2.17 %, metil tricocylic (C23 )
0.38 %, metil lignoceric (C
24) 6.01 %, dan metil pentacocylic (C
25) 0.49 %, dengan
demikian kandungan SAFA terbesar adalah C14 dan C16. Kandungan metil ester
asam lemak MUFA terdiri atas metil palmitoleic (C16:1) 31.15 %, metil oleic (C18:1)
4.73 %, dan metil nervonic (C
24:1) 0.72 %,
Servel
et al.
(1993) dalam Winaryo (2009) menyatakan bahwa kandungan
asam lemak paling dominan dari spesies
Skeletonema costatum
terdiri atas asam
palmitic (C16 ) 16.50 %, asam myristic (C14) 16.50 %, dan asam arachidic (C20:5 )
40.70 %. Selain itu juga berdasarkan penelitian Berge (1995) kandungan utama
(PUFA) diatom
Skeletonema costatum
terdiri atas C
16:1, C
16:2, C
16:3, dan C
20:5.
Mikroalga yang diekstrak dengan pelarut heksan menunjukan perbedaan
dengan mikroalga yang diekstrak dengan menggunakan pelarut klorofom, dimana
pada pelarut heksan terdeteksi metil capric, lauric, arachidic, tricocylic, dan
pentacocylic, sedangkan pada pelarut klorofom tidak terdeteksi metil asam lemak
tersebut. Perbedaan juga terjadi pada kadar SAFA, MUFA, dan PUFA mikroalga
Skeletonema costatum,
pada pelarut klorofom kadar SAFA, MUFA, dan PUFA
32
SAFA dan MUFA adalah sebesar 63.40 % dan 36.60 %, dan untuk kadar PUFA
tidak terdeteksi.
4.4.3
Fatty Acids Methyl Esters
(FAME) Mikroalga
Thalassiosira
sp.
Karakteristik metil esters asam lemak dari mikroalga
Thalassiosira
sp. yang
diekstrak dengan menggunakan pelarut klorofom terdeteksi berkisar antara C14
sampai C
24(Gambar 12). Metil esters ini terdiri atas 3 golongan asam lemak, yaitu
SAFA (Saturated fatty acids) 67.22 %, MUFA 31.89 %, dan PUFA 0.89 %.
Kandungan metil esters asam lemak SAFA terdiri atas metil myristic (C
14) 20.93 %,
metil pentadecylic (C15 ) 9.13 %, metil palmitic (C16 ) 34.17 %, metil margaric (C17 )
0.96 %, metil stearic (C18 ) 0.80 %, dan metil lignoceric (C24 ) 1.23 %, dengan
demikian kandungan SAFA terbesar adalah C
14dan C
16. Kandungan metil ester
asam lemak MUFA adalah metil palmitoleic (C16:1) 31.89 %. Kandungan metil ester
asam lemak PUFA terdiri atas metil hexadecadienoic (C
18:2) 0.89 %.
Karakteristik metil esters asam lemak dari mikroalga
Thalassiosira
sp. yang
diekstrak dengan menggunakan pelarut heksan terdeteksi berkisar antara C12 sampai
C
25(Gambar 13). Metil esters ini terdiri atas 3 golongan asam lemak, yaitu SAFA
33
5.0
7.5
10.0
12.5
15.0
17.5
20.0
22.5
25.0
27.5
0.0
0.5
1.0
1.5
2.0
[image:33.792.75.734.105.466.2](x10,000,000)
TIC
Gambar 10. Total ionic current metil esters asam lemak diatom
Skeletonema costatum
dengan pelarut klorofom
C24
C22
C18
C18:1
C17
C16
C16:1
C15
C14
34
5.0
7.5
10.0
12.5
15.0
17.5
20.0
22.5
25.0
27.5
0.0
1.0
2.0
3.0
4.0
[image:34.792.42.736.101.473.2](x10,000,000)
TIC
Gambar 11. Total ionic current metil esters asam lemak diatom
Skeletonema costatum
dengan pelarut heksan
C25
C24
C23
C22
C21
C20
C18
C18:1
C17
C16
C16:1
C15
C14
C13
C12
35
Kandungan metil esters asam lemak SAFA terdiri atas metil lauric (C
12) 0.36 %,
metil tridecylic (C13) 0.52 %, metil myristic (C14) 11.15 %, metil pentadecylic (C15 )
13.96 %, metil palmitic (C16 ) 16.64 %, metil margaric (C17) 2.00 %, metil stearic
(C
18) 1.88 %, metil behenic (C
22) 0.49 %, metil lignoceric (C
24) 3.26 %, dan metil
pentacocylic (C25 ) 0.17 %, dengan demikian kandungan SAFA terbesar adalah C15
dan C
16. Kandungan metil ester asam lemak MUFA terdiri atas metil myristoleic
(C14:1) 0.38 %, metil pentadecenoic (C15:1) 0.62 %, metil palmitoleic (C16:1) 44.72 %,
dan metil oleic (C18:1) 2.66 %. Berdasarkan penelitian Pratoomyot
et al.
(2005)
kandungan asam lemak paling dominan pada
Thalassiosira
sp.
yang dipanen pada
fase stasioner adalah asam palmitic (C16 ) 20.67 %, asam myristic (C14) 6.37 %, dan
asam palmitoleic (C
16:1) 42.02 %.
Thalassiosira
sp.
yang diekstrak dengan pelarut heksan menunjukan
perbedaan dengan mikroalga yang diekstrak dengan menggunakan pelarut klorofom,
dimana pada pelarut heksan terdeteksi metil lauric, tridecylic, behenic, dan
pentacocylic, sedangkan pada pelarut klorofom tidak terdeteksi metil asam lemak
tersebut. Perbedaan juga terjadi pada kadar SAFA (Saturated fatty acids), MUFA
(Monounsaturated fatty acids), dan PUFA (Polyunsaturated fatty acids) mikroalga
Thalassiosira
sp.
,
pada pelarut klorofom kadar SAFA, MUFA, dan PUFA
berturut-turut 67.22 %, 31.89 %, dan 0.89 %, sedangkan pada pelarut heksan kadar SAFA,
36
5.0
7.5
10.0
12.5
15.0
17.5
20.0
22.5
25.0
27.5
0.00
0.25
0.50
0.75
1.00
[image:36.792.57.739.123.503.2](x10,000,000)
TIC
Gambar 12. Total ionic current metil esters asam lemak diatom
Thalassiosira
sp. dengan pelarut klorofom
C18C17 C16
C16:1
C15 C14
37
5.0
7.5
10.0
12.5
15.0
17.5
20.0
22.5
25.0
27.5
0.0
1.0
2.0
3.0
4.0
5.0
6.0
(x10,000,000)
TIC
[image:37.792.58.740.95.492.2]
Gambar 13. Total ionic current metil esters asam lemak diatom
Thalassiosira
sp. dengan pelarut heksan
C25 C24C22 C18
C18:1 C18:2 C17 C16 C16:1
C15 C14
38
4.5 Kandungan SAFA, MUFA, dan PUFA pada Ketiga Spesies Diatom
Kandungan SAFA pada spesies
Skeletonema costatum
berkisar antara 63.40
% sampai 68.31 %, kandungan MUFA berkisar antara 29.59 % sampai 36.60 %, dan
kandungan PUFA berkisar antara 0 % sampai 2.1 %. Kandungan SAFA pada
spesies
Chaetoceros gracilis
berkisar antara 44.44 % sampai 63.05 %, kandungan
MUFA berkisar antara 34.01 % sampai 52.92 %, dan kandungan PUFA berkisar
antara 2.64 % sampai 2.94 %. Kandungan SAFA pada spesies
Thalassiosira
sp.
berkisar antara 50.43 % sampai 67.22 %, kandungan MUFA berkisar antara 31.89 %
sampai 48.38 %, dan kandungan PUFA berkisar antara 0.89 % sampai 1.19 %.
Secara umum SAFA adalah kandungan paling dominan pada ketiga jenis
diatom, hal ini serupa dengan penelitian Tonon
et al.
(2002) dalam Pratiwi
et al.
(2009) dimana SAFA adalah asam lemak paling dominan dibandingkan MUFA dan
PUFA. Kandungan total SAFA, MUFA, dan PUFA dalam mikroalga dapat diubah
dengan mengubah kondisi lingkungan dan media kultur (Mansour
et al.,
2003;
Rousch
et al.,
2003). Suhu lingkungan yang rendah dapat meningkatkan sintesis
asam lemak tak jenuh, karena pada suhu rendah ketersediaan oksigen di dalam sel
meningkat, dengan meningkatnya ketersediaan oksigen dapat membantu
39
4.6 Perbandingan Fatty Acids Methyl Esters (FAME) pada Ketiga Spesies
Fatty Acids Methyl Esters (FAME) yang terdeteksi dari ketiga spesies diatom
berkisar antara C10 sampai C25 (Tabel 5). Kandungan yang paling dominan terdeteksi
adalah metil myristic (C
14:0), metil palmitic (C
16:0), dan metil palmitoleic (C
16:1),
sedangkan kandungan terkecil yang terdeteksi adalah metil undecyclic (C11 ).
Kandungan FAME paling dominan yang diekstrak dengan menggunakan klorofom
pada ketiga spesies yaitu ; metil ester palmitic (C16 ) pada spesies
Chaetoceros
gracilis
dan
Thalassiosira
sp.
,
dan
metil ester myristic (C14) pada spesies
Skeletonema costatum
. Sedangkan FAME paling dominan yang diekstrak dengan
menggunakan heksan yaitu metil ester palmitoleic (C16:1 ) pada ketiga spesies.
Menurut Borowitzka dan Borowitzka (1988) kandungan mayor dari asam
lemak
Bacillariophyceae
(diatom) terdiri atas asam palmitic (C16:0 ), hexadecenoic
(C16:1) dan polynoic (C20), sedangkan kandungan minor adalah asam linoleic (C20).
Penelitian Pratoomyot (2005) juga menyatakan bahwa kandungan utama asam lemak
pada
Bacillariophyceae
(diatom) adalah C16:1, C16:0, dan C20:5. Hal ini sesuai
dengan data FAME diatas yang menyatakan bahwa kandungan asam palmitic (C
16:0)
dan palmitoleic (C16:1) merupakan kandungan utama asam lemak pada
Bacillariophyceae
(diatom).
Trigliserida diproduksi oleh spesies/strain spesifik yang pada akhirnya
dikendalikan oleh susunan genetik dari individu organisme, Mikroalga
memproduksi trigliserida dalam jumlah yang kecil dibawah pertumbuhan optimal
40
tingginya akumulasi trigliserida yang disertai dengan perubahan yang cukup besar
pada komposisi asam lemak, terjadi pada saat mikroalga mengalami kondisi stress
baik secara rangsangan kimia dan fisik. Rangsangan kimia yang utama adalah
pemiskinan nutrient sedangkan rangsangan fisik utama adalah temperatur dan
intensitas cahaya. Selain itu fase pertumbuhan mikroalga juga mempengaruhi
trigliserida dan komposisi asam lemak mikroalga.
Nutrient yang paling mempengaruhi metabolisme lipid dalam mikroalga
adalah nitrogen, dengan pembatasan nitrogen terjadi akumulasi kandungan
trigliserida (Hu
et al.
, 2008). Pada diatom silikon merupakan nutrisi yang sama
pentingnya dengan nitrogen dalam mempengaruhi metabolisme lipid, Ketika
kekurangan silikon proporsi Saturated Fatty Acids (SAFA) dan Monounsaturated
Fatty Acids (MUFA) meningkat (Hu
et al.
, 2008). Pembatasan fosfor juga dapat
meningkatkan kandungan trigliserida pada spesies
Chaetoceros Sp.
(Bacillariophyceae),
I. Galbana
(Prymnesiophyceae), tetapi terjadi penurunan
kandungan pada
Nannochlorosis atomus
(Chlorophyta) dan
Tetraselmis sp.
(Prasinophyceae) (Hu
et al.
, 2008).
Suhu dan intensitas cahaya juga mempengaruhi komposisi asam lemak dari
mikroalga. Menurunnya suhu akan meningkatkan asam lemak tidak jenuh
sedangkan apabila suhu ditingkatkan akan meningkatkan asam lemak jenuh pada
mikroalga. Intensitas cahaya rendah akan menginduksi pembentukan polar lipid
terutama yang berkaitan dengan kloroplas sedangkan apabila intensitas cahaya tinggi
41
Tabel 5. Komposisi fatty acid methyl esters (FAME) dari diatom (persentase dari
total fatty acids)
FAME
Chaetoceros gracilis Skeletonema costatum Thalassiosira sp. Klorofom Heksan Klorofom Heksan Klorofom Heksan
C10:0
0.11 0.52 0.4C11:0
0.07C12:0
1.97 0.36C13:0
0.34 4.2 0.52C14:0
20.72 10.39 41.46 14.37 20.93 11.15C14:1
0.38C14:2
C15:0
1.62 3.57 2.27 11.38 9.13 13.96C16:0
33.41 15.44 22.36 12.83 34.17 16.64C16:1
32.61 49.42 26.68 31.15 31.89 44.72C16:2
2.76 2.56 2.1C16:3
C17:0
0.71 0.28 1.65 0.96 2C18:0
4.65 9.09 0.88 6.63 0.8 1.88C18:1
2.63 6.14 2.91 4.73 0.89 2.66C18:2
1.19C18:3
C19:0
C20:0
0.3 0.86 0.92C20:1
C20:2
C21:0
C22:0
0.43 1.83 0.16 2.17 0.49C22:1
C22:2
C23:0
0.38C24:0
0.69 1.52 0.38 6.01 1.23 3.26C24:1
0.7242
4.7 Pengaruh Fatty Acids Methyl Esters (FAME) pada Biodiesel
Komposisi kimia biodiesel dan fosil diesel sangat jauh berbeda. Fosil diesel
biasanya terdiri dari hidrokarbon aromatik 30-35%, parafin 65-70%, dan trace
olefins yang sebagian besar berada pada kisaran C
10dan C
16. Sedangkan biodiesel
mengandung C16 dan C18 metil ester asam lemak dengan satu sampai tiga ikatan
rangkap per molekul (Mittelbach dan Remschmidt, 2006).
Beberapa parameter biodiesel seperti densitas, bilangan setana, dan
kandungan sulfur dipengaruhi oleh jenis minyak yang digunakan. Perbedaan
densitas dipengaruhi oleh komposisi asam lemak dan kemurnian bahan baku.
Densitas akan meningkat seiring dengan penurunan panjang rantai karbon dan
peningkatan jumlah ikatan rangkap pada asam lemak, jadi semakin tidak jenuh
minyak yang digunakan maka densitas akan semakin tinggi (Mittelbach dan
Remschmidt, 2006). Sama halnya dengan densitas, bilangan setana biodiesel
dipengaruhi oleh komposisi metil ester asam lemak penyusun biodiesel. Semakin
tidak jenuh asam lemak metil ester yang terkandung dalam minyak maka semakin
rendah bilangan setana. Semakin rendah bilangan setana semakin rendah pula
kualitas penyalannya. Selain asam lemak tak jenuh, panjang rantai karbon yang
menyusun asam-asam lemak juga mempengaruhi bilangan setana (Mittelbach dan
Remschmidt, 2006). Hasil penelitian Gorpinath
et al
. (2009)
in
Tazora (2011)
menyatakan bahwa asam stearat (C18:0) memiliki bilangan setana 85.9, asam palmitat
(C
18:0) 76.6, asam miristat (C
14:0) 66.9, asam laurat (C
12:0) 61.1, asam oleat (C
18:0)
43
Berdasarkan hasil penelitian, kandungan fatty acids methyl esters pada ketiga
spesies dapat mempengaruhi densitas dan bilangan setana biodiesel yang dihasilkan.
Kandungan SAFA tertinggi terdapat pada spesies
Skeletonema costatum
, sehingga
dapat disimpulkan
Skeletonema costatum
memiliki densitas biodiesel yang lebih
rendah, sedangkan spesies
Chaetoceros gracilis
memiliki kandungan MUFA dan
PUFA yang lebih besar sehingga memiliki densitas biodiesel yang lebih tinggi.
Berbeda dengan densitas, bilangan setana berkaitan dengan kandungan SAFA,
semakin tinggi kandungan SAFA semakin tinggi bilangan setana. Dapat
disimpulkan spesies
Skeletonema costatum
memiliki bilangan setana yang lebih
tinggi dari ketiga spesies, sedangkan
Chaetoceros gracilis
memiliki bilangan setana
44
5. KESIMPULAN DAN SARAN
5.1 Kesimpulan
Kandungan lipid tertinggi baik menggunakan klorofom maupun heksan terdapat pada spesies Chaetoceros gracilis sedangkan kandungan lipid terendah terdapat pada spesies Skeletonema costatum. Perbedaan pelarut juga memberikan perbedaan kandungan lipid yang diperoleh dimana pelarut klorofom memberikan kandungan lipid yang lebih besar dibandingkan pelarut heksan.
Kandungan Fatty Acids Methyl Esters (FAME) tertinggi pada spesies Chaetoceros gracilis adalah metil palmitic (C16:0 ) ekstraksi dengan pelarut klorofom dan metil palmitoleic (C16:1) ekstraksi dengan pelarut heksan. FAME tertinggi pada spesies Skeletonema costatum adalah metil palmitoleic (C16:1) ekstraksi dengan pelarut heksan dan metil myristic (C14:0) ekstraksi dengan pelarut klorofom. FAME tertinggi pada spesies Thalassiosira sp. adalah metil palmitic (C16:0) ekstraksi dengan pelarut klorofom dan metil palmitoleic (C16:1) ekstraksi dengan pelarut Heksan.
5.2 Saran
KOMPOSISI ASAM LEMAK MIKROALGA JENIS
Skeletonema costatum
,
Thalassiosira
sp., DAN
Chaetoceros gracilis
VICKY RIZKY A. KATILI
SKRIPSI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul:
KOMPOSISI ASAM LEMAK MIKROALGA JENIS
Skeletonema
costatum
,
Thalassiosira
sp., DAN
Chaetoceros gracilis
adalah benar merupakan hasil karya sendiri dan belum diajukan dalam bentuk apa
pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang
berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan oleh penulis
lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian
akhir Skripsi ini.
Bogor, Juni 2012
RINGKASAN
VICKY RIZKY AFFANDI KATILI. Komposisi Asam Lemak Mikroalga Jenis
Skeletonema costatum
,
Thalassiosira
sp., dan
Chaetoceros gracilis
. Dibimbing
oleh MUJIZAT KAWAROE dan TRI PRARTONO.
Penelitian dilakukan berdasarkan pada perkembangan bioteknologi mikroalga
dewasa ini yang memanfaatkan mikroalga tidak hanya untuk pakan alami, sumber
pigmen alami, sel protein tunggal, bidang farmasi dan kesehatan, tetapi juga
digunakan sebagai sumber energi alternatif seperti penghasil
biofuel
. Tujuan dari
penelitian ini adalah membandingkan kandungan lipid tiga spesies diatom
(
Chaetoceros gracilis, Skeletonema costatum
, dan
Thalassiosira
sp.) dan
mengidentifikasi kandungan
fatty acids
tiga spesies diatom.
Penelitian ini dilakukan pada bulan Mei sampai dengan Agustus 2011 di
Laboratorium Mikroalga di Pusat Penelitian Surfaktan dan Bioenergi (SBRC)
Baranangsiang, Bogor. Analisis sampel dilanjutkan pada bulan Oktober sampai
dengan November di Pusat Laboratorium Terpadu Universitas Islam Negeri (UIN)
Syarif Hidayatullah, Jakarta. Ekstraksi lipid mikroalga dilakukan dengan
menggunakan pelarut klorofom dan heksan. Lipid yang diperoleh diesterifikasi
menggunakan BF3-metanol 14% dan selanjutnya dianalisis dengan Kromatografi Gas
– Spektrometri Massa (GC-MS), untuk penentuan asam lemak. Identifikasi metil
esters asam lemak dilakukan dengan membandingkan
mass spectra
dengan data
literatur. Penentuan nomor karbon pada senyawa metil esters asam lemak adalah
dengan menghitung bobot molekul yang muncul pada spectra massa.
Berdasarkan hasil penelitian diperoleh bahwa kandungan lipid tertinggi
terdapat pada spesies
Chaetoceros gracilis
sedangkan kandungan lipid terendah
terdapat pada spesies
Skeletonema costatum.
Perbedaan pelarut juga memberikan
perbedaan kandungan lipid yang diperoleh dimana pelarut klorofom memberikan
kandungan lipid yang lebih besar dibandingkan pelarut heksan.
Kandungan Fatty Acids Methyl Esters (FAME) tertinggi pada spesies
©
Hak cipta milik IPB, tahun 2012
Hak Cipta Dilindungi Undang-Undang
1.
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau
menyebutkan sumber
a.
Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya
ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b.
Pengutipan tidak merugikan kepentingan yang wajar IPB
KOMPOSISI ASAM LEMAK MIKROALGA JENIS
Skeletonema costatum
,
Thalassiosira
sp., DAN
Chaetoceros gracilis
VICKY RIZKY A. KATILI
SKRIPSI
sebagai salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan pada
Departemen Ilmu dan Teknologi Kelautan
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
SKRIPSI
Judul Skripsi: KOMPOSISI ASAM LEMAK MIKROALGA JENIS Skeletonema costatum, Thalassiosira sp., DAN Chaetoceros gracilis
Nama Mahasiswa: Vicky Rizky A. Katili Nomor Pokok: C54063241
Departemen: Ilmu dan Teknologi Kelautan
Menyetujui, Dosen Pembimbing
Dr. Ir. Mujizat Kawaroe, M.Si Dr. Ir. Tri Prartono, M.Sc NIP. 19651213 199403 2 002 NIP. 19600727 198601 1 006
Mengetahui,
Ketua Departemen Ilmu dan Teknologi Kelautan
Tanggal Sidang : 22 Juni 2012
vi
KATA PENGANTAR
Puji dan rasa syukur penulis panjatkan kehadirat Allah SWT, karena atas rahmat dan karunianya, penulis dapat menyelesaikan skripsi ini. Skripsi yang berjudul ”KOMPOSISI ASAM LEMAK MIKROALGA JENIS Skeletonema costatum, Thalassiosira sp., DAN Chaetoceros gracilis” diajukan sebagai salah satu syarat untuk mendapatkan gelar sarjana.
Dalam kesempatan ini penulis ingin mengucapkan terima kasih yang sebesar-besarnya kepada :
1. Dr. Ir. Mujizat Kawaroe, M.Si dan Dr. Ir. Tri Prartono, M.Sc selaku komisi pembimbing yang telah memberikan bimbingan, saran dan kritik kepada penulis.
2. Dr. Ir. Etty Riani H., MS selaku dosen penguji tamu pada sidang ujian akhir.
3. Keluarga tercinta, Ayah, Ibu, Vebriyanto, Ayini Wahidji yang selalu memberikan dukungan dan kasih sayangnya.
4. Nur Endah Fitrianto, S.Pi, Dina Agustina, S.Pi, dan Dahlia Wulansari, S.Pi atas waktu dan tenaga serta dampingannya selama penulis melakukan penelitian.
5. Laboratorium Pangan Pusat Laboratorium Terpadu UIN Syarif Hidayatullah khususnya Mbak pipit atas bantuannya selama penulis melakukan penelitian.
6. Pusat Penelitian Surfaktan dan Bioenergi (SBRC) IPB khususnya mas Saeful atas bantuannya selama penulis melakukan penelitian.
7. Teman-teman Pondok Wina atas dukungan untuk menyelesaikan skripsi ini.
8. Teman-teman ITK 43 atas dukungan untuk menyelesaikan skripsi ini. Semoga skripsi ini dapat memberi manfaat bagi semua pihak.
Bogor, Juni 2012
vii
DAFTAR ISI
Halaman DAFTAR TABEL ... ix DAFTAR GAMBAR ... x DAFTAR LAMPIRAN ... xi 1. PENDAHULUAN ... 1
1.1 Latar belakang ... 1 1.2 Tujuan ... 3 2. TINJAUAN PUSTAKA ... 4 2.1 Biologi, Morfologi, dan Habitat Diatom ... 4 2.1.1 Skeletonema costatum ... 5 2.1.2 Thalassiosira sp. ... 6 2.1.3 Chaetoceros gracilis ... 7 2.2 Lipid dan Fatty Acids pada Mikroalga ... 9 2.3 Mikroalga untuk Produksi Biodiesel ... 13 2.4 Kromatografi Gas-Mass Spektrometri (GC-MS) ... 15 3. METODOLOGI PENELITIAN ... 16 3.1 Waktu dan Lokasi Penelitian ... 16 3.2 Alat dan Bahan ... 16 3.3 Pengambilan Contoh Mikroalga ... 17 3.4 Analisis Fatty Acids ... 18 3.4.1 Ekstraksi Soxhlet ... 18 3.4.2 Esterifikasi ... 18 3.4.3 Analisis Kromatografi Gas-Spektrometri massa ... 18 3.4.4 Identifikasi Asam Lemak Diatom ... 19 3.5 Analisis Data ... 20 4. HASIL DAN PEMBAHASAN ... 21 4.1 Ekstraksi Mikroalga ... 21 4.2 Persentase Kadar Lemak Diatom ... 22 4.3 Esterifikasi ... 24 4.4 Identifikasi Fatty Acids Methyl Esters (FAME) Mikroalga .... 25
4.4.1 Fatty Acids Methyl Esters (FAME) Mikroalga Chaetoceros
gracilis ... 26 4.4.2 Fatty Acids Methyl Esters (FAME) Mikroalga Skeletonema
costatum ... 28 4.4.3 Fatty Acids Methyl Esters (FAME) Mikroalga
Thalassiosira sp. ... 32 4.5 Kandungan SAFA, MUFA, dan PUFA pada Ketiga Spesies
Diatom ... 38 4.6 Perbandingan Fatty Acids Methyl Esters (FAME) pada Ketiga
viii
ix
DAFTAR TABEL
x
DAFTAR GAMBAR
Halaman 1. Bentuk sel Skeletonema costatum ... 6 2. Bentuk sel Thalassiosira sp. ... 7 3. Bentuk sel Chaetoceros gracilis ... 9 4. Diagram proses sintesa lipid ... 10 5. Reaksi esterifikasi trigliserida dengan BF3 metanol ... 24 6. Spektra massa senyawa metil palmitic (C16:0 ) pada diatom ... 26 7. Spektra massa senyawa metil palmitoleic (C16:1 ) pada diatom ... 26 8. Total ionic current metil esters asam lemak diatom Chaetoceros
gracilis dengan pelarut klorofom ... 29 9. Total ionic current metil esters asam lemak diatom Chaetoceros
gracilis dengan pelarut heksan ... 30 10. Total ionic current metil esters asam lemak diatom dengan pelarut
Skeletonema costatum klorofom ... 33 11. Total ionic current metil esters asam lemak diatom Skeletonema
costatum dengan pelarut heksan ... 34 12. Total ionic current metil esters asam lemak diatom Thalassiosira sp.
dengan pelarut klorofom ... 36 13. Total ionic current metil esters asam lemak diatom
xi
DAFTAR LAMPIRAN
1
1.
PENDAHULUAN
1.1. Latar Belakang
Kebutuhan minyak bumi Indonesia terus mengalami peningkatan seiring dengan pertumbuhan dan pembangunan ekonomi nasional. Pada tahun 2011, kebutuhan Bahan Bakar Minyak (BBM) Indonesia mencapai 56 juta kiloliter per tahun dan terus meningkat dengan laju konsumsi rata-rata 4 persen per tahun. Sebaliknya, produksi Bahan Bakar Minyak (BBM) yang mampu diproduksi adalah 41 juta kiloliter per tahun yang terdiri atas premium 12 juta kiloliter, solar 18.3 juta kiloliter, kerosene 7 juta kiloliter, dan avtur sejumlah 3.3 juta kiloliter (Karyuliarto, 2011). Ketidakseimbangan antara kebutuhan dan produksi ini diperkirakan dapat menimbulkan krisis energi (BBM), sehingga upaya penyediaan bahan bakar alternatif menjadi sangat penting diantaranya, melalui bahan bakar nabati.
Saat ini upaya pengembangan bahan baku telah dilakukan seperti crude palm oil (CPO) dari kelapa sawit, corn, soybean, canola, jatropha, coconut, dan mikroalga dengan kapasitas produksi tanaman adalah jagung 172 liter per hektar, kedelai 446 liter per hektar, minyak zaitun 1190 liter per hektar, jarak 1892 liter per hektar, kacang-kacangan 2689 liter per hektar, kelapa sawit 5950 liter per hektar, dan mikroalga 58700 liter per hektar (Chisti, 2007).
2
contoh, setiap 1 ton minyak kelapa sawit yang diproduksi diperkirakan akan dihasilkan 33 ton CO2 akibat konversi hutan (Kardono, 2008). Oleh karena itu, pemakaian suatu bahan bakar terbarukan yang lebih aman bagi lingkungan perlu dilakukan.
Salah satu bahan baku yang memiliki potensi dan aman bagi lingkungan adalah mikroalga. Mikroalga dapat diekstraksi secara besar-besaran dalam menghasilkan biofuel. Penghasil bahan bakar nabati ini dapat diproduksi dalam waktu yang sangat singkat serta proses produksinya dapat dikatakan ramah lingkungan. Selain itu mikroalga juga berpotensi untuk menyerap gas buang CO2 yang dihasilkan oleh proses pembakaran baik kendaraan, industri, respirasi, dan dekomposisi (Wiyarno, 2009). Indonesia memiliki wilayah perairan yang sangat luas yang berpotensi untuk kultur mikroalga, Sehingga budidaya mikroalga untuk ekstraksi biofuel sesuai untuk dilakukan di Indonesia.
3
1.2. Tujuan
Tujuan dari Penelitian ini untuk :
- Membandingkan kandungan lipid tiga spesies diatom (Chaetoceros gracilis, Skeletonema costatum, dan Thalassiosira sp.).
4
2. TINJAUAN PUSTAKA
2.1. Biologi, Morfologi, dan Habitat Diatom
Diatom merupakan mikroalga uniseluler yang distribusinya sangat universal di semua tipe perairan. Disebut diatom karena selnya terdiri dari 2 bagian (2 atom), dimana yang satu menutupi yang lain seperti layaknya kaleng pastiles (Basmi, 1999). Diatom diklasifikasikan kedalam dua order berdasarkan bentuk selnya yaitu diatom pennate (Pennales) dengan bentuk bilateral simetris dan diatom centris (Centrales) dengan bentuk radial simetris (lingkaran) apabila dilihat dari atas (Pandey dan Trivedi, 2005; Basmi, 1999). Pada Centrales hiasan valvanya berbentuk jari-jari lingkaran, sedangkan pada Pennales secara bilateral. Pergerakan tidak pernah dijumpaipada jenis-jenis anggota Centrales, namun hanya pada pennales yang valvanya berbentuk memanjang (Basmi, 1999). Diatom mempunyai keunikan yang sangat spesifik, karena arsitektur dan anatomi dinding selnya tersusun dari silika, sehingga dapat tersimpan dalam kurun waktu yang sangat lama di dalam sedimen (Soeprobowati dan Suwarno, 2009). Diatom Centrales akan lebih sering kita temui pada air laut dan payau dibandingkan air tawar (Darley, 1982), sedangkan diatom pennate menempel pada tanaman, hewan, batuan atau butir pasir dengan sebuah lapisan getah atau tangkai (Darley, 1982).
5
2.1.1. Skeletonema costatum
Klasifikasi Skeletonema costatum menurut Bougis (1979) in Tjahjo et al. (2002) dan Edhy et al. (2003) adalah sebagai berikut :
Divisi : Chrysophyta Clasis : Bacillariophyceae Ordo : Centrales
Family : Skeletonemoidae Genus : Skeletonema
Spesies : Skeletonema costatum
Skeletonema costatum memiliki sel yang dipenuhi oleh sitoplasma,
membentuk untaian rantai yang terdiri dari epiteka pada bagian atas dan hipoteka pada bagian bawah (Isnansetyo dan Kurniastuty, 1995). Dinding sel Skeletonema costatum mempunyai frustula yang menghasilkan skeletal external berbentuk silindris (cembung) dan mempunyai duri-duri yang berfungsi sebagai penghubung antar frustula sehingga membentuk filamen (Kamat 1976 in Tjahjo et al., 2002). Bentuk sel Skeletonema costatum dapat dilihat pada Gambar 1.
Skeletonema costatum merupakan diatom yang bersifat eurytermal yaitu mampu tumbuh pada kisaran suhu 3–30 oC dan temperatur optimal adalah 25-27 o
C (Susetyowati, 1994 in Tjahjo et al., 2002). Daerah penyebarannya meliputi daerah tropis dan subtropis mulai dari pantai sampai lautan, sebagai meroplankton dan benthos. Diatom laut, Skeletonema costatum memiliki kandungan
6
[image:62.612.239.398.86.232.2]. Sumber : planktonnet.awi.de (2010)
Gambar 1. Bentuk sel Skeletonema costatum 2.1.2. Thalassiosira sp.
Klasifikasi Thallassiosira sp. menurut (Edhy et al., 2003) adalah sebagai berikut :
Divisi : Chrysophyta Kelas : Bacillariophyceae Ordo : Centrales
Famili : Coscinodiscineae Genus : Thalassiosira Spesies : Thallassiosira sp.
Sel Thalassiosira sp. menempel dalam sebuah massa mukus. Pori-pori sentral mukus ini disebut dengan single apikulus, benang mukus ini
7
Thalassiosira sp. merupakan diatom yang bersifat eurytermal yaitu mampu tumbuh pada kisaran suhu 10–30 oC dan temperatur optimal sekitar 21 oC. Daerah penyebarannya meliputi perairan tawar dan payau habitat pesisir (Kipp, 2007). Diatom laut, Thalasiossira sp. pada kondisi medium N:P:Si= 11:1:6 memberikan biomassa sebesar 0.067 g/mL, dengan kandungan karbohidrat sebesar 7.7%, kandungan protein sebesar 0.93% dan kandungan lemak sebesar 9.69% (Purba, 2008).
[image:63.612.230.435.269.454.2]Sumber : Becerril et al. (2009)
Gambar 2. Bentuk sel Thalassiosira delicatula
2.1.3. Chaetoceros gracilis
Klasifikasi Chaetoceros gracilis menurut (Zipcodezoo, 2009 dan Edhy et al., 2003)adalah sebagai berikut :
Divisi : Chrysophyta Classis : Bacillariophyceae Ordo : Centrales
8
Genus : Chaetoceros
Spesies : Chaetoceros gracilis