DIFERENSIASI STEM CELL MESENKIMAL SUMSUM TULANG
EKAYANTI MULYAWATI KAIIN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi berjudul Kajian In Vitro Kultur Sel dan Conditioned Medium Sel Leydig Tikus dan Peranannya Terhadap Diferensiasi Stem Cell Mesenkimal Sumsum Tulang adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Pebruari 2014
Ekayanti Mulyawati Kaiin B362080032
EKAYANTI MULYAWATI KAIIN. Kajian In Vitro Kultur Sel dan Conditioned Medium Sel Leydig Tikus dan Peranannya Terhadap Diferensiasi Stem Cell Mesenkimal Sumsum Tulang. Dibimbing oleh MOHAMAD AGUS SETIADI, TUTY LASWARDI YUSUF dan ITA DJUWITA.
Penggunaan gradien Percoll untuk isolasi sel Leydig dilaporkan dapat menyebabkan toksisitas pada sel sehingga dapat mengurangi viabilitas dan perolehan jumlah sel hidup setelah dikultur. Untuk mengatasi permasalahan tersebut, telah dilakukan penelitian isolasi dan purifikasi sel Leydig dengan menggunakan gradien non toksik Nycodenz. Penggunaan gradien Nycodenz untuk isolasi dan purifikasi sel Leydig belum pernah dilakukan oleh peneliti lain. Untuk memperoleh potensi sel Leydig yang optimum, diperlukan medium yang mengandung human Chorionic Gonadotrophin (hCG) sebagai induktor sekresi testosteron oleh sel Leydig. Di samping itu, untuk menghasilkan kondisi optimum sel Leydig secara in vitro, diperlukan faktor pertumbuhan yang akan mendukung perkembangannya. Oleh karena itu dalam penelitian ini dilakukan penambahan hCG dan Insulin Transferrin Selenium (ITS). Conditioned medium (CM) kultur sel Leydig mengandung berbagai bahan bioaktif yang disekresikan oleh sel Leydig secara in vitro seperti testosteron dan faktor pertumbuhan. Untuk itu, penelitian penggunaan conditioned medium sel Leydig sebagai medium kultur stem cell mesenkimal sumsum tulang dilakukan untuk mengetahui pengaruhnya terhadap diferensiasi stem cell mesenkimal.
Tahapan penelitian yang dilakukan meliputi :
1.Isolasi dan purifikasi sel Leydig dengan dua perlakuan gradien Nycodenz yaitu: (I) gradien terdiri dari 3 kolom (5%,10% ,15%) dan (II) gradien terdiri dari 5 kolom (4%, 8%, 10%, 12% ,15%) serta gradien Percoll (21%, 26%, 34% , 40%, 60%) sebagai kontrol.
2. Kultur in vitro sel Leydig hasil purifikasi dengan hasil yang terbaik dari penelitian tahap 1 (gradien Nycodenz II) dengan penambahan hormon dan faktor pertumbuhan sebagai berikut: (1) DMEM+NBCS 10% sebagai kontrol, (2) DMEM+NBCS+hCG 2,5 IU/ml, (3) DMEM+NBCS+ insulin 5 μg/ml, transferrin, 10 μg/ml, selenium 5 μg/ml (ITS) dan (4) DMEM+NBCS+hCG+ ITS.
3.Penggunaan CM sel Leydig yang telah dianalisis kandungan testosteron dan proteinnya sebagai medium kultur stem cell mesenkimal sumsum tulang tikus untuk mengetahui kemampuan CM tersebut dalam mengarahkan diferensiasi.
Kecepatan proliferasi (Population Doubling Time, PDT) sel Leydig kultur primer pada perlakuan kombinasi hCG dan ITS menunjukkan kecepatan proliferasi yang paling cepat (0,88 hari) dibandingkan dengan perlakuan lainnya (ITS 0,97 hari; hCG 1,02 hari; kontrol 1,03 hari). Hasil serupa juga tampak pada kultur sel Leydig pada galur sel pertama dan kedua.
Hasil analisis testosteron pada medium kultur menunjukkan bahwa perlakuan kombinasi hCG dan ITS menghasilkan testosteron paling tinggi (5,25 ng/ml) dibandingkan dengan perlakuan lain (hCG 5,06 ng/ml; ITS 3,19 ng/ml; kontrol 2,46 ng/ml). Dari kedua hasil tersebut mengindikasikan bahwa kombinasi medium kultur dengan penambahan hCG dan ITS mendukung pertumbuhan dan produksi testosteron oleh sel Leydig secara in vitro yang lebih baik dibandingkan dengan kombinasi medium lainnya.
Stem cell mesenkimal sumsum tulang yang dikultur dengan CM sel Leydig mampu mengarahkan 53,2% sel berdiferensiasi menjadi sel Leydig yang ditunjukkan dengan reaksi positif terhadap pewarnaan γ -HSD. Penambahan hCG ke dalam medium kultur stem cell mesenkimal mengandung CM sel Leydig mampu meningkatkan jumlah sel Leydig menjadi 71,9%. Hal tersebut didukung pula dengan adanya kandungan testosteron di dalam medium kultur (0,93 ng/ml dan 10,22 ng/ml).
Hasil pengujian lebih lanjut terhadap CM kultur sel Leydig dengan perlakuan kombinasi hCG dan ITS memiliki kandungan testosteron (0,71 ng/ml) dan protein (985,29 µg/ml) yang lebih tinggi dibandingkan dengan perlakuan lainnya. Di samping itu, conditioned medium kultur sel Leydig pada penelitian ini menghasilkan pita protein antara berat molekul (BM) mendekati 29 kDa, 62–70 kDa dan 95-130 kDa.
Berdasarkan hasil tersebut dapat disimpulkan bahwa penggunaan gradien Nycodenz II efektif untuk melakukan purifikasi sel Leydig. Kombinasi penambahan ITS dan hCG menghasilkan tingkat proliferasi sel yang lebih baik dengan PDT yang lebih pendek. Selain itu, diperoleh kandungan testosteron yang lebih banyak di dalam medium kultur sel Leydig. Penggunaan CM Leydig mampu mendiferensiasikan stem cell mesenkimal sumsum tulang menjadi sel Leydig (transdiferensiasi).
EKAYANTI MULYAWATI KAIIN. Study of In Vitro Cell Culture and The Role of Rat Leydig Cells Conditioned Medium on Bone Marrow Mesenchymal Stem Cells Differentiation. Supervised by MOHAMAD AGUS SETIADI, TUTY LASWARDI YUSUF and ITA DJUWITA.
The use of Percoll gradients for Leydig cells isolation has been reported to influence cell toxicity and reduce the viability and the amount of living cells after culture. To dissolve this problem, study has been carried out used non toxic Nycodenz gradient to isolated and purified the Leydig cells. The use of Nycodenz gradient for the isolation and purification of Leydig cells has not been done by other researchers. To obtain the optimum condition of Leydig cells production, growth factor is required as supporting factors for development of growing cells. Therefore, hCG and ITS has been used in this study. Leydig cells conditioned medium (LCM) contained bioactive materials such as testosterone and growth factors. The Leydig cells conditioned medium as culture medium for bone marrow mesenchymal stem cells will be used to determine its influence to differentiation of cells.
The phase of this study included:
1. Isolation and purification of Leydig cells using Nycodenz gradient : (I) with 3 column ( 5 % , 10 % , 15 % ) and ( II ) with 5 columns ( 4 % , 8 % , 10 % , 12 % , 15 % ) and Percoll gradient ( 21 % , 26 % , 34 % , 40 % , 60 % ) as a control .
2. In vitro culture of the best result from cell purification was cultured with the addition of hormones and growth factors : (1) DMEM+NBCS 10% as control, (2) DMEM + NBCS + 2.5 IU/ml hCG , (3) DMEM + NBCS+ 5 ug / ml insulin, 10 ug/ml transferrin, selenium 5 ug/ml (ITS ) and (4) DMEM +NBCS + hCG+ITS .
3 . The concentration of testosteron and protein analyzed from Leydig cells conditioned medium has been used for culturing bone marrow mesenchymal stem cells.
Leydig cells to 71.9%. It was also showed that concentration of testosterone has been increased (0.93 ng/ml and 10.22 ng/ml) in the culture medium.
The combination of hCG and ITS in DMEM had testosterone (0.71 ng/ml) and protein concentration (985.29 µg/ml) higher than the other treatments. The Leydig cell conditioned medium in this study had three protein bands with molecular weight (MW) approximately to 29 kDa, 62-70 kDa and 95-130 kDa.
Based on these results it could be concluded that the use of Nycodenz gradient II was effective to purified of Leydig cells. The combination of hCG and ITS was the best result to increase proliferation and testosterone. Leydig cells conditioned medium could also to differentiate mesenchymal stem cells into Leydig cells (transdiferentiation).
Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah dan pengutipan tersebut tidak merugikan kepentingan IPB
DIFERENSIASI STEM CELL MESENKIMAL SUMSUM TULANG
EKAYANTI MULYAWATI KAIIN
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor
Pada
Program Studi Biologi Reproduksi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Penguji pada Ujian Tertutup: 1. Prof Dr drh Arief Boediono
2. drh Ni Wayan Kurniani Karja, MP, PhD
Puji dan syukur kepada Allah Yang Maha Kasih atas segala karunia dan penyertaan-Nya sehingga penulis menyelesaikan penelitian dan penulisan disertasi dengan baik. Judul disertasi yang ditulis adalah Kajian In Vitro Kultur Sel dan Conditioned Medium Sel Leydig Tikus dan Peranannya Terhadap Diferensiasi Stem Cell Sumsum Tulang, diajukan sebagai salah satu syarat untuk menyelesaikan pendidikan Program Doktor pada Program Studi Biologi Reproduksi, Sekolah Pascasarjana, Institut Pertanian Bogor.
Ucapan terima kasih dan penghargaan yang setinggi-tingginya penulis sampaikan kepada Prof Dr drh Mohamad Agus Setiadi, selaku ketua komisi pembimbing, Prof Dr drh Tuty Laswardi Yusuf, MS dan Dr drh Ita Djuwita, M.Phil selaku anggota komisi pembimbing yang dengan penuh ketulusan memberi arahan dan masukan sejak penyusunan proposal, selama masa penelitian hingga penulisan disertasi. Ucapan terima kasih disampaikan pula kepada Prof drh Arief Boediono, PhD dan drh Ni Wayan Kurniani Karja, MP, PhD selaku penguji luar komisi pada Ujian Tertutup, kepada Dr Siti Nuramaliati Prijono dan Dr drh Joko Pamungkas, MSc selaku penguji luar komisi pada Ujian Terbuka atas masukan dan saran perbaikan yang memperkaya isi disertasi ini.
Ucapan terima kasih disampaikan pula kepada Kepala dan Staf Laboratorium Embriologi, Departemen AFF, Fakultas Kedokteran Hewan IPB : Prof drh Arief Boediono,PhD, drh Mokhamad Fachrudin, PhD, drh Wahono Esthi Prasetyaningtyas, M.Si, drh Kusdiantoro Mohamad, M.Si dan Wahyudin, A.Md yang telah mengijinkan dan mendukung kegiatan penelitian yang telah dilakukan. Terima kasih juga disampaikan kepada seluruh dosen dan pegawai di Bagian Reproduksi dan Kebidanan, Departemen KRP, Fakultas Kedokteran Hewan IPB, juga kepada Dekan dan seluruh staf Sekolah Pascasarjana IPB.
Pada kesempatan ini penulis juga menyampaikan terima kasih kepada Prof Dr Baharuddin Tappa dan Prof Dr Bambang Prasetya atas ijin dan kesempatan yang diberikan kepada penulis untuk melanjutkan studi. Terima kasih disampaikan juga kepada Kepala Bidang Biologi Sel dan Jaringan, Dr Puspita Lisdiyanti atas segala dukungan dan bantuannya serta kepada Kepala Pusat Penelitian Bioteknologi LIPI, Dr Witjaksono, MSc. atas ijin yang diberikan.
dan penghargaan yang tak terhingga disampaikan kepada ayahanda Drs. Mulyana Kaiin, MM (almarhum) dan ibunda Suryati Elia yang telah membesarkan, mendidik dan senantiasa mendoakan dan mendukung penulis sampai saat ini. Kepada ibu mertua Etty Madjiah-Nikodemus, adikku Dwiyadi Mulyawan Kaiin, SE dan seluruh keluarga besar atas dukungan dan doa yang diberikan. Apa yang telah dicapai pada saat ini kiranya dapat menjadi penyemangat bagi anak-anakku dan keponakan-keponakanku untuk meraih cita-citanya.
Kiranya kasih Tuhan selalu menyertai kita sekalian.
Semoga disertasi ini dapat memberikan manfaat yang sebesar-besarnya bagi perkembangan ilmu pengetahuan pada umumnya.
Bogor, Pebruari 2014
Ekayanti Mulyawati Kaiin
DAFTAR TABEL
xvii xvii
DAFTAR GAMBAR xviii
DAFTAR LAMPIRAN
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 3
Kerangka Pemikiran 3
KONSENTRASI, KEMURNIAN DAN VIABILITAS SEL LEYDIG HASIL PURIFIKASI DENGAN GRADIEN NYCODENZ DAN
KULTUR IN VITRO 6
Pendahuluan 7
Materi dan Metode 8
Hasil dan Pembahasan 11
Simpulan 16
OPTIMASI KULTUR IN VITRO DAN ANALISIS TESTOSTERON PADA MEDIUM KULTUR SEL LEYDIG TIKUS HASIL
PURIFIKASI DENGAN GRADIEN NYCODENZ 18
Pendahuluan 19
Materi dan Metode 20
Hasil dan Pembahasan 23
Simpulan 28
UJI BIOLOGIS CONDITIONED MEDIUM SEL LEYDIG TERHADAP TRANSDIFERENSIASI STEM SEL MESENKIMAL SUMSUM
TULANG TIKUS DEWASA 30
Pendahuluan 31
Materi dan Metode 33
Hasil dan Pembahasan 37
Simpulan 42
PEMBAHASAN UMUM 45
SIMPULAN DAN SARAN 46
DAFTAR PUSTAKA 48
1 Konsentrasi, kemurnian dan viabilitas sel Leydig hasil purifikasi
dengan gradien Nycodenz dan Percoll 14
2 Konsentrasi dan viabilitas sel Leydig hasil purifikasi dan dikultur in
vitro selama 3 hari 15
3 Kemurnian, viabilitas dan konsentrasi sel Leydig hasil purifikasi
dengan gradien Nycodenz 23
4 Kultur primer sel Leydig hasil isolasi dan purifikasi dengan gradien
Nycodenz 24
5 Jumlah dan PDT suspensi sel pada kultur in vitro 25 6 Kemurnian,viabilitas dan jumlah sel hidup galur sel Leydig 26 7 Hasil pengujian testosteron dalam medium kultur sel Leydig 27 8 Analisis konsentrasi testosteron dan protein dari conditioned
medium kultur sel Leydig 38
9 Kultur in vitro sel mesenkimal sumsum tulang dengan perlakuan conditioned medium kultur sel Leydig serta analisis konsentrasi testosteron dan protein di dalam medium kultur 40
DAFTAR GAMBAR
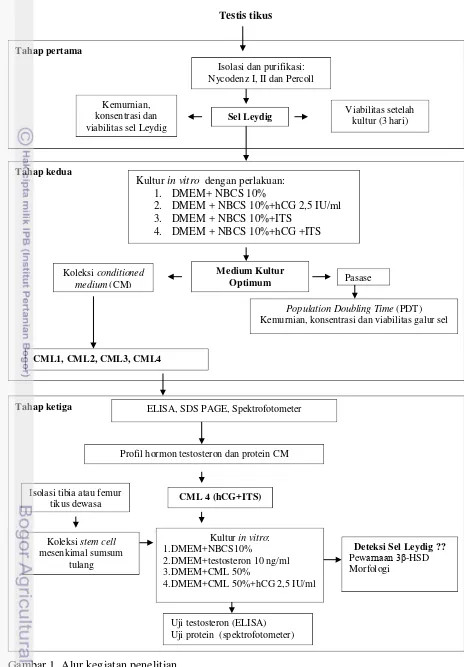
1 Alur kegiatan penelitian 4
2 Populasi suspensi sel testiskuler hasil disosiasi jaringan testis tikus dengan enzim collagenase dan trypsin inhibitor. 12 3 Sel Leydig setelah pewarnaan 3β-HSD dan Trypan Blue 13 4 Sel Leydig hasil purifikasi dengan beberapa gradien perlakuan
setelah dikultur selama 3 hari 16
5 Hasil analisis SDS PAGE terhadap conditioned medium kultur sel
Leydig 38
6 Kultur sel mesenkimal sumsum tulang tikus yang diwarnai dengan
pewarnaan histokimia spesifik 3β-HSD 40
7 Morfologi sel mesenkimal sumsum tulang yang dikultur secara in
1 Pewarnaan histokimia γ -HSD 52 2 Penghitungan Sel Menggunakan Haemositometer (kamar hitung)
Improved Neubaeur
53
3 Komposisi medium DPBS serum 54
PENDAHULUAN
Latar Belakang
Kehidupan modern dewasa ini menyebabkan tingkat stress yang tinggi, sehingga menjadi salah satu faktor pemicu berkembangnya berbagai macam penyakit yang memerlukan penanganan khusus. Berbagai penyakit tersebut dapat menyerang berbagai organ yang bersifat degeneratif, termasuk kelainan reproduksi. Salah satu penyakit kelainan reproduksi yang ditakuti oleh laki-laki adalah rendahnya produksi kadar testosteron, sehingga mengurangi kejantanan pria. Hal ini karena kekurangan hormon testosteron di dalam tubuh jantan dapat menghambat proses spermatogenesis (Hardy et al. 1991), sehingga menyebabkan infertilitas.
Kegagalan reproduksi pada jantan seperti defisiensi hormonal, saat ini umumnya diatasi dengan cara pemberian suplemen hormon testosteron sintetis, tetapi terapi tersebut pada manusia dapat menyebabkan resiko jangka panjang seperti menyebabkan penyakit jantung koroner, retensi cairan, kanker prostat dan sebagainya (Gruennewald & Matsumoto 2003). Untuk itu, beberapa peneliti telah melakukan upaya terapi lainnya dengan menggunakan sel Leydig sebagai sumber sel penghasil hormon testosteron yang dapat ditransplantasikan ke dalam testis. Penggunaan sel Leydig sebagai terapi alternatif penghasil hormon testosteron membutuhkan sumber sel Leydig yang akan ditransplantasikan dalam jumlah yang memadai. Produksi galur (cell line) sel Leydig secara in vitro diharapkan sebagai upaya tersedianya sumber sel Leydig untuk digunakan dalam mengembangkan terapi alternatif pada kegagalan reproduksi akibat defisiensi hormonal.
Isolasi sel Leydig pada umumnya dilakukan menggunakan gradien Percoll, tetapi diketahui bahwa Percoll dapat dimetabolisme oleh sel Leydig sehingga dapat menurunkan viabilitas sel Leydig ketika dikultur. Oleh karena itu diperlukan metoda isolasi dan purifikasi yang lebih baik. Nycodenz merupakan gradien pemisah yang bersifat non toksik dan tidak dapat diabsorpsi oleh beberapa jenis sel mammalia serta dapat dengan mudah dihilangkan dari sampel sel dibandingkan dengan gradien pemisahan lain (Miller 2006).
Progenitor sel Leydig diduga merupakan stem cell mesenkimal karena mempunyai morfologi seperti sel yang terdapat pada jaringan ikat yang berasal dari mesoderm embrio (Hardy et al 1991). Pada tikus, progenitor sel Leydig mempunyai kemampuan proliferasi tinggi dan menunjukkan marker fungsi diferensiasi (Ge et al. 2005). Disisi lain hormon LH atau hCG sangat diperlukan untuk proliferasi dan diferensiasi sel Leydig (Saez 1994) sehingga sel Leydig mampu memproduksi testosteron. Proliferasi sel Leydig di dalam kultur secara in vitro memerlukan bahan bioaktif tambahan dan yang umum digunakan adalah ITS (Insulin Transferrin Sodium Selenite) yang mengandung tiga faktor pertumbuhan. Selain itu juga berfungsi mengurangi penggunaan serum di dalam medium kultur.
Sel-sel yang dikultur secara in vitro mampu mensekresikan berbagai bahan bioaktif seperti faktor pertumbuhan (growth factor) yang bermanfaat bagi pertumbuhan sel dalam kultur. Kultur sel Leydig diduga mensekresikan berbagai bahan bioaktif seperti peptida, faktor pertumbuhan, hormon testosteron ke dalam medium kultur (Chemes et al. 1992, Cudicini et al. 1997, Hu et al. 1998). Medium tersebut dapat digunakan untuk mengkultur kembali sel Leydig maupun sel yang lain dan dikenal sebagai conditioned medium. Penggunaan conditioned medium ditemukan dapat mengarahkan diferensiasi stem cell mesenkimal menjadi sel tertentu (Djuwita et al. 2010), selain itu stem cell mesenkimal sumsum tulang belakang yang ditransplantasikan ke dalam testis menyebabkan sel tersebut berdiferensiasi menjadi sel Leydig (Yazawa et al. 2006).
Berdasarkan beberapa hal yang telah diuraikan di atas, maka perlu dilakukan penelitian untuk mendapatkan teknik isolasi dan pemurnian sel Leydig yang mempunyai viabilitas sel setelah kultur yang tinggi sehingga diperoleh galur sel sebagai sumber sel Leydig, untuk mendapatkan sistem kultur sel Leydig yang optimum, serta untuk mendapatkan sel Leydig alternatif dari stem cell mesenkimal yang diferensiasinya diarahkan dengan menggunakan conditioned medium kultur sel Leydig (transdiferensiasi).
Tujuan Penelitian
1. Menguji efektivitas gradien Nycodenz dalam meningkatkan konsentrasi, kemurnian dan viabilitas sel Leydig setelah diisolasi, dipurifikasi dan kultur in vitro.
2. Menguji pengaruh penambahan hCG dan/atau ITS ke dalam medium DMEM terhadap proliferasi dan perkembangan sel untuk mendapatkan kondisi optimum kultur in vitro sel Leydig hasil purifikasi dengan gradien Nycodenz.
3. Mengidentifikasi sekresi testosteron dan protein yang terdapat dalam conditioned medium (CM) kultur sel Leydig.
Manfaat Penelitian
Sel Leydig dan CM kultur sel Leydig dapat digunakan untuk aplikasi terapi reproduksi pada manusia dan hewan terutama hewan yang terancam punah.
Kerangka Pemikiran
Penggunaan gradien Percoll banyak digunakan untuk melakukan purifikasi sel Leydig berdasarkan densitas sel. Percoll terdiri dari silica koloid yang dilapisi oleh polyvinylpyrrolidone (PVP) dan merupakan medium yang mempunyai partikel dengan diameter 15-30 nm. Keuntungan penggunaan gradien Percoll adalah untuk memisahkan sel karena mempunyai viskositas, osmolaritas dan toksisitas yang rendah. Namun penggunaan Percoll untuk mempurifikasi sel Leydig ditemukan bersifat toksik terhadap sel karena adanya proses pinositosis sehingga partikel Percoll dapat masuk ke dalam sel Leydig.
Oleh karena itu, diperlukan gradien lainnya yang digunakan untuk mengatasi masalah toksisitas sel Leydig setelah purifikasi. Di samping itu, gradien alternatif yang digunakan untuk purifikasi sel Leydig juga harus menghasilkan kemurnian yang tinggi. Gradien non toksik Nycodenz yang merupakan gradien non partikel sudah sering digunakan untuk memperoleh berbagai jenis sel. Nycodenz atau iohexol bersifat non ionik dan non toksik serta tidak dimetabolisme oleh sel. Lebih lanjut diketahui juga bahwa Nycodenz merupakan larutan non partikel, sehingga mudah dihilangkan dari medium setelah digunakan untuk memisahkan sel. Purifikasi sel dengan gradien Nycodenz dilakukan dengan cara sentrifugasi sehingga sel dengan densitas tertentu akan berada pada konsentrasi gradien Nycodenz tertentu. Penggunaan gradien Nycodenz untuk mempurifikasi Leydig diharapkan dapat memperoleh tingkat kemurnian sel Leydig yang tinggi dan setara dengan penggunaan gradien Percoll.
Kultur sel Leydig yang optimal memerlukan berbagai bahan bioaktif yang mampu mendukung proliferasi dan perkembangan sel di dalam kultur. Produksi hormon testosteron oleh sel Leydig diatur oleh hormon gonadotropin yaitu hormon LH yang diperlukan oleh sel Leydig sebagai induktor untuk memproduksi testosteron secara in vivo. Di dalam kultur in vitro, penambahan hormon hCG yang merupakan analog dari LH digunakan untuk menginduksi sel Leydig dalam memproduksi testosteron. Di samping hormon, diduga bahwa untuk proliferasi sel diperlukan penambahan faktor pertumbuhan yang dapat mendukung proliferasi sel dengan baik. Faktor pertumbuhan ITS merupakan faktor yang berperan dalam proliferasi sel. Untuk itu kajian penambahan hCG atau ITS ke dalam medium kultur sel Leydig secara in vitro dilakukan untuk dapat meningkatkan konsentrasi sel serta memperoleh testosteron dan bahan bioaktif lainnya .
Testis tikus
Gambar 1. Alur kegiatan penelitian
Tahap ketiga Tahap kedua Tahap pertama
Sel Leydig
Pasase
Medium Kultur Optimum
Koleksi conditioned medium (CM)
Population Doubling Time (PDT) Kemurnian, konsentrasi dan viabilitas galur sel
ELISA, SDS PAGE, Spektrofotometer
Profil hormon testosteron dan protein CM
Koleksi stem cell mesenkimal sumsum
tulang Isolasi tibia atau femur
tikus dewasa
Kultur in vitro: 1.DMEM+NBCS10%
2.DMEM+testosteron 10 ng/ml 3.DMEM+CML 50%
4.DMEM+CML 50%+hCG 2,5 IU/ml Kultur in vitro dengan perlakuan:
1. DMEM+ NBCS 10%
2. DMEM + NBCS 10%+hCG 2,5 IU/ml
3. DMEM + NBCS 10%+ITS
4. DMEM + NBCS 10%+hCG +ITS
CML1, CML2, CML3, CML4
Isolasi dan purifikasi: Nycodenz I, II dan Percoll
Kemurnian, konsentrasi dan viabilitas sel Leydig
Viabilitas setelah kultur (3 hari)
CML 4 (hCG+ITS)
Deteksi Sel Leydig ??
Pewarnaan γ -HSD Morfologi
KONSENTRASI, KEMURNIAN DAN VIABILITAS SEL
LEYDIG HASIL PURIFIKASI DENGAN GRADIEN
NYCODENZ DAN KULTUR IN VITRO
ABSTRAK
Peran sel Leydig sebagai penghasil hormon testosteron di dalam tubuh jantan diketahui diperlukan untuk terjadinya proses spermatogenesis. Pada kasus hipogonadism, terapi transplantasi sel Leydig telah dilakukan. Dengan demikian penelitian kultur in vitro sel Leydig diperlukan untuk mendukung ketersediaan sumber sel Leydig yang akan ditransplantasi.
Koleksi sel dari jaringan testis menghasilkan suspensi dengan jenis sel yang beragam. Untuk mendapatkan sel Leydig diperlukan proses purifikasi dan yang umum digunakan adalah gradien Percoll, namun dilaporkan bahwa Percoll dapat dimetabolisme oleh sel Leydig sehingga menyebabkan toksisitas rendah pada sel yang dapat mempengaruhi viabilitas dan perolehan jumlah sel hidup setelah dikultur. Untuk mengatasi permasalahan tersebut, telah dilakukan purifikasi dengan menggunakan gradien Nycodenz yang tidak toksik terhadap sel. Perlakuan dilakukan dengan gradien Nycodenz I, 3 kolom (5%, 10%, 15%) dan II, 5 kolom (4%,8%,10%,12%,15%) yang dibandingkan dengan gradien Percoll 5 kolom (21%, 26%, 34%, 40% dan 60%). Parameter yang diamati adalah konsentrasi, kemurnian, viabilitas serta jumlah sel Leydig hidup setelah purifikasi dan kultur in vitro. Hasil menunjukkan bahwa isolasi dan purifikasi sel Leydig dengan gradien Nycodenz I (85,53%) dan II (91,40%) menghasilkan kemurnian yang tidak berbeda dibandingkan dengan gradien Percoll (92,22%). Viabilitas sel Leydig pada Nycodenz I (85,53%) dan Nycodenz II (91,40%) juga tidak berbeda dibandingkan dengan Percoll (92,22%). Konsentrasi sel yang diperoleh setelah dipurifikasi menggunakan gradien Nycodenz I (7,12x106sel/ml) dan gradien Nycodenz II (7,03 x 106sel/ml ) masih rendah (p<0,05) dibandingkan dengan Percoll (15,42x 106sel/ml). Peranan Nycodenz II (3,88x106 sel/ml) terhadap konsentrasi sel terlihat tinggi setelah 3 hari dikultur dibandingkan Nycodenz I (3,21 x 106sel/ml) dan Percoll (2,44 x106sel/ml) (p<0,05). Viabilitas sel setelah dikultur juga tampak lebih baik pada Nycodenz I (90%) dan Nycodenz II (91,16%) dibandingkan dengan Percoll (82,30%). Disimpulkan bahwa Nycodenz II lebih efektif mempurifikasi sel Leydig dan setelah dikultur, penggunaan gradien Nycodenz lebih baik terhadap konsentrasi dan viabilitas sel Leydig dibandingkan dengan Percoll.
ABSTRACT
The role of Leydig cells is to produce testosterone which is important for spermatogenesis process. The transplantation of Leydig cells has been success to increase testosterone concentration in hypogonadism. Research on in vitro culture of Leydig cell is required to support availability of Leydig cell for transplantation. The purification of Leydig cell from testicular tissue produce heterogenous of cells. It is therefore further method to purify of Leydig cells is required. Percoll gradient is one method to purify Leydig cells, but it is reported that it can cause toxicity to Leydig cells, so it can influence on cell viability and recovery rate. To overcome these problem, this research used non toxic Nycodenz gradient with different column namely (I) 3 columns (5%, 10%, 15%) and (II) 5 columns (4 % ,8 % ,10 % ,12 % ,15 % ) compared with 5 columns Percoll gradient (21 %, 26 %, 34 %, 40 % and 60 % ) as control. The percentage of cell viability, live cells and the cell concentration were measured after purification and culture. The result showed that the purity of Leydig cells after purification using Nycodenz I (85.53%), Nycodenz II (91.40%) were comparable with Percoll (92.22%). However, the cells concentration after purification with Nycodenz (I: 7.12 x 106 cells/ml; II : 7.03 x x 106 cells/ml) showed still lower than Percoll (15.42 x 106 cells/ml) (p<0.05). After 3 days culture, the cells concentration was higher in Nycodenz I (3.21 x 106cells/ml) , Nycodenz II (3.88 x 106cells/ml) than Percoll gradient (2.44 x 106cells/ml), with similar result on cell viability. It can be concluded that Nycodenz gradient II more effective to purify Leydig cells to obtain high concentration and viability of cells after culture.
Keywords : Leydig cells, gradient, Nycodenz, Percoll, purity, viability
PENDAHULUAN
alternatif penghasil hormon testosteron membutuhkan sumber sel Leydig dalam konsentrasi dan viabilitas yang memadai. Untuk itu diperlukan penelitian menghasilkan sel Leydig dengan konsentrasi, kemurnian dan viabilitas tinggi, baik setelah purifikasi maupun setelah dikultur secara in vitro.
Isolasi dan purifikasi sel Leydig telah banyak dilakukan dengan beberapa metode, di antaranya gradien Percoll dengan konsentrasi yang bervariasi. Percoll adalah silika koloid yang dilapisi oleh polyvinylpyrrolidone (PVP) merupakan bahan yang dapat digunakan untuk memisahkan berbagai jenis sel. Hasil purifikasi Chemes et al. (1992) menggunakan gradien Percoll diskontinu pada gradien 34% dan 60% menghasilkan sel Leydig dengan kemurnian 90%, sedangkan Bilinska et al. (2009) menggunakan metoda yang sama memperoleh kemurnian sebesar 80-83% hasil peneguhan dengan pewarnaan 3β-hydroxysteroid dehidrogenase (3β-HSD).
Wakefield et al. (1982) melaporkan bahwa penggunaan gradien Percoll untuk mengisolasi sel Leydig tikus pada suhu 20 C- 37 C dapat menyebabkan partikel Percoll masuk ke dalam sel Leydig yang berakibat menurunnya viabilitas sel. Hal tersebut disebabkan gradien Percoll bersifat sitotoksik. Gradien pemisah sel lainnya adalah Nycodenz atau Iohexol, yang mempunyai beberapa kelebihan dibandingkan dengan Percoll di antaranya mempunyai osmolalitas dan viskositas rendah tetapi mempunyai densitas yang tinggi, sehingga dapat secara efektif memisahkan makromolekul dan sel dengan rentang ukuran yang lebih luas untuk jenis sel yang lebih bervariasi. Nycodenz bersifat stabil, larut dalam air dan dapat disterilisasi dengan filter syringe sehingga mudah digunakan di laboratorium, bersifat non sitotoksik terhadap sel mammalia. Selain itu, Nycodenz dengan mudah dapat dihilangkan dari suspensi sel dengan cara sentrifugasi dibandingkan dengan gradien dari bahan lain karena residu gradien pemisah dapat menyebabkan kematian sel. Nycodenz dapat digunakan secara mudah dengan metode sederhana tanpa ada keterbatasan dalam suhu, pH dan stabilitas (Miller 2006). Gradien Nycodenz telah digunakan untuk memisahkan sel darah, sel hati, primordial germ cell (PGC), spermatogonia dan sel Sertoli (Evans & Flint 1985, Manayagi et al. 2003, Nakayama et al. 1999), namun penelitian menggunakan gradien Nycodenz untuk mengisolasi sel Leydig pada tikus belum dilaporkan. Untuk itu, penelitian ini dilakukan untuk menguji efektivitas gradien Nycodenz dalam meningkatkan konsentrasi, kemurnian dan viabilitas sel Leydig setelah diisolasi dan purifikasi serta kultur in vitro.
MATERI DAN METODE
Waktu dan Tempat Penelitian
Materi Penelitian
Untuk mendapatkan suspensi testikular dilakukan isolasi dan koleksi dari testis yang dikoleksi dari tiga ekor tikus (Sprague Dawley) jantan dewasa berumur 8-10 minggu yang diperoleh dari Fakultas Peternakan IPB. Perlakuan terhadap hewan percobaan pada penelitian ini telah dilakukan dengan mengikuti kaidah ilmiah terstandar dengan memperhatikan prinsip-prinsip kesejahteraan hewan.
Metode Penelitian
Kegiatan penelitian yang dilakukan terdiri dari : 1. Pembuatan Suspensi Sel Testikuler 2. Isolasi dan Purifikasi Sel Leydig
3. Kultur In Vitro Sel Leydig Hasil Purifikasi
Pembuatan Suspensi Sel Testikuler
Isolasi dan Purifikasi Sel Leydig
Isolasi dan purifikasi sel Leydig dilakukan dengan menggunakan metode gradien Nycodenz® (1002424, Axis-Shield PoC AS, Oslo Norway) yang dimodifikasi dari Nakayama et al. (1999). Suspensi sel kemudian dimasukkan ke dalam larutan Nycodenz dengan gradien 3 kolom 5%, 10% dan 15% (Nycodenz I) atau gradien 5 kolom 4%, 8%, 10%, 12%, 15% (Nycodenz II). Setelah itu, larutan gradien disentrifugasi menggunakan sentrifus swing rotor (Kokusan H-26F) dengan kecepatan 1.500 g selama 10 menit pada suhu ruang. Lapisan sel yang terbentuk kemudian dikoleksi dan dicuci berturut-turut dengan mDPBS sebanyak empat kali dengan cara disentrifugasi dengan kecepatan 200 g selama tiga menit. Pelet sel diencerkan dengan 500 µl mDPBS.
Sebagai kontrol, isolasi dan purifikasi sel Leydig dilakukan dengan menggunakan gradien Percoll (Sigma P-1644St Louis, MO, USA) dengan 5 kolom yaitu 21%, 26%, 34% , 40% dan 60% (modifikasi Chemes et al. 1992). Setelah itu suspensi sel disentrifugasi berturut-turut dengan kecepatan 400 g selama 15 menit dan 800 g selama 15 menit dengan menggunakan sentrifus swing rotor pada suhu ruang, kemudian dilakukan perlakuan seperti pada Nycodenz.
Kultur In Vitro Sel Leydig Hasil Purifikasi
Sebanyak 1 x 106 sel/ml suspensi sel Leydig dari masing-masing perlakuan dikoleksi dan dikultur dalam medium DMEM (Sigma, D5532, St. Louis, MO, USA) yang ditambah NBCS 10% (mDMEM) di dalam inkubator CO2 5% dengan suhu 37o C selama tiga hari.
Evaluasi
Rancangan Percobaan dan Analisis Data
Purifikasi sel Leydig hasil isolasi dari tubulus seminiferus dilakukan dengan dua perlakuan yaitu gradien Nycodenz 3 kolom (5%, 10% dan 15% disebut Nycodenz I), gradien Nycodenz 5 kolom (4%,8%,10%,12%, dan 15% disebut Nycodenz II) dan gradien Percoll 5 kolom (21%, 26%, 34%, 40% dan 60%) sebagai kontrol. Parameter yang diamati adalah konsentrasi sel, kemurnian, viabilitas, dan sel Leydig hidup setelah purifikasi dan kultur in vitro. Setiap perlakuan dilakukan tiga kali ulangan. Data yang diperoleh kemudian diuji secara statistik dengan uji ANOVA dengan tingkat kepercayaan 95% dan uji lanjut Duncan.
HASIL DAN PEMBAHASAN
Suspensi Testikuler Hasil Disosiasi
Sel Leydig merupakan sel yang berada di jaringan interstisial di antara tubuli seminiferi testis. Isolasi sel Leydig dilakukan dengan cara disosiasi jaringan testis menggunakan enzim collagenase dan trypsin inhibitor, sehingga diperoleh suspensi sel testikuler yang terdiri dari sel-sel gamet yakni spermatogonia (1), spermatosit, spermatid (2), dan spermatozoa (3), serta sel-sel somatis lainnya seperti sel Sertoli, sel darah (4) ,fibroblast (5) dan sel Leydig (6) (Gambar 1).
Gambar 2. Populasi suspensi sel testikuler hasil disosiasi jaringan testis tikus dengan enzim collagenase dan trypsin inhibitor.1. spermatogonia , 2. spermatid, 3. spermatozoa, 4. sel darah merah, 5. Fibroblas, 6 Sel Leydig. Skala = 10 µm
Konsentrasi, Kemurnian dan Viabilitas Sel Leydig Setelah Purifikasi
Lapisan sel Leydig yang dipurifikasi dengan gradien Nycodenz I (3 kolom) dan Nycodenz II (5 kolom) diperoleh masing-masing di antara gradien 5% dan 10% dan gradien 8% dan 10%, sedangkan dengan menggunakan gradien Percoll (5 kolom) diperoleh lapisan sel Leydig di antara gradien 34% dan 40%.
[image:30.595.81.470.76.760.2]pada penelitian ini terdapat perbedaan posisi pembentukan lapisan sel pada gradien Nycodenz dengan gradien Percoll.
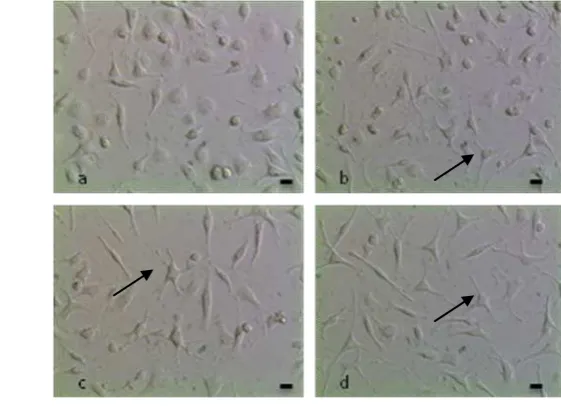
Setelah dipurifikasi baik menggunakan gradien Nycodenz maupun Percoll, tampak populasi sel Leydig menjadi lebih homogen dibandingkan sebelumnya. Hal tersebut ditunjukkan oleh persentase kemurnian sel Leydig yang diperoleh yaitu di antara 85 sampai 92 % (Tabel 1) dan dibuktikan dengan pewarnaan 3β-HSD yang menghasilkan sel yang positif terhadap pewarnaan tersebut menandakan bahwa sel-sel tersebut adalah sel Leydig (Gambar 3a). Ukuran sel Leydig bervariasi berdasarkan penambahan lipid pada sitoplasma. Perubahan sel Leydig dewasa immature menjadi sel Leydig mature dikenali dengan adanya peningkatan ukuran sel dan menghilangnya droplet lipid pada sitoplasma (Mendis-Handagama & Ariyaratne 2001).
\
Gambar 3. Sel Leydig setelah pewarnaan 3β-HSD dan Trypan Blue a. Sel Leydig adalah sel yang berwarna ungu , menunjukkan sel positif 3β-HSD (tanda panah); sel tidak terwarna (x) adalah sel non Leydig. b.Warna biru menunjukkan sel Leydig yang mati (kepala panah) dengan Pewarnaan Trypan Blue. Skala = 20 µm.
Pengujian viabilitas sel Leydig hasil purifikasi digunakan untuk mengetahui kualitas sel setelah dipurifikasi oleh gradien Nycodenz maupun Percoll. Pada Gambar 3b tampak viabilitas sel Leydig tinggi yang ditunjukkan dengan sedikitnya jumlah sel Leydig berwarna biru (sel mati). Viabilitas sel Leydig dari hasil koleksi dengan tiga metode tersebut menghasilkan viabilitas pada Nycodenz I (98,93%) dan Nycodenz II (98,17%) serta Percoll (98,00 %) (Tabel 1). Hasil isolasi dan purifikasi menggunakan gradien Nycodenz maupun gradien Percoll tidak mempengaruhi viabilitas sel Leydig.
kecepatan, waktu dan konsentrasi yang digunakan untuk purifikasi belum optimal. Waktu dan kecepatan sentrifugasi yang tepat diperlukan supaya sel Leydig berada dalam gradien yang seharusnya karena jika terlalu lama dan/atau terlalu cepat maka semua sel akan mengendap di dasar tabung.
Tabel 1.Konsentrasi, kemurnian dan viabilitas sel Leydig hasil purifikasi dengan gradien Nycodenz dan Percoll
Perlakuan pemurnian
Konsentrasi Sel Leydig suspensi
(106 /ml)
Kemurnian (%)
Viabilitas (%)
Sel hidup (%)
Percoll 15,42a 92,22 98,00 90,40
Nycodenz I 7,12b 85,53 98,93 84,55
Nycodenz II 7,03b 91,40 98,17 89,62
Keterangan : huruf superskrip yang berbeda pada kolom yang sama menunjukkan perbedaan yang sangat nyata (p<0,01) dengan uji lanjut Duncan
Purifikasi yang dilakukan menggunakan gradien Nycodenz 3 kolom diperoleh kemurnian sel Leydig yang relatif rendah yaitu 85,53%. Untuk meningkatkan kemurnian sel Leydig, dilakukan modifikasi penggunaan gradien Nycodenz menjadi 5 kolom sehingga diperoleh peningkatan kemurnian sel Leydig menjadi 91,40%. Kemurnian sel Leydig tersebut tidak berbeda dengan hasil purifikasi dengan gradien Percoll (92,22%). Perbedaan rentang kolom gradien dapat mempengaruhi proses pemisahan sel, semakin banyak jumlah kolom yang digunakan akan meningkatkan seleksi sel. Pada Nycodenz I yang terdiri dari 3 kolom, sel Leydig diperoleh berada di antara gradien 5% dan 10%, sedangkan pada Nycodenz II (5 kolom) sel Leydig diperoleh di antara 8% dan 10%. Hal ini menunjukkan bahwa pada gradien Nycodenz dengan rentang konsentrasi gradien yang lebih pendek dapat mempurifikasi sel Leydig dan menghasilkan kemurnian yang lebih tinggi.
Nycodenz merupakan bahan kimia tidak bermuatan listrik dengan mempunyai nama lain 5-(N-2.3-dihydroxypropylacetamido)-2.4.6-tri-iodo-N.N’-bis (2.3-dihydroxyproppyl) isophtalamide mempunyai berat molekul 821, mempunyai viskositas rendah, daya larut dalam air tinggi dan lebih stabil ketika dipanaskan. Hal tersebut memudahkan penggunaan Nycodenz di laboratorium karena pemisahan sel dapat dilakukan tanpa memerlukan peralatan khusus dan tanpa dibatasi oleh suhu dan pH.
dan waktu sentrifugasi sehingga akan mempurifikasi sel Leydig dengan lebih baik.
Konsentrasi dan Viabilitas Sel Leydig Setelah Purifikasi dan Kultur In Vitro
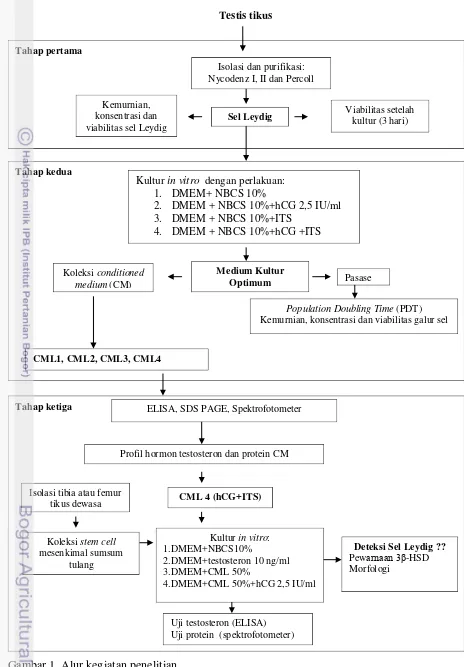
Kualitas sel Leydig setelah dikultur selama 3 hari ditampilkan pada Tabel 2. Hasil menunjukkan bahwa setelah dikultur viabilitas sel Leydig menurun pada semua perlakuan dibandingkan setelah purifikasi. Setelah dikultur, viabilitas sel pada perlakuan dengan gradien Percoll menurun secara nyata (82,30%) (p<0,05) dibandingkan dengan penggunaan gradien Nycodenz I (90,00%) dan gradien Nycodenz II (91,16%). Hal ini membuktikan bahwa Nycodenz tidak bersifat sitotoksik terhadap sel Leydig, sehingga lebih banyak sel yang hidup setelah dikultur. Penggunaan Percoll untuk mempurifikasi sel Leydig menghasilkan jumlah dan kemurnian sel yang lebih tinggi, tetapi karena Percoll bersifat sedikit toksik dan dapat dimetabolisme oleh sel Leydig (Wakefield et al. 1982) diduga dapat menyebabkan penurunan viabilitas sel Leydig setelah dikultur.
Tabel 2. Konsentrasi dan viabilitas sel Leydig hasil purifikasi dan dikultur in vitro selama 3 hari
Perlakuan pemurnian
Konsentrasi awal
Sel Leydig setelah kultur (106 sel/ml) Konsentrasi
(106 sel/ml)
Viabilitas (%) Sel hidup (%)
Percoll 1 2,44a 82,30a 81,97a
Nycodenz I 1 3,21b 90,00b 90,03b
Nycodenz II 1 3,88c 91,16 b 90,98b
Keterangan : huruf superskrip yang berbeda pada kolom yang sama menunjukkan perbedaan yang nyata (p<0,05) dengan uji lanjut Duncan
Gambar 4. Sel Leydig hasil purifikasi dengan beberapa gradien perlakuan setelah dikultur selama 3 hari (a= Percoll; b= Nycodenz I; c= Nycodenz II). Skala = 10µm.
SIMPULAN
1. Penggunaan gradien Nycodenz 5 kolom (4%,8%,10%, 12%,15%) efektif untuk mempurifikasi sel Leydig dengan kemurnian yang sama dengan gradien Percoll, namun konsentrasi sel Leydig yang diperoleh setelah purifikasi masih rendah.
2. Gradien Nycodenz lebih efektif terjadi setelah kultur terhadap konsentrasi dan viabilitas sel Leydig dibandingkan dengan Percoll.
DAFTAR PUSTAKA
Anonimous 2012. Blue Histology: Male Reproductive System.
m#Testes
Amersham Bioscience. 2010. Percoll : Methodology and Applications.
Chemes H, Cigorraga S, Bergada C, Schteingart H, Rey R, Pellizzari E. 1992. Isolation of human Leydig cell mesenchymal precursors from patients with the androgen sensitivity syndrome: Testosteron Production and response to human chorionic gonadotrophin stimulation in culture. Biol Reprod 46: 793-801.
Evans WH, Flint N. 1985. Subfraction of hepatic endosomes in Nycodenz gradients and by free electrophoresis. Biochem J 232 :25-32. Abstract. Heller CG, Leach DR. 1971. Quantification of Leydig cells and measurement of
Leydig-cell size following administration of human Chorionic Gonadotrophin to normal men. J Reprod Fert 25 : 185-192.
Manayagi T, Kurosawa R, Ohnuma K, Ueyama A, Ito K, Takahashi J. 2003. Purification of mouse primordial germ cells by Nycodenz. Reprod 125: 667-675.
Mendis-Handagama SMIC, Ariyaratne HBS. 2001. Differentiation of the adult Leydig cell population in the postnatal testis. Biol Reprod 65 : 660-671. Miller SR. 2006. Assessment of Nycodenz gradient on enrichment and culture of
perinatal porcine spermatogonial stem cell. Thesis (pdf). The Graduate Faculty of North Carolina State University.
Nakayama Y, Yamamoto T, Abe S. 1999. IGF-I, IGF-II and insulin promote differentiation of spermatogonia to primary spermatocytes in organ culture of newt testes. Int J Dev Biol 43 : 343-347.
Salva A, Klinefelter GR, Hardy MP. 2001. Purification of rat Leydig cells: Increased yields after unit-gravity sedimentation of collagenase-dispersed interstitial cells. J Androl 22: 665-671
Sharpe PT. 1988. Methods of Cell Separation Vol. 18.http://books.google.co.id/ Thermo. 2012. Basic centrifugation.http://www.coleparmer.com/TechLibraryArticle Wakefield J St John, Gale JS, Berridge MV, Jordan TW ,Ford HC. 1982. Is
OPTIMASI KULTUR IN VITRO DAN ANALISIS
TESTOSTERON MEDIUM KULTUR SEL LEYDIG TIKUS
HASIL PURIFIKASI DENGAN GRADIEN NYCODENZ
ABSTRAK
Penggunaan gradien Nycodenz yang bersifat non toksik untuk isolasi dan purifikasi sel Leydig belum dilakukan oleh peneliti lain. Pada penelitian ini dilakukan pengujian pengaruh penambahan hCG dan/atau ITS ke dalam medium kultur terhadap perkembangan dan proliferasi sel Leydig tikus dewasa hasil purifikasi dengan gradien Nycodenz serta mendapatkan kondisi optimum kultur sel Leydig in vitro. Parameter yang diamati adalah konsentrasi, kemurnian serta viabilitas sel Leydig setelah purifikasi, proliferasi dan kemurnian sel Leydig setelah dikultur, serta nilai population doubling time (PDT) galur sel Leydig. Sel Leydig hasil purifikasi dengan gradien Nycodenz masing-masing sebanyak 1x 106 sel/ml dikultur di dalam medium: 1) DMEM yang ditambahkan NBCS 10% (M) sebagai kontrol ; 2) M+hCG β,5 IU/ml; γ) M+ITS (insulin 5 μg/ml, transferrin, 10 μg/ml, selenium 5 μg/ml); 4) M+hCG+ ITS. Hasil penelitian menunjukkan bahwa penggunaan gradien Nycodenz menghasilkan kemurnian 91,40%, viabilitas 98,17% dengan konsentrasi 7,03 x106 sel/ml. Penambahan ITS dan kombinasi penambahan hCG dan ITS pada medium kultur menghasilkan proliferasi sel lebih tinggi yaitu 88,35% dan 90,64% dibandingkan dengan kontrol (86,82%) (p<0,05). Pemberian hCG saja tidak meningkatkan proliferasi sel (86,99%). Nilai PDT kultur primer pada medium dengan kombinasi penambahan hCG dan ITS (0,88 hari) dan penambahan ITS (0,97 hari) lebih rendah daripada medium kontrol (1,03 hari) dan medium dengan penambahan hCG saja (1,02 hari) (p<0,05). Hasil serupa juga tampak pada kultur sel Leydig galur pertama dan kedua. Semakin rendah nilai PDT menunjukkan kecepatan proliferasi yang meningkat. Pada penelitian ini, konsentrasi testosteron lebih tinggi pada penambahan hCG saja (5,06 ng/ml) ataupun kombinasi penambahan hCG dan ITS (5,25 ng/ml) dibandingkan tanpa hCG (2,46 ng/ml) dan penambahan ITS (3,19 ng/ml) (p<0,05). Dapat disimpulkan bahwa kombinasi penambahan hCG dan ITS ke dalam medium DMEM meningkatkan konsentrasi testosteron serta proliferasi sel Leydig hasil purifikasi dengan gradien Nycodenz.
ABSTRACT
The used of non toxic Nycodenz gradient to isolate and purify of Leydig cells has not been done yet by other researchers. This study was to evaluate the effect of hCG and/ ITS in DMEM medium to obtain optimum condition on Leydig cells development and proliferation after purified with Nycodenz gradient. The aim of this experiment was to obtain an optimum culture condition to produced cell line. Evaluation was done also on population doubling time (PDT). This experiment used 1 x 106 cells/ml were cultured in : 1) DMEM was supplemented with 10% NBCS (M) as a control ; 2) M supplemented with 2.5 IU/ml hCG; 3) M supplemented with ITS (5 mg/ml insulin, 10 μg/ml transferrin, 5 μg/ml selenium) ; 4) M supplemented with combination of hCG and ITS. The results showed that the higher cell proliferation was found in medium containing ITS (88.35%) and the combination with hCG (90.64%) than control (86.99%) (p<0.05). hCG supplementation did not increase the cell proliferation (86.99%). Furthermore, supplementation of the combination hCG and ITS (0.88 day) revealed faster cell growth than ITS (0.97 day), hCG (1.02 day) and control (1.03 day) (p<0.05). The cell viability and PDT on first and second cell lines have similarity with primary culture. Additional data showed that supplementation of the combination hCG and ITS produced higher testosterone concentration (5.25 ng/ml) compared with hCG (5.06 ng/ml), ITS (3.19 ng/ml) and control (2.46 ng/ml). It can be concluded that supplementation of the combination hCG and ITS are able to support higher cell proliferation and testosterone concentration.
Keywords : Leydig, in vitro, rat, Nycodenz, hCG, ITS, testosterone
PENDAHULUAN
jaringan dan sel. Kultur sel dan produksi galur sel Leydig (cell line) diperlukan untuk mendapatkan sumber sel yang akan digunakan pada terapi seluler.
Jaringan testis terdiri dari sel somatik dan sel spermatogenik seperti sel Sertoli, sel Leydig, sel fibroblas, sel gamet jantan dalam berbagai tahapan perkembangan serta sel yang lainnya, sehingga diperlukan teknik isolasi dan purifikasi yang tepat untuk mendapatkan populasi sel Leydig yang murni. Isolasi dan purifikasi menggunakan gradien Nycodenz telah dilakukan untuk memperoleh sel Leydig (Kaiin et al. 2013). Kultur sel Leydig secara in vitro dapat menghasilkan galur dari kultur primer. Untuk memperoleh hasil kultur yang optimal perlu dilakukan penelitian untuk memperoleh kondisi optimum antara lain komposisi medium terbaik dalam mengkultur sel Leydig dengan penambahan human Chorionic Gonadotrophin (hCG) dan Insulin Transferrin Sodium Selenite (ITS) pada medium DMEM secara in vitro. Sel Leydig diduga mensekresikan berbagai bahan bioaktif seperti peptida, growth hormon, Interleukin-1 (IL-1) dan Interleukin- 6 (IL-6), hormon testosteron serta lainnya (Chemes et al. 1992, Cudicini et al. 1997, Hu et al. 1998) ke dalam medium kulturnya. Saez (1994) menyatakan bahwa hormon LH atau hCG sangat diperlukan untuk proliferasi dan diferensiasi sel Leydig sehingga sel mampu memproduksi testosteron. Peningkatan konsentrasi testoteron dalam medium kultur sel Leydig manusia terjadi setelah dilakukan penambahan hCG 1 IU/ml (Chemes et al. 1992, Bilinska et al. 1997), sedangkan penambahan hCG 5 IU pada medium kultur sel Leydig kelinci muda menghasilkan kandungan testosteron dalam jumlah besar yaitu 150 ± 9 ng/ 106 sel Leydig (El-Sherbiny et al. 1994). Penambahan ITS diperlukan sebagai bahan bioaktif untuk proliferasi sel Leydig. Chemes et al.(1992) menambahkan transferrin10 µg/ml dan zat lainnya yaitu insulin dapat meningkatkan produksi testosteron oleh sel Leydig fetus mencit dalam medium kultur selama 24 dan 48 jam (Pointis et al. 1984). Bernier et al. (1983) menambahkan insulin dan transferrin masing-masing 5 µg/ml dan hCG 1 IU/ml ke dalam kultur sel Leydig anak babi menyebabkan peningkatan sintesis testosteron dibandingkan tanpa penambahan hCG. Tujuan penelitian ini adalah untuk menguji pengaruh penambahan hCG dan/atau ITS ke dalam medium DMEM terhadap perkembangan dan proliferasi sel Leydig serta mendapatkan kondisi optimum kultur sel Leydig tikus dewasa in vitro setelah dipurifikasi dengan gradien Nycodenz
.
MATERI DAN METODE
Tempat dan Waktu Penelitian
Materi Penelitian
Testis diperoleh dari enam ekor tikus (Sprague Dawley) jantan dewasa berumur 8-10 minggu yang diperoleh dari Fakultas Peternakan IPB. Tiga ekor untuk penelitian kultur sel, dan tiga ekor untuk penelitian produksi galur sel. Perlakuan terhadap hewan percobaan pada penelitian ini telah dilakukan dengan mengikuti kaidah ilmiah terstandar dengan memperhatikan prinsip-prinsip kesejahteraan hewan.
Metode Penelitian
Penelitian dilakukan dalam tahapan : 1. Isolasi dan Purifikasi Sel Leydig 2. Kultur In Vitro dan Produksi Galur Sel
3. Uji Kandungan Testosteron dari Medium Kultur Sel Leydig.
Isolasi dan Purifikasi Sel Leydig
Tikus (Sprague Dawley) jantan dewasa berumur 8-10 minggu diambil testisnya setelah dibius dengan ether dan dikorbankan dengan cara cervical dislocation. Selaput tunika albuginea dan jaringan ikat lainnya dibuang, kemudian jaringan testis ditempatkan di dalam cawan petri berisi medium Dulbecco’s Phosphate Buffer Saline (DPBS) tanpa Ca dan Mg (Gibco, 21600-010, Invitrogen, NY, USA). Jaringan tersebut kemudian dicuci sebanyak tiga kali menggunakan medium DPBS yang ditambah Newborn Calf Serum (NBCS, Gibco, 16010-159, Invitrogen, New Zealand) 0,1% (DBPS). Pengambilan jaringan testis dilakukan secara aseptis kemudian dimasukkan ke dalam tabung yang berisi satu ml collagenase type I (Sigma, C0130,St Louis, MO, USA)0,04% dan trypsin inhibitor (Sigma, T9003, St Louis, MO, USA) 10 µg/ml dalam DPBS dan diinkubasi di dalam waterbath pada suhu 34 o C selama 40 menit. Suspensi sel diencerkan sebanyak empat kali volume awal dengan medium DPBS, kemudian didiamkan selama dua menit agar sel mengendap. Cairan supernatan dikoleksi dan disentrifugasi dengan kecepatan 200 g selama tiga menit. Pelet sel dicuci sebanyak dua kali menggunakan medium DPBS dengan cara yang sama. Terakhir, pelet sel diencerkan dengan 500 µ l medium DPBS.
D5532, St Louis, MO, USA) yang ditambah serum NBCS 10% sebanyak satu kali. Pencucian dilakukan dengan cara disentrifugasi dengan kecepatan 200 g selama tiga menit. Pelet sel diencerkan dengan 500 µ l medium DMEM, kemudian dilakukan penghitungan konsentrasi sel dengan menggunakan haemositometer (kamar hitung) Neubauer.
Kultur In Vitro dan Produksi Galur Sel Leydig
Sel Leydig sebanyak 1 x 106 sel/ ml ditempatkan dalam cawan petri (Corning, 430165, NY USA) 35 x 10 mm dengan perlakuan medium DMEM yang ditambah dengan NBCS 10% sebagai kontrol (1); dengan hCG (Chorulon, Intervet, EU) 2,5 IU/ml (2); dengan insulin 5 μg/ml, transferrin, 10 μg/ml, Se 5 μg/ml (ITS, Sigma I3146, St Louis, MO,USA) (3) serta hCG dan ITS (4) kemudian dikultur dalam inkubator CO2 5% (Sanyo, MCO-95, Japan) dengan temperatur 37 C. Setelah dikultur selama tiga hari, dilakukan penghitungan konsentrasi dan proliferasi. Pewarnaan histokimia spesifik 3β-HSD dilakukan untuk menghitung kemurnian sel Leydig.
Kultur primer dari masing-masing perlakuan dipasase pada hari ke-3, setelah pencucian dengan medium DPBS lalu dihitung konsentrasinya dengan menggunakan haemositometer Neubauer. Sel kemudian dikultur kembali sampai mencapai tahap konfluen. Pasase dilakukan sebanyak dua kali dan dilakukan penghitungan Population Doubling Time (PDT) dengan rumus:
PDT (hari) =
Uji Kandungan Testosteron dari Medium Kultur Sel Leydig
Medium kultur sel Leydig dari masing-masing perlakuan dikoleksi pada hari ke-3. Sampel kemudian dibekukan pada temperatur -20oC sebelum dilakukan pengujian konsentrasi testosteron dengan menggunakan kit Testosteron ELISA (DRG Diagnostic EIA 1559). Pengujian dilaksanakan di Laboratorium Hormon, Unit Rehabilitasi Reproduksi, Departemen Klinik, Reproduksi dan Patologi, Fakultas Kedokteran Hewan IPB.
Rancangan Percobaan dan Analisis Data
menggunakan rancangan acak lengkap (RAL) dan diuji secara statistik dengan ANOVA dan jika terdapat perbedaan di antara perlakuan dilanjutkan dengan uji Duncan. Produksi galur sel Leydig dilakukan sampai pasase ke-2 dengan masing-masing galur dilakukan tiga kali ulangan. Parameter yang diamati adalah data konsentrasi sel awal kultur serta konsentrasi sel akhir kultur selama tiga hari untuk menentukan PDT, serta kemurnian, viabilitas dan jumlah sel Leydig yang hidup. Pengujian kandungan testosteron di dalam medium kultur dilakukan sebanyak tiga kali ulangan pada masing-masing perlakuan.
HASIL DAN PEMBAHASAN
Isolasi dan Purifikasi Sel Leydig
Persentase kemurnian sel Leydig pada gradien Nycodenz diperoleh sebesar 91,40% dengan viabilitas 98,17% dan konsentrasi sel hasil purifikasi diperoleh sebesar 7,30 x 106 sel/ml (Tabel 3). Persentase kemurnian sel hasil purifikasi dengan gradien Nycodenz pada penelitian ini lebih tinggi dibanding dengan hasil yang diperoleh Risbridger dan Hedger (1992) yaitu sebesar 87% dan hampir sama dengan yang diperoleh Yang et al. (2003) sebesar 95% dengan menggunakan gradien Percoll. Konsentrasi sel Leydig hasil purifikasi dengan Percoll (Kaiin et al. 2013) diperoleh hasil lebih tinggi yaitu sebesar 15,42 x 106 sel/ml.
Tabel 3.Kemurnian, viabilitas dan konsentrasi sel Leydig hasil purifikasi dengan gradien Nycodenz
Parameter Sel Leydig
Kemurnian (%) Viabilitas (%)
Konsentrasi (106 sel/ml) Jumlah hidup (106 sel/ml)
91,40 ± 5,02 98,17 ± 0,51 7,03 ± 1,04
Kultur In Vitro dan Produksi Galur Sel Leydig
Proliferasi sel Leydig yang dikultur dengan penambahan ITS dan kombinasi hCG dan ITS menghasilkan persentase proliferasi yang lebih tinggi yaitu sebesar 88,35% dan 90,64% (p<0,05) dibandingkan dengan kontrol (86,82%) dan penambahan hCG (86,99%). (Tabel 4). Persentase sel Leydig pada akhir kultur cenderung menurun pada semua perlakuan. Insulin Transferrin Sodium Selenite (ITS) merupakan supplemen yang digunakan untuk meningkatkan proliferasi sel di dalam medium kultur. Insulin merupakan hormon polipeptida yang berfungsi membantu penyerapan glukosa dan asam amino, sedangkan transferrin merupakan protein pembawa zat besi bertujuan membantu penyerapan nutrisi sel. Selenium merupakan trace element essential yang terdapat di dalam serum.
Tabel 4. Kultur primer sel Leydig hasil isolasi dan purifikasi dengan gradient Nycodenz
Parameter Medium perlakuan
M M +hCG M +ITS M+hCG+ITS
Tingkatproliferasi (%) Sel Leydig (%): -Awal kultur -Akhir kultur
86,82 a 90.75 88,75
86,99a 90.75 88,25
88,35b 90.75 88.00
90,64c 90.75 88,50
Keterangan : Huruf superskrip yang berbeda pada baris yang sama menunjukkan perbedaan yang nyata (p<0,05) dengan uji lanjut Duncan . M = medium mDMEM
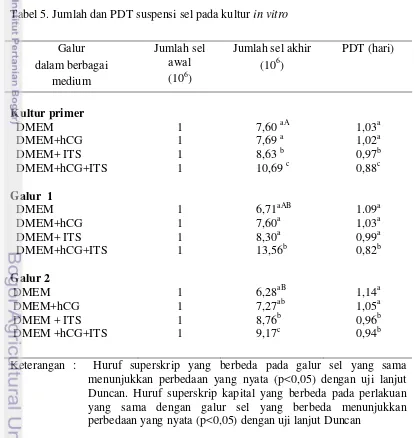
Dari hasil pasase terlihat peningkatan jumlah sel pada akhir kultur baik pada kultur primer maupun pada galur sel pertama dan kedua (Tabel 5). Di antara perlakuan terlihat bahwa peranan hCG dan ITS meningkatkan jumlah sel Leydig dibanding dengan perlakuan lainnya.
bioaktif yang dapat meningkatkan proliferasi sel. Butler (2004) menyatakan bahwa waktu yang diperlukan untuk proses pembelahan sel secara in vivo terjadi sekitar 18-24 jam. Setelah pasase, sel lebih homogen dan mampu beradaptasi dengan kondisi lingkungan in vitro (Freshney 2005). Sel Leydig pada kultur primer memiliki persentase kemurnian yang cukup tinggi (>90%). Oleh karena itu, sel yang dikultur merupakan sel yang homogen sehingga dapat menghasilkan nilai PDT mendekati waktu proliferasi secara in vivo. Jumlah sel Leydig pada perlakuan dengan medium DMEM menurun pada galur 1 dan galur 2 (p<0,05), sehingga menghasilkan PDT lebih tinggi dari kultur primer. Hal serupa terjadi pada perlakuan lain kecuali pada galur sel 1 terjadi peningkatan jumlah sel pada perlakuan kombinasi penambahan hCG dan ITS. Penambahan ITS pada DMEM menyebabkan peningkatan jumlah sel Leydig galur kedua dibandingkan galur pertama. Pada umumnya terjadi penurunan kemampuan proliferasi sel Leydig setelah pasase sebanyak dua kali. Kombinasi penambahan hCG dan ITS meningkatkan jumlah sel pada akhir kultur pada semua galur sel, sehingga perlakuan tersebut menyebabkan kecepatan proliferasi yang lebih tinggi dibandingkan dengan perlakuan lainnya.
Tabel 5. Jumlah dan PDT suspensi sel pada kultur in vitro
Galur dalam berbagai
medium
Jumlah sel awal (106)
Jumlah sel akhir (106)
PDT (hari) Kultur primer DMEM DMEM+hCG DMEM+ ITS DMEM+hCG+ITS Galur 1
DMEM DMEM+hCG DMEM+ ITS DMEM+hCG+ITS 1 1 1 1 1 1 1 1
7,60 aA 7,69 a 8,63 b 10,69 c
6,71aAB 7,60a 8,30a 13,56b 1,03a 1,02a 0,97b 0,88c 1.09a 1,03a 0,99a 0,82b Galur 2 DMEM DMEM+hCG DMEM + ITS DMEM +hCG+ITS 1 1 1 1 6,28aB 7,27ab 8,76b 9,17c 1,14a 1,05a 0,96b 0,94b
Persentase kemurnian sel dan viabilitas tinggi ditemukan pada semua perlakuan (85-91%). Kemampuan sel Leydig berproliferasi dilihat dari jumlah sel Leydig hidup tertinggi pada kombinasi penambahan hCG dan ITS pada kultur primer, galur 1 dan galur 2 dibandingkan dengan perlakuan lainnya (Tabel 6).
[image:44.595.78.464.192.778.2]Penambahan ITS, kombinasi hCG dan ITS pada medium meningkatkan jumlah sel Leydig hidup (p<0,05) pada kultur primer sebesar 6.68 x 106/ml dan 8,31 sel x 106/ml. Jumlah sel hidup galur 1 dan 2 pada semua perlakuan meningkat (p<0,05) dibandingkan dengan kontrol. Perlakuan medium yang sama pada galur 1 dan 2 menurunkan jumlah sel hidup (p<0,05) dibandingkan dengan kultur primer kecuali perlakuan kombinasi penambahan hCG dan ITS pada galur 1, terjadi peningkatan jumlah sel Leydig hidup.
Tabel 6. Kemurnian,viabilitas dan jumlah sel hidup galur sel Leydig Galur dalam berbagai medium Konsentrasi suspensi sel Sel Leydig
(x106sel /ml)
Kemurnian (%)
Jumlah (x106sel /ml)
Viabilitas (%)
Sel hidup (x106sel/ ml)
Kultur primer
M M + hCG M + ITS M + hCG +ITS
Galur Sel 1
M M + hCG M + ITS M + hCG +ITS
Galur Sel 2
M M + hCG M + ITS M + hCG +ITS
7,60aA 7,69a 8,63b 10,69c 6,71aAB 7,60a 8,30a 13,56b 6,28aB 7,27ab 8,76b 9,17c 85.17 85.50A 86.67 87.00 85.67 85.33A 86.67 87.33 86.67 89.17B 90.67 91.17 6.47aA 6.58a 7.48b 9.30c 5.74aAB 6.49a 7.19a 11.84b 5.44aB 6.49ab 7.94b 8.36c 88.67A 89.00C 89.33E 89.33G 86.33A 84.00D 87.00E 88.33G 80.67B 81.67D 82.67F 83.33H 5.74aA 5.85aD 6.68bG 8.31cI 4.96aB 5.45bE 6.26cH 10.46dJ 4.39aC 5.30bF 6.57cH 6.97cK
Menurut Habert et al. (2001) stimulasi proliferasi prekursor sel Leydig tikus dipengaruhi oleh faktor pertumbuhan (growth factor) yaitu Transforming Growth Factor (TGF-α) dan Insulin-like Growth Factor (IGF-I). Selain itu, Platelet-derived Growth Factor (PDGF-A) yang disekresikan oleh sel Sertoli juga dibutuhkan untuk proliferasi dan diferensiasi sel Leydig dewasa. Terjadinya penurunan jumlah sel Leydig hidup pada galur 1 dan 2 kemungkinan dipengaruhi oleh ketersediaan ketiga faktor tumbuh tersebut di dalam medium kultur.
Uji Kandungan Testosteron dari Medium Kultur Sel Leydig
Sel Leydig di dalam kultur mempunyai kemampuan mensekresikan testosteron sampai dengan 72 jam (Browning et al. 1983). Perlakuan hCG, kombinasi hCG dan ITS meningkatkan kandungan testosteron di dalam medium kultur (p<0,05) menjadi sebesar 5,06 ng/ml dan 5,25 ng/ml dibandingkan tanpa hCG (2,46 ng/ml) (Tabel 7). Hasil serupa terjadi pada kultur sel Leydig anak babi (Bernier et al. 1983). Sel Leydig yang dikultur dalam DMEM + ITS mempunyai kadar testosteron sebesar 3,19 ng/ml. Pointis et al. (1984) menyatakan bahwa penambahan insulin dalam medium kultur dapat meningkatkan akumulasi testosteron pada kultur sel Leydig fetus mencit. Luiteinizing Hormone (LH) yang disekresikan oleh hipofisa merupakan hormon yang menstimulasi steroidogenesis pada sel Leydig. Perubahan kadar LH secara in vivo dapat menggambarkan variasi kondisi fisiologis yang dapat menginduksi perubahan morfologi dan kemampuan sel Leydig mensintesis dan mensekresikan testosteron (Klinefelter et al. 1987). Hormon hCG merupakan analog dari LH sehingga dapat berikatan pada reseptor yang sama dengan reseptor LH pada sel Leydig (Renlund 2006) dan menyebabkan terjadinya sekresi testosteron. Penambahan hCG serta kombinasi penambahan hCG dan ITS ke dalam medium kultur sel Leydig menyebabkan peningkatan sekresi testosteron (5,06 ng/ml; 5,25 ng/ml) dibandingkan dengan kontrol (2,46 ng/ml) (p<0,05) (Tabel 7). Penambahan ITS tidak meningkatkan konsentrasi testosteron di dalam medium (3,19 ng/ml). Kandungan testosteron yang sedikit lebih tinggi dari kontrol tampaknya disebabkan oleh jumlah sel Leydig yang lebih banyak.
Tabel 7. Hasil pengujian testosteron dalam medium kultur sel Leydig
Perlakuan Ulangan Testosteron (ng/ml)
DMEM + NBCS 10% (M) 2 1,29a
Sel Leydig + M 3 2,46ab
Sel Leydig + M + hCG 3 5,06c
Sel Leydig + M + ITS 3 3,19b
Sel Leydig + M + hCG + ITS 3 5,25d
Penambahan hormon NBCS 10% dalam medium DMEM menghasilkan kandungan testosteron sebesar 1,29 ng/ml (Tabel 7). Sedelaar dan Isaacs (2009) menyatakan serum sapi yang baru lahir sampai berumur satu tahun mengandung hormon testosteron dengan konsentrasi antara 1,2 sampai 7,5 ng/ml dan diuji menggunakan metoda RIA. Penambahan serum dilakukan karena mengandung beberapa komponen nutrisi seperti: asam lemak, kolesterol, T3, insulin, IGF, EGF dan androgen (Hedlund dan Miller 1994). Selain itu, penambahan serum dilakukan untuk menyediakan hormon-hormon yang menstimulasi pertumbuhan dan fungsi sel. Serum menyediakan biomatriks yang membantu proses penempelan dan penyebaran sel, serta protein transpor pembawa hormon, mineral dan lipid (Freshney 1987). Penambahan serum di dalam medium kultur dilakukan untuk menyediakan nutrisi dan faktor pertumbuhan sehingga sel yang dikultur mengalami perkembangan dan proliferasi sel.
SIMPULAN
1. Penambahan ITS terhadap medium DMEM meningkatkan proliferasi sel Leydig, sedangkan penambahan hCG meningkatkan konsentrasi hormon testosteron di dalam medium kultur sel Leydig.
2. Proliferasi sel Leydig dan konsentrasi hormon testosteron meningkat pada medium DMEM yang diberi kombinasi penambahan hCG dan ITS. Perlakuan yang sama mempercepat waktu proliferasi sel (PDT).
DAFTAR PUSTAKA
Behre HM, Kliesch S, Leifke E, Link TM, Nieschlag E. 1997. Long-term effect of testosterone therapy on bone mineral density in hypogonadal men. J Clin Endocrin Metab 82 : 2386-2390.
Bernier M, Gibb W, Haour F, Collu R, Saez JM, Ducharme JR.1983. Studies with purified immature porcine Leydig cells in primary culture. Biol Reprod 29 : 1172 – 1178.
Bhasin S, Singh AB, Mac RP, Carter B, Lee MI, Cunningham GR. 2003. Managing the risk of prostate disease during testosterone replacement therapy in older men : recommendations for a standardized monitoring plan. J Androl 24(3): 299-311.
Bilinska B, Genissel C, Carreau S. 1997. Paracrine effect of seminiferous tubule factors on rat Leydig cell testosterone production: Role of cytoskeleton. Biol Cell 89:435-442.
Browning JY, Heindel JJ, Grotjan Jr HE. 1983. Method for primary culture of purified Leydig cells isolated from adult rat testes. J Tissue Culture Methods 7(2) : 55-58.
Butler M. 2004. Animal Cell Culture & Technology 2nd ed. London: Bios Scientific Publisher, Taylor & Francis Group.
Chemes H, Cigorraga S, Bergada C, Schteingart H, Rey R, Pellizzari E. 1992. Isolation of human Leydig cell mesenchymal precursors from patients with the androgen sensitivity syndrome: Testosteron Production and response to human chorionic gonadotrophin stimulation in culture. Biol Reprod 46: 793-801.
Cudicini C, Lejeune H, Gomez E, Bosmans E, Ballet F, Saez J, Jegou B.1997. Human Leydigs cells and Sertoli cells are producers of Interleukin-1 and -6. J Clin Endocrin Metab 82 (5) : 1426-1433.
El-Sherbiny AM, Amin SO, Hernandez C, Carreau S. 1994. The immature rabbit testis : presence of two distinct populations of Leydig cells. World Rabbit Sci 2(4) : 141-146.
Freshney 1987. Animal Cell Culture : A practical approach. Washington: IRL Press.
Freshney RI. 2005. Culture of animal cells: A manual of basic technique. John Wiley & Sons Inc. Publication.
Habert R, Lejeune H, Saez JM. 2001. Origin, differentiation and regulation of fetal and adult Leydig cells. Mol Cell Endocrin 179 : 47 – 74.
Hendlund TE, Miller GJ. 1994. A serum-free defined medium capable of supporting growth of four established human prostatic carcinoma cell lines. Prostate 24(5) : 221-228.
Hu J, You S, Li W, Wang D, Nagpal ML, Mi Y, Liang P, Lin T. 1998. Expression and regulation of interferon- -inducible protein 10 genes in rat Leydig cells. Endocrin 139 : 3637-3645.
Kaiin EM, Djuwita I, Yusuf TL, Setiadi MA. 2013. Konsentrasi, kemurnian dan viabilitas sel Leydig hasil purifikasi dengan gradien Nycodenz dan kultur in vitro. J K H Unsyiah Vol.7(1) : 75-80.
Klinefelter GR, Hall PF, Ewing LL. 1987. Effect of luteinizing hormone deprivation in situ on steroidogenesis of rat Leydig cells purified by a multistep procedure. Biol Reprod 36 : 769-783.
Mader SS. 2000. Human Biology. Iowa: McGraw Hill.
Pointis G, Rao B, Latreille MT, Cedard L. 1984. Hormonal regulation of testosteron in short term primary culture of fetal mouse Leydig cells. J Steroid Biochem 20(1) : 525-528.
Renlund N. 2006. Hormonal and paracrine influences on Leydig cell steroidogenesis [dissertation]. Stockholm: Karolinska Institutet.
Risbridger GP, Hedger MP. 1992. Adult rat Leydig cell cultures: minimum requirement for maintenance of luteinizing hormone responsiveness and testosterone production. Mol Cell Endocrin 83: 125-132.
Saez JM. 1994. Leydig Cells : Endocrine, paracrine and autocrine regulation. Endocrin Rev 15(5) :574-626.
Seedelaar JPM dan Isaacs JT. 2009. Tissue culture Media Supplemented with 10% Fetal Calf Serum Contains a Castrate Level of Testosterone. Prostate 69 (16) : 1724-1729.
UJI BIOLOGIS CONDITIONED MEDIUM SEL LEYDIG
TERHADAP DIFERENSIASI STEM CELL MESENKIMAL
SUMSUM TULANG TIKUS DEWASA
ABSTRAK
Terapi menggunakan stem cell mesenkimal sumsum tulang telah banyak dilakukan pada penyakit degeneratif. Conditioned medium (CM) dari beberapa jenis kultur sel diperkirakan mengandung berbagai bahan bioaktif yang disekresikan secara in vitro sudah diuji terhadap transdiferensiasi stem cell mesenkimal sumsum tulang. Penelitian ini dilakukan untuk menguji CM sel Leydig terhadap diferensiasi stem cell mesenkimal sumsum tulang. Conditioned medium dikoleksi dari kultur sel Leydig hasil purifikasi dengan gradien Nycodenz masing-masing sebanyak 1x 106 sel/ml setelah dikultur di dalam medium: 1) DMEM + NBCS 10% (M) sebagai kontrol; 2) dengan hCG 2.5 IU/ml; 3) dengan insulin 5 μg/ml, transferrin 10 μg/ml, Selenium 5 μg/ml (ITS) serta 4) hCG dan ITS. Setelah dikultur selama tiga hari, medium dari masing-masing perlakuan diganti dengan medium DMEM tanpa serum dengan perlakuan yang sama. Conditioned medium dikoleksi pada tiga hari kemudian dan disimpan dalam temperatur -20o C. Setelah dianalisis, CM yang diperoleh dari perlakuan hCG+ITS ditetapkan untuk digunakan sebagai medium kultur stem cell mesenkimal sumsum tulang tikus. Masing-masing sebanyak 1x 106 sel/ml stem cell mesenkimal sumsum tulang dikultur di dalam medium: 1) DMEM+ NBCS 10% sebagai kontrol ; 2) dengan testosteron 10 ng/ml; 3) dengan CM sel Leydig 50% ; 4) dengan CM sel Leydig 50% dan hCG 2.5 IU/ml. Hasil penelitian menunjukkan bahwa penambahan hCG+ITS pada CM sel Leydig meningkatkan konsentrasi testosteron (0,71 ng/ml) dibandingkan dengan perlakuan lainnya. Perlakuan yang sama juga meningkatkan konsentrasi protein (985,29µg/ml) yang terdapat di dalam CM dibandingkan dengan perlakuan lainnya (p<0,05). Pita protein yang dihasilkan mempunyai berat molekul (BM) mendekati 29 kDA, 62-70 kDa dan 95-130 kDa. Stem cell mesenkimal sumsum tulang yang dikultur dengan CM sel Leydig bereaksi positif terhadap pewarnaan spesifik 3β-HSD menghasilkan sel Leydig (53,2%), testosteron (0,93 ng/ml) dan protein (1251,94 μg/ml). Penambahan hCG ke dalam CM sel Leydig mampu meningkatkan konsentrasi testosteron (10,22 ng/ml) (p<0,05) dibandingkan dengan tanpa hCG. Dapat disimpulkan bahwa CM sel Leydig mampu mengarahkan stem cell mesenkimal sumsum tulang menjadi sel Leydig. Penambahan hCG ke dalam CM sel Leydig yang digunakan sebagai medium kultur stem cell mesenkimal sumsum tulang meningkatkan perolehan sel Leydig dan testosteron yang disekresikan.
ABSTRACT
Bone marrow mesenchymal stem cells theraphy have been carried out on degenerative diseases. Conditioned medium (CM) from several types of cultured cells contain of bioactive materials secreted in vitro. In this study were used Leydig cells conditioned medium to evaluate the ability differentiation of bone marrow mesenchymal stem cells. Conditioned medium was collected from culture of 1x 106 cells/ml with 4 treatments, respectively: 1) DMEM supplemented with 10 % NBCS (M) as control ; 2) M supplemented with 2.5 IU/ml hCG ; 3) M supplemented with 5 µg/ml insulin, 10 µg/ml transferrin, 5 mg/ml Selenium (ITS) and 4) M supplemented with the combination of hCG and ITS. Each culture medium treatment was replaced after 3 days using DMEM without serum. Conditioned medium were collected 3 days later and analyzed for testosterone and protein concentration. The best result of treatment above was used for culture medium of bone marrow mesenchymal stem cells. The 1x 106 cells/ml bone marrow mesenchymal