PENCEGAHAN REBAH DAN BUSUK KECAMBAH
(
Colletotrichum
gloeosporioides
(Penz.) Sacc.) PADA PEPAYA
CALINA OLEH BEBERAPA AGENS BIOKONTROL
DERRY AULIA BARUS
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Pencegahan rebah dan busuk kecambah (Colletotrichum gloeosporioides (Penz.) Sacc.) pada pepaya calina oleh beberapa agens biokontrol adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2013
Derry Aulia Barus
ABSTRAK
DERRY AULIA BARUS. Pencegahan Rebah dan Busuk Kecambah (Colletotrichum gloeosporioides (Penz.) Sacc.) Pada Pepaya Calina Oleh Beberapa Agens Biokontrol. Dibimbing oleh MEITY SURADJI SINAGA.
Pepaya Calina (IPB-9) merupakan salah satu varietas pepaya unggul yang dihasilkan oleh IPB. Varietas IPB-9 termasuk rentan terhadap penyebab antraknosa. Antraknosa yang disebabkan oleh Colletotrichum gloeosporioides
merupakan penyakit penting pada buah pepaya yang mengakibatkan penurunan kualitas buah pada saat masa penyimpanan. Selain itu, penyebab antraknosa juga dapat menyebabkan rebah dan busuk kecambah pada pembibitan. Oleh karena itu, dilakukan suatu studi yang bertujuan untuk mengevaluasi keefektifan lima agens biokontrol (Trichoderma harzianum (TH17), Gliocladium fimbriatum (G84),
Bacillus subtilis (B12) and Actinomycetes (APS5 and APS12)) dalam mengurangi rebah atau busuk kecambah yang disebabkan oleh Colletotrichum gleosporioides
pada pepaya varietas calina (IPB-9). Studi dilakukan dalam pengujian in vitro
dengan metode uji ganda dan umpan beracun serta in vivo dengan metode aplikasi penyiraman suspensi agens biokontrol pada media tanah. Hasil uji in vitro
menunjukkan bahwa TH17 dan G84 paling efektif untuk menekan pertumbuhan
C. gloeosporioides dengan tingkat penghambatan sebesar 100% pada taraf nyata (α) 5%. Hasil uji in vivo menunjukkan bahwa penggunaan suspensi B12 dan G84 paling efektif untuk menekan kejadian penyakit rebah dan busuk kecambah sebesar 66.67% pada taraf nyata (α) 5%.
Kata kunci: Penyakit kecambah, agens biokontrol, penyakit antraknosa, persemaian pepaya calina
ABSTRACT
DERRY AULIA BARUS. Preventiveness Damping Off and Seedling Rot (Colletotrichum gloeosporioides (Penz.) Sacc.) Of Calina Papaya Using Several Biocontrol Agents. Supervised by MEITY SURADJI SINAGA.
Calina (IPB-9) is one of the superior varieties of papaya that have been released by IPB. This variety is susceptible to the causal agent of anthracnose. Anthracnose caused by Colletotrichum gloeosporioides is an impotant disease of papaya that reduce the quality of papaya in the storage. However, this patogen also caused damping-off and seedling rot at nursery. Therefore, this study purposed to evaluate the effectiveness of five biocontrol agents (Trichoderma harzianum (TH17), Gliocladium fimbriatum (G84), Bacillus subtilis (B12) and Actinomycetes (APS5 and APS12)) to reduce damping-off or seedling rot caused by Colletotrichum gloeosporioides on Calina (IPB-9). This study using in vitro suppressing incidental disease of damping off with relative resistance level 66.67% on α = 5%.
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Proteksi Tanaman
PENCEGAHAN REBAH DAN BUSUK KECAMBAH
(
Colletotrichum
gloeosporioides
(Penz.) Sacc.) PADA PEPAYA
CALINA OLEH BEBERAPA AGENS BIOKONTROL
DERRY AULIA BARUS
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Judul Usulan : Pencegahan Rebah dan Busuk Kecambah (Colletotrichum gloeosporioides (Penz.) Sacc.) Pada Pepaya Calina Oleh Beberapa Agens Biokontrol
Nama Mahasiswa : Derry Aulia Barus
NIM : A34090015
Disetujui oleh
Prof. Dr. Ir. Meity Suradji Sinaga MSc. Dosen Pembimbing
Diketahui oleh,
Dr. Ir. Abdjad Asih Nawangsih MSc. Ketua Departemen
PRAKATA
Segala puji bagi Allah SWT yang atas kuasa dan kehendak-Nya penulis dapat menyelesaikan skripsi yang berjudul Pencegahan Rebah dan Busuk Kecambah pada Pepaya Calina (Colletotrichum gloeosporioides (Penz.) Sacc.) oleh Beberapa Agens Biokontrol, sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian ini dilaksanakan di laboratorium Mikologi, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor dari bulan Maret 2013 sampai Agustus 2013. Penulis menyampaikan terima kasih kepada orang tua dan keluarga penulis yang senantiasa memberikan perhatian, dorongan semangat dan kasih sayang selama penulis belajar, Dr. Ir. Tri Asmira Damayanti MAgr. selaku dosen pembimbing akademik atas bimbingan, ajaran dan didikannya selama ini, Prof. Dr. Ir. Meity Suradji Sinaga, MSc. selaku dosen pembimbing skripsi atas perhatian, bantuan, arahan dan bimbingan kepada penulis dalam penulisan skripsi ini, Dr. Ir. Idham Sakti Harahap MSi. selaku dosen penguji tamu atas perhatian, bantuan, arahan, saran dan kritiknya terhadap penulisan skripsi ini dan semua pihak yang telah memberikan semangat dan dukungannya sehingga penulis dapat menyelesaikan penelitian ini dengan baik. Semoga Allah SWT senantiasa membalas segala amal ibadah dan kebaikan kepadanya. Semoga hasil penelitian ini dapat bermanfaat meskipun dalam penulisan skripsi ini masih terdapat kekurangan. Oleh karena itu, penulis mengharapkan kritik dan saran yang bersifat membangun untuk perbaikan skripsi ini.
Bogor, April 2013
DAFTAR ISI
DAFTAR TABEL viii
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN ix
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 3
Manfaat Penelitian 3
BAHAN DAN METODE 4
Tempat dan Waktu Penelitian 4
Isolasi Patogen dari Bahan Tanaman Sakit 4
Peremajaan Agens Antagonis 4
Uji Antagonisme Secara in vitro 4
Uji Antagonisme Secara in vivo 6
Rancangan Percobaan dan Analisis Data 6
HASIL DAN PEMBAHASAN 7
Isolasi Cendawan Patogen 7
Uji Antagonisme secara In Vitro 8
Uji Antagonisme secara In Vivo 10
SIMPULAN DAN SARAN 14
Kesimpulan 14
Saran 14
DAFTAR PUSTAKA 15
DAFTAR TABEL
1. Persentase penghambatan pertumbuhan C. gloeosporioides oleh
agens biokontrol pada media PDA 8
2. Persentase penghambatan rebah kecambah pada bibit pepaya umur 21 hari setelah tanam (HST) setelah diberi perlakuan agens
biokontrol 11
3. Rata-rata tinggi tajuk bibit pepaya umur 21 hari setelah tanam (HST)
setelah diberi perlakuan agens biokontrol 12
DAFTAR GAMBAR
1. Gejala busuk antraknosa berwarna kecoklatan dengan pola
konsentris pada buah pepaya IPB-9. 7
2. Morfologi cendawan C. gloeosporioides dibawah mikroskop dengan perbesaran 400x, hifa yang berwarna hialin dan konidia
C. gloeosporioides yang berbentuk seperti basil (b), seta
C. gloeosporioides yang berwarna kehitaman (c). 7 3. Uji antagonisme dengan metode peracunan media, APS12 (a) dan
APS5 (b) tidak mampu menekan pertumbuhan C. gloeosporioides
(p), koloni TH 17 (c) dan G84 (d) yang menutupi koloni
C. gloeosporioides (p) serta koloni C. gloeosporioides (p) yang tidak
melewati koloni B12 (e). 9
4. Gejala yang muncul pada perkecambahan pepaya setelah
diinokulasikan C. gloeosporioides, daun seperti terbakar (a dan b), terdapat bercak kehitaman pada akar (c) dan bercak seperti terbakar
pada batang (d dan e). 10
5. Morfologi cendawan hasil reisolasi dari tanaman yang bergejala
pada umur 21 hari setelah tanam (HST) pada perbesaran 400x. 11 6. Keadaan vigor bibit pepaya yang diinokulasikan C. gloeosporioides
pada umur 21 hari setelah tanam (HST) dengan perlakuan (a) TH17, (b) APS5, (c) APS12, (d) G84 dan (e) B12 yang tidak menunjukkan
DAFTAR LAMPIRAN
1. Isolat agens biokontrol umur 7 HSI 19
2. Diameter pertumbuhan koloni C. gloeosporioides pada perlakuan
suspensi dan metabolit aktinomiset 19
3. Diameter pertumbuhan koloni patogen C. gloeosporioides pada
kontrol 20
4. Jari-jari pertumbuhan koloni patogen C. gloeosporioides dengan
metode uji ganda pada media PDA 20
5. Kejadian penyakit pada bibit pepaya berumur 21 HST dengan
PENDAHULUAN
Latar Belakang
Pepaya merupakan tanaman buah berupa herba dari famili Caricaceae yang berasal dari Amerika Tengah dan Hindia Barat bahkan kawasan sekitar Meksiko dan Kosta Rika (PKBT 2010). Jenis-jenis pepaya yang banyak dibudidayakan di Indonesia di antaranya adalah pepaya jingga, pepaya semangka paris, pepaya dampit, pepaya cibinong, pepaya mini (pepaya hawai, pepaya solo atau pepaya sun rise) dan pepaya California (Kementan 2011). Indonesia adalah produsen pepaya terbesar kelima dunia setelah Brazil, Nigeria, India dan Mexico (Budiyanti dan Sunyoto 2011). Produksi pepaya pada tahun 2011 mencapai 958 ribu ton (BPS 2011). Sentra pertanaman buah pepaya di Indonesia adalah daerah Jawa Barat (Kabupaten Sukabumi), Jawa Timur (Kabupaten Malang), Pasar Induk Kramat Jati DKI Jakarta, Yogyakarta (Sleman), Lampung Tengah, Sulawesi Selatan (Toraja) dan Sulawesi Utara (Manado) (Kemenristek 2010).
Salah satu varietas pepaya unggul Indonesia yaitu genotype IPB 9 (Calina) sudah terdaftar dalam SK Pelepasan No. 2 108/Kpts/SR.120/5/2010. Genotipe IPB 9 memiliki beberapa keunggulan diantaranya bentuk buah silindris seperti peluru, warna kulit buah hijau terang dan mulus, rasa buah manis, warna daging buah jingga kemerahan, daging buah tebal dan renyah, daya simpan lama (lebih dari satu minggu), bobot buah 974.2-1 355 g, dan mempunyai tebal daging buah lebih besar dari genotipe IPB 1 dan IPB 3 serta memiliki nilai kekerasan daging buah pada bagian tengah lebih baik dari IPB 1 (Sobir 2009; Suketi et al. 2010). Umumnya pepaya termasuk tanaman yang rentan terhadap berbagai penyakit seperti antraknosa, bercak buah Alternaria, busuk kering, busuk Fusarium, bercak
Guignardia, busuk ujung tangkai buah, busuk buah Phytophthora, busuk
Rhizopus, busuk Stemphylium, busuk buah basah dan busuk buah cat ungu (Martoredjo 2009).
Genotipe IPB-9 termasuk pepaya yang rentan terhadap antraknosa yang disebabkan oleh Colletotrichum gloeosporioides (Penz.) Sacc. Gejala antraknosa nampak sebagai bercak bulat basah, bercak agak mengendap pada buah yang mengalami proses pematangan, bercak dapat meluas hingga berdiameter 5 cm dan di bagian tengah bercak terdapat massa konidia berwarna jingga keunguan serta membentuk lingkaran sepusat (Martoredjo 2009). Patogen ini banyak menyerang buah-buahan, selain menyerang buah, patogen tersebut dapat menyerang daun, bunga, ranting dan bibit di persemaian (Kalie 2000). Pada persemaian penyakit ini dapat menyebabkan rebah dan busuk kecambah, bercak atau busuk akar serta busuk benih. Pada tanaman dewasa dapat menyebabkan mati pucuk (dieback) dan diikuti infeksi lanjut pada buah (Hakim 2010).
2
(2008) menyebutkan bahwa tingkat kerusakan buah pepaya akibat serangan antraknosa pada masa penyimpanan ini mencapai 80 %.
Upaya pengendalian penyakit antraknosa telah banyak dilakukan meliputi penyemprotan fungisida dengan interval 14-28 hari, menanam kultivar tahan, perendaman dengan air panas dan penyemprotan buah dengan fungisida pascapanen (Kalie 2000; Martoredjo 2009), namun, upaya pengendalian tersebut masih belum berhasil dengan baik, sedangkan dampak negatif penggunaan fungisida sintetik terhadap lingkungan hidup termasuk manusia secara langsung sangat besar.
Agens hayati/biokontrol merupakan mikroorganisme, baik yang terjadi secara alami seperti bakteri, cendawan, virus dan protozoa, maupun hasil rekayasa genetik (genetically modified microorganisms) yang digunakan untuk mengendalikan organisme pengganggu tumbuhan (OPT) (FAO 1988).
Trichoderma spp dan Gliocladium spp merupakan cendawan yang paling banyak dikembangkan sebagai agens biokontrol. Kedua cendawan ini bersifat saprofitik dalam tanah, mampu menghambat pertumbuhan patogen dengan hiperparasitik, kompetisi dalam menyerap nutrisi, modifikasi rhizosfer, antibiosis, biofertilisator dan stimulus ketahanan tanaman (Sinaga et al. 1992; Benitez et al.
2004). Hasil penelitian Hartal (2010) menunjukkan bahwa Trichoderma sp. dan
Gliocladium pada aplikasi tunggal mampu menekan pertumbuhan Fusarium oxysporum sebesar 56.4% dan 55.9% bahkan pada aplikasi kombinasi (Trichoderma+Gliocladium) persentase penghambatan meningkat menjadi 70.1%. Dua jenis mikroba golongan bakteri yang paling banyak dikembangkan sebagai pestidida hayati adalah Pseudomonas fluorescens dan Bacillus sp. Keunikan dari kedua bakteri tersebut adalah bersifat saprofitik (mampu bertahan dan berkembang biak pada sisa-sisa limbah organik), menghasilkan sifat antagonisme yang dapat membunuh mikroba patogen tumbuhan, mengkelat ion Fe, melarutkan fosfat serta kalium Kedua jenis bakteri tersebut juga mampu menghasilkan senyawa pemicu pertumbuhan tanaman seperti indole acetic acid
(IAA), giberellin, ditambah dengan sifat kitinolitik (mendegradasi kitin) yang mampu meningkatkan performan bakteri tersebut sebagai agens hayati (Giyanto et al. 2009).
Aktinomiset adalah kelompok besar dari bakteri berfilamen, umumnya bersifat gram positif dan membentuk filament yang bercabang. Pertumbuhan aktinomiset yang sukses mampu menghasilkan jaringan berfilamen yang memiliki cabang-cabang yang rumit, disebut juga miselium. Aktinomiset menghasilkan struktur bertahan berupa eksospora yang dapat bertahan dalam kondisi tidak menguntungkan seperti rendahnya kadar air dan suhu tinggi serta dapat bertahan dalam waktu yang lama (Putra 2011). Hasil penelitian Sitompul (2013) menyebutkan bahwa Aktinomiset (APS5 dan APS12) dapat menekan pertumbuhan Marasmius palmivorus sebesar 100% dengan metode umpan beracun.
3
Oleh karena itu, studi ini diharapkan mampu menambah informasi mengenai kegunaan beberapa agens biokontrol dan mengurangi ketergantungan petani dalam menggunakan pestisida sintetik.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengevaluasi keefektifan agens biokontrol dalam mengurangi rebah kecambah yang disebabkan oleh Colletotrichum gloeosporioides pada pepaya varietas calina (IPB-9).
Manfaat Penelitian
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Percobaan ini dilaksanakan di Laboratorium Mikologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor dari Maret sampai Agustus 2013.
Isolasi Patogen dari Bahan Tanaman Sakit
Sampel buah yang menunjukkan gejala terserang patogen C. gloeosporioides yang diperoleh dari pedagang buah di sekitar Dramaga. Sterilisasi permukaan dilakukan dengan mencuci buah yang terinfeksi, kemudian didisinfeksi menggunakan larutan natrium hipoklorit (NaOCl) 1% selama satu menit, setelah itu direndam pada alkohol 70% selama satu menit, kemudian dibilas menggunakan air steril sebanyak tiga kali pembilasan, lalu dikering anginkan. Isolasi patogen dilakukan dengan memotong diantara bagian buah yang bergejala dan buah yang sehat sepanjang 0.5 cm, kemudian ditanam pada media digunakan dalam penelitian ini diperoleh dari stok kultur koleksi Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman IPB. Isolat aktinomiset APS5 dan APS12 berasal dari tanah bagian top soil sekitar perakaran sawit (Putra 2011). Peremajaan isolat agens biokontrol bakteri B12 digores pada media PDA dan NA masing-masing sebanyak satu lup kemudian diinkubasi pada suhu ruang. Perbanyakan isolat murni aktinomiset dilakukan dengan menggoreskan sebanyak satu lup yang mengandung isolat pada media YCED dan diinkubasi pada suhu ruang. Pertumbuhan isolat berhasil apabila terdapat koloni aktinomiset yang tumbuh dan mengeluarkan spora seperti berdebu (merupakan eksospora yang terbentuk, mengandung pigmen tertentu dan berbau khas tanah (Sitompul 2013).
Isolat Trichoderma harzianum (TH17) dan Gliocladium fimbriatum (G84) yang digunakan dalam penelitian ini berasal dari stok koleksi Laboratorium Mikologi Tumbuhan, Departemen Proteksi Tanaman IPB. Peremajaan kedua isolat ini dilakukan dengan menumbuhkan pada media PDA yang telah diberi
chloramphenicol dan media jagung yang ditambahkan zeolit (dengan perbandingan berat 3:7) lalu diinkubasi pada suhu ruang.
Uji Antagonisme Secara in vitro
Penghambatan pertumbuhan C. gloeosporioides dilakukan dengan metode uji ganda dan metode peracunan media. Uji antagonisme dengan metode uji ganda menggunakan agens biokontrol TH17, G84, B12, suspensi APS5, suspensi APS12, metabolit APS5 dan metabolit APS12. Koloni C. gloeosporioides
5
Diameter masing-masing agens biokontrol (TH17 dan G84) dan patogen sebesar 0.5 cm, sedangkan B12 diinokulasikan dengan cara penggoresan, tiap pengujian dilakukan tiga kali ulangan.
Pengaruh penghambatan agens antagonis terhadap pertumbuhan patogen menggunakan rumus persentase menurut Skidmore and Dickinson (1976):
=
Keterangan :
R1 : Jari-jari koloni patogen yang menjauhi koloni biokontrol R2 : Jari-jari koloni patogen yang mendekati koloni biokontrol PPh : Persentase penghambatan pertumbuhan
Penghambatan pertumbuhan koloni patogen oleh agens biokontrol aktinomiset menggunakan metode peracunan media. Masing-masing aktinomiset (APS5 dan APS12) yang berumur 7 hari diinokulasikan ke dalam 10 ml media cair LB sebanyak satu ose dan diinkubasi pada inkubator bergoyang dengan kecepatan 100 rpm selama 4 hari. Media cair LB yang mengandung biakan aktinomiset dimasukkan ke dalam tabung ependorff masing-masing sebanyak 1 ml, lalu disentrifugasi dengan kecepatan 12000 rpm selama 15 menit hingga didapatkan supernatan yang mengandung senyawa bioaktif aktinomiset. Supernatan disaring dengan millipore ukuran 0.22 µm untuk memperoleh senyawa bioaktif yang steril. Senyawa metabolit dan suspensi cair aktinomiset sebanyak 1 ml tersebut dicampurkan ke dalam 9 ml media PDA yang telah dicairkan dengan suhu kurang lebih 35˚C, kemudian dimasukkan kedalam cawan petri. Koloni C. gloeosporioides yang berumur 7 hari diinokulasikan pada titik pusat cawan petri dengan diameter 0.5 cm, kemudian diinkubasi pada suhu ruang. Pengamatan dilakukan terhadap pertumbuhan miselium pada setiap perlakuan dengan menghitung persentase penghambatan C.gloeosporioides dengan persamaan:
a a am a = k k
Keterangan :
6
Uji Antagonisme Secara in vivo
Pengujian antagonisme ini dilakukan pada perkecambahan pepaya. Uji antagonisme ini menggunakan media tanah steril yang ditempatkan pada polibag dengan tinggi 10 cm, lebar 4 cm. Setiap tanah akan diinokulasikan T. harzianum
(TH17), G. frimbriatum (G84), B. subtilis (B12), APS5 dan APS12, dengan enam ulangan.
Isolat TH17 dan G84 pada media jagung dilarutkan sebanyak 5 gram dengan 100 ml air steril. Isolat B12, APS5 dan APS12 pada media cair dilarutkan sebanyak 5 ml dengan 95 ml air steril. Setiap polibag hanya diberikan satu jenis agens biokontrol, suspensi tersebut disiram sebanyak 10 ml untuk setiap polibagnya.
Setelah itu, benih pepaya varietas calina (IPB-9) yang telah direndam selama semalam, ditanam sebanyak 1 biji pepaya setiap polibagnya. Metode pemberian patogen dilakukan dengan metode penyiraman. Pemberian patogen C. gloeosporioides dilakukan semalam setelah ditanam dan disiram dengan suspensi isolat agens biokontrol. Peubah yang diamati ialah kejadian penyakit dan vigor tanaman. Pengamatan dilakukan setelah 1 minggu setelah tanam hingga 3 minggu setelah tanam. Persentase kejadian penyakit dihitung dengan persamaan :
e adian en aki = n
n : Jumlah tanaman yang bergejala N : Jumlah tanaman dalam perlakuan
Rancangan Percobaan dan Analisis Data
a
HASIL DAN PEMBAHASAN
Isolasi Cendawan Patogen
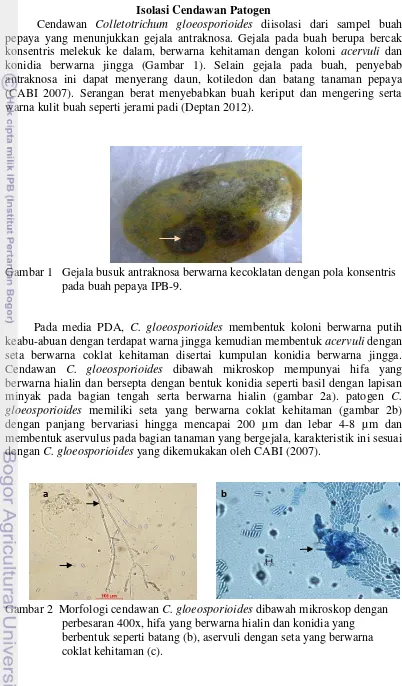
Cendawan Colletotrichum gloeosporioides diisolasi dari sampel buah pepaya yang menunjukkan gejala antraknosa. Gejala pada buah berupa bercak konsentris melekuk ke dalam, berwarna kehitaman dengan koloni acervuli dan konidia berwarna jingga (Gambar 1). Selain gejala pada buah, penyebab antraknosa ini dapat menyerang daun, kotiledon dan batang tanaman pepaya (CABI 2007). Serangan berat menyebabkan buah keriput dan mengering serta warna kulit buah seperti jerami padi (Deptan 2012).
Gambar 1 Gejala busuk antraknosa berwarna kecoklatan dengan pola konsentris pada buah pepaya IPB-9.
Pada media PDA, C. gloeosporioides membentuk koloni berwarna putih keabu-abuan dengan terdapat warna jingga kemudian membentuk acervuli dengan seta berwarna coklat kehitaman disertai kumpulan konidia berwarna jingga. Cendawan C. gloeosporioides dibawah mikroskop mempunyai hifa yang berwarna hialin dan bersepta dengan bentuk konidia seperti basil dengan lapisan minyak pada bagian tengah serta berwarna hialin (gambar 2a). patogen C. gloeosporioides memiliki seta yang berwarna coklat kehitaman (gambar 2b) dengan panjang bervariasi hingga mencapai 200 µm dan lebar 4-8 µm dan membentuk aservulus pada bagian tanaman yang bergejala, karakteristik ini sesuai dengan C. gloeosporioides yang dikemukakan oleh CABI (2007).
b
8
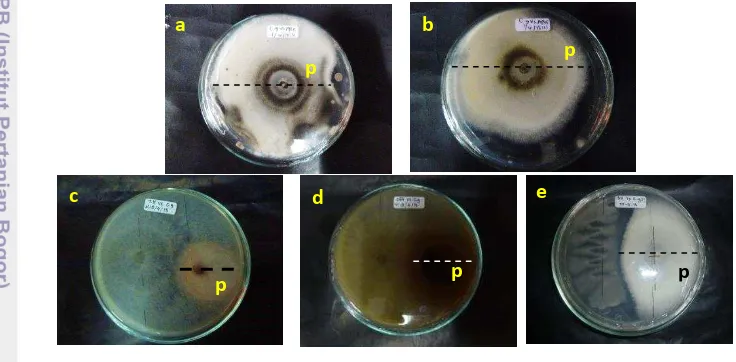
Uji Antagonisme secara In Vitro
Hasil uji in vitro menunjukkan kemampuan penghambatan pertumbuhan koloni C. gloeosporioides yang berbeda oleh masing-masing agens biokontrol. pada hari pertama uji in vitro, pada beberapa perlakuan agens biokontrol belum terlihat adanya proses penghambatan bahkan koloni patogen ternyata lebih cepat tumbuh dibandingkan agens biokontrolnya. Hal ini dimungkinkan karena setiap individu yang baru diinokulasikan pada media buatan akan langsung menyerap nutrisi dan memanfaatkan ruang kosong untuk perkembangannya tanpa ada persaingan atau penghambatan (Smith dan Onions 1994).
Pada pengujian secara in vitro 7 hsi (hari setelah inokulasi) nampak terdapat empat agens biokontrol yaitu TH17, G84, suspensi APS5 dan suspensi APS12 yang berpotensi menghambat pertumbuhan penyebab antraknosa pada pepaya. Keempat agens biokontrol tersebut menunjukkan persen penghambatan yang cukup tinggi untuk menghambat patogen tersebut (Tabel 1). Agens biokontrol yang paling efektif dalam menghambat pertumbuhan penyebab antraknosa pada pepaya ialah TH17 dan G84 dengan persentase penghambatan mencapai 100%.
Tabel 1 Persentase penghambatan pertumbuhan C. gloeosporioides oleh agens biokontrol pada media PDA
Suspensi Aktinomiset (APS5 dan APS12) mampu menekan pertumbuhan patogen sebesar 45.36% dan 59.60% (Tabel 1). Penghambatan dapat terjadi karena secara umum aktinomiset tergolong dalam bakteri gram positif yang memiliki perkembangan yang cepat dan dapat menghasilkan antibiotik seperti azole, terbinafine, amphotricine dan polyene-Nystatin yang mampu merusak dinding sel cendawan (Zaki 2008; Madigan et al. 2009). Menurut Himmah (2012) aktinomiset dengan kode isolat (APS5 dan APS12) memiliki kesamaan dengan aktinomiset dengan genus Streptomyces dengan tingkat kesamaan mencapai 99%.
Penghambatan terhadap pertumbuhan diameter koloni C. gloeosporioides
oleh TH17 dan G84 dilakukan melalui mekanisme penghambatan hiperparasitisme, antibiosis (toksin), lisis dan kompetisi ruang serta nutrisi.
9
c
Diketahui bahwa genus Gliocladium dapat memproduksi toksin seperti gliotoxin, gliovirin dan epidethiodiketopiperszine (Wilhite dan Straney 1996). kedua cendawan agens biokontrol mampu menutupi pertumbuhan koloni patogen mulai hari ke-4, koloni TH17 dan G84 sudah dapat tumbuh diatas koloni patogen.
Isolat agens B. subtilis (B12) dengan penggoresan pada media mampu menekan pertumbuhan koloni patogen sebesar 28.67% (Tabel 1). Mekanisme antagonisme yang dilakukan oleh B. subtilis ialah dengan antibiosis senyawa antibiotik. Menurut Awais et al. (2010) B. subtilis dapat menghasilkan senyawa toksik seperti polymyxin, difficidin, subtilin, mycobacilin dan bacitracin.
Persentase penghambatan dari berbagai agens biokontrol ini dipengaruhi oleh banyak faktor seperti kemampuan tumbuh, kecepatan tumbuh, umur dari agens biokontrol tersebut, kemampuan bertahan dari patogen dan mekanisme penghambatan yang berbeda untuk setiap agens biokontrolnya serta seberapa besar kemampuan agens biokontrol dalam menghasilkan senyawa antibiotik.
Hasil yang berbeda ditunjukkan pada metabolit aktinomiset (APS5 dan APS12) dimana terlihat dalam Tabel 1 bahwa hingga hari kelima agens biokontrol tersebut tidak mampu menghambat pertumbuhan dari koloni C. gloeosporioides
(gambar 3a dan 3b), hal ini kontradiksi dengan hasil penelitian yang dilakukan oleh Sitompul (2013) yang menyebutkan bahwa peracunan media dengan menggunakan metabolit aktinomiset tersebut mampu menekan pertumbuhan
Marasmius palmivorus. Hal tersebut dapat terjadi karena pada media agar kemampuan aktinomiset dalam memproduksi antibiotik sangat lambat, proliferasi yang lambat dan produksi antibiotiknya dipengaruhi oleh media tumbuh dapat menjadi kendala penggunaan aktinomiset sebagai agens biokontrol (Sariyanto 2006).
a b
d e
Gambar 3 Uji antagonisme dengan metode peracunan media, metabolit APS12 (a) dan metabolit APS5 (b) tidak mampu menekan pertumbuhan C. gloeosporioides (p), koloni TH 17 (c) dan G84 (d) yang tumbuh menutupi koloni patogen(p), koloni B12 mampu menghambat koloni patogen (e).
p p p
10
a
e
d
c
b
Penggunaan suspensi aktinomiset (APS5 dan APS12) lebih mampu menekan pertumbuhan cendawan C. gloeosporioides pada pengujian secara in vitro (Tabel 1), sehingga pada uji in vivo, perlakuan aktinomiset menggunakan suspensi APS5 dan APS12.
Uji Antagonisme secara In Vivo
Hasil pengujian in vivo dengan inokulasi patogen dan aplikasi agens antagonis nampak gejala antraknosa yang terjadi berbeda-beda (Gambar 4). Pada daun dan batang bibit pepaya bisa terjadi bercak seperti terbakar, sedangkan gejala pada akar berupa bercak coklat kehitaman. Antraknosa merupakan salah satu penyakit penting pada pascapanen, namun menurut PKHT (2012) ternyata penyebab antraknosa juga dapat menimbulkan masalah pada masa pembibitan, gejala yang muncul pada masa pembibitan ialah mati pucuk (dieback), bercak nekrosis pada daun dan batang serta rebah kecambah atau busuk benih.
Dari kecambah yang tumbuh dan bergejala seperti pada Gambar 4, selanjutnya dilakukan reisolasi guna membuktikan bahwa gejala tersebut disebabkan oleh C. gloeosporioides atau oleh patogen lain. Hasil reisolasi (Gambar 6) terlihat adanya konidia C. gloeosporioides dengan bentuk seperti batang dengan terdapat minyak pada bagian tengah.
Gambar 4 Gejala yang muncul pada perkecambahan pepaya setelah
11
Hasil pengujian in vivo menunjukkan bahwa antar perlakuan penambahan agens biokontrol menunjukkan persentase hasil yang berbeda-beda antar perlakuan agens biokontrol (Tabel 2). Hasil uji dengan inokulasi patogen, nampak ada bibit pepaya yang menunjukkan terserang patogen dan menampakkan gejala antraknosa sebesar 50%.
Tabel 2 Persentase penghambatan rebah kecambah pada bibit pepaya umur 21 hari setelah tanam (HST) setelah diberi perlakuan agens biokontrol
Perlakuan Persentase penghambatan pada umur kecambah 21 HST (%) a
Patogen Non patogen
K 0.00 100.00
TH17 50.00 100.00
G84 66.67 66.67
B12 66.67 100.00
APS12 16.67 66.67
APS5 50.00 100.00
a
Angka-angka pada kolom yang sama berdasarkan uji proporsi pada taraf nyata 5%.
Gambar 5 Konidia cendawan penyebab antraknosa hasil reisolasi dari tanaman yang bergejala pada umur 21 hari setelah tanam (HST) pada
12
a b c
d e
Tabel 3 Rata-rata tinggi tajuk bibit pepaya umur 21 hari setelah tanam (HST) setelah diberi perlakuan agens biokontrol
Perlakuan Rata-rata tinggi tajuk pada umur kecambah 21 HST (cm) a
Patogen Non patogen
K 8.63ab 8.70ab
TH17 7.75b 8.35b
G84 9.07a 9.02a
B12 9.12a 9.02a
APS12 9.07a 9.15a
APS5 9.35a 9.20a
Pada pengujian in vivo, agens biokontrol yang mampu menekan kejadian penyakit dengan baik ialah G84 dan B12 sebesar 66.67% (Tabel 2), berdasarkan Tabel 2, dapat dikatakan semua agens biokontrol tersebut memiliki potensi untuk dapat mengurangi kerusakan akibat penyakit antraknosa. Hal ini didukung bahwa keempat agens biokontrol (G84, B12, APS5 dan APS12) berpotensi memicu pertumbuhan bibit pepaya (Tabel 3) dengan vigor tanaman yang baik (Gambar 6). Tinggi tajuk yang rendah terdapat pada perlakuan TH17 meskipun demikian TH17 diduga memiliki mekanisme pemicu pertahanan dan penguat jaringan tanaman (Benitez et al. 2004).
Gambar 6 Keadaan vigor bibit pepaya yang diinokulasikan C. gloeosporioides pada umur 21 hari setelah tanam (HST) dengan perlakuan (a) TH17, (b) APS5, (c) APS12, (d) G84 dan (e) B12 yang tidak menunjukkan adanya gejala antraknosa.
a
13
Pada perlakuan tanpa inokulasi patogen, nampak ada bibit pepaya yang menunjukkan gejala antraknosa sebesar 13.33%. Hal ini dapat terjadi karena penyebab antraknosa dapat terbawa benih dan infeksinya bersifat laten dan sistemik (Sinaga et al. 1992). Hasil perlakuan agens biokontrol (TH17, G84, B12, APS5 dan APS12) tanpa inokulasi patogen menunjukkan bahwa kelima agens tersebut tidak bersifat fitotoksik. Pada pengamatan bibit pepaya pada 21 HST dengan perlakuan agens biokontrol tanpa inokulasi patogen walaupun ada yang bergejala antraknosa bibit tetap dapat tumbuh dengan baik.
Mekanisme antagonisme yang dilakukan oleh TH17 dan G84 ialah dengan hiperparasitisme, lisis dan antibiosis (Syatrawati 2008). Trichoderma harzianum
SIMPULAN DAN SARAN
Kesimpulan
Evaluasi antagonisme pada uji secara in vitro pada media PDA menunjukkan bahwa Trichoderma harzianum (TH17), Gliocladium fimbriatum
(G84), suspensi aktinomiset (APS5) dan (APS12) yang berpotensi menghambat pertumbuhan koloni C. gloeosporioides dengan persentase penghambatan sebesar 100% (G84 dan TH17), 45.36% (suspensi APS5) dan 59,60% (suspensi APS12). Pada pembibitan pepaya diketahui bahwa agens biokontrol yang cukup berpotensi dalam mengendalikan antraknosa ialah TH17, APS5, G84 dan B12 dengan persen penghambatan yaitu sebesar 50% (TH17 dan APS5) dan 66.67% (G84 dan B12). Selain itu, diketahui bahwa isolat APS5 dan APS12 berpotensi sebagai pemicu pertumbuhan pada pembibitan pepaya karena memiliki rata-rata tinggi tajuk yang tertinggi yaitu sebesar 9.07-9.35 cm Mekanisme penghambatan perkembangan patogen C. gloeosporioides oleh T. harzianum (TH17) dan G. fimbriatum (G84) pada pembibitan pepaya diduga melalui mekanisme hiperparasitik, antibiosis dan persaingan nutrisi dan tempat tumbuh. Mekanisme penghambatan perkembangan patogen tersebut oleh B. subtilis (B12) dan aktinomiset diduga dengan antibiosis dan hormon pertumbuhan.
Saran
DAFTAR PUSTAKA
Awais M, Perves A, Yaqub A, Shah MM. 2010. Production of antimicrobial metabolits by Bacillus subtilis immobilized in polyacrylamide gel. J Zool. 42(3):267-275.
[BPS] Badan Pusat Statistik. 2011. Produksi buah-buahan menurut provinsi [Internet]. Jakarta (ID): Badan Pusat Statistik Republik Indonesia; [diunduh 2013 April 6]. Tersedia pada: http://www.bps.go.id/tab_sub/view.php?tabel =1&daftar=1&id_sub yek=55¬ab=2.
Benitez T, Rincon AM, Limon MC, Codon AC. 2004. Biocontrol mechanisms of
Trichoderma strains. Int J Microbiol. 7(4):249-260.
Budiyanti T, Sunyoto. 2011 November 2-8. Varietas unggul buah pepaya merah delima si merah yang manis. Sinar Tani. Agroinovasi:5 (kol. 1-9).
Butt TM, Jackson C, Magan N. 2001. Introduction-fungal biological control agents: progress, problems and potential. Di dalam: Butt TM, Jackson C, Magan N, editor. Fungi as Biocontrol Agents. Wallingford (GB): CABI. hlm 1-8.
[CABI] Central for Agricultural and Bioscience International. 2007. Crop Protection Compendium [CD-ROM]. Wallingford (UK): CAB International. Chrisnawati. 2011. Pengujian formulasi agensia hayati Bacillus sp. dan
Pseudomonasflourescens untuk mengendalikan penyakit layu bakteri Nilam [Internet]. Solok (ID): Universitas Mahaputra Muhammad Yamin; [diunduh 2013 Maret 7]. Tersedia pada: C isnawa i-edi d .
[Deptan] Departemen Pertanian. 2012. Penyakit busuk buah antraknosa [Internet]. Jakarta (ID): Departemen Pertanian RI; [diunduh 2012 Oktober 7]. Tersedia pada: http://ditlin.hortikultura.deptan.go.id/index.php?option=com_content &view=article&id=246&Itemid=350.
[FAO] Food and Agriculture Organization. 1998. Guidelines on the registration of biological pest control agents [Internet]. Rome (IT): Food and Agriculture of United Nations; [diunduh 2012 Oktober 2]. Tersedia pada: http://www.fao.org/ag/AGPP/Pesticid/code/Download/BIOPEST.pdf. Giyanto, Suhendar A, Rustam. 2009. Kajian pembiakan bakteri kitinolitik
Pseudomonas flourescens dan Bacillus sp. pada limbah organik dan formulasinya sebagai pestisida hayati (bio-pesticide). Di dalam: Prosiding Seminar Hasil-hasil Penelitian IPB; 2009 Desember 22-23; Bogor. Bogor (ID): LPPM-IPB. hlm 849-858.
Hakim A. 2010. Evaluasi daya hasil dan ketahanan cabai (Capsicum annuum L.) terhadap antraknosa yang disebabkan oleh Colletotrichum acutatum
[skripsi]. Bogor (ID): Institut Pertanian Bogor.
Hartal, Misnawaty, Budi I. 2010. Efektifitas Trichoderma sp. dan Gliocladium sp. dalam pengendalian layu Fusarium pada tanaman krisan. JIPI. 12(1):7-12. Himmah NIF. 2012. Seleksi dan identifikasi aktinomiset sebagai agens hayati
untuk pengendalian penyakit kresek yang disebabkan oleh Xanthomonas oryzae pv. oryzae pada padi [skripsi]. Bogor (ID): Institut Pertanian Bogor. Kalie MB. 2000. Mengatasi Buah Rontok, Busuk, dan Berulat. Jakarta (ID):
16
[Kementan] Kementerian Pertanian. 2011. Diversifikasi olahan buah pepaya [Internet]. Jakarta (ID): Kementerian Pertanian; [diunduh 2013 April 6]. Tersedia pada: http://cybex.deptan.go.id/penyuluhan/diversifikasi-olahan-buah-pepaya.
[Kemenristek] Kementerian Riset dan Teknologi. 2011. Pepaya (Carica papaya
L.) [Internet]. Jakarta (ID): Kementerian Riset dan Teknologi Republik Indonesia; [diunduh 2010 November 13]. Tersedia pada: http://www.warintek.ristek.go.id/pertanian/pepaya.pdf.
Madigan MT, John MM, Jack P. 2009. Brock Biology of Microorganisms 12th ed. New Jersey (US): Prentice-Hall.
Martoredjo T. 2009. Ilmu Penyakit Pascapanen. Jakarta (ID): Bumi Aksara. Mattjik AA, Sumertajaya M. 2006. Perancangan Percobaan dengan Aplikasi
SAS dan Minitab. Bogor (ID): Institut Pertanian Bogor Press.
Putra MC. 2011. Kompatibilitas Bacillus spp. dan aktinomiset sebagai agens hayati Xanthomonas oryzae pv. oryzae dan pemicu pertumbuhan padi [skripsi]. Bogor (ID): Institut Pertanian Bogor.
[PKBT] Pusat Kajian Buah Tropika. 2010. Sejarah pepaya [Internet]. Bogor (ID): Pusat Kajian Buah Tropika IPB; [diunduh 2013 April 6]. Tersedia pada: http://pkbt.ipb.ac.id/media.php?module=Sejarah%20pepaya&konten=pepay a&db=pepaya&dalam=sejarahpepaya&id=1
[PKHT] Pusat Kajian Hortikulltura Tropika. 2012. Waspada serangan antraknosa [Internet]. Bogor (ID): Pusat Kajian Hortikultura Tropika IPB; [diunduh 2013 April 16]. Tersedia pada: http://pkht.or.id/seputar-dunia-buah/111-waspada-serangan-antraknosa.
Rini P. 2008. Pengaruh sekat dalam kemasan kardus terhadap masa simpan dan mutu pepaya IPB 9 [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Rizwan M. 2011. Survei pengetahuan, sikap dan tindakan petani pepaya terhadap organisme pengganggu tanaman di Kecamatan Rancabungur dan Desa Bojong, Kecamatan Kemang, Kabupaten Bogor [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Sariyanto N. 2006. Eksplorasi agens antagonis yang berpotensi menekan penyakit layu Fusarium pada pisang [skripsi]. Bogor (ID): Institut Pertanian Bogor. Sinaga MS, Widodo, Poernomo BWS, Supramana. 1992. Kemungkinan
pengendalian hayati bagi Colletotrichum capsici (Syd.) Butl. et Bisby penyebab antraknosa pada cabai. Di dalam: Bappenas, editor. Laporan akhir penelitian pendukung PHT dalam rangka pelaksanaan program nasional pengendalian hama terpadu. Kerjasama Prasarana Fisik Bappenas dengan Fakultas Pertanian Institut Pertanian Bogor. Hlm 1-29.
Sitompul SK. 2013. Evaluasi keefektifan penghambatan beberapa agens biokontrol terhadap pertumbuhan Marasmius palmivorus Sharples [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Skidmore AM. and Dickinson CH, 1976. Colony interactions and hyphal interference between Septoria nodorum and phylloplane fungi. Transactions of the British Mycological Society 66(1): 57-64.
Smith D, Onions AUS. 1994. The preservations and maintanance of living fungi. Oxon: Center For Agriculture and Bioscience International (CABI).
17
Suketi K, Poerwanto R, Sujiprihati S, Sobir, Widodo WD. 2010. Studi karakter mutu buah pepaya IPB. J Hort. 1(1):17-26.
Syatrawati. 2008. Produksi senyawa biofungisida berbahan aktif Gliocladium sp. pada berbagai medium limbah organik. J Agrisistem. 4(2):121-125.
Whipps JM, Lumsden RD. 2001. Commercial use of fungi as plant disease biological control agents: status and prospects. Di dalam : Butt TM, Jackson C, Magan N, editor. Fungi as BiocontrolAgents. Wallingford (GB): CABI. hlm 9-22.
Wilhite SE, Staney DC. 1996. Timing of gliotoxin biosynthesis in the fungal biocontrol agent Gliocladium virens (Trichoderma virens). J Appl Microbiol Biotechnol. 45(1996):513-518.
19
Keterangan : Bacillus subtilis (a), APS12 (b), APS5 (c), Trichoderma Harzianum
(d), Gliocladium fimbriatum (e)
Lampiran 2 Diameter pertumbuhan koloni C. gloeosporioides pada perlakuan suspensi dan metabolit aktinomiset
Agens antagonis
HSI Ulangan
Diameter Koloni C. gloeosporioides (cm)
1 2 3 4 5 6 7
Keterangan : HSI (Hari Setelah Inokulasi), Susp (Suspensi), Met (Metabolit) a
e
c b
d
Lampiran 3 Diameter pertumbuhan koloni patogen C. gloeosporioides pada kontrol
Perlakuan HSI Ulangan
Diameter Koloni C. gloeosporioides (cm)
1 2 3 4 5 6 7
Kontrol
1 1.1 2.3 3.9 5.2 6.3 7.1 7.7
2 1.1 2.2 4.0 5.3 6.8 7.7 8.4
3 1.1 2.5 4.0 5.3 6.9 8.5 9.0
Keterangan : HSI (Hari Setelah Inokulasi)
Lampiran 4 Jari-jari pertumbuhan koloni patogen C. gloeosporioides dengan metode uji ganda pada media PDA
Agens biokontrol
HIS Ulangan
Jari - jari koloni C.gloeosporioides(cm)
1 2 3 4 5 6 7 Keterangan : HSI (Hari Setelah Inokulasi), R1 (Jari-jari yang mendekati agens biokontrol), R2 (Jari-jari yang menjauhi agens biokontrol)
21
Lampiran 5 Kejadian penyakit pada bibit pepaya berumur 21 HST dengan berbagai perlakuan agens biokontrol
Agens biokontrol Ulangan Kejadian Penyakit
Diberi patogen Tanpa patogen Kontrol
1
Bergejala Tidak Bergejala
TH17 Tidak Bergejala Tidak Bergejala
APS5 Bergejala Tidak Bergejala
APS12 Bergejala Tidak Bergejala
G84 Bergejala Bergejala
B12 Tidak Bergejala Tidak Bergejala
Kontrol
2
Bergejala Tidak Bergejala
TH17 Tidak Bergejala Tidak Bergejala
APS5 Bergejala Tidak Bergejala
APS12 Bergejala Tidak Bergejala
G84 Tidak Bergejala Tidak Bergejala
B12 Bergejala Tidak Bergejala
Kontrol
3
Bergejala Tidak Bergejala
TH17 Bergejala Tidak Bergejala
APS5 Tidak Bergejala Tidak Bergejala
APS12 Bergejala Tidak Bergejala
G84 Tidak Bergejala Bergejala
B12 Tidak Bergejala Tidak Bergejala
Kontrol
4
Bergejala Tidak Bergejala
TH17 Bergejala Bergejala
APS5 Bergejala Tidak Bergejala
APS12 Bergejala Bergejala
G84 Bergejala Tidak Bergejala
B12 Bergejala Tidak Bergejala
Kontrol
5
Bergejala Tidak Bergejala
TH17 Tidak Bergejala Tidak Bergejala
APS5 Tidak Bergejala Tidak Bergejala
APS12 Bergejala Tidak Bergejala
G84 Tidak Bergejala Tidak Bergejala
B12 Tidak Bergejala Tidak Bergejala
Kontrol
6
Bergejala Tidak Bergejala
TH17 Bergejala Tidak Bergejala
APS5 Tidak Bergejala Tidak Bergejala
APS12 Tidak Bergejala Bergejala
G84 Tidak Bergejala Tidak Bergejala
22
RIWAYAT HIDUP
Penulis lahir di Medan pada tanggal 14 Juli 1992 sebagai anak kedua dari empat bersaudara dari pasangan Bapak M. Taufik S. Barus dan Ibu Rosmawaty. Penulis menyelesaikan pendidikan sekolah dasar di SDN Cikuya 2 pada tahun 2003. menyelesaikan pendidikan sekolah menengah pertama di SMPN 1 Cisoka pada tahun 2006. Penulis juga menyelesaikan sekolah menengah atas di SMA Mandiri Balaraja pada tahun 2009.