MODIFIKASI PATI GARUT (Marantha arundinaceae L.)
DENGAN ASAM, ENZIM, DAN PERLAKUAN FISIK UNTUK
MEMPRODUKSI PATI RESISTEN TIPE 3 (RS 3)
FITRIA SLAMEUT
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Modifikasi Pati Garut (Marantha arundinaceae L.) dengan Asam, Enzim, dan Perlakuan Fisik untuk Memproduksi Pati Resisten Tipe 3 adalah benar karya saya dengan arahan dari pembimbing skripsi dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
FITRIA SLAMEUT. Modifikasi Pati Garut (Marantha arundinaceae L.) dengan Asam, Enzim, dan Perlakuan Fisik untuk Memproduksi Pati Resisten Tipe 3 (RS 3). Dibimbing oleh DIDAH NUR FARIDAH
Pati Resiten (RS) adalah pati yang tidak dapat dicerna oleh enzim di dalam usus halus manusia, namun dapat difermentasi oleh mikroflora dalam usus besar dan memberikan dampak positif bagi kesehatan. Tujuan penelitian ini adalah untuk melihat efek hidrolisis asam (lintnerization) (HA), debranching, autoclaving-cooling (AC), heat moisture treatment (HMT) dan kombinasinya untuk memproduksi RS 3 pada pati garut. Metode yang dilakukan dalam penelitian ini adalah hidrolisis asam pati garut alami (NA) dalam larutan HCl 2.2 N selama 2 jam, dilanjutkan dengan AC (autoklaf 121 oC 15 menit, cooling pada 4 oC 24 jam). Setelah itu, sampel dihidrolisis dengan enzim pullulanase (10.4 U/g pati, 16 jam) (debranching) dan AC lagi selama 2 siklus (HADAC). Sampel yang telah mengalami perlakuan modifikasi HADAC diberi perlakuan HMT (suhu 121 oC, kadar air 20%) selama 15 menit (HADAC-HMT15’) dan 60 menit
(HADAC-HMT60’). Pengaruh kombinasi perlakuan ini dapat meningkatkan kadar pati resisten dari 2.15% (NA) menjadi 17 kali lipatnya, yaitu 36.30% pada perlakuan HADAC, lalu meningkat lagi ke 52.59% (HADAC-HMT15’) dan 54.11 % (HADAC-HMT60’). Kadar amilosa juga meningkat dari 50.84% ke 57.74% (HADAC ke HADAC-HMT60’). Sementara itu, daya cerna pati dan jumlah gula pereduksi sampel menurun dari 44.94% ke 24.22% dan 13.23% ke 5.53% (HADAC ke HADAC-HMT60’).
Kata kunci: daya cerna pati, debranching, heat moisture treatment, hidrolisis asam, pati resisten
ABSTRACT
FITRIA SLAMEUT. Arrowroot (Marantha arundinaceae L.) Modification by Acid, Enzyme, and Physical Treatment to Produce Resistant Starch Type 3 (RS 3). Supervised by DIDAH NUR FARIDAH.
Resistant starch (RS) is a starch that can not be digested in human’s small
(HADAC-HMT60’). The effect of combination increased RS content from 36.30% (HADAC) to 52.59% (HADAC-HMT15’) to 54.11 % (HADAC-HMT60’). The number of amylose content also increased from 50.84% to 57.74% (HADAC to HADAC-HMT60’). Meanwhile, the starch digestibility and reducing sugar decreased from 44.94% to 24.22% and from 13.23% to 5.53% (HADAC to HADAC-HMT60’).
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada
Departemen Ilmu dan Teknologi Pangan
MODIFIKASI PATI GARUT (Marantha arundinaceae L.)
DENGAN ASAM, ENZIM, DAN PERLAKUAN FISIK UNTUK
MEMPRODUKSI PATI RESISTEN TIPE 3 (RS 3)
FITRIA SLAMEUT
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari 2015 ini ialah pembuatan pati resisten tipe 3, dengan judul Modifikasi Pati Garut (Marantha arundinaceae L.) dengan Asam, Enzim, dan Perlakuan Fisik untuk Memproduksi Pati Resisten Tipe 3 (RS 3).
Terima kasih penulis ucapkan kepada Dr. Didah Nur Faridah selaku dosen pembimbing, yang telah banyak meluangkan waktu untuk membimbing dan memberi masukan kepada penulis selama penelitian ini. Penulis juga mengucapkan terima kasih kepada Direktorat Jenderal Pendidikan Tinggi (DIKTI) yang telah bersedia mendanai penelitian ini melalui dana BOPTN, serta Faleh Setia Budi, ST, MT dan Dr. Ir. Sukarno, M.Sc yang telah bersedia menjadi penguji dalam sidang skripsi penulis dan memberi banyak masukan dalam penyusunan skripsi ini. Di samping itu, penghargaan penulis sampaikan kepada Bapak Yahya selaku teknisi Laboratorium Kimia Pangan dan Bapak Rojak dari bagian Stockroom atas segala bantuan yang diberikan selama penelitian ini berlangsung. Ucapan terima kasih juga penulis sampaikan kepada Chairul Anand, Fathma Syahbanu, Kak Mutiara Pratiwi dan Kak Ratna Sari sebagai rekan yang saling membantu dalam penelitian ini. Ungkapan terima kasih yang terbesar juga penulis sampaikan kepada keluarga, Bapak, Mama, dan Adik atas segala doa dan dukungan yang senantiasa diberikan kepada penulis. Tak lupa juga terima kasih kepada teman-teman ITP 48 dan Wisma Maharani yang selalu bersedia dimintai bantuan oleh penulis.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 3
TINJAUAN PUSTAKA 3
METODE 7
Bahan 7
Alat 7
Metodologi Penelitian 14
Analisis Statistik 14
HASIL DAN PEMBAHASAN 14
Pengaruh Modifikasi Pati Garut terhadap Kadar Amilosa dan Kadar Pati
Resisten 14
Pengaruh Modifikasi Pati Garut terhadap Daya Cerna Pati dan Total Pati 19 Pengaruh Modifikasi Pati Garut terhadap Kadar Gula Pereduksi 21
SIMPULAN DAN SARAN 23
Simpulan 23
Saran 23
DAFTAR PUSTAKA 24
DAFTAR TABEL
1 Kadar pati resisten pada pati garut alami dan termodifikasi 16
2 Analisis proksimat pati garut 23
DAFTAR GAMBAR
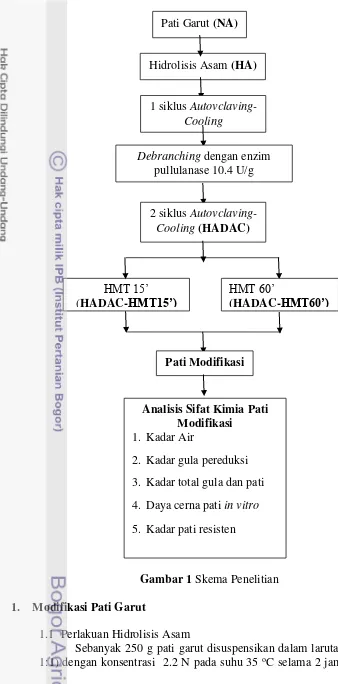
1 Skema Penelitian 8
2 Kadar pati resisten sampel modifikasi pati garut 15
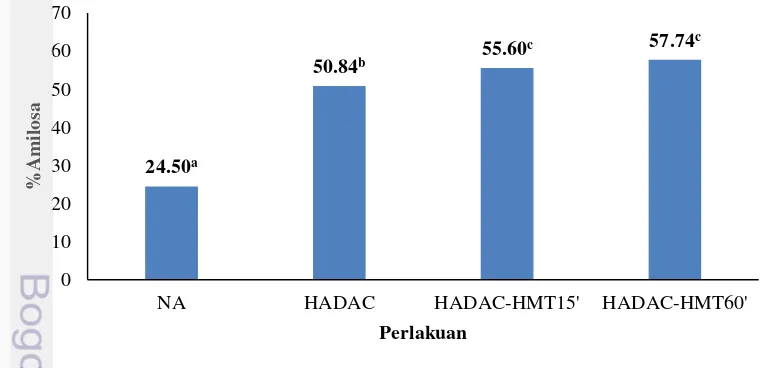
3 Kadar amilosa sampel modifikasi pati garut 17
4 Hubungan antara kadar pati resisten dengan kadar amilosa sampel 18
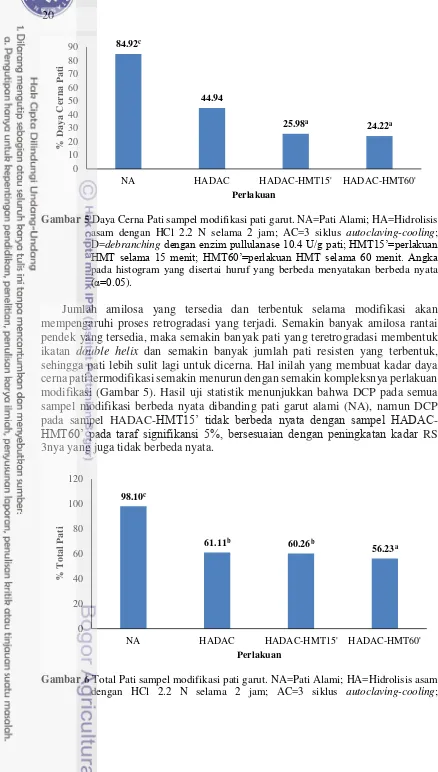
5 Daya cerna pati sampel modifikasi pati garut 20
6 Total pati sampel modifikasi pati garut 20
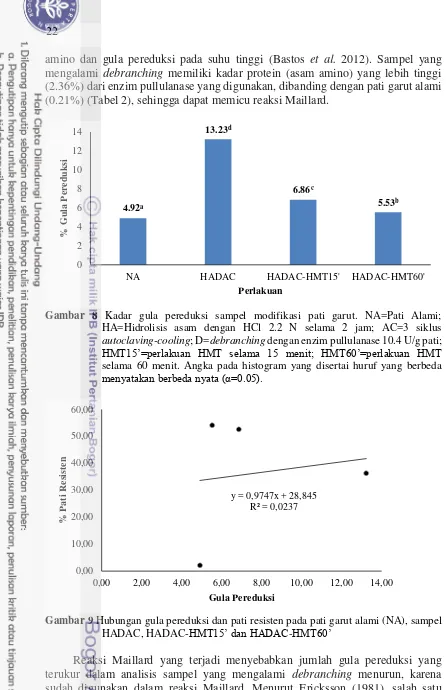
7 Hubungan antara pati resisten, daya cerna pati, dan total pati 21 8 Kadar gula pereduksi sampel modifikasi pati garut 22
9 Hubungan pati resisten dan gula pereduksi 22
DAFTAR LAMPIRAN
1 Analisis sidik ragam (ANOVA) amilosa, kadar RS, daya cerna pati, kadar kadar gula pereduksi, dan kadar total pati pada pati garut termodifikasi 27
1
PENDAHULUAN
Latar Belakang
Perubahan pola hidup masyarakat memiliki pengaruh yang besar terhadap arah perkembangan industri pangan. Kesadaran masyarakat yang meningkat tentang korelasi positif konsumsi pangan sehat dengan tingkat kesehatan setiap individu menjadi salah satu alasan meningkatnya popularitas pangan bernilai gizi dan pangan fungsional. Pangan fungsional adalah bahan pangan yang memiliki manfaat tertentu untuk mengurangi resiko terjadinya penyakit kronis atau penyakit degeneratif disamping fungsinya untuk memenuhi kebutuhan gizi manusia (Zaragoza et al. 2010).
Salah satu ingredien pangan yang dapat dijadikan sebagai bahan baku dalam pembuatan pangan fungsional adalah pati resisten atau Resistant Starch (RS). RS didefinisikan sebagai bagian pati atau produk turunan pati yang tidak dapat dicerna oleh enzim pencernaan dalam usus halus, sehingga berlanjut ke usus besar dan difermentasi oleh mikroflora usus. Sifat RS yang tidak dapat dicerna ini mengakibatkan pangan yang mengandung RS memberikan respon indeks glikemik yang rendah (Haub et al. 2009). Pati resisten memiliki cakupan yang luas tergantung pada bahan bakunya dan memiliki tipe yang berbeda-beda (RS 1-5). Saat ini, tipe-tipe tersebut dibedakan berdasarkan karakteristik fisik dan kimia masing-masing pati (Nugent 2005, Diane et al. 2013). Di antara kelima jenis pati resisten tersebut, pati resisten tipe 3 (RS 3) merupakan tipe pati resisten yang banyak digunakan sebagai bahan baku pangan fungsional.
RS 3 dapat dihasilkan dari proses pemanasan suhu tinggi dan pendinginan secara berulang atau disebut siklus autoclaving-cooling (AC). Proses ini dapat menyebabkan terjadinya retrogradasi fraksi amilosa, kadar RS 3 secara proporsional berbanding lurus dengan kandungan amilosa dalam bahan pangan (Shu et al. 2007). Peningkatan fraksi amilosa rantai pendek yang berperan dalam pembentukan RS 3 dapat dihasilkan melalui proses hidrolisis asam secara lambat (lintnerization) atau pemutusan ikatan percabangan α-1,6 pada rantai amilopektin (debranching) sehingga dihasilkan DP (derajat polimerisasi) antara 10-35 yang dibutuhkan untuk meningkatkan kadar RS 3 (Lehmann et al. 2003). Perlakuan heat moisture treatment (HMT) dilakukan dengan memanaskan pati dengan kadar air rendah (< 35%) di atas suhu glass transition selama waktu tertentu. HMT berpengaruh terhadap sifat fisiko kimia pati melalui interaksi antara bagian amorf dan kristalin pati dan/atau merusak kristalit pati (Hoover 2010). Penelitian yang dilakukan oleh Kittipongpatana dan Kittipongpatana (2014) menunjukkan bahwa perlakuan HMT dapat meningkatkan kadar RS pada pati biji buah nangka sebesar 10-40% tergantung suhu dan waktu HMT.
2
sehingga dapat menurunkan nilai IG (Indeks Glikemik) produk pangan. Sifat fungsional ini menjadi penting apabila pati garut hasil modifikasi ini akan dijadikan sebagai bahan baku pangan fungsional, misalnya pangan dengan nilai IG rendah. Produk pangan dengan nilai IG rendah dapat dijadikan bahan pangan alternatif khususnya bagi penderita diebetes. Beberapa penelitian menunjukkan bahwa kombinasi hidrolisis asam, debranching dan autoclaving-cooling yang dikombinasikan dengan modifikasi HMT dapat meningkatkan kadar RS 3 yang sangat tinggi hingga mencapai 84% (Lehmann et al. 2002). Berdasarkan penjelasan di atas, maka diperlukan penelitian untuk dapat meningkatkan kadar pati resisten (RS 3) dari pati garut dengan kombinasi proses hidrolisis asam (lintnerization), pemutusan ikatan cabang amilopektin secara enzimatis (debranching), AC, dan HMT.
Perumusan Masalah
Pati garut alami memiliki kadar pati resisten yang rendah, sebagaimana sumber pati lainnya. Namun pati garut berpotensi untuk dijadikan sebagai bahan baku pembuatan pati resisten karena memiliki struktur yang sesuai untuk pembentukan pati resisten. Salah satu cara untuk meningkatkan pati resisten adalah dengan proses retrogradasi pati yang dapat menghasilkan RS 3. Retrogradasi pati dapat dilakukan dengan cara pemanasan pada suhu tinggi (autoclaving) yang dilanjutkan dengan proses pendinginan (cooling) secara berulang. Pati lebih mudah mengalami retrogradasi dalam bentuk molekul amilosa rantai pendek dengan derajat polimerasi (DP) berkisar 10-35. Semakin banyak jumlah fraksi amilosa rantai pendek maka semakin besar peluang terbentuknya pati yang teretrogradasi. Jumlah fraksi amilosa rantai pendek dapat ditingkatkan dengan cara menghidrolisis secara parsial ikatan glikosidik pada rantai molekul amilosa dan amilopektin dengan hidrolisis asam. Selain itu, bisa juga dilakukan pemotongan secara spesifik pada rantai cabang amilopektin dengan menggunakan enzim pululanase. Kedua proses ini dapat menghasilkan amilosa rantai pendek. Sifat resistensi pati berhubungan dengan kristalinitas granula pati. Metode HMT berperan dalam menyempurnakan pembentukan kristalit pada granula pati, sehingga dapat meningkatkan kadar RS 3 pada pati garut. Dengan adanya kombinasi hidrolisis asam, siklus autoclaving-cooling, dan HMT, diharapkan terjadinya peningkatan kadar RS 3 pada pati garut.
Tujuan Penelitian
Penelitian ini bertujuan untuk mempelajari karakteristik kimia pati resisten dari pati garut hasil modifikasi asam dan debranching dengan autoclaving-cooling dan HMT untuk pengembangan RS sebagai ingredien pangan fungsional.
Adapun tujuan khusus dari penelitian ini adalah:
3
2. Mengetahui pengaruh perbedaan waktu heat moisture treatment (HMT) terhadap kenaikan kadar RS 3 yaitu HMT selama 15 menit dan 60 menit.
Manfaat Penelitian
Hasil penelitian ini bermanfaat untuk menambah informasi ilmiah terkait produksi RS 3 berbahan dasar umbi garut sebagai bahan baku pangan fungsional. Melalui hasil penelitian ini diharapkan bahwa masyarakat dan industri pangan memiliki pilihan yang lebih kaya dalam membuat dan memperoleh pati resisten yang memiliki daya cerna pati rendah, sehingga nilai IGnya juga rendah. Selain itu, penggunaan RS 3 dari pati garut juga diharapkan dapat meningkatkan mutu produk yang dihasilkan.
TINJAUAN PUSTAKA
Pati Resisten
Pati merupakan sumber terbesar karbohidrat dalam bahan pangan (Ratnayake dan Jackson 2008). Pada umumnya, pati dicerna di dalam usus manusia dengan cara
hidrolisis oleh enzim α-amilase, glukoamilase, dan sucrase-isomaltase di dalam usus halus untuk menghasilkan glukosa bebas yang dapat dicerna (Nugent 2005). Namun, tidak semua jenis pati dapat dicerna di dalam usus halus (Ratnayake dan Jackson 2008). Pati yang tidak dapat dicerna ini disebut dengan pati resisten.
4
ulang setelah pemasakan, sehingga RS 5 ini tergolong stabil panas (Diane et al. 2013).
Metode Hidrolisis Asam
Perlakuan hidrolisis pati secara lambat (lintnerization) dimaksudkan untuk meningkatkan jumlah fraksi amilosa rantai pendek dengan bobot molekul rendah yang merupakan hasil degradasi fraksi amilosa rantai panjang dan titik percabangan
α-1,6 inter-klaster dari rantai amilopektin. Apabila jumlah fraksi amilosa rantai pendek meningkat, maka semakin banyak fraksi amilosa yang teretrogradasi atau terkristalisasi, sehingga proses pembentukan RS 3 semakin tinggi dan berdampak pada penurunan daya cerna pati. Fraksi amilosa sebagai struktur linear akan memfasilitasi ikatan silang dengan adanya ikatan hidrogen sehingga struktur amilosa membentuk kristalit yang kompak (Lehmann et al. 2003, Aparicio-Saguilán et al. 2005, Zhao dan Lin 2009).
Modifikasi pati dengan metode hidrolisis asam tidak mengubah bentuk granula pati yang dihasilkan, tetapi menyebabkan penurunan kemampuan mengembang (swelling), viskositas dan kestabilan pasta pati selama proses gelatinisasi. Proses hidrolisis asam terjadi dalam dua tahap penyerangan pada granula pati, yaitu tahap penyerangan secara cepat pada daerah amorf, dan tahap penyerangan yang lebih lambat terhadap fraksi amilopektin di daerah kristalin (Jayakody dan Hoover 2002).
Beberapa peneliti melaporkan pengaruh kombinasi pengasaman dan autoclaving-cooling terhadap kadar RS 3. Pati jagung yang dihidrolisis dengan asam sitrat 0.1 M selama 12 jam yang dilanjutkan dengan proses pemanasan pada 121 oC selama 20 menit dan pendinginan 4 oC dengan jumlah siklus yang sama juga meningkatkan kadar RS 3 dari 8.0% menjadi 11.0%. Hidrolisis asam lebih atau kurang dari 12 jam menghasilkan pembentukan RS 3 yang lebih rendah. Mun dan Shin (2006) melaporkan bahwa pati jagung yang dihidrolisis dengan HCl 0.1 N selama 6 jam menyebabkan peningkatan kadar RS 3 menjadi 13.8-14.9%. Faridah (2011) menunjukkan bahwa konsentrasi dan suhu autoklaf akan berpengaruh terhadap pembentukan RS 3 selama proses autoclaving-cooling dengan pembentukan RS 3 paling optimum pada konsentrasi suspensi pati 20% dan suhu 121 oC.
Metode Debranching
Enzim pullulanase (EC 3.2.1.4.1 atau pullulan 6-glucanohydrolase) merupakan enzim mikrobial yang dihasilkan dari Klebsiella pneumoniae. Enzim ini
memecah ikatan glikosidik α-1,6 yang merupakan ikatan percabangan pada molekul amilopektin. Pemutusan ikatan percabangan (debranching) oleh
5 et al. 2009; Ozturk et al. 2009). Hasil penelitian tersebut memberikan kadar RS 3 yang berbeda-beda untuk jenis pati dan kondisi proses debranching yang berbeda. Secara umum, kadar RS 3 dipengaruhi oleh konsentrasi enzim pullulanase dan waktu inkubasi selama proses debranching, serta suhu dan waktu pemanasan (autoclaving) dan pendinginan (cooling) setelah proses debranching.
Pongjanta et al. (2009) membandingkan proses debranching pati beras tinggi amilosa dengan menggelatinisasi dahulu suspensi pati (15%) pada suhu 95 oC dan 121 oC selama 30 menit, lalu dihidrolisis oleh enzim pullulanase (8 U/g pati) pada 55 oC dan waktu inkubasi pada selang 0-24 jam. Hasilnya menunjukkan bahwa pati beras yang dipanaskan pada 121 oC memberikan kadar RS 3 lebih tinggi dibandingkan pada 95 oC untuk kondisi debranching yang bersesuaian. Semakin lama proses debranching maka proses hidrolisis amilopektin semakin banyak sehingga dihasilkan amilosa rantai pendek yang dapat memperbanyak peluang pembentukan RS 3. Kombinasi pemanasan pada 121 oC dengan waktu inkubasi selama 24 jam memberikan kadar RS 3 paling tinggi (18.33%) bila dibandingkan kombinasi suhu dan waktu inkubasi lainnya. Pongjanta et al. (2009) juga melaporkan bahwa proses debranching meningkatkan kadar RS 3 pati beras tinggi amilosa sebanyak 4 kali lipat lebih tinggi dibandingkan dengan yang diproses tanpa debranching pada kondisi autoclaving-cooling yang sama.
Gonzales-Soto et al. (2007) juga membandingkan suspensi pati pisang yang dihidrolisis oleh enzim pullulanase dan dipanaskan di dalam otoklaf 121 oC selama 30 menit dengan waktu pendinginan yang berbeda (suhu 4 oC dan 32 oC). Hasilnya menunjukkan bahwa suhu pendinginan 4 oC dan 32 oC tidak memberikan kadar RS 3 yang berbeda nyata. Ozturk et al. (2009) melakukan modifikasi pati jagung tinggi amilosa, yaitu Hylon V (H5) dan Hylon 7 (H7), dengan perlakuan debranching oleh enzim pullulanase (1.5 U/g pati) pada suhu 60 oC selama 48 jam. Proses autoclaving-cooling dilakukan pada suhu 123 oC dan 133 oC dan dilanjutkan dengan penyimpanan pada suhu rendah (4 oC), selanjutnya dikeringkan dengan menggunakan oven dan freeze dryer. Hasilnya menunjukkan bahwa pengeringan pati yang telah dimodifikasi dalam oven memberikan kadar RS 3 lebih tinggi bila dibandingkan dengan freeze dryer. Berat molekul menurun dan kadar RS 3 meningkat dengan meningkatnya waktu inkubasi selama debranching. Kadar RS 3 pati jagung H7 lebih tinggi dibandingkan dengan H5 pada kondisi proses debranching yang sama. Berdasarkan hasil analisis menggunakan DSC, proses debranching-autoclaving-cooling menurunkan suhu puncak (Tp) dan meningkatkan nilai entalpi pada kedua jenis pati jagung tersebut. Kelarutan dan kapasitas pengikatan air juga lebih tinggi dibandingkan dibandingkan pati alaminya.
6
Miao et al. (2009) melakukan proses debranching pati jagung tinggi amilopektin (waxy maize) dengan konsentrasi 10, 20 atau 40 U/g pati dengan waktu inkubasi 6 jam, kemudian dilanjutkan dengan pemanasan di dalam otoklaf pada 121 oC selama 30 menit dan disimpan pada 4 oC selama 2 hari. Hasilnya menunjukkan bahwa kadar RS 3 meningkat dengan meningkatnya konsentrasi enzim pullulanase yang digunakan. Secara umum, kadar RS 3 dipengaruhi oleh konsentrasi enzim pullulanase dan waktu inkubasi selama proses debranching, serta suhu dan waktu pemanasan (autoclaving) dan pendinginan (cooling) setelah proses debranching (Faridah 2011).
Metode Autoclaving-cooling
Pembentukan pati resisten tipe 3 (RS 3) tergantung pada banyak faktor, diantaranya pH, temperatur, waktu inkubasi, waktu penyimpanan, jumlah siklus pemanasan dan pendinginan, tipe pati, dan sebagainya (Milasinovic et al. 2010). Proses pemanasan pada suhu tinggi di dalam otoklaf (autoclaving) menyebabkan suspensi pati mengalami gelatinisasi. Adapun proses penyimpanan suhu rendah dari pasta pati yang dihasilkan akan mempercepat terjadinya retrogradasi pati (Liu 2005). Proses autoclaving-cooling yang berulang dapat menyebabkan terjadinya peningkatan penyusunan ulang ikatan amilosa-amilosa dan amilosa-amilopektin dan peningkatan pembentukan kristalin yang lebih sempurna dan berakibat pada peningkatan kadar RS 3 (Leong et al. 2007). Faktor lain yang berpengaruh terhadap pembentukan RS 3 melalui proses autoclaving-cooling adalah konsentrasi pati dan suhu autoclaving, konsentrasi amilosa dan amilopektin, panjang rantai amilosa, dan jumlah siklus autoclaving-cooling (Sajilata et al. 2006).
Penelitian yang dilakukan oleh Milasinovic et al.(2010) menunjukkan adanya kenaikan kadar RS pati maizena sebanyak 2.1% setelah tiga kali siklus autoclaving-cooling. Sajilata et al. (2006) melaporkan bahwa proses autoclaving-cooling pada pati gandum dapat meningkatkan kadar pati resisten menjadi sembilan kali lipat dari pati gandum alami. Jumlah siklus autoclaving-cooling juga mempengaruhi kadar pati resisten yang dihasilkan, misalnya pati gandum yang diproses dengan tiga kali siklus autoclaving-cooling meningkat kadar RS 3-nya menjadi 7.8% bila dibandingkan hanya satu kali siklus (6.2%).
Metode Heat Moisture Treatment
Heat moisture treatment (HMT) adalah proses modifikasi hidrotermal yang dilakukan pada kadar air sampel kurang dari atau sama dengan 35%, dipanaskan pada suhu di antara suhu glass transition dan suhu gelatinisasi selama waktu tertentu. Proses HMT biasa dilakukan untuk memodifikasi sifat fisiko-kimia, daya cerna dan sifat fungsional dengan meminimumkan efeknya terhadap struktur granula pati (Gunaratne dan Hoover 2002; S. Li et al. 2011). Proses modifikasi HMT dapat merubah sifat fisikokimia pati dengan memfasilitasi interaksi rantai pati pada daerah amorf dan daerah kristalin dengan mengganggu kristalit pati.
Pada tahap ini juga terjadi pembentukan struktur double helix (Ji et al. 2015),
amilopektin-7 amilopektin, serta rantai amilosa-amilopektin sehingga membentuk struktur yang lebih kompak dan stabil, yang terbentuk selama proses HMT (Zavareze dan Dias 2011). Besarnya perubahan yang dilakukan oleh proses HMT bergantung pada komposisi pati, kadar air, dan suhu pemanasan, serta struktur amilosa dan amilopektin pada granula pati native (Hoover 2010). Penelitian yang dilakukan oleh Kittipongpatana dan Kittipongpatana (2014) menunjukkan bahwa perlakuan HMT dapat meningkatkan kadar pati resisten hingga mencapai 52.2% pada pati biji nangka. Peningkatan kadar pati resisten akibat perlakuan HMT juga dilaporkan oleh Li et al. (2011) dalam penelitian terhadap pati kacang hijau yang diduga sebagai hasil interaksi antar rantai pati pada daerah amorf granula pati.
METODE
Bahan
Bahan utama yang digunakan dalam penelitian ini adalah pati garut dari Kelompok Tani Wanita Yogyakarta. Bahan-bahan untuk analisis yaitu H2SO4,
buffer fosfat pH 6 dan pH 7, termamyl (α amilase Sigma A-3403), NaOH, enzim protease (Sigma P-3910), enzim amiloglukosidase (Sigma A-9913), etanol, aseton, enzim pepsin (Sigma P-7000), enzim pankreatin (Sigma P-1750), NaHCO3, akuades, air bebas ion, HCl asam asetat, KI, I2, pereaksi Anthrone, asam
dimetilsalisilat (DNS), enzim α-amilase (Fluca), pati murni (E Merck), maltosa murni (E Merck), Na2S2O5, enzim pullulanase, fenol, ba-metabisulfit, glukosa, indikator fenolfetalin, HClO4, Na2HPO4, kuprisulfat, Na2SO4, amonium molibdat, Na2HPO4.7H2O, butanol, dan etanol.
Alat
Alat yang digunakan dalam penelitian ini terdiri dari peralatan gelas, blender, mortar, pH meter, penggiling tepung, refrigerator, freezer, termometer, neraca analitik, spektrofotometer, waterbath shaker, oven, sentrifuse, alat analisa pati resisten dan lain-lain.
Metodologi Penelitian
8
Gambar 1 Skema Penelitian 1. Modifikasi Pati Garut
1.1 Perlakuan Hidrolisis Asam
Sebanyak 250 g pati garut disuspensikan dalam larutan HCl (nisbah 1:1) dengan konsentrasi 2.2 N pada suhu 35 oC selama 2 jam, sambil terus
Pati Garut (NA)
Hidrolisis Asam (HA)
1 siklus Autovclaving-Cooling
Debranching dengan enzim pullulanase 10.4 U/g
2 siklus Autovclaving-Cooling (HADAC)
HMT 15’
(HADAC-HMT15’)
HMT 60’
(HADAC-HMT60’)
Pati Modifikasi
Analisis Sifat Kimia Pati Modifikasi
1. Kadar Air
9 dilakukan pengadukan. Suspensi pati garut yang telah mengalami perlakuan hidrolisis asam tersebut kemudian dinetralkan dengan menggunakan larutan natrium hidroksida (NaOH 1 M) hingga mencapai pH 6.0. Suspensi pati tersebut kemudian dikeringkan pada suhu 50 oC selama 24 jam hingga mencapai kadar air 10-12%.
1.2 Perlakuan Debranching dan Autoclaving-Cooling (DAC)
Pati garut hasil hidrolisis asam sebanyak 40.0 g dibuat menjadi suspensi pati garut 20% b/v dalam air deionisasi dan diberi pemanasan awal pada suhu 80 oC selama 5 menit. Pasta pati kemudian dipanaskan pada suhu 121 oC dengan otoklaf selama 15 menit. Setelah itu, pasta pati didinginkan selama satu jam pada suhu ruang, kemudian disimpan di dalam refrigerator 4 oC selama 24 jam. Pasta pati yang telah mengalami modifikasi AC satu siklus ini kemudian dipanaskan kembali hingga suhu 50 oC.
Pasta pati kemudian diencerkan sampai konsentrasi 10% b/v dengan menggunakan buffer asetat dan campuran buffer asetat dengan enzim pullulanase konsentrasi 10.4 U/g pati dengan perbandingan 1:1. Sampel diinkubasi pada suhu 50 oC selama 24 jam dalam penangas air bergoyang. Setelah itu, dilakukan kembali dua siklus autoclaving-cooling pada suhu 121 oC dan 4 oC. Sampel dikeringkan dengan menggunakan freeze dry dan diayak 80 mesh serta dikemas dalam kantung plastik. Sampel disimpan pada suhu -18 oC sampai digunakan.
1.3 Perlakuan Heat Moisture Treatment
Sejumlah sampel hasil modifikasi HADAC ditimbang dan disemprotkan air secara merata sampai mencapai kadar air 20%. Sampel disimpan dalam plastik tahan panas pada suhu kamar selama semalam. Kemudian sampel diberi perlakuan panas dalam autoklaf 121 oC dengan dua parameter waktu yang berbeda yaitu 15 menit dan 60 menit. Setelah itu, sampel dikeringkan kembali dalam oven 50 oC selama 24 jam, diayak dan disimpan dalam freezer -18 oC sampai digunakan.
2. Tahap Analisis
2.1 Analisis Kadar air (925.10 AOAC 2012)
Kadar air sampel dianalisis dengan menggunakan metode gravimetri. Cawan aluminium dikeringkan dengan oven pada suhu 130 + 3°C selama 15 menit, kemudian didinginkan dalam desikator selama 10 menit. Cawan yang sudah kering ditimbang sebelum digunakan. Sebanyak 2 g sampel ditimbang ke dalam cawan tersebut, kemudian dikeringkan dengan oven pada suhu 130°C selama 1 jam, didinginkan dalam desikator dan ditimbang hingga beratnya konstan. Kadar air dihitung dengan rumus sebagai berikut:
Kadar air (%bb) = ܽ−(ܾ−ܿ)ܽ x 100 (1)
10
2.2 Analisis Kadar gula pereduksi metode Park-Johnson (Hizukuri et al. 1983)
Kadar gula pereduksi sampel dianalisis dengan metode Park-Johnson yang terdiri atas tahapan pembuatan kurva standar glukosa, persiapan sampel, dan analisis sampel sebagai berikut.
a. Pembuatan Kurva Standar Larutan Glukosa
Sebanyak 1.0 mL larutan glukosa murni yang masing-masing mengandung 0.0, 2.0, 4.0, 6.0, 8.0, dan 10.0 μg glukosa dalam tabung reaksi ditambahkan dengan 0.5 mL buffer sodium karbonat-sodium hidrogen karbonat dan 0.5 mL larutan potasium ferisianida. Sampel dipanaskan dalam air mendidih selama 15 menit kemudian didinginkan dalam air mengalir selama 10 menit. Selanjutnya 5.0 mL larutan ferri-amonium sulfat ditambahkan ke dalam sampel, kemudian diaduk menggunakan vorteks. Sampel diinkubasi pada suhu ruang selama 20 menit. Sampel diukur absorbansinya dengan menggunakan spektrofotometer UV-Vis pada panjang gelombang 715 nm. Persamaan dan kurva standar larutan glukosa dibuat sebagai hubungan antara konsentrasi larutan glukosa (pada sumbu x) dan absorbansi (pada sumbu y).
b. Persiapan Sampel
Sebanyak 1.0 g pati dimasukkan secara perlahan ke dalam 100.0 mL etanol 95% dan dihomogenkan dengan menggunakan pengaduk magnetik. Suspensi pati tersebut kemudian disaring menggunakan kertas saring. Kertas yang berisi residu pati didiamkan semalam di dalam desikator. Setelah kering, pati yang terdapat dalam kertas saring diambil, lalu dihaluskan dengan mortar. Sebanyak 40.0 mg pati yang telah dihaluskan ditambahkan dengan 20.0 mL akuades, kemudian dipanaskan dalam otoklaf 105 oC selama 1 jam. Setelah pemanasan selesai, pasta pati didinginkan pada suhu kamar dan dilakukan 40 kali pengenceran sebelum digunakan.
c. Analisis Sampel
Sampel sebanyak 1 mL ditambahkan 0.5 mL larutan buffer sodium karbonat-sodium hydrogen karbonat (4.8 g Na2CO3, 9.2 g NaHCO3 dan 0.65 g KCN yang dilarutkan dalam aquades 1 L) dan ditambahkan 0.5 ml potasium fericianida 0.1% (b/v). Campuran larutan tersebut dipanaskan selama 15 menit dalam air mendidih dan didinginkan dalam air mengalir
2.3 Analisis Kadar Total Gula dan Pati (Dubois et al. 1956)
Kadar total gula dan pati sampel pati garut dianalisis dengan menggunakan metode fenol sulfat yang mencakup tahapan pembuatan kurva standar larutan glukosa, persiapan sampel, dan analisis sebagai berikut. a. Pembuatan Kurva Standar Larutan Glukosa
11 tersebut ditambahkan 0.5 mL fenol 5%, kemudian diaduk dengan menggunakan vorteks. Sebanyak 2.5 mL larutan H2SO4 pekat ditambahkan secara cepat ke dalam tabung reaksi tersebut (terjadi reaksi eksoterm yang menghasilkan panas). Larutan tersebut didiamkan selama 10 menit, kemudian diaduk lagi dengan vorteks. Sampel disimpan pada suhu ruang selama 20 menit sebelum diukur absorbansi dengan spektrofotometer UV-Vis pada panjang gelombang 490 nm. Persamaan dan kurva standar larutan glukosa dibuat sebagai hubungan antara konsentrasi larutan glukosa (pada sumbu x) dan absorbansi (pada sumbu y).
b. Persiapan Sampel Analisis Kadar Pati
Sebanyak 1 g pati dimasukkan secara perlahan ke dalam 100.0 mL etanol 95% dan dihomogenkan menggunakan pengaduk magnetik. Suspensi pati kemudian disaring menggunakan kertas saring. Kertas yang berisi residu pati didiamkan semalam dalam desikator. Residu pati ditimbang sehingga diketahui beratnya untuk menghitung pati pada sampel sebelum mengalami pencucian dengan etanol.
Setelah pati kering, pati yang terdapat dalam kertas saring diambil, kemudian dihaluskan dengan mortar. Sebanyak 40 mg pati yang telah dihaluskan ditambah dengan 20.0 mL akuades, lalu diotoklaf pada suhu 105 oC selama 1 jam. Setelah diotoklaf, sampel didinginkan pada suhu kamar lalu diencerkan sebanyak 40 kali.
c. Analisis Sampel
Sebanyak 0.5 mL sampel dimasukkan ke dalam tabung reaksi, kemudian ditambahkan 0.5 mL fenol 5% dan dihomogenkan dengan menggunakan vorteks. Sebanyak 2.5 mL larutan H2SO4 pekat lalu ditambahkan secara cepat ke dalam tabung reaksi, sehingga terjadi reaksi eksoterm yang menghasilkan panas. Larutan sampel kemudian didiamkan selama 10 menit pada suhu ruang, diaduk dengan vorteks dan didiamkan kembali selama 20 menit pada suhu ruang. Nilai absorbansi diukur dengan spektrofotometer UV-Vis pada panjang gelombang 490 nm. Kadar glukosa (μg/mL) ditentukan dengan menggunakan kurva standar. Kadar total gula (%bb) diperoleh dari kurva standar, sedangkan kadar pati (%bb) dihitung dengan mengalikan kadar total gula dengan faktor 0.9.
2.4 Analisis Daya Cerna Pati in Vitro (Anderson et al. 2002)
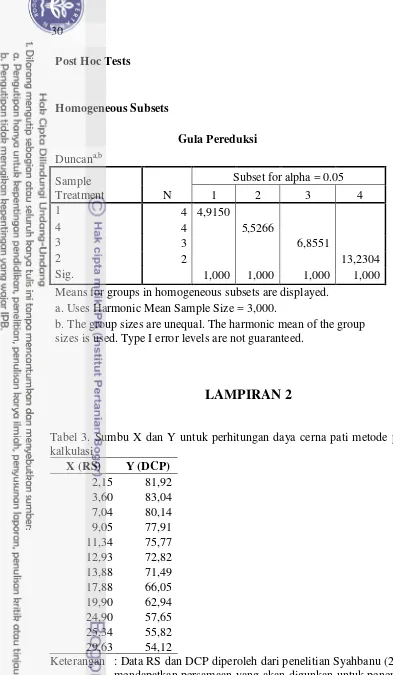
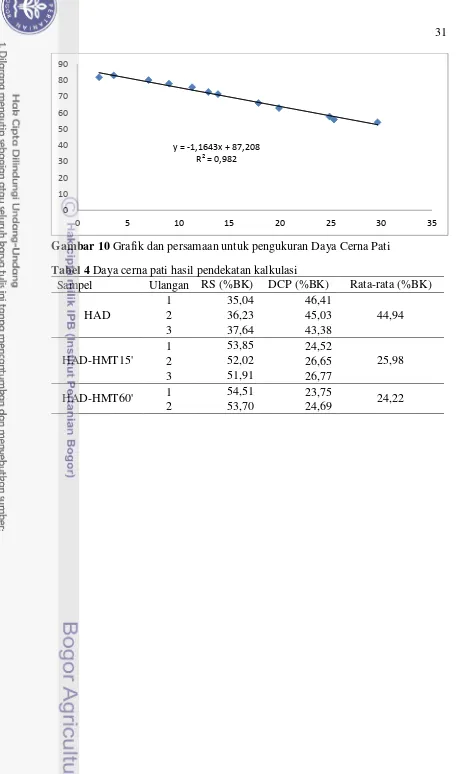
Analisis daya cerna pati dilakukan dengan metode pendekatan yaitu kalkulasi terhadap 12 sampel dari hasil penelitian Syahbanu (2015) yaitu
sampel NA, HA, AC, HAAC, HMT15’, HMT60’, HA-HMT15’, HA
-HMT60’, AC-HMT15’, AC-HMT60’, HAAC-HMT15’, dan HAAC-HMT60’ dengan nilai R2 = 0.9820 (Lampiran 2). Daya cerna pati in vitro pada penelitian Syahbanu (2015) dianalisis secara spektroskopi yang mencakup tahapan pembuatan kurva standar maltosa dan analisis sampel sebagai berikut. a. Pembuatan Kurva Standar Larutan Maltosa
12
10.0 mL akuades, kemudian diaduk hingga homogen dengan menggunakan vorteks. Sampel diukur absorbansinya dengan spektrotometer UV-Vis pada panjang gelombang 520 nm.
b. Analisis Sampel
Sebanyak 1.0 g sampel pati garut dimasukkan ke dalam erlenmeyer 250 mL, lalu ditambahkan dengan 100.0 mL akuades. Labu erlenmeyer ditutup dengan aluminium foil dan dipanaskan dalam penangas air hingga mencapai suhu 90 oC sambil terus diaduk, lalu didinginkan. Sebanyak 2.0 mL larutan sampel tersebut dipipet ke dalam tabung reaksi bertutup, lalu ditambahkan 3.0 mL akuades dan 5.0 mL larutan bufer fosfat pH 7.0. Masing-masing sampel dibuat dua kali, salah satunya digunakan sebagai blanko. Tabung ditutup dan diinkubasikan pada suhu 37 oC selama 15 menit. Larutan sampel dan blanko diangkat dan ditambahkan 5.0 mL larutan enzim α -amilase (1 mg/mL dalam larutan bufer fosfat pH 7.0). Kedua tabung tersebut diinkubasi kembali selama 30 menit, lalu dipindahkan ke dalam tabung reaksi bertutup berisi 2.0 mL larutan DNS (asam dinitrosalisilat).
Larutan dipanaskan dalam air mendidih selama 12 menit, lalu segera didinginkan dengan air mengalir. Sebanyak 10.0 mL akuades kemudian ditambahkan, lalu diaduk hingga homogen dengan menggunakan vorteks. Larutan sampel dan blanko tersebut kemudian diukur absorbansinya dengan spektrofotometer UV-Vis pada panjang gelombang 520 nm. Daya cerna pati (dalam persen) dihitung dengan menggunakan rumus sebagai berikut (persamaan 11):
Daya cerna pati (%bb) = (A – a B – b )x 100
dengan : A = maltosa dalam sampel (mg); a = maltosa dalam blanko (mg), B = maltosa dalam pati murni (mg); b = maltosa dalam blanko pati murni (mg). 2.5 Analisis Kadar Pati Resisten (Goni et al. 1996)
Kadar pati resisten sampel dianalisis dengan metode spektroskopi yang mencakup tahapan pembuatan kurva standar glukosa dan analisis sampel sebagai berikut.
a. Pembuatan Kurva Standar Glukosa (Dubois et al. 1956)
Larutan glukosa murni (0.5 mL) yang masing-masing mengandung 0.0, 10.0, 20.0, 30.0, 40.0, 50.0, 60.0, 70.0 dan 80.0 μg larutan glukosa ditempatkan dalam tabung reaksi. Ke dalam masing-masing tabung reaksi tersebut ditambahkan 0.5 mL fenol 5%, kemudian diaduk dengan menggunakan vorteks. Sebanyak 2.5 mL larutan H2SO4 pekat ditambahkan secara cepat ke dalam tabung reaksi tersebut (terjadi reaksi eksoterm yang menghasilkan panas). Larutan tersebut didiamkan selama 10 menit, kemudian diaduk lagi dengan vorteks. Sampel disimpan pada suhu ruang selama 20 menit sebelum diukur absorbansi dengan spektrofotometer UV-Vis pada panjang gelombang 490 nm. Persamaan dan kurva standar larutan glukosa dibuat sebagai hubungan antara konsentrasi larutan glukosa (pada sumbu x) dan absorbansi (pada sumbu y).
b. Analisis Sampel
13 sampel diinkubasi pada suhu 40 oC selama 60 menit pada penangas bergoyang. Sampel kemudian didinginkan pada suhu ruang.
Sebanyak 4.5 mL larutan bufer fosfat pH 6.9 dan 0.5 mL larutan porcine
α-amilase (15.2 mg α-amilase per mL bufer fosfat) ditambahkan ke dalam sampel. Sampel kemudian diaduk dengan vorteks dan diinkubasi pada suhu 37 oC selama 16 jam sambil terus digoyang. Setelah sampel disentrifus (15 menit, 3000 g), bagian residu diambil dan dicuci dengan 10.0 mL akuades. Proses sentrifusi diulang lagi dengan cara yang sama seperti di atas dan residunya kembali diambil dan dicuci. Proses pencucian diulang sebanyak 2-3 kali.
Ke dalam residu sampel di atas ditambahkan 3.0 mL akuades dan 1.5 mL larutan KOH 4 M, lalu diaduk dengan menggunakan vorteks dan didiamkan selama 30 menit pada suhu ruang. Secara berturut-turut ke dalam sampel tersebut ditambahkan 2.75 mL 2 M HCl dan 1.5 mL bufer sodium asetat pH 4.75 dan 40 µl enzim amilo-glukosidase. Sebelum diinkubasi pada suhu 60 oC selama 45 menit, sampel diaduk dengan menggunakan vorteks dalam penangas air bergoyang. Sampel kemudian disentrifus (15 menit, 3000 g), kemudian bagian supernatan diambil dan dimasukkan ke dalam labu takar. Bagian residu dicuci dengan 10.0 mL akuades, lalu disentrifus kembali. Bagian supernatan kemudian dicampurkan dengan supernatan sebelumnya. Sebanyak 25.0-1000.0 mL sampel diencerkan dengan akuades (tingkat pengenceran tergantung pada kandungan pati resisten dalam sampel).
Sebanyak 0.5 mL sampel dimasukkan ke dalam tabung reaksi, kemudian ditambahkan 0.5 mL fenol 5% dan dihomogenkan dengan menggunakan vorteks. Sebanyak 2.5 mL larutan H2SO4 pekat lalu ditambahkan secara cepat ke dalam tabung reaksi, sehingga terjadi reaksi eksoterm yang menghasilkan panas. Larutan sampel kemudian didiamkan selama 10 menit pada suhu ruang, diaduk dengan vorteks dan didiamkan kembali selama 20 menit pada suhu ruang. Nilai absorbansi diukur dengan spektrofotometer UV-Vis pada panjang gelombang 490 nm. Kadar glukosa
(μg/mL) ditentukan dengan menggunakan kurva standar. Kadar pati resisten
(%bb) dihitung dengan mengalikan kadar glukosa dalam sampel dengan faktor 0.9.
2.6 Analisis Kadar Amilosa (IRRI 1978)
Kadar amilosa dianalisis dengan metode spektroskopi. Analisis kadar amilosa mencakup tahapan pembuatan kurva standar larutan amilosa dan analisis sampel sebagai berikut.
a. Pembuatan Kurva Standar Amilosa
14
dan 1.0 mL larutan asam asetat 1 N. Sebanyak 2.0 mL larutan iod (0.2 g I2 dan 2.0 g KI yang dilarutkan dalam 100.0 mL air destilata) dipipet ke dalam setiap labu, lalu ditambahkan air destilata hingga tanda tera. Larutan dibiarkan selama 20 menit dan diukur absorbansinya dengan spektrofotometer UV-Vis pada panjang gelombang 625 nm. Persamaan dan kurva standar dibuat sebagai hubungan antara kadar amilosa (sumbu x) dan absorbansi (sumbu y).
b. Analisis Sampel
Sebanyak 100.0 mg sampel pati garut dimasukkan ke dalam labu takar 100 mL, kemudian ditambahkan 1.0 mL etanol 95 % dan 9.0 mL larutan NaOH 1 N. Labu takar ini lalu dipanaskan dalam penangas air pada suhu 95 ºC selama 10 menit. Setelah didinginkan, larutan gel pati ditambahkan air destilata sampai tanda tera dan dihomogenkan. Dari labu takar ini dipipet 5.0 mL larutan gel pati dan dipindahkan ke dalam labu takar 100 mL. Ke dalam labu takar tersebut kemudian ditambahkan 1.0 mL larutan asam asetat 1 N dan 2.0 mL larutan iod, lalu ditambah akuades hingga tanda tera. Larutan sampel ini dibiarkan selama 20 menit pada suhu ruang sebelum diukur absorbansinya dengan spektrofotometer UV-Vis pada panjang gelombang 625 nm. Kadar amilosa (dalam persen) ditentukan dengan menggunakan persamaan kurva standar larutan amilosa.
Analisis Statistik
Analisis sidik ragam dilakukan untuk mengetahui ada tidaknya perbedaaan di dalam variabel-variabel yang diuji dalam hal ini adalah karakteristik kimia terhadap perlakuan modifikasi pada pati garut. Apabila nilai signifikansi (α) yang dihasilkan dari output ANOVA menunjukkan nilai kurang dari 5% (0.05), maka ada perbedaan
yang signifikan antar variabel yang diuji, dan sebaliknya. Αlfa (α) merupakan
besarnya kesalahan (error) yang masih bisa diterima dalam pengujian. Setelah ditemukan adanya perbedaan yang signifikan, maka dilakukan uji lanjut Duncan. Output yang dihasilkan berupa subset-subset dimana sampel-sampel yang berada pada subset yang sama berarti tidak memiliki perbedaan yang signifikan, sedangkan sampel-sampel yang berada pada subset yang berbeda berarti memiliki perbedaan
yang signifikan pada α = 0.05. Analisis sidik ragam ini menggunakan software SPSS 22.00.
HASIL DAN PEMBAHASAN
Pengaruh Modifikasi Pati Garut terhadap Kadar Amilosa dan Kadar Pati Resisten
15 (native) (Gambar 2). Kadar pati resisten semakin meningkat dengan adanya perlakuan HMT 15 menit (HAD-HMT15’) dan 60 menit (HAD-HMT60’) menjadi 52.59% dan 54.11%. Nilai ini lebih besar dibanding perlakuan yang dilakukan oleh Syahbanu (2015) dan perlakuan Anand (2015) dengan kadar pati resisten tertinggi sebesar 29.63% dan 48.59% (Tabel 1). Hal ini terjadi karena pada perlakuan Syahbanu (2015) dan Anand (2015), perlakuan hidrolisis pati menggunakan asam dan enzim dilakukan secara terpisah, sedangkan pada penelitian ini hidrolisis asam (HA) dan hidrolisis enzimatis (debranching) dikombinasikan secara bersama.
Cara kerja asam pada proses HA adalah dengan menghidrolisis secara acak
ikatan α-1,4 yang menghubungkan rantai-rantai amilosa dan beberapa ikatan α-1,6 pada rantai cabang amilopektin menghasilkan rantai-rantai amilosa yang lebih pendek dan berbobot molekul rendah (Lehmann et al. 2003). Adapun hidrolisis secara enzimatis dilakukan dengan cara menghidrolisis ikatan glikosidik pada titik
percabangan (α-1,6) rantai amilopektin. Proses debranching menggunakan enzim pullulanase dilakukan untuk memperoleh rantai glukan yang lurus dan berbobot molekul rendah yang diharapkan DPnya sesuai untuk pembentukan RS 3, serta rantai polimer rekristalisasi. (Guraya et al. 2001, Yin et al. 2007). Hasil dari proses
debranching berupa campuran unit rantai linier dengan panjang beragam, yang kemudian dapat memicu terjadinya retrogradasi pati.
Penggabungan HA dengan debranching memungkinkan jumlah amilosa rantai pendek semakin tinggi, bisa dilihat berdasarkan peningkatan kadar amilosa sampel dari 24.50% (NA) menjadi 50.84% (HADAC) dan berbeda pada taraf signifikansi 5% (Gambar 3). Pengaruh debranching terhadap kadar RS 3 juga dilaporkan oleh Gonzales-Soto et al. (2007). Mereka melakukan proses modifikasi pati pisang melalui proses debranching-autoclaving-cooling dengan menggunakan enzim pulullanase pada berbagai konsentrasi (0.5, 2.6, 5.3, 10.6, 15.9 dan 21.1 U/g pati) pada suhu inkubasi 50 oC dengan selang waktu 2-10 jam. Hasilnya menunjukkan bahwa penggunaan enzim pullulanase pada konsentrasi 10.6 U/g pati dengan waktu inkubasi 5 jam memberikan kadar RS 3 yang optimal. Hasil ini tidak berbeda jauh dengan penelitian yang dilakukan Faridah (2011) pada pati garut yang menunjukkan peningkatan kadar RS 3 optimal terjadi pada penambahan enzim pullulanase sebesar 10.4 U/g pati dan digunakan sebagai acuan pada penelitian ini.
Gambar 2 Kadar pati resisten sampel modifikasi pati garut. NA=Pati Alami; HA=Hidrolisis asam dengan HCl 2.2 N selama 2 jam; AC=3 siklus
autoclaving-cooling; D=debranching dengan enzim pullulanase 10.4 U/g
pati; HMT15’=perlakuan HMT selama 15 menit; HMT60’=perlakuan HMT
16
selama 60 menit. Angka pada histogram yang disertai huruf yang berbeda
menyatakan berbeda nyata (α=0.05)
Tabel 1 Kadar pati resisten pada pati garut alami dan termodifikasi Perlakuan Sampel Kadar Pati Resisten (%BK)
Native (NA) 2.15
Keterangan : kadar pati resisten dalam satuan g/100g berat sampel * : data penelitian sebelumnya oleh Syahbanu (2015)
** : data penelitian sebelumnya oleh Anand (2015)
Peningkatan kadar pati resisten pada pati garut termodifikasi erat kaitannya dengan peningkatan kadar amilosa pada sampel tersebut. Pada Gambar 3 dapat dilihat bahwa kadar amilosa pati garut meningkat dari 50.84% (HADAC) menjadi 55.60% (HADAC-HMT15’) dan 57.74 % (HADAC-HMT60’), berbanding lurus dengan peningkatan kadar pati resistennya. Berdasarkan Gambar 4 dapat dilihat bahwa kadar pati resisten berkorelasi positif dengan kadar amilosa dengan R2 = 0.9738. Hidrolisis secara lambat oleh asam dan debranching dapat memperpendek
panjang rantai α-glukan sehingga derajat polimerisasi (DP) menurun. Schmiedl et al. (2000) menunjukkan bahwa nilai DP antara 10-35 cukup optimal untuk meningkatkan kadar RS 3. Mutungi et al. (2009) melakukan proses debranching pati singkong dengan enzim pullulanase (25 U/g pati) selama 24 jam. Proses debranching dilakukan setelah pemanasan di dalam otoklaf pada 121 oC selama 15 menit. Hasil modifikasi tersebut dapat meningkatkan kadar RS 3 dari 21.4% menjadi 88.4%. Peningkatan kadar RS 3 yang menyolok ini berhubungan dengan peningkatan jumlah fraksi amilosa rantai pendek (DP 10-24) sebesar 58.9%. Sebagaimana telah dijelaskan oleh Lehmann et al. (2003), rantai glukan dengan DP<10 dapat menghalangi pembentukan RS 3. Proses penghilangan rantai glukan dengan DP<10 juga berkontribusi pada peningkatan peluang terjadinya pembentukan RS 3.
17 Faridah et al. 2010), sehingga penggabungan kedua metode ini dapat membuat kadar amilosa yang terukur meningkat. Retrogradasi mudah terjadi pada sebagian rantai amilosa sebagai struktur linear yang memfasilitasi ikatan silang dengan adanya ikatan hidrogen. Selama retrogradasi, molekul pati kembali membentuk struktur kompak yang distabilkan dengan adanya ikatan hidrogen (Sajilata et al., 2006). Hal inilah yang mengakibatkan kadar RS 3 pada penelitian ini lebih tinggi dibanding pada penelitian sebelumnya yang melakukan proses HA (Syahbanu 2015) dan debranching (Anand 2015) secara terpisah. Proses HA dan debranching
sebelum proses autoclaving-cooling ditujukan untuk memperoleh lebih banyak jumlah rantai-rantai glukan dengan DP yang optimal untuk pembentukan RS 3. Pada penelitian ini juga dilakukan proses autoclaving-cooling (AC) yang memiliki peran penting dalam membantu proses hidrolisis pati. Pemanasan diatas suhu
100 °C dapat meningkatkan pembentukan RS 3. Perlakuan pemanasan dan penyimpanan (cooling) secara berulang erat kaitannya dengan penurunan daya cerna pati yang disebabkan oleh peningkatan pembentukan RS 3 (Milasinovic et al. 2010).
Berdasarkan penelitian yang telah dilakukan oleh Faridah (2011) terhadap pati garut, diperoleh data bahwa perlakuan 3 kali siklus AC cukup efektif untuk meningkatkan kadar RS 3 pati garut sebanyak 5 kali lipat (10.91%) dibanding pati garut alami (2.12%), dan tidak berbeda nyata dengan perlakuan 5 kali siklus AC (12.15%). Zhao dan Lin (2009) melaporkan bahwa pati pisang yang dihidrolisis dengan HCl 1N selama 6 jam yang dilanjutkan dengan proses pemanasan pada 121 oC selama 1 jam dan pendinginan pada 4 oC (proses dilakukan sebanyak 3 siklus) meningkatkan kadar RS 3 dari 1.51% menjadi 16.02%. Penelitian yang dilakukan oleh Milasinovic et al. (2010) terhadap pati jagung juga menunjukkan kadar pati resisten yang lebih tinggi pada 3 siklus AC (7.0%) dibanding 1 kali siklus (4.8%). Penelitian tersebut juga menunjukkan bahwa kadar RS 3 pati jagung yang disimpan pada suhu 4 oC tidak berbeda nyata dengan penyimpanan (cooling) pada suhu -20
oC. Hal tersebut mendukung proses cooling yang dilakukan pada penelitian ini,
yaitu 4 oC.
18
pada histogram yang disertai huruf yang berbeda menyatakan berbeda nyata
(α=0.05)
Hasil uji statistik menunjukkan bahwa semua perlakuan memberikan pengaruh yang berbeda nyata terhadap kadar amilosa dan kadar pati resisten sampel dibandingkan dengan kadar amilosa dan kadar pati resisten pati garut alami (Gambar 2 dan Gambar 3). Kadar amilosa dan kadar pati resisten sampel mengalami kenaikan yang signifikan pada taraf signifikansi 5% setelah proses HMT (Gambar 2 dan Gambar 3). Kadar RS 3 pada sampel HADAC-HMT15’ meningkat sebanyak 1.4 kali lipat dibanding sampel HADAC (Gambar 2). Pada perlakuan HMT terjadi perubahan karakteristik pati yang disebabkan oleh pembentukan kristal baru atau proses rekristalisasi dan penyempurnaan struktur kristalin pada granula pati yang terjadi selama proses modifikasi (Hoover 2010; Olayinka et al 2008; Ambigaipalan et al 2014). Pada tahap ini juga terjadi pembentukan struktur double helix (Ji et al. 2015), serta peningkatan interaksi ikatan antara rantai amilosa-amilosa, rantai amilopektin-amilopektin, serta rantai amilosa-amilopektin sehingga membentuk struktur yang lebih kompak dan stabil, yang terbentuk selama proses HMT (Zavareze dan Dias 2011; Faridah 2011).
Teknik HMT juga dapat meningkatkan asosiasi rantai pati antara rantai amilosa-amilosa dan atau rantai amilosa-amilosa-amilopektin pada area amorphous sehingga membentuk struktur yang kompak (Sun et al. 2013; Gunaratne dan Hoover 2002). Hasil penelitian yang dilakukan oleh Li et al. (2011) juga menunjukkan adanya peningkatan kadar pati resisten selama proses HMT terhadap pati kacang hijau.
Gambar 4 Hubungan antara kadar pati resisten dengan kadar amilosa sampel. NA=Pati Alami; HA=Hidrolisis asam dengan HCl 2.2 N selama 2 jam; AC=3 siklus
autoclaving-cooling; D=debranching dengan enzim pullulanase 10.4 U/g pati;
HMT15’=perlakuan HMT selama 15 menit; HMT60’=perlakuan HMT selama
60 menit. Angka pada histogram yang disertai huruf yang berbeda menyatakan
berbeda nyata (α=0.05)
Perlakuan HMT selama 60 menit (HADAC-HMT60’) tidak menunjukkan peningkatan yang signifikan terhadap kadar amilosa dan kadar pati resisten dibandingkan dengan sampel yang hanya diberi perlakuan HMT selama 15 menit
19 (HADAC-HMT15’). Hal ini sesuai dengan penelitian yang telah dilakukan oleh Kittipongpattana OS dan Kittipongpattana N (2014) terhadap pati biji nangka. Pada penelitian ini dilakukan pengukuran terhadap kadar pati resisten biji nangka yang diberi perlakuan HMT dengan berbagai suhu, kadar air, dan waktu. Hasil penelitian menunjukkan bahwa kadar RS tertinggi (52.2%) diperoleh dari sampel dengan kadar air 25%, diinkubasi pada suhu 80 oC selama 16 jam. Berdasarkan parameter yang diuji, ternyata waktu perlakuan HMT memiliki efek yang kecil terhadap peningkatan kadar RS dibandingkan dengan suhu dan kadar air sampel.
Pengaruh Modifikasi Pati Garut terhadap Daya Cerna Pati, dan Total Pati
Daya cerna pati (DCP) memiliki hubungan yang terbalik dengan kadar pati resisten pada pangan. Semakin besar kadar pati resistennya, semakin kecil daya cerna pati pangan tersebut. Peningkatan pati resisten juga berbanding terbalik dengan jumlah total pati yang tersedia pada sampel (R2= 0.9257) (Gambar 7). Berdasarkan Gambar 5, DCP pati termodifikasi menurun dari 84.92% (NA) ke 44.94% (HADAC), 25.98% (HADAC-HMT15’), dan 24.22% (HADAC-HMT60’). Melalui proses retrogradasi yang terjadi selama pendinginan (cooling), rantai-rantai amilosa berasosiasi kembali dengan membentuk ikatan double helix baru yang distabilkan oleh ikatan hidrogen. Meningkatnya persentasi kristalinitas pati ini dapat membuat pati lebih resisten terhadap suhu dan hidrolisis oleh enzim dalam saluran pencernaan, dengan mencegah interaksi antara enzim dan amilase pada pati, sehingga jumlah pati yang dapat dicerna semakin sedikit (Munio et al. 2015). Daya cerna pati garut pada semua perlakuan modifikasi menurun karena pada saat siklus
autoclaving-cooling terjadi penyusunan ulang molekul antara amilosa-amilosa atau amilosa-amilopektin, yang berakibat pada penguatan ikatan hidrogen pada pati, sehingga pati lebih sulit untuk dicerna (Shin et al. 2004).
Hal ini sesuai dengan penelitian yang dilakukan oleh Faridah (2011) terhadap pati garut yang menunjukkan bahwa pati garut yang dimodifikasi dengan hidrolisis asam, debranching pada konsentrasi 10.4 U/g pati dan siklus autoclaving-cooling
memberikan daya cerna yang paling rendah (54.81%) dengan kadar RS 3 paling tinggi (39.3%). Hasil penelitian yang dilakukan oleh Milasinovic et al. (2010) terhadap pati jagung juga menunjukkan bahwa perlakuan AC berulang dan
20
Gambar 5 Daya Cerna Pati sampel modifikasi pati garut. NA=Pati Alami; HA=Hidrolisis asam dengan HCl 2.2 N selama 2 jam; AC=3 siklus autoclaving-cooling; D=debranching dengan enzim pullulanase 10.4 U/g pati; HMT15’=perlakuan HMT selama 15 menit; HMT60’=perlakuan HMT selama 60 menit. Angka
pada histogram yang disertai huruf yang berbeda menyatakan berbeda nyata
(α=0.05).
Jumlah amilosa yang tersedia dan terbentuk selama modifikasi akan mempengaruhi proses retrogradasi yang terjadi. Semakin banyak amilosa rantai pendek yang tersedia, maka semakin banyak pati yang teretrogradasi membentuk ikatan double helix dan semakin banyak jumlah pati resisten yang terbentuk, sehingga pati lebih sulit lagi untuk dicerna. Hal inilah yang membuat kadar daya cerna pati termodifikasi semakin menurun dengan semakin kompleksnya perlakuan modifikasi (Gambar 5). Hasil uji statistik menunjukkan bahwa DCP pada semua sampel modifikasi berbeda nyata dibanding pati garut alami (NA), namun DCP pada sampel HADAC-HMT15’ tidak berbeda nyata dengan sampel HADAC
-HMT60’ pada taraf signifikansi 5%, bersesuaian dengan peningkatan kadar RS 3nya yang juga tidak berbeda nyata.
21
D=debranching dengan enzim pullulanase 10.4 U/g pati; HMT15’=perlakuan
HMT selama 15 menit; HMT60’=perlakuan HMT selama 60 menit. Angka pada histogram yang disertai huruf yang berbeda menyatakan berbeda nyata
(α=0.05)
Kadar total pati yang terdapat pada sampel juga berbanding terbalik dengan kadar pati resistennya (Gambar 7) dengan R2= 0.9257. Hal ini terjadi karena pada saat proses HA, yang terpotong bukan hanya amilosa rantai panjang dan amilopektin saja. Proses hidrolisis ini juga mengakibatkan rantai-rantai pendek amilosa pada pati tehidrolisis menjadi rantai-rantai glukan yang lebih pendek dan terukur sebagai gula-gula sederhana. Proses pembentukan gula-gula sederhana inilah yang menyebabkan jumlah total pati menurun. Pemanasan yang terjadi pada proses AC dan HMT juga dapat menyebabkan depolimerisasi rantai-rantai pendek amilosa, sehingga jumlah total pati yang terukur pada sampel NA (98.10%) lebih rendah dibanding sampel HADAC (61.11%), HADAC-HMT15’(60.26%), dan HADAC-HMT60’(56.23%) (Gambar 6).
Gambar 7 Hubungan antara pati resisten (RS) dan total pati
Pengaruh Modifikasi Pati Garut terhadap Kadar Gula Pereduksi
Kombinasi perlakuan hidrolisis asam, debranching, dan AC menghasilkan gugus aldosa yang terukur sebagai gula pereduksi. Fraksi amilosa rantai pendek yang terbentuk juga terhitung sebagai gula pereduksi, sehingga jumlah gula pereduksi yang terukur meningkat. Gambar 8 menunjukkan bahwa kadar gula pereduksi pada semua perlakuan meningkat jika dibandingkan dengan kadar gula pereduksi pati garut alami (4.92%) yaitu 13.23% (HADAC), 6.86%
(HADAC-HMT15’), dan 5.53% (HADAC-HMT60’). Berdasarkan penelitian yang telah dilakukan Syahbanu (2015), kadar gula pereduksi ini berbanding lurus dengan kadar pati resisten. Namun pada penelitian ini kadar gula pereduksi berbanding terbalik dengan kadar pati resisten (R2=0.0237) (Gambar 9). Hal ini terjadi karena adanya reaksi Maillard yang terjadi pada sampel yang mengalami perlakuan
debranching dan HMT. Reaksi Maillard terjadi karena adanya interaksi antara asam
22
amino dan gula pereduksi pada suhu tinggi (Bastos et al. 2012). Sampel yang mengalami debranching memiliki kadar protein (asam amino) yang lebih tinggi (2.36%) dari enzim pullulanase yang digunakan, dibanding dengan pati garut alami (0.21%) (Tabel 2), sehingga dapat memicu reaksi Maillard.
Gambar 8 Kadar gula pereduksi sampel modifikasi pati garut. NA=Pati Alami; HA=Hidrolisis asam dengan HCl 2.2 N selama 2 jam; AC=3 siklus
autoclaving-cooling; D=debranching dengan enzim pullulanase 10.4 U/g pati;
HMT15’=perlakuan HMT selama 15 menit; HMT60’=perlakuan HMT
selama 60 menit. Angka pada histogram yang disertai huruf yang berbeda
menyatakan berbeda nyata (α=0.05).
Gambar 9 Hubungan gula pereduksi dan pati resisten pada pati garut alami (NA), sampel HADAC, HADAC-HMT15’ dan HADAC-HMT60’
Reaksi Maillard yang terjadi menyebabkan jumlah gula pereduksi yang terukur dalam analisis sampel yang mengalami debranching menurun, karena sudah digunakan dalam reaksi Maillard. Menurut Ericksson (1981), salah satu faktor yang mempengaruhi reaksi Maillard yaitu suhu dan waktu pemanasan. Semakin lama waktu dan semakin tinggi suhu yang digunakan, maka reaksi
0,00 2,00 4,00 6,00 8,00 10,00 12,00 14,00
23
Maillard akan terjadi lebih banyak lagi. Pati garut yang dimodifikasi dengan
debranching, autoclaving-cooling, dan HMT 60 menit memiliki kadar gula pereduksi yang lebih rendah dibanding pati dengan perlakuan debranching,
autoclaving-cooling, dan HMT 15 menit. Hal ini terjadi karena waktu pemanasan
pada proses HMT60’ yang lebih lama dibanding HMT15’ dan adanya pemanasan pada oven suhu 50 oC, sehingga reaksi Maillard terjadi lebih banyak dan kadar gula pereduksi yang terukur semakin sedikit.
Tabel 2. Analisis Proksimat Pati Garut
Komponen % Kadar
Air1 11.26 ± 0.16
Abu1 0.43 ± 0.01
Protein1 0.21 ± 0.00
Protein2 3.01 ± 0.77
Lemak1 0.62 ± 0.02
Karbohidrat1 98.74 ± 0.30
* Semua data dilaporkan dalam basis kering, kecuali kadar air, dan merupakan hasil rata-rata dari dua kali ulangan
1 Pati Garut Alami (Syahbanu 2015)
2 Pati Garut dengan Debranching-AC (Anand 2015)
SIMPULAN DAN SARAN
Simpulan
Penelitian ini menunjukkan bahwa semua perlakuan modifikasi pati garut dapat meningkatkan kadar RS 3 dan dapat menurunkan daya cerna patinya. Kadar pati resisten tertinggi (54.11%) diperoleh dari modifikasi pati garut dengan hidrolisis asam, debranching, tiga siklus autoclaving‒cooling dan HMT dengan pemanasan menggunakan otoklaf selama 60 menit. Perlakuan ini juga memberikan nilai daya cerna pati terendah sebesar 24.22 %. Namun nilai ini tidak berbeda nyata dengan perlakuan HADAC-HMT 15’ yang memberikan kadar pati resisten sebesar 52.59% dan daya cerna pati sebesar 25.98%. Nilai ini menunjukkan bahwa perlakuan modifikasi HA, debranching, 3 kali siklus AC dan HMT selama 15 menit sudah efektif untuk meningkatkan kadar RS 3 tanpa harus melakukan HMT selama 60 menit. Berdasarkan hal tersebut, dapat dipilih perlakuan
HADAC-HMT15’ untuk meningkatkan kadar RS 3 karena waktu yang diperlukan lebih pendek dengan hasil yang baik.
Saran
24
tersebut. Penelitian ini juga memerlukan perlakuan secara kontinyu untuk mendapatkan hasil yang optimal, sehingga perlu diperhatikan alokasi waktu penelitian secara baik dan tepat.
DAFTAR PUSTAKA
Ambigaipalan P, Hoover R, Donner E, Liu Q. 2014. Starch chain interactions within the amorphous dan crystalline domains of pulse starches during heat moisture treatment at different temperatures dan their impact on physicochemical properties. Food Chem. 143:175–184.
Anand C. 2015. Modifikasi pati garut (Maranta arundinaceae L.) dengan metode debranching, siklus autoclaving-cooling, dan heat moisture treatment (HMT) untuk menghasilkan pati resisten tipe III (RS 3) [skripsi]. Bogor (ID): Institut Pertanian Bogor
[AOAC]. Analysis of the Association of Official Agriculture Chemistry. 2012. Official Methods of Analysis of AOAC International. Vol II. 19th Edition. Gaithersburg, Maryland (US).
Aparicio-Saguilan, Flores-Huicochea E, Tovar J, García-Suárez F, Gutiérrez-Meraz F, Bello-Pérez LA. 2005. Resistant starch-rich powders prepared by auto-claving of native and lintnerized banana starch: partial characterization. Starch/ Starke 57:405-412.
Bastos DM, Monaro E, Siguemoto E, Sefora M. 2012. Maillard Reaction Products in Processed Food: Pros dan Cons. Food Industrial Processes- Methods and Equipment, Dr. Benjamin Valdez (Ed). 281-300 InTech.
Brumovsky JO, Thompson DB. 2001. Production of boiling-stabel granular resistant starch by partial acid hydrolysis dan hydrothermal treatments of high amylose maize starch. Cereal Chem. 78:680–689.
Diane FB, Terri B, Suzanne H, Jay-Lin J, James H, Li Li, John M, Samuel M, Gregory JP, Matthew R et al. 2013. Resistant Starch: Promise for Improving Human Health. Adv. Nutr. 4:587–601.
Dubois M, Gilles KA, Hamilton JK, Rebers PA, Smith F. 1956. Calorimetric method for determination of sugars and related substance. Anal. Chem. 28:350-356.
Ericksson C. 1981. Maillard Reaction in Food: Chemical, Physiological and Technological Aspect. Oxford (GB): Pergamon Pr.
Faridah DN, Fardiaz D, Danarwulan N, Sunarti TC. 2010. Perubahan struktur pati garut (Marantha arundinaceae L.) sebagai akibat modifikasi hidrolisis asam, pemotongan titik percabangan, dan siklus pemanasan-pendinginan. J Teknol Indust Pangan 21(2):135-142.
Faridah DN. 2011. Perubahan karakteristik kristalin pati garut (Marantha arundinacea L.) dalam pengembangan pati resisten tipe III. [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Faridah DN, Fardiaz D, Danarwulan N, Sunarti TC. 2014. Karakteristik sifat fisikokimia pati garut(Maranta arundinaceae L.). J Agritech 34(1):15-21.
25 Gonzalez-Soto et al. 2007. The influence of time dan storage temperature on
resistant starch formation from autoclaved debranched banana starch. Food Res. Int. 40:304-310.
Gunaratne A, Hoover R. 2002. Effect of heat-moisture treatment on the structure and physicochemical properties of tuber and root starches. Carbohydr. Chem. 49:425–437.
Guraya HS, James T, Champagne ET. 2011. Effect of cooling and freesing on the digestibility of debranched rice starch and physical properties of the resulting material. Starch/Starke 53:64
Haub Mark D, Kelcie LH, Enas K Al-tamimi, Sammy O, Paul AS. 2009. Different types of resistant starch elicit different glucose reponses in humans. J Nutr. Metabol.
Hizukuri S, Kaneko T, Takeda Y. 1983. Measurement of the chain length of amylopectin dan its relevance to the origin of crystalline polymorphism of starch granules. Biochim. Biophys. Acta 760:188–191.
Hoover R. 2010. The impact of heat-moisture treatment on molecular structures and properties of starches isolated from different botanical sources. Critic. Rev. in Food Sci. and Nutr. 50(9): 835-847
[IRRI] International Rice Research Institute. 1978. Rice Research and Production
In China : An IRRI Team’s View. Los Banos (PH): IRRI.
Jayakody L, Hoover R. 2002. The effect of lintnerization on cereal starch granules. Food Res. Int. 35:665-680.
Ji N, Li , Qiu C, Li G, Sun Q, Xiong L. 2015. Effects of heat moisture treatment on the physicochemical properties of starch nanoparticles. Carbohydr. Chem. 117:605-609.
Kittipongpatana Ornanong S, Kittipongpatana Nisit. 2014. Resistant Starch Contents of Native and Heat-Moisture Treated Jackfruit Seed Starch. Sci. World J.
Lehmann U, Jacobasch G, Schmiedl D. 2002. Characterization of resistant starch type III from banana (Musa acuminata). J. Agric. Food Chem. 50:5236-5240. Lehmann U, Rossler C, Schmiedl D Jacobash G. 2003. Production and physico-chemical characterization of resistant strach type 3 derived from pea strach. Nahrung/Food 43:60-63.
Leong YH, Karim AA, Norziah MH. 2007. Effect of pullulanase debranching of sago (Metroxylon sagu) starch at subgelatinization temperature on the yield of resistant starch. Starch/Starke 59:21-32.
Li S, Ward R, Gao Q. 2011. Effect of heat moisture treatment on the formation dan physicochemical properties of resistant starch from mung bean (Phaseolus radiatus) starch. Food Hydrocol. 25:1702-1709.
Liu H, Liang R, Antoniou J, Liu F, Shoemaker CF, Li Y. 2014. The effect of high moisture heat-acid treatment on the structure dan digestion property of normal maize starch. Food Chem. 159:222–229.
Miao M, Jiang B, Zhang T. 2009. Effect of pullulanase debranching and recrystallization on structure and digestibility of waxy maize starch . Carbohydr. Polym. 76:214–221.
26
Mun SH, Shin M. 2006. Mild hydrolysis of resistant starch from maize. Food Chem. 96:115-121.
Mutungi C, Rosta F, Onyangob C, Jarosa D, Rohma H. 2009. Crystallinity, thermal dan morphological characteristics of resistant starch type III produced by hydrothermal treatment of debranched cassava starch. Starch/Starke 61:1-12. Nugent AP. 2005. Health properties of resistant starch. British Nutrition Foundation
(GB). Nutr. Bull. 30:27–54.
Olayinka OO, Adebowale KO, Olu-Owolabi BI. 2008. Effect of heat moisture treatment on phsycochemical properties of white shorgum starch. Food Hydrocol. 22:225-230.
Ozturk S, Koksel H, Kahraman K, Ng PKW. 2009. Production of resistant starch samples prepared from two high-amylose maize starches through debranching and heat treatments. Cereal Chem. 86:503-510
Pongjanta J, Utaipattanaceep O, Naivikul, Piyachomkwan K. 2009. Debranching
enzyme concentration effected on physicochemical properties and α-amylase hydrolysis rate of resistant starch type III from amylose rice starch. Carbohydr. Polym. 78:5–9.
Ratnayake WS, Jackson DS. 2008. Thermal behavior of resistant starches RS 2, RS 3, and RS 4. Food Sci. 73(5):356–366.
Sajilata MG, Singhal RS, Kulkarni PR. 2006. Resistant starch - a review. Comprehen. Rev. in Food Sci. Food Saf. 5:1–17.
Sanz T, Salvador A, Baixauli R, Fiszman SM. 2009. Evaluation of four types of resistant starch in muffins. II. Effects in texture, colour and consumer response. Eur Food Res. Technol. 229(2):197–204.
Schmiedl D, Bauerlein M, Bengs H, Jacobasch G. 2000. Production of heat stable, butyrogenic resistant starch. Carbohydr. Chem. 43:183-193
Shin S, Byun J, Park KW, Moon TW. 2004. Effect of partial acid dan heat moisture treatment of formation of resistant tuber starch. Cereal Chem. 81(2):194-198. Shu X, Jia L, Gao J, Sing Y, Zhao H, Nakamura Y, Wu D. 2007. the influence of
chain length of amilopectin on resistant starch in rice (Oryza sativa L). Starch/Starke 59:504-509.
Srichuwong S. 2006. starches from different plant origins:from structure to physicochemical properties. [disertasi]. Mie (JP): Mie University.
Sun Q, Wang T, Liu X, Zhao Y. 2013. The effect of heat moisture treatment on physicochemical properties of early indica rice. Food Chem. 141:853–857. Syahbanu F. 2015. Modifikasi pati garut (Maranta arundinaceae L.) dengan
hidrolisis asam, siklus autoclaving – cooling, dan heat moisture treatment (hmt) untuk menghasilkan pati resisten tipe III (RS 3) [skripi]. Bogor (ID): Institut Pertanian Bogor.
Zaragoza EF, Navarrete MJR, Zapata ES, Alvarez JAP. 2010. Resistant starch as functional ingredient: a review. Food Res. Int. 43:931–942.
Zavareze ER, Dias ARG. 2011. Impact of heat moisture treatment and annealing in starches: a review. Carbohydr. Chem. 83:317-328.
27
LAMPIRAN 1
ANOVA Amylose
Content
Sum of Squares Df
Mean
Square F Sig.
Between Groups 2242,704 3 747,568 504,245 ,000
Within Groups 8,895 6 1,483
Total 2251,600 9
Post Hoc Tests
Amylose Content Duncana,b
Sample
Treatment N
Subset for alpha = 0.05
1 2 3
1 4 24,5000
2 2 50,8400
3 2 55,5950
4 2 57,7450
Sig. 1,000 1,000 ,108
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 2,286.
b. The group sizes are unequal. The harmonic mean of the group sizes is used. Type I error levels are not guaranteed.
ANOVA RS
Sum of
Squares Df
Mean
Square F Sig.
Between Groups 5869,290 3 1956,430 2565,579 ,000
Within Groups 6,101 8 ,763
28
RS Duncana,b
Sample N
Subset for alpha = 0.05
1 2 3
1 4 2,1500
2 3 36,3047
3 3 52,5932
4 2 54,1064
Sig. 1,000 1,000 ,073
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 2,824.
b. The group sizes are unequal. The harmonic mean of the group sizes is used. Type I error levels are not guaranteed.
ANOVA Starch Digestibility
Sum of Squares df
Mean
Square F Sig.
Between Groups
8013,076 3 2671,025 2567,707 ,000 Within Groups
8,322 8 1,040
Total 8021,398 11
Post Hoc Tests
Starch Digestibility
Duncana,b
Sample Treatment N
Subset for alpha = 0.05
1 2 3
4 2 24,2200
3 3 25,9800
2 3 44,9400
1 4 84,9150
Sig. ,074 1,000 1,000
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 2,824.