OPTIMASI PRODUKSI ANTIMIKROBA DARI
Lactobacillus
plantarum
LIPI13-2-BAL011 DENGAN SIMULASI
PERMUKAAN RESPON
AYU SYAFITRI S
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi berjudul Optimasi Produksi Antimikroba dari Lactobacillus plantarum LIPI13-2-BAL011 Dengan Simulasi Permukaan Respon adalah benar karya saya sebagai bagian dari kegiatan penelitian di Pusat Penelitian Bioteknologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong, Bogor dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
ABSTRAK
AYU SYAFITRI S. Optimasi Produksi Antimikroba dari Lactobacillus plantarum LIPI13-2-BAL011 dengan Simulasi Permukaan Respon. Dibimbing oleh SYAMSUL FALAH dan ROHMATUSSOLIHAT.
Lactobacillus plantarum merupakan spesies bakteri asam laktat (BAL) yang telah banyak digunakan sebagai antimikroba. Penelitian ini bertujuan melakukan optimasi produksi antimikroba dari L. plantarum LIPI13-2-BAL011 menggunakan simulasi permukaan respon (RSM) terhadap Staphylococcus aureus, Bacillus subtilis dan Candida albicans. Optimasi produksi isolat L. plantarum dilakukan dengan kombinasi glukosa, NaCl, inokulum, dan suhu berbeda selama 48 jam. Aktivitas daya hambat dilakukan dengan metode difusi cakram dan dilusi cair. Isolat L. plantarum LIPI13-2-BAL011 lebih optimal menghasilkan senyawa antimikroba dalam media cair de Mann Rogose Sharpe (MRS) pada keadaan statis. Kondisi optimum produksi antimikroba terhadap S. aureus dengan persen penghambatan representatif 99.34% adalah menggunakan substrat glukosa 1.99%, NaCl 3.01%, inokulum 3.74%, dan suhu 31.6 oC. Kondisi optimum produksi antimikroba terhadap C. albicans dengan indeks zona bening representatif 1.9160 adalah glukosa 1.63%, NaCl 3.4%, inokulum 3.03%, dan suhu 33.74 oC. Kondisi optimum produksi antimikroba terhadap B. subtilis tidak dapat ditentukan dengan faktor dan variabel yang digunakan.
Kata kunci: antimikroba, Lactobacillus plantarum LIPI13-2-BAL011, RSM
ABSTRACT
AYU SYAFITRI S. Optimization of Antimicrobial Production from Lactobacillus plantarum LIPI13-2-BAL011 Using Response Surface Methodology. Supervised by SYAMSUL FALAH and ROHMATUSSOLIHAT.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
OPTIMASI PRODUKSI ANTIMIKROBA DARI
Lactobacillus
plantarum
LIPI13-2-BAL011 DENGAN SIMULASI
PERMUKAAN RESPON
AYU SYAFITRI S
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian ini ialah Optimasi Produksi Antimikroba dari Lactobacillus plantarum 13-2-BAL011 dengan Simulasi Permukaan Respon. Penelitian ini dilaksanakan pada bulan Januari - Mei 2015 di Laboratorium Mikrobiologi Terapan, Pusat Penelitian (Puslit) Bioteknologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong, Bogor.
Terima kasih penulis ucapkan kepada Bapak Dr Syamsul Falah, SHut MSi dan Ibu Rohmatussolihat, SSi MSi selaku pembimbing yang telah banyak memberi saran, kritik, dan bimbingan. Terima kasih juga penulis sampaikan kepada Puslit Bioteknologi LIPI Cibinong yang telah mendanai penelitian ini, serta Pak Kukun, Kak Mira, dan Kak Joni dari Puslit Bioteknologi LIPI Cibinong yang telah membantu penulis dalam menyelesaikan penelitian ini. Terima kasih juga penulis sampaikan kepada Kak Nia, Qudsi dan Shareen selaku teman-teman satu bimbingan, serta Kak Wulan, Muzakkir, dan Kak Bambang yang telah membantu dan memberi dukungan kepada penulis. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, Ninis dan Rani atas doa, semangat, dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL viii
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN viii
PENDAHULUAN 1
METODE 2
Bahan dan Alat 2
Metode 2
HASIL 4
Medium Terseleksi untuk Produksi Senyawa Antimikroba 4 Kondisi Optimum Produksi Senyawa Antimikroba terhadap S. aureus 5 Kondisi Optimum Produksi Senyawa Antimikroba terhadap B. subtilis 7 Kondisi Optimum Produksi Senyawa Antimikroba terhadap C. albicans 8
PEMBAHASAN 11
Medium Terseleksi untuk Produksi Senyawa Antimikroba 11 Kondisi Optimum Produksi Senyawa Antimikroba terhadap S. aureus 11 Kondisi Optimum Produksi Senyawa Antimikroba terhadap B. subtilis 12 Kondisi Optimum Produksi Senyawa Antimikroba terhadap C. albicans 14
SIMPULAN DAN SARAN 15
Simpulan 15
Saran 15
DAFTAR PUSTAKA 16
LAMPIRAN 19
DAFTAR TABEL
1 Seleksi medium pertumbuhan L. plantarum LIPI13-2-BAL011 4 2 Matriks Central Composite Design dan nilai eksperimental indeks
zona bening dan penghambatan terhadap mikroba patogen indikator 6 3 ANOVA untuk model permukaan respon kuadratik penapisan metode
dilusi cair terhadap S. aureus 7
4 ANOVA untuk model permukaan respon kuadratik penapisan metode
difusi cakram terhadap C. albicans 8
5 ANOVA untuk model permukaan respon kuadratik penapisan metode
dilusi cair terhadap C. albicans 10
DAFTAR GAMBAR
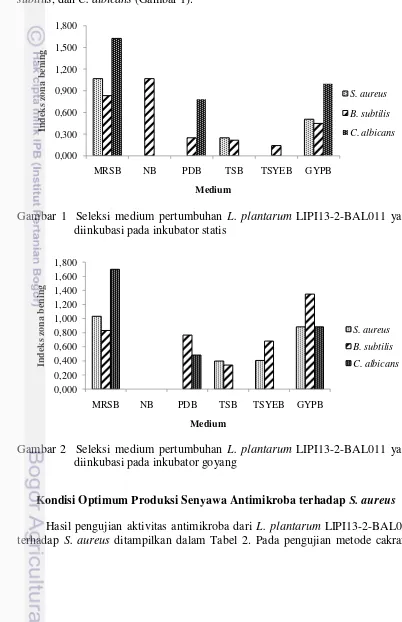
1 Seleksi medium pertumbuhan L. plantarum LIPI13-2-BAL011 yang
diinkubasi pada inkubator keadaan statis 5
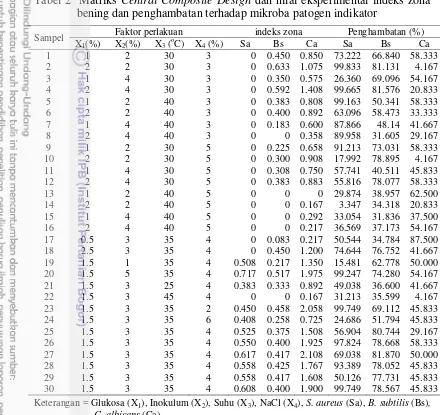
2 Seleksi medium pertumbuhan L. plantarum LIPI13-2-BAL011 yang
diinkubasi pada inkubator goyang 5
3 Permukaan respon aktivitas antimikroba bentuk tiga dimensi terhadap persen penghambatan pada S. aureus (Y) yang menggambarkan hubungan (a) variabel glukosa (X1) dan NaCl (X4); (b) variabel
inokulum (X2) dan NaCl (X4); (c) variabel suhu (X3) dan NaCl (X4) 7
4 Permukaan respon aktivitas antimikroba bentuk tiga dimensi terhadap indeks zona bening pada C. albicans (Y) yang menggambarkan hubungan (a) variabel glukosa (X1) dan suhu (X3); (b) variabel
glukosa (X1) dan NaCl (X4); (c) variabel inokulum (X2) dan suhu
(X3); (d) variabel inokulum (X2) dan NaCl (X4); (e) variabel suhu
(X3) dan NaCl (X4) 9
5 Permukaan respon aktivitas antimikroba bentuk tiga dimensi terhadap persen penghambatan pada C. albicans (Y) yang menggambarkan hubungan (a) variabel glukosa (X1) dan inokulum (X2); (b) variabel
glukosa (X1) dan suhu (X3); (c) variabel glukosa (X1) dan NaCl (X4) 10
6 Mekanisme kerja senyawa antimikroba terhadap sel bakteri 13 7 Mekanisme kerja senyawa antimikroba terhadap sel khamir 15
DAFTAR LAMPIRAN
1 Bagan alir penelitian 20
2 ANOVA untuk model permukaan respon kuadratikpenapisan metode
difusi cakram terhadap S. aureus 20
3 ANOVA untuk model permukaan respon kuadratikpenapisan metode
difusi cakram terhadap B. subtilis 21
4 ANOVA untuk model permukaan respon kuadratikpenapisan metode
dilusi cair terhadap B. subtilis 22
5 Koefisien regresi dan signifikansi dari model permukaan respon kuadratik penapisan metode dilusi cair terhadap S. aureus 23 6 Koefisien regresi dan signifikansi dari model permukaan respon
kuadratik penapisan metode difusi cakram terhadap C. albicans 23 7 Koefisien regresi dan signifikansi dari model permukaan respon
PENDAHULUAN
Indonesia merupakan salah satu negara beriklim tropis yang sangat cocok bagi pertumbuhan dan perkembangan berbagai makhluk hidup, termasuk mikroorganisme (mikroba). Mikroba adalah organisme berukuran mikroskopis yang antara lain terdiri atas bakteri, fungi dan virus (Waluyo 2009). Mikroba hidup pada berbagai habitat dan melakukan interaksi intraspesies dan interspesies dengan spesies lain di sekitarnya. Interaksi intrerspesies mikroba dapat menguntungkan atau pun bersifat patogen bagi spesies lain. Staphylococcus aureus, Bacillus subtilis, dan Candida albicans merupakan contoh mikroba patogen. Mikroba patogen bersifat sangat merugikan karena dapat menimbulkan penyakit, menginfeksi serta dapat mengontaminasi pangan.
Staphylococcus aureus menghasilkan enterotoksin (menyerang saluran pencernaan). Toksin ini akan dihasilkan ketika populasi S. aureus melebihi 106 cfu/g (Roy dan Bhunia 2007). Berbagai toksin dapat dihasilkan oleh S. aureus, yaitu hemolisin, leukosidin, toksin eksfoliatif, eksotoksin pirogenik dan enterotoksin (Jawetz et al. 2001). Bacillus subtilis memproduksi toksin ekstraseluler yang dikenal dengan subtilisin. Walaupun subtilisin memiliki level toksisitas yang rendah (HERA 2007), namun komponen protein ini dapat menyebabkan reaksi alergi pada individu yang mengalami paparan berulang kali (Cohen et al. 2012). Spesies Candida merupakan flora normal tubuh yang dapat menyebabkan infeksi apabila tercapai suatu kondisi tertentu (McClatchey 2002). Menurut Petersen (2011), khamir ini dapat menyebabkan vaginitis, infeksi saluran pencernaan, infeksi pada kulit dan infeksi sistemik.
Berbagai macam senyawa antimikroba sintetik telah dikembangkan untuk mencegah dan menangani berbagai kasus patogenitas. Namun, penggunaan beberapa antimikroba sintetik dapat memberikan efek samping yang tidak diinginkan terhadap tubuh. Penggunaan antimikroba yang berlebihan dan kurang terarah juga mendorong terjadinya perkembangan resistensi (Wardani 2008).
Tingginya kasus infeksi dan meningkatnya kasus resistensi, menunjukkan perlunya dilakukan penelitian untuk mengembangkan senyawa antimikroba, khususnya dari bahan alam. Senyawa antimikroba merupakan molekul kofaktor dalam sistem pertahanan tubuh dan sistem imunitas terhadap infeksi (Yeaman et al. 2005) yang dapat digunakan apabila memiliki sifat toksisitas selektif. Senyawa peptida antimikroba (Antimicrobial Peptide, AMP) adalah senyawa dengan bobot molekul rendah baik berupa protein atau peptida pendek yang memiliki aktivitas menghambat atau membunuh mikroba (antimikroba) (Marshall 2003).
2
Lactobacillus plantarum merupakan jenis bakteri anaerob fakultatif yang dapat mengendalikan pertumbuhan mikroba patogen dengan memproduksi asam organik, hidrogen peroksida, diasetil dan bakteriosin (Januarsyah 2007). Dalam penelitian Todorov et al. (2011), L. plantarum ST16PA menghasilkan bakteriosin yang aktif menghambat pertumbuhan genus Enterobacter, Enterococcus, Lactobacillus, Pseudomonas, Streptococcus dan Staphylococcus dan beberapa serotipe Listeria spp. Rohmatussolihat (2009), telah berhasil melakukan seleksi dan optimasi komposisi medium pada isolat bakteri asam laktat terseleksi untuk menghasilkan senyawa antikapang menggunakan simulasi permukaan respon (RSM). Namun, penelitian tentang kemampuan L. plantarum LIPI13-2-BAL011 sebagai penghasil antimikroba dengan simulasi RSM belum dilakukan.
Simulasi permukaan respon merupakan suatu metode gabungan antara teknik matematika dan statistika yang digunakan untuk membuat model dan menganalisa suatu respon yang dipengaruhi oleh beberapa variabel bebas (faktor x) untuk mengoptimalkan respon (Montgomery 2001). Penelitian ini bertujuan melakukan optimasi produksi antimikroba yang dihasilkan oleh L. plantarum LIPI13-2-BAL011 dan menguji aktifitasnya dalam menghambat pertumbuhan beberapa mikroba patogen menggunakan simulasi permukaan respon.
METODE
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah Lactobacillus plantarum LIPI13-2-LAB011 dari koleksi Indonesian Culture Collection (InaCC) LIPI, bakteri patogen indikator (Staphylococcus aureus BTCC B-611, Bacillus subtilis BTCC B-612, dan Candida albicans BTCC Y-33) dari koleksi British Type Culture Collection (BTCC), medium de Man Rogosa Sharpe (MRS), medium Tryptone Soy Broth (TSB), medium Natrium Broth (NB), medium Potato Dextrose Broth (PDB),ekstrak khamir, ekstrak gandum, glukosa, pepton, gliserol, K2HPO4, NaCH2COOH·3H2O, MgSO4·7H2O, Tween 80, Lab Lamco, diamonium
sitrat, MnSO4· H2O, NaCl, CaCO3, agar, amoksilin, sikloheksamid, akuades,
alkohol 70%, kapas, plastik tahan panas, alumunium foil, dan kertas cakram. Alat-alat yang digunakan adalah kabinet laminar air flow, autoklaf, inkubator bakteri dan kapang, spektrometer Spectronic 21D USA, pH meter Eutech New Zealand, penangas magnetik, vorteks, neraca analitik, neraca seimbang, tip (ukuran 200 µ L, 1000 µ L, 10 mL), pipet mikro (ukuran 200 µ L, 1000 µ L, 10 mL), tabung reaksi, labu erlenmeyer (ukuran 100 mL, 250 mL, 500 mL), sudip, dispenser, tabung corning, microtube Biologix USA, bunsen, cawan petri plastik, cawan petri kaca, ose plastik, ose kawat, dan pengaduk magnetik.
Metode
Sterilisasi Alat (ORS 2010)
3 microtube, kertas cakram, dan pinset disterilkan dengan autoklaf pada suhu 121
o
C selama 15 menit. Cawan petri plastik dan lup plastik yang digunakan sudah dalam kondisi steril.
Pemeliharaan dan pertumbuhan mikroorganisme (Lee et al. 2006)
Sebanyak 2 lup isolat L. plantarum LIPI13-2-BAL011 diinokulasikan dari stok gliserol ke dalam medium cair MRS dan medium agar MRS. Komposisi agar MRS, yaitu 1% pepton, 0.8% Lab lemco, 0.4% ekstrak khamir, 2% glukosa, 0.2% K2HPO4, 0.315% natrium asetat, 0.2% diamonium sitrat, 0.02% MgSO4.7H2O,
0.005% MnSO4.H2O, 0.1% Tween 80, 0.5% CaCO3 dan 2% agar. Inokulasi ke
medium agar MRS dilakukan dengan metode Deep Agar, yaitu dengan menusukkan secara tegak oseyang mengandung L. plantarum LIPI13-2-BAL011. Kultur kemudian diinkubasi selama 48 jam pada suhu 30 oC.
Kultur Mikroba Patogen (Bromberg et al. 2004)
Mikroba patogen indikator yang digunakan adalah dua spesies bakteri (S. aureus BTCC B-611 dan B. subtilis BTCC B-612), dan satu spesies khamir (C. albicans BTCC Y-33). Bakteri indikator diinokulasikan pada medium NB steril sebanyak 2 lup lalu diinkubasi pada inkubator goyang selama 24 jam, sedangkan khamir indikator diinokulasikan pada medium PDB steril sebanyak 1 lup lalu diinkubasi pada inkubator goyangselama 24 jam pada suhu ruang.
Seleksi Medium Produksi Senyawa Antimikroba (Modifikasi Vijayakumari
et al. 2013)
Seleksi medium untuk produksi senyawa antimikroba dari L. plantarum LIPI13-2-BAL011 dilakukan menggunakan 6 jenis medium, yaitu MRSB, NB, TSB, PDB, Tryptone Soy Yeast Extract (TSYE), dan Glucose Yeast Peptone (GYP). Prekultur dilakukan dengan menginokulasi 1 koloni L. plantarum LIPI13-2-BAL011 pada medium tersebut dan diinkubasi pada 30 oC selama 48 jam. Sebanyak 5 % prekultur diinokulasikan kembali pada medium MRSB, NB, TSB, TGE, TSYE, dan GYE steril dan diinkubasi kembali pada dua jenis inkubator, yaitu inkubator keadaan statis pada 30 oC dan inkubator goyang pada suhu ruang selama 48 jam. Setelah 48 jam, kultur disentrifugasi pada 3220 g, suhu 4 oC selama 10 menit. Supernatan digunakan dalam pengujian antimikroba dengan metode difusi cakram.
Optimasi Produksi Antimikroba (Al-rawi et al. 2009; Leal-Sa´nchez et al.
2002)
Optimasi kondisi produksi antimikroba dilakukan menggunakan metode RSM dengan rancangan Central Composite Design (CCD). Rancangan penelitian dan analisis data dilakukan menggunakan Software Statistic Design-Expert 7. Desain yang digunakan mengacu pada Leal-Sa´nchez et al. (2002) terdiri atas 4 faktor yaitu glukosa (X1), inokulum (X2), suhu (X3), dan kadar garam (NaCl) (X4)
dengan 5 taraf kombinasi (Tabel 1).
4
tunggal. Prekultur dilakukan dengan menginokulasikan satu koloni tunggal ke dalam 5 mL MRSB dan diinkubasi pada 30 oC selama 48 jam.
Tabel 1 Kombinasi empat faktor dan lima tingkat kombinasi menggunakan CCD
Faktor Satuan Level
Selanjutnya, dilakukan optimasi produksi senyawa antimikroba dengan menginokulasi prekultur ke dalam 25 mL medium MRS optimasi dan diinkubasi pada suhu yang bervariasi berdasarkan desain eksperimen menggunakan RSM selama 48 jam. Isolat yang tumbuh ditimbang sebanyak 15 mL untuk selanjutnya disentrifugasi pada 3220 g, suhu 4 °C selama 10 menit. Sebanyak 10 mL kultur yang tersisa digunakan untuk pengukuran kerapatan optik pada panjang gelombang 600 nm (Al-rawi et al. 2009). Supernatan selanjutnya dianalisis antimikrobanya menggunakan metode difusi cakram dan metode dilusi cair.
Difusi Cakram (Bromberg et al. 2004; Saranya dan Hemashenpagam 2011)
Sebanyak 15 mL lapisan dasar dan 5 mL lapisan pembenihan dituangkan dalam cawan petri. Lapisan pembenihan diduga mengandung biakan bakteri uji 0.1% S. aureus, 0.1% B. subtilis, dan 0.5% C. albicans (Otuguro 2004). Cawan petri dibagi menjadi 6 wilayah pada bagian belakang, dan diberi nomor berdasarkan kode sampel. Sebanyak 30 µ L sampel diinjeksikan pada kertas cakram kemudian didiamkan hingga kering. Setelah itu cakram diletakkan pada cawan yang telah berisi medium dan mikroba uji. Inkubasi pada suhu 30 ºC selama 24 jam. Zona bening yang terbentuk disekitar kertas cakram diamati dan diukur menggunakan jangka sorong.
Dilusi Cair (Modifikasi CLSI 2012)
Supernatan dari bakteri L. plantarum diencerkan dengan konsentrasi 2.5% dalam tabung reaksi dan ditambahkan mikroba patogen 0.1% S. aureus, 0.1% B. subtilis, 0.5% untuk C. albicans (Otuguro 2004). Sampel diinkubasi pada inkubator goyang dengan suhu ruang selama selama 24 jam, kemudian diamati adanya kekeruhan pada tiap sampel. Hasilnya diamati menggunakan spektrometer UV-VIS pada panjang gelombang 600 nm.
Selanjutnya data yang diperoleh dari penapisan secara difusi cakram dan dilusi cair dianalisis menggunakan Software Statistic Design-Expert 7.
HASIL
Medium Terseleksi untuk Produksi Senyawa Antimikroba
5 inkubator goyang. Hasil dari penapisan aktivitas antimikroba yang diproduksi pada dua jenis inkubator menunjukkan L. plantarum LIPI13-2-BAL011 lebih optimal tumbuh dalam inkubator keadaan statis (Gambar 1) daripada inkubator goyang (Gambar 2). Pertumbuhan L. plantarum LIPI13-2-BAL011 pada 6 medium berbeda menunjukkan hasil yang lebih optimal dalam menghasilkan senyawa antimikroba pada medium MRS. Penapisan antimikroba menggunakan sampel medium MRS dengan metode cakram menghasilkan diameter zona bening sebesar 1.067 mm, 0.833 mm dan 1.625 mm masing-masing terhadap S. aureus, B.
Kondisi Optimum Produksi Senyawa Antimikroba terhadap S. aureus
6
sebagian besar sampel tidak menghasilkan senyawa antimikroba. Hal ini menyebabkan data pengujian aktivitas antimikoba metode cakram tidak dapat dianalisis menggunakan software Design Expert 7. Berbeda dengan pengujian aktivitas senyawa antimikroba metode dilusi cair dari L. plantarum LIPI13-2-BAL011 menunjukkan adanya aktivitas penghambatan yang dihasilkan sampel terhadap S. aureus (Tabel 2).
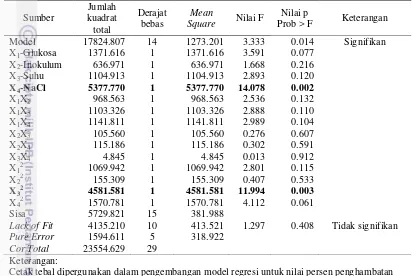
Tabel 2 Matriks Central Composite Design dan nilai eksperimental indeks zona bening dan penghambatan terhadap mikroba patogen indikator
Sampel Faktor perlakuan indeks zona Penghambatan (%)
X1(%) X2(%) X3 (
Berdasarkan hasil analisis ragam anova dari penapisan metode dilusi cair (Tabel 3), faktor yang berpengaruh nyata terhadap aktivitas hambat antimikroba adalah pengaruh NaCl dan suhu. Model regresi terbaik berdasarkan tabel ANOVA dan koefisien regresi (Lampiran 5) dengan nilai koefisien determinan 75.67% adalah Y = 73.64 – 14.97 X4 – 12.92 X32. Pada persamaan tersebut, X3, X4
7 Hasil kurva divisualisasikan dalam bentuk tiga dimensi ditampilkan pada Gambar 3. Peningkatan konsentrasi NaCl dan glukosa dapat meningkatkan nilai penghambatan (Gambar 3a), peningkatan konsentrasi NaCl dan jumlah inokulum dapat meningkatkan nilai penghambatan (Gambar 3b), dan Peningkatan konsentrasi NaCl dan suhu dapat meningkatkan nilai penghambatan (Gambar 3c) pada pertumbuhan S. aureus.
Tabel 3 ANOVA untuk model permukaan respon kuadratik penapisan metode dilusi cair terhadap S. aureus
Sumber
Cetak tebal dipergunakan dalam pengembangan model regresi untuk nilai persen penghambatan
(a) (b) (c)
Gambar 3 Permukaan respon aktivitas antimikroba bentuk tiga dimensi terhadap persen penghambatan pada S. aureus (Y) yang menggambarkan hubungan (a) variabel glukosa (X1) dan NaCl (X4); (b) variabel
inokulum (X2) dan NaCl (X4); (c) variabel suhu (X3) dan NaCl (X4).
Kondisi Optimum Produksi Senyawa Antimikroba terhadap B. subtilis
8
beberapa sampel tidak menghasilkan senyawa antimikroba. Hal ini menyebabkan data pengujian aktivitas antimikoba metode cakram tidak dapat dianalisis menggunakan software Design Expert 7.
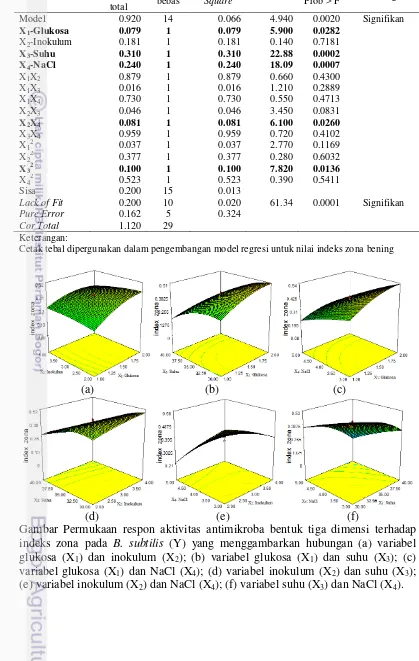
Berbeda dengan pengujian aktivitas senyawa antimikroba dari L. plantarum LIPI13-2-BAL011 menggunakan metode dilusi cair menunjukkan adanya aktivitas penghambatan oleh semua sampel (Tabel 2). Berdasarkan hasil analisis ragam ANOVA (Lampiran 4), diperoleh model regresi yang signifikan. Namun, nilai LOF dari model juga signifikan yang artinya model belum cukup untuk menggambarkan data.
Kondisi Optimum Produksi Senyawa Antimikroba terhadap C. albicans
Hasil pengujian aktivitas antimikroba dari L. plantarum LIPI13-2-BAL011 terhadap C. albicans ditampilkan dalam Tabel 2. Pada pengujian aktivitas antimikroba terhadap C. albicans, baik metode difusi cakram maupun dilusi cair, hanya satu sampel pada metode difusi cakram yang tidak menghasilkan senyawa antimikroba. Oleh karena itu, data pengujian aktivitas antimikoba terhadap C. albicans dapat dianalisis menggunakan software Design Expert 7. Hasil analisis ragam ANOVA penapisan senyawa antimikroba dengan metode difusi cakram ditampilkan pada Tabel 4.
Cetak tebal dipergunakan dalam pengembangan model regresi untuk nilai indeks zona bening
9 menunjukkan glukosa, suhu, NaCl, dan Y adalah nilai indeks zona bening. Kondisi optimal produksi senyawa antimikroba adalah 1.63% glukosa, 3.03% inokulum, 33.74oC, dan 3.4% NaCl dengan indeks zona bening 1.9160. Interpretasi hasil ditunjukkan melalui tabel ANOVA (Tabel 4) dengan nilai LOF tidak signifikan, yang artinya model telah cukup menggambarkan data.
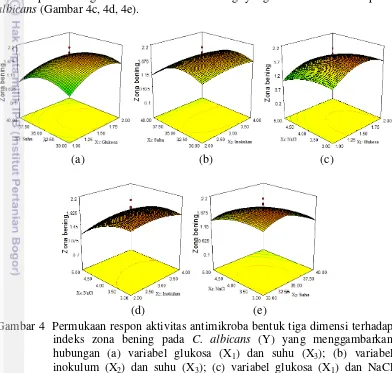
Hasil kurva yang divisualisasikan dalam bentuk tiga dimensi berdasarkan faktor yang berpengaruh nyata ditunjukkan pada Gambar 4. Peningkatan suhu dan glukosa serta suhu dan jumlah inokulum dapat meningkatkan indeks zona bening yang dihasilkan terhadap C. albicans (Gambar 4a, 4b). Selain itu, peningkatan konsentrasi NaCl dan glukosa, NaCl dan inokulum, serta NaCl dan suhu dapat meningkatkan indeks zona bening yang dihasilkan terhadap C. albicans (Gambar 4c, 4d, 4e).
(a) (b) (c)
(d) (e)
Gambar 4 Permukaan respon aktivitas antimikroba bentuk tiga dimensi terhadap indeks zona bening pada C. albicans (Y) yang menggambarkan hubungan (a) variabel glukosa (X1) dan suhu (X3); (b) variabel
inokulum (X2) dan suhu (X3); (c) variabel glukosa (X1) dan NaCl
(X4); (d) variabel inokulum (X2) dan NaCl (X4); (e) variabel suhu (X3)
dan NaCl (X4)
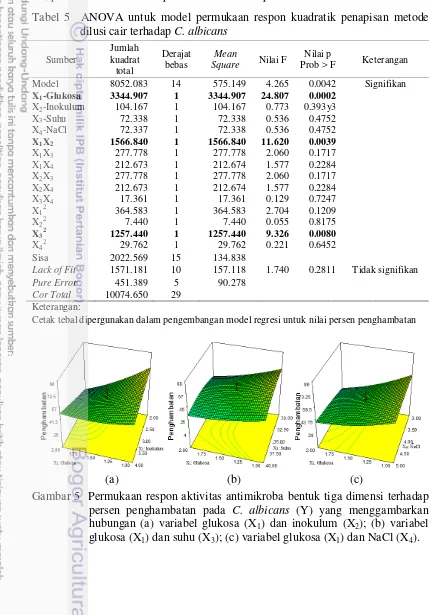
Berdasarkan hasil analisis ragam ANOVA (Tabel 5), faktor yang berpengaruh nyata terhadap aktivitas senyawa antimikroba dengan metode dilusi cair terhadap C. albicans adalah konsentrasi glukosa, interaksi glukosa dan inokulum, dan interaksi suhu (Tabel 5). Model regresi terbaik dengan nilai koefisien determinan 79.92% adalah Y = 45.83 + 11.81 X1 + 9.89 X1X2 - 6.77 X32
(Lampiran 7).
Persamaan tersebut X1, X2, X3 berturut-turut menunjukkan konsentrasi
10
optimal produksi senyawa antimikroba adalah 1% glukosa, 2% inokulum, 34.83
o
C, dan 3% NaCl dengan penghambatan 74.15%. Hasil kurva yang divisualisasikan dalam bentuk tiga dimensi berdasarkan faktor yang berpengaruh nyata ditunjukkan pada Gambar 5. Penurunan konsentrasi glukosa dan inokulum, penurunan konsentrasi glukosa dan peningkatan inokulum, serta penurunan konsentrasi glukosa dan NaCl dapat meningkatkan nilai penghambatan pada pertumbuhan C. albicans (Gambar 5a, 5b, 5c). Namun, ketiga kurva yang dipengaruhi oleh konsentrasi glukosa menunjukkan bentuk pelana. Oleh karena itu, pada model ini tidak dapat ditemukan area optimum.
Tabel 5 ANOVA untuk model permukaan respon kuadratik penapisan metode
Cetak tebal dipergunakan dalam pengembangan model regresi untuk nilai persen penghambatan
(a) (b) (c)
Gambar 5 Permukaan respon aktivitas antimikroba bentuk tiga dimensi terhadap persen penghambatan pada C. albicans (Y) yang menggambarkan hubungan (a) variabel glukosa (X1) dan inokulum (X2); (b) variabel
11
PEMBAHASAN
Medium Terseleksi untuk Produksi Senyawa Antimikroba
Isolat L. plantarum LIPI13-2-BAL011 diregenerasi menggunakan media cair MRS. Peremajaan isolat dilakukan pada medium MRS yang merupakan medium yang paling umum untuk BAL (Polak-Berecka et al. 2010). Kelompok BAL merupakan bakteri yang tergolong sulit tumbuh selain pada media kompleks (Zacharof dan Lovitt 2012). Sebelum dilakukan produksi senyawa antimikroba, dilakukan seleksi medium pertumbuhan untuk memaksimalkan pertumbuhan L. plantarum. Isolat ditumbuhkan pada 6 jenis medium berbeda, yaitu MRSB, NB, PDB, TSB, TSYEB dan GYPB.
Isolat L. plantarum LIPI13-2-BAL011 ditumbuhkan selama 48 jam pada suhu 30 oC dalam enam medium berbeda. Medium ini digunakan karena mengandung komponen media kultur BAL, yaitu sumber karbon, sumber vitamin, nitrogen, sumber asam amino, nitrogen, belerang dan fosfat, serta berbagai komponen mineral (Zacharof dan Lovitt 2012). Setelah ditumbukan, isolat disentrifugasi pada 3220 g, suhu 4oC selama 10 menit untuk mendapatkan supernatan yang mengandung senyawa antimikroba. Supernatan digunakan sebagai senyawa aktif dalam penapisan antimikroba menggunakan metode difusi cakram. L. plantarum LIPI13-2-BAL011 lebih optimum menghasilkan senyawa antimikroba ketika diinkubasi pada inkubator keadaan statis. Hal ini sesuai dengan penelitian Gupta et al. (2010) yang melaporkan bahwa akumulasi asam laktat maksimum dari L. plantarum diperoleh pada keadaan inkubasi statis.
Diameter zona bening terbesar dihasilkan oleh supernatan yang diproduksi pada medium cair MRS. Diameter yang terbentuk sebesar 1.067 mm, 0.833 mm dan 1.625 mm masing-masing terhadap S. aureus, B. subtilis, dan C. albicans. Hasil ini sesuai dengan penelitian Polak-Berecka et al. (2010) bahwa media MRS merupakan media paling umum digunakan untuk pertumbuhan BAL. Selain itu, media MRS dengan modifikasi komposisi juga merupakan media terbaik untuk produksi bakteriosin oleh L. plantarum ST194BZ (Todorov dan Leon 2005). Media MRS memiliki komposisi nutrisi yang dibutuhkan Lactobacillus (Polak-Berecka et al. 2010). Menurut penelitian Rachmania (2011), kandungan ammonium sitrat pada pH rendah menunjang pertumbuhan bakteri genus Lactobacillus, namun menghambat pertumbuhan mikroba genus lain. Selain itu, dikalium fosfat dan natrium asetat merupakan buffer untuk menjaga pH tetap rendah.
Kondisi Optimum Produksi Senyawa Antimikroba terhadap S. aureus
12
sekitar kertas cakram. Zona bening terbentuk karena adanya metabolit sekunder yang dihasilkan oleh isolat L. plantarum LIPI13-2-BAL011 dan mampu menghambat mikroba patogen.
Penapisan antimikroba hasil optimasi produksi dilakukan dengan metode difusi cakram dan dilusi cair. Aktivitas hambat metode difusi cakram terhadap S. aureus tidak dapat ditentukan karena memiliki nilai LOF yang berpengaruh nyata terhadap model regresi. Hal ini sesuai dengan penelitian Lenth (2009), informasi pada kurva tiga dimensi belum dapat digunakan apabila memiliki nilai LOF yang signifikan. Pada kondisi ini disarankan untuk melakukan analisis dengan model orde yang lebih tinggi dan menambah jumlah data yang digunakan. Pada penelitian ini, beberapa data yang dihasilkan dari penapisan antimikroba bernilai nol sehingga sulit untuk dianalisis menggunakan software Design Expert 7.
Data penapisan metode dilusi cair terhadap S. aureus menunjukkan pengaruh linier NaCl dan kuadratik suhu yang berpengaruh nyata terhadap persen penghambatan. Hasil ini sesuai dengan penelitian Al-Madboly dan Abeer(2015), suhu dan konsentrasi NaCl berpengaruh signifikan terhadap produksi senyawa antimikroba dan pertumbuhan bakteri L. plantarum. Berdasarkan Gambar 3, permukaan respon pada aktivitas hambat bakteriosin terhadap S. aureus menghasilkan kurva maksimum, yang menunjukkan bahwa hasil optimum dapat ditentukan dengan menggunakan model persamaan yang diperoleh.
Staphylococcus aureus merupakan bakteri Gram positif dan berbentuk kokus yang menghasilkan staphylococcal enterotoksin yang merupakan agen penyebab sindrom keracunan dalam makanan (Purnomo 2006). Bakteri Gram positif memiliki peptidoglikan yang tebal pada dinding sel sehingga membentuk suatu struktur yang kaku (Jawetz et al. 2001). Oleh karena itu, senyawa aktif dari isolat BAL sulit untuk merusak sel bakteri. Hal ini sesuai oleh banyaknya data difusi cakram yang bernilai nol. Namun menurut penelitian Bariyah (2012), L. plantarum memiliki aktivitas antimikroba melalui aktivitas antagonistik terhadap S. aureus ATCC 25923, Salmonella enteritidis, Typhimurium ATCC 14028, E. coli ATCC 25922,Pseudomonas aeruginosa ATCC 27853 dan B. cereus.
Kondisi Optimum Produksi Senyawa Antimikroba terhadap B. subtilis
Aktivitas senyawa antimikroba dengan metode difusi cakram terhadap B. subtilis tidak dapat ditentukan karena memiliki nilai LOF yang signifikan atau berpengaruh nyata. Nilai LOF yang berpengaruh nyata terhadap model regresi menunjukkan bahwa model yang dihasilkan pada analisis ragam ANOVA belum cukup untuk menggambarkan data (Lenth 2009). Keterangan yang signifikan ini disebabkan banyaknya indeks zona bening yang bernilai nol, sehingga menyebabkan data tidak dapat dianalisis keragamannya menggunakan software Design Expert 7.
13 Apabila LOF signifikan maka model yang dibuat belum sesuai untuk menggambarkan data.
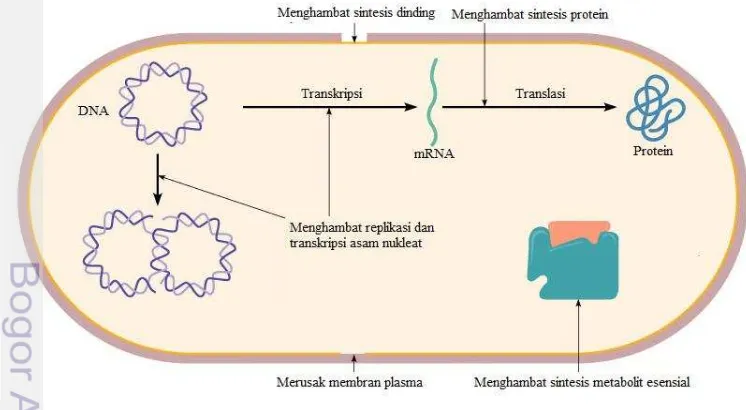
Bacillus subtilis merupakan bakteri Gram positif berbentuk batang, memiliki endospora, bersifat motil dan tergolong ke dalam bakteri aerob atau fakultatif anaerob. Penghambatan pertumbuhan terhadap B. subtilis dilakukan dengan merusak dinding sel sehingga melibatkan lisis atau menghambat pertumbuhan dinding sel pada sel bakteri yang sedang tumbuh, menghambat sintesis protein dan asam nukleat melalui denaturasi protein dan asam nukleat, menghambat kerja enzim intraseluler sehingga mengganggu metabolisme sel (Corcoran 2012).
Menurut penelitian Bogaert dan Naidu (2000) aktivitas antimikroba BAL terutama disebabkan oleh asam organik yang diproduksi melalui katabolisme glukosa. Lactobacillus plantarum merupakan BAL homofermentatif sehingga katabolisme glukosa melalui jalur Embden Meyerhoff Parnas (EMP) atau glikolisis hanya menghasilkan asam laktat (Nelson dan Cox 2008). Menurut penelitian Theron dan Rykers (2010), asam organik dapat berperan sebagai bakterisida yang menyebabkan sitoplasma sel bakteri menjadi asam sehingga terjadi difusi asam terprotonasi bermuatan melalui membran. Hal ini sesuai dengan penelitian Kuipers et al. (2000), keberadaan asam organik akan menurunkan pH sehingga mengakibatkan asam organik melarutkan lemak dan difusi melalui membran sel menuju sitoplasma sehingga sel mengalami kematian. Berdasarkan sifat toksisitas selektif, senyawa antimikroba bekerja dengan beberapa mekanisme, yaitu dengan merusak dinding sel, mengubah permeabilitas sel, mengubah molekul protein dan asam nukleat, menghambat kerja enzim dan menghambat sintesis asam nukleat dan protein. Struktur dinding sel dapat dirusak dengan menghambat pembentukannya atau merusak konformasinya setelah terbentuk. Membran sitoplasma mempertahankan bahan-bahan tertentu di dalam sel serta mengatur aliran keluar-masuknya bahan-bahan lain. Kerusakan pada membran ini akan mengakibatkan terhambatnya pertumbuhan atau matinya sel. Selain itu, terganggunya homeostasis DNA, RNA dan protein dapat mengakibatkan kerusakan total pada sel (Kohanski et al. 2010) (Gambar 6).
14
Kondisi Optimum Produksi Senyawa Antimikroba terhadap C. albicans
Hasil analisis ragam terhadap hasil penapisan metode difusi cakram menunjukkan bahwa faktor yang mempengaruhi aktivitas hambat bakteriosin terhadap C. albicans adalah suhu, NaCl, dan interaksi glukosa. Hasil ini sesuai dengan Leal-Sa´nchez et al. (2002) bahwa suhu, konsentrasi NaCl, jumlah inokulum, dan konsentrasi glukosa berpengaruh dalam mendapatkan kondisi optimum produksi antimikroba oleh L. plantarum LPCO10. Berdasarkan Gambar 3, aktivitas hambat maksimum antimikroba terhadap C. albicans adalah 1.63% glukosa, 3.03% inokulum, 33.74oC, dan 3.4% NaCl dengan indeks zona bening 1.9160. Kelima kurva menunjukkan titik maksimum respon.
Berdasarkan hasil uji aktivitas antimikroba metode dilusi cair, isolat menghasilkan senyawa antibakteri secara ekstraseluler karena ekstrak kultur L. plantarum mampu menghambat pertumbuhan dan/atau membunuh mikroba indikator. Variabel yang berpengaruh nyata dalam optimasi produksi antimikroba adalah konsentrasi NaCl dan interaksi suhu. Permukaan respon pada aktivitas hambat antimikroba terhadap C. albicans menghasilkan kurva pelana (Gambar 5). Wilayah tersebut belum dapat dikatakan wilayah optimum, disebabkan hampir semua wilayah dari kisaran perlakuan percobaan yang ada masuk dalam daerah minimum tersebut, sehingga area minimum yang dihasilkan terlalu melebar dan menyebabkan tidak ada batasan penentuan nilai stasioner. Titik-titik prediksi yang mempengaruhi model untuk memperoleh nilai optimumnya tidak dapat dicari karena semua nilai maksimum dan minimum terkumpul pada satu area stasioner. Oleh karena itu, pada model ini tidak dapat ditemukan area optimum.
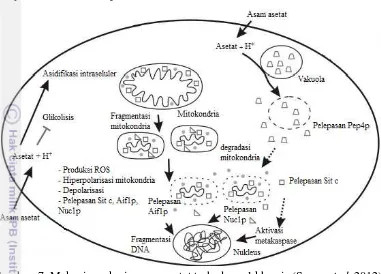
Candida albicans tergolong khamir, memiliki morfologi bulat, lonjong atau bulat lonjong yang membentuk koloni bulat dengan permukaan timbul, halus dan licin. Khamir C. albicans merupakan golongan mikroba yang paling sensitif dari segi kulitas zona bening yang terbentuk terhadap antimikroba yang digunakan. Hal ini disebabkan komponen dinding sel dari C. albicans. Menurut Calderone (2002) dinding sel C. albicans terdiri dari lima lapisan yang berbeda. Membran sel C. albicans seperti sel eukariotik lainnya terdiri dari lapisan fosfolipid ganda. Membran protein ini memiliki aktifitas enzim seperti manan sintase, kitin sintase, glukan sintase, ATPase dan protein yang mentransport fosfat. Terdapatnya membran sterol pada dinding sel memegang peranan penting sebagai target antimikotik dan kemungkinan merupakan tempat bekerjanya enzim-enzim yang berperan dalam sintesis dinding sel.
15 endonuklease pada khamir (Nuc1p). Sitokrom c akan mengaktivasi metakaspase dan mendegradasi DNA khamir bersama Aif1p dan Nuc1p, sehingga menyebabkan kematian pada sel khamir (Sousa et al. 2012).
Gambar 7 Mekanisme kerja asam asetat terhadap sel khamir (Sousa et al. 2012)
SIMPULAN DAN SARAN
Simpulan
Isolat L. plantarum LIPI13-2-BAL011 lebih optimal menghasilkan senyawa antimikroba dalam media cair MRS pada keadaan statis yang mampu menghambat pertumbuhan S. aureus, B. subtilis dan C. albicans. Hasil optimasi produksi menggunakan metode RSM menunjukkan hanya penghambatan terhadap S. aureus metode dilusi cair serta C. albicans metode difusi cakram yang dapat dianalisis kondisi optimumnya dalam produksi antimikroba oleh L. plantarum LIPI13-2-BAL011. Kondisi optimum produksi antimikroba terhadap S. aureus dengan persen penghambatan representatif 99.34% adalah konsentrasi glukosa 1.99%, NaCl 3.01%, inokulum 3.74%, dan suhu 31.6 oC. Kondisi optimum produksi antimikroba terhadap C. albicans dengan indeks zona bening representatif 1.9160 adalah konsentrasi glukosa 1.63%, NaCl 3.4%, inokulum 3.03%, dan suhu 33.74 oC. Kondisi optimum produksi antimikroba terhadap B. subtilis tidak dapat ditentukan menggunakan faktor dan variabel yang digunakan.
Saran
16
karakterisasi dan purifikasi terhadap senyawa antimikroba L. plantarum LIPI13-2-BAL011 untuk menentukan senyawa yang dapat menghambat pertumbuhan mikroba patogen indikator.
DAFTAR PUSTAKA
Abdelbasset, Djamila. 2008. Antimicrobial activity of autochthonous lactic acid bacteria isolated from Algerian traditional fermented milk Raïb. Afr J Biotechnol 7(16): 2908-2914.
Al-rawi A, Al-mola. 2009. Antimicrobial activity of lactic acid bacteria isolated from minced beef against some pathogenic bacteria. Iraqi J Vet Sci 23(1): 115-117.
Al-Madboy LA, Abeer KA. 2015. Potent antagonostic activity of egyptian Lactobacillus plantarum against multiresistant and virulent food-associated pathogens. Front Microbiol 6(347): 1-11.
Bariyah K. 2012. Aktivitas antimikrob bakteriosin asal Lactobacillus plantarum terhadap berbagai bakteri patoge n selama penyimpanan suhu dingin. [tesis]. Bogor (ID):Institut Pertanian Bogor.
Bogaert J, A Naidu. 2000. Natural Food Antimicrobial System. Florida (US): CRC Pr.
Bromberg et al. 2004. Isolation of bacteriocin producing lactic acid bacteria from meat and meat products and its spectrumof inhibitory activity. Braz J Microbiol 35(1-2): 137-144.
Calderone RA. 2002. Candida and Candidiasis. Washington (US): ASM Pr. [CLSI] Clinical and Laboratory Standards Institute. 2012. Methods for Dilution
Antimicrobial Susceptibility Tests for Bacteria That Grow Aerobically; Approved Standard-Ninth Edition. Wayne (PA): CLSI.
Cohen MD, Judith TZ, Richard BS. 2012. Pulmonary immunotoxicology. New York (US): Springer.
Corcoran JW, Hahn FE. 2012. Mechanism of Action of Antimicrobial and Antitumor Agents. New York (US): Springer.
Ernawati. 2012. Identifikasi pengaruh variabel proses dan penentuan kondisi optimim dekomposisi katalik metana dengan metode respon permukaan. [skripsi]. Jakarta (ID): Universitas Indonesia.
Galvez A, Abriouel H, Lopez R, Omar N. 2007. Bacteriocin-based strategies for food biopreservation. Int J Food Microbiol 120(1-2): 51-70.
Gupta S, Ghannam NA, Scannell AGM. 2010. Growth and kinetics of Lactobacillus plantarum in the fermentation of edible Irish briwn seaweeds. Food Bioprod Pro 89(4): 346-356.
[HERA] Human and Environmental Risk Assessment. 2007. Subtilisins (Protease). Brussels (BE): HERA.
Januarsyah T. 2007. Kajian Aktivitas Hambat Bakteriosin Dari Bakteri Asam Laktat Galur SCG 1223. [skripsi]. Bogor (ID): Institut Pertanian Bogor. Jawetz E. 2001. Mikrobiologi untuk Kesehatan. Jakarta (ID): EGC.
17 Kuipers OP, G Buist, J Kok. 2000. Current strategies for improving food bacteria.
ResMicrobiol 151(10): 815-822.
Leal-Sánchez MV, Jimenez-Diaz R, Maldonado-Barragan, Garrido-Fernandez A, Ruiz-Barba JL. 2002. Optimization of bacteriocin production by batch fermentation Lactobacillus plantarum LPCO10. Appl Environ Microbiol 68(9): 4465-4471.
Lee JY, Kim CJ, Kunz B. 2006. Identification of lactic acid bacteria isolated from kimchi and studies on their suitability for application as starter culture in the production of fermented sausage. Meat Sci 72(3): 437–445.
Lenth RV. 2009. Response surface methods in R-using RSM. J of Stat Soft 32(7): 1-17.
Marshall SH. 2003. Antimicrobial peptides: as natural alternative to chemical antibiotics and a potential for applied biotechnology. Electron J Biotech 6(3): 272-284.
McClatchey K. 2002. Clinical Laboratory Medicine. Maryland (US): Williams and Wilkins Baltimore.
Montgomery DC. 2001. Introduction to Statistical Quality Control. Canada (CA): Wiley.
Nelson DL, Cox MM. 2008. Lehninger: Principles of Biochemistry, fifth edition. Madison Avenue (NY): WH Freeman Comp.
[ORS] Office of Research Savety. 2010. Autoclave Quality Control Policy. Northwestern (US): Northwestern Pr.
Otoguro M. 2004. Workshop on Isolation Method and Clasification of Actinomycetes. Bogor (ID): LIPI Bioteknologi Pr.
Petersen E. 2011. Infections in Obstetrics and Gynecology. New York (US): Thieme.
Polak-Berecka M, Adam W, Monika K, Marcin P, Zdzislaw T, Agnieszka K. 2010. Optimization of medium composition for enhancing growth of Lactobacillus rhamnosus PEN using response surface methodology. Polish J Microbiol 59(2): 113-118.
Purnomo A, Hartatik K, Salasia SIO, Soegiyono. 2006. Isolation and Characterization of Staphylococcus aureus of Milk of Ettawa Crossbred Goat. Bogor (ID): Media Kedokteran Hewan.
Rachmania S. 2011. Perbandingan jumlah bakteri Lactobacillus casei pada media MRS broth dan media modifikasi MRS broth berbahan campuran air kelapa dan limbah cair tempe [skripsi]. Jember (ID): Universitas Negeri Jember. Ray B, Bhunia A. 2007. Fundamental Food Microbiology. Raton (US): CRC Pr. Rohmatussolihat. 2009. Seleksi dan optimasi bakteri asam laktat penghasil
senyawa antikapang [Tesis].Bogor (ID): Institut Pertanian Bogor.
Saranya S, Hemashenpagam N. 2011. Antagonistic activity and antibiotic sensitivity of lactic acid bacteria from fermented dairy products. Adv in Appl Sci Res 2(4): 528-534.
Sousa MJ, Ludovico P, Rodrigues F, Leão C, Cõrte-Real M. 2012. Cell Metabolism-Cell Homeostasis and Stress Response. Rijeka (HR): Intech. Theron MM, Rykers JFL. 2010. Organic Acid and Food Preservation. Boca
18
Todorov SD, Leon MTD. 2005. Effect of growth medium on bacteriocin production by Lactobacillus plantarum ST194BZ, a strain isolated from Boza. Food Technol Microbiol 43(2): 165-173.
Todorov SD, Prévost H, Lebois M, Dousset X, LeBlanc JG, Franco BDGM. 2011. Bacteriocinogenic Lactobacillus plantarum ST16Pa isolated from papaya (Carica papaya)-From isolation to application: Characterization of a bacteriocin. Food Res Int 44(5): 1351-1363.
Vijayakumari SJ, Nishanth KS, Bala N, Chellappan M. 2013. Optimization of media and temperature for enhanced antimicrobial production by bacteria associated with Rhabditis sp. Iranian J Microbiol 5(2): 136-141.
Waluyo L. 2009. Mikrobiologi Umum. Bandung (ID): UPT UMM.
Wardani KA. 2008. Uji aktivitas antibakteri fraksi residu ekstrak etanolik daun arbenan (Duchesnea indica (andr.) focke.) terhadap Staphylococcus aureus dan Pseudomonas aeruginosa multi resisten antibiotika beserta profil kromatografi lapis tipis [Skripsi]. Surakarta (ID): Universitas Muhammadiyah Surakarta.
Yang E, Lihua F, Yueming J, Craig D, Sherry F. 2012. Antimicrobial activity of bacteriocin-producing lactic acid bacteria isolated from cheeses and yogurts. AMB Express 2(1): 48-59.
Yeaman MR, Yount NY. 2005. Immunocontinuum: perspective in antimicrobial peptide mechanism of action and resistance. Protein Pept Lett 12(1): 49-67. Zacharof MP, Lovitt RW. 2012. Bacteriocins produced by lactic acid bacteria, a
19
20
Lampiran 1 Bagan alir penelitian
Kultur L. plantarum
Lampiran 2 ANOVA untuk model permukaan respon kuadratikpenapisan metode difusi cakram terhadap S. aureus
21 Lampiran 3 ANOVA untuk model permukaan respon kuadratikpenapisan metode
difusi cakram terhadap B. subtilis
Cetak tebal dipergunakan dalam pengembangan model regresi untuk nilai indeks zona bening
(a) (b) (c)
(d) (e) (f) Gambar Permukaan respon aktivitas antimikroba bentuk tiga dimensi terhadap
indeks zona pada B. subtilis (Y) yang menggambarkan hubungan (a) variabel glukosa (X1) dan inokulum (X2); (b) variabel glukosa (X1) dan suhu (X3); (c)
variabel glukosa (X1) dan NaCl (X4); (d) variabel inokulum (X2) dan suhu (X3);
22
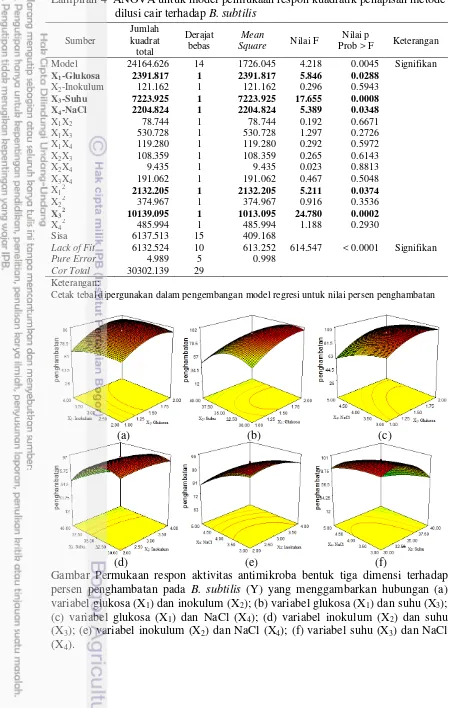
Lampiran 4 ANOVA untuk model permukaan respon kuadratik penapisan metode dilusi cair terhadap B. subtilis
Sumber
Cetak tebal dipergunakan dalam pengembangan model regresi untuk nilai persen penghambatan
(a) (b) (c)
(d) (e) (f)
Gambar Permukaan respon aktivitas antimikroba bentuk tiga dimensi terhadap persen penghambatan pada B. subtilis (Y) yang menggambarkan hubungan (a) variabel glukosa (X1) dan inokulum (X2); (b) variabel glukosa (X1) dan suhu (X3);
(c) variabel glukosa (X1) dan NaCl (X4); (d) variabel inokulum (X2) dan suhu
(X3); (e) variabel inokulum (X2) dan NaCl (X4); (f) variabel suhu (X3) dan NaCl
23 Lampiran 5 Koefisien regresi dan signifikansi dari model permukaan respon
kuadratik penapisan metode dilusi cair terhadap S. aureus Faktor Koefisien kuadratik penapisan metode difusi cakram terhadap C. albicans Faktor Koefisien kuadratik penapisan metode dilusi cair terhadap C. albicans
24
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 17 Maret 1993 di Makassar dari ayah Syahruddin S dan ibu Humaerah. Penulis terlahir sebagai anak kedua dari empat bersaudara. Penulis menyelesaikan pendidikan sekolah menengah atas di SMAN 1 Maros, Sulawesi Selatan, pada tahun 2011 dan pada tahun yang sama berhasil lulus masuk IPB melalui Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN) jalur undangan. Penulis memilih mayor Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama masa perkuliahan, penulis pernah mengikuti program IPB Goes to Field ke daerah Pekalongan dengan tema Budidaya dan Pengolahan Hasil Perikanan pada tahun 2013. Selain itu, penulis juga pernah menjadi anggota tim Program Kreativitas Mahasiswa (PKM) bidang penelitian yang diselenggarakan oleh Direktorat Jendral Pendidikan Tinggi (DIKTI) dengan judul ‘XOSweet: Xilooligosakarida Hasil Degradasi Limbah Tongkol Jagung secara Enzimatis sebagai Pemanis Prebiotik’ pada tahun 2014.