PERTUMBUHAN DAN PRODUKSI SENYAWA
ANTIMIKROBA DARI
Lactobacillus plantarum
IIA-1A5
PADA MEDIA WHEY KEJU
ANDI MUTMAINNA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul pertumbuhan dan produksi senyawa antimikroba dari Lactobacillus plantarum IIA-1A5 pada media whey keju adalah benar karya saya denganarahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
ANDI MUTMAINNA. Pertumbuhan dan Produksi Senyawa Antimikroba dari Lactobacillus plantarum IIA-1A5 pada Media Whey Keju. Dibimbing oleh IRMA ISNAFIA ARIEF dan CAHYO BUDIMAN.
Lactobacillus plantarum IIA-1A5 sebagai isolat indegenus dari daging sapi di Indonesia mempunyai kemampuan untuk menghambat bakteri patogen. Tujuan dari penelitian ini adalah untuk mengetahui potensi whey keju untuk dijadikan sebagai media pertumbuhan L. plantarum IIA-1A5 dan produksi bakteriosin. Kurva pertumbuhan L. plantarum IIA-1A5 menghasilkan senyawa antimikroba pada fase logaritmik pada waktu inkubasi jam ke 28 dan 32. Purifikasi plantarisin IIA-1A5 menghasilkan peptida dengan ukuran berat molekul pada perlakuan whey 9.59 kDa dan whey+ (sukrosa,tripton,dan yeast extract) 9.59 kDa, berada pada kelas IIa (<10 kDa) terdiri dari peptida termostabil. Konsentrasi protein plantarisin yang dihasilkan L. plantarum IIA-1A5 pada perlakuan whey+ adalah 1883.17 mg/mL lebih tinggi dari perlakuan whey 325.58 mg.mL-. Berdasarkan uji aktivitas antimikroba plantarisin IIA-1A5 menunjukkan kemampuan aktivitas antimikroba terhadap S. aureus ATCC 25923 dan E. coli ATCC 25922 bisa menghambat. Berdasarkan efektivitas plantarisin IIA-1A5 dengan uji aktivitas antimikroba whey sangat berpotensi untuk dijadikan media pertumbuhan untuk BAL.
Keywords :Lactobacillus plantarum, antimikroba, whey keju,plantarisin
SUMMARY
ANDI MUTMAINNA. The Growth and Production of Antimicrobial Coumpounds From Lactobacillus plantarum IIA-IA5 on Whey Medium. Supervised by IRMA ISNAFIA ARIEF and CAHYO BUDIMAN.
Lactobacillus plantarum IIA-1A5 as indigenous bacterium isolated from Indonesia beef has ability to inhibit pathogenic bacteria. The purpose of this study is to analyzed cheese whey potentially to be used as a growth medium for production of bacteriocin. The growth curve of Lactobacillus plantarum IIA-1A5 to produced antimicrobial compounds was occurred during logarithmic phase at the incubation time to 28 and 32 hours. Plantaricin purificated from whey and whey+ medium displayed abound 9.59 kDa in apparent size in SDS-PAGE, which was considered as class IIa bacteriocin. It was composed of a thermostable peptide. The protein concentration of plantarisin IIA-1A5 whey+ (sucrose, tryptone and yeast extract) treatment (1883.17 mg/mL) which was higherthan whey 325.58 mg/mL. The effectiveness of plantaricin IIA- 1A5 to test the antimicrobial activity in whey medium was shown the good result. It was indicated that whey potentially to be used as a growth medium for production of bacteriocin.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Produksi dan Teknologi Peternakan
PERTUMBUHAN DAN PRODUKSI SENYAWA
ANTIMIKROBA DARI
Lactobacillus plantarum
IIA-1A5
PADA MEDIA WHEY KEJU
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari 2016 ini ialah Pertumbuhan dan Produksi Senyawa Antimikroba dari Lactobacillus plantarum IIA-1A5 pada Media Whey Keju .
Terima kasih penulis ucapkan kepada Ibu Irma Isnafia Arief dan Bapak Cahyo Budiman selaku pembimbing. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Penulis mengucapkan terimakasih kepada Laboratorium THT, dan ITP 2014 atas persahabatan yang telah dilalui bersama. Semoga tesis ini bermanfaat bagi yang membacanya.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
2 TINJAUAN PUSTAKA 4
Whey Secara Umum 4
Media Optimum Pertumbuhan Bakteriosin 4
Peranan Bakteri Asam Laktat (BAL) dan Senyawa Antimikroba 5
3 MATERI DAN METODE 6
Materi 7
Prosedur Penelitian 8
Prosedur Analisis Data 10
4 HASIL DAN PEMBAHASAN 12
Kurva Pertumbuhan 12
Purifikasi Plantarisin 15
Bobot Molekul Planracin IIA-1A5 16
Aktivitas Antimikroba Plantarisin IIA-1A5 18 Komposisi Asam Amino Plantarisin IIA-1A5 19
5 SIMPULAN DAN SARAN 21
Simpulan 21
Saran 21
DAFTAR PUSTAKA 22
LAMPIRAN
DAFTAR TABEL
1 Fraksi protein whey susu 5
2 Pertumbuhan Lactobacillus plantarum IIA-1A5 14
3 Aktivitas antimikroba plantarisin IIA-1A5 16
4 Komposisi asam amino plantarisin IIA-1A5 19
DAFTAR GAMBAR
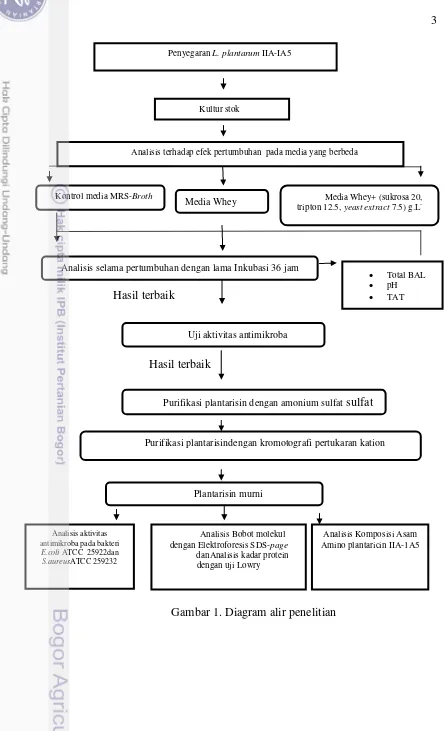
1 Diagram alir penelitian 3
2 Kurva pertumbuhan Lactobacillus plantarum IIA-1A5 4 3 Profil elusi prantarisin spektrofotometer 280 nm 14
4 Profil SDS-PAGE plantarisin IIA-1A5 15
5 Total konstrasi protein plantarisin IIA-1A5 16
DAFTAR LAMPIRAN
1. Hasil perhitungan T-Test BAL L. plantarum IIA-1A5 27 2. Hasil perhitungan T-Test TAT L. plantarum IIA-1A5 27 3. Hasil perhitungan T-Test pH L. plantarum IIA-1A5 27 4. Hasil perhitungan T-Test aktivitas antimikroba E.coli L. plantarum
IIA-1A5 27
5.Hasil perhitungan T-Test aktivitas antimikroba S. aureus L. plantarum
1
1
PENDAHULUAN
Latar Belakang
Konsumsi bahan baku susu di Indonesia mengalami peningkatan setiap tahun, tahun 2011 konsumsi susu segar di Indonesia sebesar 0.156 liter per kapita per tahun, atau mengalami peningkatan sebesar 50 persen dibandingkan konsumsi tahun 2010 sebesar 0.104 liter per kapita per tahun (Kementerian Pertanian 2012). Susu banyak dikonsumsi tidak hanya dalam bentuk segar, tetapi juga dalam bentuk olahannya, antara lain keju. Keju merupakan produk olahan susu melalui proses penggumpalan yang menghasilkan produk samping berupa whey yang jumlahnya melebihi produk keju yang dihasilkan. Satu kilogram keju dihasilkan dari penggumpalan susu sebanyak 10 liter dan menghasilkan whey sebanyak 8-9 liter. Whey mengandung 4.7 g.L- laktosa, 5.6 g.L- protein, 0.5 g.L- lemak, asam laktat, dan sejumlah nutrien minor seperti laktoferin, laktoperoxidas, lisozim, immunoglobulin, besi, iodin, dan vitamin (De Wit 2001).
Bakteri asam laktat (BAL) secara luas terdistribusi pada susu, daging segar, sayuran serta produk-produknya. Penggunaan BAL sebagai kultur starter dalam produksi daging fermentasi, produk-produk susu serta sayuran dan buah-buahan adalah salah satu metode pemrosesan pangan tertua yang digunakan untuk menstabilkan produk-produk pangan tersebut hingga diperoleh cita rasa yang spesifik (Smid dan Gorris 2007). Efek preservatif yang ditimbulkan oleh bakteri asam laktat pada pangan fermentasi disebabkan oleh kondisi asam yang terbentuk selama pemrosesan dan selanjutnya selama penyimpanan. Efek asam tersebut diakibatkan adanya konversi karbohidrat menjadi asam organik (asam laktat dan asam asetat) dan menurunkan pH produk selama fermentasi.
Salah satu sifat fungsional dari BAL adalah kemampuannya memproduksi komponen antimikroba, khususnya bakteriosin yang potensial menjadi biopreservatif menggantikan pengawet kimiawi pada bahan makanan guna memperpanjang umur simpan produk. Kemampuan bakteriosin dalam melakukan aktivitasnya sebagai biopresevatif dicapai oleh efek penghambatannya terhadap mikroorganisme patogen yang berbahaya (Savadogo et al. 2006). Salah satu jenis bakteriosin adalah plantarisin yang secara spesifik disintesis oleh kelompok bakteri Gram positif Lactobacillus plantarum dan mempunyai kemampuan untuk menghambat pertumbuhan dan membunuh kelompok bakteri Gram negatif yang bersifat patogen (Gong et al. 2010; Abo-Amer 2007). L. plantarum termasuk bakteri dalam filum Firmicutes, kelas Bacilli, ordo Lactobacillales, famili Lactobacillaceae dan genus Lactobacillus. L. plantarum mempunyai kemampuan untuk menghambat mikroorganisme patogen pada bahan pangan dengan daerah penghambatan terbesar dibandingkan dengan bakteri asam laktat lainnya (Jenie dan Rini 1995). L. plantarum IIA-1A5 diisolasi dari daging sapi Indonesia (Arief et al. 2015a). Isolat ini dari sapi Peranakan Ongole, dan terbukti menghasilkan bakteriosin, yang disebut plantarisin IIA-1A5 (Arief et al. 2013)
2
digunakan untuk pembiakan BAL yang mempunyai komponen nutrisi penyusun media kultur bakteri asam laktat sebagai sumber karbon dan energi, yeast extract sebagai sumber vitamin dan nitrogen, pepton/tripton sebagai sumber asam amino. L. plantarum merupakan salah satu strain BAL penghasil bakteriosin yang dikenal sebagai plantarisin (Diep et al. 1996; Holo et al. 2001; Maldonado et al. 2003). Pemanfaatan plantarisin sebagai bakteriosin, di Indonesia masih terbatas. Pencapaian tahap tersebut memerlukan studi tentang plantarisin IIA-1A5 untuk ditumbuhkan dan diproduksi dengan penggunaan media alami.
Perumusan Masalah
Berdasarkan latar belakang yang telah diuraikan diatas dapat dirumuskan permasalahan sebagai berikut:
1. Bagaimana potensi whey keju sebagai media pertumbuhan Lactobacillus plantarum IIA-1A5
2. Bagaimana potensi whey menghasilkan produksi bakteriosin Lactobacillus plantarum IIA-1A5
Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk analisis potensi whey keju sebagai media pertumbuhan Lactobacillus plantarum IIA-1A5 dan produksi bakteriosin.
Manfaat Penelitian
Sebagai informasi mengenai whey keju dapat dimanfaatkan sebagai media pertumbuhan dan produksi plantarisin yang dihasilkan oleh L. plantarum IIA-1A5.
Ruang Lingkup Penelitian
3
Hasil terbaik
Hasil terbaik
Gambar 1. Diagram alir penelitian
Analisis selama pertumbuhan dengan lama Inkubasi 36 jam
Penyegaran L. plantarum IIA-IA5
Analisis terhadap efek pertumbuhan pada media yang berbeda
Analisis aktivitas antimikroba pada bakteri
E.coli ATCC 25922dan
S.aureusATCC 259232
Kultur stok
Purifikasi plantarisin dengan amonium sulfat sulfat
Purifikasi plantarisindengan kromotografi pertukaran kation
Plantarisin murni
Analisis Bobot molekul dengan Elektroforesis SDS-page
danAnalisis kadar protein dengan uji Lowry
Analisis Komposisi Asam Amino plantaricin IIA-1A5
Total BAL
pH
TAT Kontrol media MRS-Broth
Media Whey Media Whey+ (sukrosa 20,
tripton 12.5, yeast extract 7.5) g.L
4
2
TINJAUAN PUSTAKA
Whey Secara Umum
Whey susu didefinisikan sebagai serum atau bagian air dari susu yang tersisa setelah pemisahan curd dan merupakan hasil koagulasi protein susu dengan asam atau enzim proteolitik. Komposisi utama whey adalah protein 0.8% - 1.0% dan laktosa 3.8%-4.3%. Whey merupakan polutan terbesar dari limbah cair dalam pembuatan keju diikuti dengan air pencuci dan air pasteurisasi. Komponen nutrisi whey dari produk samping pengolahan keju dapat dimanfaatkan oleh bakteri sebagai sumber nutrisi pertumbuhan. Whey mengandung sekitar 55% total nutrisi dari susu seperti laktosa, protein terlarut, lemak, vitamin yang larut dalam air dan garam mineral (Vinderola et al. 2000).
Tabel 1. Fraksi protein whey susu sapi
Fraksi Kandungan (g/L) Total Protein
(%w/w)
Menurut Spreer (1998), walaupun whey merupakan produk samping namun whey mempunyai nilai nutrisi protein dan karbohidrat sehingga dapat dimanfaatkan dalam bidang pangan. Pemanfaatan whey secara tepat akan memberikan nilai ekonomi yang tinggi, memberikan kelengkapan dan efisiensi penggunaan bahan baku susu, serta mengurangi polutan cair. Pemanfaatan whey secara komersial telah dilakukan, yaitu dengan mengolah whey menjadi bahan makanan dan minuman (Gordon 1993).
Media Optimum Pertumbuhan Bakteriosin
Sukrosa atau gula tebu merupakan disakarida yang paling manis yang terdiri dari glukosa dan fruktosa. Sumber-sumber sukrosa yang terdapat di alam antara lain: tebu (100% mengandung sukrosa), gula nira (50%) dan jelly. Sukrosa merupakan gula pasir biasa. Sukrosa adalah disakarida yang apabila dihidrolisis berubah menjadi dua molekul monosakarida yaitu glukosa dan fruktosa (De Man, 1997; Sastrohamidjojo 2005).
5 pula oleh pendapat Malaka (2010) yang menyatakan bahwa peningkatan asam laktat diakibatkan oleh aktivitas bakteri, pH akan menurun, akibat aktivitas buffer fosfat, sitrat dan protein. Ditambahkan pula oleh pendapat Helferich dan Westhoff (1980), yang menyatakan bahwa pembentukan asam laktat dari laktosa digunakan sebagai sumber energi dan karbon selama pertumbuhan bakteri dalam proses fermentasi sehingga pH akan menurun. Sehingga pertumbuhan mikroba berbahaya pada produk fermentasi akan terhambat, akibat adanya penurunan pH oleh aktivitas proses fermentasi. Penuruan pH juga yang menyebabkan rasanya agak asam karena terbentuknya asam laktat sebagai produk utama hasil metabolisme BAL.
Tripton merupakan salah satu sumber nitrogen yang dapat menghasilkan aktivitas bakteriosin ST194BZ sebesar 12800 AU/ml dan berdasarkan beberapa hasil yang diperoleh juga disimpulkan bahwa tingginya aktivitas bakteriosin berasal dari penambahan tripton ke dalam media pertumbuhan dan bukan dari penambahan yeast extract maupun meat extract. Bakteriosin ST194BZ adalah bakteriosin yang dihasilkan oleh L. plantarum ST194BZ hasil isolasi dari Boza (Todorov et al. 2005). Produksi bakteriosin dipengaruhi oleh tipe dan level karbon, sumber nitrogen dan fosfat, surfaktan kation dan penghambat. Bakteriosin dapat diproduksi dari media dengan sumber karbohidrat yang berbeda (Savadogo et al. 2006).
Yeast extract juga diperlukan untuk menjaga pertumbuhan heterotrofik dan sintesis asetat dari glukosa dalam spesies asetogenik, kecuali dalam strain Streptococcus, dengan tidak adanya yeast extract, vitamin lebih efisien mengembalikan fermentasi glukosa menjadi asetat. Mungkin jalur reduktif dan oksidatif sintesis asetat, oleh karena itu, tergantung pada faktor vitamin yang diberikan oleh yeast extract di sebagian besar bakteri asetogenik manusia. Faktor-faktor bukan vitamin muncul dan terlibat dalam metabolisme beberapa spesies asetogenik (Leclerc et al. 1998).
Peranan Bakteri Asam Laktat (BAL) dan Senyawa Antimikroba
Bakteri asam laktat (BAL) sering digunakan untuk makanan dan pengawetan makanan misalnya untuk produksi produk fermentasi susu, keju, roti dan beberapa spesies juga digunakan sebagai protektif dalam industri daging (Vermeiren et al. 2004). Salah satu genus yang sering digunakan adalah Lactobacillus. Keberadaan Lactobacillus di alam cukup beragam, dapat ditemukan pada tanaman, tanah, air, hewan, makanan dan saluran usus manusia. Bakteri L. plantarum berbentuk batang dan tidak bergerak, bakteri ini memiliki sifat katalase negatif, aerob atau fakultatif anaerob, mampu mencairkan gelatin, cepat mencerna protein, tidak mereduksi nitrat, toleran terhadap asam, dan mampu memproduksi asam laktat. Koloni L. plantarum dalam media agar be rukuran 2-3 mm, berwarna putih. L. plantarum mempunyai kemampuan untuk menghambat mikroba patogen pada bahan pangan dengan daerah penghambatan terbesar dibandingkan dengan bakteri asam laktat lainnya
6
dan terbentuk selama pengolahan atau hasil sintesis mikroorganisme yang tumbuh selama fermentasi pangan.Selain itu dijelaskan juga, bahwa senyawa antimikroba dapat bersifat bakteriosidal (membunuh bakteri), bakteriostatik (menghambat pertumbuhan bakteri) dan germisidal (menghambat germinasi spora bakteri). Produk metabolit dari BAL yang bersifat antimikroba antara lain asam organik, hidrogen peroksida, karbondioksida, diasetil, dan bakteriosin. Bakteriosin merupakan suatu senyawa protein yang memiliki sifat bakterisidal terhadap bakteri Gram positif dan Gram negatif. Pada awalnya bakteriosin diketahui hanya menghambat pertumbuhan bakteri yang berkerabat dekat dengan sel produser (filogenik), tetapi pada saat ini beberapa jenis bakeriocin menunjukkan spektrum yang lebih luas. Bakteriosin yang dihasilkan oleh BAL sangat menguntungkan bagi industri pangan karena aktivitasnya mampu menghambat pertumbuhan bakteri pembawa penyakit yang biasanya terdapat pada makanan
Bakteriosin merupakan peptida ribosomal yang diproduksi oleh satu strain bakteri, yang mempunyai sifat antagonistik terhadap strain bakteri lain, tetapi strain penghasil bakteriosin itu sendiri dilindungi dari aktivitas bakteriosin tersebut. Galvez et al. (2007) menyatakan bahwa bakteriosin merupakan ribosomal peptida atau protein antimikroba hasil translasi dari satu atau lebih gen pengkode peptida tersebut.Beberapa bakteriosin yang dihasilkan oleh BAL tidak hanya menghambat spesies yang berkerabat dekat tapi juga efektif melawan patogen pembusuk makanan seperti Listeria monocytogenes (Delves-Broughton, 1990).Van Belkum dan Stiles (2000) melaporkan bahwa bakteriosin dari BAL adalah sekelompok bakteri antagonis yang heterogen, mulai dari ukuran molekul beberapa ribu Dalton sampai pada struktur protein kompleks yang mungkin mengandung gugus karbohidrat atau lipid. Salah satu jenis bakteriosin adalah plantarisin yang secara spesifik disintesis oleh kelompok bakteri Gram positif Lactobacillus plantarum dan mempunyai kemampuan untuk menghambat pertumbuhan dan membunuh kelompok bakteri Gram negatif yang bersifat patogen (Gong et al. 2010; Abo-Amer 2007).
3
MATERI DAN METODE
Materi
Bahan-bahan utama penelitian ini adalah whey yang diperoleh dari produk samping pengolahan keju PT Bukit Baros Cempaka, Sukabumi, Jawa Barat. Media yang digunakan adalah De Man Rogosa Sharp Broth (MRS-Broth),de Man Regosa and sharpe Agar (MRS agar), Buffer Peptone Water (BPW), Muller Hinton Agar (MHA), Indikator phenolphthalein (PP), Bakteri Patogen (E.coli dan S. Aureus), Tripton, Sukrosa, yeast extract (YE), akuades, larutan NaOH 0.1 N, dan 1 N Serbuk Ammoniun sulfat, Tris-HCl, acrylamide, SDS reducing buffer, larutan running buffer, dan buffer kalium fosfat(campuran KH2PO4 dan K2HPO4
dengan konsentrasi tertentu).
7 sentrifuse, membran filter Millipore (0.20 μm), alumunium foil, kapas, tip, pH meter, jangka sorong, inkubator, refrigerator, autoklaf, oven, vortex, buret, spektrofotometer UV-Vis, membran dialisis, dan alat-alat tulis.
Prosedur Penelitian
Persiapan Bakteri Lactobacillus plantarum IIA-1A5
Bakteri yang digunakan dalam penelitian ini adalah Lactobacillus plantarum IIA-1A5. Sebelum digunakan, L. plantarumIIA-1A5 disegarkan dari stock culture untuk mengaktifkan kembali kultur bakteri yang digunakan Lactobacillus plantarum IIA-1A5 disegarkan ke dalam media MRSB. Penyegaran bakteri dilakukan berdasarkan Waluyo (2008) dengan menumbuhkan masing-masing 1 ml sampel di dalam media MRSB 9 ml. Bakteri starter diinkubasi pada suhu 37°C selama 24 jam. Proses penyegaran dilakukan sebanyak 3 kali. Final kultur yang diperoleh dari hasil penyegaran ini digunakan untuk tahapan penelitian selanjutnya.
Analisis Pertumbuhan Lactobacillus plantarum IIA-1A5 pada Media yang Berbeda
Analisis pertumbuhan L. plantarum IIA-1A5 dilakukan berdasarkan metode modifikasi dari Daneysa et al. (2015), kurva pertumbuhan L. plantarum IIA-1A5 ditentukan dengan menumbuhkan bakteri dalam 3 media yang berbeda yaitu media MRS-Broth, media whey 100%,danmedia whey+ (Sukrosa 20 g/L,tripton 12.5 g/L, yeast extract 7.5 g/L). Kultur L. plantarum IIA-1A5 dalam 3 media yang berbeda, sebanyak 1 ml diencerkan dalam media BPW (Buffer Peptone Water) (Oxoid, Inggris). Untuk semua sampel, masing-masing 1 mL dari pengenceran BPW diinokulasi dan dihomogenkan dengan MRSA. Selanjutnya diinkubasi pada 37°C selama 48 jam.
Pengukuran pH dan Total Asam Tertitrasi
Pengukuran pH menggunakan pH meter yang dikalibrasi dengan larutan buffer pH 4 dan 7 sebelum digunakan.Kemudian elektroda yang telah dibilas dengan air akuades dicelupkan ke dalam sampel. Nilai yang dibaca adalah nilai saat pH meter telah stabil (AOAC 2005). Persentase asam laktat diukur melalui metode titrasi.Sebanyak 10 ml sampel dimasukkan ke dalam Erlenmeyer kemudian ditambahkan 3 tetes indikator fenolftalein 1%.Sampel dititrasi dengan larutan NaOH 0.1 N sampai berwarna merah muda.
Purifikasi Plantarisin Lactobacillus plantarum IIA-1A5 (Arief et al. 2015)
8
Purifikasi Plantarisin dengan Amonium Sulfat
Supernatan bebas sel (SBS) dikoleksi dari media tumbuh L. plantarum IIA-1A5 seperti dijelaskan sebelumnya, yang kemudian dilanjutkan dengan filtrasi
dengan 0.20 μm, dan netralisasi pH dengan penambahan NaOH 1N hingga mencapai 5.8-6.2. Supernatan kemudian dievaporasi dengan menggunakan Heidolph VV micro evaporator sampai volumenya menjadi setengah dari volume awal. Proses presipitasi amonium sulfat dilakukan dengan penjenuhan supernatan dengan amonium sulfat hingga mencapai konsentrasi 90%. Presipitan (Endapan) dari proses penjenuhan ini kemudian dipisahkan dengan sentrifugasi dengan kecepatan 10000 rpm selama 20 menit. Seluruh tahapan ini dilakukan pada suhu
4˚C.
Purifikasi Plantarisin dengan Kromotografi Pertukaran Kation
Plantarisin yang secara parsial sudah dimurnikan lewat presipitasi amonium sulfat dimurnikan lebih lanjut dengan kromatografi pertukaran ion. Kolom yang digunakan untuk proses pemurnian ini adalah HiTrap SP dengan volume sekitar 5 mL. Untuk tujuan ini, presipitat plantarisin yang diperoleh dari tahap sebelumnya didialisis dengan menggunakan membran dialisis berdiameter
20 μm dan direndam dalam bufer fosfat konsentrasi 20 mm dan pH 6.8 selama 12 jam. Buffer diganti sebanyak 3 kali yaitu pada jam kedua, keempat, dan keenam. Proses dialisis ini dilakukan pada suhu 4˚C. Hasil proses dialisis selanjutnya digunakan untuk tahapan purifikasi dengan menggunakan kolom HiTrap SP. Sebelum digunakan, kolom HiTrap SP XL volume 5 mL cuci dengan aquabidest sebanyak tiga kali volume kolom dan selanjutnya diekuilibrasi dengan 20 mM fosfat bufer pH 6.0, masing-masing sebanyak empat kali volume kolom. Sampel hasil dialisis dimasukkan ke dalam kolom secara manual dengan syringe dan
sebagai satu fraksi.Seluruh tahapan ini dilakukan pada 4˚C. Keberadaan protein yang terelusi pada fraksi-fraksi tersebut dideteksi dengan spektofotometer UV-VIS pada panjang gelombang 280 nm.Selanjutnya keberadaan dan kemurnian plantarisin pada fraksi-fraksi tersebut dikonfirmasi dengan elektroforesis SDS-PAGE, sedangkan konsentrasi plantarisin diukur dengan menggunakan uji Lowry 20 mm.
Elektroforesis SDS-PAGE
9 protein dimurnikan plantarisin IIA-1A5 yang ditentukan berdasarkan metode Lowry (Lowry et al.1951) kemudian penentuan antimikroba terhadap fraksi yang terpilih.
Analisis Kadar Protein Metode Lowry (Lowry et al. 1951)
Penetapan Kadar Protein metode Lowry et al. (1951) sebagai berikut: 1 ml suspensi protein dimasukkan ke dalam kuvet dan ditambah 1 ml larutan Na2COs
2% (w/v) dalam NaOH 0.1 N, Na+K+tartrate 2% (w/v), dan CuSO4.5H2O 1%
(w/v) dengan perbandingan 10:0.5:0.5. 3 ml Folin-ciocalteu ditambahkan ke dalam kuvet. Setelah diinkubasi selama 10 menit, absorban dibaca pada A 600 nm. Untuk kurva standar, digunakan BSA dengan konsentrasi 0; 0.1; 0.2; 0.4; 0.6, 0.8 dan 1.0 mg mL-.
Uji Aktivitas Antimikroba
Aktivitas antibakteri berdasarkan metode modifikasi dari Dhiman et al. (2011), bahwa untuk menentukan aktivitas antibakteri plantarisin itu, 0,1 ml bakteri patogen dituangkan dengan media Muller Hinton Agar (20 ml) di cawan petri (90 mm). Disterilkan paper disc (Oxoid, United kingdom) direndam dalam eppendorf yang berbeda yang berisi plantarisin IIA-1A5 sebanyak 50 μL dari konsentrasi yang berbeda. Cawan diinkubasi pada 37°C selama 24 jam untuk S. aureus 25922 dan E. coli 25923 pada 37°C. Setelah inkubasi, aktivitas antimikroba plantarisin ditentukan oleh pembentukan zona bening di sekitar paper disc dan zona bening diukur diameternya.
Analisis Komposisi Asam Amino (Osthoff et al. 2002)
Komposisi asam amino ditentukan dengan menggunakan high-performance liquid chromatography (HPLC). Sampel dihidrolisis dengan asam mengikuti Osthoff et al. (2002) kemudian sekitar 5 mL sampel diinjeksikan ke dalam kolom HPLC dan ditunggu sampai pemisahan semua asam amino selesai. Waktu yang diperlukan sekitar 30 menit. Pengerjaan pada tahap penambahan pereaksi OPA sampai pemisahan asam amino selesai dilakukan secara otomatis. Komposisi nitrogen dalam protein total ditentukan melalui metode Kjeldahl. Konsentrasi asam amino dalam sampel dapat dihitung sebagai berikut :
10
Prosedur Analisis Data
Rancangan yang akan digunakan dalam penelitian ini adalah Rancangan Acak Lengkap (RAL) dengan model rancangan seperti di bawah ini:
Yij = µ + Pi + Eij
Keterangan:
Yij = Nilai respon akibat pengaruh perlakuan pada taraf ke-I (i= perlakuan media yang berbeda) pada ulangan ke-j.
µ = Nilai tengah umum
Pi = Pengaruh perlakuan ke-i dari 3 taraf perlakuan media pertumbuhan yang berbeda pada taraf ke-i
Εij = Pengaruh galat percobaan ke-i dan ulangan ke-j (1,2,3).
Rancangan acak lengkap (RAL) pola faktorial, dengan model rancangan sebagai berikut:
Yijk = μ + Ci + Pj + CPij + εijk
Keterangan :
Yijk = Variabel respon akibat perlakuan media ke–I
(L.plantarum IIA-1A5) atau lama inkubasi ke-j (jam) pada ulangan ke-j (1, 2, 3).
µ = Nilai rata-rata pertumbuhan dan produksi bakteriosin. Ci = Pengaruh Media ke-i (L. plantarum IIA-1A5)
terhadap pertumbuhan dan produksi bakteriosin Pj = Pengaruh lama inkubasi ke-j (jam) terhadap
pertumbuhan dan produksi bakteriosin.
CPij = Pengaruh interaksi antara media tumbuh ke-i (L. plantarum IIA-1A5) dan lama inkubasi ke-j (jam).
εijk = Pengaruh galat media ke-i (L. plantarum IIA-1A5) dan
lama inkubasi ke-j (jam) pada ulangan ke-j (1, 2, 3)
Rancangan acak kelompok (RAK) pola faktorial, dengan model rancangan sebagai berikut:
11 Keterangan :
Hijk = Hasil akibat perlakuan ke-j dan perlakuan ke-k pada kelompok ke-i
Π = Nilai tengah umum
Ki = Pengaruh kelompok ke-I (1, 2, ….,)
Pj = Pengaruh faktor perlakuan ke-j(1, 2, …., p ke-1) Pk = Pengaruh faktor perlakuan ke-k(1, 2,…... p ke-2) Pj x Pk = Interaksi perlakuan ke-j dan perlakuan ke-k
Eijk = Eror akibat perlakuan ke-j dan perlakuan ke-k pada kelompok ke- I (1, 2, …., k (k = kelompok).
12
4
HASIL DAN PEMBAHASAN
Kurva Pertumbuhan
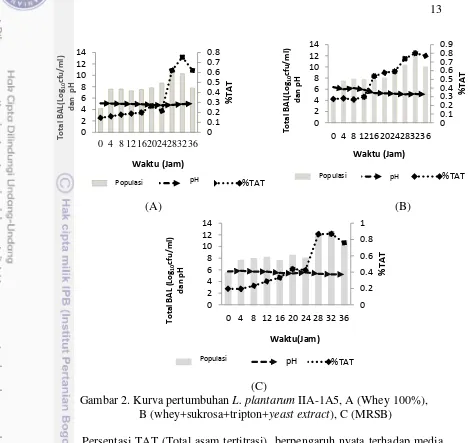
Kurva pertumbuhan L. plantarum IIA-1A5 dalam media tumbuh (Whey, Whey+, dan MRSB) menunjukkan bahwa bakteri L. plantarum 1A5 pada masa inkubasi jam ke-28 dan jam ke-32 mengalami fase logaritmik (Gambar 2), total BAL tidak berpengaruh nyata terhadap media tumbuh (P>0.05). Media pertumbuhan yang digunakan berbeda dari media pertumbuhan sebelumnya (MRSB). Hal ini sesuai dengan pendapat Polak-Berecka et al. (2010) bahwa media MRS merupakan media paling umum digunakan untuk pertumbuhan BAL.
Total BAL berpengaruh nyata terhadap masa inkubasi (P<0.05), karena kurva pertumbuhan dalam proses pembelahan sel sangat tergantung dengan waktu. Kurva pertumbuhan juga menunjukkan bahwa bakteri memiliki fase adaptasi yang lambat untuk setiap perlakuan, dan masa inkubasi padajam ke-28 dan jam ke-32 terjadi peningkatan populasi tertinggi , L. plantarum IIA-1A5 mengalami fase log. Hal ini sesuai pendapat Martinez et al. (2013) bahwa pertumbuhan dan produksi bakteriosin sering terjadi selama akhir fase log atau awal fasestasioner. Todar (2009) juga menambahkan bahwa lamanya fase adaptasi tergantung pada berbagai faktor termasuk ukuran inokulum, waktu yang diperlukan untuk pulih dari kerusakan fisik pada saat inokulasi, dan waktu yang dibutuhkan untuk mensintesis enzim baru yang diperlukan untuk membantu metabolisme substrat yang terdapat dalam media tumbuh. Hal inisesuai pendapat Kleerebezem dan Quadri (2001) bahwa fase adaptasi pada bakteriberbeda, tergantung dari setiap strain L. plantarum. Todorov dan Dicks (2007), menyebutkan bahwa L. pentosus ST712BZ optimum setelah lama fermentasi 24 jam
13
(A) (B)
(C)
Gambar 2. Kurva pertumbuhan L. plantarum IIA-1A5, A (Whey 100%), B (whey+sukrosa+tripton+yeast extract), C (MRSB)
14
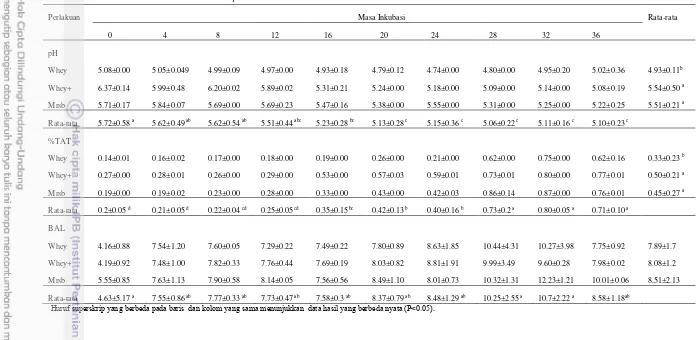
Tabel 2. Pertumbuhan Lactobacillus plantarum IIA-1A5
Perlakuan Masa Inkubasi Rata-rata
0 4 8 12 16 20 24 28 32 36 pH
Whey 5.08±0.00 5.05±0.049 4.99±0.09 4.97±0.00 4.93±0.18 4.79±0.12 4.74±0.00 4.80±0.00 4.95±0.20 5.02±0.36 4.93±0.11b
Whey+ 6.37±0.14 5.99±0.48 6.20±0.02 5.89±0.02 5.31±0.21 5.24±0.00 5.18±0.00 5.09±0.00 5.14±0.00 5.08±0.19 5.54±0.50 a
Mrsb 5.71±0.17 5.84±0.07 5.69±0.00 5.69±0.23 5.47±0.16 5.38±0.00 5.55±0.00 5.31±0.00 5.25±0.00 5.22±0.25 5.51±0.21 a
Rata-rata 5.72±0.58 a 5.62±0.49 ab 5.62±0.54 ab 5.51±0.44 abc 5.23±0.28 bc 5.13±0.28 c 5.15±0.36 c 5.06±0.22 c 5.11±0.16 c 5.10±0.23 c
%TAT
Whey 0.14±0.01 0.16±0.02 0.17±0.00 0.18±0.00 0.19±0.00 0.26±0.00 0.21±0.00 0.62±0.00 0.75±0.00 0.62±0.16 0.33±0.23 b
Whey+ 0.27±0.00 0.28±0.01 0.26±0.00 0.29±0.00 0.53±0.00 0.57±0.03 0.59±0.01 0.73±0.01 0.80±0.00 0.77±0.01 0.50±0.21 a
Mrsb 0.19±0.00 0.19±0.02 0.23±0.00 0.28±0.00 0.33±0.00 0.43±0.00 0.42±0.03 0.86±0.14 0.87±0.00 0.76±0.01 0.45±0.27 a
Rata-rata 0.2±0.05 d 0.21±0.05 d 0.22±0.04 cd 0.25±0.05 cd 0.35±0.15bc 0.42±0.13 b 0.40±0.16 b 0.73±0.2 a 0.80±0.05 a 0.71±0.10 a
BAL
Whey 4.16±0.88 7.54±1.20 7.60±0.05 7.29±0.22 7.49±0.22 7.80±0.89 8.63±1.85 10.44±4.31 10.27±3.98 7.75±0.92 7.89±1.7 Whey+ 4.19±0.92 7.48±1.00 7.82±0.33 7.76±0.44 7.69±0.19 8.03±0.82 8.81±1.91 9.99±3.49 9.60±0.28 7.98±0.02 8.08±1.2 Mrsb 5.55±0.85 7.63±1.13 7.90±0.58 8.14±0.05 7.56±0.56 8.49±1.10 8.01±0.73 10.32±1.31 12.23±1.21 10.01±0.06 8.51±2.13 Rata-rata 4.63±5.17 a 7.55±0.86 ab 7.77±0.33 ab 7.73±0.47 ab 7.58±0.3 ab 8.37±0.79 ab 8.48±1.29 ab 10.25±2.55 a 10.7±2.22 a 8.58±1.18ab
15
Secara umum BAL adalah kelompok bakteri yang memproduksi asam laktat sebagai hasil metabolisme utamanya selama fermentasi karbohidrat. Media tumbuh (Whey+ dan MRSB) berpengaruh nyata terhadap total BAL, persentasi TAT, dan pH (P<0.05), hal ini dipengaruhi oleh komposisi nutrisi pada media tumbuh, media tumbuh whey+ dan MRSB menghasilkan total BAL yang tinggi. Zacharof dan Lovit (2012) menyatakan bahwa, kandungan nutrisi pada media tumbuh sangat berpengaruh, yaitu sumber karbon, sumber vitamin, nitrogen, sumber asam amino, belerang dan fosfat, serta berbagai komponen mineral. Todorov dan Leon (2005), media MRS merupakan media terbaik untuk produksi bakteriosin oleh L. plantarum ST194BZ.
Masa inkubasi berpengaruh nyata terhadap total BAL, pH, dan persentasi TAT (P<0.05). Puncak populasi tertinggi pada total BAL dan persentasi asam tertitrasi dalam masa inkubasi jam 28 dan 32 jam, tetapi terjadi penurunan pH (Tabel 2). Rendahnya nilai pH secara umum berhubungan dengan asam organik yang diproduksi oleh BAL. Hal ini sesuai pendapat Sun et al. (2010) bahwa perbedaan jumlah mikroba ditentukan oleh lama fermentasi dan fermentasi selama 30 jam menggunakan bakteri L. helveticus pada susu skim dapat menurunkan pH dari 6.52 menjadi 4.16.
Besarnya persentasi TAT (Total asam tertitrasi) berbanding terbalik dengan nilai pH. Nilai persentasi TAT menunjukkan jumlah semua asam yang terdapat dalam media (Whey, Whey+ dan MRSB), baik asam yang terdisosiasi maupun asam yang tidak terdisosiasi.Hasil persentasi TAT L.plantarum disajikan pada Tabel 2. Nilai persentasi TAT pada ketiga media tumbuh yang dihasilkan berbanding terbalik dengan nilai pH. Hal ini disebabkan semakin tinggi jumlah asam yang dihasilkan, maka mempengaruhi penurunan pH. Hal ini sesuai pendapat Winarno dan Fernandez (2007) bahwa, penurunan nilai pH selama penyimpanan disebabkan oleh adanya aktivitas bakteri asam laktat yang mengubah laktosa menjadi asam laktat, asam laktat yang dihasilkan dari metabolisme karbohidrat akan dapat menurunkan nilai pH lingkungan pertumbuhannya dan menimbulkan rasa asam.
Purifikasi Plantarisin
16
Plantarisin IIA-1A5 mengandung-fraksi dari presipitat amonium yang kemudian diterapkan dengan menggunakan kolom kromatografi pertukaran ion, plantarisin mengikat kuat kationik resin pada pH 6.8 jumlah total plantarisin dimurnikan IIA-1A5 menggunakan SP Sepharose fast flow 74.26 mg/L. Sedangkan plantarisin ASM1 jumlah total dimurnikan dengan SP-Sepharose mengikat 17.5 mg/mL (Hata et al. 2010). Arief et al. (2015b) menyatakan bahwa, jumlah total plantarisin IIA-1A5 dimurnikan menggunakan SP Sepharose fast flow adalah 4.5 mg (dari 1 liter kultur MRSB, ditambah dengan yeast extract 3%).
(A) (B)
Gambar 3. Profil elusi plantarisin IIA-1A5 spektrofotometer (280nm).A (Whey+, sukrosa, tripton, yeast extract), B (Whey keju 100%).
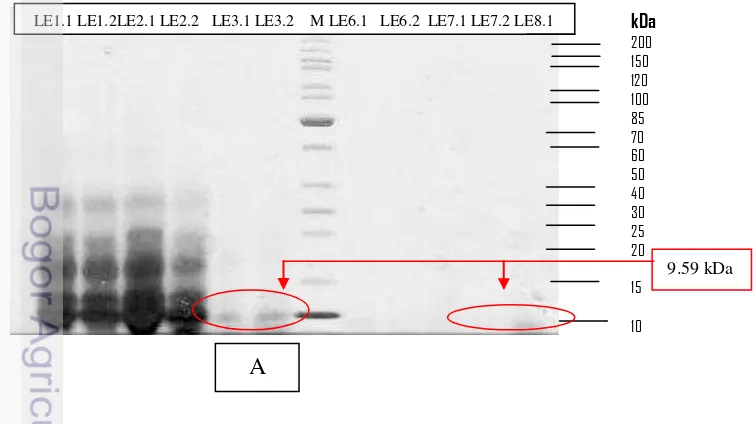
Bobot Molekul dan Konsentrasi Protein Plantarisin IIA-1A5
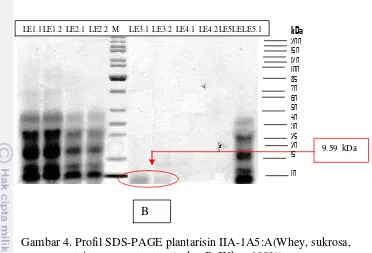
Berdasarkan elektroforesis SDS-PAGE diketahui bobot molekul plantarisin IIA-1A5 pada media whey+ 9.59 kDa (Gambar 4. A) dan whey 9.59 kDa (Gambar 4. B), berada pada kelas IIa `(<10 kDa). Nilai ini lebih tinggi dibandingkan dengan plantirisin IIA-1A5 Arief et al. (2015a) bahwa bobot molekul plantarisin IIA-1A5 yang diperoleh berdasarkan elektroforesis SDS-PAGE adalah 6.41 namun masih berada pada kelas IIa (<10 kDa).
17
Gambar 4. Profil SDS-PAGE plantarisin IIA-1A5:A(Whey, sukrosa, tripton, yeast extract), dan B (Whey 100%)
Plantarisin IIA-1A5 berada pada kelas IIa (<10 kDa) Kelas II: terdiri dari peptida termostabil (<10 kDa, sekitar 37-48 asam amino), yang menurut Drider et al. (2006) yang dibagi menjadi tiga subclass dikenal sebagai Kelas IIa (kelompok bakteriosin pediocin yang aktif terhadap Listeria spp.). Konsentrasi protein plantarisin yang dihasilkan Lactobacillus plantarum IIA-1A5 pada perlakuan whey+ total protein 1883.17 mg/mL, dan whey total protein 325.58 mg/mL (Gambar 5). Konsentrasi protein plantarisin ASM1 adalah 17.500 mg/mL (Hata et al. 2010) sedangkan pada plantarisin LR14 berada pada kisaran 59.21 μg/mL (Tiwari & Srivastava 2008). Hal ini membuktikan bahwa perbedaan strain Lactobacillus plantarum akan mempengaruhi karakteristik plantarisin yang dihasilkan (Saenz et al. 2009; Arief et al. 2015b).
Gambar 5. Jumlah protein plantarisin IIA-1A5
18
Aktivitas Antimikroba Plantarisin
Plantarisin IIA-1A5 memiliki aktivitas antimikroba yang lebih besar,menunjukkan bahwa laktosa pada wheyberhasil difermentasi dengan baik, dengan aktivitas antimikroba pada S. aureus ATCC 25923 dalam media whey 38.02 (IU/dL) dan dalam whey+ (Sukrosa, tripton, dan yeast extact) 321.10 (IU/dL) (Tabel 3). Hal ini sesuai pendapat Kia et al. (2016) bahwa aktivitas antibakteri plantarisin IIA-1A5 menunjukkan aktivitas antibakteri yang kuat dari plantarisin IIA-1A5 terhadap E. coli ATCC 25922 dan S. aureus ATCC 25923 dengan diameter zona hambat adalah sekitar 10 mm. Arief et al. (2015) menyatakan bahwa aktivitas antimikroba plantarisin IIA-1A5 terhadap S. aureus ATCC 25923 10.39 mm2. Menurut Hu et al. (2013) bahwa plantarisin lain menunjukkan spektrum antimikroba yang lebih luas menghambat dari bakteri patogen spesies Lactobacillus, diproduksi oleh L. plantarum 163 yang diisolasi dari fermentasi sayuran Cina tradisional, menghambat bakteri Gram-positif. Hal ini sesuai Gong et al. (2010), plantarisin MG terdapat aktivitas antimikroba terhadap bakteri gram positif dan Gram negative termasuk L. monocytogenes, S.aureus , Salmonella typhimurium , dan E. coli.
Tabel 3. Aktivitas antimikroba plantarisin IIA-1A5 (IU/dL)
Media E. coli ATCC 25922 S. aureus ATCC 25923
(IU.dL-1)
Whey 44.85±1.12a 38.02±1.25a
Whey+ 172.02±1.68b 321.10±0.67b
Ampisilin 53125±5622 53125±5621
Penisilin 67665±615.18 67665±615.18
Gentamisin 82093±1074 82093±1074
khloramphenikol 28670±9262 37490±6729
Novobiosin 29184±16960 38157±29088
Huruf superskrip yang berbeda pada kolom yang sama menunjukkan hasil yang berbeda nyata(P<0.05),Whey+ (sukrosa,tripton,dan yeast extract).
19
Gambar 5. Aktivitas antimikroba plantarisin IIA-1A5, a; whey (E. coli ATCC
25922), b; Whey+ (E. coli ATCC 25922), c; Whey (S. aureusATCC
25923),d; Whey+ (S. aureus ATCC 25923), e; khlorampenicol (S.
aureus ATCC 25923), dan f; novobiocin (S. aureus ATCC 25923).
Media tumbuh (Whey dan whey+) berpengaruh nyata terhadap zona hambat plantarisin (P<0.05), dan bakteri indikator pathogen berpengaruh nyata terhadap zona hambat (P<0.05).Plantarisin IIA-1A5 dibandingkan dengan menggunakan beberapa antibiotik yaitu ampicilin, penicilin,gentamicin, kloramfenicol dan novobiocin, memiliki zona hambat lebih tinggi pada antibiotik dengan bakteri indikator E. coli ATCC 25922 dan S. aureus ATCC 25923 (Tabel 3). Antibiotik memiliki zona hambat yang lebih tinggi yang menghambat sintesis protein pada bakteri, dan dinding sel bakteri. Hal ini sesuai pendapat Jawetz et al. (2005), bahwa gentamicin dan khorampenicol dapat menghambat sintesis protein pada bakteri, sedangkan ampicilin dapat menghambat sintesis dinding sel bakteri sehingga aktif melawan pertumbuhan bakteri.
Komposisi Asam Amino Plantarisin IIA-1A5
Asam amino adalah suatu komponen organik yang mengandung gugus amino dan karboksil. Susunan kandungan asam amino dapat menentukan kualitas protein. Protein yang mengandung semua asam amino penting dalam jumlah yang diperlukan tubuh, maka protein ini mempunyai mutu yang tinggi. Jika mengalami kekurangan salah satu atau lebih asam amino esensial maka protein ini termasuk mutu yang rendah (Winarno 2008). Asam amino biasanya larut dalam air dan tidak larut dalam pelarut organik non polar yaitu eter, aseton, dan kloroform
c d
20
(Sitompul 2004). Berdasarkan sifat kimia rantai sampingnya, asam amino dapat dibagi menjadi empat kelompok, yaitu asam amino yang bersifat basa lemah, asam lemah, hidrofilik jika polar dan hidrofobik jika nonpolar (Almatsier 2006). Komponen protein susu sekitar 95% disintesis dari asam amino. Komponen yang
utama protein dalam whey: β-laktoglobulin, α-lactalbumin, serum albumin dan beberapa immunoglubin (Edwards et al. 2009).
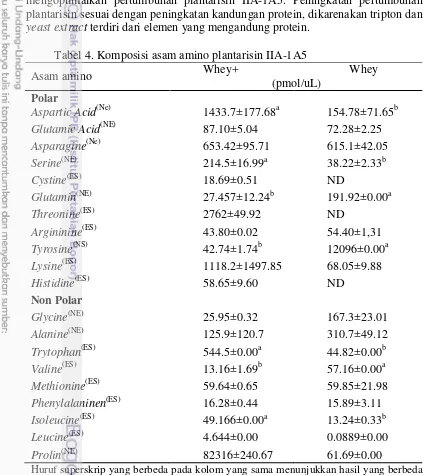
Tabel 4 menunjukkan bahwa dalam media whey dan whey+ terdapat komposisi asam amino yang lebih tinggi dalam media whey+, karena dalam media whey+ terdapat penambahan bahan tripton dan yeast extract, yang menunjukkan bahwa penambahan tripton dan yeast extract mampu mengoptimalkan pertumbuhan plantarisin IIA-1A5. Peningkatan pertumbuhan plantarisin sesuai dengan peningkatan kandungan protein, dikarenakan tripton dan yeast extract terdiri dari elemen yang mengandung protein.
Tabel 4. Komposisi asam amino plantarisin IIA-1A5
Asam amino Whey+ Whey (pmol/uL)
Polar
Aspartic Acid(Ne) 1433.7±177.68a 154.78±71.65b
Glutamic Acid(NE) 87.10±5.04 72.28±2.25
Asparagine(Ne) 653.42±95.71 615.1±42.05
21 Pada Tabel 4 asam amino esensial (tryptopan, treonine, lysine, histidin) terdapat konsentrasi yang paling tinggi dibandingkan dengan asam amino non esensial. Hal ini sesuai pendapat Edwards et al. (2009) , protein whey adalah sumber yang optimal untuk fortifikasi, terutama karena beberapa asam amino esensial, termasuk lysin, triptofan, isoleusin, leusin, treonin, dan valin. Namun Tabel 4 menunjukkan sistein dan treonin tidak terdeteksi, hal ini mungkin disebabkan tingkat konsentrasi asam amino yang rendah. Hal ini sesuai pernyataan Atrih et al. (2001) melaporkan bahwa plantarisin C19 mengandung proporsi yang tinggi dari glisin, asam amino hidrofobik (terutama alanin dan valin), sementara tryptophan dan sistein tidak terdeteksi, karena ketidakstabilan hidrolisis asam yang rendah, sehingga tidak memungkinkan kuantifikasi akurat.
Tabel 4 pada asam amino polar lebih tinggi dibandingkan non polar, hal ini berpengaruh positif terhadap kelarutan. Komposisi asam-asam amino merupakan salah satu faktor yang berpengaruh terhadap sifat fungsional suatu protein. Hal ini sesuai pendapat Sinz and Schwab (2012) melaporkan bahwa L. plantarum memiliki dipeptida yang lebih tinggi yang dapat diamati, di mana sistem hidrolase peptida dengan aktivitas tinggiyang terdapat dalam sel. Akumulasi asam amino dari dipeptida internal yang lebih tinggi dari asam amino bebas mengkonfirmasikan peran utama dipeptida sebagai sumber nitrogen untuk pertumbuhan mikroorganisme (Saguir et al. 2008).
SIMPULAN
Whey berpotensi digunakan sebagai media produksi bakteriosin L. plantarum IIA-1A5 dan menghasilkan senyawa antimikroba terhadap S. aureus ATCC 25923 dan E. coli ATCC 25922. Plantarisin yang dproduksi dari L. plantarum IIA-1A5 mempunyai bobot molekul 9.59 kDa.
SARAN
22
DAFTAR PUSTAKA
Abo-Amer AE. 2007. Characterization of a bacteriocin-like inhibitory substance produced by Lactobacillus plantarum isolated from egyptian home-made yogurt. J Sci Asia 33:313-319
AOAC. 2005. Official method of analysis vol I. 18 th edn. Association of Official Analytical Chemists Inc, Maryland
Arasu MV et al. 2013. Isolation and characterization of antifungal compound from Lactobacillus plantarum kcc-10 from forage silage with potential beneficial properties. J of Applied Microbiology 115:1172-1185.
Arief II, Budiman C, Jenie B, Andreas E, Yuneni A. 2015a. Plantarisin IIA-1A5 from Lactobacillus plantarum IIA-1A5 displays bactericidal activity against Staphylococcus aureus. Beneficial Microbes. 6:603-613.
Arief II, Jenie BSL, Astawan M, Fujiyama K, and Witarto AR. 2015b. Identification and probiotic characteristics of Lactic Acid Bacteria Isolated from Indonesian Local Beef. Asian J of Animal Sciences. 9(1):25-36 Arief II, Jakaria, Suryati T, Wulandari Z, Andreas E. 2013. Isolation and
characterization of plantarisin produced by Lactobacillus plantarumstrains (IIA-1A5, IIA-1B1, IIA-2B2). Media Peternakan. 36:91-100
Arief II, Jenie BSL, Suryati T, Ayuningtyas G, Fuziawan A. 2012. Antimicrobial activity of bacteriocin from indigenous Lactobacillus plantarum 2C12 and its application on beef meatball as biopreservative. J of the Indonesian Tropic Anim Agric. 37:90-96.
Atrih A, Rekhif N, Moir AJG, Lebrihi A, Lefebvre G. 2001. Mode of action, purification and amino acid sequence of plantarisin C19, an anti-Listeria bacteriocin produced by Lactobacillus plantarum C19. International J of Food Microbiology. 68:93-104.
23 Daneysa LK, Rute W, Ademir M, Cleonice MPS, Luciane MC, Eliane C . 2015.
Characterization of the spoilage lactic acid bacteria in sliced vacuum-packed cooked ham. Brazilian J of Microbiology. 46:1:173-181
Delves-Broughton J. 1990. Nisin and its uses as a food preservative. J. Food Technol. 74:100–112.
De Man JM. 1997. Kimia Makanan. ITB, Bandung.
De Wit JN. 2001. Lecture's handbook on whey and whey product. European Whey Products Association, Brussels, Belgium
Dhiman A, Nanda A, Ahmad S, Narasimhan B. 2011. In vitro antimicrobial activity of methanolic leaf extract of Psidium guajava L. J Pharm Bioallied Sci. 3(2):226-9.
Diep D, Hacarstein LS, Nes IF. 1996. Characterization of the locus responsible for the bacteriocin production in Lactobacillus plantarum C11. J of Bacteriology. 4472-4483.
Drider D, Fimland G, Héchard Y, McMullen LM, Prévost H. 2006.The continuing story of class IIa bacteriocins. Microbiology and Molecular Biology Reviews. 70:562-582 .
Edwards PB, Creamer LK, Jameson GB. 2009. Structure and stability of whey proteins In: Thompson A, Boland M, Singh H (eds) Milk proteins: From expression to food. Academic Press, San Diego, pp 163-201.
Fardiaz S. 1992. Mikrobiologi Pangan. Raja Grafindo Persada, Jakarta.
Galvez A, Abrionel H, Lopez R.L, and Omar NB. 2007. Bacteriosin-based strategies for food bi, preservation. Int J Food microbio. 120: 51-70. Gaspers V. 1991. Analysis Techniques in Experimental Research. Tarsito,
Bandung
Gong HS, Meng XC, Wang H. 2010.Plantarisin mg active against gram-negative bacteria produced by Lactobacillus plantarum klds1.0391 isolated from "Jiaoke", a traditional fermented cream from china. Food Control. 21:89-96.
Gordon, J., 1993. Dairy Products in Food Industries Manual 23rd ed. Chapman and Hall. London.
24
Helferich W, and Westhoff D. 1980. All About Yoghurt. Prentice-Hall, Inc. Englewood Cliffs : New Jersey.
Hernandez D, Cardell E, Zarate V. 2005. Antimicrobial activity of lactic acid bacteria isolated from tenerife cheese: Initial characterization of plantarisinTF711, a bacteriocin-like substance produced by Lactobacillus plantarum tf711. J of Applied Microbiology. 99:77-84.
Holo H, Jeknic Z, Daeschel M, Stevanovic S, Nes IF. 2001. Plantaricin W from Lactobacillus plantarum belongs to new family of two-peptide lantibiotics. J Microbiology. 147:643-651.
Hu M, Zhao H, Zhang C, Yu J, Lu Z. 2013. Purification and characterization of plantarisin 163, a novel bacteriocin produced byLactobacillus plantarum 163 isolated from traditional chinese fermented vegetables. J of Agric and Food Chemist. 61:11676-11682.
Jawetz E, Melnick JL, Adelberg EA. 2005. Medical Microbiology. 1 Edn. Salemba Medika, Jakarta
Jenie SL, dan Rini SE. 1995. Aktivitas Antimikroba dari Beberapa Spesies Lactobacillus terhadap Mikroba Patogen dan Perusak Makanan. Buletin Teknologi Industri Pangan. 7(2) : 46-51.
Kementerian Pertanian. 2012. Statistik Peternakan dan Kesehatan Hewan 2012. Direktorat Jenderal Peternakan dan Kesehatan Hewan, Kementerian Pertanian [Internet]. Tersedia pada: http://ditjennak.deptan.go.id.
Kia KW, Arief II, Sumantri C, Budiman C. 2016. Plantarisin IIA-1A5 from Lactobacillus plantarum IIA-1A5 retards pathogenic bacteria in beef meatball stored at room temperature. Amrican J of Food Technology.11:37-43.
Kleerebezem M, Quadri LE. 2001. Peptide pheromone-dependent regulation of antimicrobial peptide production in Gram-positive bacteria: A case of multicellular behavior. Peptides 22:1579-1596. Laemmli UK. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage t4. Nature. 227:680-685
Leclerc ML, Elfoul-Bensaid , and Bernalier A. 1998 . Effect of yeast extract on growth and metabolism of H2-utilizing acetogenic bacteria from the human colon. J Appl Microb. 37(3):166-71.
Lowry OH, Rosebrough NJ, Farr AL, Randall RJ. 1951. Protein Measurement with the Folin Phenol Reagent. J Biol Chem.193:265-275
25 Maldonado A, ui - arba JL, Jime ne -Díaz R. 2003. Purification and genetic
characterization of plantaricin NC8, a novel coculture-inducible two-peptide bacteriocin from Lactobacillus plantarum NC8. J App Environm Microb.69 : 383-389.
Martinez FAC, Balciunas EM, Converti A, Cotter PD, de Souza Oliveira RP. 2013. Bacteriocin production by bifidobacterium spp. A review. Biotechnology Advances. 31:482-488.
Mazza G. 1998. Functional Food. Biochemical and Processing. Aspects Technomic Publishing Company, Inc, USA.
Moulay, M, H. Aggad, Z. Benmechernene, B. Guessas, D.E. Henni & M. Kihal.
2006. Cultivable lactic acid bacteria isolated from algerian raw goat’s milk
and their proteolytic activity. World J Dairy & Food Sci. 1(1): 12-18. Osthoff G, Hugo A, Venter H. 2002. Study of the changes in protein fractions and
amino acids of an unfermented south african dried sausage. J of Food Technology in Africa. 7:101-108.
Polak-Berecka M, Adam W, Monika K, Marcin P, Zdzislaw T, Agnieszka K.2010. Optimization of medium composition for enhancing growth ofLactobacillus rhamnosus PEN using response surface methodology. Polish J Microbiol 59(2): 113-118.
Pomeranz Y. 1985. Functional Properties of Food Components. 2nd edn. Academic Press Inc, San Diego
Saenz Y, Rojo-Bezares B, Navarro L, Diez L. Samalo S, Zarazaga M, Ruiz-larrea, Torres C. 2009. Genetic diversity of the pln locus among oenological Lactobacillus plantarum strains. International J of Food Microbiology. 134:176-183.
Saguir FM, Loto Campos IE, Manca de Nadra MC. 2008. Utilization of amino acids and dipeptides by Lactobacillus plantarum from orange in nutritionally stressed conditions. J of Applied Microbiology . 104:1597-1604.
Sastrohamidjojo, H. 2005. Kimia Organik. Sterokimia, Karbohodrat, Lemak dan Protein. Gadjah mada University Press, Yogyakarta.
Savadogo A, Cheik ATQ, Imael HNB and Traore SA. 2006. Bacteriocins and lactic acid bacteria – a minireview. Afric J Biotechnol. 5 (9): 678-683. Spreer E. 1998. Milk and Dairy Product Technology. Marcel Dekker Inc. USA. Sinz Q, Schwab W. 2012. Metabolism of amino acids, dipeptides and
26 T.S.Sun and H.P. Zhang. 2010. Identification and characterization of dominant lactic acid bacteria isolated from traditional fermented milk in mongolia. Folia Microbiol. 55(3) : 270-276.
Tiwari SK, Srivastava S. 2008. Purification and characterization of plantarisin lr14: A novel bacteriocin produced by Lactobacillus plantarum LR/14. Applied Microbiology and Biotechnology. 79:759-767.
Todar K, 2009. The growth of bacterial populations.
http://textbookofbacteriology.net/growth.html. Accessed 3 March 2016
Todorov SD, Leon MTD. 2005. Effect of growth medium on bacteriocinproduction by Lactobacillus plantarum ST194BZ, a strain isolated from Boza. Food Technol Microbiol. 43(2): 165-173.
Todorov SD, Nyati H, Meincken M, Dicks LMT. 2007. Partial characterization of bacteriocin ama-k, produced by Lactobacillus plantarum ama-k isolated from naturally fermented milk from zimbabwe. Food Control. 18:656-664. Van Belkum MJ and Stiles ME. 2000. Nonlantibiotic antibacterial peptides from
lactic acid bacteria. Nat Prod Rep. 17: 323-335.
Vinderola CG, Gueimonde M, Delgado T, Reinheimer JA and de los Reyes
– Gavilan CG. 2000. Characteristics carbonated fermented milk and survival of probiotik bacteria. Internasional Dairy J . 10-213-220.
Vermeiren L, Devlieghere F, Debevere J.2004.Evaluation of meat born lactic acid bacteria as protective cultures for the bio-preservation of cooked meat products. Int J Food Microbiol. 96:149-164.
27
28
Lampiran 1. Hasil perhitungan T-test BAL L. plantarum IIA-1A5
Sumber Keragaman Jumlah Kuadrat db Kuadrat Tengah T.Hit P
Media 2.977 2 1.489 0.335 0.717
Jam 147.5 9 16.389 3.693 0.001
Galat 212.99 48 4.437
Total 4340.193 60
Lampiran 2. Hasil perhitungan T-test TAT L. plantarum IIA-1A5
Sumber Keragaman Jumlah Kuadrat db Kuadrat Tengah T.Hit P
Media 0.336 2 0.168 35.508 0.00
Jam 2.983 9 0.331 69.964 0.00
Galat 0.227 48 0.005
Total 14.927 60
Lampiran 3. Hasil perhitungan T-test pH L. plantarum IIA-1A5
Sumber Keragaman Jumlah Kuadrat Db Kuadrat Tengah T.Hit P
Media 4.778 2 2.389 41.02 0.00
Jam 3.616 9 0.402 6.898 0.00
Galat 2.796 48 0.058
Total 1717.963 60
Lampiran 4. Hasil perhitungan T-test Aktivitas antimikroba E.coli plantaricin IIA-1A5
Sumber Keragaman Jumlah Kuadrat db Kuadra Tengah T.Hit P
Perlakuan 16172.144 11 16172.144 7920 0.00
Galat 4.082 2 2.041
Total 63209.563 4
Lampiran 5. Hasil perhitungan T-test Aktivitas antimikroba S. aureus plantaricin IIA-1A5
Sumber Keragaman Jumlah Kuadrat Db Kuadrat Tengah T.Hit P
Perlakuan 80135.19 1 0135.179 78610 0.00
Galat 2.039 2 1.019
29