TOKSISITAS EKSTRAK TEMU LAWAK (
Curcuma xanthorriza
Roxb) BERDASARKAN UJI LETALITAS LARVA UDANG
DAN EMBRIO IKAN ZEBRA
NURFADILAWATI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Toksisitas Ekstrak Temu Lawak (Curcuma xanthorriza Roxb) Berdasarkan Uji Letalitas Larva Udang dan Embrio Ikan Zebra adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
NURFADILAWATI. Toksisitas Ekstrak Temu Lawak (Curcuma xanthorriza) Berdasarkan Uji Letalitas Larva Udang dan Embrio Ikan Zebra. Dibimbing oleh GUSTINI SYAHBIRIN dan KUSDIANTORO MOHAMAD.
Temu lawak (Curcuma xanthorriza) telah diketahui memiliki berbagai aktivitas farmakologis dengan kurkuminoid adalah senyawa aktif yang dominan. Penelitian ini bertujuan menentukan kadar kurkuminoid dan menguji toksisitas ekstrak etanol dan fraksi etil asetat temu lawak. Kadar kurkuminoid ditentukan menggunakan kromatografi cair kinerja tinggi, sedangkan uji toksisitas menggunakan larva udang (metode BSLT) dan embrio ikan zebra (metode ZFET). Berdasarkan hasil penelitian, kadar kurkuminoid ekstrak etanol lebih tinggi daripada fraksi etil asetat, yaitu 105 mg/g. Hasil uji toksisitas menunjukkan nilai konsentrasi mematikan 50% (LC50) pada metode ZFET lebih kecil daripada metode BSLT. Pada metode BSLT, nilai LC50 ekstrak etanol adalah 238 ppm dan fraksi etil asetat 177 ppm, sedangkan pada metode ZFET, nilai LC50 96 jam pascafertilisasi ekstrak etanol adalah 80 ppm dan fraksi etil asetat 94 ppm. Ekstrak etanol menyebabkan malformasi mayor pada jantung, sedangkan pemberian fraksi etil asetat menyebabkan malformasi mayor pada sumbu tubuh dan jantung embrio ikan zebra.
Kata kunci: BSLT, LC50, temu lawak, toksisitas, ZFET
ABSTRACT
NURFADILAWATI. Toxicity of Temu Lawak (Curcuma xanthorriza) Based on Brine Shrimp and Zebrafish Embryo Lethality Test. Supervised by GUSTINI SYAHBIRIN and KUSDIANTORO MOHAMAD.
Temu lawak (Curcuma xanthorriza) has been known to have various pharmacological activities with curcuminoids are the predominant active compounds. This study aims to determine the curcuminoids content and toxicity of the ethanol extract and ethyl acetate fraction of temu lawak. Curcuminoids content was determined by using high performance liquid chromatography, while the toxicity test used brine shrimp (BSLT method) and zebrafish embryo (ZFET method). The results showed higher curcuminoid content of the ethanol extract as compared with the ethyl acetate fraction, that is 105 mg/g. The toxicity test showed that the 50% lethal concentration (LC50) values from ZFET method was lower than that of BSLT method. In BSLT method, the LC50 value of ethanol extract was 238 ppm and 177 ppm for ethyl acetate fraction, whereas the ZFET method gave LC50 values of 96 hours after fertilization was 80 ppm for ethanol extract and 94 ppm for ethyl acetate fraction. The ethanol extract caused major malformation on heart, while the ethyl acetate fraction caused major malformation on body axis and heart in zebra fish embryos.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
TOKSISITAS EKSTRAK TEMU LAWAK (
Curcuma xanthorriza
Roxb) BERDASARKAN UJI LETALITAS LARVA UDANG
DAN EMBRIO IKAN ZEBRA
NURFADILAWATI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Toksisitas Ekstrak Etanol Temu Lawak (Curcuma xanthorriza Roxb) Berdasarkan Uji Letalitas Larva Udang dan Embrio Ikan Zebra
Nama : Nurfadilawati NIM : G44100064
Disetujui oleh
Dr Gustini Syahbirin, MS Pembimbing I
drh Kusdiantoro Mohamad, MSi, PAVet Pembimbing II
Diketahui oleh
Prof Dr Drs Purwantiningsih Sugita, MS Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah Subhanahu Wa Ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan April 2014 ini ialah Toksisitas Ekstrak Etanol Temu Lawak (Curcuma xanthorriza Roxb) berdasarkan Uji Letalitas Larva Udang dan Ikan Zebra.
Terima kasih penulis ucapkan kepada Dr Gustini Syahbirin, MS dan drh Kusdiantoro Mohamad, Msi, PAVet selaku pembimbing yang telah banyak memberi saran. Di samping itu, penghargaan penulis sampaikan kepada Bapak Sabur, Ibu Yeni, dan Ibu Nia yang memberikan saran selama penelitian di Laboratorium Kimia Organik, Bapak Wahyu yang telah membantu selama penelitian di Laboratorium Embriologi, dan Ibu Ella yang telah membantu dalam analisis KCKT. Rasa terima kasih juga disampaikan untuk Kurnia Alysia sebagai teman bimbingan yang selalu bersama selama penelitian ini, Herdiyanto, Lestari Pudjiastuti, Ayustiyan Futu Wijaya, Nur Amallia, Ibna Anggi Meinar, Nurul Qomariah, Gemilang Tanisan, dan Adani Fajrina, yang telah membantu, memberi saran, semangat, dan menemani selama penelitian.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
BAHAN DAN METODE 2
Alat dan Bahan 2
Metode Penelitian 2
HASIL DAN PEMBAHASAN 4
Kadar Air dan Ekstrak 4
Hasil Analisis Kurkuminoid dengan KCKT 5
Toksisitas Ekstrak Terhadap Larva Udang dan Embrio Ikan Zebra 7
Efek Teratogenik pada Embrio Ikan Zebra 8
SIMPULAN DAN SARAN 12
Simpulan 12
Saran 12
DAFTAR PUSTAKA 12
LAMPIRAN 13
DAFTAR TABEL
1 Nilai LC50 ekstrak etanol dan fraksi etil asetat terhadap embrio ikan
zebra
7 2 Efek teratogenik pada embrio ikan zebra akibat paparan ekstrak etanol
dan fraksi etil asetat
9
DAFTAR GAMBAR
1 Struktur kimia kurkumin, demetoksikurkumin, dan bisdemetoksikurkumin
5 2 Kromatogram KCKT standar kurkuminoid, ekstrak etanol, dan fraksi
etil asetat
6 3 Morfologi embrio ikan zebra normal pada kontrol dan beberapa
abnormalitas pada perlakuan ekstrak etanol
10 4 Morfologi embrio ikan zebra normal pada kontrol dan beberapa
abnormalitas pada perlakuan fraksi etil asetat
11
DAFTAR LAMPIRAN
1 Diagram alir penelitian 15
2 Sertifikat persetujuan etik hewan 16
3 Hasil determinasi tumbuhan 17
4 Kadar air temu lawak 18
5 Rendemen ekstrak etanol temu lawak dan fraksi etil asetat 18
6 Kromatogram KCKT 19
7 Hasil analisis KCKT ekstrak 21
8 Hasil uji toksisitas BSLT ekstrak etanol 22
9 Hasil uji toksisitas BSLT fraksi etil asetat 23
10 Hasil uji toksisitas ZFET ekstrak etanol 24
PENDAHULUAN
Temu lawak (Curcuma xanthorriza Roxb.) merupakan tanaman obat yang banyak tumbuh di daerah tropis, tumbuh secara merumpun dan banyak ditanam di kebun atau di sekitar pekarangan rumah. Hasil utama dari tanaman ini adalah umbi atau rimpangnya yang beraroma khas dan berwarna kuning. Nama lain temu lawak ialah koneng gede (Sunda) dan temu labak (Madura). Temu lawak telah diketahui memiliki banyak khasiat terutama dalam bidang kesehatan. Secara tradisional, masyarakat Indonesia menjadikan temu lawak sebagai bahan baku jamu.
Temu lawak memiliki banyak jenis metabolit sekunder dengan berbagai bioaktivitas. Senyawa aktif utama yang terkandung dalam temu lawak adalah kurkuminoid dan xantorizol (Nurcholis et al. 2012c). Minyak atsiri temu lawak dengan komponen utama xantorizol memiliki aktivitas sebagai antimikrob (Mary et al. 2012). Sementara itu, kurkuminoid dalam ekstrak etil asetat (Ruslay et al. 2007) dan ekstrak etanol (Nurcholis et al. 2012a) terbukti sebagai antioksidan. Itokawa et al. (2008) juga melaporkan bahwa ekstrak etanol temu lawak aktif sebagai antiradang. Selain itu, penelitian Cheah et al. (2009) menunjukkan bahwa kombinasi xantorizol dan kurkumin dari temu lawak dapat menghambat perkembangan aktivitas sel kanker MDA-MB-231.
Peraturan Menteri Kesehatan RI No. 761/MENKES/SK/IX/1992 menyatakan bahwa uji toksisitas merupakan prasyarat formal keamanan calon obat untuk pemakaian pada manusia (Depkes RI 1992).Uji pendahuluan untuk mengamati ketoksikan suatu bahan dapat dilakukan dengan uji letalitas larva udang (BSLT, brine shrimp lethality test) dan embrio ikan zebra (ZFET, zebrafish embryo acute toxicity). Nurcholis et al. (2012b) dan Devaraj et al. (2013) menggunakan metode BSLT untuk menguji toksisitas ekstrak temu lawak. Uji toksisitas menggunakan larva udang merupakan metode pendahuluan yang telah terbukti memiliki korelasi dengan daya toksisitas. Larva udang sebagai bioindikator sangat peka terhadap bahan toksik, sehingga toksisitas suatu bahan terhadap larva udang dapat dijadikan indikasi awal dari efek farmakologis bahan tersebut. Keunggulan metode ini ialah larva udang peka terhadap bahan uji, mudah dibiakkan, memiliki siklus hidup yang cepat, waktu uji cepat, mudah dilakukan, dan biaya relatif murah (Meyer et al. 1982). Akan tetapi, terdapat kelemahan dari uji BSLT, yaitu hasil pengamatan tidak menunjukkan penyebab kematian atau abnormalitas hewan uji, sehingga diperlukan uji lanjutan untuk melihat efek senyawa aktif terhadap perkembangan hewan uji, yaitu dengan uji ZFET.
2
lawak dengan metode ZFET belum pernah dilakukan. Hal tersebut yang mendasari dilakukannya penelitian ini untuk menguji toksisitas ekstrak temu lawak dengan metode BSLT dan ZFET.
BAHAN DAN METODE
Alat dan Bahan
Alat yang digunakan meliputi maserator lompok, corong pisah, penguap putar, Kromatografi Cair Kinerja Tinggi (KCKT), oven, kertas saring Millipore, mikropipet, pelat 24 sumur, vial, aerator, dan mikroskop inverted yang dilengkapi dengan kamera digital. Bahan-bahan yang digunakan adalah rimpang temu lawak, etanol 80%, etil asetat, dimetil sulfoksida (DMSO), larva udang Artemia salina Leach, air laut, dan embrio ikan zebra (Danio rerio).
Metode Penelitian
Metode penelitian mengikuti diagram alir pada Lampiran 1. Metode penelitian terdiri atas determinasi tanaman, preparasi sampel temu lawak, penentuan kadar air, maserasi dengan etanol, partisi ekstrak etanol, analisis kadar kurkumin dengan KCKT, uji toksisitas ekstrak terhadap A. salina, dan uji toksisitas ekstrak terhadap embrio ikan zebra. Uji toksisitas mengikuti prinsip penggunaan dan asas kesejahteraan hewan dan telah mendapat persetujuan dari Komisi Etik Hewan, Fakultas Kedokteran Hewan, IPB (Lampiran 2).
Determinasi Tanaman
Temu lawak yang akan dijadikan bahan uji berasal dari Kebun Percobaan Pusat Studi Biofarmaka, Bogor. Tanaman ini dipastikan autentitasnya di Balai Penelitian dan Pengembangan Botani “Herbarium Bogoriense”, Pusat Penelitian dan Pengembangan Biologi-LIPI Cibinong, Bogor, Jawa Barat.
Preparasi Sampel
Rimpang temu lawak segar dicuci bersih dengan air mengalir, ditiriskan, dan dirajang hingga berukuran kecil. Rimpang kemudian dikeringkan dalam oven pada suhu 40 ºC selama 24 jam. Setelah kering, rimpang temu lawak digiling untuk mendapatkan serbuk temu lawak.
Penentuan Kadar Air (AOAC 2006)
3
Kadar air (%) = A − AB ×100%
Keterangan:
A = bobot bahan sebelum dikeringkan (g) B = bobot bahan setelah dikeringkan (g)
Ekstraksi Temu lawak (Srijanto dan Syahbirin 2007)
Ekstraksi temu lawak menggunakan metode maserasi dengan pelarut etanol 80%. Nisbah antara sampel temu lawak dan pelarut adalah 1:6. Sebanyak 100 g serbuk temu lawak direndam dengan etanol 80% di dalam maserator dan didiamkan selama 3 jam dengan suhu 40–45 ºC. Rendaman temu lawak selanjutnya disaring dengan menggunakan kertas saring untuk memisahkan filtrat dari maseratnya. Filtrat yang terkumpul kemudian diuapkan menggunakan rotavapor (penguap vakum) hingga diperoleh ekstrak yang lebih pekat untuk digunakan dalam tahapan selanjutnya. Rendemen ekstrak pekat dihitung dengan persamaan
Partisi Ekstrak Etanol Temu Lawak
Ekstrak etanol temu lawak dilarutkan dengan air sebanyak 100 mL dan dimasukkan ke dalam corong pisah, lalu diekstraksi menggunakan etil asetat dengan nisbah 1:3. Penambahan etil asetat dilakukan secara bertahap sampai fase organik tidak berwarna. Fase organik dipisahkan dari fase air, kemudian dipekatkan dengan penguap putar.
Penentuan Kadar Kurkuminoid dengan KCKT (Jayaprakasha et al. 2002)
Sebanyak 0.05 g ekstrak ditimbang dan dilarutkan dalam 50 mL metanol. Larutan sampel diencerkan 50 kali dan disaring menggunakan kertas saring Millipore 0.45 µm, kemudian dimasukkan ke dalam vial KCKT. Standar kurkuminoid dibuat dengan konsentrasi 0.5 µg/mL. Kolom yang digunakan adalah kolom fase terbalik C18 dengan detektor ultraviolet-tampak (UV-Vis) dan volume injeksi 20 µL. Elusi dilakukan dengan kecepatan alir 1 mL/menit. Digunakan campuran eluen metanol (A), asam asetat 2% (B), dan asetonitril (C). Elusi gradien linear dilakukan dengan konsentrasi A dibuat konstan 5%, sedangkan konsentrasi C dalam B dinaikkan dari 45% ke 65% untuk menit ke 0– 15 dan diturunkan menjadi 65% hingga 45% untuk menit ke 15–20. Kadar kurkuminoid diukur pada panjang gelombang 425 nm.
Uji Toksisitas Ekstrak terhadap Larva A. Salina (Meyer et al. 1982)
4 lawak. Pengujian dilakukan sebanyak 3 kali ulangan. Vial lalu ditutup dengan kertas aluminium dan diinkubasi selama 24 jam pada suhu ruang. Nilai konsentrasi letal 50% (LC50) ditentukan dengan menggunakan kurva hubungan log konsentrasi ekstrak (sumbu x) dengan nilai probit (sumbu y).
Uji Toksisitas Ekstrak terhadap Embrio Ikan Zebra (OECD 2013)
Ekstrak etanol dan etil asetat temu lawak dilarutkan dalam air sumur yang telah disaring dan dibuat larutan induk dengan konsentrasi 2000 ppm. Jika tidak larut, maka dilarutkan dengan penambahan DMSO. Larutan induk ini kemudian diencerkan hingga diperoleh konsentrasi 50, 100, 200, 400, dan 600 ppm. Uji toksisitas dilakukan pada pelat 24-sumur, berisi 20 telur ikan zebra per konsentrasi uji (satu embrio per sumur) dan 4 kontrol internal, serta 1 pelat kontrol negatif, dan 1 pelat kontrol pelarut jika menggunakan DMSO sebagai pelarut dengan 24 embrio masing-masing. Pelat yang berisi embrio ikan zebra ditempatkan pada suhu kamar (±26 ºC), diamati setiap 24 jam sampai dengan 96 jam atau 4 hari menggunakan mikroskop inverted (Olympus) yang dilengkapi dengan komputer dan kamera. Pengamatan berupa hidup atau mati, normal atau abnormal, menetas atau tidak (khusus 48 jam), serta pengamatan detil abnormalitas yang meliputi kelainan pada sumbu tubuh, kepala, ekor, sirkulasi darah, mata, jantung, pigmentasi, somit, dan kantung kuning telur. Nilai LC50 ditentukan dengan menggunakan kurva hubungan antara log konsentrasi ekstrak (sumbu x) dan nilai probit (sumbu y).
HASIL DAN PEMBAHASAN
Kadar Air dan Ekstrak
Rimpang yang digunakan terbukti rimpang temu lawak (Curcuma xanthorriza Roxb) berdasarkan hasil determinasi (Lampiran 3). Kadar air temu lawak yang diperoleh, yaitu 14.05% (Lampiran 4), tidak berbeda jauh dengan yang dilaporkan oleh Srijanto et al. (2005), yaitu 15.32%. Kadar air tersebut dihitung berdasarkan banyaknya air yang teruapkan dari sampel setelah dipanaskan pada suhu 105 oC. Kadar air digunakan sebagai koreksi dalam menghitung rendemen ekstrak dan untuk menduga ketahanan sampel selama proses penyimpanan. Nilai kadar air sampel yang cukup tinggi, yaitu di atas 10% menyebabkan waktu simpan sampel cukup singkat karena rentan ditumbuhi oleh mikrob.
5 toksik etanol tergolong rendah sehingga aman untuk mengekstraksi bahan yang akan dijadikan obat herbal.
Ekstrak etanol temu lawak berbentuk pasta dan berwarna cokelat kekuningan. Rendemen ekstrak berdasarkan bobot kering sampel ialah 17.77% (Lampiran 5). Hasil tersebut lebih tinggi daripada yang dilaporkan oleh Mangunwardoyo et al. (2012) dengan metode refluks, yaitu 13.33%. Sebagian ekstrak etanol kemudian dipartisi cair-cair menggunakan pelarut air-etil asetat. Ekstrak etil asetat diperoleh dengan rendemen 45.74% berdasarkan bobot basah ekstrak etanol. Partisi ini dilakukan untuk memisahkan senyawa polar dalam ekstrak dengan senyawa semipolar. Senyawa polar akan terekstraksi pada fase air, sedangkan senyawa semipolar akan terekstraksi pada fase organik (etil asetat). Partisi dilakukan dengan penambahan etil asetat secara bertahap sampai fase organik tidak berwarna, sehingga diduga semua senyawa telah terekstraksi ke dalam fase organik.
Hasil Analisis Kurkuminoid dengan KCKT
Salah satu komponen metabolit sekunder dengan jumlah paling besar dalam temu lawak adalah kurkuminoid (Ruslay et al. 2007). Kurkuminoid adalah senyawa golongan fenilpropanoid yang terdiri atas kurkumin, demetoksikurkumin, dan bisdemetoksikurkumin. Struktur kurkuminoid (Gambar 1) tersusun dari 2 cincin fenolik yang dihubungkan oleh rantai alifatik takjenuh dengan 2 gugus karbonil pada karbon nomor 3 dan 5. Pada senyawa kurkuminoid, kedua cincin fenolik tersubstitusi oleh gugus metoksi pada posisi orto, pada demetoksikurkumin hanya 1 yang tersubstitusi metoksi, sedangkan pada bisdemetoksikurkumin tidak ada yang tersubstitusi.
Gambar 1 Struktur kimia kurkumin (A), demetoksikurkumin (B), dan bisdemetoksikurkumin (C).
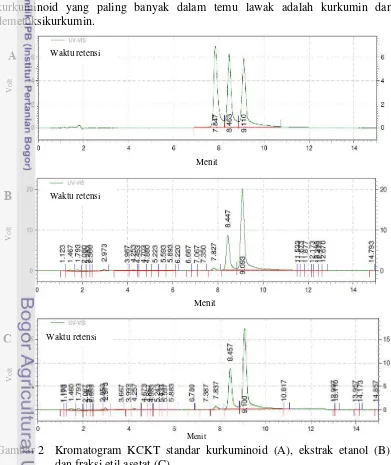
Kadar kurkuminoid dalam ekstrak etanol dan fraksi etil asetat temu lawak ditentukan menggunakan KCKT, dengan standar kurkuminoid yang digunakan ialah bisdemetoksikurkumin, demetoksikurkumin, dan kurkumin. Kromatogram
(A)
6
KCKT menunjukkan puncak standar kurkuminoid pada waktu retensi 7.847 menit (bisdemetoksikurkumin), 8.463 menit (demetoksikurkumin), dan 9.110 menit (kurkumin). Pada ekstrak etanol dan fraksi etil asetat temu lawak terbentuk puncak dengan waktu retensi yang sama dengan standar (Gambar 2). Berdasarkan hasil KCKT untuk kedua ekstrak, kurkuminoid dengan persentase luas puncak paling tinggi ialah kurkumin, yang mencapai 68.06% untuk ekstrak etanol dan 62.98% untuk ekstrak etil asetat. Persentase terbesar kedua berasal dari demetoksikurkumin dengan persentase luas puncak ekstrak etanol dan etil asetat masing-masing 24.60% dan 27.48%. Sementara bisdemetoksikurkumin memiliki persentase luas puncak paling rendah, yaitu ekstrak etanol 1.41% dan ekstrak etil asetat 1.91% (Lampiran 6). Berdasarkan persentase luas puncak tersebut kandungan kurkuminoid yang dominan dalam ekstrak etanol maupun etil asetat adalah demetoksikurkumin dan kurkumin. Hasil tersebut sesuai dengan Mangunwardoyo et al. (2012) yang melaporkan bahwa senyawa golongan kurkuminoid yang paling banyak dalam temu lawak adalah kurkumin dan demetoksikurkumin.
Gambar 2 Kromatogram KCKT standar kurkuminoid (A), ekstrak etanol (B), dan fraksi etil asetat (C).
7 Kadar kurkuminoid dalam sampel dihitung berdasarkan nisbah luas puncak setiap senyawa kurkuminoid dalam sampel dengan luas puncak dalam standar (Lampiran 7). Kadar total kurkuminoid dalam ekstrak etanol adalah 104.7 mg/g dan dalam fraksi etil asetat adalah 90.9 mg/g. Kadar kurkuminoid yang lebih tinggi dalam ekstrak etanol dapat disebabkan oleh sifat etanol yang lebih polar daripada etil asetat. Perbedaan kadar kurkuminoid yang terekstraksi tersebut diduga dapat memengaruhi toksisitas ekstrak.
Efek farmakologis temu lawak telah terbukti ditimbulkan oleh senyawa golongan kurkuminoid (EMA 2013). Simon et al. (1998) melaporkan bahwa demetoksikurkumin merupakan penghambat perkembangan sel kanker MCF-7 paling baik, diikuti oleh kurkumin dan bisdemetoksikurkumin. Sharma et al. (2005) melaporkan bahwa selain sebagai antikanker, kurkumin berperan pula sebagai antiradang. Penelitian lainnya menyebutkan bahwa peran bisdemetoksikurkumin sebagai antioksidan sama efektifnya dengan kurkumin (Kim et al. 2001). Hal ini disebabkan oleh peran gugus hidroksil pada cincin aromatik dan ß-diketon dalam menangkap radikal bebas sehingga kurkuminoid aktif sebagai antioksidan (Beevers dan Huang 2011).
Toksisitas Ekstrak Terhadap Larva Udang dan Embrio Ikan Zebra
BSLT dapat meramalkan toksisitas komponen aktif dengan hasil uji berupa nilai LC50, yaitu konsentrasi yang dibutuhkan untuk mematikan 50% populasi. Jika nilai LC50 kurang dari 1000 ppm, maka ekstrak yang diujikan bersifat toksik. Sementara itu, pada ZFET ekstrak dikatakan toksik jika embrio ikan zebra terhambat perkembangannya atau terjadi abnormalitas pada organ. Nilai LC50 diperoleh berdasarkan persamaan kurva hubungan antara log konsentrasi dan nilai probit. Ekstrak etanol yang diujikan pada larva udang menghasilkan nilai LC50 238.23 ppm (Lampiran 8), sedangkan fraksi etil asetat menghasilkan nilai LC50 176.73 ppm (Lampiran 9). LC50 hasil penelitian sebelumnya yang dilakukan Nurcholis et al. (2012b) tidak berbeda jauh dengan hasil penelitian, yaitu 210.30 ppm untuk ekstrak etanol.
Nilai LC50 ekstrak etanol dan fraksi etil asetat hasil ZFET ditunjukkan pada Tabel 1. Dapat dilihat pada tabel tersebut bahwa nilai LC50 semakin rendah seiring dengan bertambahnya waktu pengamatan. LC50 pada 96 jam pascafertilisasi (jpf) lebih rendah daripada LC50 48 jpf (Lampiran 10 dan 11) yang berarti semakin lama suatu bahan memapari hewan uji, semakin toksik pula bahan tersebut. Hal ini disebabkan seiring lamanya waktu pemaparan, daya tahan tubuh ikan zebra semakin menurun, sedangkan konsentrasi ekstrak tetap sama.
Tabel 1 Nilai LC50 ekstrak etanol dan ekstrak etil asetat terhadap embrio ikan zebra Sampel Waktu pengamatan (jpf) LC 50 (ppm)
Etanol 48 180.52
96 79.55
Etil asetat 48 126.81
8
Secara keseluruhan, nilai LC50 hasil BSLT lebih besar daripada hasil ZFET. Pada BSLT, ekstrak ditambahkan saat A. salina telah menjadi larva, sedangkan penambahan ekstrak pada ZFET dilakukan saat ikan zebra masih dalam keadaan embrio yang lebih peka. Selain itu, pengamatan embrio ikan zebra yang dilakukan selama 96 jam memungkinkan ekstrak terakumulasi dalam embrio dibandingkan dengan BSLT yang hanya dilakukan selama 24 jam pengamatan.
Kedua metode uji toksisitas menghasilkan nilai LC50 kurang dari 1000 ppm yang menandakan bahwa kedua ekstrak tersebut toksik. Berdasarkan hasil pengamatan ZFET 96 jpf, ekstrak etanol lebih toksik daripada fraksi etil asetat. Hasil tersebut berkorelasi dengan hasil analisis KCKT yang menunjukkan kadar senyawa kurkuminoid yang lebih tinggi dalam ekstrak etanol daripada dalam fraksi etil asetat. Sebaliknya, ZFET 48 jpf dan BSLT menunjukkan nilai LC50 fraksi etil asetat lebih toksik daripada ekstrak etanol. Ketidaksesuaian ini dapat disebabkan oleh daya tahan tubuh setiap individu hewan uji yang berbeda-beda walaupun telah mendapatkan perlakuan yang sama sebelum pemberian ekstrak.
Efek Teratogenik pada Embrio Ikan Zebra
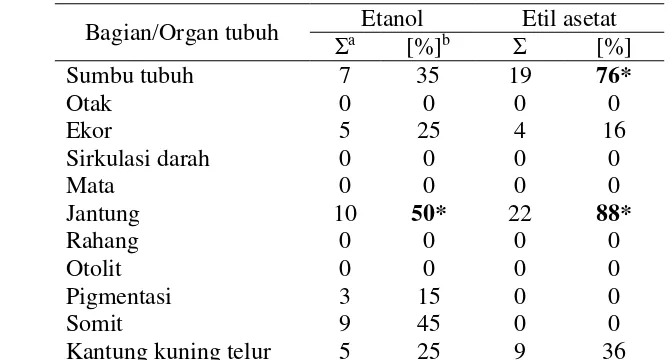
9 Tabel 2 Efek teratogenik pada embrio ikan zebra akibat paparan ekstrak etanol
dan fraksi etil asetat
Bagian/Organ tubuh Etanol Etil asetat
Ʃa [%]b Ʃ [%]
Jumlah embrio yang terkena efek teratogenik pada seluruh konsentrasi dan waktu perlakuan
b
Jumlah embrio yang terkena efek teratogenik/jumlah embrio abnormal pada seluruh konsentrasi dan waktu perlakuan
*Malformasi mayor (≥ 50%)
Satu embrio dapat mengalami lebih dari satu malformasi.
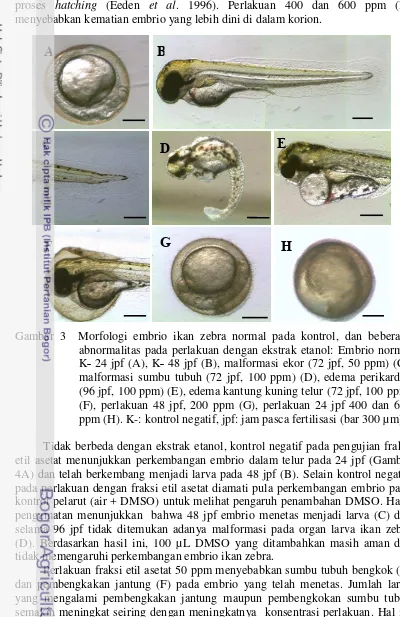
Perlakuan dengan ekstrak etanol menghasilkan perbedaan morfologi embrio yang signifikan (Gambar 3). Kontrol negatif pada 24 jpf telah menampakkan perkembangan embrio dalam telur (A). Pada 48 jpf embrio telah berkembang normal menjadi larva dengan organ yang jelas terbentuk sempurna dan sumbu tubuh yang lurus (B). Larva ikan zebra dikatakan normal jika memiliki sumbu tubuh yang lurus (Heiden et al. 2007). Pada 48 jpf embrio yang diberikan perlakuan dengan konsentrasi 50 ppm hanya menetas sebanyak 50%. Hal tersebut menunjukkan bahwa pada konsentrasi 50 ppm ekstrak telah memberikan efek penghambatan terhadap perkembangan embrio. Malformasi yang dominan terlihat pada perlakuan 50 ppm adalah kelainan pada ekor (C) dan pada organ jantung, yaitu edema perikardial. Senyawa aktif dari ekstrak yang masuk ke dalam kantung perikardial dapat mengiritasi sel sehingga jantung terlihat membengkak.
10
proses hatching (Eeden et al. 1996). Perlakuan 400 dan 600 ppm (H) menyebabkan kematian embrio yang lebih dini di dalam korion.
Gambar 3 Morfologi embrio ikan zebra normal pada kontrol, dan beberapa abnormalitas pada perlakuan dengan ekstrak etanol: Embrio normal K˗ 24 jpf (A), K˗ 48 jpf (B), malformasi ekor (72 jpf, 50 ppm) (C), malformasi sumbu tubuh (72 jpf, 100 ppm) (D), edema perikardial (96 jpf, 100 ppm) (E), edema kantung kuning telur (72 jpf, 100 ppm) (F), perlakuan 48 jpf, 200 ppm (G), perlakuan 24 jpf 400 dan 600 ppm (H). K-: kontrol negatif, jpf: jam pasca fertilisasi (bar 300 µm). Tidak berbeda dengan ekstrak etanol, kontrol negatif pada pengujian fraksi etil asetat menunjukkan perkembangan embrio dalam telur pada 24 jpf (Gambar 4A) dan telah berkembang menjadi larva pada 48 jpf (B). Selain kontrol negatif, pada perlakuan dengan fraksi etil asetat diamati pula perkembangan embrio pada kontrol pelarut (air + DMSO) untuk melihat pengaruh penambahan DMSO. Hasil pengamatan menunjukkan bahwa 48 jpf embrio menetas menjadi larva (C) dan selama 96 jpf tidak ditemukan adanya malformasi pada organ larva ikan zebra (D). Berdasarkan hasil ini, 100 µL DMSO yang ditambahkan masih aman dan tidak memengaruhi perkembangan embrio ikan zebra.
Perlakuan fraksi etil asetat 50 ppm menyebabkan sumbu tubuh bengkok (E) dan pembengkakan jantung (F) pada embrio yang telah menetas. Jumlah larva yang mengalami pembengkakan jantung maupun pembengkokan sumbu tubuh semakin meningkat seiring dengan meningkatnya konsentrasi perlakuan. Hal ini mengindikasikan ekstrak etil asetat spesifik terhadap sumbu tubuh dan jantung. Selain malformasi tersebut, pada perlakuan 100 ppm mulai ditemukan adanya edema kantung kuning telur (G) dan malformasi ekor (H) pada larva ikan zebra.
A
B
C
D
E
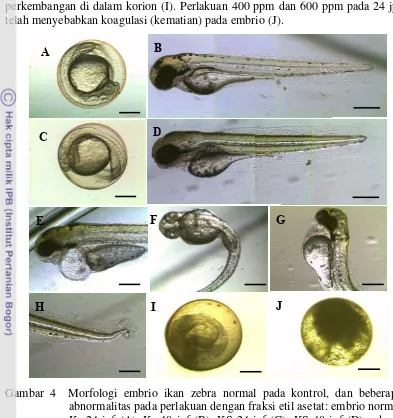
11 Sama halnya dengan ekstrak etanol, perlakuan konsentrasi 200 ppm fraksi etil asetat juga menyebabkan embrio tidak dapat menetas, tetapi telah terjadi perkembangan di dalam korion (I). Perlakuan 400 ppm dan 600 ppm pada 24 jpf telah menyebabkan koagulasi (kematian) pada embrio (J).
Gambar 4 Morfologi embrio ikan zebra normal pada kontrol, dan beberapa abnormalitas pada perlakuan dengan fraksi etil asetat: embrio normal K˗ 24 jpf (A), K˗ 48 jpf (B), KS 24 jpf (C), KS 48 jpf (D), edema perikardial (96 jpf, 50 ppm) (E), malformasi sumbu tubuh (48 jpf, 50 ppm) (F), edema kantung kuning telur (72 jpf, 100 ppm) (G), malformasi ekor (72 jpf, 100 ppm) (H), perlakuan 48 jpf 200 ppm (I). perlakuan 24 jpf, 400 dan 600 ppm (J), K-: kontrol negatif, KS: kontrol pelarut, jpf: jam pasca fertilisasi (bar 300 µm)
Wu et al. (2007) melaporkan bahwa efek teratogenik akibat pemberian kurkumin pada embrio ikan zebra adalah pembengkokan ekor, pembengkokan tulang belakang, edema perikardial, edema kantung kuning telur, dan ukuran badan larva yang lebih pendek. Efek teratogenik pada embrio ikan zebra setelah dipapari ekstrak etanol dan fraksi etil asetat tidak jauh berbeda dengan hasil tersebut. Hal tersebut menunjukkan bahwa senyawa aktif dalam kedua ekstrak adalah kurkumin. Hasil ini sesuai dengan hasil analisis KCKT yang menunjukkan kadar kurkumin pada kedua ekstrak paling tinggi dibandingkan dengan 2 senyawa golongan kurkuminoid lainnya. Jumlah embrio yang mengalami malformasi
A B
C D
E F G
12
dengan perlakuan fraksi etil asetat lebih banyak daripada perlakuan dengan ekstrak etanol, tetapi jumlah embrio yang mati lebih banyak disebabkan oleh perlakuan ekstrak etanol daripada fraksi etil asetat. Hasil tersebut sebanding dengan nilai LC50 96 jpf yang diperoleh. Nilai LC50 ekstrak etanol lebih rendah daripada fraksi etil asetat yang menunjukkan ekstrak etanol lebih toksik terhadap embrio ikan zebra daripada fraksi etil asetat.
SIMPULAN DAN SARAN
Simpulan
Ekstrak etanol maupun fraksi etil asetat bersifat toksik terhadap larva udang dan embrio ikan zebra. Secara umum nilai LC50 hasil uji ZFET lebih rendah daripada hasil uji BSLT, dengan ekstrak yang paling toksik adalah ekstrak etanol. Malformasi mayor yang teramati pada perlakuan ekstrak etanol ialah kelainan pada jantung, sedangkan pada perlakuan fraksi etil asetat ialah kelainan sumbu tubuh dan jantung.
Saran
Perlu dilakukan penelitian lebih lanjut pada uji ZFET dengan menggunakan deret konsentrasi yang lebih rendah agar proses perkembangan embrio dapat lebih teramati dengan jelas. Selain itu, perkembangan embrio perlu dianalisis menggunakan kurkumin murni sebagai kontrol positif.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemist. 2006. Official Method of Analysis of The Association of Official Analytical of Chemist. Arlington (US): AOAC Int.
Beevers CS, Huang S. 2011. Pharmacological and clinical properties of curcumin. Botanics: Targets and Therapy. 1:5-18.
Brannen KC, Panzica–Kelly JM, Danberry TL, Augustine-Rauch KA. 2010. Development of a zebrafish embryo teratogenecity assay and quantitative prediction model. Birth Defects Res Part B: Dev Reprod Toxicol. 89:66-77. Chakraborty C, Hsu CH, Wen ZH, Lin CS, Agoramoorthy G. 2009. Zebrafish: a
complete animal model for in vivo drug discovery and development. Curr Drug Metabolism. 10(2):116-124.
13 Coelho S, Oliveira R, Pereira S, Musso C, Domingues I, Bhujel RC, Soares AMVM, Nogueira AJA. 2011. Assessing lethal and sub-lethal effects of trichlorfon on different trophic levels. Aqua Toxicol. 103:191-198.
[Depkes RI] Departemen Kesehatan RI. 1992. Pedoman Fitofarmaka. Jakarta (ID): Departemen Kesehatan RI.
Devaraj S, Ismail S, Ramanathan S, Yam MF. 2013. In vivo toxicological investigation of standardized ethanolic extract of Curcuma xanthorrhiza Roxb. rhizome. J Nat Plant Resour. 3(1):67-73.
Eeden FJMV, Granato M, Schach U, Brand M, Seiki MF, Haffter P, Hammerschmidt M, Heisenberg CP, Jiang YJ, Kane DA et al. 1996. Mutation affecting somite formation and patterning in the zebrafish Danio rerio. Development. 123:153-164.
[EMA] European Medicines Agency. Assessment report on Curcuma xanthorrhiza Roxb. (C. xanthorrhiza D. Dietrich)., rhizome. London (UK): EMA.
Heiden TCK, Dengler E, Kao WJ, Heideman W, Peterson RE. 2007. Developmental toxicity of low generation PAMAM dendrimers in zebrafish. Toxicology Appl Pharmacol. 225:70-79
Itokawa H, Shi Q, Akiyama T, Morris-Natschke SL, Lee KH. 2008. Recent advances in the investigation of curcuminoids. Chin Med. 3(11):1-13.
Jayaprakasha GK, Rao LJM, Sakariah KK. 2002. Improved HPLC method for the determination of curcumin, demethoxycurcumin, and bisdemethoxy curcumin. J Agric Food Chem. 50:3668-3672.
Kari G, Rodeck U, Dicker AP. 2007. Zebrafish: an emerging model system for human disease and drug discovery. Clin Pharmacol Therapeutics. 82:70-80. Kim DS, Park SY, Kim JY. 2001. Curcuminoids from Curcuma longa L.
(Zingiberaceae) that protect PC12 rat pheochromocytoma and normal human umbilical vein endothelial cells from âA (1-42) insult. Neurosci Lett. 303:57-61.
Ma C, Pang C, Seng WL, Zhang C, Willet C, McGrath P. 2007. Zebrafish, an in vivo model for drug screening. Drug Discovery. 6:38-45.
Mangunwardoyo W, Deasywaty, Usia T. 2012. Antimicrobial and identification of active compound Curcuma xanthorrhiza Roxb. IJBAS-IJENS. 12(1): 69-78.
Mary HPA, Susheela GK, Jayasree S, Nizzy AM, Rajagopal B, Jeeva S. 2012. Phytochemical characterization and antimicrobial activity of Curcuma xanthorrhiza Roxb. Asian Pacific J Trop Biomed. 60288:3-6. doi:10.1016/S2221-1691(12)60288-3.
Meyer BN, Ferrigni NR, Putman JE, Jacobson LB, Nichol DE, McLaughlin JL. 1982. Brine shrimps: a convenient general bioassay for active plant constituent. Planta Med. 45:31-34.
14
Nurcholis W, Priosoeryanto BP, Purwakusumah ED, Katayama T, Suzuki T. 2012b. Antioxidant, cytotoxic activities and total phenolic content of four Indonesian medicinal plants. Valensi. 4(2):501-510.
Nurcholis W, Purwakusumah ED, Rahardjo M, Darusman LK. 2012c. Variasi bahan bioaktif dan bioaktivitas tiga nomor harapan temu lawak pada lokasi budidaya berbeda. J Agron Indonesia. 40(2):153-159.
[OECD] The Organization for Economic Co-operation and Development. 2013. OECD Guidelines for The Testing of Chemicals No. 236. Fish Embryo Acute Toxicity (FET) Test. Paris (FR): OECD.
Ruslay S, Abas F, Shaari K, Zainal Z, Maulidiani, Sirat H, Israf DA, Lajis NH. 2007. Characterization of the components present in the active fractions of health gingers (Curcuma xanthorrhiza and Zingiber zerumbet) by HPLC-DAD-ESIMS. Food Chem. 104:1183-1191.
Sharma RA, Gescher AJ, Steward WP. 2005. Curcumin: The story so far. Eur J Cancer. 41:1955-1968.
Simon A, Allais DP, Duroux JL, Basly JP, Durand FS, Delage C. 1998. Inhibitory effect of curcuminoidss on MCF-7 cell proliferation and structure-activity relationship. Cancer Lett. 129:111-116.
Srijanto B, Rosidah I, Rismana E, Syahbirin G, Yusro AK, Aan. 2005. Perbandingan ekstraksi kurkumin dari temu lawak (Curcuma xanthorriza Roxb.) dengan pelarut aseton dan etanol. Di dalam: Prosiding Seminar Nasional Penggalian Potensi Sembilan Tanaman Obat Unggulan Indonesia 2005; 2005 Mei 6-7; Purwokerto, Indonesia.
Srijanto B, Syahbirin G. 2007. Optimasi ekstraksi kurkumin dari temu lawak (Curcuma xanthorriza Roxb.) secara batch. Di dalam: Prosiding Seminar Nasional Teknik Kimia Universitas Parahyangan; 2007 Nov 22; Bandung, Indonesia.
Wei X, Bugni TS, Harper MK, Sandoval IT, Manos EJ, Swift J, Wagoner RMV, Jones DA, Ireland CM. 2010. Evaluation of pyridoacridine alkaloids in a zebrafish phenotypic assay. Mar Drugs 8:1769-1778.
15 Lampiran 1 Diagram alir penelitian
KCKT BSLT ZFET
Temu lawak
Temu lawak kering
Dikeringkan pada suhu 40 ºC, 24 jam
Serbuk temu lawak Penentuan kadar air
Ekstrak etanol
Fraksi etil asetat Determinasi
tumbuhan
Maserasi
16
18
Lampiran 4 Kadar air temu lawak
Ulangan
Lampiran 5 Rendemen ekstrak etanol temu lawak dan fraksi etil asetat Sampel Bobot contoh awal
(g)
Bobot ekstrak (g)
Rendemen (%)
Ekstrak etanol 100.6700 15.3793 17.77
Fraksi etil asetat 6.1690 2.8219 45.74
Perhitungan:
Rendemen ekstrak etanol = a
(1 − kadar air)b×100%
= 15.3793 g
1−0.1405 100.6700 ×100% = 17.77 %( b b⁄ )
19 Lampiran 6 Kromatogram KCKT
20
lanjutan Lampiran 6
Kromatogram fraksi etil asetat
Hasil UV-VIS
Waktu retensi Luas puncak
Luas puncak (%)
Tinggi puncak
Tinggi puncak (%)
7.837 26028 1.91 2553 2.21
8.457 373557 27.48 34596 29.95
9.100 856209 62.98 68707 59.47
Waktu retensi
Menit
Vo
21 Lampiran 7 Hasil analisis KCKT ekstrak
Sampel Kurkuminoid Luas area
Luas
Bisdemetoksikurkumin 21774 345871 1.4848
104.6834 Demetoksikurkumin 380185 305170 29.3824
Kurkumin 1051747 336042 73.8162
Fraksi etil asetat
Bisdemetoksikurkumin 26028 345871 1.7782
90.9090 Demetoksikurkumin 373557 305170 28.9247
Kurkumin 856209 336042 60.2061
Contoh perhitungan:
Bobot sampel ekstrak etanol = 0.053 g Bobot sampel fraksi etil asetat = 0.0592 g
Kadar (mg/s) =
22
23 Lampiran 9 Hasil uji toksisitas BSLT fraksi etil asetat
24
25 Lampiran 11 Hasil uji toksisitas ZFET fraksi etil asetat
26
RIWAYAT HIDUP
Penulis dilahirkan di Cianjur pada tanggal 17 Oktober 1992 dari ayah Mumuh Muhaemin dan ibu Onoh Rodiah. Penulis adalah putri pertama dari 2 bersaudara. Penulis lulus dari SMA Negeri 1 Cilaku, Cianjur pada tahun 2010 dan pada tahun yang sama pula penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Ujian Seleksi Masuk IPB (USMI) dan diterima di Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.