PENYELESAIAN NUMERIK PERSAMAAN SCHRöDINGER
UNTUK MOLEKUL BaO DAN SrO MENGGUNAKAN MODEL
POTENSIAL MORSE
NUGRAHA WANDA SANJAYA
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Penyelesaian Numerik
Persamaan Schrödinger untuk Molekul BaO dan SrO Menggunakan Model
Potensial Morse adalah benar karya saya dengan arahan dari komisi pembimbing
dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun.
Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun
tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan
dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut
Pertanian Bogor.
Bogor, April 2014
ABSTRAK
NUGRAHA WANDA SANJAYA. Penyelesaian Numerik Persamaan Schrödinger untuk Molekul BaO dan SrO Menggunakan Model Potensial Morse. Dibimbing oleh SIDIKRUBADI PRAMUDITO dan TONY IBNU SUMARYADA.
Potensial Morse merupakan model potensial yang digunakan untuk menerangkan tingkah laku vibrasi suatu molekul antar atom. Tujuan penelitian ini adalah memperoleh nilai energi disosiasi, energi eigen dari masing-masing tingkat energi, serta menggambarkan bentuk fungsi gelombang dari molekul BaO dan SrO pada keadaan vibrasi. Energi disosiasi dihitung dengan menambahkan energi disosiasi ekperimen dan energi eigen pada keadaan dasar. Dilakukan penghitungan energi eigen dari tingkat energi ke 0 hingga ke 4 menggunakan metode shooting yang diintegrasi dengan metode Numerov dan Runge-Kutta. Nilai energi eigen dari masing-masing tingkat energi yang dihitung secara numerik memilliki ketepatan 100% dengan energi eigen yang dihitung secara analitik. Bentuk fungsi gelombang yang digambarkan juga menunjukkan keadaan masing-masing tingkat energi dan memenuhi kondisi ternormalisasi fungsi gelombang.
Kata kunci: BaO, energi disosiasi, energi eigen, potensial Morse, SrO
ABSTRACT
NUGRAHA WANDA SANJAYA. Numerical Solution of Schrodinger Equation for Molecules BaO and SrO Using Morse Potential Model. Supervised by SIDIKRUBADI PRAMUDITO and TONY IBNU SUMARYADA.
Morse potential is a potential model used to describe the behavior of a molecular vibration between atoms. This study aimed to obtain the value of the dissociation energy, the energy eigenvalues of each energy level, and describe the shape of the wave function of the molecule BaO and SrO on the vibrational state. Dissociation energy is calculated by adding the experimental dissociation energy and the ground state energy eigenvalues. Calculating the energy eigenvalues of the energy levels 0 to 4 using shooting method integrated with Numerov and Runge-Kutta method. Energy eigenvalues of each levels that calculated numerically having accuracy of 100% compared with the calculated analytically. The profil of wave functions accurately show the corresponding states and their normalized wavefunctions.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Fisika
PENYELESAIAN NUMERIK PERSAMAAN SCHRöDINGER
UNTUK MOLEKUL BaO DAN SrO MENGGUNAKAN MODEL
POTENSIAL MORSE
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Skripsi : Penyelesaian Numerik Persamaan Schrödinger untuk Molekul BaO dan SrO Menggunakan Model Potensial Morse
Nama : Nugraha Wanda Sanjaya NIM : G74100071
Disetujui oleh
Drs Sidikrubadi Pramudito, MSi Pembimbing I
Dr Tony Ibnu Sumaryada Pembimbing II
Diketahui oleh
Dr Akhiruddin Maddu, MSi Ketua Departemen Fisika
PRAKATA
Alhamdulillahirabbil’alamin. Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah yang berjudul “Penyelesaian Numerik Persamaan Schrödinger untuk Molekul BaO dan SrO Menggunakan Model Potensial Morse” yang dilaksanakan sejak bulan Agustus 2013. Shalawat serta salam semoga tetap tercurahkan kepada Nabi Muhammad SAW.
Terima kasih penulis ucapkan kepada Bapak Drs Sidikrubadi Pramudito, MSi dan Bapak Dr Tony Ibnu Sumaryada sebagai dosen yang membimbing penulis selama penelitian, Bapak Heriyanto Syafutra, MSi yang telah banyak memberi saran, serta rekan satu penelitian Bima Maha Putra yang banyak membantu penelitian penulis. Ungkapan terimakasih setulus hati penulis sampaikan kepada ayah, ibu, serta adik-adik tercinta, atas doa dan kasih sayangnya kepada penulis. Begitu juga dengan rekan-rekan mahasiswa/i Fisika angkatan 47 yang senantiasa memberikan motivasi, saran dan bimbingannya selama ini.
Semoga karya ilmiah ini dapat bermanfaat untuk mengembangkan pemodelan sifat molekul di Departemen Fisika FMIPA-IPB.
Bogor, April 2014
DAFTAR ISI
Persamaan Schrödinger Bebas Waktu 3
Energi Vibrasional Molekul Diatomik 3
Potensial Morse 3
Metode Numerov 4
Metode Runge-Kutta 4
Metode Shooting 5
METODE 5
Waktu dan Tempat 5
Alat 6
Studi Pustaka 6
Menghitung Energi Disosiasi Ikatan Molekul BaO dan SrO 6 Menentukan Bentuk Fungsi Gelombang dan Tingkat-tingkat Energi Molekul
BaO dan SrO 6
Fungsi Gelombang dan Energi Eigen Untuk Osilator Anharmonik 6 Fungsi Gelombang dan Energi Eigen Untuk Osilator Harmonik 7 Pembuatan Program Penggambaran Fungsi Gelombang dan Penghitungan
Energi Eigen 7
Prosedur Analisis Data 7
HASIL DAN PEMBAHASAN 8
Energi Disosiasi Molekul BaO dan SrO 8
Energi Eigen Vibrasi Untuk Osilator Anharmonik 8
Energi Eigen Vibrasi Pada Osilator Harmonik dan Anharmonik 9
Bentuk Fungsi Gelombang Osilator Anharmonik 11
SIMPULAN DAN SARAN 16
Simpulan 16
Saran 16
DAFTAR PUSTAKA 16
LAMPIRAN 18
DAFTAR TABEL
1 Perbandingan energi disosiasi perhitungan dan eksperimen molekul BaO
dan SrO 8
2 Nilai energi eigen perhitungan secara numerik dan analitik molekul BaO 9 3 Nilai energi eigen perhitungan secara numerik dan analitik molekul SrO 9 4 Perhitungan energi eigen pada osilator harmonik dan anharmonik molekul
BaO 10
5 Perhitungan energi eigen pada osilator harmonik dan anharmonik molekul
SrO 10
DAFTAR GAMBAR
1 Model Molekul BaO 2
2 Model Molekul SrO 2
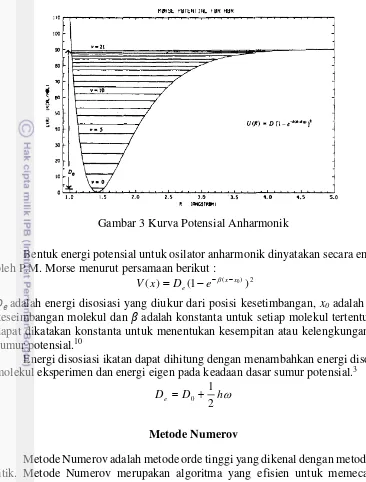
3 Kurva Potensial Anharmonik 4
4 Fungsi gelombang tingkat ke 0 molekul BaO menggunakan Metode
1 Algoritma program perhitungan energi eigen dan penggambaran fungsi
gelombang 18
2 Parameter-parameter input 18
4 Fungsi gelombang molekul BaO menggunakan metode Numerov untuk
tingkat energi (a) 1 (b) 2 (c) 3 19
5 Fungsi gelombang molekul BaO menggunakan metode Runge-Kutta
untuk tingkat energi (a) 1 (b) 2 (c) 3 20
6 Fungsi gelombang molekul SrO menggunakan metode Numerov untuk
tingkat energi (a) 1 (b) 2 (c) 3 22
7 Fungsi gelombang molekul SrO menggunakan metode Runge-Kutta
untuk tingkat energi (a) 1 (b) 2 (c) 3 23
8 Penyelesaian analitik energi eigen untuk molekul (a) BaO dan (b) SrO 24 9 Fungsi gelombang osilator harmonik molekul BaO untuk tingkat
energi (a) 0 dan (b) 4 26
10 Fungsi gelombang osilator harmonik molekul SrO untuk tingkat
energi (a) 0 dan (b) 4 27
PENDAHULUAN
Latar Belakang
Seiring berkembangnya ilmu pengetahuan dan teknologi, terdapat peningkatan penggunaan ferroelektrik material yang diaplikasikan dalam berbagai hal diantaranya: (1) sensor dengan detektornya menggunakan sifat pizzoelektrik, (2) multilayer kapasitor dengan memanfaatkan nilai konstanta dielektrik yang tinggi, (3) infra red detector yang memanfaatkan prinsip piroelektrik. Jenis material ferroelektrik yang sering dipergunakan adalah Barium Strontium Titanate (BST).1 Pada pembuatannya BST disintesis dari beberapa molekul seperti barium oksida (BaO), strontium oksida (SrO) dan titanium dioksida (TiO2). Molekul BaO dan SrO tergolong molekul diatomik yang berguna sebagai reagen atau reaktan dalam sintesis BST. Untuk mensintesis suatu material tertentu diperlukan kajian tentang molekul penyusunnya. Kajian tentang molekul BaO dan SrO telah banyak diteliti oleh berbagai kalangan, namun kedepannya diperlukan pemodelan suatu molekul agar lebih mudah dipahami karakteristiknya.
Ikatan antar atom dalam molekul diatomik bersifat elastis yang mengakibatkan atom-atom penyusunnya tidak berada pada posisi yang tetap melainkan bervibrasi di sekitar titik kesetimbangan.2 Potensial Morse merupakan model potensial yang digunakan untuk menerangkan tingkah laku vibrasi suatu molekul antar atom. Pendekatan yang baik untuk struktur vibrasi dari molekul pada osilator harmonik kuantum, karena secara eksplisit mencakup efek pemutusan ikatan, seperti adanya keadaan terikat pada suatu molekul.3
Karakteristik molekul diatomik BaO dan SrO dapat diketahui dengan cara pemodelan yang tepat. Dengan menyelesaikan persamaan Schrödinger secara numerik akan didapatkan bentuk fungsi gelombang serta tingkat-tingkat energi vibrasi molekul BaO dan SrO, sedangkan dengan melakukan penghitungan kembali energi disosiasi ikatan molekul BaO dan SrO akan dibandingkan dengan energi disosiasi eksperimennya.
Perumusan Masalah
Molekul BaO dan SrO dibutuhkan dalam mensintesis molekul BST, maka peneliti menyimpulkan bahwa dibutukan penelitian lebih lanjut untuk mengetahui karakteristik molekul BaO dan SrO. Perumusan masalah dari penelitian ini adalah : 1. Bagaimana menentukan dan menggambarkan bentuk fungsi gelombang
molekul BaO dan SrO ?
2. Bagaimana menentukan tingkat-tingkat energi molekul BaO dan SrO ? 3. Bagaimana menentukan energi disosiasi ikatan molekul BaO dan SrO ?
Tujuan Penelitian
Berdasarkan permasalahan diatas maka penelitian ini bertujuan untuk : 1. Menentukan dan menggambarkan bentuk fungsi gelombang molekul BaO dan
SrO secara numerik.
2
3. Menghitung kembali energi disosiasi ikatan molekul BaO dan SrO secara numerik.
Hipotesis
Bentuk fungsi gelombang serta tingkat-tingkat energi molekul BaO dan SrO dapat ditentukan dengan menyelesaikan persamaan Schrödinger secara numerik dengan menggunakan metode shooting yang diintegrasi dengan metode Numerov dan metode Runge-Kutta.
Energi disosiasi ikatan molekul BaO dan SrO dapat dihitung dengan menambahkan energi disosiasi eksperimen dan energi eigen pada keadaan dasar
TINJAUAN PUSTAKA
Molekul BaO dan SrO
Barium oksida (BaO) adalah adalah senyawa higroskopis putih yang dibentuk melalui pembakaran senyawa barium pada oksigen, namun juga terbentuk melalui dekomposisi garam barium lainnya. Barium oksida merupakan kristal tak berwarna dan berbentuk kubus atau heksagonal.
Molekul barium oksida memiliki karakteristik antara lain mempunyai jarak antar atom sebesar 1.939692 Å, berdasarkan eksperimen memiliki energi disosiasi atau energi yang dibutuhkan untuk memutuskan ikatan barium dan oksigen sebesar 47063 cm-1. Penggunaan barium oksida yang telah banyak diaplikasikan antara lain digunakan sebagai pelapis pada katoda panas dan sebagai reagen yang digunakan dalam sintesis Barium Strontium Titanat (BST).4
Sedangkan Strontium oksida (SrO) adalah senyawa higroskopis yang dibentuk ketika strontium direaksikan dengan oksigen, selain itu molekul SrO dapat dibentuk dari dekomposisi strontium karbonat (SrCO3) molekul ini tergolong oksida basa kuat.5
Molekul strontium oksida memiliki karakteristik antara lain mempunyai jarak antar atom sebesar 1.919809Å, berdasarkan ekperimen memiliki energi disosiasi sebesar 37951 cm-1. Penggunaan strontium oksida yang telah banyak diaplikasikan antara lain sebagai pembuatan tabung kaca televisi dan juga sebagai bahan untuk sintesis Barium Strontium Titanat (BST).6
Ba O
Gambar 1 Model Molekul BaO
Sr O
3
Persamaan Schrödinger Bebas Waktu
Persamaan Schrödinger bebas waktu dapat dituliskan sebagai:
energi potensial dan E adalah tingkat energi .
Untuk kasus dua partikel pada keadaan vibrasi, massa partikel diganti dengan massa tereduksi dan x menjadi distorsi jarak antara dua partikel dari panjang ikatan kesetimbangan.7
Energi Vibrasional Molekul Diatomik
Tingkat energi vibrasional molekul diatomik adalah:
vibrasional yang nilainya = 0,1,2,3... .
Keadaan vibrasional yang lebih tinggi dari sebuah molekul diatomik tidak mengikuti persamaan (2) karena aproksimasi parabolik untuk kurva energi potensialnya makin tidak cocok untuk energi yang semakin tinggi. Sebagai gantinya molekul diatomik harus dipandang dengan pendekatan osilator anharmonik.8
Tingkat energi vibrasional untuk pendekatan osilator anharmonik dinyatakan dengan:
Potensial Morse merupakan model potensial yang digunakan untuk menerangkan tingkah laku vibrasi suatu molekul antar atom. Pendekatan yang baik untuk struktur vibrasi dari molekul pada osilator harmonik kuantum, karena secara eksplisit mencakup efek pemutusan ikatan, seperti adanya keadaan terikat pada suatu model molekul.3
4
Bentuk energi potensial untuk osilator anharmonik dinyatakan secara empiris oleh P.M. Morse menurut persamaan berikut :
2 � adalah energi disosiasi yang diukur dari posisi kesetimbangan, x0 adalah jarak keseimbangan molekul dan � adalah konstanta untuk setiap molekul tertentu atau dapat dikatakan konstanta untuk menentukan kesempitan atau kelengkungan dari sumur potensial.10
Energi disosiasi ikatan dapat dihitung dengan menambahkan energi disosiasi molekul eksperimen dan energi eigen pada keadaan dasar sumur potensial.3
Metode Numerov adalah metode orde tinggi yang dikenal dengan metode tiga titik. Metode Numerov merupakan algoritma yang efisien untuk memecahkan persamaan diferensial orde dua, tanpa perlu merubah menjadi persamaan differensial orde satu.11 Penggunaan metode Numerov, integrasi numerik dapat dilakukan dengan akurasi yang relatif tinggi bahkan dengan ukuran step size yang lebih besar.12
Bentuk umum metode Numerov:
)
Metode Runge-Kutta adalah suatu metode yang digunakan untuk menyelesaikan persamaan differensial secara numerik atau pendekatan sehingga mendapatkan penyelesaian yang lebih signifikan dibandingkan penyelesaian secara
5 eksak atau analitik. Metode ini memperoleh akurasi dari pendekatan deret Taylor tanpa memerlukan perhitungan derivatif yang lebih tinggi.13
Bentuk umum metode Runge-Kutta :
)
Dalam analisis numerik, metode shooting adalah metode yang digunakan untuk menyelesaikan masalah nilai batas dengan menggunakan metode iterasi numerik untuk mencapai kemiringan yang sebenarnya. Prinsip metode shooting adalah menembak ke salah satu jalur fitting point, di mana solusi untuk persamaan dan kondisi batas ditemukan dengan meluncurkan "tembakan" dari kedua sisi interval dan mencoba untuk mencocokkan kondisi kontinuitas dibeberapa titik tengah. Fungsi diperoleh dengan mengintegrasikan N persamaan diferensial dari x1 ke x2.14
METODE
Waktu dan Tempat
6
Alat
Penelitian ini menggunakan peralatan berupa alat tulis (kertas/ buku tulis, pena, pensil), laptop/komputer dengan memori 3 GB dan menggunakan Windows 8. Komputer tersebut dilengkapi dengan Microsoft Office dan software Matlab.
Studi Pustaka
Tahap ini merupakan penelusuran tinjauan pustaka untuk mendukung penelitian lebih lanjut. Penelitian ini dimulai dengan studi pustaka dari molekul BaO dan SrO, persamaan Schrödinger, potensial Morse, teori vibrasi molekul, metode Numerov, metode Runge-Kutta dan metode shooting.
Menghitung Energi Disosiasi Ikatan Molekul BaO dan SrO
Pada tahap ini energi disosiasi ditentukan dengan menambahkan energi disosiasi eksperimen dan energi eigen pada keadaan dasar. Perumusannya :
D0 merupakan nilai energi disosiasi eksperimen.
Menentukan Bentuk Fungsi Gelombang dan Tingkat-tingkat Energi Molekul BaO dan SrO
Fungsi Gelombang dan Energi Eigen Untuk Osilator Anharmonik
Pada tahap ini persamaan potensial Morse : 2 Dimodelkan ke persamaan Schrödinger bebas waktu :
Sehingga persamaan Schrödinger menjadi :
7 Sedangkan untuk metode Runge-Kutta, persamaan (16) harus diubah menjadi persamaan differensial orde satu, yaitu :
) Untuk menentukan bentuk fungsi gelombang dan energi eigen masing-masing tingkat energi digunakan metode shooting yang diitegrasikan dengan persamaan (17), (18) dan (19). Referensi yang digunakan untuk mencari fungsi gelombang yang sesuai adalah nilai analitik energi vibrasi osilator yang diteliti. Dengan memberikan beberapa inisialiasi seperti N, E_initial, delta_x, delta_E, xmin, xmax, , dan .
Fungsi Gelombang dan Energi Eigen Untuk Osilator Harmonik
Pada tahap ini fungsi potensial :
2 sebelumnya untuk menentukan bentuk fungsi gelombang dan energi eigen.
Pembuatan Program Penggambaran Fungsi Gelombang dan Penghitungan Energi Eigen
Pembuatan program perhitungan energi eigen dan penggambaran fungsi gelombang dimulai dengan menyusun algoritma sebagai langkah-langkah yang jelas untuk mendapatkan energi eigen dari masing-masing tingkat energi. Penyusunan algoritma juga melibatkan penebakan parameter-parameter yang tidak diperoleh dalam tahapan studi pustaka. Parameter-parameter yang dimaksud adalah nilai konstanta anharmonik (wexe) dan konstanta kedalaman atau kesempitan sumur potensial (β). Setelah penyusunan algoritma selesai, program dibuat menggunakan bahasa pemrograman MATLAB.
Prosedur Analisis Data
8
HASIL DAN PEMBAHASAN
Energi Disosiasi Molekul BaO dan SrO
Hasil energi disosiasi perhitungan tersaji pada Tabel 1, terlihat ada perbedaan antara energi disosiasi perhitungan (De ) dengan energi disosiasi eksperimen (D0). Energi disosiasi yang didapat dari perhitungan untuk molekul BaO dan SrO masing-masing adalah 47397.88 cm-1 dan 38277.70 cm-1.
Selisih dari energi disosiasi perhitungan dengan energi disosiasi eksperimen untuk molekul BaO dan SrO masing-masing adalah 334.88 cm-1 dan 326.70 cm-1. Nilai selisih tersebut merupakan nilai energi eigen pada keadaan dasar atau tingkat energi ke 0 osilator harmonik. Hal ini sesuai dengan teori, yaitu energi disosiasi dapat dihitung dengan menambahkan energi disosiasi eksperimen dan nilai eigen pada tingkat ke 0.
Tabel 1 Perbandingan energi disosiasi perhitungan dan eksperimen molekul BaO dan SrO Energi disosiasi terkait dengan energi yang diperlukan untuk memutuskan ikatan senyawa molekul. Pada molekul BaO diperlukan energi sebesar 47397.88 cm-1 agar ikatan Ba dan O terputuskan, sedangkan pada molekul SrO diperlukan energi sebesar 38277.70 cm-1 untuk memutuskan ikatan Sr dan O. Ketika ikatan molekul diatomik putus, maka tidak akan terjadi keadaan vibrasi pada molekul tersebut.
Perhitungan energi disosiasi molekul BaO dan SrO (Lampiran 10) dilakukan dengan membuat guide user interface (GUI) yang akan memudahkan dalam
perhitungan energi disosiasi untuk molekul diatomik lainnya, tetapi perlu dilakukan konversi energi terlebih dahulu sebelum menggunakannya.
Energi Eigen Vibrasi Untuk Osilator Anharmonik
Untuk menentukan energi eigen pada tiap-tiap level energi diperlukan nilai tebakan awal energi sebelum terjadi proses iterasi dalam menentukan energi eigen yang cocok.
9 molekul BaO akan bervibrasi menjauhi titik kesetimbangannya dan memerlukan energi yang lebih besar untuk bervibrasi. Untuk penelitian ini tingkat energi ke 4 merupakan level energi tertinggi yang dihitung energi vibrasinya.
Tabel 2 Nilai energi eigen perhitungan secara numerik dan analitik molekul BaO Tingkat
Energi
Energi Eigen Ketepatan
(%) perhitungan. Energi yang dilakukan oleh molekul SrO ketika bervibrasi pada tingkat energi ke 0 sampai 4 masing-masing sebesar 326.00 cm-1, 973.85 cm-1, 1616.10 cm-1, 2252.80 cm-1 dan 2884.00 cm-1. Meningkatnya energi vibrasi molekul SrO sebanding dengan kenaikan tingkat energi. Hal ini menandakan molekul SrO akan bervibrasi menjauhi titik kesetimbangannya.
Tabel 3 Nilai energi eigen perhitungan secara numerik dan analitik molekul SrO Tingkat
Energi
Energi Eigen Ketepatan
(%)
Ketepatan perhitungan secara numerik menandakan keakuratan metode shooting dalam menentukan nilai harga eigen untuk kasus persamaan differensial. Secara sederhana metode shooting akan mencocokkan kondisi kontinuitas dibeberapa titik tengah dengan menembakkan nilai tebakan awal dari kedua interval xmin dan xmax.
Energi Eigen Vibrasi Pada Osilator Harmonik dan Anharmonik
10
Selisih energi eigen semakin meningkat seiring meningkatnya tingkat energi, hal ini disebabkan pada osilator anharmonik nilai eigen vibrasi dipengaruhi oleh nilai konstanta anharmonisitas (wexe) dari molekul BaO.
Tabel 4 Perhitungan energi eigen pada osilator harmonik dan anharmonik molekul BaO
Tingkat Energi
Energi Eigen Selisih
(cm-1) Osilator Harmonik Osilator Anharmonik
0 334.88 cm-1 (0.0415 eV) 334.29 cm-1 (0.0414 eV) 0.59 1 1004.60 (0.1236 ) 999.33 (0.1239 ) 5.27 2 1674.40 (0.2076 ) 1659.70 (0.2058 ) 14.70 3 2344.20 (0.2906 ) 2315.30 (0.2871 ) 28.90 4 3013.90 (0.3737 ) 2966.10 (0.3677 ) 47.80
Selisih energi eigen pada osilator harmonik dan anharmonik untuk molekul SrO pada tingkat energi ke 0 hingga 4 ditunjukkan pada Tabel 5 masing-masing sebesar 0.59 cm-1, 5.27 cm-1, 14.70 cm-1, 28.90 cm-1, 47.80 cm-1. Selisih energi eigen pada molekul SrO meningkat seiring dengan bertambahnya tingkat energi.
Molekul SrO memiliki nilai konstanta anharmonisitas yang lebih besar dibandingkan molekul BaO (Lampiran 2), sehingga nilai energi eigen pada molekul SrO lebih kecil dibandingkan molekul SrO.
Tabel 5 Perhitungan energi eigen pada osilator harmonik dan anharmonik molekul SrO
Tingkat Energi
Energi Eigen Selisih
(cm-1) Osilator Harmonik Osilator Anharmonik
0 326.70 cm-1 (0.0405 eV) 326.00 cm-1 (0.0404 eV) 0.70 1 980.10 (0.1215 ) 973.85 (0.1207 ) 6.25 2 1633.50 (0.2025 ) 1616.10 (0.2004 ) 17.40 3 2286.90 (0.2835 ) 2252.80 (0.2793 ) 34.10 4 2940.30 (0.3645 ) 2884.00 (0.3576 ) 56.30
Adanya selisih energi yang semakin besar pada setiap kenaikan tingkat energi menuju tingkat energi yang lebih tinggi dikarenakan keadaan vibrasional yang lebih tinggi dari sebuah molekul diatomik tidak mengikuti tingkat energi osilator harmonik karena aproksimasi parabolik untuk kurva energi potensialnya makin tidak cocok untuk energi yang semakin tinggi. Sebagai gantinya molekul diatomik harus dipandang dengan pendekatan osilator anharmonik.
11 Bentuk Fungsi Gelombang Osilator Anharmonik
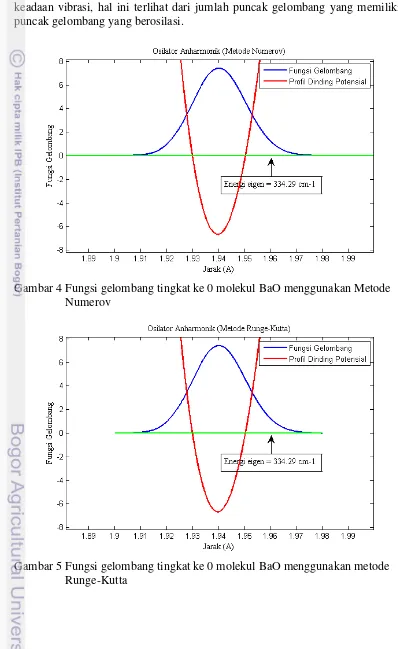
Pada kasus osilator anharmonik, persamaan Schrödinger dimodelkan dengan potensial Morse. Pada Gambar 4 dan 5 ditunjukkan bentuk fungsi gelombang menyatakan keadaan tingkat energi ke 0 molekul BaO pada saat keadaan vibrasi, hal ini terlihat dari jumlah puncak gelombang yang memiliki 1 puncak gelombang yang berosilasi.
Gambar 4 Fungsi gelombang tingkat ke 0 molekul BaO menggunakan Metode Numerov
12
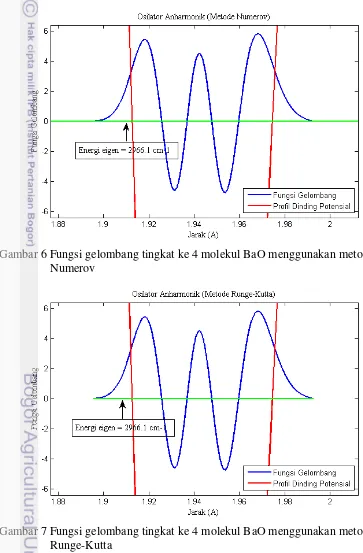
Tidak terdapat perbedaan dari kedua plot fungsi gelombang, Gambar 4 (metode Numerov) dan Gambar 5 (metode Runge-Kutta) namun untuk penelitian ini metode Numerov lebih akurat perhitungannya karena memiliki nilai error yang lebih kecil dibandingkan metode Runge-Kutta, karena metode Numerov memiliki orde lebih tinggi dibandingkan metode Runge-Kutta orde 4.
Pada gambar 6 dan 7 ditunjukkan bentuk fungsi gelombang menyatakan keadaan tingkat energi ke 4 molekul BaO pada saat keadaan vibrasi, hal ini terlihat dari 5 puncak gelombang yang berosilasi.
Gambar 6 Fungsi gelombang tingkat ke 4 molekul BaO menggunakan metode Numerov
13
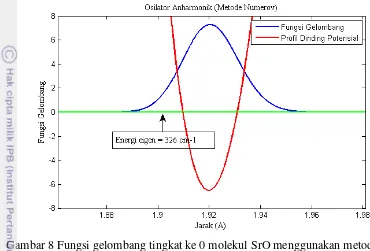
Pada Gambar 8 dan 9 ditunjukkan bentuk fungsi gelombang yang menyatakan keadaan tingkat energi ke 0 molekul SrO, hal ini terlihat dari 1 puncak gelombang yang berosilasi.
Gambar 8 Fungsi gelombang tingkat ke 0 molekul SrO menggunakan metode Numerov
14
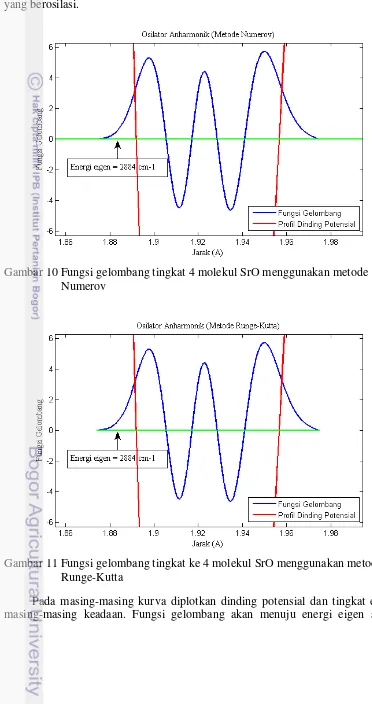
Pada Gambar 10 dan 11 ditunjukkan bentuk fungsi gelombang menyatakan keadaan tingkat energi ke 4 molekul SrO, hal ini terlihat dari 5 puncak gelombang yang berosilasi.
Gambar 10 Fungsi gelombang tingkat 4 molekul SrO menggunakan metode Numerov
Gambar 11 Fungsi gelombang tingkat ke 4 molekul SrO menggunakan metode Runge-Kutta
15 eksponensial ketika mengenai dinding potensial yang bernilai tak hingga. Sehingga terlihat bahwa partikel hanya dapat ditemukan didalam dinding potensial karena partikel hanya berosilasi disekitar titik kesetimbangan dalam dinding potensial.
Fungsi gelombang yang diplotkan juga telah memenuhi kondisi normalisasi karena nilai luasan dalam kurva fungsi gelombang bernilai 1.
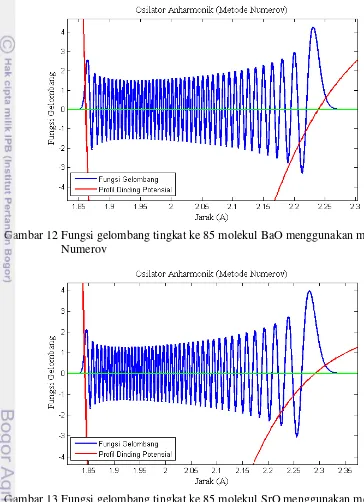
Gambar 12 Fungsi gelombang tingkat ke 85 molekul BaO menggunakan metode Numerov
Gambar 13 Fungsi gelombang tingkat ke 85 molekul SrO menggunakan metode Numerov
16
mempengaruhi osilasi dari gelombang, karena kurva akan menuju ke titik dimana energi potensial sama dengan energi disosiasi.
SIMPULAN DAN SARAN
Simpulan
Energi disosiasi dapat ditentukan dengan menambahkan energi disosiasi eksperimen dan energi eigen pada keadaan dasar. Metode shooting yang diintegrasi dengan metode Numerov dan Runge-Kutta telah berhasil menentukan energi eigen yang akurat pada setiap tingkat-tingkat energi yang dihitung dan fungsi gelombang yang tergambar sesuai dengan keadaan masing-masing tingkat energi. Semakin tinggi tingkat energi maka energi eigen semakin besar nilainya. Osilator anharmonik atau potensial Morse merupakan pendekatan yang baik untuk struktur vibrasi pada molekul BaO dan SrO karena memiliki aproksimasi pendekatan tingkat energi yang lebih tinggi.
Saran
Tingkat energi yang lebih tinggi perlu ditentukan untuk mengetahui pada tingkat energi ke berapa terjadi efek pemutusan ikatan pada suatu molekul diatomik. Serta perlu dilakukan rancangan program yang lebih fleksibel sehingga dapat digunakan untuk penelitian selanjutnya.
DAFTAR PUSTAKA
1. Saha S. 2000. Study of pulsed laser ablated Barium Strontium Titanate Thin films for dynamic Random Access Memory Application[thesis]. Bangalore (IN) : Indian Institute of Science.
2. Anam C. 2001. Kajian Teoretis Penentuan Tenaga Vibrasi-Rotasi Molekul Diatomik [skripsi]. Semarang (ID): Universitas Diponegoro.
3. Lima EF, Hornos, JEM. 2005. Matrix Elements for the Morse Potential Under an External Field [jurnal]. Sao Carlos (BR): Instituto de Fisica de Sao Carlos.
4. [SU] Sheffield University. 2007. Compounds of Barium: barium (II) oxide [internet]. [diunduh 2013 Okt 27]. Tersedia pada http://www.webelements.com/barium/ [27 Oktober 2013]
5. [SU] Sheffield University. 2007. Compounds of Strontium: strontium (II) Oxide [internet]. [diunduh 2013 Okt 27]. Tersedia pada http://www.webelements.com/strontium/ [27 Oktober 2013]
17 7. Barrow GM. 1962. Introduction to Molecular Spectroscopy. New York
(US): McGraw-Hill Book Company, Inc.
8. Fitrianto D. 2000. Kajian Teoretis Analisis Spektroskopi Penentuan Temperatur Vibrasional Molekul Diatomik [skripsi]. Semarang: Universitas Diponegoro
9. Schlick T., & Pesikin CS. 1989. Can Classical Equations Simulate Quantum-Mechanical Behavior? A Molecular Dynamics Investigation of a Diatomic Molecule with a Morse Potential. Communications on Pure and Applied Mathematics, Vol. XLII , 1141-1163
10.Herzberg G. 1950. “Spectra of Diatomic Molecules,” chap. 3. Princeton (US): D. Van Nostrand Company, Inc.
11.Gonzalez JLMQ., & Thompson, D. 1997. Getting started with Numerov’s method [jurnal]. Peru: Pontifica Universidad Catolica del Peru.
12.Pillai M., Goglio J., & Walker TG. 2012. Matrix Numerov method for solving Schrödinger’s equation[jurnal]. Wisconsin (US): University of Wisconsin-Madison.
13.Chapra SC. 2012. Applied Numerical Methods with MATLAB for Engineers and Scientist. Massachusetts (US): The MathWorks, Inc.
18
LAMPIRAN
Lampiran 1 Algoritma program perhitungan energi eigen dan penggambaran fungsi gelombang
Lampiran 2 Parameter-parameter input
Molekul Massa (amu) (cmDe -1) (Å) x0 (cmwe -1) (cmwexe -1) BaO 14.33225 47397.88 1.939692 669.76 2.36
SrO 13.52657 38277.70 1.919809 653.40 2.78 Start
Inisialisasi energi, xmin, xmax dan
yawal
Inisialisasi N, delta_x, delta_E
dan b
Inisialisasi y1 dan y2
Inisialisasi minimum_delta_E
delta_E > minimum_delta_
E ? Normalisasi y
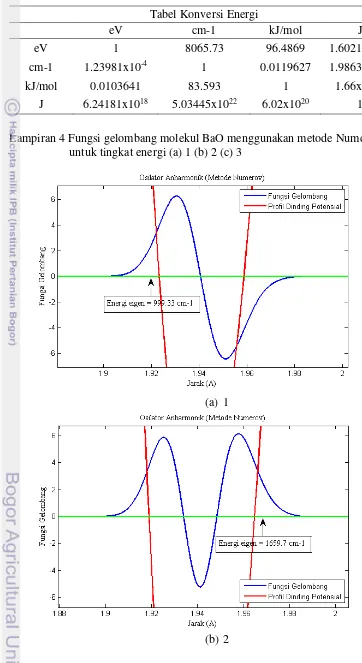
19 Lampiran 3 Tabel konversi energi
Tabel Konversi Energi
eV cm-1 kJ/mol J
eV 1 8065.73 96.4869 1.6021x10-19
cm-1 1.23981x10-4 1 0.0119627 1.9863x10-23
kJ/mol 0.0103641 83.593 1 1.66x10-21
J 6.24181x1018 5.03445x1022 6.02x1020 1 Lampiran 4 Fungsi gelombang molekul BaO menggunakan metode Numerov
untuk tingkat energi (a) 1 (b) 2 (c) 3
(a) 1
20
(c) 3
Lampiran 5 Fungsi gelombang molekul BaO menggunakan metode Runge-Kutta untuk tingkat energi (a) 1 (b) 2 (c) 3
21
(b) 2
22
Lampiran 6 Fungsi gelombang molekul SrO menggunakan metode Numerov untuk tingkat energi (a) 1 (b) 2 (c) 3
(a) 1
23
(c) 3
Lampiran 7 Fungsi gelombang molekul SrO menggunakan metode Runge-Kutta untuk tingkat energi (a) 1 (b) 2 (c) 3
24
(b) 2
(c) 3
Lampiran 8 Penyelesaian analitik energi eigen untuk molekul (a) BaO dan (b) SrO E = e( + ) - exe( + )
(A.1) - ʋ = 0
-25 - ʋ = 1
E = . ( + ) - . ( + ) E = . cm
-- ʋ = 2
E = . ( + ) - . ( + ) E = . cm
-- ʋ = 3
E = . ( + ) - . ( + ) E = . cm
-- ʋ = 4
E = . ( + ) - . ( + ) E = . cm
-(a)BaO - ʋ = 0
E = . ( + ) - . ( + ) E = . cm
-- ʋ = 1
E = . ( + ) - . ( + ) E = . cm
-- ʋ = 2
E = . ( + ) - . ( + ) E = . cm
-- ʋ = 3
E = . ( + ) - . ( + ) 3 = . ��−1
- ʋ = 4
E = . ( + ) - . ( + ) E = . cm
26
Lampiran 9 Fungsi gelombang osilator harmonik molekul BaO untuk tingkat energi (a) 0 dan (b) 4
(a) 0
27 Lampiran 10 Fungsi gelombang osilator harmonik molekul SrO untuk tingkat
energi (a) 0 dan (b) 4
(a) 0
28
Lampiran 11 Perhitungan energi disosiasi molekul (a) BaO dan (b) SrO
(a) BaO
29
RIWAYAT HIDUP
Penulis dilahirkan di Padang pada tanggal 10 September 1992. Penulis adalah anak pertama dari 5 bersaudara, dari pasangan Bapak Syamsul Bahar dan Ibu Roslinda. Pada tahun 2010 penulis berhasil menyelesaikan studi di SMA Negeri 3 Padang dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Ujian Saringan Masuk IPB (USMI) dan diterima di Departemen Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam.