UIN SYARIF HIDAYATULLAH JAKARTA
ISOLASI DAN SKRINING FITOKIMIA BAKTERI
ENDOFIT DARI DAUN RAMBUTAN (Nephelium
lappaceum L.) YANG BERPOTENSI SEBAGAI
ANTIBAKTERI
SKRIPSI
BRASTI EKA PRATIWI
1111102000061
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
UIN SYARIF HIDAYATULLAH JAKARTA
ISOLASI DAN SKRINING FITOKIMIA BAKTERI
ENDOFIT DARI DAUN RAMBUTAN (Nephelium
lappaceum L.) YANG BERPOTENSI SEBAGAI
ANTIBAKTERI
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
BRASTI EKA PRATIWI
1111102000061
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
HALAMAN PERNYATAAN ORISINALITAS
Skripsi ini adalah karya saya sendiri,
dan semua sumber baik yang dikutip maupun dirujuk
HALAMAN PERSETUJUAN PEMBIMBING
Nama : Brasti Eka Pratiwi Nim : 1111102000061 Program Studi : Farmasi
Judul : Isolasi dan Skrining Fitokimia Bakteri Endofit Dari Daun Rambutan (Nephelium Lappaceum L.) Yang Berpotensi Sebagai Antibakteri
HALAMAN PENGESAHAN
Skripsi ini diajukan oleh :
Nama : Brasti Eka Pratiwi NIM : 1111102000061 Program Studi : Farmasi
Judul Skripsi : Isolasi dan Skrining Fitokimia Bakteri Endofit Dari Daun Rambutan (Nephelium lappaceum L.) Yang Berpotensi Sebagai Antibakteri
ABSTRAK
Nama : Brasti Eka Pratiwi. Program Studi : Farmasi
Judul : Isolasi dan skrining fitokimia Bakteri Endofit Dari Daun Rambutan (Nephelium lappaceum L.) Yang Berpotensi
Sebagai Antibakteri.
Tanaman merupakan salah satu sumber daya alam yang digunakan oleh masyarakat dalam bidang pengobatan. Salah satu tanaman yang digunakan oleh masyarakat adalah daun rambutan atau dengan nama ilmiah Nephelium lappaceum L. Mikroba endofit merupakan mikroorganisme yang hidup di dalam jaringan tanaman dan dapat memproduksi metabolit sekunder. Penelitian ini bertujuan untuk mengisolasi bakteri endofit dari daun Nephelium lappaceum L. yang mempunyai aktivitas sebagai antibakteri dan dilakukan skrining metabolit sekunder dengan reaksi warna pada isolat yang diperoleh. Isolat bakteri endofit diidentifikasi secara makroskopis dan mikroskopis. Hasil dari isolasi bakteri endofit yang diperoleh diujikan terhadap bakteri Escherichia coli ATCC 35218,
Salmonella thypimurium ATCC 14028, Stapylococcus aureus ATCC 6633, dan
Bacillus subtilis ATCC 6538 dengan metode difusi agar. Hasil dari penelitian ini didapatkan 4 isolat bakteri, yaitu DR1, DR2, DR3 dan DR4. Pada isolat DR1, DR2, dan DR4 menunjukan aktivitas antibakteri dengan adanya zona bening terhadap semua bakteri uji, dan isolat DR3 tidak memberikan aktivitas antibakteri terhadap bakteri Staphylococcus aureus. Isolat DR1, DR2, DR3 dan DR4 memberikan hasil negatif terhadap uji terpenoid/steroid, alkaloid, fenolik, flavonoid, dan tanin.
ABSTRACT
Name : Brasti Eka Pratiwi. Major : Pharmacy
Title : Isolation and Phytochemical Screening of Bacteria Endophytic from Rambutan Leaves (Nephelium lappceum L.) Which is a
Potential as Antibacterial Agent
Plants are the resources that often used as the main material of medical treatment. One of the plants is Rambutan leaves or Nephelium lappaceum L. Endophytic microbes are microorganism that live within the living tissue of host plant and can produce its secondary metabolic. The purpose of this research are to isolate endophytic bacteria from Rambutan leaves as antibacterial agent and screen the secondary metabolic with colour reaction. Bacterial endophytic was identified by macroscopic and microscopic method. The result of bacterial endophytic isolation was examined against Escherichia coli ATCC 35218,
Salmonella thypimurium ATCC 14028, Stapylococcus aureus ATCC 6633, and
Bacillus subtilis ATCC 6538 with diffusion method agar. The result of this research were 4 isolates, these are DR1, DR2, DR3 and DR4. Isolates DR1, DR2 and DR4 showed antibacterial activity with inhibition zone to all bacteria pathogens, and isolate DR3 showed no antibacterial activity to Staphylococcus aureus. Isolates DR1, DR2, DR3 and DR4 showed negative result for terpenoids/steroids, alkaloids, phenolics, flavonoids, and tannin test.
KATA PENGANTAR
Alhamdulillahirabbil’alamiin, segala puji dan syukur bagi Allah SWT yang telah melimpahkan rahmat dan ridho-Nya serta shalawat serta salam tak lupa penulis ucapkan yang terlimpah kepada Nabi Muhammad SAW, yang begitu besar sehingga penulis dapat menyelesaikan penyusunan skripsi ini hingga selesai.
Skripsi yang berjudul “Isolasi dan Skrining Fitokimia Bakteri Endofit Dari Daun Rambutan (Nephelium lappaceum L.) yang Berpotensi Sebagai Antibakteri” disusun dalam rangka memenuhi persyaratan untuk memperoleh gelar Sarjana Farmasi pada Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
Pada kesempatan ini penulis ingin mengucapkan terima kasih dan penghargaan sebesar-besarnya kepada :
1. Dr. Arief Sumantri, S.KM., M.KM, selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Jakarta. 2. Yardi, Ph.D., Apt, selaku ketua Program Studi Farmasi Fakultas
Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Jakarta. 3. Ibu Eka Putri, M.Si.,Apt, selaku pembimbing I dan Bapak Saiful
Bahri, M.Si selaku pembimbing II yang telah tulus ikhlas serta kesabaran dalam membimbing, memberikan nasehat serta ilmu kepada saya sehingga penelitian ini dapat terselesaikan.
4. Bapak serta Ibu Dosen Farmasi Fakultas Kedokteran dan Ilmu Kesehatan, terima kasih atas ilmu dan nasehat selama ini yang telah diberikan kepada penulis.
5. Kedua orangtuaku tercinta, Papa Mochamad Basuki dan Mama Entik Sumartini, dan kakakku tersayang Mas Barri Eko Pratama, terima kasih atas doa dan dukungan baik moral maupun material dari mulai kuliah hingga akhir sampai terwujudnya skripsi ini.
7. Fio, Fiza, Astri, Mahar, Diyah, Achi, Rhesa, Haidar, Reza, Sutar, Novi, Henny dan Irun, terima kasih atas bantuan secara moral dan tenaga selama kuliah dan penelitian, sehingga skripsi ini dapat selesai.
8. Arini, Meri, Ambar, Ati, Rachma, Puput, Imeh dan teman-teman Mikrobiologi 2011 lainnya, terima kasih atas kerja sama kalian selama ini serta suka dan duka yang telah kita lalui sehingga skripsi ini selesai.
9. Tatiana, Prasasti, Dilla dan teman-teman IPA DUA lainnya, terima kasih karena telah memotivasi, memberi canda, dan tawa.
10.Teman-teman seperjuangan Farmasi 2011 yang tidak dapat disebutkan satu persatu, terima kasih telah membantu menyemangati penulis hingga skripsi ini terselesaikan.
11.Serta pihak-pihak lain yang tidak dapat disebutkan satu persatu, yang telah memberikan dukungan hingga terwujudnya skripsi ini.
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna, namun penulis berharap semoga hasil penelitian ini dapat bermanfaat bagi perkembangan ilmu pengetahun pada umumnya dan ilmu Farmasi pada khususnya.
Jakarta, 12 Juni 2015
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI TUGAS
AKHIR UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademik Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta, saya yang bertanda tangan di bawah ini :
Nama : Brasti Eka Pratiwi NIM : 1111102000061 Program Studi : Farmasi
Fakultas : Fakultas Kedokteran dan Ilmu Kesehatan Jenis Karya : Skripsi
Demi kepentingan ilmu pengetahuan, saya menyetujui skripsi/karya ilmiah saya, dengan judul :
Isolasi dan Skrining Fitokimia Bakteri Endofit Dari Daun Rambutan
(Nephelium lappaceum L.) Yang Berpotensi Sebagai Antibakteri
Untuk dipublikasikan atau ditampilkan di internet atau media lain yaitu Digital Library Perpustakaan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta untuk kepentingan akademik sebatas sesuai dengan Undang-Undang Hak Cipta.
DAFTAR ISI
Halaman
HALAMAN JUDUL ... ii
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAN ... v
ABSTRAK ... vi
ABSTRACT ... vii
KATA PENGANTAR ... viii
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... x
DAFTAR ISI ... xi
1.2 Batasan dan Rumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 3
BAB II. TINJAUAN PUSTAKA ... 4
2.1 Rambutan (Nephelium lappaceum L.) ... 4
2.2 Tinjauan Tentang Bakteri ... 6
2.2.1 Bakteri Gram Positif dan Negatif ... 6
2.2.2 Tahapan Siklus Bakteri ... 6
2.2.3 Teknik Pewarnaan ... 7
2.3. Metabolit Sekunder ... 8
2.3.1 Metabolit Sekunder Tanaman ... 8
2.3.2 Metabolit Sekunder Mikroorganisme ... 11
2.4 Bakteri Endofit ... 12
2.4.1 Interaksi Mikroba Endofit Dengan Tanaman ... 13
2.4.2 Peranan Bakteri Endofit ... 13
2.4.3 Mikroba Endofit Penghasil Metabolit Sekunder ... 14
2.4.4 Isolasi Bakteri Endofit ... 15
2.4.5 Fermentasi Bakteri Endofit ... 15
2.5 Bakteri Uji ... 16
2.6 Uji Aktivitas Antimikroba ... 21
2.6.1 Metode Difusi ... 21
2.7 Antibakteri Pembanding ... 22
BAB III. METODOLOGI PENELITIAN ... 23
3.1 Waktu dan Tempat Penelitian ... 23
3.2 Alat dan Bahan ... 23
3.2.1 Alat ... 23
3.2.2 Bahan ... 23
3.2.3 Determinasi Tanaman ... 24
3.3.1 Skrining Fitokimia Daun Nephelium lappaceum Segar ... 24
3.3.4 Pembuatan Kurva Pertumbuhan Bakteri Uji ... 27
3.3.5 Isolasi Bakteri Endofit ... 27
3.3.6 Pemurnian Isolat Bakteri ... 27
3.3.7 Pembuatan Stock Culture dan Working Culture ... 28
3.3.8 Identifikasi Bakteri Endofit ... 28
3.3.9 Identifikasi Bakteri Uji ... 29
3.3.10 Fermentasi Bakteri Endofit ... 29
3.3.11 Uji Fitokimia Isolat Hasil Fermentasi (Adiarti, 2013) ... 29
3.3.12 Uji Aktivitas Antibakteri ... 30
BAB IV. HASIL DAN PEMBAHASAN ... 32
4.1 Determinasi Daun Rambutan ... 32
4.2 Skrining Fitokimia Daun Nephelium lappaceum L. Segar ... 32
4.3 Isolasi, Pemurnian dan Peremajaan Bakteri Endofit ... 36
4.4 Identifikasi Bakteri Endofit ... 38
4.5 Kurva Pertumbuhan Bakteri Uji ... 38
4.6 Fermentasi Isolat Bakteri Endofit ... 40
4.7 Skrining Fitokimia Bakteri Endofit ... 40
4.8 Uji Aktivitas Antibakteri ... 42
BAB V. PENUTUP ... 46
5.1 Kesimpulan ... 46
5.2 Saran ... 46
DAFTAR PUSTAKA ... 47
DAFTAR GAMBAR
Halaman
Gambar 1. Daun Rambutan (Nephelium lappaceum L.) ... 4
Gambar 2. Struktur Utama Flavonoid ... 9
Gambar 3. Staphylococcus aureus Perbesaran 1000x ... 17
Gambar 4. Bacillus subtilis Perbesaran 1000x ... 19
Gambar 5. Escherichia coli Perbesaran 1000x ... 20
Gambar 6. Salmonella thypimurium Perbesaran 1000x ... 21
Gambar 7. Daun Segar Rambutan ... 32
Gambar 8. Pembuatan Ekstrak Etanol Daun Segar dengan n – heksana ... 35
Gambar 9. Isolasi Daun Rambutan Hari ke – 0 ... 37
Gambar 10. Pemurnian Isolat Bakteri Endofit ... 37
DAFTAR TABEL
Halaman
Tabel 1. Ciri Bakteri Gram positif dan Gram negatif ... 6
Tabel 2. Tabel Pewarnaan Gram ... 8
Tabel 3. Hasil Uji Skrining Metabolit Sekunder Daun Segar ... 33
Tabel 4. Identifikasi Bakteri Endofit ... 38
Tabel 5. Skrining Metabolit Sekunder Bakteri Endofit ... 41
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Determinasi Daun Rambutan ... 52
Lampiran 2. Skema Kerja Penelitian ... 53
Lampiran 3. Sterilisasi Permukaan Daun ... 54
Lampiran 4. Pemurniaan dan Identifikasi Isolat ... 55
Lampiran 5. Fermentasi Bakteri Endofit ... 56
Lampiran 6. Uji Aktivitas Antibakteri ... 57
Lampiran 7. Hasil Isolasi Bakteri Endofit Pada Daun Rambutan ... 58
Lampiran 8. Hasil Pemurnian Isolat Bakteri Endofit ... 59
Lampiran 9. Skrining Fitokimia Daun Segar ... 60
Lampiran 10. Uji Katalase Isolat ... 61
Lampiran 11. Uji Aktivitas Antibakteri ... 62
Lampiran 12. Identifikasi Isolat Bakteri Endofit ... 64
Lampiran 13. Identifikasi Bakteri Uji ... 65
BAB I
PENDAHULUAN
1.1 Latar Belakang
Tanaman merupakan salah satu sumber daya yang sangat penting dalam upaya pengobatan dan upaya mempertahankan kesehatan pada masyarakat. Masyarakat masih sering menggunakan pengobatan tradisional yang berasal dari tanaman obat. Indonesia dikenal sebagai salah satu negara yang mempunyai keanekaragaman hayati yang tinggi, maka dari itu nilai potensial untuk mengembangkan obat herbal yang berasal dari tanaman obat sangat besar. Sudah banyak tanaman obat yang digunakan untuk bahan baku obat, karena tanaman tersebut menghasilkan metabolit sekunder dengan aktivitas biologis yang beraneka ragam, serta mempunyai potensi besar untuk digunakan dan dikembangkan menjadi obat untuk berbagai penyakit, seperti contohnya pada tanaman rambutan.
Tanaman Rambutan atau dengan nama Latin Nephelium lappaceum
(Sapindaceae), merupakan tanaman buah yang tumbuh pada daerah iklim tropis. Rambutan berasal dari Indonesia dan Malaysia, dan mulai berkembang ke Filipina, Singapura, Thailand, Vietnam, India, Syria, Zaire, Afrika Selatan, Madagaskar dan Australia (Tindall, 1994 dan Arenas dkk., 2010). Buah rambutan banyak dikonsumsi dan digunakan oleh masyarakat, baik buahnya atau bagian lain dari tanaman tersebut. Secara tradisional, seluruh bagian tanaman rambutan mempunyai khasiat tersendiri. Seperti pada bagian biji buah rambutan yang bisa digunakan sebagai anti diabetes, batang yang dapat digunakan sebagai pengobatan kanker, daun digunakan sebagai antidiare serta digunakan untuk menghitamkan rambut, dan akar untuk menurunkan demam (Muhtadi dkk., 2013).
(2014) dikatakan bahwa pada daun rambutan mengandung metabolit sekunder yaitu steroid, flavonoid, polifenol, saponin dan tanin.
Metabolit sekunder adalah senyawa yang dihasilkan oleh tanaman, yang mempunyai peran biologis dan ekologi, terutama digunakan sebagai pembawa pesan dan senyawa pelindung untuk tanaman itu sendiri (Jones dkk., 2012). Pada umumnya, tanaman yang mempunyai metabolit sekunder diharapkan mempunyai fungsi sebagai obat. Metabolit sekunder diproduksi oleh tanaman bukan sebagai kebutuhan hidup utamanya atau senyawa ini biasanya diproduksi oleh tanaman sebagai bagian dari sistem pertahanan dirinya, baik terhadap perubahan lingkungan maupun serangan penyakit (Tisnadjaja, 2006). Pada manusia, metabolit sekunder dapat digunakan untuk menangani berbagai macam penyakit, seperti saponin digunakan sebagai antikolesterol (Forester, 2006), flavonoid sebagai anti diare (Schuier, 2005).
Pada tanaman terdapat mikroorganisme yang dapat memproduksi berbagai metabolit sekunder yang mempunyai kemampuan sebagai antibakteri. Sumber daya mikroorganisme yang terdapat di dalam jaringan tanaman mulai dikenal dengan sebutan mikroba endofit. Mikroba endofit adalah mikroorganisme yang seluruh atau sebagian hidupnya berada dalam jaringan tumbuhan (batang, cabang atau ranting tumbuhan), dimana diantara keduanya terjalin hubungan yang saling menguntungkan (Kumala dkk., 2006). Setiap tanaman tingkat tinggi dapat mengandung beberapa mikroba endofit yang mampu menghasilkan senyawa biologi atau metabolit sekunder. Kemampuan mikroba endofit memproduksi senyawa metabolit sekunder sesuai dengan tanaman inangnya, merupakan peluang yang sangat besar dan dapat diandalkan untuk memproduksi metabolit sekunder dari mikroba endofit yang diisolasi dari tanaman tersebut (Radji, 2005). Maka, apabila endofit yang diisolasi dari suatu tanaman dapat menghasilkan metabolit sekunder sama dengan tanaman aslinya atau bahkan dalam jumlah yang lebih tinggi, maka kita tidak perlu menebang tanaman aslinya untuk diambil sebagai simplisia, yang kemungkinan memerlukan waktu yang relatif lama untuk dipanen (Radji, 2005).
antibakterinya. Isolat yang mempunyai aktivitas antibakteri akan dilakukan skrining fitokimia untuk membuktikan bahwa metabolit sekunder yang dihasilkan pada daun rambutan berasal dari bakteri endofit.
1.2 Batasan dan Rumusan Masalah
Hingga saat ini, belum adanya penelitian mengenai isolasi, skrining fitokimia dan uji aktivitas antibakteri isolat bakteri endofit dari daun Rambutan (Nephelium lappaceum L.).
1.3 Hipotesis
1. Didapatkan bakteri endofit dari isolasi Daun Rambutan (Nephelium lappaceum L.)
2. Bakteri endofit mempunyai kandungan senyawa metabolit sekunder yang sama dengan tanaman aslinya
3. Zat antimikroba dari bakteri endofit yang diisolasi dari daun rambutan mampu menghambat pertumbuhan mikroba patogen Staphylococcus aureus, Bacillus subtilis, Escherichia coli, dan Salmonella thypimurium.
1.4 Tujuan Penelitian
1. Mendapatkan isolat bakteri endofit dari daun Rambutan (Nephelium lappaceum L.).
2. Mengetahui metabolit sekunder dari daun Rambutan dan isolat bakteri endofit.
3. Mengetahui kemampuan zat antibakteri dari isolat bakteri endofit terhadap bakteri patogen.
1.5 Manfaat Penelitian
1. Memberikan informasi aktivitas antibakteri yang poten dari isolat bakteri endofit daun rambutan yang tumbuh di Indonesia terhadap bakteri
Staphylococcus aureus, Bacillus subtilis, Escherichia coli, dan Salmonella thypimurium.
2. Mengetahui metabolit sekunder yang dihasilkan oleh isolat bakteri daun rambutan.
BAB II
TINJAUAN PUSTAKA
2.1 Rambutan (Nephelium lappaceum L.)
Menurut Rukmana dkk., (2002), taksonomi tumbuhan rambutan dikelompokan dalam klasifikasi :
Kingdom : Plantae
Divisio : Magnoliophyta Kelas : Magnoliopsida Ordo : Sapindales Famili : Sapindaceae Genus : Nephelium
Spesies : Nephelium lappaceum L.
Rambutan berasal dari Malaysia dan Indonesia, namun lokasi tepatnya tidak diketahui. Rambutan mulai menyebar ke Asia Tenggara, dan banyak terdapat di daerah tropis seperti India, Sri Lanka, Zanzibar, bagian dataran rendah Amerika Selatan, Australia Selatan, Papua Nugini, Kepulauan Pasifik, dan Hawai (Lim, 2013).
Gambar 1. Daun Rambutan (Nephelium lappaceum L.) (Dokumentasi pribadi)
suhu tropika hangat (Kalie, 1994). Suhu optimum pertumbuhan pohon rambutan yaitu antara 20-32oC, dan kelembapan harus sekitar 80% (Lim, 2013).
Rambutan mempunyai nama daerah antara lain : Rambot (Aceh, Sumatra), Barangkasa (Maluku), Buiuwan (Bali), Jailan Rambutan (Batak), Rambuta (Bima, Timor), Rambuten (Gajo, Sumatra), Rambutan (Jawa), Buwa Buluwan (Kambang), Puru Bianjak (Kubu, Kalimantan), Hayuham, Kakapas, Likes, Rabut, Rambuta, Rambutan, Takuyung alu (Lampung, Sumatra) (Lim, 2013).
Pada buah rambutan mempunyai aktivitas sebagai antihiperglikemi dengan senyawa aktif yang teridentifikasi adalah geraniin dan ellagitanin (Palanisamy dkk., 2011). Pada daun rambutan terdapat senyawa metabolit sekunder antioksidan yaitu fenol (Sidker dkk., 2013). Sedangkan penelitian yang dilakukan Dalimartha (2003) bahwa daun rambutan mengandung senyawa tanin dan saponin. Menurut penelitian Maradona (2013) dengan menggunakan etanol 70%, bahwa ekstrak daun rambutan mengandung senyawa steroid, flavonoid, polifenol, hidrokuinon, saponin dan tanin.
Secara tradisional, daun rambutan digunakan oleh masyarakat Ulu Legong, Kedah, Malaysia, sebagai sebagai obat penurun panas yang disebabkan oleh penyakit flu dengan cara menumbuk daun rambutan (Mohammad dkk., 2012). Kegunaan lain adalah kulit buah digunakan sebagai penurun panas dan disentri, biji digunakan sebagai penurun gula darah (anti diabetes), daun digunakan sebagai pengobatan diare dan penghitam rambut, akar digunakan sebagai penurun panas (Muhtadi dkk., 2013), kulit kayu digunakan untuk mengatasi sariawan (Dalimartha, 2003).
2.2 Tinjauan Tentang Bakteri
Bakteri merupakan sel prokariot yang khas, uniseluler dan tidak mengandung struktur yang membatasi membran di dalam sitoplasmanya. Reproduksi utama dengan pembelahan biner sederhana yaitu suatu proses aseksual. Morfologi bakteri terdiri dari tiga bentuk, yaitu sferis (kokus), batang (basil) dan spiral. Ukuran bakteri bervariasi tetapi pada umumnya berdiameter sekitar 0.5-1.0 µm dan panjang 1.5-2.5 µm (Pelczar & Chan, 2008).
2.2.1 Bakteri Gram Positif dan Negatif
Berdasarkan komposisi dinding selnya, bakteri dibagi menjadi dua golongan : bakteri Gram positif dan Gram negatif (Goering dkk., 2008).
Tabel 1. Ciri bakteri Gram positif dan Gram negatif (Pelczar & Chan, 2008).
Ciri Perbedaan Relatif
Gram Positif Gram Negatif
Struktur dinding sel Tebal (15-80 nm)
Berlapis tunggal (mono)
Tipis (10-15 nm) Berlapis tiga (multi)
Komposisi dinding sel Kandungan lipid rendah (1-4%)
Peptidoglikan ada sebagai lapisan tunggal; komponen utama lebih dari
50% berat kering pada beberapa sel bakteri
Persyaratan nutrisi Relatif rumit pada banyak spesies Relatif sederhana
Resistensi terhadap gangguan fisik
Lebih resisten Kurang resisten
2.2.2 Tahapan Siklus Bakteri
yaitu fase lag, fase log (fase eksponensial), fase stasioner dan fase kematian (Pelczar, 2008 dan Pratiwi, 2008).
a. Fase lag
Merupakan fase adaptasi, yaitu fase penyesuaian mikroorganisme pada suatu lingkungan baru. Ciri fase lag adalah tidak adanya peningkatan jumlah sel, yang ada hanyalah peningkatan ukuran sel dan sel mengalami perubahan dalam komposisi kimiawi.
b. Fase log (eksponensial)
Merupakan fase dimana mikroorganisme tumbuh dan membelah pada kecepatan maksimum, tergantung pada genetika mikroorganisme, sifat media, dan kondisi pertumbuhan. Sel baru terbentuk dengan laju konstan dan massa yang bertambah secara eksponensial. Aktivitas metabolik yang dihasilkan seimbang. Bila nutrisi dalam kultur habis, laju pertumbuhan dapat terhambat, sehingga hasil metabolisme yang bersifat racun akan tertimbun dan menghambat pertumbuhan.
c. Fase stasioner
Pertumbuhan mikroorganisme berhenti dan terjadi keseimbangan antara jumlah sel yang membelah dengan jumlah sel yang mati. Pada fase ini terjadi akumulasi produk buangan yang toksik.
d. Fase kematian
Yaitu jumlah sel yang mati lebih cepat daripada terbentuknya sel baru. Faktor penyebabnya adalah ketidaktersediaan nutrisi dan akumulasi produk buangan yang toksik.
2.2.3 Teknik Pewarnaan
Tujuan dilakukan pewarnaan adalah (Pelczar & Chan, 2008) :
1. Mengamati dengan lebih baik bentuk sel mikroorganisme secara kasar 2. Mengidentifikasi bagian-bagian struktural sel mikroorganisme
3. Membantu mengindetifikasi dan membedakan organisme yang serupa.
a. Pewarnaan Gram
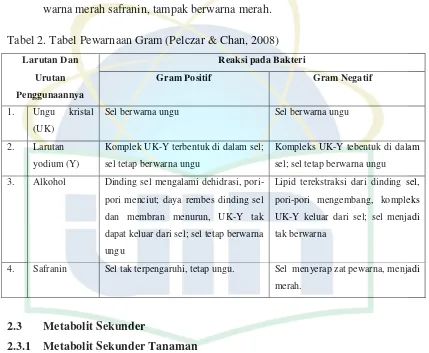
dalam publikasi pada tahun 1884 oleh ahli bakteriologi Christian Gram yang berasal dari Denmark. Bakteri yang diwarnai dengan metode Gram dibagi menjadi dua kelompok. Pada kelompok bakteri Gram positif mempertahankan zat pewarna ungu kristal dan tampak berwarna ungu tua. Sedangkan pada kelompok bakteri Gram negatif akan terjadi kehilangan ungu kristal ketika dicuci dengan alkohol, dan sewaktu diberi warna merah safranin, tampak berwarna merah.
Tabel 2. Tabel Pewarnaan Gram (Pelczar & Chan, 2008)
Larutan Dan
Sel berwarna ungu Sel berwarna ungu
2. Larutan
yodium (Y)
Komplek UK-Y terbentuk di dalam sel; sel tetap berwarna ungu
Kompleks UK-Y tebentuk di dalam sel; sel tetap berwarna ungu
3. Alkohol Dinding sel mengalami dehidrasi,
pori-pori menciut; daya rembes dinding sel dan membran menurun, UK-Y tak dapat keluar dari sel; sel tetap berwarna ungu
Lipid terekstraksi dari dinding sel, pori-pori mengembang, kompleks UK-Y keluar dari sel; sel menjadi tak berwarna
4. Safranin Sel tak terpengaruhi, tetap ungu. Sel menyerap zat pewarna, menjadi
merah.
2.3 Metabolit Sekunder
2.3.1 Metabolit Sekunder Tanaman
ginjal, antibiotik, insektisida dan herbisida (Croteau dkk., 2000 dan Dewick, 2002).
a. Flavonoid
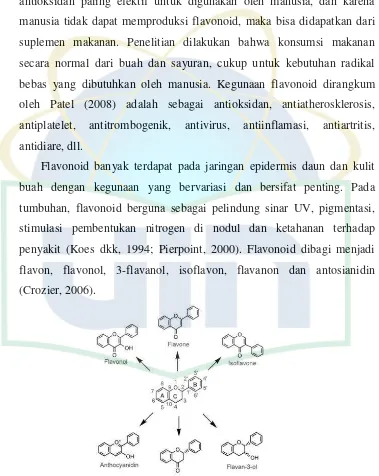
Flavonoid merupakan senyawa yang paling kuat dan sebagai antioksidan paling efektif untuk digunakan oleh manusia, dan karena manusia tidak dapat memproduksi flavonoid, maka bisa didapatkan dari suplemen makanan. Penelitian dilakukan bahwa konsumsi makanan secara normal dari buah dan sayuran, cukup untuk kebutuhan radikal bebas yang dibutuhkan oleh manusia. Kegunaan flavonoid dirangkum oleh Patel (2008) adalah sebagai antioksidan, antiatherosklerosis, antiplatelet, antitrombogenik, antivirus, antiinflamasi, antiartritis, antidiare, dll.
Flavonoid banyak terdapat pada jaringan epidermis daun dan kulit buah dengan kegunaan yang bervariasi dan bersifat penting. Pada tumbuhan, flavonoid berguna sebagai pelindung sinar UV, pigmentasi, stimulasi pembentukan nitrogen di nodul dan ketahanan terhadap penyakit (Koes dkk, 1994; Pierpoint, 2000). Flavonoid dibagi menjadi flavon, flavonol, 3-flavanol, isoflavon, flavanon dan antosianidin (Crozier, 2006).
Gambar 2. Stuktur utama flavonoid (Crozier, 2006)
b. Tanin
Makkar (2003), tanin biasa terdapat pada bagian tanaman yang spesifik seperti daun, buah, kulit dahan dan batang. Tanin merupakan senyawa polifenolik, yang secara garis besar dibagi menjadi dua kelompok, yaitu : i. Tanin terhidrolisa yang mempunyai inti pusat karbohidrat dengan asam karboksiklat fenolik berikatan dengan ester, potensial beracun ke hewan karena dapat menyebabkan toksisitas pada ginjal dan hati bila terakumulasi banyak dan menyebabkan kematian pada hewan;
ii. Tanin terkondensasi atau protoantosianin yang mempunyai oligomer 2- atau 3-flavanol, seperti katekin, epikatekin, atau gallokatekin.
Tanin memiliki afinitas yang sangat tinggi untuk protein dan komplek tanin-protein (McSweeney, 2003). Tanin adalah polifenol tanaman yang berfungsi mengikat dan mengendapkan protein. Tanin juga digunakan untuk menyamak kulit (Harbone, 1987).
c. Saponin
Saponin merupakan senyawa yang secara struktural mempunyai steroid dan triterpenoid aglikon (sapogenin) yang berikatan dengan satu atau lebih oligosakarida dengan ikatan glikosida. Aktivitas biologi saponin adalah untuk interaksi dengan komponen seluler dan membran. Contohnya adalah saponin dapat menghemolisis sel darah merah dengan interaksi nonspesifik dengan protein membran, fosfolipid, dan kolesterol di eritrosit (Croizer, 2006).
d. Alkaloid
Alkaloid adalah senyawa pertama dan paling banyak digunakan dalam farmasi, sebagai senyawa tumbuhan yang mengandung nitrogen (Meissner, 1819). Menurut Ladenburg, alkaloid adalah senyawa yang berasal dari tumbuhan yang mempunyai sifat dasar dan mengandung sedikitnya satu nitrogen pada cincin heterosiklik. Fungsi alkaloid pada tumbuhan yaitu :
i. Agen beracun pada tanaman yang digunakan sebagai agen pelindung dari hewan herbivora atau serangga
ii. Sebagai faktor pertumbuhan tanaman
iii. Cadangan makanan pada tumbuhan untuk pasokan nitrogen dan unsur-unsur lain.
Pada manusia, alkaloid berguna untuk analgesik narkotik (morfin), ekspektoran, analgesik (kodein), stimulan SSP (brusin, striknin), midriatik (atropine, homotropin), miotik (pilokarpin, fisostigmin), hipertensi (efedrin), hipotensi (reserpin) (Kar, 2003).
e. Fenolik
Fenolik memiliki cincin aromatik dengan satu atau lebih gugus hidroksi (OH) dan gugus-gugus lain penyertanya. Senyawa ini diberi nama berdasarkan nama senyawa induknya, yakni fenol. Sebagian besar senyawa fenol memiliki gugus hidroksi lebih dari satu sehingga disebut polifenol.
Fenolik dapat diklasifikasikan ke dalam komponen yang tidak larut seperti lignin dan komponen yang larut seperti asam fenolik, phenylopropanoids, flavonoid dan kuinon (Indrawati, 2013).
2.3.2 Metabolit Sekunder Mikroorganisme
Fungsi metabolit sekunder bagi mikroorganisme penghasil itu sendiri sebagian besar belum jelas. Metabolit sekunder dibuat dan disimpan secara ekstraseluler. Metabolit sekunder banyak dimanfaatkan oleh manusia dan makhluk hidup lain karena banyak diantaranya bersifat sebagai obat, pigmen, vitamin, ataupun hormon.
Metabolit sekunder tidak diproduksi pada saat pertumbuhan sel secara cepat (fase logaritmik), tetapi disintesis pada akhir siklus pertumbuhan sel, yaitu pada fase stasioner saat populasi sel tetap karena jumlah sel yang tumbuh sama dengan jumlah sel yang mati. Pada fase ini sel mikroorganisme lebih tahan terhadap keadaan ekstrem, misalnya suhu yang lebih panas atau dingin, radiasi, bahan-bahan kimia, dan metabolit yang dihasilkannya sendiri (misalnya antibiotik). Ciri-ciri metabolit sekunder adalah :
1. Dibuat melalui proses metabolisme sekunder; 2. Diproduksi selama fase stasioner;
3. Fungsi bagi organisme penghasil belum jelas, diduga tidak berhubungan dengan sintesis komponen sel atau pertumbuhan;
4. Dibuat dan disimpan secara ekstrseluler;
5. Hanya dibuat oleh spesies tertentu dan dalam jumlah terbatas;
6. Umumnya diproduksi oleh fungi filamentus dan bakteri pembentuk spora;
7. Merupakan kekhasan bagi spesies tertentu;
8. Biasanya berhubungan dengan aktivitas antimikroba, enzim spesifik, penghambatan, pendorongan pertumbuhan dan sifat-sifat farmakologis.
2.4 Bakteri Endofit
Endofit berasal dari bahasa Yunani, “endo” berarti di dalam dan “fit” (phyte) berarti tumbuhan. Bakteri endofit hidup dalam jaringan vaskular tumbuhan tanpa menyebabkan efek negatif. Hubungan simbiosis metabolisme antara bakteri dan tumbuhan memungkinkan bakteri menghasilkan senyawa bioaktif yang sama seperti terkandung di dalam tumbuhan inangnya (Barbara dan Christine, 2006).
ranting, serta kulit kayu dari berbagai macam jenis tanaman (Tarabily dkk., 2003).
Awalnya keberadaan mikroba endofit diduga bersifat netral, maksudmya tidak memberikan pengaruh baik manfaat maupun kerusakan yang ditimbulkan terhadap tanaman. Ternyata setelah para peneliti mulai mempelajari lebih mendalam, ada hubungan simbiosis mutualisme antara mikroba endofit dengan tanaman inang terutama peranannya yang sangat penting dalam melindungi tanaman inang terhadap predator dan patogen (Prasetyoputri dan Atmosukarto, 2006).
2.4.1 Interaksi Mikroba Endofit Dengan Tanaman
Interaksi mikroba endofit dengan inangnya yang ditemukan pada bagian organ tumbuhan tertentu, berhubungan erat dengan siklus hidup yang dilaluinya. Masuknya mikroba endofit pada jaringan tanaman inang tergantung pada keberhasilan mikroba tersebut menembus lapisan eksternal inangnya. Proses masuknya mikroba endofit ini dicapai melalui mekanisme pemecahan atau degradasi jaringan pelindung pada lapisan kutikula dan epidermis (Bacon dan Siegel, 1990).
Proses masuknya mikroba endofit ke dalam jaringan tanaman inang terjadi secara langsung dan tidak langsung. Secara langsung ditandai dengan masuknya endofit ke dalam bagian internal jaringan pembuluh tanaman dan diturunkan melalui biji, sedangkan secara tidak langsung mikroba endofit hanya menginfeksi bagian eksternal yaitu pada bagian pembungaan (Bacon, 1985).
2.4.2 Peranan Bakteri Endofit
2.4.3 Mikroba Endofit Penghasil Metabolit Sekunder
Setiap tanaman tingkat tinggi dapat mengandung beberapa mikroba endofit yang mampu menghasilkan senyawa biologi atau metabolit sekunder yang diduga sebagai akibat koevolusi atau transfer genetik (genetic recombination) dari tanaman inangnya ke dalam mikroba endofit (Tan dkk., 2001). Sekitar 300.000 jenis tanaman yang tersebar di muka bumi ini, masing-masing tanaman mengandung satu atau lebih mikroba endofit yang terdiri dari bakteri dan jamur (Strobel dkk., 2003). Apabila endofit yang diisolasi dari suatu bagian tanaman dapat menghasilkan metabolit sekunder sama dengan tanaman aslinya atau bahkan dalam jumlah yang lebih tinggi. Contoh mikroba endofit yang menghasilkan aktivitas :
a. Antibiotika : Cryptocandin adalah antifungi yang dihasilkan oleh mikroba endofit Cryptosporiopsis quercina yang diisolasi dari tanaman obat Tripterigeum wilfordii dan berkhasiat sebagai antijamur yang patogen terhadap manusia yaitu Candida albicans dan Trichopyton sp. (Strobel dkk., 1999 dalam Radji, 2005).
b. Antivirus : jamur endofit Cytonaema sp. dapat menghasilkan metabolit
cytonic acid A dan B dengan struktur molekul isomer p-tridepside, yang berkhasiat sebagai anti virus. Cytonic acid A dan B merupakan protease inhibitor dan dapat menghambat pertumbuhan cytomegalovirus manusia (Guo dkk., 2000 dalam Radji, 2005).
c. Antidiabetes : endofit Pseudomassaria sp. yang diisolasi dari hutan lindung, menghasilkan metabolit sekunder yang bekerja seperti insulin (Zhang dkk. 1999 dalam Radji, 2005).
d. Antimalaria : Colletotrichum sp. merupakan endofit yang diisolasi dari tanaman Artemisia annua, menghasilkan metabolit artemisinin yang sangat potensial sebagai anti malaria (Lu dkk., 2000 dalam Radji, 2005). e. Antikanker : Paclitaxel dan derivatnya merupakan zat yang berkhasiat
sebagai antikanker yang pertama kali ditemukan yang diproduksi oleh mikroba endofit, diproduksi oleh endofit Pestalotiopsis microspora, yang diisolasi dari tanaman Taxus andreanae, T. brevifolia, dan T. wallichiana
f. Antioksidan : Pestacin dan isopestacin merupakan metabolit sekunder yang dihasilkan oleh endofit P. microspora. Endofit ini berhasil diisolasi dari tanaman Terminalia morobensis, yang tumbuh di Papua Nugini. Baik pestacin atau isopestacin berkhasiat sebagai antioksidan, dimana aktivitas ini diduga karena struktur molekulnya mirip dengan flavonoid (Strobel dkk., 2002 dalam Radji, 2005).
2.4.4 Isolasi Bakteri Endofit
Prosedur untuk mengisolasi endofit pada umumnya relatif mudah. Salah satu hal yang penting dalam mengisolasi bakteri endofit adalah mempertahankan kesegaran sampel. Bila sampel disimpan dalam waktu yang cukup lama, akan terjadi kematian jaringan. Meskipun demikian, masih memungkinkan untuk mengisolasi sejumlah kapang endofit dari jaringan yang telah layu setelah penyimpanan beku (Freezing) dalam waktu lebih dari satu tahun.
Isolasi bakteri endofit diawali dengan sterilisasi permukaan. Sterilisasi permukaan bertujuan untuk mengeliminasi mikroba yang terkandung pada permukaan tanaman. Sterilisasi permukaan dilakukan dengan cara mencuci keseluruhan tanaman dengan air bersih yang mengalir selama 10 menit. Kemudian bagian – bagian tanaman, seperti daun, batang, buah, akar atau rimpang dipisahkan dan dipotong – potong sepanjang kurang lebih 1 cm. Proses sterilisasi selanjutnya dilakukan dengan merendam potongan tanaman sampel di dalam larutan alkohol 75%, Natrium hipoklorit 5.25% dan aquades steril.
2.4.5 Fermentasi Bakteri Endofit
Fermentasi adalah proses yang memanfaatkan kemampuan mikroba untuk menghasilkan metabolit primer dan metabolit sekunder dalam suatu lingkungan yang dikendalikan. Pengendalian dilakukan dengan pengaturan kondisi medium, komposisi medium, suplai O2, dan agitasi (Anonim, 2012).
Medium yang digunakan dalam fermentasi harus memenuhi syarat antara lain : mengandung nutrisi yang dibutuhkan bagi pertumbuhan sel mikroba, mengandung nutrisi yang dapat digunakan sebagai sumber energi bagi mikroba, tidak mengandung zat yang dapat membahayakan pertumbuhan sel, dan tidak terdapat kontaminan yang dapat meningkatkan persaingan dalam penggunaan substrat (Anonim, 2012).
2.5 Bakteri Uji
Pada penelitian digunakan 4 spesies bakteri uji yang diketahui bersifat patogen terhadap manusia. Bakteri uji yang digunakan adalah bakteri kelompok Gram positif (Staphylococcus aureus dan Bacillus subtilis) dan kelompok Gram negatif (Escherichia coli dan Salmonella sp.).
a. Morfologi dan Klasifikasi Staphylococcous aureus (S. aureus)
Klasifikasi S. aureus sebagai berikut : Divisio : Protophyta
Species : Staphylococcus aureus (Brooks dkk., 2007).
Nama Staphylococcus aureus berasal dari bahasa Yunani, yaitu
staphyle yang berarti kumpulan anggur dan cocci yang berarti bulat. Sedangkan nama aureus berasal dari bahasa Latin yang berarti emas, karena pada koloni terlihat berwarna emas (Freeman dkk., 2005).
Staphylococcus aureus merupakan bakteri Gram positif dengan sel berbentuk bulat yang menyerupai anggur. S. aureus mempunyai ukuran sel dengan diameter 1 µm, bersifat patogen, tidak bergerak (non-motil) dan tidak membentuk spora (Brooks dkk. 2007).
Staphylococcus tumbuh pada kondisi aerobik atau mikroaerofilik, dengan suhu optimum 37oC. batas suhu pertumbuhan Staphylococcus
(Freeman dkk., 2005). Pada permukaan media, bentuk koloni terlihat bulat, permukaan halus, cembung, berkilau, dan terbentuk koloni berwarna abu-abu hingga kuning keemasan.
Staphylococcus bersifat relatif resisten terhadap pengeringan, panas (bisa bertahan hingga suhu 30oC selama 30 menit), dan 9% NaCl tetapi akan terhambat dengan beberapa bahan kimia, seperti heksaklorofen 3% (Brooks dkk., 2007).
S.aureus merupakan bakteri patogen yang bersifat invasif, dapat memproduksi koagulase, mampu membentuk pigmen kuning emas dan dapat menghemolisis sel darah merah.
Penyakit yang disebabkan oleh S. aureus seperti pneumonia, meningitis, endokarditis, dan infeksi kulit. Beberapa antibiotik yang dapat digunakan untuk menghambat pertumbuhan S. aureus antara lain ampisilin, penisilin, tetrasiklin, kloksasilin, sefalosporin, vankomisin, dan metisilin (Jawetz dkk., 1996).
Gambar 3. Staphylococcus aureus perbesaran 1000x (Dokumentasi pribadi)
b. Morfologi dan Klasifikasi Bacillus subtilis (B. subtilis)
Klasifikasi Bacillus menurut Bergey’s Manual of Determinative Bacteriology, 8th edition (1985) :
Species : Bacillus subtilis
Bacillus subtilis merupakan bakteri Gram positif, berbentuk batang yang membentuk rantai, beberapa spesies aerob obligat dan bersifat anaerob fakultatif, memiliki endospora sebagai struktur bertahan saat kondisi lingkungan tidak mendukung (Backman dkk., 1994). Suhu optimum pertumbuhan Bacillus subtilis yaitu 30-37oC, dengan suhu minimum 18oC dan maksimum 43oC (Korsten dkk., 1996).
Banyak dari genus Bacillus bersifat saprofit dan berasal dari tanah (banyak karbohidrat dan polisakarida), air, dan udara dan tanaman. Beberapa bersifat patogen, dan berkembang di dalam makanan lalu menghasilkan enterotoksin atau toksin emetic dan menyebabkan makanan menjadi beracun. Bacillus subtilis dapat menyebabkan penyakit pada manusia, seperti meningitis, endokarditis, endophalmitis, konjungtivitis atau gastroenteritis akut (Jawetz dkk., 1996).
Pada Bergey’s Manual of Systemic Bacteriology, edisi ke-2 (2004) Sel Bacillus subtilis berukuran 1 x 3.4 µm, berbentuk batang dan tersusun menjadi rantai panjang. Mempunyai spora yang terletak di tengah sel, tidak bergerak (Jawetz dkk., 1996), serta mempunyai flagela.
Spesies Bacillus memperlihatkan morfologi koloni yang sangat bervariasi, dan komposisi media yang digunakan sangat mempengaruhi bentuk morfologi yang akan terlihat. Koloni Bacillus subtilis setelah inkubasi 24-48 jam, ukuran koloni berkisar antara 2-4 mm, permukaan kasar, berlendir, dan bergelombang pada bagian pinggir koloni. Bacillus dapat tumbuh pada media Nutrient Agar, Trypticase Soy Agar dan paling cocok pada media Blood Agar.
Gambar 4. Bacillus subtilis perbesaran 1000x (Dokumentasi pribadi)
c. Morfologi dan Klasifikasi Eschericia coli (E. coli)
Klasifikasi dari E. coli adalah sebagai berikut : Divisio : Bacteria
Subdivisio : Schizomycetes Kelas : Schizomycetes Ordo : Eubacteriales Famili : Enterobactericeae Genus : Escherichia
Spesies : Escherichia coli (Krieg dkk., 1984)
Escherichia coli pertama kali ditemukan di usus bayi oleh seorang dokter penyakit anak German, yaitu Theodor Escherich (1885). E. coli
merupakan bakteri anaerob fakultatif Gram negatif dengan sel berbentuk batang yang termasuk dalam famili Enterobacteriaceae. Bakteri ini merupakan penghuni normal usus, selain berkembang biak di lingkungan sekitar manusia (Arisman, 2009).
Sel Bakteri E. coli berbentuk batang yang single atau pairs, berukuran sekitar 2.5 µm, dengan diameter 0.8 µm. Bila ditumbuhkan pada media Nutrient Broth yang kaya nutrisi hanya memerlukan waktu 20 menit untuk tumbuh (Berg, 2004), dengan suhu antara 10-40oC (optimum 37oC) dan pH 7,2.
Agar, dan MacConkey agar. Isolasi utama dapat ditemukan pada Nutrient Agar dan Blood Agar (Parija, 2009).
E. coli dikenali sebagai bakteri yang sedikit membahayakan dan juga patogen. E. coli dapat menyebabkan penyakit dengan spectrum luas pada manusia, seperti Traveler’s diarrhea, disentri, hemoragik colitis,
neonatal meningitis dan sindrom hemolitik uremik (Parija, 2009).
Gambar 5.Escherichia coli perbesaran 1000x (Dokumentasi pribadi)
d. Morfologi Salmonella enterica sv Thypimurium (S. thypimurium)
Klasifikasi dari Salmonellathypimurium adalah sebagai berikut : a. Divisio : Bacteria
b. Kelas : Gammaproteobacteria c. Ordo : Enterobacterial d. Famili : Enterobactericeae e. Genus : Salmonella
f. Spesies : Salmonella enterica
g. Subspesies : S. enterica sv typimurium (S. typimurium)
Salmonella thypimurium merupakan bakteri Gram negatif dan merupakan bakteri anaerob fakultatif. Salmonella merupakan bakteri tidak berspora, dengan panjang yang bervariasi.
Salmonella tyhpimurium merupakan bakteri patogen, karena dapat menyerang pada manusia dan hewan mamalia. Salmonella tyhpimurium
antibiotik kloramfenikol, ciprofloksasin, sefalosporin dan sefotaksim (Carrica, 2011).
Gambar 6. Salmonella thypimurium perbesaran 1000x(Dokumentasi Pribadi)
2.6 Uji Aktivitas Antimikroba
Antimikroba adalah substansi yang menghambat pertumbuhan atau membunuh bakteria atau mikroorganisme lain (organisme mikroskopik termasuk bakteria, virus, jamur, protozoa, dan riketsia) (Kee dkk., 1996). Kegunaan uji antimikroba adalah diperolehnya suatu sistem pengobatan yang efektif dan efisien.
Antibiotik dinyatakan sebagai metabolit sekunder mikroorganisme yang mempunyai massa molekul rendah, sehingga pada konsentrasi rendah dapat menghambat pertumbuhan mikroorganisme lain (Sudjaji, 2008). Pengukuran aktivitas antibakteri menggunakan metode difusi dengan menggunakan kertas cakram.
2.6.1 Metode Difusi
2.7 Antibakteri Pembanding
Karakteristik kloramfenikol digunakan sebagai antibakteri pembanding adalah sebagai berikut (Farmakope Indonesia, 1995) :
1. Rumus bangun :
2. Rumus kimia : C12H12Cl2N2O5
3. Pemerian : hablur halus berbentuk jarum atau lempeng memanjang; putih hingga putih kelabu atau putih kekuningan; larutan praktis netral terhadap
lakmus P; stabil dalam larutan netral atau larutan agak asam
4. Kelarutan : sukar larut dalam air; mudah larut dalam etanol, dalam propilen glikol, dalam aseton dan dalam etil asetat
5. Penyimpanan : dalam wadah tertutup rapat
BAB III
METODOLOGI PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian dilakukan pada bulan Februari sampai bulan Juni 2015 di Laboratorium Mikrobiologi Pusat Laboratorium Terpadu (PLT), Laboratorium Farmakognosi dan Fitokimia dan Laboratorium Penelitian I, UIN Syarif Hidayatullah Jakarta.
3.2 Alat dan Bahan
3.2.1 Alat
Alat-alat yang digunakan dalam penelitian ini antara lain : cawan petri bulat (Petriq), gelas ukur (Pyrex), labu Erlenmeyer (Pyrex), beaker glass (Pyrex), tabung reaksi (Pyrex), jarum ose, pinset, batang L, pipet mikro (Socorex), tip
Bahan yang digunakan dalam penelitian adalah daun rambutan (Nephelium lappaceum). Daun rambutan diperoleh dari kebun depan Kampus Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Jakarta, Pisangan, Ciputat, Tangerang Selatan pada bulan Februari 2015.
Bakteri uji yang digunakan meliputi bakteri Staphylococcus aureus
ATCC 6538, Bacillus subtilis ATCC 6633, Escherichia coli ATCC 35218 dan
Salmonella thypimurium ATCC 14028. yang diperoleh dari Laboratorium Mikrobiologi FMIPA UI dan PT DIPA PUSPA.
Medium Nutrient Agar (Merck), medium Mueller-Hinton Agar (Merck),
anhidrat, larutan NaCl 0.9%, FeCl3, HCl, H2SO4, pereaksi
Lieberman-Bourchardat, pereaksi Dragendorff, pereaksi Mayer, logam magnesium, gentian violet, larutan lugol, safranin, kertas saring, antibiotik kloramfenikol (Oxoid), kapas, aluminium foil.
3.2.3 Determinasi Tanaman
Sampel tanaman daun rambutan (Nephelium lappaceum) diidentifikasi di Herbarium Bogoriense Bidang Botani, Puslit Biologi, LIPI Cibinong.
3.3 Metode Penelitian
3.3.1 Skrining Fitokimia Daun Nephelium lappaceum Segar
a. Pembuatan ekstrak daun segar dan uji saponin
Daun rambutan sebanyak 2 g dibersihkan dengan menggunakan air. Daun dipotong dengan ukuran sedang atau kecil, dimasukan kedalam mortar dan tambahkan pasir bersih, lalu disaring dengan menggunakan kasa. Tambahkan akuades sambil dikocok kuat-kuat selama 1 menit, saponin positif ditunjukan dengan adanya bisa yang stabil selama 30 menit (Harbone, 1996).
b. Pembuatan ekstrak daun segar dan uji alkaloid
Daun rambutan sebanyak 4 g dibersihkan dengan menggunakan air. Daun dipotong dengan ukuran kecil, dimasukkan kedalam mortar dan tambahkan kloroform amoniak 10 ml dan pasir bersih. Campuran disaring kedalam tabung reaksi dengan diperas menggunakan kain kasa. Kemudian tambahkan 0.5 mL 1 M H2SO4 dan di homogenkan. Pisahkan
antara lapisan asam (atas) dan lapisan kloroform (bawah). Uji alkaloid dengan metode Culvenor-Fitzgerald
c. Pembuatan ekstrak daun segar untuk uji terpenoid/steroid, fenolik dan flavonoid
Daun rambutan sebanyak 2 g dibersihkan dengan menggunakan air. Daun dipotong dengan ukuran sedang atau kecil, dimasukkan kedalam mortar dan tambahkan alkohol 80%, saring dengan kain kasa dan keringkan diatas penangas air. Kemudian lemaknya dihilangkan dengan pencucian heksan beberapa kali sehingga warna pigmen hilang atau larutan heksana tidak berwarna lagi.
i. Terpenoid dan steroid. Tambahkan residu dengan 10 mL kloroform amoniak dan aduk campuran selama 5 menit, lalu saring dan tambahkan natrium sulfat anhidrat, dan bagi menjadi dua tabung reaksi. Masing- masing tabung ditambahkan pereaksi Liberman-Bourchardat (3 tetes asam asetat anhidrat + 1 tetes asam sulfat pekat). Hasil positif apabila terbentuk warna merah merupakan terpenoid dan warna hijau-biru merupakan steroid. ii. Fenolik. Tambahkan residu dengan 3 mL pereaksi FeCl3 dan 1
mL larutan H2SO4 pekat. Hasil positif bila terbentuk warna dari
merah-kecoklatan menjadi biru atau lembayung.
iii. Flavonoid. Tambahkan residu dengan 20 mL alkohol dan pindahkan masing-masing 10 mL kedalam 2 tabung reaksi. Masing-masing tabung ditambahkan 0.5 mL asam klorida pekat. Dilakukan uji dengan pereaksi Willstatter. Pada pereaksi Willstatter ditambahkan 3-4 butir logam Magnesium (Mg). Bila terjadi perubahan warna, tambahkan 1 mL amil alkohol, kocok kuat-kuat dan amati perubahan warna.
d. Pembuatan ekstrak eter untuk uji terpenoid/steroid dan flavonoid
Daun rambutan sebanyak 2 g dibersihkan dengan menggunakan air. Daun dipotong dengan ukuran sedang atau kecil, dimasukan kedalam mortar dan tambahkan eter saring dengan kain kasa dan keringkan diatas penangas air.
i. Residu ditambahkan asam asetat anhidrat 3 tetes dan H2SO4 pekat
atau kuning dan positif steroid bila terbentuk warna hijau (Arifin, 2006).
ii. Residu ditambahkan dengan NaOH pekat, warna akan berubah menjadi kuning pekat. Bila ditambahkan dengan asam pekat atau asam lemah, maka warna kuning akan menghilang (Singh, 2013). e. Pembuatan ekstrak dan uji tanin
Daun rambutan sebanyak 2 g dibersihkan dengan menggunakan air. Daun dipotong dengan ukuran sedang atau kecil, dimasukan kedalam mortar dan tambahkan alkohol 80%, saring dengan kain kasa dan keringkan diatas penangas air. Residu ekstrak dilarutkan dengan 20 mL air panas, ditambahkan 5 tetes larutan NaCl dan 3 tetes pereaksi ferri klorida (FeCl3), bagi kedalam 2 tabung reaksi. Hasil positif tanin
terhidrolisa memberikan warna biru atau biru-hitam, sedangkan kondensasi tanin memberikan warna biru-hijau.
3.3.2 Sterilisasi Alat
Alat yang akan digunakan dicuci terlebih dahulu dan dikeringkan. Alat kemudian dibungkus dengan kertas pembungkus setelah itu dilakukan sterilisasi. Sterilisasi dilakukan dengan menggunakan autoklaf selama 15 menit pada 121oC.
3.3.3 Pembuatan Media
3.3.3.1 Nutrient Agar (NA)
NA ditimbang sebanyak 23 g dilarutkan dalam 1 liter aquades. Setelah semua bahan tercampur, medium dipanaskan hingga larut sempurna, lalu disterilkan dengan autoklaf pada suhu 121oC selama 15 menit.
3.3.3.2 Nutrient Broth (NB)
NB ditimbang sebanyak 9 g dilarutkan dalam 1 liter aquades. Bahan medium dicampur dengan pengadukan dan pemanasan menggunakan hot plate
3.3.3.3 Mueller-Hinton Agar (MHA)
Serbuk MHA sebanyak 38 g dilarutkan dalam 1 liter aquades, kemudian dipanaskan sampai mendidih sehingga semuanya larut, kemudian disterilkan dengan autoklaf pada suhu 121oC selama 15 menit.
3.3.4 Pembuatan Kurva Pertumbuhan Bakteri Uji
Biakan bakteri uji yang telah tumbuh pada agar miring NA ditambahkan dengan 5 mL NaCl 0.9% steril. Sebanyak 0.1 % suspensi bakteri uji dimasukkan ke dalam 200 mL NB steril. Spektrofotometer UV-vis diatur dengan panjang gelombang 600 nm, kuvet dibersihkan kemudian diukur absorban awal NB steril sebagai kontrol dan NB yang mengandung bakteri pada menit ke-0 (t0). Setelah
absorban awal ditentukan, media NB digojog pada 120 rpm menggunakan
shaker, suhu 27oC. Setiap interval 30 menit dilakukan pengukuran absorban untuk mendapatkan kurva pertumbuhan. Kurva pertumbuhan diakhiri setelah melewati fase stastioner.
3.3.5 Isolasi Bakteri Endofit
Daun rambutan dari lokasi pengumpulan segera dicuci dengan menggunakan air mengalir untuk menghilangkan kotoran yang menempel pada permukaan daun. Daun selanjutnya dikeringkan dan dimasukan ke kantong plastik dan dibawa ke Laboratorium Mikrobiologi Pusat Laboratorium Terpadu UIN Syarif Hidayatullah Jakarta. Tahap awal isolasi adalah memotong bagian daun sepanjang ± 2 cm dan selanjutnya disterilisasi bagian permukaan menggunakan larutan alkohol 70% selama 1 menit, Natrium hipoklorit 5.25% selama 5 menit, dan terakhir dengan larutan alkohol 70% selama 30 detik. Setelah itu sampel daun dibilas dengan air steril 2 kali masing-masing 1 menit dan ditanam di dalam media agar NA, diletakan pada posisi tertelungkup. Cawan petri yang sudah mengandung sampel daun diinkubasi dalam inkubator pada suhu 35oC selama 2-7 hari (Kumala dkk., 2006).
3.3.6 Pemurnian Isolat Bakteri
pada media NA. Media diinkubasi dalam inkubator pada suhu 37oC selama 24 jam.
3.3.7 Pembuatan Stock Culture dan Working Culture
Pembuatan Stock Culture dan Working Culture dilakukan dengan menginokulasi koloni tunggal hasil pemurnian ke dalam 2 tabung reaksi. Koloni yang membentuk satu koloni dan tidak menempel dengan koloni lain dipisahkan dari isolat majemuk dengan menggunakan ose dan ditanam pada media NA miring. Media diinkubasi dalam inkubator pada suhu 37oC selama 24 jam. Stock
disimpan pada suhu 4oC dalam lemari pendingin.
3.3.8 Identifikasi Bakteri Endofit
a. Makroskopis
Pengamatan makroskopis dilakukan dengan menggunakan metode streak plate. Identifikasi secara visual meliputi pengamatan bentuk koloni, bentuk tepi koloni dan warna koloni.
b. Mikroskopis
i. Pewarnaan Gram : Identifikasi secara mikroskopis dilakukan dengan mengamati morfologinya dengan pewarnaan Gram. Isolat pada agar miring diambil sebanyak satu ose diletakkan di atas kaca objek yang telah ditetesi dengan NaCl fisiologis. Sebarkan bakteri pada kaca objek dengan menggunakan ose bulat kemudian dilewatkan di atas api (difiksasi).
ii. Uji Katalase : Pengujian aktivitas enzim katalase dilakukan dengan cara menginokulasikan satu ose koloni bakteri pada kaca objek, kemudian ditetesi dengan H2O2 3%. Timbulnya gelembung gas
menunjukan reaksi positif terhadap uji katalase.
3.3.9 Identifikasi Bakteri Uji
Identifikasi bakteri uji secara mikroskopis dilakukan dengan menggunakan pewarnaan Gram.
3.3.10 Fermentasi Bakteri Endofit
Untuk fermentasi, digunakan isolat yang telah disuspensikan dengan menggunakan 5 mL NaCl 0.9% steril. Suspensi bakteri endofit sebanyak 0.1% ditumbuhkan dalam media NB sebanyak 10 mL, lalu digojog dengan kecepatan 170 rpm, pada suhu 27oC, selama 48 jam. Hasil fermentasi disentrifugasi pada kecepatan 3000 rpm, pada suhu 4oC selama 20 menit untuk memisahkan supernatan dan biomassa. Supernatan yang diperoleh digunakan sebagai uji aktivitas antimikroba dan skrining fitokimia (Kumala dkk., 2006).
3.3.11 Uji Fitokimia Isolat Hasil Fermentasi (Adiarti, 2013)
a. Uji terpenoid/steroid
Supernatan dimasukkan ke dalam tabung reaksi dan dicampurkan kloroform beramoniak kemudian ditambahkan H2SO4 2 N ke dalam
tabung dan dikocok kuat. Campuran didiamkan hingga terbentuk dua lapisan yaitu lapisan asam (atas) dan lapisan kloroform (bawah). Lapisan kloroform diletakkan di plat tetes dan dibiarkan menguap lalu ditambahkan dengan asam asetat anhidrat dan asam sulfat pekat (pereaksi Lieberman-Burchardat). Apabila terbentuk warna merah menandakan adanya senyawa terpenoid, dan hijau menandakan steroid.
b. Uji alkaloid
penambahan pereaksi Dragendorff dan warna putih setelah penambahan pereaksi Mayer.
c. Uji fenolik
Supernatan diletakkan di atas plat tetes dan ditambahkan larutan besi (III) klorida. Hasil positif dinyatakan dengan adanya perubahan warna larutan menjadi biru-hitam.
d. Uji flavonoid
Supernatan dimasukan kedalam tabung reaksi kemudian ditambahkan alkohol 70% dan dipanaskan. Campuran ditambahkan lempeng logam magnesium dan setetes asam klorida pekat. Hasil positif mengandung flavonoid bila terjadi perubahan warna larutan menjadi kuning.
e. Uji saponin
Supernatan ditambahkan aquades dan dipanaskan hingga mendidih. Kemudian larutan dikocok kuat dan apabila terbentuk busa yang stabil selama 10 menit maka sampel dinyatakan mengandung saponin.
f. Profil KLT
Fase gerak dibuat campuran alkohol – etil asetat (8:2) dimasukkan ke dalam chamber dan dibiarkan sampai jenuh. Pada plat KLT ditotolkan supernatan dan dimasukkan ke dalam chamber, dielusi sampai tanda batas atas dan dibiarkan sampai kering. Plat diamati pada sinar UV 254 nm dan 366 nm.
3.3.12 Uji Aktivitas Antibakteri
Inokulum bakteri uji (OD600nm ~ 0.1) setara 107 CFU/mL diambil
BAB IV
HASIL DAN PEMBAHASAN
4.1 Determinasi Daun Rambutan
Dalam penelitian ini dilakukan determinasi tanaman, terutama pada daun rambutan yang digunakan untuk penelitian isolasi bakteri endofit. Determinasi tanaman bertujuan untuk memastikan kebenaran tanaman yang digunakan untuk penelitian.
Dari hasil identifikasi terhadap daun rambutan (Nephelium lappaceum L.) yang dilakukan di Herbarium Bogoriense Bidang Botani, Puslit Biologi, LIPI Cibinong, menunjukkan bahwa sampel yang digunakan adalah daun rambutan (Nephelium lappaceum L.). Hasil determinasi dapat dilihat di Lampiran 1.
4.2 Skrining Fitokimia Daun Nephelium lappaceum L. Segar
Pada penelitian dilakukan skrining fitokimia pada daun segar Nephelium lappaceum. Untuk melakukan skrining metabolit sekunder pada daun segar, diperlukan pembuatan ekstrak daun segar, yang dilakukan dengan cara menghaluskan daun segar menggunakan blender hingga halus lalu ditambahkan dengan pelarut eter atau alkohol (Gambar 7).
Gambar 7. Daun segar rambutan (Dokumentasi pribadi)
Tabel 3. Hasil Uji Skrining Metabolit Sekunder Daun Segar
Uji Pereaksi Perubahan Warna Keterangan
Saponin Ekstrak + akuades kocok kuat
busa stabil +
Alkaloid Meyer, Dragendorf Tidak ada endapan - Terpenoid/
Flavonoid Residu alkohol 80% + etanol + logam Mg +
Fenolik Residu alkohol 80% + FeCl3
Ungu tua +
Tanin Residu alkohol 80% + FeCl3 + NaCl
Hijau-hitam +
Dari hasil diatas, diketahui bahwa daun Nephelium lappaceum positif mengandung metabolit sekunder yaitu saponin, terpenoid, steroid, fenolik dan tannin.
Dari hasil diketahui bahwa pada daun segar positif mengandung saponin. Pengujian saponin dilakukan dengan cara penambahan akuades pada ekstrak daun, lalu dikocok kuat-kuat selama 10 detik, hasil postif ditunjukan dengan adanya busa yang stabil selama 30 menit. Pada penelitian ini, busa yang dihasilkan stabil selama lebih dari 1 jam.
Pada skrining alkaloid ekstrak daun segar ditambahkan pelarut kloroform, kemudian ditambahkan dengan H2SO4 pekat, lalu dihomogenkan. Kloroform
ionik, saat ikatan terputus alkaloid akan bebas lalu diikat oleh H2SO4 pekat dan
asam tanin terikat oleh kloroform. Lapisan asam (atas) dibagi menjadi 2, dan masing-masing ditambahkan dengan pereaksi Mayer dan Dragendorff. Hasil menunjukan bahwa ekstrak daun segar tidak mengandung alkaloid
Pada skrining terpenoid/steroid, fenolik dan flavonoid dilakukan proses penghilangan lemak atau pigmen klorofil dari ekstrak daun segar. Ektrak daun segar ditambahkan dengan alkohol 80%, lalu dilakukan partisi pelarut-pelarut dengan menggunakan n-heksan digunakan untuk menghilangkan pigmen warna klorofil pada daun, akan terlihat 2 lapisan yaitu lapisan n-heksan dan alkohol hingga n-heksan tidak berwarna lagi (Gambar 8). Residu yang didapat akan dilanjutkan untuk diuji terpenoid/steroid, fenolik dan flavonoid. Pada uji skrining terpenoid/steroid didapatkan hasil bahwa daun Nephelium lappaceum
mengandung terpenoid yang dilihat dari adanya warna merah dengan menggunakan pereaksi Lieberman-Bouchardat.
Gambar 8. Pembuatan ekstrak etanol daun segar dengan n – heksana (Dokumentasi pribadi)
Pada uji fenolik, residu yang ditambahkan dengan FeCl3 dan H2SO4 akan
menghasilkan warna biru atau lembayung bila positif mengandung fenolik. Namun, pada literatur lain disebutkan bahwa untuk menguji fenolik dengan menambahkan FeCl3 akan menghasilkan warna ungu tua (Kar, 2003) dan
didapatkan hasil warna ungu tua-hitam yang menunjukan daun positif mengandung fenolik.
Pada uji flavonoid dilakukan uji dengan pereaksi Wilstatter, yang dilakukan dengan cara residu ditambahkan dengan alkohol, logam magnesium dan HCl pekat. Bila positif mengandung flavonoid akan menghasilkan warna merah, kuning dan jingga. Namun, pada pengujian dihasilkan warna hijau pucat (abu-abu pucat) yang berarti ekstrak daun segar negatif flavonoid. Menurut penelitian Dharmadewi (2014) dan Maradona (2013), bahwa daun rambutan mempunyai flavonoid, sedangkan pada hasil penelitian didapatkan hasil negatif pada daun rambutan. Maka dari itu, dilakukan metode lain untuk pengujian flavonoid. Pada literatur Farnsworth (1966) diketahui bahwa kandungan flavonoid pada tanaman segar akan menghilang apabila dilakukan ekstraksi menggunakan metanol atau alkohol, maka dari pelarut bisa diganti dengan menggunakan petroleum eter.
Untuk pengujian flavonoid dilakukan dengan metode uji NaOH (Audu, 2007). Daun segar yang telah dihancurkan ditambahkan dengan pelarut eter, lalu disaring dengan menggunakan kasa. Ekstrak daun segar ditambahkan dengan NaOH dan adanya perubahan warna dari hijau menjadi kuning intens. Lalu ditambahkan dengan asam encer (CH3COOH), maka didapatkan warna kuning
diekstraksi dengan menggunakan eter, karena itu digunakan eter untuk pengujian ini.
Pada penelitian ini didapatkan hasil daun rambutan segar mengandung senyawa metabolit sekunder saponin, terpenoid/steroid, flavonoid, fenolik, dan tanin.
4.3 Isolasi, Pemurnian dan Peremajaan Bakteri Endofit
Sampel yang digunakan sebagai sumber isolat bakteri endofit berasal dari daun rambutan yang diperoleh dari kebun depan Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Jakarta, Pisangan, Ciputat, Tangerang Selatan.
Daun rambutan yang digunakan merupakan daun tua dan daun muda. Pemilihan berdasarkan letak daun yang dipetik, yaitu daun yang berada diujung ranting (daun muda) dan daun yang berada di pangkal ranting (daun muda). Daun yang telah dipetik dicuci dengan menggunakan air mengalir hingga bersih untuk menghilangkan kotoran yang menempel pada permukaan daun, lalu dilakukan sterilisasi permukaan untuk menghindari kontaminan atau adanya pertumbuhan dari bakteri lain yang bukan berasal dari daun rambutan, sehingga pada saat isolasi didapatkan isolat murni bakteri endofit.
Sterilisasi permukaan daun dilakukan dengan merendam daun kedalam larutan alkohol 70% selama 1 menit, natrium hipoklorit 5.25% selama 5 menit, larutan alkohol 70% selama 30 detik, dan terakhir dibilas menggunakan aquades steril selama 1 menit sebanyak 2 kali. Alkohol dan Natrium hipoklorit yang digunakan bertujuan untuk dekontaminasi permukaan daun dan merupakan kombinasi yang sesuai karena alkohol mempunyai spektrum afinitas yang relatif sempit, sehingga perlu ditambahkan dengan Natrium hipoklorit. Setelah proses dekontaminasi, daun tersebut dilakukan pembilasan dengan menggunakan aquades steril, hal ini bertujuan untuk menghilangkan sisa alkohol dan Natrium hipoklorit yang masih menempel pada daun rambutan yang dapat mengganggu pertumbuhan bakteri endofit.
telah berisi daun rambutan kemudian diinkubasi selama 2 – 7 hari pada suhu 35oC (Gambar 9).
Gambar 9. Isolasi daun rambutan hari ke – 0 (Dokumentasi pribadi)
Sebagai kontrol, digunakan aquades bilasan terakhir dari proses isolasi. Hal ini dilakukan untuk menguji keefektifan sterilisasi permukaaan. Jika tidak terdapat kontaminasi pertumbuhan mikroba pada kontrol, maka proses sterilisasi sudah sempurna.
Setelah proses inkubasi selama 4 hari, bakteri endofit yang tumbuh pada sekitar daun dimurnikan dengan menggunakan metode streak plate pada media
Nutrient Agar untuk mendapatkan koloni yang terpisah dari koloni yang lain (Gambar 10).
Gambar 10. Pemurnian isolat bakteri endofit (Dokumentasi pribadi)
4.4 Identifikasi Bakteri Endofit
Isolat yang diperoleh, yaitu DR1, DR2, DR3 dan DR4 dilakukan identifikasi secara makroskospis yaitu karakteristik bentuk koloni dan mikroskopis dengan cara pewarnaan Gram dan uji Katalase.
Berdasarkan pengamatan yang dilakukan diketahui bahwa isolat DR1, DR3 merupakan bakteri Gram negatif, bentuk sel kokus dan positif terhadap uji katalase. Isolat DR2 merupakan bakteri Gram negatif, bentuk sel batang dan positif terhadap uji katalase, dan isolat DR4 merupakan bakteri Gram positif, bentuk sel kokus, dan positif terhadap uji katalase yang ditandai dengan adanya gelembung pada isolat saat ditetesi dengan H2O2 3% (Tabel 4).
Tabel 4. Identifikasi Bakteri Endofit
Isolat
Morfologi Koloni Gram Morfologi Sel
Bentuk Elevasi Tepi Warna Bentuk Katalase
DR1 Bulat Konveks Halus Putih Negatif Kokus +
DR2 Konsentrik Rata Bergelombang Putih Negatif Basil +
DR3 Bulat Timbul Halus Kuning Negatif Kokus +
DR4 Bulat Gunung Halus Putih Positif Kokus +
Uji katalase digunakan untuk mengetahui adanya enzim katalase pada isolat. Hasil uji menunjukan bahwa semua isolat mempunyai enzim katalase yang ditandai dengan adanya gelembung gas. Gelembung gas tersebut berasal dari penguraian hidrogen peroksida (H2O2) yang terbentuk dari proses respirasi aerob
dan bersifat toksik terhadap bakteri, menjadi air (H2O) dan O2 oleh aktivitas
enzim katalase dari isolat yang tidak bersifat toksik.
4.5 Kurva Pertumbuhan Bakteri Uji
Gambar 11. Kurva Pertumbuhan Bakteri Uji
Berdasarkan hasil kurva yang didapatkan, diketahui bahwa bakteri Gram negatif Escherichia coli mengalami fase logaritmik pada jam 4 sampai jam ke-15. Untuk melakukan uji aktivitas antibakteri, maka E. coli ditumbuhkan sampai jam ke-4. Sedangkan untuk bakteri Salmonella thypimurium mengalami fase logaritmik pada jam ke-10 sampai jam ke-15. Untuk melakukan uji aktivitas antibakteri, maka S.thypimurium ditumbuhkan sampai jam ke-10.
Untuk bakteri Gram positif, yaitu bakteri Staphylococcus aureus
mengalami fase logaritmik pada jam ke-3 sampai jam ke-9. Untuk melakukan uji aktivitas antibakteri, maka S. aureus ditumbuhkan sampai jam ke-3. Sedangkan untuk bakteri Bacillus subtilis mengalami fase logaritmik pada jam ke-13 sampai jam ke-15. Untuk melakukan uji aktivitas antibakteri, maka Bacillus subtilis
ditumbuhkan sampai jam ke-13.
Pembuatan kurva pertumbuhan dilakukan hingga nilai OD600nm (Optical