BAB 3
METODE PENELITIAN
3.1 Alat dan Bahan 3.1.1 Alat
Spektrofotometri UV-Visible SP-300
Rotari Evaporator Buchi
Laminar air flo cabinet Astec HLF 1200 L
Oven Fischer Scientific
Inkubator Fiber Scientific
Lemari Pendingin Toshiba
Glass Beaker Gelas erlenmeyer
Neraca analitis Mettler AE 200
Corong pisah
Desikator Simax Czechoslovakia
Pipet makro Eppendorf
Jarum ose
Autoklaf Yamata SN 20
Kuvet
3.1.2 Bahan
Daun Benalu Kopi (Loranthus parasiticus (L.) Merr)
Etanol p.a Merck
Metanol Etil Asetat Aquadest
Pereaksi Wagner Pereaksi Maeyer Pereaksi Bouchardat Pereaksi Dragendorf FeCl3 5%
CeSO4 1% dalam H2SO4 10%
Logam Mg HCl pekat Amoniak Kloroform HCl 2N
DPPH (2,2-diphenyl-1-picryl-hydrazil) p.a Aldrich
DMSO (dimetilsulfoksida) p.a Fisons
Nutrient Broth (NB) p.a Oxoid
Nutrient Agar (NA) p.a Oxoid
Mueller Hinton Agar (MHA) p.a Oxoid
Bakteri Staphylococcus aureus
3.2 Prosedur Penelitian 3.2.1 Penyediaan Sampel
Bahan yang digunakan dalam penelitian ini adalah Daun Benalu Kopi yang diperoleh dari Desa Parongil,Kecamatan Sumbul, Kabupaten Dairi, Sumatera Utara. Daun benalu kopi dipisahkan dari batang dan buahnya. Sampel dikeringkan dalam ruangan selama 5 hari kemudian dihaluskan dengan blender.
3.2.2 Analisa Kadar Air
Ditimbang 2 gram sampel lalu dikeringkan dalam oven pada suhu 105̊ C- 110̊ C selama 2 jam, lalu didinginkan dalam desikator selama 30 menit. Kemudian ditimbang. Diulangi pengeringan sampai diperoleh berat tetap.
3.2.3 Pembuatan Ekstrak Metanol dan Etil asetat dari Daun Benalu Kopi
3.2.4 Uji Skrining Fitokimia 1. Uji Alkaloid
Ekstrak metanol dan etil asetat daun benalu kopi masing-masing dimasukkan dalam tabung reaksi. Tabung I ditetesi pereaksu Wagner, jika terbentuk endapan jingga, maka positif mengandung alkaloid. Tabung II ditetesi pereaksi Maeyer, jika terbentuk endapan putih,maka positif mengandung alkaloida. Tabung III ditetesi pereaksi Boucahardat,jika terbentuk endapan cokelat, maka positif mengandung alkaloida,dan tabung IV ditetesi dengan pereaksi Dragendorf, jika terbentuk endapan jingga, maka positif mengandung alkaloida.
2. Uji Flavonoida
Ekstrak metanol dan etil asetat daun benalu kopi masing-masing dimasukkan kedalam 2 tabung reaksi. Tabung I ditetesi NaOH 10%, jika terbentuk larutan warna biru violet maka positif mengandung flavonoida. Tabung II ditambah serbuk Mg dan HCl pekat,jika terbentuk larutan warna jingga maka positif mengandung flavonoida.
3. Uji Tanin
Ekstrak metanol dan etil asetat daun benalu kopi masing-masing dimasukkan kedalam tabung reaksi,kemudian ditambah dengan FeCl3 5%. Jika terbentuk
larutan warna biru kehitaman maka positif mengandung tanin.
4. Uji Terpenoida
Ekstrak metanol dan etil asetat daun benalu kopi masing-masing dimasukkan dalam tabung reaksi kemudian ditambah dengan CeSO4 1% dalam H2SO4 10%.
5. Uji Saponin
Ekstrak metanol dan etil asetat daun benalu kopi masing-masing ditambah 10 ml aquades,kemudian dikocok kuat-kuat. Jika muncul busa yang stabil maka positif mengandung saponin.
3.2.5 Uji Sifat Antioksidan Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
3.2.5.1 Pembuatan Larutan DPPH 0,3 mM
Larutan DPPH 0,3 mM dibuat dengan melarutkan 11.83 mg serbuk DPPH dengan etanol p.a dalam labu takar 100 ml, kemudian dihomogenkan.
3.2.5.2 Pembuatan Variasi Konsentrasi Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
Ekstrak metanol dan etil asetat daun benalu pohon kopi dibuat larutan induk 1000 ppm, dengan melarutkan 0,025 g ekstrak metanol dan etil asetat dengan pelarut etanol p.a dalam labu takar 25 ml. Kemudian dari larutan induk 1000 ppm dibuat larutan 100 ppm. Kemudian dari larutan 100 ppm dibuat larutan 50 ppm. Kemudian dari larutan 50 ppm dibuat lagi variasi konsentrasi 5 ppm, 10 ppm, 15 ppm, 20 ppm, 25 ppm untuk diuji aktivitas antioksidannya.
3.2.5.3 Uji Aktivitas Antioksidan
a. Uji Aktivitas Antioksidan Larutan Blanko
b. Uji Aktivitas Antioksidan Sampel
Sebanyak 2,5 ml ekstrak metanol dan etil asetat daun benalu kopi 5 ppm ditambahkan dengan 1 ml larutan DPPH 0,3 mM dalam tabung reaksi,dihomogenkan dan dibiarkan dalam ruang gelap selama 30 menit. Lalu diukur absorbansinya dengan panjang gelombang maksimum 515 nm. Dilakukan perlakuan yang sama untuk konsentrasi 10, 15, 20, 25 ppm.
3.2.6 Uji Sifat Antibakteri Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
3.2.6.1 Pembuatan Media Nutrient Agar (NA)
Sebanyak 7 g nutrient agar dimasukkan dalam erlenmeyer lalu dilarutkan dalam 250 ml aquadest dan dipanaska hingga semua larut dan mendidih. Lalu disterilkan di autoklaf pada suhu 121̊ C selama 15 menit.
3.2.6.2 Pembuatan Media Agar Miring dan Stok Kultur Bakteri
Kedalam tabung reaksi yang steril dimasukkan 3 ml media nutrient agar steril, didiamkan pada temperatur kamar sampai memadat pada posisi miring membentuk sudut 30-45̊ C. Biakan bakteri Staphylococcus aureus dari strain utama diambil dengan jarum ose steril lalu diinokulasikan pada permukaan media nutrient agar miring dengan cara menggores, kemudian diinkubasi pada suhu 35 ̊C
selama 18-24 jam. Hal yang sama juga dilakukan pada biakan bakteri Escherichia coli.
3.2.6.3 Pembuatan Media Mueller Hinton Agar (MHA)
3.2.6.4 Penyiapan Inokulum Bakteri
Sebanyak 3,25 g nutrient broth dilarutkan dengan 250 ml aquadest dalam erlenmeyer dan dipanaskan hingga semua larut dan mendidih, kemudian disterilkan di autoklaf pada suhu 121̊ C selama 15 menit dan didinginkan. Lalu
koloni bakteri Staphylococcus aureus diambil dari stok kultur menggunakan jarum ose steril kemudian disuspensikan ke dalam 10 ml media nutrient broth steril dalam tabung reaksi dan diinkubasikan pada suhu 35̊ C selama 3 jam,lalu
diukur panjang gelombang dengan menggunakan spektrofotometer UV-Vis pada panjang gelombang 540-600 nm. Hal yang sama dilakukan untuk koloni bakteri
Escherichia coli.
3.2.6.5 Pembuatan Variasi Konsentrasi Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
Ekstrak Metanol dan Etil Asetat dibuat dalam berbagai konsentrasi dengan menimbang ekstrak masing-masing sebanyak 100 mg,200 mg,300 mg,400 mg,500 mg, kemudian dilarutkan masing-masing dengan 1 ml DMSO. Konsentrasi ekstrak adalah 100 mg/ml,200 mg/ml,300 mg/ml,400 mg/ml dan 500 mg/ml.
3.2.6.6 Uji Aktivitas Antibakteri Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
Sebanyak 0,1 ml inokulum Staphylococcus aureus dimasukkan ke dalam cawan petri steril, setelah itu dituang media Mueller Hinton Agar sebanyak 15 ml dengan suhu 45-50̊ C dihomogenkan sampai media dan bakteri tercampur rata,kemudian dibiarkan sampai media memadat. Dimasukkan kertas cakram yang telah
3.3 Bagan Penelitian
3.3.1 Pembuatan Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
Daun Benalu Kopi
3.3.2 Analisa Kadar Air
2 g serbuk daun benalu kopi
dikeringkan dalam oven pada suhu 105C-110C selama 2 jam
didinginkan dalam desikator selama 30 menit
ditimbang
diulangi pengeringan sampai diperoleh berat tetap
Hasil
3.3.4 Uji Sifat Antioksidan Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
3.3.4.1 Pembuatan Variasi Konsentrasi Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
0,025 g Ekstrak Metanol Daun Benalu Kopi
dimasukkan kedalam labu takar 25 mL
dihomogenkan
25 mL larutan induk 1000 ppm
ditambahkan etanol p.a hingga garis tanda
dipipet 2,5 mL larutan induk 1000 ppm dimasukkan ke dalam labu takar 25 mL ditambahkan etanol p.a hingga garis tanda dihomogenkan
25 mL larutan induk 100 ppm
dipipet 12,5 mL larutan induk 100 ppm dimasukkan ke dalam labu takar 25 mL ditambahkan etanol p.a hingga garis batas dihomogenkan
25 mL larutan induk 50 ppm
dibuat variasi 5,10,15,20,dan 25 ppm
3.3.4.2 Pembuatan Larutan DPPH 0,3 mM
11,85 mg DPPH
Dimasukkan ke dalam labu takar 100 mL
Ditambahkan etanol p.a hingga garis batas
Dihomogenkan
Larutan DPPH 0,3mM
3.3.4.3 Uji Aktivitas Antioksidan a. Uji Blanko
1 mL larutan DPPH 0,3 mM
Dimasukkan ke dalam tabung reaksi
Ditambahkan 2,5 mL etanol p.a
Dihomogenkan
Hasil
b. Uji Aktivitas Antioksidan Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
1 ml larutan DPPH 0,3 mM
Dimasukkan kedalam tabung reaksi
Ditambahkan 2,5 ml ekstrak metanol daun benalu kopi sesuai dengan variasi konsentrasi
Dihomogenkan
Dibiarkan selama 30 menit pada ruang gelap
Diukur absorbansi pada panjang gelombang maksimum 515 nm
Hasil
Dilakukan perlakuan yang sama untuk ekstrak Etil Asetat Daun Benalu Kopi.
3.3.5 Uji Sifat Antibakteri Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
3.3.5.1 Pembuatan Media Mueller Hinton Agar (MHA)
7 gram media MHA (Mueller Hinton Agar)
Dilarutkan dengan 250 ml aquadest dalam gelas erlenmeyer
Dipanaskan sambil diaduk hingga larut dan mendidih
Disterilkan dalam autoklaf pada suhu 121oC selama 15 menit
3.3.5.2 Pembuatan Media Nutrient (NA), Media Agar Miring dan Stok Kultur Bakteri
7 gram media NA (Nutrient Agar)
Dilarutkan dengan 250 ml aquadest kedalam gelas erlenmeyer
Dipanaskan sambil diaduk hingga larut dan mendidih
Disterilkan dalam autoklaf
pada suhu 121oC selama 15 menit
Media NA (Nutrient Agar) steril
Dituangkan kedalam tabung reaksi sebanyak 3 ml
Dibiarkan pada temperatur kamar sampai memadat pada
posisi miring membentuk sudut 30-45oC
Diambil biakan bakteri Staphylococcus aureus dari strain utama dengan jarum ose laludigoreskan pada media NA
yang telah memadat
Diinkubasi pada suhu 35oC selama 18-24 jam
Stok Kultur Bakteri
3.3.5.3 Penyiapan Inokulum Bakteri
6,5 gram Media NB (Nutrient Broth)
Dilarutkan dengan 500 ml aquadest kedalam gelas erlenmeyer
Dipanaskan sambil diaduk hingga larut dan mendidih
Disterilkan dalam autoklaf pada suhu 121oC selama 15 menit
Media NB (Nutrient Broth) steril
Dituangkan kedalam tabung reaksi sebanyak 5 ml
Diambil koloni bakteri dari
stok kultur bakteri Staphylococcus aureus
dengan jarum ose
Disuspensikan kedalam Nutrient Broth (NB)
Diinkubasi pada suhu 350oC selama 2-3 jam
Diukur kekeruhan larutan pada
panjang gelombang 580-600 nm sampai diperoleh transmitan 25
(disamakan kekeruhanna dengan standart Mcfarland)
Hasil
3.3.5.4 Pengujian Aktivitas Antibakteri Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
0,1 ml Inokulum Bakteri
Dimasukkan kedalam cawan petri steril
Ditambah dengan 15 ml media Mueller Hinton Agar (MHA) dengan suhu 45-50oC
Dihomogenkan sampai media dan bakteri tercampur rata
Dibiarkan sampai media memadat
Dimasukkan kertas cakram yang telah direndam dengan ekstrak metanol daun benalu kopi dengan berbagai konsentrasi dengan cawan petri yang telah berisi bakteri
Diinkubasi selama 18-24jam pada suhu 35oC
Diukur diameter zona bening di sekitar cakram dengan jangka sorong
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian
4.1.1 Penentuan Kadar Air Serbuk Daun Benalu Kopi
Sampel daun benalu kopi dilakukan analisa kadar air untuk mengetahui kandungan air yang masih terkandung dalam sampel yang telah dikeringkan. Kadar air daun benalu kopi diperoleh dari hasil perhitungan sebagai berikut :
Berat sampel = 2 g
Berat setelah pemanasan = 1,78 g
Kehilangan bobot = 2 g – 1,78 g = 0,22 g
Kadar air serbuk daun benalu kopi = Ke
e e x 100%
= 0, x 100% = 11 %
4.1.2 Ekstraksi Daun Benalu Kopi
Ekstraksi daun benalu kopi dilakukan secara maserasi menggunakan pelarut metanol dan etil asetat sehingga diperoleh dengan perhitungan sebagai berikut : -Kadar Ekstrak Metanol Daun Benalu Kopi
Berat serbuk = 600 gram
Berat ekstrak = 76,23 gram
Kadar ekstrak metanol daun benalu kopi = Berat sampel kering x Berat ekstrak %
= , gram gram x % = , %
-Kadar Ekstrak Etil Asetat Daun Benalu Kopi
Berat ekstrak metanol kering = 70 gram
Berat ekstrak etil asetat = 14,5 gram
Kadar ekstrak etil asetat daun benalu kopi = Berat sampel kering x Berat ekstrak %
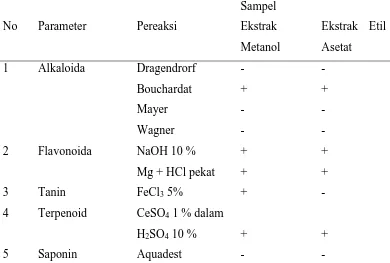
4.1.3 Skrining Fitokimia Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
Ekstrak metanol daun benalu kopi yang diperoleh diuji skrining fitokimia untuk mengetahui adanya golongan senyawa alkaloida, flavonoida, terpenoida dan tanin sedangkan ekstrak etil asetat daun benalu kopi mengandung golongan senyawa alkaloida, flavonoida dan terpenoida, yang ditunjukkan pada tabel 4.1.
Tabel 4.1. Skrining Fitokimia Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
No Parameter Pereaksi
Sampel Ekstrak Metanol
Ekstrak Etil Asetat
1 Alkaloida Dragendrorf - -
Bouchardat + +
Mayer - -
Wagner - -
2 Flavonoida NaOH 10 % + +
Mg + HCl pekat + +
3 Tanin FeCl3 5% + -
4 Terpenoid CeSO4 1 % dalam
H2SO4 10 % + +
5 Saponin Aquadest - -
Keterangan : - = Tidak terdeteksi adanya senyawa metabolit sekunder + = Terdeteksi adanya senyawa metabolit sekunder
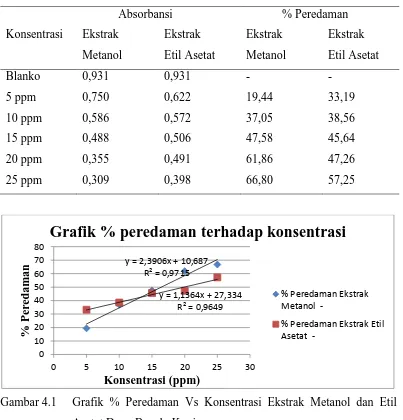
4.1.4 Hasil Uji Aktivitas Antioksidan Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
Ekstrak metanol daun benalu kopi dilakukan uji aktivitas antioksidan dengan metode DPPH radikal bebas untuk memperoleh nilai IC50 menggunakan
Tabel 4.2 Hasil Pengukuran Absorbansi Ekstrak Metanol dan Ekstrak Etil Asetat
Persamaan garis regresi dan nilai IC50 yang diperoleh dari ekstrak metanol dan etil
asetat daun benalu kopi dapat ditunjukkan pada Tabel 4.3 dibawah ini.
Tabel 4.3 Persamaan Garis Regresi dan Nilai IC50 yang diperoleh dari ekstrak
metanol dan etil asetat daun benalu kopi.
No Sampel Persamaan Garis Regresi IC50
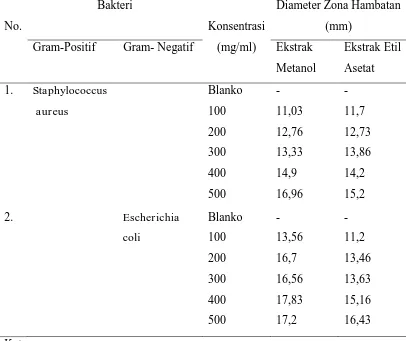
4.1.5 Hasil Uji Aktivitas Antibakteri Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
a. Hasil Uji Aktivitas Antibakteri Ekstrak Metanol Daun Benalu Kopi
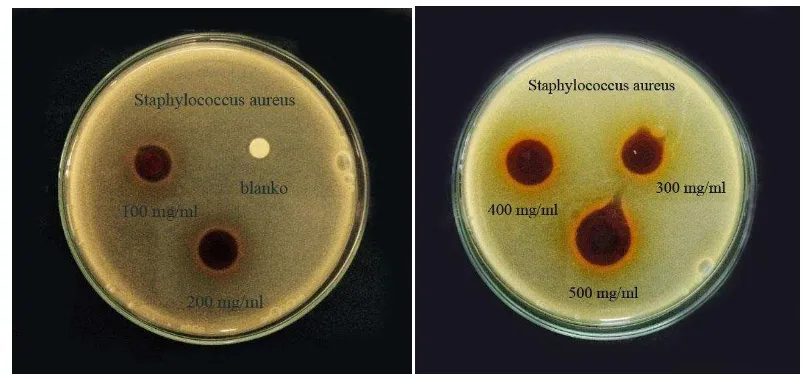
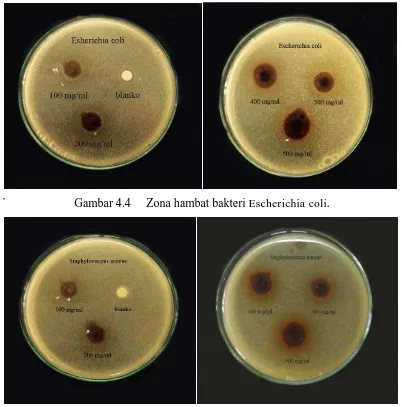
Sifat antibakteri ekstrak metanol daun benalu kopi menunjukkan zona hambat pada pertumbuhan beberapa bakteri yaitu Escherichia coli dan Staphylococcus aureus seperti yang ditunjukkan pada tabel 4.4 dan gambar 4.2 dan 4.3 dibawah ini :
Tabel 4.4 Hasil Uji Aktivitas Antibakteri Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi.
Keterangan :
Blanko = kertas cakram direndam dengan pelarut DMSO. No.
Gram-Positif Gram- Negatif Ekstrak
Gambar 4.2 Zona hambat bakteri Escherichia coli.
b. Hasil Uji Aktivitas Antibakteri Ekstrak Etil Asetat Daun Benalu Kopi.
Sifat antibakteri ekstrak etil asetat daun benalu kopi menunjukkan zona hambat pada pertumbuhan beberapa bakteri yaitu Escherichia coli dan Staphylococcus aureus seperti yang ditunjukkan pada tabel 4.4 diatas dan gambar 4.4 dan 4.5 dibawah ini.
` Gambar 4.4 Zona hambat bakteri Escherichia coli.
Gambar 4.5 Zona hambat bakteri Staphylococcus aureus.
4.2 Pembahasan
4.2.1 Penentuan Kadar Air Daun Benalu Kopi
Dari hasil penelitian diperoleh kadar air untuk simplisia daun benalu kopi adalah sebesar 11%. Simplisia dinilai cukup aman bila mempunyai kadar air ±10 %. Tujuan dari penentuan kadar air adalah untuk mengetahui batasan maksimal atau rentang besarnya kandungan air didalam bahan. Hal ini terkait dengan kemurnian dan adanya kontaminan dalam simplisia tersebut. Dengan demikian, penghilangan kadar air hingga jumlah tertentu berguna untuk memperpanjang daya tahan bahan selama penyimpanan (Harborne, 1987). Dan juga proses pengeringan didalam prosedur percobaan bertujuan untuk mencegah kerusakan yang ada dalam tanaman sehingga dapat disimpan dalam waktu yang lama dan juga bertujuan untuk mencegah penjamuran pada sampel ,dimana kapang dapat berkembang dengan baik dalam simplisia dengan kadar air sekitar 18% (Miryanti et al, 2011).
4.2.2 Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
Dari hasil penelitian yang diperoleh kadar ekstrak metanol daun benalu kopi lebih tinggi dibandingkan dengan ekstrak etil asetat yaitu masing-masing sebesar 11% dan 20,71%. Kadar ekstrak etil asetat daun benalu kopi lebih besar dibandingkan ekstrak metanol kemungkinan karena didalam daun benalu kopi memiliki kadar tanin yang lebih besar dibandingkan dengan senyawa metabolit sekunder lainnya.
4.2.3 Skrining Fitokimia Kandungan Senyawa Metabolit Sekunder Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
Ekstrak metanol daun benalu kopi positif pada golongan alkaloida, apabila direaksikan dengan pereaksi Bouchardat yang menghasilkan endapan cokelat. Pada pembuatan pereaksi Bouchardat, iodin bereaksi dengan ion I- dari kalium iodida menghasilkan ion I3- yang berwarna cokelat. Pada uji Bouchardat, ion
logam K+ akan membentuk ikatan kovalen koordinat dengan nitrogen pada alkaloid membentuk kompleks kalium-alkaloid yang mengendap (Pardede et al,
2013) Gambar 4.6 dibawah ini menunjukkan reaksi alkaloid dengan pereaksi Bouchardat.
I2 + I- I3-
Coklat
Kalium-Alkaloid
Endapan cokelat
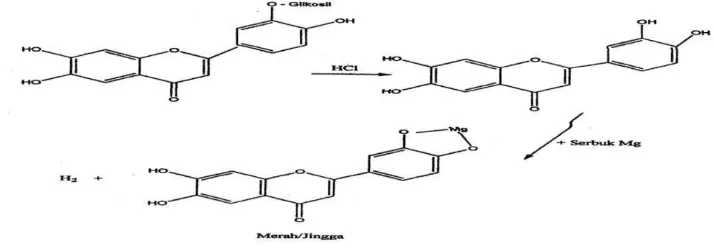
Gambar 4.6 Reaksi Alkaloid dengan pereaksi Bouchardat (Pardede et al, 2013). Pada uji flavonoida, penambahan NaOH pada ekstrak metanol dan etil asetat daun benalu kopi menghasilkan perubahan warna menjadi biru violet yang menunjukkan kandungan golongan flavonoid. Sedangkan penambahan HCl pekat digunakan untuk menghidrolisis flavonoid menjadi aglikonnya yaitu dengan menghidrolisis O-glikosil. Glikosil akan terganti oleh H+ dari asam karena sifatnya yang elektrofilik. Glikosida berupa gula dapat dijumpai yaitu glukosa, galaktosa, dan ramnosa. Serbuk Mg menghasilkan senyawa kompleks yang berwarna merah / jingga ( Sangi et al, 2008). Gambar 4.7 menunjukkan reaksi flavonoid dengan HCl pekat dan serbuk Mg.
Gambar 4.7 Reaksi uji flavonoid dengan HCl pekat dan serbuk Mg
Pengujian tanin dilakukan dengan penambahan larutan FeCl3 5% pada
ekstrak metanol daun benalu kopi sehingga menghasilkan hasil yang positif dan terbentuk warna biru kehitaman. Pada penambahan larutan FeCl3 5% diperkirakan
larutan ini bereaksi dengan salah satu gugus hidroksil yang ada pada senyawa tanin. Pereaksi FeCl3 dipergunakan secara luas untuk mengidentifikasi senyawa
fenol termasuk tanin (Robinson, 1995). Gambar 4.8 menunjukkan reaksi tanin dengan FeCl3.
Gambar 4.8 Reaksi uji tanin dengan FeCl3 (Robinson, 1995).
Dan juga terpenoid, analisis senyawa didasarkan pada kemampuan senyawa tersebut membentuk warna dengan penambahan CeSO4 1% dalam H2SO4 10%.
4.2.2 Uji Aktivitas Antioksidan Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi.
Uji aktivitas antioksidan ekstrak metanol dan etil asetat daun benalu kopi dengan metode DPPH dengan menggunakan alat spektrofotometri UV Visible. Adapun mekanisme utama peredaman utama peredaman radikal DPPH adalah sebagai berikut:
Pada uji DPPH, perendaman radikal DPPH diikuti dengan pematauan penurunan absorbansi pada panjang gelombang maksimum yang terjadi karena pengurangan radikal oleh antioksidan AH atau reaksi dengan spesi radikal (R) yang ditandai dengan berubahnya warna ungu pada larutan menjadi warna kuning pucat, data yang sering dilaporkan sebagai IC50 merupakan konsentrasi
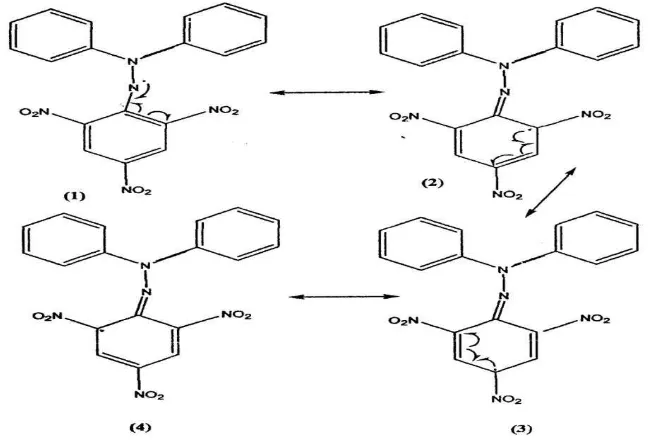
antioksidan yang dibutuhkan untuk 50 % peredaman radikal DPPH pada periode waktu tertentu (15 – 30 menit) (Pokornya et al, 2001). DPPH merupakan suatu molekul radikal bebas yang distabilkan oleh bentuk resonansi seperti ditunjukkan pada gambar 4.9 dibawah ini.
Dari persamaan Y = ax + b dapat diketahui oleh nilai IC50 dengan
memasukkan nilai 50 sebagai sumbu Y, sehingga diperoleh berapa besar nilai x yang akan mempresentasikan besaran IC50. Dari perhitungan diperoleh nilai IC50
untuk ekstrak metanol dan etil asetat masing-masing sebesar 16,66 mg/L dan 19,29 mg/L.
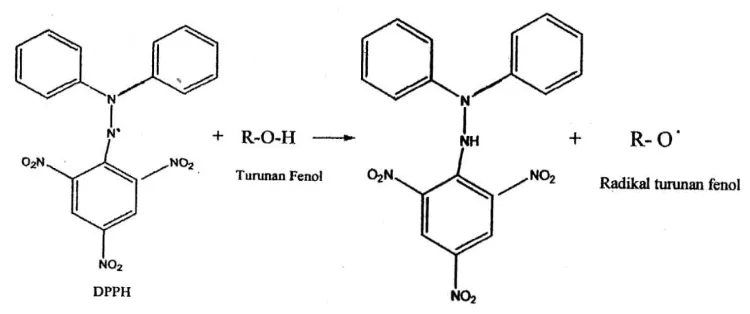
Hasil skrining fitokimia menunjukkan ekstrak metanol dan etil asetat daun benalu kopi mengandung golongan senyawa kimia berupa flavonoida dan tanin. Flavonoida dan tanin merupakan senyawa fenol yang bersifat sebagai antioksidan (Harbone, 1996). Senyawa – senyawa polifenol mengandung gugus hidroksil yang dapat bertindak sebagai donor hidrogen terhadap radikal bebas, yang reaksinya dapat dilihat pada gambar 4.10 (Silalahi, 2006).
Gambar 4.10 Reaksi DPPH dengan turunan fenol (Silalahi, 2006).
Dari literatur dapat diketahui bahwa jika nilai IC50 yang dihasilkan kurang
dari 50, maka senyawa tersebut dapat dikatakan memiliki aktivitas antioksidan yang sangat kuat. Oleh karena itu berdasarkan perhitungan yang diperoleh dapat dikatan bahwa senyawa antioksidan yang terdapat dalam ekstrak metanol dan etil asetat daun benalu kopi sama-sama memiliki aktivitas antioksidan yang sangat kuat. Tingkat kekuatan senyawa antioksidan menggunakan metode DPPH dapat dilihat pada tabel 4.5 dibawah ini.
Tabel 4.5 Tingkat kekuatan senyawa antioksidan dengan menggunakan DPPH.
`Intensitas IC50`
Sangat kuat <50 mg/L
Kuat 50-100 mg/L
Sedang 101-150 mg/L
Lemah >150 mg/L
(Ionita, 2005).
4.2.3 Uji Aktivitas Antibakteri Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
Pengujian aktivitas antibakteri bertujuan untuk mengetahui aktivitas bakteri terhadap sampel uji. Metode pengujian aktivitas antibakteri yang digunakan pada penelitian ini adalah metode difusi agar. Pada metode ini aktivitas bakteri terhadap sampel uji ditunjukkan dengan terbentuknya zona hambat disekitar kertas cakram yang menandakan daerah pertumbuhan bakteri.
Pada penelitian ini menggunakan bakteri patogen yang berasal dari gram positif dan gram negatif. Bakteri patogen yang digunakan adalah Staphylococcus aureus
dan Escherichia coli.
Berdasarkan Clinical and Laboratory Standars Institute (2012) bahwa
suatu senyawa memiliki aktivitas antibakteri dengan zona hambat ≤ 14 mm lemah
Hasil uji aktivitas antibakteri dari ekstrak metanol dan etil asetat efektif menghambat perrtumbuhan bakteri Staphylococcus aureus dan Escherichia coli.
Pada tabel 4.4 memperlihatkan bahwa ekstrak metanol dan etil asetatmemiliki aktivitas antibakteri dengan kategori sedang pada konsentrasi 500 mg/ml dengan zona hambat masing-masing sebesar 16,96 mm dan 15,2 mm terhadap bakteri
Staphylococcus aureus dan pada konsentrasi 500 mg/ml dengan zona hambat masing-masing sebesar 17,2 mm dan 16,43 mm terhadap bakteri Escherichia coli. Adanya perbedaan diameter zona hambat pada kedua bakteri menunjukkan bahwa terdapat perbedaan sentivitas ekstrak pada mikroba uji tersebut. Senyawa yang bersifat sebagai antimikroba dapat menyebabkan kerusakan pada dinding sel serta kerusakan pada membran sel berupa denaturasi protein dan lemak yang menyusun membran sel.
Ekstrak metanol dan etil asetat daun benalu kopi lebih efektif menghambat pertumbuhan bakteri gram positif Staphylococcus aureus dibandingkan dengan bakteri gram negatif Escherichia coli. Hal ini disebabkan oleh perbedaan komposisi dan struktur dinding sel pada bakteri gram positif dan gram negatif. Struktur dinding sel bakteri gram positif berlapis tunggal dengan kandungan lipid yang rendah (1-4%), sedangkan bakteri gram negatif memiliki kandungan lipid tinggi yaitu 11-12% (Fardiaz, 1992) dan membran luar terdiri dari 3 lapisan yaitu lipopolisakarida, lipoprotein dan pospolipid (Tortora, 2011).
Senyawa fenol bekerja dengan cara mendenaturasi protein sel sehingga protein sel bakteri menjadi kehilangan aktivitas biologinya. Akibatnya fungsi permeabilitas sel bakteri terganggu dan sel bakteri akan mengalami lisis yang berakibat pada kematian sel bakteri (Harborne, 1987). Selain itu senyawa fenol juga dapat merusak lipid pada membran sel melaui mekanisme penurunan tegangan permukaan membran sel (Pelczar dan Chan, 1988).
Senyawa alkaloid yang terkandung dalam ekstrak daun benalu kopi yang memiliki kemampuan sebagai antibakteri. Mekanisme diduga dengan cara mengganggu komponen penyusun peptidoglikan pada sel bakteri sehingga lapisan dinding sel tidak terbentuk secara utuh, terganggunya sintesis peptidoglikan sehingga permukaan sel tidak sempurna karena tidak mengandung peptidoglikan dan dinding selnya hanya meliputi membran sel. Rangka dasar dinding sel bakteri adalah lapisan peptidoglikan. Peptidoglikan tersusun dari N-asetil glukosamin dan N-asetil asam muramat, yang terikat melalui ikatan 1,4- glikosida. Pada N-asetil asam muramat terdapat rantai pendek asam amino : alanin, glutamat, diaminopimelat, lisin dan alanin, yang terikat melalui ikatan peptida. Peranan ikatan peptida sangat penting dalam menghubungkan antara rantai satu dengan rantai yang lain. Mekanisme kerusakan dinding sel bakteri terjadi karena proses perakitan dinding sel bakteri yang diawali dengan pembentukan rantai peptida yang akan membentuk jembatan silang peptida yang menggabungkan rantai glikan dari peptidoglikan pada rantai yang lain sehingga menyebabkan dinding sel terakit sempurna. Keadaan ini menyebabkan sel bakteri mudah mengalami lisis, baik berupa fisik maupun osmotik dan menyebabkan kematian sel. S.aureus
Senyawa flavonoid merupakan salah satu senyawa kimia yang terkandung dalam ekstrak daun benalu kopi yang bersifat bakteriostatik. Mekanisme kerjanya dengan cara mendenaturasi protein sel bakteri dan merusak membran sitoplasma. Volk dan Wheeler (1998) dalam Prajitno (2007) menjelaskan bahwa senyawa flavonoid dapat merusak membran sitoplasma yang dapat menyebabkan bocornya metabolit penting dan menginaktifkan sistem enzim bakteri. Kerusakan ini memungkinkan nukleotida dan asam amino merembes keluar dan mencegah masuknya bahan-bahan aktif kedalam sel, keadaan ini dapat menyebabkan kematian bakteri. Pada perusakan membran sitoplasma, ion H+ dari senyawa fenol dan turunannya (flavonoid) akan menyerang gugus polar (gugus posfat) sehingga molekul fosfolipida akan terurai menjadi gliserol, asam karboksilat dan asam posfat. Hal ini mengakibatkan fosfolipida tidak mampu mempertahankan bentuk membran sitoplasma akibatnya membran sitoplasma akan bocor dan bakteri akan mengalami hambatan pertumbuhan dan bahkan kematian.
Senyawa tanin juga dapat menghambat dan membunuh pertumbuhan bakteri dengan cara bereaksi dengan membran sel. Senyawa tanin termasuk senyawa polifenol, senyawa ini dapat menghambat bakteri dengan cara merusak membran plasma bakteri yang tersusun dari 60 % protein dan 40 % lipid yang umumnya berpa fosfolipid, didalam membran sel tanin akan bereaksi dengan protein membentuk ikatan hidrogen sehingga protein akan terdenaturasi, selain itu tanin juga dapat bereaksi dengan fosfolipid yang terdapat dalam membran sel, akibatnya senyawa tanin akan merusak membran sel, yang menyebabkan bocornya metabolit penting yang menginaktifkan sistem enzim bakteri. Kerusakan pada membran sel dapat mencegah masuknya bahan-bahan makanan atau nutrisi yang diperlukanbakteri untuk menghasilkan energi akibatnya bakteri akan mengalami hambatan pertumbuhan atau bahkan kematian (Volk and Wheller, 1998).
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Berdasarkan uji skrining fitokimia ekstrak metanol daun benalu kopi mengandung senyawa alkaloid, flavonoida, terpenoida dan tanin, sedangkan ekstrak etil asetat daun benalu kopi mengandung senyawa alkaloid, flavonoida dan terpenoida.
2. Hasil uji aktivitas antioksidan ekstrak metanol dan etil asetat termasuk golongan antioksidan yang sangat kuat dimana kedua ekstrak tersebut memiliki nilai IC50 masing-masing sebesar 16,66 mg/L dan 19,29 mg/L.
3. Hasil uji aktivitas antibakteri menunjukkan bahwa ekstrak metanol dan etil asetat memiliki aktivitas antibakteri dengan kategori sedang pada konsentrasi 500 mg/ml dengan zona hambat 16,96 mm dan 15,2 mm terhadap bakteri
Staphylococcus aureus dan pada konsentrasi 500 mg/ml dengan zona hambat 17,2 mm dan 16,43 mm terhadap bakteri Escherichia coli.
5.2 Saran