Lampiran 2. Daun Benalu Kopi (Loranthus parasiticus (L.) Merr.)
Lampiran 4. Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi (Loranthus
parasiticus (L.) Merr.)
A. Ekstrak Metanol Daun Benalu Kopi (Loranthus parasiticus (L.) Merr.)
Lampiran 5. Hasil Uji Aktivitas Antioksidan Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
A. Perhitungan % Peredaman Ekstrak Metanol Daun Benalu Kopi
% Peredaman =A A −A e x %
1. Konsentrasi 5 ppm
% Peredaman = , ,− , x % = , %
NB : dilakukan perhitungan yang sama untuk konsentrasi 10, 15, 20, 25 ppm.
Peredaman radikal ekstrak metanol daun benalu kopi :
Sampel Absorbansi % Peredaman
Blanko 0,931 -
Perhitungan Nilai IC50 Ekstrak Metanol Daun Benalu Kopi :
X Y Xy x2
Jadi persamaan garis regresi Y = 2,695X + 5,089 Nilai IC50 :
50 = 2,695X + 5,089 X = 16,66
B. Perhitungan % Peredaman Ekstrak Etil Asetat Daun Benalu Kopi
% Peredaman = A A −A e x %
1.Konsentrasi 5 ppm
% Peredaman = , ,− , x % = , %
NB : dilakukan perhitungan yang sama untuk konsentrasi 10, 15, 20, 25 ppm.
Peredaman radikal ekstrak etil asetat daun benalu kopi
Sampel Absorbansi % Peredaman
Blanko 0,931 0
Perhitungan Nilai IC50 Ekstrak Etil Asetat Daun Benalu Kopi
X Y xy x2
Jadi persamaan garis regresi Y = 1,917X + 13,016 Nilai IC50 :
50 = 1,917X + 13,016 X = 19,29
DAFTAR PUSTAKA
Adler, L.S. 2002. Host Effect On Herbivory And Pollination In A Hemiparasitic Plant. Jurnal Biologi. Vol 83.
Hal 2701.
Agoes, G. 2007. Teknologi Bahan Alam. Bandung : Penerbit ITB Press.
Ajizah, A. 2004 . Sensitivitas Salmonella Tyhimurium Terhadap Ekstrak Daun Psidium Guajava L. Jurnal Bioscientiae. Volume 1. Nomor 1. Halaman 36.
Anita, A, Khotimah S, dan Yanti AH. 2014. Aktivitas Antibakteri Ekstrak Daun Benalu Jambu Air (Dendropthoe Pentandra (L.) Miq) Terhadap Pertumbuhan Salmonella Typhi Jurnal Biologi. Vol.3. Halaman 268.
Phenolic Compounds with The CUPPRAC Assay. Molecules 12:1496-1547.
Artanti, N, Djamilah, Lotulung P, Liswidowati, Minarti, Hanafi, M, Kardono, LBS dan Darmawan A. 2003. Evaluasi Potensi Ekstrak Taxus Sumatrana dan Benalu sebagai Antibakteri. Serpong : Puslit Kimia.
Athiroh, NAS. 2012. Mekanisme Kerja Benalu Teh Pada Pembuluh Darah. Jurnal
Biologi.Vo l27. No 1.
Halaman 4.
Atun, S. 2003. Pemanfaatan Bahan Alam Bumi Indonesia Menuju Riset yang Berkualitas Internasional. Jurusan Kimia FMIPA Universitas Yogyakarta.
Benzie IFF, Strain JJ. 1996. The Ferric Reducing Ability Of Plasma (FRAP) As A
Measurement Of ‘Antioxidant Power’ : the FRAP assay.
Bilbiana, L dan Hastowo, S. 1992. Mikrobiologi. Jakarta : Rajawali Press.
Chamber, H. F. 2007. Dasar Farmakologi Terapi. Jilid 2. Edisi 10. Diterjemahkan oleh Cucu., Ella, E., Winny, R.S., Amalia, H dan Juli, M. Jakarta : Penerbit Buku Kedokteran EGC.
Cowan, M, M. 1999. Plant Products as Antimicrobial Agents. Clinical microbiology reviews. Vol. 12. No.4. 82-564.
Dachriyanus. 2004. Analisis Struktur Senyawa Organik secara Spektroskopi. Padang : Andalas University Press.
Dalimartha, S dan Soedibyo, M. 1998. Awet Muda dengan Tumbuhan Obat dan Diet Suplemen. Jakarta : Trubus Agriwidya.
Depkes RI. 2000 . Parameter Standar Umum Ekstrak Tumbuhan Obat . Cetakan Pertama. Jakarta: Direktorat Jenderal Pengawasan Obat & Makanan.
Dixon, R. A. 2004. Phytoesterogens. Ann. Rev. Plant Biol., 55, 225-261.
Erlyani, 2012. Identifikasi Kandungan Metabolit Sekunder Dan Uji Antioksidan Ekstrak Metanol Tandan Bunga Jantan Enau (Arenga Pinnata Merr.). Jurnal Skripsi Jurusan F.MIPA FKIP Unhalu
Halaman 5.
Fardiaz, S. 1992. Mikrobiologi Pangan I. Jakarta : PT. Gramedia Pustaka Umum.
Forkmann, G and Heller, W. 1999. Polyketides and other Secondary Metabolites Including Fatty Acids and Their Derivates. Comprehensive Natural
Products Biochemistry. Amsterdam : Elsevier.
Gaman, P. M. 1992. Ilmu Pangan. Edisi Kedua. Yogyakarta : Gajah Mada University Press.
Ganiswara, S.G dkk. 1995. Farmakologi dan Terapi. Edisi IV. Gaya baru. Jakarta.
Hagerman, A. E. 2002. Tannin Handbook. Department of Chemistry and Biochemistry, Miami University.
Harborne, J. B. 1987. Metode Fitokimia Penuntun Cara Modern Menganalisis Tumbuhan. Penerjamah : Kosasih Padmawinata dan Iwang Soediro. Edisi Ketiga. Bandung : ITB Press.
Hargono, D. 2012. Beberapa hasil Penelitian yang Mendukung Manfaat Tumbuhan Jambu Biji (Psidiumguajava). Jakarta : Universitas Pancasila.
Hirota, A., Taki, S., Kawai, S., Yano, M dan Abe. 2000. 1,1-Diphenyl-2-Picryl-Hydrazil Radical Scavenging Compounds from Soybean Miso and Antiproliferative Activity of isoflavanes Soybean Miso Toward the Cancer Cell Lines. Biosci. Biotechnol. Biochem. 64(5): 1038-1040.
Irianto,K. 2006. Mikrobiologi Menguak Dunia Mikroorganisme. Bandung: Yrama Widya.
Iswari, K. 2011. Kulit Manggis Berkhasiat Tinggi. Cetakan I. Jakarta : Penerbit APMK
Jawetz, E. J. L., Melnick and E.A Adelberg. 1996. Mikrobiologi Kedokteran. Edisi ke-20, Jakarta : Penerbit Buku Kedokteran EGC.
Kalt W., Forney, C. F., Martin, A., & Prior, R. L., 1999. Antioxidant Capacity, Vitamin C, Phenolics, and Anthocyanins After Fresh Storage of Small Fruits. Journal of Agricultural and Food Chemistry.
Khopkar, S. M. 2007. Konsep Dasar Kimia Analitik. Jakarta : UI Press.
Khunaifi, M. 2010. Uji Antibakteri Ekstrak Daun Binahong (Anredera cordifolia (Ten.) Steenis) Terhadap Bakteri Staphylococcus aureus dan Pseudomonas aeruginosa.
Kirana, C., Matuti, R., Widodo, M.A., Suwito, S.B., Indrayanni, S., Eka, N.P., Sigiharanati, N., dan Ayi, B.2001. Komposisi Bahan Biaktif Benalu.
Jurnal Ilmu-Ilmu Teknik (Engineering). Vol. 13.
Kosasih, E. N. 2004. Peran Antioksidan Pada Lanjut Usia. Jakarta : Pusat Kajian Nasional Majalah Lanjut Usia.
Kumalaningsih, S. 2006. Antioksidan Alami Penangkal Radikal Bebas, Sumber Manfaat, Cara Penyediaan dan Pengolahan. Surabaya : Trubus Agrisarana.
Lenny, S. 2006. Senyawa Terpenoida dan Steroida. Karya Ilmiah. Medan : Universitas Sumatera Utara.
Markham, K.R., 1998. Cara Mengidentifikasi Flavonoid. (Diterjemahkan oleh Kosasih Padmawinata), Penerbit ITB, Bandung.
Maulida, D. 2010. Skripsi Ekstraksi Antioksidan (LIKOPEN) Dari Buah Tomat Dengan Menggunakan Solven Campuran, n-Heksana, Aseton dan Etanol. Universitas Diponegoro Semarang.
Molyneux, P. 2004. The Use of The Stable Free Radical Dyphenylpycrilhydrazil (DPPH) for Estimating Antioxidant Activity. Journals science and
thecnology : 26:211-219.
Mosquera. 2007. Antioxidants Activity of Twenty Five Plants from Colombian Biodiversity. Rio de Janeiro : Memorias Oswaldo Cruz. Vol 102 (5) : 631-634.
Nasution, P, Roza, RM dan Fitmawati. 2008. Aktivitas Antibakteri Ekstrak Daun Benalu (Scurulla sp) yang Tumbuh Pada Beberapa Inang Terhadap Pertumbuhan Salmonella Typhi. Pekanbaru : Fakultas Matematika dan Ilmu Pengetahuan Alam.
Pardede, A., Manjang, Y., dan Efdi, M. 2013. Skrining Fitokimia Ekstrak Metanol Dari Kulit Batang Manggis (Gracinia cymosa). Jurnal Kimia FMIPA
Universitas Andalas. Volume 6. Nomor 2. Halaman 60-66
Pelczar, M. J., dan Chan, E. C.S. (1998). Dasar-Dasar Mikrobiologi II. Jakarta : Penerbit UI-Press.
Pitojo, S. 1996. Benalu Hortikultural Pengendalian dan Pemanfaatan. Ungaran : Trubus Agriwidya.
Pokornya, J. N. Yanishlieva and N. Gordon. 2001. Antioxidant in Food. Woodhead Publishing Limited : England.
Pourmourad F, Hosseinimehr SJ, Shahabimajd N. 2006. Antioxidant Activity, Phenol And Flavonoid Contents of Some Selected Irian Medicinal Plants. African journal of Biotechnology 5(11): 1142-1145.
Prajitno, Arief. 2007. Uji Sensitifitas Flavonoid Rumput Laut (Eucheuma Cottoni) Sebagai Bioaktif Alami Terhadap Bakteri Vibrio Harveyi. Skripsi. Fakultas Perikanan, Universitas Brawijaya.
Pratiwi, Sylvia. T. 2008. Mikrobiologi Farmasi. Jakarta : Erlangga
Purnomo, B. 2000. Uji Ketoksikan Akut Fraksi Etanol Daun Benalu (Dendropthae Sp) Pada Mencit Jantan Dan Uji Kandungan Kimia, Skripsi. Fakultas Farmasi Universitas Gadjah Mada. Yogyakarta.
Rasyid, A. 2012. Identifikasi Senyawa Metabolit Sekunder – Serta Uji Aktivitas Antibakterian dan Antioksidan Ekstrak Metanol Teripang Stichopus Hermanii, Jurnal Ilmu dan Teknik Kelautan Tropis, Vol.4, No.2, Halaman 360-368
Rijayanti, R. P. 2014. Uji Aktivitas Antibakteri Ekstrak Etanol Daun Mangga Bacang (Mangifera foetida L.) Terhadap Staphylococcus aureus secara In Vitro. Universitas Tanjung Pura. Pontianak
Rohman, A. 2007. Kimia Farmasi Analisis. Yogyakarta : Pustaka Pelajar.
Rusdi. 1990. Tetumbuhan Sebagai Sumber Bahan Obat. Padang : Pusat Penelitian Universitas Andalas.
Sabir, A. 2005. Aktivitas Antibakteri Flavonoid Propolis Trigona sp Terhadap Bakteri Streptococcus Mutans (In Vitro). Majelis Ked.Gigi.
Sajomsang, W and Gonil, P. 2010. Synthesis and Bacterial Activity of Quartenized N-pyridymethyl Chitosan Perivates. Thailand : Polimer Prepint 55 (1), 151.
Sangi, et al, 2008. Analisa Fitokimia Tumbuhan Obat di Kabupaten Minahasa Utara. Manado : Biologi Fakultas MIPA Unsrat.
Sastrohamidjojo, H. 1996. Sintesis Bahan Alam. Yogyakarta : Gadjah Mada University Press.
Scalbert, A. 1991. Antimicrobial Properti of Tannins. Review Article Number 63. France : Pergamon Press. Journal Phytochemistry.
Setiabudi, R dan Gan, V. H. S. 1995. Farmakologi dan Terapi. Edisi 4. Bagian Farmakologi FK UI : Jakarta 571-583.
Siahaan,C.E. 2015. Uji Skrining Fitokimia,Aktivitas Antioksidan dan Antibakteri Ekstrak Metanol,Etil Asetat dan n-Heksana Daun Benalu Kakao (Dendrophthoe pentandra (L.) Miq), Skripsi. Medan : Universitas Sumatera Utara.
Silalahi, J. 2006. Antioksidan dalam Diet dan Karsinogenesis. Cermin Dunia Kedokteran. 153:42-47.
Sirait, M. 2007. Penentuan Fitokimia dalam Farmasi. Bandung : ITB.
Sjamsul Arifin Achmad. 1986. Buku Materi Pokok Kimia Organik Bahan Alam Modul 1-6. Jakarta : DEPDIKBUD UT.
Soejono, 1995. Inventarisasi Pohon Inang Benalu di Kebun Raya Purwodadi. Makalah Seminar Kelompok Kerja Nasional Tumbuhan Obat Indonesia IX 21-22 September 1995. Universitas Gadjah Mada.
Subeki. 1998. Pengaruh Cara Pemasakan Terhadap Kandungan Antioksidan Beberapa macam Sayuran Serta Daya Serap dan Retensinya pada Tikus Percobaan. Program Pascasarjana. Institut Pertanian Bogor.
Sutrisno, Jenri. 2014. Uji Aktivitas Antibakteri Ekstrak Etanol Biji Pinang (Areca
Catechu L.) Terhadap Staphylococcus aureus Secara In Vitro. Pontianak.
Universitas Tanjungpura.
Tortora, G.J. 2001. Microbiology an Introduction. Edisi Ketujuh. New York : M Addison Wesley Longman, Inc.
Welle, R and Grisebach, H. 1998. Isolation of a novel NADPH-dependent
reductase which coacts with chalcone sythase in the biosynthesis of 6’ -deoxychalcone. FEBS Lett., 236, 221-225.
Widyastuti, N. 2010. Pengukuran Aktivitas Antioksidan dengan Metode CUPRAC, DPPH, dan FRAP serta korelasinya dengan Fenol dan Flavonoida pada Enam Tanaman, Skripsi Sarjana Sains Institut Pertanian Bogor.
Volk. W. And M. F Wheeler. 1998. Mikrobiologi Dasar. Alih Bahasa : Markham. Jakarta : PT. Gelora Aksara Pratama.
Yuhernita dan Juniarti. 2009. Analisa Senyawa Metabolit Sekunder Ekstrak Metanol Daun Surian yang Berpotensi Sebagai Antioksidan. Jurnal kimia
BAB 3
METODE PENELITIAN
3.1 Alat dan Bahan 3.1.1 Alat
Spektrofotometri UV-Visible SP-300
Rotari Evaporator Buchi
Laminar air flo cabinet Astec HLF 1200 L
Oven Fischer Scientific
Inkubator Fiber Scientific
Lemari Pendingin Toshiba
Glass Beaker
Gelas erlenmeyer
Neraca analitis Mettler AE 200
Corong pisah
Desikator Simax Czechoslovakia
Pipet makro Eppendorf
Jarum ose
Autoklaf Yamata SN 20
Kuvet
Neraca analitis
Cawan petri
3.1.2 Bahan
Daun Benalu Kopi (Loranthus parasiticus (L.) Merr)
Etanol p.a Merck
Metanol
Etil Asetat
Aquadest
Pereaksi Wagner
Pereaksi Maeyer
Pereaksi Bouchardat
Pereaksi Dragendorf
FeCl3 5%
CeSO4 1% dalam H2SO4 10%
Logam Mg
HCl pekat
Amoniak
Kloroform
HCl 2N
DPPH (2,2-diphenyl-1-picryl-hydrazil) p.a Aldrich
DMSO (dimetilsulfoksida) p.a Fisons
Nutrient Broth (NB) p.a Oxoid
Nutrient Agar (NA) p.a Oxoid
Mueller Hinton Agar (MHA) p.a Oxoid Bakteri Staphylococcus aureus
3.2 Prosedur Penelitian
3.2.1 Penyediaan Sampel
Bahan yang digunakan dalam penelitian ini adalah Daun Benalu Kopi yang
diperoleh dari Desa Parongil,Kecamatan Sumbul, Kabupaten Dairi, Sumatera
Utara. Daun benalu kopi dipisahkan dari batang dan buahnya. Sampel dikeringkan
dalam ruangan selama 5 hari kemudian dihaluskan dengan blender.
3.2.2 Analisa Kadar Air
Ditimbang 2 gram sampel lalu dikeringkan dalam oven pada suhu 105̊ C- 110̊ C selama 2 jam, lalu didinginkan dalam desikator selama 30 menit. Kemudian
ditimbang. Diulangi pengeringan sampai diperoleh berat tetap.
3.2.3 Pembuatan Ekstrak Metanol dan Etil asetat dari Daun Benalu Kopi
Ditimbang serbuk daun benalu kopi sebanyak 600 g, dimaserasi dengan
menggunakan pelarut metanol selama 3×24 jam. Kemudian disaring. Dilakukan
pengulangan hingga larutan berwarna jernih. Filtrat yang diperoleh
dirotarievaporator dan ekstrak pekat metanol yang diperoleh dipekatkan kembali
pada penangas air sampai diperoleh ekstrak bebas dari pelarut metanol dan
ditimbang. Sebagian ekstrak kering metanol dilarutkan dengan pelarut etil
asetat,kemudian disaring. Dilakukan pengulangan hingga larutan berwarna jernih.
Filtrat yang diperoleh dirotarievaporator dan ekstrak pekat etil asetat yang
diperoleh dipekatkan kembali pada penangas air sampai diperoleh ekstrak bebas
dari pelarut etil asetat dan ditimbang. Ekstrak kering yang dihasilkan diuji
3.2.4 Uji Skrining Fitokimia
1. Uji Alkaloid
Ekstrak metanol dan etil asetat daun benalu kopi masing-masing dimasukkan
dalam tabung reaksi. Tabung I ditetesi pereaksu Wagner, jika terbentuk endapan
jingga, maka positif mengandung alkaloid. Tabung II ditetesi pereaksi Maeyer,
jika terbentuk endapan putih,maka positif mengandung alkaloida. Tabung III
ditetesi pereaksi Boucahardat,jika terbentuk endapan cokelat, maka positif
mengandung alkaloida,dan tabung IV ditetesi dengan pereaksi Dragendorf, jika
terbentuk endapan jingga, maka positif mengandung alkaloida.
2. Uji Flavonoida
Ekstrak metanol dan etil asetat daun benalu kopi masing-masing dimasukkan
kedalam 2 tabung reaksi. Tabung I ditetesi NaOH 10%, jika terbentuk larutan
warna biru violet maka positif mengandung flavonoida. Tabung II ditambah
serbuk Mg dan HCl pekat,jika terbentuk larutan warna jingga maka positif
mengandung flavonoida.
3. Uji Tanin
Ekstrak metanol dan etil asetat daun benalu kopi masing-masing dimasukkan
kedalam tabung reaksi,kemudian ditambah dengan FeCl3 5%. Jika terbentuk
larutan warna biru kehitaman maka positif mengandung tanin.
4. Uji Terpenoida
Ekstrak metanol dan etil asetat daun benalu kopi masing-masing dimasukkan
dalam tabung reaksi kemudian ditambah dengan CeSO4 1% dalam H2SO4 10%.
Jika terbentuk endapan warna merah kecoklatan maka positif mengandung
5. Uji Saponin
Ekstrak metanol dan etil asetat daun benalu kopi masing-masing ditambah 10 ml
aquades,kemudian dikocok kuat-kuat. Jika muncul busa yang stabil maka positif
mengandung saponin.
3.2.5 Uji Sifat Antioksidan Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
3.2.5.1 Pembuatan Larutan DPPH 0,3 mM
Larutan DPPH 0,3 mM dibuat dengan melarutkan 11.83 mg serbuk DPPH dengan
etanol p.a dalam labu takar 100 ml, kemudian dihomogenkan.
3.2.5.2 Pembuatan Variasi Konsentrasi Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
Ekstrak metanol dan etil asetat daun benalu pohon kopi dibuat larutan induk 1000
ppm, dengan melarutkan 0,025 g ekstrak metanol dan etil asetat dengan pelarut
etanol p.a dalam labu takar 25 ml. Kemudian dari larutan induk 1000 ppm dibuat
larutan 100 ppm. Kemudian dari larutan 100 ppm dibuat larutan 50 ppm.
Kemudian dari larutan 50 ppm dibuat lagi variasi konsentrasi 5 ppm, 10 ppm, 15
ppm, 20 ppm, 25 ppm untuk diuji aktivitas antioksidannya.
3.2.5.3 Uji Aktivitas Antioksidan
a. Uji Aktivitas Antioksidan Larutan Blanko
Sebanyak 2,5 ml etanol p.a ditambahkan 1 ml larutan DPPH 0,3 mM dalam
tabung reaksi, dihomogenkan dan dibiarkan selama 30 menit pada ruang gelap.
b. Uji Aktivitas Antioksidan Sampel
Sebanyak 2,5 ml ekstrak metanol dan etil asetat daun benalu kopi 5 ppm
ditambahkan dengan 1 ml larutan DPPH 0,3 mM dalam tabung
reaksi,dihomogenkan dan dibiarkan dalam ruang gelap selama 30 menit. Lalu
diukur absorbansinya dengan panjang gelombang maksimum 515 nm. Dilakukan
perlakuan yang sama untuk konsentrasi 10, 15, 20, 25 ppm.
3.2.6 Uji Sifat Antibakteri Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
3.2.6.1 Pembuatan Media Nutrient Agar (NA)
Sebanyak 7 g nutrient agar dimasukkan dalam erlenmeyer lalu dilarutkan dalam 250 ml aquadest dan dipanaska hingga semua larut dan mendidih. Lalu disterilkan di autoklaf pada suhu 121̊ C selama 15 menit.
3.2.6.2 Pembuatan Media Agar Miring dan Stok Kultur Bakteri
Kedalam tabung reaksi yang steril dimasukkan 3 ml media nutrient agar steril, didiamkan pada temperatur kamar sampai memadat pada posisi miring membentuk sudut 30-45̊ C. Biakan bakteri Staphylococcus aureus dari strain
utama diambil dengan jarum ose steril lalu diinokulasikan pada permukaan media nutrient agar miring dengan cara menggores, kemudian diinkubasi pada suhu 35 ̊C selama 18-24 jam. Hal yang sama juga dilakukan pada biakan bakteri Escherichia
coli.
3.2.6.3 Pembuatan Media Mueller Hinton Agar (MHA)
3.2.6.4 Penyiapan Inokulum Bakteri
Sebanyak 3,25 g nutrient broth dilarutkan dengan 250 ml aquadest dalam erlenmeyer dan dipanaskan hingga semua larut dan mendidih, kemudian disterilkan di autoklaf pada suhu 121̊ C selama 15 menit dan didinginkan. Lalu koloni bakteri Staphylococcus aureus diambil dari stok kultur menggunakan
jarum ose steril kemudian disuspensikan ke dalam 10 ml media nutrient broth steril dalam tabung reaksi dan diinkubasikan pada suhu 35̊ C selama 3 jam,lalu diukur panjang gelombang dengan menggunakan spektrofotometer UV-Vis pada
panjang gelombang 540-600 nm. Hal yang sama dilakukan untuk koloni bakteri
Escherichia coli.
3.2.6.5 Pembuatan Variasi Konsentrasi Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
Ekstrak Metanol dan Etil Asetat dibuat dalam berbagai konsentrasi dengan
menimbang ekstrak masing-masing sebanyak 100 mg,200 mg,300 mg,400 mg,500
mg, kemudian dilarutkan masing-masing dengan 1 ml DMSO. Konsentrasi
ekstrak adalah 100 mg/ml,200 mg/ml,300 mg/ml,400 mg/ml dan 500 mg/ml.
3.2.6.6 Uji Aktivitas Antibakteri Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
Sebanyak 0,1 ml inokulum Staphylococcus aureus dimasukkan ke dalam cawan
petri steril, setelah itu dituang media Mueller Hinton Agar sebanyak 15 ml dengan suhu 45-50̊ C dihomogenkan sampai media dan bakteri tercampur rata,kemudian dibiarkan sampai media memadat. Dimasukkan kertas cakram yang telah direndam dengan ekstrak metanol dan etil asetat dengan berbagai variasi konsentrasi kedalam cawan petri yang telah berisi bakteri, kemudian diinkubasi dalam inkubator pada suhu 35̊ C selama 18-24 jam. Selanjutnya diukur diamater zona hambat di sekitar kertas cakramdengan jangka sorong. Dilakukan perlakuan
3.3 Bagan Penelitian
3.3.1 Pembuatan Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
3.3.2 Analisa Kadar Air
3.3.4 Uji Sifat Antioksidan Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
3.3.4.1 Pembuatan Variasi Konsentrasi Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
dipipet 2,5 mL larutan induk 1000 ppm dimasukkan ke dalam labu takar 25 mL ditambahkan etanol p.a hingga garis tanda dihomogenkan
25 mL larutan induk 100 ppm
dipipet 12,5 mL larutan induk 100 ppm dimasukkan ke dalam labu takar 25 mL ditambahkan etanol p.a hingga garis batas
3.3.4.2 Pembuatan Larutan DPPH 0,3 mM
11,85 mg DPPH
Dimasukkan ke dalam labu takar 100 mL
Ditambahkan etanol p.a hingga garis batas
Dihomogenkan
Larutan DPPH 0,3mM
3.3.4.3 Uji Aktivitas Antioksidan a. Uji Blanko
1 mL larutan DPPH 0,3 mM
Dimasukkan ke dalam tabung reaksi
Ditambahkan 2,5 mL etanol p.a
Dihomogenkan
Hasil
Dibiarkan selama 30 menit pada ruang gelap
b. Uji Aktivitas Antioksidan Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
1 ml larutan DPPH 0,3 mM
Dimasukkan kedalam tabung reaksi
Ditambahkan 2,5 ml ekstrak metanol daun benalu kopi sesuai dengan variasi konsentrasi
Dihomogenkan
Dibiarkan selama 30 menit pada ruang gelap
Diukur absorbansi pada panjang gelombang maksimum 515 nm
Hasil
Dilakukan perlakuan yang sama untuk ekstrak Etil Asetat Daun Benalu Kopi.
3.3.5 Uji Sifat Antibakteri Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
3.3.5.1 Pembuatan Media Mueller Hinton Agar (MHA)
7 gram media MHA (Mueller Hinton Agar)
Dilarutkan dengan 250 ml aquadest dalam gelas erlenmeyer
Dipanaskan sambil diaduk hingga larut dan mendidih
Disterilkan dalam autoklaf pada suhu 121oC selama 15 menit
3.3.5.2 Pembuatan Media Nutrient (NA), Media Agar Miring dan Stok Kultur Bakteri
7 gram media NA (Nutrient Agar)
Dilarutkan dengan 250 ml aquadest kedalam gelas erlenmeyer
Dipanaskan sambil diaduk hingga larut dan mendidih
Disterilkan dalam autoklaf
pada suhu 121oC selama 15 menit
Media NA (Nutrient Agar) steril
Dituangkan kedalam tabung reaksi sebanyak 3 ml
Dibiarkan pada temperatur kamar sampai memadat pada
posisi miring membentuk sudut 30-45oC
Diambil biakan bakteri Staphylococcus aureus dari strain utama dengan jarum ose laludigoreskan pada media NA
yang telah memadat
Diinkubasi pada suhu 35oC selama 18-24 jam
Stok Kultur Bakteri
3.3.5.3 Penyiapan Inokulum Bakteri
6,5 gram Media NB (Nutrient Broth)
Dilarutkan dengan 500 ml aquadest kedalam gelas erlenmeyer
Dipanaskan sambil diaduk hingga larut dan mendidih
Disterilkan dalam autoklaf pada suhu 121oC selama 15 menit
Media NB (Nutrient Broth) steril
Dituangkan kedalam tabung reaksi sebanyak 5 ml
Diambil koloni bakteri dari
stok kultur bakteri Staphylococcus aureus dengan jarum ose
Disuspensikan kedalam Nutrient Broth (NB)
Diinkubasi pada suhu 350oC selama 2-3 jam
Diukur kekeruhan larutan pada
panjang gelombang 580-600 nm sampai diperoleh transmitan 25
(disamakan kekeruhanna dengan standart Mcfarland)
Hasil
3.3.5.4 Pengujian Aktivitas Antibakteri Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
0,1 ml Inokulum Bakteri
Dimasukkan kedalam cawan petri steril
Ditambah dengan 15 ml media Mueller Hinton Agar (MHA) dengan suhu 45-50oC
Dihomogenkan sampai media dan bakteri tercampur rata
Dibiarkan sampai media memadat
Dimasukkan kertas cakram yang telah direndam dengan ekstrak metanol daun benalu kopi dengan berbagai konsentrasi dengan cawan petri yang telah berisi bakteri
Diinkubasi selama 18-24jam pada suhu 35oC
Diukur diameter zona bening di sekitar cakram dengan jangka sorong
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian
4.1.1 Penentuan Kadar Air Serbuk Daun Benalu Kopi
Sampel daun benalu kopi dilakukan analisa kadar air untuk mengetahui
kandungan air yang masih terkandung dalam sampel yang telah dikeringkan.
Kadar air daun benalu kopi diperoleh dari hasil perhitungan sebagai berikut :
Berat sampel = 2 g
Berat setelah pemanasan = 1,78 g
Kehilangan bobot = 2 g – 1,78 g = 0,22 g
Kadar air serbuk daun benalu kopi = Ke
e e x 100%
= 0, x 100% = 11 %
4.1.2 Ekstraksi Daun Benalu Kopi
Ekstraksi daun benalu kopi dilakukan secara maserasi menggunakan pelarut
metanol dan etil asetat sehingga diperoleh dengan perhitungan sebagai berikut :
-Kadar Ekstrak Metanol Daun Benalu Kopi
Berat serbuk = 600 gram
Berat ekstrak = 76,23 gram
Kadar ekstrak metanol daun benalu kopi = Berat sampel kering x Berat ekstrak %
= , gram gram x % = , %
-Kadar Ekstrak Etil Asetat Daun Benalu Kopi
Berat ekstrak metanol kering = 70 gram
Berat ekstrak etil asetat = 14,5 gram
Kadar ekstrak etil asetat daun benalu kopi = Berat sampel kering x Berat ekstrak %
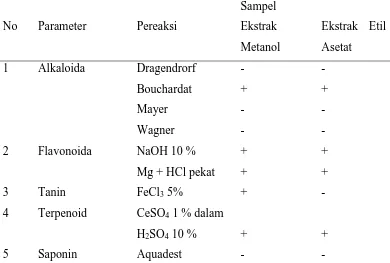
4.1.3 Skrining Fitokimia Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
Ekstrak metanol daun benalu kopi yang diperoleh diuji skrining fitokimia untuk
mengetahui adanya golongan senyawa alkaloida, flavonoida, terpenoida dan tanin
sedangkan ekstrak etil asetat daun benalu kopi mengandung golongan senyawa
alkaloida, flavonoida dan terpenoida, yang ditunjukkan pada tabel 4.1.
Tabel 4.1. Skrining Fitokimia Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
No Parameter Pereaksi
Keterangan : - = Tidak terdeteksi adanya senyawa metabolit sekunder
+ = Terdeteksi adanya senyawa metabolit sekunder
4.1.4 Hasil Uji Aktivitas Antioksidan Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
Ekstrak metanol daun benalu kopi dilakukan uji aktivitas antioksidan dengan
metode DPPH radikal bebas untuk memperoleh nilai IC50 menggunakan
spektrofotometer UV-Visible pada panjang gelombang maksimum 515 nm.
Kemampuan antioksidan diukur sebagai penurunan serapan larutan DPPH
(peredaman warna ungu DPPH). Tabel 4.2 dan gambar 4.1 menunjukkan hasil
Tabel 4.2 Hasil Pengukuran Absorbansi Ekstrak Metanol dan Ekstrak Etil Asetat
Persamaan garis regresi dan nilai IC50 yang diperoleh dari ekstrak metanol dan etil
asetat daun benalu kopi dapat ditunjukkan pada Tabel 4.3 dibawah ini.
Tabel 4.3 Persamaan Garis Regresi dan Nilai IC50 yang diperoleh dari ekstrak
metanol dan etil asetat daun benalu kopi.
No Sampel Persamaan Garis Regresi IC50
4.1.5 Hasil Uji Aktivitas Antibakteri Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
a. Hasil Uji Aktivitas Antibakteri Ekstrak Metanol Daun Benalu Kopi
Sifat antibakteri ekstrak metanol daun benalu kopi menunjukkan zona hambat
pada pertumbuhan beberapa bakteri yaitu Escherichia coli dan Staphylococcus
aureus seperti yang ditunjukkan pada tabel 4.4 dan gambar 4.2 dan 4.3 dibawah
ini :
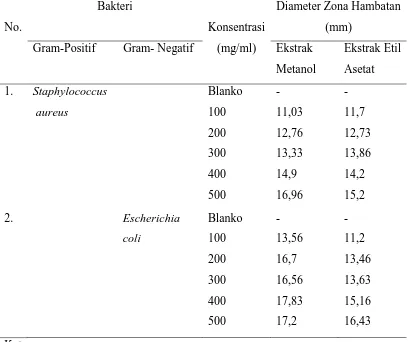
Tabel 4.4 Hasil Uji Aktivitas Antibakteri Ekstrak Metanol dan Etil Asetat Daun
Benalu Kopi.
Keterangan :
Blanko = kertas cakram direndam dengan pelarut DMSO. No.
Gram-Positif Gram- Negatif Ekstrak
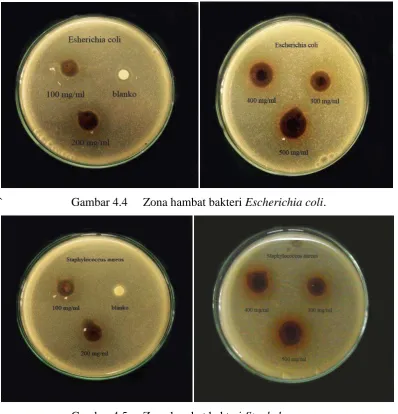
Gambar 4.2 Zona hambat bakteri Escherichia coli.
b. Hasil Uji Aktivitas Antibakteri Ekstrak Etil Asetat Daun Benalu Kopi.
Sifat antibakteri ekstrak etil asetat daun benalu kopi menunjukkan zona hambat
pada pertumbuhan beberapa bakteri yaitu Escherichia coli dan Staphylococcus
aureus seperti yang ditunjukkan pada tabel 4.4 diatas dan gambar 4.4 dan 4.5
dibawah ini.
` Gambar 4.4 Zona hambat bakteri Escherichia coli.
Gambar 4.5 Zona hambat bakteri Staphylococcus aureus.
4.2 Pembahasan
4.2.1 Penentuan Kadar Air Daun Benalu Kopi
Dari hasil penelitian diperoleh kadar air untuk simplisia daun benalu kopi adalah
sebesar 11%. Simplisia dinilai cukup aman bila mempunyai kadar air ±10 %.
Tujuan dari penentuan kadar air adalah untuk mengetahui batasan maksimal atau
rentang besarnya kandungan air didalam bahan. Hal ini terkait dengan kemurnian
dan adanya kontaminan dalam simplisia tersebut. Dengan demikian, penghilangan
kadar air hingga jumlah tertentu berguna untuk memperpanjang daya tahan bahan
selama penyimpanan (Harborne, 1987). Dan juga proses pengeringan didalam
prosedur percobaan bertujuan untuk mencegah kerusakan yang ada dalam
tanaman sehingga dapat disimpan dalam waktu yang lama dan juga bertujuan
untuk mencegah penjamuran pada sampel ,dimana kapang dapat berkembang
dengan baik dalam simplisia dengan kadar air sekitar 18% (Miryanti et al, 2011).
4.2.2 Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
Dari hasil penelitian yang diperoleh kadar ekstrak metanol daun benalu kopi lebih
tinggi dibandingkan dengan ekstrak etil asetat yaitu masing-masing sebesar 11%
dan 20,71%. Kadar ekstrak etil asetat daun benalu kopi lebih besar dibandingkan
ekstrak metanol kemungkinan karena didalam daun benalu kopi memiliki kadar
tanin yang lebih besar dibandingkan dengan senyawa metabolit sekunder lainnya.
4.2.3 Skrining Fitokimia Kandungan Senyawa Metabolit Sekunder Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
Skrining fitokimia merupakan tahap pendahuluan dari suatu penelitian yang
bertujuan untuk memberikan gambaran tentang golongan senyawa yang
terkandung dalam tumbuhan. Berdasarkan hasil skrining fitokimia, golongan
senyawa yang terkandung dalam ekstrak metanol adalah alkaloid, flavonoid,
tanin dan terpenoida, sedangkan dalam ekstrak etil asetat adalah alkaloid,
Ekstrak metanol daun benalu kopi positif pada golongan alkaloida, apabila
direaksikan dengan pereaksi Bouchardat yang menghasilkan endapan cokelat.
Pada pembuatan pereaksi Bouchardat, iodin bereaksi dengan ion I- dari kalium
iodida menghasilkan ion I3- yang berwarna cokelat. Pada uji Bouchardat, ion
logam K+ akan membentuk ikatan kovalen koordinat dengan nitrogen pada
alkaloid membentuk kompleks kalium-alkaloid yang mengendap (Pardede et al,
2013) Gambar 4.6 dibawah ini menunjukkan reaksi alkaloid dengan pereaksi
Bouchardat.
I2 + I- I3-
Coklat
Kalium-Alkaloid
Endapan cokelat
Gambar 4.6 Reaksi Alkaloid dengan pereaksi Bouchardat (Pardede et al, 2013).
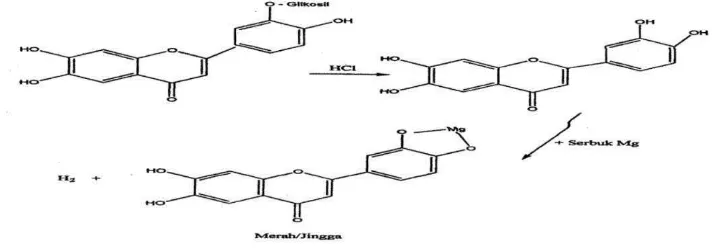
Pada uji flavonoida, penambahan NaOH pada ekstrak metanol dan etil
asetat daun benalu kopi menghasilkan perubahan warna menjadi biru violet yang
menunjukkan kandungan golongan flavonoid. Sedangkan penambahan HCl pekat
digunakan untuk menghidrolisis flavonoid menjadi aglikonnya yaitu dengan
menghidrolisis O-glikosil. Glikosil akan terganti oleh H+ dari asam karena
sifatnya yang elektrofilik. Glikosida berupa gula dapat dijumpai yaitu glukosa,
galaktosa, dan ramnosa. Serbuk Mg menghasilkan senyawa kompleks yang
berwarna merah / jingga ( Sangi et al, 2008). Gambar 4.7 menunjukkan reaksi
flavonoid dengan HCl pekat dan serbuk Mg.
Gambar 4.7 Reaksi uji flavonoid dengan HCl pekat dan serbuk Mg
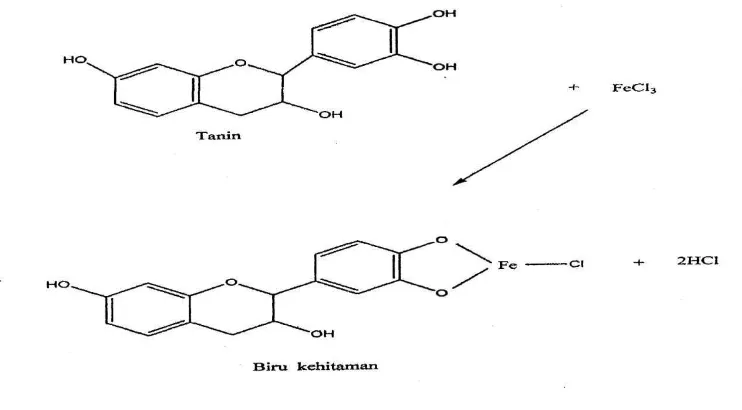
Pengujian tanin dilakukan dengan penambahan larutan FeCl3 5% pada
ekstrak metanol daun benalu kopi sehingga menghasilkan hasil yang positif dan
terbentuk warna biru kehitaman. Pada penambahan larutan FeCl3 5% diperkirakan
larutan ini bereaksi dengan salah satu gugus hidroksil yang ada pada senyawa
tanin. Pereaksi FeCl3 dipergunakan secara luas untuk mengidentifikasi senyawa
fenol termasuk tanin (Robinson, 1995). Gambar 4.8 menunjukkan reaksi tanin
dengan FeCl3.
Gambar 4.8 Reaksi uji tanin dengan FeCl3 (Robinson, 1995).
Dan juga terpenoid, analisis senyawa didasarkan pada kemampuan senyawa
tersebut membentuk warna dengan penambahan CeSO4 1% dalam H2SO4 10%.
Hasil yang diperoleh menunjukkan hasil positif dengan perubahan warna menjadi
merah kecoklatan yang menunjukkan kandungan golongan senyawa terpenoida.
Dari hasil uji skrining fitokimia ekstrak etil asetat mengandung golongan
senyawa flavonoida, alkaloida dan terpenoida. Ekstrak metanol dan etil asetat
memberikan hasil yang negatif untuk golongan saponin. Ekstrak metanol dapat
mengikat golongan flavonoida dan tanin karena pelarut metanol merupakan
pelarut yang kepolarannya sangat tinggi sehingga dapat mengikat senyawa polar
dan juga senyawa nonpolar. Sedangkan pada ekstrak etil asetat tidak terkandung
tanin karena tanin sangat polar sehingga pelarut etil asetat tidak dapat melarutkan
4.2.2 Uji Aktivitas Antioksidan Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi.
Uji aktivitas antioksidan ekstrak metanol dan etil asetat daun benalu kopi dengan
metode DPPH dengan menggunakan alat spektrofotometri UV Visible. Adapun
mekanisme utama peredaman utama peredaman radikal DPPH adalah sebagai
berikut:
Pada uji DPPH, perendaman radikal DPPH diikuti dengan pematauan
penurunan absorbansi pada panjang gelombang maksimum yang terjadi karena
pengurangan radikal oleh antioksidan AH atau reaksi dengan spesi radikal (R)
yang ditandai dengan berubahnya warna ungu pada larutan menjadi warna kuning
pucat, data yang sering dilaporkan sebagai IC50 merupakan konsentrasi
antioksidan yang dibutuhkan untuk 50 % peredaman radikal DPPH pada periode
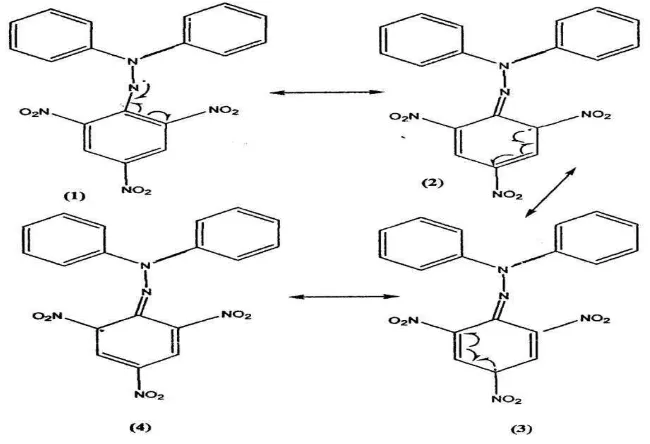
waktu tertentu (15 – 30 menit) (Pokornya et al, 2001). DPPH merupakan suatu
molekul radikal bebas yang distabilkan oleh bentuk resonansi seperti ditunjukkan
pada gambar 4.9 dibawah ini.
Gambar 4.9 Kestabilan radikal bebas DPPH (Pokornya et al, 2001).
Tabel 4.2 dan 4.3 (halaman 45 dan 46) menunjukkan telah terjadi
peredaman radikal bebas DPPH setelah penambahan ekstrak metanol dan etil
asetat daun benalu kopi, dimana semakin tinggi konsentrasi maka % peredaman
Dari persamaan Y = ax + b dapat diketahui oleh nilai IC50 dengan
memasukkan nilai 50 sebagai sumbu Y, sehingga diperoleh berapa besar nilai x
yang akan mempresentasikan besaran IC50. Dari perhitungan diperoleh nilai IC50
untuk ekstrak metanol dan etil asetat masing-masing sebesar 16,66 mg/L dan
19,29 mg/L.
Hasil skrining fitokimia menunjukkan ekstrak metanol dan etil asetat daun
benalu kopi mengandung golongan senyawa kimia berupa flavonoida dan tanin.
Flavonoida dan tanin merupakan senyawa fenol yang bersifat sebagai antioksidan
(Harbone, 1996). Senyawa – senyawa polifenol mengandung gugus hidroksil
yang dapat bertindak sebagai donor hidrogen terhadap radikal bebas, yang
reaksinya dapat dilihat pada gambar 4.10 (Silalahi, 2006).
Gambar 4.10 Reaksi DPPH dengan turunan fenol (Silalahi, 2006).
Pada senyawa polifenol, aktivitas antioksidan berkaitan erat dengan
struktur rantai samping dan juga substitusi pada cincin aromatiknya.
Kemampuannya untuk bereaksi dengan radikal bebas DPPH dapat mempengaruhi
urutan kekuatan antioksidannya. Aktivitas perendaman radikal bebas senyawa
polifenol diyakini dipengaruhi oleh jumlah dan posisi hidrogen fenolik dalam
molekulnya. Dengan demikian aktivitas antioksidan yang lebih tinggi akan
dihasilkan pada senyawa fenolik yang mempunyai jumlah gugus hidroksil yang
lebih banyak pada inti flavonoidnya. Senyawa fenolik ini mempunyai kemampuan
untuk menyumbangkan hidrogen, maka aktivitas antioksidan senyawa fenolik
pada reaksi netralisasi radikal bebas yang mengawali proses oksidasi atau pada
Dari literatur dapat diketahui bahwa jika nilai IC50 yang dihasilkan kurang
dari 50, maka senyawa tersebut dapat dikatakan memiliki aktivitas antioksidan
yang sangat kuat. Oleh karena itu berdasarkan perhitungan yang diperoleh dapat
dikatan bahwa senyawa antioksidan yang terdapat dalam ekstrak metanol dan etil
asetat daun benalu kopi sama-sama memiliki aktivitas antioksidan yang sangat
kuat. Tingkat kekuatan senyawa antioksidan menggunakan metode DPPH dapat
dilihat pada tabel 4.5 dibawah ini.
Tabel 4.5 Tingkat kekuatan senyawa antioksidan dengan menggunakan DPPH.
`Intensitas IC50`
Sangat kuat <50 mg/L
Kuat 50-100 mg/L
Sedang 101-150 mg/L
Lemah >150 mg/L
(Ionita, 2005).
4.2.3 Uji Aktivitas Antibakteri Ekstrak Metanol dan Etil Asetat Daun Benalu Kopi
Pengujian aktivitas antibakteri bertujuan untuk mengetahui aktivitas
bakteri terhadap sampel uji. Metode pengujian aktivitas antibakteri yang
digunakan pada penelitian ini adalah metode difusi agar. Pada metode ini aktivitas
bakteri terhadap sampel uji ditunjukkan dengan terbentuknya zona hambat
disekitar kertas cakram yang menandakan daerah pertumbuhan bakteri.
Pada penelitian ini menggunakan bakteri patogen yang berasal dari gram positif
dan gram negatif. Bakteri patogen yang digunakan adalah Staphylococcus aureus
dan Escherichia coli.
Hasil uji aktivitas antibakteri dari ekstrak metanol dan etil asetat efektif
menghambat perrtumbuhan bakteri Staphylococcus aureus dan Escherichia coli.
Pada tabel 4.4 memperlihatkan bahwa ekstrak metanol dan etil asetatmemiliki
aktivitas antibakteri dengan kategori sedang pada konsentrasi 500 mg/ml dengan
zona hambat masing-masing sebesar 16,96 mm dan 15,2 mm terhadap bakteri
Staphylococcus aureus dan pada konsentrasi 500 mg/ml dengan zona hambat
masing-masing sebesar 17,2 mm dan 16,43 mm terhadap bakteri Escherichia coli.
Adanya perbedaan diameter zona hambat pada kedua bakteri menunjukkan bahwa
terdapat perbedaan sentivitas ekstrak pada mikroba uji tersebut. Senyawa yang
bersifat sebagai antimikroba dapat menyebabkan kerusakan pada dinding sel serta
kerusakan pada membran sel berupa denaturasi protein dan lemak yang menyusun
membran sel.
Ekstrak metanol dan etil asetat daun benalu kopi lebih efektif menghambat
pertumbuhan bakteri gram positif Staphylococcus aureus dibandingkan dengan
bakteri gram negatif Escherichia coli. Hal ini disebabkan oleh perbedaan
komposisi dan struktur dinding sel pada bakteri gram positif dan gram negatif.
Struktur dinding sel bakteri gram positif berlapis tunggal dengan kandungan lipid
yang rendah (1-4%), sedangkan bakteri gram negatif memiliki kandungan lipid
tinggi yaitu 11-12% (Fardiaz, 1992) dan membran luar terdiri dari 3 lapisan yaitu
lipopolisakarida, lipoprotein dan pospolipid (Tortora, 2011).
Berdasarkan hasil skrining fitokimia menunjukkan bahwa ekstrak metanol
daun benalu kopi mengandung golongan senyawa metabolit sekunder berupa
alkaloid, flavonoida, terpenoida dan tanin, sedangkan ekstrak etil asetat
mengandung senyawa akaloid, flavonoid dan terpenoid.Adanya senyawa
flavonoida dan tanin menunjukkan bahwa ekstrak metanol dan etil asetat daun
benalu kopi mempunyai aktivitas antibakteri karena flavonoida dan tanin
Senyawa fenol bekerja dengan cara mendenaturasi protein sel sehingga
protein sel bakteri menjadi kehilangan aktivitas biologinya. Akibatnya fungsi
permeabilitas sel bakteri terganggu dan sel bakteri akan mengalami lisis yang
berakibat pada kematian sel bakteri (Harborne, 1987). Selain itu senyawa fenol
juga dapat merusak lipid pada membran sel melaui mekanisme penurunan
tegangan permukaan membran sel (Pelczar dan Chan, 1988).
Senyawa alkaloid yang terkandung dalam ekstrak daun benalu kopi yang
memiliki kemampuan sebagai antibakteri. Mekanisme diduga dengan cara
mengganggu komponen penyusun peptidoglikan pada sel bakteri sehingga lapisan
dinding sel tidak terbentuk secara utuh, terganggunya sintesis peptidoglikan
sehingga permukaan sel tidak sempurna karena tidak mengandung peptidoglikan
dan dinding selnya hanya meliputi membran sel. Rangka dasar dinding sel bakteri
adalah lapisan peptidoglikan. Peptidoglikan tersusun dari N-asetil glukosamin dan
N-asetil asam muramat, yang terikat melalui ikatan 1,4- glikosida. Pada N-asetil
asam muramat terdapat rantai pendek asam amino : alanin, glutamat,
diaminopimelat, lisin dan alanin, yang terikat melalui ikatan peptida. Peranan
ikatan peptida sangat penting dalam menghubungkan antara rantai satu dengan
rantai yang lain. Mekanisme kerusakan dinding sel bakteri terjadi karena proses
perakitan dinding sel bakteri yang diawali dengan pembentukan rantai peptida
yang akan membentuk jembatan silang peptida yang menggabungkan rantai
glikan dari peptidoglikan pada rantai yang lain sehingga menyebabkan dinding sel
terakit sempurna. Keadaan ini menyebabkan sel bakteri mudah mengalami lisis,
baik berupa fisik maupun osmotik dan menyebabkan kematian sel. S.aureus
merupakan bakteri gram positif yang memiliki dinding peptidoglikan yang tebal.
Sehingga lebis sensitif terhadap senyawa-senyawa yang punya potensi merusak
atau menghambat sintesis dinding sel. Rusaknya dinding sel akan menyebabkan
terhambatnya pertumbuhan sel bakteri, dan pada akhirnya bakteri akan mati.
Secara umum adanya kerja suatu bahan kimia sebagai zat antibakteri dapat
mengakibatkan terjadinya perubahan- perubahan yang mengarah pada kerusakan
terhambatnya pertumbuhan sel bakteri tersebut. Diduga kerja alkaloid terlebih
dahulu merusak dinding sel dan dilanjutkan kerja flavonoid yang merusak
Senyawa flavonoid merupakan salah satu senyawa kimia yang terkandung
dalam ekstrak daun benalu kopi yang bersifat bakteriostatik. Mekanisme kerjanya
dengan cara mendenaturasi protein sel bakteri dan merusak membran sitoplasma.
Volk dan Wheeler (1998) dalam Prajitno (2007) menjelaskan bahwa senyawa
flavonoid dapat merusak membran sitoplasma yang dapat menyebabkan bocornya
metabolit penting dan menginaktifkan sistem enzim bakteri. Kerusakan ini
memungkinkan nukleotida dan asam amino merembes keluar dan mencegah
masuknya bahan-bahan aktif kedalam sel, keadaan ini dapat menyebabkan
kematian bakteri. Pada perusakan membran sitoplasma, ion H+ dari senyawa fenol
dan turunannya (flavonoid) akan menyerang gugus polar (gugus posfat) sehingga
molekul fosfolipida akan terurai menjadi gliserol, asam karboksilat dan asam
posfat. Hal ini mengakibatkan fosfolipida tidak mampu mempertahankan bentuk
membran sitoplasma akibatnya membran sitoplasma akan bocor dan bakteri akan
mengalami hambatan pertumbuhan dan bahkan kematian.
Senyawa tanin juga dapat menghambat dan membunuh pertumbuhan
bakteri dengan cara bereaksi dengan membran sel. Senyawa tanin termasuk
senyawa polifenol, senyawa ini dapat menghambat bakteri dengan cara merusak
membran plasma bakteri yang tersusun dari 60 % protein dan 40 % lipid yang
umumnya berpa fosfolipid, didalam membran sel tanin akan bereaksi dengan
protein membentuk ikatan hidrogen sehingga protein akan terdenaturasi, selain itu
tanin juga dapat bereaksi dengan fosfolipid yang terdapat dalam membran sel,
akibatnya senyawa tanin akan merusak membran sel, yang menyebabkan
bocornya metabolit penting yang menginaktifkan sistem enzim bakteri. Kerusakan
pada membran sel dapat mencegah masuknya bahan-bahan makanan atau nutrisi
yang diperlukanbakteri untuk menghasilkan energi akibatnya bakteri akan
mengalami hambatan pertumbuhan atau bahkan kematian (Volk and Wheller,
1998).
Mekanisme terpenoid sebagai antibakteri adalah bereaksi dengan porin
(protein transmembran) pada membran luar dinding sel bakteri, membentuk ikatan
polimer yang kuat sehingga mengakibatkan rusaknya porin (protein
Hasil penelitian uji aktivitas antioksidan dan antibakteri menunjukkan
bahwa aktivitas antioksidan dan antibakteri ekstrak metanol lebih tinggi
dibandingkan dengan ekstrak etil asetat daun benalu kopi. Hal ini kemungkinan
terjadi karena adanya gugus hidroksil dan gula yang terikat pada inti flavonoid
yang membuat flavonoid lebih polar sehingga tidak terekstraksi dengan pelarut
etil asetat yang menyebabkan ekstrak etil asetat tidak efektif bekerja sebagai
antibakteri (Crozier, A, 2006). Kemudian untuk uji aktivitas antioksidan sama
halnya dengan uji antibakteri. Dimana Menurut Juniarti (2009), bahwa aktivitas
antioksidan berkaitan erat dengan struktur rantai samping dan juga subtitusi pada
cincin aromatiknya. Aktivitas peredaman radikal bebas senyawa polifenol
diyakini dipengaruhi oleh jumlah dan posisi hidrogen fenolik dalam molekulnya.
Dengan demikian aktivitas antioksidan yang lebih tinggi akan dihasilkan pada
senyawa fenolik yang mempunyai jumlah gugus hidroksil yang lebih banyak pada
inti flavonoidnya. Senyawa fenolik ini mempunyai kemampuan untuk
menyumbangkan hidrogen, maka aktivitas antioksidan senyawa fenolik dapat
dihasilkan pada reaksi netralisasi radikal bebas yang mengawali proses oksidasi
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Berdasarkan uji skrining fitokimia ekstrak metanol daun benalu kopi
mengandung senyawa alkaloid, flavonoida, terpenoida dan tanin, sedangkan
ekstrak etil asetat daun benalu kopi mengandung senyawa alkaloid, flavonoida
dan terpenoida.
2. Hasil uji aktivitas antioksidan ekstrak metanol dan etil asetat termasuk
golongan antioksidan yang sangat kuat dimana kedua ekstrak tersebut memiliki
nilai IC50 masing-masing sebesar 16,66 mg/L dan 19,29 mg/L.
3. Hasil uji aktivitas antibakteri menunjukkan bahwa ekstrak metanol dan etil
asetat memiliki aktivitas antibakteri dengan kategori sedang pada konsentrasi
500 mg/ml dengan zona hambat 16,96 mm dan 15,2 mm terhadap bakteri
Staphylococcus aureus dan pada konsentrasi 500 mg/ml dengan zona hambat
17,2 mm dan 16,43 mm terhadap bakteri Escherichia coli.
5.2 Saran
BAB 2
TINJAUAN PUSTAKA
2.1 Tumbuhan Benalu Kopi (Loranthus parasiticus (L.) Merr.)
Klasifikasi Benalu kopi hasil identifikasi tumbuhan di laboratorium Herbarium
Medanense (MEDA) Universitas Sumatera Utara, adalah sebagai berikut :
Kingdom : Plantae
Divisi : Spermatophyta
Class : Dicotyledoneae
Ordo : Santalales
Famili : Loranthaceae
Genus : Loranthus
Spesies : Loranthus parasiticus (L.) Merr.
Nama Lokal : Benalu Kopi (Herbarium Medanense (MEDA))
Benalu (Loranthus) merupakan jenis tumbuhan yang hidupnya tidak
memerlukan media tanah. Ia hidup sebagai parasit, melekat pada sel inang, dan
menghisap nutrisi yang dimilikinya sehingga menyebabkan kematian pada sel
inang tersebut. Adanya klorofil menyebabkan tanaman benalu memiliki
kemampuan melakukan proses fotosintesis. Akan tetapi, tanaman ini tidak mampu
mengambil air dan unsur hara secara langsung dari tanah yang menjadikannya
sebagai tanaman parasit. Berdasarkan pengalaman, benalu yang menempel pada
tumbuhan tertentu telah digunakan dalam pengobatan tradisional. Benalu pada
umumnya digunakan sebagai obat campak, sedangkan benalu pada jeruk nipis
dimanfaatkan sebagai ramuan obat penyakit amandel. Benalu kopi sendiri
digunakan untuk mengobati sakit pinggang, diabetes, rematik, batuk, diare dan
antikanker. Kandungan kimia yang terdapat dalam benalu adalah flavonoid, tanin,
Bentuk daun benalu kopi yang digunakan dalam penelitian dapat dilihat pada
gambar 2.1.
Gambar 2.1 Daun Benalu Kopi (Penelitian)
Benalu kopi adalah salah satu tanaman parasit yang biasa digunakan dalam
pengobatan tradisional. Sebagai tanaman parasit benalu tidak banyak
dimanfaatkan,hal ini berkaitan dengan sifat parasit benalu yang dapat merusak
tanaman inangnya,sementara sebagai salah satu tanaman obat,benalu mempunyai
peranan yang penting. Secara tradisional benalu digunakan antara lain sebagai
obat batuk,amandel,campak,diabetes dan kanker (Pitojo,1996).
2.2 Senyawa Metabolit Sekunder
Senyawa metabolit sekunder merupakan biomolekul yang dapat digunakan
sebagai lead compounds dalam penemuan dan pengembangan obat-obat baru
(Atun, S, 2003). Senyawa-senyawa kimia yang merupakan hasil metabolisme
sekunder pada tumbuhan sangat beragam dan dapat diklasifikasikan dalam
beberapa golongan senyawa bahan alam yaitu alkaloid, flavonoid, terpenoid,
Dalam perkembangannya senyawa metabolit sekunder tersebut dipelajari
dalam disiplin ilmu tersendiri yaitu kimia bahan alam (natural product chemistry).
Contoh metabolit sekunder adalah antibiotik, pigmen, toksik, efektor kompetisi
ekologi dan simbiosis, feromon, inhibitor enzim, agen immunemodulasi, reseptor
antagonis dan agonis, pestisida, agen antitumor, dan promotor pertumbuhan
binatang dan tumbuhan. Identifikasi kandungan metabolit sekunder merupakan
langkah awal yang penting dalam penelitian pencarian senyawa bioaktif baru dari
bahan alam yang dapat menjadi prekursor bagi sintesis obat baru atau prototipe
obat beraktivitas tertentu (Rasyid, 2012). Identifikasi ini merupakan uji fitokimia.
Metode yang dilakukan merupakan metode uji berdasarkan yang telah
dimodifikasi. Uji yang dilakukan antara lain uji flavonoid, senyawa fenolik,
alkaloid, saponin, tanin dan terpenoid (Harbone, 1987).
2.2.1 Flavonoid
Flavonoid merupakan golongan terbesar dari senyawa fenol, senyawa fenol
mempunyai sifat efektif menghambat pertumbuhan virus, bakteri, dan jamur.
Khunaifi (2010) menambahkan bahwa senyawa-senyawa flavonoid umumnya
bersifat antioksidan dan banyak telah digunakan sebagai salah satu komponen
bahan baku obat-obatan. Senyawa flavonoid dan turunannya memiliki dua fungsi
fisiologi tertentu, yaitu sebagai bahan kimia untuk mengatasi serangan penyakit
(sebagai antibakteri) dan anti virus bagi tanaman. Para peneliti lain juga
menyatakan pendapat sehubungan dengan mekanisme kerja dari flavonoid dalam
menghambat pertumbuhan bakteri, antara lain bahwa flavanoid terjadinya
kerusakan permeabilitas dinding sel bakteri (Sabir, 2008). Didukung juga dengan
penelitian Mirzoeva et al, (1997) mendapatkan bahwa flavanoid mampu
menghambat motilitas bakteri.
Flavonoida pada tumbuhan berfungsi dalam pengaturan fotosintesis, kerja
antimikroba dan antivirus dan kerja terhadap serangga (Robinson, 1995). Adapun
fungsi flavonoida dalam kehidupan manusia yaitu sebagai stimulant pada jantung,
hesperidin mempengaruhi pembuluh darah kapiler. Flavon terhidrolisasi bekerja
2.2.2 Tanin
Tanin merupakan salah satu metabolit sekunder yang dapat digunakan tumbuhan
untuk melindungi dari serangan bakteri dari cendawan (Salisbury, 1995).
Secara kimiawi tanin merupakan kompleks, biasanya merupakan campuran
polifenol yang sulit dipisahkan karena tidak mengkristal. Apabila tanin
direaksikan dengan air membentuk larutan koloid yang memberikan reaksi asam
dan reaksi yang tajam (Harborne, 1996). Tanin memiliki peranan fisiologis yang
kompleks mulai dari pengendap protein hingga pengkhelat logam. Tanin juga
dapat berfungsi sebagai antioksidan biologis (Hagerman, 2002).
Secara kimia terdapat dua jenis tanin yang tersebar tidak merata dalam
dunia tumbuhan yaitu tanin terkondensasi (Proantosianidin) dan tanin terhidrolisis
(Hydrolyzable tannin) (Harbone, 1987). Kedua golongan tanin menunjukkan
reaksi yang berbeda dalam larutan garam Fe (III). Tanin terkondensasi
menghasilkan warna hijau kehitaman sedangkan tanin terhidrolisis memberikan
biru kehitamanan.
1. Tanin terhidrolisis
Tanin terhidrolisis biasanya berupa senyawa amorf, higrokopis, berwarna coklat
kuning yang larut dalam air (terutama air panas) membentuk larutan koloid bukan
larutan sebenarnya. Makin murni tanin, makin kurang kelarutannya dalam air dan
makin mudah diperoleh dalam bentuk kristal. Tanin ini larut dalam pelarut
organik yang polar, tetapi tidak larut dalam pelarut organik nonpolar seperti
benzene atau kloroform (Robinson, 1995).
2. Tanin terkondensasi
Tanin terkondensasi secara biosintesis dapat dianggap terbentuk dengan cara
kondensasi katekin tunggal (galokatekin) yang membentuk senyawa dimer dan
kemudian oligimer yang lebih tinggi. Proantosianidin merupakan nama lain dari
tanin terkondensasi karena jika direaksikan dengan asam panas, beberapa ikatan
karbon penghubung satuan terputus dan dibebaskanlah monomer antosianidin
2.2.3 Biosintesa Senyawa Flavonoida dan Tanin
Biosintesis dari flavonoida, stilbene, hidroksisinamat dan asam fenolik meliputi
jaringan yang kompleks berdasarkan prinsip jalur sikimat, phenilpropanoid dan
flavonoid (Gambar 2.3).
Struktur flavonoid (C6- C3- C6) adalah produk dari 2 jalur biosintesis yang
terpisah (Gambar 2.2). Jembatan dan cincin-B aromatik merupakan sintesis unit
phenilpropanoid dari p-kumaril-CoA. Enam karbon dari cincin-A berasal dari
hasil kondensasi dari 3 unit asetat melalui jalur asam malonat. Fusi dari dua
bagian ini merupakan tahap reaksi kondensasi dari p-kumaril-CoA dengan residu
3 malonil CoA yang masing-masing mendonorkan dua atom karbon, didalam
reaksi ini dikatalis oleh chalcone synthase (CHS). Produk dari reaksi ini adalah
naringenin-chalcone. Sedikit modifikasi dalam jalur ini merupakan dalam
produksi isoflavon, seperti daidzein, yang berasal dari isoliquiritigenin tidak
sepertti naringenin-chalcone, kelompok 2’-hidroksil (Dixon, 2004). Bentuk dari
isoliquiritigenin dikatalis oleh chalcone reduktase, sepertienzim NADPH yang
mungkin berinteraksi dengan CHS (Welle and Grisebach,1998). Langkah
selanjutnya dalam jalur biosintesis flavonoid adalah konversi stereospesifik pada
naringenin-chalcone menjadi naringenin oleh chalcone isomerase (CHI). Pada
kacangan, CHI juga mengkatalis konversi dari isoliquritingenin menjadi
liquiritigenin (Forkmann and Heller, 1999). Isomerasi dari naringenin-chalcone
menjadi naringenin adalah sangat cepat daripada isomerasi dari isoliquiritigenin
menjadi liquiritigenin. Sebagi konsekuensi, CHI telah dikelompokkan menjadi 2
kelompok, tipe pertama CHI, yang ditemukan pada legumes dan tidak legumes,
termasuk 2’-deoksi dan 2’-hidrokalkon sebagai substrat (Shimada et al, 2003). Naringenin adalah perantara utama dari jalur utama biosintesis flavonoid
yang menyimpang menjadi beberapa cabang samping yang menghasilkan kelas
yang berbeda dari flavonoid termasuk isoflavon, flavanon, flavon, flavonol, dan
Gambaran sistematik untuk menghasilkan stilbene dan flavonoid dapat dilihat
pada gambar 2.2 dibawah.
Asam galat dibentuk terutama melalui jalur asam sikimat dari asam
3-dehidroksinamat (Gambar 2.3) meskipun ada jalur alternatif dari asam hidroksi
benzoat. Alternatif dari produk fotosintesis yang disalurkan melalui jalur sikimat
adalah untuk asam 3-dehidroksinamat diubah menjadi L-fenilalanin dan dilajutkan
jalur fenilpropanoid (Gambar 2.3). Katalis fenilalanin amonia- liase adalah
langkah awal dari jalur ini, konversi dari L-fenilalanin menjadi asam sinamat,
yang mana reaksi ini dikatalis oleh sinamat 4-hidroksi dikonversi menjadi asam
coumric yang akan dimetabolime menjadi coumaroyl-CoA dengan
p-coumaric:CoA ligase. Asam sinamat juga dimetabolisme menjadi asam benzoat
dan asam salisilat dengan katalis asam 2-hidroksi benzoat, muncul hanya untuk
menjadi signifikan dalam tanaman tahan penyakit dimana infeksi menyebabkan
akumulasi dari asam salisilat (Crozier et al, 2000). asam p-coumaric juga di
metabolime melalui jalur dari reaksi hidroksilasi dan metilasi menjadi caffeic,
ferulic, 5- hidroxyferulic dan sinapic acids. Asam sinapic dan ferulic adalah
prekursor dari lignin. Awalnya diperkirakan caffeic acids prekursor dari 5-O-
caffeoylquinic acids, komponen dasar dari sayuran dan buahbuahan.
Bagaimanapun, studi biologi molekuler terbaru menunjukkan bahwa jalur utama
untuk 5-O- caffeoylquinic acids dan mungkin terkait dengan caffeoylquinic acids,
adalah dari p-coumaroyl-CoA melalui 5-O- caffeoylquinic acids (Gambar 2.3)
(Hoffman et al, 2004). p-coumaroyl-CoA juga penting untuk sintesis dari senyawa
Skematis dari jalur utama dalam biosintesa tanin terhidrolisa, asam salisilat,
hidroksinamat, dan asam 5-caffeoylquinic dapat dilihat pada gambar 2.3 dibawah.
Gambar 2.3 Skematis biosintesa dari tanin terhirolisa, asam salisilat,
2.2.4 Alkaloid
Alkaloid merupakan senyawa kimia bersifat basa yang mengandung satu atau
lebih atom nitrogen, umumnya tidak berwarna, dan berwarna jika mempunyai
struktur kompleks dan bercincin aromatik. Alkaloid pada umumnya juga
mempunyai kereaktifan fisiologi yang menonjol, sehingga oleh manusia alkaloida
sering dimanfaatkan sebagai pengobatan. Secara kimia, alkaloid merupakan suatu
golongan heterogen. Secara fisik, alkaloida dipisahkan dari kandungan tumbuhan
lainnya sebagai garamnya dan sering diisolasi sebagai kristal hidroklorida atau
pikrat (Harbone, 1987).
Alkaloid merupakan golongan zat tumbuhan sekunder yang terbesar.
Alkaloid memiliki kemampuan sebagai antibakteri. Mekanisme yang diduga
adalah dengan cara mengganggu komponen penyusun peptidoglikan pada sel
bakteri, sehingga lapisan dinding sel terbentuk secara utuh dan menyebabkan
kematian sel tersebut (Robinson, 1995).
Alkaloid tanaman diturunkan saat ini digunakan secara klinis termasuk
analgesik, agen anti-neoplastik, relaksan otot, antivirus, sitotoksik, antinosiseptik,
antiinflamasi (Seifu et al, 2002)
Menurut Hegnauer, alkaloid dikelompokkan sebagai berikut :
a. Alkaloid sesungguhnya
Alkaloid sesungguhnya adalah racun, senyawa tesebut menunjukkan aktivitas
phisiologi yang luas, hampir tanpa terkecuali bersifat basa ; lazim menggunakan
nitrogen dalam cincin heterosiklis, diturunkan dari asam amino, biasanya terdapat
dalam tanaman sebagai garam basa organik. Beberapa perkecualian terhadap
aturan tersebut adalah kolkhisin dan asam aristolokhat yang bersifat bukan basa
dan tidak memiliki cincin heterosiklis dan alkaloid kuartener yang bersifat agak
asam.
b. Protoalkaloid
Protoalkaloid merupakan amin yang relatif sederhana dimana nitrogen asam
amino tidak terdapat dalam cincin heterosiklis. Protoalkaloid diperoleh
berdasarkan biosintesis dari asam amino yang bersifat basa. Contoh meskalin,
c. Pseudoalkaloida
Pseudoalkaloida tidak diturunkan dari prekursor asam amino. Senyawa biasanya
bersifat basa. Ada dua seri alkaloid yang penting dalam kelas ini, yaitu alkaloid
stereoidal (contoh konnesin, purin dan kafein ) (Sastrohamidjojo, 1996).
Biosintesa benzilisoquinonlin alkaloid dimulai dengan dekarboksilasi orto
hiroksilasi dan penjumlahan dengan mengubah tirosin dan keduanya antara
dopamin dan 4 hidroksipenilasetaldehid (4-HPAA) (gambat 2.4). molekul klon
untuk aromatik asam L amino dekarboksilase (TYDC) yang diubah oleh tirosin
dan dopa ke masing masing bagian yang akan diisolasi. Norcocluasin mengalami
pendinginan oleh dopamine dan 4-HPAA menjadi (S) –horcocluadin. Pusat
prekursor ke semua benzylisoquinolin alkaloid dalam tanaman (S)-horcoclaudin
diubah menjadi (S) retikulin oleh 6-O metiltransferase (60MT). N-metil
transferase (CNMT) hidroksilase puso (CYP80B) dan 4’-O metiltransferase
(4’OMT). Molekul klon yang telah diisolasi pada setiap enzim yang terlibat didalamnya mengalami perubahan menjadi (S) norcoclausin ke (S) reikulisin yang
bercabang dalam biosintesa dengan perbedaan oleh benzylisoquinon alkaloid
(Facchini, 2001). Intermediate (S) retikulin juga digunakan sebagai prekursor
lebih dari 270 dimerik bisbenzylisoquinon alkaloid sebagai (+) tubocuranin.
Molekul klon untuk puso tergantung oxida (CYPPOA) yang merupakan pasangan
(R) N metil kockairin menjadi R atau S N metilcoclamin menjadi
bisbenzilisoquinolin alkaloid masing masing diisolasi dari jaringan.Banyak
difokuskan pada cabang bagian benzophenuntridine alkaloid seperti sanguinasin,
protobarbier alkaloid, atau barberin dengan morphinan alkaloid seperti morfin.
Enzim yang sangat berpengaruh dalam kelima molekul klon yang telah diisolasi
(gambar 2.4).Tahap pertama benzopenantridin dan protoberberin biosintesa
alkaloid yang mengubah (S)-retikulin menjadi (S)-scoulerin oleh enzim berberin
Biosintesa dari benzylisoquionoline alkaloid dapat ditunjukkan pada gambar 2.4.
Gambar 2.4 Biosintesia dari benzylisoquinoline alkaloid (Crozier, A, 2006).
2.2.5 Terpenoid
Terpenoid adalah merupakan komponen-komponen tumbuhan yang mempunyai
bau dan dapat diisolasi dari bahan nabati dengan penyulingan disebut sebagai
minyak atsiri. Minyak atsiri yang berasal dari bunga pada awalnya dikenal dari
penentuan struktur secara sederhana, yaitu dengan perbandingan atom hidrogen
dan atom karbon dari suatu senyawa terpenoid yaitu 8 : 5 dan dengan
perbandingan tersebut dapat dikatakan bahwa senyawa tersebut adalah golongan
Terpenoid tumbuhan mempunyai manfaat penting sebagai obat tradisional,
anti bakteri, anti jamur, dan gangguan kesehatan (Thomson, 1993). Beberapa hasil
penelitian menunjukkan bahwa senyawa terpenoid dapat menghambat
pertumbuhan dengan mengganggu proses terbentuknya membran dan atau dinding
sel, membran atau dinding sel tidak terbentuk atau terbentuk tidak sempurna
(Ajizah, 2004).
Biosintesis dari terpenoid pada tumbuhan mengikuti jalur asam asetat
mevalonat. Asam asetat yang diaktifkan oleh koenzim A membentuk asetilCoA
dan melakukan reaksi kondensasi dengan asetilCoA yang lain sehingga terbentuk
tiga unit gabungan dari asetilCoA yang selanjutnya diprotonasi membentuk asam
mevalonat. Dengan adanya pirofosfat pada asm mevalonat dapat terjadi pelepasan
komponen CO2 (dekarboksilasi) dan pelepasan OPP- membentuk isopentil
pirofosfat (IPP) dengan isomernya dimetilalil pirofosfat (DMAPP)
(Sjamsul,1986). Proses biosintesis terpenoid dapat dilihat pada gambar 2.5.
Gambar 2.5 Biosintesis Isopentil Pirofosfat (IPP) dan Isomernya Dimetilalil
Langkah selanjutnya antara IPP dan DMAPP terjadi reaksi adisi
membentuk geranil pirofosfat (C10) (Gambar 2.6). Geranil pirofosfat juga
mengalami reaksi adisi dengan satu unit IPP membentuk farsenil pirofosfat (C15).
Farsenil pirofosfat juga mengalami reaksi adisi dengan satu unit IPP membentuk
geranil-geranil pirofosfat (C30) (Sjamsul, 1986).
Biosintesis terpenoid dapat dilihat pada gambar 2.6.
Gambar 2.6 Biosintesis terpenoid (Sjamsul, 1986).
2.2.6 Saponin
Saponin merupakan glukosida yang larut dalam air dan etanol, tetapi tidak larut
dalam eter. Saponin bekerja sebagai antibakteri dengan mengganggu stabilitas
membran sel bakteri sehingga menyebabkan sel bakterilisis, jadi mekanisme kerja
saponin termasuk dalam kelompok antibakteri yang mengganggu pemeabilitas
membran sel bakteri, yang mengakibatkan kerusakan membran sel dan
menyebabkan keluarnya berbagai kompone penting dari dalam sel bakteri yaitu