PEMBUATAN, PENCIRIAN, DAN UJI APLIKASI
NANOKOMPOSIT BERBASIS MONTMORILONIT
DAN BESI OKSIDA
DIAN HAMSAH
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
PEMBUATAN, PENCIRIAN, DAN UJI APLIKASI
NANOKOMPOSIT BERBASIS MONTMORILONIT
DAN BESI OKSIDA
DIAN HAMSAH
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
DIAN HAMSAH. Pembuatan, Pencirian, dan Uji Aplikasi Nanokomposit
Berbasis Montmorilonit dan Besi Oksida. Dibimbing oleh TUTI SETIAWATI
SUDJANA dan ADEL FISLI.
Montmorilonit mampu menjerap kontaminan air, tetapi ia sulit dipisahkan
dari air karena membentuk suspensi bila kontak dengan air. Hal ini diatasi dengan
mengkompositkan montmorilonit dan besi oksida nanopartikel yang bersifat
magnet dapat berupa magemit atau magnetit.
Komposit dan besi oksida berukuran nanometer disintesis menggunakan
teknik kopresipitasi dengan metode pipet tetes. Pembuatan nanokomposit
diragamkan terhadap nisbah bobot montmorilonit-besi oksida, yaitu 2:1 dan 1:1.
Setiap varian dibuat pada dua suhu berbeda, yaitu suhu ruang dan 70
oC. Sintesis
nanokomposit dalam suasana N
2juga dilakukan dengan nisbah bobot
montmorilonit-besi oksida 2:1 dan suhu pembuatan 70
oC. Besi oksida
nanopartikel disintesis pada suhu ruang dan 70
oC tanpa tambahan montmorilonit.
ABSTRACT
DIAN HAMSAH. Synthesis, Characterization, and Application Test of
Nanocomposite Based on Montmorillonite and Iron Oxide. Under the direction of
TUTI SETIAWATI SUDJANA and ADEL FISLI.
Montmorillonite has the ability to adsorb water contaminants, but it is
difficult to be separated from water because it forms a suspension when exposed
to water. This problem can be eliminated by combining montmorillonite with
magnetic iron oxide nanoparticles such as magnetite and maghemite.
Composites and nanometer-size iron oxide were synthesized by a
coprecipitation technique using the pipette drop method. Nanocomposites were
synthesized using montmorilonite:iron oxide weight ratios of 2:1 and 1:1. The
variants were made at room temperature or 70
oC. Nanocomposite was also
synthesized in N
2atmosphere with montmorillonite:iron oxide weight ratio of 2:1
at 70
oC. Iron oxide nanoparticles without the addition of montmorillonite were
synthesized at room temperature and 70
oC.
Judul Skripsi : Pembuatan, Pencirian, dan Uji Aplikasi Nanokomposit Berbasis
Montmorilonit dan Besi Oksida
Nama :
Dian
Hamsah
NIM : G44202008
Disetujui
Dra. Tuti Setiawati Sudjana, MS. Drs. Adel Fisli, MSi.
Ketua Anggota
Diketahui
Prof. Dr. Ir. Yonny Koesmaryono
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
No one can go back and make a brand new start.
Anyone can start from now on and make a brand new
ending.
ALLAH didn’t promise days without pain, laughter
without sorrow, sun without rain.
But ALLAH did promise strength for the day, comfort for
the tears, and light for the way.
I dedicate this for my late father
Sayuti Pudji, my beloved mother Farida, my sisters K’ Anna and
K’ Anita, my niece Shafira, and my soul mate E-Krn.
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segala rahmat
dan karunia-Nya, sehingga penulis dapat menyelesaikan karya ilmiah ini. Tema
yang dipilih dalam penelitian ini adalah nanoteknologi dengan judul Pembuatan,
Pencirian, dan Uji Aplikasi Nanokomposit Berbasis Montmorilonit dan Besi
Oksida.
Karya ilmiah ini ditulis dengan maksud memberikan gambaran mengenai
perkembangan penelitian materi pada skala nanometer.
Dalam penyusunan laporan ini penulis banyak mendapatkan bantuan,
bimbingan, dan arahan. Oleh karena itu, penulis ingin mengucapkan terima kasih
kepada Dra. Tuti Setiawati Sudjana, MS dan Drs. Adel Fisli, MSi selaku
pembimbing yang telah memberikan bimbingan, pengarahan, serta semangat
dalam penelitian dan penyusunan karya tulis ini. Penghargaan penulis sampaikan
juga kepada Dr. Ridwan selaku Kepala Pusat Teknologi Bahan Industri Nuklir
(PTBIN) dan Dr. Setyo Purwanto selaku Kepala Bidang Karakterisasi Bahan.
Terima kasih yang sebesar-besarnya disampaikan kepada Dra. Mujamilah, MSc
serta seluruh staf Laboratorium Karakterisasi dan Analisis Nuklir, dan
Laboratorium Bahan Industri Nuklir, PTBIN, Badan Tenaga Nuklir Nasional
(BATAN) atas segala bantuan dan pengarahan yang telah diberikan. Selain itu,
ucapan terima kasih kepada seluruh staf Laboratorium Kimia Analitik, IPB atas
segala bantuan dan kemudahan yang diberikannya. Kepada sahabat setia, keluarga
B2, dan teman-teman Kimia 39 terima kasih atas segala bantuan, semangat, dan
perhatian yang diberikan serta kebersamaan yang tidak dapat dilupakan.
Ungkapan cinta dan terima kasih penulis sampaikan kepada ibunda, kakak-kakak,
dan keponakan atas pengorbanan, kasih sayang, dan doanya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Maret 2007
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 30 Oktober 1983 dari Bapak
Sayuti Pudji dan Ibu Farida Abdullah Abdad. Penulis merupakan anak kelima dari
lima bersaudara.
Tahun 2002 penulis lulus dari SMU Negeri 84 Jakarta dan pada tahun yang
sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB
(USMI). Penulis memilih Program Studi Kimia, Departemen Kimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Montmorilonit ... 1
Sifat Kemagnetan Bahan ... 2
Besi Oksida ... 3
Difraksi Sinar-X (XRD) ... 3
Magnetometri Getar Cuplikan (VSM) ... 4
Metode BET (Brunauer, Emmett, dan Teller) ... 4
Polarografi ... 5
BAHAN DAN METODE
Alat dan Bahan ... 5
Metode ... 5
HASIL DAN PEMBAHASAN
Pembuatan Montmorilonit-Besi Oksida Nanopartikel ………... 6
Pencirian ... 7
Uji Aplikasi ... 11
SIMPULAN DAN SARAN ... 12
DAFTAR PUSTAKA ... 12
DAFTAR TABEL
Halaman
1
Variasi pembuatan nanokomposit dan besi oksida nanopartikel ... 7
2
Puncak-puncak difraksi sinar-X pada besi oksida ……….. 7
3
Puncak-puncak difraksi sinar-X pada montmorilonit …………...……….. 8
DAFTAR GAMBAR
Halaman
1
Struktur unit partikel montmorilonit ………... 2
2
Proses pembengkakan montmorilonit ketika ditambahkan air ………... 2
3
Proses pertukaran kation pada montmorilonit ………... 2
4
Struktur hematit ……….... 3
5
Struktur magnetit ……….. 3
6
Sistem Magnetometri Getar Cuplikan ...……….. 4
7
Pemisahan nanokomposit dari larutan ……….. 6
8
Proses pembentukan nanokomposit ... 7
9
Pola difraksi sinar-X untuk montmorilonit, besi oksida nanopartikel, dan
nanokomposit
……….... 8
10
Pola difraksi sinar-X dari magemit (
γ
-Fe2O3) nanopartikel
(a) metode pipet tetes, (b) metode nozel piezoelektrik ……….... 8
11
Sampel A, B, D, dan E ketika dikenakan medan magnet ……... 9
12
Hasil pengukuran VSM untuk sampel
A
,
B
,
C
,
D
,
E
,
F
, dan
G
……….. 9
13
Luas permukaan spesifik montmorilonit, sampel A, B, C,
dan E ………... 11
14 Proses pengumpulan kembali sampel E dengan menggunakan magnet
setelah menjerap standar Pb
2+……….………..…...………….... 11
15
Kemampuan penjerapan sampel E terhadap Pb
2+……….... 11
PEMBUATAN, PENCIRIAN, DAN UJI APLIKASI
NANOKOMPOSIT BERBASIS MONTMORILONIT
DAN BESI OKSIDA
DIAN HAMSAH
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
PEMBUATAN, PENCIRIAN, DAN UJI APLIKASI
NANOKOMPOSIT BERBASIS MONTMORILONIT
DAN BESI OKSIDA
DIAN HAMSAH
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
DIAN HAMSAH. Pembuatan, Pencirian, dan Uji Aplikasi Nanokomposit
Berbasis Montmorilonit dan Besi Oksida. Dibimbing oleh TUTI SETIAWATI
SUDJANA dan ADEL FISLI.
Montmorilonit mampu menjerap kontaminan air, tetapi ia sulit dipisahkan
dari air karena membentuk suspensi bila kontak dengan air. Hal ini diatasi dengan
mengkompositkan montmorilonit dan besi oksida nanopartikel yang bersifat
magnet dapat berupa magemit atau magnetit.
Komposit dan besi oksida berukuran nanometer disintesis menggunakan
teknik kopresipitasi dengan metode pipet tetes. Pembuatan nanokomposit
diragamkan terhadap nisbah bobot montmorilonit-besi oksida, yaitu 2:1 dan 1:1.
Setiap varian dibuat pada dua suhu berbeda, yaitu suhu ruang dan 70
oC. Sintesis
nanokomposit dalam suasana N
2juga dilakukan dengan nisbah bobot
montmorilonit-besi oksida 2:1 dan suhu pembuatan 70
oC. Besi oksida
nanopartikel disintesis pada suhu ruang dan 70
oC tanpa tambahan montmorilonit.
ABSTRACT
DIAN HAMSAH. Synthesis, Characterization, and Application Test of
Nanocomposite Based on Montmorillonite and Iron Oxide. Under the direction of
TUTI SETIAWATI SUDJANA and ADEL FISLI.
Montmorillonite has the ability to adsorb water contaminants, but it is
difficult to be separated from water because it forms a suspension when exposed
to water. This problem can be eliminated by combining montmorillonite with
magnetic iron oxide nanoparticles such as magnetite and maghemite.
Composites and nanometer-size iron oxide were synthesized by a
coprecipitation technique using the pipette drop method. Nanocomposites were
synthesized using montmorilonite:iron oxide weight ratios of 2:1 and 1:1. The
variants were made at room temperature or 70
oC. Nanocomposite was also
synthesized in N
2atmosphere with montmorillonite:iron oxide weight ratio of 2:1
at 70
oC. Iron oxide nanoparticles without the addition of montmorillonite were
synthesized at room temperature and 70
oC.
Judul Skripsi : Pembuatan, Pencirian, dan Uji Aplikasi Nanokomposit Berbasis
Montmorilonit dan Besi Oksida
Nama :
Dian
Hamsah
NIM : G44202008
Disetujui
Dra. Tuti Setiawati Sudjana, MS. Drs. Adel Fisli, MSi.
Ketua Anggota
Diketahui
Prof. Dr. Ir. Yonny Koesmaryono
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
No one can go back and make a brand new start.
Anyone can start from now on and make a brand new
ending.
ALLAH didn’t promise days without pain, laughter
without sorrow, sun without rain.
But ALLAH did promise strength for the day, comfort for
the tears, and light for the way.
I dedicate this for my late father
Sayuti Pudji, my beloved mother Farida, my sisters K’ Anna and
K’ Anita, my niece Shafira, and my soul mate E-Krn.
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segala rahmat
dan karunia-Nya, sehingga penulis dapat menyelesaikan karya ilmiah ini. Tema
yang dipilih dalam penelitian ini adalah nanoteknologi dengan judul Pembuatan,
Pencirian, dan Uji Aplikasi Nanokomposit Berbasis Montmorilonit dan Besi
Oksida.
Karya ilmiah ini ditulis dengan maksud memberikan gambaran mengenai
perkembangan penelitian materi pada skala nanometer.
Dalam penyusunan laporan ini penulis banyak mendapatkan bantuan,
bimbingan, dan arahan. Oleh karena itu, penulis ingin mengucapkan terima kasih
kepada Dra. Tuti Setiawati Sudjana, MS dan Drs. Adel Fisli, MSi selaku
pembimbing yang telah memberikan bimbingan, pengarahan, serta semangat
dalam penelitian dan penyusunan karya tulis ini. Penghargaan penulis sampaikan
juga kepada Dr. Ridwan selaku Kepala Pusat Teknologi Bahan Industri Nuklir
(PTBIN) dan Dr. Setyo Purwanto selaku Kepala Bidang Karakterisasi Bahan.
Terima kasih yang sebesar-besarnya disampaikan kepada Dra. Mujamilah, MSc
serta seluruh staf Laboratorium Karakterisasi dan Analisis Nuklir, dan
Laboratorium Bahan Industri Nuklir, PTBIN, Badan Tenaga Nuklir Nasional
(BATAN) atas segala bantuan dan pengarahan yang telah diberikan. Selain itu,
ucapan terima kasih kepada seluruh staf Laboratorium Kimia Analitik, IPB atas
segala bantuan dan kemudahan yang diberikannya. Kepada sahabat setia, keluarga
B2, dan teman-teman Kimia 39 terima kasih atas segala bantuan, semangat, dan
perhatian yang diberikan serta kebersamaan yang tidak dapat dilupakan.
Ungkapan cinta dan terima kasih penulis sampaikan kepada ibunda, kakak-kakak,
dan keponakan atas pengorbanan, kasih sayang, dan doanya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Maret 2007
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 30 Oktober 1983 dari Bapak
Sayuti Pudji dan Ibu Farida Abdullah Abdad. Penulis merupakan anak kelima dari
lima bersaudara.
Tahun 2002 penulis lulus dari SMU Negeri 84 Jakarta dan pada tahun yang
sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB
(USMI). Penulis memilih Program Studi Kimia, Departemen Kimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Montmorilonit ... 1
Sifat Kemagnetan Bahan ... 2
Besi Oksida ... 3
Difraksi Sinar-X (XRD) ... 3
Magnetometri Getar Cuplikan (VSM) ... 4
Metode BET (Brunauer, Emmett, dan Teller) ... 4
Polarografi ... 5
BAHAN DAN METODE
Alat dan Bahan ... 5
Metode ... 5
HASIL DAN PEMBAHASAN
Pembuatan Montmorilonit-Besi Oksida Nanopartikel ………... 6
Pencirian ... 7
Uji Aplikasi ... 11
SIMPULAN DAN SARAN ... 12
DAFTAR PUSTAKA ... 12
DAFTAR TABEL
Halaman
1
Variasi pembuatan nanokomposit dan besi oksida nanopartikel ... 7
2
Puncak-puncak difraksi sinar-X pada besi oksida ……….. 7
3
Puncak-puncak difraksi sinar-X pada montmorilonit …………...……….. 8
DAFTAR GAMBAR
Halaman
1
Struktur unit partikel montmorilonit ………... 2
2
Proses pembengkakan montmorilonit ketika ditambahkan air ………... 2
3
Proses pertukaran kation pada montmorilonit ………... 2
4
Struktur hematit ……….... 3
5
Struktur magnetit ……….. 3
6
Sistem Magnetometri Getar Cuplikan ...……….. 4
7
Pemisahan nanokomposit dari larutan ……….. 6
8
Proses pembentukan nanokomposit ... 7
9
Pola difraksi sinar-X untuk montmorilonit, besi oksida nanopartikel, dan
nanokomposit
……….... 8
10
Pola difraksi sinar-X dari magemit (
γ
-Fe2O3) nanopartikel
(a) metode pipet tetes, (b) metode nozel piezoelektrik ……….... 8
11
Sampel A, B, D, dan E ketika dikenakan medan magnet ……... 9
12
Hasil pengukuran VSM untuk sampel
A
,
B
,
C
,
D
,
E
,
F
, dan
G
……….. 9
13
Luas permukaan spesifik montmorilonit, sampel A, B, C,
dan E ………... 11
14 Proses pengumpulan kembali sampel E dengan menggunakan magnet
setelah menjerap standar Pb
2+……….………..…...………….... 11
15
Kemampuan penjerapan sampel E terhadap Pb
2+……….... 11
2
Stoikiometri dalam pembuatan besi oksida (Fe3O4) ………..….. 15
3 Kalibrasi
Peniter
………...…... 16
4 Kalibrasi
metode
square wave voltammetry (SWV) yang diukur pada
daerah potensial -0.3 sampai -0.5 ……….…...…. 17
5
Contoh kurva yang dihasilkan dari pengukuran Pb
2+menggunakan
metode square wave voltammetry (SWV) diukur pada
daerah potensial -0.3 sampai -0.5 V ………...……….. 18
6
Hasil difraksi sinar-X dari magemit PCPDFWIN versi 1.30
International Centre of Diffraction Data (1997),
nomor arsip 03-086 ……….. 19
7
Hasil difraksi sinar-X dari magemit PCPDFWIN versi 1.30
International Centre of Diffraction Data (1997),
nomor arsip 39-1346 ……… 20
8
Hasil difraksi sinar-X dari montmorilonit PCPDFWIN versi 1.30
International Centre for Diffraction Data (1997), nomor arsip 02-0014,
03-0014, dan 13-0135 ………..…….... 21
1
PENDAHULUAN
Penelitian mengenai nanokomposit kini sedang marak dikembangkan di berbagai bidang, seperti biologi, kimia, elektronik, industri, dan sebagainya. Nanokomposit adalah suatu bahan yang dibuat dari penggabungan antara dua komponen berbeda yang salah satu atau keduanya berskala nanometer (10-9 meter) atau setara dengan ukuran atom dan molekul. Nanokomposit dibuat untuk meningkatkan sifat individu bahan, baik dari segi kekuatan, struktur, atau stabilitas sehingga diperoleh bahan baru dengan kualitas yang lebih baik (Netcomposites 2007).
Montmorilonit adalah sejenis mineral yang terbentuk dari proses alam abu vulkanik. Struktur montmorilonit berbentuk lembaran, setiap lembaran terdiri atas dua lapisan tetrahedral (silikat) saling berhadapan dan satu lapisan oktahedral (aluminium) berada di antaranya sehingga membentuk struktur seperti sandwich. Bahan ini termasuk nanopartikel karena ketebalan setiap lembarannya mendekati 1 nm dan memiliki panjang yang bervariasi, yaitu sekitar 0.2–2 µm. Adanya substitusi Si4+ dengan Al3+ pada lapisan tetrahedral,
dan substitusi Al3+ dengan Mg2+ pada lapisan oktahedral menyebabkan terbentuknya muatan negatif di setiap permukaan lembaran montmorilonit. Muatan negatif tersebut dinetralkan oleh kation-kation, seperti Na+, K+, Ca2+, dan Mg2+. Kation-kation ini menempati ruang antar lembaran montmorilonit dan mudah dipertukarkan dengan kation lain. Hal ini menyebabkan tidak hanya zat beracun yang dapat menempel di permukaan, tetapi berbagai jenis unsur dan bahan organik juga dapat menempati ruang antar lembarnya (Wikipedia 2006).
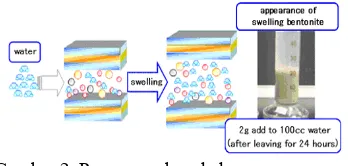
Montmorilonit banyak digunakan untuk bahan kosmetik, keramik, semen, cat, dan sebagainya. Sifat adsorptif dan absorptifnya juga sangat berguna dalam pemurnian air serta dapat melindungi air tanah dari kontaminan. Akan tetapi, montmorilonit memiliki sifat koloid yang tinggi, ukurannya dapat membesar sampai beberapa kali lipat jika kontak dengan air, dan membentuk suspensi sehingga sulit dipisahkan dari air (Ima-eu 2006).
Jenis besi oksida yang bersifat magnet adalah magnetit (Fe3O4) dan magemit (γ
-Fe2O3). Sintesis magnetit dan magemit
dalam skala nanometer telah banyak
dilakukan dengan berbagai metode, antara lain metode reaksi sol-gel, larutan kimia,
sonochemical, dan kopresipitasi (Lee et al.
2004). Penelitian ini membuat besi oksida nanopartikel yang bersifat magnet dengan menggunakan metode kopresipitasi untuk digabungkan dengan montmorilonit sehingga membentuk nanokomposit. Salah satu penerapan nanokomposit ini adalah pada pemurnian air. Montmorilonit dalam nanokomposit tersebut akan berfungsi sebagai penjerap kontaminan air, sedangkan besi oksida nanopartikel berfungsi sebagai magnet yang dapat dikendalikan dari luar komposit. Hal ini menyebabkan montmorilonit beserta kontaminan yang terjerap dapat dipisahkan dari air dan dapat diperoleh air yang bebas dari kontaminan.
Penelitian ini bertujuan membuat nanokomposit berbasis montmorilonit dan besi oksida nanopartikel, menguji sifat kemagnetannya, dan kemampuan penjerapannnya terhadap kontaminan air khususnya Pb2+.
Melalui pembuatan nanokomposit ini, kelemahan montmorilonit yang membentuk suspensi bila kontak dengan air dapat diatasi sehingga dapat diterapkan dalam proses pemurnian air.
TINJAUAN PUSTAKA
Montmorilonit
Montmorilonit adalah bahan penyusun utama dari bentonit yang terdapat pada debu vulkanik dan banyak digunakan untuk bahan kosmetik, keramik, semen, cat dan sebagainya. Sifat adsorptif dan absorptifnya juga sangat berguna dalam pemurnian air serta dapat melindungi air tanah dari kontaminan. Bahkan, montmorilonit digunakan di bidang obat-obatan sebagai penawar untuk keracunan logam berat (Ima-eu 2006).
Montmorilonit atau natrium kalsium alumunium magnesium silikat hidroksida terhidrasi yang memiliki rumus molekul (Na, Ca)(Al, Mg)6(Si4O10)3(OH)6 · nH2O ini
2
(2005), susunan lembar tiga lapis tersebut memungkinkan adanya air antar lembar atau kation antar lembar. Substitusi Si4+ dengan Al3+ pada lapisan tetrahedral dan substitusi Al3+ dengan Mg2+ pada lapisan oktahedral menyebabkan terbentuknya muatan negatif di dua permukaan lembarannya. Substitusi ini disebut substitusi isomorfik, yaitu proses substitusi kation dengan kation lain tanpa mengubah susunan kristalnya. Muatan negatif tersebut dinetralkan oleh kation-kation (Na+, K+, Ca2+, dan Mg2+) yang
terdapat pada bagian antar lembarannya. Struktur ini yang menyebabkan montmorilonit bersifat stabil (Kunimine 2006).
Gambar 1 Struktur unit partikel montmorilonit.
Montmorilonit dapat membengkak atau volumenya membesar hingga dua kali volume asalnya apabila kontak dengan air. Pembengkakan ini disebabkan oleh penyerapan air dalam ruang antarlembarnya (Notodarmojo 2005). Menurut Kunimine (2006), pembengkakan terjadi karena interaksi antara kation dalam ruang antarlembar montmorilonit dengan molekul air. Kekuatan ikatan antara permukaan bermuatan negatif dengan kation dalam ruang antarlembar montmorilonit lebih rendah dibandingkan dengan interaksi energi antara kation dalam antarlembar dan molekul air sehingga celah antar lapisan melebar ketika kation dalam antarlembar menarik molekul air. Jika interaksi antara kation antarlembar dengan air mencapai batasnya, maka pembengkakan berhenti dengan sendirinya (Kunimine 2006).
Gambar 2 Proses pembengkakan montmorilonit ketika ditambahkan air.
Pembengkakan pada montmorilonit juga disebabkan oleh kemampuannya sebagai penukar ion. Hal ini dikarenakan rendahnya kekuatan ikatan antara muatan negatif yang terdapat pada permukaan lempeng dengan kation dalam antarlembar montmorilonit sehingga pada saat montmorilonit berinteraksi dengan suatu larutan yang mengandung ion lain terjadi pertukaran antara kation antarlembar dengan kation larutan (Kunimine 2006).
Gambar 3 Proses pertukaran kation pada montmorilonit.
Sifat Kemagnetan Bahan
Atom terdiri atas inti atom yang dikelilingi elektron-elektron yang tersebar dalam kulit-kulit atom. Tiap kulit-kulit elektron suatu atom dibagi menjadi orbital atom, yaitu ruang di mana kebolehjadian ditemukannya sebuah elektron. Elektron mempunyai spin (+ ½ atau - ½) yang dapat menimbulkan medan magnet kecil atau momen magnet. Atom yang memiliki elektron berpasangan dengan spin yang berlawanan akan menghasilkan medan magnet yang saling meniadakan. Atom yang elektron-elektronnya tidak berpasangan akan memiliki momen magnet. Hal inilah yang mendasari perbedaan sifat kemagnetan pada suatu bahan (Ndt-ed 2007). Sifat kemagnetan bahan dikelompokkan menjadi lima golongan, yaitu diamagnetik, paramagnetik, feromagnetik, ferimagnetik, dan antiferomagnetik (Geo 2007).
Materi diamagnetik memiliki elektron-elektron yang berpasangan dan tidak menghasilkan momen magnet sehingga tidak memiliki sifat kemagnetan. Contoh bahan diamagnetik, yaitu tembaga, perak, emas, SiO2,
kalsit (CaCO3), dan air. Berbeda dengan
diamagnetik, sifat paramagnetik bahan disebabkan oleh keberadaan elektron-elektron yang tidak berpasangan di dalam orbitalnya dengan rangkaian spin yang tidak beraturan. Bahan paramagnetik memiliki sifat kemagnetan yang kecil. Contoh unsur paramagnetik, yaitu magnesium, molibdenum, litium, dan tantalum (Ndt-ed 2007).
3
materi feromagnetik, yaitu besi, nikel, kobalt, Ni3Fe, dan CoFe (Geo 2007).
Ferimagnetik terjadi pada senyawa yang memiliki elektron-elektron tidak berpasangan, spinnya tersusun secara antiparalel dengan besar momen spin yang berbeda. Walaupun momen spinnya saling meniadakan, tetapi masih menghasilkan total momen magnet yang positif sehingga mempunyai sifat magnet yang besar. Senyawa ferimagnetik antara lain, magnetit, magemit, MnFe2O4, MgFe2O4, Fe7S8, Fe3S4,
dan γ-FeOOH (Geo 2007).
Antiferomagnetik terjadi pada senyawa yang mempunyai elektron-elektron tidak berpasangan dengan spin yang tersusun antiparalel dan momen setiap spin sama besar sehingga menyebabkan momen spin saling meniadakan dan menghasilkan momen magnet total nol. Hematit, Fe2TiO2,
FeTiO2, FeS, dan α-FeOOH merupakan
contoh dari senyawa antiferomagnetik (Geo 2007).
Besi Oksida
Besi oksida merupakan salah satu mineral penyusun fragmen batuan pada tanah. Besi oksida banyak digunakan sebagai zat pewarna, katalis, dan bahan utama pada pembuatan magnet. Menurut Notodarmojo (2005), besi oksida dapat menjerap logam berat, seperti Pb, Cu, dan Zn. Besi oksida tidak beracun, tetapi jika debunya terhirup dalam jumlah yang banyak dapat menyebabkan iritasi pada tenggorokan dan saluran pernapasan (Caryacademy 2006). Jenis-jenis besi oksida, antara lain hematit (α-Fe2O3), magemit (γ-Fe2O3), dan
magnetit (FeOFe2O3 atau Fe3O4).
Besi(III) oksida atau lebih dikenal dengan hematit adalah mineral primer atau mineral yang secara alami terdapat di dalam batuan. Mineral ini juga terdapat dalam bentuk selaput butir pasir, pengkerakan, dan bubuk yang tersebar dalam tanah (Darmawijaya 1990). Warnanya bervariasi mulai dari cokelat sampai cokelat kemerahan atau merah. Nama hematit sendiri berasal dari bahasa Yunani yang berarti merah darah, sesuai dengan warnanya yang menyerupai warna darah. Hematit memiliki struktur korundum dengan ion-ion oksigen dalam kemasan rapat heksagonal. Pada suhu di bawah -10oC, hematit akan memiliki momen magnet bernilai nol atau bersifat antiferomagnetik. Pada suhu di atas -10oC, hematit bersifat
feromagnetik lemah atau memiliki sifat kemagnetan yang kecil (Wikipedia 2006).
Gambar 4 Struktur hematit.
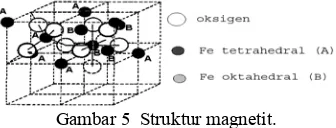
Besi(II, III) oksida atau magnetit merupakan mineral primer berwarna hitam dan bersifat ferimagnetik atau memiliki sifat kemagnetan yang tinggi. Magnetit memiliki struktur spinel dengan ion-ion oksigen dalam kemasan rapat kubus. Struktur magnetit mempunyai dua jenis ion Fe, yaitu Fe tetrahedral (Fe yang dikelilingi empat oksigen) dan Fe oktahedral (Fe yang dikelilingi oleh enam oksigen). Jika magnetit teroksidasi, maka magnetit akan berubah menjadi magemit. Magemit adalah isostruktur dari magnetit, berwarna coklat kemerahan, dan bersifat ferimagnetik (Wikipedia 2006).
Gambar 5 Struktur magnetit.
Difraksi Sinar-X (XRD)
Suatu atom terdiri atas sebuah inti dan sejumlah elektron. Elektron-elektron tersebut terdapat di dalam lapisan-lapisan atau kulit-kulit dengan elektron valensi yang terletak di kulit terluar. Apabila elektron yang bergerak cepat bertumbukan dengan sebuah atom, maka energi elektron tersebut digunakan untuk mengeluarkan sebuah elektron dari salah satu kulit bagian dalam atom sehingga terjadi ionisasi. Sebuah elektron yang memiliki tingkat energi lebih tinggi atau yang terdapat pada kulit bagian luar kemudian menempati orbital kosong tersebut. Selama proses perpindahan elektron dari tingkat energi tinggi ke tingkat energi yang lebih rendah, terjadi pelepasan energi berupa sinar-X. Panjang gelombang sinar-X yang dipancarkan bersifat khas terhadap unsur yang ditumbuk. Kisaran panjang gelombang sinar-X, yaitu antara 10-5 Å sampai 100 Å (Skoog et al.
1998).
4
hamburan kemudian terjadi interferensi dan jarak antara pusat hamburan sebanding dengan panjang gelombang radiasi. Hukum Bragg menyebutkan, ketika sinar-X mengenai permukaan kristal pada sudut θ, sebagian sinar dihamburkan oleh permukaan lapisan atom. Sinar yang tidak dihamburkan lapisan pertama menembus ke lapisan atom kedua dan sebagian dari fraksi tersebut dihamburkan lagi, dan seterusnya sampai ke lapisan berikutnya (Skoog et al. 1998).
Metode pengukuran difraksi sinar-X menggunakan sistem tabung sinar-X sebagai sumber, sampel, dan sebuah detektor yang berotasi dalam lingkaran Rowland. Sampel dimasukkan ke dalam tempat sampel lalu dirotasikan relatif terhadap sumber sinar-X pada kecepatan θo/menit. Radiasi terdifraksi datang dari sampel sesuai dengan persamaan Bragg dan penambahan θo/menit agar detektor secara simultan berotasi pada kecepatan 2θo/menit. Sinyal kemudian diteruskan ke detektor dan diolah oleh komputer sehingga diperoleh hasil kualitatif dan semikuantitatif.
Difraksi sinar-X dapat digunakan untuk mengidentifikasi struktur kristal dari berbagai senyawa padat, mengidentifikasi senyawa dari strukturnya, menentukan susunan molekul dalam sebuah kristal, serta dapat memperoleh informasi mengenai struktur logam dan jaringan makhluk hidup. Identifikasi tersebut diperoleh dari pola difraksi yang didasarkan pada posisi garis (dalam bentuk θ atau 2θ) dan intensitas relatifnya. Sudut difraksi dan panjang gelombang yang diperoleh secara eksperimental tersebut dapat digunakan untuk menentukan jarak antar bidang pendifraksi (d) dengan menggunakan persamaan Hukum Bragg, yaitu nλ = 2d sin
θ. Penetapan nilai d menggunakan persamaan Bragg merupakan dasar analisis kuantitatif dan dari nilai d pula dapat diidentifikasi jenis kristal sampel (Skoog et al. 1998).
Magnetometri Getar Cuplikan (VSM)
Semua bahan mempunyai momen magnet jika ditempatkan dalam medan magnet. Momen magnet per satuan volume dikenal sebagai magnetisasi. Prinsip pengukuran menggunakan VSM didasarkan pada metode induksi, yaitu mengukur magnetisasi dari signal yang ditimbulkan atau diinduksikan oleh cuplikan yang bergetar dalam lingkungan medan magnet pada sepasang kumparan (Users 2006).
Gambar 6 Sistem Magnetometri Getar Cuplikan.
Pengukuran dilakukan dengan meletakkan sampel pada medan magnet yang konstan. Jika sampel bersifat magnet, maka medan magnet yang konstan tersebut akan memagnetkan sampel. Semakin kuat medan magnet, semakin besar magnetisasinya. Momen magnet sampel membentuk medan magnet di sekitar sampel yang disebut dengan medan magnet sesatan. Ketika sampel bergerak naik turun, terjadi perubahan medan magnet sesatan dan dideteksi oleh kumparan pick-up atau kumparan analisis. Perubahan medan magnet menimbulkan medan listrik di dalam kumparan analisis. Arus listrik yang timbul bersifat proporsional terhadap magnetisasi sampel. Semakin besar magnetisasi, semakin besar arus imbasan (Txstate 2007). VSM digunakan untuk menentukan sifat-sifat magnet dari lapisan tipis dan kristal berukuran kecil (Drecam 2006).
Metode BET (Brunauer, Emmett, dan Teller)
BET merupakan singkatan dari Brunauer, Emmett, dan Teller, yaitu orang-orang yang menemukan cara untuk menentukan luas permukaan efektif suatu materi padat yang berbentuk rumit dengan menggunakan molekul gas terjerap sebagai pengukur. Salah satu sifat molekul gas adalah kecenderungannya untuk menempel pada permukaan materi sehingga luas permukaan materi dapat diketahui dari jumlah molekul gas yang terjerap. Jumlah molekul gas dapat ditentukan dengan isoterm adsorpsi atau desorpsinya. Isoterm adalah hubungan antara volume dan tekanan pada suhu tetap (British Broadcast Centre 2006).
5
lebih lemah dibandingkan dengan interaksi antara molekul dengan permukaan materi, lama-kelamaan molekul yang ditambahkan tidak dapat menempel lagi karena interaksinya terlalu lemah. Pada penambahan molekul gas inilah yang akan meningkatkan tekanan (British Broadcast Centre 2006).
Alat ukur BET terdiri atas ruang sampel yang terhubung dengan asupan gas, pompa vakum, dan barometer. Sampel dimasukkan ke dalam kompartemen sampel, gas pada jumlah tertentu dialirkan, kemudian secara otomatis akan terukur tekanannya. Persamaan BET adalah [Vm
/(p-p0)]1/V = 1/c[1/p+(c-1)/cp0]. V adalah
volume total molekul yang ditambahkan, Vm
volume molekul gas yang berinteraksi pada lapisan pertama, p adalah tekanan, po
tekanan uap jenuh, dan c merupakan konstanta yang berhubungan dengan kalor adsorpsi. Persamaan inilah yang mendasari penentuan luas permukan spesifik pada alat ukur BET (British Broadcast Centre 2006).
Polarografi
Polarografi adalah metode yang didasarkan pada hubungan antara arus yang mengalir dalam suatu larutan dan potensial yang dikenakan pada elektrode tetesan raksa
(dropping mercury electrode, DME). Arus
timbul apabila terjadi beda potensial di antara dua elektrode yang dicelupkan ke dalam suatu larutan, walaupun di dalam larutan tersebut tidak terdapat spesi elektroaktif, tetapi arus yang kecil tetap timbul akibat reaksi antara pelarut dan pengotor terlarut. Larutan yang mengandung berbagai ion logam tidak akan mengalami elektrolisis sampai potensial negatif yang dialirkan menjadi lebih negatif dibanding reduksi ion logam. Dasar dari polarografi adalah pengukuran perubahan arus pada suatu larutan dengan potensial yang kurang negatif dibandingkan potensial reduksinya dan dengan potensial yang lebih negatif dari potensial reduksi ion logam (Skoog et al.
1998).
Sel polarografi terdiri atas suatu elektrode pembanding besar yang tidak dapat terpolarisasi umumnya berupa elektrode kalomel jenuh (saturated calomel
electrode, SCE), satu elektrode kecil yang
mudah terpolarisasi berupa elektrode tetesan raksa (DME), sebuah kawat Pt sebagai
counter electrode atau elektrode pendukung,
dan larutan yang akan ditetapkan. Pada DME, raksa dibiarkan jatuh oleh gaya
beratnya sendiri melalui pipa kapiler sehingga terbentuk tetesan-tetesan raksa kontinu yang sama besarnya dan jatuh pada selang waktu yang teratur (2-6 detik). Pada polarografi goncangan-goncangan harus dihindari dan sel polarografi harus ditempatkan pada ruangan dengan temperatur yang konstan (Skoog et al.
1998).
Data yang dihasilkan dari polarografi adalah polarogram, yaitu berupa kurva hubungan antara potensial dengan arus. Nilai arus difusi yang diperoleh dari polarogram berbanding lurus dengan konsentrasi dari konstituen yang reaktif sehingga menjadi dasar analisis kuantitatif. Suatu zat yang aktif secara listrik ditandai oleh potensial setengah gelombang, yaitu potensial pada polarogram dengan arus I = ½ Id. Potensial setengah
gelombang (E1/2) karena sifatnya yang khas
untuk zat yang mengalami oksidasi dan reduksi pada elektroda mikro, maka dapat digunakan untuk mengidentifikasi suatu zat. Nilai E1/2
untuk suatu spesies tertentu dipengaruhi oleh elektrolit penunjang. Pemilihan elektrolit juga merupakan pertimbangan penting dalam analisis kualitatif (Khopkar 2002).
BAHAN DAN METODE
Alat dan Bahan
Alat-alat yang digunakan adalah neraca analitik, termometer, alat peniter, pemanas, pengaduk magnetik, ultrasonik, konduktometer, oven, sentrifus, x-ray diffractometer (XRD) Shimadzu XD-610, alat BET Quantachrome Corporation, OXFORD vibrating sample
magnetometer (VSM) tipe 1.2H, Polarografi
penganalisis EG&E Princeton Applied Research model 384B, dan peralatan kaca.
Bahan-bahan yang digunakan, ialah montmorilonit alam yang berasal dari Sukabumi koleksi Laboratorium Bahan Industri Nuklir BATAN, FeCl3 6H2O, FeSO4 7H2O, NaOH 5
M, metanol, etanol, magnet, gas N2, standar
Pb2+ (PbNO3), buffer asetat nitrat pH 4.5, dan
akuadem.
Metode
Penelitian ini terdiri atas tiga tahapan besar, yaitu pembuatan montmorilonit-besi oksida nanopartikel, pencirian, dan uji aplikasi (Lampiran 1).
6
200 ml larutan FeCl3 6H2O (7.8 g, 28 mmol)
dan FeSO4 7H2O (3.9 g, 14 mmol) pada
suhu 70oC, sehingga diperoleh nisbah bobot montmorilonit dengan besi oksida sebesar 2:1 (Lampiran 2). Suspensi tersebut ditambahkan tetes demi tetes NaOH 5 M sampai 100 ml (Oliveira et al. 2004). Penetesan dilakukan berdasarkan penelitian
Lee et al. (2004) dengan diameter pipet
sekitar 2000 µm dan laju penetesan konstan pada 2.4 ml/menit (Lampiran 3). Setelah itu nanokomposit dicuci dengan air demineral dan dikeringkan dalam oven suhu 100oC sehingga akan diperoleh nanokomposit yang memiliki sifat magnet (Oliveira et al. 2004). Pembuatan nanokomposit ini dilakukan dengan variasi suhu, yaitu suhu ruang, suhu 70oC, dan suhu 70oC dalam suasana N2
(keadaan inert). Nanokomposit juga dibuat dengan nisbah bobot montmorilonit dan besi oksida 1:1 pada suhu ruang dan 70oC. Sebagai pembanding bahan magnet besi oksida yang terbentuk, sintesis besi oksida juga dilakukan dengan menggunakan metode yang sama tanpa montmorilonit pada suhu ruang dan 70oC.
Pencirian. Besi oksida nanopartikel dan nanokomposit (montmorilonit-besi oksida nanopartikel) yang telah dipreparasi kemudian dicirikan menggunakan metode XRD (x-ray diffraction) untuk menentukan fase oksida besi yang terjerap di dalam montmorilonit, BET (Brunauer, Emmett dan Teller) untuk menentukan luas permukaan montmorilonit dan komposit, dan VSM
(vibrating sample magnetometry) untuk
menentukan sifat magnet dari komposit.
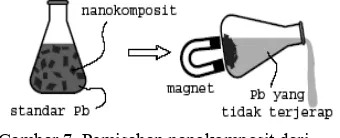
Gambar 7 Pemisahan nanokomposit dari larutan.
Uji Aplikasi. Nanokomposit hasil preparasi dimasukkan ke dalam 10 ml standar Pb2+ konsentrasi 50, 100, 200, 400, 600, 800, dan 1000 µg/ml. Ketujuh sampel tersebut diaduk kemudian didiamkan selama 24 jam. Setelah itu, komposit dipisahkan dari standar Pb2+ dengan bantuan magnet (Gambar 7). Kadar Pb2+ yang tidak terjerap di dalam komposit ditentukan dengan menggunakan metode Polarografi (Lampiran
4). Jumlah Pb2+ yang terjerap komposit diperoleh melalui selisih antara konsentrasi standar Pb2+ dengan konsentrasi Pb2+ yang tidak terjerap. Uji aplikasi hanya dilakukan terhadap nanokomposit yang memiliki sifat magnet terbesar.
HASIL DAN PEMBAHASAN
Pembuatan Montmorilonit-Besi Oksida Nanopartikel
Besi oksida nanopartikel dibuat dari penggabungan antara Fe3+ dan Fe2+ dengan nisbah mol 2:1. Nisbah mol 1Fe2+:2Fe3+ adalah stoikiometri yang dibutuhkan untuk membentuk Fe3O4. Penambahan NaOH bertujuan
membentuk Fe(OH)2 dan Fe(OH)3 (Waynert et
al. 2003). Reaksinya adalah sebagai berikut, Fe2+ + 2Fe3+ + 8OH- Fe(OH)2 (s)
+ 2Fe(OH)3 (s)
Penambahan NaOH melalui cara penetesan konstan dengan menggunakan pipet berdiameter 2000 µm dan laju penetesan 2.4 ml/menit dilakukan untuk memperoleh partikel besi oksida yang berukuran nanometer, yaitu berkisar 5-8 nm (Lee et al. 2004).
Pencucian dilakukan menggunakan akuadem sampai komposit tidak dapat memisah, dilanjutkan dengan pencucian menggunakan metanol dan etanol sampai nilai konduktivitasnya kurang dari 100 µS/cm. Pencucian bertujuan menghilangkan ion-ion sisa berupa kation dan anion terlarut yang ditandai dengan tingginya nilai konduktivitas. Pemanasan merupakan proses dehidrasi sehingga terbentuk FeOFe2O3 atau yang lebih
sering disebut dengan Fe3O4 (Waynert et al.
2003). Reaksinya adalah sebagai berikut, Fe(OH)2 (s) + 2Fe(OH)3 (s) FeOFe2O3(s)
+ 4H2O
Perlakuan variasi suhu pembuatan pada 25oC dan 70oC adalah untuk membandingkan sifat magnetnya.
7
pertukaran ion atau menempel pada permukaan montmorilonit yang bermuatan negatif. Fe3+ dan Fe2+ kemudian membentuk Fe(OH)2 dan Fe(OH)3 ketika ditambahkan
dengan NaOH. Setelah mengalami pemanasan, Fe(OH)2 dan Fe(OH)3
teroksidasi menjadi besi oksida (Fe3O4)
sehingga menghasilkan nanokomposit yang memiliki sifat magnet.
Gambar 8 Proses pembentukan nanokomposit.
Nanokomposit dibuat dengan menggabungkan montmorilonit dan besi oksida nanopartikel dengan nisbah bobot 1:1 dan 2:1, masing-masing dibuat pada suhu ruang dan 70oC. Nanokomposit dengan nisbah montmorilonit-besi oksida 1:1 suhu pembuatan 70oC juga disintesis pada
keadaan inert, yaitu dengan mengalirkan gas N2 yang bertujuan mencegah terjadinya
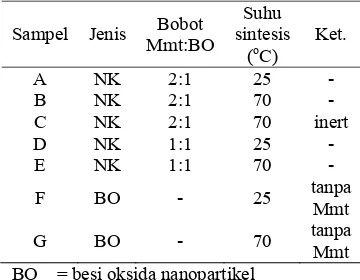
oksidasi Fe2+ menjadi Fe3+ selama proses pembuatan (Wikipedia 2006). Variasi pembuatan nanokomposit dan besi oksida nanopartikel dapat dilihat pada Tabel 1. Tabel 1 Variasi pembuatan nanokomposit
dan besi oksida nanopartikel
BO = besi oksida nanopartikel NK = nanokomposit
Mmt = montmorilonit
Pencirian
Hasil pencirian sampel menggunakan XRD dengan Cu sebagai target yang memiliki panjang gelombang 1.5405 Å dapat dilihat pada Gambar 9. Hasil XRD menunjukkan bahwa besi oksida
nanopartikel hasil sintesis pada suhu ruang dan 70oC (sampel F dan G) mempunyai puncak-puncak khas yang sama dengan magnetit program PCPDFWIN versi 1.30 International Centre for Diffraction Data (1997), nomor arsip 03-0863 (Lampiran 6). Akan tetapi, sampel F dan G tidak dapat dinyatakan sebagai magnetit karena berdasarkan basis data PCPDFWIN terdapat magemit dengan nomor arsip 39-1346 (Lampiran 7) yang memiliki pola difraksi seperti sampel F dan G. Hal ini diperkuat oleh hasil penelitian Lee et al. (2004) yang menghasilkan pola XRD γ-Fe2O3 (Gambar 10)
yang sangat mirip dengan sampel F dan G. Terbentuknya magemit dapat disebabkan oleh sebagian magnetit yang teroksidasi menjadi magemit. Reaksinya adalah sebagai berikut (Jeong et al. 2005),
Fe2+ + 2Fe3+ Fe3O4 γ-Fe2O3
Kemiripan puncak-puncak difraksi sinar-X
(peaks) antara besi oksida hasil sintesis (sampel
F dan G) dengan basis data PCPDFWIN nomor 03-0863 dan 39-1346 dapat dilihat pada Tabel 2.
Tabel 2 Puncak-puncak difraksi sinar-X pada besi oksida
Jenis besi oksida Puncak (2θ(intensitas))
Fe3O4 (magnetit)
PCPDFWIN nomor 03-0863 30.166(20) 32.052(10) 35.450(100) 43.251(20) 53.544(10) 56.779(20) 62.723(40)
Fe2O3 (magemit)
PCPDFWIN nomor 39-1346 30.239(35) 35.629(100) 43.282(16) 53.730(10) 57.269(24) 62.922(34) Besi oksida disintesis pada suhu
ruang (F) 18.094(20) 21.129(17) 30.233(25) 35.706(59) 43.564(14) 53.806(16) 57.545(21) 63.073(28) Besi oksida disintesis pada suhu 70 oC (G)
30.047(29) 35.519(67) 42.996(18) 53.723(23) 57.191(12) 62.88(31) Sampel Jenis Bobot
Mmt:BO
Suhu sintesis
(oC)
Ket. A NK 2:1 25 - B NK 2:1 70 - C NK 2:1 70 inert D NK 1:1 25 - E NK 1:1 70 - F BO - 25 tanpa
8
Gambar 9 Pola difraksi sinar-X untuk montmorilonit, besi oksida nanopartikel, dan nanokomposit A, B, C, D, dan E.
Kedua besi oksida nanopartikel hasil sintesis (sampel F dan G) berwarna cokelat kemerahan. Berdasarkan sifat fisik ini, sampel F dan G lebih menyerupai magemit karena warna magnetit adalah hitam (Wikipedia 2006). Sampel F dan G memiliki sifat kemagnetan yang tinggi, ketika sampel
F dan G didekatkan dengan sebuah magnet ternyata kedua sampel tersebut menempel pada magnet. Sifat ini mendukung hasil pencirian menggunakan XRD karena hanya besi oksida magemit dan magnetit yang memiliki kemagnetan yang besar (Geo 2007).
Gambar 10 Pola difraksi sinar-X dari magemit (γ-Fe2O3) nanopartikel (a) metode
pipet tetes, (b) metode nozel piezoelektrik.
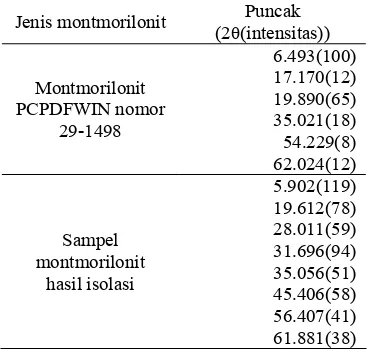
Pola difraksi sinar-X dari sampel montmorilonit (Gambar 9) menunjukkan kemiripan dengan montmorilonit yang terdapat di dalam basis data PCPDFWIN versi 1.30 International Centre for Diffraction Data (1997), yaitu montmorilonit nomor 29-1498 (Lampiran 8). Puncak-puncak difraksi montmorilonit sampel dan basis data PCPDFWIN nomor 29-1498 dapat dilihat pada Tabel 3. Hasil identifikasi menunjukkan bahwa sampel adalah montmorilonit, tetapi tidak dapat ditentukan secara spesifik jenisnya karena puncak-puncak khas yang dimiliki sampel juga ditemukan pada beberapa jenis montmorilonit di dalam program PCPDFWIN.
Tabel 3 Puncak-puncak difraksi sinar-X pada montmorilonit
Jenis montmorilonit Puncak (2θ(intensitas))
Montmorilonit PCPDFWIN nomor 29-1498 6.493(100) 17.170(12) 19.890(65) 35.021(18) 54.229(8) 62.024(12) Sampel montmorilonit hasil isolasi 5.902(119) 19.612(78) 28.011(59) 31.696(94) 35.056(51) 45.406(58) 56.407(41) 61.881(38)
0
50
100
150
200
250
300
350
400
450
500
550
600
650
0
10 20 30 40 50 60 70
2θ in te n sita s
G
montmorilonitF
E
D
A
B
C
57. 191 35.519 30. 047 42. 996 53.723 62.
88 35. 706 18. 094 63. 073 53. 806 43. 56 4 35. 544 62. 856 53. 535 29. 962 43. 401 19. 828 5. 902 1 9. 612 28. 011 31. 696 35. 056 45. 406 56. 353 61. 881 19. 666 35. 815 20. 533 57. 329 35. 598 30. 07 63. 181 12. 946
9
[image:30.612.133.305.346.466.2]Keberhasilan terbentuknya besi oksida nanopartikel di dalam montmorilonit juga ditunjukkan pada Gambar 9. Hal ini terbukti dari pola difraksi nanokomposit yang berbeda dengan montmorilonit dan lebih menyerupai pola difraksi besi oksida nanopartikel. Nanokomposit yang dibuat pada suhu 70oC (sampel B dan E), kecuali sampel C, memiliki puncak-puncak pada sudut difraksi yang sama dengan besi oksida nanopartikel (sampel F dan G). Kemiripan sampel B dan E dengan sampel F dan G terlihat jelas pada Gambar 9 melalui garis lurus yang menghubungkan puncak-puncak hasil difraksi. Hal ini menandakan bahwa sampel B dan E mengandung magemit atau magnetit. Puncak-puncak pada pola difraksi sampel C melemah jika dibandingkan dengan sampel B dan E. Sedangkan nanokomposit yang dibuat pada suhu ruang (sampel A dan D) tidak mengandung magemit atau pun magnetit, karena pola difraksinya yang berbeda dengan sampel F dan G.
[image:30.612.328.515.455.685.2]Gambar 11 Sampel A, B, D, dan E ketika dikenakan medan magnet. Jika besi oksida nanopartikel, berupa magnetit atau magemit, berhasil digabungkan dengan montmorilonit, maka dihasilkan nanokomposit yang bersifat magnet. Hal ini dibuktikan dengan mendekatkan komposit-komposit tersebut pada medan magnet, komposit yang memiliki sifat magnet akan menempel pada magnet (Gambar 11). Melalui uji kemagnetan sederhana ini diperoleh tiga nanokomposit yang memiliki sifat magnet, yaitu nanokomposit yang disintesis pada suhu 70oC (sampel B, C, dan E). Sedangkan nanokomposit yang disintesis pada suhu ruang (sampel A dan D) menunjukkan sifat magnet yang sangat kecil, bahkan pada Gambar 11 dapat dilihat, bahwa sampel A tidak merespon terhadap keberadaan magnet. Komposit yang memiliki sifat
kemagnetan terbesar adalah komposit dengan nisbah bobot montmorilonit dan besi oksida sebesar 1:1 dan disintesis pada suhu 70oC (sampel E). Sifat magnet sampel E paling kuat di bandingkan dengan sampel B dan C. Hal ini terbukti, ketika magnet digerakkan, sampel E mengikuti arah gerak magnet (Gambar 11). Hasil uji kemagnetan sederhana ini mendukung data XRD yang menunjukkan kemiripan pola difraksi antara sampel F dan G yang teridentifikasi sebagai magemit atau magnetit, dengan sampel B dan E. Hal ini menunjukkan bahwa sampel B dan E mengandung magemit atau magnetit.
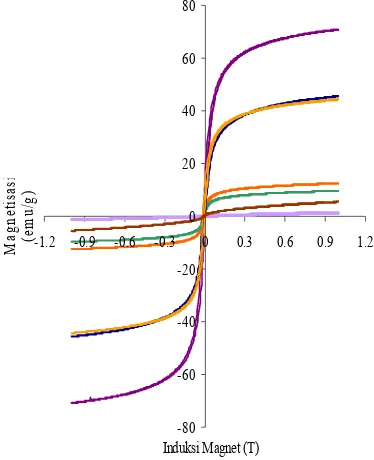
Pengukuran menggunakan VSM dilakukan dengan memberikan medan magnet sampai dengan 1 Tesla. Momen magnet yang dihasilkan sampel akibat medan magnet yang diberikan menandakan sifat kemagnetan bahan. Semakin besar momen magnet suatu bahan semakin besar pula sifat kemagnetannya. Hasil VSM menunjukkan bahwa besi oksida nanopartikel yang disintesis pada suhu 70 oC (sampel G) memiliki sifat kemagnetan yang lebih besar dibandingkan dengan besi oksida nanopartikel yang disintesis pada suhu ruang (sampel F). Hal ini membuktikan bahwa temperatur mempengaruhi reaksi pembentukan besi oksida nanopartikel, karena dengan menaikkan suhu, energi gerak molekul bertambah dan tumbukan lebih sering terjadi sehingga reaksi dapat berlangsung lebih sempurna. -80 -60 -40 -20 0 20 40 60 80
-1.2 -0.9 -0.6 -0.3 0 0.3 0.6 0.9 1.2
Induksi Magnet (T)
Ma g n et is as i (e m u /g )
10
Pengaruh suhu pembuatan terhadap sifat kemagnetan nanokomposit ditunjukkan pada Gambar 12. Sifat kemagnetan nanokomposit yang disintesis pada suhu 70oC (sampel B, C, dan E) lebih besar dibandingkan dengan komposit yang disintesis pada suhu ruang (sampel A dan D). Hal ini disebabkan oleh sifat kemagnetan besi oksida nanopartikel yang terbentuk di dalam nanokomposit yang dipengaruhi oleh suhu. Selain itu, sifat ketebalan lapisan baur atau jarak antar lembar montmorilonit yang bergantung terhadap suhu larutan. Semakin tinggi suhu larutan, semakin tebal lapisan baur montmorilonit (Notodarmojo 2005). Ketika lapisan baur membesar, besi oksida nanopartikel akan lebih mudah masuk ke dalam ruang antar lembar montmorilonit sehingga menghasilkan nanokomposit yang memiliki sifat kemagnetan yang besar.
Berdasarkan pengukuran menggunakan VSM, sampel E memiliki kekuatan magnet paling besar dibandingkan nanokomposit lainnya (sampel A, B, C, dan D). Bahkan berdasarkan Gambar 12, besarnya magnetisasi sampel E menyamai magnetisasi besi oksida nanopartikel F (magemit atau magnetit). Hasil VSM ini mendukung hasil uji kemagnetan sederhana yang membuktikan bahwa nanokomposit dengan perbandingan bobot montmorilonit-besi oksida 1:1 dan disintesis pada suhu 70o
C (sampel E) memiliki sifat magnet yang terkuat di antara nanokomposit lainnya. Hasil VSM juga membuktikan lemahnya sifat kemagnetan sampel A dan D yang dapat dilihat dari nilai magnetisasinya yang mendekati nol (Gambar 12).
Magnetisasi sampel C lebih rendah dibandingkan dengan nilai magnetisasi sampel B. Seharusnya nilai magnetisasi sampel C lebih besar dari sampel B, karena dengan dialirkannya gas N2, Fe2+ tidak
teroksidasi menjadi Fe3+ sehingga Fe3O4
yang terbentuk di dalam montmorilonit tidak teroksidasi menjadi γ-Fe2O3. Sifat
kemagnetan sampel C yang lebih kecil dari sampel B dapat disebabkan terbentuknya hematit (α-Fe2O3) akibat pengaliran gas N2.
Hematit merupakan besi oksida yang pada suhu di atas -10oC memiliki sifat kemagnetan yang rendah atau feromagnetik lemah (Geo 2007). Hal ini diperkuat oleh penelitian Gnanaprakash et al. (2006) yang membuktikan perubahan magemit menjadi hematit dengan mengalirkan gas N2.
Hasil uji sifat kemagnetan nanokomposit sesuai dengan nisbah bobot montmorilonit dan besi oksida nanopartikel. Sampel E memiliki sifat kemagnetan yang lebih besar dari sampel B dan C, karena bobot montmorilonit pada sampel E lebih sedikit dibandingkan dengan sampel B dan C sehingga besi oksida yang menempati ruang antar lembaran montmorilonit pada sampel E menjadi lebih banyak.
Hasil pencirian menggunakan metode Brunauer, Emmett, dan Teller (BET) memberikan informasi tentang luas permukaan spesifik bahan (Gambar 13). Luas permukaan spesifik ini penting karena reaksi permukaan seperti adsorpsi tergantung antara lain dari luas permukaan spesifik. Semakin halus atau semakin kecil diameter partikelnya, maka akan semakin luas permukaan spesifiknya (Notodarmojo 2005). Informasi luas permukaan spesifik komposit dibutuhkan untuk membuktikan masuknya besi oksida nanopartikel ke dalam montmorilonit ditandai dengan luas permukaan spesifik komposit yang lebih besar dari montmorilonit.
Sampel A, B, dan C merupakan nanokomposit yang dibuat dengan nisbah bobot montmorilonit dan besi oksida sebesar 2:1. Berdasarkan Gambar 13 diperoleh luas permukaan spesifik sampel A, B, dan C lebih besar dari montmorilonit. Nisbah bobot montmorilonit yang dua kali lebih besar dari besi oksida pada sampel A, B, dan C dapat diartikan bahwa besi oksida hanya menempati setengah dari keseluruhan montmorilonit. Penambahan Fe2+ dan Fe3+ ini menyebabkan bertambahnya kehadiran ion selain kation-kation yang menempati ruang antar lembar montmorilonit sehingga ketebalan lapisan baur atau jarak antar lembarannya semakin membesar. Hal inilah yang menyebabkan luas permukaan sampel A, B, dan C lebih besar dari montmorilonit.
Sampel E adalah nanokomposit yang dibuat dengan nisbah bobot montmorilonit-besi oksida 1:1. Nilai luas permukaan spesifik sampel E lebih kecil dari montmorilonit karena dengan nisbah bobot tersebut akan lebih banyak kation-kation yang terdapat di ruang antar lembar montmorilonit yang tergantikan oleh Fe3+ dan Fe2+. Atau lebih banyak juga Fe3+ dan Fe2+ yang menempel pada pada permukaan
11
mengalami pertukaran kation atau menempel pada permukaan lembaran montmorilonit. Menurut Notodarmojo (2005), bila yang terikat pada permukaan lembar montmorilonit adalah kation dengan jari-jari ion yang kecil, maka jika kation tersebut terhidrasi oleh adanya molekul air akan membentuk kation dengan jari-jari hidrasi yang relatif kecil. Akibatnya jarak antara partikel montmorilonit akan semakin kecil, ketebalan lapisan baur semakin menipis dan menyebabkan luas permukaan menjadi lebih kecil.
83.09 120.97 138.00 95.48 83.03 0 50 100 150 mon tmor iloni
t A B C E
[image:32.612.137.300.236.377.2]Sampel L ua s pe rm uka an s pe si fi k ( m 2 /g )
Gambar 13 Luas permukaan spesifik montmorilonit, sampel A, B, C, dan E.
Uji Aplikasi
Uji aplikasi dilakukan untuk mengetahui kemampuan penjerapan dari nanokomposit terhadap kontaminan logam berat yang pada penelitian ini menggunakan Pb2+. Nanokomposit yang digunakan untuk uji aplikasi adalah sampel E, karena berdasarkan pencirian menggunakan VSM, terbukti sampel E memiliki sifat magnet yang paling kuat dibandingkan dengan sampel A, B, C, dan D sehingga mempermudah proses pengambilan sampel E kembali dengan menggunakan magnet (Gambar 14).
Gambar 14 Proses pengumpulan kembali sampel E dengan menggunakan magnet setelah menjerap standar Pb2+.
Mekanisme penjerapan Pb2+ juga memanfaatkan sifat permukaan montmorilonit yang memiliki muatan negatif akibat substitusi isomorfik. Keberadaan besi oksida di dalam ruang antar lembar montmorilonit tidak mempengaruhi muatan montmorilonit karena besi oksida bersifat netral atau tidak bermuatan. Setelah nanokomposit menjerap Pb2+, kemudian dipisahkan dari larutan menggunakan magnet (Gambar 14). Kadar Pb2+ yang tersisa pada larutan kemudian diukur menggunakan metode polarografi sehingga diperoleh jumlah Pb yang terjerap (Gambar 15).
Kemampuan penjerapan sampel E terhadap Pb2+ ditunjukkan pada Gambar 15. Bobot rata-rata sampel E yang digunakan sebanyak 0.0463±0.0009 gram. Pada Gambar 15, kemampuan penjerapan sampel E terhadap Pb2+ konsentrasi 50, 100, 200, dan 400 µg/ml sangat besar karena jumlah Pb2+ yang terjerap lebih banyak dari jumlah Pb2+ yang tidak terjerap. Akan tetapi, di dalam larutan yang mengandung Pb2+ sebanyak 600, 800, dan 1000 µg/ml, kemampuan penjerapan sampel E berkurang. Jumlah Pb2+ yang dijerap oleh
sampel E lebih kecil dari jumlah Pb2+ yang tidak dijerap. 3 9 163 350 498 749 47 91 140 237 250 302 60 251 0 200 400 600 800
50 100 200 400 600 800 1000 Standar Pb2+ (µg/ml)
K o n sen tr asi P b
2+ (µ
g
/m
l)
[image:32.612.328.507.386.552.2]tidak terjerap terjerap
Gambar 15 Kemampuan penjerapan sampel E terhadap Pb2+.
Menurunnya kemampuan penjerapan sampel E terhadap Pb2+ pada konsentrasi 600, 800, dan 1000 µg/ml dikarenakan semakin besar konsentrasi Pb2+, semakin banyak jumlah partikel Pb2+ yang menempati ruang antar lembar montmorilonit atau pun terjerap pada permukaan montmorilonit di dalam komposit. Jika konsentrasi Pb2+ dalam larutan sangat tinggi, maka nanokomposit akan jenuh oleh Pb2+ sehingga nanokomposit tidak mampu lagi
[image:32.612.132.306.572.699.2]12
yang mampu dijerap sampel E adalah 400 µg/ml. Sampel E memiliki kemampuan penjerapan yang tinggi terhadap larutan yang mengandung Pb2+ di bawah 400 µg/ml. Sebaliknya, sampel E memiliki kemampuan penjerapan yang rendah terhadap larutan yang mengandung Pb2+ yang lebih dari 400
µg/ml.
SIMPULAN DAN SARAN
Simpulan
Besi oksida nanopartikel yang dihasilkan berupa magnetit atau magemit dan memiliki sifat magnet. Sampel besi oksida dan komposit yang disintesis pada suhu 70oC memiliki sifat kemagnetan lebih besar dibandingkan dengan sampel yang disintesis pada suhu ruang.
Nanokomposit yang mempunyai sifat magnet terbesar adalah montmorilonit-besi oksida nisbah bobot 1:1 dan disintesis pada suhu 70oC. Nanokomposit tersebut dapat menjerap Pb2+ dengan konsentrasi
maksimum sebesar 400 µg/ml. Setelah penjerapan, nanokomposit dan Pb yang terjerap di dalamnya dapat dipisahkan dari larutan dengan bantuan magnet.
Saran
Pencirian menggunakan x-ray
fluorescence (XRF) perlu dilakukan
terhadap nanokomposit dan besi oksida untuk mengetahui komposisi unsurnya. Sampel juga sebaiknya dicirikan menggunakan scanning electron microscope
(SEM) agar dapat ditentukan ukuran partikelnya. Sintesis nanokomposit menggunakan montmorilonit standar juga perlu dilakukan guna memperjelas penciriannya. Uji aplikasi terhadap montmorilonit-besi oksida nanopartikel nisbah bobot 2:1 yang disintesis pada suhu 70oC juga perlu dilakukan untuk mengetahui kemampuan penjerapannya.
DAFTAR PUSTAKA
British Broadcast Centre. 2006. BET –
Measuring Areas Using Molecules.
http://www.bbc.co.uk/dna/h2g2/A8457 23.html [17 Mei 2005].
Caryacademy. 2006. Iron Oxide. http://www.caryacademy.org/chemistry /rushin/StudentProjects/CompoundWeb
Sites/2003/ironoxide.html [17 Mei 2006]. Chemistry. 2006. Polarography.
http://www.chemistry.adelaide.edu.html [17 Mei 2006].
Darmawijaya MI. 1990. Klasifikasi Tanah. Yogyakarta: UGM Press.
Dixon JB, Weed SB, editor. 1989. Minerals in
Soil Environments. Ed. ke-2. Wisconsin:
Soil Science Society of America.
Drecam. 2006. Vibrating Sample
Magnetometry.http://www.drecam.cea.htm
l [15 Mei 2006].
Geo. 2007. Classes of Magnetic Materials. http://www.geo.umn.edu.html [11 Jan 2007].
Gnanaprakash G. 2006. Magnetic nanoparticles with enhanced γ-Fe2O3 to α-Fe2O3 phase
transition temperature. Nanotechnology
17:5851. [terhubung berkala]. http://www.iop.org/EJ/abstract.html [11 Jan 2007].
Ima-eu. 2006. Bentonite. http://www.ima-eu.org.html [29 Apr 2006].
Jeong JR et al. 2004. Magnetic Properties of Superparamagnetic γ-Fe2O3 Nanoparticles
Prepared by Coprecipitation Technique.
Journal of Magnetism and Magnetic
Materials 286: 5-9.
Khopkar SM. 2002. Konsep Dasar Kimia
Analitik. A Saptorahardjo, penerjemah;
Jakarta: UI Press. Terjemahan dari: Basic
Concepts of Analytical Chemistry.
Kunimine. 2006. Montmorillonite. http://www.kunimine.com/montmorillonite .html [27 Apr 2006].
Lee SJ et al. 2004. Synthesis and Characterization of Superparamagnetic Maghemite Nanoparticles Prepared by Coprecipitation Technique. Journal of
Magnetism and Magnetic Materials 282:
147-150.
Nano. 2006. Magnetic Nanoparticle Heaters
Kill Breast Cancer Cells.
13
Ndt-ed. 2007. Diamagnetic, Paramagnetic,
and Ferromagnetic Materials.
http://www.ndt-ed.org.html [11 Jan 2007].
Netcomposites. 2006. A Fundamental Study of the Processing-Structure-Properties of Nanocomposites for Industrial
Application.http://www.netcomposites.
com/images/montmorillonite.html [6 Nov 2006].
Notodarmojo S. 2005. Pencemaran Tanah
dan Air Tanah. Bandung: ITB press.
Oliveira LC et al. 2004. A Simple Preparation of Magnetic Composites for the Adsorption of Water Contaminants. Journal of Chemical
Education 81: 248-250.
Skoog DA et al. 1998. Principles of
Instrumental Analysis. Ed. ke-5.
London: Harcourt Brace Coll.
Txstate. 2007. Vibrating Sample
Magnetometer.http://www.txstate.edu/~
WG06/manuals/vsm/vsm.html [12 Feb 2007].
Users. 2006. Vibrating Sample
Magnetometry.http://www.users.york
.
ac.uk/~phys18/vsm.html [15 Mei 2006]. Waynert J et al. 2003. Wastewater
Treatment with Magnetic Seperation.
Superconductivity for Electric Systems
Program Review 1:1-29.
14
Lampiran 1 Diagram alir kerja
+ NaOH 5 M setetes demi setetes sampai 100 ml
penetesan konstan 2.4 ml/menit
diameter pipet 2000 µm
dicuci, dikeringkan di oven
pencirian
nanokomposit
XRD, metode BET, VSM
Standar Pb
2+50,
100, 200, 400, 600,
800, dan 1000 µg/ml
Polarografi
¾
bobot montmorilonit : bobot besi oksida = 2:1
9
suhu pembuatan 25
oC
9
suhu pembuatan 70
oC
9
suhu pembuatan 70
oC dalam keadaan inert
(dialirkan gas N
2)
¾
bobot montmorilonit : bobot besi oksida = 1:1
9
suhu pembuatan 25
oC
9
suhu pembuatan 70
oC
montmorilonit
+
(2Fe
3++ Fe
2+)
variasi pembuatan
nanokomposit
+
nanokomposit
dengan sifat
magnet terbesar
15
Lampiran 2 Stoikiometri dalam pembuatan besi oksida (Fe
3O
4)
Fe
3+: Fe
2+= 2 : 1
2Fe
3++ Fe
2+FeO Fe
2O
328 mmol 14 mmol 14 mmol
FeO Fe
2O
3= Fe
3O
4FeCl
36H
2O : FeSO
47H
2O = 28 mmol : 14 mmol
¾
FeCl
36H
2O
= 28 mmol = 28 × 10
-3mol
BM FeCl
36H
2O
= 270.3188 g/mol
Bobot FeCl
36H
2O
= 28 × 10
-3mol × 270.3188 g/mol
= 7.5689 g
¾
FeSO
47H
2O
= 14 mmol = 14 × 10
-3mol
BM FeSO
47H
2O
= 278.0362 g/mol
Bobot FeSO
47H
2O
= 14 × 10
-3mol × 278.0362 g/mol
= 3.8925 g
¾
Fe
3O
4= 14 mmol = 14 × 10
-3mol
BM Fe
3O
4= 231.5386 g/mol
Bobot Fe
3O
4= 14 × 10
-3mol × 231.5386 g/mol
= 3.2415 g
16
Lampiran 3 Kalibrasi Peniter
Tampilan peniter
t (menit)
t rata-rata (menit)
v (ml/menit)
3.40
5 3.50
3.40
3.43 1.46
1.50
10 1.50
1.50
1.50 3.33
1.10
15 1.20
1.10
1.13 4.42
0.57
20 0.58
0.58
0.58 8.62
0.48
25 0.46
0.46
0.47 10.64
y = 0.473x - 1.401
R2 = 0.9617
0 4 8 12
0 10 20 30
angka peniter
v (
m
l/
m
en
it
)
v (laju penetesan) = y = 2.4 ml/menit
y
= 0.473x – 1.401
x =
8.0359
17
Lampiran 4 Kalibrasi menggunakan metode
square wave voltammetry
(SWV)
yang diukur pada daerah potensial -0.3 sampai -0.5 V
Konsentrasi standar Pb
2+(µg/ml)
Arus difusi (µA)
2.5000 0.4160
5.0000 0.8270
10.0000 1.3854
y = 0.1267x + 0.1368
R
2= 0.9895
0
0.5
1
1.5
0
5
10
15
Konsentrasi Pb
2+(µg/ml)
A
rus
di
fu
si
(
µ
18
Lampiran 5 Contoh kurva yang dihasilkan dari pengukuran Pb
2+menggunakan
metode
square wave voltammetry
(SWV) diukur pada daerah
potensial -0.3 sampai -0.5 V
A
rus difusi
(× 10
2
nA)
19
20
21