MELALUI KULTUR JARINGAN
ANDRI DENISH
DEPARTEMEN
KONSERVASI SUMBERDAYA HUTAN DAN EKOWISATA
FAKULTAS KEHUTANAN
Blanco.) melalui Kultur Jaringan. Dibimbing oleh EDHI SANDRA dan AGUS HIKMAT.
Perkembangan industri obat tradisional dan jamu yang bahan bakunya berasal dari tumbuhan kemaitan (Lunasia amara Blanco.), turut meningkatkan permintaan terhadap simplisia kemaitan yang berasal dari hutan. Masalah yang berkembang selama ini, penelitian tumbuhan obat lebih terfokus pada aspek farmakologi, sedangkan penelitian untuk aspek yang lain sangat kurang, hal ini menyebabkan perhatian terhadap kelestarian tumbuhan obat kemaitan masih rendah. Penelitian kultur jaringan kemaitan menjadi penting sebagai langkah awal untuk melestarikan pemanfaatan tumbuhan obat kemaitan.
Penelitian ini bertujuan untuk mendapatkan kondisi pertumbuhan kemaitan dalam kultur jaringan serta menganalisa pengaruh media MS (Murashige Skoog) dengan penambahan zat pengatur tumbuh BAP (Benzylaminopurin) terhadap pertumbuhan kemaitan.
Pelaksanaan penelitian dilakukan pada bulan September 2006 hingga Januari 2007. Penelitian ini dilaksanakan di Unit Kultur Jaringan Laboratorium Konservasi Tumbuhan Departemen Konservasi Sumberdaya Hutan dan Ekowisata, Fakultas Kehutanan Institut Pertanian Bogor.
Bahan tanaman (eksplan) yang digunakan adalah pucuk kemaitan. Pucuk disterilisasi dengan menggunakan deterjen, fungisida, HgCl2, klorin dan dibilas
dengan air steril. Eksplan ditumbuhkan pada media MS dengan penambahan perlakuan BAP yaitu; 0; 0,5; 1; 1,5; dan 2 mg/l. Percobaan disusun dalam rancangan acak lengkap dengan 10 ulangan. Pengamatan dilakukan terhadap seluruh eksplan yang ditanam, meliputi: persentase peluang hidup eksplan, persentase pencoklatan (browning), persentase kontaminasi cendawan, morfologi daun dan tinggi tanaman.
Hasil dari penelitian ini menunjukkan bahwa semua perlakuan BAP tidak mampu membentuk tunas baru. Semua taraf perlakuan BAP yang diberikan tidak berpengaruh nyata terhadap produktivitas tinggi tanaman.
Dari penelitian ini dapat disimpulkan, semua taraf perlakuan BAP (0; 0,5; 1; 1,5; dan 2 mg/l) belum dapat dijadikan sebagai konsentrasi optimum dalam memperbanyak kemaitan melalui kultur jaringan.
amara Blanco.) through Tissue Culture. Supervisors: EDHI SANDRA and AGUS HIKMAT.
The development of traditional medicine industry and herb which is basic material came from kemaitan (Lunasia amara Blanco.), effects the demand of kemaitan from the forest increase. The problem has develop now, the medicine plant research is more focused on pharmacology aspect, while the research of the other aspects is not quite therefore attention of sustainability of kemaitan as medicine plants is low. Tissue culture research of kemaitan became important as first step to sustain the adventages medicine plant of kemaitan.
The objectives of this research are to obtain the growth condition of kemaitan in tissue culture and to analyse the influences of MS (Murashige Skoog) material with addition of growth manage matter BAP (Benzylaminopurin) kemaitan growth.
The research was conducted in September 2006 - January 2007 at the Tissue Culture Unit, Plant Conservation Laboratory, Department of Forest Resouces Conservation and Ecotourism, Forestry of Faculty, Bogor Agriculture University.
As plant materials (explant) used shoot, which was sterilized by detergent, fungicide, HgCl2, clorin and it washed with sterile water. Explant was growth in
MS material with addition BAP treatment are 0; 0,5; 1; 1,5 and 2 mg/l. The research was arranged in complete random design with 10 repetition. The observe was done to all explant, consists of explant life opportunity percentage, browning percentage, mildew contamination percentage, leaf morfology and plant height.
The result of this research showed all BAP treatment could not afford to formed new shoot, and all BAP treatment didn’t show the significant effect to the high productivity plants.
The conclusion of this research is all BAP treatment (0; 0,5; 1; 1,5; 2 mg/l) can not be as optimum concentration in the tissue culture of kemaitan propagation yet.
Perbanyakan Vegetatif Kemaitan (Lunasia amara Blanco.) melalui Kultur Jaringan adalah benar-benar hasil karya saya sendiri dengan bimbingan dosen pembimbing dan belum pernah digunakan sebagai karya ilmiah pada perguruan tinggi atau lembaga manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Maret 2007
Andri Denish
Nama : Andri Denish
NIM : E34102047
Departemen : Konservasi Sumberdaya Hutan dan Ekowisata
Menyetujui: Komisi Pembimbing
Ketua, Anggota,
Ir. Edhi Sandra, MSi Dr. Ir. Agus Hikmat, MSc.F
NIP. 132 055 229 NIP. 131 865 340
Mengetahui:
Dekan Fakultas Kehutanan IPB,
Prof. Dr. Ir. Cecep Kusmana, MS NIP. 131 430 799
KATA PENGANTAR
Syukur Alhamdulillah penulis panjatkan ke hadirat Allah SWT karena hanya dengan kuasa-Nya, penulis dapat menyelesaikan skripsi ini tepat pada waktunya guna memperoleh gelar Sarjana Kehutanan pada Fakultas Kehutanan Institut Pertanian Bogor.
Skripsi ini disusun berdasarkan hasil penelitian yang penulis lakukan di Unit Kultur Jaringan Laboratorium Konservasi Tumbuhan Departemen Konservasi Sumberdaya Hutan dan Ekowisata, Fakultas Kehutanan IPB. Dengan judul “Percobaan Perbanyakan Vegetatif Kemaitan (Lunasia amara Blanco.) melalui Kultur Jaringan”.
Dengan tersusunnya skripsi ini, penulis tak lupa menyampaikan rasa terima kasih kepada Bapak Ir. Edhi Sandra, MSi dan Bapak Dr. Ir. Agus Hikmat, MSc.F selaku dosen pembimbing yang telah memberikan segenap ilmu, tenaga dan waktu selama penelitian hingga rampungnya penulisan skripsi ini. Penulis sampaikan rasa terima kasih pula kepada Bapak Ir. Muhdin, MSc selaku dosen penguji wakil dari Departemen Manajemen Hutan dan Bapak Effendi Tri Bahtiar, S. Hut selaku dosen penguji wakil dari Departemen Hasil Hutan atas segala kritik dan saran demi kesempurnaan dalam penulisan skripsi ini.
Ungkapan terima kasih juga disampaikan kepada bapak, ibu, dan adik tercinta atas segala doa dan kasih sayangnya. Selain itu penghargaan penulis disampaikan pula kepada Bapak Husein, Bapak Santa, Bapak Eko, Ibu Minah dan Bapak Udin atas bantuannya selama penelitian. Tak lupa pula penulis curahkan rasa terima kasih setulusnya kepada Intan Mayasari atas segala doa dan dukungannya selama penelitian. Selain itu, penulis ucapkan terima kasih kepada Ambar, Lisbeth, Iwan, Azwin, Nuy, Indri, Nofrizal, Susie, Maryanti, Jamal, Teti, Ulfah, Cita, Lambok, Salwa, Yandi, Rofadia dan teman-teman KSH39 atas persahabatan dan bantuannya. Semoga Allah SWT memberikan rahmat dan pahala bagi kalian semua, Amin. Penulis menyadari bahwa skripsi ini masih jauh dari sempurna, namun penulis berharap semoga skripsi ini dapat bermanfaat bagi kita semua.
RIWAYAT HIDUP
Penulis dilahirkan di Bogor, pada tanggal 29 Desember 1983 sebagai anak pertama dari empat bersaudara dengan Ayah Edi Indra Asmara dan Ibu Euis Sunarsih.
Pada tahun 2002 penulis lulus dari SMU Negeri 7 Bogor dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB. Penulis memilih Program Studi Konservasi Sumberdaya Hutan, Jurusan Konservasi Sumberdaya Hutan, Fakultas Kehutanan.
Selama menuntut ilmu di IPB, penulis pernah menjadi anggota organisasi kemahasiswaan yakni Organisasi Kesenian Sunda Gentra Kaheman (2004), panitia Bina Corp Rimbawan (BCR) Fakultas Kehutanan (2004), panitia Pemanenan dan Pelepasan Sarjana Baru Fakultas Kehutanan tahun (2003), panitia Sahabat Katak Departemen Konservasi Sumberdaya Hutan Fakultas Kehutanan (2004), panitia Pameran dan Workshop Konservasi Rafflesia yang diselenggarakan oleh Kelompok Pemerhati Flora Himakova Fakultas Kehutanan (2005).
Penulis juga melakukan Praktek Pengenalan dan Pengelolaan Hutan (P3H) di KPH Banyumas Timur dan KPH Banyumas Barat, Perum Perhutani Unit I Jawa Tengah (2005). Penulis juga melakukan Praktek Kerja Lapang Profesi (PKLP) di Taman Nasional Bukit Barisan Selatan, Lampung (2006). Selain itu penulis pernah menjadi asisten praktikum untuk mata kuliah Konservasi Tumbuhan Obat sub bidang kultur jaringan (2006) dan asisten praktikum untuk mata kuliah Konservasi Tumbuhan Langka (2007).
DAFTAR ISI
BAB I PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Tujuan Penelitian ... 2
1.3 Hipotesis ... 3
1.4 Manfaat Penelitian ... 3
BAB II TINJAUAN PUSTAKA 2.1 Keterangan Jenis Kemaitan (Lunasia amara Blanco.) ... 4
2.2 Perbanyakan Tanaman secara Kultur Jaringan ... 7
2.3 Zat Pengatur Tumbuh Sitokinin BAP (Benzylaminopurin) ... 11
2.4 Penelitian Kemaitan yang Telah Dilakukan ... 12
BAB III BAHAN DAN METODE PENELITIAN 3.1 Tempat dan Waktu Penelitian ... 13
3.2 Bahan dan Alat Penelitian ... 13
3.3 Metode Penelitian ... 15
3.4 Pengamatan (peubah yang diukur) ... 18
3.5 Metode Analisis ... 18
BAB IV HASIL DAN PEMBAHASAN 4.1 Peluang Hidup Tanaman Kultur ... 20
4.2 Penyebab Kematian pada Tanaman Kultur ... 21
4.2.1 Pencoklatan (Browning) ... 21
4.2.2 Kontaminasi Cendawan ... 23
4.3 Kondisi Pertumbuhan Tanaman Kultur ... 24
DAFTAR TABEL
No. Halaman
1. Ringkasan hasil penelitian kemaitan yang telah dilakukan ... 12
2. Data eksplan pucuk kemaitan yang hidup hingga 12 MST ... 20
3. Persen rata-rata peluang hidup eksplan pucuk kemaitan dalam medium perlakuan selama 12 MST ... 21
4. Data hasil pengamatan tinggi kemaitan ... 27
5. Tes Homogenitas dalam varian ... 28
6. Hasil uji Anova ... 28
DAFTAR GAMBAR
No. Halaman
1. Kemaitan (Lunasia amara Blanco.) ... 4
2. Kondisi browning pada beberapa eksplan kemaitan ... 22
3. Kondisi serangan cendawan pada beberapa tanaman kultur ... 23
4. Bentuk daun tanaman kultur kemaitan ... 25
5. Proses absisi pada salah satu tanaman kultur kemaitan ... 26
DAFTAR LAMPIRAN
No. Halaman
1. Pembuatan dan Komposisi Larutan Stok MS (Murashige Skoog)... 35
2. Skema prosedur pembuatan media MS ... 36
3. Kondisi pertumbuhan dan perkembangan eksplan Lunasia amara Blanco. pada beberapa taraf konsentrasi BAP ... 37
4. Rancangan lingkungan acak lengkap ... 38
5. Riwayat kematian eksplan ... 39
6. Persentase kematian dan hidup eksplan ... 40
7. Rekapitulasi pengukuran tinggi ... 41
8. Tabel pengamatan tinggi selama 12 MST ... 42
1.1Latar Belakang
Indonesia merupakan salah satu negara megabiodiversitas yang memiliki hutan alam tropika yang kaya akan keanekaragaman spesies tumbuhan obat. Diperkirakan mencapai kurang lebih 1300 spesies tumbuhan yang telah diketahui secara pasti berkhasiat obat dan terdapat di hutan tropika Indonesia, dimana sebagian besar spesies tersebut tidak dimiliki oleh negara lain di dunia (Zuhud et al. 1994).
Salah satu spesies tumbuhan obat yang mempunyai potensi untuk dikembangkan adalah kemaitan (Lunasia amara Blanco). Kemaitan merupakan spesies tumbuhan obat yang mempunyai manfaat antara lain sebagai obat untuk mengatasi gangguan seksualitas pada kaum pria, obat anti diare, penawar racun makanan atau ular, mengatasi masalah kelainan kulit, obat bengkak, penyubur rambut, dan kosmetika (Rusdianto 1999).
Berdasarkan hasil penelitian yang telah dilakukan sebelumnya oleh Adhiyanto (2001), kemaitan sangat berpotensi sebagai komoditi simplisia di dunia kesehatan, baik modern maupun tradisional. Perkembangan industri obat modern maupun tradisional yang bahan bakunya berasal dari jenis kemaitan, turut meningkatkan permintaan terhadap simplisia kemaitan yang berasal dari hutan. Di lain pihak, upaya mengatur pemanenan tumbuhan obat dari alam dan budidaya terhadap tumbuhan obat tersebut masih belum dilakukan, hal ini dapat menjadi faktor penyebab kelangkaan kemaitan di alam. Ditambah lagi karakteristik pertumbuhan kemaitan yang termasuk ke dalam kategori slow growing species, sehingga apabila usaha eksploitasi yang dilakukan secara berlebihan, hal ini dapat menghambat regenerasi atau pertumbuhannya.
obat. Penelusuran informasi baik melalui media cetak, literatur, maupun penelusuran data via internet, hanya ditemukan beberapa penelitian yang pernah dilakukan untuk spesies kemaitan, salah satunya adalah aspek ekologi kemaitan (Adhiyanto 2001). Dari hasil penelusuran tersebut tidak diperoleh informasi budidaya baik secara konvensional maupun non-konvensional khususnya kultur jaringan untuk spesies kemaitan.
Berdasarkan permasalahan tersebut di atas, penelitian budidaya kemaitan melalui kultur jaringan menjadi penting sebagai langkah awal untuk melestarikan pemanfaatan spesies tumbuhan obat kemaitan.
Pemanfaatan bioteknologi pada tumbuhan obat di Indonesia sampai saat ini masih terbatas pada teknik kultur jaringan. Teknik ini diaplikasikan dalam perbaikan mutu genetik dan perbanyakan tanaman serta penyimpan plasma nutfah secara in vitro. Perbanyakan melalui kultur jaringan memiliki kelebihan antara lain tanaman baru mempunyai sifat sama dengan induknya, bibit dapat diproduksi dalam jumlah besar dan bebas dari hama dan penyakit.
Beberapa spesies tumbuhan obat yang telah berhasil dibudidayakan melalui kultur jaringan antara lain: purwoceng (Pimpinella pruatjan), pulosari (Alyxia stellata), pule pandak (Rauwolfia serpentina), dan temu puteri (Curcuma petiola) (Peni 1995). Melihat kenyataan ini, tidak menutup kemungkinan dilakukannya pengembangan atau perbanyakan tumbuhan obat kemaitan melalui kultur jaringan.
1.2 Tujuan Penelitian
1.3 Hipotesis
Penambahan zat pengatur tumbuh BAP dengan taraf konsentrasi yang berbeda, memberikan pengaruh yang berbeda terhadap pertumbuhan kultur pucuk kemaitan.
1.4 Manfaat Penelitian
2.1 Keterangan Jenis Kemaitan (Lunasia amara Blanco) 2.1.1 Taksonomi
Secara taksonomi, kemaitan mempunyai klasifikasi sebagai berikut (Heyne, 1987) :
Kingdom : Plantae
Divisio : Spermatophyta
Sub Divisio : Angiospermae
Klas : Dicotyledonae
Sub Klas : Rosidae
Ordo : Sapindales
Famili : Rutaceae
Genus : Lunasia
Spesies : Lunasia amara Blanco. Sinonim : L. costulata Miq.;
Mytilococcus quercifolius Zoll. Gambar 1 Kemaitan (Lunasia amara Blanco.).
2.1.2 Nama Daerah
Lunasia amara mempunyai beberapa nama daerah, yaitu kemaitan, maitan (Jawa), mamaitan (Madura), makelum halahuna, aifafa, pintan (Minahasa), bungkus susu (Maluku), dan Sanrego (Bone) (Rusdianto 1999).
2.1.3 Ciri Morfologi
Sedangkan dalam Rusdianto (1999), diterangkan bahwa kemaitan merupakan pohon tegak tak bercabang (monopodial) yang mampu mencapai tinggi 12 m, keras dan licin. Berdaun lebat dimana daun mudanya ditutupi bulu-bulu putih dan coklat. Bagian kelopak bunganya ditutupi bulu-bulu coklat berukuran 1,5 mm dan mengeluarkan bau yang harum.
Kemaitan adalah tumbuhan berupa perdu tegak, kebanyakan mempunyai tinggi 3 meter. Rantingnya licin dan daunnya tersusun secara sasak alternate, berbentuk oblong-obovate, dengan ukuran panjang 20-40 cm dan lebar 7-12 cm. Buahnya terdiri dari 3 kapsul kekuningan, licin dan ditandai dengan seperti urat, membuka sepanjang uratnya dengan bagian atasnya seperti jahitan luka (Quisumbing 1951, diacu dalam Adhiyanto 2001).
Sastrapradja et al. (1980), menerangkan kemaitan berupa perdu atau pohon kecil yang tingginya mencapai 2 sampai 6 meter yang berbatang pahit. Pada daun yang masih muda terdapat bulu-bulu putih atau kecoklatan. Bunganya kecil, putih atau coklat, berbau harum, tersusun dalam dua macam karangan yang tumbuh pada ketiak-ketiak daun. Buahnya berupa buah buni yang berbentuk bundar telur terbalik, merekah menjadi 3 keping bila sudah masak. Bijinya berbentuk lonjong.
2.1.4 Penyebaran dan Habitat Kemaitan
Sastrapradja et al. (1980), kemaitan tumbuh dengan baik di dataran rendah yang beriklim kering. Banyak dijumpai tumbuh di Jawa Timur, Madura dan Nusa tenggara dari daerah pantai sampai bukit-bukit berbatu pada ketinggian 400 m di atas permukaan laut (dpl).
Beberapa pustaka mengungkapkan potensi terbesar kemaitan berada di Sulawesi dan daerah Irian Jaya (Heyne 1987; Rusdianto 1999). Sedangkan EISAI (1995) diacu dalam Adhiyanto (2001), menyebutkan bahwa penyebaran kemaitan di nusantara mencakup beberapa wilayah yang tersebar di Jawa Tengah, Jawa Timur, Nusa Barung, Madura, Sulawesi, dan Indonesia bagian Timur.
situ pula diketahui habitat kemaitan berbeda-beda di tiap-tiap lokasi. Adapun tempat habitat yang diketahui merupakan daerah penyebaran kemaitan meliputi hutan pegunungan, hutan primer, hutan sekunder, bukit dengan tanah kapur, dataran rendah, dan daerah dekat lembah sungai serta hutan hujan tropis.
Heyne (1987) mengemukakan bahwa kemaitan tumbuh pada ketinggian di bawah 400 m dpl, tumbuh di perbukitan yang gundul dan berbatu serta terkadang pada karang batu yang gundul di dekat pantai. Kemaitan merupakan salah satu jenis tumbuhan obat yang mempunyai spesifikasi ekologi yang khas, pada umumnya tersebar secara mengelompok, memiliki kondisi habitat yang bisa dikatakan cukup ekstrim bagi eksistensi suatu jenis vegetasi di ekosistem hutan alam. Di habitatnya, kemaitan menempati ruang dengan ciri ekologi solum yang tipis, dan terkadang didominasi dengan bebatuan dan kelerengan yang terjal (Adhiyanto 2001).
2.1.5 Pemanfaatan Kemaitan
Sastrapradja et al. (1980), menyatakan yang bermanfaat sebagai obat adalah daun dan batangnya. Seduhan daun atau batangnya berguna sebagai obat gosok untuk mengobati bengkak atau bisul. Hingga saat ini daun dan kulit batang kemaitan sering digerus lalu dijual dalam perdagangan obat. Rebusan dari bahan kemaitan yang dibubuhi sedikit tawas dapat digunakan sebagai obat gosok bagian badan yang bengkak, kemaitan ini juga dapat digunakan sebagai obat yang cocok untuk mengatasi cascado (sejenis penyakit kulit, di daerah Kalimantan) dengan cara daunnya digerus lalu dipanaskan, dibungkus dalam daun yang utuh lalu diikatkan kepada tempat yang terkena penyakit (Heyne 1987).
Kulit batang kemaitan bermanfaat sebagai obat nyeri perut, penawar racun ular dan serangga, sedangkan daunnya bermanfaat sebagai obat bengkak dan penyubur rambut (EISAI 1995, diacu dalam Adhiyanto 2001). Rusdianto (1999), mengungkapkan bahwa kemaitan bermanfaat sebagai pelancar saluran urine, memacu gairah seksual, kosmetik, penghambat pertumbuhan bakteri (Eschericia coli), obat diare, penawar racun makanan, dan bisa ular.
dilihat dari sekian banyak faktor lingkungan yang ada, faktor eksploitasi manusialah yang sangat mengancam eksistensi kemaitan di habitat aslinya. Diperparah lagi karena karakteristiknya yang termasuk ke dalam kategori slow growing species dan kondisi lingkungannya yang cukup ekstrim.
2.1.6 Kandungan Kimia Kemaitan
Sastrapradja et al. (1980), menyatakan bahwa daun maupun kulit batang tumbuhan ini mengandung senyawa-senyawa alkaloid yang menyebabkan rasa pahit. Beberapa dari alkaloid tersebut yang sudah diidentifikasi adalah lunasin dan limarin. Alkaloid-alkaloid ini diketahui mempunyai daya racun yang keras yang dapat melumpuhkan jantung.
Kulit batang kemaitan yang sangat pahit, ternyata mengandung zat alkoloida yang beracun, yang dapat melumpuhkan jantung. Selain itu alkoloida juga terdapat didalam daunnya tetapi dalam kadar yang jauh lebih sedikit (Heyne 1987). Kulit batang, akar, dan daun kemaitan mengandung beberapa zat kimia yang penting, yaitu alkoloid, sitosterol, dan glikosida (Rusdianto 1999).
2.2 Perbanyakan Tanaman secara Kultur Jaringan
2.2.1 Pengertian Kultur Jaringan
Menurut Bonga et al. (1982) kultur jaringan adalah suatu teknik dimana potongan-potongan jaringan yang kecil atau organ yang diambil dari tanaman donor dan dikultur secara aseptik pada suatu medium yang mengandung unsur-unsur hara. Dengan cara memanipulasi komposisi kimia medium dan faktor-faktor lingkungan lain pertumbuhan dan perkembangan jaringan pada kultur dapat diarahkan sesuai tujuan yang diinginkan.
Dalam bahasa Inggris, kultur jaringan disebut dengan tissue culture.Tissue
menumbuhkannya dalam kondisi aseptic (bebas hama dan penyakit). Selanjutnya bagian-bagian tersebut dapat memperbanyak diri dan menjadi tanaman lengkap (Nugroho dan Sugito 2002). Teknik budidaya secara kultur jaringan sering disebut dengan teknik budidaya in vitro.
Kultur jaringan menggunakan dasar teori seperti yang dikemukakan oleh Schleiden dan Schwann, sel memiliki kemampuan otonom atau mampu tumbuh mandiri, bahkan memiliki kemampuan totipotensi. Totipotensi adalah kemampuan setiap sel, dimana pada bagian manapun sel tersebut diambil, apabila diletakkan dalam lingkungan yang sesuai akan tumbuh menjadi tanaman yang sempurna (Nugroho dan Sugito 2002).
2.2.2 Manfaat Kultur Jaringan
Hendaryono dan Wijayani (1994) diacu dalam Wirawan (2003), kegunaan utama dari kultur jaringan adalah untuk mendapatkan tanaman baru dalam jumlah yang banyak, dalam waktu yang relatif singkat, serta mempunyai sifat fisiologis dan morfologis yang sama seperti induknya. Teknik kultur jaringan ini pula diharapkan diperoleh tanaman baru yang bersifat unggul.
Wattimena et al. (1992) menyatakan bahwa pelestarian plasma nutfah secara in vitro mempunyai beberapa keuntungan dibandingkan dengan cara in situ. Keuntungan tersebut antara lain : hemat dalam pemakaian ruang, dapat menyimpan tanaman langka yang hampir punah, dapat digunakan untuk tanaman yang tidak menghasilkan biji, bebas dari segala gangguan hama dan penyakit, serta dapat disimpan dalam keadaan bebas penyakit.
2.2.3 Faktor-faktor yang Berpengaruh dalam Kultur Jaringan
Ada beberapa faktor yang berpengaruh terhadap teknik kultur jaringan. Faktor-faktor tersebut antara lain :
a. Media Kultur
perkembangan, serta kadang-kadang arang aktif untuk mengurangi efek penghambatan dari persenyawaan polifenol (warna coklat-hitam) yang keluar akibat pelukaan jaringan pada jenis-jenis tanaman tertentu. Gula, asam amino, dan vitamin ditambahkan karena eksplan yang ditanam tidak lagi sepenuhnya hidup secara autotrof (hidup dari bahan-bahan anorganik dari alam). Dalam kultur in vitro, segmen tanaman hidup secara heterotrof (mendapat suplai bahan organik) (Gunawan 1995).
Hartmann dan Kester (1968), menyatakan bahwa komposisi nutrisi medium kultur dapat dikatagorikan dalam : garam-garam mineral, karbohidrat, vitamin dan bahan organik lain zat tumbuh dan senyawa-senyawa organik kompleks seperti air kelapa, sari tomat, ekstrak yeast dan lain-lain.
Hartmann dan Kester (1968) juga menyatakan bahwa media kultur yang memenuhi syarat adalah media yang mengandung nutrien makro dan mikro dalam kadar dan perbandingan tertentu, serta sumber tenaga (umumnya digunakan sukrosa). Garam-garam anorganik atau garam-garam mineral terdiri atas : unsur-unsur makro nitrogen, phospor, potasium, kalsium, magnesium dan sulfur sangat penting untuk seluruh jaringan tanaman dan pertumbuhan bagian tanaman secara
in vitro. Dan unsur-unsur mikro yaitu B, Co, Fe, Mn, Zn, Cu, Mo, penting di tambahkan tetapi pada beberapa media dapat dihilangkan.
Unsur-unsur esensial dalam suatu media berfungsi untuk mengatur proses-proses fisiologis, serta mengaktifkan enzim dan mengatur kecepatan proses-proses enzim (Epstein 1972). Disamping itu juga untuk mengatur proses-proses metabolisme. Kekurangan unsur-unsur esensial akan menimbulkan gangguan fisiologis.
b. Bahan Tanaman (eksplan)
dihasilkan sebagai sumber eksplan merupakan tanaman yang sehat dan tumbuh kuat serta menggunakan jaringan yang muda dan ukuran eksplan yang cukup besar.
Menurut Conger (1981), eksplan yang digunakan dapat berasal dari daun, umbi, dan anther. Gunawan (1995) menambahkan bahwa eksplan yang akan digunakan dalam perbanyakan secara kultur jaringan harus dalam keadaan aseptik. Faktor yang perlu diperhatikan dalam pemilihan eksplan yaitu ukuran eksplan, sumber eksplan, dan sebaiknya tidak terinfeksi oleh penyakit. Jenis eksplan akan mempengaruhi morfogenesis suatu kultur in-vitro (Wattimena et al. 1992).
c. Faktor Lingkungan
Beberapa kondisi lingkungan seperti cahaya, suhu dan fase-fase gas mempengaruhi pertumbuhan tanaman dalam kultur in vitro, karena faktor-faktor tersebut diduga mempunyai pengaruh yang penting pada bagian tanaman dalam mikropropagasi (Mantell dan Smith. 1985).
Intensitas cahaya yang rendah dapat mempertinggi embriogenesis dan organogenesis. Temperatur yang dibutuhkan untuk dapat terjadi pertumbuhan yang optimum umumnya berkisar 20° - 30°C (Hendaryono dan Wijayani 1994, diacu dalam Wirawan 2003).
d. Zat Pengatur Tumbuh (ZPT)
Dalam perbanyakan secara kultur jaringan, peranan ZPT sangatlah besar. ZPT yang dihasilkan oleh tanaman disebut fitohormon sedangkan yang sintetik disebut ZPT tanaman sintetik (Wattimena 1988). Zat tumbuh (plant growth regulation) atau pengatur tumbuh adalah senyawa organik bukan nutrisi tanaman yang pada konsentrasi rendah aktif merangsang, menghambat atau merusak pertumbuhan dan perkembangan tanaman secara kuantitatif maupun kualitatif (Moore 1979).
Zat pengatur tumbuh (plant regulator) pada tanaman adalah senyawa organik bukan hara, yang dalam jumlah sedikit dapat mendukung, menghambat
dan dapat mengubah proses fisiologis tumbuhan (Abidin 1985). Wattimena (1988), membedakan 6 kelompok zat pengatur tumbuh, yaitu auksin, giberelin, asam abisik (ABA), etilen, dan retardan. Namun ada dua golongan zat pengatur tumbuh yang sangat penting dalam kultur jaringan, yaitu sitokinin dan auksin. Sitokinin dan auksin ini berfungsi untuk merangsang pertumbuhan akar dan pucuk (Gunawan 1995).
Menurut Abidin (1985), zat pengatur tumbuh di dalam tanaman terdiri atas 5 kelompok yaitu : auksin, giberelin, sitokinin, etilen, dan inhibitor dengan ciri khas dan pengaruh yang berlainan terhadap proses fisiologis. Tanaman memiliki kemampuan untuk merubah zat pengatur tumbuh itu menjadi lebih aktif atau kurang aktif. Kemampuan metabolisme tanaman itu sangat tergantung kepada genetik tanaman. Menurut Hartmann dan Kester (1968), dua macam zat pengatur tumbuh yang sangat penting dalam kultur jaringan adalah auksin dan sitokinin, yang mengontrol/ mengatur pembentukan pucuk akar dan kalus. Zat pengatur tumbuh memegang peranan penting dalam pertumbuhan dan perkembangan kultur. Faktor yang perlu mendapat perhatian dalam penggunaan zat pengatur tumbuh antara lain jenis zat pengatur tumbuh yang akan digunakan, konsentrasi, urutan penggunaan, dan periode masa induksi dalam kultur tertentu (Gunawan 1995).
2.3 Zat Pengatur Tumbuh Sitokinin BAP (Benzylaminopurin)
Menurut Abidin (1985), sitokinin merupakan senyawa yang mempunyai bentuk dasar adenin (6-amino purin) yang mendukung terjadinya pembelahan sel. Sedangkan Prawiranata et al. (1985) diacu dalam Nawangsasih (1989), sitokinin berpengaruh sangat luas pada proses-proses fisiologis dalam tumbuhan, aktifitas utama adalah mendorong pembelahan sel. Sitokinin juga membantu perkembangan dari embrio pada perkembangan biji, dan pada keadaan tertentu sitokinin mendorong pembesaran sel dari lempeng daun dan kotiledon.
sitokinin sintetik, yang dalam penggunaannya dipengaruhi oleh ZPT lainnya. Sitokinin mempengaruhi berbagai proses fisiologi di dalam tanaman. Aktivitas yang utama dari sitokinin adalah sitokenesis atau pembelahan sel. Aktivitas ini yang menjadi kriteria utama untuk menggolongkan suatu zat pengatur tumbuh ke dalam sitokinin (Wattimena 1988).
2.4 Penelitian Kemaitan yang Telah Dilakukan
Beberapa penelitian terhadap kemaitan yang telah dilakukan diantaranya oleh Adhiyanto (2001) dan Zumrotun (2006), ringkasan hasilnya dapat dilihat pada Tabel 1.
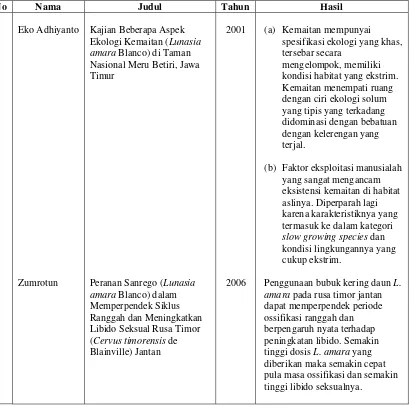
Tabel 1 Ringkasan hasil penelitian kemaitan yang telah dilakukan
No Nama Judul Tahun Hasil amara Blanco) di Taman Nasional Meru Betiri, Jawa Timur
Peranan Sanrego (Lunasia amara Blanco) dalam Memperpendek Siklus Ranggah dan Meningkatkan Libido Seksual Rusa Timor (Cervus timorensis de Blainville) Jantan
2001
2006
(a) Kemaitan mempunyai spesifikasi ekologi yang khas, tersebar secara
mengelompok, memiliki kondisi habitat yang ekstrim. Kemaitan menempati ruang dengan ciri ekologi solum yang tipis yang terkadang didominasi dengan bebatuan dengan kelerengan yang terjal.
(b) Faktor eksploitasi manusialah yang sangat mengancam eksistensi kemaitan di habitat aslinya. Diperparah lagi karena karakteristiknya yang termasuk ke dalam kategori slow growing species dan kondisi lingkungannya yang cukup ekstrim.
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Unit Kultur Jaringan Laboratorium Konservasi
Tumbuhan Departemen Konservasi Sumberdaya Hutan dan Ekowisata, Fakultas
Kehutanan Institut Pertanian Bogor. Penelitian dilaksanakan selama 5 bulan,
terhitung dari bulan September 2006 sampai akhir Januari 2007.
3.2 Bahan dan Alat Penelitian 3.2.1 Bahan Penelitian
a. Bahan Media
Media yang digunakan dalam penelitian ini adalah media MS (Murashige
Skoog). Media ditambahkan zat pengatur tumbuh sitokinin BAP (Benzylaminopurin)
dengan beberapa konsentrasi yang berbeda yaitu 0; 0,5; 1; 1,5 dan 2 mg/l. Media MS
ini dibuat dalam bentuk padat dengan menambahkan agar-agar pada media.
b. Bahan Tanaman
Bahan tanaman yang digunakan sebagai eksplan dalam penelitian ini adalah
pucuk kemaitan (Lunasia amara Blanco.) dari koleksi tanaman Laboratorium
Konservasi Tumbuhan Departemen Konservasi Sumberdaya Hutan dan Ekowisata,
Fakultas Kehutanan Institut Pertanian Bogor. Ukuran pucuk yang digunakan
panjangnya kurang lebih 2 cm. Ukuran pucuk yang dijadikan eksplan mempengaruhi
keberhasilan viabilitas pada kondisi invitro. Pucuk dengan ukuran lebih besar
biasanya lebih tahan saat dipindahkan pada kondisi invitro serta pertumbuhan lebih
cepat (Wattimena et al. 1992).
Tanaman induk sebagai sumber eksplan dalam kondisi tumbuh yang baik, hal
ini dapat dilihat pada saat pemotongan pucuk, induk sedang berbunga tanpa terjadi
kerontokan, daun tidak layu dan berwarna hijau tua, serta tinggi rata-rata tanaman
c. Bahan Sterilisasi
Sterilisasi dilakukan terhadap bahan (eksplan dan media) serta alat-alat yang
digunakan. Bahan-bahan sterilisasi tersebut diantaranya : bubuk deterjen, fungisida
cair, HgCl2, alkohol 70%, klorin, cairan antiseptik dan air steril.
3.2.2 Alat-alat
Alat-alat yang digunakan dalam penelitian ini meliputi botol kultur, oven,
kompor gas, gelas piala, hot plate dan magnetic stirer, cawan petri, spatula,
autoclave, bunsen, kertas pH, pipet, scalpel, pinset, timbangan analitik, Laminar Air Flow Cabinet, sprayer, termometer ruangan, timer, rak-rak kultur, dan Air Conditioner (AC).
Dengan masing-masing spesifikasi kegunaan sebagai berikut,
1. Kegiatan sterilisasi
a. Autoclave untuk mensterilkan alat dan media
b. Oven sebagai tempat penyimpanan peralatan yang telah disterilkan
c. Bunsen digunakan untuk mensterilkan alat yang digunakan saat
melakukan penanaman
d. Kompor gas digunakan untuk memanaskan autoclave
2. Kegiatan pembuatan media
a. Timbangan analitik untuk menimbang bahan-bahan penyusun media
b. Pipet 10 ml untuk pengambilan larutan dalam pembuatan media
c. Hot plate and magnetic stirer sebagai tungku pemanas listrik dan pengaduk magnetik dalam pembuatan media
d. Gelas piala 1000 ml digunakan sebagai wadah dalam pembuatan media
e. Kertas pH untuk mengetahui tingkat kemasaman atau basa dalam
pembuatan media
3. Kegiatan penanaman
a. Cawan petri digunakan sebagai tempat memotong eksplan
b. Scalpel untuk memotong eksplan
c. Pinset untuk menanam eksplan
d. Laminar Air Flow Cabinet sebagai ruang kerja dalam penanaman eksplan
4. Inkubasi
a. Rak kultur sebagai tempat menyimpan botol kultur
b. Termometer ruangan untuk mengetahui suhu ruangan inkubasi
c. Timer untuk mengatur lamanya pencahayaan
d. Air Conditioner (AC) untuk menjaga suhu tetap stabil yaitu sekitar 25-28°C.
3.3 Metode Penelitian
3.3.1 Pembuatan Media Kultur
Tahapan pertama dalam pelaksanaan kultur jaringan adalah persiapan media.
Dalam media diberikan berbagai garam mineral, air, gula (sukrosa), asam amino,
vitamin, zat pengatur tumbuh (ZPT), dan agar sebagai pemadat media. Hal ini
bermanfaat bagi pertumbuhan dan perkembangan eksplan.
Langkah awal dalam pembuatan media kultur adalah pembuatan larutan
induk (stock), yang terdiri atas larutan induk unsur makro-mikro, larutan induk
vitamin, larutan induk Fe-EDTA dan myo-inositol (Lampiran 1). Pembuatan larutan
induk ini bertujuan untuk efisiensi dan kecermatan pekerjaan menimbang bahan
kimia.
Adapun tahapan selanjutnya dalam pembuatan media MS padat sebanyak 1
liter adalah sebagai berikut:
a. 500 ml air aquades ditambahkan ke dalam gelas piala 1000 ml.
b. Dimasukkan larutan stok sesuai konsentrasi penggunaan, terdiri dari larutan
A sebanyak 20 ml/l, larutan B sebanyak 20 ml/l, larutan C sebanyak 5 ml/l,
larutan D sebanyak 5 ml/l, larutan E sebanyak 5 ml/l, larutan F sebanyak 5
ml/l, vitamin sebanyak 5 ml/l dan Myo-inositol sebanyak 10 ml/l, pembuatan
larutan stok untuk media MS dapat dilihat pada Lampiran 1.
c. Ditimbang dan dimasukkan 30 gram gula pasir.
d. Dijadikan volume larutan mendekati 1000 ml, dengan batang magnetik di
dalamnya. Kemudian ukur pH pada kisaran 5.7-6 dengan penambahan NaOH
bila terlalu asam atau HCl bila terlalu basa.
e. Ditambahkan pemadat yaitu agar-agar sebanyak 7 gram, lalu dipanaskan
f. Ditambahkan larutan zat pengatur tumbuh sesuai dengan kebutuhan
(konsentrasi BAP 0; 0,5; 1; 1,5; 2 mg/l). Setiap perlakuan dibuat 10 ulangan.
g. Dituangkan media tersebut ke dalam botol kultur sebanyak 20 ml per botol
untuk seluruh perlakuan, dan ditutup..
h. Tahapan terakhir, botol kultur yang berisi media dimasukkan ke dalam
autoclave dengan suhu 121°C (250°F) pada tekanan 17,5 pound square inchi (psi) selama 20 menit.
i. Waktu sterilisasi dihitung setelah tekanan yang diinginkan tercapai. Setelah
pemanasan dengan autoklaf selesai, media dibiarkan menjadi dingin pada
suhu kamar, dan disimpan dalam ruang inkubasi dengan suhu 26°C.
Menurut Sandra (2003), media yang telah disterilisasi disimpan di tempat
yang sejuk dan dibiarkan selama 1 minggu. Hal ini bertujuan untuk mengetahui ada
tidaknya kontaminasi di dalam media kultur sebelum digunakan untuk menanam
eksplan. Skema prosedur pembuatan media MS dapat dilihat pada Lampiran 2.
3.3.2 Sterilisasi
a. Sterilisasi Lingkungan Kerja
Untuk menjaga kebersihan lingkungan kerja dapat dilakukan dengan cara
menerapkan peraturan tertentu dengan membatasi orang-orang yang masuk ke dalam
ruangan dan selalu membersihkannya dua hari sekali dengan cairan desinfektan.
Permukaan tempat kerja harus selalu dibersihkan, baik sebelum, selama maupun
setelah digunakan. Pembersihan dapat dilakukan dengan kapas atau tisu yang telah
disemprot/ dicelupkan ke dalam alkohol 70%. Sebelum dan selama pemakaian,
blower atau peniup udara dalam laminar air flow cabinet harus selalu dinyalakan, hal ini dilakukan untuk menghindari kontaminan masuk kedalam botol kultur saat
penanaman. Selain itu pada saat memulai pekerjaan dilakukan penyemprotan dengan
alkohol 70% baik terhadap kedua telapak tangan, kotak tanam maupun alat-alat yang
akan dipakai dalam kotak tanam.
b. Sterilisasi Alat-alat dan Media Kultur
Alat-alat yang digunakan dalam penelitian harus selalu dalam keadaan steril.
scalpel, spatula) dibungkus rapi dengan kertas koran. Semuanya itu disterilkan dengan autoklaf pada suhu 121°C (250°F) pada tekanan 17,5 pound square inchi
(psi) selama 1 jam. Penghitungan waktu sterilisasi dimulai setelah tekanan yang
diinginkan tercapai.
Pada saat melakukan penanaman, alat-alat diseksi seperti pinset, dan mata
pisau scalpel disterilkan dengan pembakaran di atas api bunsen, setelah sebelumnya
dicelupkan dalam alkohol 70%.
Media tanam dan air mineral/galon juga disterilkan dengan autoklaf. Air
galon disterilisasi dengan waktu, suhu, dan tekanan yang sama untuk sterilisasi alat,
air galon ini disterilkan guna mendapatkan air steril yang akan digunakan pada saat
sterilisasi eksplan sebelum di tanam, sedangkan media disterilkan dengan autoklaf
pada suhu 121°C (250°F) pada tekanan antara 15-17,5 psi selama 20-25 menit.
c. Sterilisasi Eksplan
Bagian pucuk kemaitan dipotong sepanjang 2 cm dari tanaman induknya
dengan menggunakan pisau silet yang tajam. Setelah jumlah pucuk terpenuhi,
kegiatan sterilisasi dilakukan di laboratorium, sebagai berikut :
1. Pucuk dibersihkan dari segala kotoran yang menempel dan mengalirinya
dengan air ledeng selama 15 menit. Hal ini dilakukan untuk mensiasati agar
kandungan tanin/ alkaloid pada eksplan dapat keluar habis sehingga pada saat
penanaman nanti dapat mereduksi timbulnya peristiwa browning.
2. Eksplan direndam dalam larutan deterjen encer 3g/l selama 7 menit sambil
mengocoknya lalu membilasnya dengan air steril 3 kali hingga bersih.
3. Kemudian eksplan direndam dalam larutan fungisida cair 0,5% sambil
mengocoknya selama 5 menit. Lalu membilasnya dengan air steril 3 kali
hingga bersih.
4. Tahapan sterilisasi selanjutnya dilakukan dalam laminar atau kotak tanam.
Eksplan direndam dan dibilas kembali dengan air steril selama 1 menit.
5. Sebelum sterilisasi dengan menggunakan cairan pemutih pakaian dilakukan,
bahan eksplan direndam terlebih dahulu ke dalam larutan HgCl2 0,5mg/l
selama 6 menit, seluruh bagian tanaman terendam dalam larutan. Setelah
6. Barulah, sterilisasi lanjutan dilakukan dalam larutan cairan pemutih pakaian
yaitu masing-masing dengan konsentrasi 9% selama 5 menit, kemudian
larutan 6% selama 5 menit, lalu larutan 3% selama 5 menit. Setiap kali
sesudah sterilisasi dalam larutan pemutih pakaian, bahan eksplan tersebut
dibilas dengan air steril 3 kali. Setelah itu barulah ke tahap selanjutnya yaitu
penanaman eksplan.
3.3.3 Penanaman
Penanaman dilakukan dalam kotak tanam (Laminar Air Flow Cabinet).
Eksplan pucuk yang sudah melewati tahap sterilisasi, dipindahkan ke dalam cawan
petri yang telah berisi air steril setinggi ±1/6 tinggi cawan petri dan 3 tetes cairan
antiseptik. Berbeda dengan teknik kultur meristem, dalam kultur pucuk, daun
primordia tidak perlu dihilangkan.
Kemudian pucuk diiris dengan keseragaman panjang (1cm). Setelah itu
potongan-potongan tersebut ditanam pada botol kultur dengan media kultur yang
telah disiapkan sesuai perlakuan. Satu botol kultur digunakan untuk satu eksplan.
3.4 Pengamatan (peubah yang diukur)
Pengamatan dilakukan terhadap seluruh eksplan yang ditanam pada setiap
satuan perlakuan, meliputi
a. Persentase hidup kemaitan dalam kultur jaringan (kuantitatif)
b. Persentase kontaminan cendawan (kuantitatif)
c. Persentase browning (kuantitatif)
d. Morfologi daun meliputi warna dan bentuk secara visual (kualitatif)
e. Tinggi tanaman kultur (kuantitatif)
3.5 Metode Analisis
Rancangan yang digunakan dalam menganalisis hasil penelitian ini adalah
Rancangan Acak Lengkap (RAL) dengan jumlah perlakuan 5 dan jumlah ulangan 10.
Sehingga total kultur yang diamati adalah 5 x 10 = 50 satuan percobaan (botol).
Faktor atau perlakuan yang digunakan adalah konsentrasi BAP yang diberikan pada
Model umum rancangan yang digunakan adalah sebagai berikut (Mattjik dan
µ = Nilai tengah rata-rata umum penelitian (populasi)
τi = Pengaruh perlakuan/ konsentrasi BAP ke-i
εij = Pengaruh galat atau sisa percobaan pada eksplan kemaitan ke-j yang memperoleh perlakuan konsentrasi BAP ke-i.
Faktor perlakuan konsentrasi BAP ke-i: A (Kontrol) : Konsentrasi BAP 0 mg/l
B : Konsentrasi BAP 0,5 mg/l
C : Konsentrasi BAP 1 mg/l
D : Konsentrasi BAP 1,5 mg/l
E : Konsentrasi BAP 2 mg/l
Untuk mengetahui pengaruh yang diberikan pada penelitian ini maka
dilakukan uji F dan dilakukan uji lanjutan Tukey untuk mengetahui perbedaan
pengaruh tersebut antar taraf perlakuan.
Pengujian Hipotesis
Hipotesis yang dirumuskan dalam penelitian ini adalah:
H0 = Penambahan ZPT BAP tidak memberikan pengaruh yang berbeda nyata
terhadap pertumbuhan eksplan. (Sig. > 0,05)
Ha = Penambahan ZPT BAP memberikan pengaruh yang berbeda nyata terhadap
pertumbuhan eksplan. (Sig. < 0,05)
Pengolahan data dilakukan dengan menggunakan perangkat lunak Statistical
4.1 Peluang Hidup Tanaman Kultur
Penelitian kultur jaringan kemaitan (Lunasia amara Blanco.) ini menggunakan 50 eksplan pucuk dengan 5 jenis perlakuan medium berupa zat pengatur tumbuh sitokinin BAP (Benzylaminopurin) dengan taraf konsentrasi yang berbeda yaitu; 0 mg/l (kontrol); 0,5 mg/l; 1 mg/l; 1,5 mg/l dan 2 mg/l. Setiap jenis perlakuan dilakukan 10 ulangan.
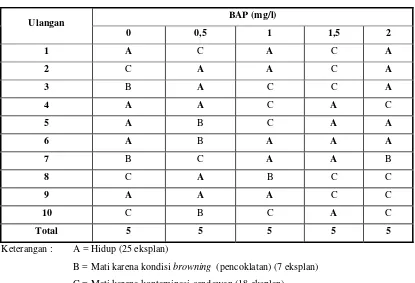
Berdasarkan hasil pengamatan diketahui adanya respon eksplan terhadap medium perlakuan yang ditunjukkan dengan tetap hidupnya eksplan selama 12 minggu setelah tanam (MST) yang dapat dilihat pada Tabel 2.
Tabel 2 Data eksplan pucuk kemaitan yang hidup hingga 12 MST BAP (mg/l)
B = Mati karena kondisi browning (pencoklatan) (7 eksplan)
C = Mati karena kontaminasi cendawan (18 eksplan)
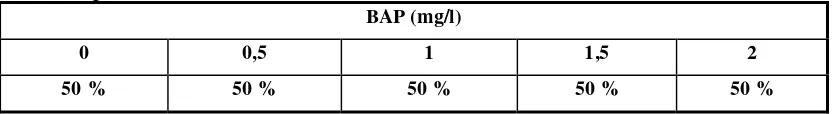
Tabel 3 Persen rata-rata peluang hidup eksplan pucuk kemaitan dalam medium perlakuan selama 12 MST
BAP (mg/l)
0 0,5 1 1,5 2
50 % 50 % 50 % 50 % 50 %
Keterangan : Persen dihitung berdasarkan data reaksi jaringan yang hidup.
Data dari Tabel 3 menunjukkan bahwa persentase peluang hidup dari total eksplan sebanyak 50 pucuk untuk masing-masing taraf perlakuan adalah sama yaitu 50 %.
4.2 Penyebab Kematian pada Tanaman Kultur
Selama kegiatan penelitian berlangsung, kematian pada eksplan disebabkan oleh 2 (dua) faktor yaitu kontaminasi cendawan dan peristiwa pencoklatan (browning). Pada Tabel 2 terlihat bahwa kematian pada eksplan didominasi oleh faktor kontaminasi cendawan yaitu sebanyak 18 eksplan sedangkan kematian yang disebabkan kondisi browning adalah sebanyak 7 eksplan.
4.2.1 Pencoklatan (Browning)
Browning atau pencoklatan adalah salah satu masalah yang sering terjadi dalam kegiatan kultur jaringan. Terutama apabila eksplan yang digunakan berasal dari jaringan tanaman berkayu dan tanaman yang mengandung banyak zat ekstraktif berupa alkaloid.
Menurut Collins dan Edwards (1998), browning merupakan terjadinya warna coklat pada jaringan yang baru disayat atau dipotong. Hal ini disebabkan karena terjadinya reaksi antara senyawa fenolik yang diproduksi jaringan dengan oksigen dalam botol kultur. Mereka pun menambahkan bahwa senyawa fenolik diproduksi sebagai respon atas kondisi stress yang dialami oleh tanaman. Pernyataan ini sesuai dengan hasil pengamatan bahwa setelah 1 MST, beberapa eksplan yang mengalami peristiwa browning pada akhirnya mati karena keracunan, akibat dari terserapnya senyawa fenolik yang terakumulasi pada media oleh tanaman kultur (Gambar 2).
Gambar 2 Kondisi browning pada beberapa eksplan kemaitan.
4.2.2 Kontaminasi Cendawan
Kontaminasi adalah gangguan yang sangat umum terjadi dalam kegiatan kultur jaringan, munculnya gangguan ini dipahami sebagai hal yang wajar sebagai konsekuensi penggunaan media yang diperkaya (Santoso dan Nursandi 2003, diacu dalam Sudrajat 2005).
Kematian karena faktor kontaminasi selama penelitian dapat dipastikan akibat adanya aktifitas hidup cendawan dalam media kultur. Hal ini diduga karena mikroorganisme yang tampak dalam media kultur berupa bubuk putih halus dan menyerupai spora serta tidak berlendir. Bila dibiarkan terus menerus tanpa adanya kegiatan penyelamatan eksplan, maka dapat memacu pertumbuhan cendawan dan mendominasi permukaan media, sehingga eksplan yang ditanam tidak lagi memiliki ruang tumbuh atau pertumbuhannya kalah cepat dengan cendawan yang terus memperbanyak diri. Dan akhirnya eksplan pun akan mengalami kematian.
Keberadaan cendawan ini diduga bukan berasal dari faktor internal tumbuhan, tetapi dikarenakan adanya agen cendawan yang berasal dari botol kultur yang kurang steril, akibat pencucian yang kurang bersih. Selain itu juga diduga akibat kurangnya keterampilan peneliti pada saat penanaman (inokulasi) yang menyebabkan adanya mikroorganisme berupa spora cendawan yang masuk dalam media kultur. Kondisi lingkungan kultur pun diduga sebagai penyebab kontaminasi, karena mikroorganisme untuk jenis cendawan dapat mudah tersebar dengan bantuan aliran udara, dan bila mikroorganisme ini jatuh dalam media maupun eksplan, maka cendawan mampu tumbuh dan berkembangbiak.
Dari Gambar 3 dapat dilihat serangan cendawan pada awalnya tidak terlalu tampak terlihat karena hanya berkembang pada beberapa titik saja pada media. Akan tetapi dengan seiring berjalannya waktu, cendawan mulai memperbanyak diri dan mendominasi di dalam media dibandingkan dengan tanaman kultur, pada akhirnya pertumbuhan tanaman kultur menjadi terhambat dan mengalami kematian karena tidak mampu bersaing dengan pertumbuhan cendawan yang begitu cepat.
Adapun upaya yang telah dilakukan untuk mengurangi terjadinya kontaminasi baik itu cendawan, bakteri maupun mikroorganisme lainnya adalah dengan melakukan sterilisasi bertahap terhadap bahan tanaman (eksplan). Proses sterilisasi tersebut melibatkan beberapa bahan sterilan yaitu fungisida, HgCl2, dan
klorin.
Pengambilan eksplan yang berasal dari alam umumnya memiliki resiko untuk terjadinya kontaminasi yang sangat tinggi, baik itu kontaminasi eksternal maupun internal. Kontaminasi internal umumnya berasal dari bahan eksplan itu sendiri, sedangkan kontaminasi eksternal umumnya disebabkan jamur dan bakteri. Untuk mengatasi kontaminasi internal digunakanlah HgCl2 karena mampu
menurunkan laju kontaminasi bakteri internal tanpa merusak jaringan.
Penggunaan fungisida, HgCl2 dan klorin mampu menghasilkan kondisi yang
lebih menguntungkan karena kombinasi dari ketiga bahan sterilan tersebut merupakan usaha sterilisasi berlapis yang mampu mereduksi resiko terjadinya kontaminasi baik dari bakteri, cendawan maupun kotoran-kotoran lain yang menempel pada permukaan eksplan.
4.3 Kondisi Pertumbuhan Tanaman Kultur
4.3.1 Morfologi Daun Tanaman Kultur
Salah satu peubah yang dapat dijadikan sebagai parameter pertumbuhan dari suatu tanaman adalah serangkaian aktifitas dari sebuah organ daun. Pertumbuhan ini ditandai dengan perubahan morfologi pada daun, pertambahan ukuran daun menjadi besar dan terjadinya pelebaran daun atau perekahan sempurna.
Pengamatanmorfologi daun dilakukan setelah kultur berumur 7 MST, hal ini dikarenakan pada umur tersebut pertumbuhan dan perubahan morfologi daun dapat dengan mudah diamati. Peubah morfologi daun yang diamati meliputi bentuk dan warna daun. Pengamatan morfologi daun dijumpai keseragaman bentuk. Secara umum daun tanaman kultur memiliki bentuk sasak oblong-obovate dengan ujung daun yang sedikit meruncing (Gambar 4).
6 : 1
Gambar 4 Bentuk daun tanaman kultur kemaitan.
Beberapa organ tanaman mempunyai pola pertumbuhan determinate
sedangkan organ-organ yang lain bersifat in-determinate. Pola pertumbuhan
Gugurnya daun dari batang dikenal dengan istilah absisi. Proses absisi ini didahului oleh perubahan struktur dan susunan kimia pada daerah di sekitar pangkal daun, tempat ini disebut daerah absisi. Pada tanaman dikotil berkayu di daerah absisi terdapat 2 (dua) lapisan yang berbeda yaitu lapisan pemisah dan lapisan pelindung (Tjitrosomo 1984). Lapisan pemisah menyebabkan pemisahan dan lapisan pelindung yang melindungi permukaan yang terdedah dari kekeringan dan serangan parasit. Proses absisi dapat dilihat pada Gambar 5 berikut ini.
Gambar 5 Proses absisi pada salah satu tanaman kultur kemaitan.
Tjitrosomo (1984) menambahkan, gugurnya daun adalah sifat tumbuhan berkayu. Jatuhnya daun dipercepat oleh faktor-faktor lingkungan, seperti mengerutnya daun pada hari terang dan panas, pukulan air hujan pada daun, suatu lapisan pelindung dari gabus terbentuk tepat di bawah lapisan pemisah dan melindungi jaringan batang yang terbuka.
Selama penelitian, daun yang diamati adalah daun yang sudah ada yaitu daun primordia yang menutupi bagian meristem pucuk yang berkembang dan merekah sempurna. Daun ini tetap ada karena saat penanaman daun primordia ini tidak dihilangkan, hal ini dimaksudkan agar eksplan dapat tumbuh dan memiliki daya viabilitas yang cukup ketika tumbuh dalam lingkungan media kultur.
Dari hasil pengamatan, hampir seluruh eksplan tidak mengalami multiplikasi tunas, atau tumbuhnya tunas baru. Dari 25 eksplan yang hidup, hanya satu eksplan (BAP 1,5 mg/l) saja yang mengalami multiplikasi tunas. Hal ini karenakan sel-sel meristematik pada jaringan organ pucuk kurang aktif membelah dan kemampuan setiap sel untuk bermultiplikasi dan kemapuan sel membentuk jaringan adalah berbeda.
jenis zat pengatur tumbuh yang diberikan sebagai perlakuan dapat menjadi faktor penyebab tidak terjadinya pertumbuhan tunas baru, hal ini dikarenakan belum adanya literatur yang merekomendasikan jenis media yang cocok untuk jenis kemaitan.
4.3.2. Pertumbuhan Tinggi Tanaman Kultur
Tinggi merupakan ukuran tanaman yang sering digunakan sebagai parameter pertumbuhan karena mudah untuk diamati (Sitompul dan Guritno 1995). Pertumbuhan batang terjadi melalui 2 (dua) proses, yaitu pembelahan dan pemanjangan sel daerah meristem apikal. Selain itu menurut Heddy (1991), kedua proses tersebut terjadi pada jaringan meristem, yaitu pada titik tumbuh batang. Saat pengamatan, semua tanaman kultur mengalami pembesaran, pemanjangan batang dan pertumbuhan ke arah tinggi. Hal ini dikarenakan eksplan pucuk sudah memiliki titik tumbuh berupa jaringan meristematik, sehingga pertumbuhan selanjutnya sudah terarah.
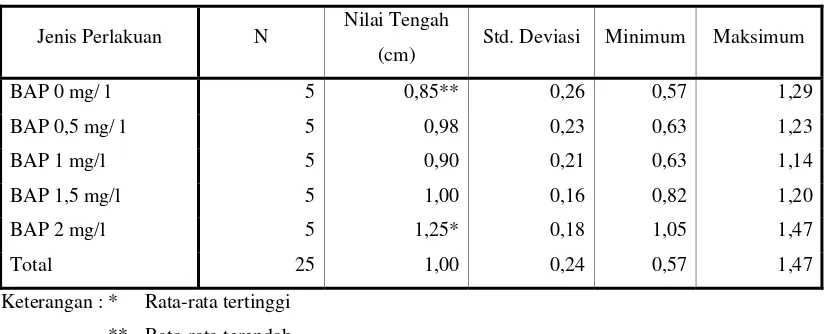
Tabel 4 berikut merupakan ringkasan statistik deskriptif pada setiap kelompok sampel, yang dapat diinterpretasi sebagai berikut. Produktivitas tinggi pada perlakuan BAP 0 mg/l memiliki rata-rata adalah 0,85 cm, dengan standar deviasi 0,26 dan rata-rata standar error 0,11. produktivitas tinggi minimum 0,57 cm dan maksimum 1,29 cm. Demikian pula hingga perlakuan terakhir.
Tabel 4 Data hasil pengamatan tinggi kemaitan
Jenis Perlakuan N Nilai Tengah
(cm) Std. Deviasi Minimum Maksimum
Keterangan : * Rata-rata tertinggi
** Rata-rata terendah
mg/l, tetapi masih memerlukan pengujian lanjut untuk mengetahui apakah perbedaan tersebut signifikan pada taraf kepercayaan 95% atau p<0,05.
Kegiatan penelitian ini dirancang dengan melibatkan satu faktor yaitu zat pengatur tumbuh BAP dan 5 taraf sebagai perlakuan yang dirancang dalam pola acak lengkap. Penggunaan pola acak lengkap dikarenakan penelitian dilakukan di laboratorium, sehingga kehomogenan unit percobaan bisa dijamin. Selain itu, kehomogenan pun harus dimiliki oleh semua sampel percobaan. Untuk memastikan sampel yang digunakan memiliki variasi yang sama, dapat diketahui melalui pengolahan data dari hasil pengamatan terhadap tinggi tanaman kultur.
Analisis dari Tabel 5 merupakan ringkasan hasil pengujian untuk menentukan apakah data memenuhi atau tidak memenuhi terhadap persyaratan asumsi uji ANOVA , yaitu homogenitas (mempunyai varian sama).
Tabel 5 Tes Homogenitas dalam varian
Levene Statistic db1 db2 Sig.
0,105 4 20 0,98
Keputusan: Levene Test hitung= 0,105 ternyata memiliki probabilitas (sig.)= 0,98. Akibat nilai probabilitas >0,05 maka kelima varian populasi adalah homogen. Dengan demikian asumsi homogenitas varian telah terpenuhi, sehingga uji one way anova dapat dilanjutkan, seperti tercantum pada Tabel 6.
Tabel 6 Hasil uji Anova
JK db KT F Sig.
Perlakuan 0.47 4 0,11 2,58 0,06
Galat 0,91 20 0,04
Total 1,39 24
Sehingga dapat ditarik kesimpulan bahwa terbukti secara meyakinkan bahwa kelima taraf perlakuan BAP tidak menyebabkan perbedaan nyata produktivitas tinggi eksplan kemaitan. Dikarenakan hasil yang diperoleh tidak menunjukkan perbedaan yang nyata, maka tidak perlu melakukan uji lanjut. Namun demikian agar lebih meyakinkan asumsi ini, dapat kita lihat pada uji lanjutan Tukey, dan hasilnya pada Tabel 7 berikut.
Tabel 7 Hasil uji lanjutan faktor perlakuan konsentrasi BAP terhadap tinggi Himpunan bagian
Jenis perlakuan N
1
Keterangan : Huruf yang sama dibelakang rata-rata menunjukkan pengaruh yang tidak berbeda nyata pada taraf kepercayaan 95%.
Tabel 7 menunjukkan bahwa pengaruh perlakuan BAP pada setiap taraf perlakuan tidak menunjukkan pengaruh yang berbeda nyata. Lebih jelasnya dapat dilihat pada Gambar 6.
ê ê ê ê ê
Berdasarkan analisis statistik, semua taraf perlakuan BAP tidak berpengaruh nyata terhadap parameter tinggi tanaman kultur. Akan tetapi secara deskriptif dan visual, konsentrasi BAP dengan taraf 2 mg/l mampu menghasilkan tinggi rata-rata terbesar yaitu 1,25 cm dibandingkan dengan taraf konsentrasi yang lain. Hal ini dikarenakan pada media yang diberi perlakuan BAP 2 mg/l mampu menstimulir aktivitas sel-sel meristematik pada batang tanaman kultur, sehingga pertumbuhan tinggi tanaman lebih cepat dibanding kontrol dan taraf konsentrasi BAP yang lain.
4.4 Kendala yang dihadapi dalam Kultur Jaringan Kemaitan
Di daerah Bogor tidak dapat ditemukan spesies kemaitan yang tumbuh secara alami. Hal ini dikarenakan penyebarannya hanya berkisar pada wilayah timur Indonesia. Eksplan pucuk kemaitan yang digunakan berasal dari tanaman koleksi Laboratorium Konservasi Tumbuhan Departemen Konservasi Sumberdaya Hutan dan Ekowisata Fakultas Kehutanan Institut Pertanian Bogor.
Akibat keterbatasan tanaman kemaitan, maka jumlah pucuk yang dihasilkan pun sangat terbatas yaitu ± 30 pucuk per tanaman. Oleh karena itu, jumlah pucuk yang dijadikan eksplan ditetapkan jumlahnya sebanyak 50 pucuk yang diambil dari 2 (dua) tanaman kemaitan, yang kondisi pertumbuhannya seragam. Kedua tanaman kemaitan tersebut dalam keadaan sehat, hal ini dapat dilihat dari warna daun yang hijau tua, daun tidak layu, berbunga tanpa terjadi kerontokan, serta tinggi rata-rata tanaman sekitar 2,5 meter. Pucuk yang dipilih adalah pucuk yang relatif besar, hijau dan segar, secara keseluruhan terlihat baik. Menurut Murashige (1977) diacu dalam Nawangsasih (1989), ukuran eksplan menentukan kemampuan hidup kultur. Secara umum semakin besar eksplan maka semakin baik kemampuan hidupnya.
5.1 Kesimpulan
Kesimpulan yang dapat dikemukakan dalam penelitian ini adalah :
1. Secara umum kondisi pertumbuhan kemaitan dalam kultur jaringan belum mampu mengalami proses multiplikasi tunas, pertumbuhan eksplan hanya ke arah tinggi dan pembesaran jaringan.
2. Berdasarkan analisis statistik, semua taraf perlakuan BAP tidak berpengaruh nyata terhadap produktivitas tinggi tanaman kultur. Akan tetapi secara deskriptif dan visual, konsentrasi BAP dengan taraf 2 mg/l mampu menghasilkan tinggi rata-rata terbesar.
3. Semua taraf perlakuan BAP (0; 0,5; 1; 1,5; 2 mg/l) yang diberikan belum dapat dijadikan sebagai konsentrasi optimum dalam memperbanyak kemaitan melalui kultur jaringan.
5.2 Saran
Abidin Z. 1985. Dasar-dasar Pengetahuan tentang Zat Pengatur Tumbuh. Bandung: Angkasa.
Adhiyanto E. 2001. Kajian Beberapa Aspek Ekologi Kemaitan (Lunasia amara
Blanco) di Taman Nasional Meru Betiri, Jawa Timur [skripsi]. Bogor: Fakultas Kehutanan. Institut Pertanian Bogor.
Bonga JM, Durzan DJ., Nijhoff M., editor. 1982. Tissue Culture in Forestry. New York: Junk Publisher the Hague.
Collin, Edwards. 1998. Plant Cell Culture. Singapore: Bios Sci. Publ. Ltd.
Conger BV. 1981. Cloning Agricultural Plants Via Invitro Technique. Florida: CRC Press Inc.
Epstein E. 1972. Mineral Nutrition of Plants. Principles and Perspectives. New York: John Wiley and Sons. Inc.
Gunawan LW. 1995. Teknik Kultur In Vitro dalam Hortikultura. Bogor: Penebar Swadaya.
Hartmann HT, Kester DE. 1968. Plant Propagation, Principles and Practices. New York: Prentice Hall. Inc.
Heddy S. 1991. Hormon Tumbuhan. Jakarta: Rajawali.
Heyne K. 1987. Tumbuhan Berguna Indonesia. Ed ke-3. Jakarta: Badan Litbang Departemen Kehutanan.
Mantell SH, Smith H. 1985. Plant Biotechnology Society for Experimental Biology. London: Camberidge University Press. Cambridge.
Mattjik AA, Sumertajaya M. 2000. Perancangan Percobaan dengan Aplikasi SAS dan Minitab. Jilid ke-1. Bogor: IPB Pr.
Moore TC. 1979. Biochemistry and Physiology Of Plant Hormones. New York: Springer-Verlag.
Nawangsasih SR. 1989. Percobaan Perbanyakan Vegetatif Meranti Merah (Shorea leprosula Miq) melalui Kultur Jaringan [skripsi]. Bogor: Fakultas Kehutanan. Institut Pertanian Bogor.
Peni. Des 1995. Melestarikan tanaman obat dengan kultur jaringan. Trubus: 88-89 (kolom 1-8)
Rusdianto. Nov 1999. Sanrego serbuk pembangkit “semangat”. Trubus: 76-77 (kolom 1-4)
Sandra E. 2003. Kultur Jaringan Anggrek Skala Rumah Tangga. Jakarta: AgroMedia Pustaka.
Sastrapradja S, Asy`ari E, Djajasukma E. Kasim I, Lubis, Lubis SHA. 1980. Tumbuhan Obat Lembaga Biologi Nasional – LIPI. Jakarta: Balai Pustaka. Sitompul, Guritno. 1995. Analisis Pertumbuhan Tanaman. Yogyakarta: Gadjah
Mada University Pr.
Sudrajat A. 2005. Pengaruh Zat Pengatur Tumbuh Benzylaminopurin (BAP) Terhadap Pertumbuhan Zodia (Evodia suaveolens Scheff) Secara Kultur Invitro [skripsi]. Bogor: Fakultas Kehutanan. Institut Pertanian Bogor. Tjitrosomo S. 1984. Botani Umum. Jilid ke-3. Bandung: Angkasa.
Wattimena GA. 1988. Zat Pengatur Tumbuh Tanaman. Bogor: Pusat Antar Universitas Bioteknologi Institut Pertanian Bogor. hlm 1-93.
Wattimena GA, Gunawan LW, Mattjik NA, Syamsudin E, Wiendi NMA, Ernawati A. 1992. Bioteknologi Tanaman. Bogor: Pusat Antar Universitas Bioteknologi IPB – Lembaga Sumberdaya Informasi IPB.
Wirawan D. 2003. Pengaruh Konsentrasi BAP (6-Benzylaminopurin) terhadap Pertumbuhan (Kultur In Vitro) Mahkota Dewa (Phaleria macrocarpa
Scheff. Boerl.) [skripsi]. Bogor: Fakultas Kehutanan. Institut Pertanian Bogor.
Zuhud EAM, Ekarelawan, Riswan S. 1994. Hutan Tropika sebagai Sumber Plasma Nutfah Tumbuhan Obat. Di dalam: Haryanto (Editor). Pelestarian Pemanfaatan Tumbuhan Obat Hutan Tropika Indonesia. Bogor: Jurusan Konservasi Sumberdaya Hutan, Fakultas Kehutanan, IPB – Lembaga Alam Tropika Indonesia (LATIN).
Lampiran 1. Pembuatan dan Komposisi Larutan Stok MS (Murashige Skoog)
Larutan Nama Bahan
Kimia Konsentrasi (g/ l)
Lampiran 2. Skema Prosedur Pembuatan Media MS
Masukkan ZPT (BAP) Sesuai dengan perlakuan
Disimpan dalam ruang inkubasi hingga media hendak
digunakan max 8 MSP.
Tutup dan disterilkan menggunakan Autoklaf selama 20 menit dengan
tekanan 17.5 psi 121°C
Tuangkan larutan ke dalam botol kultur Masukkan agar-agar, lalu
panaskan sambil diaduk dengan pengaduk magnetik Ukur pH 5.7-6 penambahan NaOH bila terlalu asam &
HCl bila terlalu basa.
Larutan A, Larutan B, Larutan C, Larutan D
Larutan E, Larutan F Vitamin, Myo- inositol sesuai
konsentrasi penggunaan
Gelas piala 1L,
Ditambahkan aquades (500ml) hingga volume yang diinginkan
Tambahkan aquades sampai mendekati 1L
Lampiran 3. Kondisi Pertumbuhan dan Perkembangan Eksplan Lunasia amara Blanco. pada Beberapa Taraf Konsentrasi BAP
BAP 0.0 (A)
A1 A4 A5 A6 A9
BAP 0.5 (B)
B2 B3 B4 B8 B9
BAP 1.0 (C)
C1 C2 C6 C7 C9
BAP 1.5 (D)
D4 D5 D6 D7 D10
BAP 2.0 (E)
E1 E2 E3 E5 E6
Lampiran 4. Rancangan Lingkungan Acak Lengkap
B9 E4* C6 D7 A7+ B1* C7 D4 C3* D5
D1* C10* A10* D6 B7* E3 D2* A9 E7+ B3
B2 A5 C4* A4 E2 A3+ D9* B5+ A6 D10
E6 E9* B4 B6+ D3* C1 A1 C5* A8* D8*
C8+ E10* E1 E5 E8* B10+ B8 C2 C9 A2*
* Yang diarsir mati dikarenakan kontaminasi cendawan (18 eksplan)
Lampiran 5. Riwayat Kematian Eksplan
18 September 2006 (1 MST)
Cendawan : B1, C4, D1, D2, D3, E9 Browning : A3, A7, B5, B6, B10, C8, E7
25 September 2006 (2 MST)
Cendawan : A2, A8, B7,
16 Oktober 2006 (13 Oktober 2006 mati lampu dari pkl. 14.00-15.00 wib) (5
MST) - 28°C
Cendawan : C3, C5, D8, E4, E10
20 Nopember 2006 ( 16 Nopember 2006 mati lampu dari pkl. 07.00-09.00
wib) (10 MST) - 29°C
Cendawan : C10, D9
27 Nopember 2006 (11 MST)
Lampiran 6. Persentase Kematian dan Hidup Eksplan
Total Eksplan : 50 eksplan
Persentase eksplan hidup : 25 eksplan (50%)
Persentase eksplan mati : 25 eksplan (50%), dengan rincian sebagai berikut :
Persentase eksplan mati karena kontaminasi cendawan :
(Jumlah eksplan yang terkontaminasi cendawan/ jumlah total eksplan) X 100 % =(18/50) X 100% = 36%
Persentase eksplan mati karena kondisi browning :
(Jumlah eksplan yang browning/ jumlah total eksplan) X 100 % =(7/50) X 100% = 14%
Lampiran 7. Rekapitulasi Pengukuran Tinggi
BAP (mg/l) Ulangan
0 0.5 1.0 1.5 2.0
1 0,8 0,8 1,0 1,2 1,1
2 0,5 0,6 0,9 0,8 1,4
3 0,8 1,1 0,6 0,9 1,4
4 0,7 1,2 1,1 1,1 1,0
5 1,2 1,0 0,7 0,9 1,2
42
Pengamatan minggu ke : Jenis
43
Pengamatan minggu ke : Jenis
44
parameter Botol 0 1 2 3 4 5 6 7 8 9 10 11 12
E1 0.5 0.6 0.7 0.8 0.8 0.9 0.9 1 1 1.8 1.5 1.6 1.7
E2 0.5 0.6 0.7 0.9 1.2 1.3 1.5 1.7 1.8 1.9 2 2 2.1
E3 0.5 0.6 0.8 0.9 1.1 1.4 1.6 1.8 1.9 2 1.9 1.5 1.6
E4 0.5 0.7 0.8 1 1 Mati karena cendawan
E5 0.5 0.7 0.8 0.8 0.9 1 1.1 1.1 1.2 1.3 1.3 1.1 1.3
E6 0.5 0.7 0.7 0.8 1 1.2 1.4 1.4 1.5 1.5 1.5 1.5 1.5
E7 0.5 Mati karena Browning
E8 0.5 0.6 0.7 0.7 0.8 0.9 0.9 1.1 1.2 1.4 1.4 Mati cendawan
E9 0.5 Mati karena cendawan
Jenis perlakuan
BAP 2 mg/l
Tinggi (cm)
E10 0.5 0.7 0.8 0.8 1 Mati karena cendawan
MELALUI KULTUR JARINGAN
ANDRI DENISH
DEPARTEMEN
KONSERVASI SUMBERDAYA HUTAN DAN EKOWISATA
FAKULTAS KEHUTANAN
Blanco.) melalui Kultur Jaringan. Dibimbing oleh EDHI SANDRA dan AGUS HIKMAT.
Perkembangan industri obat tradisional dan jamu yang bahan bakunya berasal dari tumbuhan kemaitan (Lunasia amara Blanco.), turut meningkatkan permintaan terhadap simplisia kemaitan yang berasal dari hutan. Masalah yang berkembang selama ini, penelitian tumbuhan obat lebih terfokus pada aspek farmakologi, sedangkan penelitian untuk aspek yang lain sangat kurang, hal ini menyebabkan perhatian terhadap kelestarian tumbuhan obat kemaitan masih rendah. Penelitian kultur jaringan kemaitan menjadi penting sebagai langkah awal untuk melestarikan pemanfaatan tumbuhan obat kemaitan.
Penelitian ini bertujuan untuk mendapatkan kondisi pertumbuhan kemaitan dalam kultur jaringan serta menganalisa pengaruh media MS (Murashige Skoog) dengan penambahan zat pengatur tumbuh BAP (Benzylaminopurin) terhadap pertumbuhan kemaitan.
Pelaksanaan penelitian dilakukan pada bulan September 2006 hingga Januari 2007. Penelitian ini dilaksanakan di Unit Kultur Jaringan Laboratorium Konservasi Tumbuhan Departemen Konservasi Sumberdaya Hutan dan Ekowisata, Fakultas Kehutanan Institut Pertanian Bogor.
Bahan tanaman (eksplan) yang digunakan adalah pucuk kemaitan. Pucuk disterilisasi dengan menggunakan deterjen, fungisida, HgCl2, klorin dan dibilas
dengan air steril. Eksplan ditumbuhkan pada media MS dengan penambahan perlakuan BAP yaitu; 0; 0,5; 1; 1,5; dan 2 mg/l. Percobaan disusun dalam rancangan acak lengkap dengan 10 ulangan. Pengamatan dilakukan terhadap seluruh eksplan yang ditanam, meliputi: persentase peluang hidup eksplan, persentase pencoklatan (browning), persentase kontaminasi cendawan, morfologi daun dan tinggi tanaman.
Hasil dari penelitian ini menunjukkan bahwa semua perlakuan BAP tidak mampu membentuk tunas baru. Semua taraf perlakuan BAP yang diberikan tidak berpengaruh nyata terhadap produktivitas tinggi tanaman.
Dari penelitian ini dapat disimpulkan, semua taraf perlakuan BAP (0; 0,5; 1; 1,5; dan 2 mg/l) belum dapat dijadikan sebagai konsentrasi optimum dalam memperbanyak kemaitan melalui kultur jaringan.
amara Blanco.) through Tissue Culture. Supervisors: EDHI SANDRA and AGUS HIKMAT.
The development of traditional medicine industry and herb which is basic material came from kemaitan (Lunasia amara Blanco.), effects the demand of kemaitan from the forest increase. The problem has develop now, the medicine plant research is more focused on pharmacology aspect, while the research of the other aspects is not quite therefore attention of sustainability of kemaitan as medicine plants is low. Tissue culture research of kemaitan became important as first step to sustain the adventages medicine plant of kemaitan.
The objectives of this research are to obtain the growth condition of kemaitan in tissue culture and to analyse the influences of MS (Murashige Skoog) material with addition of growth manage matter BAP (Benzylaminopurin) kemaitan growth.
The research was conducted in September 2006 - January 2007 at the Tissue Culture Unit, Plant Conservation Laboratory, Department of Forest Resouces Conservation and Ecotourism, Forestry of Faculty, Bogor Agriculture University.
As plant materials (explant) used shoot, which was sterilized by detergent, fungicide, HgCl2, clorin and it washed with sterile water. Explant was growth in
MS material with addition BAP treatment are 0; 0,5; 1; 1,5 and 2 mg/l. The research was arranged in complete random design with 10 repetition. The observe was done to all explant, consists of explant life opportunity percentage, browning percentage, mildew contamination percentage, leaf morfology and plant height.
The result of this research showed all BAP treatment could not afford to formed new shoot, and all BAP treatment didn’t show the significant effect to the high productivity plants.
The conclusion of this research is all BAP treatment (0; 0,5; 1; 1,5; 2 mg/l) can not be as optimum concentration in the tissue culture of kemaitan propagation yet.
Perbanyakan Vegetatif Kemaitan (Lunasia amara Blanco.) melalui Kultur Jaringan adalah benar-benar hasil karya saya sendiri dengan bimbingan dosen pembimbing dan belum pernah digunakan sebagai karya ilmiah pada perguruan tinggi atau lembaga manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Maret 2007
Andri Denish
Nama : Andri Denish
NIM : E34102047
Departemen : Konservasi Sumberdaya Hutan dan Ekowisata
Menyetujui: Komisi Pembimbing
Ketua, Anggota,
Ir. Edhi Sandra, MSi Dr. Ir. Agus Hikmat, MSc.F
NIP. 132 055 229 NIP. 131 865 340
Mengetahui:
Dekan Fakultas Kehutanan IPB,
Prof. Dr. Ir. Cecep Kusmana, MS NIP. 131 430 799