PENGARUH JENIS LAMPU YANG BERBEDA TERHADAP
MITOTIK INDEKS, DENSITAS ZOOXANTELLAE DAN
MORFOLOGI ANEMON ( Heteractis malu ) PADA SKALA
LABORATORIUM
Oleh : MARIA ULFA
C64101045
IN
ST
IT
UT P E R TA
N
IA
N
B
O G O R
PROGRAM STUDI ILMU DAN TEKNOLOGI KELAUTAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini Saya menyatakan bahwa skripsi yang berjudul :
PENGARUH JENIS LAMPU YANG BERBEDA TERHADAP
MITOTIK INDEKS, DENSITAS ZOOXANTHELLAE, DAN
MORFOLOGI ANEMON ( Heteractis malu ) PADA SKALA
LABORATORIUM
adalah benar merupakan hasil karya Saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Agustus 2009
RINGKASAN
MARIA ULFA. Pengaruh Jenis lampu Yang Berbeda Terhadap Mitotik Indeks, Densitas Zooxanthellae, dan Morfologi Anemon ( Heteractis malu ) Pada Skala Laboratorium. Dibimbing oleh NEVIATY PUTRI ZAMANI dan ADI WINARTO.
Anemon hidup di daerah tidal sampai dengan kedalaman 10-14 meter
bergantung dari tingkat kejernihan air dan daya tembus cahaya matahari. Cahaya merupakan faktor yang membatasi penyebaran anemon secara vertikal karena zooxanthella yang hidup bersimbiosis dalam tubuh anemon membutuhkan cahaya untuk melakukan fotosintesis. Dalam penelitian ini anemon diberikan perlakuan pencahayaan menggunakan lampu incandescent, lampu flourescent dan cahaya matahari sebagai kontrol. Tujuan penelitian ini adalah melihat pengaruh pencahayaan yang diberikan oleh lampu incandescent dan lampu flourescent
terhadap viabilitas zooxanthellae dan morfologi anemon ( H. malu ). Anemon pada ketiga akuarium memperlihatkan penurunan kesehatan. Anemon akuarium 1 dan 2 mengalami bleaching, penyusutan ukuran tubuh dan memperlihatkan tanda-tanda stress, seperti produksi mucus yang berlebihan, keluarnya mesenterial filament, dan tentakel tidak aktif bergerak bila disentuh.
Stress yang dialami anemon akuarium 1 lebih ringan daripada stress yang dialami
oleh anemon akuarium 2. Anemon akuarium 3 memperlihatkan penyusutan ukuran tubuh dan mengalami bleaching dengan kondisi yang lebih stabil bila dibandingkan dengan anemon akuarium 1 dan 2.
Mitotik indeks zooxanthellae pada akhir perlakuan : akuarium 1 bertambah sebesar18,4%; akuarium 2 berkurang sebesar 67%; dan akuarium 3 bertambah 37%. Rata-rata densitas zooxanthellae pada individu akuarium 1 sebelum diberikan perlakuan sebesar 9,3 x104 /cm2 dan rata-rata densitas zooxanthellae pada d5h9 sebesar 3,5 x104 / cm2 atau berkurang sebesar 62,37%. Rata-rata densitas zooxanthellae pada individu akuarium 2 sebelum diberikan perlakuan sebesar 5,4 x 104 /cm2 dan rata-rata densitas zooxanthellae pada d5h9 sebesar 1,3 x 104 / cm2 atau berkurang sebesar 75,9%. Rata-rata densitas zooxanthellae pada individu akuarium 3 sebelum diberikan perlakuan sebesar 12,8 x 104/cm2 dan rata-rata densitas zooxanthellae pada d5h9 sebesar 9,3 x 104/ cm2 atau berkurang sebesar 27,3%. Rasio ketebalan gastroderm dengan ektoderm pada akhir
perlakuan: akuarium 1 berkurang sebesar 56,77%; akuarium 2 berkurang sebesar 1,58%; dan akuarium 3 berkurang sebesar 40,54%.
Penggunaan lampu incandescent dan fluorescent secara tidak langsung
mengakibatkan kerusakan morfologi anemon ( H. malu ). Viabilitas anemon
( H. malu ) dipengaruhi oleh densitas zooxanthellae. Penggunaan lampu
incandescent dan fluorescent dapat memacu mitotik indeks zooxanthellae dan
@Hak cipta IPB tahun 2009
Hak cipta dilindungi undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
PENGARUH JENIS LAMPU YANG BERBEDA TERHADAP MITOTIK
INDEKS, DENSITAS ZOOXANTHELLAE DAN MORFOLOGI ANEMON ( Heteractis malu ) PADA SKALA LABORATORIUM
SKRIPSI
Sebagai salah satu syarat memperoleh gelar Sarjana Perikanan Pada Fakultas Perikanan Dan Ilmu Kelautan
Institut Pertanian Bogor
Oleh : MARIA ULFA
C64101045
PROGRAM STUDI ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
SKRIPSI
Judul skripsi : PENGARUH JENIS LAMPU YANG BERBEDA TERHADAP MITOTIK INDEKS, DENSITAS
ZOOXANTHELLAE, DAN MORFOLOGI ANEMON
( Heteractis malu ) PADA SKALA LABORATORIUM
Nama : Maria Ulfa NIM : C64101045
Departemen : Ilmu dan Teknologi Kelautan
Menyetujui, Dosen Pembimbing
Pembimbing I Pembimbing II
Dr. Ir. Neviaty Putri Zamani, M.Sc drh. Adi Winarto, Ph.D
NIP. 19641014 198803 2 001 NIP. 19540516 198601 1 001
Mengetahui,
Dekan Fakultas Perikanan dan Ilmu Kelautan
Prof. Dr. Ir. Indra Jaya, M.Sc NIP. 19610410 198601 1 002
KATA PENGANTAR
Segala puji bagi-Mu ya Allah yang telah memberikan kenikmatan dan kesempatan untuk menyelami lautan ilmu-Mu yang Maha Luas. Skripsi dengan judul “Pengaruh Jenis Lampu yang Berbeda Terhadap Mitotik Indeks, Densitas Zooxanthella, dan Morfologi Anemon ( Heteractis malu ) Pada Skala
Laboratorium” ini Penulis ajukan sebagai Salah satu syarat dalam memperoleh gelar Sarjana Perikanan di Institut Pertanian Bogor.
Dalam proses penyelesaian tugas akhir ini Penulis tidak lepas dari kesalahan dan kekurangan. Berkat bantuan, dorongan, dan pengarahan dari berbagai pihak akhirnya Penulis dapat menyelesaikannya. Oleh karena itu Penulis mengucapkan terima kasih yang sebesar-besarnya kepada :
1. Dr. Ir. Neviaty Putri Zamani, M. Sc dan drh. Adi Winarto, Ph. D sebagai Komisi Pembimbing atas bimbingan, arahan, kesabaran dan motivasi yang diberikan selama membimbing Penulis sehingga Penulis Terus berjuang menyelesaikan pendidikan di IPB;
2. Dr. Ir. Tri Prartono, M.Sc. sebagai Dosen Pembimbing Akademik atas bimbingan, arahan, dan nasihatnya sehingga Penulis termotivasi dan terus berjuang menyelesaikan pendidikan di IPB;
3. Prof. Dr. Ir. Dietriech G. Bengen, DEA sebagai dosen penguji;
4. Dr. Ir. Henry M. Manik sebagai Ketua Program Studi Ilmu dan Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan, IPB;
5. Staf dosen Program Studi Ilmu dan Teknologi Kelautan, semoga ilmu yang diberikan dapat bermanfaat dan Allah SWT memberikan pahala yang berlipat atas segala amal dan ibadahnya;
6. Badan Dakwah Islam Petrocina atas bantuan dana sehingga penulis dapat melaksanakan penelitian dan menyelesaikan pendidikan di IPB;
7. Ayahanda Kusnayadi dan Ibunda Fauziah tercinta yang telah mendidik dan membesarkan Penulis dengan penuh kasih sayang. Berkat doa dan ridho beliaulah Allah SWT memberikan pertolongan, petunjuk, dan sebagian kecil dari samudera ilmu-Nya kepada Penulis;
9. Kakanda Dani H. tercinta yang senantiasa mengorbankan waktu, tenaga, dan pikiran serta haknya kepada penulis selama menyelasaikan studi di IPB;
10. Putra dan putri tercinta yang memotivasi dan memberikan semangat selama Penulis menyelesaikan skripsi ini;
11. Staf Departememen ITK, rekan-rekan ITK dan pihak-pihak lain yang telah membantu Penulis selama penelitian dan proses penyusunan Skripsi ini. Kesempurnaan hanyalah milik Allah SWT. Kritik dan saran yang bersifat membangun diharapkan dapat mengurangi ketidaksempurnaan Penulis. Semoga Skripsi ini dapat bermanfaat bagi berbagai pihak.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ……… xi
DAFTAR LAMPIRAN ……… xv
I. PENDAHULUAN ………... 1
1.1. Latar Belakang ……….. 1
1.2. Tujuan ………... 2
. II. TINJAUAN PUSTAKA ………... 3
2.1. Biologi anemon ……… 3
2.1.1. Struktur tubuh anemon ………. 3
2.1.2. Klasifikasi ………. 5
2.1.3. Reproduksi ………...… 5
2.1.4. Cara makan ……… 6
2.1.5. Stress pada anemon ……… 7
2.2. Zooxanthellae ……… 7
2.3. Mitosis dan mitotik indeks ……… 10
2.3.1. Pembelahan mitosis ……….. 10
2.3.2. Mitotik indeks ……… 12
2.4. Karakteristik Cahaya ……… 12
III. METODE PENELITIAN ……….. 13
3.1. Waktu dan tempat penelitian ……….. 13
3.2. Alat dan bahan ……… 13
3.3. Metode ……… 14
3.4. Metode pengambilan data ……….. 15
3.4.1. Pengamatan visual ………... . 15
3.4.2. Rasio ketebalan gastroderm dengan ektoderm anemon ( H. malu )………….………. 16
3.4.3. Mitotik indeks zooxanthellae……… 17
3.4.4. Densitas zooxanthellae ... 17
3.5. Analisa data ………... 18
3.5.1. Rasio ketebalan gastroderm dengan ektoderm ………….. 18
3.5.2. Mitotik indeks ……… 18
3.5.3. Densitas zooxanthellae …………. ... 19
IV. HASIL DAN PEMBAHASAN ………... 20
4.1. Hasil penelitian ……… 20
4.1.1. Karakteristik gelombang lampu …………... 20
4.1.2. Pengamatan visual ………. 21
4.1.3. Pengamatan preparat histologis ………. 24
4.1.4. Rasio ketebalan gastroderm dengan ektoderm …………. 25
4.1.5. Mitotik indeks ………. 30
4.1.6. Densitas zooxanthellae ……….. 41
4.2.Pembahasan ……… 52
V. KESIMPULAN DAN SARAN ……… 59
5.1.Kesimpulan ……… 59
5.2.Saran ……… 61
DAFTAR PUSTAKA ………... 62
LAMPIRAN ………...….. 65
PENGARUH JENIS LAMPU YANG BERBEDA TERHADAP
MITOTIK INDEKS, DENSITAS ZOOXANTELLAE DAN
MORFOLOGI ANEMON ( Heteractis malu ) PADA SKALA
LABORATORIUM
Oleh : MARIA ULFA
C64101045
IN
ST
IT
UT P E R TA
N
IA
N
B
O G O R
PROGRAM STUDI ILMU DAN TEKNOLOGI KELAUTAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini Saya menyatakan bahwa skripsi yang berjudul :
PENGARUH JENIS LAMPU YANG BERBEDA TERHADAP
MITOTIK INDEKS, DENSITAS ZOOXANTHELLAE, DAN
MORFOLOGI ANEMON ( Heteractis malu ) PADA SKALA
LABORATORIUM
adalah benar merupakan hasil karya Saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Agustus 2009
RINGKASAN
MARIA ULFA. Pengaruh Jenis lampu Yang Berbeda Terhadap Mitotik Indeks, Densitas Zooxanthellae, dan Morfologi Anemon ( Heteractis malu ) Pada Skala Laboratorium. Dibimbing oleh NEVIATY PUTRI ZAMANI dan ADI WINARTO.
Anemon hidup di daerah tidal sampai dengan kedalaman 10-14 meter
bergantung dari tingkat kejernihan air dan daya tembus cahaya matahari. Cahaya merupakan faktor yang membatasi penyebaran anemon secara vertikal karena zooxanthella yang hidup bersimbiosis dalam tubuh anemon membutuhkan cahaya untuk melakukan fotosintesis. Dalam penelitian ini anemon diberikan perlakuan pencahayaan menggunakan lampu incandescent, lampu flourescent dan cahaya matahari sebagai kontrol. Tujuan penelitian ini adalah melihat pengaruh pencahayaan yang diberikan oleh lampu incandescent dan lampu flourescent
terhadap viabilitas zooxanthellae dan morfologi anemon ( H. malu ). Anemon pada ketiga akuarium memperlihatkan penurunan kesehatan. Anemon akuarium 1 dan 2 mengalami bleaching, penyusutan ukuran tubuh dan memperlihatkan tanda-tanda stress, seperti produksi mucus yang berlebihan, keluarnya mesenterial filament, dan tentakel tidak aktif bergerak bila disentuh.
Stress yang dialami anemon akuarium 1 lebih ringan daripada stress yang dialami
oleh anemon akuarium 2. Anemon akuarium 3 memperlihatkan penyusutan ukuran tubuh dan mengalami bleaching dengan kondisi yang lebih stabil bila dibandingkan dengan anemon akuarium 1 dan 2.
Mitotik indeks zooxanthellae pada akhir perlakuan : akuarium 1 bertambah sebesar18,4%; akuarium 2 berkurang sebesar 67%; dan akuarium 3 bertambah 37%. Rata-rata densitas zooxanthellae pada individu akuarium 1 sebelum diberikan perlakuan sebesar 9,3 x104 /cm2 dan rata-rata densitas zooxanthellae pada d5h9 sebesar 3,5 x104 / cm2 atau berkurang sebesar 62,37%. Rata-rata densitas zooxanthellae pada individu akuarium 2 sebelum diberikan perlakuan sebesar 5,4 x 104 /cm2 dan rata-rata densitas zooxanthellae pada d5h9 sebesar 1,3 x 104 / cm2 atau berkurang sebesar 75,9%. Rata-rata densitas zooxanthellae pada individu akuarium 3 sebelum diberikan perlakuan sebesar 12,8 x 104/cm2 dan rata-rata densitas zooxanthellae pada d5h9 sebesar 9,3 x 104/ cm2 atau berkurang sebesar 27,3%. Rasio ketebalan gastroderm dengan ektoderm pada akhir
perlakuan: akuarium 1 berkurang sebesar 56,77%; akuarium 2 berkurang sebesar 1,58%; dan akuarium 3 berkurang sebesar 40,54%.
Penggunaan lampu incandescent dan fluorescent secara tidak langsung
mengakibatkan kerusakan morfologi anemon ( H. malu ). Viabilitas anemon
( H. malu ) dipengaruhi oleh densitas zooxanthellae. Penggunaan lampu
incandescent dan fluorescent dapat memacu mitotik indeks zooxanthellae dan
@Hak cipta IPB tahun 2009
Hak cipta dilindungi undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
PENGARUH JENIS LAMPU YANG BERBEDA TERHADAP MITOTIK
INDEKS, DENSITAS ZOOXANTHELLAE DAN MORFOLOGI ANEMON ( Heteractis malu ) PADA SKALA LABORATORIUM
SKRIPSI
Sebagai salah satu syarat memperoleh gelar Sarjana Perikanan Pada Fakultas Perikanan Dan Ilmu Kelautan
Institut Pertanian Bogor
Oleh : MARIA ULFA
C64101045
PROGRAM STUDI ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
SKRIPSI
Judul skripsi : PENGARUH JENIS LAMPU YANG BERBEDA TERHADAP MITOTIK INDEKS, DENSITAS
ZOOXANTHELLAE, DAN MORFOLOGI ANEMON
( Heteractis malu ) PADA SKALA LABORATORIUM
Nama : Maria Ulfa NIM : C64101045
Departemen : Ilmu dan Teknologi Kelautan
Menyetujui, Dosen Pembimbing
Pembimbing I Pembimbing II
Dr. Ir. Neviaty Putri Zamani, M.Sc drh. Adi Winarto, Ph.D
NIP. 19641014 198803 2 001 NIP. 19540516 198601 1 001
Mengetahui,
Dekan Fakultas Perikanan dan Ilmu Kelautan
Prof. Dr. Ir. Indra Jaya, M.Sc NIP. 19610410 198601 1 002
KATA PENGANTAR
Segala puji bagi-Mu ya Allah yang telah memberikan kenikmatan dan kesempatan untuk menyelami lautan ilmu-Mu yang Maha Luas. Skripsi dengan judul “Pengaruh Jenis Lampu yang Berbeda Terhadap Mitotik Indeks, Densitas Zooxanthella, dan Morfologi Anemon ( Heteractis malu ) Pada Skala
Laboratorium” ini Penulis ajukan sebagai Salah satu syarat dalam memperoleh gelar Sarjana Perikanan di Institut Pertanian Bogor.
Dalam proses penyelesaian tugas akhir ini Penulis tidak lepas dari kesalahan dan kekurangan. Berkat bantuan, dorongan, dan pengarahan dari berbagai pihak akhirnya Penulis dapat menyelesaikannya. Oleh karena itu Penulis mengucapkan terima kasih yang sebesar-besarnya kepada :
1. Dr. Ir. Neviaty Putri Zamani, M. Sc dan drh. Adi Winarto, Ph. D sebagai Komisi Pembimbing atas bimbingan, arahan, kesabaran dan motivasi yang diberikan selama membimbing Penulis sehingga Penulis Terus berjuang menyelesaikan pendidikan di IPB;
2. Dr. Ir. Tri Prartono, M.Sc. sebagai Dosen Pembimbing Akademik atas bimbingan, arahan, dan nasihatnya sehingga Penulis termotivasi dan terus berjuang menyelesaikan pendidikan di IPB;
3. Prof. Dr. Ir. Dietriech G. Bengen, DEA sebagai dosen penguji;
4. Dr. Ir. Henry M. Manik sebagai Ketua Program Studi Ilmu dan Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan, IPB;
5. Staf dosen Program Studi Ilmu dan Teknologi Kelautan, semoga ilmu yang diberikan dapat bermanfaat dan Allah SWT memberikan pahala yang berlipat atas segala amal dan ibadahnya;
6. Badan Dakwah Islam Petrocina atas bantuan dana sehingga penulis dapat melaksanakan penelitian dan menyelesaikan pendidikan di IPB;
7. Ayahanda Kusnayadi dan Ibunda Fauziah tercinta yang telah mendidik dan membesarkan Penulis dengan penuh kasih sayang. Berkat doa dan ridho beliaulah Allah SWT memberikan pertolongan, petunjuk, dan sebagian kecil dari samudera ilmu-Nya kepada Penulis;
9. Kakanda Dani H. tercinta yang senantiasa mengorbankan waktu, tenaga, dan pikiran serta haknya kepada penulis selama menyelasaikan studi di IPB;
10. Putra dan putri tercinta yang memotivasi dan memberikan semangat selama Penulis menyelesaikan skripsi ini;
11. Staf Departememen ITK, rekan-rekan ITK dan pihak-pihak lain yang telah membantu Penulis selama penelitian dan proses penyusunan Skripsi ini. Kesempurnaan hanyalah milik Allah SWT. Kritik dan saran yang bersifat membangun diharapkan dapat mengurangi ketidaksempurnaan Penulis. Semoga Skripsi ini dapat bermanfaat bagi berbagai pihak.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ……… xi
DAFTAR LAMPIRAN ……… xv
I. PENDAHULUAN ………... 1
1.1. Latar Belakang ……….. 1
1.2. Tujuan ………... 2
. II. TINJAUAN PUSTAKA ………... 3
2.1. Biologi anemon ……… 3
2.1.1. Struktur tubuh anemon ………. 3
2.1.2. Klasifikasi ………. 5
2.1.3. Reproduksi ………...… 5
2.1.4. Cara makan ……… 6
2.1.5. Stress pada anemon ……… 7
2.2. Zooxanthellae ……… 7
2.3. Mitosis dan mitotik indeks ……… 10
2.3.1. Pembelahan mitosis ……….. 10
2.3.2. Mitotik indeks ……… 12
2.4. Karakteristik Cahaya ……… 12
III. METODE PENELITIAN ……….. 13
3.1. Waktu dan tempat penelitian ……….. 13
3.2. Alat dan bahan ……… 13
3.3. Metode ……… 14
3.4. Metode pengambilan data ……….. 15
3.4.1. Pengamatan visual ………... . 15
3.4.2. Rasio ketebalan gastroderm dengan ektoderm anemon ( H. malu )………….………. 16
3.4.3. Mitotik indeks zooxanthellae……… 17
3.4.4. Densitas zooxanthellae ... 17
3.5. Analisa data ………... 18
3.5.1. Rasio ketebalan gastroderm dengan ektoderm ………….. 18
3.5.2. Mitotik indeks ……… 18
3.5.3. Densitas zooxanthellae …………. ... 19
IV. HASIL DAN PEMBAHASAN ………... 20
4.1. Hasil penelitian ……… 20
4.1.1. Karakteristik gelombang lampu …………... 20
4.1.2. Pengamatan visual ………. 21
4.1.3. Pengamatan preparat histologis ………. 24
4.1.4. Rasio ketebalan gastroderm dengan ektoderm …………. 25
4.1.5. Mitotik indeks ………. 30
4.1.6. Densitas zooxanthellae ……….. 41
4.2.Pembahasan ……… 52
V. KESIMPULAN DAN SARAN ……… 59
5.1.Kesimpulan ……… 59
5.2.Saran ……… 61
DAFTAR PUSTAKA ………... 62
LAMPIRAN ………...….. 65
DAFTAR GAMBAR
Halaman
1. Anatomi anemon ……….. 3
2. Potongan membujur tubuh anemon ……… 4
3. Zooxanthellae yang berasal dari Porites lutea dilihat dengan menggunakan mikroskop cahaya ……….. 8
4. Pembelahan sel secara mitosis ……….. 10
5. Proses pembelahan mitosis ……… 11
6. Akuarium 1 menggunakan lampu incandescent……… 14
7. Akuarium 2 menggunakan lampu fluorescent ………. 14
8. Akuarium 3 sebagai control dengan cahaya matahari alami ………… 15
9. Diagram pembuatan preparat histologis ………... 17
10. Karakteristik gelombang lampu incandescent ( A ) dan lampu fluorescent ( B )………. 20
11. Kondisi anemon pada akuarium 1 ( lampu incandescent ). Anemon sebelum diberikan perlakuan ( A ), saat diberi perlakuan ( B ), warna lebih pucat pada d5 ( C ), dan setelah 26 hari ( D ) …... 22
12. Kondisi anemon pada akuarium 2 ( lampu fluorescent ). Anemon sebelum diberikan perlakuan ( A & B ), saat d3 ( C ), dan setelah diberikan perlakuan pada d7 ( D ) ……… 23
13. Kondisi anemon pada akuarium 3. Sebelum anemon diberikan perlakuan ( A ). Saat anemon diberikan perlakuan ( B ). Setelah anemon diberikan perlakuan ( C ) ……… 24
14. Morfologi anemon pada akuarium 1 saat d-1 ( A ), saat d3 ( B ), dan saat d5 ( C )……….. 24
15. Morfologi anemon pada akuarium 2 saat d-1 ( A ), saat d3 ( B ), dan saat d5 ( C )………. 24
17. Nilai rata-rata dan standard error rasio ketebalan gastroderm
dengan ektoderm akuarium 1 ( lampu incandescent )……….. 26 18. Potongan melintang tentakel anemon ( H. malu ) di akuarium 1 saat
d-1 ( A ), saat d3 ( B ), dan saat d5 ( C )………. 26 19. Nilai rata-rata dan standard error rasio ketebalan gastroderm
dengan ektoderm akuarium 2 ( lampu flourecent ) ……… 27 20. Potongan melintang tentakel anemon ( H. malu ) di akuarium 1 saat
d-1 ( A ), saat d3 ( B ), dan saat d5 ( C )………. 27 21. Nilai rata-rata dan standard error rasio ketebalan gastroderm
dengan ektoderm akuarium 3 ( cahaya matahari ) ……… 28 22. Potongan melintang tentakel anemon ( H. malu ) di akuarium 1 saat
d-1 ( A ), saat d3 ( B ), dan saat d5 ( C )………. 28 23. Nilai rata-rata dan standard error rasio ketebalan gastroderm
dengan ektoderm pada setiap perlakuan saat d-1 ... 29 24. Nilai rata-rata dan standard error rasio ketebalan gastroderm
dengan ektoderm pada setiap perlakuan saat d3... 29 25. Nilai rata-rata dan standard error rasio ketebalan gastroderm
dengan ektoderm pada setiap perlakuan saat d5 …... 30 26. Nilai rata-rata dan standard error mitotik indeks pada akuarium 1
( lampu incandescent )………... 31 27. Nilai rata-rata dan standard error mitotik indeks pada akuarium 2
( lampu flourescent ) ………... 31 28. Nilai rata-rata dan standard error mitotik indeks pada akuarium 3
( cahaya matahari )…….……... 32 29. Nilai rata-rata dan standard error mitotik indeks zooxanthellae
pada setiap perlakuan saat d-1 ……….. 33 30. Nilai rata-rata dan standard error mitotik indeks zooxanthellae
pada setiap perlakuan saat d1h0 ……… 34 31. Nilai rata-rata dan standard error mitotik indeks zooxanthellae
pada setiap perlakuan saat d1h1 ……… 34 32. Nilai rata-rata dan standard error mitotik indeks zooxanthellae
33. Nilai rata-rata dan standard error mitotik indeks zooxanthellae
pada setiap perlakuan aat d1h6 ……… 36 34. Nilai rata-rata dan standard error mitotik indeks zooxanthellae
pada setiap perlakuan saat d1h9 ……… 36 35. Nilai rata-rata dan standard error mitotik indeks zooxanthellae
pada setiap perlakuan saat d2h1……….. 37 36. Nilai rata-rata dan standard error mitotik indeks zooxanthellae
pada setiap perlakuan saat d2h9………. 37 37. Nilai rata-rata dan standard error mitotik indeks zooxanthellae
pada setiap perlakuan saat d3h1……….. 38 38. Nilai rata-rata dan standard error mitotik indeks zooxanthellae
pada setiap perlakuan saat d3h9 ... 39. Nilai rata-rata dan standard error mitotik indeks zooxanthellae
pada setiap perlakuan saat d4h1 ……… 39 40. Nilai rata-rata dan standard error mitotik indeks zooxanthellae
pada setiap perlakuan saat d4h9 ……… 39 41. Nilai rata-rata dan standard error mitotik indeks zooxanthellae
pada setiap perlakuan saat d5h1……….. 40 42. Nilai rata-rata dan standard error mitotik indeks zooxanthellae
pada setiap perlakuan saat d5h9 ……… 40 43. Nilai rata-rata dan standard error densitas zooxanthellae pada
akuarium 1 ( lampu incandescent )……... 41 44. Nilai rata-rata dan standard error densitas zooxanthellae pada
akuarium 2 ( lampu flourecent ) ………... 42 45. Nilai rata-rata dan standard error densitas zooxanthellae pada
akuarium 3 ( cahaya matahari )………... 43 46. Nilai rata-rata dan standard error densitas zooxanthellae pada
setiap perlakuan saat d-1 ……… 43 47. Nilai rata-rata dan standard error densitas zooxanthellae pada
setiap perlakuan saat d1h0……….. 44 48. Nilai rata-rata dan standard error densitas zooxanthellae pada
49. Nilai rata-rata dan standard error densitas zooxanthellae pada
setiap perlakuan saat d1h3 ………. 45 50. Nilai rata-rata dan standard error densitas zooxanthellae pada
setiap perlakuan saat d1h6……… 46 51. Nilai rata-rata dan standard error densitas zooxanthellae pada
setiap perlakuan saat d1h9……… 46 52. Nilai rata-rata dan standard error densitas zooxanthellae pada
setiap perlakuan saat d2h1……… 47 53. Nilai rata-rata dan standard error densitas zooxanthellae pada
setiap perlakuan aat d2h9 ……….. 48 54. Nilai rata-rata dan standard error densitas zooxanthellae pada
setiap perlakuan saat d3h1 ……… 48 55. Nilai rata-rata dan standard error densitas zooxanthellae pada
setiap perlakuan saat d3h9 ……… 49 56. Nilai rata-rata dan standard error densitas zooxanthellae pada
setiap perlakuan saat d4h1………. 50 57. Nilai rata-rata dan standard error densitas zooxanthellae pada
setiap perlakuan saat d4h9……… 50 58. Nilai rata-rata dan standard error densitas zooxanthellae pada
setiap perlakuan saat d5h1………. 51 59. Nilai rata-rata dan standard error densitas zooxanthellae pada
setiap perlakuan saat d5h9………. 51 60. Keterkaitan antara Rasio ketebalan gastroderm dengan ektoderm
anemon ( H. malu ), mitotik indeks zooxanthellae, dan densitas
DAFTAR LAMPIRAN
Halaman 1. Data mentah mitotik indeks ……… 65 2. Data mentah densitas zooxanthellae di akuarium 1
( lampu incandescent ) ……… 67 3. Data mentah densitas zooxanthellae di akuarium 2
( lampu flourescent ) ……… 68 4. Data mentah densitas zooxanthellae di akuarium 3
( cahaya matahari ) ……… 69
5. Data mentah rasio ketebalan gastroderm dengan ektoderm
akuarium 1……… 70
6. Data mentah ketebalan gastroderm dengan ektoderm
akuarium 2……… 72
7. Data mentah ketebalan gastroderm dengan ektoderm
akuarium 3……… 74
8. Hasil uji statistik densitas zooxanthellae ……… 76 9. Hasil uji statistik mitotik indeks zooxanthellae……… 86 10. Hasil uji statistik rasio ketebalan gastroderm dengan ektoderm …….. 96
11. Data kualitas air ……… 98
12. Alat dan bahan ………. 99
PENDAHULUAN
1.1 Latar Belakang
Terumbu karang merupakan ekosistem khas perairan tropis yang memiliki karakter unik dengan keanekaragaman hayati yang sangat tinggi. Daerah terumbu menyediakan variasi habitat untuk berbagai jenis biota. Daerah ini tidak hanya terdiri dari terumbu saja, tetapi juga daerah berpasir, berbagai teluk dan celah, daerah laguna, daerah alga dan juga perairan yang dangkal. Variasi habitat mengakibatkan banyak biota yang hidup berasosiasi di dalamnya, sehingga ekosistem terumbu karang memiliki keanekaragaman spesies yang sangat tinggi termasuk biota anemon.
Anemon merupakan salah satu biota yang hidup di ekosistem terumbu karang. Anemon ditemukan hidup di daerah tidal sampai dengan kedalaman 10-14 meter ( Haefelfinger & Thenius, 1974 ) bergantung dari tingkat kejernihan air dan daya tembus cahaya matahari. Cahaya merupakan faktor yang membatasi penyebaran anemon secara vertikal karena zooxanthella yang hidup bersimbiosis dalam tubuh anemon membutuhkan cahaya untuk melakukan fotosintesis.
Cahaya mengalami proses perenyapan ( ekstinksi ) dalam perambatannya baik di atmosfer maupun dalam perairan, Energi gelombang cahaya yang berhasil menembus lapisan-lapisan air akan semakin habis dan pada kedalaman tertentu akan lenyap sama sekali sehingga lapisan air pada batas kedalaman tadi
biru dengan intensitas sangat kecil. Di bawah kedalaman 100 m merupakan daerah gelap gulita ( Ilahude, 1999 ).
Karakteristik cahaya yang unik ini digunakan dalam penelitian untuk mengetahui pengaruhnya pada kesehatan anemon. Biota ini dapat digunakan sebagai indikator perubahan lingkungan perairan tropis yang baik karena
kesensitifannya terhadap faktor-faktor lingkungan dan sifat mereka yang menetap. Selain itu biota ini juga memiliki hubungan yang unik antara inang dengan alga simbionnya, yaitu zooxanthella.
1.2. Tujuan Penelitian
Penelitian ini bertujuan untuk melihat pengaruh penyinaran dengan lampu
flourescent, lampu incandescent dan matahari terhadap morfologi anemon dan
TINJAUAN PUSTAKA
2.1. Biologi Anemon
2.1.1. Struktur tubuh anemon
Secara garis besar struktur tubuh anemon terdiri atas oral disk, coloum dan
pedal disk. Oral disk adalah bagian teratas anemon. Pada oral disk terdapat
mulut yang juga berfungsi sebagai anus. Di sekeliling mulut terdapat tentakel yang berfungsi untuk menangkap makanan. Di tentakel terdapat sel knidosit atau sel penyengat yang menjadi ciri khas Filum Cnidaria. Sel knidosit berfungsi untuk menyengat mangsa. Mulut dilanjutkan dengan stomodaeum yang langsung menghubungkannya dengan coelenteron atau rongga perut. Di dalam rongga perut terdapat mesenteri filament yang berfungsi sebagai usus. Basal disk
merupakan bagian yang menempel pada substrat.
Sumber : Fautin dan Mariscal ( 1991 ).
Dinding polip terdiri atas dua lapisan. Lapisan luar disebut ektoderm dan lapisan dalam disebut endoderm atau gastroderm. Di antara ektoderm dan gastroderm terdapat lapisan antara yang disebut mesoglea. Ektoderm terdiri atas sel lendir yang berada dalam sel-sel kelenjar dan sel nematoksis yang berada dalam sel knidoblast. Sel lendir menghasilkan lendir yang berfungsi untuk memerangkap makanan dan membersihkan diri dari kotoran yang menempel. Sel nematoksis berfungsi sebagai sel penyengat untuk menangkap makanan dan sebagai alat untuk mempertahankan diri. Pada lapisan gastroderm terdapat alga bersel tunggal yang merupakan simbion anemon. Alga yang bersimbiosis ini disebut zooxanthellae.
Sumber : Fautin dan Mariscal ( 1991 ).
Gambar 2. Potongan membujur tubuh anemon memperlihatkan ektoderm ( EP ), gastroderm ( G ), mesenteri ( M ), filament ( E ),
coelenteron dan silia ( CT ).
Struktur utama dari lapisan gastroderm adalah mesenteri filament. Meserteri
filament terlibat dalam banyak fungsi , seperti dalam sistem reproduksi,
mesenteri memiliki silia. Silia ini sangat penting dalam pergerakan air yang melewati coelenteron ( Fautin & Mariscal,1991 )
Jaringan saraf tersebar di ektoderm, gastroderm dan mesoglea. Jaringan saraf ini dikoordinasikan oleh sel khusus yang disebut sel penghubung. Sel
penghubung bertanggung jawab memberi respon, baik secara mekanis maupun kimiawi serta adanya stimuli cahaya ( Suharsono, 1996 ).
2.1.2. Klasifikasi anemon
Anemon merupakan salah satu biota pembentuk ekosistem terumbu karang. Secara morfologi dan fisiologi hewan ini mirip dengan koral. Berikut klasifikasi anemon yang digunakan dalam penelitian menurut Kaestner ( 1967 ) :
Filum : Cnidaria Kelas : Anthozoa
Ordo : Actinaria
Sub Ordo : Myantheae Tribe : Endimyaria
Famili : Stichodactylidae Genus : Heteractis
Spesies : H. malu
2.1.2. Reproduksi
bebas dalam perairan. Bila planula telah menemukan tempat yang cocok, maka planula akan menempel pada substrat untuk menetap dan berkembang. Reproduksi aseksual dilakukan dengan cara membentuk tunas. Tunas baru yang tumbuh di permukaan bagian bawah atau pada bagian sisi melekat sampai mencapai ukuran tertentu, kemudian melepaskan diri dan tumbuh menjadi individu baru. Pembentukan tunas dapat dilakukan secara intertentakular dan ekstratentakular. Pertunasan intertentakular merupakan pembentukan individu baru di dalam individu lama. Sedangkan pertunasan ekstratentakular adalah pembentukan individu baru di luar.
2.1.4. Cara makan
Berdasarkan makanannya, anemon dikelompokkan menjadi dua, yaitu fishers
dan particle feeders. Kelompok pertama biasanya memakan ikan- ikan kecil,
crustacea dan plankton. Mangsa akan disengat oleh nematoksis kemudian dijerat
oleh tentakel kemudian dibawa ke mulut. Pada anemon yang bersimbiosis dengan ikan Amphiprion, ikan ini akan membantu anemon memotong-motong
makanannya dan membantu anemon untuk memasukan makanannya ke mulut anemon. Sedangkan kelompok kedua memperoleh makanan menggunakan
mucus. Partikel akan menempel pada mucus kemudian akan dibawa ke mulut
dengan menggunakan siliayang ada di seluruh permukaan tubuhnya ( Haefelfinger & Thenius, 1974 ).
Emmers ( 1990 ), banyak anemon pemakan yang aktif di dalam akuarium, tetapi makanannya harus datang sendiri kepadanya.
2.1.5. Stress pada anemon
Stress merupakan suatu kondisi penurunan kualitas hidup yang disebabkan oleh adanya perubahan ekosistem atau adanya faktor-faktor yang menyebabkan menurunnya produktifitas. Anemon yang mengalami stress akan mengalami perubahan-perubahan dalam metabolisme, respon tingkah laku terhadap lingkungan dan biologi reproduksinya akibat faktor-faktor eksternal ataupun internal yang membatasi aktifitas biota ini. Hayes dan Bush in Zamani ( 1995 ) mengemukakan bahwa koral yang mengalami bleaching akan mengeluarkan
mucus, gangguan pada lapisan gastroderm, dan gangguan pada vakuola yang
didalamnya terdapat zooxanthellae. Anemon akan melakukan adaptasi untuk mengurangi atau menghilangkan stress. Jika adaptasi yang dilakukan berhasil maka biota ini akan kembali dalam keadaan homeostatis, tetapi bila tidak berhasil maka biota ini akan mengalami stress kembali dengan kemungkinan stress yang bertambah besar ( Sarwono, 1992 ).
2.2. Zooxanthellae
Zooxanthella merupakan alga bersel tunggal dari kelas Dinoflagellatae.
memberikan warna pa berwarna coklat dan d Sumber zooxanthe melalui reproduksi, ba langsung mentransfer zooxanthellae di lingk pemakan karang dan p zooxanthellae.
Hubungan antara a Zooxanthellae menyu kebutuhan energi bag zooxanthellae, karang menyediakan nutrien untuk fotosintesis
Gambar 3. Z m
Intensitas cahaya y suplai nutrisi penting zooxanthellae untuk f 102,000 lux ( 1,900 µ
pada hewan-hewan tersebut. Alga disebut zoo n disebut zoochlorella bila berwarna hijau.
hellae yang ada di dalam polip diturunkan oleh , baik secara seksual maupun aseksual. Secara s fer zooxanthellae ke dalam telur atau larva. Sed gkungan berasal dari perairan sekitar atau dari n pemakan zooplankton yang di dalamnya men
a anemon dengan zooxanthellae adalah simbios yumbang 90% dari hasil fotosintesisnya untuk m agi koral ( Davies, 1984 in Zamani, 1995 ). Sem ng memberikan perlindungan dari grazer, shelt
n seperti nitrogen, fosfor dan karbon dioksida s
Sumber : Wikipedia, 2008.
Zooxanthellae yang berasal dari Porites lutea
menggunakan mikroskop cahaya.
a yang cukup akan memungkinkan zooxanthell g ke tubuh koral. Intensitas cahaya yang dibutu k fotosintesis berasal dari sinar matahari yang m µ E m s ). Tetapi, koral tidak membutuhkan ca
ooxanthellae bila
eh induknya a seksual induk
edangkan sumber ri sisa organisme engandung
iosis mutualisme. k memenuhi Sementara bagi
elter dan
a sebagai bahan
dilihat dengan
ellae memberi utuhkan
secara penuh. Mereka dapat berkembang baik dengan intensitas cahaya relatif yang lebih sedikit ( Emmers, 1990 ).
Kejernihan air juga berhubungan dengan pencahayaan. Kejernihan air dalam akuarium dipengaruhi oleh banyak faktor. Semakin jernih air, semakin besar porsi cahaya yang sampai ke dasar akuarium. Kejernihan air dipengaruhi oleh jumlah kandungan fitoplankton, zooplankton, sedimen/debu pasir yang melayang di air serta partikel terlarut yang akan membuat air akuarium menjadi keruh. Selain disebabkan oleh tingkat kekeruhan air, intensitas cahaya yang sampai ke dasar akuarium juga dipengaruhi oleh pergerakan air. Semakin deras pergerakan air, intensitas cahaya yang sampai ke dasar akuarium akan semakin berkurang ( Emmers, 1990 ).
Densitas zooxanthellae dari setiap koloni sangat bervariasi tergantung dari habitat dan kedalaman tempat inangnya hidup. Haefelfinger dan Thenius ( 1974 ) menyatakan dalam larva planula sepanjang 1 mm telah ditemukan sekitar 7000 sel alga. Wilson ( 1989 ) in Zamani ( 1995 ) menemukan jumlah zooxanthellae pada Porites lutea berkisar antara 2.01 x 106 sampai 3,13 x 106 per cm2.
Penelitian yang dilakukan oleh Brown et al. ( 1995 ) menemukan jumlah
zooxantellae pada koral di zona inter-tidal berkisar antara 0,9 x 106 sampai 2,3 x 107 per cm2. Jumlah zooxantellae terbesar ditemukan pada bagian yang paling banyak terpapar oleh sinar ( Brown et al., 1995), seperti pada bagian oral disk,
oral cone, dan tentakel ( Zamani,1995 ).
Dalam keadaan normal, jumlah zooxanthellae berubah sesuai musim sebagaimana penyesuian karang terhadap lingkungan. Selama peristiwa
tersisa dapat kehilangan 50-80% dari pigmen fotosintesisnya ( Westmacott et al., 2000 ). Jika intensitas cahaya rendah, maka kandungan klorofil zooxanthellae tetap. Peningkatan intesitas cahaya dalam waktu lama dapat membuat zooxanthellae mengurangi klorofil di dalam tubuhnya ( fotodegradasi ). Fotodegradasi juga terjadi jika anemon zooxanthellae terpapar sinar ultra violet dalam jangka waktu cukup lama dan perubahan warna pigmen akan sangat jelas dapat teramati ( Thieberger et al., 1995).
2.3. Mitosis Dan Mitotik Indeks 2.3.1. Pembelahan mitosis
Mitosis merupakan tahapan pembelahan dalam siklus sel. Pembelahan mitosis menghasilkan sel anak yang jumlah kromosomnya sama dengan jumlah kromosom induknya. Pada organisme bersel satu, mitosis merupakan proses reproduksi untuk memperbanyak diri. Sedangkan pada organisme multiseluler, mitosis terjadi di sel somatis untuk perbanyakan sel dan pertumbuhan. Sel-sel tersebut memiliki kemampuan yang berbeda dalam melakukan pembelahan . Ada sel yang mampu melakukan pembelahan secara cepat, ada yang lambat, dan ada juga yang tidak mengalami pembelahan sama sekali setelah melewati masa pertumbuhan tertentu.
.
Sumber : Wikipedia, 2009.
Pada organisme multiseluler, poses pembelahan sel dibedakan menjadi dua tahap utama, yaitu tahap interfase dan tahap mitosis. Interfase terdiri atas tiga tahap, yaitu tahap G1, tahap S, dan tahap G2. G1 adalah tahap dimana proses metabolisme telah lengkap dalam persiapan sintesis DNA. Pada tahap S terjadi sintesis DNA. G2 merupakan tahapan sebelum tahap mitosis ( Zamani, 1995 ).
Sumber : Crayonpedia, 2009.
Gambar 5. Proses pembelahan mitosis.
Tahap mitosis dibedakan atas dua tahap, yaitu tahap kariokinesis dan
sitokinesis. Kariokinesis adalah proses pembagian materi inti yang terbagi dalam beberapa tahap, yaitu profase,metafase, anafase dan telofase. Sedangkan
2.3.2. Mitotik indeks
Mitotik indeks adalah angka indeks yang menyatakan jumlah sel yang melakukan pembelahan dalam 500 sel sebagai dasar perbandingan. Pada beberapa penelitian didapatkan hasil bahwa mitotik indeks merupakan indeks yang sensitif terhadap perubahan yang terjadi. Oleh karena itu, mitotik indeks digunakan sebagai indikator perubahan lingkungan.
2.4. Karakteristik Cahaya
Dalam perambatannya di atmosfer maupun dalam perairan, cahaya mengalami proses perenyapan ( ekstinksi ). Energi gelombang cahaya yang berhasil
menembus lapisan-lapisan air akan semakin habis dan pada kedalaman tertentu akan lenyap sama sekali sehingga lapisan air pada batas kedalaman tadi
METODE PENELITIAN
3.1. Waktu dan Tempat Penelitian
Penelitian dilakukan pada bulan Maret-Agustus 2007. Pengamatan dan pengambilan data dilakukan pada bulan Maret-Mei 2007 di Bagian Hidrobiologi, Departemen Ilmu dan Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Pembuatan preparat histologis dilakukan pada bulan Juni-Agutus di Bagian Histologi, Departemen Anatomi, Fisiologi dan
Farmakologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
3.2. Alat dan Bahan
Alat yang digunakan dalam penelitian ini yaitu : 3 Set akuarium yang dilengkapi dengan sistem filtrasi dan aerasi; lampu incandescent dan lampu
fluorescent; termometer; refraktometer; spektrometer; kertas pH; oven;
mikroskop cahaya Olympus CHS 20 EM; inkubator; mikrotom; plastik hitam; gunting dan pinset.
Bahan yang digunakan dalam penelitian ini yaitu : 1600 liter air laut; 9 ekor anemone ( Heteractis malu ); glacial acetic acid; formalin 4%; 1M HCl; alkohol dengan konsentrasi 70%,80%,90% dan 100%; xilol; paraffin; gliserin; hemaktosilin; eosin; akuades; air keran; objec glass; cover glass; lem perekat
balsamic ( merek dagang ); minyak imersi; kertas tisu; dan pakan anemon
3.3 Metode
[image:39.595.116.531.547.715.2]Penelitian ini dilakukan dengan menggunakan 3 buah akuarium. Masing masing akuarium diisi dengan air laut dan di dalamnya diletakkan 3 ekor anemon. Akuarium 1 diberi lampu incandescent dan akuarium 2 diberi lampu fluorescent, sedangkan akuarium 3 mendapatkan penyinaran alami. Akuarium 1 dan akuarium 2 ditutup dengan menggunakan plastik hitam sehingga hanya menerima cahaya yang bersumber dari lampu saja. Penyinaran dengan menggunakan lampu dilakukan selama 9 jam, dimulai pada pukul 08.00 WIB sampai dengan pukul 17.00 WIB. Perlakuan penyinaran diberikan selama lima hari.
Gambar 6. Akuarium 1 menggunakan lampu incandescent.
Pembuat arus (pompa)
Pompa (pecahan karang)Rubble
Biota
outlet
Termometer
Protein skimmer
Plastik hitam
aerator outlet
t Kapas
(B) Lampu fluorescent
Matahari Termometer
Outlet Inlet
Biota Pembuat arus
(pompa)
Aerator
Pompa
Outlet
Rubble (Pecahan karang)
Kapas filter
Protein Skimmer
Gambar 8. Akuarium 3 sebagai kontrol dengan cahaya matahari alami.
3.4. Metode Pengambilan Data 3.4.1. Pengamatan visual
Pengamatan visual dilakukan selama adaptasi didalam akuarium, sebelum diberikan perlakuan, saat diberikan perlakuan, dan setelah diberikan perlakuan. Pengamatan dilakukan 1 kali dalam satu hari selama adaptasi, sebelum perlakuan dan setelah perlakuan. Pada saat anemon diberi perlakuan, pengamatan visual dilakukan tiga kali dalam satu hari pada pukul 08.00, pukul 12.00 dan pukul 17.00 WIB.
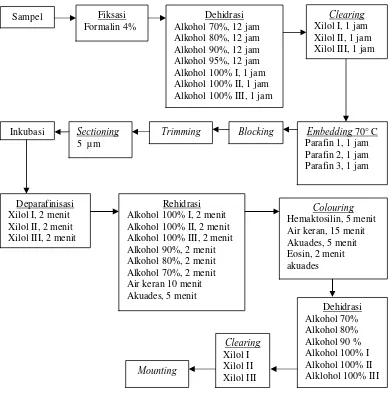
3.4.4. Rasio ketebalan ektoderm dengan gastroderm anemon ( H.malu ) Tiga tentakel diambil dari setiap individu. Kemudian tentakel difiksasi dengan menggunakan formalin 4%. Setelah itu tentakel dibuat sediaan histologisnya. Proses pembuatan preparat histologis dapat dilihat pada gambar 9. Analisa rasio ketebalan ektoderm dengan gastroderm dilakukan dengan menggunakan preparat histologis dan dilihat pada perbesaran 40x pada mikroskop cahaya. Ketebalan lapisan gastroderm dan ektoderm diukur dengan menggunakan mikrometer.
Gambar 4. Diagram pembuatan peparat histologis.
Sampel Fiksasi
Formalin 4%
Dehidrasi Alkohol 70%, 12 jam Alkohol 80%, 12 jam Alkohol 90%, 12 jam Alkohol 95%, 12 jam Alkohol 100% I, 1 jam Alkohol 100% II, 1 jam Alkohol 100% III, 1 jam
Clearing
Xilol I, 1 jam Xilol II, 1 jam Xilol III, 1 jam
Embedding 70° C Parafin 1, 1 jam Parafin 2, 1 jam Parafin 3, 1 jam
Deparafinisasi Xilol I, 2 menit Xilol II, 2 menit Xilol III, 2 menit
Inkubasi Sectioning
5 µm
Trimming Blocking
Rehidrasi Alkohol 100% I, 2 menit Alkohol 100% II, 2 menit Alkohol 100% III, 2 menit Alkohol 90%, 2 menit Alkohol 80%, 2 menit Alkohol 70%, 2 menit Air keran 10 menit Akuades, 5 menit
Colouring
Hemaktosilin, 5 menit Air keran, 15 menit Akuades, 5 menit Eosin, 2 menit akuades
Dehidrasi Alkohol 70% Alkohol 80% Alkohol 90 % Alkohol 100% I Alkohol 100% II Alklohol 100% III
Clearing
Xilol I Xilol II Xilol III
3.4.2. Mitotik indeks zooxanthellae
Sebelum anemon diberi perlakuan, terlebih dahulu diambil data awal untuk mengetahui mitotik indeks dengan memotong tiga tentakel dari setiap individu. Saat anemon diberi perlakuan, sampel diambil dua kali dalam satu hari pada pukul 08.00 WIB dan pada pukul 16.30 WIB. Tiga tentakel diambil dari setiap individu dalam satu kali pengambilan sampel. Kemudian tentakel difiksasi dalam larutan alkohol 70% dan glacial acetic acid dengan perbandingan 3 : 1 selama 30 menit. Setelah itu tentakel dimasukkan ke dalam alkohol 70% dan disimpan pada suhu 4°C sampai akan digunakan kembali untuk analisa mitotik indeks.
Analisa mitotik indeks dilakukan dengan menggunakan mikroskop cahaya pada perbesaran 100x. Angka indeks sel zooxanthellae diketahui dengan
menghitung jumlah sel yang membelah dalm 500 sel. Sebelum analisa dilakukan, tentakel terlebih dahulu dibilas dengan menggunakan larutan HCl 1M. Setelah itu tentakel direndam dalam HCl 1M dan dipanaskan di dalam oven. Tentakel
dipanaskan pada suhu 60°C selama 30 menit, kemudian suhu diturunkan sampai 20°C dan dipanaskan pada suhu tersebut selama 10 menit. Setelah dipanaskan dalam oven, tentakel siap dipergunakan untuk analisa mitotik indeks.
3.4.3. Densitas zooxanthellae
Analisa densitas zooxanthella dilakukan dengan menggunakan mikroskop cahaya pada perbesaran 40x. Densitas diketahui dengan menghitung jumlah sel pada lima lapang pandang.
3.5. Analisa Data
3.5.1. Rasio ketebalan ektoderm dengan gastroderm ( H. malu )
Rasio ketebalan ektoderm dengan endoderm diperoleh dengan menggunakan rumus berikut :
100
x KE KG
R=
dimana :
R : rasio ketebalan gastroderm dengan ektoderm ( % )
KG : ketebalan gastroderm/endoderm ( µm )
KE : ketebalan ektoderm ( µm )
3.5.2. Mitotik indeks zooxanthellae
Rumus yang digunakan untuk menentukan mitotik indeks sel zooxanthellae
adalah sebagai berikut:
100
x
n
A
MI
=
dimana :
MI : mitotik indeks zooxanthellae ( % )
A : jumlah sel yang melakukan pembelahan mitosis
3.5.3. Densitas zooxanthellae
Densitas zooxantella dihitung dengan menggunakan rumus berikut :
m z D
n
i i
i
∑
== 1
dimana :
Di : densitas zooxanthellae ( cm2 )
z : jumlah zooxanthella dalam satu lapang pandang m : jumlah lapang pandang
3.5.4. Uji Statistik
Data diuji dengan menggunakan Analisis of Varians ( ANOVA ) Klasifikasi Dua Arah untuk melihat pengaruh pemberian perlakuan. Data diuji pada selang kepercayaan 95%. Uji BNT digunakan untuk melihat perlakuan yang paling berpengaruh terhadap morfologi anemon dan viabilitas zooxanthellae. Proses penghitungan dilakukan dengan menggunakan program SPSS 15.0. Hipotesis yang diuji adalah sebagai berikut :
1. H0 : α1 = α2 = … = αr = 0
H1 : sekurang-kurangnya ada satu αi ≠ 0 2. H0 : β1 = β2 = … = βc = 0
4.1. Hasil Penelitian 4.1.1. Karakteristik Lampu incandesce
yang diemisikan lamp spektrum warna biru ( Selain spektrum warn ( 500-600 nm ) denga ultraviolet ( <400 nm ultraviolet yang diemi ultraviolet A ( UV A gambar 10.
Lampu fluorescent
spektrum ultraviolet ( spektrum ultraviolet s sebagai ultraviolet A pada gambar 10.
Gambar 10. Karakt
fluore
HASIL DAN PEMBAHASAN
ian
tik gelombang lampu
scent mengemisikan tiga spektrum warna. Panj
mpui incandescent didominasi oleh panjang gel u ( 400-500 nm ) dengan intensitas relatif sebes
rna biru, lampu ini juga mengemisikan spektru gan intensitas relatif sebesar 1391 lux, dan spek m ) dengan intensitas relatif sebesar 1500 lux. misikan oleh lampu incandescent dikategorikan A ). Intensitas relatif lampu incandescent dapat
ent hanya mengemisikan satu spektrum gelomb t ( <400 nm ). Intensitas relatif yang diemisika t sebesar 905 lux. Spektrum yang diemisikan d A ( UV A ). Intensitas relatif lampu fluorescent
akteristik gelombang lampu incandescent ( A
escent ( B ).
A
njang gelombang elombang
esar 2427 lux. trum warna hijau
ektrum . Spektrum an sebagai pat dilihat pada
bang, yaitu kan oleh n dikategorikan
ent dapat dilihat
4.1.2. Pengamatan Visual
Kondisi anemon pada akuarium 1 yang diberi perlakuan lampu incandescent
selama lima hari memperlihatkan penurunan tampilan. Hanya dua dari tiga individu yang hidup selama periode lima hari pengamatan. Warna kedua individu yang hidup ini lebih pucat di akhir pengamatan daripada sebelum diberikan perlakuan. Walaupun demikian, kedua anemon ini memperlihatkan kondisi dan tingkah laku yang normal. Tentakelnya terkembang dan aktif bergerak serta tidak terjadi penyusuatan ukuran tubuh.
Individu yang mati memperlihatkan tampilan yang kurang baik sejak sebelum diberi perlakuan. Warnanya agak pucat dibandingkan dengan kedua individu lainnya. Tentakel terkembang dan aktif bergerak, tetapi mesenteri filamentnya keluar. Kondisinya semakin memburuk setelah diberi perlakuan. Pada hari pertama, tentakelnya terkembang tetapi tidak aktif bergerak dan mesentery
filamentnya keluar. Pada hari kedua ukuran tubuh menyusut, tentakel terkembang
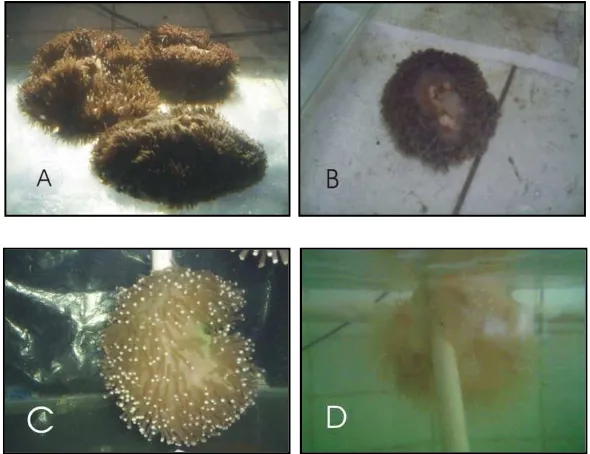
Gambar 11. Kondisi anemon pada akuarium 1 ( lampu incandescent ). Anemon sebelum diberikan perlakuan ( A ), saat diberi perlakuan ( B ), warna lebih pucat pada d5 ( C ), dan setelah 26 hari ( D ).
Kondisi anemon pada akuarium 2 yang diberi perlakuan lampu fluorescent
selama periode lima hari memperlihatkan penurunan tampilan. Pada d-1 kondisi ketiga individu relatif tidak sehat bila dibandingkan dengan individu anemon pada akuarium 1 dan 3. Walaupun demikian, ketiga individu memperlihatkan kondisi aktif, yaitu tentakel terkembang dan bergerak bila disentuh. Pada hari pertama, ketiga individu mengeluarkan mesenteri filament tetapi kondisi tentakel aktif. Demikian pula pada hari berikutnya sampai dengan hari ke lima, anemon terlihat mengeluarkan mesentery filament, tentakel terkembang dan aktif bergerak, tetapi tubuh anemon akan menguncup bila terlalu banyak sentuhan. Warna anemon mulai terlihat memucat sejak hari kedua pengamatan. Individu ke tiga
memperlihatkan kondisi stress pada hari ke tiga. Mulutnya membuka lebar,
mesenteri filament keluar, mengeluarkan lendir, tentakel terkembang dan hanya
pengamatan, warna ketiga individu lebih pucat daripada individu di akuarium 1, ukuran tubuh menyusut, dan mengeluarkan banyak lendir. Hasil pengamatan visual pada akuarium 2 dapat dilihat pada gambar 12.
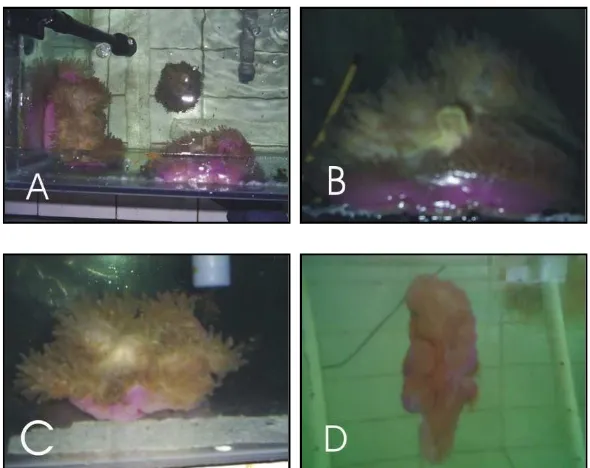
Gambar 12. Kondisi anemon pada akuarium 2 ( lampu fluorescent ). Anemon sebelum diberikan perlakuan ( A & B ), saat d3 ( C ), dan setelah diberikan perlakuan pada d7 ( D ).
Kondisi anemon pada akuarium 3 dengan penyinaran cahaya matahari selama periode lima hari pengamatan memperlihatkan penurunan tampilan. Ketiga individu terlihat lebih pucat, ukuran tubuh menyusut, dan terkadang mengeluarkan
mesenteri filament setelah diberi makan. Secara keseluruhan, ketiga individu
Gambar 13. Kondisi anemon pada akuarium 3. Sebelum anamon diberikan perlakuan ( A ). Saat diberikan perlakuan ( B ). Setelah diberikan perlakuan ( C ).
4.1.3. Pengamatan Preparat Histologis
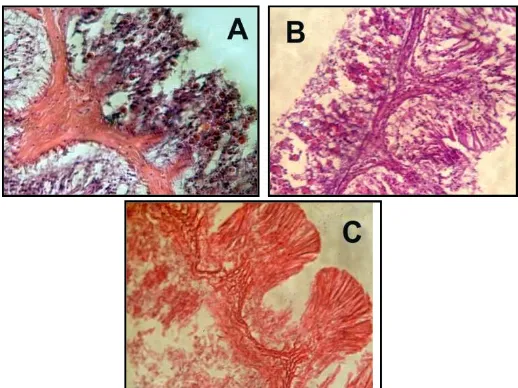
Pengamatan preparat histologis memperlihatkan adanya perubahan morfologi pada anemon yang mendapatkan perlakuan lampu incandescent dan lampu
fluorescent. Dari gambar 14 & 15 dapat diamati jumlah zooxanthellae semakin
berkurang dan hanya sedikit zooxanthellae yang berada di lapisan gastroderm pada akhir pengamatan. Lapisan gastroderm mengalami perubahan ketebalan dan jaringan pada tentakel mulai mengalami kerusakan.
Gambar 15. Morfologi anemon ( H. malu ) pada perbesaran objektif 40x di akuarium 2 saat d-1 ( A ), saat d3 ( B ), dan saat d5 ( C ). Berbeda dengan morfologi anemon pada perlakuan lampu incandescent dan lampu fluorescent, morfologi anemon akuarium 3 dengan cahaya matahari tidak memperlihatkan perubahan yang signifikan. Jumlah zooxanthellae yang ada di lapisan gastroderm relatif tetap. Ketebalan lapisan gastroderm cenderung lebih stabil. Hanya beberapa sampel yang memperlihatkan kerusakan jaringan pada akhir pengamatan. Morfologi anemon dengan cahaya matahari dapat dilihat pada gambar 16.
Gambar 16. Morfologi anemon ( H. malu ) pada perbesaran objektif 40x di akuarium 3 saat d-1 ( A ), saat d3 ( B ), dan saat d5 ( C ).
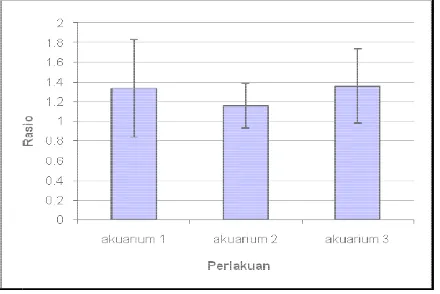
4.1.4. Rasio Ketebalan Gastroderm dengan Ektoderm
Rasio ketebalan gastroderm dengan ektoderm pada akuarium 1 ( lampu
incandescent ) mengalami perubahan setelah diberikan perlakuan seperti terlihat
d5. Rasio ketebalan g menjadi 1,63 atau ber 1,63 menjadi 1,16 ata gastroderm anemon p seperti terlihat pada g
Sum
Gambar 17. N d
Gambar 18. P s p
Rasio ketebalan ga
fluorescent ) mengala
pada gambar 19 yang dengan ektoderm indi
Bar 1 : 5 m
n gastroderm dengan ektoderm individu 3 berta ertambah sebesar 16,015% pada d3, kemudian tau berkurang 39,70% pada d5. Perubahan ke pada akuarium 1 dapat diamati pada preparat h
gambar 18.
umber : diolah dari lampiran 5.
Nilai rata-rata dan standard error rasio keteba dengan ektoderm akuarium 1 ( lampu incande
Potongan melintang tentakel anemon ( H. malu
saat d-1 ( A ), saat d3 ( B ), dan saat d5 ( C ) d perbesaran objektif 10x.
gastroderm dengan ektoderm pada akuarium 2 lami perubahan setelah diberikan perlakuan sep ng diolah dari lampiran 6. Rasio ketebalan ga dividu 1 bertambah dari 1,27 menjadi 1,42 atau
Bar 1 : 5 m Bar 1 : 5 m
rtambah dari 1,36 an berkurang dari ketebalan lapisan
t histologis
balan gastroderm
descent ).
alu ) akuarium 1 ) dengan
2 ( lampu seperti terlihat gastroderm
10,56% pada d3, kem pada d5. Rasio keteb 0,97 menjadi 1,36 ata menjadi 1,16 atau seb ektoderm individu 3 b d3, kemudian berkura
Sum
Gambar 19. N d
Respon individu d sama. Ketiga individu terhadap ektoderm pa kembali pada d5 berk lapisan gastroderm an histologis seperti gam
mudian berkurang dari 1,42 menjadi 1,29 atau ebalan gastroderm dengan ektoderm individu 2 tau sebesar 28,68% pada d3 kemudian berkura ebesar 17,24% pada d5. Rasio ketebalan gastro 3 bertambah dari 1,23 menjadi 1,28 atau sebesa
rang dari 1,28 menjadi 0,97 atau sebesar 31,96
umber : diolah dari lampiran 6.
Nilai rata-rata dan standard error rasio keteba dengan ektoderm akuarium 2 ( lampu fluoresc
di dalam akuarium 2 terhadap perlakuan yang idu mengalami peningkatan rasio ketebalan ga pada d3 berkisar antara 4,07%-28,68% dan ras rkisar antara 10,085%-31,96% pada d5. Perub anemon pada akuarium 2 dapat diamati pada pr
ambar 20 berikut.
au sebesar10,08 % 2 bertambah dari rang dari1,36 troderm dengan sar 4,07% pada 96% pada d5.
balan gastroderm
escent ).
g diberikan relatif gastroderm
rasio berkurang ubahan ketebalan
Gambar 20. P s p
Rasio ketebalan ga matahari ) mengalami gambar 21 yang diol dengan ektoderm seba individu berbeda-beda berkurang dari 1,45 m bertambah dari 1,17 m
Sum
Gambar 21. N d
Rasio ketebalan ga menjadi 1,02 atau seb Bar 1
Potongan melintang tentakel anemon ( H. malu
saat d-1 ( A ), saat d3 ( B ), dan saat d5 ( C ) d perbesaran objektif 10x..
gastroderm dengan ektoderm pada akuarium ko mi perubahan setelah diberikan perlakuan seper iolah dari lampiran 7. Berubahnya rasio keteba bagai respon terhadap perlakuan yang diberika eda. Rasio ketebalan gastroderm dengan ektode menjadi 1,17 atau sebesar 23,93% pada d3, ke 7 menjadi 1,25 atau sebesar 6,4% pada d5.
umber : diolah dari lampiran 7.
Nilai rata-rata dan standard error rasio keteba dengan ektoderm akuarium 3 ( cahaya mataha
gastroderm dengan ektoderm individu 2 berkur ebesar 54,90 % pada d3, kemudian berkurang d
1 : 5 m Bar 1 : 5 m Bar 1 : 5 m
alu ) akuarium 2 ) dengan
kontrol ( cahaya perti terlihat pada ebalan gastroderm ikan oleh tiap
derm individu 1 kemudian
balan gastroderm hari )
menjadi 0,84 atau seb ektoderm individu 3 b kemudian dari 1,25 m ketebalan lapisan gast preparat histologis sep
Gambar 22. P s p Hasil uji BNT ras selang kepercayan 95 antara ketiga akuarium ektoderm saat d-1 dap
Sum
Gambar 23. N d Bar 1 : 5 m
ebesar 21,43% pada d5. Rasio ketebalan gastro 3 bertambah dari 1,05 menjadi 1,25 atau sebesa
menjadi 0,81 atau sebesar 54,32% pada d5 Per astroderm anemon pada akuarium 3 dapat diam seperti terlihat pada gambar 22.
Potongan melintang tentakel anemon ( H. malu
saat d-1 ( A ), saat d3 ( B ), dan saat d5 ( C ) d perbesaran objektif 10x.
asio ketebalan gastroderm dengan ektoderm saa 95% menunjukkan bahwa tidak ada perbedaan ium. Grafik hasil uji BNT rasio ketebalan gastr
apat dilihat pada gambar 23 yang diolah dari l
umber : diolah dari lampiran 10.
Nilai rata-rata dan standard error rasio keteba dengan ektoderm pada setiap perlakuan saat d
B
C
Bar 1 : 5 m
troderm dengan sar 16% pada d3, erubahan
mati pada
alu ) akuarium 3 dengan
saat d-1 pada n yang nyata stroderm dengan
lampiran 10.
balan gastroderm t d-1.
Hasil uji BNT rasi selang kepercayan 95 antara ketiga akuarium ektoderm saat d3 dapa
Sum
Gambar 24. N d
Hasil uji BNT ras selang kepercayan 95 antara ketiga Akuariu ektoderm saat d5 dapa
Sum
Gambar 25. N d
4.1.5. Mitotik indeks
sio ketebalan gastroderm dengan ektoderm saa 95% menunjukkan bahwa tidak ada perbedaan ium. Grafik hasil uji BNT rasio ketebalan gastro apat dilihat pada gambar 24 yang diolah dari la
umber : diolah dari lampiran 10.
Nilai rata-rata dan standard error rasio keteba dengan ektoderm pada setiap perlakuan saat d
asio ketebalan gastroderm dengan ektoderm saa 95% menunjukkan bahwa tidak ada perbedaan rium. Grafik hasil uji BNT rasio ketebalan gastr apat dilihat pada gambar 25 yang diolah dari la
umber : diolah dari lampiran 10.
Nilai rata-rata dan standard error rasio keteba dengan ektoderm pada setiap perlakuan saat d
eks
aat d3 pada n yang nyata
troderm dengan lampiran 10.
balan gastroderm t d3.
saat d5 pada n yang nyata stroderm dengan
lampiran10.
Pembelahan mitos memiliki pola yang ce zooxanthellae akuariu tertinggi terjadi pada Pembelahan yang terj terjadi pada d2 h9 seb dilihat pada gambar
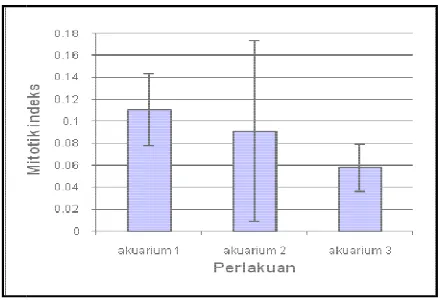
Sumber
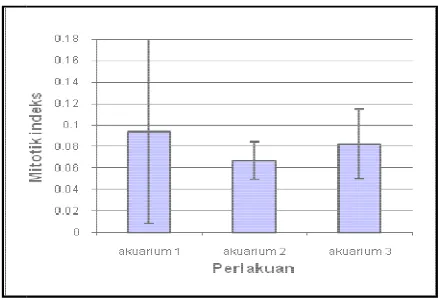
Gambar 26. N a
Pembelahan mitos memiliki pola yang be d3h9 sebesar 40,91%.
flourecent ) berkisar a
dapat dilihat pada gam
osis zooxanthellae pada akuarium 1 ( lampu inc
cenderung sama pada tiap individu. Mitotik in rium 1 berkisar antara 0,041-0,44. Puncak pem a d1h1, yaitu pada 1 jam setelah diberikan perl erjadi sebesar 77,27%. Puncak pembelahan pad
ebesar 56%. Mitotik indeks zooxanthellae aku r 26 yang diolah dari lampiran1.
er : diolah dari lampiran 1.
Nilai rata-rata dan standarderror mitotik ind akuarium 1 ( lampu incandescent ).
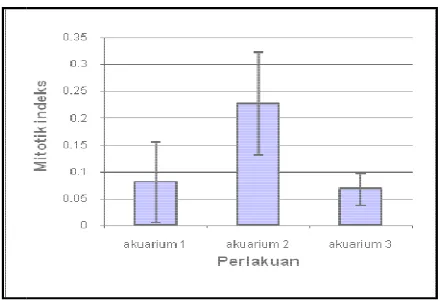
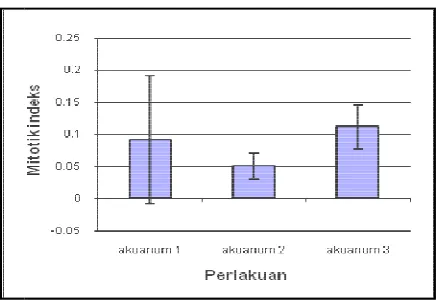
osis zooxantellae pada akuarium 2 ( lampu fluo
berbeda pada tiap individu. Puncak tertinggi t %. Mitotik indeks zooxanthellae pada akuarium r antara 0,03-0,37. Mitotik indeks zooxanthella ambar 27 yang diolah dari lampiran 1.
incandescent )
indeks embelahan erlakuan.
ada hari ke dua kuarium 1 dapat
ndeks pada
luorescent )
i terjadi pada ium 2 ( lampu
Sumber
Gambar 27. N a
Pembelahan mitos memiliki pola yang ce tertinggi terjadi pada hari ke dua terjadi pad akuarium 3 ( cahaya m zooxanthellae akuariu lampiran 1.
Sumber
er : diolah dari lampiran 1.
Nilai rata-rata dan standarderror mitotik inde akuarium 2 ( lampu flourescent ).
osis zooxantellae pada akuarium 3 ( cahaya ma cenderung sama pada tiap individu. Puncak pe
a d1h1 sebesar 83,14%. Puncak pembelahan te ada d2h9 sebesar 82,09%. Mitotik indeks zoox a matahari ) berkisar antara 0,05-0,39. Mitotik i rium 3 dapat dilihat pada gambar 28 yang diol
er : diolah dari lampiran 1.
deks pada
atahari ) pembelahan
tertinggi pada ooxanthellae pada ik indeks
Gambar 28. N a
Hasil uji terhadap menggunakan uji BNT berbeda nyata karena mitotik indeks zooxan dari lampiran 9.
Su
Gambar 29. N z
Hasil uji BNT ( P<
menunjukkan bahwa :
incandescent berbeda
nyata dengan kontrol;
fluorescent berbeda n
nyata dengan kontrol; berbeda nyata dengan perlakuan lampu fluor
Nilai rata-rata dan standarderror mitotik inde akuarium 3 ( cahaya matahari ).
p mitotik indeks zooxanthellae pada saat d-1 de NT ( P<0,05 ) menunjukkan bahwa ketiga aku na belum diberikan perlakuan. Grafik hasil uji B
anthellae saat d-1 dapat dilihat pada gambar 2
Sumber : diolah dari lampiran 9.
Nilai rata-rata dan standard error pada mitotik zooxanthellae pada setiap perlakuan saat d-1.
P<0,05 ) terhadap mitotik indeks zooxanthellae
a : mitotik indeks zooxanthellae pada perlakuan da nyata dengan perlakuan lampu flourescent d
; mitotik indeks zooxanthellae pada perlakuan nyata dengan perlakuan lampu incandescent d
; dan mitotik indeks zooxanthellae pada akua an perlakuan lampu incandescent dan berbeda n
uorescent. Hal ini terjadi karena perbedaan ritm
deks pada
dengan kuarium tidak ji BNTpada r 29 yang diolah
tik indeks
lae saat d1h0 uan lampu
dan berbeda an lampu
dan berbeda uarium kontrol
ketiga akuarium terse saat d1h0 dapat diliha
Sum
Gambar 30. N z
Hasil uji terhadap menggunakan uji BNT zooxantellae pada per lampu incandescent d mitotik indeks zooxan dari lampiran 9.
Sum
sebut. Grafik hasil uji BNT pada mitotik indek ihat pada gambar 30 yang diolah dari lampiran
umber : diolah dari lampiran 9.
Nilai rata-rata dan standard error pada mitotik zooxanthellae pada setiap perlakuan saat d1h0
p mitotik indeks zooxanthellae pada saat d1h1 NT ( P<0,05 ) menunjukkan bahwa mitotik ind
erlakuan lampu fluorescent berbeda nyata deng dan berbeda nyata dengan kontrol. Grafik has anthellae saat d1h1 dapat dilihat pada gambar
umber : diolah dari lampiran 9.
eks zooxanthellae ran 9.
k indeks h0.
1 dengan indeks
Gambar 31. N z
Hasil uji terhadap menggunakan uji BNT berbeda nyata. Grafik dapat dilihat pada gam
Sum
Gambar 32. N z
Hasil uji terhadap menggunakan uji BNT zooxantellae pada per lampu incandescent d d1h6 merupakan punc indeks akuarium 1 da indeks zooxanthellae lampiran 9.
Nilai rata-rata dan standard error pada mitotik zooxanthellae pada setiap perlakuan saat d1h1
p mitotik indeks zooxanthellae pada saat d1h3 NT ( P<0,05 ) menunjukkan bahwa ketiga perl fik hasil uji BNT pada mitotik indeks zooxanthe
ambar 32 yang diolah dari lampiran 9.
umber : diolah dari lampiran 9.
Nilai rata-rata dan standard error pada mitotik zooxanthellae pada setiap perlakuan saat d1h3
p mitotik indeks zooxanthellae pada saat d1h6 NT ( P<0,05 ) menunjukkan bahwa mitotik ind
erlakuan lampu fluorescent berbeda nyata deng dan berbeda nyata dengan kontrol. Hal ini ter ncak tertinggi mitotik indeks akuarium 2 sedan dan 3 udah mulai menurun. Grafik hasil uji BN ae saat d1h3 dapat dilihat pada gambar 33 yang
k indeks h1.
dengan erlakuan tidak thellae saat d1h3
k indeks 3.
dengan indeks
ngan perlakuan terjadi karena saat
Sum
Gambar 33. N z
Hasil uji terhadap menggunakan uji BNT berbeda nyata. Grafik dapat dilihat pada gam
Sum
Gambar 34. N z
Hasil uji terhadap menggunakan uji BNT berbeda nyata. Grafik dapat dilihat pada gam
umber : diolah dari lampiran 9.
Nilai rata-rata dan standard error pada mitotik zooxanthellae pada setiap perlakuan saat d1h6
p mitotik indeks zooxanthellae pada saat d1h9 NT ( P<0,05 ) menunjukkan bahwa ketiga perl fik hasil uji BNT pada mitotik indeks zooxanthe
ambar 34 yang diolah dari lampiran 9.
umber : diolah dari lampiran 9.
Nilai rata-rata dan standard error pada mitotik zooxanthellae saat pada setiap perlakuan d1h9
p mitotik indeks zooxanthellae pada saat d2h1 NT ( P<0,05 ) menunjukkan bahwa ketiga perl fik hasil uji BNT pada mitotik indeks zooxanthe
ambar 35 yang diolah dari lampiran 9.
k indeks 6.
dengan erlakuan tidak thellae saat d1h9
tik indeks h9.
Sum
Gambar 35. N z
Hasil uji terhadap menggunakan uji BNT berbeda nyata. Grafik dapat dilihat pada gam
Sum
Gambar 36. N z
Hasil uji terhadap menggunakan uji BNT berbeda nyata. Grafik dapat dilihat pada gam
umber : diolah dari lampiran 9.
Nilai rata-rata dan standard error pada mitotik zooxanthellae pada setiap perlakuan saat d2h1
p mitotik indeks zooxanthellae pada saat d2h9 NT ( P<0,05 ) menunjukkan bahwa ketiga perl fik hasil uji BNT pada mitotik indeks zooxanth
ambar 36 yang diolah dari lampiran 9.
umber : diolah dari lampiran 9.
Nilai rata-rata dan standard error pada mitotik zooxanthellae pada setiap perlakuan saat d2h9
p mitotik indeks zooxanthellae pada saat d3h1 NT ( P<0,05 ) menunjukkan bahwa ketiga perl fik hasil uji BNT pada mitotik indeks zooxanthe
ambar 37 ya