ENZIMATIS
HERRY
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Degradasi Ampas Perasan Kelapa Sawit Menggunakan Kombinasi Kimia dan Enzimatis adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini
Bogor, Maret 2010
Herry. Degradation Of Palm Oil Dregs Using Chemical and Enzimatic Combination. Under direction of ZAINAL ALIM MAS’UD and KOMAR SUTRIAH
Degradation of palm oil dregs using chemical and cellulose enzim combination has been tried to produce simple sugar from cellulose and hemicellulose moleculs in palm oil dregs. Combination chemical (sodium hypochlorite and hydrogen peroxide) and enzim are used to degrade cellulose and hemicellulose. It is proposed to produce simple sugar that can be used as raw material resources in feed. The reason of using sodium hypochlorite and hydrogen peroxide is their characteristic as an oxidator that can cleave molecul binding in cellulose, hemicellulose, and also release lignin that binded with cellulose and hemicellulose. The objective of this research is to get scientific information about the technic of palm oil dregs degradation using combination method of chemical and enzim. This reaserch has done on March 2008 – February 2009 at Testing Laboratory of Balai Besar Pengembangan Budidaya Air Tawar and Laboratorium Terpadu IPB. The procedur consists of (1) preparing palm oil dregs; (2) treatment palm kernel meal with NaOCl – H2O2 on effect of pH (4, 6, 8, 10, 12), temperature (25, 50, 70, 90oC), time (0,5, 3, 24, 100 hours); and then (2) treatment palm oil dregs with combination of chemical and cellulose enzim. The result show that NaOCl 0,12% - H2O2 1% and sulfuric acid 72% can be effective to degrade palm kernel meal to be glucose, fructose and other sugar compound. The effect of pH, temperature, and time on palm oil dregs treatment can produce the glucose and fructose compound. The highest glucose compound is reached at pH 6, 70oC and 100 hours about 9,86%, 8,24% and 12,49% respectively. Glucose concentration on combination treatment is approximately 25,42% twice higher that treatment of time and three times from pH 6 and 70oC.
RINGKASAN
Herry. Degradasi Ampas Perasan Kelapa Sawit Menggunakan Kombinasi Kimia dan Enzimatis. Dibimbing oleh ZAINAL ALIM MAS’UD dan KOMAR SUTRIAH.
Ampas perasan kelapa sawit merupakan hasil samping industri minyak kelapa sawit yang cukup melimpah keberadaannya di Indonesia. Ampas perasan kelapa sawit dapat digunakan sebagai sumber gula, sebuah alternatif sumber bahan baku pakan ikan lokal. Namun, nilai nutrisi dan kecernaannya yang rendah bila langsung digunakan sebagai bahan baku pakan ikan karena kandungan serat kasar yang tinggi merupakan faktor pembatas pemanfaatannya sebagai bahan baku pakan ikan yang tidak dapat memanfaatkan selulosa sebagai sumber energinya. Sebagian besar masalahnya adalah fungsi struktur lignoselulosa, yang terdiri dari selulosa, hemiselulosa, dan lignin. Produk glukosa dapat dihasilkan dari degradasi selulosa selulosa, sedangkan produk gula berkarbon lima dapat dihasilkan dari hemiselulosa. Selulosa dan hemiselulosa pada lignoselulosa ampas perasan kelapa sawit tidak dapat dihidrolisis kecuali lignin yang berikatan pada lignoselulosa dihilangkan terlebih dahulu. Berdasarkan fakta tersebut perlu dilakukan usaha merekayasa ampas perasan kelapa sawit secara kimia dan enzimatis sehingga menghasilkan bahan baku pakan ikan yang nilai nutrisi dan kecernaannya tinggi.
Penelitian ini bertujuan untuk memperoleh informasi ilmiah mengenai teknik degradasi ampas perasan kelapa sawit dengan menggunakan metode kombinasi kimia dan enzimatik. Sementara manfaat penelitian ini adalah untuk memberikan salah satu teknik pengolahan ampas perasan kelapa sawit sebagai bahan baku pakan ikan sehingga dapat meningkatkan nilai ekonomis ampas perasan kelapa sawit.
Metode degradasi ampas perasan kelapa sawit yang digunakan adalah metode kombinasi kimia dan enzimatik dengan menggunakan natrium hipoklorit-hidrogen peroksida untuk proses delignifikasi dan degradasi selulosa menjadi glukosa menggunakan hidrolisis asam sulfat dan enzima selulase. Penggunaan natrium hipoklorit dan hidrogen peroksida adalah karena sifat pengoksidasinya yang cukup kuat sehingga dapat menghilangkan lignin ada di dalam molekul lignoselulosa yang berikatan dengan selulosa atau hemiselulosa yang akan didegradasi oleh asam sulfat dan enzim selulase.
DEGRADASI AMPAS PERASAN KELAPA SAWIT
MENGGUNAKAN KOMBINASI KIMIA DAN
ENZIMATIS
HERRY
Tesis
Sebagai salah satu syarat untuk memperoleh gelas Magister Sains pada
Program Studi Kimia
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
© Hak Cipta milik IPB, tahun 2010 Hak Cipta dilindungi Undang-Undan
DEGRADASI AMPAS PERASAN KELAPA
SAWIT MENGGUNAKAN KOMBINASI KIMIA
DAN ENZIMATIS
HERRY
Tesis
Sebagai salah satu syarat untuk memperoleh gelas Magister Sains pada
Program Studi Kimia
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Degradasi Ampas Perasan Kelapa Sawit Menggunakan Kombinasi Kimia dan Enzimatis.
Nama : Herry
NIM : G452040011
Disetujui Komisi Pembimbing
Dr. Zainal Alim Mas’ud, DEA Drs. Komar Sutriah, M.S
Ketua Anggota
Diketahui
Ketua Program Studi Kimia Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Latifah K. Darusman, M.S Prof. Dr. Ir. Khairil A. Notodiputro, M.S
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2008 ini ialah degradasi ampas perasan kelapa sawit, dengan judul degradasi ampas perasan kelapa sawit menggunakan kombinasi kimia dan enzimatis.
Terima kasih penulis ucapkan kepada Bapak Dr. Zainal Alim Mas’ud, DEA dan Bapak Drs. Komar Sutriah, M.S selaku pembimbing, serta Pak Muhammad Farid yang telah banyak memberikan saran. Di samping itu, penghargaan penulis sampaikan kepada Nurdiyan, Mas Khotib, Pak Farid, Mila, Ian, Ibu Eti Pak Wawan dan staf Laboratorium Terpadu serta pegawai Laboratorium Nutrisi Balai Besar Pengembangan Budidaya Air Tawar Sukabumi yang telah membantu selama pelaksanaan penelitian ini, serta M. Rafi, S.Si, M.Si atas nasehat dan luangan waktu dalam diskusi hasil penelitian. Ungkapan terima kasih dan doa juga disampaikan kepada istriku dan anakku tercinta, ayah, mama, bapak mertua, ibu mertua, dan mega serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Maret 2010
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 5 Agustus 1977 sebagai anak kedua dari pasangan Budjang dan Wati. Pendidikan sarjana ditempuh di Program Studi Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam IPB, lulus tahun 2001. Pada tahun 2004, penulis diterima di Program Studi Kimia pada Sekolah Pascasarjana IPB. Beasiswa pendidikan pascasarjana diperoleh dari Departemen Pendidikan Nasional Republik Indonesia.
DAFTAR TABEL………... xii
DAFTAR GAMBAR………... xiii
DAFTAR LAMPIRAN………... xiv
PENDAHULUAN
Latar Belakang………... Tujuan dan Manfaat Penelitian...………...……
1 2
TINJAUAN PUSTAKA
Ampas Perasan Kelapa Sawit Sebagai Biomassa Lignoselulosa... Selulosa.………….……... Hemiselulosa... Lignin ... Metode Perlakuan Untuk lignoselulosa ... Kombinasi Kimia dan Enzimatis ... Natrium Hipoklorit ... Hidrogen Peroksida ... Campuran Natrium Hipoklorit dan Hidrogen peroksida ... Degradasi Selulosa ... Hidrolisis Asam ... Hidrolisis Enzimatis ...
3
BAHAN DAN METODE
Waktu dan Tempat Penelitian... Bahan dan Alat ... Persiapan Ampas Perasan Kelapa Sawit ... Larutan NaOCl-H2O2 Induk ...
Larutan NaOCl 0,12% - H2O2 1% untuk Perlakuan...
Perlakuan Ampas Perasan Kelapa Sawit dengan Larutan NaOCl 0,12% - H2O2 1% dengan variasi pH dan H2SO4 72% ...
Perlakuan Ampas Perasan Kelapa Sawit dengan Larutan NaOCl 0,12% - H2O2 1% dengan variasi Suhu dan H2SO4 72% ...
Perlakuan Ampas Perasan Kelapa Sawit dengan Larutan NaOCl 0,12% - H2O2 1% dengan variasi waktu dan H2SO4 72% ...
Perlakuan Ampas Perasan Kelapa Sawit dengan Larutan NaOCl 0,12% - H2O2 1% pada pH 7, suhu 70oC dan waktu 100 jam dan kombinasi
HASIL DAN PEMBAHASAN
Tahap Pertama : Perlakuan Ampas Perasan Kelapa Sawit dengan Larutan NaOCl 0,12% - H2O2 1% pada variasi pH, Suhu, waktu dan
Hidrolisis H2SO4 72%…...
Tahap Kedua: Perlakuan Ampas Perasan Kelapa Sawit dengan Larutan NaOCl 0,12% - H2O2 1% pada pH 6, Suhu 700C, waktu 100
jam dan Kombinasi Hidrolisis Enzim Selulase dan H2SO4 72%...
20
24
SIMPULAN DAN SARAN………... 27
DAFTAR PUSTAKA………... 28
DAFTAR TABEL
Halaman 1. Komposisi Bahan-Bahan Lignoselulosa…..……….... 4 2. Metode Treatmen Biomassa Lignoselulosa...………... 3. Waktu Retensi (tR) dari Ampas Perasan Kelapa Sawit Perlakuan NaOCl
0,12% dan H2O2 1% dengan variasi pH, Suhu dan Waktu...
4. Luas Peak dari Ampas Perasan Kelapa Sawit Perlakuan NaOCl
0,12% dan H2O2 1% dengan variasi pH, Suhu dan Waktu...
10
22
Halaman 1. Pengolahan buah sawit menghasilkan produk utama minyak sawit serta
produk samping ………...…………..… 2
2. Sruktur Sekunder Dingding Sel Selulosa, Hemiselulosa, dan Lignin dari Bahan Lignoselulosa... 4
3. Struktur Selulosa………….………...………. 5
4. Struktur Hemiselulosa ……...………. 6
5. Struktur Lignin...……….. 7
6. Aktifasi Hidrogen Peroksida... 12
7. Skema turunan senyawa oksigen reaktif dari NaOCl dan H2O2... 14
8. Diagram dari reaksi enzim selulase pada hidrolisis selulosa……... 16
9. Persen bobot ampas perasan kelapa sawit yang hilang pada Perlakuan NaOCl 0,12% dan H2O2 1% dengan variasi pH... 21
10. Persen bobot ampas perasan kelapa sawit yang hilang pada Perlakuan NaOCl 0,12% dan H2O2 1% dengan variasi suhu... 21
11. Persen bobot ampas perasan kelapa sawit yang hilang pada Perlakuan NaOCl 0,12% dan H2O2 1% dengan variasi waktu... 21
12. Kandungan glukosa hasil hidrolisis asam sulfat 72% pada ampas perasan kelapa sawit Perlakuan NaOCl 0,12% dan H2O2 1% dengan variasi pH, suhu dan waktu ... 21
13. Kandungan glukosa pada ampas perasan kelapa sawit Perlakuan kombinasi dibandingkan variasi pH, suhu dan waktu... 22
DAFTAR LAMPIRAN
Halaman 1. Diagram alir penelitian tahap pertama ...…………... 32 2. Diagram alir penelitian tahap kedua ...………... 33 3. Perlakuan ampas perasan kelapa sawit dengan Larutan NaOCl 0,12% - H2O2 1%
pada variasi pH dan H2SO4 72% ...
34
4. Perlakuan ampas perasan kelapa sawit dengan Larutan NaOCl 0,12% - H2O2 1%
pada variasi Suhu dan H2SO4 72%...
35
5. Perlakuan ampas perasan kelapa sawit dengan Larutan NaOCl 0,12% - H2O2 1%
pada Waktu variasi dan H2SO472% ...
36
6. Perlakuan ampas perasan kelapa sawit dengan Larutan NaOCl 0,12% - H2O2 1%
Enzim Selulase dan H2SO4 72%...
37
7. Kadar ampas perasan kelapa sawit yang Hilang selama Perlakuan Larutan NaClO 0,12% - H2O2 ...
38
8. Luas Peak dan Waktu Retensi (tR) Standar Gula... 39 9. Luas Peak dan Waktu Retensi (tR) ampas perasan kelapa sawit Perlakuan ... 40 10.Kandungan Komposisi Glukosa dan Fruktosa pada Sampel ampas perasan
kelapa sawit Perlakuan... 41 11.Kromatogram Standar Gula Menggunakan KCKT... 42 12.Kromatogram ampas perasan kelapa sawit pengaruh pH 4 pada analisa
Komposisi Kandungan Gula Menggunakan KCKT...
43
13.Kromatogram ampas perasan kelapa sawit pengaruh pH 6 pada analisa Komposisi Kandungan Gula Menggunakan KCKT...
44
14.Kromatogram ampas perasan kelapa sawit pengaruh pH 8 pada analisa Komposisi Kandungan Gula Menggunakan KCKT...
45
15.Kromatogram ampas perasan kelapa sawit pengaruh pH 10 pada analisa Komposisi Kandungan Gula Menggunakan KCKT ...
46
16.Kromatogram ampas perasan kelapa sawit pengaruh pH 12 pada analisa Komposisi Kandungan Gula Menggunakan KCKT...
47
17.Kromatogram ampas perasan kelapa sawit pengaruh T25 oC pada analisa Komposisi Kandungan Gula Menggunakan KCKT...
48
18.Kromatogram ampas perasan kelapa sawit pengaruh T50 oC pada analisa Komposisi Kandungan Gula Menggunakan KCKT...
49
19.Kromatogram ampas perasan kelapa sawit pengaruh T70 oC pada analisa Komposisi Kandungan Gula Menggunakan KCKT...
50
20.Kromatogram ampas perasan kelapa sawit pengaruh T90 oC pada analisa Komposisi Kandungan Gula Menggunakan KCKT...
51
21.Kromatogram ampas perasan kelapa sawit pengaruh waktu 0,5 jam pada analisa Kandungan Gula Menggunakan KCKT...
52
22.Kromatogram ampas perasan kelapa sawit pengaruh waktu 3 jam pada analisa Kandungan Gula Menggunakan KCKT... ...
53
23.Kromatogram ampas perasan kelapa sawit pengaruh waktu 24 jam pada analisa Kandungan Gula Menggunakan KCKT... ...
25.Kromatogram Kombinasi Larutan NaOCl 0,12% - H2O2 1%, H2SO4 72% dan
PENDAHULUAN
Latar Belakang
Ampas perasan kelapa sawit merupakan hasil samping industri minyak kelapa sawit yang cukup melimpah keberadaannya di Indonesia. Setiap tahun dihasilkan 5.394 metrik ton ampas perasan kelapa sawit (Hem, 2005). Ampas perasan kelapa sawit dapat digunakan sebagai sumber gula (karbohidrat), sebuah alternatif sumber bahan baku pakan ikan lokal. Namun, nilai nutrisi dan kecernaannya yang rendah bila langsung digunakan sebagai bahan baku pakan ikan karena kandungan serat kasar yang tinggi merupakan faktor pembatas pemanfaatannya sebagai bahan baku pakan ikan yang tidak dapat memanfaatkan selulosa sebagai sumber energinya.
Sebagian besar masalahnya adalah fungsi struktur lignoselulosa (Sun, 2002), yang terdiri dari selulosa (senyawa gula berkarbon enam), hemiselulosa (senyawa gula berkarbon lima), dan lignin (senyawa polifenol). Produk glukosa dapat dihasilkan dari degradasi selulosa selulosa, sedangkan produk gula berkarbon lima dapat dihasilkan dari hemiselulosa (Klass, 1998). Selulosa dan hemiselulosa pada lignoselulosa ampas perasan kelapa sawit tidak dapat dihidrolisis kecuali lignin yang berikatan pada lignoselulosa dihilangkan terlebih dahulu. Lignin secara kimia berikatan dengan komponen selulosa dan hemiselulosa dan secara fisik bertindak sebagai penghalang proses perombakan dinding sel oleh enzim (Pareek, 2000).
Tujuan Penelitian
Tujuan penelitian ini adalah memperoleh informasi ilmiah menyangkut teknik degradasi ampas perasan kelapa sawit dengan menggunakan metode kombinasi kimia dan enzimatik.
Manfaat Penelitian
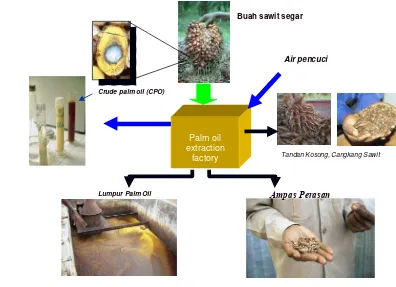
Buah sawit segar
Palm oil extraction
factory
Crude palm oil (CPO)
Lumpur Palm Oil
Tandan Kosong, Cangkang Sawit
Ampas Perasan
Air pencuci
TINJAUAN PUSTAKA
Ampas Perasan Kelapa Sawit Sebagai Biomassa Lignoselulosa Pengolahan buah kelapa sawit menghasilkan produk utama minyak kelapa
sawit serta produk samping seperti tandan kelapa sawit (TKS), ampas perasan
kelapa sawit, dan lumpur kelapa sawit (Gambar 1). Setiap hektar tanaman kelapa
sawit dapat menghasilkan 4 ton minyak per tahun, yang diperoleh dari sekitar 16
ton tandan buah segar (TBS). Selanjutnya setiap ton TBS dapat menghasilkan 250
kg minyak kelapa sawit, 294 kg lumpur kelapa sawit, dan 180 kg ampas perasan
kelapa sawit. Jumlah ini setara dengan 1.223 kg lumpur kelapa sawit, 509 kg
BKS, dan 2.678 kg ampas perasan kelapa sawit, dan 3.386 kg TKS setiap hektar
setiap tahun. Dari angka ini maka perkebunan kelapa sawit Indonesia dapat
menghasilkan 2.463 metrik ton lumpur sawit, 5.394 metrik ton ampas perasan
kelapa sawit, dan 6.818 metrik ton TKS (Hem, 2005).
Gambar 1. Pengolahan buah sawit menghasilkan produk utama minyak sawit
Ampas perasan kelapa sawit merupakan biomassa lignoselulosa potensial
yang dapat dijadikan sumber bahan baku pakan ikan, tidak bersaing dengan
manusia, serta tersedia secara terus-menerus yang sampai saat ini belum
digunakan secara maksimal. Ampas perasan kelapa sawit mempunyai beberapa
keuntungan untuk produksi gula. Hal yang paling penting, tidak seperti jagung,
ampas perasan kelapa sawit dikumpulkan sebagai produksi samping, sehingga
tidak disyaratkan untuk pemisahan panen. Terlebih lagi, ampas perasan kelapa
sawit murah, tersedia banyak, dan mempunyai unsur karbon yang tinggi.
Degradasi lignoselulosa seperti ampas perasan kelapa sawit, relatif sulit
dilakukan karena komponennya merupakan struktur yang kompak dengan ikatan
intermolekul yang kuat. Ringkasan dari komposisi berbagai senyawa
lignoselulosa yang dapat diubah menjadi gula ditampilkan pada Tabel 1.
Dalam sel tanaman termasuk tanaman sawit, dinding sekundernya, terdiri
dari 3 lapisan (S1, S2, dan S3) yang dikelilingi oleh dinding utama yang tipis.
Dinding sekunder dikelilingi oleh lignin. Lapisan S1 dan S3 mengandung banyak
selulosa dan hemiselulosa. Lapisan S2 mengandung selulosa kristal. Bentuk
kristal terdiri dari ikatan hidrogen linier. Bentuk amorf terdapat pada diantara
bentuk kristal selulosa. Amorf selulosa, hemiselulosa, dan lignin terdapat diantara
lapisan (S1, S2, dan S3) (Fox, 1987). Gambar dinding sel dengan komponennya
ditampilkan pada Gambar 2.
Tabel 1. Komposisi Bahan – Bahan Lignoselulosa (Saha, 2003, Sun, 2002)
Bahan Lignoselulosa Komposisi (% bobot kering)
5
Gambar 2. Sruktur Sekunder Dinding Sel Selulosa, Hemiselulosa, dan Lignin dari Bahan Lignoselulosa. BKS, mempunyai komposisi 55% selulosa, 24-40% hemiselulosa, dan 18-25% lignin. Lapisan S1 dan S3 mempunyai selulosa amorf dan hemiselulosa. Lapisan S2 mempunyai daerah selulosa kristal (Fox, 1987)
Selulosa
Selulosa merupakan komponen utama penyusun dinding sel tanaman.
Kandungan selulosa pada dinding sel tanaman tingkat tinggi sekitar 35 – 50% dari
berat kering tanaman (Lynd dkk. 2002). Selulosa merupakan polimer glukosa
dengan ikatan β-1,4-glukosida dalam rantai lurus dengan ukuran molekul berkisar
antara 300.000 Dalton hingga 500.000 Dalton (Klass, 1998. Bertran, 1986).
Bangun dasar selulosa (Gambar 3) berupa suatu selobiosa yaitu dimer dari
glukosa. Rantai panjang selulosa terhubung secara bersama melalui ikatan
hidrogen dan gaya van der walls (Perez dkk. 2002).
Selulosa mengandung sekitar 50-90% bagian berkristal dan sisanya bagian
amorf. Ikatan β-1,4-glukosida pada serat selulosa dapat dipecah menjadi monomer
menghasilkan sejumlah oligosakarida, termasuk selubiosa, selutriosa, selutetrosa
(Sjostrom, 1981. Feller, 1986). Kesempurnaan pemecahaan selulosa pada saluran
pencernaan ternak tergantung pada ketersediaan enzim pemecahan selulosa yaitu
selulase.
Selulosa dapat digunakan sebagai bahan baku produksi gula (Bezerra,
2004). Selulosa merupakan senyawa poliglikan yang tidak larut air yang
terkandung sekitar setengah dari bobot tanaman (Klass, 1998). Kapas merupakan
sumber selulosa yang hampir seluruhnya selulosa murni sedangkan ampas perasan
kelapa sawit hanya mengandung 40-55% selulosa.
Gambar 3. Struktur Selulosa (Sjostrom, 1981)
Ikatan hidrogen intramolekuler terbentuk antara gugus hidroksil pada
rantai selulosa yang sama menyebabkan tingginya viskositas dan rigiditas polimer
selulosa. Gugus hidroksil pada akhir setiap rantai selulosa mempunyai sifat kimia
yang berbeda. Atom karbon pertama pada akhir rantai selulosa mengandung
gugus aldehid sedangkan atom karbon keempat adalah gugus hidroksil alkohol.
Setiap unit glukosa pada rantai selulosa mempunyai tiga gugus hidroksil yang
berinteraksi dengan rantai lainnya melalui ikatan valensi. Kekuatan ikatannya
adalah 25 kj/mol, hampir seratus kali lebih kuat daripada ikatan Van der Wall
(sekitar 0,15kj/mol), tetapi lebih rendah sepuluh kalinya dari ikatan kovalen O-H
(460 kj/mol) (Krassig, 1993). Interaksi gugus hidroksil intra dan inter merupakan
kekuatan yang utama pada struktur selulosa.
Hemiselulosa
Hemiselulosa terdapat dalam dinding sel dan berikatan dengan selulosa.
7
rendah. Jumlah hemiselulosa biasanya antara 15 sampai 30% dari berat kering
bahan lignoselulosa. Hemiselulosa relatif lebih mudah dihidrolisis dengan asam
menjadi monomer yang mengandung glukosa, mannosa, galaktosa, xilosa, dan
arabinosa. Hemiselulosa mengikat lembaran serat selulosa membentuk mikrofibril
yang meningkatkan stabilitas dinding sel. Hemiselulosa juga berikatan silang
dengan lignin membentuk jaringan kompleks dan memberikan struktur yang kuat.
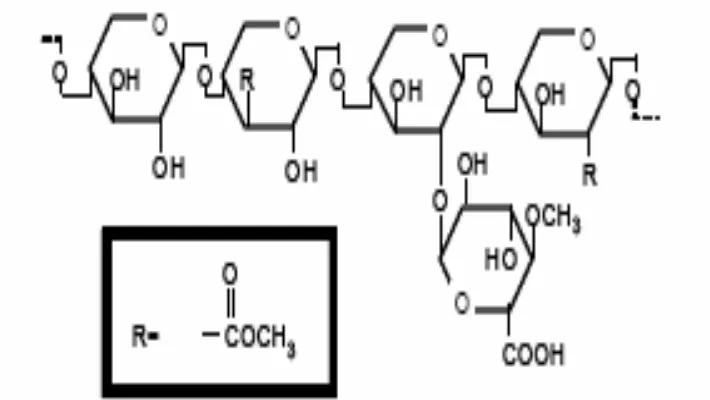
Gambar 4. Struktur Hemiselulosa (Sjostrom, 1981)
Xilosa (gula C5) adalah komponen yang paling banyak dalam
hemiselulosa. Xilane mengandung unit D-xilosa dan terikat pada karbon nomor
satu dan nomor empat dari setiap residunya. Arabinosa adalah komponen
terbanyak lainnya dalam hemiselulosa. Komponen minor, termasuk manosa,
galaktosa, dan asam uronik terdapat juga didalamnya. Beberapa hemiselulosa
mengandung glukomanan dan galaktoglukomanan. Glukomanan mengandung
unit D-glukosa dan D-manosa dengan perbandingan 30:70. Galaktoglukomanan
mengandung unit D-galaktosa, D-glukosa, dan D-manosa dengan perbandingan
2:10:30 (Kiass, 1998. Saha, 2003. Paster, 2003). Ringkasan struktur hemiselulosa
Lignin
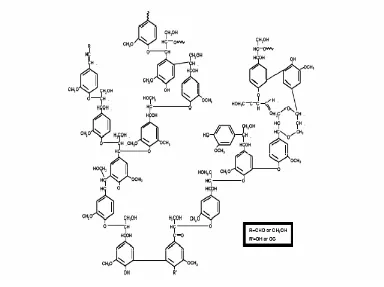
Lignin merupakan polimer dengan struktur aromatik yang terbentuk
melalui unit-unit penilpropan yang berhubungan secara bersama oleh beberapa
jenis ikatan berbeda (Klass, 1998, Pareek, 2000). Lignin sulit didegradasi karena
mempunyai struktur yang kompleks dan heterogen yang berikatan dengan selulosa
dan hemiselulosa dalam jaringan tanaman. Lebih dari 30% tanaman tersusun atas
lignin yang memberikan bentuk yang kokoh dan memberikan proteksi terhadap
serangga dan patogen. Disamping memberikan bentuk yang kokoh terhadap
tanaman, lignin juga membentuk ikatan yang kuat dengan polisakarida yang
melindungi polisakarida dari degradasi mikroba dan membentuk struktur
lignoselulosa.
Lignin terutama terkonsentrasi pada lamela tengah dan lapisan S2 dinding
sel yang terbentuk selama proses lignifikasi jaringan tanaman. Lignin tidak hanya
mengeraskan mikrofibril selulosa, juga berikatan secara fisik dan kimia dengan
hemiselulosa. Lignin terbentuk melalui polimerisasi tiga dimensi derivat dari
sinamil alkohol terutama p-kumaril, coniferil dan sinafil alkohol dengan bobot
molekul mencapai 11.000 (Gambar 5) (Gratzl, 2000. Campbell, 1996). Lignin
yang melindungi selulosa bersifat tahan terhadap hidrolisis karena adanya ikatan
arilalkil dan ikatan eter.
Pembentukan lignin terjadi secara intensif setelah proses penebalan
dinding sel terhenti. Pembentukan dimulai dari dinding primer dan dilanjutkan ke
dinding sekunder. Faktor lignin dalam membatasi fermeabilitas dinding sel
tanaman dapat dibedakan menjadi efek kimia dan efek fisik. Efek kimia, yaitu
hubungan lignin-karbohidrat dan asetilasi hemiselulosa. Lignin secara fisik
membungkus mikrofibril dalam suatu matriks hidrofobik dan terikat secara
kovalen dengan hemiselulosa. Hubungan lignin karbohidrat berperan dalam
mencegah hidrolisis selulosa.
Pada kayu keras, lignin mengandung banyak unit guaiasilpropan dan
siringilpropan dengan sedikit unit p-hidroksifenilpropan. Lignin mengandung unit
guaiasilpropan dengan unit p-hidroksifenilpropan pada kayu lunak (Baucher,
9
siringilpropan. Unit p-hidroksifenilpropan terdapat sebagai komponen minor
lignin pada tanaman rerumputan (Grabber, 2004).
Gambar 5. Struktur Lignin (Hammel, 1997)
Metode Perlakuan Untuk Lignoselulosa
Metode Perlakuan untuk lignoselulosa dirancang untuk dapat
meghilangkan lignin terlebih dahulu kemudian dilanjutkan proses hidrolisis asam
atau enzimatik (Wu, 1997). Selulosa berada secara alami sebagai matriks yang
kompak dan kompleks dengan lignin dan hemiselulosa (Cote, 1982). Selulosa
dikelilingi oleh lignin yang bertindak sebagai pelindung (Fox, 1987) dan
tergabung dengan hemiselulosa. Secara jelasnya reduksi selulosa dan
hemiselulosa dan hilangnya lignin merupakan tujuan penting dari berbagai proses
perlakuan (Wu, 1997). Menurut Tsao (1978), ikatan β-1.4 glukosidik dalam
selulosa lebih mudah terbuka daripada ikatan α-1.4-glukosidik pada kanji. Hal ini
jelas bahwa masalah utama hidrolisis selulosa dan hemiselulosa adalah struktur
Sejumlah metode perlakuan telah dikembangkan untuk mendegradasi
selulosa dan hemiselulosa, antara lain pulverisasi mekanis, pirolisis, asam, basa,
hidogen peroksida, autohidrolisis, eksplosi serat ammonia (AFEX), oksidasi
basah, kapur, eksplosi CO2, pelarut organik. Ringkasan metode perlakuan
ditampilkan pada Tabel 2. Setiap metode perlakuan memiliki kelebihan dan
kekurangan (Saha, 2003. Martin, 2002. Klass, 1998. Ramos, 1996).
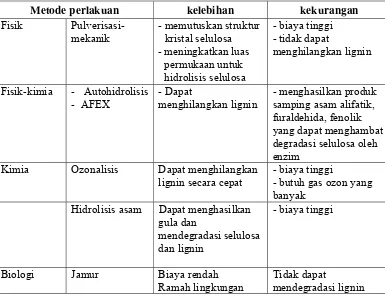
Tabel 2. Metode Treatmen Biomassa Lignoselulosa (Saha, 2003. Sun, 2002)
Metode perlakuan kelebihan kekurangan
Fisik Pulverisasi-
mekanik
-memutuskan struktur
kristal selulosa
-meningkatkan luas
permukaan untuk hidrolisis selulosa
- biaya tinggi - tidak dapat
menghilangkan lignin
Fisik-kimia - Autohidrolisis
- AFEX
- Dapat
menghilangkan lignin
- menghasilkan produk samping asam alifatik, furaldehida, fenolik yang dapat menghambat degradasi selulosa oleh enzim
Kimia Ozonalisis Dapat menghilangkan
lignin secara cepat
- biaya tinggi
- butuh gas ozon yang banyak
Hidrolisis asam Dapat menghasilkan
gula dan
mendegradasi selulosa dan lignin
- biaya tinggi
Biologi Jamur Biaya rendah
Ramah lingkungan
Tidak dapat
mendegradasi lignin
Kombinasi Kimia dan Enzimatis
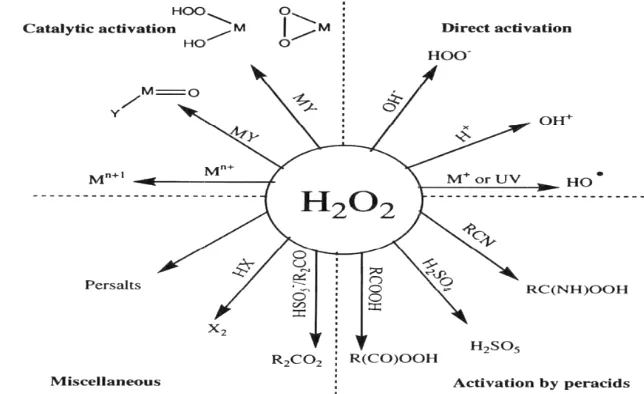
Perlakuan kimia bertujuan untuk menghasilkan radikal dengan elektron
tidak berpasangan yang mempunyai reaktifitas tinggi dan waktu paruh pendek.
Beberapa radikal cukup stabil dalam waktu yang lama. Kombinasi radikal dengan
molekul lain supaya tercapai stabilitas, menghasilkan penghilangan elektron.
Radikal seperti oksigen tunggal, superoksida, dan radikal hidroksil menyebabkan
kerusakan DNA, protein, dan lipid. Mereka juga dapat bereaksi dengan
11
digunakan untuk treatmen lignoselulosa ialah natrium hipoklorit dan hidrogen
peroksida yang dapat menghasilkan agen pengoksidasi (Chapman, 2003).
Natrium Hipoklorit
Natrium hipoklorit telah banyak digunakan untuk perlakuan air dan limbah
cair. Biasanya digunakan sebagai pencuci cairan atau cairan pencuci (Casson,
2003). Produksi natrium hipoklorit menggunakan klorin dengan causatic soda.
Reaksinya sebagai berikut:
2NaOH + Cl2 NaOC1 + NaC1 + H20 + panas
Kausatik soda (NaOH) digunakan sebagai penstabil (stabilizer). Kekuatan larutan
pencuci NaOH sering ditunjukkan sebagai “trade percent” atau “persen per
volum” terhadap ketersediaan kandungan klorin.
Secara komersial, natrium hipoklorit tersedia dalam konsentrasi 5-15%.
Padatan natrium klorida terbentuk jika kandungan konsentrasinya di atas 15%.
Stabilitas natrium hipoklorit sangat dipengaruhi oleh pH, panas, cahaya, dan
kation logam berat. Larutan hipoklorit paling stabil pada konsentrasi hipoklorida
10% pada pH 11, dengan logam Fe, Cu, atau Ni dengan konsentrasi 0,5 mg/L dan
harus disimpan di tempat gelap pada suhu 21oC. Jika pH kurang dari 11, biasanya
akan mengalami dekomposisi dengan cepat (Casson, 2003. White 1999). Pada
temperatur tinggi, hipoklorit dapat mendekomposisi membentuk ion klorida
(Gordon, 1997).
Reaksinya ditunjukkan sebagai berikut (Gordon, 1997):
NaOCl + H20 HOC1 + Na+(OH-)
HOC1 H+ + OCl-
OCl- + OCl- ClO2- + Cl- (lambat)
OCl- + ClO2- ClO3- + Cl- (cepat)
Di bawah pH 11, kecepatan rata-rata pembentukan ClO3- dari hipoklorida akan
meningkat, dan pada pH tersebut larutan OCl- menurun dengan berjalannya
waktu, dikarenakan oleh reaksi pembentukan asam (H+):
2HOC1 + OCl- ClO3- + 2H+ + 2Cl
-Penurunan kecepatan pembentukan ClO3- dipengaruhi oleh pH di atas 11 (Gordon,
b
aseptik dan
untuk treatm
kondisi bas
kekurangan
perhidroksil
asil yang ke
asam kuat, h
hidrogen sep
Hidrogen pe
(Fiorenza, 1
ogen perok
n dapat dic
eroksida bia
proses pack
men lignosel
an oksidatif
eroksida. Hi
an alkena. U
sidan turuna
eroksida ter
sa (Jones,
elektron
diubah men
ekurangan e
hidrogen per
Untuk dapat
an dari hidro
rdiri dari hi
1999). Anio
6. Aktifasi H
ogen Perok akan larutan
gan pelarut
an untuk ste
n, 1994). Hi
agai agen ok
i. Hidrogen
oksida dapat
digunakan,
ogen peroks
idrogen dan
on perhidro
efin dan a
an kuat den
u nitrit (Per
bah ke dalam
ah ini (Jones
H302
mi dekompos
Hidrogen Pero sida
n yang tidak
organik da
erilisasi dan
idrogen pero
ksidasi, hidr
peroksida da
mengoksida
, hidrogen p
sida dapat d
n ion perhid
oksil dapat
aldehida. K
gan cara me
rez-Benito,
m bentuk eku
s, 1999).
sisi oleh cah
oksida (Jone
k berwarna
an air (Jon
zat disinfek
oksida juga
rogen perok
apat dihasilk
asi olefin, h
peroksida m
dilihat pada
droksil (HO
haya, logam,
es, 1999)
dan tidak
nes, 1999).
ktan dalam
digunakan
ksida dapat
kan dengan
hidrokarbon
an senyawa
am kondisi
yaitu kation
13
Campuran Natrium hipoklorit dan Hidrogen Peroksida
Oksigen tunggal, superoksida, dan radikal hidroksil adalah produk penting
dalam reaksi antara natrium hipoklorit dan hidrogen peroksida. Mereka ikut serta
dan dapat bereaksi dengan molekul organik seperti karbohidrat, protein, lipid dan
asam nukleat serta mengubah struktur kimia dan sifatnya (Gierer, 1996). Suatu
kompleks stabil antara natrium hipoklorit dan H2O2 terbentuk jika direaksikan
dengan konsentrasi yang tepat.
Oksigen tunggal telah diteliti oleh Khan dan Kasha pada tahun 1963 ketika
pengukuran spektrum merah chemiluminescence dari reaksi hidrogen peroksida
dan natrium hipoklorit dalam larutan air (Khan, 1991.). Ion Hipoklorit (OCl-)
bereaksi dengan hidrogen peroksida dan menghasilkan oksigen tunggal. Reaksi
tersebut sebagai berikut:
H2O2 + OCl- 1O2 + H2O + Cl-
Superoksida dan radikal hidroksil merupakan intermedit penting antara
oksigen dan hidrogen peroksida. Superoksida dan radikal hidroksil dapat berperan
dalam degradasi oksidatif pada lignin dan karbohidrat (Gierer, 1996). Gambar 8
menunjukkan spesies oksigen dapat digenerasi dari reaksi natrium hipoklorit
dengan oksigen peroksida. Selektifitas superoksida yaitu dengan penambahan
radikal ke substrat yang meyebabkan pemutusan rantai karbon-karbon,
pembukaan cincin aromatik, dan pemutusan rantai samping alifatik. Disamping
itu, radikal hidroksil bereaksi sangat cepat dan menyerang molekul substrat secara
langsung menyebabkan pembukaan atau pemutusan struktur aromatik dan alifatik
(Gierer, 1996). Radikal hidroksil merupakan derivat utama dari asam hipoklor
Gambar 7. Skema turunan senyawa oksigen reaktif dari NaOCl dan H2O2
(Gordon, 1997. White, 1999).
(I) HClO terdekomposisi menjadi radikal hidroksil (OH-) dan radikal klorin (·Cl). (II) H2O2 terdekomposisi menjadi OH·+·OH.
(III) Turunan radikal superoksida (02
-) beraksi pada H2O2 dan OH
(IV) HClO mengekstrak ion hidrogen dari H2O2 dan kemudian radikal hidroperoksil (HOO-) dan O
2- diturunkan.
(V) Ekstrak OCl- terdiri dari oksigen tunggal (O2) dari H2O2
Degradasi Selulosa
Degradasi selulosa menjadi gula merupakan tahap penting pada produksi
bahan baku pakan dari ampas perasan kelapa sawit. Di alam (Garves, 1996),
Jamur basidiomicetes dapat melakukan depolimerisasi struktur selulosa kayu
tanpa membuang bagian ligninnya. Metode asam atau hidrolisis enzim biasanya
digunakan untuk hidrolisis selulosa pada proses industri. Hidrolisis asam lebih
cepat reaksinya dan lebih efektif daripada hidrolisis enzim. Bagaimanapun, asam
mendekomposisi selulosa dan menghasilkan produk degradasi. Sedangkan enzim
hidrolisis menghasilkan produk samping lebih sedikit (Martin, 2002. Camacho,
15
Hidrolisis Asam
Selulosa dapat didegradasi menjadi gula oleh asam. Molekul selulosa
mempunyai karakteristik ikatan β-1,4-glukosida antara unit monomer glukosa.
Ada tiga gugus hidroksil reaktif pada masing-masing unit monomer glukosa.
Asam dapat menyerang ikatan β-1,4-glukosida pada degradasi selulosa. Proses
reaksinya tiga tahap. Pertama, Kecepatan protonasi pada atom oksigen glukosida,
kedua, perpindahan muatan positif ke satu atom karbon menghasilkan kation
karbonium siklik pada ikatan glukosida, dan ketiga, penambahan molekul air pada
ion karbonium (Kraaig, 1993). Asam dapat mendegradasi selulosa menjadi gula,
namun rendemennya sedikit karena larutan asam bersifat tidak netral pada daerah
kristalis selulosa. Kekuatan asam dapat mengurangi daerah kristal dan
mendegradasi glukosa (Klass, 1998).
Hidrolisis Enzimatik
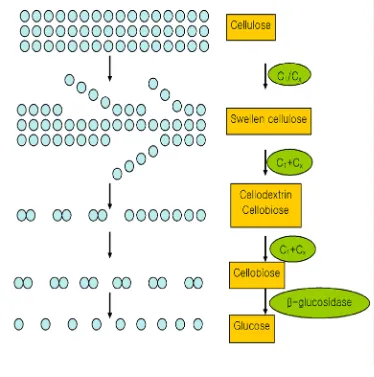
Enzim selulase biasa digunakan untuk menghasilkan gula dari selulosa,
dengan sedikit pembentukan produk samping. Enzim selulase dihasilkan oleh
sebagian besar bakteri dan jamur. Jamur genus trichorderma yang paling banyak
menghasilkan enzim selulale aktif. Mereka menghasilkan tiga selulase:
endo-glukanase, exo-endo-glukanase, dan β-glukosidase. Endo-glukanase menyerang
struktur internal selulosa. Pembukaan ikatan β-1,4-glukosidik pada struktur
selulosa pada posisi acak untuk menghasilkan fragmen rantai oligomerik.
Exo-glukanase menyerang lokasi spesifik pada non-reducing ends dalam struktur
selulosa. Produk utamanya ialah unit selubiosa atau glukosa. β-glukosidase
mengubah selubiosa menjadi glukosa (Krassig, 1993. Klass, 1998). Reaksi
tersebut ditunjukkan pada Gambar 8.
Trichoderma reesei menghasilkan 2 exo-glucanase, 5 endo-glucanase,
seperti xylanase, β-glucosidase, β-xylosidase dan galaktomannase yang dapat
Gambar 8. Diagram dari reaksi enzim selulase pada hidrolisis selulosa (Krassig,
BAHAN DAN METODE
Waktu dan Tempat PenelitianPenelitian ini dilaksanakan antara bulan Maret 2008-Februari 2009 di Laboratorium Uji Balai Besar Pengembangan Budidaya Air Tawar dan Laboratorium Terpadu IPB.
Alat dan Bahan
Alat yang digunakan yaitu mesin penepung, saringan 200 mess, satu set waterbath yang dilengkapi pengatur suhu, termometer, pH meter, pengaduk magnetik, neraca analitik, oven, soxlet, KCKT dan peralatan gelas Bahan yang digunakan yaitu ampas perasan kelapa sawit, H2SO4 1,25%, NaOH 3,5%, NaOCl 6%, H2O2 50%, aquades, heksana, metanol, asetonitril, dan jamur Trichoderma
viride
Diagram alir penelitian ditunjukkan pada Lampiran 1 sampai 6. Persiapan Ampas Perasan Kelapa Sawit
Ampas perasan kelapa sawit berasal dari perkebunan kelapa sawit di lampung. Sebelum digunakan Ampas perasan kelapa sawit dihaluskan menggunakan mesin penepung (discmill) dan dibebaskan lemaknya dengan cara mengaduk, mengenap tuangkan contoh dalam pelarut organik sebanyak tiga kali dan sampel dikeringkan. Ampas perasan kelapa sawit yang sudah bebas lemak kemudian dihilangkan proteinnya dengan cara melarutkan dengan H2SO4 1,25 %, dan NaOH 3,5% dan dikeringkan sampai bobot konstan. Ampas perasan kelapa sawit ini digunakan untuk seluruh Ampas perasan kelapa sawit penelitian.
Larutan NaOCl-H2O2 Induk
Larutan NaOCl-H2O2induk dibuat dari kombinasi NaOC1 6% dan H2O2 50% dengan perbandingan 10:1. Larutan NaOCl 6% - H2O2 50% dibuat segar sebelum eksperimen dilakukan.
Larutan NaOCl 0,12% - H2O2 1% untuk Perlakuan.
Perlakuan Ampas Perasan Kelapa Sawit dengan Larutan NaOCl 0,12% - H2O2 1% pada variasi pH dan H2SO4 72%.
2,5 gram ampas perasan kelapa sawit disuspensikan ke dalam 100 ml larutan NaOCl 0,12% - H2O2 1%. Larutan suspensi digoyang secara kontinyu selama 30 menit pada suhu ruang dan pH dijaga pada nilai (4, 6, 8, 10, dan 12) dengan penambahan larutan HCl atau NaOH menggunakan pH meter kemudian disaring dengan kertas saring, endapan dicuci dengan 100 ml air destilata, lalu dijenuhkan selama satu jam dalam 0,6% NaOH, pada suhu 25oC, disaring dan dicuci dengan 100 ml air destilata. Endapan kemudian ditimbang dan dilanjutkan ke tahap hidrolisis dengan cara ditambahkan H2SO4 (72%) dengan perbandingan 10 bagian H2SO4 (72%) : 1 bagian endapan dan diaduk pada suhu ruang selama 1 jam, kemudian tambahkan 50 ml air destilata dan diinkubasi pada suhu 120oC didalam oven selama 1 jam. Kemudian didinginkan pada suhu ruang kemudian ditera, lalu dipisahkan antara fraksi cairan dan padatan dengan kertas saring. Fraksi cairan ditentukan kandungan gula mengunakan KCKT.
Perlakuan Ampas Perasan Kelapa Sawit dengan Larutan NaOCl 0,12% - H2O2 1% pada variasi Suhu dan H2SO4 72%.
19
Perlakuan Ampas Perasan Kelapa Sawit dengan Larutan NaOCl 0,12% - H2O2 1% pada variasi waktu dan H2SO4 72%.
2,5 gram ampas perasan kelapa sawit diperlakukan dengan 100 ml larutan NaOCl 0,12% - H2O2 1% selama 0,5; 3; 24; dan 100 jam pada suhu 25oC. Seperti perlakuan sebelumnya, endapan dipisahkan, dicuci dengan 100ml air destilata. Endapan kemudian ditimbang dan dilanjutkan ke tahap hidrolisis dengan cara ditambahkan H2SO4 (72%) dengan perbandingan 10 bagian H2SO4 (72%) : 1 bagian endapan dan diaduk pada suhu ruang selama 1 jam, kemudian tambahkan 50 ml air destilata dan diinkubasi pada suhu 120oC didalam oven selama 1 jam. Kemudian didinginkan pada suhu ruang kemudian ditera, lalu dipisahkan antara fraksi cairan dan padatan dengan kertas saring. Fraksi cairan ditentukan kandungan gula mengunakan KCKT.
Perlakuan Kombinasi Ampas Perasan Kelapa Sawit dengan Larutan NaOCl 0,12% - H2O2 1% Enzim Selulase dan H2SO4 72%.
Kondisi ini dilakukan berdasarkan hasil analisa komposisi kandungan glukosa tertinggi dari masing-masing perlakuan pH, suhu, dan waktu. Sebanyak 2,5 gram ampas perasan kelapa sawit diperlakukan dengan larutan NaOCl 0,12% - H2O2 1%. Seperti sebelumnya, setelah perlakuan, endapan dipisahkan, dicuci, dengan 100 ml air destilata. Endapan kemudian dilanjutkan untuk pengujian dengan enzime selulase.
HASIL DAN PEMBAHASAN
Degradasi ampas perasan kelapa sawit diawali melalui proses perlakuan
mekanis berupa penepungan dan penyaringan yang bertujuan untuk memutuskan
bentuk kristal dari lignoselulosa ampas kelapa sawit dan untuk menghasilkan luas
permukaan yang banyak agar lignoselulosa tersebut dapat bereaksi dengan pelarut
yang digunakan.
Perlakuan deffating dengan pelarut organik seperti heksana dan
deproteinasi dengan mengggunakan asam sulfat 1,25% dan natrium hidroksida
3,5% bertujuan untuk menghilangkan lipid dan protein yang dapat mengganggu
proses hidrolisis selulosa pada ampas perasan kelapa sawit.
Tahap Pertama: Perlakuan ampas perasan kelapa sawit dengan larutan NaOCl 0,12% - H2O2 1% pada variasi pH, Suhu, Waktu dan hidrolisis
H2SO4 72%
Perlakuan ini dilakukan setelah ampas perasan kelapa sawit dilakukan
deffating dan deproteinasi. Dimana ampas perasan kelapa sawit dilarutkan terlebih
dahulu dengan NaOCl 0,12% dan H2O2 1% dengan variasi pH (4, 6, 8, 10, 12),
suhu (250C, 500C, 700C, 900C) dan waktu (0,5; 3; 24; 100 jam). Setelah itu
dilakukan hidrolisis dengan asam sulfat 72%.
Penggunaan NaOCl 0,12% dan H2O2 1% untuk menghilangkan kandungan
lignin yang terdapat di dalam lignoselulosa ampas perasan kelapa sawit, dimana
reaksitivitasnya sangat dipengaruhi oleh pH, suhu dan waktu perlakuan. Larutan
NaOCl 0,12% dan H2O2 1% merupakan zat pengoksidator yang dapat
menghasilkan radikal hidroksil, superoksida dan oksigen tunggal yang dapat
bereaksi dengan lignoselulosa serta dapat mengubah struktur kimia dan sifatnya
(Gierer, 1996).
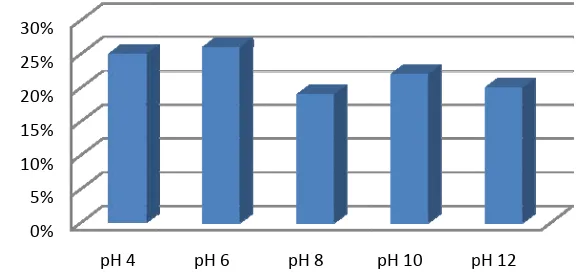
Dari hasil penelitian ini didapat bobot ampas perasan kelapa sawit yang
hilang selama perlakuan larutan NaOCl 0,12% dan H2O2 1% dengan variasi pH
(Gambar 9 dan lampiran 7), variasi suhu (Gambar 10 dan lampiran 7), variasi
waktu (gambar 11 dan Lampiran 7). Persen bobot yang hilang ini menggambarkan
G
t Ampas Per
2 1% dengan n variasi pH
as Perasan 1% dengan v
as Perasan 1% dengan v
pH 8
C 70 o
m 24 ja
a Sawit yang
kelapa Saw
g hilang pada
wit yang hi
wit yang hi u
pH 12
oC
jam
21
a perlakuan
ilang pada
Ampas perasan kelapa sawit yang telah diperlakukan dengan larutan NaOCl
0,12% - H2O2 1% kemudian dihidrolisis dengan asam sulfat 72% agar didapat
produk glukosa yang diinginkan. Hasil hidrolisis dianalisa dengan menggunakan
kromatografi cair kinerja tinggi (KCKT).
Hasil analisa KCKT berupa kromatogramnya ditampilkan pada Lampiran
12 sampai 25. Ampas perrasan kelapa sawit perlakuan pH, suhu dan waktu
memiliki pola kromatogram yang hampir sama, hal ini ditunjukkan dari
puncak-puncak yang dihasilkan memilki waktu retensi (tR) yang sama (Tabel 3).
Tabel 3. Waktu Retensi (tR) dari ampas perasan kelapa sawit perlakuan
NaOCl 0,12% dan H2O2 1% dengan variasi pH, Suhu, dan Waktu
No Perlakuan tR (menit)
Unknown 1 Glukosa Unknown 1 Fruktosa
1 pH 4 9,2 13,1 14,7
Puncak pertama terdeteksi pada waktu retensi sembilan menit dengan area
dari 2,4 107 sampai 3,5 107 (Tabel 4). Puncak pertama ini tidak dapat diketahui
dikarenakan tidak sesuai dengan standar monosakarida yang ada, kemungkin
puncak pertama ini masih berupa oligosakarida. Puncak kedua terdeteksi pada
waktu 13 menit yang terdeteksi sebagai puncak glukosa dengan area dari 3,7 104
sampai 2,1 104 dengan nilai konsentrasi glukosa dari 6,80% sampai 12,49%
ditampilkan pada Gambar 12. Puncak ketiga terdeteksi pada waktu retensi 14,7
menit dengan area dari 9,3 104 sampai 2,1 105. Puncak ketiga ini tidak dapat
diidentifikasi waktu retensinya tidak sama dengan standar monosakarida yang
p
Tabel 4. Lua H2O
suhu dan wa 0
ngan nilai ko
liki oleh pH
ng teridentif
merisasi dari g
as Peak dari
apa sawit pe
aktu
03 sampai 9
onsentrasi d
8, 10, 12,
fikasi pada a
glukosa pada
ampas peras n variasi pH
Unknown 1
n Glukosa h
erlakuan Na
9,2 103, yan
ari 0,54% sa
suhu 250C,
ampas kelap
a waktu hidr
san kelapa s H, Suhu, dan
waktu 3 jam
pa sawit ini
rolisis oleh a
awit perlaku
isis asam su
dan H2O2 1
fikasi sebaga
%. Puncak k
m dan 24 ja
dimungkink
asam sulfat 7
uan NaOCl 0
wn 1 Fruk
ai senyawa
keempat ini
am. Produk
kan karena
72%.
Dari hasil hidrolisis asam sulfat 72% pada ampas perasan kelapa sawit
didapat kandungan glukosa yang bervariasi. Hal ini menunjukkan bahwa selulosa
dapat didegradasi oleh asam sulfat 72%. Ion H+ dari asam sulfat dapat menyerang
ikatan β-1,4-glukosida antara unit monomer glukosa pada degradasi selulosa.
Proses reaksinya tiga tahap. Pertama, Kecepatan protonasi pada atom oksigen
glukosida, kedua, perpindahan muatan positif ke satu atom karbon menghasilkan
kation karbonium siklik pada ikatan glukosida, dan ketiga, penambahan molekul
air pada ion karbonium (Kraaig, 1993). Asam dapat mendegradasi selulosa
menjadi gula, namun rendemennya sedikit karena larutan asam bersifat tidak
netral pada daerah kristalis selulosa. Kekuatan asam dapat mengurangi daerah
kristal dan mendegradasi glukosa (Klass, 1998). Nilai glukosa tertinggi hanya
dimiliki oleh pH 6, suhu 700C dan waktu 100 jam sebesar 9,86%, 8,24% dan
12,49%.
Tahap Kedua: Perlakuan ampas perasan kelapa sawit dengan larutan NaOCl 0,12% - H2O2 1% pada pH 6, Suhu 700C , Waktu 100 jam dan
kombinasi hidrolisis enzim selulase dan H2SO4 72%
Perlakuan ini dilakukan berdasarkan hasil dari penelitian tahap pertama,
dimana kandungan glukosa tertinggi dimiliki oleh pH 6, suhu 70 dan waktu 100
jam dengan nilai konsentrasi berturut-turut sebesar 9,86%, 8,24% dan 12,49%.
Nilai kandungan glukosa yang didapat dari degradasi selulosa tersebut masih
dibawah kandungan selulosa yang dimiliki oleh ampas perasan kelapa sawit
sebesar 40-55%. Perlakuan tahap kedua ini menggabungkan hidrolisis enzimatis
seelulase yang kemudian akan dilanjutkan dengan hidrolisis asam sulfat 72%,
diharapkan dapat meningkatkan degradasi selulosa menjadi glukosa.
Perlakuan kedua dilakukan setelah ampas perasan kelapa sawit dilakukan
deffating dan deproteinasi. Dimana ampas perasan kelapa sawit dilarutkan terlebih
dahulu dengan NaOCl 0,12% dan H2O2 1% dengan variasi pH 6, suhu 700C dan
waktu 100 jam. setelah itu dilakukan hidrolisis dengan enzim selulase dan asam
2
dua kali lebi
Gambar 13.
kombinasi 0.0
ih tinggi dari
Kandungan
ombinasi dib
sentrasi glu
an oleh deg
n hidrolisis
matogram ya
itian tahap k
asi ini 3 kali
i perlakuan w
Glukosa pa
bandingkan d
ukosa yang
gradasi dua
s asam sulfa
ang terbentuk
am KCKT am T‐70
kedua ini di
lebih tinggi
waktu (Gam
da ampas pe
dengan varia
i dari perlaku
mbar 13).
erasan kelapa
asi pH, suhu
pada pen
g dilakukan
al tersebut ju
14).
an kelapa saw
0jam kom
entrasi gluko
uan pH dan
a sawit deng
u, waktu
nelitian tah
oleh hidrol
uga dapat d
wit dengan p binasi
25
osa sebesar
suhu, serta
gan
hap kedua
lisis enzim
dilihat dari
Puncak pertama yang terdeteksi pada waktu retensi sembilan menit lebih
bersifat ramping bila dibandingkan dengan kromatogram penelitian tahap pertama
(Lampiran 12 sampai dari Lampiran 24), hal ini menunjukkan telah terjadinya
dergradasi pada oligosakarida yang terdapat pada punyak pertama tersebut
menjadi glukosa atau monosakarida lainnya. Puncak kedua dan keempat yang
teridentifikasi sebagai glukosa dan fruktosa memiliki area yang lebih besar bila
SIMPULAN DAN SARAN
Simpulan
Larutan NaOCl 0,12% - H2O2 1% dan asam sulfat 72% dapat digunakan untuk degradasi ampas perasan kelapa sawit menjadi glukosa, fruktosa dan senyawa gula lainnya.
Perlakuan Larutan NaOCl 0,12% - H2O2 1% dengan variasi pH, suhu dan waktu pada pelakuan ampas perasan kelapa sawit menunjukkan adanya pengaruh terhadap kandungan glukosa yang dihasilkan.
Kandungan glukosa tertinggi penelitian tahap pertama didapat pada perlakuan larutan NaOCl 0,12% - H2O2 1% dengan pH 6, suhu 70oC, waktu 100 jam dan asam sulfat 72% dengan nilai berturut-turut 9,86%, 8,24% dan 12,49%. Konsentrasi glukosa pada perlakuan kombinasi (penelitian tahap kedua) didapat hasil sebesar 25,42% lebih tinggi dua kali dari perlakuan larutan NaOCl 0,12% - H2O2 1% variasi waktu dan tiga kali dari perlakuan larutan NaOCl 0,12% - H2O2 1% variasi pH dan suhu.
Saran
Bäckvall, J.E. 2004. Modem Oxidation method. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim. 2-47.
Baucher, M., Monties, B., Van Montagu, M., and Boerijan, W. 1998. Biosynthesis and genetic engineering of lignin. Crit. Rev. Plant. Sci. 17:125-197.
Bertran, M.S., and Dale, B. E. 1986. Determination of cellulose accessibility by differential scanning calorimetry. J. Appl. Polym. Sci. 32:4241-4253.
Bezerra, R.M., and Dias, A.A. 2004. Discrimination among eight modified Michaelis-Mehten kinetics models of cellulose hydrolysis with a large range of substrate/enzyme ratios. Apple. Biochem. Biotech. 112:173-184.
Camacho, F., González-Tello, P., Jurado, E., and Robles, A. 1996. Microcrystalline-cellulose hydrolysis with concentrated sulphuric acid. J. Chem. Tech. Biotechnol. 67:350
Campbell, M., and Sederoff, R. 1996. Variation in lignin content and composition.Mechanisms of control and implications for the genetic improvement of plants. Plant. Physiol.110:3-13. 59
Casson, L.,W. and Bess,J.W.2003.Conversion to on-site sodium hypochlorite genergation:water and wastewater application. Lewis Publichers, Boca Raton. FL.
Chapman, J.S.2003. Biocide resistance mechanisms. Biodeter. Biodegr. 5 1:133
Christophersen, A. G., Jun, H., Jorgensen, K., and Skibsted, L. H. 1991. Photobleaching of astaxanthin and canthaxanthin: quantum-yields dependence of solvent, temperature, and wavelength of irradiation in relation to packaging and storage of carotenoid pigmented salmonoids. Z Lebensm. Unters. Forsch., 192:433-439.
Côté, W. 1982. Biomass utilization. Serier A: Life Sciences Vol. 67. Plenum press. New York.
Feller, R. L., Lee, S. B., and Bogaard, J. 1986. The kinetic of cellulose deterioration. Advances in Chemistry, ACS series 2 12:329-347.
29
Fox, D., Gray, P., Dunn, N., and Marsden, W. 1987. Factors affecting the enzymic susceptibility of alkali and acid pretreated sugarcane bagasse. J. Chem. Tech. Biotechnol. 40: 60 117-132.
Garves, K. 1996. Temperature, salt, and acidity effects on the hydrolysis of cellulose dissolved in concentrated acids. Cell. Chem. Technol. 30:3-12.
Gierer, J. 1996. The interplay between oxygen-derived radical species in the delignification during oxygen and hydrogen peroxide bleaching (Chapeter 21). American chemical Society in New Orleans(2000). 422-446.
Gordon, G, Adam, C. L., Bubnis, B., Kuo, C., Cushing, R., and Sakaji, R. 1997. Predicting liquid bleach decomposition. J. Am. Water. Works. Ass. 89(4):142-149.
Grabber, H. J., Ralph, J., Lapierre, C., and Barrière, Y. 2004. Genetic and molecular basis of grass cell-wall degradability. I. Lignin-cell wall matrix interactions. C. R. Biologies. 327: 455-465.
Gratzl, J., and Chen, C. L. 2000. Chapter 20 : Chemistry of pulping: Lignin reactions. American Chemical Society. 392-421.
Hem, Saurin. 2005. Conversion of Agro-Industrial Waste and by Products for Aquaculture. IRD LaboGamet 911, av. Agropolis, BP 64501 34394 – Montpellier (France).
Hu, Q. T. 2002. Chemical modification, properties, and usage of lignin. Kiuwer academic/Plenum publishers, New York. 4 1-100.
Jones, C.W., and Clark, J.H. 1999. Applications of hydrogen peroxide and derivatives. Royal society of chemistry. Ch2:37-77.
Khan, A.U. 1991. The discovery of the chemical evolution of singlet oxygen. Some current chemical, photochemical, and biological applications. mt. J. Quantium. Chem. 39:25 1-267.
Klass,L.D. 1998. Biomass for renewable energy, fuels, and chemicals. Academic Press, San Diego, California.
Krassig, H.A. 1993. Cellulose: Structure, accessibility, and reactivity. Gordon and Breach Science Publishers S.A. 6-13, 187-205.
Pareek, S., Azuma, J., Shimizu, Y., and Matsui, S. 2000. Hydrolysis of newspaper polysaccharides under sulfate reducing and methane producing conditions. Biodegradation.11:229-237.
Paster, M. 2003. Industrial bioproduct: Today and tomorrow. U.S. Department of Energy, Office of Energy Efficiency and Renewable Energy, Office of the Biomass Program. Washington, D.C.
Perez-Benito, J. 2001. Cooper(II)-catalyzed decomposition of hydrogen peroxide: catalyst activation by halide ions. Monatshefte Fuir Chemie. 132:1477-1492.
Ramos, D.F.,and Fontana. J. 1996. Pretreatment of sugarcane bagasse for enhanced ruminal digestion. Appl. Biochem. Biotech. 57:171-182.
Saha, B. 2003. Hemicellulose bioconversion. J. Ind. Microbiol. Biotechnol. 30:279-291.
Shin, S., Calvisi, E., Beaman, T., Pankratz, S., Gerhardt, P., and Marquis, R.1994. Microscopic and thermal characterization of hydrogen peroxide killing and lysis of spores and protection by transition metal ions, chelators, and antioxidants. Appl. Environ. Microbiol.60: 3192-3197
Sjostrom, E. 1981. Wood chemistry: Fundamental and application. Academic Press, New York.
Sun, Y., Cheng, J. 2002. Hydrolysis of lignocellulosic materials for ethanol production: a review. Bioresource. Technol. 83:1-11.
Sudaryanto, B., M.Winugroho, A. Djajanegara dan A.R.A. Karto. 1999. Potensi dan Kualitas Biomassa Kebun Kelapa Sawit Untuk Pakan Ternak Ruminansia. Laporan Penelitian Integrasi Usaha Ternak Sapi dengan Perkebunan Kelapa Sawit. Balai Penelitian Ternak Ciawi ,Bogor.
Tsao, G, Ladisch, M., Ladisch, C., Hsu, T., Dale, B., and Chou, T. 1978, Chapter 1. Fermentation substrates from cellulosic materials: production of fermentable sugars from cellulosic materials: Annual reports on fermentation processes, vol 2. Academic Press, New York, NY.
White, C. 1999. Handbook of Chlorination and Alternatives Disinfectants (4th Ed.). John Wiley and Sons, Inc., New York, NY. Wright, J.D. 1998. Ethanol form biomass by enzymatic hydrolysis. Chem. Eng. Prog. 84(8):62-74.
Lampiran 1. Diagram Alir Penelitian Tahap Pertama
Ampas Perasan Kelapa Sawit
Dihaluskan dan disaring dengan ukuran 200 mess
- Defatting dengan pelarut heksana
- Deproteinasi dengan H2SO4 1,25% dan NaOH 3,5%
Delignifikasi : NaOCl 0,12% - H2O2
1% dengan Variasi pH 4; 6; 8; 10; 12
Degradasi Selulosa dan Hemiselulosa dengan H2SO4 72%
Analsisa Kandungan Gula dengan KCKT Delignifikasi : NaOCl
0,12% - H2O2 1%
variasi Suhu 25; 50; 70; 90 0C
Delignifikasi : NaOCl 0,12% - H2O2 1%
33
Lampiran 2. Diagram Alir Penelitian Tahap Kedua
Dihaluskan, disaring, Defatting, Deproteinasi
Didegradasi Selulosa dan Hemiselulosa Secara kombinasi Kimia dan Enzimatis
Analsisa Kandungan Gula dengan KCKT Delignifikasi : NaOCl 0,12% - H2O2 1% pada Kondisi pH, Suhu,
Lampiran 3. Perlakuan ampas perasan kelapa sawit dengan larutan NaOCl 0,12% - H2O2 1% pada variasi pH dan H2SO4 72%.
2,5 g ampas perasan kelapa sawit
- disuspensikan 100 ml NaOCl 0,12% - H2O2 1%
pH 4 pH 6 pH 8 pH 10 pH 12
+ HCl atau NaOH
- distirer selama 30 menit - disaring
- dicuci dengan 100 ml air
- dijenuhkan dengan NaOH 0,6%, 1 jam, 25oC - disaring
- dicuci dgn 100 ml air
Endapan
+ H2SO4 72% dengan perbandingan 1:10
- distirer selama 1 jam + 50 ml air
- inkubasi 120oC selama 1 jam - didinginkan, ditera
- disaring
ditimbang
Cairan
35
Lampiran 4. Perlakuan ampas perasan kelapa sawit dengan larutan NaOCl 0,12% - H2O2 1% pada variasi Suhu dan H2SO4 72%.
- disuspensikan 100 ml NaOCl 0,12% - H2O2 1%
25oC 50oC 70oC 90oC
- distirer selama 30 menit - disaring
- dicuci dengan 100 ml air
- dijenuhkan dengan NaOH 0,6%, 1 jam, 25oC - disaring
- dicuci dgn 100 ml air
Endapan
+ H2SO4 72% dengan perbandingan 1:10
- distirer selama 1 jam + 50 ml air
- inkubasi 120oC selama 1 jam - didinginkan, ditera
-disaring
ditimbang
Cairan
Lampiran 5. Perlakuan ampas perasan kelapa sawit dengan larutan NaOCl 0,12% - H2O2 1% pada variasi waktu dan H2SO4 72%.
- disuspensikan 100 ml NaOCl 0,12% - H2O2 1%
0,5 jam 3 jam 24 jam 100 jam
- distirer selama 30 menit - disaring
- dicuci dengan 100 ml air
- dijenuhkan dengan NaOH 0,6%, 1 jam, 25oC - disaring
- dicuci dgn 100 ml air
Endapan
+ H2SO4 72% dengan perbandingan 1:10
- distirer selama 1 jam + 50 ml air
- inkubasi 120oC selama 1 jam - didinginkan, ditera
-disaring
ditimbang
Cairan
37
Lampiran 6. Perlakuan kombinasi ampas perasan kelapa sawit dengan Larutan NaOCl 0,12% - H2O2 1% Enzim Selulase dan H2SO4 72%.
- disuspensikan 100 ml NaOCl 0,12% - H2O2 1%
- diatur pada pH, suhu, waktu yg menghasilkan glukosa tertinggi
- distirer selama 30 menit - disaring
- dicuci dengan 100 ml air
- dijenuhkan dengan NaOH 0,6%, 1 jam, 25oC - disaring
- dicuci dgn 100 ml air
Endapan
+ jamur trichoderma viride
- inkubasi 37oC selama 37 jam sambil dirotasi + H2SO4 72% dengan perbandingan 1:10 - distirer selama 1 jam
+ 50 ml air,inkubasi 120oC selama 1 jam - didinginkan, ditera, disaring
ditimbang
Cairan
Lampiran 7. Kadar ampas perasan kelapa sawit yang hilang selama perlakuan NaOCl-H2O2
% BKS setelah perlakuan % BKS yang hilang setelah perlakuan
pH
pH 4 75% 25%
pH 6 74% 26%
pH 8 81% 19%
pH 10 78% 22%
pH 12 80% 20%
SUHU
Suhu 25 oC 87% 9%
Suhu 50 oC 92% 8%
Suhu 70 oC 87% 13%
Suhu 90 oC 91% 13%
WAKTU
0,5 jam 88% 12%
3 jam 85% 15%
24 jam 89% 11%
100 jam 85% 15%
39
Lampiran 8. Luas peak dan waktu retensi (tR) dari standar gula.
No
Standar Gula
Kadar (g/100ml)
Luas Peak (Area) tR
(8,8 mnt)
tR (9,5 mnt)
tR (10,6 mnt)
tR (13,1 mnt)
tR (15,7 mnt) A Mystosa/
stachiosa 0,4 142045
B Rafinosa 0,4 85574
C Trachiosa/ sukrosa/
Maltosa 0,4 237271
D Glukosa 0,4 79862
Lampiran 9. Luas Peak dan Waktu Retensi (tR) dari ampas perasan kelapa sawit perlakuan pH, suhu, waktu dan kombinasi.
No Perlakuan tR (menit)
Unknown 1 Glukosa Unknown 1 Fruktosa
1 pH 4 9,2 13,1 14,7
Luas Peak (Area)
Unknown 1 Glukosa Unknown 1 Fruktosa
1 pH 4 35465288 51400 141144
2 pH 6 25499478 59436 185993
3 pH 8 35071024 47272 110129 3856
4 pH 10 34591784 51933 135429 9218
5 pH 12 30691026 49527 121450 7624
6 T-25C 30593484 40851 93247 6587
7 T-50C 35846884 47495 134630
8 T-70C 25529888 49388 121278
9 T-90C 33008140 48001 116346
10 t-0,5jam 24242648 37867 106084
11 t-3jam 28204754 51533 152079 5546
12 t-24jam 27832648 49129 137031 8826
13 t-100jam 32832048 75375 218619
41
Lampiran 10. Kandungan glukosa dan fruktosa pada ampas perasan kelapa sawit perlakuan NaOCl 0,12% - H2O2 1% pada variasi pH, suhu, waktu dan kombinasi
NO
Perlakuan
Glukosa Fruktosa
% (g/100g sampel) % (g/100g sampel)
1 pH 4 8,58 ‐
2 pH 6 9,86 ‐
3 pH 8 7,88 0,54
4 pH 10 8,66 1,29
5 pH 12 8,25 1,07
6 T‐25C 6,80 0,93
7 T‐50C 7,90 ‐
8 T‐70C 8,24 ‐
9 T‐90C 7,99 ‐
10 t‐0,5jam 6,31 ‐
11 t‐3jam 8,60 0,78
12 t‐24jam 8,14 1,24
13 t‐100jam 12,49 ‐
43
Lampiran 12. Kromatogram KCKTampas perasan kelapa sawit perlakuan NaOCl 0,12% - H2O2 1% pada pH 4 dan H2SO4 72%.
g l u k o s a U
n k n o w n 1
Lampiran 13. Kromatogram KCKTampas perasan kelapa sawit perlakuan NaOCl 0,12% - H2O2 1% pada pH 6 dan H2SO4 72%.
g l u k o s a U
n k n o
w Un
45
Lampiran 14. Kromatogram KCKTampas perasan kelapa sawit perlakuan NaOCl 0,12% - H2O2 1% pada pH 8 dan H2SO4 72%.
U n k n o w n 1
g l u k o s a
U n k n o w n 2
Lampiran 15. Kromatogram KCKTampas perasan kelapa sawit perlakuan NaOCl 0,12% - H2O2 1% pada pH 10 dan H2SO4 72%.
U n k n o
w gl
u k o s a
U n k n o w
47
Lampiran 16. Kromatogram KCKTampas perasan kelapa sawit perlakuan NaOCl 0,12% - H2O2 1% pada pH 12 dan H2SO4 72%.
U n k n o
w g
l u k o s a
U n k n o w
Lampiran 17. Kromatogram KCKTampas perasan kelapa sawit Perlakuan NaOCl 0,12% - H2O2 1% pada suhu 25 0C dan H2SO4 72%.
U n k n o
w g
l u k o s a
49
Lampiran 18. Kromatogram KCKTampas perasan kelapa sawit perlakuan NaOCl 0,12% - H2O2 1% pada suhu 50 0C dan H2SO4 72%.
U n k n o w n 1
g l u k o s a
Lampiran 19. Kromatogram KCKTampas perasan kelapa sawit perlakuan NaOCl 0,12% - H2O2 1% pada suhu 70 0C dan H2SO4 72%.
U n k n o w n 1
g l u k o s a
K n o w n 2
51
Lampiran 20. Kromatogram KCKTampas perasan kelapa sawit Perlakuan NaOCl 0,12% - H2O2 1% pada suhu 90 0C dan H2SO4 72%.
U n k n o w n 1
g l u k o s a
Lampiran 21. Kromatogram KCKTampas perasan kelapa sawit perlakuan NaOCl 0,12% - H2O2 1% pada waktu 0,5 jam dan H2SO4 72%.
U n k n o w n 1
g l u k o s a
53
Lampiran 22. Kromatogram KCKTampas perasan kelapa sawit perlakuan NaOCl 0,12% - H2O2 1% pada waktu 3 jam dan H2SO4 72%.
U n k n o w n 1
g l u k o s a
Lampiran 23. Kromatogram KCKTampas perasan kelapa sawit perlakuan NaOCl 0,12% - H2O2 1% pada waktu 24 jam dan H2SO4 72%.
U n k n o w n 1
g l u k o s a
U n k n o w n 2
55
Lampiran 24. Kromatogram KCKTampas perasan kelapa sawit perlakuan NaOCl 0,12% - H2O2 1% pada waktu 100 jam dan H2SO4 72%.
U n k n o w n 1
g l u k o s a
Lampiran 25. Kromatogram KCKT ampas perasan kelapa sawit perlakuan Kombinasi
U n k n o w n 1
g l u k o s a
U n k n o w n 2