IDENTIFIKASI KERAGAMAN GEN HORMON PERTUMBUHAN
DI DAERAH
EXON
PADA SAPI LOKAL INDONESIA
BERDASARKAN METODE PCR-SSCP
SURYA NUR RAHMATULLAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Identifikasi Keragaman Gen Hormon Pertumbuhan di Daerah Exon pada Sapi Lokal Indonesia Berdasarkan Metode PCR-SSCP adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Oktober 2011
ABSTRACT
SURYA NUR RAHMATULLAH. Identification of Growth Hormone Gene Variation in the Exon Region of Indonesian Local Cattle Based on PCR-SSCP Method. Under supervision of RONNY RACHMAN NOOR and JAKARIA.
The aim of this study was to identify the polymorphisms of the growth hormone gene (GH) of Indonesian local cattle breeds as well as two exotic breed as the out grouped using polymerase chain reaction and single strand conformation polymorphism (PCR-SSCP). 20 DNA samples of each Indonesian local cattle in consists of Bali, Pesisir, Madura and Katingan and 10 DNA samples of Simmental and Limousine cattle were used. The results show that the polymorphism of the GH gene was found in the three exon regions which are exon 1, 2 and 5 at Indonesian local cattle except for the Bali and Madura cattle that showed polymorphism only at exon 2. This two cattle showed monomorphism at their exon 3 and 4. On the other hand, the exotic breed showed the polymorphism in all exon regions, except for exon 2 in Simmental cattle which was found to be monomorphic. Bos javanicus was monomorphic in the fifth exon except at exon 2 that is polymorphic, while Bos taurus and Bos indicus were polymorphic in the fifth exon. The degree of heterozygosity in the Bos javanicus was a lower when compared to the value of Bos taurus and Bos indicus, so that it can be stated that the high diversity found in the Bos taurus and Bos indicus cattle.
RINGKASAN
SURYA NUR RAHMATULLAH. Identifikasi Keragaman Gen Hormon Pertumbuhan di Daerah Exon pada Sapi Lokal Indonesia Berdasarkan Metode PCR-SSCP. Dibimbing oleh RONNY RACHMAN NOOR dan JAKARIA.
Indonesia memiliki berbagai bangsa ternak sapi potong yang merupakan ternak lokal yang informasi genetiknya masih terbatas seperti sapi Bali, Aceh, Madura, Pesisir dan sapi Katingan. Sapi potong tersebut memiliki potensi yang sangat besar karena merupakan sumber daya genetik ternak lokal yang tidak ternilai harganya. Keunggulan yang dimiliki sapi lokal Indonesia adalah kemampuan adaptasi lingkungan ekstrim, ketersediaan pakan yang berkualitas rendah dan fertilitasnya yang sangat baik, serta mampu bertahan pada kondisi iklim tropis. Keunggulan pada sapi lokal Indonesia inilah yang menjadi salah satu alasan dasar atas kajian molekuler terhadap gen hormon pertumbuhan (GH) yang diduga sebagai salah satu gen utama (major gene) yang berperan penting dalam proses pertumbuhan. Polimorfisme dari gen GH yang terdapat sapi lokal seperti sapi Bali, Madura, Pesisir, dan sapi Katingan (Kalimantan Tengah) belum banyak informasinya. Hal ini terkendala dari segi penelitian maupun teknik dalam pendeteksian keragaman gen tersebut. Teknik yang juga bisa digunakan untuk mendeteksi keragaman gen pada suatu ternak adalah dengan teknik PCR-SSCP (Polymerase Chain Reaction-Single Strand Conformation Polymorphism). Teknik ini relatif masih baru dalam penentuan polimorfisme suatu gen, dan tidak banyak dilakukan, khususnya dalam penentuan gen GH terlebih pada ternak sapi lokal Indonesia. Tujuan dari penelitian ini adalah untuk mengetahui keragaman gen hormon pertumbuhan di daerah exon dengan menggunakan teknik PCR-SSCP pada populasi sapi lokal Indonesia.
Sampel darah sapi yang digunakan adalah sapi lokal Indonesia yaitu sapi Bali, Madura, Pesisir dan Katingan, sebanyak 80 sampel dengan masing-masing bangsa sapi sebanyak 20 sampel, sedangkan sampel sapi yang digunakan sebagai pembanding adalah sapi yang berasal dari bangsa Bos taurus seperti Limousin dan Simmental dengan masing-masing bangsa sebanyak 10 sampel, yang sudah dikoleksi dan disimpan di Laboratorium Genetika dan Molekuler Ternak Bagian Pemuliaan dan Genetika Ternak, Fakultas Peternakan IPB. Isolasi DNA total menggunakan metode Sambrook et al. (1989) yang dimodifikasi. Isolasi DNA total, teknik PCR dan SSCP dilakukan di Laboratorium Genetika Molekuler Ternak Bagian Pemuliaan Ternak Fakultas Peternakan IPB. Penelitian berlangsung sejak Oktober 2010 s/d Juni 2011. Primer yang digunakan untuk mengamplifikasi fragmen gen GH daerah exon 1, 2, 3, 4 dan 5 didasarkan pada Lagziel et al. (1996) dan Kioka et al. (1989) yang dimodifikasi. Panjang produk hasil amplifikasi fragmen gen GH pada masing–masing exon adalah exon 1: 315 pb, exon 2 : 283 pb , exon 3 : 158 pb, exon 4 : 198 pb dan exon 5 : 392 pb. Deteksi polimorfisme gen GH dilakukan melalui teknik PCR-SSCP. Keragaman gen GH ditentukan dengan analisis frekuensi alel, nilai heterozigositas pengamatan (Ho) dan nilai heterozigositas harapan (He). Keseimbangan genotipe gen GH dalam populasi diuji dengan uji χ2 (chi-square).
sapi lokal Indonesia yang merupakan alel-alel yang memiliki nilai frekuensi yang jauh tinggi dibandingkan frekuensi alel pada sapi impor. Sapi impor bersifat polimorfik untuk semua exon (exon 1,2,3,4,5). Bangsa sapi yang termasuk dalam bangsa Bos javanicus bersifat monomorfik pada kelima exon kecuali pada exon 2 bersifat polimorfik, bangsa sapi yang termasuk dalam bangsa Bos taurus dan Bos indicus bersifat polimorfik di kelima exon. Derajat heterozigositas pada bangsa sapi yang termasuk dalam bangsa Bos javanicus memiliki nilai heterozigositas yang rendah dibandingkan nilai heterozigositas bangsa sapi yang termasuk dalam bangsa sapi Bos taurus dan Bos indicus, sehingga dapat dinyatakan bahwa keragaman yang tinggi terdapat pada bangsa sapi yang termasuk dalam bangsa Bos taurus dan Bos indicus.
©Hak Cipta Milik IPB, Tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
IDENTIFIKASI KERAGAMAN GEN HORMON PERTUMBUHAN
DI DAERAH
EXON
PADA SAPI LOKAL INDONESIA
BERDASARKAN METODE PCR-SSCP
SURYA NUR RAHMATULLAH
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Mayor Ilmu Produksi dan Teknologi Peternakan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
HALAMAN PENGESAHAN
Judul Tesis : Identifikasi Keragaman Gen Hormon Pertumbuhan di Daerah Exon pada Sapi Lokal Indonesia Berdasarkan Metode PCR-SSCP
Nama : Surya Nur Rahmatullah
NIM : D151090061
Program Studi/Mayor : Ilmu Produksi dan Teknologi Peternakan
Disetujui Komisi Pembimbing
Prof. Dr. Ir. Ronny Rachman Noor, M.Rur.Sc Ketua
Dr. Jakaria, S.Pt, M.Si Anggota
Diketahui Koordinator Mayor
Ilmu Produksi dan Teknologi Peternakan
Dr. Ir. Rarah R.A. Maheswari, DEA
Tanggal Ujian: 20 September 2011
Dekan Sekolah Pascasarjana IPB
Dr. Ir. Dahrul Syah, M.Sc.Agr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT karena dengan limpahan rahmat dan karunia-Nya lah penulis dapat menyelesaikan studi magister ini dengan baik. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Oktober 2010 ini ialah identifikasi tentang genetika molekuler pada ternak
dengan judulμ “Identifikasi Keragaman Gen Hormon Pertumbuhan di Daerah
Exon pada Sapi Lokal Indonesia Berdasarkan Metode PCR-SSCP”.
UCAPAN TERIMA KASIH
Pada kesempatan ini, penulis mengucapkan banyak terima kasih kepada Prof. Dr. Ir. Ronny Rachman Noor, M.Rur.Sc. dan Dr. Jakaria, S.Pt, M.Si. atas bimbingan, arahan, dan dorongan sehingga karya ilmiah ini dapat diselesaikan. Semoga Allah SWT memberikan balasan yang terbaik atas segala amal ibadah, pengorbanan, curahan waktu, pikiran dan tenaga, serta ilmu yang diberikan kepada penulis. Ucapan terima kasih dan penghargaan yang tinggi penulis sampaikan kepada Prof. Dr. Ir. Muladno, MSA. sebagai penguji pada ujian sidang tesis atas kesediaannya meluangkan waktu menjadi penguji luar komisi. Beberapa pertanyaan, saran, dan komentar yang telah diberikan sangat bermanfaat dan memiliki arti penting bagi penulis untuk kesempurnaan tesis ini.
Kepada Ketua dan staf dosen Program Studi Peternakan, Fakultas Peternakan, Universitas Lambung Mangkurat Kalimantan Selatan, penulis mengucapkan banyak terima kasih atas izin dan kesempatan yang diberikan untuk menempuh pendidikan program Magister di Sekolah Pascasarjana IPB. Kepada Gubernur Provinsi Daerah Kalimantan Selatan, Bupati Kepala Daerah Tingkat II Banjar, Kalimantan Selatan, serta PD. Baramarta terima kasih penulis sampaikan atas bantuan dana penelitian yang telah diberikan. Terima kasih juga penulis sampaikan kepada Dr. drh. Bambang Ngaji Utomo, M.Sc. atas izin penggunaan data dan sampel darah sapi Katingan, Kalimantan Tengah. Ucapan terima kasih penulis sampaikan kepada Prof. Dr. Ir. Cece Sumantri, M.Agr.Sc sebagai Ketua Departemen Ilmu Produksi dan Teknologi Peternakan, Dr. Ir. Rarah R.A Maheswari, DEA sebagai Ketua Program Mayor Ilmu Produksi dan Teknologi Peternakan , staf pengajar, dan staf penunjang Sekolah Pascasarjana IPB.
Ucapan terima kasih yang tulus penulis sampaikan kepada Andi Baso LI,MP, M Ihsan AD, M.Si, Irine, S.Pt, Ferdy, S,Pt, Revy, S.Pt, dan semua kawan atau sahabat seperjuangan di Laboratorium Genetika Molekuler Bagian Pemuliaan dan Genetika Ternak Fakultas Peternakan IPB . Ucapan terima kasih juga penulis sampaikan kepada Eryk Andreas, S.Pt, M.Si yang telah banyak membantu selama kegiatan penelitian berlangsung. Ucapan terima kasih juga penulis sampaikan kepada teman-teman ITP’0κ, ’10 dan ’11, khususnya pada kawan
Yoshi, Adi R, Jaya PJ, Petlane “David” M, terima kasih atas do’a restu, semangat, dan motivasi yang diberikan.
Kepada orang tua, Ibunda Mahdanur Masy, S.Pd dan Ayahanda Suriani Dasri serta Kakak Yayan dan Istri serta Ayra, dan Adinda Didi yang selalu memberikan dorongan, semangat dan do’a restu yang tidak ada hentinya. Keberhasilan ini sebenarnya adalah buah keberhasilan dan kerja keras ibunda dan ayahanda peroleh, semoga ilmu dan keberhasilan yang didapatkan ini dapat penulis manfaatkan bagi kepentingan masyarakat . Kepada teman-teman serta sahabat yang ada di Kalimantan Selatan terima kasih banyak atas segala pengorbanan, kasih sayang, dan pengertian yang diberikan. Akhirnya penulis mengucapkan banyak terima kasih kepada semua pihak yang tidak dapat disebutkan namanya satu per satu yang telah memberikan bantuan, dorongan, dan semangat untuk menyelesaikan studi ini. Semoga ALLAH SWT membalas segala amal ibadah dan kebaikan yang diberikan dengan pahala atau balasan yang setimpal.
Bogor, Oktober 2011
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 01 Agustus 1985 di Barabai. Penulis adalah anak kedua dari tiga bersaudara dari pasangan Suriani Dasri, BA dan Mahdanur Masy, S.Pd.
Pendidikan dasar diselesaikan pada tahun 1997 di SDN Negeri Jawa 4, Martapura. Pendidikan lanjutan tingkat pertama diselesaikan pada tahun 2000 di SLTP N 1 Martapura. Pendidikan lanjutan menengah tingkat atas diselesaikan pada tahun 2003 di SLTA Negeri 1 Martapura. Tahun 2003 penulis lulus seleksi masuk Universitas Lambung Mangkurat melalui jalur Seleksi Masuk Perguruan Tinggi Negeri Universitas Lambung Mangkurat (SMPTN). Penulis memilih Program Studi Produksi Ternak, Fakultas Pertanian Universitas Lambung Mangkurat dan lulus pada tahun 2008, pada tahun 2009 penulis melanjutkan studi magister di Sekolah Pascasarjana IPB dengan Program Studi/Mayor Ilmu Produksi dan Teknologi Peternakan.
xxi
Elektroforesis dan Visualisasi DNA ……….. 26
Pendeteksian Varian Gen GH dengan Metode PCR-SSCP ………... 27
Analisis Data ……….. 28
Frekuensi Alel ……….... 28
Frekuensi Hereozigositas Pengamatan ……….. 28
Frekuensi Heterozigositas Harapan ………... 29
Ragam Heterozigositas Harapan ………... 29
xxii
HASIL DAN PEMBAHASAN ………... 31
Amplifikasi Gen Hormon Pertumbuhan ………... 31 Keragaman Gen Hormon Pertumbuhan ………. 32
Keragaman Gen Hormon Pertumbuhan dalam Populasi Sapi
Lokal Indonesia ……….. 32
Keragaman Gen Hormon Pertumbuhan antar Bangsa Sapi ……… 40
Keseimbangan Gen dalam Populasi ……….. 46
Keseimbangan Hardy-Weinberg dalam Populasi Sapi Lokal
Indonesia ……… 46
Keseimbangan Hardy-Weinberg antar Bangsa Sapi di Indonesia... 48 Derajat Heterozigositas …………...………... 50 Derajat Heterozigositas Populasi Sapi Lokal Indonesia …………. 50 Derajat Heterozigositas Bangsa Sapi di Indonesia ………. 52
KESIMPULAN DAN SARAN ………… ……….. 55
Kesimpulan ………….. …………...………... 55
Saran ……….……….. 55
DAFTAR PUSTAKA ……….. 57
xxiii
DAFTAR TABEL
Halaman 1. Sampel, jumlah dan asal sapi yang digunakan dalam penelitian ……... 23 2. Posisi, panjang fragmen dan sekuens primer yang digunakan untuk
mengamplifikasi gen GH ………... 25 3. Frekuensi alel gen GH pada kelima exon pada masing-masing bangsa
sapi………. 39
4. Frekuensi genotipe di kelima exon gen GH………. 39 5. Frekuensi alel gen GH pada semua bangsa sapi……… 41 6. Frekuensi genotipe di kelima exon gen GH pada semua bangsa sapi…... 42 7. Keragaman gen GH pada beberapa bangsa sapi yang telah dilakukan
penelitiannya ………. 44
8. Uji Khi-kuadrat (χ2) terhadap genotipe fragmen gen GH di kelima
exon……… 47
9. Uji Khi-kuadrat (χ2) terhadap genotipe fragmen gen GH di kelima exon pada semua bangsa sapi di Indonesia ………... 49 10. Nilai heterozigositas pengamatan (Ho) dan heterozigositas harapan (He)
fragmen gen GH di kelima exon seluruh populasi sampel …………...… 51 11. Nilai heterozigositas pengamatan (Ho) dan heterozigositas harapan (He)
fragmen gen GH di kelima exon seluruh populasi bangsa sapi di
Indonesia ………...… 51
xxv
DAFTAR GAMBAR
Halaman 1. Penyebaran dan tipe-tipe sapi domestikasi yang terdapat di Asia, Afrika
dan Eropa (MacHugh 1λλ6) ………..……... 6
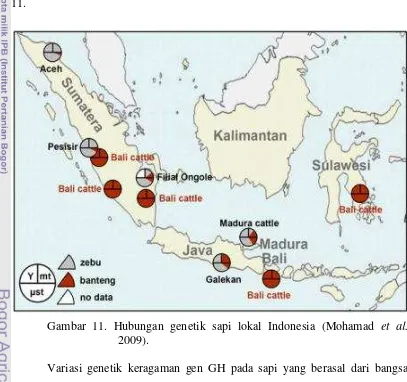
2. Lokasi dan hubungan genetik dari populasi sapi Indonesia (Mohamad et
al. 200λ) ………...………. 7
3. Mekanisme kerja hormon pertumbuhan dalam pengaturan pertumbuhan
otot dan tulang (Roith et al. 2001) ……… 14 4. Diagram pengaturan sekresi hormon pertumbuhan dan kerjanya pada
ternak domestik (Lawrence & Fowler 2002) ………...……. 16
5. Rekonstruksi struktur gen GH berdasarkan sekuens gen GH
di GenBank (Gordon et al. 1λκ3) ………. 17 6. Sekuens gen hormon pertumbuhan (bGH) pada sapi Bos taurus yang
diakses di GenBank (Gordon et al. 1λκ3) ……….….... 19 7. Posisi penempelan primer (cetak tebal) pada sekuens gen GH (nomor
akses M57764) ……….. 26
8. Elektroforesis produk PCR gen GH pada gel acrilamyde 6% …………. 31 9. Macam genotipe yang ditemukan di gen GH pada sapi lokal
Indonesia ………... 33
10. Sapi PO dan sapi Katingan (Utomo 2011)…….………... 40 11. Hubungan genetik lokal sapi Indonesia (Mohamad et al. 200λ) ……….. 43 12. Kemungkinan rute domestikasi sapi di Asia
xxvii
DAFTAR LAMPIRAN
Halaman
1. Informasi sekuen gen GH pada ternak sapi (Bovine) …...…………... 65 2. Modifikasi isolasi DNA menggunakan metode
Sambrook et al. (1989) ……….. 67 3. Jumlah alel dan genotipe serta frekuensi genotipe gen GH di kelima
1
PENDAHULUAN
Latar Belakang
Indonesia memiliki keistimewaan dengan adanya tipe ternak sapi yang berbeda dari tipe Zebu maupun Taurine, tetapi ternak sapi tersebut termasuk spesies liar, yaitu termasuk ke dalam Bos banteng dan bangsa sapi silangan. Spesies banteng yang sudah didomestikasi ini di Indonesia dikenal sebagai sapi Bali yang termasuk dalam spesies Bos javanicus atau Bos sondaicus (Talib et al. 2002). Sapi Bali, dengan kehadirannya sekarang merupakan salah satu aset peternakan di dunia yang banyak diteliti dalam upaya mengembangkannya. Selain itu, juga terdapat beberapa ternak lokal lainnya yang belum dieksplorasi melalui penelitian–penelitian walaupun tidak sepopuler sapi Bali, seperti sapi Madura, sapi Pesisir, bahkan yang terbaru adalah sapi Katingan yang terdapat di Kalimantan Tengah. Sapi lokal Indonesia tersebut merupakan salah satu sumber daya genetik ternal lokal yang memiliki keunikan serta keistimewaan seperti memiliki penampilan (fenotipe) dengan bentuk dan ukuran tubuh yang kecil dibandingkan dengan bangsa sapi lainnya, seperti bangsa sapi Indicus dan Taurine. Oleh karena itu, sapi lokal Indonesia merupakan salah bangsa sapi terkecil di dunia setelah sapi dwarf West Afrika shorthorn dari wilayah pantai Afrika Barat dan termasuk ke dalam kelompok sapi kecil (mini cattle) (Sarbaini 2004).
2
memanfaatkan pakan yang berkualitas rendah dan fertilitasnya yang sangat baik, serta mampu bertahan pada kondisi iklim tropis (Jakaria 2008).
Pemanfaatan penerapan teknologi molekuler dapat digunakan untuk membantu mengidentifikasi keragaman genetik ternak asli Indonesia dengan menggunakan beberapa penanda molekuler. Penanda molekuler ini dapat digunakan untuk mengetahui keragaman genetik suatu ternak juga dapat digunakan untuk mengetahui asal usul ternak. Penanda molekuler atau marker genetik, merupakan penanda yang dapat dideteksi baik secara langsung maupun tidak langsung berdasarkan genotipe suatu individu ternak. Hasil dari suatu penanda molekuler ini dapat dilacak untuk mengetahui keberadaan lokasinya di kromosom.
Beberapa penciri genetik yang dianggap berpotensi digunakan sebagai gen yang pengendali sifat pertumbuhan dan kualitas karkas adalah hormon pertumbuhan (GH) yang merupakan salah satu gen kandidat (Unanian et al. 2000) yang dicari untuk menduga penampilan produksi karena diduga berhubungan dengan lokus-lokus penyandi (Dybus et al. 2002). Selain itu, gen GH dipertimbangkan sebagai gen kandidat penciri produksi susu karena fungsinya yang mengatur metabolisme galactopoietic dan proses pertumbuhan (Høj et al. 1993). Gen GH juga berperan dalam perkembangan sel di kelenjar mammae, lactogenesis serta proliferasi sel mammae (Horvat & Medrano 1995; Lagziel et al. 1999).
Hormon pertumbuhan pada sapi (bovine) merupakan single protein yang memiliki berat molekul sebesar 22-kDa, yang terdiri atas 190 – 191 asam amino (Wallis 1973). Sekuen gen hormon pertumbuhan (GH) pada sapi Bos taurus memiliki panjang 2856 pasang basa (pb) dengan daerah coding 1826 bp yang terdiri atas lima exon dan empat intron (Woychick et al. 1982; Gordon et al. 1983) terletak di kromosom 19 (Hediger et al. 1990).
3
exon 5, intron 3 parsial dan exon 4 parsial, intron 4 parsial dan exon 5 parsial, serta pada fragmen 223 pb (lokus 1) dan fragmen 329 pb (lokus 2).
Terbatasnya informasi tentang keragaman fragmen gen growth hormone (GH) pada sapi lokal Indonesia yang belum banyak dieksploitasi terutama di daerah exon 1, 2, 3, 4 dan 5. Hal ini penting untuk diketahui sebagai upaya melengkapi kerangka kerja genetika molekuler yang terdapat dalam program pemuliaan ternak lokal, sehingga informasi tersebut dapat digunakan di masa mendatang pada tingkatan nasional maupun internasional.
Mengingat pentingnya kajian molekuler dan masih terbatasnya informasi karakteristik genetik sapi potong Indonesia khususnya kajian DNA pada tingkat gen (coding sequence) maka perlu dilakukan eksplorasi terhadap gen-gen lain yang sangat potensial. Salah satu gen yang sangat potensial adalah gen GH yang merupakan gen yang dapat mengontrol ekspresi gen lain yaitu gen prolaktin, gen tirotropin dan gen Pit-1. Gen GH juga dianggap sebagai kandidat untuk penciri genetik (genetic marker) sifat pertumbuhan dan kualitas karkas (Curi et al. 2010). Teknik yang banyak digunakan untuk mendeteksi keragaman gen GH berbasis teknik genetika molekuler seperti PCR (polymerase chain reaction) antara lain PCR RFLP (Restriction Fragment Length Polymorphism), PCR-RAPD (Random Amplified Polymorphic DNA), Degradative Gradien Gel Electrophoresis (DGGE), Mikrosatelit dan PCR-SSCP (Single Strand Conformation Polymorphism). PCR-SSCP untuk mendeteksi adanya keragaman di gen GH pada sapi lokal seperti sapi Bali, Pesisir, Madura dan Katingan, belum pernah dilakukan. Hal inilah yang mendorong dilakukannya penelitian untuk mengetahui keragaman gen GH pada sapi lokal tersebut.
Tujuan Penelitian
4
Manfaat
5
TINJAUAN PUSTAKA
Asal Usul dan Penyebaran Sapi Lokal Indonesia
Keanakeragaman ternak yang terdapat di Indonesia khususnya pada ternak sapi berasal dari sumber daya genetik ternak asli dan ternak impor. Impor ternak sapi Ongole dan Zebu (Bos indicus) yang dimulai pada awal abad ke-20 memegang peranan penting dalam upaya pengembangan peternakan sapi di Indonesia. Ongole murni pertama kali dibawa ke Pulau Sumba yang kemudian dikenal dengan sebutan Sumba Ongole (SO) dan selanjutnya dibawa ke wilayah lain di Indonesia untuk disebarkan. Penyebaran tersebut dimaksudkan untuk dapat disilangkan dengan sapi asli Jawa dan akhirnya membentuk suatu bangsa sapi peranakan Ongole dan sapi Madura (Utoyo 2002). Proses perkembangan sapi di Indonesia telah menghasilkan sumber daya genetik ternak yang lebih beragam, yaitu mulai dari sapi asli seperti sapi Bali, juga sapi hasil silangan yang telah menjadi sapi lokal seperti sapi Pesisir, sapi Aceh, sapi Madura, sapi Sumba Ongole (SO) dan sapi Peranakan Ongole (PO) (Utoyo 2002; Martojo 2003).
Sapi Bali (Bibos sondaicus) yang ada saat ini diduga berasal dari hasil domestikasi banteng liar (Bibos banteng). Menurut Rollinson (1984) proses domestikasi sapi Bali itu terjadi sebelum 3.500 SM di Indonesia atau Indochina. Banteng liar saat ini bisa ditemukan di Jawa bagian Barat dan bagian Timur, di Pulau Kalimantan, serta ditemukan juga di Malaysia (Payne & Rollinson 1973). Hardjosubroto dan Astuti (1993) mengemukakan bahwa di Indonesia saat ini, banteng liar hanya terdapat di hutan lindung Baluran, Jawa Timur dan Ujung Kulon, Jawa Barat, serta di beberapa kebun binatang. Pada keadaan liar, habitat asli banteng di Indonesia, adalah di Jawa Timur (Baluran) dan di Jawa Barat (Ujung Kulon), selain itu banteng juga ditemukan di perbatasan hutan Kalimantan Timur, Laos, Vietnam dan di Semenanjung Coubourgh di Australia Utara (Scherf 1995).
6
tahun 1947 sapi Bali disebarkan ke propinsi ini secara besar besaran. Sapi-sapi inilah bersama dengan pendahulunya menjadi cikal bakal sapi Bali di Sulawesi Selatan yang telah berkembang menjadi propinsi dengan jumlah sapi Bali terbanyak di Indonesia. Pada tahun 1964 di Bali terjadi musibah penyakit jembrana secara besar-besaran yang menyebabkan sapi Bali tidak boleh dikeluarkan lagi dari pulau Bali sebagai ternak bibit. Mulai periode inilah sumber bibit sapi Bali bagi daerah lain di Indonesia digantikan oleh NTT, Sulawesi Selatan dan NTB (Talib 2002).
Gambar 1. Penyebaran dan tipe–tipe sapi domestikasi yang terdapat di Asia, Afrika dan Eropa (MacHugh 1996).
Gambar 1 terlihat dengan jelas bahwa penyebaran sapi yang secara tertutup (warna hijau), hal ini terkait dengan spesies Bos (Bibos) seperti banteng, gaur dan kouprey (MacHugh 1996). Hasil domestikasi spesies liar Bos (Bibos) banteng adalah sapi Bali (Bos sondaicus) atau Bos javanicus (Talib et al. 2002).
8
dipertimbangkan untuk dijadikan kriteria seleksi, mengingat produksi susu sapi Bali yang baik hanya dalam 4 bulan pertama (Talib et al. 1999). Korelasi genetik bobot umur 120 hari dengan sifat-sifat ekonomis seperti bobot potong dan pertambahan bobot badan pada bangsa sapi Bali cukup tinggi (Talib 2002).
Cara lain untuk meningkatkan produktivitas sapi adalah dengan memanfaatkan banteng yang memiliki bobot dewasa yang besar (pejantan sapi
Bali dengan bobot sekitar 600−κ00 kg terdapat di luar pulau Bali) ataupun sapi Mithan yang memang masih satu tetua dengan sapi Bali (Scherf 1995; Talib et al. 1997). Sapi Bali umur sekitar 2 tahun dengan bobot 400 kg atau umur 4 tahun dengan bobot badan sekitar 600–800 kg dapat ditemukan di Bali. Kasus penyakit-penyakit yang menjadi khas sapi Bali seperti Jembrana, mengakibatkan potensi yang baik ini belum dapat digunakan dengan semestinya di luar Pulau Bali. Pada umumnya di Sulawesi Selatan pemeliharaan sapi Bali dengan digembalakan, sehingga penampilan produksi lebih rendah. Hal yang sama juga ditunjukkan oleh batas bawah dari performan sapi Bali di NTT, tetapi pada pemeliharaan intensif terlihat bahwa sapi Bali baik di Bali ataupun di NTT menunjukkan performan yang sama baiknya (Talib 2002).
Sapi Bali merupakan salah satu penyumbang daging terbesar dari kelompok ruminansia khususnya dari ternak sapi, terhadap produksi daging nasional sehingga usaha ternak ini berpotensi untuk dikembangkan sebagai usaha yang menguntungkan. Sapi Bali telah lama dipelihara oleh sebagian masyarakat di Indonesia, seperti di wilayah Bali, Nusa Tenggara Barat, Sulawesi Selatan, Kalimantan Selatan, dan beberapa wilayah di pulau Jawa, sebagai tabungan dan tenaga kerja untuk mengolah tanah dengan manajemen pemeliharaan secara tradisional. Pola usaha ternak sapi Bali sebagian besar berupa usaha rakyat untuk menghasilkan bibit atau penggemukan, dan pemeliharaan secara terintegrasi dengan tanaman pangan maupun tanaman perkebunan. Pengembangan usaha ternak sapi potong berorientasi agribisnis dengan pola kemitraan merupakan salah satu alternatif untuk meningkatkan keuntungan peternak (Suryana 2009).
9
Ujung Pandang berukuran kecil tetapi mempunyai body condition score yang baik, artinya sapi-sapi tersebut tidak kurus. Kemampuan adaptasi ini merupakan salah satu keunggulan sapi Bali tetapi juga sekaligus merupakan kelemahannya. Keadaan lingkungan hidup sapi Bali yang kurang baik (pakan jelek) maka adaptasi sapi Bali adalah dengan menurunkan ukuran tubuh, sehingga akan menghasilkan jumlah edible meat sedikit dan kecil-kecil. Kondisi ini akan menyebabkan pasarannya sapi Bali hanya dapat menjangkau kalangan bawah sampai menengah.
Sapi Pesisir
Sapi di Sumatera Barat, menurut catatan sejarah terdiri atas sapi lokal, sapi Zebu dan sapi Eropa. Sejak tahun 1907 telah dimasukkan sapi-sapi Zebu (Ongole dan Hissar) untuk meningkatkan mutu genetik sapi lokal. Setelah kemerdekaan, kembali dimasukkan sapi Ongole di Sumatera Barat dalam rangka Program Ongolisasi. Terbatasnya sarana perhubungan di bagian selatan Sumatera Barat terutama di Kabupaten Pesisir Selatan, Program Ongolisasi tidak berjalan sebaik di daerah bagian utara dan tengah, seperti di Kabupaten Agam, Kabupaten Lima Puluh Kota dan Kabupaten Tanah Datar (Sarbaini 2004).
Ciri-ciri sapi lokal Sumatera Barat adalah tubuh kecil, badan pendek dan kaki kecil. Sapi Pesisir memiliki pola warna bulu tunggal yang dikelompokkan atas lima warna utama, yaitu merah bata (34.35%), kuning (25.51%), cokelat (19.96%), hitam (10.91%), dan putih (9.26%) (Sarbaini 2004). Selain itu, sapi Pesisir juga dikenal bertemperamen jinak sehingga mudah dikendalikan dalam pemeliharaan (Saladin 1983).
Sapi Pesisir Sumatera Barat khususnya sapi Pesisir Selatan yang terdapat di Kabupaten Pesisir Selatan merupakan salah satu sapi terkecil di dunia. Contoh sapi terkecil di dunia yang lainnya berdasarkan bobot badannya adalah sapi dwarf West Afrika shorthorn yang berasal dari Wilayah Pantai Afrika Barat dan Bonsai Brahman dari Meksiko (Sarbaini 2004).
Sapi Madura
10
merah bata baik pada jantan maupun betina. Sapi jantan memiliki tanduk yang pendek dan beragam lebih kurang 15 – 20 cm, sedangkan pada betina, tanduk lebih kecil dan pendek lebih kurang 10 cm. Panjang badan lebih mirip seperti sapi Bali tetapi berpunuk kecil, dengan tinggi badan kira 118 cm dengan berat badan rata–rata 350 kg (Arbi 2009). Saat ini breed sapi lain dilarang masuk ke pulau Madura, tetapi sapi Madura disebarkan ke berbagai daerah seperti Jawa Timur, Flores, Kalimantan dan Sumatra, walaupun perkembangannya tidak sebaik di Pulau Madura. Berdasarkan bentuk fenotipe, sapi Madura menyerupai sapi Bali, yakni bentuknya yang uniform, ukuran tubuhnya sedang sampai kecil, bertulang dan berotot yang bagus, terutama sapi jantan (karapan) dan mempunyai kaki yang cukup kuat untuk bertahan terhadap kerja tarik yang berat. Sapi Madura umumnya berwarna coklat medium dan coklat merah. Warna putih seperti pada kaki (white stocking) juga sering ditemukan di daerah abdomen dan bagian paha dalam. White stocking yang ditemukan pada kaki sapi Madura berwarna lebih muda dan tidak sejelas yang ditemukan pada sapi Bali (Suwiti et al. 2008).
Sapi Madura merupakan salah satu jenis sapi potong lokal dari Indonesia yang berkembang pesat di Pulau Madura serta pulau–pulau disekitarnya. Asal domestikasi sapi Madura juga hingga saat ini masih belum diketahui secara pasti. Secara morfologi, sapi Madura memiliki karakter yang hampir sama dengan sapi Bali, kecuali ukuran tubuh dan tanduknya yang lebih kecil (Setiadi 2010). Sapi Madura mempunyai keunggulan yang patut dibanggakan dan diberdayakan. Keunggulan itu antara lain, memiliki kemampuan daya adaptasi yang baik terhadap stres pada lingkungan tropis, mampu hidup dalam keadaan pakan yang kurang baik, tumbuh dan berkembang dengan baik, serta tahan terhadap investasi serangan caplak dan memiliki kualitas karkasnya yang tinggi dan ketahanannya terhadap parasit tertentu. Beberapa sumber hingga kini menyebutkan bahwa sapi Madura telah mengalami degradasi produktivitas karena seleksi negatif dan inbreeding (Leasa 2009).
Sapi Katingan
11
ciri umum sapi Katingan adalah bergelambir, berpunuk, bertanduk dan mempunyai banyak variasi warna. Keberadaan sapi katingan yang unik ini dipelihara di sepanjang daerah aliran sungai (DAS) Katingan dan Kahayan secara ekstensif dalam bentuk ranch-ranch. Sapi-sapi tersebut hanya dipelihara oleh masyarakat lokal setempat atau yang dikenal dengan sebutan suku Dayak, sedangkan sapi-sapi lokal lainnya seperti sapi Bali (dominan), sapi Madura dan sapi PO kebanyakan dipelihara oleh masyarakat pendatang (transmigran). Tidak seperti sapi lokal lainnya yang sudah banyak dilakukan penelitian, informasi mengenai sapi lokal dari Kalimantan Tengah ini masih sangat minim, mulai dari informasi tentang reproduksi, pertumbuhan bahkan dari genetika. Keberadaan sapi tersebut sudah puluhan bahkan ratusan tahun dan sudah beradaptasi dengan lingkungan sekitar yang lahannya tergolong asam dan rawa (Utomo 2011).
Penciri pada sapi Katingan ditunjukkan pada sapi betinanya, yaitu adanya variasi pertumbuhan tanduk seperti melengkung ke depan, melengkung ke samping, dan melengkung ke bawah, sedangkan pada sapi jantan, hanya terdapat variasi tanduk melengkung ke atas dan menyamping ke atas. Pola warna bulu pada sapi Katingan juga sangat bervariasi baik pada jantan maupun betina mulai dari pola warna coklat kemerahan, coklat keputihan, hitam hingga putih keabuan. Hal menarik yang terdapat pada sapi Katingan adalah adanya tonjolan kecil pada bagian kepala yang kemungkinan dapat mejadi penciri morfologi dari sapi Katingan. Tonjolan yang terdapat pada bagian tengah (diantara dua tanduk) dari kepala sapi Katingan hanya ditemukan pada sapi betina saja. Berdasarkan bobot badan, sapi Katingan jantan memiliki rata-rata bobot badan sebesar 250-299.9 kg, sedangkan betina memiliki rata-rata bobot badan sebesar 201-217 kg, hal ini dapat menyatakan bahwa sapi Katingan tergolong bangsa sapi tipe kecil dan sedang (Utomo 2011).
Pertumbuhan Sapi
12
diferensiasi sel-sel induk menjadi beberapa lapisan yaitu ektodermis, mesodermis dan endodermis dan mekanisme pengendalian pertumbuhan dan diferensiasi. Pertumbuhan sel meliputi perbanyakan sel, pembesaran sel dan akumulasi substansi ekstraseluler atau material-material non protoplasma. Pertumbuhan dimulai sejak terjadinya pembuahan dan berakhir pada saat dicapainya kedewasaan. Pertumbuhan ternak dapat dibedakan menjadi pertumbuhan sebelum kelahiran (prenatal) dan pertumbuhan setelah terjadi kelahiran (postnatal) (Aberle et al. 2001).
Pertumbuhan merupakan indikator yang utama dan terpenting dalam produksi daging pada sapi pedaging, sehingga memiliki nilai ekonomi yang tinggi dalam budidaya sapi pedaging. Sapi Bali merupakan salah satu sapi pedaging lokal Indonesia yang memiliki kelebihan berupa kemampuan adaptasi yang tinggi terhadap lingkungan Indonesia baik terhadap iklim, ketersediaan makanan alami, ketersediaan air dan juga ketahanan terhadap bakteri maupun parasit yang ada di lingkungan Indonesia. Meskipun sapi Bali ini mampu berkembang biak dengan baik di Indonesia, namun kualitas dan kuantitas produksinya masih kalah dengan sapi impor (Talib 2002). Peningkatan kualitas maupun kuantitas produksi daging bagi sapi lokal Indonesia akan lebih tepat bila dilakukan melalui seleksi yang tidak hanya berdasarkan pada penampakan luar (fenotipe), melainkan melalui seleksi langsung pada tingkat DNA yang mengkodekan fenotipe yang ingin diperbaiki kualitasnya (Martojo 2003).
13
Salah satu faktor genetik yang mempunyai peranan dalam pertumbuhan suatu individu adalah gen GH (hormon pertumbuhan). Gen GH memiliki peranan yang sangat penting dalam pengaturan regulasi pertumbuhan dan matabolisme dari tubuh ternak (Carnicella et al. 2003). Fungsi dari gen GH pada suatu individu khususnya ternak menjadi hal yang penting dikarenakan gen GH mengatur sifat-sifat yang bernilai ekonomi yang tinggi.
Menurut Silveira et al. (2007), GH merupakan kandidat gen yang sangat mendasar dan berperan dalam pertambahan dan pertumbuhan bobot badan pada ternak. Gen GH merupakan kandidat gen dalam pengaturan produksi susu, karkas dan respon immun (Ge et al. 2003). Selain itu, gen GH juga diperlukan dalam pertumbuhan jaringan, metabolisme lemak dan reproduksi (Burton et al. 1994).
Gen lain yang berpengaruh terhadap pertumbuhan ternak adalah gen yang termasuk dalam famili POU atau transcription factor family yaitu gen Pit-1 (pituitary specific transciptation factor-1) yang berfungsi sebagai faktor pengatur
(regulator) hormon pertumbuhan, hormone prolaktin dan hormon tirotropin β- subunit (Tuggle & Trenkle 1996). Selain itu gen Pit-1 juga berperan dalam diferensiasi dan proliferasi sel kelenjar pituitary (Hoggard et al. 1993). Mengingat peran penting gen tersebut dalam mengatur gen-gen lain dalam proses pertumbuhan khususnya pada ternak sapi, maka gen Pit-1 dipilih sebagai salah satu gen kandidat yang perlu dicari hubungan atau keterkaitannya dengan performa pertumbuhan, kualitas karkas dan juga performa laktasi pada beberapa bangsa sapi seperti yang telah dilaporkan oleh beberapa penelitian sebelumnya (Woollard et al. 1994; Moody et al. 1995; Zwierzhowski et al. 2001; Dybus et al. 2003; Oprzadek et al. 2003; Zhao et al. 2004; Viorica et al. 2007).
Gen lain yang berpengaruh terhadap pertumbuhan pada ternak adalah gen Insulin-like growth factor I (IGF-I) yang merupakan faktor utama peningkatan polipeptida hormon pertumbuhan pada hewan. Gen IGF-I mengatur pertumbuhan somatik dari rangsangan perkembangan dan penghambatan beberapa tipe sel apoptosis, termasuk otot, tulang, epitel dan sel fibroblast (Wu et al. 2008).
14
metabolism yang berhubungan dengan deposisi protein. Gen IGF-I menstimulasi metabolisme protein dan berperan penting terhadap fungsi beberapa organ (Pereira et al. 2005).
Hormon Pertumbuhan
Pertumbuhan dapat diterapkan pada suatu sel, organ, jaringan, seekor ternak maupun populasi ternak. Pertumbuhan secara umum adalah adanya perubahan bentuk atau ukuran serta penampilan seekor ternak yang dapat dinyatakan dengan panjang, volume ataupun massa dengan satuan berat maupun satuan panjang. Menurut Aberle et al. (2001) pertumbuhan dapat dinilai sebagai peningkatan tinggi, panjang, ukuran lingkar dan bobot yang terjadi pada seekor ternak muda yang sehat serta diberi pakan, minum dan mendapat tempat berlindung yang layak. Secara lanjut, Lawrence dan Fowler (2002) menyatakan bahwa pertumbuhan merupakan suatu proses deposisi, pemindahan substansi sel-sel, serta peningkatan ukuran dan jumlah pada tingkat dan titik berbeda dalam suatu waktu tertentu.
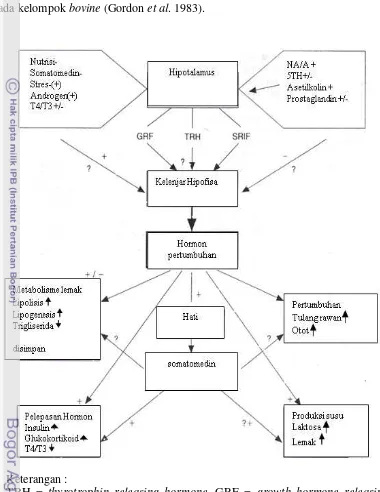
Gambar 3. Mekanisme kerja hormon pertumbuhan dalam pengaturan pertumbuhan otot dan tulang (Roith et al. 2001).
15
pertumbuhan otot, meningkatkan efisiensi penggunaan pakan, meningkatkan pertumbuhan organ, dan meningkatkan pertumbuhan tulang (Roith et al. 2001) (Gambar 3). Pertumbuhan secara efektif dikontrol oleh hormon dan salah satu hormon yang penting dalam mengatur proses pertumbuhan adalah hormon pertumbuhan. Hormon pertumbuhan pada sapi (bovine growth hormone) mempunyai peran utama pada pertumbuhan, laktasi dan perkembangan kelenjar susu (Cunningham 1994; Hoj et al. 1993). Menurut Sellier et al. (2005), pertumbuhan pada ternak dikontrol oleh suatu sistem yang kompleks, salah satu yang memiliki peranan penting dalam proses ini adalah somatotropin. Gen yang mengatur dari somatotropin ini dalam menjalankan fungsinya dalam masa pertumbuhan postnatal adalah GH yang berperan penting dalam pertumbuhan tulang dan otot, dan gen yang membantu GH dalam proses tersebut adalah IGF-1.
Hormon pertumbuhan menyebabkan perubahan yang luar biasa di dalam tubuh hewan dan mempengaruhi banyak proses fisiologis di dalam jaringan dan organ tubuh (Gambar 4). Selain itu, aksi biologis hormon pertumbuhan selama pertumbuhan akan berpengaruh secara fisiologis pada pengeluaran dan sintesis protein, pengambilan asam amino, glukosa, dan efisiensi penggunaan asam amino (Bauman & Vernon 1993).
Hormon pertumbuhan adalah hormon peptida yang reseptornya terdapat di permukaan sel, superfamili dari reseptor sitokinin. Ikatan antara hormon pertumbuhan dengan reseptornya mengakibatkan terjadinya aktivasi enzim fosforilase yang dilakukan oleh enzim kinase dengan cara menambah gugus fosfat. Hal ini menyebabkan timbulnya reaksi intrasel yang dapat berpengaruh pada metabolisme dan fungsi sel (Granner 2003). Pengikatan hormon pertumbuhan akan menyebabkan dimerisasi dua buah reseptor hormon pertumbuhan (GHR).
16
disusun oleh 190-191 asam amino sebagai produk dari gen hormon pertumbuhan pada kelompok bovine (Gordon et al. 1983).
Keterangan :
TRH = thyrotrophin releasing hormone, GRF = growth hormone releasing factor, SRIF = somatostatin inhibitory releasing factor, T3 = triidothyronine, T4 = thyroxine, NA = Non adrenaline, A = Adrenaline, 5HT = 5-hydroxytryptamine, = meningkat, = menurun.
17
Gen Hormon Pertumbuhan
Gen adalah unit pewarisan sifat yang terdapat pada organisme dan terdiri dari dua bentuk, yaitu DNA (yang berfungsi sebagai penyandi protein) dan RNA (yang berfungsi dalam rantai kehidupan organisme dalam bentuk protein). Semua gen terdiri atas rangkaian DNA, namun tidak semua rangkaian DNA identik dengan gen atau dengan kata lain ada bagian DNA yang bukan merupakan gen. DNA yang bukan gen dapat diidentifikasi, dikarakterisasi dan ditentukan posisinya pada genom. Analisis genetik untuk lokus penyandi sifat-sifat kuantitatif dapat dilakukan dengan menggunakan pendekatan gen kandidat (candidate gene) yang dieksplorasi menggunakan penciri DNA (Muladno 2002).
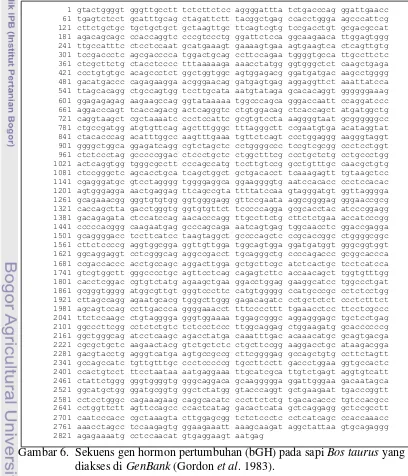
Gen hormon pertumbuhan sapi telah dipetakan terletak pada kromosom 19 dengan lokasi q26-qtr (Hediger et al. 1990). Sekuen gen ini terdiri atas 2856 pb yang terbagi dalam lima exon dan dipisahkan oleh empat intron (Gambar 5). Intron 1, 2, 3 dan 4 berturut-turut terdiri atas 248 pb, 227 pb, 227 pb dan 274 pb. Woychick et al. (1982) dan Gordon et al. (1983) menyatakan bahwa gen hormon pertumbuhan (GH) pada sapi Bos taurus memiliki panjang sekuens nukleotida 2856 pb (Gambar 6). Variasi gen pengkode hormon pertumbuhan telah dilaporkan pada sapi Eropa, misalnya sapi perah jenis Red Danish (Hoj et al. 1993), serta sapi pedaging Hereford dan komposit (Sutarno 1998; Sutarno et al. 1996).
18
Penelitian yang dilakukan pada sapi Hereford dan komposit di Wokalup Research Station Australia Barat oleh Sutarno et al. (1996) dan Sutarno (1998) menunjukkan bahwa variasi pada lokus gen hormon pertumbuhan secara signifikan berhubungan dengan terjadinya variasi rerata pertumbuhan. Penelitian yang telah dilakukan Schlee et al. (1994) menemukan bahwa perbedaan genotipe dari gen hormon pertumbuhan mempengaruhi konsentrasi sirkulasi hormon pertumbuhan dan IGF-I pada sapi Eropa jenis Simmental. Rocha et al. (1991) juga telah menemukan hubungan signifikan antara alel hormon pertumbuhan dengan berat badan waktu lahir serta lebar punggung saat lahir pada sapi jenis Brahman.
Gen GH terkait dengan beberapa ekspresi gen yang mempengaruhi pertumbuhan salah satunya adalah gen Pit-1. Gen Pit-1 mengatur ekspresi gen Growth Hormone (GH), prolaktin (PRL) (Tuggle et al. 1993) dan
thyroid-stimulating hormone β (TSH-β) (Pan et al. 2008) pada pituitary anterior. Menurut McCormick et al. (1990) defisiensi dari gen Pit-1 mengurangi ekspresi GH, disebabkan penurunan proliferasi lapisan sel dalam memproduksi GH.
Keragaman Genetik Gen GH
Sifat polimorfisme gen GH sudah banyak diidentifikasi, baik dengan menggunakan enzim restriksi MspI dan AluI, bahkan Yardibi et al. (2009) mengidentifikasi gen GH yang bisa digunakan sebagai selection marker untuk penyeleksian sifat kadar lemak susu pada ternak sapi lokal di Turki. Dybus et al. (2004), mengidentifikasi bahwa kombinasi penggunaan enzim restriksi MspI–AluI dapat digunakan sebagai marker selection pada ternak perah, terutama pada ternak Polish black – white dengan sifat kadar lemak pada susu.
19
daging (Unanian et al. 2000; Garcia et al. 2003; Di Stasio et al. 2005). Schlee et al. (1994) menyatakan bahwa polimorfisme fragmen gen GH AluI yang bergenotipe LL diduga kuat berhubungan dengan tingkat plasma hormon pertumbuhan. Genotipe VV menurut Growchowska et al. (1997) memiliki konsentrasi GH yang lebih tinggi dibandingkan dengan genotipe LV dan LL. Sebaliknya Reis et al. (2001) menyatakan bahwa genotipe LL berhubungan dengan konsentrasi sirkulasi yang lebih tinggi dibandingkan dengan genotipe LV pada hormon pertumbuhan.
Gambar 6. Sekuens gen hormon pertumbuhan (bGH) pada sapi Bos taurus yang diakses di GenBank (Gordon et al. 1983).
20
Curi et al. (2010), melaporkan bahwa polimorfisme GH1, dapat digunakan sebagai tanda dalam seleksi sifat karkas dan daging pada ternak persilangan Bos taurus– Bos indicus, polimorfisme ini terjadi pada intron 3. Adanya polimorfisme pada gen GH AluI juga berhubungan dengan sifat produksi daging (Chrenek et al. 1998), deposisi daging (Oprzadek et al. 2003) dan bobot karkas (Growchowska et al. 1999).
Reis et al. (2001) menyatakan bahwa terdapat hubungan yang nyata antara genotipe LL dan LV gen GH dengan rataan bobot badan hidup ternak dari bangsa sapi Alentejana, Marinhoa, dan Preta asal Portugis. Unanian et al. (2000), melaporkan bahwa adanya polimorfisme GH AluI dan GH MspI mungkin dapat dijadikan sebagai penciri genetik yang potensial untuk sifat pertumbuhan bobot badan pada sapi pejantan muda. Beauchemin et al. (2006) menyatakan bahwa gen GH merupakan gen kandidat untuk program seleksi yang dibantu penciri pada ternak sapi. Namun, tidak semua polimorfisme dari gen GH dapat digunakan sebagai marker dalam seleksi, menurut Balogh et al. (2009), polimorfisme gen GH-AluI tidak memiliki efek terhadap calving interval pada ternak yang mengalami ovulasi pertama kali dan tidak berpengaruh secara langsung pada produksi susu dan body condition score (BCS) dari ternak perah yang telah beranak setelah satu bulan (bulan pertama setelah beranak).
PCR-SSCP (Polymerase Chain Reaction-Single Strand Conformation Polymorphism)
21
1991). Sensitivitas dari teknik SSCP ini tergantung oleh beberapa faktor yaitu komposisi gel yang digunakan (gel yang sering digunakan berbahan acrilamide), ukuran fragmen DNA, komposisi buffer yang digunakan termasuk jumlah ion (konsentrasi) dan pH, suhu pada saat elektroforesis, dan konsentrasi dari DNA tersebut (Nataraj et al. 1999; Hayashi et al. 1991).
PCR-SSCP terdiri atas beberapa tahapan dalam prosesnya, yaitu tahapan amplifikasi fragmen DNA dengan proses PCR, tahapan denaturasi produk PCR yang sudah diberi formida dye pada suhu 930-950C selama 5 menit. Tahapan terakhir elektroforesis pada gel polyacrilamide adalah proses dilakukan pada kondisi temperatur tertentu (Hayashi 1991 ; Nataraj et al. 1999).
23
MATERI DAN METODE
Tempat dan Waktu
Penelitian ini dilakukan di Laboratorium Genetika Molekuler Ternak, Bagian Pemuliaan Genetika, Fakultas Peternakan, Institut Pertanian Bogor. Penelitian berlangsung selama sembilan bulan dimulai pada Oktober 2010 sampai Juni 2011.
Materi dan Alat Penelitian
Materi penelitian yang digunakan untuk analisis DNA adalah koleksi sampel sapi Bali (Bali), Madura (Pulau Madura), Pesisir (Sumatera Barat), Katingan (Kalimantan Tengah), Limousin dan Simmental yang terdapat di Laboratorium Genetika Molekuler Ternak, Fakultas Peternakan IPB. Sampel ternak, jumlah dan asal ternak sapi yang digunakan dalam penelitian ini disajikan pada Tabel 1.
Tabel 1. Sampel, jumlah dan asal sapi yang digunakan dalam penelitian
No. Sampel Sapi Tahun Koleksi Jumlah Asal
24
Analisis PCR
Beberapa bahan yang digunakan untuk PCR adalah destilated water, DNA, primer forward dan reverse fragmen gen GH exon 1– exon 5 berdasarkan Lagziel et al. (1996) dan Kioka et al. (1989), beberapa pereaksi PCR yang terdiri atas enzim Tag DNA polymerase 5 unit/µl, bufer thermophilic DNA polymerase 10x reaksi bebas MgCl2 25 mM dan campuran nukleotida 40 nM (masing-masing 10 mM dATP, dCTP, dGTP, dan dTTP). Peralatan yang digunakan dalam analisis PCR adalah pipet tip Eppendorf, mikropipet 10 P, 20 P, 200 P Gilson, microtube, dan mesin PCR (eppendorf 5332) serta stabilizer.
Analisis Elektroforesis
Teknik elektroforesis gel poliakrilamida (PAGE) digunakan untuk menguji ada tidaknya produk PCR dilakukan dengan 6-12 % dalam buffer 0.5 x TBE (Tris 0.5 M, asam borat 0.65 M dan EDTA 0.02 M). Elektroforesis dijalankan pada kondisi 200 V selama 1 jam (Zhao et al. 2004). Visualisasi produk PCR dilakukan dengan pewarnaan sensitif perak mengikuti motede Tegelstrom (1986) dan Byun et al. (2009) yang dimodifikasi. Peralatan yang digunakan untuk elektroforesis adalah pipet tip Eppendorf, mikro pipet 10 P Gilson, gelas ukur, electrophoresis (BIO-RAD machine), power supply.
Metode Penelitian
Isolasi DNA Total
Isolasi DNA dilakukan dari sampel darah yang disimpan dalam alkohol. Ekstraksi DNA menggunakan metode Fenol kloroform berdasarkan Sambrook et al. (1989) yang dimodifikasi untuk penggunaan sampel darah yang disimpan dalam alkohol (Lampiran 2).
Amplifikasi Gen GH
25
volume reaksi 12 l adalah 5 l buffer PCR 10x bebas MgCl2, 2 l MgCl2, 1 l dNTP, 1.5 l masing-masing primer Forward dan Reverse, 1.5 l sampel DNA, dan 0.25 l enzim Tag DNA Polymerase dan sisanya deionized water 37.25 l. Sebelum bahan-bahan tersebut dimasukkan ke dalam mesin PCR, terlebih dahulu diputar sebentar (spin down) dengan mikro sentrifuge. Primer yang digunakan yaitu primer forward dan primer reverse, seperti yang terlihat pada Tabel 2. Tabel 2. Posisi, panjang fragmen dan sekuens primer yang digunakan untuk
Kelima primer tersebut memiliki polimorfisme tinggi terhadap gen GH. Kondisi mesin PCR dilakukan dengan denaturasi awal pada suhu 95ºC selama 5 menit, 35 siklus yang terdiri dari denaturasi pada suhu 95ºC selama 45 detik, penempelan primer pada suhu 60º–66ºC selama 45 detik dan ekstensi DNA baru pada suhu 72ºC selama 1 menit, dan ekstensi akhir pada suhu 72ºC selama 5 menit.
26
1 gtactggggt gggttgcctt tctcttctcc aggggattta tctgacccag ggattgaacc 61 tgagtctcct gcatttgcag ctagattctt tacggctgag ccacctggga agcccattcg 121 cttctgctgc tgctgctgct gctaagttgc ttcagtcgtg tccgacctgt gcgacgccat 181 agacagcagc ccaccaggtc cccgtccctg ggattctcca ggcaagaaca ttggagtggg 241 ttgccatttc ctcctccaat gcatgaaagt gaaaagtgaa agtgaagtca ctcagttgtg 301 tccgaccctc agcgacccca tggactgcag ccttccagaa tggggtgcca ttgccttctc 361 ctcgcttctg ctacctcccc tttaaaaaga aaacctatgg ggtgggctct caagctgaga 421 ccctgtgtgc acagccctct ggctggtggc agtggagacg ggatgatgac aagcctgggg 481 gacatgaccc cagagaagga acgggaacag gatgagtgag aggaggttct aaattatcca 541 ttagcacagg ctgccagtgg tccttgcata aatgtataga gcacacaggt ggggggaaag 601 ggagagagag aagaagccag ggtataaaaa tggcccagca gggaccaatt ccaggatccc 661 aggacccagt tcaccagacg actcagggtc ctgtggacag ctcaccagct atgatggctg 721 caggtaagct cgctaaaatc ccctccattc gcgtgtccta aaggggtaat gcggggggcc 781 ctgccgatgg atgtgttcag agctttgggc tttagggctt ccgaatgtga acataggtat 841 ctacacccag acatttggcc aagtttgaaa tgttctcagt ccctggaggg aagggtaggt 901 ggggctggca ggagatcagg cgtctagctc cctggggccc tccgtcgcgg ccctcctggt 961 ctctccctag gcccccggac ctccctgctc ctggctttcg ccctgctctg cctgccctgg 1021 actcaggtgg tgggcgcctt cccagccatg tccttgtccg gcctgtttgc caacgctgtg 1081 ctccgggctc agcacctgca tcagctggct gctgacacct tcaaagagtt tgtaagctcc
1141 cgagggatgc gtcctagggg tggggaggca ggaaggggtg aatccacacc ccctccacac 1201 agtgggagga aactgaggag ttcagccgta ttttatccaa gtagggatgt ggttagggga 1261 gcagaaacgg gggtgtgtgg ggtggggagg gttccgaata aggcggggag gggaaccgcg 1321 caccagctta gacctgggtg ggtgtgttct tcccccagga gcgcacctac atcccggagg 1381 gacagagata ctccatccag aacacccagg ttgccttctg cttctctgaa accatcccgg 1441 cccccacggg caagaatgag gcccagcaga aatcagtgag tggcaacctc ggaccgagga
1501 gcaggggacc tccttcatcc taagtaggct gccccagctc ccgcaccggc ctggggcggc 1561 cttctccccg aggtggcgga ggttgttgga tggcagtgga ggatgatggt gggcggtggt 1621 ggcaggaggt cctcgggcag aggccgacct tgcagggctg ccccagaccc gcggcaccca 1681 ccgaccaccc acctgccagc aggacttgga gctgcttcgc atctcactgc tcctcatcca 1741 gtcgtggctt gggcccctgc agttcctcag cagagtcttc accaacagct tggtgtttgg 1801 cacctcggac cgtgtctatg agaagctgaa ggacctggag gaaggcatcc tggccctgat 1861 gcgggtgggg atggcgttgt gggtcccttc catgtggggg ccatgcccgc cctctcctgg 1921 cttagccagg agaatgcacg tgggcttggg gagacagatc cctgctctct ccctctttct 1981 agcagtccag ccttgaccca ggggaaacct tttccccttt tgaaacctcc ttcctcgccc 2041 ttctccaagc ctgtagggga gggtggaaaa tggagcgggc aggagggagc tgctcctgag
2101 ggcccttcgg cctctctgtc tctccctccc ttggcaggag ctggaagatg gcaccccccg 2161 ggctgggcag atcctcaagc agacctatga caaatttgac acaaacatgc gcagtgacga 2221 cgcgctgctc aagaactacg gtctgctctc ctgcttccgg aaggacctgc ataagacgga 2281 gacgtacctg agggtcatga agtgccgccg cttcggggag gccagctgtg ccttctagtt 2341 gccagccatc tgttgtttgc ccctcccccg tgccttcctt gaccctggaa ggtgccactc
2401 ccactgtcct ttcctaataa aatgaggaaa ttgcatcgca ttgtctgagt aggtgtcatt 2461 ctattctggg gggtggggtg gggcaggaca gcaaggggga ggattgggaa gacaatagca 2521 ggcatgctgg ggatgcggtg ggctctatgg gtacccaggt gctgaagaat tgacccggtt 2581 cctcctgggc cagaaagaag caggcacatc cccttctctg tgacacaccc tgtccacgcc 2641 cctggttctt agttccagcc ccactcatag gacactcata gctcaggagg gctccgcctt 2701 caatcccacc cgctaaagta cttggagcgg tctctccctc cctcatcagc ccaccaaacc 2761 aaacctagcc tccaagagtg ggaagaaatt aaagcaagat aggctattaa gtgcagaggg 2821 agagaaaatg cctccaacat gtgaggaagt aatgag
Keterangan : huruf tebal situs primer (forward – reverse).
Gambar 7. Posisi penempelan primer (cetak tebal) pada sekuen gen GH (nomor akses M57764).
Elektroforesis dan Visualisasi DNA
Teknik elektroforesis gel poliakrilamida (Polyacrilamide gel (PAGE)) digunakan untuk menguji ada tidaknya produk PCR dilakukan dengan dalam buffer 0.5 x TBE (Tris 0.5 M, asam borat 0.65 M dan EDTA 0.02 M). Elektroforesis dijalankan pada kondisi 200 V selama ± 2 jam. Visualisasi pola pita hasil SSCP dilakukan dengan menggunakan elektroforesis gel poliakrilamid 6% yang diikuti dengan metode pewarnaan perak (silver stainning) menurut
Exon 1
Exon 2
Exon 3
Exon 4
27
petunjuk Tegelstrom (1986) yang telah dimodifikasi. Tahapan pewarnaan perak (silver staining) yaitu gel dicuci secara bertahap sebagai berikut: dengan larutan AgNO3 0.2 gram, 80 µl NaOH 10 N, 800µl ammonia dalam 200 ml air destilasi selama 8 menit, kemudian dibilas dengan air destilasi selama 2 menit. Memunculkan pita dalam gel dimulai dengan merendam gel dalam larutan yang terdiri atas 3.6 gram NaOH, 1.6 gram NaCO3, 200 ml air destilata dan 200 µl formaldehid selama 6 menit selanjutnya ditambah. Setelah pita muncul, larutan asam asetat ( 100 ml air destilasi dan 100 µl asam asetat) dituangkan untuk menghentikan aktifitas oksidasi perak oleh formaldehid.
Pendeteksian Varian Gen GH dengan Metode PCR-SSCP
Produk PCR yang dianalisis dengan metode SSCP (Single Strand Conformation Polymorphism) dimanfaatkan untuk pendeteksian adanya mutasi pada ruas exon dan intron produk gen GH (Lagziel et al. 1996). Produk PCR yang didapatkan kemudian diidentifikasi konformasi DNA utas tunggal (single strand conformational), maka sekitar 12 l produk PCR dicampur dengan 12 l loading dye (98% formamide, 10 mM EDTA,0.025% bromophenol blue, 0.025% xylene-cyanol), dan setelah didenaturasi pada suhu 95 oC selama 5 menit, sampel langsung didinginkan dengan es batu selama 3 menit dan diloading pada gel poliacryalmide 12-10% untuk setiap fragmen. Penggunaan teknik perendaman produk PCR di dalam waterbath dan icebath tersebut, memungkinkan DNA yang sudah terdenaturasi menjadi utas tunggal tidak kembali menjadi utas ganda lagi. Elektroforesis dilakukan dengan menggunakan Protean II xi cells (Bio-Rad) pada kondisi 200-300 V pada suhu 5oC selama 8-14 jam pada larutan buffer 0,5x TBE. Setelah elektroforesis gel kemudian diwarnai dengan metode silver staining (Byun et al. 2009) dan Tegelstrom (1986) yang dimodifikasi.
Deteksi untai tunggal diuji dengan gel poliakrilamida (PAGE) 10-12 % yang merupakan campuran akrilamid dengan bis akrilamid dengan perbandingan 29 : 1. Selanjutnya elektroforesis dijalankan pada kondisi 200-350 V selama 8–14 jam pada suhu 40C yang dilanjutkan dengan pewarnaan perak.
28
Data penelitian yang diperoleh dari metode PCR-SSCP, berupa pita DNA yang dibedakan berdasarkan laju migrasi dan jumlah pitanya. Frekuensi alel di fragmen exon-1, exon-2, exon-3, exon-4 dan exon-5 gen GH dianalisis dengan menggunakan rumus (Nei & Kumar 2000) :
Keterangan :
xi = frekuensi alel ke-i
nii = jumlah individu bergenotipe AiAi nij = jumlah individu bergenotipe AiAj n = jumlah total sampel
Frekuensi Heterozigositas Pengamatan
Analisis keragaman dilakukan melalui estimasi frekuensi heterozigositas pengamatan (Ho), heterozigositas harapan (He) dan standard error heterozigositas harapan (Weir 1996) :
∑
Keterangan :
Ho = frekuensi heterozigositas pengamatan
29
Frekuensi Heterozigositas Harapan
∑ Keterangan :
Ho = frekuensi heterozigositas harapan P1i = frekuensi alel ke-i pada lokus 1 n = jumlah alel pada lokus ke-1
Ragam Heterozigositas Harapan
{ (∑ ∑
) ∑
∑ }
Keterangan :
Vsl (He) = ragam heterozigositas harapan xi = frekuensi gen ke-1
Ragam (SE) heterosigositas harapan diperoleh dari = √ (Weir 1996).
Pengujian Chi-Kuadrat
Keseimbangan Hardy-Weinberg diuji dengan Chi-Kuadrat (χ²) dengan rumus (Nei & Kumar 2000) :
∑
Keterangan :
χ2
= Chi-Kuadrat O = nilai pengamatan E = nilai harapan
31
HASIL DAN PEMBAHASAN
Amplifikasi Gen Hormon Pertumbuhan
Amplifikasi fragmen gen hormon pertumbuhan (GH) yang dilakukan pada sapi Bali, Pesisir, Madura, Katingan, Simmental dan Limousin menunjukan posisi gen GH pada masing-masing exon 1, 2, 3, 4 dan 5. Amplifikasi gen GH kelima exon (Gambar 8) dilakukan dengan panjang produk PCR adalah exon 1: 315 pb, exon 2 : 283 pb , exon 3 : 158 pb, exon 4 : 198 pb dan exon 5 : 392 pb
Keterangan: M=Marker 100 pasang basa (pb)
Gambar 8. Elektroforesis produk PCR gen GH pada gel acrylamide 6%. Lagziel et al. (1996) melaporkan bahwa amplifikasi gen GH didapatkan dengan annealing (penempelan) primer pada masing–masing exon yaitu pada suhu 58⁰-680C selama 30 detik. Yao et al. (1996) mendapatkan bahwa amplifikasi gen GH terutama pada penempelan primer pada masing–masing exon 1 s/d 5 adalah 590C. Hasil penelitian ini mendapatkan bahwa annealing primer gen GH terjadi pada suhu 60⁰-660C selama 45 detik. Keberhasilan amplifikasi fragmen gen GH pada setiap exon sangat ditentukan oleh kondisi penempelan primer pada DNA genom (gen target), bahan pereaksi PCR dan kondisi suhu mesin thermal cycler.
32
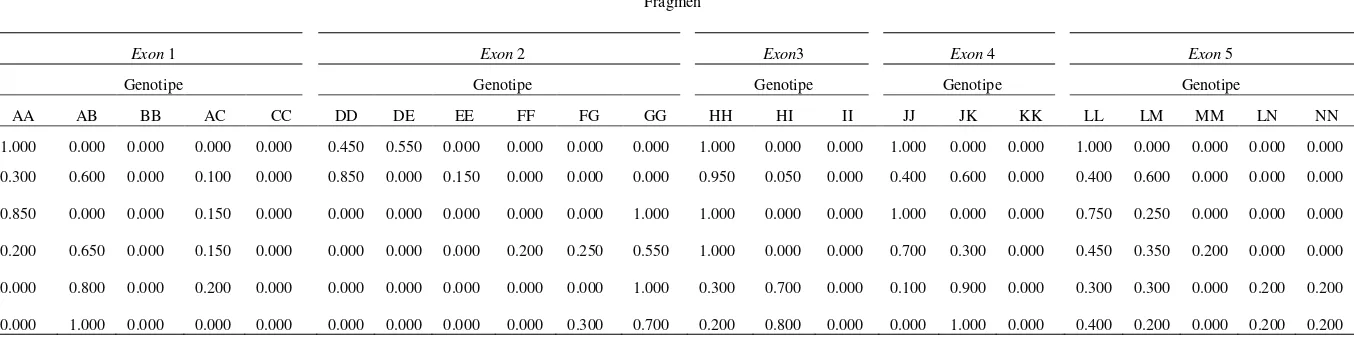
Pada exon 1, terdapat lima genotipe, seperti genotipe AA, AB dan AC. Pada exon 2, terdiri atas 6 genotipe, yaitu genotipe DD, DE, GG dan FG. Exon 3 dan 4, masing-masing memiliki 2 macam genotipe yaitu genotipe HH dan HI (exon 3), JJ dan JK (exon 4) sedangkan di exon 5 terdiri atas 5 macam genotipe yaitu genotipe LL, MM, LM, NN dan LN. Jumlah genotipe yang ditemukan dalam penelitian ini berbeda dengan hasil penelitian yang telah dilakukan sebelumnya seperti pada sapi Frisien Holstein. Yao et al. (1996) menemukan 3 genotipe yaitu A, B dan C sedangkan Lagziel et al. (1996) mendapatkan genotipe sebanyak 13 genotipe yaitu A, B, C, D, E, F, G, H, I, J, K, L dan M. Pada kambing Algarvia di Portugal, Malviero et al. (2001) menemukan genotipe gen GH sebanyak 19 genotipe. Perbedaan genotipe dapat disebabkan adanya mutasi dari nukleotida-nukleotida yang terdapat pada sampel sapi penelitian,atau karena nukleotida dari sapi lokal Indonesia yang kemungkinan berbeda dengan sapi impor yang berada di daerah subtropis.
Keragaman Gen Hormon Pertumbuhan
Keragaman Gen Hormon Pertumbuhan Populasi Sapi Lokal Indonesia
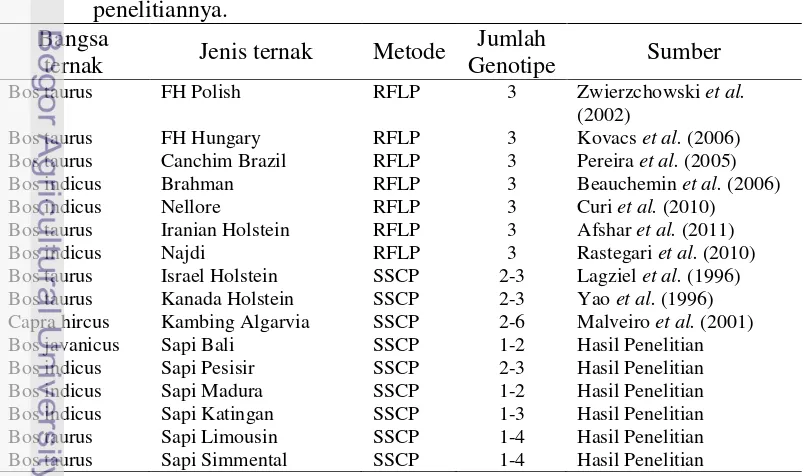
Macam dan frekuensi genotipe yang diperoleh dari hasil penelitian ini (Gambar 9) menunjukkan bahwa terdapat variasi genotipe dan frekuensi genotipe pada sapi lokal Indonesia (sapi Bali, Pesisir, Madura dan Katingan) dan sapi impor (sapi Simmental dan Limousin). Jumlah genotipe yang ditemukan secara keseluruhan pada gen GH exon-1, 2, 3, 4 dan 5 adalah 16 genotipe dengan jumlah alel yang ditemukan sebanyak 14 macam alel. Jumlah alel yang terdapat pada sapi lokal Indonesia untuk setiap exon bervariasi dari 1-4 alel, sedangkan pada sapi Simmental dan Limousin 1-3 alel. Beberapa penelitian sebelumnya menunjukkan bahwa jumlah alel yang ditemukan pada sapi FH adalah 2-3 alel (Lagziel et al. 1996; Yao et al. 1996), sedangkan Malveiro et al. (2001) memperoleh 2-6 alel pada kambing Algarvia di Portugal.
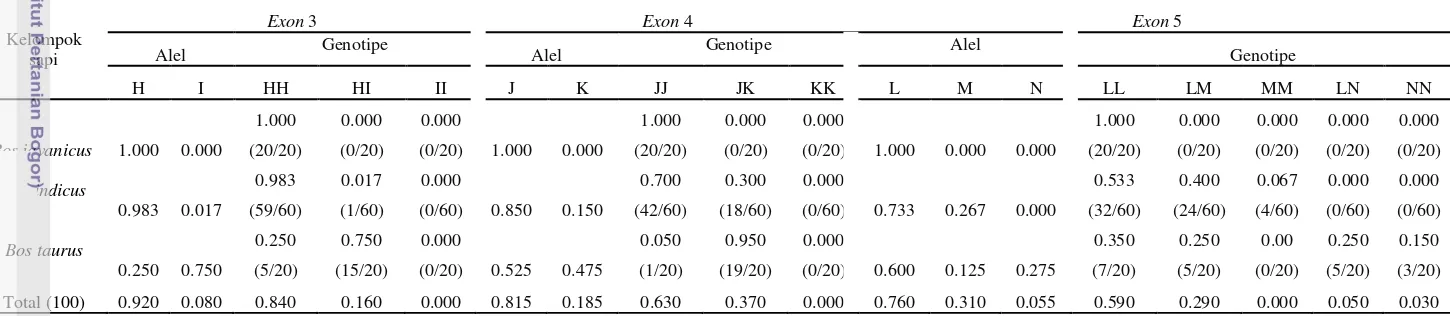
34
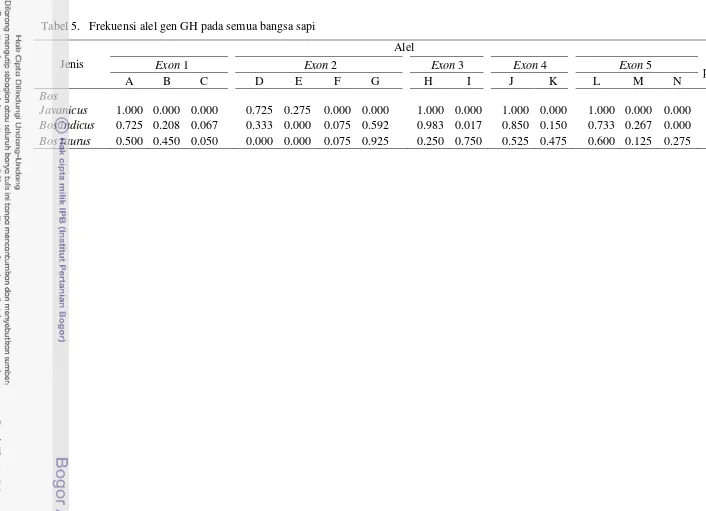
Pada Tabel 3 dan 12 (Lampiran 3) tampak bahwa frekuensi genotipe dan alel gen GH pada kelima exon sapi lokal Indonesia memiliki nilai frekuensi genotipe atau alel yang tinggi, sebaliknya pada sapi Limousin dan sapi Simmental adalah rendah kecuali pada exon 2. Hal ini mengindikasikan bahwa terdapat perbedaan frekuensi genotipe dan alel antara sapi lokal Indonesia dengan sapi impor (sapi Limousin dan sapi Simmental) untuk fragmen gen GH pada kelima exon. Perbedaan tersebut dapat disebabkan oleh kondisi lingkungan tropis (ekstrim) yang membentuk sapi lokal Indonesia seperti sapi Bali, Pesisir, Madura dan Katingan, berbeda dari sapi impor (sapi Simmental dan sapi Limousin) yang berkembang di daerah subtropik sehingga diduga dapat mengubah frekuensi genotipe atau alel fragmen gen GH sebagai akibat adanya seleksi alam atau seleksi buatan. Selain itu, mungkin juga peran sapi Bali yang bersifat monomorfik pada kelima exon gen GH kecuali exon 2 telah memberikan proporsi yang besar terhadap pembentukan sapi lokal Indonesia seperti sapi Pesisir, Madura dan Katingan.
Frekuensi alel pada gen GH di kelima fragmen exon (Tabel 3) sangat bervariasi. Nei dan Kumar (2000) menyatakan bahwa suatu alel pada suatu populasi dikatakan polimorfik jika memiliki dua atau lebih alel dengan frekuensi lebih dari 1%. Pada sapi Bali di exon 1 memiliki nilai frekuensi alel A sebesar 1.000 dan hanya memiliki satu alel sehingga bersifat monomorfik, sedangkan nilai frekuensi alel sapi lokal Indonesia lainnya seperti sapi Pesisir, Madura dan Katingan memiliki nilai kurang dari 0.990 serta memiliki dua atau lebih frekuensi alel sehingga dikategorikan bersifat polimorfik. Pada sapi Simmental dan Limousin memiliki dua atau tiga alel dengan nilai frekuensi berkisar 0.100-0.500, sehingga dapat dinyatakan bersifat polimorfik.
35
bersifat polimorfik. Sapi Madura dan Simmental pada alel G memiliki nilai frekuensi alel sebesar 1.000 sehingga bersifat monomorfik.
Gen GH pada exon 3 lebih sedikit variasinya karena jumlah alel yang terdapat hanya ada dua alel. Sapi Bali, Madura dan Katingan memiliki nilai frekuensi alel H sebesar 1.000 dan bersifat monomorfik, sedangkan sapi Pesisir memiliki nilai frekuensi alel H sebesar 0.950, dan alel I sebesar 0.050 sehingga dinyatakan bersifat polimorfik. Sapi impor yaitu sapi Simmental dan Limousin bersifat polimorfik, hal ini dikarenakan sapi Simmental memiliki nilai frekuensi alel I sebesar 0.700 dan alel H sebesar 0.300, sedangkan alel I pada sapi Limousin memiliki nilai sebesar 0.800 dan alel H sebesar 0.200.
Keragaman alel di exon 4 juga bervariasi seperti halnya pada sapi Bali dan Madura yang memiliki nilai frekuensi alel sebesar 1.000, yaitu pada alel J sehingga dinyatakan bersifat monomorfik. Sapi Pesisir dan Katingan, jumlah alel ditemukan ada dua alel (alel J dan K) serta memiliki nilai frekuensi kurang dari 0.990 sehingga bersifat polimorfik. Hasil yang berbeda didapatkan pada bangsa sapi Bos taurus, yaitu sapi Simmental dan Limousin. Variasi alel yang ditemukan menunjukan bahwa kedua bangsa tersebut bersifat polimorfik, hal ini dikarenakan frekuensi alel tertinggi pada sapi Simmental adalah alel J sebesar 0.550, sedangkan pada sapi Limousin jumlah frekuensi alel yang ditemukan pada alel J dan alel K masing-masing adalah sebesar 0.500.
Gen GH pada exon 5 menunjukan keragaman alel lebih bervariasi terutama pada sapi lokal Indonesia dengan sifat monomorfik hanya ditemukan pada sapi Bali ditunujjan oleh hanya satu alel yang ditemukan yaitu alel L sebesar 1.000. Sapi lokal Indonesia lainnya seperti sapi Pesisir, Madura dan Katingan bersifat polimorfik disebabkan nilai frekuensi alel pada sapi-sapi tersebut berkisar 0.125-0.875 serta memiliki dua buah alel, yaitu alel L dan M. Polimorfik yang terdapat pada sapi impor dikarenakan frekuensi alel serta jumlah alel yang ditemukan lebih banyak. Jumlah alel pada sapi Simmental dan Limousin ditemukan sebanyak tiga alel (alel L, M dan N) dengan nilai frekuensi berkisar 0.100-0.650.