ARAB
SETELAH PENGERINGAN DAN PENYIMPANAN
HENI RIZQIATI
F 251020021
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
SURAT PERNYATAAN
Saya yang bertanda tangan di bawah ini :
Nama : Heni Rizqiati
Program Studi : Ilmu Pangan
NRP : F251020021
Asal Instansi : Fakultas Peternakan U niversitas Diponegoro Semarang
NIP : 132232284
Alamat asal : Jl. Satria Utara 4 no : 44 Semarang 50171
menyatakan dengan sebenarnya, bahwa : judul, isi dan data hasil penelitian di dalam proses penyusunan dan penulisan tesis ini merupakan hasil karya saya sendiri dengan bimbingan dari komisi pembimbing dan belum pernah dipublikasikan. Semua sumber data dan informasi yang digunakan telah dinyatakan secara jelas dan dapat diperiksa kebenarannya.
Bogor, Oktober 2006
Heni Rizqiati
Dienkapsulasi dengan Susu Skim dan Gum Arab Setelah Pengeringan dan Penyimpanan. Dibimbing oleh BETTY SRI LAKSMI JENIE, NOVIK NURHIDAYAT dan C.C. N URWITRI.
Probiotik adalah suplemen berupa mikroba hidup yang memberi keuntungan bagi kesehatan pencernaan manusia dalam jumlah yang cukup (107-109 cfu/g). (Fuller 1999). Dalam sistem pencernaan, probiotik menghadapi beberapa hambatan diantaranya keberadaan pH yang rendah dan adanya garam empedu. Untuk mengatasi kendala diatas dan untuk meningkatkan viabilitas probiotik maka perlu perlindungan dengan cara enkapsulasi.
Tujuan penelitian ini adalah untuk memperoleh bahan enkapsulasi probiotik L. plantarum yang mampu melindungi probiotik selama pengeringan (spray drying), dalam kondisi pH rendah (pH 2,0) dan garam empedu (3%) serta selama penyimpanan satu bulan pada suhu rendah(4 oC) dan suhu kamar. Penelitian meliputi empat tahap, yaitu seleksi probiotik tahan panas, produksi kultur dan biomasa se l probiotik, enkapsulasi dengan metode spray drying, serta penyimpanan mikrokapsul probiotik.
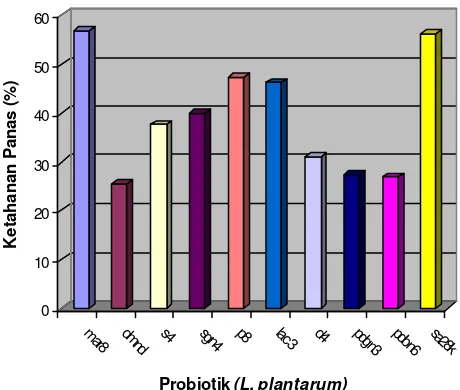
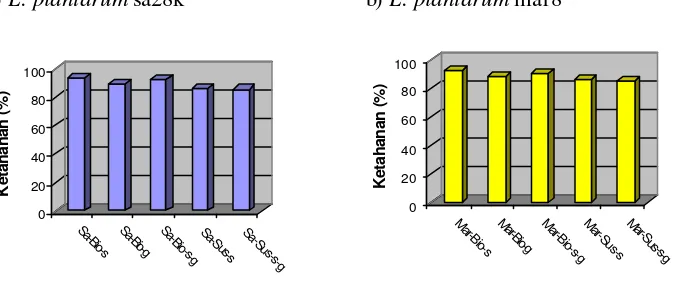
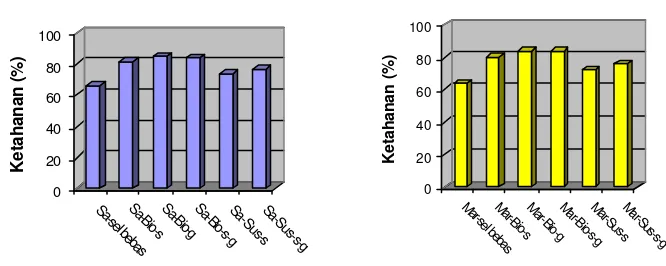
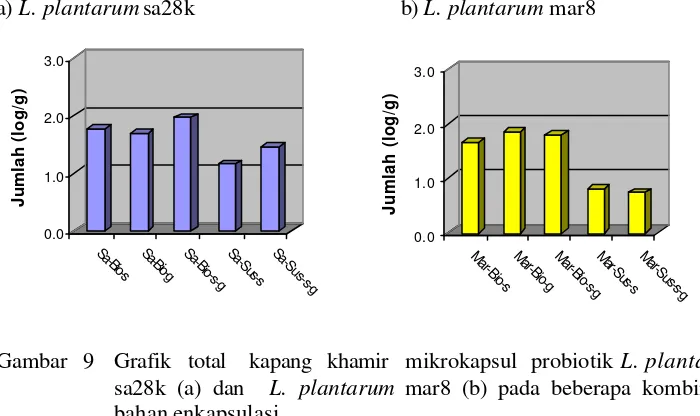
Pada pengujian ketahanan panas diperoleh dua isolat yang mempunyai ketahanan panas tertinggi, yaitu L. plantarum sa28k dan L. plantarum mar8. Kultur probiotik baik L. plantarum sa28k dan L. plantarum mar8 yang dienkapsulasi dalam bentuk biomasa menghasilkan ketahanan setelah spray drying dan viabilitas setelah disimpan satu bulan pada suhu rendah dan suhu kamar yang lebih baik dari pada dalam bentuk suspensi, tetapi pada ketahanan pH rendah (pH 2,0) dan garam empedu (3%) tidak berbeda nyata. Bahan enkapsulasi susu skim, gum arab dan kombinasi susu skim gum arab menghasilkan ketahanan setelah spray drying, viabilitas setelah penyimpanan selama satu bulan pada suhu rendah (4 oC) dan suhu kamar, serta ketahanan pada pH rendah (pH 2,0) dan garam empedu (3%) yang tidak berbeda nyata secara statistik.
© Hak cipta milik Institut Pertanian Bogor, tahun 2006
Hak cipta dilindungi
YANG DIENKAPSULASI DENGAN SUSU SKIM DAN GUM
ARAB
SETELAH PENGERINGAN DAN PENYIMPANAN
HENI RIZQIATI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Pangan
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Ketahanan dan Viabilitas Lactobacillus plantarum yang Dienkapsulasi dengan Susu Skim dan Gum Arab Setelah Pengeringan dan Penyimpanan.
Nama Mahasiswa : Heni Rizqiati
NRP : F251020021
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. Betty Sri Laksmi Jenie, MS Ketua
Dr. Novik Nurhidayat Ir. C.C. Nurwitri, DAA Anggota Anggota
Diketahui
Ketua Program Studi Ilmu Pangan Dekan Sekolah Pasca Sarjana
Prof. Dr. Ir. Betty Sri Laksmi Jenie, MS Dr. Ir. Khairil A. Notodiputro, MS
Puji syukur penulis panjatkan kehadirat Allah SWT atas segala rahmat dan karuniaNya serta kemudahan yang diberikan sehingga penulis dapat menyelesaikan tesis ini sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Ilmu Pangan, Sekolah Pascasarjana IPB.
Pada kesempatan ini penulis juga menyampaikan terima kasih yang sebesar-besarnya kepada :
1. Ibu Prof. Dr. Ir. Betty Sri Laksmi Jenie, MS., Bapa k Dr. Novik Nurhidayat dan Ibu Ir. C.C. Nurwitri, DAA selaku komisi pembimbing yang telah meluangkan waktu, tenaga dan pikirannya untuk membimbing dan mengarahkan penulis sejak awal penelitian hingga akhir penulisan tesis ini.
2. Pusat Penelitian Biologi, Lembaga Ilmu Penelitian Indonesia yang telah memberikan dana penelitian ini.
3. Rektor dan Pembantu Rektor IPB, Dekan Sekolah Pasca Sarjana IPB, Dekan dan Wakil Dekan Fakultas Teknologi Pertanian, Ketua Departemen Ilmu dan Teknologi Pangan IPB, Ketua Program Studi Ilmu Pangan IPB atas kesempatan yang telah diberikan kepada penulis untuk melanjutkan pendidikan S2 di IPB.
4. Rektor Universitas Diponegoro, Dekan Fakultas Peternakan UNDIP, Ketua Jurusan Produksi Ternak serta Ketua Program Studi Teknologi Hasil Ternak atas ijin dan kesempatan yang telah diberikan kepada penulis untuk melanjutkan pendidikan S2 di IPB.
5. Direktur Jenderal Pendidikan Tinggi atas dukungan beasiswa BPPS selama masa studi.
6. Suamiku Ali Fauzi yang telah banyak membantu baik dalam bentuk moril maupun materiil serta kedua buah hatiku tercinta Shaquilla dan abyan yang selalu mengerti dengan kesibukanku untuk menyelesaikan studi. 7. Keluarga besar Bpk. Moh Rosjidin, Ch dan Ibu Mariyah di Semarang dan
keluarga besar Ibu Isti Qomariah di Jakarta, serta kakak dan adik tercinta (Mbak Hesti, Mas Agung, Husni, Husin, Ghofar, Eti dan Ade), atas doa dan kasih sayangnya yang tiada pernah putusnya kepada penulis.
8. Ibu Nery, Ibu Ani, Ibu Erna dan Teh Ratih, dan seluruh warga Laboratorium Biosistematika dan Genetika Mikrobiologi, Pusat Penelitian Biologi, Lembaga Ilmu Penelitian Indonesia atas kebersamaan, bantuan dan doanya.
9. Mbak Ari, Indri, Ida dan teman-teman IPN-2002/2003 serta semua pihak yang telah membantu penulis selama menyelesaikan penelitian dan tesis ini.
Bogor, Oktober 2006
RIWAYAT HIDUP
Penulis dilahirkan di Semarang pada tanggal 3 Januari 1974 sebagai anak kedua dari lima bersaudara dari ayah Moh. Rosjidin Ch dan ibu Mariyah. Penulis telah menikah dengan Ali Fauzi pada tahun 2000, dan mempunyai 2 putra Mohamad Shaquilla Anfasa Fauzi dan Mohamad Abyan Wijdanatha Fauzi.
DAFTAR ISI... i
DAFTAR GAMBAR ... ii
DAFTAR LAMPIRAN... iii
PENDAHULUAN Latar Belakang ... 1
Tujuan Penelitian ... 2
TINJAUAN PUSTAKA Bakteri Asam Laktat ... 3
Probiotik... 4
Enkapsulasi ... 10
METODOLOGI UMUM Waktu dan Tempat Penelitian... 15
Bahan dan Alat Penelitian... 15
Pelaksanaan Penelitian... 16
Analisis... 19
Daftar Pustaka ... 23
ENKAPSULASI Lactobacillus plantarum DENGAN SUSU SKIM DAN GUM ARAB SERTA KETAHANANNYA SETELAH SPRAY DRYING DAN VIABILITASNYA SELAMA PENYIMPANAN Abstract... 27
Pendahuluan... 27
Bahan dan Metode ... 28
Hasil dan Pembahasan ... 33
Kesimpulan ... 43
Daftar Pustaka ... 45
KARAKTERISTIK DAN KETAHANAN MIKROKAPSUL PROBIOTIK Lactobacillus plantarum YANG DIENKAPSULASI DENGAN SUSU SKIM DAN GUM ARAB TERHADAP pH RENDAH DAN GARAM EMPEDU Abstract... 47
Pendahuluan... 47
Bahan dan Metode ... 48
Hasil dan Pembahasan ... 52
Kesimpulan ... 58
Daftar Pustaka ... 59
PEMBAHASAN UMUM... 61
DAFTAR GAMBAR
Halaman
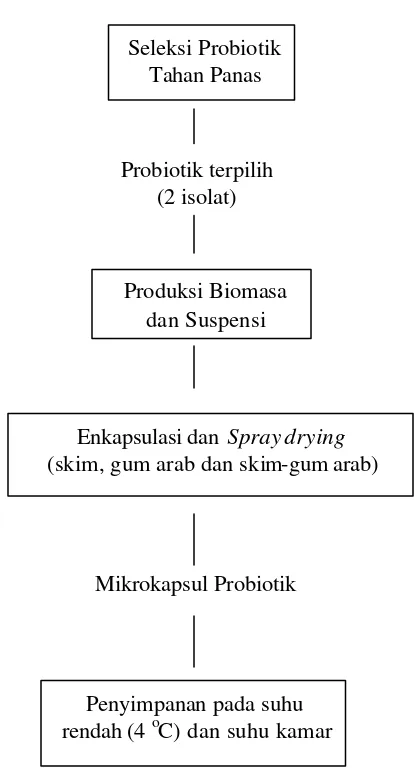
1 Diagram alir enkapsulasi probiotik dengan metode spray drying... 18
2 Grafik hasil uji ketahanan panas probiotik ... 33
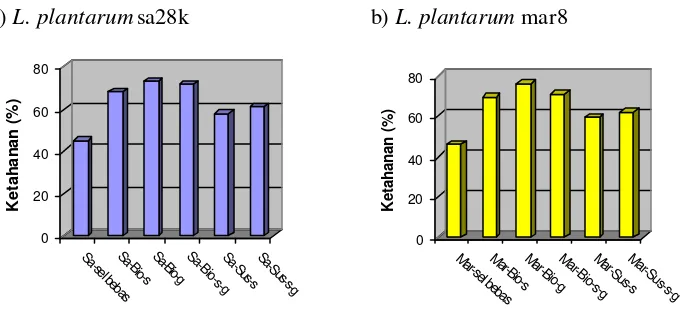
3 Grafik ketahanan setelah spray drying mikrokapsul probiotik
L. plantarum sa28k (a) dan L. plantarum mar 8 (b) pada beberapa bahan
enkapsulasi ... 35
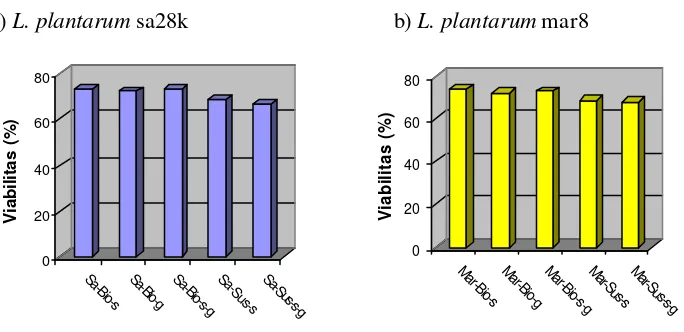
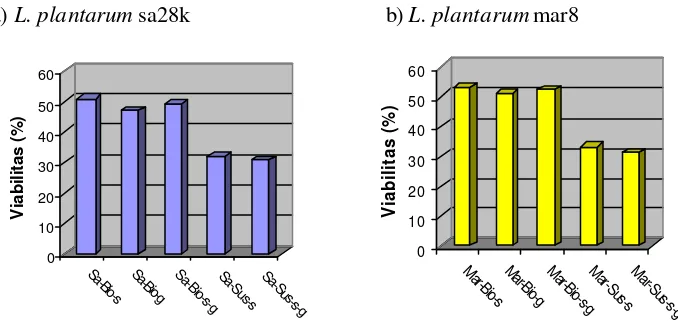
4 Grafik viabilitas mikrokapsul probiotik L. plantarum sa28k (a) dan L. plantarum mar 8 (b) pada beberapa bahan enkapsulasi setelah
disimpan 1 bulan pada suhu rendah (4o C) ... 38
5 Grafik viabilitas mikrokapsul probiotik L. plantarum sa28k (a) dan L. plantarum mar 8 (b) pada beberapa bahan enkapsulasi setelah
disimpan 1 bulan pada suhu kamar ... 41
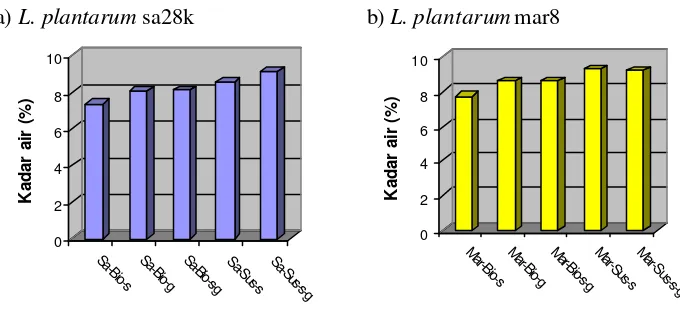
6 Grafik kadar air mikrokapsul probiotik L. plantarum sa28k (a)
dan L. plantarum mar 8 (b) pada beberapa bahan enkapsulasi... 43
7 Grafik ketahanan terhadap pH rendah (pH 2,0) mikrokapsul bakteri probiotik L. plantarum sa28k (a) dan L. plantarum mar8 (b) pada
beberapa kombinasi bahan enkapsulasi... 53
8 Grafik ketahanan terhadap garam empedu mikrokapsul probiotik L. plantarum sa28k (a) dan L. plantarum mar8 (b) pada beberapa
kombinasi bahan enkapsulasi... 55
9 Grafik total kapang khamir mikrokapsul probiotik L. plantarum sa28k (a) dan L. plantarum mar8 (b) pada beberapa kombinasi bahan
enkapsulasi ... 56
10 Mikrokapsul yang dilihat dengan scanning electron microscope
Halaman
1 Gambar mikrokapsul yang disimpan di dalam botol steril ... 66
2 Hasil uji ketahanan panas probiotik ... 67
3 Perhitungan statistik hasil uji ketahanan panas probiotik ... 68
4 Data ketahanan mikrokapsul probiotik setelah spray drying... 69
5 Perhitungan statistik ketahanan mikrokapsul probiotik setelah spray drying ... 70
6 Data viabilitas mikrokapsul probiotik setelah disimpan 1 bulan pada suhu refrigerator (4 oC)... 71
7 Perhitungan statistik viabilitas mikrokapsul probiotik setelah disimpan 1 bulan pada suhu refrigerator (4oC) ... 72
8 Data viabilitas mikrokapsul probiotik setelah disimpan 1 bulan pada suhu kamar ... 73
9 Perhitungan statistik viabilitas mikrokapsul probiotik setelah disimpan 1 bulan pada suhu kamar ... 74
10 Data kadar air mikrokapsul probiotik ... 75
11 Perhitungan statistik kadar air mikrokapsul probiotik ... 76
12 Data ketahanan mikrokapsul probiotik terhadap pH rendah (pH 2) ... 77
13 Perhitungan statistik ketahanan mikrokapsul probiotik terhadap pH rendah (pH 2) ... 78
14 Data ketahanan mikrokapsul probiotik terhadap garam empedu... 79
15 Perhitungan statistik ketahanan mikrokapsul probiotik terhadap garam empedu ... 80
16 Data total kapang khamir pada mikrokapsul probiotik... 81
PENDAHULUAN
Latar Belakang
Minat masyarakat terhadap makanan dan minuman kesehatan akhir-akhir ini
cenderung meningkat, terutama untuk produk-produk yang dapat menstimulasi
sistem kekebalan tubuh. Hal ini disebabkan oleh adanya pergeseran gaya hidup,
perkembangan ilmu pengetahuan tentang sistem pencernaan dan metabolisme di
dalam tubuh, serta munculnya beberapa penyakit yang disebabkan oleh mikroba
yang terdapat di dalam usus. Salah satu jenis produk kesehatan yang berkembang
pesat adalah probiotik dengan bermacam bentuk dan kultur bakteri asam laktat
(BAL) yang digunakan.
Probiotik adalah suplemen berupa mikroba hidup yang memberi keuntungan
kepada manusia, khususnya dalam keseimbangan mikroflora usus (Fuller 1999).
Salminen et al. (1998) menjelaskan pentingnya viabilitas probiotik, yaitu
preparasi mikroba hidup yang bermanfaat bagi kesehatan. Jumlah mikroba hidup
harus cukup untuk memberikan efek positif bagi kesehatan dan mampu
berkolonisasi sehingga dapat mencapai jumlah yang diperlukan selama waktu
tertentu.
Viabilitas sel bakteri dalam produk probiotik harus berkisar antara 107-109 cfu/g, karena viabilitas probiotik mengalami penurunan selama penyimpanan dan
saat berada dalam sistem pencernaan. Hal ini disebabkan faktor lingkungan yang
kurang menguntungkan untuk kelangsungan hidupnya, diantaranya keberadaan
pH yang rendah dan adanya garam empedu di dalam sistem pencernaan (Gomes
dan Malcata 1999) . Untuk memperbaiki ketahanan dan viabilitasnya, maka
probiotik perlu dilindungi misalnya dengan metode enkapsulasi.
Enkapsulasi adalah suatu proses pembungkusan(coating)suatu bahan inti,
dalam hal ini adalah bakteri probiotik sebagai bahan inti dengan menggunakan
bahan enkapsulasi tertentu, yang bermanfaat untuk mempertahankan viabilitasnya
dan melindungi probiotik dari kerusakan akibat kondisi lingkungan yang tidak
menguntungkan, seperti asam lambung dan garam empedu (Wu et al. 2000).
seperti mikroorganisme, dapat dienkapsulasi untuk meningkatkan viabilitas dan
umur simpannya.
Bahan yang umum digunakan untuk enkapsulasi adalah berbagai jenis
polisakarida dan protein seperti pati, alginat, gum arab, gelatin, karagenan,
albumin dan kasein. Penggunaan bahan untuk enkapsulasi perlu dipertimbangkan,
karena masing-masing bahan mempunyai karakter yang berbeda dan belum tentu
cocok dengan bahan inti yang akan dienkapsulasi (Desmond et al. 2002).
Penelitian tentang enkapsulasi probiotik sebelumnya sudah dilakukan oleh
beberapa peneliti dengan berbagai variasi bahan enkapsulasi dan kultur yang
dienkapsulasi, diantaranya : enkapsulasi Bifidobacteria dan Lactobacillus dengan
alginat - pati (Sultana et al. 2000), Lactobacillus casei dengan alginat - tepung
polard dan terigu (Widodo et al. 2003), Bifidobacteria dengan whey protein (Picot
dan Lacroix 2004), Lactobacillus spp. dengan kalsium alginat (Chandramouli et
a l. 2004). Dari beberapa penelitian di atas dihasilkan bahwa penggunaan bahan
enkapsulasi dari jenis protein, memberi hasil ketahanan setelah proses enkapsulasi
yang lebih baik dan penggunaan bahan enkapsulasi dari jenis polisakarida
menyebabkan tekstur yang kasar pada mikrokapsul yang dihasilkan maupun
setelah diaplikasikan pada produk. Untuk itu dalam penelitian ini dipelajari bahan
enkapsulasi skim yang berbahan dasar protein dan polisakarida gum arab serta
kombinasi dari keduanya untuk memperoleh hasil yang terbaik.
Tujuan
Tujuan penelitian ini adalah untuk mengkaji pengaruh enkapsulasi
probiotik L. plantarum dalam bentuk biomas a dan suspensi menggunakan bahan
enkapsulasi susu skim, gum arab serta kombinasi susu skim dan gum arab
terhadap ketahanan probiotik setelah spray drying, pada kondisi pH rendah dan
garam empedu serta viabilitasnya setelah penyimpanan selama satu bulan pa da
TINJAUAN PUSTAKA
Bakteri Asam Laktat
Bakteri asam laktat (BAL) merupakan bakteri Gram positif, tidak
membentuk spora, berbentuk batang atau bulat, katalase atau oksidase negatif,
bersifat anaerob aerotoleran, tahan asam, fermentatif, habitatnya harus ka ya
nutrisi, dengan komposisi basa DNA kurang dari 50% mol G+C (Axelsson 1998;
Adam dan Mos 1997).
Berdasarkan kemampuannya dalam metabolisme glukosa dan produk akhir
yang dihasilkan, bakteri asam laktat dibagi menjadi dua kelompok yaitu
homofermentatif dan heterofermentatif. Bakteri asam laktat homofermentatif
merupakan bakteri asam laktat yang memproduksi asam laktat sebagai produk
utama atau satu-satunya produk hasil fermentasi glukosa, sedangkan bakteri asam
laktat heterofermentatif yaitu bakteri asam laktat yang memproduksi laktat, CO2,
dan etanol dari metabolisme heksosa (Jay 1997).
Bakteri asam laktat homofermentatif sering digunakan dalam pengawetan
pangan karena produksi asam laktat dalam jumlah besar dan mampu menghambat
bakteri penyebab kerusakan makanan dan patogen lain. Bakteri asam laktat
heterofermentatif lebih dimanfaatkan dalam pembentukan flavor dan komponen
aroma, seperti asetaldehid dan diasetil, tetapi kedua jenis bakteri asam laktat
tersebut tetap mempunyai kemampuan menghasilkan asam organik, hidrogen
peroksida dan bakteriosin (Gomes dan Malcata 1999).
Secara umum grup inti dari bakteri asam laktat terdiri dari 4 genus yaitu
Lactobacillus, Leuconostoc, Pediococcus dan Streptococcus yang didasarkan pada
ciri morfologi, tipe fermentasi, kemampuan tumbuh pada suhu yang berbeda, sifat
stereospesifik (D atau L laktik), seta toleransi terhadap asam dan basa. Klasifikasi
bakteri asam laktat terus berkembang, sehingga genus Lactobacillus menjadi
Lactobacillus dan Carnobacterium. Genus Streptococcus menjadi 4 yaitu
Streptococcus, Lactococcus, Vagococcus, Enterococcus. Genus Pediococcus
menjadi Pediococcus, Tetratogenococcus, dan Aerococcus. Sementara tidak ada
perubahan pada genus Leuconostoc. Klasifikasi yang baru tersebut dihasilkan
dan urutan rRNA, serta persen guanin dan sitosin pada DNA (Salminen dan
Wright 1998).
Peranan utama BAL adalah sebagai kultur starter produk-produk yang
melibatkan proses fermentasi untuk memperoleh produk akhir dengan tingkat
konsistensi yang tinggi. Selain menghasilkan produk akhir yang konsisten, bakteri
asam laktat ternyata memiliki efek mengawetkan pada produk fermentasi yang
diinginkan. Untuk keperluan yang terakhir ini dibutuhkan produksi massa sel yang
tinggi, tahan selama proses pembekuan dan pengeringan, serta stabil selama
penyimpanan. Di samping itu kultur harus mampu tumbuh pesat, tidak rentan
terhadap phage, toleran terhadap garam dan stabil secara genetika (Jenie dan Rini
1995). Bakteri asam laktat juga dapat menghambat mikroba patogen yang berada
pada saluran pencernaan yang sering terinfeksi oleh Escherichia coli, Salmonella,
Campylobacter, Clostridium dan rotavirus (Fuller 1999).
Probiotik
Probiotik adalah makanan suplemen berupa mikroba hidup yang memberi
keuntungan pada manusia khususnya dalam keseimbangan mikroflora usus
(Shortt 1999; Fuller 1999). Definisi probiotik digunakan pada pemberian pakan
ternak yang disuplementasi dengan mikroba untuk membantu hewan ternak
khususnya dalam saluran pencernaannya. Dalam perkembangannya, banyak
dilakukan penelitian mengenai mekanisme probiotik yang menggunakan hewan
percobaan untuk diekstrapolasikan pada manusia (Pessi et al. 1998; Fuller 1999).
Probiotik sangat bermanfaat bagi tubuh karena menunjukkan peranan
fisiologis yang penting dalam menjaga keseimbangan mikroflora saluran
pencernaan sehingga terbentuk suatu ekosistem yang unik, dimana terjadi
interaksi yang kompleks yang bekerja secara sinergis dan antagonis tergantung
dari galur yang terlibat, jumlah dan aktivitas metaboliknya (Matilla-Sandholm et
al. 1999). Bakteri asam laktat yang bersifat sebagai probiotik pada pencernaan
manusia merupakan mikroflora normal usus, yang terdiri dari Bifidobacteria dan
Lactobacillus acidophilus (Gomes dan Malcata 1999; Shortt 1999).
Penelitian bakteri asam laktat yang berpotensi probiotik untuk kesehatan
5
gangguan saluran pencernaan seperti adanya inflamasi pada saluran pencernaan,
sebagai antimikroba yang dapat menghambat pertumbuhan bakteri patogen seperti
L.monocytogenes, E.coli, Salmonella spp dan lainnya sehingga dapat mencegah
terjadinya diare dan infeksi usus, sebagai imunomudulator untuk meningkatkan
daya tahan tubuh, sebagai antihipertensi atau menurunkan tekanan darah dan
bersifat antimutagenik dan antikarsinogenik sehingga dapat menurunkan risiko
terjadinya tumor dan kanker kolon (Gomes dan Malcata 1999; Erickson 2000;
Rolfe 2000; Roos dan Katan 2000).
Untuk bersifat sebagai probiotik maka bakteri asam laktat harus memiliki
beberapa syarat sebagai berikut (Reid 1999):
(1) Stabil terhadap asam (terutama asam lambung), sehingga mampu bertahan dan
hidup selama melalui lambung dan usus.
(2) Stabil terhadap garam empedu dan mampu bertahan hidup selama berada pada
bagian atas usus kecil.
(3) Memproduksi senyawa antimikroba seperti asam, hidrogen peroksida dan
bakteriosin.
(4) Mampu menempel dan mengkolonisasi sel usus manusia. Hal ini akan
meningkatkan kompetisi dengan mikroba patogen dan pe nyebab karsinogen.
(5) Tumbuh baik dan berkembang dalam saluran pencernaan.
(6) Aman digunakan oleh manusia.
(7) Tahan terhadap mikrobisida dan spermisida vaginal. Sifat ini diperlukan untuk
probiotik yang ditujukan untuk mengobati infeksi saluran urinovaginal.
(8) Koagregasi membentuk lingkungan mikroflora yang normal dan seimbang.
Bakteri asam laktat yang berpotensi probiotik telah banyak diteliti, selain itu
juga banyak digunakan dan diaplikasikan untuk produk-produk berbasis susu
seperti yogurt, es krim, keju serta produk-produk fermentasi lainnya (Shin et al.
2000).
L. plantarum sa28k
L. plantarum sa28k adalah salah satu bakteri asam laktat yang berasal dari
makanan fermentasi Indonesia, yang diisolasi dari asinan kubis (Jenie et al. 1996)
dilakukan diantaranya uji ketahanan terhadap pH rendah, ketahanan terhadap
garam empedu, aktivitas antagonistik terhadap bakteri patogen, pengujian
asimilasi kolesterol dan uji klinis secara in vivo ke dalam tubuh tikus
(Kusumawati 2002).
L. plantarum mar8
L. plantarum mar8 diisolasi dari buah markisa yang merupakan salah satu
makanan asli Indonesia, dan telah terbukti mempunyai sifat probiotik. Pengujian
sifat probiotik yang telah dilakukan diantaranya uji ketahanan terhadap pH
rendah, ketahanan terhadap garam empedu, aktivitas antagonistik terhadap bakteri
patogen, pengujian kemampuan menurunkan kolesterol dan uji klinis secara in
vivo ke dalam tubuh tikus (Gunawan 2003 dan Yulianto 2004).
Karakteristik Probiotik
Karakteristik suatu isolat bakteri untuk dapat dikategorikan sebagai
probiotik antara lain, mampu bertahan pada kondisi asam lambung dan tahan
terhadap garam empedu, memiliki aktivitas antagonis terhadap bakteri patogen
serta menempel pada permukaan usus.
Ketahanan terhadap Asam Lambung. Ketahanan terhadap asam lambung merupakan syarat penting suatu isolat untuk dapat menjadi probiotik. Hal ini
disebabkan bila isolat tersebut masuk ke dalam saluran pencernaan manusia, maka
ia harus mampu bertahan dari pH asam lambung yaitu sekitar 2,5 (Jacobsen et al.
1999). Getah lambung terdiri atas air (97–99%), musin (lendir) serta garam
anorganik, enzim pencernaan (pepsin serta renin) dan lipase. Chou dan Weimer
(1999) menyatakan bahwa waktu yang diperlukan mulai saat bakteri masuk
sampai keluar dari lambung sekitar 90 menit. Jadi isolat yang diseleksi untuk
digunakan sebagai probiotik harus mampu bertahan dalam keadaan asam lambung
selama sedikitnya 90 menit.
BAL adalah mikroorganisme fermentatif yang dapat hidup pada kisaran
7
seluler yang terdiri atas struktur lemak dua lapis. Bila sel bakteri terpapar pada
kondisi yang sangat asam, maka membran sel dapat mengalami kerusakan dan
berakibat hilangnya komponen-komponen intraseluler, seperti Mg, K dan lemak
dari sel. Biasanya kerusakan ini menyebabkan kematian pada sel. Kondisi ini
dapat dideteksi dengan cara mengukur konsentrasi komponen intraseluler yang
keluar dari dalam sel.
Toleransi BAL yang cukup tinggi terhadap asam juga disebabkan oleh
kemampuannya untuk mempertahankan pH sitoplasma lebih basa daripada pH
ekstraseluler. Menurut Siegumfeldt et al. (2000), pada BAL terjadi perubahan
dinamis pH intraseluler seiring dengan terjadinya penurunan pH ekstraseluler
sehingga tidak terjadi gradien proton yang besar. Bagi BAL gradien proton yang
besar tidak menguntungkan sebab translokasi proton menggunakan banyak energi.
Selain itu gradien proton yang besar mengakibatkan akumulasi anion, asam
organik dalam sitosol yang bersifat toksik bagi sel tersebut.
BAL tidak hanya tumbuh dengan lambat pada pH rendah, tapi kerusakan
akibat asam dan hilangnya viabilitas juga dapat terjadi pada sel bakteri yang
terpapar pada pH rendah. Tiap galur memiliki ketahanan yang berbeda terhadap
asam atau pH rendah. Contohnya Lactobacillus lebih toleran terhadap pH rendah
daripada laktokoki dan streptokoki. Zavaglia et al. (1998) telah menguji
ketahanan isolat klinis Bifidobacteria bila terpapar pada pH 3,0 selama 1 jam.
Hasilnya menunjukkan bahwa sebanyak 11 dari 25 isolat klinis Bifidobacteria
berhasil hidup dalam kondisi pH rendah, dengan ketahanan lebih besar dari 1%.
Jacobsen et al. (1999) menguji ketahanan 47 isolat BAL dari berbaga i sumber
pada pH 2,5. Dari 47 isolat tersebut hanya 29 isolat yang mampu bertahan pada
pH 2,5 dan tidak ada satupun yang mampu tumbuh setelah inkubasi 4 jam. Chou
dan Weimer (1999) menyeleksi 7 isolat Lactobacillus acidophilus dan hasilnya
menunjukkan bahwa semua isolat tahan terhadap pH 3,5 selama 90 menit.
Isolat BAL dari dadih yang berhasil diisolasi oleh Elida (2002) ternyata
menunjukkan ketahanan yang cukup tinggi saat dipaparkan pada pH 3,5 selama
24 jam. BAL yang diisolasi dari dadih tersebut (Lactobacillus brevis ae4,
Streptococcus lactis subsp. diacetylactis abk1, Leuconostoc mesenteroides abk1
berkisar antara 70-90 % dengan penurunan sebesar 1 log dari jumlah awal 108 CFU/ml. Sedangkan isolat BAL dari tempoyak mempunyai ketahanan yang lebih
rendah yaitu sebesar 40 % pada pH 2,5 yang berarti bahwa BAL yang diisolasi
dari tempoyak tersebut lebih sensitif terhadap asam (Wirawati 2002).
Kusumawati (2002) melakukan seleksi BAL asal makanan fermentasi
Indonesia dan hasilnya menunjukkan hampir semua isolat memiliki ketahanan
yang baik untuk tumbuh pada pH rendah dengan penurunan jumlah koloni pada
pH rendah dibandingkan kontrol tidak sampai 1 unit log/ml, kecuali Lactobacillus
p lantaru m FNCC 107 mengalami penurunan 1,1 unit log/ml. Evanikastri (2003)
menguji ketahanan 17 isolat klinis BAL yang diisolasi dari feses bayi. Dari 17
isolat ternyata terdapat 13 yang mengalami penurunan jumlah koloni kurang dari
1 unit log/ml (paling resisten) , sedangkan 4 isolat lainnya mengalami penurunan
jumlah koloni antara 1,5 – 3,5 unit log/ml (resisten).
Ketahanan terhadap Garam Empedu (Bile Salt). Lactobacillus adalah mikroflora normal yang terdapat di dalam saluran pencernaan manusia dan
mempunyai ketahanan yang bervariasi terhadap garam empedu. Ketahanan isolat
klinis BAL terhadap garam empedu juga merupakan syarat penting untuk
probiotik.
Asam empedu disintesis dalam hati dari kolesterol, menghasilkan senyawa
asam empedu primer. Asam empedu ini berkonjugasi dengan glisin atau taurin
dan disekresikan ke dalam kantung empedu sebagai asam empedu terkonjugasi.
Asam empedu di dalam kantung empedu dilepaskan ke dalam lumen duodenum
dalam bentuk misel dengan asam lemak dan gliserol yang dihasilkan oleh
pence rnaan lipase pankreatik. Menurut Corzo dan Gilliland (1999), antara 5.500
sampai 35.500 mg asam empedu terkonjugasi disekresikan ke dalam usus kecil
manusia setiap harinya untuk membantu absorpsi lemak makan, kolesterol,
vitamin hidrofobik dan senyawa larut lemak yang lain. Asam empedu terkonjugasi
diserap dari usus kecil (sekitar 97%) dan dikembalikan ke dalam hati. Sebagian
kecil dari asam empedu (250–400 mg) yang tidak terserap hilang dari tubuh
manusia sebagai asam empedu bebas di feses. Mekanisme di ma na asam empedu
diserap dalam usus kecil dan kolon, disintes is kembali dan disekresikan lagi
9
Laktobasili yang paling bersifat resisten terhadap garam empedu terdapat
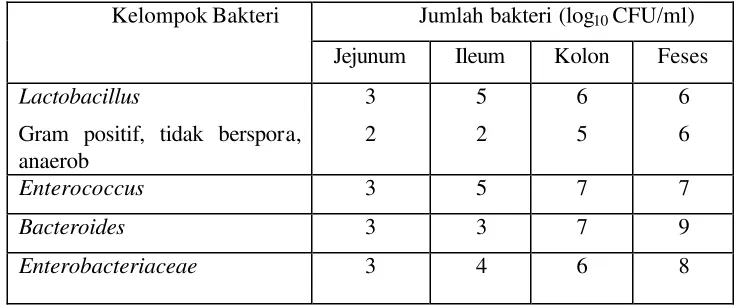
pada bagian atas usus halus (jejunum). Hal ini juga dila porkan oleh Ray (1996)
dan Drouault et al. (1999), bahwa jumlah BAL yang terdapat di jejunum lebih
rendah dibanding ileum, caecum dan kolon (Tabel 1). Hal ini disebabkan
konsentrasi garam empedu pada bagian jejunum paling tinggi daripada ileum,
karena lokasinya paling dekat bila garam empedu masuk ke dalam saluran usus.
Tabel 1 Populasi kelompok bakteri utama pada usus manusia (Ray 1996)
Jumlah bakteri (log10 CFU/ml)
Kelompok Bakteri
Jejunum Ileum Kolon Feses
Lactobacillus
Gram positif, tidak berspora, anaerob
3
2
5
2
6
5
6
6
Enterococcus 3 5 7 7
Bacteroides 3 3 7 9
Enterobacteriaceae 3 4 6 8
Menurut Smet et al. (1995) beberapa Lactobacillus mempunyai enzim
dengan aktivitas untuk menghidrolisis garam empedu (bile salt hydrolase, BSH).
Enzim ini mampu mengubah kemampuan fisika-kimia yang dimiliki oleh garam
empedu, sehingga tidak bersifat racun bagi BAL. Semakin tinggi konsentrasi
garam empedu, maka jumlah sel Lactobacillus yang mati juga akan meningkat
(Ngatirah et al. 2000 ; Kusumawati 2002). Hal ini disebabkan karena peningkatan
aktivitas enzim β-galaktosidase terhadap garam empedu, sehingga meningkatkan
permeabilitas membran sel. Bila permeabilitas membran sel meningkat maka
banyak materi intraseluler yang keluar dari dalam sel. Bila hal ini berlangsung
terus-menerus akan menyebabkan lisis sel bakteri.
Kusumawati (2002) melaporkan bahwa isolat BAL yang diisolasi dari
makanan fermentasi asal Indonesia menunjukkan perbedaan ketahanan untuk
tumbuh pada lingkungan yang mengandung garam empedu 1% dan 5% , dimana
perbedaan tersebut bersifat beragam untuk masing-masing galur. Pada konsentrasi
0.73 unit log/ml dan pada konsentrasi 5% Lactobacillus plantarum To22 (isolat
tempoya k) memiliki selisih log yang terkecil yaitu 0.68 unit log/ml, dimana hasil
tersebut tidak berbeda nyata dengan beberapa galur yang lain.
Menurut Wirawati (2002), ketahanan isolat BAL asal tempoyak terhadap
garam empedu 0.3% berkisar antara 34.8% - 100%. Berdasarkan kisaran tersebut
terlihat bahwa isolat BAL asal tempoyak relatif tahan terhadap garam empedu.
Bahkan L.plantarum To 8 tidak menunjukkan penurunan selama inkubasi 24 jam.
Evanikastri (2003) menguji ketahanan 17 isolat klinis bakteri asam laktat terhadap
garam empedu 0.5%. Hasilnya menunjukkan bahwa Lactobacillus G1 mempunyai
ketahanan yang baik terhadap garam empedu kemudian disusul berturut-turut oleh
F1, G2, M, Kk, Nkp, En6, K, F2 dan Ae1 (penurunan log < 1.0 cfu/ml).
Lactobacillus N merupakan isolat yang paling sensitif terhadap 0.5% garam
empedu.
Enkapsulasi
Enkapsulasi adalah suatu proses pembungkusa n (coating) suatu bahan.
Bahan yang dibungkus atau bahan yang ditangkap umumnya disebut sebagai
bahan inti atau bahan aktif atau bahan internal. Zat-zat yang terkurung di dalam
mikrokapsul dapat berwujud padat, cair atau gas dengan sifat permukaan
hidrofilik atau hidrofobik. Struktur yang menyelimuti bahan mikrokapsul disebut
dinding, kulit atau film pelindung yang berguna untuk melindungi inti dari
kerusakan dan inti dapat terlepas pada saat kondisi yang memungkinkan (Young
et al. 1993).
Mosilhey (2003) mendefinisikan enkapsulasi sebagai teknologi pengemasan
zat padat, cair atau gas dalam kapsul berukuran kecil yang dapat melepaskan
isinya dalam lingkungan tertentu. Mikrokapsul ini dapat berukuran dari
submikron hingga beberapa milimeter dan memiliki berbagai bentuk tergantung
pada bahan dan metode yang digunakan untuk membuatnya. Secara umum,
mikrokapsul memiliki kemampuan untuk memodifikasi dan meningkatkan bentuk
dan sifat substansi. Bahkan lebih spesifik, mikrokapsul memiliki kemampuan
11
Enkapsulasi produk pangan telah lama diaplikasikan pada berbagai bahan
tambahan pangan (BTP). Proses enkapsulasi banyak digunakan untuk
mempertahankan flavor, asam, lipid, enzim, mikroorganisme, pemanis buatan,
vitamin, mineral, air, bahan pengembang, warna dan garam (Risch 1995).
Enkapsulasi dapat dilakukan pada bakteri, yang bertujuan untuk
memberikan kondisi yang mampu mempertahankannya dari kondisi yang tidak
menguntungkan seperti panas dan bahan kimia (Frazier & Westhoff, 1998).
Keuntungan dari proses enkapsulasi antara lain menurunkan reaktivitas bahan inti
dengan lingkungan luar (misalnya: cahaya, oksigen, dan air), menurunkan laju
evaporasi atau transfer bahan inti ke lingkungan luar, mempermudah penanganan
bahan inti, mengendalikan pelepasan bahan inti untuk mencapai penundaan yang
tepat, menyembunyikan rasa bahan inti, dan melarutkan bahan inti jika digunakan
dalam jumlah yang sangat kecil, namun tetap mencapai penyebaran yang merata
dalam bahan pembawanya.
Metode Enkapsulasi
Spray Drying. Spray drying merupakan teknologi yang sangat dikenal
dalam industri pangan yang memiliki laju produksi tinggi dan biaya operasional
yang rendah. Metode ini umum digunakan untuk membuat tambahan pangan yang
kering, stabil dan memiliki volume kecil. Selain itu spray drying digunakan juga
untuk mengawetkan dan mengkonsentrasikan mikroorganisme. Namun
mikroorganisme rentan terhadap panas dan kerusakan dehidrasi selama spray
drying. Karenanya, survival mikroorganisme harus mendapat banyak perhatian
jika spray drying dilakukan untuk membuat kultur kering mikroba (Lian et al.
2002 dan Mosilhey 2003).
Proses spray drying mengubah masukan berupa cairan emulsi atau
pembentuk fase dispersi menjadi produk kering. Cairan kemudian diubah menjadi
bagian-bagian yang sangat kecil dengan menggunakan roda yang berputar dan
menyemburkan butiran yang langsung kontak dengan aliran udara yang panas
(atomisasi dengan sejumlah udara panas). Waktu kontak antara udara pengering
beberapa detik saja sehingga sedikit sekali kemungkinan terjadinya degradasi
karena panas (Filkova dan Mujumdar 1995).
Lian et al. (2002) menyatakan bahwa pada semua perlakuan bahan
enkapsulasi, spray drying menghasilkan pengurangan Bifidobacteria dengan
reduksi populasi sekitar 1,0-2,0 log/g berat kering. Tanpa melihat strain dan bahan
enkapsulasi, mikrokapsul yang dihasilkan mengandung Bifidobacteria dengan
jumlah populasi sekitar 109-1010 cfu/g berat kering. Mosilhey (2003) juga
melaporkan bahwa spray drying dengan berbagai bahan enkapsulasi
menyebabkan penurunan sel L. acidophilus sekitar 1,0-2,0 log/g berat kering.
Mikrokapsul yang dihasilkan setelah spray drying mengandung L.acidophilus
dengan populasi sekitar 108-109 cfu/g berat kering, memenuhi jumlah untuk digunakan sebagai probiotik. Begitu pula yang dilakukan Harmayani et al. (2001)
dengan metode spray drying untuk pengawetan kultur Lactobacillus sp diperoleh
viabilitas sel dari 1011 cfu/ml menjadi 108 cfu/g.
Freeze Drying. Freeze drying atau pengeringan beku merupakan
pengeringan yang terbaik untuk mencegah terjadinya perubahan kimia dan
meminimumkan kehilangan nutrien selama proses pengeringan berlangsung,
tetapi freeze drying memiliki kekurangan yaitu alatnya sangat mahal, proses
kerjanya lama, dan memerlukan biaya besar untuk operasionalnya (Filkova dan
Mujumdar 1995). Pengawetan kultur bakteri dengan metode freeze drying akan
menghasilkan viabilitas sel yang lebih baik. Johnson dan Etzel (1995) menyatakan
bahwa dengan proses freeze drying diperoleh viabilitas sel L.helveticus sebesar
1010 cfu/ml dari jumlah awal 1012 cfu/ml. Demikian pula Harmayani et al. (2001) melakukan pengawetan Lactobacillus sp dengan metode freeze drying diperoleh
viabilitas selnya dari 1011 cfu/ g dari jumlah awal 1013 cfu/ ml.
Proses freeze drying menggunakan bahan-bahan kriogenik yang melindungi
bakteri dari kerusakan selama pengeringan beku. Bahan pangan yang diawetkan
dengan freeze drying biasanya membentuk struktur porous yang memungkinkan
bahan untuk direhidrasi kebentuk semula dengan cepat, sehingga bahan pangan
harus dilindungi agar tidak mengabsorbsi uap air dari udara. Walaupun prinsip
keseluruhan kerja dari bahan kriogenik tersebut belum begitu jelas tetapi
13
Bahan Enkapsulasi
Penggunaan bahan enkapsulasi (coating) perlu diperhatikan, karena
bahan-bahan tertentu belum tentu cocok dengan bahan-bahan jenis lainnya. Menurut Swaisgood
(1991) penggunaan bahan enkapsulasi biasanya berupa hidrokoloid yaitu polimer
rantai panjang dengan berat molekul yang tinggi, dapat larut atau terdispersi
didalam air, be rfungsi sebagai pengental dan memberikan efek membentuk gel.
Menurut Young et al. (1993) untuk bahan-bahan yang menggunakan metode
spray drying maka bahan enkapsulasi tersebut harus memperlihatkan kemampuan
kelarutan yang tinggi dan memiliki kemampuan mengemulsi, dapat membentuk
lapisan film, kemampuan mengering dan menghasilkan konsentrat larutan dengan
viskositas yang rendah. Swaisgood (1991) menyimpulkan bahwa penggunaan
bahan enkapsulasi yang banyak digunakan umumnya adalah pati modifikasi, gum
arabik, karagenan, alginat, walaupun bahan-bahan lain juga dapat digunakan.
Metode enkapsulasi dapat meningkatkan viabilitas bakteri probiotik
dibandingkan dengan sel bebas tanpa enkapsulasi. Enkapsulasi dengan alginat
dapat digunakan dan aman untuk melindungi bakteri probiotik saat berada dalam
saluran pencernaan (Chandramouli et al. 2003).
Penelitian telah menunjukkan bahwa kalsium alginat melindungi kultur lebih
baik yang ditunjukkan dengan peningkatan survival bakteri, di bawah kondisi
pengujian yang berbeda-beda dibanding ketika bakteri diuji tanpa dienkapsulasi
(Sultana et al. 2000).
Gum arab merupakan hidrokoloid yang dihasilkan dengan eksudasi alami
dari pohon akasia dan merupakan bahan enkapsulasi efektif karena memiliki
kelarutan air yang tinggi, viskositas yang rendah dan larutan terkonsentrasi relatif
terhadap hidrokoloid lainnya dan memiliki kemampuan untuk berperan sebagai
emulsifier minyak dalam air. Gum arab terdiri dari susunan banyak cabang dari
gula sederhana galaktosa, arabinosa, ramnosa dan asam glukoronat dan juga
mengandung sedikit komponen protein (2%) yang terikat secara kovalen dalam
susunan molekulnya (Mosilhey 2003) .
Gum arab merupakan hidrokoloid yang sangat mudah larut dalam air panas
maupun air dingin, membentuk larutan dengan viskos itas rendah, akan tetapi tidak
pada industri makanan dan farmasi. Karakteristik utamanya adalah bersifat
pembentuk tekstur, pembentuk film, pengikat dan pengemulsi. Gum arab dapat
mempertahankan flavor dari makanan yang dikeringkan dengan metode spray
drying karena gum ini dapat membentuk lapisan yang dapat melindungi dari
oksidasi, absorbsi dan evaporasi (Thevenet 1995). Karena sifat viskositasnya yang
rendah dan tidak adanya rasa dan warna, maka gum arab dapat ditambahkan
dalam jumlah tertentu tanpa mengganggu sifat organoleptik produk pangan
METODOLOGI UMUM
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan Juni 2004 sampai dengan April 2005, di
Laboratorium Biosistematika dan Genetika Mikrobiologi, Pusat Penelitian Biologi
Lembaga Ilmu Pengetahuan Indonesia (LIPI) yang berlokasi di dalam Kebun
Raya Bogor; Laboratorium Scanning Electron Microscope (SEM) Bidang
Zoologi LIPI Cibinong; Laboratorium Layanan Terpadu Fakultas Kedokteran
Hewan Institut Pertanian Bogor (IPB); Pilot Plant SEAFAST (Southeast Asian
Food and Agriculture Science and Technology) Center, IPB.
Bahan dan Alat
Bahan
Bahan-bahan yang digunakan untuk enkapsulasi adalah susu skim (Oxoid),
dan gum arab (Oxoid). Medium yang digunakan untuk pembuatan stok kultur
adalah medium Glucose Yeast Peptone (GYP) yang berisi antara lain glukosa 10
g, ekstrak khamir 10 g, bacto pepton 5 g, ekstrak daging sapi 2 g, Na asetat H2O
1,4 g, larutan garam 5 ml, tween 80 10 ml, dan H2O 1000 ml. Uji ketahanan
terhadap asam menggunakan media GYP, NaCl 0,85% steril dan HCl. Uji
ketahanan terhadap garam empedu menggunakan media GYP, NaCl 0,85% steril
dan oxgall (Oxoid). Bahan lain yang digunakan adalah Phosphat Buffer Saline
(PBS) dan alkohol.
Alat
Alat-alat yang digunakan adalah BUCHI mini spray dryer, Scanning
Electron Microscope (SEM ), sentrifus suhu rendah (refrigerated), refrigerator,
otoklaf, waterbath, laminar air flow, inkubator, neraca digital, pH-meter,
Bakteri Asam Laktat
Bakteri asam laktat (BAL) yang digunakan sebanyak sepuluh isolat yang
berpotensi probiotik, yaitu L. plantarum mar8, L. plantarum dmnd, L. plantarum
s4, L. plantarum sgn4, L. plantarum p8, L. plantarum lac3, L. plantarum d4, L.
plantarum pdgn3, L. plantarum pdbn6 yang diperoleh dari Laborator ium
Mikrobiologi Puslit Biologi LIPI Bogor dan L. plantarum sa28k dari
Laboratorium Mikrobiologi Departemen Ilmu dan Teknologi Pangan, Fakultas
Teknologi Pertanian IPB. Semua isolat tersebut telah berpotensi sebagai probiotik
berdasarkan sifat-sifat antimikroba serta ketahanan terhadap asam dan garam
empedu.
Pelaksanaan Penelitian
Secara garis besar penelitian terdiri dari beberapa tahap, meliputi seleksi
probiotik tahan panas, produksi biomasa dan suspensi, enkapsulasi probiotik dan
analisis.
Persiap an dan Pengawetan Probiotik
Pemurnian dan peremaja an dilakukan untuk memperoleh kultur murni dari
probiotik, menggunakan metode Harmayani et al. 2001 dengan modifikasi pada
media yang digunakan. Semua probiotik dimurnikan lebih dahulu dengan metode
goresan kuadran yang diulangi beberapa kali sampai diperoleh koloni terpisah
dengan menggunakan media GYP. P robiotik yang telah dimurnikan, disegarkan
dan diperbanyak. Kultur stok dalam agar GYP disimpan pada suhu rendah (suhu
4-5 oC).
Seleksi Probiotik Tahan Panas
Pengujian ketahanan panas merupakan kriteria seleksi untuk memperoleh
probiotik yang paling tahan terhadap panas, menggunakan metode tabung
17
suhu yang digunakan 100 oC. Dar i sepuluh probiotik yang ada, akan dipilih dua probiotik terbaik yang akan dienkapsulasi.
Perbanyakan probiotik pada medium cair GYP dilakukan dengan
menginokulasikan probiotik ke dalam 10 ml media GYP cair steril lalu diinkubasi
pada 37 oC selama 24 jam, dan dihitung jumlah awal bakteri sebelum perlakuan pemanasan.
Pengujian dilakukan dengan cara tabung reaksi yang berisi 4,5 ml media
GYP cair dipanaskan dalam penangas air sampai bagian dalam media mencapai
suhu 100 oC. Pengukuran suhu dilakukan dengan mencelupkan termometer langsung ke tabung kontrol. Sebanyak 0,5 ml suspensi probiotik uji dimasukkan
ke dalam tabung reaksi kemudian dikocok dengan alat vortex 2-3 detik dan segera
dimasukkan ke dalam penangas air selama 1 menit. Setelah pemanasan
dilakukan pemupukan pada 37 oC selama 24 jam dan dihitung jumlah koloni untuk masing-masing probiotik . Ketahanan panas probiotik dihitung dengan
rumus :
Ketahanan (%) = x 100%
Produksi Biomasa dan Suspensi Probiotik
Dua probiotik dengan ketahanan panas tertinggi yang telah ditumbuhkan
pada agar miring GYP, ditumbuhkan kembali pada media GYP cair selama 24
jam pada suhu 37 oC, yang selanjutnya digunakan sebagai kultur antara. Sebanyak 10 ml kultur antara ditumbuhkan pada GYP cair 1000 ml (1:100) yang digunakan
untuk produksi biomasa. Selanjutnya biomasa dipanen dengan cara sentrifugasi
(5000xg) selama 10 menit pada 4 oC, dan dicuci dua kali dengan buffer fosfat (Harmayani et al. 2001).
Dua probiotik dengan ketahanan panas tertinggi, ditumbuhkan kembali pada
media 10% susu skim cair steril selama 24 jam pada suhu 37 oC, yang selanjutnya digunakan sebagai kultur antara. Sebanyak 2,5 ml kultur antara dimasukkan ke
dalam 250 ml larutan susu skim 10% steril (b/v), kemudian diinkubasi selama 24
jam pada suhu 37 oC (Yulianto 2004) .
Log jumlah sel setelah pemanasan/ml
Probiotik terpilih (2 isolat)
Mikrokapsul Probiotik
Gambar 1 Diagram alir enkapsulasi probiotik dengan metode spray drying
Enkapsulasi Probiotik dan Spray Drying
Kultur probiotik yang digunakan sebelum dienkapsulasi adalah dalam
bentuk biomasa dan suspensi. Biomasa yang diperoleh diresuspensikan ke dalam
akuades steril dan dienkapsulasi dengan susu skim, gum arab serta campuran susu
skim dan gum arab. Perbandingan biomasa dan bahan enkapsulasi yang
digunakan adalah sebesar 3:7 (b/b) (Lian et al. 2002).
Probiotik dalam bentuk suspensi yang telah ditumbuhkan dalam susu skim
10% (b/v) langsung dikeringkan dengan spray dryer, kemudian selanjutnya Seleksi Probiotik
Tahan Panas
Produksi Biomasa dan Suspensi
Enkapsulasi dan Spray drying (skim, gum arab dan skim-gum arab)
19
suspensi dienkapsulasi dengan gum arab dengan perbandingan 1:1 (b/b) (Yulianto
2004).
Kombinasi perlakuan enkapsulasi adalah sebagai berikut : biomasa - susu
skim, biomasa - gum arab, biomasa - susu skim - gum arab, suspensi - susu skim
dan suspensi - susu skim - gum arab. Campuran dihomogenisasi, kemudian
dikeringkan dengan BUCHI mini spray dryer pada suhu inlet 100 oC dan suhu outlet 50 oC.
Penyimpanan Mikrokapsul Probiotik
Probiotik yang sudah dienkapsulasi (mikrokapsul) dimasukkan ke dalam
botol steril dan disimpan pada suhu rendah (4 oC) dan suhu kamar selama satu bulan untuk pengujian viabilitas probiotik.
Analisis
Ketahanan Probiotik Selama Spray Drying
Uji ketahanan probiotik selama spray drying dilakukan untuk mengetahui
pengaruh proses spray drying dan bahan enkapsulasi terhadap jumlah probiotik
yang masih tetap bertahan hidup. Ketahanan probiotik ditentukan dengan
membandingkan jumlah sel sesudah pengeringan semprot dan jumlah sel sebelum
pengeringan semprot. Untuk penghitungan kuantitatif jumlah probiotik dilakukan
dengan metode plate count (Lian et al. 2002)., yaitu probiotik yang dienkapsulasi
dengan metode spray drying diencerkan dengan beberapa seri pengenceran.
Sebanyak 0,1 g contoh diambil dan dimasukkan kedalam tabung reaksi yang
berisi 9,9 ml larutan pengencer steril (pengencer 10-2), kemudian dikocok pada alat vortex. Deretan pengenceran dipersiapkan sampai 10-8, kemudian sebanyak 1 ml contoh dipipet ke dalam cawan petri steril dan ditambahkan sebanyak 10 ml
media GYP Agar steril, lalu diinkubasi selama 48 jam pada suhu 37 oC.
Ketahanan (%) = x 100% Log jumlah sel sesudah pengeringan/g dry basis
Uji Ketahanan Terhadap pH Rendah (pH 2)
Ketahanan probiotik pada pH 2 dinyatakan dalam persen jumlah yang tahan
terhadap pH 2 dibandingkan jumlah pada kondidi normal (pH 7). Pengujian
ketahanan terhadap pH rendah (pH 2) dilakukan menurut metode Lian et al.
(2003), dengan cara mikrokapsul sebanyak 1 g dan 1 ml kultur dalam GYP yang
sudah berumur 24 jam dimasukkan dalam 9 ml GYP kontrol dan GYP asam yang
diatur pada pH 2 menggunakan HCl, kemudian divortex dan diinkubasi pada
suhu 37 oC selama 3 jam. Setelah itu dipanen dengan sentrifugasi pada 5000 x g selama 10 menit pada suhu 4 oC dan dicuci dua kali dengan buffer fosfat. Pellet diberi 10ml akuades dan selanjutnya dibuat seri pengenceran dan di taburkan
dalam cawan serta diinkubasi pada suhu 37 oC selama 48 jam. Jumlah koloni yang tumbuh dihitung baik yang ada di kontrol maupun yang di perlakuan. Ketahanan
terhadap asam dihitung berdasarkan rumus :
Ketahanan (%) = x 100%
Uji Ketahanan Terhadap Garam Empedu
Uji terhadap garam empedu dilakukan menurut Lian et al. (2003), dan
konsentrasi garam empedu yang digunakan 3% dengan penentuan akhir
menggunakan metode hitungan cawan. Mikrokapsul sebanyak 1 g dan 1 ml kultur
dalam GYP yang sudah berumur 24 jam, dimasukkan dalam 9 ml GYP (Kontrol)
dan GYP yang berisi garam oxgal 3% (b/v) kemudian divortex dan diinkubasi
pada suhu 37 oC selama 3 jam. Setelah itu dipanen dengan sentrifugasi pada 5000 x g selama 10 menit pada suhu 4 oC dan dicuci dua kali dengan buffer phospat. Selanjutnya pellet diresusitasi dengan 10 ml akuades dan selanjutnya dibuat seri
pengenceran dan di plating serta diinkubasi pada suhu 37 oC selama 48 jam. Jumlah koloni yang tumbuh dihitung baik yang ada di kontrol maupun yang di
perlakuan. Ketahanan terhadap garam empedu dihitung berdasarkan rumus :
Ketahanan (%) = x 100% Log jumlah sel pada media pH 2/ml
Log jumlah sel pada media normal/ml
Log jumlah sel pada media uji/ml
21
Kadar Air
Pada pengukuran kadar air menurut metode Apriyantono et al. (1989),
terlebih dahulu cawan dikeringkan dengan oven selama 15 menit dan didinginkan
dalam desikator kemudian ditimbang. Setelah itu ditimbang dengan cepat sampel
sebanyak 0,5 g. Selanjutnya cawan sampel dimasukkan ke dalam oven bersuhu
105 oC selama 6 jam. Cawan sampel didinginkan dalam desikator dan ditimbang beratnya. Cawan dan sampel dimasukkan kembali kedalam oven sampai diperoleh
berat yang tetap (3 desimal). Kadar air dihitung berdasarkan basis kering.
Analisis Total Kapang Khamir
Analisis kontaminasi kapang khamir dilakukan pada media YMA agar.
Mikrokapsul sebanyak 1 g secara aseptis dimasukkan ke dalam 9 ml akuades steril
dan divortex, selanjutnya diencerkan sampai pengenceran 10-2. Jumlah kontaminan dihitung dengan metode hitungan cawan dengan beberapa seri
pengenceran setelah diinkubasi pada 37 oC selama 48 jam. Kemudian dihitung total kapang dan khamir berdasarkan standar plate count (Fardiaz 1992).
Ukuran dan Bentuk Mikrokapsul
Diameter dan bentuk dari mikrokapsul diperiksa dengan Scanning Electron
Microscope, dengan cara mikrokapsul ditempatkan merata pada aluminium stubs
yang berupa lempengan berdiameter 6 mm kemudian divakum dengan gas argon
sampai stabil dan dilapisi emas dengan sputter coater selama 20 detik.
Selanjutnya aluminium stubs yang berisi sampel dimasukkan pada alat electron
microscope dan diamati diameter mikrokapsul serta bentuk mikroskopis dari
mikrokapsul (Lian et al. 2002).
Penghitungan Viabilitas Sel
Untuk penghitungan kuantitatif viabilitas sel dengan metoda plate count,
yaitu kultur bakteri yang dienkapsulasi dengan metoda spray drying diencerkan
dimasukkan kedalam tabung reaksi yang berisi 9,9 ml larutan pengencer steril
(diperoleh pengencera n 10-2), kemudian dilakukan pengocokan dengan vortex. Deretan pengenceran dipersiapkan sampai 10-8, kemudian sebanyak 1 ml contoh dipipet ke dalam cawan petri steril dan ditambahkan sebanyak 10 ml media GYP
Agar steril, lalu diinkubasi selama 48 jam pada suhu 37 oC.
Viabilitas probiotik dihitung berdasarkan rasio log jumlah bakt eri per gram
sesudah dan sebelum penyimpanan, dan dinyatakan dalam persen (%) (Lian et al.
2002). Rumus perhitungannya adalah sebagai berikut:
Viabilitas (%) = x 100% Log cfu/g dry basis probiotik sesudah penyimpanan
23
DAFTAR PUSTAKA
Adam MR, Moss MO. 1995. Food Mikrobiology. The Royal Society of
Chemistry, Cambridge, London.
Apriyantono A, Fardiaz D, Puspitasari NL, Sedarnawati, Budiyanto S. 1989. Petunjuk Laboratorium Analisa Pangan. Bogor: Pusat Antar Universitas IP B.
Axellson L. 1998. Lactid acid bacteria: classification and physiology. Didalam: Salminen S dan Wright AV, editor. Lactid Acid Bacteria: Microbiology and Funcional Aspects. Ed ke-2.. Marcell Dekker, Inc, New York.
Chandramouli V, Kailasapathy K, Peiris P, Jones M. 2004. An improved method of microencapsulation and its evaluation to protect Lactobacillus spp. in simulated gastric condition. J Microb Methods 56:27– 35.
Chou LS, Weimer B. 1999. Isolation and characterization of acid and bile tolerant isolates from strains of Lactobacillus acidophilus. J Dairy Sci 82:23-31.
Corzo G, Gilliland SE. 1999. Measurement of bile salt hydrolase activity from Lactobacillus acidophilus based on dissapearance of conjugated bile salts. J Dairy Sci 82:466-471.
Drouault S, G Corthier, SD Erlich dan P Renault. 1999. Survival physiology and lysis of Lactococcus lactis in the digestive tract. Appl Env Microbiol 65:4881-4886.
Elida M. 2002. Profil bakteri asam laktat dari dadih yang difermentasi dalam berbagai jenis bambu dan potensinya sebagai probiotik [tesis]. Bogor: Program Pasca Sarjana, Institut Pertanian Bogor.
Erickson KL, Hubband NE. 2000. Probiotic immunomodulationin health and disease. J Nutr 130:403S -409S.
Evanikastri. 2003. Isolasi dan karakterisasi bakteri asam laktat dari sampel klinis yang berpotensi sebagai probiotik [tesis]. Bogor: Program Pasca Sarjana, Institut Pertanian Bogor.
Fardiaz, S. 1992. Mikrobiologi Pangan I. PT Gramedia, Jakarta.
Filkova I, Mujumdar AS. 1995. Industrial Spray Drying Systems. Di dalam : Mujumdar AS, editor. Handbook of Industrial Drying. Marcell Dekker, New York.
Frazier WC dan DC Westhoff. 1988. Food Microbiology. 4th ed. Mc Graw-Hill Book Co., New York.
Gomes AMP, Malcata GA. 1999. Bifidobacterium ssp. and L. Acidophilus: Biological , technological and therapeutical properties relevant for use as probiotics. Review. Trend in Food Sci Tech 10:139-157.
Gunawan. 2003. Uji kemampuan probiosis isolat Lactobacillus strain lokal dan analisis asam organik yang dihasilkan dalam menurunkan kolesterol secara invitro [skripsi]. Purwokerto : Fakultas Biologi, Universitas Jendral Soedirman.
Harmayani E, Ngatirah, Rahayu ES, Utami T. 2001. Ketahanan dan viabilitas probiotik bakteri asam laktat selama proses pembuatan kultur kering dengan metode freeze dan spray drying. J Tek dan Ind Pangan 12:126-132.
Jacobsen CN, VR Nielsen, AE Hayford, PL Moller, KF Michaelsen, AP Erregaard, B Sandstrom, M Tvede dan M Jakobsen. 1999. Screening of probiotic activities of forty seven strains of Lactobacillus spp. by in vitro techniques and evaluation of the colonization ability of five selected strains in human. J Appl Env Microbiol 65:4949-4956.
Jay JM. 2000. Modern Food Microbiology. Chapman and Hall. New York, USA.
Jenie BSL, Rini SE. 1995. Aktivitas antimikroba dari beberapa species Lactobacillus terhadap mikroba pathogen dan perusak makanan. Bul Tek dan Ind Pangan 6:46-51.
Kusumawati N. 2002. Seleksi bakteri asam laktat indigenus sebagai galur probiotik dengan kemampuan mempertahankan keseimbangan mikroflora usus feses dan mereduksi kolesterol serum darah tikus [tesis]. Bogor: Program Pasca Sarjana, Institut Pertanian Bogor.
Lian WC, Hsio HC, Chou CC. 2002. Survival of Bifidobacterium longum after spray drying. Int J Food Microbiol 74:79– 86.
Lian WC, Hsio HC, Chou CC. 2003. Viability of microencapsulated Bifidobacteria in simulated gastric juice and bile solution. Int J Food Microbiol 86:293-301.
Mattila-Sandholm T. 1999. Probiotics: towards demonstrating efficacy. Trends in Food Sci and Tech 10:393-399.
Mosilhey SH. 2003. Influence of different capsule materials on the physiological properties of microencapsulated Lactobacillus acidophilus. Institute of Food Technology, Faculty of Agriculture University of Bonn. 153 pages.
Ngatirah A, Harmayanti ES dan T Utami. 2000. Seleksi bakteri asam laktat sebagai agensia probiotik yang berpotensi menurunkan kolesterol. Di Dalam : Prosiding Seminar Nasional Industri Pangan. Surabaya: Perhimpunan Ahli Teknologi Pangan Indonesia. hlm 63-70.
25
Pessi T, Sutas Y, Marttinen A, Isolauri E. 1998. Probiotics reinforce mucosal degradation of antigens in rats: Implications for therapeutic use of probiotics. J Nutrition 128: 2313-2318.
Picot A, Lacroix C. 2004. Encapsulation of Bifidobacteria in whey protein-based microcapsules and survival in simulated gastrointestinal condition and in yoghurt. Int Dairy J 14:505– 515.
Ray B. 1996. Probiotic of lactic acid bacteria. Science or Myth. Di Dalam: NATO ASI Series, editor. Lactic acid bacteria. Current advances in metabolism, genetic and application . Volume 5(98). Springer-Verlag. Germany.
Reid G. 1999. The scientific basis for probiotic strain of Lactobacillus. Minireview. J Appl Env Microbiol 65:3763-3766.
Risch AJ. 1995. Encapsulation: overview of uses and techniques. Didalam Risch, AJ dan GA Reineccius. Encapsulation and Controlled Release of Food Ingredients. American Chemical Society, Washington D.C.
Rolfe RD. 2000. The role of probiotic culture in the control of gastrointestinal health. J Nutr Supplement 130: 396S -402S.
Roos de NM, Katan MB. 2000. Effect of probiotic bacteria on diarrhea, lipid metabolism and carcinogenesis: a review of papers published between 1988 and 1998. Am J Clin Nutr 71:405-411.
Salminen S dan AV Wright. 1998. Lactic Acid Bacteria. Marcell Dekker Inc. New York
Shin H, Lee J, Pestka JJ, Ustunol Z. 2000. Viability of Bifidobacteria in commercial dairy products during refrigerated storage. J Food Prot 63: 327-331.
Shortt C. 1999. The probiotic century: Historical and current perspectives. Review. Trend Food Sci and Tech 10: 411-417.
Siegumfeldt H, Rechninger BK, Jacobsen M. 2000. Dynamic changes of intracellular pH in individual lactic acid bacterium cells in response to a rapid drop in extracellular pH. J Appl Env Microbiol 66:2330-2335
Smet ID, L van Hoorde, MV Woestyne, H Christiaens dan W Verstraete. 1995. Significance of bile salt hydrolytic activities of lactobacilli. J Appl Bacteriol 79:292-301
Suita -Cruce P, Goulet J. 2001. Improving probiotic survival rates. Food Tech 55: 36-40.
Swaisgood. 1991. Immobilized Enzymes. Aplication to Bioprocessing of Food. Di dalam : Fox PF, editor. Food Enzymology Vol 2. Elsevier Apllied Science, London.
Teixeira PC, Castro MH, Malcata FX, Kirby KM. 1995. Survival of Lactobacillus delbruechii ssp. bulgaricus following spray drying. J Food Sci 78: 1025-1031.
To BCS, Etzel MR. 1997. Spray drying, freeze drying, or freezing of three different lactic acid bacteria species. J Food Sci 62: 576-578.
Widodo, Soeparno, Wahyuni E. 2003. Bioenkapsulasi probiotik (Lactobacillus casei) dengan pollard dan tepung terigu serta pengaruhnya terhadap viabilitas dan laju pengasaman. J Tek dan Industri Pangan 14:98-106.
Wirawati CU. 2002. Potensi bakteri asam laktat yang diisolasi dari tempoyak sebagai probiotik. [tesis]. Bogor: Program Pasca Sarjana, Institut Pertanian Bogor.
Young SL, Sarda X, Rosenberg M. 1993. Microencapsulating properties of whey proteins with carbohydrate. J Dairy Sci 76:2878-2885.
Yulianto E. 2004. Uji viabilitas dan fisiologis Lactobacillus sp. sebagai minuman probiotik penurun koles terol dalam bentuk serbuk [skripsi]. Yogyakarta: Fakultas Biologi, Universitas Gadjah Mada.
ENKAPSULASI Lactobacillus plantarum
DENGAN SUSU SKIM
DAN GUM ARAB SERTA KETAHANANNYA SETELAH
SPRAY DRYING DAN VIABILITASNYA SELAMA
PENYIMPANAN
(Survival of Lactobacillus plantarum Encapsulated with Skim Milk and Arabic Gum after Spray Drying and Its Viability during Storage)
ABSTRACT
Ten isolates of Lactobacillus plantarum were selected for its survival after heating. Two isolates which showed the highest survival rate were then encapsulated with skim milk, arabic gum and mixtured of skim milk - arabic gum. The probiotic cultures were prepared in the form of suspension and biomass and then spray dried. Survival of the probiotic encapsulated in the form of biomass after spray drying, and the viability after one month of storage at room temperature were higher than the suspension. It was found that the survival of probiotic bacteria in different encapsulation materials varied after spray drying. The number of probiotic survivals decreased after spray drying for all encapsulation materials tested ranged from less than 1 log cycle to 2 log cycles. Encapsulation of probiotic with three types combination of encapsulating materials showed that no significant difference of survivals after spray drying and viability after one month of storage were observed. The remained number of the probiotic after one month of storage at 4 oC and room temperature was 104-107 cfu/gand 102-105 cfu/g, respectively.
Keyword: encapsulation, probiotic, skim milk, arabic gum
PENDAHULUAN
Probiotik merupakan suplemen mikroba hidup yang memberikan efek
menguntungkan bagi inang dengan meningkatkan keseimbangan mikroba
pencernaan. Keuntungan yang diperoleh meliputi pengendalian infeksi
pencernaan, pengendalian tingkat kolesterol dan memiliki aktivitas
antikarsinogenik (Krasaekoopt et al. 2003) .
Interna tional Dairy Federation merekomendasikan bahwa bakteri harus
aktif dan berlimpah dalam produk dan harus terdapat sekitar 107 cfu/g berat kering. Namun beberapa penelitian menunjukkan bahwa bakteri mungkin tidak
produk dan kondisi penyimpanan (Sultana et al. 2000 dan Chandramouli et al.
2004).
Mikroenkapsulasi berbagai kultur bakteri termasuk probiotik telah menjadi
praktek umum untuk meningkatkan masa simpan dan mengubahnya menjadi
bentuk untuk mempermudah penggunaannya. Terdapat beberapa teknik seperti
spray drying dan freeze drying untuk mengenkapsulasi kultur dan mengubahnya
menjadi bentuk bubuk terkonsentrasi (Krasaekoopt et al. 2003).
Bubuk kering hasil spray drying yang mengandung sejumlah besar
mikroorganisme hidup merupakan bentuk yang sesuai untuk tujuan penyimpanan
dan aplikasi dalam pengembangan pangan fungsional. Namun kendala utama
kultur probiotik yang di spray drying adalah kehilangan viabilitas yang terjadi
selama pengolahan dan penyimpanan bubuk. Tingkat survival kultur selama spray
drying dan penyimpanan selanjutnya tergantung pada beberapa faktor, meliputi
spesies, strain kultur, kondisi pengeringan, inokulum dan medium yang digunakan
dan bahan pelindung (Desmond et al. 2002).
Tujuan penelitian ini adalah untuk memperoleh bahan enkapsulasi L.
plantarum dalam bentuk biomasa dan suspensi yang sesuai dengan menggunakan
susu skim, gum arab serta kombinasi susu skim dan gum arab terhadap ketahanan
probiotik setelah spray drying serta viabilitasnya setelah penyimpanan selama
satu bulan pada suhu rendah (4 oC) dan suhu kamar.
BAHAN DAN METODE
Bakteri Asam Laktat
Bakteri asam laktat (BAL) yang digunakan sebanyak sepuluh isolat yang
berpotensi probiotik, yaitu L. plantarum mar8, L. plantarum dmnd, L. plantarum
s4, L. plantarum sgn4, L. plantarum p8, L. plantarum lac3, L. plantarum d4, L.
plantarum pdgn3, L. plantarum pdbn6 yang diperoleh dari Laboratorium
Mikrobiologi Puslit Biologi LIPI Bogor dan L. plantarum sa28k dari
Laboratorium Mikrobiologi Departemen Ilmu dan Teknologi Pangan, Fakultas
29
berdasarkan sifat-sifat antimikroba serta ketahanan terhadap asam dan garam
empedu.
Persiapan dan Pengawetan Probiotik
Pemurnian dan peremajaan dilakukan untuk memperoleh kultur murni dari
probiotik, menggunakan metode Harmayani et al. 2001 dengan modifikasi pada
media yang digunakan. Semua probiotik dimurnikan lebih dahulu dengan metode
goresan kuadran yang diulangi beberapa kali sampai diperoleh koloni terpisah
dengan menggunakan media GYP. Probiotik yang telah dimurnikan, disegarkan
dan diperbanyak. Kultur stok dalam agar GYP disimpan pada suhu rendah (suhu
4-5 oC).
Seleksi Probio tik Tahan Panas
Pengujian ketahanan panas merupakan kriteria seleksi untuk memperoleh
probiotik yang paling tahan terhadap panas, menggunakan metode tabung
(Murhadi 1994) dengan sedikit perubahan yaitu media yang digunakan GYP dan
suhu yang digunakan 100 oC. Dari sepuluh probiotik yang ada, akan dipilih dua probiotik terbaik yang akan dienkapsulasi.
Perbanyakan probiotik pada medium cair GYP dilakukan dengan
menginokulasikan probiotik ke dalam 10 ml media GYP cair steril lalu diinkubasi
pada 37 oC selama 24 jam, dan dihitung jumlah awal bakteri sebelum perlakuan pemanasan.
Pengujian dilakukan dengan cara tabung reaksi yang berisi 4,5 ml media
GYP cair dipanaskan dalam penangas air sampai bagian dalam media mencapai
suhu 100 oC. Pengukuran suhu dilakukan dengan mencelupkan termometer langsung ke tabung kontrol. Sebanyak 0,5 ml suspensi probiotik uji dimasukkan
ke dalam tabung reaksi kemudian dikocok dengan alat vortex 2-3 detik dan segera
dimasukkan ke dalam penangas air selama 1 menit. Setelah pemanasan
untuk masing-masing probiotik. Ketahanan panas probiotik dihitung dengan
rumus :
Ketahanan (%) = x 100%
Produksi Biomasa dan Suspensi Probiotik
Dua probiotik dengan ketahanan panas tertinggi yang telah ditumbuhkan
pada agar miring GYP, ditumbuhkan kembali pada media GYP cair selama 24
jam pada suhu 37 oC, yang selanjutnya digunakan sebagai kultur antara. Sebanyak 10 ml kultur antara ditumbuhkan pada GYP cair 1000 ml (1:100) yang digunakan
untuk produksi biomasa. Selanjutnya biomasa dipanen dengan cara sentrifugasi
(5000xg) selama 10 menit pada 4 oC, dan dicuci dua kali dengan buffer fosfat (Harmayani et al. 2001).
Dua probiotik dengan ketahanan panas tertinggi, ditumbuhkan kembali pada
media 10% susu skim cair steril selama 24 jam pada suhu 37 oC, yang selanjutnya digunakan sebagai kultur antara. Sebanyak 2,5 ml kultur antara dimasukkan ke
dalam 250 ml larutan susu skim 10% steril (b/v), kemudian diinkubasi selama 24
jam pada suhu 37 oC (Yulianto 2004).
Enkapsulasi Probiotik dan Spray Drying
Kultur probiotik yang digunakan sebelum dienkapsulasi adalah dalam
bentuk biomasa dan suspensi. Biomasa yang diperoleh diresuspensikan ke dalam
akuades steril dan dienkapsulasi dengan susu skim, gum arab serta campuran susu
skim dan gum arab. Perbandingan biomasa dan bahan enkapsulasi yang
digunakan adalah sebesar 3:7 (b/b) (Lian et al. 2002).
Probiotik dalam bentuk suspensi yang telah ditumbuhkan dalam susu skim
10% (b/v) langsung dikeringkan dengan spray dryer, kemudian selanjutnya Log jumlah sel setelah pemanasan/ml
31
suspensi dienkapsulasi dengan gum arab dengan perbandingan 1:1 (b/b) (Yulianto
2004).
Kombinasi perlakuan enkapsulasi adalah sebagai berikut : biomasa - susu
skim, biomasa - gum arab, biomasa - susu skim - gum arab, suspensi - susu skim
dan suspensi - susu skim - gum arab. Campuran dihomogenisasi, kemudian
dikeringkan dengan BUCHI mini spray dryer pada suhu inlet 100 oC dan suhu outlet 50 oC.
Penyimpanan Mikrokapsul Probiotik
Probiotik yang sudah dienkapsulasi (mikrokapsul) dimasukkan ke dalam
botol steril dan disimpan pada suhu rendah (4 oC) dan suhu kamar selama satu bulan untuk pengujian viabilitas probiotik.
Ketahanan Probiotik Selama Spray Drying
Uji ketahanan probiotik selama spray drying dilakukan untuk mengetahui
pengaruh proses spray drying dan bahan enkapsulasi terhadap jumlah probiotik
yang masih tetap bertahan hidup. Ketahanan probiotik ditentukan dengan
membandingka n jumlah sel sesudah pengeringan semprot dan jumlah sel sebelum
pengeringan semprot. Untuk penghitungan kuantitatif jumlah probiotik dilakukan
dengan metode plate count (Lian et al. 2002)., yaitu probiotik yang dienkapsulasi
dengan metode spray drying diencerkan dengan beberapa seri pengenceran.
Sebanyak 0,1 g contoh diambil dan dimasukkan kedalam tabung reaksi yang
berisi 9,9 ml larutan pengencer steril (pengencer 10-2), kemudian dikocok pada alat vortex. Deretan pengenceran dipersiapkan sampai 10-8, kemudian sebanyak 1 ml contoh dipipet ke dalam cawan petri steril dan ditambahkan sebanyak 10 ml
media GYP Agar steril, lalu diinkubasi selama 48 jam pada suhu 37 oC.
Ketahanan (%) = x 100% Log jumlah sel sesudah pengeringan/g dry basis
Penghitungan Viabilitas Sel
Untuk penghitungan kuantitatif viabilitas sel dengan metoda plate count,
yaitu kultur bakteri yang dienkapsulasi dengan metoda spray drying diencerkan
dengan beberapa seri pengenceran. Sebanyak 0,1 g contoh diambil dan
dimasukkan kedalam tabung reaksi yang berisi 9,9 ml larutan pengencer steril
(diperoleh pengenceran 10-2), kemudian dilakukan pengocokan dengan vortex. Deretan pengenceran dipersiapkan sampai 10-8, kemudian sebanyak 1 ml contoh dipipet ke dalam cawan petri steril dan ditambahkan sebanyak 10 ml media GYP
Agar steril, lalu diinkubasi selama 48 jam pada suhu 37 oC.
Viabilitas probiotik dihitung berdasarkan rasio log jumlah bakteri per gram
sesudah dan sebelum penyimpanan, dan dinyatakan dala m persen (%) (Lian et al.
2002). Rumus perhitungannya adalah sebagai berikut:
Viabilitas (%) = x 100%
Kadar Air
Pada pengukuran kadar air menurut metode Apriyantono et a l. (1989),
terlebih dahulu cawan dikeringkan dengan oven selama 15 menit dan didinginkan
dalam desikator kemudian ditimbang. Setelah itu ditimbang dengan cepat sampel
sebanyak 0,5 g. Selanjutnya cawan sampel dimasukkan ke dalam oven bersuhu
105 oC selama 6 jam. Cawan sampel didinginkan dalam desikator dan ditimbang beratnya. Cawan dan sampel dimasukkan kembali kedalam oven sampai diperoleh
berat yang tetap (3 desimal). Kadar air dihitung berdasarkan basis kering. Lo