STANDARDISASI EKSTRAK ETANOL DAUN
ANGSANA (Pterocarpus indicus Willd.)
SKRIPSI
RISDA YULIANTI
109102000013
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
STANDARDISASI EKSTRAK ETANOL DAUN
ANGSANA (Pterocarpus indicus Willd.)
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi (S.Far
)
RISDA YULIANTI
109102000013
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
Program studi : Farmasi
Judul : STANDARDISASI EKSTRAK ETANOL DAUN ANGSANA (Pterocarpus indicus Willd)
Standardisasi ekstrak tanaman obat perlu dilakukan untuk melindungi masyarakat dari penggunaan obat alami yang tidak memenuhi persyaratan mutu. Standardisasi ekstrak etanol daun p.indicus ini dilakukan terhadap tiga tempat tumbuh yang berbeda yaitu Tanggerang selatan, Bogor, dan Yogyakarta. Tujuan dari penelitian ini adalah menetapkan beberapa parameter spesifik dan non spesifik sehingga menjamin bahwa simplisia tersebut mempunyai mutu dan nilai parameter yang terukur. Hasil standardisasi parameter spesifik menunjukan organoleptik ekstrak (bentuk ekstrak kental, berwarna hijau coklat kehitaman, bau lemah dan tidak khas dan memiliki rasa pahit), dengan kandungan senyawa larut dalam air (22,882 ±0,4119 - 24,437 ±3,9825) dan larut etanol (13,624 ±1,206 -15,374 ±0,715) dan kadar total flavonoid ( 3,88824 % - 4,02045 %). Hasil uji parameter non spesifik menunjukan kadar air (13,843 ±3,591 - 20,595 ±2,133), susut pengeringan (15,852 ±1,576 - 33,367 ±2,843), kadar abu ekstrak (5,514 ±0,565 - 7,631 ±1,5320), dan kadar abu tidak larut asam (0,058 ±0,039 - 1,486 ±0,246) serta bobot jenis (1,008 ±0,002 -1,021±0,011). Hasil pengujian cemaran mikroba (60* - 130* koloni/g) sedangkan pengujian cemaran kapang khamir (0 - 45* koloni/g) serta hasil pengujian logam arsen (0,208 x10-3µg/kg - 0,956 x10-3 µg/kg), timbal (0,002388 - 0,003357 mg/kg), dan cadmium (0,000011 - 0,000021 mg/kg).
Program study : Pharmacy
Title : THE STANDARDIZATION OF ETHANOL
EXTRACT OF ANGSANA LEAVES (Pterocarpus indicus Willd)
Standardization of medicinal plant extract is has to be done to protect public from the use of natural remedies that do not fulfill quality requirements. The process of standardization of ethanol’s extract of p.indicus leaves were conducted in three different growing places, they are southern of Tangerang, Bogor, and Yogyakarta. The purpose of this research is to determine specific and non-specific parameter which capable to ensure that these botanicals have quality and value of measured parameter. The results of parameter specific standardization shown organoleptic extract (thick, blackish brown green color, weak and do not have special odor, and bitter tasted), with the content of water-soluble compounds (22.882 ± 0.4119 to 24.437 ± 3.9825), and ethanol-soluble (13.624 ± 1.206 -15.374 ± 0.715), and total flavonoid levels (3.88824% - 4.02045%). The result of non-specific parameters test shown that the content of water (13.843 ± 3.591 to 20.595 ± 2.133), drying shrinkage (15.852 ± 1.576 to 33.367 ± 2.843), ash extract (5.514 ± 0.565 to 7.631 ± 1.5320), insoluble ash in acid (0.058 ± 0.039 to 1.486 ± 0.246), and specific gravity (1.008 ± 0.002 -1.021 ± 0.011). The microbial contamination test resulted (60* - 130*colonies/g), while the test of mold yeasts contamination (0 - 45* colonies /g) as well as arsenic (0.208 x10-3 mg/kg - 0.956 x10-3 mg/kg), material lead (0.002388 to 0.003357 mg/kg), and cadmium (0.000011 to 0.000021 mg / kg).
Assalamu’alaikum warahmatullah wabarakatuh.
Alhamdulillah, syukur kepada Allah dengan memanjatkan segala puji kepada-Nya, Shalawat dan salam kepada nabi dan rasul paling mulia, junjungan kami Muhammad SAW, dengan segala rahmat dan karunia-Nya penulis dapat menyelesaikan penelitian dan penulisan skripsi dengan judul “STANDARDISASI EKSTRAK ETANOL DAUN ANGSANA (Pterocarpus indicus Willd)”. Skripsi ini disusun untuk memenuhi tugas akhir sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Kedokteran dan Ilmu Kesehatan program studi farmasi UIN Syarif Hidayatullah Jakarta.
Saya menyadari tanpa bantuan dan bimbingan dari berbagai pihak dari masa perkuliahan sampai pada penyusunan skripsi ini sangatlah sulit bagi saya untuk menyelesaikan skripsi ini. oleh karena itu pada kesempatan ini, penulis menyampaikan ucapan terimakasih kepada pihak-pihak terkait yang telah memberi dukungan kepada penulis.
1. Allah SWT, berkat rahmat dan hidayahnya dengan izinnya penulis dapat menyelesaikan skripsi ini
2. Ibu Puteri Amelia, M.Farm., Apt dan Ibu Marissa Angelina, M.farm.,Apt yang memiliki andil besar dalam proses penelitian dan penyelesaian tugas akhir saya ini, semoga segala bantuan dan bimbingan ibu, mendapat pahala yang berlipat ganda dari Allah SWT.
3. Dr. Linar zalinar Udin selaku Kepala Pusat Penelitian Kimia Lembaga Ilmu Pengetahuan Indonesia atas penggunaan segala fasilitas.
4. Ibu Lia, bu Mega, bu Lala, bu Hani, pa Udin dan mas Lili terimakasih atas segala bantuan selama penelitian.
5. Prof. Dr.(hc) dr. M. K. Tadjudin, Sp. And selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta.
serta dukungan kepada ananda baik moril maupun materil. Kepada kakaku Ervan Ruswandi, Nurliana dan adik-adikku Dian dan Alwi serta saudara-saudaraku yang telah banyak menghibur dan memberikan do’a serta semangat hingga penulis dapat menyelsaikan skripsi ini.
8. Sahabat penulis Liza, Dina yang telah banyak membantu penulis dalam suka dan duka. Mila, Mutia, Caca, Widya, Ziah yang selama 4 tahun telah menjadi sahabat-sahabat yang paling baik.
9. Sahabat tercinta Aida, Siska, Eca, Elih, yang selalu mendengarkan keluhan dengan sabar selama penelitian.
10.Teman seperjuangan penelitian Neneng, Rani dan Irsyad atas kerjasama selama penelitian dan tema-teman seperjuangan farmasi angkatan 2009 khusunya PHENOL, yang sama-sama berjuang selama 4 tahun untuk menyelesaikan skripsi ini.
Semoga Allah SWT senantiasa memberikan balasan yang lebih baik kepada pihak-pihak yang telah membantu kelancaran dalam penelitian ini.
Wassalamu’alaikum Wr. Wb
Jakarta, September 2013
Sebagai sivitas akademik Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta, saya yang bertanda tangan di bawah ini:
Nama : Risda yulianti
NIM : 109102000013
Program Studi : Farmasi
Fakultas : Kedokteran dan Ilmu Kesehatan Jenis Karya : Skripsi
demi pengembangan ilmu pengetahuan, saya menyetujui skripsi/karya ilmiah saya, dengan judul :
STANDARDISASI EKSTRAK ETANOL DAUN ANGSANA (Pterocarpus indicus Willd)
untuk dipublikasikan atau ditampilkan di internet atau media lain yaitu Digital Library Perpustakaan akademik Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta untuk kepentingan akademik sebatas sesuai dengan Undang-Undang Hak Cipta.
Demikian pernyataan persetujuan publikasi karya ilmiah ini saya buat dengan sebenarnya.
Halaman
HALAMAN JUDUL ... i
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
LEMBAR PENGESAHAN SKRIPSI ... v
ABSTRAK ... vi
ABSTRACT ... vii
KATA PENGANTAR ... viii
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... x
DAFTAR ISI ... xi
2.6.3 Standardisai menjamin aspek keamanan ... 11
2.6.4 Standardisai meningkatkan nilai ekonomi ... 11
2.9.1 Spektofotometri Serapan Atom ... 18
2.9.1 Spektofotometri UV-Vis ... 19
BAB 3 METODOLOGI PENELITIAN ... 21
3.1 Tempat dan Waktu Penelitian ... 21
3.2 Bahan ... 21
3.2.1 Tanaman ... 21
3.2.2 Bahan Kimia ... 21
3.3 Alat ... 21
3.4 Prosedur Penelitian ... 22
3.4.1 Penyiapan Bahan Uji ... 22
3.4.2 Standardisasi ekstrak etanol daun Angsana (Pterocarpus indicus Willd) ... 23
BAB 4 HASIL PENELITIAN DAN PEMBAHASAN ... 31
4.1 Hasil Penelitian ... 31
4.1.1 Hasil Determinasi Tanaman ... 31
4.1.2 Hasil Standardisasi ekstrak etanol daun P.indicus .... 31
4.1.2.1 Hasil Rendemen ekstrak ... 31
4.1.2.2 Hasil Penapisan Fitokimia ... 32
4.1.2.3 Parameter Spesifik ... 32
4.1.2.4 Parameter non spesifik ekstrak ... 33
4.2 Pembahasan ... 34
BAB 5 KESIMPULAN DAN SARAN ... 41
5.1 Kesimpulan ... 41
5.2 Saran ... 41
DAFTAR PUSTAKA ... 42
Halaman
Gambar 1 Angsana (Pterocarpus indicus Willd.) ... 5
Gambar 2 Skema umum komponen pada alat SSA ... 18
Gambar 3 Profil KLT daun P.indicus ... 36
Gambar 4 Rotary evaprator ... 46
Gambar 5 Furnace ... 46
Gambar 6 Oven ... 46
Gambar 7 Perkolator ... 46
Gambar 8 Autoklaf ... 46
Gambar 9 Desikator ... 46
Gambar 10 Spectroscopy Serapan Atom ... 46
Gambar 11 Spektrofotometri UV-Vis ... 46
Gambar 12 Ekstrak Tangsel ... 47
Gambar 13 Ekstrak Bogor ... 47
Gambar 14 Ekstrak Yogyakarta ... 47
Gambar 15 Standar Kuersetin ... 47
Gambar 16 Nutrien Agar ... 47
Halaman
Tabel 4.1 Hasil Rendemen Ekstrak ... 17
Tabel 3.1 Penapisan Fitokimia ... 25
Tabel 3.2 Parameter Spesifik Ekstrak dengan pancaindra ... 26
Tabel 3.3 Parameter spesifik ekstrak ... 27
Tabel 3.4 Parameter non spesifik ekstrak ... 28
Tabel L.6 Senyawa terlarut dalam air ... 60
Tabel L.7 Senyawa terlarut dalam etanol ... 62
Tabel L.8 Kadar air ... 64
Tabel L.9 Susut pengeringan ... 66
Tabel L.10 Kadar abu ... 68
Tabel L.11 Kadar abu tidak larut asam ... 70
Tabel L.12 Bobot jenis ... 71
Tabel L.13 Cemaran mikroba ... 73
Tabel L.14 Cemaran kapang/khamir ... 74
Halaman
Lampiran 1 Alat-alat penelitian ... 49
Lampiran 2 Bahan-bahan penelitian ... 50
Lampiran 3 Hasil Determinasi Tumbuhan ... 51
Lampiran 4 Hasil Pengujian AAS P.Indicus Yogyakarta ... 52
Lampiran 5 Hasil Pengujian AAS P.Indicus Bogor ... 53
Lampiran 6 Hasil Pengujian AAS P.Indicus Tangsel ... 54
Lampiran 7 Hasil Cemaran Mikroba ... 55
Lampiran 8 Hasil Cemaran Kapang/Khamir ... 56
Lampiran 9 Alur Penelitian ... 57
Lampiran 10 Perhitungan Rendemen Ekstrak ... 58
Lampiran 11 Perhitungan Senyawa larut air ... 59
Lampiran 12 Perhitungan senyawa larut etanol ... 60
Lampiran 13 Perhitungan Kadar air ... 58
Lampiran 14 Perhitungan Susut pengeringan ... 59
Lampiran 15 Perhitungan Kadar Abu ... 60
Lampiran 16 Perhitungan Kadar abu tidak larut asam ... 58
Lampiran 17 Perhitungan Bobot jenis ... 59
Lampiran 18 Perhitungan Cemaran Mikroba ... 60
Lampiran 19 Perhitungan Cemaran Kapang/Khamir ... 58
Lampiran 20 Perhitungan Kadar total Flavonoid ... 59
Lampiran 21 Perhitungan Cemaran logam berat ... 59
1.1LATAR BELAKANG
Indonesia merupakan salah satu negara dengan kekayaan hayati terbesar di dunia yang memiliki lebih dari 30.000 spesies tanaman tingkat tinggi. Hingga saat ini, tercatat 7000 spesies tanaman telah diketahui khasiatnya, namun hanya kurang dari 300 tanaman yang telah digunakan sebagai bahan baku industri farmasi secara regular. Sekitar 1000 jenis tanaman telah diidentifikasi dari aspek botani sistematik tumbuhan dengan baik. World Health Organization (WHO) pada tahun 2008 mencatat bahwa 68% penduduk dunia masih menggantungkan sistem pengobatan tradisional yang mayoritas melibatkan tumbuhan untuk menyembuhkan penyakit dan lebih dari 80% penduduk dunia menggunakan obat herbal untuk mendukung kesehatan mereka (Saifudin, et al., 2011).
Tumbuhan obat Indonesia atau saat ini lebih dikenal dengan nama obat bahan alam Indonesia, telah semakin banyak dimanfaatkan baik sebagai obat tradisional Indonesia (jamu), obat herbal terstandar ataupun fitofarmaka. Obat tradisional atau jamu telah diakui keberadaannya sejak zaman dahulu baik di Indonesia maupun negara-negara lainnya dan sampai sekarang tetap dimanfaatkan dan bahkan cenderung meningkat.
Tumbuhan obat di Indonesia digunakan untuk meningkatkan kesehatan (promotif), memulihkan kesehatan (rehabilitatif), pencegahan penyakit (preventif) dan penyembuhan (kuratif). Namun eksistensinya belum dapat disetarakan dengan pelayanan pengobatan modern dengan menggunakan obat kimia, karena memang belum seluruhnya teruji keamanan dan manfaatnya (BPOM, 2005). Untuk itu perlu dilakukan penelitian berkesinambungan terkait efek farmakologi, toksisitas, farmakokinetik zat berkhasiat, penetapan mutu dan keamanan bahan baku ekstrak yang di gunakan di dalam penunjang kesehatan (Saifudin, et al., 2011).
Pterocarpus indicus Willd merupakanan tanaman hutan yang terbesar diseluruh Nusantara. P.indicus termasuk kedalam famili Leguminosae. P.indicus ini digunakan sebagai tanaman penghijau di semua kota besar di Indonesia. P.indicus dikenal dengan nama Sono kembang dan Cendana Merah (Direktorat Pembenihan Tanaman Hutan, 2002).
Efek farmakologi dari P.indicus ini adalah antidiabetik dan antitumor. Berbagai penelitian juga telah dilakukan terhadap tanaman ini antara lain : isolasi dan identifikasi komponen kimia ekstrak dietil eter daun Pterocarpus indicus (ahmad najib, 2008) dan uji aktivitas antibakteri. Ekstrak daun Pterocarpus indicus setelah diteliti menunjukan bahwa ekstrak etanol daun tersebut mempunyai aktivitas penghambatan pertumbuhan yang baik pada Staphylococcus Aureus dan kurang baik pada Streptococcus Pyogenes dan Escherichia coli sedangkan ekstrak kloroform dan heksan tidak menunjukan penghambatan pertumbuhan seluruh bakteri (fatimah, et al., 2006). Akan tetapi penelitian tentang standardisasi daun Pterocarpus indicus sampai saat ini belum ada yang melaporkan dalam publikasi ilmiah.
Standardisasi dalam kefarmasian adalah serangkaian parameter, prosedur dan cara pengukuran yang hasilnya merupakan unsur-unsur terkait paradigma mutu kefarmasian, mutu dalam artian memenuhi syarat standar (kimia, biologi, dan farmasi), termasuk jaminan (batas-batas) stabilitas sebagai produk kefarmasian umumnya. Persyaratan mutu ekstrak terdiri dari berbagai parameter standar umum dan parameter standar spesifik. Pengertian standardisasi juga berarti proses menjamin bahwa produk akhir (obat, ekstrak atau produk ekstrak) mempunyai nilai parameter tertentu yang konstan (ajeg) dan ditetapkan (dirancang dalam formula) terlebih dahulu (Depkes RI, 2000)
Dalam proses standardisasi daun Pterocarpus indicus Willd, diperlukan bahan baku atau simplisia yang memenuhi persyaratan dalam monografi terbitan resmi Departemen Kesehatan (Materia Medika Indonesia, 1989) dan ekstrak yang memenuhi persyaratan dalam buku khusus monografi ekstrak tumbuhan obat.
memiliki mutu yang terukur, mampu mendukung derajat kesehatan dan terjamin keamanan serta terbebas dari bahan dan mikroba berbahaya.
1.2RUMUSAN MASALAH
Dari hasil penelusuran pustaka diketahui bahwa belum ada penelitian mengenai standardisasi ekstrak etanol daun Pterocarpus indicus Willd. Dengan latar belakang tersebut mencoba melakukan standardisasi ekstrak etanol tentang daun tumbuhan ini.
1.3TUJUAN
Tujuan penelitian ini adalah untuk melakukan standardisasi berdasarkan beberapa parameter spesifik dan non spesifik ekstrak etanol daun Pterocarpus indicus sehingga menjamin bahwa simplisia tersebut mempunyai mutu dan nilai parameter yang terstandar.
1.4MANFAAT
2.1TANAMAN ANGSANA (Pterocarpus indicus Willd.)
Pterocarpus indicus memiliki tempat asli yang membentang dari Selatan Burma melalui Semenanjung Thailand, Vietnam, Malaysia, Sumatera, Jawa Barat, Borneo, Filipina, Kepulauan Sunda, Maluku, Papua, Kepulauan Andaman India, Kepulauan Solomon, dan Carolina (Rojo, 1977). Pohon itu secara luas tersebar di habitat hutan yang asli (John K, 1979).
Pterocarpus indicus adalah pohon deciduous (berumah dua), biasanya tumbuh 25-35 m tingginya (82-115 kaki). Tumbuh di bawah kondisi terbuka, diameter kanopi ini mirip dengan ketinggian pohon. Memiliki distribusi alam yang sangat luas di tenggara dan asia timur yang membentang ke arah timur ke utara dan barat daya pasifik. pohon Ini dapat ditemukan dalam berbagai tanaman masyarakat tetapi mencapai perkembangan terbaik di sungai, tropis, dan hutan sekunder, termasuk yang dekat dengan pantai dan tepi air pasang. Pterocarpus indicus banyak ditanam untuk tujuan hias di daerah tropis (Thomson, 2006).
Pterocarpus indicus dibagi ke dalam dua spesies: P.indicus forma P.indicus Willd. dan P.indicus forma echinatus. Dibedakan oleh duri di bagian benih-bantalan buah yang kedua. Bentuk berduri yang bijinya tumbuh di Pulau Luzon di Filipina dan mungkin Kepulauan Celebes, Ambon, Andora, Wetar, dan Kisar (Rojo, 1977).
2.2DESKRIPSI TANAMAN ANGSANA (Pterocarpus indicus Willd.)
2.2.1 Klasifikasi Tumbuhan Kingdom : Plantae
Divisi : Magnoliophyta Kelas : Magnoliopsida Ordo : Fabales Famili : Fabaceae Sub Famili : Papilionoideae Genus : Pterocarpus
Spesies : Pterocarpus indicus Willd
Gambar 1 : Angsana (Pterocarpus indicus Willd) (sumber: koleksi pribadi )
2.2.2 Nama Daerah
Tanaman angsana (Pterocarpus indicus Willd) memiliki berbagai nama lain: narra (Filipina); angsana (Indonesia);, sena (Malaysia dan Singapura); pradoo (Thailand); Nugini rosewood (Papua Nugini); narra (umum untuk batang pohon spp.), paduak Melayu, halus narra, amboyna, Andaman redwood, cendana merah (English); santal rouge (Perancis); Asan (Aceh) ; Sena, sona, hasona (Batak); asana, sana, langsano, lansano (Minangkabau); angsana, babaksana ( Betawi); linggua (Maluku) (Joker, 2002).
2.2.3 Morfologi
hingga lebih dari 2 meter. Biasanya bentuk pohon jelek, pendek dan berbanir. Kayu mengeluarkan eksudat merah gelap yang disebut „kino’ atau darah naga. Daun majemuk dengan 5 – 11 anak daun, berbulu. Bunga dengan panjang 6 – 13 cm di ujung. Bunga berkelamin ganda, berwarna kuning cerah dan harum (Joker, 2002).
Daun (folium) merupakan salah satu organ tumbuhan yang penting dan terdapat dalam jumlah besar pada suatu tanaman. Bentuk daun biasanya tipis melebar, kaya akan suatu zat warna hijau yang disebut klorofil (Tjitrosoepomo, 1996). Bentuk daun yang tipis melebar dengan posisi daun pada batang yang menghadap ke atas selaras yang berperan penting pada saat peristiwa fotosintesis, transpirasi, dan respirasi bagi tumbuhan.
Daun penumpu berbentuk lanset, panjang 1-2 cm. daun berseling. Anakan daun 5-13, berbentuk bulat telur, memanjang, meruncing mengkilat. Tandan bunga di bagian ujung dan duduk di ketiak, sedikit atau tidak bercabang, berambut coklat, berbunga banyak dan panjang berukuran 7-11 cm, anak tangkai 0,5 – 1,5 cm, bunga sangat harum (Tjitrosoepomo, 1996).
Buah berbentuk Polong tidak merekah tebungkus sayap besar (samara). Berbentuk bulat, coklat muda, diameter 4 – 6 cm, dengan sayap besar berukuran 1 – 2,5 cm yang mengelilingi tempat biji berdiameter 2 – 3 cm dan tebal 5 – 8 mm. Permukaan tempat biji bervariasi dari yang halus pada forma indicus sampai yang tertutup oleh bulu lebat pada forma echinatus. Bentuk antara juga ditemukan. Biji: panjang 6 – 8 mm, berbentuk seperti buncis dengan testa berwarna coklat kertas (Joker, 2002).
2.2.4 Kandungan Kimia
2.2.5 Khasiat Dan Kegunaan
Tanaman angsana (Pterocorpus indicus Willd.) memiliki sejumlah besar kegunaan obat tradisional, terutama dari ekstrak kulit kayu. Di beberapa daerah kulit kayu diparut kemudian direbus dan diambil cairan dan digunakan secara oral untuk mengobati disentri dan diare. Di Papua nugini kulit kayu digunakan untuk mengobati TBC, sakit kepala, dan luka, dan sebagai pencahar. Di Malaysia sari akar telah digunakan untuk mengobati luka sifilis dan ulkus mulut. Di Indonesia daun muda telah digunakan dalam pengobatan bisul, dan ruam biang keringat. Dalam beberapa tahun terakhir, teh herbal dan pil yang terbuat dari Narra extrakta telah dipopulerkan di Filipina untuk mengobati berbagai penyakit termasuk lepra, nyeri haid, flu, rheumatoid arthritis, dan diabetes (Thomson, 2006).
2.3SIMPLISIA
Simplisia adalah bahan alamiah yang dipergunakan sebagai obat yang belum mengalami pengolahan apapun juga dan kecuali dikatakan lain, berupa bahan yang telah dikeringkan. Simplisia dibedakan atas simplisia nabati, simplisia hewani, dan simplisia mineral. Simplisia nabati adalah simplisia yang berupa tumbuhan utuh, bagian tumbuhan atau eksudat tumbuhan. Eksudat tumbuhan adalah isi sel yang secara spontan keluar dari tumbuhan atau isi sel yang dengan cara tertentu dikeluarkan dari selnya, atau senyawa nabati lainnya yang dengan cara tertentu dipisahkan dari tumbuhannya dan belum berupa senyawa kimia murni (Depkes RI, 2000).
Simplisia sebagai produk hasil pertanian atau pengumpulan dari tumbuhan liar (wild crop) memiliki kandungan kimia yang tidak terjamin selalu konstan karena adanya variabel bibit, tempat tumbuh, iklim, kondisi (umur) panen, serta proses pasca panen dan preparasi akhir. Variasi kandungan senyawa dalam produk hasil panen tumbuhan obat disebabkan oleh beberapa aspek sebagai berikut (Depkes RI, 2000) :
1) Genetik (bibit)
2) Lingkungan (tempat tumbuh, iklim)
Standardisasi suatu simplisia mempunyai pengertian bahwa simplisia yang akan digunakan untuk obat sebagai bahan baku harus memenuhi persyaratan yang tercantum dalam monografi terbitan resmi Departemen Kesehatan (Materia Media Indonesia). Sedangkan sebagai produk yang langsung dikonsumsi (serbuk jamu dsb.) masih harus memenuhi persyaratan produk kefarmasian sesuai dengan peraturan yang berlaku (Depkes RI, 2000).
2.4 EKSTRAKSI
2.4.1 Pengertian Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak dapat larut. Pengetahuan mengenai golongan senyawa aktif yang dikandung dalam simplisia akan mempermudah proses pemilihan pelarutan dan cara ekstraksi yang tepat (Depkes, 2000).
Ekstraksi dilakukan untuk mengambil zat-zat yang terkandung dalam suatu campuran. Ekstraksi merupakan proses yang secara selektif mengambil zat terlarut dengan bantuan pelarut. Metode pemisahan pada ekstraksi pelarut menggunakan prinsip kelarutan. Prinsip kelarutan adalah like dissolve like, yaitu pelarut polar akan melarutkan senyawa polar dan pelarut nonpolar akan melarutkan senyawa nonpolar (Harborne, 1987).
2.4.2 Metode Ekstraksi
Ekstraksi dengan menggunakan pelarut 1. Cara dingin
a. Maserasi
b. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai sempurna (exhaustive extraction) yang umumnya dilakukan pada temperatur ruangan. Proses terdiri dari tahapan pengembangan bahan, tahap maserasi antara tahap perkolasi sebenarnya (penetesan / penampungan ekstrak), terus menerus sampai di peroleh ekstrak (perkolat) yang jumlahnya 1-5 kali bahan ( Depkes RI, 2000).
2. Cara panas a. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relative konstan dengan adanya pendingin balik. Umumnya dilakukan pengulangan proses pada residu pertama sampai 3-5 kali sehingga dapat termasuk proses ekstraksi sempurna (Depkes RI, 2000).
b. Soxhlet
Soxhlet adalah ekstraksi menggunakan pelarut yang selalu baru yang umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik (Depkes RI, 2000).
c. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada temperatur yang lebih tinggi dari temperatur ruangan (kamar), yaitu secara umum dilakukan pada temperatur 40 - 50o C ( Depkes RI, 2000).
d. Infusa
Infusa adalah ekstraksi dengan pelarut air pada temperatur penangas air (bejana infus tercelup dalam penangas air mendidih, temperatur terukur (96- 98oC) selama waktu tertentu ( 15- 20 menit) ( Depkes RI, 2000).
e. Dekok
Dekok adalah infus pada waktu yang lebih lama ( ≥ 30o
2.5EKSTRAK
Ekstrak adalah sediaan kental yang diperoleh dengan mengekstraksi senyawa aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian hingga memenuhi baku yang telah ditetapkan. Sebagian besar ekstrak dibuat dengan mengekstraksi bahan baku obat secara perkolasi. Seluruh perkolat biasanya dipekatkan secara destilasi dengan pengurangan tekanan, agar bahan sedikit mungkin terkena panas (Farmakope Indonesia, 1995). Ada beberapa jenis ekstrak yakni: ekstrak cair, ekstrak kental dan ekstrak kering. Ekstrak cair jika hasil ekstraksi masih bisa dituang, biasanya kadar air lebih dari 30%. Ekstrak kental jika memiliki kadar air antara 5-30%. Ekstrak kering jika mengandung kadar air kurang dari 5% (Voigt, 1994).
2.6STANDARDISASI
Standardisasi adalah rangkaian parameter, prosedur dan cara pengukuran yang hasilnya merupakan unsur-unsur terkait paradigma mutu kefarmasian, dalam artian memenuhi syarat standard (kimia, biologi, farmasi), termasuk jaminan (batas-batas) stabilitas sebagai produk kefarmasian umumnya (Depkes, 2000).
Standardisasi secara normatif ditujukan untuk memberikan efikasi yang terukur secara farmakologis dan menjamin keamanan konsumen. Standardisasi obat herbal meliputi dua aspek :
1. Aspek parameter spesifik: berfokus pada senyawa atau golongan senyawa yang bertanggung jawab terhadap aktivitas farmakologis. Analisis kimia yang dilibatkan ditujukan untuk analisa kualitatif dan kuantitatif terhadap senyawa aktif.
2. Aspek parameter non spesifik: berfokus pada aspek kimia, mikrobiologi dan fisis yang akan mempengaruhi keamanan konsumen dan stabilitas misalnya kadar logam berat, aflatoksin, kadar air dan lain-lain.
2.6.1 Standardisasi Menjamin Keseragaman Khasiat (Efikasi)
tidak menjamin konsistensi khasiat. Salah satu tujuan dari standardisasi adalah menjaga konsistensi dan keseragaman khasiat dari obat herbal. Standardisasi melibatkan pemastian kadar senyawa aktif farmakologis melalui analisis kuantitatif metabolit sekunder yang akan menjamin keseragaman khasiat (Saefudin, et al., 2011).
2.6.2 Standardisasi Untuk Uji Klinik
Uji klinik adalah uji senyawa kimia obat, obat herbal, ekstrak dan berbagai sediaan pada dosis tertentu dengan target biologis manusia agar memberikan respon biologis berupa parameter-parameter klinik perbaikan dari kondisi patologis yang terkait dengan penyakit tertentu. Untuk itu semua aspek dituntut terdesain dan di kontrol dengan baik (Saefudin, et al., 2011).
Respon uji klinik sangat ditentukan oleh keajegan (konsistensi) dosis. Jika jumlah zat aktif yang diberikan tidak konsisten maka interpretasinya menjadi bias dan justru merugikan. Di sinilah peran besar standardisasi untuk menjaga senyawa-senyawa aktif selalu konsisten terukur antar perlakuan. Jadi penentuan dosis senyawa marker untuk uji klinik ekstrak atau obat herbal sangatlah fundamental (Saifudin, et al., 2011).
2.6.3 Standardisasi Menjamin Aspek Keamanan Dan Stabilitas Ekstrak / Bentuk Sediaan
Tempat tumbuh tanaman, penanganan pasca panen, proses ekstraksi, penyiapan simplisia tanaman dan ekstrak juga mempengaruhi elemen keamanan terhadap pemakai misal keberadaan logam berat (Pb, Cd, dan As), pestisida dalam tanah, udara dan air, jenis dan jumlah mikroorganisme dan metabolit pencemar logam berbahaya. Untuk itu dilakukan berbagai analisis untuk menentukan batas minimal kadar air, zat dan jumlah pencemar mikroba (Saifudin, et al., 2011).
2.6.4 Standardisasi Meningkatkan Nilai Ekonomi
product Indonesia mengakibatkan banyak produk ekspor herbal yang berdaya tawar rendah. Standardisasi adalah upaya penting untuk menaikkan nilai ekonomi produk alam Indonesia (Saifudin, et al., 2011).
2.7PARAMETER-PARAMETER STANDAR EKSTRAK
Parameter- parameter standar ekstrak terdiri dari parameter spesifik dan parameter non spesifik
2.7.1 Parameter Spesifik Ekstrak (DEPKES RI, 2000)
Penentuan parameter spesifik adalah aspek kandungan kimia kualitatif dan aspek kuantitatif kadar senyawa kima yang bertanggung jawab langsung terhadap aktivitas farmakologis tertentu. Parameter spesifik ekstrak meliputi :
1. Identitas (parameter identitas ekstrak) meliputi : deskripsi tata nama, nama ekstrak (generik, dagang, paten), nama lain tumbuhan (sistematika botani), bagian tumbuhan yang digunakan (rimpang, daun dsb) dan nama Indonesia tumbuhan.
2. Organoleptis : Parameter organoleptik ekstrak meliputi penggunaan panca indera mendeskripsikan bentuk, warna, bau, rasa guna pengenalan awal yang sederhana se-objektif mungkin.
3. Senyawa terlarut dalam pelarut tertentu : melarutkan ekstrak dengan pelarut (alkohol/air) untuk ditentukan jumlah larutan yang identik dengan jumlah senyawa kandungan secara gravimetrik. Dalam hal tertentu dapat diukur senyawa terlarut dalam pelarut lain misalnya heksana, diklorometan, metanol. Tujuannya untuk memberikan gambaran awal jumlah senyawa kandungan.
4. Uji kandungan kimia ekstrak : a. Pola kromatogram
b. Kadar kandungan kimia tertentu
Suatu kandungan kimia yang berupa senyawa identitas atau senyawa kimia utama ataupun kandungan kimia lainnya, maka secara kromatografi instrumental dapat dilakukan penetapan kadar kandungan kimia tersebut. Instrumen yang dapat digunakan adalah densitometri, kromatografi gas, KCKT atau instrumen yang sesuai. Tujuannya memberikan data kadar kandungan kimia tertentu sebagai senyawa identitas atau senyawa yang diduga bertanggung jawab pada efek farmakologi (Depkes, 2000).
2.7.2 Parameter Non Spesifik Ekstrak
Parameter non spesifik adalah segala aspek yang tidak terkait dengan aktivitas farmakologi secara langsung namun mempengaruhi aspek keamanan dan stabilitas ekstrak dan sediaan yang dihasilkan.
Parameter nonspesifik ekstrak meliputi: 1. Susut pengeringan dan bobot jenis
a. Parameter susut pengeringan
Parameter susut pengeringan adalah pengukuran sisa zat setelah pengeringan pada temperatur 105o C selama 30 menit atau sampai berat konstan yang dinyatakan sebagai nilai persen. Dalam hal khusus (jika bahan tidak mengandung minyak menguap/atsiri dan sisa pelarut organik menguap) identik dengan kadar air, yaitu kandungan air karena berada di atmosfer/lingkungan terbuka. Adapun tujuan menentukan susut pengeringan untuk memberikan batasan maksimal (rentang) tentang besarnya senyawa yang hilang pada proses pengeringan.
b. Parameter bobot jenis
2, Kadar air
Kadar air adalah pengukuran kandungan air yang berada di dalam bahan, dilakukan dengan cara yang tepat diantara cara titrasi, destilasi atau gravimetrik. Adapun tujuan menentukan kadar air untuk memberikan batasan minimal atau rentang tentang besarnya kandungan air di dalam bahan.
3. Kadar abu
Kadar abu adalah bahan dipanaskan pada temperatur dimana senyawa organik dan turunannya terdestruksi dan menguap. Sehingga tinggal unsur mineral dan anorganik. Tujuan menentukan kadar abu untuk memberikan gambaran kandungan mineral internal dan eksternal yang berasal dari proses awal sampai terbentuknya ekstrak.
4. Sisa pelarut
Sisa pelarut adalah menentukan kandungan sisa pelarut tertentu (yang memang ditambahkan). Untuk ekstrak cair berarti kandungan pelarutnya, misalnya kadar alkohol. Adapun tujuan menentukan sisa pelarut untuk memberikan jaminan bahwa selama proses tidak meninggalkan sisa pelarut yang memang seharusnya tidak boleh ada. Sedangkan untuk ekstrak cair menunjukkan jumlah pelarut (alkohol) sesuai dengan yang ditetapkan.
5. Cemaran logam berat
Cemaran logam berat adalah menentukan kandungan logam berat secara spektroskopi serapan atom yang lebih valid. Adapun tujuan uji cemaran logam berat untuk memberikan jaminan bahwa ekstrak tidak mengandung logam berat tertentu (As, Pb, Cd) melebihi nilai yang ditetapkan karena berbahaya (toksik) bagi kesehatan.
6. Cemaran mikroba
7. Cemaran kapang/khamir
Cemaran kapang/khamir adalah menentukan adanya jamur secara mikrobiologis. Adapun uji ini dilakukan untuk memberikan jaminan bahwa ekstrak tidak mengandung cemaran jamur melebihi batas yang ditetapkan karena berpengaruh pada stabilitas ekstrak (Depkes, 2000).
2.8KROMATOGRAFI
Kromatografi adalah teknik pemisahan campuran berdasarkan perbedaan distribusi dari komponen campuran tersebut diantara dua fase, yaitu fase diam dan fase gerak. Fase diam dapat berupa padatan, atau kombinasi cairan-padatan dan fase gerak berupa cairan atau gas (Estien yazid, 2005).
Kromatografi dapat dibedakan atas berbagai macam tergantung pada pengelompokannya. Berdasarkan pada mekanisme pemisahannya, kromatografi dibedakan menjadi: (Gandjar, et al., 2007)
a. Kromatografi adsorbsi b. Kromatografi partisi c. Kromatografi pasangan ion d. Kromatografi penukar ion e. Kromatografi eksklusi ukuran
Berdasarkan pada alat yang digunakan, kromatografi dapat dibagi atas: (Gandjar, et al., 2007)
a. Kromatografi kertas b. Kromatografi lapis tipis
c. KromatografiCair Kinerja Tinggi (KCKT), dan d. Kromatografi Gas
2.8.1 Kromatografi Lapis Tipis
pada permukaan bidang datar yang didukung oleh lempeng kaca, pelat alumunium, atau pelat plastik. (Gandjar, et al., 2007).
Fase diam KLT
Fase diam yang digunakan dalam KLT merupakan penjerap berukuran kecil dengan diameter partikel antara 10-30 µm. semakin kecil ukuran rata-rata partikel fase diam dan semakin sempit kisaran ukuran fase diam, maka semakin baik kinerja KLT dalam hal efisiensinya dan resolusinya. (Gandjar, et al., 2007).
Penjerap yang sering digunakan adalah silica dan serbuk selulosa, sementara mekanisme sorpsi yang utama pada KLT adalah partisi dan adsorpsi. Lapisan tipis yang digunakan sebagai penjerap juga dapat dibuat dari silica yang telah dimodifikasi, resin penukar ion, gel eksklusi, dan siklodestrin yang digunakan untuk pemisahan kiral. (Gandjar, et al., 2007).
Fase gerak KLT
Sistem fase gerak yang paling sederhana ialah campuran 2 pelarut organik karena adanya elusi campuran kedua fase pelarut ini dapat mudah diatur sedemiakan rupa sehingga pemisahan dapat terjadi secara optimal. Berikut adalah beberapa petunjuk dalam memilih dan mengoptimasi fase gerak :
a. Fase gerak harus mempunyai kemurnian yang sangat tinggi karena KLT merupakan teknik yang sensitive
b. Daya elusi fase gerak harus diatur sedemikian rupa sehingga harga Rf terletak antara 0,2 – 0,8 untuk memaksimalkan pemisahan.
c. Untuk pemisahan dengan menggunakan fase diam polar seperti silika gel, polaritas fase gerak akan menentukan kecepatan migrasi solut yang berarti juga menentukan nilai Rf. Penambahan pelarut yang bersifat sedikit polar seperti dietil eter ke dalam pelarut non polar seperti metil benzene akan meningkatkan harga Rf secara signifikan.
Kromatografi lapis tipis digunakan pada pemisahan zat secara cepat, dengan menggunakan zat penyerap berupa serbuk halus yang dilapiskan serba rata pada lempeng kaca. Lempeng yang dilapis, dapat dianggap sebagai “kolom kromatografi terbuka” dan pemisahan didasarkan pada penyerapan, pembagian atau gabungannya, tergantung dari jenis zat penyerap dan cara pembuatan lapisan zat penyerap dan jenis pelarut. Kromatografi lapis tipis dengan penyerap penukar ion dapat digunakan untuk pemisahan senyawa polar (Depkes, 1989).
Harga Rf yang diperoleh pada kromatografi lapis tipis, tidak tetap jika dibandingkan dengan yang diperoleh pada kromatografi kertas. Karena itu pada lempeng yang sama disamping kromatogram dari zat yang diperiksa perlu dibuat kromatogram dari zat pembanding kimia, lebih baik dengan kadar yang berbeda-beda. Perkiraan identifikasi diperoleh dengan pengamatan 2 bercak dengan harga Rf dan ukuran yang lebih kurang sama. Ukuran dan intensitas bercak dapat digunakan untuk memperkirakan kadar. Penetapan kadar yang lebih teliti dapat dilakukan dengan cara densitometri atau dengan mengambil bercak dengan hati – hati dari lempeng, kemudian disari dengan pelarut yang cocok dan ditetapkan dengan cara spektrometri. Pada kromatografi lapis tipis dua dimensi, lempeng yang telah dielusi diputar 90o C dan dielusi lagi, umumnya menggunakan bejana lain yang berisi pelarut lain (Depkes, 1989).
Harga Rf dihitung dengan menggunakan perbandingan sebagaimana persamaan sebagai berikut:
Harga maksimum Rf adalah 1, sampel bermigrasi dengan kecepatan sama dengan fase gerak. Harga minimum Rf adalah 0, dan ini teramati jika sampel tertahan pada posisi titik awal di permukaan fase diam (Gandjar, et al., 2007).
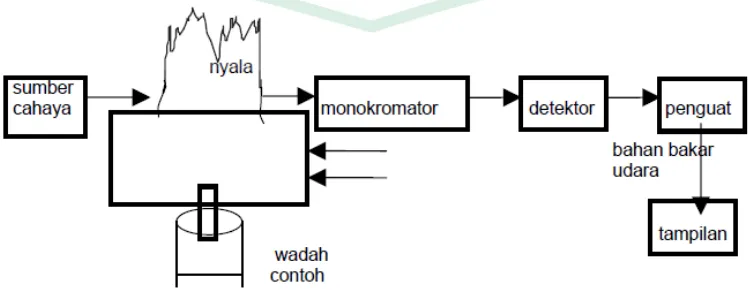
2.9SPEKTROFOTOMETRI
energi secara relativ jika energi tersebut ditransmisikan, direfleksikan, atau diemisikan sebagai fungsi dari panjang gelombang. Spektrofotometer menghasilkan sinar dari spektrum dengan panjang gelombang tertentu, dan fotometer adalah alat pengukur intensitas cahaya yang ditransmisikan atau yang diabsorpsi.
2.9.1 Spektrofotometri Serapan Atom
Spektrometri merupakan suatu metode analisis kuantitatif yang pengukurannya berdasarkan banyaknya radiasi yang dihasilkan atau yang diserap oleh spesi atom atau molekul analit. Salah satu bagian dari spektrometri ialah Spektrometri Serapan Atom (SSA), merupakan metode analisis unsur secara kuantitatif yang pengukurannya berdasarkan penyerapan cahaya dengan panjang gelombang tertentu oleh atom logam dalam keadaan bebas (Skoog, et. al., 2000).
Spektrometri Serapan Atom (SSA) digunakan dalam uji batas untuk logam-logam di dalam obat sebelum dimasukan ke dalam formulasi. Sampel biasanya dilarutkan dalam asam nitrat 0,1 M untuk menghindari pembentukan hidroksida logam dari logam berat, yang relatif non volatile dan menekan hasil pembacaan Spektrometri Serapan Atom (SSA) (Watson, 2009).
Pada alat SSA terdapat dua bagian utama yaitu suatu sel atom yang menghasilkan atom-atom gas bebas dalam keadaaan dasarnya dan suatu sistem optik untuk pengukuran sinyal. Suatu skema umum dari alat SSA adalah sebagai berikut :
Dalam metode SSA, sebagaimana dalam metode spektrometri atomik yang lain, contoh harus diubah ke dalam bentuk uap atom. Proses pengubahan ini dikenal dengan istilah atomisasi, pada proses ini sampel diuapkan dan didekomposisi untuk membentuk atom dalam bentuk uap. Secara umum pembentukan atom bebas dalam keadaan gas melalui tahapan-tahapan sebagai berikut (Basset, et al. 1994) :
a. Pengisatan pelarut, pada tahap ini pelarut akan teruapkan dan meninggalkan residu padat.
b. Penguapan zat padat, zat padat ini terdisosiasi menjadi atomatom penyusunnya yang mula-mula akan berada dalam keadaan dasar.
c. Beberapa atom akan mengalami eksitasi ke tingkatan energi yang lebih tinggi dan akan mencapai kondisi dimana atom-atom tersebut mampu memancarkan energi.
2.9.2 Spektrofotometri UV-Vis
Spektrofotometri UV-Vis adalah alat yang digunakan untuk mengukur serapan yang dihasilkan dari interaksi kimia antara radiasi elektromagnetik dengan molekul atau atom dari suatu zat kimia pada daerah ultraviolet (200-400 nm) dan sinar tampak (400-800 nm).
Spektrofotometer yang sesuai untuk pengukuran di daerah spektrum ultraviolet dan cahaya tampak terdiri dari suatu sistem optik dengan kemampuan menghasilkan cahaya monokromatik dalam jangkauan 200 nm hingga 800 nm dan suatu alat yang sesuai untuk menetapkan serapan. Kedua sel yang digunakan untuk larutan yang diperiksa dan larutan pembanding harus mempunyai karakteristik spektrum yang sama. Bila digunakan instrumen bekas ganda dengan perekam, sel yang berisi pelarut ditempatkan pada jalur berkas pembanding (Underwood, 1λ88).
Jika tidak dinyatakan lain, serapan diukur pada panjang gelombang yang
ditetapkan dengan menggunakan kuvet yang panjangnya 1 cm pada suhu 1λo C
hingga 20o C. Jika hal tersebut tidak sesuai untuk instrumen tertentu, panjang
Kecuali dinyatakan lain, pengukuran dilakukan terhadap pelarut yang digunakan untuk membuat larutan uji sebagai pembanding. Dalam hal tertentu, pengukuran dilakukan terhadap suatu campuran pereaksi sebagai pembanding.
Panjang gelombang dimana terjadi eksitasi elektronik yang memberikan absorban maksimum disebut sebagai panjang gelombang maksimum ( maks). Penentuan panjang gelombang maksimum yang pasti (tetap) dapat dipakai untuk identifikasi molekul yang bersifat karakteristik-karakteristik sebagai data sekunder (Underwood, 1λ88).
3.1WAKTU DAN TEMPAT PENELITIAN
Penelitian ini dilakukan selama ± 6 bulan, Februari-Juli di Laboratorium bahan alam Pusat Penelitian Kimia, Lembaga Ilmu Pengetahuan Indonesia (LIPI), Pusat Penelitian Ilmu Pengetahuan dan Teknologi (PUSPITEK), Serpong dan Laboratorium Farmakognosi dan Penapisan Fitokimia Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta.
3.2BAHAN
3.2.1 TANAMAN
Tanaman yang diteliti adalah Pterocarpus indicus Willd yang diperoleh dari tiga tempat tumbuh yang berbeda, yaitu Tangerang selatan dari daerah Puspitek , Bogor dari kelurahan Mekarwangi Tanah Sereal dan Yogyakarta dari daerah Tirtomartani Kalasan Sleman. Masing-masing Tanaman yang diambil berumur 6 tahun. Bagian yang digunakan dalam penelitian ini adalah daun dari tanaman tersebut yang sudah tua.
3.2.2 BAHAN KIMIA
Bahan-bahan yang digunakan dalam penelitian ini adalah etanol 70%, metanol, ammonia, kloroform, pereaksi dragendroff, pereaksi meyer, Mg, HCl, amil alcohol, FeCl3, NaOH, aquadest, asam sulfat encer, AlCl3, standar Kuersetin,
Na asetat, Nutrient Agar (NA), Potato Dextrose Agar (PDA), kertas saring dan kapas.
3.3ALAT
erlenmeyer, blender, mikropipet, rotary evaporator, labu ukur, ultrasonik, furnace, Spektrofotometer UV Vis, Spektroskopi Serapan Atom.
3.4PROSEDUR PENELITIAN
Standardisasi dari ekstrak etanol daun Pterocarpus indicus Willd dilakukan melalui beberapa tahapan penelitian yang meliputi :
3.4.1 Persiapan Bahan Uji a. Determinasi Tanaman b. Penyiapan sampel c. Pembuatan ekstrak
3.4.2 Standardisasi ekstrak etanol daun Pterocarpus indicus Willd a. Penetapan parameter spesifik
1. Identitas 2. Organoleptik
3. senyawa terlarut dalam pelarut tertentu 4. Uji kandungan kimia ekstrak etanol b. Penetapan parameter non spesifik
1. Penetapan Susut Pengeringan 2. Bobot Jenis
3. Penetapan Kadar Air 4. Penetapan Kadar Abu
5. Penentuan cemaran bakteri dan cemaran kapang 6. Penentuan Cemaran Logam
3.4.1 PERSIAPAN BAHAN UJI a. Determinasi Tanaman
Pemeriksaan atau determinasi tanaman dilakukan di Herbarium Bogoriense, Pusat Penelitian Biologi-LIPI, Bogor, Jawa Barat.
b. Penyiapan Simplisia
dilakukan dengan cara sortasi basah untuk memisahkan kotoran atau bahan-bahan asing lainnya dari daun. Kemudian dilakukan pencucian untuk menghilangkan pengotor yang masih menempel pada bahan. Tahap selanjutnya adalah pengeringan, sampel dikeringkan dalam oven pada suhu 45oC selama 24 jam. Kemudian dilakukan sortasi kering, tujuannya untuk menghilangkan pengotoran-pengotoran lain yang masih ada dan tertinggal pada simplisia kering, kemudian dilakukan penggilingan untuk mendapatkan serbuk simplisia.
c. Pembuatan Ekstrak
Serbuk simplisia P.indicus Willd yang diperoleh ditimbang sebagai bobot awal. Proses ekstraksi simplisia angsana menggunakan metode maserasi dengan pelarut etanol 70% hingga terendam dalam wadah tertutup rapat selama 24 jam. Proses ekstraksi dilakukan sampai hasil larutan maserasi mendekati tidak berwarna. Filtrat yang didapat kemudian disatukan dan dipekatkan menggunakan rotary evaporator pada suhu 60oC sampai didapat ekstrak kental.
% rendemen ekstrak = berat ekstrak yang didapat (g) x 100%. berat simplisia yang di ekstrak (g)
3.4.2 STANDARDISASI EKSTRAK ETANOL a. Parameter spesifik (Depkes RI, 2000)
1. Identitas
Deskripsi tata nama dan senyawa identitas yang terkandung 2. Organoleptik
Mendeskripsikan bentuk, warna, bau dan rasa 3. Senyawa terlarut dalam pelarut tertentu
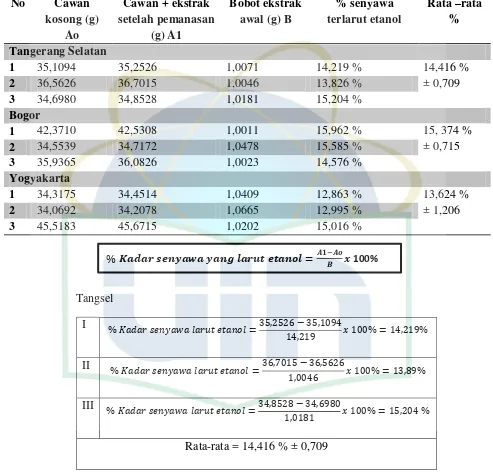
a. Kadar senyawa yang larut dalam air
desikator kemudian ditimbang. Ulangi perlakuan sampai didapatkan bobot tetap. Dihitung kadar dalam persen senyawa yang larut dalam air terhadap berat ekstrak awal.
% senyawa terlarut air = − 100%
Ket : A1 = Bobot cawan + ekstrak setelah pemanasan (g) Ao = Bobot cawan kosong (g)
B = Bobot sampel awal (g)
b. Kadar senyawa yang larut dalam etanol
Sejumlah 1 gram ekstrak dimaserasi selama 24 jam dengan 20 mL etanol 95% kemudian dibiarkan selama 18 jam, saring. Diuapkan 4 mL filtrat hingga kering dalam cawan penguap, residu dipanaskan pada suhu 105oC. Keluarkan, lalu dimasukan ke dalam desikator kemudian ditimbang. Ulangi perlakuan sampai didapatkan bobot tetap Dihitung kadar dalam persen senyawa yang larut dalam air terhadap berat ekstrak awal.
% senyawa terlarut etanol = − 100% Ket : A1 = Bobot cawan + ekstrak setelah pemanasan (g)
Ao = Bobot cawan kosong (g) B = Bobot sampel awal (g)
4. Uji kandungan kimia a. Pola kromatogram
Ekstrak sebanyak 1 mg dilarutkan dalam 1 mL metanol, kemudian ditotolkan pada lempeng KLT selanjutnya dielusi dengan fase gerak yang sesuai.
b. Penapisan golongan kimia ekstrak etanol (Nurhimah A, 2008)
Identifikasi steroid dan triterpenoid
Ekstrak etanol pekat sebanyak 1g dimaserasi dengan 10 mL dietil eter selama 10 menit. Lapisan eter dipisah lalu ditambah 3 tetes asam asetat anhidrat dan 1 tetes H2SO4.
triterpenoid pada sampel sedangkan warna hijau menunjukkan kandungan steroid
Identifikasi flavonoid
Ekstrak etanol pekat sebanyak 1gram dilarutkan dengan 100 mL air panas dan didihkan selama 10 menit. Sebanyak 5 mL filtrat ditambahkan 0.5 mg serbuk Mg, 2 mL larutan HCl, dan 2 mL amil alkohol lalu dikocok kuat. Warna jingga yang terbentuk menunjukkan terdapatnya senyawa flavonoid
Identifikasi saponin
Ekstrak etanol pekat sebanyak 1 gram dilarutkan dengan 100 mL air panas dan didihkan selama 10 menit. Sebanyak 5 mL, filtrat yang diperoleh dikocok. Timbulnya busa hingga selang waktu 10 menit menunjukkan adanya saponin.
Identifikasi tanin
Ekstrak etanol sebanyak 1gram dilarutkan dengan 100 mL air panas dan didihkan selama 10 menit. Ditambahkan beberapa tetes FeCl3. Terbentuknya warna
biru tua atau hitam kehijauan menunjukkan terdapatnya tannin
Identifikasi kuinon
Ekstrak etanol pekat sebanyak 1 gram dilarutkan dengan 100 mL air panas dan didihkan selama 10 menit. Sebanyak 5 mL filtrat ditambahkan NaOH 10% warna merah yang terbentuk menunjukkan terdapatnya senyawa kuinon
Identifikasi alkaloid
tabung reaksi, lalu ditambahkan pereaksi Dragendorff pada tabung pertama, dan pereaksi Mayer pada tabung kedua. Terdapatnya akaloid ditandai dengan terbentuknya endapan putih oleh pereaksi Mayer, dan endapan merah oleh pereaksi Dragendorf.
c. Kadar total flavonoid (Chang, et al., 2002) 1) Larutan uji
1 gram ekstrak ditimbang kemudian dihidrolisis dengan HCl 4N selama 30 menit
Ekstrak disari dengan 15 mL etil asetat sebanyak 3 kali,
fraksi EA dikumpulkan dan dipekatkan
Hasil ekstrak EA dimasukan dalam labu 25 mL, kemudian
dilarutkan dengan metanol hingga tanda batas
Larutan uji dipipet 0,5 mL kemudian dilarutkan dengan
metanol 1,5 mL pada tabung reaksi
Ditambahkan pereaksi 0,1 mL AlCl3 10%, 0,1 mL Na asetat
1M dan 2,8 mL aquadest, larutan dicampur homogen dan diinkubasi pada suhu kamar selama 30 menit
Larutan diukur serapannya pada spektro UV pada panjang gelombang 415 nm dengan menggunakan larutan blanko tanpa AlCl3 tapi diganti aquadest
Kadar flavonoid total dinyatakan dengan kesetaraan
pembanding kuersetin 2) Kurva kalibrasi
Pembuatan kurva kalibrasi dilakukan dengan pembanding kuersetin
25 mg kuersetin dilarutkan dengan metanol dalam labu ukur 100 mL hingga tanda batas
Dibuat 5 konsentrasi berbeda dengan diencerkan
Tiap konsentrasi dipipet 0,5 mL lalu dilarutkan
dengan 1,5 mL metanol, dan ditambahkan pereaksi 0,1 mL AlCl3 10%, 0,1 mL Na asetat 1M dan 2,8
mL aquadest
Larutan dicampur homogen dan diinkubasi pada
suhu kamar selama 30 menit
Larutan diukur pada panjang gelombang 415 nm
dengan larutan blangko tanpa kuersetin.
b. Parameter non spesifik (Depkes RI, 2000) 1. Penetapan susut pengeringan
Sebanyak 1 gram ekstrak ditimbang dalam cawan yang sebelumnya telah dipanaskan pada suhu 105ºC selama 30 menit dan telah ditara. Sebelum di timbang ekstrak diratakan dengan bantuan pengaduk hingga merupakan ekstrak berupa lapisan setebal 5 sampai 10 mm kemudian dikeringkan pada suhu 105ºC selama 30 menit, keluarkan, lalu dimasukan ke dalam desikator kemudian ditimbang. Ulangi perlakuan sampai didapatkan bobot tetap. Kemudian dicatat bobot tetap yang diperoleh untuk menghitung persentase susut pengeringannya.
% susut pengeringan = − 100% ( Selawa, widya et al. 2013) Ket : A= Berat sampel sebelum dipanaskan (g)
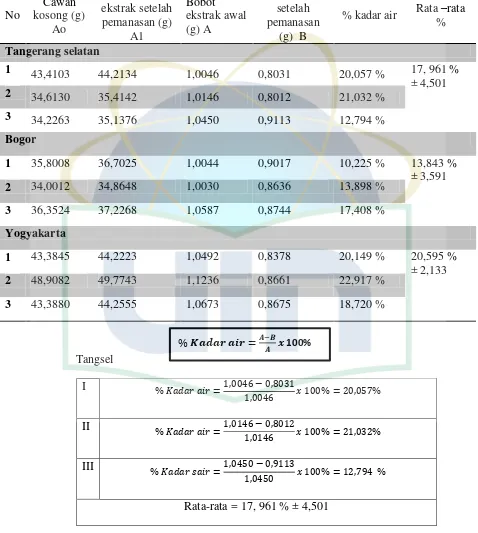
B = Berat sampel setelah dipanaskan (g) 2. Penetapan kadar air (Metode gravimetri) (Depkes, 2000)
Ditimbang seksama 1 gram ekstrak dalam cawan yang telah ditara. Dikeringkan pada suhu 105ºC selama 5 jam dan ditimbang.
kadar air = −
Ket : A = Berat sampel sebelum dipanaskan (g)
3. Bobot jenis
Bobot jenis diukur menggunakan piknometer bersih, kering dan telah dikalibrasi dengan menetapkan bobot piknometer dan bobot air pada suhu 25°C. Bobot jenis ekstrak cair ditentukan terhadap hasil yang diperoleh dengan membagi bobot ekstrak dengan bobot air, dalam piknometer pada suhu 25°C.
Bobot jenis = −
− BJ air
Ket : A1 = Bobot cawan + ekstrak setelah pemanasan (g)
Ao = Bobot cawan kosong (g)
B = Bobot sampel awal (g)
4. Penetapan kadar abu (Depkes RI,2000).
Ditimbang 1 gram ekstrak secara seksama lalu dimasukkan ke dalam krus silikat yang telah dipijarkan dan ditimbang terlebih dahulu, kemudian diratakan. Dipijarkan perlahan-lahan hingga arang abis. Lalu dinginkan dan ditimbang
Kadar abu = −
− 100%
Ket : A1 = Bobot cawan + ekstrak setelah pemanasan (g)
Ao = Bobot cawan kosong (g) B = Bobot sampel awal (g)
Kadar abu yang tidak larut dalam asam
Abu yang diperoleh dari penetapan kadar abu, didihkan dengan 25 ml asam klorida encer P selama 5 menit, bagian yang tidak larut asam dikumpulkan, disaring melalui kertas saring, kemudian dipijarkan hingga bobot tetap dan ditimbang, ditentukan kadar abu yang tidak larut asam dalam persen terhadap berat sampel awal.
Kadar abu tidak larut asam = − − 100% Ket : A1 = Bobot cawan + ekstrak setelah pemijaran (g)
B = Bobot sampel awal (g)
C = Bobot kertas saring kosong (g)
5. Penetapan cemaran mikroba dan cemaran kapang (Depkes RI, 2000) a. Penentuan cemaran mikroba
Larutan ekstrak dibuat dengan pengenceran 1:10 dengan cara melarutkan 1 gram ekstrak ke dalam labu ukur 10 mL. dilanjutkan dengan pengenceran 1:100 dan 1:1000. Untuk penentuan angka lempeng total (ALT) dipipet 1 mL dari tiap pengenceran ke dalam cawan petri yang steril (triplo) dengan menggunakan pipet yang berbeda dan steril untuk tiap pengenceran. Ke dalam tiap cawan petri dituangkan 15 mL media nutrient agar yang telah dicairkan bersuhu 450 C. Cawan petri digoyangkan dengan hati-hati (diputar dan digoyangkan ke depan dan ke belakang ke kanan dan ke kiri) hingga sampel bercampur rata dengan larutan ekstrak. Kemudian dibiarkan hingga campuran dalam cawan petri membeku. Cawan petri dengan posisi dimasukkan ke dalam lemari inkubator suhu 35oC selama 24 - 48 jam. Dicatat pertumbuhan koloni pada masing-masing cawan yang mengandung 30-300 koloni setelah 24 - 48 jam dan menentukan Angka Lempeng Totalnya
b. Penentuan cemaran kapang/khamir
pengenceran. Cawan petri digoyangkan dengan hati-hati hingga sampel tersebar secara merata pada media. Kemudian diinkubasikan pada suhu kamar (25º C) selama 5 hari, lalu ditentukan jumlah kapang dan khamir.
6. Penentuan cemaran logam berat (Saifudin, et al., 2011).
Ditimbang 1 gram ekstrak dan ditambahkan 10 mL HNO3 pekat,
kemudian dipanaskan diatas hot plate (dalam ruang asam) hingga volume larutan setengahnya, setelah itu tambahkan 5 mL HClO4
4.1
HASIL PENELITIAN4.1.1
Hasil determinasi tanamanHasil identifikasi tanaman dari Tangerang Selatan yang diperoleh dari daerah Puspitek, Bogor dari kelurahan Mekarwangi Tanah Sereal dan Yogyakarta dari daerah Tirtomartani Kalasan Sleman. Dilakukan di Herbarium Bogoriense, Pusat Penelitian Biologi LIPI, Cibinong, Bogor. Hasil determinasi Menunjukan bahwa semua sampel yang digunakan dalam penelitian ini adalah angsana (Pterocarpus indicus).
4.1.2 Hasil Standardisasi Ekstrak Etanol Daun Angsan 4.1.2.1 Hasil Rendemen Ekstrak
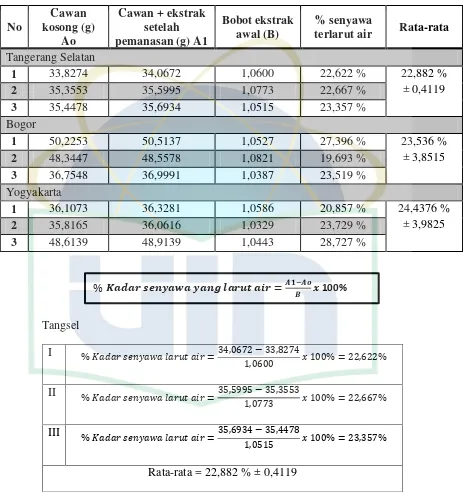
Proses ekstraksi daun P.indicus dilakukan menggunakan metode maserasi. Tabel 4.1. Hasil rendemen ekstrak
Asal simplisia
Berat (g) Simplisia yang
ditimbang
Berat ekstrak
yang diperoleh (g) Rendemen (%)
Tangsel 1000 gram 157 gram 15,7 %
Bogor 437 gram 43 gram 8,8 %
Yogyakarta 664 gram 71 gram 10,6 %
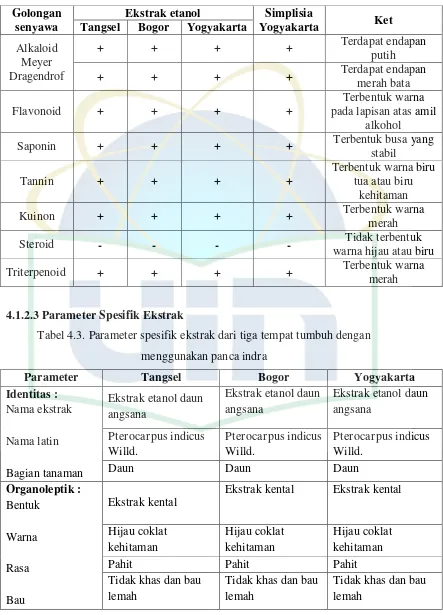
4.1.2.2Hasil Penapisan Fitokimia
Tabel 4.2. Tabel hasil penapisan fitokimia Golongan
senyawa
Ekstrak etanol Simplisia
Yogyakarta Ket
Tangsel Bogor Yogyakarta Alkaloid
warna hijau atau biru
Triterpenoid + + + + Terbentuk warna
merah
4.1.2.3Parameter Spesifik Ekstrak
Tabel 4.3. Parameter spesifik ekstrak dari tiga tempat tumbuh dengan menggunakan panca indra
Parameter Tangsel Bogor Yogyakarta
Identitas :
Ekstrak kental Ekstrak kental
Tabel 4.4. Parameter spesifik ekstrak
4.1.2.4Parameter Non Spesifik Ekstrak
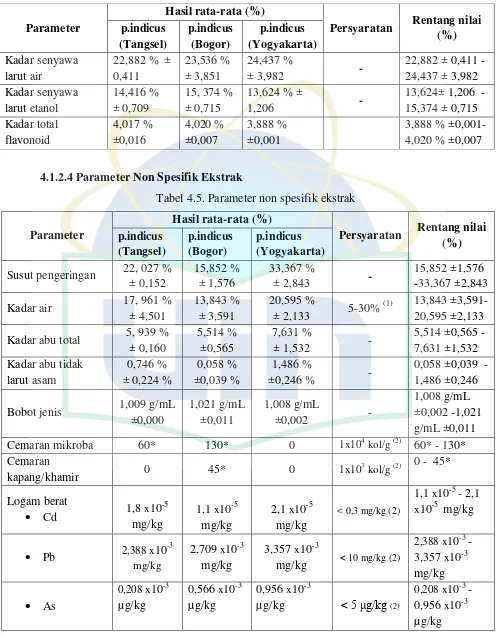
Tabel 4.5. Parameter non spesifik ekstrak
Parameter Susut pengeringan 22, 027 %
(1) Literatur diambil dari Voigt (1995)
(2) Literatur diambil dari parameter ekstrak secara umum, Monografi Ekstrak Tumbuhan Obat, jilid II (2006)
4.2 PEMBAHASAN
Penelitian standardisasi ekstrak etanol daun Pterocarpus indicus dilakukan sebagai upaya untuk menjamin bahwa produk akhir (obat, ekstrak, atau produk ekstrak) mempunyai nilai parameter tertentu yang konstan dan ditetapkan terlebih dahulu (Depkes RI, 2000).
Standardisasi ekstrak etanol daun Pterocarpus indicus ini diperoleh dari tiga tempat tumbuh yang berbeda yaitu Tangerang Selatan dari daerah Puspitek , Bogor dari kelurahan Mekarwangi tanah sereal dan Yogyakarta dari daerah Tirtomartani Kalasan Sleman. Hasil determinasi dari ketiga tempat tumbuh menjelaskan identitas tanaman adalah daun Pterocarpus indicus Willd.
Pada penelitian ini digunakan sampel berupa daun dari P.indicus. Daun yang digunakan bertujuan agar pelarut lebih mudah berpenetrasi, sehingga zat-zat yang terdapat pada daun lebih mudah terekstraksi. Metode yang digunakan dalam ekstraksi adalah maserasi, maserasi sampel dilakukan dengan menggunakan pelarut etanol, karena sifat etanol mampu melarutkan hampir semua zat, baik yang bersifat polar, semi polar dan non polar serta kemampuannya untuk mengendapkan protein dan menghambat kerja enzim, sehingga mencegah terjadinya proses hidrolisis dan oksidasi (Harborne, 1987). Etanol yang digunakan adalah etanol 70%.
Setelah dimaserasi filtrat etanol dikentalkan dengan menggunakan vacuum rotary evaporator untuk menguapkan pelarut (Harbone, 1987). Dari hasil maserasi ini P.indicus Tangsel diperoleh rendemen ekstrak sebanyak 15,7 %, sedangkan P.indicus Bogor 8,8 %, dan P.indicus Yogyakarta 10,6%. Hasil rendemen ekstrak dengan menggunakan pelarut etanol antara 8,8 – 15,7 %, rentang rendemen tersebut cukup lebar. Hal ini dipengaruhi oleh berbagai faktor, antara lain : perbedaan tempat tumbuh, musim dan penanganan pasca panen.
Setelah didapatkan ekstrak kental dilakukan penetapan standar mutu dan kandungan kimia ekstrak. Persyaratan mutu ekstrak meliputi parameter spesifik dan parameter non spesifik. Standardisasi ini dilakukan agar dapat menjamin
(Depkes RI, 2000). Dalam penentuan nilai standardisasi diperlukan acuan yang menandakan bahwa ekstrak tersebut memenuhi persyaratan yang telah ditetapkan. Pada ekstrak daun P.indicus belum terdapat acuan standardisasi resmi terbitan Departemen Kesehatan maupun sumber lain sehingga sebagai acuan peneliti menggunakan persyaratan ekstrak secara umum. Semua hasil parameter uji masing-masing ekstrak etanol diambil nilai terendah dan tertinggi untuk dijadikan sebagai nilai rentang parameter uji.
Pengujian parameter spesifik meliputi identitas, organoleptik senyawa terlarut dalam pelarut tertentu (air dan etanol), dan uji kandungan kimia ekstrak yang meliputi pola kromatogram dan kadar kandungan kimia tertentu .
Identitas ekstrak bertujuan untuk memberikan identitas obyektif dari nama dan spesifik dari senyawa, sedangkan organoleptik ekstrak bertujuan sebagai pengenalan awal menggunakan panca indra dengan mendeskripsikan bentuk, warna, bau dan rasa (Depkes RI, 2000). Ekstrak yang diperoleh berupa ekstrak kental, berwarna hijau cokelat hingga kehitaman, bau lemah dan tidak khas serta rasanya pahit.
Pada pengujian kadar senyawa yang larut dalam air diperoleh rentang antara 22,882 % ±0,411 - 24,437% ±3,982 dan kadar senyawa yang larut dalam etanol diperoleh kadar antara 13,624 % ±1,206 - 15,374% ±0,715. Ini menunjukan ekstrak lebih banyak terlarut dalam air dibandingkan dalam etanol. Penetapan kadar ekstrak larut air dan larut etanol bertujuan untuk memperkirakan kadar senyawa aktif berdasarkan sifat polaritas. Penetapan kadar ekstrak larut air dan etanol bukanlah hal yang terkait efek farmakologis namun adalah perkiraan kasar senyawa-senyawa yang bersifat polar (larut air) dan senyawa aktif yang bersifat semipolar-nonpolar (larut etanol) (Saifudin, et al., 2011).
merupakan senyawa aktif permukaan dan bersifat seperti sabun, serta dapat dideteksi berdasarkan kemampuannya membentuk busa akibatnya saponin akan menurunkan tegangan permukaan, dinding sel bakteri dan merusak permeabilitas membran, sehingga saponin ini dapat digunakan sebagai antibakteri, hasil skrining fitokimia daun P.indicus yang terlihat tajam pada saponin adalah P.indicus Yogyakarta dibandingkan Tangsel dan Bogor.
Pengujian kandungan kimia ekstrak bertujuan untuk memberikan gambaran awal komposisi kandungan kimia berdasarkan pola kromatogram, pola kromatogram ini menggunakan Kromatografi lapis tipis (KLT).
Gambar 3 : foto profil KLT daun P.indicus. fase gerak campuran Heksan : Etil asetat (4:6) dan fase diam: Silika gel . Keterangan: T= Tangerang Selatan B= Bogor Y= Yogyakarta
RF P.Indicus Tangsel P.Indicus Bogor P.Indicus Yogyakarta
1 0,33 0,33 0,33
2 - 0,43 0,43
3 - 0,84 0,86
4 0,92 0,90 0,92
5 0,96 0,96 0,96
Hasil KLT dari masing-masing ekstrak dapat dilihat pada gambar 3. Masing-masing ekstrak ditimbang sebanyak 5 mg kemudian dilarutkan dengan metanol sebanyak 1 mL dan ditotolkan pada plat KLT. Dari hasil elusi didapatkan eluen terbaik yaitu heksan : etil asetat (4:6). Pada elusi ekstrak daun P.indicus dengan eluen tersebut diperoleh pemisahan yang cukup baik. Ada 4 bercak utama
2 3
4
5
1
sebelum UV UV 254 UV 366 sesudah UV dan
terdeteksi pada pola kromatogram, setelah di semprot dengan H2SO4 terlihat ada 5
bercak, ketiga ekstrak menunjukan pola kromatogram yang hampir sama, namun berbeda dalam ukuran intensitas. Hal ini mengindikasikan adanya perbedaan konsentrasi senyawa pada tiap ekstrak. Pengamatan dibawah sinar UV pada panjang gelombang 366 nm terlihat noda yang tampak berfluoresensi dengan RF1
0,33 terlihat sejajar pada p.indicus Tangsel, p.indicus Bogor dan p.indicus Yogyakarta, setelah disemprot H2SO4 didapat nilai RF2 0,43 pada p.indicus
Yogya dan p.indicus bogor. Pada bercak selanjutnya terdapat warna kuning sebelum UV dan di semprot H2SO4 pada p.indicus Yogya dengan nilai RF3 0,86
sedangkan p.indicus bogor dengan nilai RF3 0,84. Pada nilai RF4 0,92 pada yogya
dan tangsel serta 0,90 pada bogor. Pada RF5 0,96 terlihat warna hijau sebelum UV
dan sesudah UV pada panjang gelombang 254.
Uji kandungan kimia ekstrak selanjutnya adalah penetapan kadar flavonoid total yang bertujuan untuk menetapkan kadar total golongan metabolit tertentu yang diperkirakan berkontribusi terhadap aktivitas farmakologi. Penetapan kadar flavonoid total ini menggunakan metode Chang. Standar yang digunakan dalam penetapan kadar flavonoid ini adalah kuersetin. Kuersetin digunakan sebagai standar karena sebagian besar kuersetin terdapat di dalam tumbuhan yang mengandung flavonoid. Penetapan kadar dihitung berdasarkan persamaan kurva kalibrasi. Persamaan kurva kalibrasi dapat dilihat pada tabel L.15. Dari hasil penelitian didapat kadar flavonoid total berkisar 3,888 % ±0,001- 4,020 % ±0,007.
Pengujian parameter selanjutnya yaitu susut pengeringan. Penetapan susut pengeringan pada ekstrak merupakan salah satu persyaratan yang harus dipenuhi dalam standardisasi tanaman yang berkhasiat obat. Pada uji susut pengeringan ini dilakukan pengukuran sisa zat setelah pengeringan pada suhu 105oC sampai berat konstan, pada pengujian ini identik dengan kadar air menggunakan metode gravimetri, tetapi bedanya susut pengeringan hanya melihat besarnya senyawa yang hilang pada proses pengeringan. Hasil pengujian susut pengeringan diperoleh sebesar 15,852% ±1,576 -33,367% ±2,843 hal ini menunjukan bahwa senyawa yang hilang pada ekstrak p.indicus antara 15,852% ±1,576 -33,367% ±2,843.
Pemeriksaan parameter non spesifik selanjutnya adalah kadar abu total dan kadar abu tidak larut asam. Kadar abu ditetapkan sebagai kadar anorganik (mineral) dalam ekstrak sedangkan kadar abu tidak larut asam sebagai kadar anorganik yang tidak larut asam. Kadar abu penting dilakukan karena kadar abu dapat menunjukan kelayakan suatu sampel untuk pengolahan menjadi sediaan farmasi. Pada tahap ini ekstrak dipanaskan pada suhu 500o C hingga senyawa organik dan turunannya terdestruksi dan menguap sampai tinggal unsur mineral dan organik saja. Hasil kadar abu ekstrak diperoleh sebesar 5,514% ±0,565 - 7,631% ±1,532 sedangkan kadar abu tidak larut asam sebesar 0,058% ±0,039 - 1,486% ±0,246. Besarnya kadar abu total dalam ekstrak menunjukan bahwa ekstrak yang diperoleh dari proses maserasi banyak mengandung mineral, sedangkan adanya kadar abu tidak larut asam menunjukan adanya kotoran atau pasir yang terikut. Pemeriksaan selanjutnya adalah bobot jenis, bobot jenis ekstrak ditentukan dengan menggunakan piknometer. Hasil bobot jenis ekstrak diperoleh 1,008 g/mL ±0,002 -1,021g/mL ±0,011. Bobot jenis dapat digunakan untuk mengetahui kemurnian suatu zat yang ditentukan bobot jenisnya.
jumlah bakteri atau jamur penyebab penyakit atau perusak ekstrak sehingga dapat dicegah keberadaannya (Saifudin, et al.2011).
Hasil cemaran mikroba dari ekstrak etanol P.indicus Tangerang Selatan dengan media nutrient agar (NA)
Pengenceran 10-1 (g/ml)
Hasil cemaran mikroba dari ekstrak etanol P.indicus Bogor dengan media nutrient agar (NA ) Pengenceran 10-1 (g/ml)
Hasil cemaran mikroba dari ekstrak etanol P.indicus Bogor dengan media nutrient agar (NA ) Pengenceran 10-1 (g/ml)
1 2
1 2
Hasil uji cemaran mikroba P.indicus di dapatkan tidak melebihi persyaratan yang ditetapkan oleh buku Monografi Ekstrak Tumbuhan Obat, jilid II yaitu 104 koloni/g. Rendahnya pertumbuhan bakteri ini juga bisa disebabkan karena ekstrak yang digunakan adalah etanol yang dapat menghambat pertumbuhan bakteri atau mikroba dalam ekstrak. Selain itu, menurut literatur P.indicus mempunyai aktifitas antibakteri.
Hasil cemaran kapang / khamir dari ekstrak etanol P.indicus Bogor dengan media Potato Dextrose Agar (PDA)
Pengenceran 10-1 (g/ml)
Pengujian cemaran kapang / khamir juga tidak melebihi persyaratan yang ditetapkan oleh buku Monografi Ekstrak Tumbuhan Obat, jilid II yaitu 103 koloni /g.
Penetuan kadar kandungan logam (Pb, Cd, dan AS) menggunakan alat AAS. Dari hasil yang didapat pada tabel 4.5 dapat terlihat bahwa kadar cemaran timbal, cadmium dan arsen tidak melebihi batas yang telah ditetapkan dalam buku Monografi Ekstrak Tumbuhan Obat Indonesia volume II. Batas maksimum yang dipersyaratkan yaitu Pb < 10 mg/kg dan Cd < 0,3 mg/kg dan As < 5 µg/kg. Penentuan kandungan logam berat pada ekstrak perlu dilakukan untuk menjamin bahwa ekstrak tidak mengandung logam berat melebihi batas yang ditetapkan karena bersifat toksik terhadap tubuh. Keracunan akut logam berat dapat disebabkan karena pemasukannya baik melalui pernafasan maupun melalui oral ataupun pori-pori kulit. Efek keracunan yang umum adalah iritasi saluran pernafasan bagian atas, mual, muntah, salivasi, mencret dan kejang perut. Efek berbahayanya adalah bila logam berat tersebut terakumulasi dan berikatan kuat dalam jaringan tubuh.