ABSTRAK
PEMANFAATAN KULIT BUAH KOPI SEBAGAI SUMBER NUTRIEN DALAM KULTUR Spirulina sp.
Oleh
DWINDA PANGENTASARI
Spirulina sp. adalah mikroalga yang dimanfaatkan sebagai pakan alami dalam pembenihan ikan. Kandungan nutrisi Spirulina sp. merupakan sumber protein yang potensial bagi benih ikan dan udang. Tujuan penelitian ini adalah untuk mengetahui pemanfaatan kulit buah kopi sebagai sumber nutrien dalam kultur Spirulina sp. Penelitian dilakukan selama 216 jam dengan rancangan penelitian yang digunakan adalah Rancangan Acak Lengkap (RAL). Spirulina sp. dikultur pada botol kaca 250 ml dengan 6 perlakuan dan 3 kali ulangan. Media kultur yang digunakan mengandung akuades dan kulit buah kopi. Konsentrasi media kulit buah kopi yang diberikan yaitu A (0%), B (0,5%), C (1,5%), D (2,5%), E (3,5%) dan F (4,5%). Hasil Analisis Varian (P<0,05) menunjukkan bahwa media kulit buah kopi memberikan pengaruh terhadap peningkatan kepadatan populasi Spirulina sp.. Penambahan media kulit buah kopi sebesar 4,5% menghasilkan kepadatan populasi Spirulina sp. tertinggi yaitu sebesar 3,326.105 unit/ml pada jam ke-120. Suhu, pH dan intensitas cahaya selama kultur berada dalam kisaran optimal.
ABSTRACT
POTENTIAL OF COFFEE’S EXOCARP AS A SOURCE OF NUTRIENT IN Spirulina sp. CULTURE
By
DWINDA PANGENTASARI
Spirulina sp. is microalgae that have been used as the food larvae. Nutrition of Spirulina sp. is a potential source of protein for fish and shrimp. The aim of this research is to determine the potential of coffee’s exocarp as a source of nutrients in the Spirulina sp.’s culture. The research was conducted over 216 hours and used a completely randomized design (CRD) with 6 treatments and 3 replications.
Spirulina sp. cultured in 250 ml glass bottles, culture media were used containing distilled water and coffee’s exocarp. The treatments of media concentration were A(0%), B(0,5%), C(1,5%), D(2,5%), E(3,5%) and F(4,5%). Based on Analysis of Varian (P<0,05) showed that medium of coffee’s exocarp give an effect to the increase in population density of Spirulina sp.. The addition of the concentrate medium of coffee’s exocarp 4,5%, produced the highest population density of
Spirulina sp., that was 3,326.105 units/ml at 120 hours. The water temperature, pH and light intensity of culture in the optimal range.
Keywords : coffee’s exocarp, microalgae, nutrient, Spirulina sp., addition of
RIWAYAT HIDUP
Penulis dilahirkan di Bandar Lampung pada tanggal 30 Juli
1993, sebagai anak kedua dari empat bersaudara, dari
pasangan Bapak Asep Ridwan dan Ibu Mislianah.
Pendidikan formal diawali dari pendidikan dasar di SD 4 Simpang Gadis tahun
1998 – 2004. Pendidikan tingkat pertama di SMP Negeri I Sumberjaya pada tahun
2004-2007. Pendidikan tingkat atas di SMA Negeri I Sumberjaya pada tahun
2007-2010. Pada tahun 2010, penulis terdaftar sebagai mahasiswa program studi
Budidaya Perairan, Fakultas Pertanian, Unviersitas Lampung melalui jalur Seleksi
Nasional Masuk Perguruan Tinggi Negeri (SNMPTN).
Penulis aktif dalam organisasi HIDRILA (Himpunan Mahasiswa Budidaya
Perairan Unila) sebagai Anggota Bidang Kewirausahaan periode 2011-2012 dan
sebagai Anggota Bidang Minat dan Bakat periode 2012-2013. Selama menjadi
mahasiswa, penulis pernah menjadi asisten praktikum Ikhtiologi, Oceanografi,
Fisiologi Hewan Air, Ekologi Perairan dan Produktivitas Kolam.
Penulis melaksanakan Praktik Umum (PU) di Unit Kerja Budidaya Air Tawar
Cangkringan, Yogyakarta dengan judul “Pembenihan Ikan Mas Merah (Cyprinus carpio) di Unit Kerja Budidaya Air Tawar Cangkringan, Yogyakarta” pada tahun 2013 dan melaksanakan Kuliah Kerja Nyata (KKN) Tematik di Desa Tanjung
“Dan seandainya pohon-pohon di bumi menjadi pena dan laut (menjadi tinta). Ditambahkan kepadanya tujuh laut (lagi) sesudah (kering) nya, niscaya tidak akan habis-habisnya (dituliskan) kalimat Allah, sesungguhnya Allah Maha Perkasa lagi Maha Bijaksana” (Q.S. Al Luqman : 27)
Puji syukur, ku panjatkan pada Allah SWT. yang telah
menciptakanku dengan taburan cinta dan kasih sayang. Curahan
rahmat dan hidayah-Mu telah memberikanku kesehatan, kekuatan
dan semangat pantang menyerah, serta rencana-rencana indah-Mu.
Atas kemudahan yang telah Engkau berikan, akhirnya skripsi ini
dapat terselesaikan dengan baik dan tepat pada waktunya. Sholawat
dan salam selalu ku limpahkan pada-Mu,
Allah SWT. Tuhan Semesta Alam
.
Kupersembahkan skripsi ini untuk orang-orang tercinta dan
tersayang, teristimewa untuk
PAPA
dan MAMA
terimakasih
atas segala usaha, jerih payah, do’a, dukungan, bimbingan dan
pengorbanan kalian selama selama ini. Kakak dan adik-adikku atas
do’a dan dukungannya serta sahabat
-sahabat terbaik yang selalu
memberi motivasi, semangat, dukungan dan gurau canda yang
terindah.
MOTO
“Perjalanan seribu batu di awali dengan satu langkah”.
(Lao Tze).
“Barang siapa yang menghendaki kehidupan dunia, maka
wajib baginya memiliki ilmu, dan barang siapa yang
menghendaki kehidupan akhirat, maka wajib baginya
memiliki ilmu, dan barang siapa yang menghendaki
keduanya, maka wajib baginya memiliki ilmu”.
(HR. Turmudzi)
“Tuntutlah imu dan belajarlah (untuk ilmu)
ketenangan dan kehormatan diri, dan bersikaplah
rendah hati kepada orang yang mengajar kamu”.
“Aku akan berjalan bersama mereka yang berjalan karena aku
tidak akan diam sebagai penonton yang menyaksikan
perarakan berlalu”. (Khalil Gibran)
“Seseorang yang melakukan kesalahan dan tidak
membenarkannya, berarti telah melakukan satu
kesalahan lagi”. (Conficius)
“Sepotong besi tidak akan pernah menjadi pisau
belati, tanpa merasakan panasnya bara api dan
kerasnya palu”. (Ibnu Syahri
-al Basami)
“Hiduplah seperti pohon kayu yang lebat buahnya,
hidup di tepi jalan dan di lempari orang dengan
batu, tetapi di balas dengan buah”.
SANWACANA
Alhamdulillah puji syukur penulis haturkan kehadirat Allah SWT. atas rahmat dan
hidayah-Nya penulisan skripsi yang berjudul “Pemanfaatan Kulit Buah Kopi
(Coffea robusta) sebagai Sumber Nutrien dalam Kultur Spirulina sp.” yang
merupakan salah satu syarat untuk memperoleh gelar sarana Budidaya Perairan di
Universitas Lampung, dapat diselesaikan dengan baik. Shalawat serta salam tak
lupa penulis curahkan kepada Nabi Muhammad SAW. yang selalu menjadi suri
tauladan bagi kita.
Dalam kesempatan ini penulis mengucapkan terima kasih kepada:
1. Papa dan Mama yang telah memberikan kasih sayang, dukungan, motivasi, perhatian, pengorbanan, bimbingan, semangat, do’a dan segala jerih payahnya selama masa perkuliahan dan penyelesaian skripsi.
2. Bapak Prof. Dr. Ir. Wan Abbas Zakaria, M.S., selaku Dekan Fakultas
Pertanian Universitas Lampung.
3. Ibu Ir. Siti Hudaidah, M. Sc., selaku Ketua Program Studi Budidaya Perairan
Fakultas Pertanian Universitas Lampung, yang telah memberikan izin dan
dukungannya dalam melaksanakan penelitian, dan selaku Pembimbing
Akademik atas kesediaannya untuk memberikan bimbingan dan arahannya
kepada penulis selama masa perkuliahan, serta selaku Penguji skripsi atas
koreksi, masukan dan saran kepada penulis dalam penyelesaian skripsi ini.
4. Ibu Berta Putri S. Pi., M. Si., selaku Pembimbing Utama yang telah
memberikan bimbingan, arahan, dukungan, motivasi, ide, kritik dan saran
serta waktu yang telah diluangkan selama proses penyusunan skripsi.
5. Ibu Henni Wijayanti.M, S.Pi., M.Si, selaku Pembimbing Kedua yang telah
memberikan arahan, bimbingan, ide, kritik dan saran selama proses
6. Bapak Frenklin dan staf-staf di PTPN VII, Unit Usaha Bekri, Lampung
Tengah yang telah memberikan inokulan sebagai bahan untuk penelitian serta
atas pemberian masukan, ilmu dan arahan selama berlangsungnya penelitian.
7. Seluruh dosen serta Staf Administrasi Program Studi Budidaya Perairan atas
ilmu dan bimbingannya selama perkuliahan.
8. Seluruh anggota keluarga Tante, Om, Nenek, Kakek, Kakak dan Adik-adikku yang telah memberikan perhatian, semangat, dukungan dan do’a-do’anya selama masa perkuliahan dan penyusunan skripsi.
9. Yuli Widayati selaku teman seperjuangan, sahabat, serta partner yang luar
biasa atas segala bantuan, kerjasama, tangis dan tawa selama masa-masa
perkuliahan, penelitian dan penyusunan skripsi.
10.Jelita Noviantina, Yuli Widayati, Dike Fransiska, Sera Hardiyani, Afrima Nur
Darajatun, Nyi Ayu Ika Pratiwi, Reinita Orchid Febrisca Emilly selaku teman
seperjuangan serta sahabat-sahabat terbaik atas segala bantuan, semangat,
kebersamaan, kesabaran, kehangatan, keterbukaan, pengorbanan, perhatian,
ketidakcocokan, perselisihan, keegoisan, ketidakdewasaan, kesenangan dan
kesedihan serta telah menorehkan kenangan-kenangan indah selama
berlangsungnya perkuliahan, penelitian dan masa-masa penyelesaian skripsi.
Semoga kita dapat terus menjaga tali silahturahmi dan menjadikan
momen-momen berharga menjadi sesuatu yang bisa diingat dan dirindukan ketika kita
telah menjalani kehidupan yang baru.
11.Teman-teman Kuliah Kerja Nyata (KKN) Dian Ekawati, Eka Simarmata, Fitri
Wahyuningsih, F.Inggrid Krismasari yang telah memberikan kehangatan,
kebersamaan, suka dan duka selama menjalani KKN dan masa-masa
penyusunan skripsi.
12.Teman-teman kecil Sherly, Shanti, Agung, Jimmy, Wawan, Sulis, Adi, Oky,
Febby, Titin, Anggun atas kebersamaan, kesenangan dan kesedihan yang
ditorehkan selama ini.
13.Ardiansyah, Ahmad Jumaidi, Ponco Widagdo, Dian Yuni Marita, Tri
Agusaputra, Pratica Fajrin, Rosi Dona.S dan Ahmad Fauzi yang telah
memberikan bantuan selama persiapan penelitian, proses penelitian hingga
14.Teman-teman seperjuangan, mahasiswa Budidaya Perairan Angkatan 2010
atas segala pengorbanan, perhatian, kerja sama, kecekcokan, kelucuan,
kepedihan, keributan dan kebersamaan, Assovaria, Winda, Asry, Windi, Vina,
Septi, Aulia, Selvi, Ely, Siti, Safrina, Frisca, Duma, Dwi Risca, Nikky, Soma,
Aan, Anggi, Anjar, Shoffan, Dio, Median, Adit, Febri, Baihaqi, S.A Mandala,
Erwin, Ali, Eko, Yuti, Andi, Ajil, Rudi, Rico, Aris, Hermawan, Imam, Azis
dan Robert.
15.Kakak Tingkat dari Angkatan 2004-2009 dan Adik Tingkat dari Angkatan
2011-2014 atas kebersamaan dan kerjasamanya selama ini.
16.Semua pihak yang tidak dapat disebutkan satu persatu. Penulis berharap
semoga Allah SWT membalas amal kebaikan yang telah kalian berikan.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan, namun
sedikit harapan semoga skripsi ini dapat berguna sebagai bahan referensi dalam
menunjang kemajuan ilmu pengetahuan khususnya di bidang perikanan.
Bandar Lampung, 17 September 2014
Penulis,
DAFTAR ISI
5.Faktor-faktor Pertumbuhan... 10
V. KESIMPULAN DAN SARAN
A. Kesimpulan ... 42 B. Saran ... 42
DAFTAR TABEL
Tabel Halaman
1. Kandungan Nutrisi Kulit Biji dan Kulit Buah Kopi ... 18 2. Hasil Analisis Nitrogen dan Fosfor dari Kulit Buah Kopi ... 18 3. Kandungan Kulit Buah Kopi Berdasarkan Metode Pengolahan ... 19 4. Kepadatan Populasi Pertumbuhan Spirulina sp. selama sembilan hari .
Kultur ... ... 29 5. Kepadatan Populasi Spirulina sp. yang dikultur dengan Berbagai ...
Limbah Media Organik ... 33 6. Kecepatan Pertumbuhan Spirulina sp. dalam Media Kulit Buah Kopi
DAFTAR GAMBAR
Gambar Halaman
1. Bagan Kerangka Pikir ... 4
2. Spirulina sp... ... ... 6
3. Siklus Reproduksi Spirulina sp. ... 8
4. Grafik Fase Pertumbuhan Mikroalga ... 14
5. Tanaman Kopi Robusta ... 16
6. Penempatan Botol Kultur selama Penelitian ... 22
7. Grafik Pertumbuhan Spirulina sp. selama sembilan hari ... 27
DAFTAR LAMPIRAN
Lampiran Halaman
1. Kandungan Nutrisi Spirulina sp. ... 49
2. Kandungan Nutrisi Kulit Buah Kopi ... 51
3. Hasil Uji SPSS Analisis Varian (ANOVA). ... 53
4. Data Hasil Uji Nitrogen Kulit Buah Kopi ... 54
5. Data Hasil Uji Fosfor Kulit Buah Kopi ... 55
6. Hasil Uji SPSS BNT ... 56
7. Tabel Faktor Lingkungan selama Penelitian ... 58
8. Data Jumlah Kepadatan Spirulina sp. selama Penelitian ... 59
9. Pembuatan Ekstrak Media Kulit Buah Kopi ... 60
10. Tahap-tahap Pelaksanaan Penelitian ... 61
11. Tahap-tahap Pengamatan ... 62
12. Diagram Alir Pembuatan Larutan Buffer... 63
13. Kultur Spirulina sp. pada saat T-0 dan T-akhir ... 64
14. Alat-alat Penelitian ... 65
1
I. PENDAHULUAN
A. Latar Belakang Masalah
Spirulina sp. adalah mikroalga dari golongan Cyanobacteria yang dimanfaatkan sebagai pakan alami dalam budidaya perikanan khususnya
pembenihan karena memiliki nutrisi tinggi, antara lain protein 63-68 %,
karbohidrat 18-20 %, dan lemak 2-3 % (Hariyati, 2008). Selain itu, Spirulina sp. berperan sebagai produsen primer dalam struktur rantai makanan di perairan.
Spirulina sp. relatif cepat bereproduksi dan mudah dalam sistem pemanenan karena memiliki ukuran yang lebih besar dibandingkan mikroalga lain (Khoirul,
2013). Selain untuk keperluan budidaya, Spirulina sp. juga digunakan dalam bidang industri, farmasi dan bahan pangan manusia sebagai sumber Protein Sel
Tunggal (PST) (Liu et al, 2000).
Tingginya permintaan terhadap Spirulina sp., menyebabkan produksi
Spirulina sp. meningkat. Salah satu cara untuk meningkatkan kelimpahan populasinya yaitu menyediakan media pertumbuhan yang dibutuhkan Spirulina
sp., diantaranya nutrien, intensitas cahaya, pH dan suhu (Lavens and Sorgeloos,
1996). Komposisi media kultur sebagai sumber nutrien diperlukan untuk
2
Kulit kopi merupakan sumber nutrien yang tersedia melimpah di sentra
produksi kopi. Secara kimiawi kulit kopi mengandung bahan organik seperti
karbon (C), hidrogen (H) dan oksigen (O) yang terikat dalam bentuk senyawa
selulosa (45%), hemi-selulosa (25%), lignin (2 %), resin (45%), dan abu (0,5 %)
(Etika, 2007).
Kopi merupakan komoditi perkebunan andalan Indonesia yang banyak
dikelola untuk kebutuhan masyarakat mulai dari perkebunan negara, swasta
maupun masyarakat umum. Pengolahan kopi menghasilkan limbah yang sering
menyebabkan pencemaran lingkungan. Sejauh ini, limbah kulit buah kopi hanya
diolah menjadi kompos. Menurut data statistik, luas lahan perkebunan kopi di
Kabupaten Lampung Barat mencapai 59.357 ha dengan produksi 29.712 ton.
Sementara itu, produksi biji kopi di Indonesia mencapai 611.100 ton dan
menghasilkan kulit kopi sebesar 1.000.000 ton. Jika limbah tersebut tidak
dimanfaatkan secara optimal akan menimbulkan pencemaraan lingkungan
(DJPDP, 2011). Oleh karena itu, perlu dilakukan penelitian yang mampu
memanfaatkan kulit buah kopi menjadi suatu produk yang bernilai ekonomis,
salah satunya dengan menjadikan kulit buah kopi sebagai sumber nutrien dalam
kultur Spirulina sp. B. Tujuan Penelitian
Penelitian yang dilakukan bertujuan untuk mengetahui pertumbuhan populasi
3
C. Manfaat Penelitian
Hasil penelitian yang dilakukan diharapkan dapat memberikan informasi
mengenai pemanfaatan kulit buah kopi sebagai sumber nutrien dalam kultur
Spirulina sp. serta dapat mengurangi jumlah limbahnya di alam.
D. Kerangka Pikir
Kopi adalah salah satu tanaman perkebunan yang melimpah di Indonesia dan
mempunyai peluang untuk dikembangkan lebih maksimal sehingga meningkatkan
penghasilan pengusaha dan petani serta pendapatan negara. Produksi kopi di
Indonesia yang terus berkembang kurang diikuti dengan penanganan kopi pasca
panen yang baik terutama kulit buah kopi yang berkisar antara 40 % sampai 55 %
dari total produksinya. Hal tersebut karena pemanfaatan kulit buah kopi belum
banyak sehingga petani membuang limbah tersebut ke pekarangan rumah, kebun,
sawah ataupun perairan (Etika, 2007). Kulit buah kopi yang tidak dimanfaatkan
menyebabkan pencemaran lingkungan sehingga perlu dilakukan suatu usaha
untuk memanfaatkan limbah yang ada agar menghasilkan produk yang bernilai
ekonomis.
Salah satu usaha pemanfaatan kulit buah kopi dengan dijadikan pupuk
organik karena berpotensi sebagai sumber bahan organik. Kulit buah kopi
mengandung nutrisi yang dapat mencukupi kebutuhan hidup plankton, salah
satunya Spirulina sp. Menurut Trisilawati dan Gusmaini (1999), kadar hara pada limbah kulit buah kopi dalam bentuk tepung yaitu 24,86% carbon, 1,88%
4
Permintaan kopi tinggi
analisis yang dilakukan di Laboratorium Politeknik Negeri Lampung
menunjukkan kandungan nitrogen dan fosfor pada ekstrak kulit buah kopi
0,0959% dan 0,114%.
Pemanfaatan Spirulina sp. dalam berbagai industri, meningkatkan permintaan konsumen sehingga produsen berusaha semaksimal mungkin meningkatkan
produksinya. Harrison and Berges (2005) menyatakan bahwa salah satu cara
untuk meningkatkan pertumbuhan fitoplankton adalah mengontrol kandungan
nutrien baik makro maupun mikro pada lingkungan budidaya. Kulit buah kopi
merupakan salah satu media yang memiliki kandungan nutrien baik makro
maupun mikro yang dibutuhkan untuk pertumbuhan Spirulina sp.. Oleh karena itu, selain digunakan sebagai sumber nutrien dalam kultur Spirulina sp., pemanfaatan kulit buah kopi juga dapat mengurangi limbahnya di alam.
Gambar 1. Bagan Kerangka Pikir Produksi tanaman kopi meningkat
Produk yang dipasarkan Limbah berupa kulit buah kopi yang dihasilkan
melimpah
Pemanfaatan kulit buah kopi sebagai sumber nutrien dalam kultur Spirulina sp.
Penurunan jumlah limbah di alam Peningkatan produksi
5
E. Hipotesis
Hipotesis yang digunakan dalam penelitian ini yaitu :
Ho : τi = 0 : Pada selang kepercayaan 95%, pemanfaatan kulit buah kopi sebagai
sumber nutrien tidak berpengaruh terhadap kepadatan populasi
Spirulina sp.
H1 : τi ≠ 0 : Pada selang kepercayaan 95%, pemanfaatan kulit buah kopi sebagai
sumber nutrien berpengaruh terhadap kepadatan populasi
6
II. TINJAUAN PUSTAKA
A. Spirulina sp. 1. Klasifikasi
Klasifikasi Spirulina sp. menurut Bold & Wyne (1985) adalah sebagai berikut:
Kingdom : Protista
Filum : Cyanobacteria
Divisi : Cyanophyta
Kelas : Cyanophyceae
Ordo : Nostocales
Famili : Oscilatoriaceae
Genus : Spirulina
Spesies : Spirulina sp.
7
2. Morfologi
Spirulina sp. merupakan organisme autotrof berwarna hijau kebiruan, menyerupai spiral dengan sel membentuk filamen terpilin sehingga disebut juga
alga biru hijau berfilamen. Spirulina sp. berdiameter 1-12 mikrometer dan memiliki bentuk tubuh menyerupai benang yang merupakan rangkaian sel yang
berbentuk silindris dengan dinding sel yang tipis. Selain itu, filamen Spirulina sp. juga dapat hidup soliter (Haryati, 2008).
Menurut Kebede and Ahlgren (1996), Spirulina sp. adalah jenis Cyanobacteria yang mengandung klorofil dan dapat melakukan fotosintesis untuk
membuat makanan sendiri. Zat warna alami yang dikandung Spirulina sp. terdiri atas pigmen hijau, merah, kuning dan biru (Richmond, 1988 dalam Borowitzka, 1994). Kandungan fikosianin yang tinggi pada mikroalga ini menyebabkan
warnanya cenderung hijau biru. Spirulina sp. memiliki struktur trichoma spiral dengan filamen–filamen bersifat mortal dan tidak memiliki heterosit. Sel
Spirulina sp. berukuran relatif besar yaitu 110 µm, sehingga dalam proses pemanenan dengan menggunakan kertas saring lebih mudah (Richmond, 1988
dalam Borowitzka, 1994).
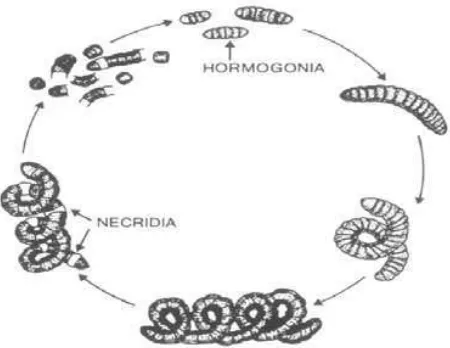
3. Reproduksi
Siklus reproduksi Spirulina sp. terdiri atas tiga tahap yaitu fragmentasi trikoma, pembesaran sel hormogonia dan perpanjangan trikoma. Kemudian
trikoma dewasa dibagi menjadi filamen atau hormogonia, lalu sel-sel hormogonia
akan meningkat dengan pembelahan biner dan tumbuh memanjang membentuk
8
Gambar 3. Siklus Reproduksi Spirulina sp. Sumber: Hongmei Gong et al., (2008)
Spirulina sp. bereproduksi dengan fragmentasi. Fragmentasi adalah pemutusan bagian tubuh yang kemudian membentuk individu baru. Pada filamen
yang panjang jika salah satu selnya mati maka sel mati itu membagi filamen
menjadi 2 bagian atau lebih. Masing-masing bagian disebut hormogonium. Selain
itu, fragmentasi juga terjadi pada pemisahan dinding yang berdekatan pada
trikoma. Pada proses fragmentasi, filamen yang panjang akan terputus menjadi
dua atau lebih benang pendek. Setiap hormogonium akan tumbuh menjadi filamen
baru. Tempat pemutusan filamen adalah sel mati yang terdapat diantara sel
penyusun filamen (Khoirul, 2013).
Selain bereproduksi dengan fragmentasi, Spirulina sp. juga bereproduksi dengan pembelahan biner. Pembelahan biner merupakan pembelahan sel secara
langsung yang dapat memperbanyak jumlah filamen. Sel-sel membelah menjadi 2
dan tidak saling terpisah sehingga membentuk filamen yang terdiri atas deretan
9
4. Kandungan nutrisi
Kandungan nutrisi yang ada di dalam Spirulina sp. antara lain protein, vitamin, mineral, asam lemak, asam amino dan berbagai jenis pigmen
(Christwardana dan Hadiyanto, 2012). Spirulina sp. memiliki dinding sel tipis yang tersusun atas kompleks gula dan protein yang mudah dicerna (Sasson, 1997).
Kandungan nutrisi Spirulina sp. lainnya adalah karbohidrat dan lemak. Komposisi lemak Spirulina sp. 0,8%-1% Gamma Linolenic Acid (GLA) yaitu sejenis asam lemak tak jenuh rantai panjang yang berfungsi menurunkan kadar
kolesterol dalam darah. GLA sangat dibutuhkan untuk pertumbuhan, tetapi tidak
dapat disintesis dalam tubuh manusia. Jenis asam lemak lainnya yang terdapat
dalam Spirulina sp. adalah Eicose Pentanic Acid (EPA) yang juga mampu menurunkan kadar kolesterol dalam darah (Prasetyo dan Kusumaningrum, 2010).
Selain itu, Spirulina sp. juga mengandung berbagai vitamin, mineral, pigmen, asam lemak dan asam amino (Lampiran 1).
Fikosianin atau pigmen biru merupakan pigmen dominan pada Spirulina sp. yang digunakan sebagai zat warna alami dalam makanan. Selain itu, fikosianin
juga berfungsi sebagai zat pewarna pada berbagai macam produk kosmetik karena
pigmen tersebut tidak larut dalam air (Sasson, 1997).
Spirulina sp. memiliki kandungan nutrisi yang tinggi sehingga saat ini terdapat beragam jenis pemanfaatannya mulai dari obat-obatan, kosmetik sampai
pangan manusia. Karakteristik serta kandungan nutrisi yang dimiliki Spirulina sp. sesuai untuk dijadikan bahan makanan fungsional. Pada tahun 1976, Spirulina sp.
10
70% produk Spirulina sp. digunakan untuk pembuatan bahan makanan dan sisanya diperuntukkan sebagai bahan dasar pembuatan pakan ikan dan udang
(Richmond,1988 dalam Borowitzka,1994).
Menurut Christwardana dan Hadiyanto (2012), Spirulina sp. memiliki kandungan mineral yang rendah sehingga tidak berbau amis dan aman untuk
digunakan sebagai makanan manusia. Selain itu, Spirulina sp. juga dapat digunakan sebagai agen penetral arsenik untuk air limbah dan bahan beracun serta
logam berat lainnya (Liu, et al., 2000). Pada perairan yang mengalami pencemaran karena polutan, Spirulina sp. dapat dimanfaatkan untuk merestorasi karena mampu menurunkan BOD dalam air limbah. Selain itu, Spirulina sp. juga memiliki kemampuan untuk mengatasi masalah eutrofikasi perairan karena
menurunkan kadar P dan N (Prasetyo dan Kusumaningrum, 2010).
Spirulina sp. berfungsi sebagai sumber nutrisi untuk immunostimulan dan
Super Oxyde Dismutase (SOD). Beberapa rumah sakit di negara modern menggunakan Spirulina sp. untuk mendapatkan immunoglobin A (LGA) dan immunoglobin B (lgM) yang lebih tinggi. Sementara itu, kandungan fikosianin
dalam Spirulina sp. berpotensi untuk menghambat pertumbuhan sel leukimia pada manusia (Liu, et al., 2000).
5. Faktor-faktor pertumbuhan
Kelangsungan hidup dan pertumbuhan suatu mikroalga sangat erat kaitannya
dengan ketersediaan nutrien (unsur hara) serta kondisi lingkungan. Pertumbuhan
mikroalga dipengaruhi oleh media kultur/nutrien, intensitas cahaya, pH, aerasi dan
11
5.1 Media kultur/nutrien
Nutrien merupakan faktor yang sangat penting untuk pertumbuhan dan
komposisi biokimia mikroalga. Kondisi nutrien yang optimum diperlukan untuk
mendapatkan nilai produktivitas kultur mikroalga yang tinggi disertai kualitas
biomasa yang baik. Konsentrasi nutrien yang rendah dapat menyebabkan
penurunan laju pertumbuhan karena sel-sel alga kekurangan unsur makanan.
Pertumbuhan Spirulina sp. membutuhkan bermacam-macam nutrien yang secara umum dibagi menjadi unsur makro dan unsur mikro. Unsur makro
merupakan nutrien yang dibutuhkan dalam jumlah besar yaitu terdiri atas N, P, K,
Na, S, C, H, O, Mg. Sementara itu, unsur mikro merupakan nutrien yang
dibutuhkan dalam jumlah sedikit yaitu terdiri atas Bo, Mo, Cu, Zn dan Co (Fogg
and Thake, 1987). Komponen vitamin yang tersedia dalam media juga dapat
mempercepat pertumbuhan terutama kandungan vitamin B12 (Becker,1995;
Andersen, 2005).
Menurut Richmond (1988) dalam Borowitzka (1994), faktor utama dalam media sangat bergantung pada komposisi hara nitrogen dan fosfor. Berkurangnya
nitrogen dan fosfor menyebabkan penurunan konsentrasi CO2 dan O2.
Nitrogen merupakan komponen esensial dari struktur dan fungsional protein
pada sel mikroalga. Secara umum, mikroalga memiliki kemampuan yang terbatas
untuk memproduksi material penyimpan nitrogen ketika tumbuh pada kondisi
nitrogen yang mencukupi kecuali sianofisin dan fikosianin (Boussiba and
Richmond, 1980). Sementara fosfor adalah makro nutrien yang memegang
peranan penting dalam proses metabolisme seluler dengan membentuk berbagai
12
pertumbuhan dan perkembangan mikroalga. Beberapa gejala dari kekurangan
fosfor mirip pada kultur dengan nitrogen terbatas. Kandungan klorofil a
cenderung mengalami penurunan sedangkan kandungan karbohidrat akan
mengalami peningkatan pada kondisi penurunan senyawa fosfor (Belay, 2002).
5.2 Intensitas cahaya
Cahaya merupakan sumber energi dalam proses fotosintesis yang berguna
untuk pembentukan senyawa karbon organik. Intensitas cahaya sangat
menentukan pertumbuhan fitoplankton yaitu dilihat dari lama penyinaran dan
panjang gelombang yang digunakan untuk fotosintesis. Cahaya berperan penting
dalam pertumbuhan mikroalga, tetapi kebutuhannya bervariasi yang disesuaikan
dengan kedalaman kultur dan kepadatannya. Kedalaman dan kepadatan kultur
yang lebih tinggi menyebabkan intensitas cahaya yang dibutuhkan tinggi. Akan
tetapi, intensitas cahaya yang terlalu tinggi dapat menyebabkan fotoinhibisi dan
pemanasan. Penggunaan lampu dalam kultur mikroalga minimal dinyalakan 18
jam per hari, hal tersebut dilakukan sampai mikroalga dapat tumbuh dengan
konstan dan normal (Coutteau, 1996) . Menurut Suryati (2002), intensitas cahaya
yang optimal untuk pertumbuhan Spirulina sp.berkisar antara 1500-3000 lux dan tidak melebihi 4000 lux untuk menghindari foto inhibisi.
5.3 pH
Penentuan kisaran pH media kultur penting untuk pertumbuhan Spirulina sp.. Kisaran pH merupakan salah satu faktor penentu bagi pertumbuhan Spirulina sp. yang dapat menentukan kemampuan biologi mikroalga dalam memanfaatkan
unsur hara (Fogg and Thake 1987). Kisaran pH berperan untuk menentukan
13
CO2 sebagai hasil perubahan bikarbonat menjadi karbonat berlangsung sampai
absorpsi dari udara mencapai keadaan seimbang dengan penggunaan CO2 oleh
Spirulina sp.. Pada saat pH meningkat sampai melewati ambang batas maka kecepatan metabolisme dari Spirulina sp. akan menurun. Selain itu, pH juga berpengaruh terhadap penyediaan nutrien dan keadaan fisiologis Spirulina sp. (Ciferri, 1983).
Derajat keasaman atau pH digambarkan sebagai keberadaan ion hidrogen.
Variasi pH dapat mempengaruhi metabolisme dan pertumbuhan kultur mikroalga
antara lain mengubah keseimbangan karbon anorganik, mengubah ketersediaan
nutrien dan mempengaruhi fisiologi sel. Kisaran pH untuk pertumbuhan Spirulina
sp. antara 8,5 – 10,5 (Cifferi, 1983).
5.5 Suhu
Suhu merupakan salah satu faktor penting yang mempengaruhi pertumbuhan
fitoplankton. Perubahan suhu berpengaruh terhadap proses kimia, biologi dan
fisika. Peningkatan suhu dapat menurunkan suatu kelarutan bahan dan dapat
menyebabkan peningkatan kecepatan metabolisme dan respirasi fitoplankton
diperairan. Secara umum suhu optimal dalam kultur mikroalga berkisar antara
20-30oC (Hariyati, 2008). Suhu dalam kultur diatur sedemikian rupa bergantung pada
medium yang digunakan. Suhu di bawah 16oC dapat menyebabkan kecepatan
pertumbuhan turun, sedangkan suhu diatas 36oC dapat menyebabkan kematian.
Beberapa mikroalga tidak tahan terhadap suhu yang tinggi. Pengaturan suhu
dalam kultur mikroalga dapat dilakukan dengan menggunakan alat pengatur suhu
14
Menurut Lavens and Sorgeloos (1996), Spirulina sp. yang paling umum dibudidayakan mampu mentolerir suhu antara 16 dan 27°C. Suhu lebih rendah
dari 16°C akan memperlambat pertumbuhan, sedangkan yang lebih tinggi dari
35°C akan mematikan bagi sejumlah spesies.
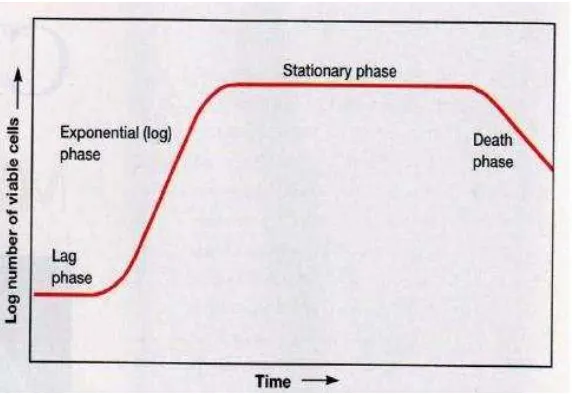
6. Fase Pertumbuhan
Terdapat 4 fase dalam pertumbuhan mikroalga yaitu fase lag (fase adaptasi),
fase eksponensial, fase stasioner dan fase kematian. Fase-fase pertumbuhan
mikroalga tersebut dapat dilihat pada Gambar 4.
Gambar 4. Grafik Fase Pertumbuhan Mikroalga Sumber: Brock and Madigan (1991)
6.1Fase Lag
Fase lag atau fase adaptasi merupakan fase ketika populasi mikroalga tidak
mengalami perubahan, tetapi ukuran sel pada fase tersebut meningkat.
Fotosintesis masih aktif berlangsung dan organisme mengalami metabolisme
tetapi belum terjadi pembelahan sel sehingga kepadatannya belum meningkat.
Fase lag diawali dengan terjadinya penyesuaian sel terhadap lingkungan baru.
15
disintesis dahulu guna berlangsungnnya aktivitas biokimia sel selanjutnya. Pada
fase lag populasi mikroalga tidak mengalami perubahan, tetapi ukuran sel pada
fase tersebut meningkat (Brock and Madigan, 1991).
6.2Fase Eksponensial
Fase eksponensial diawali dengan pembelahan sel dengan laju pertumbuhan
yang terjadi terus menerus, pertumbuhan pada fase tersebut mencapai maksimal.
Menurut Andersen (2005), fase eksponensial ditandai dengan mulai meningkatnya
kepadatan sel Spirulina sp.. Waktu penggandaan yang tercepat biasanya tercapai ketika fase eksponensial, yaitu fase pertumbuhan ketika sel-sel membelah dengan
cepat dan konstan mengikuti kurva logaritmik. Pada fase tersebut pertumbuhan
dan aktivitas sel berada dalam keadaan maksimum, sehingga pada umur tersebut
sel berada dalam keadaan aktif dan memiliki waktu adaptasi yang pendek selama
proses kultur (Andersen, 2005).
6.3Fase Stasioner
Pada fase stasioner, komposisi mikroalga berubah secara signifikan karena
terbatasnya kandungan nitrat pada media kultur yang mengakibatkan kandungan
karbohidrat meningkat hingga dua kali lipat dari kandungan protein (Brown et al., 1997). Menurut Chu et al., (1982), kandungan karbohidrat total meningkat sesuai dengan umur dari kultur mikroalga. Pada fase tersebut, laju reproduksi atau
pembelahan sel sama dengan laju kematian, artinya penambahan dan pengurangan
mikroalga relatif sama sehingga kepadatan mikroalga cenderung tetap.
6.4Fase Kematian
Fase kematian merupakan fase ketika terjadi penurunan jumlah atau
16
reproduksi. Laju kematian mikroalga dipengaruhi oleh ketersediaan
nutrien,cahaya, temperatur dan umur mikroalga itu sendiri. Kematian sel dapat
disebabkan oleh mulai berkurangnya nutrisi yang tersedia sehingga tidak mampu
mendukung pertumbuhan sel, penurunan kualitas air dan akumulasi metabolit
(NO2 dan NH4+) (Brown et al., 1997). B. Kulit Buah Kopi
Menurut Steenis (1973), klasifikasi kopi robusta adalah:
Kingdom : Plantae
Divisi : Magnoliophyta
Sub Divisi : Angiospermae
Class : Dycotyledoneae
Ordo : Rubiales
Family : Rubiaceae
Genus : Coffea
Spesies : Coffea robusta
Gambar 5. Tanaman Kopi Robusta Sumber: Najiyati dan Danarti (2006)
Kopi robusta pertama kali ditemukan di Kongo pada tahun 1898 dan masuk
ke Indonesia pada tahun 1900. Saat ini kopi robusta termasuk jenis kopi yang
17
Kopi robusta merupakan tanaman dataran tinggi yang tumbuh pada ketinggian
800 m di atas permukaan laut dan tumbuh baik dengan jumlah curah hujan yang
optimal antara 2x103 3x103 mm/tahun. Iklim yang optimal untuk pertumbuhan
tanaman kopi adalah tinggi tempat 0,8x103 – 2x103 m dpl, suhu 15º C –
25ºC, curah hujan 1.750 – 3000 mm/tahun, lamanya bulan kering yaitu 3 bulan.
Kopi robusta adalah spesies tanaman berbentuk pohon. Tanaman ini tumbuh
tegak, bercabang dan bila dibiarkan akan mencapai tinggi 12 m. Tanaman ini
memiliki beberapa jenis cabang yaitu cabang reproduksi, cabang primer, cabang
sekunder, cabang kipas, cabang pecut, cabang balik, dan cabang air (Najiyati dan
Danarti, 2006). Kopi robusta memiliki daun berbentuk bulat, ujungnya agak
meruncing sampai bulat dengan bagian pinggir yang bergelombang. Daun tumbuh
pada batang, cabang dan ranting. Pada cabang Orthrotrop letak daun berselang seling, sedangkan pada cabang Plagiotrop terletak pada satu bidang. Daun kopi robusta ukurannya lebih besar dari arabika (Wachjar, 1984).
Pada umumnya tanaman kopi berbunga setelah berumur sekitar dua tahun.
Bunga yang sudah dewasa mengalami penyerbukan dengan pembukaan kelopak
dan mahkota yang akan berkembang menjadi buah. Kulit buah yang berwarna
hijau akan menguning dan menjadi merah tua seiring dengan pertumbuhannya.
Waktu yang diperlukan dari bunga menjadi buah matang sekitar 6-11 bulan,
bergantung dari jenis dan lingkungan. Kopi robutsa membutuhkan waktu 8-11
bulan untuk tumbuh. Bunga umumnya mekar awal musim kemarau dan buah siap
dipetik di akhir musim kemarau. Di awal musim hujan, cabang primer akan
memanjang dan membentuk daun-daun baru yang siap mengeluarkan bunga pada
18
Kulit buah kopi terdiri atas lapisan bagian luar, daging buah dan kulit tanduk
atau kulit dalam. Lapisan bagian luar (exocarp) adalah lapisan yang berwarna merah apabila sudah masak, kemudian daging buah (mesocarp) mengandung serabut yang bila sudah masak berlendir dan rasanya manis serta kulit tanduk atau
kulit dalam (endocarp) adalah kulit lapisan kulit yang menjadi batas kulit dan biji yang keadaannya agak keras. Kulit buah yang masih muda berwarna hijau tua
yang kemudian berangsur-angsur menjadi hijau kuning, kuning kemerahan, merah
dan merah kehitam. Daging buah yang sudah masak akan berlendir dan rasanya
agak manis. Biji terdiri dari kulit biji dan lembaga (Ciptadi dan Nasution, 1985;
Najiyati dan Danarti, 2006). Kulit buah kopi merupakan bagian kulit terluar pada
buah kopi bertekstur keras dan berserat, sedangkan kulit biji kopi merupakan
bagian kulit pembungkus buah kopi atau disebut juga kulit ari. Menurut
Desmayanti dan Muladi (1995), kandungan nutrisi kulit biji dan kulit buah kopi
dapat dillihat pada Tabel 1.
Tabel 1. Kandungan Nutrisi Kulit Biji dan Kulit Buah Kopi
Zat nutrisi (%) Kulit biji kopi Kulit buah kopi
Bahan kering
Tabel 2. Hasil Analisis Nitrogen dan Fosfor dari Kulit Buah Kopi
Sumber : Laboratorium Politeknik Negeri Lampung, 2013
19
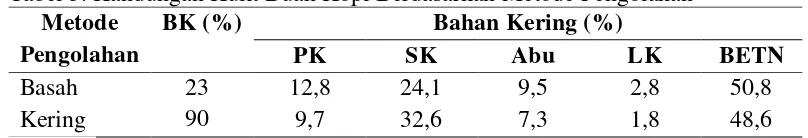
Kulit buah kopi merupakan limbah dari pengolahan buah kopi untuk
mendapatkan biji kopi yang selanjutnya digiling menjadi bubuk kopi. Kandungan
zat makanan kulit buah kopi dipengaruhi oleh metode pengolahannya secara
basah atau kering (Tabel. 3). Kandungan zat makanan kulit buah kopi berdasarkan
metode pengolahan. Pada metode pengolahan basah, buah kopi ditempatkan pada
tanki mesin pengupas lalu disiram dengan air, mesin pengupas bekerja
memisahkan biji dari kulit buah. Sedangkan pada pengolahan kering lebih
sederhana, buah kopi dibiarkan mengering pada batangnya sebelum dipanen.
Selanjutnya langsung dipisahkan biji dan kulit buah kopi dengan menggunakan
mesin (Bromokusumo and Slette, 2010). Berikut kandungan kulit buah kopi
berdasarkan metode pengolahan.
Tabel 3. Kandungan Kulit Buah Kopi Berdasarkan Metode Pengolahan
Metode
Sumber : Bromokusumo and Slette (2010)
Kopi merupakan salah satu tanaman yang penting secara ekonomi maupun
sosial. Tanaman ini merupakan komoditi ekspor utama di negara-negara penghasil
kopi. Indonesia merupakan negara terbesar kedua dalam luas areal perkebunan
kopi namun masih urutan keempat dalam produksi dan ekspor kopi dunia. Sampai
dengan tahun 2008, luas perkebunan kopi Indonesia mencapai 1,3x106 ha dan
produksi perkebunan kopi selama lima tahun terakhir naik sekitar 6%. Pada tahun
2008, diperkirakan mencapai 0,6111x106 ton. Berdasarkan hasil produksi kopi
20
dihasilkan per tahun juga dihasilkan limbah kulit kopi sebesar 1x106 ton (DJPDP,
2011).
Penghasil kopi robusta terbesar di Indonesia adalah Provinsi Lampung
dengan rata-rata produksi sekitar 1,42x105 ton/tahun dengan luas areal sekitar
1,63x105 ha. Setiap tahunnya tidak kurang dari 1,3x105 - 1,4x105 ton biji kopi
dihasilkan dari 1,35x105 ha lahan yang tersebar di sentra-sentra produksi kopi.
Sementara itu, Provinsi Lampung mengekspor sekurang-kurangnya 1,5x105-2x105
ton biji kopi per tahun yang dikirim ke berbagai negara konsumen seperti Jepang,
Amerika Serikat dan Uni Eropa. Produksi kopi di Lampung pada 2012 mengalami
peningkatan bila dibandingkan tahun sebelumnya. Produksi kopi di Kabupaten
Lampung Barat rata-rata mencapai 1,5 ton per ha atau jauh meningkat bila
dibandingkan tahun sebelumnya yang hanya 300-450 kwintal (DJPDP, 2011)
Sementara itu, produksi kopi di Kabupaten Lampung Barat sekitar 29.712 ton
per tahun dengan luas areal tanaman kopi mencapai 59.357 ha yang
dibudidayakan sekitar 45 kepala keluarga (KK) petani. Tanaman kopi di daerah
tersebut sangat dominan dan menjadikan salah satu pendapatan masyarakat
setempat (DJPDP, 2011). Dengan produksi kopi yang meningkat setiap tahunnya
tidak luput dari peningkatan jumlah limbah yang dihasilkan selama produksi.
Jumlah limbah yang tinggi tersebut merupakan suatu potensi yang layak
dimanfaatkan untuk perkebunan, peternakan mapun perikanan (Desmayanti dan
21
III. METODELOGI PENELITIAN
A. Waktu dan Tempat
Penelitian dilaksanakan di Laboratorium Budidaya Perikanan, Program Studi
Budidaya Perairan, Fakultas Pertanian, Universitas Lampung pada bulan Maret -
April 2014.
B. Alat dan Bahan 1. Alat Penelitian
Peralatan yang digunakan dalam penelitian antara lain wadah kultur (botol
kaca), botol film, pipet tetes, pipet ukur, bunsen, lampu TL 36 watt, instalasi
aerasi, mikroskop inokuler, Sedgewick rafter, gelas penutup, tabung erlenmeyer, gelas ukur, kain kasa, termometer ruang, timbangan analitik, alat sentrifugasi,
tabung sentrifuse, counter, autoklaf, aluminium foil dankapas.
2. Bahan Penelitian
Bahan yang digunakan dalam penelitian ini antara lain:
1. Spirulina sp.
Spirulina sp. yang digunakan berasal dari PTPN VII Unit Usaha Bekri, Lampung Tengah yang dikultur di Laboratorium Budidaya Perikanan Program
Studi Budidaya Perairan Fakultas Pertanian Universitas Lampung.
2. Kulit buah kopi
Kulit kopi yang digunakan berasal dari sentra produksi kopi di Desa
22
proses penggilingan kemudian dijemur hingga kering dan dihaluskan sampai
berbentuk tepung. Jenis kopi yang digunakan adalah dari jenis Coffea robusta.
3. Akuades
Akuades yang digunakan disterilisasi menggunakan autoklaf pada suhu 121oC
selama 15 menit untuk menghindari kontaminasi.
4. Buffer
Buffer yang digunakan adalah CaCO3 dengan perbandingan Buffer dan
akuades 1:10.
4. Alkohol 70%
Alkohol digunakan untuk mensterilisasi alat dan bahan.
B. Rancangan Penelitian
Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap
(RAL) yang terdiri atas 6 perlakuan dan 3 kali ulangan. Rancangan penelitian
Selama penelitian dilakukan penempatan dan ulangan secara acak (Gambar 6).
Gambar 6. Penempatan Botol Kultur selama Penelitian
23
Model Rancangan Acak Lengkap (RAL) yang digunakan adalah sebagai
berikut :
Yij = µ + σi + ∑ ij
Keterangan : Yij = Data pengamatan perlakuan ke-i, Ulangan ke-j µ = Nilai tengah umum
σi = Pengaruh penambahan ekstrak air kulit kopi ke-i ∑ij = Galat percobaan pada perlakuan ke-i dan ulangan ke-j
C. Prosedur Penelitian 1. Persiapan
a. Sterilisasi Alat dan Bahan
Persiapan penelitian meliputi persiapan alat dan bahan serta sterilisasi
alat-alat yang akan digunakan untuk mencegah kontaminasi. Seluruh peralat-alatan yang
akan digunakan dalam penelitian dicuci, dikeringkan dan disimpan di tempat yang
kering. Wadah kultur, akuades dan tabung sentrifuse disterilisasi menggunakan
autoklaf pada suhu 121 oC selama 15 menit dengan tekanan 1 atm. Botol film dan
selang aerasi dicuci lalu dikeringkan, kemudian disterilisasi dengan alkohol 70%
dan diletakkan ditempat yang kering.
b. Pembuatan Media Kulit Buah Kopi
Media kulit buah kopi yang digunakan sebagai media pertumbuhan
24
kemudian dihaluskan hingga menjadi tepung dengan jenis kopi yang digunakan
adalah Coffea robusta.
Pembuatan media dilakukan dengan cara :
- Penggilingan buah kopi untuk memisahkan kulit dan biji
- Kulit buah diambil dan dijemur selama 12 jam
- Kulit buah digiling dengan mesin penggiling hingga berbentuk tepung
- Setelah berbentuk tepung, kemudian ditimbang sebanyak 50 gr
- Selanjutnya tepung kulit buah kopi dibungkus dengan kain kasa dan
direndam dalam akuades 150 ml.
- Perendaman dilakukan hingga air berwarna kecoklatan selama ± 30 menit,
kemudian disterilisasi dengan autoklaf pada suhu 121oC selama 15 menit.
c. Menghitung Kepadatan Awal
Perhitungan dilakukan di bawah mikroskop menggunakan kamar hitung
Sedgewick rafter. Spirulina sp. sebanyak 1 ml (kepadatan ± 105 unit/ml) disentrifugasi selama 15 menit dengan kecepatan 2500 rpm untuk memisahkan biomassa Spirulina sp. dari media. Endapan Spirulina sp. diinokulasikan ke dalam masing-masing 200 ml botol kultur yang telah berisi media perlakuan. Jumlah sel
yang digunakan sebagai inokulan ± 105 unit/ml. Penghitungan jumlah bibit
Spirulina sp. untuk kultur menggunakan rumus seperti dibawah ini :
Keterangan:
V1 = Volume bibit untuk penebaran awal (ml)
N1 = Kepadatan bibit/ stock Spirulina sp. (unit/ ml)
V2 = Volume media kultur yang dikehendaki (L)
N2 = Kepadatan bibit Spirulina sp. yang dikehendaki (unit/ml)
25
Wadah kultur secara acak diletakkan ke dalam rak kultur dan diberi
pencahayaan lampu TL 2 buah berkekuatan 36 watt. Lampu diletakkan diantara
wadah kultur yang berjarak 10 cm dari wadah kultur dengan fotoperiodesitas 12
jam terang dan 12 jam gelap.
2. Pelaksanaan a. Sampling
Sampling dilakukan setiap 24 jam sekali dengan mengambil sampel dari
masing-masing wadah kultur sebanyak 1 ml, kemudian diamati di bawah
mikoskop.
b. Pengukuran Kualitas Air dan Lingkungan
Data kualitas air dan lingkungan berupa suhu air, suhu ruang, pH air dan
intensitas cahaya. Pengukuran suhu air, suhu ruang setiap dan pH dilakukan setiap
24 jam sekali. Sementara itu, pengukuran intensitas cahaya dilakukan pada akhir
penelitian.
3. Pengamatan
a. Kepadatan unit Spirulina sp.
Penghitungan unit Spirulina sp. dilakukan dibawah mikroskop menggunakan kamar hitung Sedgewick Rafter. Jumlah sel yang didapat selanjutnya digunakan untuk menghitung kerapatan sel. Perhitungan kerapatan dilakukan dengan
menggunakan rumus sebagai berikut (Sidabutar, 2010).
N
=
n ( ) (
)
Keterangan:
N = Kerapatan Spirulina sp.(unit/ml)
26
lp = Jumlah lapang pandang yang digunakan p = Volume subsampel
v = Volume sampel
b. Kecepatan Pertumbuhan
Menurut Gotelli (1995) dalam Andresen (2005), kecepatan pertumbuhan (k) mikroalga dihitung dengan menggunakan rumus berikut:
K =
Keterangan :
K = Kecepatan pertumbuhan
Nt = Kepadatan populasi pada waktu t
No = Kepadatan populasi sel pada waktu 0
T0 = Waktu awal
Tt = Waktu pengamatan
c. Kualitas Air dan Lingkungan
Data yang diambil yaitu suhu air, suhu ruang, pH dan intensitas cahaya. Suhu
air, suhu ruang dan pH di ukur setiap 24 jam sekali bersamaan dengan
pengambilan sampel. Sementara itu, intensitas cahaya di ukur pada akhir
penelitian dengan menggunakan Lux meter.
4. Analisis Data
Data yang diperoleh dalam penelitian berupa kepadatan populasi dan
kecepatan pertumbuhan. Kepadatan populasi selanjutnya dianalisis dengan
menggunakan analisis ragam ANOVA dan apabila hasil uji antar perlakuan
berbeda nyata maka akan dilakukan uji lanjut beda nyata terkecil (BNT) dengan
V. KESIMPULAN DAN SARAN
A. Kesimpulan
Pemanfaatan kulit buah kopi sebagai sumber nutrien pada kultur Spirulina sp. memberikan pengaruh yang nyata terhadap pertumbuhan Spirulina sp.. Penambahan nutrien kulit buah kopi sebesar 4,5% dalam media kultur Spirulina
sp. menghasilkan kepadatan tertinggi sebesar 3,326 x 105 unit/ml pada jam
ke-120.
B. Saran
1. Perlu dilakukan analisis lebih lengkap kandungan kulit buah kopi secara lebih
lengkap agar diketahui faktor penghambat pertumbuhan Spirulina sp.. selama kultur.
2. Penambahan kandungan Nitrogen dan Fosfor sehingga rasio N/P sesuai dengan
43
DAFTAR PUSTAKA
Akmal dan Filawati. 2008. Pemanfaatan Kapang Aspergillus niger sebagai Inokulan Fermentasi Kulit Kopi dengan Media Cair dan Pengaruhnya terhadap Performans Ayam Broiler. Jurnal Ilmiah Ilmu-Ilmu Peternakan,Vol. XI. No.3. Fakultas Peternakan Universitas Jambi.
Ali K.S and Saleh M. A. 2012. Spirulina - an Overview. International journal of pharmacy and pharmaceutical sciences. Vol 4, issue 3, 2012
Andersen, R.A. 2005. Algal Culturing Technique. Elsevier academic press. UK. Angka dan Suhartono. 2000. Manfaat dan Kandungan Biota-biota Laut. Kanisius.
Yogyakarta
Aprilianita, S. L. 2009. Pengaruh Penambahan FeCl3 terhadap Pertumbuhan Spirulina platensis yang Dikultur pada Media Asal Blotong Kering.
Fakultas Perikanan dan Kelautan. Universitas Airlangga. Surabaya.
Becker, E. W. 1995. Microalgae Biotechnology and Microbiology. Cambrige University Press. New York.
Belay A. 2002. The Potential Application of Spirulina (Arthospira) as Nutritional and Therapeutic Supplement in Health Management. J. of the American Nutraceutical Association. 5: 2.
Bold, H.C, and Wynne, M.J. 1985. Introduction to the Algae Structure and Reproduction. Second Edition. Pretice-Hall Mc. Engelwood Cliffs, New York.
Borowitzka, M.A. 1994. Products from Algae. In S. M. Phang, L. Y. Kun, M. A. Borowitzka, and B. A. Whitton eds. In. Proc. 1st Asia--‐Pacific Conference on Algal Biotechnology. Kuala Lumpur, Malaysia. University of Malaya.
Boussiba, S. and Richmond, A. E. 1980. Isolation and Purification of Phycocyanins from the Blue Green Alga Spirulina platensis. Journal of Archives of Microbiol. 120: 155-159.
44
Brown, M. R., Jeffrey, S. W., Volkman, J. K., and Dunstan, G. A. 1997.
Nutritional Properties of Microalgae for Mariculture. Aquaculture. 151: 315-331.
Bromokusumo, A.K and Slette J. 2010. Indonesia Coffee Annual 2010. Global Agricultural Information Network. USDA Foreign Agricultural Service.
Christwardana,M. dan Hadiyanto M.M.A.N. 2012. Spirulina platensis: Potensinya sebagai Bahan Pangan Fungsional. Jurnal Aplikasi Teknologi Pangan. Vol 2. UNDIP : Semarang
Ciferri, O. 1983. Spirulina The Edible Microorganisme. Microbial Review. American Society.
Ciptadi, W dan Nasution, M.Z. 1985. Pengolahan Kopi. Bogor: Jurusan Teknologi Industri Pertanian IPB
Chu, F. E., Dupuy, J. L., and Webb, K. L. 1982.Polysaccharide Composition of Five Algal Species Used as Food Larvae of the American Oyster, Crassostrea Virginica. Aquaculture. 29:241-252.
Cotteau. 1996. Trends in Ecology and Evolution. Doctor disertation. University of Rostock
Desmayanti, Z dan Muladi. 1995. Pemanfaatan Limbah Kopi dalam Ransum Ayam Pedaging. Warta Penelitian dan Pengembangan Pertanian
Diharmi A. 2001. Pengaruh Pencahayaan terhadap Kandungan Pigmen Bioaktif Mikrolaga Spirulina platensis Strain Lokal (INK). [tesis]. Bogor. Program Pasca Sarjana. Institut Pertanian Bogor.
Direktorat Jenderal Perkebunan Departemen Pertanian (DJPDP), 2011. Statistik Perkebunan. Direktorat Jenderal Perkebunan Departemen Pertanian Lampung.
Edhy, W.A., dan Kurniawan. 2003. Plankton di Lingkungan PT. Central Pertiwi Bahari. Suatu Pendekatan Biologi dan Manajemen Plankton dalam Budidaya Udang. Mitra Bahari: Lampung. hal. 3-29.
Ekawati, A. W. 2005. Diktat Kuliah Budidaya Pakan Alami. Fakultas Perikanan Universitas Brawijaya. Malang. hal. 3-48.
Etika, V.Y. 2007. Pengaruh Pemberian Kompos Kulit Kopi, Kotoran Ayam dan Kombinasinya terhadap Ketersediaan Unsur N, P dan K pada Inceptisol.
Skripsi. Fakultas Pertanian Universitas Brawijaya Malang. 67 hal.
45
Gotelli. N.J. 1995. A Primery of Ecology. In Andersen, R.A. 2005. Algal Culturing Technique. Elsevier Academic Press. New York. USA
Haryati, R. 2008. Pertumbuhan dan Biomassa Spirulina sp. dalam Skala Laboratoris. Jurnal BIOMA Universitas Diponegoro. Vol. 10, No. 1, Hal. 19-22
Harrison, P. J. and J. A. Berges. 2005. Marine Culture Media. In : R.A. Andersen (Eds). Algal culturing techniques. National Institute Enveronmental Studies.
Academic press. America. p. 21-60.
Hermawan, A. V. 2012. Pemanfaatan Air Kelapa sebagai Pengkaya Media Pertumbuhan Tetraselmis sp. Universitas Lampung. Lampung
Hongmei G., Yunlai T., Jia W., Xiaogang W., Lixin Z. and Congming L. 2008.
Characterization of Photosystem II in Salt-Stressed Cyanobacterial Spirulina platensis Cells. Biochimica et Biophysica acta 1777:2008, pp. 488-495
Kabede, E and Ahlgren, G. 1996. Optimum Growth Conditions and Light Utilization Efficiency of Spirulina platensis (Arthospirafusiformis) from Lake Chitu, Ethiopia. Hydrobiol. 332: 99--‐109.
Khoirul, A. A. 2013. Cyanobacteri (Alga hijau-biru). Universitas Brawijaya. Malang
Kusriningrum, R. 2008. Perancangan Percobaan. Universitas Airlangga. Surabaya. hal. 43-51.
Lavens, P. and Sorgeloos, 1996, Manual on the Production and Use of Live Food for Aquaculture. Fisheries Technical Paper, Food and Agriculture Organization of The United Nation, Rome.
Liu, Y. F., L. Z. Xu, N. Cheng, L. J. Lin, and C. W. Zhang. 2000. Inhibitory Effect of Phycocyanin from Spirulina platensis on the Growth of Human Leukimia K562 Cells. Journal Appl.Phycol.,12:125--‐130.
Maeda, S and Sakaguchi, T. 1990. Accumulation and Detoxification of Toxic Metal Elements by Algae. Introduction to Appl. Phycol., 109--‐136.
Najiyati S, dan Danarti. 2006. Kopi, Budidaya dan Penanganan Pasca Panen. Jakarta: Penebar Swadaya.
46
Pal, D., Goldberg, K.I, Cohen, Z. and Bousiba, S. 2011. The Effect of Light and Nitrogen Availibility on Lipid Production by Nannochhloropsis sp. Appl Microbial Biotechnol. 10:113-126
Pelupessy. W. 2003. Enviromental Issues in the Production of Beverages: Global Coffee Chain. In Mattsson B, Sonesson U, editor. Enviromental Friendly Food Processing. Cambridge England:CRCPress, Woodhead Publishing Limited.hlm 95-115
Pirie, N.W. 1975. In IBP 4: Food Protein Source, (ed. N.W. Pirie). Cambridge university Press: Cambridge.261
Prasetyo, B. dan Kusumaningrum,N.,E. 2010. Penentuan Jenis Spirulina sp. di Situ Babakan, Jagakarsa, Jakarta Selatan. Lembaga Penelitian Universitas Terbuka Jakarta Selatan.
Prihantini, N. B., Putri. B. dan Ratna. Y. 2005. Pertumbuhan Chlorella spp. dalam Medium Ekstrak Tauge (MET) dengan Variasi pH Awal. Departemen Biologi. Fakultas MIPA. Universitas Indonesia. Depok
Retnandari, N.D dan Tjokrowinoto M. 1991. Kopi Kajian Sosial Ekonomi. Yogyakarta: Penerbit Aditya Media
Richmond, A. 1988. Spirulina. In M. A. Borowitzka, eds. Microalgal Biotechnology, pp. 85--‐121. Cambridge, Cambridge University Press. Sari. A. Y. F., Suryajaya. A. M. I, dan Hadiyanto. 2012. Kultivasi Mikroalga
Spirulina platensis dalam Media POME dengan Variasi Konsentrasi POME dan Komposisi Jumlah Nutrien. Jurnal Teknologi Kimia dan Industri, Vol 1, No.1, Tahun 2012, Halaman 487-494.
Sasson, A. 1997. Micro Biotechnologies: Recent Developments and Prospects for Developing Countries. BIOTEC Publication 1/2542. Pp. 11--‐31. Place de Fontenoy, Paris. France. United Nations Educational, Scientific and Cultural Organization (UNESCO).
Sidabutar,T. 2010. Pelayaran Kebangsaan bagi Ilmuwan Muda (Plankton). Jakarta: Direktorat Kelembagaan, Direktorat Jenderal Pendidikan Tinggi, Kementrian Pendidikan Nasional Bekerja Sama dengan Pusat Penelitian Oceanografi, LIPI.
Steenis, V.M.J. 1973. Flora Malesiana.. Series 1 Vol.8,part 1. Cyclopedia of Collectors.
47
Suryati. 2002. Pemanfaatan Limbah Cair Pabrik Gula (LCPG) untuk Pertumbuhan Spirulina sp. Skripsi. Fakultas Perikanan Universitas Brawijaya. Malang.74 hal.
Switzer, L. 1980. Spirulina, The Whole Food Revolution. Proteus Corporation, USA. 1980; 1-69:
Taw Nyan, DR. 1990 . Petunjuk Pemeliharaan Kultur Murni dan Massal Mikroalga. Proyek Pengembangan Budidaya Udang : United Nations Development Progrramme Food and agriculture organization of the Unite Nations. US. 34 hal (diterjemahkan oleh : Budiono M & Indah W)
Trisilawati, O dan Gusmaini, 1999. Penggunaan Pupuk Organik bagi Pertumbuhan dan Produksi Jahe. Buletin Gakuryo. Hlm. 251-257
Vonshak, A. 1986. Laboratory Techniques for the Cultivation of Mikroalgae. In: Richmond, A. 1986. CRC Handbook of Microalgal Mass Culture. CRCPress, Inc. Florida. p. 117-145.
Wachjar, A. 1984. Pengantar Budidaya Kopi. Fakultas Pertanian. Bogor.