ABSTRACT
THE INFLUENCE OF THE COMPOSITION OF DEPOSIT NaCl/Na2SO4 TOWARD HIGH TEMPERATURE CORROSION OF STEEL AISI 4130 THAT
BE COATED BY ALUMINIUM
BY
YUDHISTYRA SAPUTRA
Steel AISI 4130 is a combination steel of 1,0 Cr-0,25 Mo-Fe that mostly used for the component heat axchanger and pipe steam boiler. However in a high temperature and contain of corrosive gas like klor and sulfur, the endurance of the corrosion of steel AISI 4130 declines. It is important to do a research for increasing the endurance of the corrosion of the steel AISI 4130 with heated Al layered dip. The calibration of the corrosion is done with the variation of deposit NaCl/Na2SO4 in the surface of steel AISI 4130 Al layered and oxidized in temperature 750 C during periods 1-49 jam. The finding of the research shows that the existence of deposit NaCl/Na2SO4 in the steel Al layered brings a large influence oxidation kinetics steel, it is proven through the largest value of parabolic constants of the steel AISI 4130 with Al layered with the comparison of deposit NaCl/Na2SO4 (gr): 30/70 is 6,89 × 10-9 g2cm–4s–1. Whereas the value of parabolic constants with the comparison of deposit (gr): 100/0 is 2,71 × 10-9 g2cm–4s–1, 50/50 is 6,15 × 10-9 g2cm–4s–1 , 70/30 is 2,97 × 10-9 g2cm–4s–1 and 0/100 is around 2,60 × 10-9 g2cm– 4s–1. The destruction of the protective layer Al
2O3 in the aluminide layer is caused by the existence of klor dan sulfur from the deposit NaCl/Na2SO4 that triggers the growth of iron-rich ovide (FeO3).
ABSTRAK
PENGARUH KOMPOSISI DEPOSIT NaCl/Na2SO4 TERHADAP KOROSI TEMPERATUR TINGGI BAJA AISI 4130 YANG DILAPISI ALUMINIUM
Oleh
YUDHISTYRA SAPUTRA
Baja AISI 4130 adalah baja paduan 1,0 Cr-0,25 Mo-Fe yang banyak digunakan untuk komponen heat axchanger dan pipa uap boiler. Namun pada temperatur tinggi dan mengandung gas korosif seperti klor dan sulfur, ketahanan korosi baja AISI 4130 menurun. Perlu dilakukan penelitian untuk meningkatkan ketahanan korosi baja AISI 4130 dengan lapis Al celup panas. Pengujian korosi dilakukan dengan variasi deposit NaCl/Na2SO4 pada permukaan baja AISI 4130 lapis Al dan dioksidasi pada temperatur 750 C selama periode 1-49 jam. Hasil penelitian menunjukan keberadaan deposit NaCl/Na2SO4 pada baja lapis Al sangat besar mempengaruhi kinetika oksidasi baja, terbukti dari nilai terbesar konstanta parabolik baja AISI 4130 lapis Al dengan perbandingan deposit NaCl/Na2SO4 (gr): 30/70 adalah 6,89 × 10-9 g2cm–4s–1 Sedangkan nilai konstanta parabolik dengan perbandingan deposit (gr): 100/0 adalah 2,71 × 10-9 g2cm–4s–1, 50/50 adalah 6,15 × 10-9 g2cm–4s–1 , 70/30 adalah 2,97 × 10-9 g2cm–4s–1 dan 0/100 adalah sebesar 2,60 × 10-9 g2cm–4s–1. Pengerusakan lapisan protektif Al2O3 pada lapisan aluminida disebabkan oleh keberadaan klor dan sulfur dari deposit NaCl/Na2SO4 yang memicu pertumbuhan oksida kaya besi (FeO3).
I.
PENDAHULUAN
A. Latar Belakang
Di dalam sistem pembangkit tenaga panas bumi, aspek material pipa baja yang digunakan untuk sistem perpipaan merupakan faktor yang sangat penting dan esensial karena masalah energi tidak hanya dari penemuan energi terbarukan tetapi juga aspek ongkos produksi dan perawatan maupun umur pemakaian pipa baja, yang terkait satu sama lainya. Proses perancangan sistem perpipaan untuk pipa saluran uap panas dari sumur-sumur produksi harus mendapat perhatian khusus terutama dari sisi ketahanan oksidasi/korosi dan kekuatan bahan selama aplikasi pada lingkungan temperatur tinggi. Hal ini perlu dilakukan agar diperoleh rancangan yang optimal baik dari ongkos operasionalnya maupun dari keamanannya [Ghosh, 2007].
Baja paduan AISI 4130 (baja Cr-Mo) dapat dipandang sebagai kandidat untuk bahan pipa gas pengarah pada pembangkit listrik tenaga panas bumi (geothermal power plant) (PLTG) yang beroperasi pada tekanan tinggi di pusat sumber Panas Bumi Ulubelu, Propinsi Lampung-Indonesia. Penggunaan pipa ini direkomendasikan untuk beroperasi pada temperatur di atas 370 °C [Al-Mazrouee and Raman, 2007]: Ini menawarkan ketahanan oksidasi temperatur tinggi dan korosi. Namun untuk kondisi aplikasi yang lama, lapisan protektif oksida krom (Cr2O3) akan mengalami pelepasan dan pecah karena pembentukan oksida besi hematit (Fe2O3) pada permukaan oksida krom, yang mengakibatkan proses oksidasi berjalan secara cepat dan akhirnya menghasilkan kerusakan pada logam [N’Dah, dkk, 2007]. Selain itu, kekuatan baja juga menurun dengan jelas dengan
meningkatnya temperatur kerja di atas level tersebut [Hélène dan Jean, 2010]. Beberapa penelitian mengenai ketahanan oksidasi telah dilakukan pada baja Cr−Mo [Zhan, dkk, 2007, Chang, 2006, Chang, dkk, 2009].
lapisan aluminium pada substrat baja dapat dikontrol untuk menghasilkan ketebalan yang di desain untuk aplikasi tertentu [Cheng dan Wang, 2009, Squillace, dkk, 1999]. Lapisan aluminium oksida yang terbentuk pada permukaan intermetalik Fe-Al-Cr dapat melindungi substrat baja dari serangan oksidasi yang agresif pada level temperatur yang berbeda [N’Dah, dkk, 2007, Zhan, dkk, 2007,
Chang, dkk, 2006, Wang dan Badaruddin, 2010]. Penelitian sekarang ini dilakukan dengan tujuan untuk meneliti peningkatan ketahanan oksidasi baja AISI 4130 pada temperatur 750 °C melalui penerapan pelapisan celup panas aluminium. Perilaku oksidasi baja yang dilapisi dipelajari melalui morfologi permukaan baja setelah dioksidasi selama durasi waktu yang berbeda. Untuk itu dibutuhkan lapisan pelindung yang protektif dari serangan klor atau sulfur. Sehubungan dengan uraian diatas maka perlu diadakan penelitian mengenai :
“
Pengaruh Komposisi Deposit NaCl/Na
2SO
4Terhadap Korosi
Temperatur Tinggi Baja Aisi 4130 Yang Dilapisi Aluminium
”.B. Tujuan Penelitian
Adapun tujuan penelitian ini adalah:
1. Meningkatkan ketahanan korosi baja AISI 4130 pada temperatur 750 °C dalam
lingkungan yang mengandung klor dan sulfur.
C. Batasan Masalah
Berdasarkan uraian diatas agar penelitian bisa berjalan dengan sesuai, maka peneliti membatasi masalah penelitiannya sebagai berikut:
1. Substrat/bare steel yang digunakan adalah baja AISI 4130 dan logam pelapis adalah almunium.
2. Proses hot dipping dilakukan pada temperatur 700 oC selama 16 detik.
3. Komposisi Deposit NaCl/Na2SO4 (gr): 100/0 (sampel 1), 70/30 sampel 2, 50/50 (sampel 3), 30/70 (sampel 4), dan 0/100 (sampel 5) dilarutkan dalam aquades dengan total volume 250 mL.
4. Larutan garam NaCl dan/atau Na2SO4 disemprotkan pada seluruh permukaan spesimen yang diletakan di atas hot plate pada temparatur 200 °C.
5. Oksidasi dilakukan dalam furnace pada temperatur 750 °C selama periode 1 jam, 4 jam, 9 jam, 25 jam dan 49 jam dalam kondisi udara statis.
D. Sistematika Penulisan Laporan
Laporan tugas akhir ini disusun menjadi lima bab. Adapun sistematika penulisannya adalah sebagai berikut :
BAB I PENDAHULUAN
Pada bab ini menguraikan latar belakang penelitian tugas akhir, tujuan penelitian tugas akhir, batasan masalah dan sistematika penulisan.
BAB II TINJAUAN PUSTAKA
BAB III METODOLOGI PENELITIAN
Pada bab ini menjelaskan metode tentang langkah-langkah, Alat dan bahan yang dilakukan untuk mencapai hasil yang diharapkan dalam penelitian ini.
BAB IV HASIL DAN ANALISA
Pada bab ini menguraikan hasil dan membahas yang diperoleh dari penelitian yang telah dilakukan.
BAB V SIMPULAN DAN SARAN
Pada bab ini menyimpulkan dari hasil dan pembahasan sekaligus memberikan saran yang dapat menyempurnakan penelitian ini.
DAFTAR PUSTAKA
Berisikan literatur-literatur atau referensi yang diperoleh penulis untuk mendukung penyusunan laporan ini.
LAMPIRAN
II. TINJAUAN PUSTAKA
A. Baja
Baja adalah logam paduan dengan besi (Fe) sebagai unsur dasar dan karbon (C) sebagai unsur paduan utamanya. Kandungan karbon dalam baja berkisar antara 0.2% hingga 2.1% berat sesuai grade-nya. Fungsi karbon dalam baja adalah sebagai unsur pengeras. Unsur paduan lain yang biasa ditambahkan selain karbon adalah mangan (manganese), krom (chromium), vanadium, dan nikel. Dengan memvariasikan kandungan karbon dan unsur paduan lainnya, berbagai jenis kualitas baja bisa didapatkan. Penambahan kandungan karbon pada baja dapat meningkatkan kekerasan (hardness) dan kekuatan tariknya (tensile strength), namun di sisi lain membuatnya menjadi getas (brittle) serta menurunkan keuletannya (ductility).
1. Klasifikasi Baja
Menurut ASM handbook vol.1:329 (1993), baja dapat diklasifikasikan berdasarkan komposisi kimianya seperti kadar karbon dan paduan yang digunakan. Adapun klasifikasi baja berdasarkan komposisi kimianya adalah sebagai berikut:
a. Baja karbon
Baja karbon adalah paduan antara besi dan karbon dengan sedikit Si, Mn, P, S, dan Cu. Sifat baja karbon sangat tergantung pada kadar karbon, bila kadar karbon naik maka kekuatan dan kekerasan juga akan bertambah tinggi. Karena itu baja karbon dikelompokkan berdasarkan kadar karbonnya [Wiryosumarto, 2004].
1) Baja Karbon Rendah
Baja karbon rendah memiliki kandungan karbon dibawah 0,3%. Baja karbon rendah sering disebut dengan baja ringan (mild steel) atau baja perkakas. Jenis baja yang umum dan banyak digunakan adalah jenis cold roll steel dengan kandungan karbon 0,08% – 0,30% yang biasa digunakan untuk body kendaraan [Sack, 1997].
2) Baja Karbon Sedang
pegas, baut, komponen mesin yang membutuhkan kekuatan tinggi, dan lain-lain.
3) Baja Karbon Tinggi
Baja karbon tinggi memiliki kandungan karbon paling tinggi jika dibandingkan dengan baja karbon yang lain yakni 0,60% - 1,7% C dan memiliki tahan panas yang tinggi, kekerasan tinggi, namun keuletannya lebih rendah. Baja karbon tinggi mempunyai kuat tarik paling tinggi dan banyak digunakan untuk material tools. Salah satu aplikasi dari baja ini adalah dalam pembuatan kawat baja dan kabel baja.
b. Baja paduan
Menurut [Amanto, 1999], baja paduan didefinisikan sebagai suatu baja yang dicampur dengan satu atau lebih unsur campuran seperti nikel, mangan, molybdenum, kromium, vanadium dan wolfram yang berguna untuk memperoleh sifat-sifat baja yang dikehendaki seperti sifat kekuatan, kekerasan dan keuletannya. Paduan dari beberapa unsur yang berbeda memberikan sifat khas dari baja. Misalnya baja yang dipadu dengan Ni dan Cr akan menghasilkan baja yang mempunyai sifat keras dan ulet. Berdasarkan kadar paduannya baja paduan dibagi menjadi tiga macam yaitu:
1) Baja Paduan Rendah (Low Alloy Steel)
unsur paduan. Dengan penambahan unsur paduan, kekuatan dapat dinaikkan tanpa mengurangi keuletannya, kekuatan fatik, daya tahan terhadap korosi, aus dan panas. Aplikasinya banyak digunakan pada kapal, jembatan, roda kereta api, ketel uap, tangki gas, pipa gas dan sebagainya.
2) Baja Paduan Menengah (Medium Alloy Steel)
Baja paduan menengah merupakan baja paduan yang elemen paduannya 2,5%-10% wt misalnya unsur Cr, Mn, Ni, S, Si, P, dan lain-lain.
3) Baja Paduan Tinggi (High Alloy Steel)
Baja paduan tinggi merupakan baja paduan yang elemen paduannya lebih dari 10% wt misalnya unsur Cr, Mn, Ni, S, Si, P, dan lain-lain. Contohnya baja tahan karat, baja perkakas dan baja mangan. Aplikasinya digunakan pada bearing, bejana tekan, baja pegas, cutting tools, frog rel kereta api dan lain sebagainya.
Pada umumnya, baja paduan mempunyai sifat yang unggul dibandingkan dengan baja karbon biasa diantaranya [Amstead, 1993]:
1) Keuletan yang tinggi tanpa pengurangan kekuatan tarik. 2) Tahan terhadap korosi dan keausan yang tergantung pada jenis
paduannya.
3) Tahan terhadap perubahan suhu, ini berarti bahwa sifat fisisnya tidak banyak berubah.
Pengaruh unsur-unsur paduan dalam baja adalah sebagai berikut: 1) Unsur karbon (C)
Karbon merupakan unsur terpenting yang dapat meningkatkan kekerasan dan kekuatan baja. Kandungan karbon di dalam baja sekitar 0,1%-1,7%, sedangkan unsur lainnya dibatasi sesuai dengan kegunaan baja. Unsur paduan yang bercampur di dalam lapisan baja adalah untuk membuat baja bereaksi terhadap pengerjaan panas dan menghasilkan sifat-sifat yang khusus. Karbon dalam baja dapat meningkatkan kekuatan dan kekerasan tetapi jika berlebihan akan menurunkan ketangguhan.
2) Unsur Mangan (Mn)
Semua baja mengandung mangan karena sangat dibutuhkan dalam proses pembuatan baja. Kandungan mangan kurang lebih 0,6% tidak mempengaruhi sifat baja, dengan kata lain mangan tidak memberikan pengaruh besar pada struktur baja dalam jumlah yang rendah. Penambahan unsur mangan dalam baja dapat menaikkan kuat tarik tanpa mengurangi atau sedikit mengurangi regangan, sehingga baja dengan penambahan mangan memiliki sifat kuat dan ulet.
3) Unsur Silikon (Si)
kekenyalan, ketahanan aus, dan ketahanan terhadap panas dan karat. Unsur silikon menyebabkan sementit tidak stabil, sehingga memisahkan dan membentuk grafit. Unsur silikon juga merupakan pembentuk ferit, tetapi bukan pembentuk karbida, silikon juga cenderung membentuk partikel oksida sehingga memperbanyak pengintian kristal dan mengurangi pertumbuhan akibatnya struktur butir semakin halus.
4) Unsur Nikel (Ni)
Nikel mempunyai pengaruh yang sama seperti mangan, yaitu memperbaiki kekuatan tarik dan menaikkan sifat ulet, tahan panas, jika pada baja paduan terdapat unsur nikel sekitar 25% maka baja dapat tahan terhadap korosi. Unsur nikel yang bertindak sebagai tahan karat (korosi) disebabkan nikel bertindak sebagai lapisan penghalang yang melindungi permukaan baja.
5) Unsur Kromium (Cr)
B. Baja AISI 4130
Dalam penelitian ini jenis material yang digunakan yaitu baja AISI 4130 yang merupakan baja paduan rendah molybdenum yang mengandung kromium dengan kandungan karbon 0,30%. Baja AISI 4130 mempunyai komposisi kimia Carbon (0,28-0,33)%; Mn (0,40-0,60)%; Phosphorus 0,035%; Sulphur 0,04%; Silicon (0,15-0,30)%; Chromium (0,80-1,10)%; Molybdenum (0,15-0,25)%.
1. Fitur desain utama
adalah baja paduan rendah yang mengandung molibdenum dan kromium sebagai agen penguatan. Isi karbon 0,30% dan nominal dengan kadar karbon relatif rendah paduan yang sangat baik dari sudut pandang mampu las fusi. Paduan ini dapat dikeraskan dengan perlakuan panas.
2. Kegunaan
Aplikasi khas untuk 4130 adalah termasuk baja paduan rendah. struktural menggunakan seperti tunggangan mesin pesawat dan aplikasi pipa dilas. 3. Proses Pengerjaan
Paduan ini mudah dikerjakan dengan metode konvensional. Pengerjaan yang terbaik dengan paduan dalam kondisi normal dan sudah mengalami perlakuan panas. Meskipun paduan mampu mesin dalam kondisi perlakuan panas sepenuhnya, kemampuan mesin menjadi lebih sulit dengan meningkatnya kekuatan (kekerasan) paduan.
4. Pembentukan
5. Pengelasan
4130 paduan terkenal karena mampu las dengan semua metode komersial. 6. Perlakuan Panas
Pemanasan pada 1600ºF diikuti dengan pendingin minyak akan mengeraskan paduan 4130. Untuk hasil terbaik perawatan sebelum pengerasan panas normalisasi dapat digunakan pada 1650 ºF -1700 ºF diikuti oleh 1600 ºF rendam dalam minyak pendingin.
7. Kemampuan Tempa
Dapat ditempa pada suhu 220ºF maksimal, dan suhu terendah 175ºF. 8. Tempering (Pengerasan)
Pengerasan dilakukan dengan perlakuan panas atau pengerjaan dingin. Tempering dilakukan untuk memulihkan beberapa daktilitas yang mungkin hilang setelah perlakuan panas pengerasan dan pendinginan. Paduan 4130 dapat dikeraskan di antara 750 ºF dan 1050 ºF, tergantung pada tingkat kekuatan yang diinginkan. Semakin rendah suhu tempering semakin besar kekuatan.
C. Korosi
Korosi adalah kerusakan atau degradasi logam akibat reaksi redoks antara suatu logam dengan berbagai zat di lingkungannya yang menghasilkan senyawa-senyawa yang tidak dikehendaki. Dalam bahasa sehari-hari, korosi disebut perkaratan. Contoh korosi yang paling lazim adalah perkaratan besi.
Rumus kimia karat besi adalah Fe2O3.nH2O, suatu zat padat yang berwarna coklat-merah.
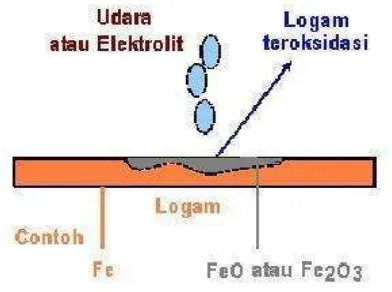
Korosi dapat juga diartikan sebagai serangan yang merusak logam karena logam bereaksi secara kimia atau elektrokimia dengan lingkungan. Ada definisi lain yang mengatakan bahwa korosi adalah kebalikan dari proses ekstraksi logam dari bijih mineralnya. Contohnya, bijih mineral logam besi di alam bebas ada dalam bentuk senyawa besi oksida atau besi sulfida, setelah diekstraksi dan diolah, akan dihasilkan besi yang digunakan untuk pembuatan baja atau baja paduan. Selama pemakaian, baja tersebut akan bereaksi dengan lingkungan yang menyebabkan korosi (kembali menjadi senyawa besi oksida). Ilustrasi Proses korosi dapat dilihat pada gambar dibawah.
Gambar 1. Korosi logam Fe dan berubah menjadi oksidanya.
Demikian pula untuk dengan logam yang potensial elektrodanya positif sukar mengalami korosi.
Untuk mencegah terjadinya korosi, beberapa teknik atau cara diusahakan. Dalam industri logam, biasanya zat pengisi (campuran) atau impurities diusahakan tersebar merata didalam logam. Logam diusahakan agar tidak kontak langsung dengan oksigen atau air, dengan cara mengecat permukaan logam dan dapat pula dengan melapisi permukaan logam tersebut dengan logam lain yang lebih mudah mengalami oksidasi.
Cara lain yang juga sering dipergunakan adalah galvanisasi atau perlindungan katoda. Proses ini digunakan pada pelapisan besi dengan seng. Seng sangat mudah teroksidasi membentuk lapisan ZnO. Lapisan inilah yang akan melindungi dari korosi. [http://www.chem-istry.org/materi_kimia/kimia-kesehatan/reaksi-kimia-kimiakesehatan materi_kimia/korosi-2/].
1. Faktor-faktor yang mempengaruhi korosi
a. Keberadaan gas terlarut
Adanya gas terlarut seperti CO2, O2 dan H2S merupakan beberapa gas yang mempengaruhi laju korosi logam. Gas tersebut ikut berperan dalam transfer muatan di dalam larutan.
b. Temperatur
Temperatur berperan mempercepat seluruh proses yang terlibat selama korosi terjadi. Titik optimum dari temperatur yang menyebabkan korosi adalah sekitar rentang 328-353 K.
c. pH larutan
Faktor lain yang mempengaruhi laju korasi di dalam media larutan adalah pH, pH dapat mempengaruhi laju korosi suatu logam bergantung pada jenis logamnya. Pada besi, laju korosi relative rendah antara pH 7 sampai 12. Sedangkan pada pH <7 dan pH>12 laju korosinya meningkat.
d. Padatan terlarut
Garam klorida, khususnya ion-ion klorida menyerang lapisan mild steel dan stainless steel. Ion-ion ini menyebabkan terjadinya pitting, crevice corrosion dan pecahnya paduan logam.
D. Oksidasi
1. Pengertian Oksidasi
senyawa merupakan reaksi reduksi dan unsur yang menyebabkan terjadinya reduksi disebut unsur pereduksi.
Jika satu materi teroksidasi dan materi yang lain tereduksi maka reaksi demikian disebut reaksi reduksi-oksidasi, disingkat reaksi redoks (redox reaction). Reaksi redoks terjadi melalui transfer elektron. Tidak semua reaksi redoks melibatkan oksigen. Akan tetapi semua reaksi redoks melibatkan transfer elektron dari materi yang bereaksi. Jika suatu materi kehilangan elektron, materi ini disebut tereduksi, dan apabila suatu materi memperoleh elektron, materi ini disebut teroksidasi.
Dalam reaksi redoks, satu reagen teroksidasi yang berarti menjadi reagen pereduksi dan reagen lawannya terreduksi yang berarti menjadi reagen pengoksidasi. Kecenderungan metal untuk bereaksi dengan oksigen didorong oleh penurunan energi bebas yang mengikuti pembentukan oksidanya. Lapisan oksida di permukaan metal bisa berpori (dalam kasus natrium, kalium, magnesium) bisa pula rapat tidak berpori (dalam kasus besi, tembaga, nikel).
2. Penebalan Lapisan Oksida
Pada umumnya lapisan oksida yang terjadi di permukaan metal cenderung menebal. Berikut ini beberapa mekanisme yang mungkin terjadi, antara lain:
Lapisan oksida ini bersifat non-protektif, tidak memberikan perlindungan pada metal yang dilapisinya terhadap proses oksidasi lebih lanjut.
Gambar 2. Lapisan oksida berpori
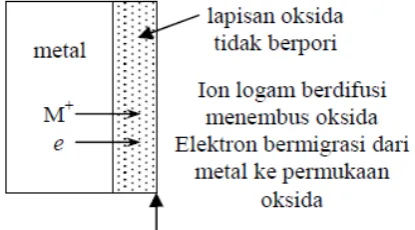
b. Jika lapisan oksida tidak berpori, ion metal bisa berdifusi menembus lapisan oksida menuju bidang batas oksida-udara, dan di perbatasan oksida-udara ini metal bereaksi dengan oksigen dan menambah tebal lapisan oksida yang telah ada. Proses oksidasi berlanjut di permukaan. Dalam hal ini elektron bergerak dengan arah yang sama agar pertukaran elektron dalam reaksi ini bisa terjadi.
Gambar 3. Lapisan oksida tidak berpori.
bergerak ke arah dalam. Reaksi oksidasi biasa terjadi di dalam lapisan oksida.
Terjadinya difusi ion, baik ion metal maupun ion oksigen, memerlukan koefisien difusi yang cukup tinggi. Sementara itu gerakan elektron menembus lapisan oksida memerlukan konduktivitas listrik oksida yang cukup tinggi pula. Oleh karena itu jika lapisan oksida memiliki konduktivitas listrik rendah, laju penambahan ketebalan lapisan juga rendah karena terlalu sedikitnya elektron yang bermigrasi dari metal menuju perbatasan oksida-udara yang diperlukan untuk pertukaran elektron dalam reaksi.
Jika koefisien difusi rendah, pergerakan ion metal ke arah perbatasan oksida-udara akan lebih lambat dari migrasi elektron. Penumpukan ion metal akan terjadi di bagian dalam lapisan oksida dan penumpukan ion ini akan menghalangi difusi ion metal lebih lanjut. Koefisien difusi yang rendah dan konduktivitas listrik yang rendah dapat membuat lapisan oksida bersifat protektif, menghalangi proses oksidasi lebih lanjut [Sudaryatno, 2011].
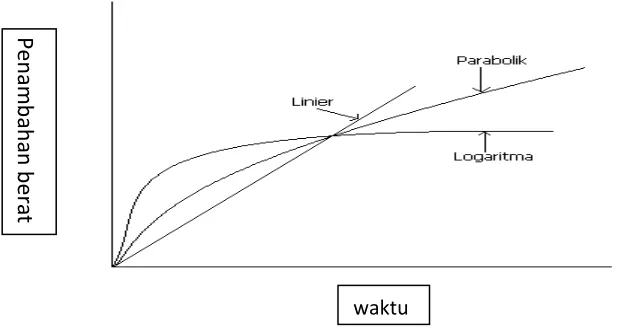
3. Oksidasi pada temperatur tinggi.
untuk membentuk proteksi. Persyaratan lapisan proteksi adalah homogen, daya lekat tinggi, tidak ada kerusakan mikro ataupun makro, baik yang berupa retak atau terkelupas. Pada tingkat oksidasi , hukum kinetika parabola, linier, dan logaritma menggambarkan tingkat oksidasi untuk logam umum dan paduan. Dalam hal ini oksigen bereaksi untuk membentuk oksida pada permukaan logam, diukur dengan penambahan berat. Penambahan berat pada setiap waktu ( t ) selama oksidasi sebanding dengan ketebalan oksida (x). Logam tertentu, seperti baja, harus dilapisi untuk pencegahan korosi, karena memiliki tingkat oksidasi yang tinggi. Pada tingkat hukum parabola, laju oksidasi temperatur tinggi pada logam sering mengikuti hukum laju parabolik, yang memerlukan ketebalan (x), propotional ke waktu ( t) yaitu,
�� = �
�……….………..(1)
Di mana kp dikenal sebagai konstanta laju parabolik.
E.
E. Aluminium
Aluminium adalah logam yang berwarna putih perak dan tergolong ringan yang mempunyai massa jenis 2,7 gr.cm–3. Tidak ada logam lain memiliki banyak kegunaan seperti aluminium. Aluminium merupakan salah satu logam non ferrous yang sangat penting di dunia industri. Aluminium menjadi salah satu komponen yang banyak digunakan pada bidang konstruksi, aplikasi elektronika, kontainer, transportasi, badan pesawat, perabot rumah tangga serta peralatan mekanik. Aluminium memiliki titik lebur mencapai 660ºC.
1. Sifat-sifat yang dimiliki aluminium antara lain:
a. Ringan, tahan korosi dan tidak beracun sehingga banyak digunakan untuk alat rumah tangga seperti panci, kuali dan lain-lain.
b. Reflektif, dalam bentuk aluminium foil digunakan sebagai pembungkus makanan, pembungkus rokok dan lain-lain.
c. Daya hantar listrik dua kali lebih besar dari Cu, sehingga aluminium digunakan sebagai kabel listrik.
d. Paduan aluminium dengan logam lainnya menghasilkan logam yang kuat, seperti duralium (campuran Al, Cu dan Mg) untuk pembuatan badan pesawat.
e. Aluminium sebagai zat reduktor untuk oksida MnO2 dan Cr2O3.
ekonomis adalah bauksit yang merupakan satu-satunya sumber aluminium. Bentuk fisik aluminium dapat dilihat pada gambar dibawah.
Gambar 5. Aluminium.
2. Hot Dipping Aluminium
pada substratnya dapat dikontrol melalui control parameter temperatur cair aluminium dan waktu pencelupan. Sehingga ketersediaan aluminium sebagai reservoir untuk produksi Al2O3 tetap terjaga pada permukaan pipa baja.
Dalam pemanfaatan logam terutama alumunium untuk pelapisan, ada dua jenis pelapisan hot dipping aluminum, yaitu:
a. Pelapisan Alumunium Type 1 (Pelapisan Al – Si)
Lapisan tipe ini adalah lapisan yang tipis yaitu dengan ketebalan menurut kelasnya. Untuk kelas 40 tebal lapisannya adalah 20 – 25 μm dan untuk
kelas 25 biasanya untuk kepentingan tertentu yaitu tebal pelapisan 12 μm.
Silicon yang dicampurkan pada pelapisan tipe 1 ini rata–rata adalah 5 – 11% untuk perintah mencegah pembentukan lapisan tebal antara logam besi–alumunium, dimana akan merusak pelekatan lapisan dan kemampuan untuk membentuk [Townsend, 1992].
b. Pelapisan Alumunium Type 2 (Al Murni)
3. Pelapisan Alumunium pada Baja Karbon Rendah
Baja karbon rendah yang mengalami pelapisan dengan cara pencelupan dengan mengunakan alumunuim yang telah dicairkan dengan mengunakan berbagai waktu pencelupan dengan titik lebur alumunium 660 ºC akan menambah pelapisan pada baja karbon rendah. Hasil penelitian dari Chaur-Jeng Wang (2009) menunjukan bahwa lapisan alumunium terdiri atas lapisan luar alumunium yaiitu FeAl3 dan laipsan utamanya FeAl5. Baja karbon rendah yang mengalami proses hot dipping dengan mengunakan alumunium umumnya mengunakan tungku pada temperatur lingkungan, yang berkaitan dengan pembentukan Al2O3 yang baik sebagai lapisan permukaan pada baja karbon rendah. Hal ini berguna untuk mencegah proses oksidasi ketika baja digunakan pada temperatur yang tinggi.
F. Peranan Konsentrasi Larutan NaCl terhadap Proses Korosi di Lingkungan NaCl/Na2SO4.
Natrium klorida dalam bentuk kristal yang dimasukkan ke dalam air akan mengalami peristiwa pelarutan. Peristiwa melarutnya NaCl kristal ini selalu disertai dengan penurunan suhu. Penurunan suhu yang terjadi pada saat melarutnya kristal NaCl dan air akan mengakibatkan suatu reaksi antar molekul-molekulnya. Di dalam air, natrium klorida dalam bentuk kristal akan pecah menjadi pertikel-partikel kecil dan kemudian akan ditarik oleh molekul-molekul air. Setelah molekul-molekul NaCl dan molekul air bereaksi dan bergabung jadi satu, pada seluruh larutan terdapat molekul air dan molekul NaCl yang sudah berikatan dalam jumlah yang seragam dan tak dapat dibedakan.
NaCl di dalam air ditarik oleh molekul-molekul air sehingga menjadi ion Na+ dan Cl-. Air memiliki daya meng- ion terhadap molekul NaCl. Oleh karena itu, maka natrium klorida dalam air membentuk larutan yang dapat menghantar listrik.
NaCl Na+ + Cl-………...………(2)
Ion-ion yang terbentuk dari peristiwa terurainya Na+ dan Cl- ini disebut disosiasi elektrolis. Ion-ion yang terbentuk mampu bergerak bebas dalam larutan dan dimungkinkan ion-ion inilah yang menghantarkan listrik.
agresif pada logam. Sifat dari ion klorida adalah sangat kuat dalam mencegah terjadinya proses pasifasi pada logam berada di dalam lingkungan yang mengandung klorida akan terurai dengan cepat dalam larutan yang mengandung klorida. Ion klorida akan terabsorbsi ke permukaan logam yang akan menyebabkan ikatan antara oksida-oksida logam yang berikatan akan tersaingi akibat masuknya ion ini ke dalam sela-sela ikatannya, sehingga akan memperlemah struktur ikatan logam yang bersangkutan.
Ion klorida selain akan mencegah proses pasifasi juga akan mencegah proses pengendapan lapisan oksida pelindung dengan membentuk zat cair kompleks yang mengandung ion ferrit. Dengan demikian, jika suatu logam berada pada lingkungan yang mengandung klorida, akan menyebabkan terjadinya proses depasifasi (tidak berlangsungnya proses pasifasi pada logam yang terkorosi), sehingga akan menimbulkan proses korosi pada logam terus berlanjut [http://digilib.its.ac.id/public/ITS-Undergraduate-7202-2702100027bab2.
pdf/Teknik Material Dan Metalurgi FTI-ITS/].
sebagian terus bergerak menghantar listrik dan ada sebagian yang menguap dan tidak terlalu berpengaruh terhadap berlangsungnya proses korosi.
Dengan berhentinya proses pasifasi ini, korosi yang terjadi pada logam tersebut dimungkinkan akan tetap terus berlangsung. Semakin tinggi konsentrasi larutan natrium klorida, semakin besar pula ion klorida yang berada di sekitar logam. Semakin besar jumlah ion klorida yang berada di sekitar logam, semakin besar pula terjadinya proses pencegahan timbulnya lapisan pelindung yang akan menimbulkan depasifasi pada permukaan logam. Dengan demikian, secara singkat dapat dikatakan bahwa semakin tinggi konsentrasi larutan natrium klorida, akan semakin besar pula dalam mempercepat laju korosi yang berlangsung pada suatu logam [Hariyati, 2011].
G. Peranan Konsentrasi Larutan Na2SO4 Terhadap Proses Korosi di Lingkungan
NaCl/ Na2SO4.
Sifat-sifat dari natrium sulfat (Na2SO4) ialah sebagai berikut : 1. Berat Molekul : 142,04 g/mol
2. Titik Leleh : 884 °C
3. Wujud : Padat
4. Warna : Putih
Gambar 6. Bubuk Natrium Sulfat (Na2SO4) .
[http://en.wikipedia.org/wiki/Sodium_sulfate]
Kecepatan reaksi kimia dalam suatu larutan yang umum terjadi, sangat dipengaruhi oleh konsentrasi dari zat-zat yang bereaksi (reaktan). Secara umum reaksi kimia akan berlangsung lebih cepat jika konsentrasi pereaksi diperbesar. Larutan yang mengandung sulfida akan memberikan efek korosif yang sangat agresif pada logam. Sifat dari ion sulfida adalah sangat kuat dalam mencegah terjadinya proses pasifasi pada logam yang berada di lingkungan yang mengandung sulfida, ia akan terurai dengan cepat pada larutan tersebut.
sebagian terus bergerak menghantarkan listrik dan ada sebagian yang menguap dan tidak terlalu berpengaruh terhadap berlangsungnya proses korosi. Dengan berhentinya proses pasifasi ini, korosi yang terjadi pada logam tersebut dimungkinkan akan tetap terus berlangsung.
IV. HASIL DAN PEMBAHASAN
A. Hasil Oksidasi
Spesimen baja AISI 4130 dilapisi alumunium dengan cara mencelupkan ke dalam bak alumunium cair pada temperatur 700 ºC selama 16 detik. NaCl/Na2SO4 dengan perbandingan berat (gr): 100/0 (sampel 1), 30/70 sampel 2, 50/50 (sampel 3), 70/30 (sampel 4), dan 0/100 (sampel 5) dilarutkan dalam aquades dengan total volume 250 mL. Larutan NaCl/Na2SO4 disemprotkan pada dua permukaan spesimen yang diletakan di atas hot-plate pada 200 ºC sampai terbentuk deposit seberat 2 mg/cm2. Pengujian oksidasi dilakukan pada 750 °C selama periode 1 jam sampai 49 jam dalam kondisi udara statis. Data penambahan berat (mg/cm2) terhadap lama oskidasi (jam) diplot secara linier dan parabolik.
Na2SO4 pada peremukaan baja AISI 4130 lapis Al terhadap perilaku oksidasinya.
Tabel 1. Nilai penambahan berat oksidasi baja lapis Alumunium AISI 4130 pada lingkungan NaCl/Na2SO4.
Waktu (Jam)
Nilai Penambahan Berat ( mg/cm2)
Sampel 1 Sampel 2 Sampel 3 Sampel 4 Sampel 5
100/0 30/70 50/50 70/30 0/100
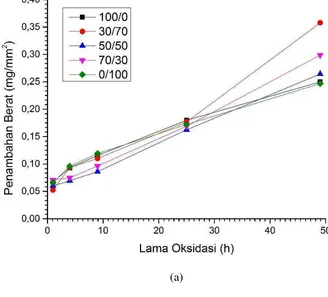
Secara lengkap data penambahan berat terhadap periode lamanya waktu oksidasi baja AISI 4130 dengan deposit NaCl dan Na2SO4 diplot pada gambar 24. Berdasarkan gambar 24(a) yang menunjukan plot data laju kinetika oksidasi baja AISI 4130 yang dilapisi Al-celup panas. Keberadaan deposit NaCl/Na2SO4 pada permukaan baja sangat besar mempengaruhi laju kinetika oksidasi baja alumunized pada 750 °C selama 1 sampai 49 jam.
meningkat drastis yaitu sebesar: 0.35773 mg/cm2. Hal ini juga menunjukkan terjadinya proses oksidasi yang berjalan sangat cepat pada baja AISI lapis Al dengan deposit yang didominasi Na2SO4.
Selanjutnya, pada waktu oksidasi berlangsung selama 1 sampai 9 jam untuk pada baja AISI 4130 lapis Al dengan perbandingan deposit (gr) NaCl/Na2SO4 50/50, laju oksidasi berjalan lambat. Namun setelah waktu oksidasi 9 – 49 jam laju oksidasi berjalan sangat cepat dengan penambahan berat mengikuti tren linier. Hal yang sama juga dapat diamati pada baja AISI lapis Al dengan perbandingan deposit deposit (gr) NaCl/Na2SO4 70/30, seperti ditunjukan pada gambar 24(a).
(b)
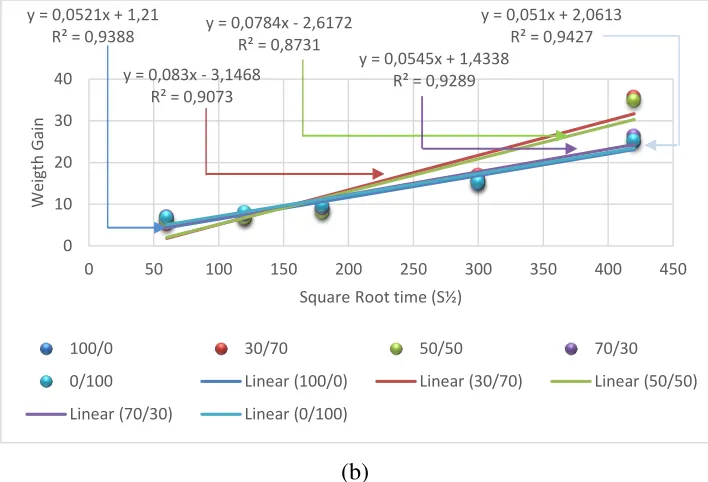
Gambar 24. (a) Plot kurva penambahan berat vs lama oksidasi (b) Plot linier weight gain terhadap akar kuadrat waktu oksidasi pada baja AISI 4130 Lapis Al di lingkungan NaCl / Na2SO4.
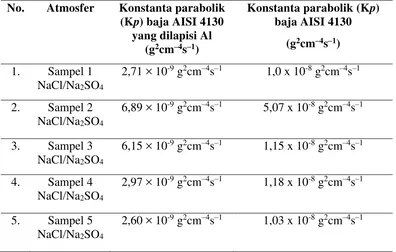
Untuk mempelajari perilaku oksidasi baja AISI 4130 dengan deposit NaCl / Na2SO4, data nilai penambahan berat dalam tabel 1 diplot secara parabolik. Untuk membandingkan secara numerik prilaku oksidasi baja AISI 4130 dengan dan tanpa lapis Al celup panas, nilai Kp untuk baja AISI 4130 diperoleh dari penelitian sebelumnya dari saudara M. Ikhsan yusuf mengenai Oksidasi Baja AISI 4130 Pada Temperatur 750 oC Dalam Lingkungan Atmosphir Yang Mengandung Klor Dan Sulfur. juga ditampilkan pada tabel 2.
Berdasarkan Tabel 2, besarnya nilai konstanta parabolik baja AISI 4130 lapis Al dengan perbandingan deposit NaCl/Na2SO4: 100/0, 30/70, 50/50, 70/30 dan 0/100adalah satu orde lebih rendah daripada konstanta parabolik (Kp) baja AISI 4130 yang tidak dilapisi alumunium, hal ini membuktikan bahwa pelapisan Al-celup panas pada permukaan baja AISI 4130 dapat menurunkan
nilai konstanta parabolik (kp) baja melalui pembentukan lapisan oksida aluminium (Al2O3) sebesar satu order lebih rendah untuk baja lapis Al dengan deposit NaCl/Na2SO4.Pada sampel 2 nilai konstanta parabolik (Kp) baja AISI 4130 yang dilapisi Al memiliki nilai terbesar 6,89 × 10-9 g2cm–4s–1 hal ini menunjukan laju oksidasi yang berlangsung lebih cepat pada sampel 2 dengan perbandingan deposit NaCl/Na2SO4 (gr): 30/70.
Tabel 2. Perbandingan Laju kinetika korosi / oksidasi baja AISI 4130 yang dilapisi almunium dan yang tidak di lapisi almunium.
No. Atmosfer Konstanta parabolik
protektif. Dengan demikian penjelasan diatas menegaskan bahwa sampel baja AISI 4130 yang tidak dilapisi alumunium dalam lingkungan yang mengandung elemen-elemen korosif (Cl) klor dan (S) sulfur, terkorosi lebih cepat dibandingkan dengan sampel baja AISI 4130 lapis Al.
B. Karakterisasi hasil pengujian oksidasi
Gambar 25. Foto spesimen baja AISI 4130 lapis Al dengan perbandingan deposit NaCl/Na2SO4 berbeda setelah dioksidasi pada temperatur 750 oC selama
Pada gambar 25 dapat diamati perbedaan warna terlihat jelas pada permukaan spesimen baja AISI 4130 lapis Al dengan komposisi deposit NaCl/Na2SO4 yang berbeda setelah dioksidasi pada temperatur 750 oC selama periode waktu 1-49 jam. Permukaan spesimen dengan deposit NaCl/Na2SO4 100/0 (gr) setelah 1 jam oksidasi berwarna coklat tua. Namun seiring bertambahnya waktu oksidasi selama 4 jam, 9 jam, 25 jam dan 49 jam, lapisan aluminida pada permukaan baja semakin lama semakin menipis akibat terkorosi oleh keberadaan klor dan sulfur. warna coklat tua pada permukaan lapisan oksida terluar mengindikasikan oksida besi (Fe2O3) tumbuh bersama lapisa oksida aluminium (warna abu-abu). Hal yang sama juga dapat diamati pada spesimen dengan deposit (gr): 30/70,50/50, 70/30 dan 100/0. Sebaliknya pada spesimen dengan deposit hanya Na2SO4, selama oksidasi 1 jam pada pemukaan baja AISI 4130 lapis Al lebih didominasi oleh warna abu–abu. Selanjutnya produk oksidasi baja AISI 4130 lapis Al diobservasi untuk menegetahui perubahan fasa melalui lapisan intermetalik yang terbentuk setelah oksidasi dengan mikroskp optik dan XRD. SEM dilakukan hanya pada permukaan oksida yang terbentuk.
1. Baja lapis Al-celup panas
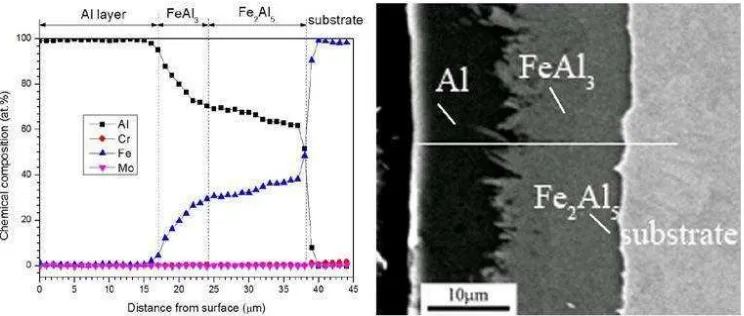
Foto mikro spesimen baja AISI 4130 lapis Al-celup panas pada temperatur 750 °C selama 16 s, dapat dilihat pada Gambar 26. Secara keseluruhan ketebalan lapisan adalah sekitar 60 µm. SEM dan EDS analisis menunjukan komposisi elemen Al dan Fe (at %) pada lapisan Al dan intermetalik pada permukaan baja. Berdasarkan komposisi kimia Al dan
terbentuk adalah aluminium dengan sedikit atom Fe yang terlarut dalam lapisan Al bagian luar, sedangkan bagian tengah adalah FeAl3. Komposisi atom Al menurun seiring dengan ketebalan lapisan intermetalik yang terbentuk di atas permukaan baja di dalam lapisan Fe2Al5.
Gambar 26. SEM/EDS Analisis komposisi (at %) dilakukan dengan EDS line scanning sepanjang ketebalan lapisan alumida spesimen
Al-coated.
homogen dan padat pada substratnya. Tidak ada pori-pori dan retak dapat diamati, yang umum terbentuk setelah proses Al-celup panas pada baja dan paduannya. Komposisi FeAl3 dan Fe2Al5 adalah sekitar
80.11Al19.8Fe0.09Cr and 69.29Al30.31Fe0.39Cr (at.%)
masing-masing. Berdasarkan kesetimbangan termodinamika, fasa Fe2Al5 terbentuk pertama kali, dan memiliki struktur ortorombik dengan kisi sepanjang sumbu c 70% ditempati oleh atom Al dan 30% kosong. Kekosongan ini menyediakan jalur difusi yang mudah ke arah sumbu c, dan akhirnya memberikan kontribusi bagi pertumbuhan yang cepat dari fasa Fe2Al5 [Cheng Dan Wang, 2011].
2. OM (Optikal Miskroskop)
Untuk memahami perilaku oksidasi dan pembentukan fasa di lapisan aluminida, pengujian oksidasi dilakukan pada 750 °C selama periode waktu 49 jam. Untuk 4 jam oksidasi seperti ditunjukkan pada Gambar 27(a). Lapisan aluminium menghilang dan lapisan aluminida terbentuk karena difusi keluar besi dari substrat dan difusi ke dalam dari aluminium. Ketebalan lapisan aluminida adalah sekitar 80 µm yang terdiri dari lapisan Al2O3 tipis di permukaannya, diikuti oleh menebalnya lapisan Fe2Al5 +
FeAl2. Sedangkan lapisan FeAl tipis terbentuk pada substrat baja. Bila
waktu oksidasi diperlama 9 jam terlihat jelas lapisan Fe2Al5 + FeAl2
Hal yang sama juga terjadi bila waktu oksidasi diperlama 25 jam, keberadaan lapisan FeAl dan Fe2Al5 + FeAl2 semakin mendominasi dan
semakin menebal. Akan tetapi terlihat retakan yang menembus ketebalan lapisan aluminida yang dihasilkan pada lapisan Fe2Al5 + FeAl2, hal ini
dikaitkan dengan perbedaan koefisien termal ekspansi pada antarmuka antara Fe2Al5 dan substrat baja [Wang dan Chen, 2006], lihat Gambar 27.
Pada gambar 28. pada permukaan baja AISI 4130 yang dioksidasi pada temperatur 750 °C selama 49 jam dalam lingkungan NaCl/Na2SO4.
Kavitasi dan rongga terbentuk di bawah lapisan tipis Al2O3, seperti yang
ditunjukkan pada Gambar 28(b). Hal lain ditampilkan gambar 28(c) dimana retak yang menembus ketebalan lapisan aluminida dihasilkan pada lapisan Fe2Al5 dikarenakan konsumsi oksidasi Al yang berdifusi ke
dalam Al. Di sisi lain, difusi Fe keluar menyebabkan fasa Fe2Al5 tidak
stabil, menyebabkan pengendapan (FeAl) Cr, yang tersebar pada lapisan intermetalik seperti ditunjukkan pada Gambar 28(a) dan Gambar 28(e).
Pada kenyataannya serangan oksidasi klor dan sulfur menyerang bagian dalam permukaan yang lebih dekat ke lapisan intermetalik sehingga mengikis lapisan Fe2Al5 dan lapisan Al2O3 yang telah terbentuk terlihat pada gambar 28(b) dan 28(c). Konsentrasi Cr dalam fasa Cr(FeAl) sedikit sama dengan Cr dari fasa FeAl2. Konsentrasi kelarutan Cr yang tinggi
hanya ditemukan dalam fasa FeAl.
Dalam penelitian ini, konstanta laju oksidasi baja Al-coated tampaknya sebagian besar konsisten dengan yang dilaporkan dalam beberapa penelitian sebelumnya, karena difusi aluminium cepat menuju susbtrat baja, yang menyebabkan kekosongan dan pembentukan rongga dalam lapisan aluminida dan di bawah lapisan oksida aluminium. Sehingga, oksigen berdifusi melalui celah dan retak. Banyak celah besar di permukaan dan di lapisan aluminida ditemukan. Al2O3 yang umumnya
membentuk rongga besar di bawah lapisan oksida aluminium [Chang dkk, 2009, Quadakkers dkk, 2004].
3. X-Ray difraksi (XRD)
Pola X-ray difraksi didilakukan untuk mendapatkan data sudut difraksi
dan intensitas pada permukaa spesimen setelah pengujian oksidasi baja
AISI 4130 pada temperatur 750 °C di lingkungan NaCl/Na2SO4 dalam periode waktu 1 -49 jam di tampilkan pada Gambar 29.
Gambar 29. Pola difraksi X-ray analisis pada baja AISI 4130 yang dilapisi Al setelah
Berdasarkan pada gambar 29(a). Pola difraksi X-ray menunjukkan terdapat lapisan intermetalik yang terbentuk, hal ini dilihat dari intesitas tertinggi pada periode waktu oksidasi 1 jam. Hal yang sama juga terjadi untuk hasil pola difraksi X-ray untuk periode waktu oksidasi 9 jam yang didominasi NaCl gambar 29(b), menunjukan elemen yang memiliki intensitas tertinggi adalah Fe2Al5, hal ini dapat diperjelas melalui gambar 27(b). Namun berbeda halnya pada perbandingan deposit yang didominasi Na2SO4 menunjukan intensitas kurva tertinggi yaitu kandungan FeCl2 dan kandungan AlCr2.
4. SEM (surface morphology)
Observasi permukaan baja AISI 4130 yang dilapisi Al yang dioksidasi pada temperatur 750 °C menghasilkan morfologi permukaan oksida yang berbeda - beda tergantung pada variasi lama waktu oksidasi dan variasi konsentrasi lingkungan NaCl/Na2SO4. Hasil pengamatan dengan menggunakan mikroskop optik yaitu morfologi permukaan yang terbentuk pada baja dapat ditunjukkan pada Gambar 30.
Setelah dilakukan SEM pada permukaan baja yang dilapisi Al dengan periode waktu oksidasi 25 jam, maka dapat dilihat gambar 30(a). Lapisan tipis Al2O3 berperan untuk mengontrol laju difusi oksigen ke dalam lapisan FeAl. Akan tetapi jika cacat terbentuk pada permukaan seperti retak ataupun lubang dapat menyebabkan oksigen masuk ke dalam lapisan intermetalik dan terjadi reaksi antar elemen yang ada, baik elemen korosif di lingkungan itu sendiri maupun elemen-elemen lain yang ada di permukaan spesimen sehingga memicu terbentuknya whisker atau scale dari Fe2O3 seperti terlihat pada gambar 30(d) adanya scale dari Fe2O3 yang merupakan hasil dari proses difusi oksigen pada permukaan spesimen yang cacat maupun rusak. Selain terbentuknya scale Fe2O3 juga terdapat whisker yang tumbuh di permukaan spesimen yang dioksidasi pada gambar 30(c). Selanjutnya pada, dimana lapisan intermetalik menipis akibat proses oksidasi. Fasa Fe2O3 yang terbentuk dikarenakan adanya penetrasi oksigen pada permukaan substrat, terlihat semakin tebal dan solid.
kemudian menyebabkan oksigen dapat melewati lapisan intemetalik dan berdifusi, sehingga tercipta scale Fe2O3. Ini juga berhubungan dengan terjadinya penambahan berat pada spesimen baja yang diuji yang disebabkan pertumbuhan scale dari Fe2O3.
Pembentukan lapisan sudah digantikan oleh fasa FeAl. Terlihat jelas lapisan protektif menunjukkan lapisan yang padat. Lapisan padat FeAl berperan sebagai lapisan pelindung baja dalam mengontrol laju difusi oksigen kedalam lapisan intermetalik. Seiring lamanya periode waktu oksidasi, maka terjadi pembentukan fasa Fe2O3 yang semakin padat dan menyeluruh. Pembentukan oksida besi menunjukkan adanya penurunan fungsi Al sebagai pelindung baja terhadap oksidasi pada temperatur tinggi.
V. KESIMPULAN DAN SARAN
A. Kesimpulan
Hasil pembahasan dari serangkaian pengujian dan observasi yang telah dilakukan dalam penelitian ini, Beberapa hal yang dapat disimpulkan, sebagai berikut :
1. Keberadaan deposit NaCl/Na2SO4 pada baja lapis Al sangat besar mempengaruhi kinetika oksidasi baja, hal ini dapat dilihat dari nilai konstanta parabolik baja AISI 4130 lapis Al dengan perbandingan deposit NaCl/Na2SO4 (gr): 30/70 adalah 6,89 × 10-9 g2cm–4s–1. Sedangkan nilai konstanta parabolik dengan perbandingan deposit (gr): 100/0 adalah 2,71 × 10-9 g2cm–4s–1, 50/50 adalah 6,15 × 10-9 g2cm–4s–1 , 70/30 adalah 2,97 × 10-9 g2cm–4s–1 dan 0/100 adalah sebesar 2,60 × 10-9 g2cm–4s–1.
2. Hasil mokroskop optik pada penampang permukaan baja 4130 lapis Al dengan komposisi deposit NaCl/Na2SO4 (gr): 30/70 yang dioksidasi pada 750
°C dengan periode waktu oksidasi 49 jam mengalami pengerusakan lapisan protektif Al2O3 pada lapisan aluminida disebabkan oleh keberadaan klor dan
sulfur dari deposit NaCl/Na2SO4 yang memicu pertumbuhan oksida kaya besi
(FeO3). Pembentukan oksida besi menunjukkan adanya penurunan fungsi Al
demikian, selama 49 jam oksidasi berlangsung lapisan FeAl yang tebal di atas substrat baja mampu menggantikan peranan lapisan Fe2Al5 dan FeAl2 sebagai
penyuplai Al dalam membentuk lapisan protektif alumina.
3. Hasil analisis X-ray (XRD) pada permukaan sampel yang dioksidasi selama 1 jam, 9 jam dan 49 jam menunjukan pertumbuhan fasa Fe2Al5 pada lapisan intermetalik yang merupakan lapisan pelindung dari fasa intermetalik untuk melindungi baja dari serangan korosi. Selanjutnya terdapat fasa FeAl yang merupakan fasa yang terbentuk dari komposisi besi dan aluminium yang sama sebagai lapisan pelindung baja AISI 4130 lapis Al terhadap serangan korosif klor dan sulfur untuk oksidasi yang berlangsung lama.
B. Saran
DAFTAR PUSTAKA
Andi, E. P. et al., Corrosion Control in Geothermal Aerated Fluids Drilling Projects in Asia Pacific. Proceedings World Geothermal Congress 2010: 176−180. Bali,
25−30 April 2010: Indonesia.
Al-Mazrouee, A., R. K. Singh Raman, , High Temperature Oxidation of Cr-Mo Steels in the Context of Accelerated Rupture Testing for Creep Life Prediction, Journal of Pressure Vessel Technology, 2007, Vol.129, pp. 454−459.
Amanto, H. dan Daryanto, 1999. Ilmu Bahan. Jakarta, Bumi Aksara
Amstead, B.H., 1993. Teknologi Mekanik. Jakarta, Erlangga
ASM International, 1993. ASM handbook vol.1:329
Badaruddin M., 2010. Effect of water vapour on the high temperature oxidation of low carbon steel and hot-dip aluminized steel, Ph.D thesis, National Taiwan University of Science and Technology, Taiwan.
Chang YY, Tsaur CC, Rock JC. Microstructures studies of an aluminida coating on 9Cr−1Mo steel during high-temperature oxidation. Surface Coating & Technology, 2006, Vol. 200, pp.6588−6593.
Cheng WJ, Wang CJ, Growth of intermetallic layer in the aluminida mild steel during hot-dipping. Surface Coating & Technology, 2009, Vol. 204, pp. 824– 828.
Davis, Troxell, dan Hauck. 1998. The Testing of Engineering Materials. Edisi 4. Penerbit Mc Graw Hill. New York.
Ghosh,S. J. Failure Analysis of a Jacking Oil Pump. Failure Analysis and Prevention, 2007, Vol. 7, pp. 23–27.
Hariyati, P., Prof. Dr. Ir. Sulistijono, DEA.,Ramadhan Mavindra. 2011. Studi Eksperimen Laju Korosi Plat Body Automobiles Pada Larutan NaCl 5% (Air Laut) Dengan Cyclic Methode SAE J2334. ITS, Surabaya. Melalui : http://www.material.chula.ac.th/Journal/v20-3/31-36%20
RUJISOMNAPA,%20J.pdf.
Hélène B, Jean BV, Influence of heat treatment on fatigue behaviour of 4130 AISI steel. Procedia Engineering, 2010, Vol. 2, pp. 917−924.
http://digilib.its.ac.id/public/ITS-Undergraduate-7202-2702100027 bab2. pdf/ Teknik Material Dan Metalurgi FTI-ITS/ , Tanggal unduh : 13 Desember 2012.
http://en.wikipedia.org/wiki/Sodium_sulfate. Tanggal unduh 10 Desember 2012.
http://www.chem-is-try.org/materi_kimia/kimia-kesehatan/reaksi-kimia-kimia kesehatan-materi_kimia/korosi-2/. Tanggal unduh : 3 Januari 2013
Karel O, Simona P, Martin J, Tomas P, Jaroslav P. Effect of Al and Al-Si
N’Dah E, Tsipas S, Hieero MP, Perez FJ, Study of the cyclic oxidation resistance of Al coated ferritic steels with 9 and 12%Cr. Corrosion Science, 2007, Vol. 49, pp.3850−3865.
Sack, Raymond J. 1997. I”Welding: Principles and Prantices”. Mc Graw Hill. USA
Sudaryatno, Sudirham & Ning Utari. 2011. Mengenal Sifat-Sifat Material. Pada eecafedotnet.files.wordpress.com/2011/08/oksidasi-dan-korosi.pdf.
Squillace A, Bonetti R, Archer NJ, Yeatman JA, The control of the composition and structure of aluminida layers formed by vapour aluminizing. Surface Coating & Technology, 1999, Vol. 120–121, pp. 118–127.
Townsend, 1992. Surface Engineering ASM Handbook volume 5. ASM International.
Xiang Z.D., Rose A.S.R, Datta A.P.K., 2006. Long-term oxidation kinetics of aluminide coatings on alloy steels by low temperature pack cementation process. J. Material Science, Vol. 41, pp. 7353-7360.
Wang, C.J., Badaruddin M., 2010. The dependence of high temperature resistance of aluminized steel exposed to water-vapour oxidation, Surface Coating Technology. Vol. 205, pp. 1200-1205.
Wiryosumarto, H dan Okumura, T. 2004. Teknologi Pengelasan Logam. Cetakan 9. Penerbit Pradnya Paramita. Jakarta.
Zhan Z, He Y, Wang D, Gao W, Aluminida coatings formed on Fe–13Cr steel at low temperature and its oxidation resistance. Oxidation of Metals, 2007, Vol.68, pp. 2438−2454.

![Gambar 6. Bubuk Natrium Sulfat (Na2[SO4) . http://en.wikipedia.org/wiki/Sodium_sulfate]](https://thumb-ap.123doks.com/thumbv2/123dok/530631.146709/30.595.201.426.84.257/gambar-bubuk-natrium-sulfat-http-wikipedia-sodium-sulfate.webp)