ABSTRACT
DAMAYANTI. Giving sinbiotic with different doses in white shrimp feed for prevention of infection IMNV (Infectious Myonecrosis Virus). Supervised by Widanarni and Sukenda.
Sinbiotic is an alternative on controling the IMNV (Infectious Myonecrosis Virus) infection in white shrimp. The effect of sinbiotic feeding with different doses on the survival and immune response white shrimp that infected with IMNV has been studied. SKT-b Vibrio alginolyticus and oligosaccharides extracted from sweet potato (sukuh variety) was used as probiotic and prebiotic. Twenty white shrimps with average weight of 0,54 ± 0,04 g, was maintained for 30 days in aquarium with 40 liter of volume. There were five treatments applied to the shrimps, consisted of K- and K- (without the addition of sinbiotic), A (the addition ofsinbiotica half dose: 0.5% probiotic and prebiotic of 1%, B (the addition of sinbioticone dose: probiotic1% and prebiotic 2%, and C (the addition ofsinbioticdouble dose: probiotic 2 % and prebiotic 4%). After 30 days given with treatment feed, the experimental shrimp was infected by oral with IMNV, except K-. The result showed that giving sinbiotic feed with the different doses can increased survival and immune response. Treatment C with dose of probiotic 2% and prebiotic 4% giving the best result for prevention of infection IMNV, had the best survival (80%) and immune response.
I.
PENDAHULUAN
Udang merupakan salah satu komoditas dalam revitalisasi perikanan dengan
produksi selama periode tahun 2003-2007 meningkat sebesar 16,39%, yaitu dari
192.926 ton pada tahun 2003 menjadi 352.220 ton pada tahun 2007 (KKP 2008).
Produksi udang pada tahun 2014 diharapkan mencapai 699.000 ton, yang
diharapkan disuplai dari 188.000 ton udang windu dan 511.000 ton dari udang
vaname (KKP 2010). Data yang dikeluarkan Kementerian Kelautan dan Perikanan
(KKP) menyebut kinerja udang tanah air pada tahun 2009 produksinya mengalami
penurunan hingga 30% dari produksi 2008, yaitu hanya mencapai 338.060 ton.
Masalah terbesar yang dihadapi dalam budidaya udang adalah infeksi penyakit
bakterial dan viral. Serangan virus IMNV (Infectious Myonecrosis Virus) terjadi pada semua sentra budidaya di Indonesia. Akibat serangan virus pada budidaya
udang, KKP bahkan merevisi target produksi udang tahun ini dari 410.000 ton
menjadi 350.000 ton. Total produksi udang nasional tahun 2010 berkisar 352.000
ton atau turun dari target semula 410.000 ton (KKP 2011).
IMNV pertama kali ditemukan menyerang budidaya udang vaname pada
tahun 2002 di Brazil (Costa et al. 2009). Di Indonesia, IMNV pertama kali ditemukan menyerang udang jenis vaname pada tahun 2006 di Situbondo. Gejala
klinis yang ditimbulkan berupa rusaknya jaringan otot dan menyebabkan
perubahan warna putih pada otot skeletal, otot kemerahan, dan mengakibatkan
kematian hingga 70% (Tang et al. 2005). Saat ini, IMNV merupakan masalah utama yang dihadapi para petambak. Dampak yang ditimbulkan berupa
menurunnya produktivitas dan menyebabkan kerugian yang besar bagi para
petani, serta mempengaruhi perekonomian nasional akibat menurunnya devisa,
sehingga diperlukan sebuah solusi untuk menangani masalah tersebut.
Sinbiotik merupakan salah satu solusi yang dapat digunakan untuk
memecahkan masalah tersebut. Menurut Li et al. (2009) sinbiotik (gabungan antara probiotik dan prebiotik) terbukti mampu meningkatkan respon imun dan
resistensi udang. Hasil penelitian Widagdo (2011) menunjukkan bahwa
penambahan sinbiotik melalui pakan mampu meningkatkan kelangsungan hidup
2 Probiotik merupakan mikroba hidup yang ditambahkan melalui pakan dan
memberi pengaruh yang menguntungkan bagi inang dengan meningkatkan
keseimbangan mikroba dalam saluran pencernaan (Fuller 1992). Prebiotik
merupakan bahan pangan yang tidak dapat dicerna oleh inang tetapi memberikan
efek menguntungkan bagi inang dengan cara merangsang pertumbuhan mikroflora
normal di dalam saluran pencernaan inang. Sinbiotik merupakan kombinasi
seimbang dari probiotik dan prebiotik dalam mendukung kelangsungan hidup dan
pertumbuhan bakteri yang menguntungkan dalam saluran pencernaan makhluk
hidup (Schrezenmeir dan Vrese 2001).
Probiotik yang digunakan dalam penelitian ini adalah bakteri Vibrio alginolyticus SKT-b, bakteri ini mampu menghambat pertumbuhan V. harveyi
dalam uji in vitro dan in vivo (Widanarni et al. 2003). Sedangkan prebiotik yang digunakan yaitu karbohidrat golongan oligosakarida yang berasal dari ubi jalar
varietas sukuh (Marlis 2008). Fermentasi oligosakarida oleh bakteri akan
menghasilkan energi metabolisme dan asam lemak rantai pendek. Hampir semua
zat yang diproduksi oleh bakteri bersifat asam dan merupakan hasil fermentasi
karbohidrat oligosakarida (Tomomatsu 1994 dalam Rini 2008). Gabungan antara
keduanya pada penelitian ini diharapkan mampu meningkatkan sintasan,
pertumbuhan, dan respon imun udang vaname.
Dosis normal probiotik dan prebiotik yang digunakan dalam penelitian ini
mengacu pada penelitian Wang (2007) dan Mahious (2006). Wang (2007)
menyatakan bahwa pemberian probiotik pada udang vaname sebanyak 1%
memiliki pertumbuhan dan aktivitas enzim pencernaan yang lebih baik
dibandingkan dengan kontrol. Pemberian prebiotik berupa oligofruktosa
(Raftilose P95) 2% pada weaning turbot, Psetta maxima menunjukkan bobot rata-rata yang lebih tinggi dibandingkan dengan inulin (Raftiline ST) 2% dan
laktosukrosa 2%. Raftilose P95 juga dapat dimanfaatkan sebagai sumber karbon
oleh Bacillus sp. sehingga dapat menghasilkan pertumbuhan Bacillus sp. yang lebih cepat (Mahious 2006). Adanya penggunaan setengah dosis dan dua kali
dosis dari dosis normal bertujuan untuk mencari dosis yang efektif dan efisien
3 Penelitian ini bertujuan untuk menguji pengaruh pemberian sinbiotik
dengan dosis berbeda pada pakan udang vaname untuk pencegahan infeksi IMNV
4
II.
METODOLOGI
2.1 Penyiapan Prebiotik
2.1.1 Ekstraksi Oligosakarida/Prebiotik
Proses ekstraksi oligosakarida/prebiotik mengacu pada metode Muchtadi
(1989). Tepung kukus ubi jalar varietas sukuh disuspensikan pada etanol 70%
dengan perbandingan 1:10. Homogenisasi dilakukan dengan menggunakan
magnetic stirer selama 15 jam. Selanjutnya, suspensi ubi jalar diendapkan dan disaring menggunakan kertas saring dan corong steril. Pemisahan natan dan
supernatan dilakukan pada sentrifus dengan kecepatan 5.000 rpm selama
10 menit. Filtrat yang telah diperoleh dipekatkan menggunakan evaporator vacum
pada suhu 40 oC.
Hasil pemekatan kemudian diencerkan dengan akuades steril hingga
mencapai kadar TPT (Total Padatan Terlarut) sebesar 5% (Marlis 2008).
Pengujian TPT ini mengacu kepada metode Apriyantono et al. (1989). Cawan porselin terlebih dahulu dimasukkan ke dalam oven selama satu jam pada suhu
100 oC, kemudian cawan dimasukkan ke dalam desikator selama 15 menit, dan
ditimbang (a gram). Sebanyak 1 ml oligosakarida yang telah diekstraksi dari ubi
jalar dimasukkan dalam cawan porselin tersebut dan ditimbang (b gram). Cawan
yang berisi oligosakarida tersebut dimasukan ke dalam oven selama 24 jam pada
suhu 100 oC, kemudian dimasukkan ke dalam desikator selama 15 menit. Setelah
itu, cawan tersebut ditimbang (c gram). Total padatan terlarut dihitung dengan
rumus:
TPT= (c-a)/b x 100%
2.2 Pengujian Sinbiotik secara In Vivo
2.2.1 Persiapan Wadah dan Media Pemeliharaan
Wadah yang digunakan dalam penelitian berupa akuarium yang berukuran
50 cm x 40 cm x 35 cm sebanyak 15 buah. Akuarium terlebih dahulu dicuci
dengan deterjen dan dikeringkan. Selanjutnya akuarium didesinfeksi dengan
kaporit 100 ppm selama 24 jam, kemudian dibersihkan kembali. Akuarium yang
telah didesinfeksi diisi dengan air laut sebanyak 40 liter pada masing-masing
5 dari Ancol. Air laut terlebih dahulu ditampung dalam tandon dan didesinfeksi
dengan kaporit 30 ppm serta dinetralkan dengan Na-Thiosulfat 15 ppm. Sebelum
digunakan, secara berkala dilakukan pengontrolan kadar klorin menggunakan
Clorine test.
2.2.2 Persiapan Hewan Uji
Hewan uji yang digunakan adalah benur udang vaname stadia Post Larvae
(PL) 10 yang berasal dari PT. Global Gen, Labuan, Banten. Benur terlebih dahulu
dipelihara selama 30 hari dalam akuarium. Akuarium yang digunakan dilengkapi
dengan shelter sebagai tempat untuk berlindung. Selain itu, dinding akuarium ditutup plastik hitam agar udang tidak stres. Waring juga ditambahkan di atas
akuarium untuk mencegah udang keluar dari akuarium. Selama pemeliharaan
udang diberi pakan komersil dengan frekuensi pemberian pakan 4 kali sehari,
yaitu pukul 07.00, 11.00, 15.00, 19.00 WIB. Pengelolaan kualitas air dilakukan
dengan penyiponan dan pergantian air pada pagi hari sebanyak 10% dari total
volume secara berkala.
2.2.3 Persiapan Pakan Uji
Persiapan pakan uji meliputi tahap kultur bakteri, pemisahan sel bakteri,
serta pencampuran pakan. Kultur bakteri probiotik SKT-b dilakukan pada media
SWC (Sea Water Complete) agar miring (Lampiran 1) selama 24 jam pada suhu
ruang (27 oC). Selanjutnya, bakteri SKT-b diinokulasikan ke dalam media SWC
cair (Lampiran 1) dan diinkubasi dalam waterbath shaker selama 24 jam pada suhu 30 oC dengan kecepatan 140 rpm.
Pemanenan sel bakteri dilakukan dengan memindahkan hasil kultur bakteri
ke dalam tabung Corning 25 ml kemudian disentrifus selama 10 menit dengan
kecepatan 5.000 rpm untuk memisahkan padatan sel bakteri dan media. Sel
bakteri kemudian dicuci sebanyak dua kali dengan larutan PBS (Posphat Buffer Saline) sebanyak 25 ml (Lampiran 1), dihomogenisasi dengan vortex dan disentrifuse selama 10 menit pada kecepatan 5.000 rpm. Setelah itu ditambahkan
larutan PBS sebanyak 10 ml dan dihomogenisasi dengan vortex.
Hasil dari vortex merupakan probiotik yang akan dicampurkan ke dalam
pakan. Dosis probiotik dan prebiotik yang digunakan sesuai dengan perlakuan.
6 campuran pakan yang berfungsi sebagai perekat (Wang 2007). Sebelum diberikan
ke udang, pakan dikeringudarakan selama 10-15 menit untuk mengurangi
kelembaban.
2.2.4 Pengujian Pakan Uji pada Udang Vaname
Pakan uji yang digunakan dalam penelitian ini berupa pelet dengan
kandungan protein 40%. Penelitian ini terdiri dari lima perlakuan, yaitu kontrol
negatif, kontrol positif, dan tiga perlakuan sinbiotik dengan dosis yang berbeda
(Tabel 1). Masing-masing perlakuan terdiri dari tiga ulangan.
Tabel 1. Perlakuan pakan uji pada udang vaname
Perlakuan Keterangan
K- Pemberian pakan tanpa penambahan sinbiotik serta tidak diinfeksi IMNV
(kontrol negatif)
K+ Pemberian pakan tanpa penambahan sinbiotik serta diinfeksi IMNV (kontrol
positif)
A Pemberian pakan dengan penambahan sinbiotik setengah dosis (probiotik
sebesar 0,5% dan prebiotik sebesar 1%) serta diinfeksi IMNV
B Pemberian pakan dengan penambahan sinbiotik satu dosis (probiotik sebesar
1% dan prebiotik sebesar 2%) serta diinfeksi IMNV
C Pemberian pakan dengan penambahan sinbiotik dua kali dosis (probiotik
sebesar 2% dan prebiotik sebesar 4%) serta diinfeksi IMNV.
Udang vaname dengan berat rata-rata 0,54±0,04 gram dipelihara selama
30 hari dalam akuarium pada volume 40 liter sebanyak 20 ekor/akuarium.
Pemberian pakan dilakukan lima kali dalam sehari pada pukul 07.00, 11.00,
15.00, 19.00, dan 23.00 WIB. Jumlah pakan yang diberikan didasarkan pada
Feeding Rate (FR) menurut SNI 01-7246-2006. FR yang digunakan dalam penelitian ini yaitu 25% menurun hingga 8% sesuai dengan bobot udang vaname.
Sampling bobot dilakukan setiap 10 hari sekali, sedangkan pengujian kualitas air
dilakukan pada awal dan akhir pemeliharaan. Setelah udang vaname diberi
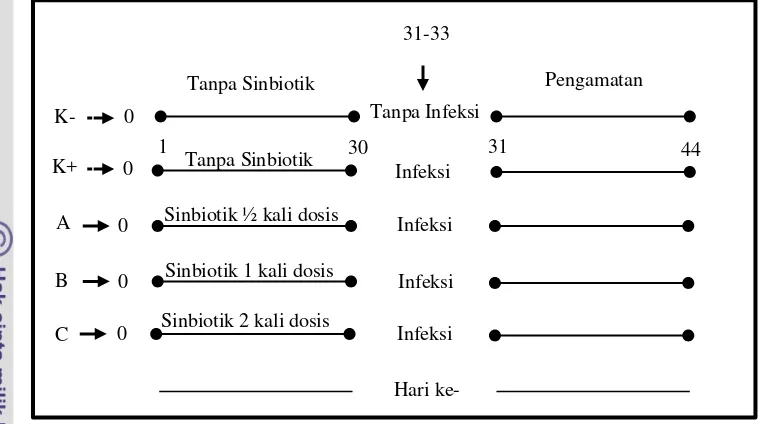
perlakuan sinbiotik selama 30 hari, udang diinfeksi IMNV. Infeksi IMNV pada
udang dilakukan melalui oral, yaitu dengan memberikan pakan berupa daging
udang yang sudah terinfeksi IMNV selama 3 hari (Coelho et al. 2009)
7
0
1 30 31 44
31-33
Tanpa Infeksi
Infeksi 0
0
0
0
Tanpa Perlakuan Tanpa Sinbiotik
Infeksi
Infeksi
Infeksi Sinbiotik ½ kali dosis
Sinbiotik 1 kali dosis Sinbiotik 2 kali dosis
Tanpa Sinbiotik Pengamatan
Hari ke-
Gambar 1. Skema uji in vivo.
2.3 Parameter Pengamatan 2.3.1 Sintasan
Sintasan atau tingkat kelangsungan hidup udang uji dapat diketahui dari
jumlah udang pada akhir perlakuan dibagi dengan jumlah udang awal
(Effendi 2004), dirumuskan sebagai berikut :
SR =
x 100%
Keterangan :
SR = Sintasan (%)
Nt = Jumlah udang pada akhir perlakuan (ekor)
No = Jumlah udang pada awal perlakuan (ekor)
2.3.2 Laju Pertumbuhan Harian
Laju pertumbuhan harian dihitung dengan menggunakan rumus
(Huissman 1987) :
α = [√ ] x 100%
Keterangan :
α = Laju pertumbuhan harian (%)
Wt = Bobot rata-rata udang pada akhir perlakuan (gram)
K- K+
A
B
8
Wo = Bobot rata-rata udang pada awal perlakuan (gram)
t = Periode pemeliharaan (hari)
2.3.3 Rasio Konversi Pakan
Rasio konversi pakan selama pemeliharaan dihitung menggunakan rumus
(Zonneveld et al. 1991) :
FCR =
Keterangan :
FCR = Konversi pakan
F = Jumlah pakan (gram)
Bt = Biomassa udang pada saat akhir perlakuan (gram)
Bm = Biomassa udang yang mati saat perlakuan (gram)
Bo = Biomassa udang pada saat awal perlakuan (gram)
2.3.4 Total Hemosit
Penghitungan total hemosit mengacu pada metode Blaxhall dan Daishley
(1973). Hemolim diambil sebanyak 0,1 ml dari pangkal kaki renang pertama
dengan syringe 1 ml yang telah berisi 0,3 ml antikoagulan. Selanjutnya campuran tersebut dihomogenkan dengan cara menggoyangkan tangan membentuk angka
delapan. Tetesan pertama dibuang, tetesan selanjutnya diteteskan pada
hemositometer. Total hemosit didapatkan dengan menghitung jumlah selnya per
ml di bawah mikroskop dengan perbesaran 400 kali.
2.3.5 Indeks Fagositik
Penghitungan indeks fagositik mengacu pada metode Anderson dan Siwicki
(1993). Hemolim udang dimasukkan sebanyak 0,1 ml ke dalam eppendorf dan
dicampurkan secara merata dengan 25 µ l bakteri Staphylococcus sp. (107 sel/ml). Selanjutnya diinkubasi selama 20 menit. Sebanyak 5 µ l diteteskan pada gelas
objek dan dibuat preparat ulas. Proses fiksasi menggunakan metanol dilakukan
selama 5-10 menit. Kemudian, hasil fiksasi direndam dalam larutan pewarna
giemsa selama 15-20 menit. Aktivitas fagositosis diukur berdasarkan persentase
sel-sel fagosit yang menunjukkan proses fagositosis dari 100 sel fagositik yang
teramati. Indeks fagositik dihitung dengan rumus :
9
2.3.6Aktivitas Phenoloxydase (PO)
Pengukuran PO dilakukan berdasarkan prosedur yang dikemukan oleh Liu
dan Chen (2004). Aktivitas PO hemosit diukur berdasarkan formasi dopachrome
yang dihasilkan oleh L-DOPA. Sebanyak 1 ml campuran hemolymph
-antikoagulan disentrifuse pada kecepatan 1.500 rpm selama 10 menit pada
temperatur 4 oC. Supernatan dikeluarkan dan pelet disuspensikan kembali secara
perlahan-lahan ke dalam 1 ml larutan cacodylate-citrate buffer (0,01 M sodium cacodylate, 0,45 M sodium chloride, 0,10 M trisodium citrate, pH 7) kemudian disentrifuse kembali. Pelet kemudian diambil dan disuspensikan dalam 200 µ l
cacodylate-citrate buffer (0,01 M sodium cacodylate, 0,45 M sodium chloride, 0,10 M trisodium citrate, pH 7).
Suspensi sel sebanyak 100 µ l kemudian diinkubasi dengan 50 µ l trypsin (1 mg/ml cacodylate buffer) sebagai aktivator selama 10 menit pada temperatur 25-26 oC. Selanjutnya ditambahkan 50 µl L-DOPA (3 mg/ml cacodylate buffer) setelah 5 menit, dan ditambahkan 800 µ l cacodylate buffer. Densitas optikal (OD) diukur dengan menggunakan spektrofotometer dengan panjang gelombang 490
nm.
Larutan standar mengandung 100 µ l suspensi haemocyte, 50 µ l cacodylate buffer (pengganti tripsin), dan 50 µ l L-DOPA digunakan untuk mengukur
background aktivitas PO pada semua larutan uji. Densitas optikal (OD) dari aktivitas PO pada semua kondisi uji dinyatakan sebagai formasi dopachrome
dalam 50 µ l haemolymph.
2.3.7 Diferensial Hemosit
Diferensial hemosit dihitung berdasarkan metode yang dilakukan Martin
dan Graves (1995). Hemolim diteteskan pada gelas objek dan dibuat ulasan,
kemudian dikeringudarakan. Preparat difiksasi dengan metanol selama 5-10 menit
kemudian dikeringudarakan kembali. Preparat direndam dalam larutan giemsa
selama 15-20 menit, dicuci dengan air mengalir dan dibiarkan kering. Ulasan
hemolim diperiksa di bawah mikroskop dengan perbesaran 100 kali dan
diidentifikasi selnya. Jumlah hemosit dihitung hingga 100 sel dan ditentukan
persentase tiap jenisnya.
10
2.4 Kualitas Air
Kualitas air diukur pada saat awal dan akhir pemeliharaan. Parameter
kualitas air yang diukur diantaranya : suhu, oksigen terlarut (DO), pH, dan TAN.
Satuan dan alat pengukuran parameter kualitas air yang diukur disajikan pada
Tabel 2.
Tabel 2. Satuan dan Alat Ukur Parameter Kualitas Air
Parameter Satuan Alat ukur
Suhu oC Termometer
Salinitas ppt Salinometer
Oksigen terlarut mg/L DO meter
pH - pH meter
TAN - Spektrometer
2.5 Analisis Data
Penelitian ini menggunakan rancangan percobaan berupa Rancangan Acak
11
III.
HASIL DAN PEMBAHASAN
3.1 Sintasan
Sintasan atau kelangsungan hidup merupakan persentase udang yang hidup
pada akhir pemanenan terhadap jumlah ikan saat ditebar. Sintasan merupakan
parameter utama dalam penelitian ini. Sintasan diamati sebelum dan setelah uji
tantang menggunakan virus IMNV. Nilai sintasan pada masing-masing perlakuan
disajikan pada Gambar 2.
Keterangan :
* Huruf yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05)
** K- (kontrol negatif), K+ (kontrol positif ), A (probiotik 0,5% dan prebiotik 1%), B (probiotik 1% dan prebiotik 2%), C (probiotik 2% dan prebiotik 4%).
Gambar 2. Sintasan udang vaname sebelum dan setelah uji tantang dengan IMNV.
Hasil uji lanjut dengan menggunakan uji Duncan menunjukan bahwa tidak
ada perbedaan yang nyata antar perlakuan sebelum infeksi IMNV dengan nilai
sintasan sebesar 100% pada semua perlakuan (p>0,05; Lampiran 2), namun
infeksi IMNV melalui oral memberikan pengaruh berbeda nyata terhadap
perlakuan (p<0,05; Lampiran 3). Setelah infeksi, uji statistik menunjukkan bahwa
perlakuan C menghasilkan sintasan yang tinggi yaitu 80% dan tidak berbeda nyata
dengan perlakuan A, B, dan K-, namun berbeda nyata dengan perlakuan K+
(p<0,05; Lampiran 2).
Dosis yang ditambahkan pada perlakuan B dan C diduga mampu
meningkatkan respon imun sehingga memiliki sintasan yang berbeda nyata
0 10 20 30 40 50 60 70 80 90 100
Sebelum uji tantang Setelah uji tantang
S in ta sa n (%) Perlakuan K-K+ A B C
bc
12 dengan kontrol positif. Hal ini didukung dengan hasil penelitian Widagdo (2011)
yang menunjukkan bahwa penambahan probiotik SKT-b 1% dan prebiotik 2%
memberikan kelangsungan hidup udang vaname sebesar 83,33% setelah diinfeksi
V. harveyi sedangkan kontrol positif hanya mencapai 31,67%. Hasil penelitian Li et al. (2009) juga menunjukkan bahwa penambahan probiotik Bacillus OJ (PB)
dengan konsentrasi 108 CFU/g pakan dan 0,2% isomaltooligosaccharides (IMO)
dapat meningkatkan resistensi udang terhadap penyakit dengan meningkatkan
respons imun udang.
3.2 Laju Pertumbuhan Harian
Pertumbuhan merupakan pertambahan ukuran baik bobot maupun panjang
dalam suatu periode atau waktu tertentu (Effendie 1997). Hasil yang disajikan
pada Gambar 3 menunjukkan bahwa pemberian sinbiotik melalui pakan
memberikan pengaruh yang berbeda nyata terhadap laju pertumbuhan harian
udang vaname (p<0,05; Lampiran 4). Secara statistik, perlakuan B dan C
(7,52-7,59%) tidak berbeda nyata, namun berbeda nyata dengan perlakuan K-,
K+, dan A (6,73-6,96%).
Keterangan :
* Huruf yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05)
** K- (kontrol negatif), K+ (kontrol positif ), A (probiotik 0,5% dan prebiotik 1%), B (probiotik 1% dan prebiotik 2%), C (probiotik 2% dan prebiotik 4%).
Gambar 3. Laju pertumbuhan harian udang vaname sebelum uji tantang dengan IMNV.
6,73 6,84 6,96
7,52 7,59
,00 1,00 2,00 3,00 4,00 5,00 6,00 7,00 8,00
K- K+ A B C
L aj u P er tum b uh an H ar ia n (%) Perlakuan
13 Dosis pemberian sinbiotik pada perlakuan B lebih rendah dibandingkan
perlakuan C, namum laju pertumbuhan udang vaname pada kedua perlakuan
tersebut tidak berbeda nyata. Hal ini menunjukkan dugaan bahwa dosis tersebut
telah mampu meningkatkan mikroflora normal dan mampu memperpanjang
kolonisasi bakteri probiotik di dalam usus sehingga pakan dapat dimanfaatkan
dengan baik untuk pertumbuhan dengan menghasilkan enzim pencernaan. Wang
(2007) menyatakan bahwa pemberian probiotik pada udang vaname sebanyak
1% memiliki pertumbuhan dan aktivitas enzim pencernaan yang lebih baik
dibandingkan dengan kontrol. Hasil penelitian Li et al. (2005) juga menunjukan bahwa prebiotik GrobiotikR–A 2% menghasilkan pertumbuhan, efisiensi pakan
dan proteksi terhadap infeksi Mycobacterium marinum yang terbaik dibandingkan dengan perlakuan lainnya. Pendapat tersebut diperkuat oleh Widagdo (2011) yang
menyatakan bahwa peningkatan bobot udang vaname pada perlakuan pakan yang
ditambahkan probiotik sebanyak 1%, prebiotik sebanyak 2%, dan sinbiotik
(probiotik sebanyak 1% dan prebiotik sebanyak 2%) cenderung lebih tinggi
dibandingkan dengan kontrol.
3.3 Rasio Konversi Pakan
Konversi pakan merupakan suatu ukuran yang menyatakan rasio jumlah
pakan yang dibutuhkan untuk menghasilkan 1 kg daging (Effendi 2004). Konversi
pakan dapat digunakan untuk mengetahui kualitas pakan yang diberikan terhadap
pertumbuhan udang. Jumlah pakan yang efektif diketahui dari konversi pakan
yang rendah. Semakin kecil nilai konversi pakan maka semakin efektif pakan
yang diberikan. Hasil pengamatan yang dapat dilihat pada Gambar 4
menunjukkan bahwa pemberian sinbiotik melalui pakan memiliki pengaruh yang
berbeda nyata terhadap konversi pakan udang vaname (p<0,05; Lampiran 5).
Perlakuan B dan C (1,64-1,65) memiliki laju pertumbuhan yang lebih baik
dibandingkan perlakuan lainnya. Secara statistik, perlakuan A tidak berbeda nyata
dengan perlakuan lainnya, sedangkan perlakuan B dan C tidak berbeda nyata,
14
Keterangan :
* Huruf yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05)
** K- (kontrol negatif), K+ (kontrol positif ), A (probiotik 0,5% dan prebiotik 1%), B (probiotik 1% dan prebiotik 2%), C (probiotik 2% dan prebiotik 4%).
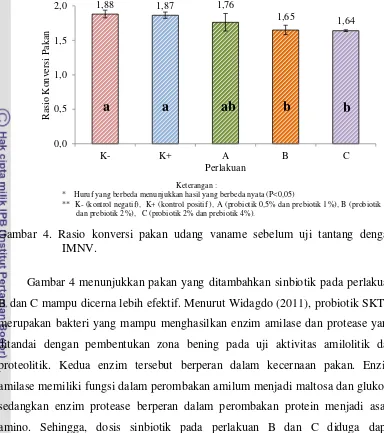
Gambar 4. Rasio konversi pakan udang vaname sebelum uji tantang dengan IMNV.
Gambar 4 menunjukkan pakan yang ditambahkan sinbiotik pada perlakuan
B dan C mampu dicerna lebih efektif. Menurut Widagdo (2011), probiotik SKT-b
merupakan bakteri yang mampu menghasilkan enzim amilase dan protease yang
ditandai dengan pembentukan zona bening pada uji aktivitas amilolitik dan
proteolitik. Kedua enzim tersebut berperan dalam kecernaan pakan. Enzim
amilase memiliki fungsi dalam perombakan amilum menjadi maltosa dan glukosa
sedangkan enzim protease berperan dalam perombakan protein menjadi asam
amino. Sehingga, dosis sinbiotik pada perlakuan B dan C diduga dapat
meningkatkan kecernaan pakan melalui peningkatan enzim pencernaan.
3.4 Gejala Klinis
Hasil pengamatan menunjukkan bahwa udang yang terinfeksi IMNV
memiliki gejala-gejala seperti timbulnya otot putih di ruas permukaan tubuh, usus
udang tidak terisi penuh, serta ketika udang mengalami kematian maka seluruh
ruas tubuhnya terlihat putih (Gambar 5). Menurut Tang et al. (2005), organ target penyakit IMNV adalah otot dan organ limfoid. Timbulnya otot putih disebabkan
oleh rusaknya jaringan otot. Usus yang tidak terisi penuh diduga akibat udang
stres ketika diinfeksi virus IMNV sehingga nafsu makan menurun.
1,88 1,87 1,76
1,65 1,64
0,0 0,5 1,0 1,5 2,0
K- K+ A B C
R as io K o n v er si P aka n Perlakuan
15
Gambar 5. Gejala klinis udang yang terinfeksi IMNV (udang normal (A), otot putih pada ruas tubuh (B), usus udang yang tidak terisi penuh (C), udang mati akibat terinfeksi IMNV(D))
Udang yang terinfeksi IMNV menularkan penyakit infectious myonecrosis
dengan gejala klinis yang utama adalah hilangnya transparansi atau opacity
jaringan perut, disebabkan oleh nekrosis di otot skeletal. Pada tahap yang lebih
parah, perut lesi yang keputihan beralih menjedi kemerahan akibat nekrosis otot
yang luas (Nunes et al. 2004; Tang et al. 2005.). Secara histologi, lesi ditandai dengan nekrosis otot coagulative, hemocytic infiltrasi dan fibrosis (Tang et al.
2005; Andrade et al. 2008). Gejala-gejala ini disertai dengan tingkat kematian harian persisten setelah udang mencapai 7 g dan setelah 120 hari, mortalitas
kumulatif dapat mencapai 70% (Nunes et al. 2004).
3.5 Total Hemosit
Hemosit krustase dan invertebrata lain memiliki peranan penting dalam
sistem pertahanan tubuh terhadap patogen seperti virus, bakteri, fungi, protozoa,
dan metazoa melalui tahap-tahap pengenalan, fagositosis, melanisasi, sitotoksis,
dan komunikasi sel (Johansson et al. 2000; Rodriguez dan Le Muollac 2000). Hemosit juga berperan dalam sintesa dan pelepasan molekul penting hemolim
seperti α2-macroglobulin (α2M), aglutinin, dan peptida antibakteri (Rodriguez dan Le Moullac 2000).
A
D B
16 Uji statistik menunjukkan bahwa infeksi IMNV melalui oral memberikan
pengaruh berbeda nyata pada total hemosit udang vaname (p<0,05; Lampiran 6).
Gambar 6 menunjukkan bahwa perlakuan sinbiotik A, B, dan C memiliki total
hemosit yang lebih tinggi ((1,13-3,76)x107 sel/ml ) dibandingkan dengan K+
(0,73x107 sel/ml). Hal tersebut mengindikasikan perlakuan sinbiotik memberikan
pengaruh yang lebih baik dibanding kontrol positif. Semakin tinggi total hemosit
maka semakin tinggi pula peluang sel-sel yang melakukan fagositosis dan sel
granular yang melakukan aktifitas phenoloxydase sehingga udang dapat bertahan terhadap serangan patogen. Apabila terjadi penurunan total hemosit maka dapat
terjadi infeksi akut yang dapat menyebabkan kematian (Rodriguez dan Le
Moullac 2000)
Keterangan :
* Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05)
** K- (kontrol negatif), K+ (kontrol positif ), A (probiotik 0,5% dan prebiotik 1%), B (probiotik 1% dan prebiotik 2%), C (probiotik 2% dan prebiotik 4%).
Gambar 6. Total hemosit udang vaname setelah uji tantang dengan IMNV.
Total hemosit yang berbeda-beda antar perlakuan (Gambar 6) diduga
diakibatkan oleh perbedaan nutrisi yang diberikan pada udang uji. Tidak ada
penambahan sinbiotik pada perlakuan K- dan K+ sedangkan perlakuan A, B, dan
C merupakan perlakuan sinbiotik dengan dosis yang berbeda. Dengan demikian,
perbedaan tersebut juga diduga mempengaruhi respon uji terhadap infeksi IMNV.
Seperti yang dinyatakan Johansson et al. (2000), jumlah haemocyte dapat sangat bervariasi berdasarkan spesies, respon terhadap infeksi, stres lingkungan, aktivitas
1,50
0,73
1,13 1,22
3,76 ,00 ,50 1,00 1,50 2,00 2,50 3,00 3,50 4,00 4,50
K- K+ A B C
T o ta l h em o si t (x10
7 s
el
/m
l)
Perlakuan
17 endokrin selama siklus molting. Selain itu, dapat dipengaruhi juga oleh seks,
perkembangan, status reproduksi dan nutrisi (Song et al. 2003).
3.6Indeks Fagositik
Fagositosis merupakan reaksi yang paling umum dalam pertahanan seluler
udang. Fagosit dapat terjadi pada luka, di dalam organ penyaringan, jaringan
sistem peredaran, dan dalam cairan tubuh. Lebih lanjut, perbandingan indeks
fagositik antar perlakuan dapat dilihat pada Gambar 7.
Keterangan :
* Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05)
** K- (kontrol negatif), K+ (kontrol positif ), A (probiotik 0,5% dan prebiotik 1%), B (probiotik 1% dan prebiotik 2%), C (probiotik 2% dan prebiotik 4%).
Gambar 7. Indeks fagositik udang vaname setelah uji tantang dengan imnv.
Gambar 7 menunjukkan bahwa indeks fagositik udang vaname perlakuan
A, B, dan C lebih tinggi (36-61%) dibandingkan dengan K+ (26,5%). Uji statistik
menunjukkan bahwa infeksi IMNV memberikan pengaruh berbeda nyata pada
indeks fagositik udang vaname (p<0,05; Lampiran 7). Berdasarkan uji lanjut
Duncan, perlakuan C tidak berbeda nyata dengan K-, namun berbeda nyata
dengan perlakuan lainnya. Meningkatnya pertahanan tubuh dapat diketahui
dengan meningkatnya aktifitas sel-sel fagosit dari hemosit. Sel-sel fagosit tersebut
berfungsi dalam proses fagositosis terhadap benda asing yang masuk ke dalam
tubuh inang. Proses fagositosis dimulai dengan pelekatan (attachment) dan penelanan (ingestion) partikel mikroba ke dalam sel fagosit. Sel fagosit kemudian membentuk vakuola pencernaan (digestive vacuola) yang disebut phagosome
(Rodriguez dan Le Moullac 2000). Sehingga, perlakuan C merupakan perlakuan
35,00 26,50 36,00 52,00 61,00 0 10 20 30 40 50 60 70
K- K+ A B C
In de ks F ago si ti k (%) Perlakuan
d
18 sinbiotik yang memiliki respon imun yang lebih baik dibandingkan perlakuan
lainnya.
3.7 Aktivitas Phenoloxydase (PO)
Enzim phenoloxydase (PO) terdapat dalam hemolim dan merupakan
inactive pro-enzyme yang disebut proPO. Uji statistik menunjukkan bahwa infeksi IMNV memberikan pengaruh berbeda nyata terhadap aktivitas enzim PO (p<0,05;
Lampiran 7). Aktivitas enzim PO udang vaname pada masing-masing perlakuan
dapat dilihat pada Gambar 8.
Keterangan :
* Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05)
** K- (kontrol negatif), K+ (kontrol positif ), A (probiotik 0,5% dan prebiotik 1%), B (probiotik 1% dan prebiotik 2%), C (probiotik 2% dan prebiotik 4%).
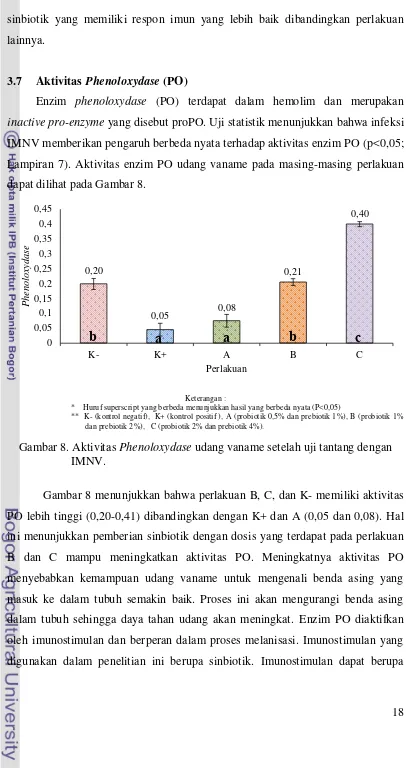
Gambar 8. Aktivitas Phenoloxydase udang vaname setelah uji tantang dengan IMNV.
Gambar 8 menunjukkan bahwa perlakuan B, C, dan K- memiliki aktivitas
PO lebih tinggi (0,20-0,41) dibandingkan dengan K+ dan A (0,05 dan 0,08). Hal
ini menunjukkan pemberian sinbiotik dengan dosis yang terdapat pada perlakuan
B dan C mampu meningkatkan aktivitas PO. Meningkatnya aktivitas PO
menyebabkan kemampuan udang vaname untuk mengenali benda asing yang
masuk ke dalam tubuh semakin baik. Proses ini akan mengurangi benda asing
dalam tubuh sehingga daya tahan udang akan meningkat. Enzim PO diaktifkan
oleh imunostimulan dan berperan dalam proses melanisasi. Imunostimulan yang
digunakan dalam penelitian ini berupa sinbiotik. Imunostimulan dapat berupa
0,20
0,05 0,08
0,21 0,40 0 0,05 0,1 0,15 0,2 0,25 0,3 0,35 0,4 0,45
K- K+ A B C
P he nol ox ydas e Perlakuan
a
a
b
c
19 bakteri dan produk bakteri, yeast, kompleks karbohidrat, faktor nutrisi, ekstrak
hewan, ekstrak tumbuhan, dan obat-obatan sintetik (Sakai 1999;
Cook et al. 2003).
Transformasi proPO menjadi PO melibatkan beberapa reaksi yang dikenal
sebagai sistem aktivasi proPO. Sistem ini terutama diaktifkan oleh beta glukan,
dinding sel bakteri dan LPS. Sistem proPO dapat digunakan sebagai marker
kesehatan udang dan lingkungan karena perubahan sistem proPO berkorelasi
dengan tahap infeksi dan variasi lingkungan (Sritunyalucksana dan
Soderhall 2000).
Enzim PO bertanggung jawab terhadap proses melanisasi pada arthropoda
(Rodriquez dan Le Moullac 2000). Enzim ini mengkatalis hidroksilasi
monophenol dan oksidasi phenol menjadi quinones yang diperlukan untuk proses
melanisasi sebagai respon terhadap penyerang asing dan selama proses
penyembuhan. Quinone selanjutnya diubah melalui suatu reaksi non-enzymatic
menjadi melanin dan sering dideposit pada benda yang dienkapsulasi, dalam
nodule haemocyte, dan pada daerah kulit yang terinfeksi jamur. Produksi reactive oxygen spesies seperti superoxyde anion dan hydroxyl radical selama pembentukan quonoid juga memainkan peranan penting sebagai antimikroba
(Sritunyalucksana dan Soderhall 2000; Vargas dan Yepiz 2000).
3.8 Diferensial Hemosit
Klasifikasi tipe haemocyte krustase terutama didasarkan pada
keberadaan granula sitoplasma, yaitu sel hyaline, semigranular, dan granular (Johansson et al. 2000). Sel hyaline merupakan tipe sel yang paling kecil dengan rasio nukleus sitoplasma tinggi dan tanpa atau hanya sedikit granula sitoplasma;
sel granular merupakan tipe sel paling besar dengan nukleus yang lebih kecil dan
terbungkus dengan granula; sel semi granulosit merupakan tipe sel diantara
20 (A)
(B)
Keterangan :
* Huruf yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05)
** K- (kontrol negatif), K+ (kontrol positif ), A (probiotik 0,5% dan prebiotik 1%), B (probiotik 1% dan prebiotik 2%), C (probiotik 2% dan prebiotik 4%).
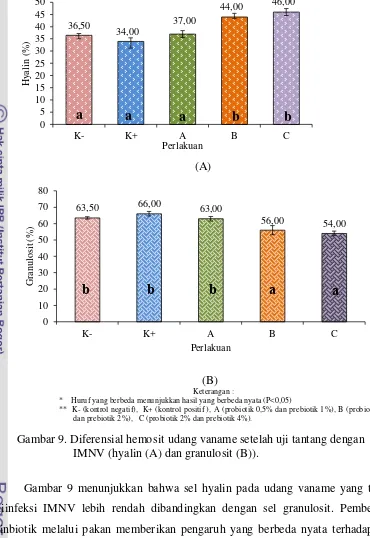
Gambar 9. Diferensial hemosit udang vaname setelah uji tantang dengan IMNV (hyalin (A) dan granulosit (B)).
Gambar 9 menunjukkan bahwa sel hyalin pada udang vaname yang telah
diinfeksi IMNV lebih rendah dibandingkan dengan sel granulosit. Pemberian
sinbiotik melalui pakan memberikan pengaruh yang berbeda nyata terhadap sel
hyalin dan sel granulosit (Lampiran 9 dan Lampiran 10). Persentase hyalin pada
perlakuan B dan C lebih tinggi (44% dan 46%) dibandingkan dengan K+, K-, dan
A (34%, 36,5% dan 37%). Sel hyaline berperan dalam proses fagositosis, sehingga dapat dikatakan bahwa persentase sel hyaline berkorelasi dengan fagositosis. Persentase sel granulosit perlakuan B dan C lebih rendah (56,00% dan
36,50
34,00
37,00
44,00 46,00
0 5 10 15 20 25 30 35 40 45 50
K- K+ A B C
H ya li n (%) Perlakuan
b
a
b
a
a
63,50 66,00 63,00
56,00 54,00
0 10 20 30 40 50 60 70 80
K- K+ A B C
21 54,00%) dibandingkan dengan K- (63,50%), K+ (66%), dan A (63,00%). Sel
granulosit terdiri dari sel semi granulosit dan sel granulosit. Sel semi granulosit
menunjukkan kapasitas dalam mengenali dan merespons partikel unsur atau
molekul asing, biasa dikenal sebagai sel aktif dalam enkapsulasi. Sel granulosit
bertanggung jawab dalam mengaktifkan sistem PO.
3.9 Kualitas Air
Kualitas air memiliki peranan penting dalam mendukung kelangsungan
hidup dan pertumbuhan udang vaname. Pengukuran kualitas air dilakukan pada
awal dan akhir masa pemeliharaan. Beberapa parameter kualitas air yang diamati
diantaranya, suhu, pH, DO (Dissolved Oxygen), salinitas, dan TAN. Tabel 3 menunjukkan bahwa parameter kualitas air yang diukur masih berada dalam
kisaran normal. Dengan demikian, perubahan kelangsungan hidup, pertumbuhan,
konversi pakan, dan respon imun udang vaname pada perlakuan bukan
diakibatkan oleh kualitas air pemeliharaan.
Tabel 4. Kualitas Air selama Pemeliharaan
Perlakuan Suhu (oC) pH DO (mg/L) Salinitas (ppt) TAN
Tandon (Awal) 27-30 8,15 5,7 30,2 0,1359
K- 27,5-29 7,89 3,48 24-26 0,2869
K+ 27,5-29 7,8 3,5 24-26 0,2924
A 27,5-29 7,76 3,5 24-26 0,3525
B 27,5-29 7,9 3,43 24-26 0,3682
C 27,5-29 7,86 3,45 24-26 0,3475
Brock dan Main
22
IV. KESIMPULAN DAN SARAN
4.1 Kesimpulan
Hasil penelitian menunjukkan bahwa pemberian sinbiotik dengan dosis
yang berbeda pada pakan udang vaname mampu meningkatkan sintasan dan
respon imun udang vaname. Perlakuan C dengan dosis probiotik 2% dan prebiotik
4% memberikan hasil terbaik untuk pencegahan infeksi IMNV dengan nilai
kelangsungan hidup tertinggi (80%) dan respon imun terbaik (total hemosit
(3,76x107 sel/ml), indeks fagositik (61%), aktivitas phenoloxydase (0,40), sel hyalin (46%), dan sel granulosit (54%)).
4.2 Saran
Perlu dilakukan penelitian lanjutan mengenai penambahan sinbiotik melalui
PEMBERIAN SINBIOTIK DENGAN DOSIS BERBEDA
PADA PAKAN UDANG VANAME UNTUK PENCEGAHAN
INFEKSI IMNV (
INFECTIOUS MYONECROSIS VIRUS
)
DAMAYANTI
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
PERNYATAAN MENGENAI SKRIPSI
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul
PEMBERIAN SINBIOTIK DENGAN DOSIS BERBEDA PADA PAKAN
UDANG VANAME UNTUK PENCEGAHAN INFEKSI IMNV
(INFECTIOUS MYONECROSIS VIRUS)
adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apa pun
kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang
berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari
penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di
bagian akhir skripsi ini.
Bogor, Desember 2011
DAMAYANTI
ABSTRAK
DAMAYANTI. Pemberian sinbiotik dengan dosis berbeda pada pakan udang
vaname untuk pencegahan infeksi IMNV (Infectious Myonecrosis Virus).
Dibimbing oleh Widanarni dan Sukenda.
Sinbiotik diharapkan dapat menjadi salah satu alternatif dalam pengendalian infeksi IMNV (Infectious Myonecrosis Virus) pada udang vaname. Penelitian ini bertujuan untuk menguji pengaruh pemberian sinbiotik dengan dosis berbeda pada pakan udang vaname untuk pencegahan infeksi IMNV (Infectious Myonecrosis Virus) melalui pengamatan kelangsungan hidup dan respon imun udang vaname. Probiotik dan prebiotik yang digunakan adalah bakteri Vibrio alginolyticus SKT-b dan oligosakarida yang diekstrak dari ubi jalar varietas sukuh. Udang vaname dengan bobot rata-rata 0,54±0,04 gram/ekor dipelihara sebanyak 20 ekor dalam akuarium bervolume 40 liter selama 30 hari. Penelitian ini terdiri lima perlakuan, yaitu K- dan K+ (tanpa penambahan sinbiotik); A (penambahan sinbiotik setengah dosis: probiotik 0,5 % dan prebiotik 1%); B (penambahan sinbiotik satu dosis: probiotik 1 % dan prebiotik 2%); C (penambahan sinbiotik dua kali dosis: probiotik 2 % dan prebiotik 4%). Setelah 30 hari perlakuan sinbiotik, udang vaname diinfeksi IMNV melalui oral, kecuali perlakuan K-. Hasil penelitian menunjukkan bahwa pemberian sinbiotik dengan dosis yang berbeda mampu meningkatkan sintasan dan respon imun udang vaname. Perlakuan C dengan dosis probiotik 2% dan prebiotik 4% memberikan hasil terbaik untuk pencegahan infeksi IMNV dengan sintasan tertinggi (80%) dan respon imun terbaik.
ABSTRACT
DAMAYANTI. Giving sinbiotic with different doses in white shrimp feed for prevention of infection IMNV (Infectious Myonecrosis Virus). Supervised by Widanarni and Sukenda.
Sinbiotic is an alternative on controling the IMNV (Infectious Myonecrosis Virus) infection in white shrimp. The effect of sinbiotic feeding with different doses on the survival and immune response white shrimp that infected with IMNV has been studied. SKT-b Vibrio alginolyticus and oligosaccharides extracted from sweet potato (sukuh variety) was used as probiotic and prebiotic. Twenty white shrimps with average weight of 0,54 ± 0,04 g, was maintained for 30 days in aquarium with 40 liter of volume. There were five treatments applied to the shrimps, consisted of K- and K- (without the addition of sinbiotic), A (the addition ofsinbiotica half dose: 0.5% probiotic and prebiotic of 1%, B (the addition of sinbioticone dose: probiotic1% and prebiotic 2%, and C (the addition ofsinbioticdouble dose: probiotic 2 % and prebiotic 4%). After 30 days given with treatment feed, the experimental shrimp was infected by oral with IMNV, except K-. The result showed that giving sinbiotic feed with the different doses can increased survival and immune response. Treatment C with dose of probiotic 2% and prebiotic 4% giving the best result for prevention of infection IMNV, had the best survival (80%) and immune response.
PEMBERIAN SINBIOTIK DENGAN DOSIS BERBEDA
PADA PAKAN UDANG VANAME UNTUK PENCEGAHAN
INFEKSI IMNV (
INFECTIOUS MYONECROSIS VIRUS
)
DAMAYANTI
SKRIPSI
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Program Studi Teknologi & Manajemen Perikanan Budidaya
Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan,
Institut Pertanian Bogor
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Judul Skripsi : Pemberian sinbiotik dengan dosis berbeda pada pakan
udang vaname untuk pencegahan infeksi IMNV
(Infectious Myonecrosis Virus)
Nama Mahasiswa : Damayanti
Nomor Pokok : C14070011
Disetujui
Dosen Pembimbing I
Dr. Ir. Widanarni, M.Si. NIP. 19670927 199403 2 001
Dosen Pembimbing II
Dr. Ir. Sukenda, M.Sc. NIP. 19671013 199302 1 001
Mengetahui:
Ketua Departemen Budidaya Perairan
Dr. Ir. Odang Carman, M.Sc. NIP. 19591222 198601 1 001
KATA PENGANTAR
Puji syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya
sehingga penelitian dan penulisan skripsi ini dapat diselesaikan dengan baik.
Penelitian dilaksanakan sejak bulan Juni 2011 s.d. Juli 2011 di Laboratorium
Kesehatan Ikan, Laboratorium Nutrisi Ikan, dan Laboratorium Lingkungan
Akuakultur, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu
Kelautan, Institut Pertanian Bogor, dengan judul “Pemberian sinbiotik dengan
dosis berbeda pada pakan udang vaname untuk pencegahan infeksi IMNV
(Infectious Myonecrosis Virus)”.
Penulis mengucapkan terima kasih kepada Dr. Widanarni dan Dr. Sukenda
selaku dosen pembimbing atas bimbingan, nasihat, dan arahan yang diberikan
selama penyusunan skripsi serta Dr. Mia Setiawati sebagai dosen penguji. Penulis
juga menyampaikan terima kasih kepada Ibunda Juleha dan Ayahanda Padi
Supadi yang telah memberikan dukungan, doa, dan kasih sayang yang tak
terbatas. Ungkapan terima kasih juga disampaikan kepada Pak Uus (Manajer
Produksi PT. Global Gen), Pak Ranta, Kang Adna, Mba Retno, dan Kang Abe
atas bantuan yang telah diberikan. Tak lupa juga kepada M. Syifaul Fuad A.,
Ghita, Dwi, Ika, Kak Fariq, Kak Rahman, Ririn, Iis, teman LKI,
teman-teman BDP 43, 44, dan 46 atas segala bantuan, kerjasama dan persahabatan yang
diberikan.
Penulis menyadari adanya ketidaksempurnaan dalam penulisan skripsi ini.
Penulis berharap skripsi ini bermanfaat bagi bagi pembaca dan perkembangan
pengetahuan di bidang perikanan budidaya
Bogor, Desember 2011
DAFTAR RIWAYAT HIDUP
Penulis merupakan anak tunggal yang dilahirkan di
Indramayu, 02 Oktober 1989 dari pasangan Bapak Padi Supadi
dan Ibu Juleha. Pendidikan formal yang dilalui penulis adalah
SMAN 1 Sindang, Indramayu dan lulus pada tahun 2007. Pada
tahun yang sama, penulis lulus seleksi masuk Institut Pertanian
Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB
(USMI), memilih Mayor Teknologi dan Manajemen Perikanan Budidaya,
Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan dengan
Minor Manajemen Fungsional.
Selama mengikuti perkuliahan, penulis pernah praktek kerja lapangan di PT.
Centra Pertiwibahari, Rembang dan PT. Tri Windu Graha Manunggal, Anyer
dengan komoditas udang vaname. Selain itu penulis juga pernah aktif sebagai staf
divisi PCC (Public Care Center) Himakua (Himpunan Mahasiswa Akuakultur) 2008/2009 dan staf divisi PPSD (Publikasi dan Pengembangan Sumber Daya
Manusia) Himakua 2009/2010, asisten mata kuliah Iktiologi 2008/2009
jenjang S1, Dasar-dasar Mikrobiologi Akuatik jenjang S1 2009/2010 dan
2010/2011, Mikrobiologi Akuatik jenjang D3 2011/2012, Mikrobiologi
Akuakultur jenjang S2 2011/2012 dan Penyakit Organisme Akuatik jenjang S1
2011/2012. Selain itu, penulis juga aktif sebagai anggota Gentra Kaheman
2007/2008 serta anggota Ikatan Keluarga dan Mahasiswa Dharma Ayu (IKADA)
periode 2007-2011. Penulis melaksanakan Program Kreativitas Mahasiswa
(PKM) pada tahun 2010 dengan judul Pelatihan produksi ikan hias dengan metode
induced breeding (kawin suntik) di Kampung Setu, Desa Parigi Mekar, Kecamatan Ciseeng, Kabupaten Bogor.
Penulis melakukan penelitian dan menyusun skripsi sebagai salah satu
syarat memperoleh gelar sarjana dalam bidang perikanan yang berjudul
DAFTAR ISI
Halaman
DAFTAR TABEL ... ii
DAFTAR GAMBAR ... iii
DAFTAR LAMPIRAN ... iv
I. PENDAHULUAN ... 1
II. METODOLOGI ... 4 2.1 Penyiapan Prebiotik ... 4 2.1.1 Ekstraksi Oligosakarida/Prebiotik ... 4 2.2 Pengujian Sinbiotik Secara In Vivo... ... 4 2.2.1 Persiapan Wadah dan Media Pemeliharaan ... 4 2.2.2 Persiapan Hewan Uji... 5 2.2.3 Persiapan Pakan Uji ... 5 2.2.4 Pengujian Pakan Uji pada Udang Vaname ... 6 2.3 Parameter Pengamatan... 7
2.3.1 Sintasan... ... 7 2.3.2 Laju Pertumbuhan Harian ... 7 2.3.3 Rasio Konversi Pakan ... 8 2.3.4 Total Hemosit ... 8 2.3.5 Indeks Fagositik ... 8 2.3.6 Aktivitas Phenoloxydase (PO) ... 9 2.3.7 Diferensial Hemosit ... 9 2.4 Kualitas Air ... 10 2.4 Analisis Data ... 10
III. HASIL DAN PEMBAHASAN ... 11 3.1 Sintasan ... 11 3.2 Laju Pertumbuhan Harian ... 12 3.3 Rasio Konversi Pakan ... 13 3.4 Gejala Klinis ... 14 3.5 Total Hemosit ... 15 3.6 Indeks Fagositik ... 17 3.7 Aktivitas Phenoloxydase (PO) ... 18 3.8 Diferensial Hemosit ... 19 3.9 Kualitas Air ... 21
IV. KESIMPULAN DAN SARAN... 22 4.1 Kesimpulan ... 22 4.2 Saran ... 22
DAFTAR PUSTAKA ... 23
DAFTAR TABEL
Halaman
1. Perlakuan Pakan Uji pada Udang Vaname... 6
2. Satuan dan Alat Ukur Parameter Kualitas Air... 10
DAFTAR GAMBAR
Halaman
1. Skema Uji In Vivo... ... 7
2. Sintasan Udang Vaname sebelum dan setelah Uji Tantang
dengan IMNV ... 11
3. Laju Pertumbuhan Harian Udang Vaname sebelum Uji Tantang
dengan IMNV ... 12
4. Rasio Konversi Pakan Udang Vaname sebelum Uji Tantang
dengan IMNV ... 14
5. Gejala Klinis Udang yang Terinfeksi IMNV (Udang Normal (A),
Otot Putih pada Ruas Tubuh (B), Usus Udang yang Tidak Terisi
Penuh (C), Udang Mati akibat Terinfeksi IMNV (D)) ... 15
6. Total Hemosit Udang Vaname setelah Uji Tantang dengan IMNV ... 16
7. Indeks Fagositik Udang Vaname setelah Uji Tantang dengan IMNV.. 17
8. Aktivitas Phenoloxydase Udang Vaname setelah Uji Tantang
dengan IMNV ... 18
9. Diferensial Hemosit Udang Vaname setelah Uji Tantang dengan
DAFTAR LAMPIRAN
Halaman
1. Prosedur Pembuatan Media Sea Water Complete (SWC)
dan Larutan Phosphate Buffer Saline (PBS) ... 28
2. Analisis Statistik terhadap Sintasan Udang Vaname sebelum
Uji Tantang dengan IMNV ... 29
3. Analisis Statistik terhadap Sintasan Udang Vaname setelah
Uji Tantang dengan IMNV ... 30
4. Analisis Statistik terhadap Laju Pertumbuhan Harian
Udang Vaname sebelum Uji Tantang dengan IMNV ... 31
5. Analisis Statistik terhadap Konversi Pakan Udang Vaname
sebelum Uji Tantang dengan IMNV ... 32
6. Analisis Statistik terhadap Total Hemosit Udang Vaname
setelah Uji Tantang dengan IMNV ... 33
7. Analisis Statistik terhadap Indeks Fagositik Udang Vaname
setelah Uji Tantang dengan IMNV ... 34
8. Analisis Statistik terhadap Phenoloxydase (PO) Udang
Vaname setelah Uji Tantang dengan IMNV ... 35
9. Analisis Statistik terhadap Sel Hyalin Udang Vaname setelah
Uji Tantang dengan IMNV ... 36
11. Analisis Statistik terhadap Sel Granulosit Udang Vaname
I.
PENDAHULUAN
Udang merupakan salah satu komoditas dalam revitalisasi perikanan dengan
produksi selama periode tahun 2003-2007 meningkat sebesar 16,39%, yaitu dari
192.926 ton pada tahun 2003 menjadi 352.220 ton pada tahun 2007 (KKP 2008).
Produksi udang pada tahun 2014 diharapkan mencapai 699.000 ton, yang
diharapkan disuplai dari 188.000 ton udang windu dan 511.000 ton dari udang
vaname (KKP 2010). Data yang dikeluarkan Kementerian Kelautan dan Perikanan
(KKP) menyebut kinerja udang tanah air pada tahun 2009 produksinya mengalami
penurunan hingga 30% dari produksi 2008, yaitu hanya mencapai 338.060 ton.
Masalah terbesar yang dihadapi dalam budidaya udang adalah infeksi penyakit
bakterial dan viral. Serangan virus IMNV (Infectious Myonecrosis Virus) terjadi pada semua sentra budidaya di Indonesia. Akibat serangan virus pada budidaya
udang, KKP bahkan merevisi target produksi udang tahun ini dari 410.000 ton
menjadi 350.000 ton. Total produksi udang nasional tahun 2010 berkisar 352.000
ton atau turun dari target semula 410.000 ton (KKP 2011).
IMNV pertama kali ditemukan menyerang budidaya udang vaname pada
tahun 2002 di Brazil (Costa et al. 2009). Di Indonesia, IMNV pertama kali ditemukan menyerang udang jenis vaname pada tahun 2006 di Situbondo. Gejala
klinis yang ditimbulkan berupa rusaknya jaringan otot dan menyebabkan
perubahan warna putih pada otot skeletal, otot kemerahan, dan mengakibatkan
kematian hingga 70% (Tang et al. 2005). Saat ini, IMNV merupakan masalah utama yang dihadapi para petambak. Dampak yang ditimbulkan berupa
menurunnya produktivitas dan menyebabkan kerugian yang besar bagi para
petani, serta mempengaruhi perekonomian nasional akibat menurunnya devisa,
sehingga diperlukan sebuah solusi untuk menangani masalah tersebut.
Sinbiotik merupakan salah satu solusi yang dapat digunakan untuk
memecahkan masalah tersebut. Menurut Li et al. (2009) sinbiotik (gabungan antara probiotik dan prebiotik) terbukti mampu meningkatkan respon imun dan
resistensi udang. Hasil penelitian Widagdo (2011) menunjukkan bahwa
penambahan sinbiotik melalui pakan mampu meningkatkan kelangsungan hidup
2 Probiotik merupakan mikroba hidup yang ditambahkan melalui pakan dan
memberi pengaruh yang menguntungkan bagi inang dengan meningkatkan
keseimbangan mikroba dalam saluran pencernaan (Fuller 1992). Prebiotik
merupakan bahan pangan yang tidak dapat dicerna oleh inang tetapi memberikan
efek menguntungkan bagi inang dengan cara merangsang pertumbuhan mikroflora
normal di dalam saluran pencernaan inang. Sinbiotik merupakan kombinasi
seimbang dari probiotik dan prebiotik dalam mendukung kelangsungan hidup dan
pertumbuhan bakteri yang menguntungkan dalam saluran pencernaan makhluk
hidup (Schrezenmeir dan Vrese 2001).
Probiotik yang digunakan dalam penelitian ini adalah bakteri Vibrio alginolyticus SKT-b, bakteri ini mampu menghambat pertumbuhan V. harveyi
dalam uji in vitro dan in vivo (Widanarni et al. 2003). Sedangkan prebiotik yang digunakan yaitu karbohidrat golongan oligosakarida yang berasal dari ubi jalar
varietas sukuh (Marlis 2008). Fermentasi oligosakarida oleh bakteri akan
menghasilkan energi metabolisme dan asam lemak rantai pendek. Hampir semua
zat yang diproduksi oleh bakteri bersifat asam dan merupakan hasil fermentasi
karbohidrat oligosakarida (Tomomatsu 1994 dalam Rini 2008). Gabungan antara
keduanya pada penelitian ini diharapkan mampu meningkatkan sintasan,
pertumbuhan, dan respon imun udang vaname.
Dosis normal probiotik dan prebiotik yang digunakan dalam penelitian ini
mengacu pada penelitian Wang (2007) dan Mahious (2006). Wang (2007)
menyatakan bahwa pemberian probiotik pada udang vaname sebanyak 1%
memiliki pertumbuhan dan aktivitas enzim pencernaan yang lebih baik
dibandingkan dengan kontrol. Pemberian prebiotik berupa oligofruktosa
(Raftilose P95) 2% pada weaning turbot, Psetta maxima menunjukkan bobot rata-rata yang lebih tinggi dibandingkan dengan inulin (Raftiline ST) 2% dan
laktosukrosa 2%. Raftilose P95 juga dapat dimanfaatkan sebagai sumber karbon
oleh Bacillus sp. sehingga dapat menghasilkan pertumbuhan Bacillus sp. yang lebih cepat (Mahious 2006). Adanya penggunaan setengah dosis dan dua kali
dosis dari dosis normal bertujuan untuk mencari dosis yang efektif dan efisien
3 Penelitian ini bertujuan untuk menguji pengaruh pemberian sinbiotik
dengan dosis berbeda pada pakan udang vaname untuk pencegahan infeksi IMNV
4
II.
METODOLOGI
2.1 Penyiapan Prebiotik
2.1.1 Ekstraksi Oligosakarida/Prebiotik
Proses ekstraksi oligosakarida/prebiotik mengacu pada metode Muchtadi
(1989). Tepung kukus ubi jalar varietas sukuh disuspensikan pada etanol 70%
dengan perbandingan 1:10. Homogenisasi dilakukan dengan menggunakan
magnetic stirer selama 15 jam. Selanjutnya, suspensi ubi jalar diendapkan dan disaring menggunakan kertas saring dan corong steril. Pemisahan natan dan
supernatan dilakukan pada sentrifus dengan kecepatan 5.000 rpm selama
10 menit. Filtrat yang telah diperoleh dipekatkan menggunakan evaporator vacum
pada suhu 40 oC.
Hasil pemekatan kemudian diencerkan dengan akuades steril hingga
mencapai kadar TPT (Total Padatan Terlarut) sebesar 5% (Marlis 2008).
Pengujian TPT ini mengacu kepada metode Apriyantono et al. (1989). Cawan porselin terlebih dahulu dimasukkan ke dalam oven selama satu jam pada suhu
100 oC, kemudian cawan dimasukkan ke dalam desikator selama 15 menit, dan
ditimbang (a gram). Sebanyak 1 ml oligosakarida yang telah diekstraksi dari ubi
jalar dimasukkan dalam cawan porselin tersebut dan ditimbang (b gram). Cawan
yang berisi oligosakarida tersebut dimasukan ke dalam oven selama 24 jam pada
suhu 100 oC, kemudian dimasukkan ke dalam desikator selama 15 menit. Setelah
itu, cawan tersebut ditimbang (c gram). Total padatan terlarut dihitung dengan
rumus:
TPT= (c-a)/b x 100%
2.2 Pengujian Sinbiotik secara In Vivo
2.2.1 Persiapan Wadah dan Media Pemeliharaan
Wadah yang digunakan dalam penelitian berupa akuarium yang berukuran
50 cm x 40 cm x 35 cm sebanyak 15 buah. Akuarium terlebih dahulu dicuci
dengan deterjen dan dikeringkan. Selanjutnya akuarium didesinfeksi dengan
kaporit 100 ppm selama 24 jam, kemudian dibersihkan kembali. Akuarium yang
telah didesinfeksi diisi dengan air laut sebanyak 40 liter pada masing-masing
5 dari Ancol. Air laut terlebih dahulu ditampung dalam tandon dan didesinfeksi
dengan kaporit 30 ppm serta dinetralkan dengan Na-Thiosulfat 15 ppm. Sebelum
digunakan, secara berkala dilakukan pengontrolan kadar klorin menggunakan
Clorine test.
2.2.2 Persiapan Hewan Uji
Hewan uji yang digunakan adalah benur udang vaname stadia Post Larvae
(PL) 10 yang berasal dari PT. Global Gen, Labuan, Banten. Benur terlebih dahulu
dipelihara selama 30 hari dalam akuarium. Akuarium yang digunakan dilengkapi
dengan shelter sebagai tempat untuk berlindung. Selain itu, dinding akuarium ditutup plastik hitam agar udang tidak stres. Waring juga ditambahkan di atas
akuarium untuk mencegah udang keluar dari akuarium. Selama pemeliharaan
udang diberi pakan komersil dengan frekuensi pemberian pakan 4 kali sehari,
yaitu pukul 07.00, 11.00, 15.00, 19.00 WIB. Pengelolaan kualitas air dilakukan
dengan penyiponan dan pergantian air pada pagi hari sebanyak 10% dari total
volume secara berkala.
2.2.3 Persiapan Pakan Uji
Persiapan pakan uji meliputi tahap kultur bakteri, pemisahan sel bakteri,
serta pencampuran pakan. Kultur bakteri probiotik SKT-b dilakukan pada media
SWC (Sea Water Complete) agar miring (Lampiran 1) selama 24 jam pada suhu
ruang (27 oC). Selanjutnya, bakteri SKT-b diinokulasikan ke dalam media SWC
cair (Lampiran 1) dan diinkubasi dalam waterbath shaker selama 24 jam pada suhu 30 oC dengan kecepatan 140 rpm.
Pemanenan sel bakteri dilakukan dengan memindahkan hasil kultur bakteri
ke dalam tabung Corning 25 ml kemudian disentrifus selama 10 menit dengan
kecepatan 5.000 rpm untuk memisahkan padatan sel bakteri dan media. Sel
bakteri kemudian dicuci sebanyak dua kali dengan larutan PBS (Posphat Buffer Saline) sebanyak 25 ml (Lampiran 1), dihomogenisasi dengan vortex dan disentrifuse selama 10 menit pada kecepatan 5.000 rpm. Setelah itu ditambahkan
larutan PBS sebanyak 10 ml dan dihomogenisasi dengan vortex.
Hasil dari vortex merupakan probiotik yang akan dicampurkan ke dalam
pakan. Dosis probiotik dan prebiotik yang digunakan sesuai dengan perlakuan.
6 campuran pakan yang berfungsi sebagai perekat (Wang 2007). Sebelum diberikan
ke udang, pakan dikeringudarakan selama 10-15 menit untuk mengurangi
kelembaban.
2.2.4 Pengujian Pakan Uji pada Udang Vaname
Pakan uji yang digunakan dalam penelitian ini berupa pelet dengan
kandungan protein 40%. Penelitian ini terdiri dari lima perlakuan, yaitu kontrol
negatif, kontrol positif, dan tiga perlakuan sinbiotik dengan dosis yang berbeda
(Tabel 1). Masing-masing perlakuan terdiri dari tiga ulangan.
Tabel 1. Perlakuan pakan uji pada udang vaname
Perlakuan Keterangan
K- Pemberian pakan tanpa penambahan sinbiotik serta tidak diinfeksi IMNV
(kontrol negatif)
K+ Pemberian pakan tanpa penambahan sinbiotik serta diinfeksi IMNV (kontrol
positif)
A Pemberian pakan dengan penambahan sinbiotik setengah dosis (probiotik
sebesar 0,5% dan prebiotik sebesar 1%) serta diinfeksi IMNV
B Pemberian pakan dengan penambahan sinbiotik satu dosis (probiotik sebesar
1% dan prebiotik sebesar 2%) serta diinfeksi IMNV
C Pemberian pakan dengan penambahan sinbiotik dua kali dosis (probiotik
sebesar 2% dan prebiotik sebesar 4%) serta diinfeksi IMNV.
Udang vaname dengan berat rata-rata 0,54±0,04 gram dipelihara selama
30 hari dalam akuarium pada volume 40 liter sebanyak 20 ekor/akuarium.
Pemberian pakan dilakukan lima kali dalam sehari pada pukul 07.00, 11.00,
15.00, 19.00, dan 23.00 WIB. Jumlah pakan yang diberikan didasarkan pada
Feeding Rate (FR) menurut SNI 01-7246-2006. FR yang digunakan dalam penelitian ini yaitu 25% menurun hingga 8% sesuai dengan bobot udang vaname.
Sampling bobot dilakukan setiap 10 hari sekali, sedangkan pengujian kualitas air
dilakukan pada awal dan akhir pemeliharaan. Setelah udang vaname diberi
perlakuan sinbiotik selama 30 hari, udang diinfeksi IMNV. Infeksi IMNV pada
udang dilakukan melalui oral, yaitu dengan memberikan pakan berupa daging
udang yang sudah terinfeksi IMNV selama 3 hari (Coelho et al. 2009)
7
0
1 30 31 44
31-33
Tanpa Infeksi
Infeksi 0
0
0
0
Tanpa Perlakuan Tanpa Sinbiotik
Infeksi
Infeksi
Infeksi Sinbiotik ½ kali dosis
Sinbiotik 1 kali dosis Sinbiotik 2 kali dosis
Tanpa Sinbiotik Pengamatan
[image:42.595.119.499.93.305.2]Hari ke-
Gambar 1. Skema uji in vivo.
2.3 Parameter Pengamatan 2.3.1 Sintasan
Sintasan atau tingkat kelangsungan hidup udang uji dapat diketahui dari
jumlah udang pada akhir perlakuan dibagi dengan jumlah udang awal
(Effendi 2004), dirumuskan sebagai berikut :
SR =
x 100%
Keterangan :
SR = Sintasan (%)
Nt = Jumlah udang pada akhir perlakuan (ekor)
No = Jumlah udang pada awal perlakuan (ekor)
2.3.2 Laju Pertumbuhan Harian
Laju pertumbuhan harian dihitung dengan menggunakan rumus
(Huissman 1987) :
α = [√ ] x 100%
Keterangan :
α = Laju pertumbuhan harian (%)
Wt = Bobot rata-rata udang pada akhir perlakuan (gram)
K- K+
A
B
8
Wo = Bobot rata-rata udang pada awal perlakuan (gram)
t = Periode pemeliharaan (hari)
2.3.3 Rasio Konversi Pakan
Rasio konversi pakan selama pemeliharaan dihitung menggunakan rumus
(Zonneveld et al. 1991) :
FCR =
Keterangan :
FCR = Konversi pakan
F = Jumlah pakan (gram)
Bt = Biomassa udang pada saat akhir perlakuan (gram)
Bm = Biomassa udang yang mati saat perlakuan (gram)
Bo = Biomassa udang pada saat awal perlakuan (gram)
2.3.4 Total Hemosit
Penghitungan total hemosit mengacu pada metode Blaxhall dan Daishley
(1973). Hemolim diambil sebanyak 0,1 ml dari pangkal kaki renang pertama
dengan syringe 1 ml yang telah berisi 0,3 ml antikoagulan. Selanjutnya campuran tersebut dihomogenkan dengan cara menggoyangkan tangan membentuk angka
delapan. Tetesan pertama dibuang, tetesan selanjutnya diteteskan pada
hemositometer. Total hemosit didapatkan dengan menghitung jumlah selnya per
ml di bawah mikroskop dengan perbesaran 400 kali.
2.3.5 Indeks Fagositik
Penghitungan indeks fagositik mengacu pada metode Anderson dan Siwicki
(1993). Hemolim udang dimasukkan sebanyak 0,1 ml ke dalam eppendorf dan
dicampurkan secara merata dengan 25 µ l bakteri Staphylococcus sp. (107 sel/ml). Selanjutnya diinkubasi selama 20 menit. Sebanyak 5 µ l diteteskan pada gelas
objek dan dibuat preparat ulas. Proses fiksasi menggunakan metanol dilakukan
selama 5-10 menit. Kemudian, hasil fiksasi direndam dalam larutan pewarna
giemsa selama 15-20 menit. Aktivitas fagositosis diukur berdasarkan persentase
sel-sel fagosit yang menunjukkan proses fagositosis dari 100 sel fagositik yang
teramati. Indeks fagositik dihitung dengan rumus :
9
2.3.6Aktivitas Phenoloxydase (PO)
Pengukuran PO dilakukan berdasarkan prosedur yang dikemukan oleh Liu
dan Chen (2004). Aktivitas PO hemosit diukur berdasarkan formasi dopachrome
yang dihasilkan oleh L-DOPA. Sebanyak 1 ml campuran hemolymph
-antikoagulan disentrifuse pada kecepatan 1.500 rpm selama 10 menit pada
temperatur 4 oC. Supernatan dikeluarkan dan pelet disuspensikan kembali secara
perlahan-lahan ke dalam 1 ml larutan cacodylate-citrate buffer (0,01 M sodium cacodylate, 0,45 M sodium chloride, 0,10 M trisodium citrate, pH 7) kemudian disentrifuse kembali. Pelet kemudian diambil dan disuspensikan dalam 200 µ l
cacodylate-citrate buffer (0,01 M sodium cacodylate, 0,45 M sodium chloride, 0,10 M trisodium citrate, pH 7).
Suspensi sel sebanyak 100 µ l kemudian diinkubasi dengan 50 µ l trypsin (1 mg/ml cacodylate buffer) sebagai aktivator selama 10 menit pada temperatur 25-26 oC. Selanjutnya ditambahkan 50 µl L-DOPA (3 mg/ml cacodylate buffer) setelah 5 menit, dan ditambahkan 800 µ l cacodylate buffer. Densitas optikal (OD) diukur dengan menggunakan spektrofotometer dengan panjang gelombang 490
nm.
Larutan standar mengandung 100 µ l suspensi haemocyte, 50 µ l cacodylate buffer (pengganti tripsin), dan 50 µ l L-DOPA digunakan untuk mengukur
background aktivitas PO pada semua larutan uji. Densitas optikal (OD) dari aktivitas PO pada semua kondisi uji dinyatakan sebagai formasi dopachrome
dalam 50 µ l haemolymph.
2.3.7 Diferensial Hemosit
Diferensial hemosit dihitung berdasarkan metode yang dilakukan Martin
dan Graves (1995). Hemolim diteteskan pada gelas objek dan dibuat ulasan,
kemudian dikeringudarakan. Preparat difiksasi dengan metanol selama 5-10 menit
kemudian dikeringudarakan kembali. Preparat direndam dalam larutan giemsa
selama 15-20 menit, dicuci dengan air mengalir dan dibiarkan kering. Ulasan
hemolim diperiksa di bawah mikroskop dengan perbesaran 100 kali dan
diidentifikasi selnya. Jumlah hemosit dihitung hingga 100 sel dan ditentukan
persentase tiap jenisnya.
10
2.4 Kualitas Air
Kualitas air diukur pada saat awal dan akhir pemeliharaan. Parameter
kualitas air yang diukur diantaranya : suhu, oksigen terlarut (DO), pH, dan TAN.
Satuan dan alat pengukuran parameter kualitas air yang diukur disajikan pada
Tabel 2.
Tabel 2. Satuan dan Alat Ukur Parameter Kualitas Air
Parameter Satuan Alat ukur
Suhu oC Termometer
Salinitas ppt Salinometer
Oksigen terlarut mg/L DO meter
pH - pH meter
TAN - Spektrometer
2.5 Analisis Data
Penelitian ini menggunakan rancangan percobaan berupa Rancangan Acak
11
III.