AKTIVITAS FIKSASI NITROGEN DAN OKSIDASI METAN
KOMBINASI BIAKAN
Azotobacter sp.,
Azospirillum sp.
, DAN
BAKTERI METANOTROF
IVAN PERMANA PUTRA
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
IVAN PERMANA PUTRA. Aktivitas Fiksasi N2 dan Oksidasi Metan Kombinasi Biakan
Azotobacter sp., Azospirillum sp., dan Bakteri Metanotrof. Dibimbing oleh IMAN RUSMANA dan ALINA AKHDIYA.
Bakteri metanotrof merupakan bakteri pengoksidasi metan. Selain itu, bakteri metanotrof tipe II dan tipe X juga mampu memfiksasi nitrogen karena adanya enzim nitrogenase. Tetapi aktivitas oksidasi metan dihambat oleh keberadaan amonium. Penelitian ini dilakukan untuk menguji aktivitas oksidasi metan dan fiksasi nitrogen keempat isolat bakteri metanotrof yaitu BGM 1, BGM 5, BGM 9, dan SKM 14 yang dikombinasikan dengan bakteri penambat nitrogen (Azotobacter dan Azospirillum). Sebanyak 6 kombinasi dikulturkan kemudian diinokulasikan ke campuran media NMS tanpa unsur N, kemudian diuji aktivitas oksidasi metan dan fiksasi nitrogen. Aktivitas oksidasi metan tertinggi terdapat pada kombinasi isolat BGM 5, BGM 9, Azospirillum, dan Azotobacter yaitu sebesar 184,5 x 10-8 M/sel/hari . Aktivitas akumulasi amonium tertinggi terdapat pada kombinasi isolat BGM 5, BGM 9, dan Azotobacter yaitu sebesar 4,075 M. Aktivitas oksidasi metan dan akumulasi amonium bakteri metanotrof menunjukkan hasil yang lebih tinggi saat dikombinasikan dengan bakteri penambat nitrogen.
Kata kunci: Metan, bakteri metanotrof, bakteri penambat nitrogen,oksidasi metan, fiksasi nitrogen
ABSTRACT
IVAN PERMANA PUTRA. N2 Fixation and Methane Oxidation Activity of mixed of culture of
Azotobacter sp., Azospirillum sp., and Methanotrophic Bacteria. Under supervision of IMAN RUSMANA and ALINA AKHDIYA.
Metanotrophs bacteria are methane oxidizing bacteria. Methanotrophic bacteria especially type II and type X were also able to fix nitrogen using nitrogenase enzyme. This reasearch was conducted to determine activity of methane oxidation and nitrogen fixation of four isolates of methanotropic bacteria i.e. BGM 1, BGM 5, BGM 9, and SKM 14 which were combined with nitrogen-fixing bacteria (Azotobacter sp. and Azospirillum sp.). Six combinations were cultured and then inoculated into nitrogen free NMS medium. Activity of methane oxidation and nitrogen fixation activity was analysed. The highest methane oxidation activity was found in the mixed culture of BGM 9, BGM 5, Azotobacter sp., and Azospirillum sp. isolates. The activity was 184.5 x 10-8 M/cell /day. The highest accumulation of ammonium was found in the mixed culture of BGM 5, BGM 9, and Azotobacter sp. isolates. The concentration of accumulated ammonium was
4.075 M. Methane oxidation activity and ammonium accumulation of methanotrophic bacteria showed higher result when they were combined with nitrogen fixing bacteria.
AKTIVITAS FIKSASI NITROGEN DAN OKSIDASI METAN
KOMBINASI BIAKAN
Azotobacter sp.,
Azospirillum sp.
, DAN
BAKTERI METANOTROF
IVAN PERMANA PUTRA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul
: Aktivitas Fiksasi Nitrogen
dan Oksidasi Metan Kombinasi Biakan
Azotobacter
sp.,
Azospirillum
sp., dan Bakteri Metanotrof
Nama
: Ivan Permana Putra
NIM
: G34070016
Menyetujui:
Pembimbing I,
Pembimbing II,
(Dr. Ir. Iman Rusmana, M.Si.)
(Alina Akhdiya, M.Si.)
NIP 196507201991031002 NIP 196812082001122001
Mengetahui:
Ketua Departemen Biologi
Fakultas Matematika dan Ilmu Pengetahuan Alam
(Dr. Ir. Ence Darmo Jaya Supena, M.S.)
NIP 196410021989031002
PRAKATA
Alhamdulillahirobbil’alamin, puji syukur penulis panjatkan ke hadirat Allah SWT yang telah memberikan rahmat dan karunia sehingga penulis dapat menyelesaikan karya ilmiah ini. Tema yang dipilih dalam penelitian ini adalah mengenai aktivitas fiksasi N2 dan oksidasi metan
kombinasi biakan Azotobacter sp., Azospirillum sp., dan bakteri Metanotrof. Penelitian ini dilaksanakan mulai bulan Januari hingga Mei 2011 di Laboratorium Mikrobiologi Departemen Biologi, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Bapak Dr. Ir. Iman Rusmana, M.Si. dan Ibu Alina Akhdiya, M.Si. selaku pembimbing atas arahan dan bimbingan yang diberikan dalam pelaksanaan penelitian dan penyusunan karya ilmiah ini. Terima kasih yang sebesar-besarnya
kepada Keluarga tercinta Bapak, Mamak, Abang, Adek dan Keluarga Besar atas do’a, dukungan,
dan kasih sayang yang diberikan. Terima kasih juga kepada Bu Ratna, Kak Tea, Kak Vina, Kak Fina, Ka Tyas, Alm. Pak Sesep, Bang jo, Rani, Tira, Atun, Vita, Hana, dan teman-teman seperjuangan di Biologi 44 atas semua kebersamaan dan motivasi yang telah diberikan.
Semoga karya ilmiah ini dapat bermanfaat.
Bogor, 2011
RIWAYAT HIDUP
Ivan Permana Putra dilahirkan di Manggar-Bangka Belitung pada tanggal 10 september 1989 dari ayahanda Wahyu Setyawan dan ibunda Hartini. Penulis merupakan anak ke-dua dari tiga bersaudara. Tahun 2007 penulis lulus dari SMU Plus Negeri 1 Pemali Bangka-Belitung dan lolos seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI) pada Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis aktif sebagai ketua divisi Budaya, Olahraga, dan Seni (BOS) Ikatan Keluarga Pelajar Belitung (IKPB), Anggota UKM sepakbola IPB 2007-2008, Duta Lingkungan FMIPA IPB 2009-2010, staff divisi Biosains Himpunan Mahasiswa Biologi (Himabio) pada tahun 2009-2010, Ketua Kelompok PKMP lolos didanai DIKTI tahun 2008 (Ekstrak Karamunting Sebagai Zat Antioksidan) dan 2009 (Potensi Lumut Sebagai Zat Antimikrob).
Penulis merupakan asisten praktikum mata kuliah Biologi Dasar Tingkat Persiapan Bersama IPB pada tahun 2009-2011, Ekologi Dasar tahun 2009, Fisiologi Prokariot tahun 2009, serta Ilmu Lingkungan tahun 2010. Penulis juga merupakan pengajar biologi bimbingan belajar
B’expert tahun 200λ-2011, Primagama tahun 211, dan Mitra Siswa tahun 2010-2011.
Pada tahun 2009, penulis melakukan Studi Lapang di Wana Wisata Cangkuang Sukabumi, Jawa Barat dengan judul laporan Laju Denitrifikasi dan Nitrifikasi Mikroba Tanah
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN... 1
Latar Belakang ... 1
Tujuan ... 1
Waktu dan Tempat ... 1
BAHAN DAN METODE ... 1
Isolat Bakteri ... 1
Peremajaan dan Perbanyakan Isolat. ... 2
Formulasi Kultur Bakteri Kombinasi ... 2
Uji Aktivitas Oksidasi Metan ... 2
Analisis Kadar Amonium ... 2
Penghitungan Populasi Bakteri dalam Kultur ... 2
Pengukuran
Optical Density
(OD) Kultur Kombinasi ... 2
HASIL ... 2
Peremajaan dan Perbanyakan Isolat ... 2
Uji Aktivitas Oksidasi Metan ... 3
Penghitungan Populasi Bakteri dalam Kultur ... 3
Optical Density
(OD) Kultur Bakteri Kombinasi ... 3
PEMBAHASAN ... 4
SARAN ... 5
DAFTAR PUSTAKA ... 5
DAFTAR TABEL
Halaman
1 Populasi masing-masing bakteri pada tiap kombinasi ... 4
DAFTAR GAMBAR
Halaman 1 Morfologi koloni isolat BGM 9 dengan masa inkubasi lima hari pada suhu 27-29°C... 32 Aktivitas oksidasi CH4 kultur kombinasi ... 3
3 Aktivitas akumulasi amonium kultur kombinasi ... 3
4 Rapat optis masing-masing kultur kombinasi ... 4
DAFTAR LAMPIRAN
Halaman 1 Kurva standar ammonium ... 81
PENDAHULUAN
Latar Belakang
Metan (CH4) merupakan salah satu gas
yang berkontribusi terhadap pemanasan global. Intergovernmental Panel of Climate Change (2007), menyatakan bahwa kontribusi metan terhadap pemanasan global menempati urutan ketiga setelah CFC dan N2O.
Kontribusi metan terhadap pemanasan global lebih besar dibandingkan dengan CO2, karena
CH4 lebih efektif menyerap radiasi pada
panjang gelombang 4-100 nm (irradiasi sinar infra merah) dibandingkan dengan CO2
(Lelieveld et al. 1993; Hanson & Hanson 1996). Sebesar 43% dari emisi metan ke atmosfer berasal dari lahan basah, yakni 20% dari sawah dan sisanya berasal dari lahan rawa (Wild 1995; Notohadiprawiro 2006). Indonesia dengan luas sawah lebih dari 9 juta ha diduga memberi kontribusi terhadap total emisi metan. Untuk mewujudkan sistem pertanian lahan sawah yang ramah lingkungan, dapat dilakukan dengan menekan tingkat emisi gas metan diantaranya melalui pemanfaatan bakteri metanotrof. Emisi metan dari lingkungan akuatik seperti tanah sawah pada dasarnya ditentukan oleh dua proses mikrobial yang berbeda, yaitu produksi metan dan konsumsi metan (Rudd dan Taylor 1980). Pada tanah sawah, metan diproduksi sebagai hasil antara dan hasil akhir dari berbagai proses mikrobial, seperti dekomposisi anaerobik bahan organik oleh Arkea Methanogen. Sementara sebagian dari metan yang diproduksi akan dioksidasikan oleh bakteri metanotrof yang bersifat aerobik di lapisan permukaan tanah dan di zona perakaran. Bakteri metanotrof merupakan bakteri yang memanfaatkan CH4 sebagai
donor elektron untuk menghasilkan energi dan sebagai sumber karbonnya (Hanson dan Hanson 1996).
Pupuk nitrogen (N) dalam bentuk urea sudah menjadi kebutuhan pokok bagi petani sebagai upaya pemenuhan kebutuhan unsur N pada lahan pertanian. Umumnya petani memberikan pupuk dengan takaran tinggi, melebihi kebutuhan pada lahan tanaman, sehingga menyebabkan pemborosan dan pencemaran lingkungan. Salah satu solusi tepat untuk mengatasi hal tersebut ialah dengan menggunakan agen pemfiksasi nitrogen biologis seperti Azotobacter dan Azospirillum. Dinitrogen diubah menjadi amonium melalui reduksi elektron dan protonasi gas dinitrogen. Selain mampu menambat nitrogen, kedua bakteri ini juga
menghasilkan zat pengatur tumbuh giberelin, sitokinin, dan asam indol asetat yang dapat memacu pertumbuhan tanaman (Alexander 1977). Berbagai hasil penelitian menunjukkan bahwa inokulasi tanah atau benih dengan bakteri yang efektif menambat nitrogen dapat meningkatkan produktivitas tanaman. Poduktivitas panen padi yang dinokulasikan dengan Azospirillum dan Azotobacter
dilaporkan mengalami peningkatan sebesar 5-60% (Kumar dan Balasubramanian 1986).
Informasi tentang aktivitas oksidasi metan dan fiksasi nitrogen bakteri metanotrof yang dikombinasikan dengan Azotobacter dan Azospirillum di Indonesia masih jarang. Berdasarkan penelitian Chatrina (2010) diketahui bahwa kombinasi isolat bakteri metanotrof BGM 5 dan BGM 9 memiliki aktivitas oksidasi metan tertinggi. Penelitian lainnya menunjukkan bahwa kombinasi SKM 14 dan BGM 1 merupakan kombinasi bakteri metanotrof yang memiliki kemampuan oksidasi metan dalam lumpur steril tertinggi (Hanif 2010). Keempat isolat tersebut berpotensi dikembangkan lebih lanjut dengan cara dikombinasikan dengan bakteri penambat nitrogen yaitu Azospirillum dan Azotobacter. Informasi mengenai kajian terhadap kombinasi ini dalam mengoksidasi metan dan menambat N2 penting dilakukan, sehingga
hasilnya dapat dimanfaatkan untuk mewujudkan sistem pertanian yang ramah lingkungan.
Tujuan
Penelitian ini bertujuan untuk mengetahui aktivitas kultur kombinasi Metanotrof, Azotobacter sp., dan Azospirillum sp. dalam mereduksi emisi metan dan memfiksasi nitrogen.
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Januari sampai dengan bulan Mei 2011 di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB.
BAHAN DAN METODE
Isolat Bakteri
2
Peremajaan dan Perbanyakan Isolat. Isolat BGM 1,BGM 5, BGM 9, dan SKM 14 diremajakan pada medium NMS + 1% methanol (Lampiran 3). Isolat Azotobacter dan Azospirillum diperbanyak dengan menggunakan media NMS + sukrosa 1% (Lampiran 3). Kemudian keduanya diinkubasi pada suhu ruang selama 5-7 hari (Hanson 1998). Koloni-koloni yang terpisah kemudian digores kembali sampai didapatkan koloni-koloni yang murni. Isolat murni yang didapat disimpan pada medium agar miring NMS yang diberi 1 % metanol untuk bakteri metanotrof dan NMS yang diberi 1% sukrosa untuk bakteri pemfiksasi nitrogen.
Formulasi Kultur Bakteri Kombinasi. Formulasi dilakukan dengan mengkombinasikan isolat bakteri terbaik metanotrof dalam mengoksidasi metan berdasarkan penelitian Chatrina dan Hanif tahun 2010 dengan bakteri penambat nitrogen. Kombinasi yang dibuat adalah : kombinasi A (BGM 1, SKM 14, dan Azospirillum), kombinasi B (BGM 1, SKM 14, dan Azotobacter), kombinasi C (BGM 5, BGM 9, dan Azospirillum), kombinasi D (BGM 5, BGM 9, dan Azotobacter), kombinasi E (BGM 1, SKM 14, Azospirillum, dan Azotobacter), serta kombinasi F (BGM 5, BGM 9, Azospirillum, dan Azotobacter). Masing-masing kombinasi dibuat sebanyak tiga ulangan dan sebagai kontrol digunakan media cair yang tidak diinokulasikan kombinasi bakteri. Sebanyak 0,1ml isolat bakteri metanotrof dan penambat N2
diinokulasikan ke dalam 9 ml medium NMS+1% sukrosa bebas nitrogen dan diinkubasi pada suhu ruang selama 15 hari. Komposisi gas di bagian head space dibuat menjadi 50% metan dan 50% udara. Inkubasi dilakukan selama 15 hari diatas mesin pengocok pada suhu ruang 27-30ºC dan kondisi gelap.
Uji Aktivitas Oksidasi Metan. Pada akhir masa inkubasi dilakukan pengukuran gas metan tersisa pada bagian head space dengan menggunakan teknik kromatografi (Kumaraswamy et al. 2001). Analisis gas metan ini dilakukan di Balai Penelitian Lingkungan Pertanian, Jakenan Pati, Jawa Tengah.
Analisis Kadar Amonium. Pengukuran aktivitas fiksasi N2, dilakukan dengan
mengukur kadar amonium yang terakumulasikan dalam kultur. Sebanyak 5 ml kultur disentrifuse pada kecepatan 4000 rpm selama 10 menit pada suhu ruang. Kemudian, 3 ml supernatan ditambah dengan 0,12 ml
fenol alkohol 10% dan divortex hingga homogen. Selanjutnya ke dalam campuran ditambahkan dengan 0,12 ml larutan Na-Dihidronitroprusit 0,5%, dan divortex kembali hingga homogen. Campuran tersebut ditambah dengan 0,3 ml Na-sitrat : NA-hipoklorit (1:4) dan didiamkan selama satu jam sampai berubah warna menjadi biru (Cleseri et al. 1989). Selanjutnya dilakukan pengukuran kadar amonium terakumulasi dengan menggunakan spektrofotometer pada panjang gelombang 640 nm. Amonium terakumulasi berdasarkan kurva standar (Lampiran 1) dihitung dengan persamaan berikut :
[amonium] =
Penghitungan Populasi Bakteri dalam Kultur. Sebanyak 1 ml isolat bakteri kombinasi diencerkan sampai 10-3, 10-4, dan 10-5. Selanjutnya dari tiap pengenceran diambil 0,1 ml dan disebar ke media NMS+1% metanol+1% sukrosa lalu diinkubasi selama 3 hari. Setelah 3 hari dilakukan penghitungan masing-masing sel bakteri pada tiap Kombinasi
Pengukuran Optical Density (OD) Kultur Kombinasi. Rapat optis kultur kombinasi pada akhir inkubasi diukur menggunakan spektrofotometer vis Genesys
20 Prancis 200-1000 nm pada OD620 dengan
blanko Akuades.
HASIL
Peremajaan dan Perbanyakan Isolat
Sebanyak empat isolat bakteri metanotrof yang memiliki aktivitas oksidasi metan tertinggi (Chatrina 2010; Hanif 2010) berhasil diremajakan. Isolat BGM 1,BGM 5, BGM 9 (Gambar 1), dan SKM 14 menunjukkan warna koloni yang berbeda ( bening, putih krem, pink, pink oranye, kuning terang, dan oranye) pada media NMS + 1% metanol, sesuai dengan hasil penelitian Hapsari (2008). Kecepatan pertumbuhan koloni tiap isolat juga bervariasi, yaitu mencapai ukuran 2 mm dalam waktu 3 – 14 hari. SKM 14 merupakan isolat yang memiliki kecepatan pertumbuhan paling tinggi, sedangkan BGM 1 merupakan isolat yang paling lambat ketika ditumbhkan pada media NMS.
3
jauh berbeda dengan Azotobacter. Kecepatan pertumbuhan kedua bakteri tersebut tidak sama. Diameter koloni Azotobacter relatif lebih besar dibandingkan dengan koloni Azospirillum.
Uji Aktivitas Oksidasi Metan.
Hasil uji aktivitas oksidasi metan menggunakan kromatografi gas menunjukkan bahwa empat dari enam kombinasi isolat yang digunakan menunjukkan kemampuan oksidasi metan setelah diinkubasi selama 15 hari. Laju oksidasi metan tertinggi ditunjukkan oleh kombinasi F (BGM 5, BGM 9, Azospirillum, dan Azotobacter) yaitu sebesar 184,5 x 10-8
M/sel/hari atau setara dengan 28,λ4 ppm/ml kultur/hari. Aktivitas oksidasi metan ini lebih tinggi 10,742 ppm/ml kultur/hari dibandingkan dengan hasil penelitian Chatrina (2010). Laju oksidasi metan terendah ditunjukkan oleh kombinasi D (BGM 5, BGM 9, dan Azotobacter) yaitu sebesar 9,3 x 10-8 M/sel/hari (Gambar 2).
[image:11.595.106.299.105.812.2]
Gambar 1 Morfologi koloni isolat BGM 9 dengan masa inkubasi lima hari pada suhu 27-29°C
Gambar 2 Aktivitas oksidasi CH4 kultur
kombinasi
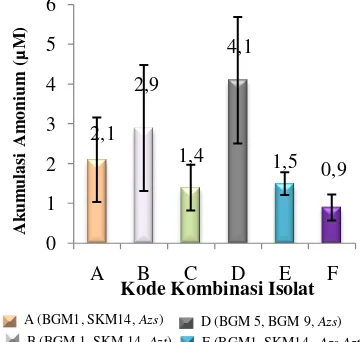
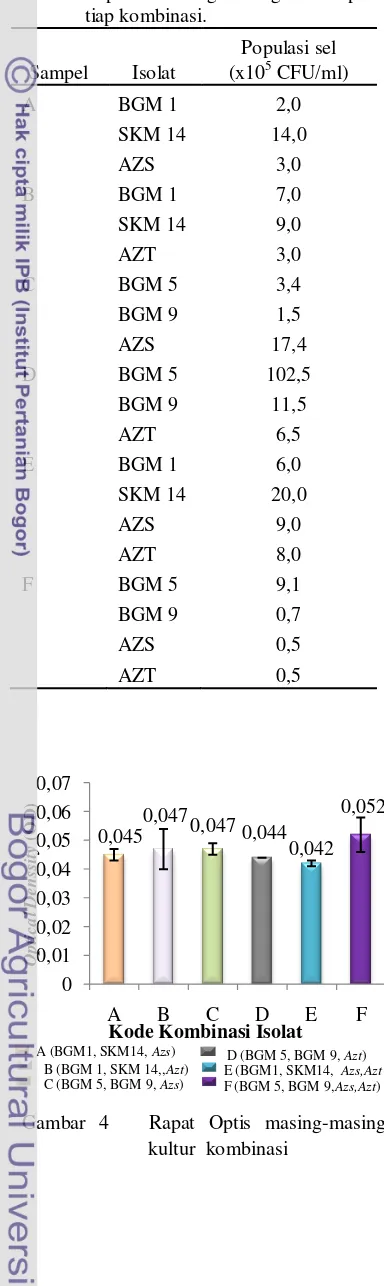
Analisis Kadar Amonium.
Uji aktivitas fiksasi nitrogen pada isolat kombinasi yang berhasil diremajakan pada medium NMS bebas unsur N menunjukkan bahwa kadar amonium terakumulasi tertinggi pada masa akhir inkubasi (hari ke-15) ditunjukkan oleh kombinasi D (BGM 5, BGM 9, dan Azotobacter) sebesar 4,075 M (Gambar 3). Aktivitas akumulasi amonium ini lebih tinggi dibandingkan dengan hasil penelitian Chatrina (2010) yaitu sebesar 2,755 µM. Akumulasi amonium pada kombinasi A (2,113 M) dan B (2,943 M), sedangkan pada kombinasi C (1,434 M) dan E (1,509
M). Akumulasi amonium terendah ditunjukkan oleh kombinasi F (BGM 5, BGM 9, Azospirillum, dan Azotobacter) sebesar 0,981 M.
Gambar 3 Aktivitas akumulasi amonium kultur kombinasi
Penghitungan Populasi Bakteri dalam Kultur.
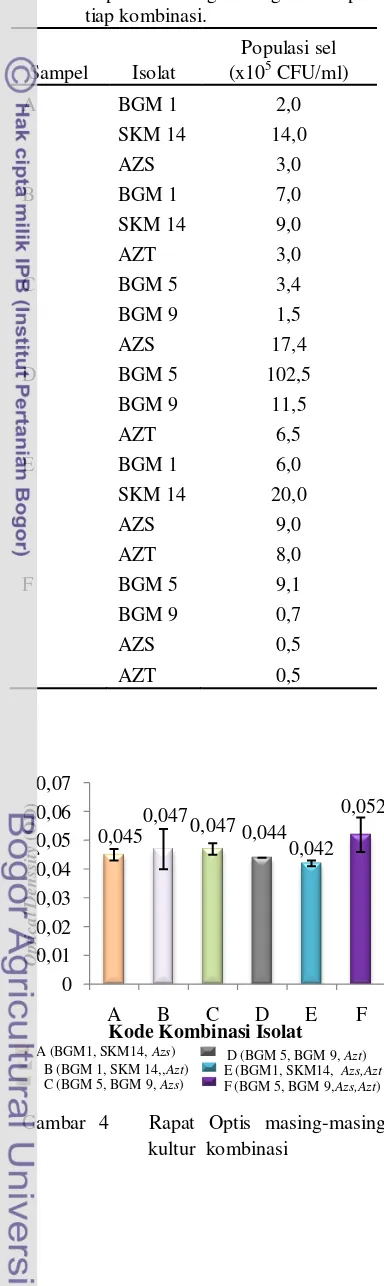
Populasi total bakteri kultur kombinasi pada akhir inkubasi (Lampiran 2) tertinggi terdapat pada kombinasi D (BGM 5, BGM 9, dan Azotobacter) yaitu 120,5x105 CFU/ml. Sedangkan populasi total bakteri paling rendah terdapat pada kombinasi F (Tabel 1).
Optical Density (OD) Kultur Bakteri
Kombinasi.
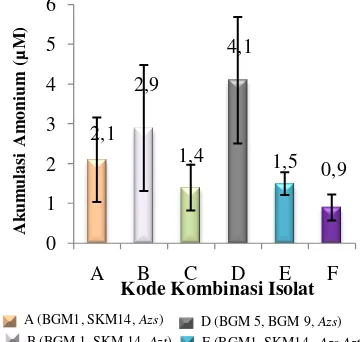
Hasil pengukuran rapat optis (OD620)
selama inkubasi kultur bakteri kombinasi menunjukkan pertumbuhan yang berbeda (Gambar 4). Setelah diinkubasi selama 15 hari diatas mesin pengocok pada suhu ruang (27-30ºC) dan kondisi gelap, didapatkan hasil pengukuran rapat optis tertinggi pada kombinasi F (BGM 5, BGM 9, Azospirillum , 132,4
0 0 9,3
128,1 184,5 0 50 100 150 200 250 300
A B C D E F
Ok si da si C H4 (x 1 0 -8µ M /s e/ h a ri )
Kode Kombinasi Isolat
A (BGM1, SKM14, Azs) B (BGM 1, SKM 14,,Azt) C (BGM 5, BGM 9, Azs)
D (BGM 5, BGM 9, Azt) E (BGM1, SKM14, Azs,Azt
F (BGM 5, BGM 9,Azs,Azt)
2,1 2,9 1,4 4,1 1,5 0,9 0 1 2 3 4 5 6
A B C D E F
A k u m ul a si A m o n ium (µ M )
Kode Kombinasi Isolat
A (BGM1, SKM14, Azs) B (BGM 1, SKM 14,,Azt) C (BGM 5, BGM 9, Azs)
D (BGM 5, BGM 9, Azs) E (BGM1, SKM14, Azs,Azt
[image:11.595.326.506.300.471.2]4
[image:12.595.107.299.175.818.2]dan Azotobacter) yaitu sebesar 0,052. Sedangkan nilai rapat optis terendah terdapat pada kombinasi E (BGM 1, SKM 14, Azospirillum, dan Azotobacter) yaitu sebesar 0,042. Nilai OD untuk empat kombinasi lainnya terlihat tidak berbeda jauh.
Tabel 1 Populasi masing-masing bakteri pada tiap kombinasi.
Sampel Isolat
Populasi sel (x105 CFU/ml)
A BGM 1 2,0
SKM 14 14,0
AZS 3,0
B BGM 1 7,0
SKM 14 9,0
AZT 3,0
C BGM 5 3,4
BGM 9 1,5
AZS 17,4
D BGM 5 102,5
BGM 9 11,5
AZT 6,5
E BGM 1 6,0
SKM 14 20,0
AZS 9,0
AZT 8,0
F BGM 5 9,1
BGM 9 0,7
AZS 0,5
AZT 0,5
Gambar 4 Rapat Optis masing-masing kultur kombinasi
PEMBAHASAN
Sawah adalah sebuah ekosistem yang di dalamnya terdapat aktivitas berbagai kelompok mikroorganisme yang mendiaminya. Kondisi sawah yang tergenang memudahkan terbentuknya GRK metan yang diproduksi oleh kelompok arkea metanogen (Conrad 1996). Indonesia dengan luas sawah lebih dari 9 juta ha diduga memberi kontribusi besar terhadap total emisi metan di atmosfer. Upaya penurunan emisi metan secara biologis dapat dilakukan dengan menggunakan kelompok bakteri metanotrof yang dapat memanfaatkan metan sebagai sumber karbon dalam kondisi oksigenik. Selain itu, pemenuhan akan sumber N2 juga dapat
dilakukan dengan penambahan inokulan bakteri penambat N2 ke lahan sawah yang
tentunya lebih ramah lingkungan dibandingkan dengan penggunaan pupuk kimia (Page 1986).
Berdasarkan hasil penelitian yang dilakukan, kombinasi F ( BGM 5, BGM 9, Azospirillum, dan Azotobacter) merupakan kombinasi yang memiliki laju oksidasi metan tertinggi dibandingkan kombinasi lainnya. Hasil tersebut mengindikasikan bahwa kemampuan optimal oksidasi metan bakteri metanotrof dipengaruhi oleh aktivitas bakteri penambat nitrogen karena akumulasi amonium dapat menghambat proses oksidasi metan. Amonium dan metan memiliki struktur molekul yang analog, sehingga apabila tersedia secara bersamaan maka akan terjadi kompetisi substrat yang akan digunakan oleh bakteri metanotrof ( King & Schneell 1994). Hal ini juga diperkuat oleh fakta bahwa bakteri metanotrof juga memiliki kemampuan untuk mengoksidasi amonium yang ada untuk mendapatkan energi dan sintesis material sel sehingga proses ini akan menghambat oksidasi metan (Hanson & Hanson 1996).
Metabolisme bakteri metanotrof diawali dengan proses oksidasi metan menjadi metanol melalui pelepasan ikatan O – O dari ikatan dioksigen oleh enzim MMO (Methane Mono Oxygenase). Semua bakteri metanotrof dapat mengekspresikan MMO (Hanson & Hanson 1996). Metanotrof mempunyai dua tipe MMO yaitu soluble MMO (sMMO) dan particulate MMO (pMMO). sMMO lebih efektif mentransformasi metan karena mampu menggunakan dua jalur untuk mengoksidasi formaldehid menjadi CO2. Bakteri metanotrof
tipe II dan X diketahui mampu mengekspresikan enzim ini (Hanson & Hanson 1996). Astuti (2009) melaporkan 0,045 0,047 0,047 0,044 0,042 0,052 0 0,01 0,02 0,03 0,04 0,05 0,06 0,07
A B C D E F
O p ti ca l D ens si ty (OD )
Kode Kombinasi Isolat
A (BGM1, SKM14, Azs) B (BGM 1, SKM 14,,Azt) C (BGM 5, BGM 9, Azs)
D (BGM 5, BGM 9, Azt) E (BGM1, SKM14, Azs,Azt
5
bahwa BGM 9 memiliki kemiripan 85% dengan Methylococcus capsulatus yang merupakan bakteri metanotrof tipe X.
Salah satu cara yang dapat dilakukan untuk mengetahui kemampuan suatu organisme dalam menambat nitrogen ialah dengan mengukur amonium yang diakumulasikannya. Hasil pengukuran kadar amonium menggunakan medium bebas N2
menunjukkan bahwa kultur kombinasi D ( BGM 5, BGM 9, dan Azotobacter) mampu mengakumulasi amonium lebih tinggi dibanding kombinasi lainnya setelah diinkubasi selama 15 hari. Efektivitas kombinasi D dalam menambat nitrogen dipengaruhi oleh keberadaan Azospirillum.
Proses fiksasi N2 bakteri metanotrof dan
penambat nitrogen dimediasi oleh enzim nitrogenase. Enzim ini sangat sensitif dengan keberadaan O2 karena akan menghambat
ekspresi gen nifD dan nifH yang menyandikan enzim nitrogenase (Auman et al. 2001). Tetapi oksigen juga dibutuhkan dalam respirasi aerob untuk menghasilkan ATP yang mendukung aktivitas nitrogenase. Fiksasi satu molekul nitrogen membutuhkan 16 molekul ATP yang selanjutnya akan diubah menjadi dua molekul amonia (2NH3) (Madigan et al.
2009). Azospirillum bersifat mikroaerofilik sehingga lebih sensitif terhadap oksigen pada konsentrasi tinggi (saturasi udara 50% pada set percobaan), berbeda halnya dengan bakteri Azotobacter yang bersifat aerob obligat sehingga mampu menggunakan O2 yang
tersedia.
Populasi bakteri pada kultur kombinasi tertinggi terdapat pada kombinasi D (BGM 5, BGM 9, dan Azotobacter). Populasi yang tinggi pada formulasi tersebut berkorelasi positif dengan kadar amonium terakumulasi. Selain perbedaan aktivitas enzim nitrogenase masing-masing isolat, kemampuan untuk mengakumulasikan amonium pada bakteri metanotrof juga dipengaruhi oleh tingkat pertumbuhannya (Maisaroh 2010). Pada kultur kombinasi, akumulasi amonium diduga juga dipengaruhi oleh aktivitas bakteri metanorof yang mampu menambat nitrogen ataupun menggunakan hasil fiksasi nitrogen tersebut.
Metanotrof merupakan bakteri yang tumbuh lambat. Hal ini disebabkan karena waktu generasi yang dibutuhkan sel bakteri ini relatif lebih lama. Panjangnya waktu generasi bakteri ini dikarenakan CH4 sebagai sumber
karbon dan energi hanya menghasilkan material sel dan energi lebih kecil untuk metabolisme sel. Nilai OD masing-masing
kombinasi (Gambar 3) menunjukan bakteri metanotrof yang dikulturkan pada media cair NMS tumbuh optimal pada umur 15 hari inkubasi.
SIMPULAN
Aktivitas oksidasi metan tertinggi terdapat pada kombinasi F ( BGM 5, BGM 9, Azospirillum, dan Azotobacter ) sebesar 184,5x10-8 M/sel/hari . Aktivitas akumulasi amonium tertinggi terdapat pada kombinasi D ( BGM 5, BGM 9, dan Azotobacter) yaitu sebesar 4,075 M . Aktivitas oksidasi metan dan akumulasi amonium bakteri metanotrof menunjukkan hasil yang lebih tinggi saat dikombinasikan dengan bakteri penambat nitrogen.
SARAN
Perlu dilakukan penelitian lanjutan untuk mengetahui efektivitas formulasi bakteri dalam mengoksidasi metan dan menambat Nitrogen pada tanah dan lahan sawah.
DAFTAR PUSTAKA
Alexander M. 1977. Introduction to Soil Mycrobiology. 2nd Ed. New York: John Wiley and Sons.
Astuti DD. 2009. Karakterisasi Fisiologi dan Identifikasi Molekuler Isolat-isolat Bakteri Metanotrof asal Sawah Wilayah Bogor dan Sukabumi [skripsi]. Bogor: Fakultas MIPA, Institut Pertanian Bogor.
Auman AJ, Speake SS, Lidstrom ME. 2001. nifH sequences and nitrogen fixation in type I and type II Methanotrophs. Appl Environ Microbiol 67: 4009–4016. Cleseri LS, Greenberg AE and Trussel RR.
1989. Standard Method for the Examination of Water and Waste Water. Baltimore: Port City Press.
Conrad R, Rothfus F. 1991. Methane oxidation in the soil surface layer of aflooded rice field and the effect of ammonium. Biol Fertil Soil 12:28-32. Hanson R, Hanson TE. 1996. Metanotrophic
bacteria. J Microbiol Reviews 60 : 439-471.
6
dan Sukabumi [skripsi]. Bogor: Fakultas MIPA, Institut Pertanian Bogor.
[IPCC] Intergovernmental Panel on Climate Change. 2007. The Physical Science Basis. Cambridge: Cambridge University Press. King GM & Schnell S. 1994. Mechanistic
analysis of ammonium inhibition of atmospheric methane consumption in forest soils. Appl Environ Microbiol 60: 3514–3521.
Kumar K. and Balasubramanian B. 1986. Field response of rice to Azospirillum biofertilizer. Curr Rsrch 15:74–76. Kumaraswamy S, Ramakrishnan B,
Sethunathan N. 2001. Methane production and oxidation in annoxic rice soil as influ enced by inorganic redox species. J Environ Qual 30: 2195-2201.
Lelieveld J, Crutzen PJ, Bruhl C. 1993. Climate Effects of Atmospheric Methane. Chemosphere 26: 739-768.
Madigan MT, Martinko JM, Dunlap PV, Clark DP. 2009. Brock Biology of Microorganism 12th Ed. San Francisco: Pearson Benjamin Cummings.
Maisaroh. 2010. Aktivitas Enzim Nitrogenase dan Oksidasi Metan Bakteri Metanotrof Asal Sawah [tesis]. Bogor:Program Pascasarjana, Institut Pertanian Bogor. Notohadiprawiro T. 2006. Sawah Dalam Tata
Guna Lahan. Yogyakarta: UGM Press. Oremland RS, and Capone DG. 1998. Use of
“specific” inhibitors in biogeo chemistry
and microbial ecology. Adv Microb Ecol. 10:285-383.
Page, W.J. 1986. Sodium-dependent growth of Azotobacter chroococcum. Appl Environ Microbiol 51: 510-514.
Rudd JWN, Taylor CD. 1980. Methan cycling in aquatic environment. Adv Aq Microbiol 2:77-150.
Sagala BT. 2009. Seleksi dan Uji Aktivitas Fiksasi Nitrogen (N2) Bakteri Metanotrof
Asal Sawah pada Konsentrasi Oksigen (O2) Berbeda [skripsi]. Bogor: Fakultas
MIPA, Institut Pertanian Bogor.
Somasegaran & Hoben. 1994. Hand Book for Rhizobia. New York : Springer-Verlag. Wild A. 1995. Soils and The Environment: An
Introduction. Cambridge: Cambridge University Press.
7
8
Lampiran 1 Kurva standar ammonium
Lampiran 2 Koloni isolat kombinasi hasil pencawanan
Lampiran 3 Komposisi media NMS (Nitrate Mineral Salt)
Komposisi media Nitrat Mineral Salts (NMS) : MgSO4.7H2O 1.0 g/L, CaCl2.6H2O 0.2 g/L,
KNO3 1.0 g/L, KH2PO4 0.272 g/L, Na2HPO4 4.0 g/L, NH4Cl 4.0 mg/L, Na2EDTA 0.5 g/L,
FeSO4.7H2O 0.2 g/L, H3BO4 0.03 g/L, CoCl2.6H2O 0.02 g/L, ZnSO4.7H2O 0.01 g/L, MnCl2.4H2O
3.0 mg/L, Na2MoO4. 2H2O 3.0 mg/L, NiCl2.6H2O 2.0 mg/L, CaCl2.2H2O 1.0 mg/L, Bacto agar 20
g/L, methanol 1%, dan sukrosa 1%.
y = 0,006x + 0,053 R² = 0,999
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8
0 20 40 60 80 100 120
Abs
or
b
an
si
Konsentrasi (ppm)
SKM 14 BGM 1
BGM 9
ABSTRAK
IVAN PERMANA PUTRA. Aktivitas Fiksasi N2 dan Oksidasi Metan Kombinasi Biakan
Azotobacter sp., Azospirillum sp., dan Bakteri Metanotrof. Dibimbing oleh IMAN RUSMANA dan ALINA AKHDIYA.
Bakteri metanotrof merupakan bakteri pengoksidasi metan. Selain itu, bakteri metanotrof tipe II dan tipe X juga mampu memfiksasi nitrogen karena adanya enzim nitrogenase. Tetapi aktivitas oksidasi metan dihambat oleh keberadaan amonium. Penelitian ini dilakukan untuk menguji aktivitas oksidasi metan dan fiksasi nitrogen keempat isolat bakteri metanotrof yaitu BGM 1, BGM 5, BGM 9, dan SKM 14 yang dikombinasikan dengan bakteri penambat nitrogen (Azotobacter dan Azospirillum). Sebanyak 6 kombinasi dikulturkan kemudian diinokulasikan ke campuran media NMS tanpa unsur N, kemudian diuji aktivitas oksidasi metan dan fiksasi nitrogen. Aktivitas oksidasi metan tertinggi terdapat pada kombinasi isolat BGM 5, BGM 9, Azospirillum, dan Azotobacter yaitu sebesar 184,5 x 10-8 M/sel/hari . Aktivitas akumulasi amonium tertinggi terdapat pada kombinasi isolat BGM 5, BGM 9, dan Azotobacter yaitu sebesar 4,075 M. Aktivitas oksidasi metan dan akumulasi amonium bakteri metanotrof menunjukkan hasil yang lebih tinggi saat dikombinasikan dengan bakteri penambat nitrogen.
Kata kunci: Metan, bakteri metanotrof, bakteri penambat nitrogen,oksidasi metan, fiksasi nitrogen
ABSTRACT
IVAN PERMANA PUTRA. N2 Fixation and Methane Oxidation Activity of mixed of culture of
Azotobacter sp., Azospirillum sp., and Methanotrophic Bacteria. Under supervision of IMAN RUSMANA and ALINA AKHDIYA.
Metanotrophs bacteria are methane oxidizing bacteria. Methanotrophic bacteria especially type II and type X were also able to fix nitrogen using nitrogenase enzyme. This reasearch was conducted to determine activity of methane oxidation and nitrogen fixation of four isolates of methanotropic bacteria i.e. BGM 1, BGM 5, BGM 9, and SKM 14 which were combined with nitrogen-fixing bacteria (Azotobacter sp. and Azospirillum sp.). Six combinations were cultured and then inoculated into nitrogen free NMS medium. Activity of methane oxidation and nitrogen fixation activity was analysed. The highest methane oxidation activity was found in the mixed culture of BGM 9, BGM 5, Azotobacter sp., and Azospirillum sp. isolates. The activity was 184.5 x 10-8 M/cell /day. The highest accumulation of ammonium was found in the mixed culture of BGM 5, BGM 9, and Azotobacter sp. isolates. The concentration of accumulated ammonium was
4.075 M. Methane oxidation activity and ammonium accumulation of methanotrophic bacteria showed higher result when they were combined with nitrogen fixing bacteria.
1
PENDAHULUAN
Latar Belakang
Metan (CH4) merupakan salah satu gas
yang berkontribusi terhadap pemanasan global. Intergovernmental Panel of Climate Change (2007), menyatakan bahwa kontribusi metan terhadap pemanasan global menempati urutan ketiga setelah CFC dan N2O.
Kontribusi metan terhadap pemanasan global lebih besar dibandingkan dengan CO2, karena
CH4 lebih efektif menyerap radiasi pada
panjang gelombang 4-100 nm (irradiasi sinar infra merah) dibandingkan dengan CO2
(Lelieveld et al. 1993; Hanson & Hanson 1996). Sebesar 43% dari emisi metan ke atmosfer berasal dari lahan basah, yakni 20% dari sawah dan sisanya berasal dari lahan rawa (Wild 1995; Notohadiprawiro 2006). Indonesia dengan luas sawah lebih dari 9 juta ha diduga memberi kontribusi terhadap total emisi metan. Untuk mewujudkan sistem pertanian lahan sawah yang ramah lingkungan, dapat dilakukan dengan menekan tingkat emisi gas metan diantaranya melalui pemanfaatan bakteri metanotrof. Emisi metan dari lingkungan akuatik seperti tanah sawah pada dasarnya ditentukan oleh dua proses mikrobial yang berbeda, yaitu produksi metan dan konsumsi metan (Rudd dan Taylor 1980). Pada tanah sawah, metan diproduksi sebagai hasil antara dan hasil akhir dari berbagai proses mikrobial, seperti dekomposisi anaerobik bahan organik oleh Arkea Methanogen. Sementara sebagian dari metan yang diproduksi akan dioksidasikan oleh bakteri metanotrof yang bersifat aerobik di lapisan permukaan tanah dan di zona perakaran. Bakteri metanotrof merupakan bakteri yang memanfaatkan CH4 sebagai
donor elektron untuk menghasilkan energi dan sebagai sumber karbonnya (Hanson dan Hanson 1996).
Pupuk nitrogen (N) dalam bentuk urea sudah menjadi kebutuhan pokok bagi petani sebagai upaya pemenuhan kebutuhan unsur N pada lahan pertanian. Umumnya petani memberikan pupuk dengan takaran tinggi, melebihi kebutuhan pada lahan tanaman, sehingga menyebabkan pemborosan dan pencemaran lingkungan. Salah satu solusi tepat untuk mengatasi hal tersebut ialah dengan menggunakan agen pemfiksasi nitrogen biologis seperti Azotobacter dan Azospirillum. Dinitrogen diubah menjadi amonium melalui reduksi elektron dan protonasi gas dinitrogen. Selain mampu menambat nitrogen, kedua bakteri ini juga
menghasilkan zat pengatur tumbuh giberelin, sitokinin, dan asam indol asetat yang dapat memacu pertumbuhan tanaman (Alexander 1977). Berbagai hasil penelitian menunjukkan bahwa inokulasi tanah atau benih dengan bakteri yang efektif menambat nitrogen dapat meningkatkan produktivitas tanaman. Poduktivitas panen padi yang dinokulasikan dengan Azospirillum dan Azotobacter
dilaporkan mengalami peningkatan sebesar 5-60% (Kumar dan Balasubramanian 1986).
Informasi tentang aktivitas oksidasi metan dan fiksasi nitrogen bakteri metanotrof yang dikombinasikan dengan Azotobacter dan Azospirillum di Indonesia masih jarang. Berdasarkan penelitian Chatrina (2010) diketahui bahwa kombinasi isolat bakteri metanotrof BGM 5 dan BGM 9 memiliki aktivitas oksidasi metan tertinggi. Penelitian lainnya menunjukkan bahwa kombinasi SKM 14 dan BGM 1 merupakan kombinasi bakteri metanotrof yang memiliki kemampuan oksidasi metan dalam lumpur steril tertinggi (Hanif 2010). Keempat isolat tersebut berpotensi dikembangkan lebih lanjut dengan cara dikombinasikan dengan bakteri penambat nitrogen yaitu Azospirillum dan Azotobacter. Informasi mengenai kajian terhadap kombinasi ini dalam mengoksidasi metan dan menambat N2 penting dilakukan, sehingga
hasilnya dapat dimanfaatkan untuk mewujudkan sistem pertanian yang ramah lingkungan.
Tujuan
Penelitian ini bertujuan untuk mengetahui aktivitas kultur kombinasi Metanotrof, Azotobacter sp., dan Azospirillum sp. dalam mereduksi emisi metan dan memfiksasi nitrogen.
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Januari sampai dengan bulan Mei 2011 di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB.
BAHAN DAN METODE
Isolat Bakteri
1
PENDAHULUAN
Latar Belakang
Metan (CH4) merupakan salah satu gas
yang berkontribusi terhadap pemanasan global. Intergovernmental Panel of Climate Change (2007), menyatakan bahwa kontribusi metan terhadap pemanasan global menempati urutan ketiga setelah CFC dan N2O.
Kontribusi metan terhadap pemanasan global lebih besar dibandingkan dengan CO2, karena
CH4 lebih efektif menyerap radiasi pada
panjang gelombang 4-100 nm (irradiasi sinar infra merah) dibandingkan dengan CO2
(Lelieveld et al. 1993; Hanson & Hanson 1996). Sebesar 43% dari emisi metan ke atmosfer berasal dari lahan basah, yakni 20% dari sawah dan sisanya berasal dari lahan rawa (Wild 1995; Notohadiprawiro 2006). Indonesia dengan luas sawah lebih dari 9 juta ha diduga memberi kontribusi terhadap total emisi metan. Untuk mewujudkan sistem pertanian lahan sawah yang ramah lingkungan, dapat dilakukan dengan menekan tingkat emisi gas metan diantaranya melalui pemanfaatan bakteri metanotrof. Emisi metan dari lingkungan akuatik seperti tanah sawah pada dasarnya ditentukan oleh dua proses mikrobial yang berbeda, yaitu produksi metan dan konsumsi metan (Rudd dan Taylor 1980). Pada tanah sawah, metan diproduksi sebagai hasil antara dan hasil akhir dari berbagai proses mikrobial, seperti dekomposisi anaerobik bahan organik oleh Arkea Methanogen. Sementara sebagian dari metan yang diproduksi akan dioksidasikan oleh bakteri metanotrof yang bersifat aerobik di lapisan permukaan tanah dan di zona perakaran. Bakteri metanotrof merupakan bakteri yang memanfaatkan CH4 sebagai
donor elektron untuk menghasilkan energi dan sebagai sumber karbonnya (Hanson dan Hanson 1996).
Pupuk nitrogen (N) dalam bentuk urea sudah menjadi kebutuhan pokok bagi petani sebagai upaya pemenuhan kebutuhan unsur N pada lahan pertanian. Umumnya petani memberikan pupuk dengan takaran tinggi, melebihi kebutuhan pada lahan tanaman, sehingga menyebabkan pemborosan dan pencemaran lingkungan. Salah satu solusi tepat untuk mengatasi hal tersebut ialah dengan menggunakan agen pemfiksasi nitrogen biologis seperti Azotobacter dan Azospirillum. Dinitrogen diubah menjadi amonium melalui reduksi elektron dan protonasi gas dinitrogen. Selain mampu menambat nitrogen, kedua bakteri ini juga
menghasilkan zat pengatur tumbuh giberelin, sitokinin, dan asam indol asetat yang dapat memacu pertumbuhan tanaman (Alexander 1977). Berbagai hasil penelitian menunjukkan bahwa inokulasi tanah atau benih dengan bakteri yang efektif menambat nitrogen dapat meningkatkan produktivitas tanaman. Poduktivitas panen padi yang dinokulasikan dengan Azospirillum dan Azotobacter
dilaporkan mengalami peningkatan sebesar 5-60% (Kumar dan Balasubramanian 1986).
Informasi tentang aktivitas oksidasi metan dan fiksasi nitrogen bakteri metanotrof yang dikombinasikan dengan Azotobacter dan Azospirillum di Indonesia masih jarang. Berdasarkan penelitian Chatrina (2010) diketahui bahwa kombinasi isolat bakteri metanotrof BGM 5 dan BGM 9 memiliki aktivitas oksidasi metan tertinggi. Penelitian lainnya menunjukkan bahwa kombinasi SKM 14 dan BGM 1 merupakan kombinasi bakteri metanotrof yang memiliki kemampuan oksidasi metan dalam lumpur steril tertinggi (Hanif 2010). Keempat isolat tersebut berpotensi dikembangkan lebih lanjut dengan cara dikombinasikan dengan bakteri penambat nitrogen yaitu Azospirillum dan Azotobacter. Informasi mengenai kajian terhadap kombinasi ini dalam mengoksidasi metan dan menambat N2 penting dilakukan, sehingga
hasilnya dapat dimanfaatkan untuk mewujudkan sistem pertanian yang ramah lingkungan.
Tujuan
Penelitian ini bertujuan untuk mengetahui aktivitas kultur kombinasi Metanotrof, Azotobacter sp., dan Azospirillum sp. dalam mereduksi emisi metan dan memfiksasi nitrogen.
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Januari sampai dengan bulan Mei 2011 di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB.
BAHAN DAN METODE
Isolat Bakteri
2
Peremajaan dan Perbanyakan Isolat. Isolat BGM 1,BGM 5, BGM 9, dan SKM 14 diremajakan pada medium NMS + 1% methanol (Lampiran 3). Isolat Azotobacter dan Azospirillum diperbanyak dengan menggunakan media NMS + sukrosa 1% (Lampiran 3). Kemudian keduanya diinkubasi pada suhu ruang selama 5-7 hari (Hanson 1998). Koloni-koloni yang terpisah kemudian digores kembali sampai didapatkan koloni-koloni yang murni. Isolat murni yang didapat disimpan pada medium agar miring NMS yang diberi 1 % metanol untuk bakteri metanotrof dan NMS yang diberi 1% sukrosa untuk bakteri pemfiksasi nitrogen.
Formulasi Kultur Bakteri Kombinasi. Formulasi dilakukan dengan mengkombinasikan isolat bakteri terbaik metanotrof dalam mengoksidasi metan berdasarkan penelitian Chatrina dan Hanif tahun 2010 dengan bakteri penambat nitrogen. Kombinasi yang dibuat adalah : kombinasi A (BGM 1, SKM 14, dan Azospirillum), kombinasi B (BGM 1, SKM 14, dan Azotobacter), kombinasi C (BGM 5, BGM 9, dan Azospirillum), kombinasi D (BGM 5, BGM 9, dan Azotobacter), kombinasi E (BGM 1, SKM 14, Azospirillum, dan Azotobacter), serta kombinasi F (BGM 5, BGM 9, Azospirillum, dan Azotobacter). Masing-masing kombinasi dibuat sebanyak tiga ulangan dan sebagai kontrol digunakan media cair yang tidak diinokulasikan kombinasi bakteri. Sebanyak 0,1ml isolat bakteri metanotrof dan penambat N2
diinokulasikan ke dalam 9 ml medium NMS+1% sukrosa bebas nitrogen dan diinkubasi pada suhu ruang selama 15 hari. Komposisi gas di bagian head space dibuat menjadi 50% metan dan 50% udara. Inkubasi dilakukan selama 15 hari diatas mesin pengocok pada suhu ruang 27-30ºC dan kondisi gelap.
Uji Aktivitas Oksidasi Metan. Pada akhir masa inkubasi dilakukan pengukuran gas metan tersisa pada bagian head space dengan menggunakan teknik kromatografi (Kumaraswamy et al. 2001). Analisis gas metan ini dilakukan di Balai Penelitian Lingkungan Pertanian, Jakenan Pati, Jawa Tengah.
Analisis Kadar Amonium. Pengukuran aktivitas fiksasi N2, dilakukan dengan
mengukur kadar amonium yang terakumulasikan dalam kultur. Sebanyak 5 ml kultur disentrifuse pada kecepatan 4000 rpm selama 10 menit pada suhu ruang. Kemudian, 3 ml supernatan ditambah dengan 0,12 ml
fenol alkohol 10% dan divortex hingga homogen. Selanjutnya ke dalam campuran ditambahkan dengan 0,12 ml larutan Na-Dihidronitroprusit 0,5%, dan divortex kembali hingga homogen. Campuran tersebut ditambah dengan 0,3 ml Na-sitrat : NA-hipoklorit (1:4) dan didiamkan selama satu jam sampai berubah warna menjadi biru (Cleseri et al. 1989). Selanjutnya dilakukan pengukuran kadar amonium terakumulasi dengan menggunakan spektrofotometer pada panjang gelombang 640 nm. Amonium terakumulasi berdasarkan kurva standar (Lampiran 1) dihitung dengan persamaan berikut :
[amonium] =
Penghitungan Populasi Bakteri dalam Kultur. Sebanyak 1 ml isolat bakteri kombinasi diencerkan sampai 10-3, 10-4, dan 10-5. Selanjutnya dari tiap pengenceran diambil 0,1 ml dan disebar ke media NMS+1% metanol+1% sukrosa lalu diinkubasi selama 3 hari. Setelah 3 hari dilakukan penghitungan masing-masing sel bakteri pada tiap Kombinasi
Pengukuran Optical Density (OD) Kultur Kombinasi. Rapat optis kultur kombinasi pada akhir inkubasi diukur menggunakan spektrofotometer vis Genesys
20 Prancis 200-1000 nm pada OD620 dengan
blanko Akuades.
HASIL
Peremajaan dan Perbanyakan Isolat
Sebanyak empat isolat bakteri metanotrof yang memiliki aktivitas oksidasi metan tertinggi (Chatrina 2010; Hanif 2010) berhasil diremajakan. Isolat BGM 1,BGM 5, BGM 9 (Gambar 1), dan SKM 14 menunjukkan warna koloni yang berbeda ( bening, putih krem, pink, pink oranye, kuning terang, dan oranye) pada media NMS + 1% metanol, sesuai dengan hasil penelitian Hapsari (2008). Kecepatan pertumbuhan koloni tiap isolat juga bervariasi, yaitu mencapai ukuran 2 mm dalam waktu 3 – 14 hari. SKM 14 merupakan isolat yang memiliki kecepatan pertumbuhan paling tinggi, sedangkan BGM 1 merupakan isolat yang paling lambat ketika ditumbhkan pada media NMS.
2
Peremajaan dan Perbanyakan Isolat. Isolat BGM 1,BGM 5, BGM 9, dan SKM 14 diremajakan pada medium NMS + 1% methanol (Lampiran 3). Isolat Azotobacter dan Azospirillum diperbanyak dengan menggunakan media NMS + sukrosa 1% (Lampiran 3). Kemudian keduanya diinkubasi pada suhu ruang selama 5-7 hari (Hanson 1998). Koloni-koloni yang terpisah kemudian digores kembali sampai didapatkan koloni-koloni yang murni. Isolat murni yang didapat disimpan pada medium agar miring NMS yang diberi 1 % metanol untuk bakteri metanotrof dan NMS yang diberi 1% sukrosa untuk bakteri pemfiksasi nitrogen.
Formulasi Kultur Bakteri Kombinasi. Formulasi dilakukan dengan mengkombinasikan isolat bakteri terbaik metanotrof dalam mengoksidasi metan berdasarkan penelitian Chatrina dan Hanif tahun 2010 dengan bakteri penambat nitrogen. Kombinasi yang dibuat adalah : kombinasi A (BGM 1, SKM 14, dan Azospirillum), kombinasi B (BGM 1, SKM 14, dan Azotobacter), kombinasi C (BGM 5, BGM 9, dan Azospirillum), kombinasi D (BGM 5, BGM 9, dan Azotobacter), kombinasi E (BGM 1, SKM 14, Azospirillum, dan Azotobacter), serta kombinasi F (BGM 5, BGM 9, Azospirillum, dan Azotobacter). Masing-masing kombinasi dibuat sebanyak tiga ulangan dan sebagai kontrol digunakan media cair yang tidak diinokulasikan kombinasi bakteri. Sebanyak 0,1ml isolat bakteri metanotrof dan penambat N2
diinokulasikan ke dalam 9 ml medium NMS+1% sukrosa bebas nitrogen dan diinkubasi pada suhu ruang selama 15 hari. Komposisi gas di bagian head space dibuat menjadi 50% metan dan 50% udara. Inkubasi dilakukan selama 15 hari diatas mesin pengocok pada suhu ruang 27-30ºC dan kondisi gelap.
Uji Aktivitas Oksidasi Metan. Pada akhir masa inkubasi dilakukan pengukuran gas metan tersisa pada bagian head space dengan menggunakan teknik kromatografi (Kumaraswamy et al. 2001). Analisis gas metan ini dilakukan di Balai Penelitian Lingkungan Pertanian, Jakenan Pati, Jawa Tengah.
Analisis Kadar Amonium. Pengukuran aktivitas fiksasi N2, dilakukan dengan
mengukur kadar amonium yang terakumulasikan dalam kultur. Sebanyak 5 ml kultur disentrifuse pada kecepatan 4000 rpm selama 10 menit pada suhu ruang. Kemudian, 3 ml supernatan ditambah dengan 0,12 ml
fenol alkohol 10% dan divortex hingga homogen. Selanjutnya ke dalam campuran ditambahkan dengan 0,12 ml larutan Na-Dihidronitroprusit 0,5%, dan divortex kembali hingga homogen. Campuran tersebut ditambah dengan 0,3 ml Na-sitrat : NA-hipoklorit (1:4) dan didiamkan selama satu jam sampai berubah warna menjadi biru (Cleseri et al. 1989). Selanjutnya dilakukan pengukuran kadar amonium terakumulasi dengan menggunakan spektrofotometer pada panjang gelombang 640 nm. Amonium terakumulasi berdasarkan kurva standar (Lampiran 1) dihitung dengan persamaan berikut :
[amonium] =
Penghitungan Populasi Bakteri dalam Kultur. Sebanyak 1 ml isolat bakteri kombinasi diencerkan sampai 10-3, 10-4, dan 10-5. Selanjutnya dari tiap pengenceran diambil 0,1 ml dan disebar ke media NMS+1% metanol+1% sukrosa lalu diinkubasi selama 3 hari. Setelah 3 hari dilakukan penghitungan masing-masing sel bakteri pada tiap Kombinasi
Pengukuran Optical Density (OD) Kultur Kombinasi. Rapat optis kultur kombinasi pada akhir inkubasi diukur menggunakan spektrofotometer vis Genesys
20 Prancis 200-1000 nm pada OD620 dengan
blanko Akuades.
HASIL
Peremajaan dan Perbanyakan Isolat
Sebanyak empat isolat bakteri metanotrof yang memiliki aktivitas oksidasi metan tertinggi (Chatrina 2010; Hanif 2010) berhasil diremajakan. Isolat BGM 1,BGM 5, BGM 9 (Gambar 1), dan SKM 14 menunjukkan warna koloni yang berbeda ( bening, putih krem, pink, pink oranye, kuning terang, dan oranye) pada media NMS + 1% metanol, sesuai dengan hasil penelitian Hapsari (2008). Kecepatan pertumbuhan koloni tiap isolat juga bervariasi, yaitu mencapai ukuran 2 mm dalam waktu 3 – 14 hari. SKM 14 merupakan isolat yang memiliki kecepatan pertumbuhan paling tinggi, sedangkan BGM 1 merupakan isolat yang paling lambat ketika ditumbhkan pada media NMS.
3
jauh berbeda dengan Azotobacter. Kecepatan pertumbuhan kedua bakteri tersebut tidak sama. Diameter koloni Azotobacter relatif lebih besar dibandingkan dengan koloni Azospirillum.
Uji Aktivitas Oksidasi Metan.
Hasil uji aktivitas oksidasi metan menggunakan kromatografi gas menunjukkan bahwa empat dari enam kombinasi isolat yang digunakan menunjukkan kemampuan oksidasi metan setelah diinkubasi selama 15 hari. Laju oksidasi metan tertinggi ditunjukkan oleh kombinasi F (BGM 5, BGM 9, Azospirillum, dan Azotobacter) yaitu sebesar 184,5 x 10-8
M/sel/hari atau setara dengan 28,λ4 ppm/ml kultur/hari. Aktivitas oksidasi metan ini lebih tinggi 10,742 ppm/ml kultur/hari dibandingkan dengan hasil penelitian Chatrina (2010). Laju oksidasi metan terendah ditunjukkan oleh kombinasi D (BGM 5, BGM 9, dan Azotobacter) yaitu sebesar 9,3 x 10-8 M/sel/hari (Gambar 2).
[image:22.595.106.299.105.812.2]
Gambar 1 Morfologi koloni isolat BGM 9 dengan masa inkubasi lima hari pada suhu 27-29°C
Gambar 2 Aktivitas oksidasi CH4 kultur
kombinasi
Analisis Kadar Amonium.
Uji aktivitas fiksasi nitrogen pada isolat kombinasi yang berhasil diremajakan pada medium NMS bebas unsur N menunjukkan bahwa kadar amonium terakumulasi tertinggi pada masa akhir inkubasi (hari ke-15) ditunjukkan oleh kombinasi D (BGM 5, BGM 9, dan Azotobacter) sebesar 4,075 M (Gambar 3). Aktivitas akumulasi amonium ini lebih tinggi dibandingkan dengan hasil penelitian Chatrina (2010) yaitu sebesar 2,755 µM. Akumulasi amonium pada kombinasi A (2,113 M) dan B (2,943 M), sedangkan pada kombinasi C (1,434 M) dan E (1,509
M). Akumulasi amonium terendah ditunjukkan oleh kombinasi F (BGM 5, BGM 9, Azospirillum, dan Azotobacter) sebesar 0,981 M.
Gambar 3 Aktivitas akumulasi amonium kultur kombinasi
Penghitungan Populasi Bakteri dalam Kultur.
Populasi total bakteri kultur kombinasi pada akhir inkubasi (Lampiran 2) tertinggi terdapat pada kombinasi D (BGM 5, BGM 9, dan Azotobacter) yaitu 120,5x105 CFU/ml. Sedangkan populasi total bakteri paling rendah terdapat pada kombinasi F (Tabel 1).
Optical Density (OD) Kultur Bakteri
Kombinasi.
Hasil pengukuran rapat optis (OD620)
selama inkubasi kultur bakteri kombinasi menunjukkan pertumbuhan yang berbeda (Gambar 4). Setelah diinkubasi selama 15 hari diatas mesin pengocok pada suhu ruang (27-30ºC) dan kondisi gelap, didapatkan hasil pengukuran rapat optis tertinggi pada kombinasi F (BGM 5, BGM 9, Azospirillum , 132,4
0 0 9,3
128,1 184,5 0 50 100 150 200 250 300
A B C D E F
Ok si da si C H4 (x 1 0 -8µ M /s e/ h a ri )
Kode Kombinasi Isolat
A (BGM1, SKM14, Azs) B (BGM 1, SKM 14,,Azt) C (BGM 5, BGM 9, Azs)
D (BGM 5, BGM 9, Azt) E (BGM1, SKM14, Azs,Azt
F (BGM 5, BGM 9,Azs,Azt)
2,1 2,9 1,4 4,1 1,5 0,9 0 1 2 3 4 5 6
A B C D E F
A k u m ul a si A m o n ium (µ M )
Kode Kombinasi Isolat
A (BGM1, SKM14, Azs) B (BGM 1, SKM 14,,Azt) C (BGM 5, BGM 9, Azs)
D (BGM 5, BGM 9, Azs) E (BGM1, SKM14, Azs,Azt
[image:22.595.326.506.300.471.2]4
[image:23.595.107.299.175.818.2]dan Azotobacter) yaitu sebesar 0,052. Sedangkan nilai rapat optis terendah terdapat pada kombinasi E (BGM 1, SKM 14, Azospirillum, dan Azotobacter) yaitu sebesar 0,042. Nilai OD untuk empat kombinasi lainnya terlihat tidak berbeda jauh.
Tabel 1 Populasi masing-masing bakteri pada tiap kombinasi.
Sampel Isolat
Populasi sel (x105 CFU/ml)
A BGM 1 2,0
SKM 14 14,0
AZS 3,0
B BGM 1 7,0
SKM 14 9,0
AZT 3,0
C BGM 5 3,4
BGM 9 1,5
AZS 17,4
D BGM 5 102,5
BGM 9 11,5
AZT 6,5
E BGM 1 6,0
SKM 14 20,0
AZS 9,0
AZT 8,0
F BGM 5 9,1
BGM 9 0,7
AZS 0,5
AZT 0,5
Gambar 4 Rapat Optis masing-masing kultur kombinasi
PEMBAHASAN
Sawah adalah sebuah ekosistem yang di dalamnya terdapat aktivitas berbagai kelompok mikroorganisme yang mendiaminya. Kondisi sawah yang tergenang memudahkan terbentuknya GRK metan yang diproduksi oleh kelompok arkea metanogen (Conrad 1996). Indonesia dengan luas sawah lebih dari 9 juta ha diduga memberi kontribusi besar terhadap total emisi metan di atmosfer. Upaya penurunan emisi metan secara biologis dapat dilakukan dengan menggunakan kelompok bakteri metanotrof yang dapat memanfaatkan metan sebagai sumber karbon dalam kondisi oksigenik. Selain itu, pemenuhan akan sumber N2 juga dapat
dilakukan dengan penambahan inokulan bakteri penambat N2 ke lahan sawah yang
tentunya lebih ramah lingkungan dibandingkan dengan penggunaan pupuk kimia (Page 1986).
Berdasarkan hasil penelitian yang dilakukan, kombinasi F ( BGM 5, BGM 9, Azospirillum, dan Azotobacter) merupakan kombinasi yang memiliki laju oksidasi metan tertinggi dibandingkan kombinasi lainnya. Hasil tersebut mengindikasikan bahwa kemampuan optimal oksidasi metan bakteri metanotrof dipengaruhi oleh aktivitas bakteri penambat nitrogen karena akumulasi amonium dapat menghambat proses oksidasi metan. Amonium dan metan memiliki struktur molekul yang analog, sehingga apabila tersedia secara bersamaan maka akan terjadi kompetisi substrat yang akan digunakan oleh bakteri metanotrof ( King & Schneell 1994). Hal ini juga diperkuat oleh fakta bahwa bakteri metanotrof juga memiliki kemampuan untuk mengoksidasi amonium yang ada untuk mendapatkan energi dan sintesis material sel sehingga proses ini akan menghambat oksidasi metan (Hanson & Hanson 1996).
Metabolisme bakteri metanotrof diawali dengan proses oksidasi metan menjadi metanol melalui pelepasan ikatan O – O dari ikatan dioksigen oleh enzim MMO (Methane Mono Oxygenase). Semua bakteri metanotrof dapat mengekspresikan MMO (Hanson & Hanson 1996). Metanotrof mempunyai dua tipe MMO yaitu soluble MMO (sMMO) dan particulate MMO (pMMO). sMMO lebih efektif mentransformasi metan karena mampu menggunakan dua jalur untuk mengoksidasi formaldehid menjadi CO2. Bakteri metanotrof
tipe II dan X diketahui mampu mengekspresikan enzim ini (Hanson & Hanson 1996). Astuti (2009) melaporkan 0,045 0,047 0,047 0,044 0,042 0,052 0 0,01 0,02 0,03 0,04 0,05 0,06 0,07
A B C D E F
O p ti ca l D ens si ty (OD )
Kode Kombinasi Isolat
A (BGM1, SKM14, Azs) B (BGM 1, SKM 14,,Azt) C (BGM 5, BGM 9, Azs)
D (BGM 5, BGM 9, Azt) E (BGM1, SKM14, Azs,Azt
5
bahwa BGM 9 memiliki kemiripan 85% dengan Methylococcus capsulatus yang merupakan bakteri metanotrof tipe X.
Salah satu cara yang dapat dilakukan untuk mengetahui kemampuan suatu organisme dalam menambat nitrogen ialah dengan mengukur amonium yang diakumulasikannya. Hasil pengukuran kadar amonium menggunakan medium bebas N2
menunjukkan bahwa kultur kombinasi D ( BGM 5, BGM 9, dan Azotobacter) mampu mengakumulasi amonium lebih tinggi dibanding kombinasi lainnya setelah diinkubasi selama 15 hari. Efektivitas kombinasi D dalam menambat nitrogen dipengaruhi oleh keberadaan Azospirillum.
Proses fiksasi N2 bakteri metanotrof dan
penambat nitrogen dimediasi oleh enzim nitrogenase. Enzim ini sangat sensitif dengan keberadaan O2 karena akan menghambat
ekspresi gen nifD dan nifH yang menyandikan enzim nitrogenase (Auman et al. 2001). Tetapi oksigen juga dibutuhkan dalam respirasi aerob untuk menghasilkan ATP yang mendukung aktivitas nitrogenase. Fiksasi satu molekul nitrogen membutuhkan 16 molekul ATP yang selanjutnya akan diubah menjadi dua molekul amonia (2NH3) (Madigan et al.
2009). Azospirillum bersifat mikroaerofilik sehingga lebih sensitif terhadap oksigen pada konsentrasi tinggi (saturasi udara 50% pada set percobaan), berbeda halnya dengan bakteri Azotobacter yang bersifat aerob obligat sehingga mampu menggunakan O2 yang
tersedia.
Populasi bakteri pada kultur kombinasi tertinggi terdapat pada kombinasi D (BGM 5, BGM 9, dan Azotobacter). Populasi yang tinggi pada formulasi tersebut berkorelasi positif dengan kadar amonium terakumulasi. Selain perbedaan aktivitas enzim nitrogenase masing-masing isolat, kemampuan untuk mengakumulasikan amonium pada bakteri metanotrof juga dipengaruhi oleh tingkat pertumbuhannya (Maisaroh 2010). Pada kultur kombinasi, akumulasi amonium diduga juga dipengaruhi oleh aktivitas bakteri metanorof yang mampu menambat nitrogen ataupun menggunakan hasil fiksasi nitrogen tersebut.
Metanotrof merupakan bakteri yang tumbuh lambat. Hal ini disebabkan karena waktu generasi yang dibutuhkan sel bakteri ini relatif lebih lama. Panjangnya waktu generasi bakteri ini dikarenakan CH4 sebagai sumber
karbon dan energi hanya menghasilkan material sel dan energi lebih kecil untuk metabolisme sel. Nilai OD masing-masing
kombinasi (Gambar 3) menunjukan bakteri metanotrof yang dikulturkan pada media cair NMS tumbuh optimal pada umur 15 hari inkubasi.
SIMPULAN
Aktivitas oksidasi metan tertinggi terdapat pada kombinasi F ( BGM 5, BGM 9, Azospirillum, dan Azotobacter ) sebesar 184,5x10-8 M/sel/hari . Aktivitas akumulasi amonium tertinggi terdapat pada kombinasi D ( BGM 5, BGM 9, dan Azotobacter) yaitu sebesar 4,075 M . Aktivitas oksidasi metan dan akumulasi amonium bakteri metanotrof menunjukkan hasil yang lebih tinggi saat dikombinasikan dengan bakteri penambat nitrogen.
SARAN
Perlu dilakukan penelitian lanjutan untuk mengetahui efektivitas formulasi bakteri dalam mengoksidasi metan dan menambat Nitrogen pada tanah dan lahan sawah.
DAFTAR PUSTAKA
Alexander M. 1977. Introduction to Soil Mycrobiology. 2nd Ed. New York: John Wiley and Sons.
Astuti DD. 2009. Karakterisasi Fisiologi dan Identifikasi Molekuler Isolat-isolat Bakteri Metanotrof asal Sawah Wilayah Bogor dan Sukabumi [skripsi]. Bogor: Fakultas MIPA, Institut Pertanian Bogor.
Auman AJ, Speake SS, Lidstrom ME. 2001. nifH sequences and nitrogen fixation in type I and type II Methanotrophs. Appl Environ Microbiol 67: 4009–4016. Cleseri LS, Greenberg AE and Trussel RR.
1989. Standard Method for the Examination of Water and Waste Water. Baltimore: Port City Press.
Conrad R, Rothfus F. 1991. Methane oxidation in the soil surface layer of aflooded rice field and the effect of ammonium. Biol Fertil Soil 12:28-32. Hanson R, Hanson TE. 1996. Metanotrophic
bacteria. J Microbiol Reviews 60 : 439-471.
5
bahwa BGM 9 memiliki kemiripan 85% dengan Methylococcus capsulatus yang merupakan bakteri metanotrof tipe X.
Salah satu cara yang dapat dilakukan untuk mengetahui kemampuan suatu organisme dalam menambat nitrogen ialah dengan mengukur amonium yang diakumulasikannya. Hasil pengukuran kadar amonium menggunakan medium bebas N2
menunjukkan bahwa kultur kombinasi D ( BGM 5, BGM 9, dan Azotobacter) mampu mengakumulasi amonium lebih tinggi dibanding kombinasi lainnya setelah diinkubasi selama 15 hari. Efektivitas kombinasi D dalam menambat nitrogen dipengaruhi oleh keberadaan Azospirillum.
Proses fiksasi N2 bakteri metanotrof dan
penambat nitrogen dimediasi oleh enzim nitrogenase. Enzim ini sangat sensitif dengan keberadaan O2 karena akan menghambat
ekspresi gen nifD dan nifH yang menyandikan enzim nitrogenase (Auman et al. 2001). Tetapi oksigen juga dibutuhkan dalam respirasi aerob untuk menghasilkan ATP yang mendukung aktivitas nitrogenase. Fiksasi satu molekul nitrogen membutuhkan 16 molekul ATP yang selanjutnya akan diubah menjadi dua molekul amonia (2NH3) (Madigan et al.
2009). Azospirillum bersifat mikroaerofilik sehingga lebih sensitif terhadap oksigen pada konsentrasi tinggi (saturasi udara 50% pada set percobaan), berbeda halnya dengan bakteri Azotobacter yang bersifat aerob obligat sehingga mampu menggunakan O2 yang
tersedia.
Populasi bakteri pada kultur kombinasi tertinggi terdapat pada kombinasi D (BGM 5, BGM 9, dan Azotobacter). Populasi yang tinggi pada formulasi tersebut berkorelasi positif dengan kadar amonium terakumulasi. Selain perbedaan aktivitas enzim nitrogenase masing-masing isolat, kemampuan untuk mengakumulasikan amonium pada bakteri metanotrof juga dipengaruhi oleh tingkat pertumbuhannya (Maisaroh 2010). Pada kultur kombinasi, akumulasi amonium diduga juga dipengaruhi oleh aktivitas bakteri metanorof yang mampu menambat nitrogen ataupun menggunakan hasil fiksasi nitrogen tersebut.
Metanotrof merupakan bakteri yang tumbuh lambat. Hal ini disebabkan karena waktu generasi yang dibutuhkan sel bakteri ini relatif lebih lama. Panjangnya waktu generasi bakteri ini dikarenakan CH4 sebagai sumber
karbon dan energi hanya menghasilkan material sel dan energi lebih kecil untuk metabolisme sel. Nilai OD masing-masing
kombinasi (Gambar 3) menunjukan bakteri metanotrof yang dikulturkan pada media cair NMS tumbuh optimal pada umur 15 hari inkubasi.
SIMPULAN
Aktivitas oksidasi metan tertinggi terdapat pada kombinasi F ( BGM 5, BGM 9, Azospirillum, dan Azotobacter ) sebesar 184,5x10-8 M/sel/hari . Aktivitas akumulasi amonium tertinggi terdapat pada kombinasi D ( BGM 5, BGM 9, dan Azotobacter) yaitu sebesar 4,075 M . Aktivitas oksidasi metan dan akumulasi amonium bakteri metanotrof menunjukkan hasil yang lebih tinggi saat dikombinasikan dengan bakteri penambat nitrogen.
SARAN
Perlu dilakukan penelitian lanjutan untuk mengetahui efektivitas formulasi bakteri dalam mengoksidasi metan dan menambat Nitrogen pada tanah dan lahan sawah.
DAFTAR PUSTAKA
Alexander M. 1977. Introduction to Soil Mycrobiology. 2nd Ed. New York: John Wiley and Sons.
Astuti DD. 2009. Karakterisasi Fisiologi dan Identifikasi Molekuler Isolat-isolat Bakteri Metanotrof asal Sawah Wilayah Bogor dan Sukabumi [skripsi]. Bogor: Fakultas MIPA, Institut Pertanian Bogor.
Auman AJ, Speake SS, Lidstrom ME. 2001. nifH sequences and nitrogen fixation in type I and type II Methanotrophs. Appl Environ Microbiol 67: 4009–4016. Cleseri LS, Greenberg AE and Trussel RR.
1989. Standard Method for the Examination of Water and Waste Water. Baltimore: Port City Press.
Conrad R, Rothfus F. 1991. Methane oxidation in the soil surface layer of aflooded rice field and the effect of ammonium. Biol Fertil Soil 12:28-32. Hanson R, Hanson TE. 1996. Metanotrophic
bacteria. J Microbiol Reviews 60 : 439-471.
AKTIVITAS FIKSASI NITROGEN DAN OKSIDASI METAN
KOMBINASI BIAKAN
Azotobacter sp.,
Azospirillum sp.
, DAN
BAKTERI METANOTROF
IVAN PERMANA PUTRA
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
5
bahwa BGM 9 memiliki kemiripan 85% dengan Methylococcus capsulatus yang merupakan bakteri metanotrof tipe X.
Salah satu cara yang dapat dilakukan untuk mengetahui kemampuan suatu organisme dalam menambat nitrogen ialah dengan mengukur amonium yang diakumulasikannya. Hasil pengukuran kadar amonium menggunakan medium bebas N2
menunjukkan bahwa kultur kombinasi D ( BGM 5, BGM 9, dan Azotobacter) mampu mengakumulasi amonium lebih tinggi dibanding kombinasi lainnya setelah diinkubasi selama 15 hari. Efektivitas kombinasi D dalam menambat nitrogen dipengaruhi oleh keberadaan Azospirillum.
Proses fiksasi N2 bakteri metanotrof dan
penambat nitrogen dimediasi oleh enzim nitrogenase. Enzim ini sangat sensitif dengan keberadaan O2 karena akan menghambat
ekspresi gen nifD dan nifH yang menyandikan enzim nitrogenase (Auman et al. 2001). Tetapi oksigen juga dibutuhkan dalam respirasi aerob untuk menghasilkan ATP yang mendukung aktivitas nitrogenase. Fiksasi satu molekul nitrogen membutuhkan 16 molekul ATP yang selanjutnya akan diubah menjadi dua molekul amonia (2NH3) (Madigan et al.
2009). Azospirillum bersifat mikroaerofilik sehingga lebih sensitif terhadap oksigen pada konsentrasi tinggi (saturasi udara 50% pada set percobaan), berbeda halnya dengan bakteri Azotobacter yang bersifat aerob obligat sehingga mampu menggunakan O2 yang
tersedia.
Populasi bakteri pada kultur kombinasi tertinggi terdapat pada kombinasi D (BGM 5, BGM 9, dan Azotobacter). Populasi yang tinggi pada formulasi tersebut berkorelasi positif dengan kadar amonium terakumulasi. Selain perbedaan aktivitas enzim nitrogenase masing-masing isolat, kemampuan untuk mengakumulasikan amonium pada bakteri metanotrof juga dipengaruhi oleh tingkat pertumbuhannya (Maisaroh 2010). Pada kultur kombinasi, akumulasi amonium diduga juga dipengaruhi oleh aktivitas bakteri metanorof yang mampu menambat nitrogen ataupun menggunakan hasil fiksasi nitrogen tersebut.
Metanotrof merupakan bakteri yang tumbuh lambat. Hal ini disebabkan karena waktu generasi yang dibutuhkan sel bakteri ini relatif lebih lama. Panjangnya waktu generasi bakteri ini dikarenakan CH4 sebagai sumber
karbon dan energi hanya menghasilkan material sel dan energi lebih kecil untuk metabolisme sel. Nilai OD masing-masing
kombinasi (Gambar 3) menunjukan bakteri metanotrof yang dikulturkan pada media cair NMS tumbuh optimal pada umur 15 hari inkubasi.
SIMPULAN
Aktivitas oksidasi metan tertinggi terdapat pada kombinasi F ( BGM 5, BGM 9, Azospirillum, dan Azotobacter ) sebesar 184,5x10-8 M/sel/hari . Aktivitas akumulasi amonium tertinggi terdapat pada kombinasi D ( BGM 5, BGM 9, dan Azotobacter) yaitu sebesar 4,075 M . Aktivitas oksidasi metan dan akumulasi amonium bakteri metanotrof menunjukkan hasil yang lebih tinggi saat dikombinasikan dengan bakteri penambat nitrogen.
SARAN
Perlu dilakukan penelitian lanjutan untuk mengetahui efektivitas formulasi bakteri dalam mengoksidasi metan dan menambat Nitrogen pada tanah dan lahan sawah.
DAFTAR PUSTAKA
Alexander M. 1977. Introduction to Soil Mycrobiology. 2nd Ed. New York: John Wiley and Sons.
Astuti DD. 2009. Karakterisasi Fisiologi dan Identifikasi Molekuler Isolat-isolat Bakteri Metanotrof asal Sawah Wilayah Bogor dan Sukabumi [skripsi]. Bogor: Fakultas MIPA, Institut Pertanian Bogor.
Auman AJ, Speake SS, Lidstrom ME. 2001. nifH sequences and nitro