AMMONIUM SERTA KARAKTERISASI GEN nifH
DAN nifD BAKTERI METANOTROF ASAL SAWAH
ARI FINA BINTARTI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2011
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan dengan sebenarnya bahwa tesis yang berjudul, Aktivitas Oksidasi Metan dan Akumulasi Ammonium serta Karakterisasi
Gen nifH dan nifD Bakteri Metanotrof Asal Sawah adalah hasil karya saya
dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juli 2011
ABSTRACT
ARI FINA BINTARTI. Methane Oxidation and Ammonium Accumulation Activity and Characterization of nifH and nifD Genes of Methanotrophic Bacteria from Ricefields. Under Direction of IMAN RUSMANA and ARIS TRI WAHYUDI
Metanotrophic bacteria have ability to oxidize methane. In addition they can fix atmospheric nitrogen, hence this bacterium has the potential role as a nitrogen source provider in the wetland. Nitrogen fixation process is catalyzed by the nitrogenase enzyme complex, encoded by nifH and nifD genes. Characterization these genes would support the use of methanotrophic bacteria in agriculture. Three methanotrophic bacteria isolated from rice fields i.e. BGM1, BGM3, and BGM9 were determined their methane oxidation and ammonium accumulation activities. Methane oxidation activity was analyzed using gas chromatography every two days. The concentration of ammonium in the culture supernatant was measured using phenate method. BGM1 isolate had a high ammonium accumulation rate, it was 2.77 ± 0.75 μmol/mL/day. The highest methane oxidation rate was shown by BGM3 isolate, the rate was 376.79 µmol/mL/day. nifD and nifH genes of three isolates and six other isolates (SS1, SS3, SS10, ST18, SP3 and INP4) were characterized. Based on nifH sequences analysis SS1 isolate was closely related to Beijerinckia mobilis and SS3, SS10, ST 18 isolates were closely related to B. indica subsp. indica ATCC 9039. While BGM3, INP4, and BGM9 isolates were related to nifH of uncultured nitrogen-fixing bacterium. Sequence analysis of nifD gene showed that SS1, SS3, SS10, ST 18 isolates were closely related to B. indica subsp. indica ATCC 9039 and BGM3, BGM9, INP4 isolates were closely related to Xanthobacter autotrophicus Py2.
Keywords: Methanotrophic bacteria, nitrogen fixation, nitrogenase, nifH, nifD
RINGKASAN
ARI FINA BINTARTI. Aktivitas Oksidasi Metan dan Akumulasi Ammonium serta Karakterisasi Gen nifH dan nifD Bakteri Metanotrof Asal Sawah. Dibimbing oleh IMAN RUSMANA and ARIS TRI WAHYUDI
Bakteri metanotrof merupakan bakteri yang mampu menggunakan metan sebagai sumber karbon dan energi untuk pertumbuhannya. Metan tersebut akan dioksidasi menjadi metanol atau dioksidasi lebih lanjut menjadi CO2. Enzim yang
berperan dalam oksidasi metan adalah metan monooksigenase (MMO). Selain itu metanotrof tipe II dan tipe X diketahui mampu memfiksasi nitrogen menjadi ammonium, sehingga bakteri metanotrof pemfiksasi nitrogen tersebut juga berperan penting sebagai penyedia sumber nitrogen di lahan sawah. Fiksasi nitrogen dikatalisis oleh kompleks enzim nitrogenase. Enzim tersebut tersusun oleh protein Fe (dinitrogenase reduktase) yang disandikan oleh gen nifH dan protein FeMo (dinitrogenase) yang dikodekan oleh gen nifDK. Gen nifH dan nifD mempunyai sekuen yang conserved terutama gen nifH, sehingga menjadikannya alat molekuler yang ideal untuk mempelajari kemampuan fiksasi nitrogen, distribusi, maupun filogeni bakteri diazotrof.
Tiga isolat metanotrof yaitu BGM1, BGM3, dan BGM 9 digunakan sebagai isolat uji untuk mempelajari aktivitas oksidasi metan dan akumulasi ammoniumnya. Aktivitas oksidasi metan dilakukan dengan menghitung konsentrasi gas metan yang ada di headspace menggunakan kromatografi gas setiap dua hari sekali. Sedangkan untuk menghitung konsentrasi ammonium yang terakumulasi di dalam media kultur digunakan spektofotometer pada panjang gelombang 640 nm.
Ketiga isolat tersebut mampu mengoksidasi metan selama pertumbuhannya, dan oksidasi metan tertinggi adalah isolat BGM3 sebesar 376.79 µmol/mL/hari. Ketiga isolat tersebut juga mampu memfiksasi nitrogen yang ditunjukkan dengan peningkatan konsentrasi ammonium yang terakumulasi di dalam media. Laju akumulasi ammonium tertinggi pada isolat BGM1 sebesar 2.77 ± 0.75
μmol/mL/hari. Gen nifH dan nifD dari ketiga isolat tersebut dan enam isolat lain (SS1, SS3, SS10, ST18, SP3, dan INP4) kemudian dikarakterisasi.
Analisis sekuen gen nifH menggunakan blastX menunjukkan bahwa isolat BGM3, BGM9, dan INP4 berkerabat dekat dengan nifH dari bakteri pemfiksasi nitrogen yang belum bisa dikulturkan, sedangkan isolat SS1, SS3, SS10, dan ST18 berkerabat dekat dengan nifH dari genus Beijerinckia yaitu B. mobilis dan B. indica subsp. indica ATCC 9039. Berdasarkan analisis sekuen gen nifD, isolat BGM3, BGM9, dan INP4 berkerabat dekat dengan nifD dari Xanthobacter autotrophicus Py2, sedangkan isolat SS1, SS3, SS10, dan ST18 berkerabat dekat dengan nifD dari B. indica subsp. indica ATCC 9039. Isolat BGM1, BGM3, dan BGM9 berpotensi untuk diaplikasikan di sawah sebagai pereduksi metan dan juga penyedia sumber nitrogen.
Kata kunci: metanotrof, oksidasi metan, fiksasi nitrogen, nitrogenase, nifH, nifD
©Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
AKTIVITAS OKSIDASI METAN DAN AKUMULASI
AMMONIUM SERTAKARAKTERISASI GEN
nif
H
DAN
nif
D BAKTERI METANOTROF ASAL SAWAH
ARI FINA BINTARTI
Tesis
sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada
Mayor Mikrobiologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dr. Ir. Dahrul Syah, M.Sc.Agr
Judul : Aktivitas Oksidasi Metan dan Akumulasi Ammonium serta Karakterisasi Gen nifH dan nifD Bakteri Metanotrof asal Sawah
Nama : Ari Fina Bintarti NRP : G351090091 Program Studi : Mikrobiologi
Disetujui, Komisi Pembimbing
Dr. Ir. Iman Rusmana, M.Si. Ketua
Dr. Aris Tri Wahyudi, M.Si. Anggota
Diketahui
Tanggal Ujian: 22 Juli 2011 Tanggal Lulus: Ketua Mayor Mikrobiologi
Dr. Gayuh Rahayu, M.Si.
Dekan Sekolah Pascasarjana IPB
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala Rahmat dan karuniaNya sehingga karya ilmiah yang berjudul ”Aktivitas Oksidasi Metan dan Akumulasi Ammonium serta Karakterisasi Gen nifH dan nifD Bakteri Metanotrof asal Sawah” dapat diselesaikan.
Penulis menyampaikan penghargaan dan ucapan terima kasih yang sebesar-besarnya kepada Bapak Dr. Ir. Iman Rusmana, M.Si dan Bapak Dr. Aris Tri Wahyudi, M.Si. atas semua bantuan, bimbingan, dan saran kepada penulis selama menempuh pendidikan S2. Terima kasih juga penulis sampaikan kepada Ibu Dr. Rahayu Widyastuti, M.Sc. selaku penguji luar komisi yang telah memberikan koreksi dan arahan untuk perbaikan tesis ini. Penulis juga mengucapkan banyak terima kasih kepada Prof. D.B. Nedwell atas segala bantuan, masukan, dan bimbingan selama penelitian di Laboratorium Ekologi Mikroba, Departemen Ilmu Biologi, Universitas Essex, UK.
Terima kasih kepada Kepala dan Staf Laboratorium Mikrobiologi Departemen Biologi FMIPA IPB, Kepala dan Staf Laboratorium Ekologi Mikroba, Departemen Ilmu Biologi, Universitas Essex, UK. Ungkapan terima kasih yang tak terhingga kepada Ayah, ibu, dan seluruh keluarga besar atas doa, kasih sayang serta keikhlasannya. Tidak lupa kepada rekan-rekan penulis mengucapkan terima kasih atas semua bantuan dan kerjasamanya.
Penulis menyadari bahwa tesis ini masih jauh dari sempurna, oleh karena itu kritik dan saran sangat diharapkan. Penulis berharap semoga karya ilmiah ini dapat bermanfaat bagi pembaca.
Bogor, Juli 2011
RIWAYAT HIDUP
Penulis dilahirkan di Rembang pada tanggal 13 Januari 1987 dari ayah Subiyanto, S.Pd, dan Ibu Jumiasih (Alm). Penulis merupakan putri pertama dari tiga bersaudara.
Tahun 2004 penulis lulus dari SMA Negeri 1 Rembang dan pada tahun yang sama penulis diterima di IPB pada Program Studi Biologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam melalui Undangan Seleksi Masuk IPB (USMI). Pada tahun 2007, penulis melaksanakan praktik kerja lapangan di PT Pyridam Farma, Cianjur, Jawa Barat. Pada tahun 2009, penulis melanjutkan studi pada mayor Mikrobiologi, Sekolah Pascasarjana IPB.
DAFTAR ISI
Halaman
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN Latar Belakang ... 1
Tujuan Penelitian ... 2
Manfaat Penelitian ... 2
TINJAUAN PUSTAKA Bakteri Metanotrof ... 3
Oksidasi Metan oleh Bakteri Metanotrof ... 4
Fiksasi Nitrogen oleh Bakteri Metanotrof ... 6
Enzim Nitrogenase ... 8
Gen nifH dan nifD ... 9
Karakterisasi Gen nif pada Bakteri Metanotrof ... 10
BAHAN DAN METODE Waktu dan Tempat Penelitian ... 12
Alat dan Bahan ... 12
Uji Aktivitas Oksidasi Metan ... 12
Uji Akumulasi Ammonium ... 12
Isolasi DNA, Amplifikasi Gen nifH dan nifD, dan Visualisasi Amplikon ... 13
Sekuensing DNA dan Analisis Bioinformatika ... 13
HASIL DAN PEMBAHASAN Hasil ... 14
Pembahasan ... 28
SIMPULAN DAN SARAN ... 38
DAFTAR PUSTAKA ... 39
DAFTAR TABEL
Halaman
1. Gen nif dan fungsinya ... 9 2. Hasil analisis sekuen gen nifD dengan menggunakan program
BLAST-X ... 19 3. Hasil analisis sekuen gen nifH dengan menggunakan program
BLAST-X ... 20
DAFTAR GAMBAR
Halaman
1. Jalur oksidasi metan dan asimilasi formaldehida pada
metanotrof. ... 6 2. Aktivitas oksidasi metan dan OD sel isolat BGM1 pada media
NMS bebas nitrat dan ammonium.. ... 14 3. Aktivitas oksidasi metan dan OD sel isolat BGM3 pada media
NMS bebas nitrat dan ammonium.. ... 14 4. Aktivitas oksidasi metan dan OD sel isolat BGM9 pada media
NMS bebas nitrat dan ammonium. ... 15 5. Konsentrasi ammonium dan OD sel isolat BGM1 pada media
NMS bebas nitrat dan ammonium. ... 16 6. Konsentrasi ammonium dan OD sel isolat BGM3 pada media
NMS bebas nitrat dan ammonium ... 16 7. Konsentrasi ammonium dan OD sel isolat BGM9 pada media
NMS bebas nitrat dan ammonium. ... 16 8. Laju akumulasi ammonium isolat BGM1, BGM3, dan BGM9 ... 17 9. Elektroforesis gel agarose 1% gen nifD berukuran 1900 bp yang
diamplifikasi dengan PCR (Keterangan : M= 1 kb ladder, Sumur 1= BGM3; 2= BGM9; 3= SS1; 4= SS3; 5= SS10; 6=
ST18; 7= INP4) ... 18 10. Elektroforesis gel agarose 1% gen nifH berukuran 400 bp yang
diamplifikasi dengan PCR (Keterangan: M= 1 kb ladder, sumur 1= BGM3, 2= BGM9, 3= SS1, 4= SS3, 5= SS10, 6= ST18, 7=
INP4, 8= SP3) ... 18 11. Prediksi struktur tiga dimensi protein (a) NifH: kuning= lembar
beta, hijau= heliks alfa, merah= klaster 4Fe-4S dan (b) NifD: kuning= lembar beta, hijau= heliks alfa, A= klaster FeMo-co,
B= klaster P ... 21 12. Penjajaran sekuen asam amino NifH isolat BGM3, BGM9, SS1,
SS3, SS10, ST18, INP4, dan SP3 dengan sekuen asam amino
NifH bakteri pembanding dari GenBank ... 22 13. Penjajaran sekuen asam amino NifH isolat BGM3, BGM9, SS1,
SS3, SS10, ST18, dan INP4 dengan sekuen asam amino NifH
14. Filogenetik berdasarkan sekuen asam amino NifH isolat metanotrof yang dibandingkan dengan beberapa bakteri
diazotrof dengan metode NJ dan bootstrap 1000x ... 26 15. Filogenetik berdasarkan sekuen asam amino NifD isolat
metanotrof yang dibandingkan dengan beberapa bakteri
diazotrof dengan metode NJ dan bootstraP 1000x ... 27 16. Filogenetik berdasarkan sekuen gen 16S rRNA isolat metanotrof
yang dibandingkan dengan beberapa bakteri diazotrof dengan
metode NJ dan bootstrap 1000x ... 28
DAFTAR LAMPIRAN
Halaman
1. Optical Density (OD) sel dan konsentrasi gas metan di headspace kultur metanotrof pada media NMS bebas nitrat dan
ammonium pada suhu 30 °C selama 12 hari. ... 46 2. Optical Density (OD) sel dan konsentrasi ammonium kultur
metanotrof pada media NMS bebas nitrat dan ammonium pada
suhu 30 °C selama 19 hari.. ... 47 3. Urutan sekuen gen nifH, sekuen asam amino NifH, dan hasil
blast-X BGM3.. ... 48 4. Urutan sekuen gen nifH, sekuen asam amino NifH, dan hasil
blast-X BGM9. ... 49 5. Urutan sekuen gen nifH, sekuen asam amino NifH, dan hasil
blast-X SS1. ... 50 6. Urutan sekuen gen nifH, sekuen asam amino NifH, dan hasil
blast-X SS3 ... 51 7. Urutan sekuen gen nifH, sekuen asam amino NifH, dan hasil
blast-X SS10. ... 52 8. Urutan sekuen gen nifH, sekuen asam amino NifH, dan hasil
blast-X ST18 ... 53 9. Urutan sekuen gen nifH, sekuen asam amino NifH, dan hasil
blast-X INP4 ... 54 10. Urutan sekuen gen nifH, sekuen asam amino NifH, dan hasil
blast-X SP3 ... 55 11. Urutan sekuen gen nifD, sekuen asam amino NifD, dan hasil
blast-X SS1 ... 56 12. Urutan sekuen gen nifD, sekuen asam amino NifD, dan hasil
blast-X SS3 ... 58 13. Urutan sekuen gen nifD, sekuen asam amino NifD, dan hasil
blast-X SS10 ... 60 14. Urutan sekuen gen nifD, sekuen asam amino NifD, dan hasil
blast-X ST18 ... 61 15. Urutan sekuen gen nifD, sekuen asam amino NifD, dan hasil
PENDAHULUAN
Latar Belakang
Metanotrof adalah bakteri yang mampu tumbuh dengan menggunakan metan sebagai sumber karbon dan energi. Oksidasi gas metan oleh bakteri metanotrof di lahan sawah dapat mencapai 80% dari metanyang diproduksi oleh bakteri metanogen (Conrad & Rothfus 1991). Oleh karena itu, bakteri metanotrof mempunyai potensi untuk mereduksi gas metan di atmosfer.
Famili metanotrof terdiri dari Methylococcaceae (metanotrof tipe I) dan Methylocystaceae (metanotrof tipe II). Metanotrof tipe I terdiri dari genus Methylomonas, Methylobacter, Methylosphaera, dan Methylomicrobium. Sedangkan metanotrof tipe II terdiri dari genus Methylosinus dan Methylocystis. Selain itu terdapat kelompok baru metanotrof tipe X yaitu genus Methylococcus dan Methylocaldum. Auman et al. (2001) dan Fedorov et al. (2008) melaporkan metanotrof tipe II dan anggota metanotrof tipe X yaitu genus Methylococcus mampu memfiksasi nitrogen menjadi ammonium. Penelitian terbaru yang dilakukan oleh Khadem et al. (2010) melaporkan bahwa metanotrof termoasidofilik genus Methylacidiphilum, filum Verrucomicrobia yaitu M. fumariolicum SolV juga mampu memfiksasi nitrogen. Sugitha dan Kumar (2009) mengatakan bahwa bakteri pemfiksasi nitrogen yang hidup bebas merupakan sumber nitrogen yang potensial di lahan sawah.
Enzim yang berperan dalam proses fiksasi nitrogenialah kompleks enzim nitrogenase. Komplek enzim nitrogenase terdiri dari protein Fe-Mo (dinitrogenase) dan protein Fe (dinitrogenase reduktase) yang disandikan oleh gen nifHDK (Sugitha & Kumar 2009). Dinitrogenase tersusun atas tetramer α2β2,
subunit α dan β masing-masing dikodekan oleh nifD dan nifK, sedangkan dinitrogenase reduktase dikodekan oleh nifH. Gen nifD dan nifH merupakan komponen utama dalam komplek enzim nitrogenase (Choo et al. 2003; Dedysh et al. 2004). Gen nifH dan nifD merupakan gen yang sangat conserved baik struktur, fungsi, dan sekuen asam aminonya (Boulygina et al. 2002).
Fedorov et al. (2007) mendeteksi gen nif pada Methylobacter dan membandingkannya dengan sekuen nukleotida diazotrof dari takson yang berbeda. Dedysh et al. (2004) mengkarakterisasi gen nifD dan nifH pada metanotrof asidofilik genus Methylocella dan Methylocapsa dan hubungan filogenetiknya dengan Beijerinckia. Auman et al. (2001) mengkarakterisasi gen nifD dan nifH untuk menyelidiki kemampuan fiksasi nitrogen pada Methylosinus trichosporium OB3b, Methylobacter marinus A45, Methylomonas methanica S1, Methylomonas rubra, dan Methylomicrobium albus BG8. Akan tetapi informasi tentang keragaman genetik gen nifH dan nifD bakteri metanotrof dari Indonesia masih jarang. Oleh karena itu, penelitian ini dilakukan untuk mempelajari aktivitas oksidasi metan serta mendeteksi keberadaan gen nifH dan nifD yang berkaitan dengan kemampuannya dalam memfiksasi nitrogen. Informasi yang didapatkan dari penelitian ini diharapkan dapat mendukung pemanfaatan bakteri tersebut sebagai penambat nitrogen dan pereduksi emisi metan di lahan pertanian.
Tujuan
Penelitian ini bertujuan untuk mempelajari aktivitas oksidasi metan dan akumulasi ammonium serta mengidentifikasi gen nifH dan nifD dari beberapa bakteri metanotrof asal sawah.
Manfaat Penelitian
TINJAUAN PUSTAKA
Bakteri Metanotrof
Metanotrof merupakan bakteri Gram negatif dan termasuk ke dalam kelompok metilotrof. Kelompok bakteri metilotrof mempunyai kemampuan untuk tumbuh pada senyawa beratom karbon satu seperti metan, metanol, amina termetilasi, halometan, maupun senyawa termetilasi yang mengandung sulfur (Norina 2007; Hanson & Hanson 1996).
Metanotrof tumbuh dengan baik pada kondisi aerob, meskipun bakteri ini juga dapat tumbuh pada lingkungan mikroaerofil. Metanotrof membutuhkan komposisi metan di atmosfer sebesar 10-50%. Habitat yang sering menjadi tempat hidup metanotrof adalah daerah akar dan sekitar perakaran. Terdapat dua famili metanotrof yaitu Methylococcaceae (metanotrof tipe I) termasuk filum gammaproteobakteria dan Methylocystaceae (metanotrof tipe II) yang termasuk ke dalam filum Alphaproteobacteria. Metanotrof tipe I yaitu genus Methylomonas, Methylobacter, Methylosarcina, Methylothermus, Methylohalobius, Methylosphaera, dan Methylomicrobium menggunakan jalur ribulosa monofosfat (RuMP) dalam mengasimilasi formaldehida suatu senyawa intermediet penting dalam oksidasi metan menjadi CO2, genus Methylosoma belum diketahui cara
mengasimilasi sumber karbonnya. Sedangkan metanotrof tipe II yang terdiri dari genus Methylosinus, Methylocella, Methylocapsa, dan Methylocystis menggunakan jalur serin. Kelompok baru metanotrof tipe X yaitu genus Methylococcus dan Methylocaldum mempunyai karakter fisiologi sama dengan tipe I yang menggunakan jalur RuMP. Perbedaannya ialah metanotrof tipe X mempunyai enzim ribulosabifosfat karboksilase, suatu enzim yang terdapat pada siklus Calvin-Benson. Metanotrof tipe X juga tumbuh pada temperatur yang lebih tinggi dari pada metanotrof tipe I dan II dan mempunyai DNA dengan persentase GC yang lebih tinggi dari pada kebanyakan metanotrof tipe I (Bowman 2006; Hanson & Hanson 1996).
Penelitian terbaru yang dilakukan oleh para peneliti telah menemukan dan mengidentifikasi anggota metanotrof baru yang berbeda dari filum gamma dan alfaproteobakteria. Metanotrof tersebut merupakan genus Methylacidiphila dan
dimasukkan ke dalam filum Verrucomicrobia. Tiga jenis metanotrof genus Methylacidiphila antara lain M. infernorum V4 (Dunfield et al. 2007), M. fumarolicum SolV (Pol et al. 2007), dan M. kamchatkense Kam1 (Islam et al. 2008) masing-masing berhasil diisolasi dari lahan geotermal yang mengandung metan di New Zealand, lumpur volkano solfatara di Italia, dan mata air panas asam di Kamchatka, Rusia. Anggota metanotrof ini merupakan termoasidofilik dan dapat tumbuh pada temperatur lebih dari 50 °C dan pH di bawah 5. Selain itu juga ditemukan metanotrof berfilamen yaitu Crenothrix polyspora (Stoecker et al. 2006) dan Clonothrix fusca (Vigliotta et al. 2007) yang termasuk ke dalam filum gammaproteobakteria dan secara filogenetik berkerabat dekat dengan metanotrof tipe I. Heyer et al. (2005) mengisolasi metanotrof halofilik Methylohalobius crimeensis 10KiT dan melaporkan bahwa metanotrof tersebut mampu tumbuh pada konsentrasi NaCl 15 %, Sorokin et al. (2007) juga berhasil mengisolasi metanotrof halofilik filum gammaproteobakteria yaitu Methylohalomonas lacus dan Methylonatrum kenyense dari danau hipersalin yang mengandung klorid dan sulfat di Rusia.
Oksidasi Metan oleh Bakteri Metanotrof
Gas metan secara alami diproduksi di lingkungan anaerob oleh arkhea metanogenik. Lahan sawah basah merupakan salah satu sumber emisi metan yang menghasilkan sekitar 115 Tongram metan per tahun atau sebesar 21% dari total metan yang dilepaskan ke atmosfer (Hanson & Hanson 1996).
Metan sebagai salah satu gas rumah kaca memiliki sifat meneruskan radiasi gelombang pendek atau cahaya matahari tetapi menyerap dan memantulkan radiasi gelombang panjang sehingga meningkatkan suhu di atmosfer bumi (Setyanto et al. 2004). Hanson dan Hanson (1996) melaporkan bahwa metan mampu menyerap radiasi infra merah 30 kali lebih besar dibandingkan karbondioksida sehingga metan mempunyai potensi lebih besar dalam pemanasan global.
dalam. Bakteri metanotrof yang ditemukan, diketahui melakukan simbiosis dengan berasosiasi di dalam jaringan insang Mytilidae yang hidup di lingkungan hydrothermal vents. Sejauh ini mikroorganisme yang berperan dalam oksidasi metan secara anaerob belum bisa dikulturkan. Mikroorganisme yang terlibat dalam oksidasi metan secara anaerob ini diidentifikasi sebagai arkhea metanotrofik (ANME), ANME-1 (Hinrich et al.1999), ANME-2 (Boetius et al. 2000), dan ANME-3 (Knittel et al. 2005).
Proses oksidasi metan dikatalisis oleh enzim metan monooksigenase (MMO). Tahap pertama oksidasi metan akan menghasilkan metanol yang kemudian dioksidasi menjadi formaldehida. Formaldehida kemudian diasimilasi ke dalam biomassa sel atau dioksidasi lebih lanjut menjadi karbondioksida untuk menghasilkan energi pereduksi untuk biosintesis dan hidroksilasi metan (Gambar 1) (Hanson & Hanson 1996). Auman et al. (2001) mengatakan sebagian besar metanotrof tipe I hanya mempunyai MMO yang berikatan dengan membran intrasitoplasmik yang disebut partikulat MMO (pMMO), sedangkan metanotrof tipe II dan Methylococcus juga mempunyai MMO yang berada di sitoplasma yang dinamakan soluble MMO (sMMO).
Berbagai penelitian dilakukan untuk mempelajari oksidasi metan pada metanotrof. Benstead et al. (1998) melaporkan bahwa dua bakteri metanotrof yaitu Methylobacter albus BG8 dan Methylosinus trichosporium OB3b mampu mengoksidasi metan pada kultur batch dengan substrat metanol. Pada penelitian sebelumnya oleh Best dan Higgins (1981) dilaporkan bahwa metanol merupakan inhibitor kompetitif bagi enzim MMO. Hilangnya aktivitas epoksidasi dan hidroksilasi kultur M. trichosporium OB3b yang ditumbuhkan dengan metanol menunjukkan bahwa sistem enzim yang berperan bersifat indusibel. Matheson et al. (1997) melaporkan tentang terhambatnya proses oksidasi metan pada Methylococcus capsulatus (Bath) ketika dipaparkan dengan hidroklorofluorokarbon 21, difluoroklorometan, fluorodiklorometan, dan berbagai metan terflorinasi.
dari genus Methylocella juga dapat menggunakan senyawa multikarbon sebagai sumber karbon dan energi. Senyawa multikarbon yang dapat digunakan antara lain asetat, suksinat, piruvat, malat, dan etanol. Genus Methylocella terdiri dari M. palustris, M. silvestris, dan M. tundrae yang masing-masing diisolasi dari tanah gambut, hutan, dan tundra. Anggota genus tersebut dan Methylocapsa acidiphila mengelompok dalam satu klaster yang berbeda dengan metanotrof tipe II lain. Bahkan Methylocella lebih dekat kekerabatannya dengan Beijerinckia indica. Selain itu, tidak adanya sistem membran internal yang mengandung pMMO membuat Methylocella secara morfologi dan metabolisme berbeda dengan metanotrof lain. Dari fakta tersebut, genus Methylocella digolongkan sebagai metanotrof fakultatif.
Gambar 1 Jalur oksidasi metan dan asimilasi formaldehida pada metanotrof (Hanson & Hanson 1996).
Fiksasi Nitrogen pada Bakteri Metanotrof
diazotrof. Diazotrof tersebut bisa hidup bebas atau bersimbiosis dengan tumbuhan (Caton 2007).
Distribusi diazotrof di alam sangat luas dan meliputi bakteria dan arkhaea. Fiksasi nitrogen secara biologis hanya dapat dilakukan oleh bakteri dan arkhaea baik itu aerobik, mikroaerofilik, fakultatif maupun anaerob obligat yang mempunyai operon nif, yang mengkodekan enzim nitrogenase (Capone et al. 2006).
Metanotrof diketahui dapat mengekspresikan enzim nitrogenase dan memfiksasi nitrogen sebagai sumber N, meskipun proses ini terbatas pada beberapa genus saja. Metanotrof tipe II dan anggota metanotrof tipe X yaitu genus Methylococcus memperlihatkan kemampuan dalam memfiksasi nitrogen, sehingga dapat diaplikasikan pada lingkungan yang jumlah nitrogennyaterbatas (Carini et al. 2003). Selain itu, Auman et al. (2001) juga melaporkan bahwa metanotrof tipe I yaitu genus Methylomonas dan Methylobacter marinus A45 mengindikasikan adanya kemampuan dalam memfiksasi nitrogen.
Bakteri pemfiksasi nitrogen sebagian besar mempunyai gen struktural pengkode enzim nitrogenase yang terdiri dari nifH, D, dan K terletak berdampingan dalam satu operon. Ward et al. (2004) melaporkan bahwa Methylococcus capsulatus mampu memfiksasi nitrogen dan gen-gen struktural penyandi enzim nitrogenase (nifHDK) terletak berdampingan seperti bakteri pemfiksasi nitrogen lain. Perpanjangan dari gen-gen nif tersebut ialah nifE, nifN, dan nifX, berfungsi untuk sintesis kofaktor Fe-Mo. Gen-gen tersebut mempunyai kesamaan sekuen yang tinggi diantara bakteri diazotrof.
Proses fiksasi nitrogen bisa terjadi di berbagai lingkungan seperti di lahan basah seperti sawah (Sugitha & Kumar 2009), rizosfer (Zumft 1997), lingkungan akuatik (Hanson & Hanson 1996), lingkungan asam (Dedysh et al. 2004), acidic forest cambisol (Dunfield et al. 2003), thermal soil (Burr et al. 2006), bahkan laut dalam dan hydrothermal vents (Mehta et al. 2003).
Proses ini menghabiskan energi sebanyak 16 ATP untuk memfiksasi satu mol N2,
dengan stoikiometri sebagai berikut:
N2 + 8e- + 16 ATP + 16 H2O 2NH3 + H2 + 16 ADP + 16 Pi + 8 H+
(Caton 2007). Enzim Nitrogenase
Konversi nitrogen menjadi ammonia dikatalisis oleh enzim nitrogenase. Enzim ini merupakan suatu kompleks metallo-protein yang mempunyai struktur yang conserved. Nitrogenase terdiri dari dua komponen protein yang dapat larut yaitu komponen I berupa protein Fe-Mo dan komponen II yaitu protein Fe. Protein Fe berfungsi sebagai donor elektron yang bergantung ATP yang ditransfer kepada komponen I, sedangkan protein Fe-Mo mengandung situs katalitik enzim (Chai 2007). Penambatan nitrogen berlangsung secara anaerob atau mikroaerob, karena keberadaan oksigen akan dapat menghambat aktivitas enzim nitrogenase.
Komponen I (dinitrogenase) yang dikodekan oleh nifDK mempunyai berat molekul antara 220-250 kiloDalton. Subunit ini berbentuk tetramer dengan dua metallo-komplek heterodimer yang disebut klaster fosfat (P) dan kofaktor besi molibdenum (FeMo-co). Satu subunit memiliki sepasang α-β dan sepasang klaster P dan molekul FeMo-co. Molekul FeMo-co terdiri dari satu gugus homositrat dan MoFe3-S3. Komponen yang lebih kecil yaitu komponen II (dinitrogenase
reduktase) dikodekan oleh nifH memiliki berat molekul sekitar 60-70 kiloDalton. Komponen II tersusun oleh dua subunit identik α yang mempunyai gugus 4Fe-4S di tengah. Komponen ini juga memiliki dua situs pengikatan Mg-ATP yang terletak di setiap subunit, dimana bagian ini adalah donor elektron obligat kepada komplek Fe-Mo. Oleh karena itu, protein ini sangat esensial untuk proses fiksasi nitrogen (Caton 2007).
Enzim nitrogenase sangat sensitif terhadap oksigen. Oleh karena itu oksigen merupakan salah satu faktor yang mengatur proses fiksasi nitrogen. Oksigen akan merusak enzim nitrogenase dan menghambat proses fiksasi nitrogen. Untuk organisme pemfiksasi nitrogen anaerob obligat, pengaturan terhadap konsentrasi oksigen tidak menjadi masalah karena lingkungan tempat hidupnya bebas oksigen, sedangkan organisme diazotrof aerob dan anaerob fakultatif mempunyai suatu mekanisme atau strategi tertentu untuk melindungi enzim nitrogenase dari paparan oksigen (Jäntti 2007).
Gen nifH dan nifD
Proses reduksi nitrogen menjadi ammonia secara genetik dikontrol oleh gen nif. Terdapat sekitar 20 gen nif pada Klebsiella pneumonia yang menyandikan aktivitas fiksasi nitrogen. Dalam proses fiksasi nitrogen terdapat sekitar 20 kb DNA untuk menyandikan gen-gen yang dibutuhkan untuk mengekspresikan komplek enzim (Tabel 1) (Lee et al. 2000; Caton 2007).
Tabel 1 Gen nif dan fungsinya
Gen nif Fungsi
nifA Aktivator transkripsi nifB Sintesis kofaktor Fe-Mo nifZ Maturasi dan aktivasi nifH nifH Struktur nitrogenase; protein Fe
nifD Struktur nitrogenase; protein Fe-Mo subunit α nifK Struktur nitrogenase; protein Fe-Mo subunit nifE Sintesis kofaktor Fe-Mo
nifN Sintesis kofaktor Fe-Mo nifX Sintesis kofaktor Fe-Mo nifQ Sintesis kofaktor Fe-Mo
nifU Maturasi dan aktivasi, kumpulan dari klaster Fe-S nifS Maturasi dan aktivasi, sistein desulfurase homodimer nifV Sintesis kofaktor Fe-Mo; homositrat sintase
nifW Maturasi dan aktivasi; perlindungan terhadap oksigen dari protein Fe-Mo
nifT Belum diketahui
nifY/nafY Chaperon untuk protein Fe-Mo; nafY merupakan FeMo-co carrier
nifE Sintesis FeMo-co
Gen nifH dan nifD adalah gen yang sangat penting dalam proses fiksasi nitrogen karena menyandikan komplek enzim nitrogenase. Pada sebagian besar diazotrof, gen nifHDK letaknya saling bersebelahan. Analisis sekuen dari gen-gen yang berhubungan dengan fiksasi nitrogen dari berbagai diazotrof memperlihatkan penataan gen nif dan asosiasinya masing-masing sangat berbeda. Pada alfa dan gamma proteobakteria yang bertanggung jawab dalam proses transkripsi enzim nitrogenase ialah operon nifHDK, sedangkan pada diazotrof simbiosis yang tumbuh lambat enzim nitrogenasenya dikodekan oleh dua operon nifH dan nifDK (Choo et al. 2003).
Gen nifH sering digunakan sebagai penanda suatu mikroorganisme yang dapat memfiksasi nitrogen. Sekuen gen nifH dari bakteri pada berbagai habitat telah dibuat basis datanya dan beberapa primer oligonukleotida universal untuk mengamplifikasi gen nifH telah diketahui. Gen struktural lain pengkode nitrogenase ialah nifD. Gen nifD juga bisa digunakan sebagai penanda kemampuan suatu mikroorganisme dalam memfiksasi nitrogen, akan tetapi primer untuk amplifikasinya masih sedikit yang telah diketahui. Hal ini dapat dikatakan bahwa protein NifD kurang conserved jika dibandingkan dengan NifH, sehingga seleksi primer untuk deteksi dan amplifikasi gen nifD masih menjadi masalah yang signifikan (Fedorov et al. 2008). Ueda et al. (1995) mengatakan bahwa gen nifH sama sekali tidak mengalami perubahan selama melewati proses evolusi. Gen nifH mempunyai sekuen basis data non-ribosomal terbesar dari berbagai mikroorganisme. Gen nifH memperlihatkan keunikan filogenetik sehingga dapat dibuat hubungan kekerabatan dari mikroorganisme diazotrof. Karena sifatnya yang conserved, nifH merupakan alat molekuler yang ideal untuk mempelajari fiksasi nitrogen secara biologis di lingkungan. Selain itu nifH dapat juga digunakan untuk menentukan distribusi filogenetik dari setiap kelompok diazotrof. Karakterisasi Gen nif pada Bakteri Metanotrof
LW 15, dan M. methanica S1) sekelompok dengan sekuen nifH dengan diazotrof dari gammaproteobakteria. Sedangkan metanotrof tipe II (Methylocystis sp. LW 2 dan LW 5, Methylosinus sp. PW 1, LW 3, LW 8, dan LW 4, dan M. trichosporium OB3b) sekelompok dengan sekuen nifH dengan diazotrof dari alfaproteobakteria.
Hasil penelitian yang dilakukan oleh Auman et al. (2001) menunjukkan perbandingan sekuen NifH pada tiga isolat Methylomonas memperlihatkan homologi yang tinggi (95-99%) dengan sekuen NifH bakteri pemfiksasi nitrogen yang diamplifikasi dari sampel perakaran padi dan danau air tawar. Sekuen NifH isolat metanotrof tipe II memperlihatkan homologi sebesar 94-99% dengan sekuen NifH dari berbagai lingkungan termasuk perakaran padi, danau air tawar, lautan oligotrofik, dan tanah hutan. Hasil tersebut memperlihatkan bahwa metanotrof pemfiksasi nitrogen mempunyai penyebaran yang luas dan berperan penting dalam siklus nitrogen di berbagai lingkungan
Dedysh et al. (2004) melaporkan bahwa bakteri metanotrof asidofilik secara filogenetik berkerabat dekat dengan bakteri heterotrof pemfiksasi nitrogen dari genus Beijerinckia. Sekuen gen nifH dan nifD dari isolat metanotrof asidofilik Methylocella dan Methylocapsa serta dari Beijerinckia dibandingkan dengan sekuen gen nifH dan nifD dari isolat metanotrof asidofilik yaitu tipe I, alfaproteobakteria (Methylosinus dan Methylocystis) dan metanotrof tipe II, gammaproteobakteria. Dalam proses amplifikasi gen nifH digunakan kombinasi primer F1 dan nifH-r yang menghasilkan produk PCR 453 bp. Dari hasil amplifikasi nifD diketahui bahwa gen nifH dan nifD terletak pada operon yang sama yang menunjukkan bahwa organisasi gen nif pada isolat metanotrof asidofilik sama dengan alfaproteobakteria dan gammaproteobakteria (nifHDK).
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilakukan dari bulan Juli 2010 sampai dengan Maret 2011 di Laboratorium Mikrobiologi, Departemen Biologi, Institut Pertanian Bogor.
Alat dan Bahan
Alat-alat yang digunakan pada penelitian ini adalah inkubator bergoyang, sentrifus, laminar air flow, lemari pendingin, autoklaf, pipet mikro. Bahan-bahan yang digunakan ialah isolat bakteri metanotrof asal sawah (BGM1, BGM3, dan BGM9) yang berhasil diisolasi dari penelitian sebelumnya (Hapsary 2008) untuk diuji aktivitas oksidasi metan dan akumulasi ammonium serta karakterisasi gen nifH dan nifDnya dan isolat SS1, SS3, SS10, ST18, SP3, dan INP4 (Reginaldi 2010) untuk dikarakterisasi gen nifH dan nifDnya, media Nitrate Mineral Salt (NMS), bahan-bahan yang digunakan untuk isolasi DNA dan PCR.
Uji Aktivitas Oksidasi Metan
Uji aktivitas oksidasi metan dilakukan dengan mengkulturkan ketiga isolat uji (BGM1, BGM3, dan BGM9) ke dalam media cair NMS bebas nitrat dan ammonium dengan sumber karbon gas metan. Kultur sebanyak lima ml diinokulasikan ke dalam 40 ml media NMS cair pada botol serum volume 120 ml. Komposisi gas di headspace diatur menjadi 50 % metan dan 50 % udara, kemudian diinkubasi di atas inkubator bergoyang pada suhu 30 ºC pada kondisi gelap selama 12 hari. Uji aktivitas oksidasi metan dilakukan dengan mengukur konsentrasi gas metan pada bagian headspace menggunakan kromatografi gas setiap dua hari sekali (Kumaraswamy et al. 2001).
Uji Akumulasi Ammonium
Uji ini dilakukan dengan mengkulturkan isolat BGM1, BGM3, dan BGM9 ke dalam 40 ml media cair NMS bebas nitrat dan ammonium lalu diinkubasi pada suhu 30 ºC selama 19 hari di atas inkubator bergoyang. Untuk pembuatan kurva standar ammonium digunakan konsentrasi ammonium 5, 10, 40, 80, dan 100 µM dari stok larutan NH4Cl 1 mM. Kultur bakteri diambil setiap tiga hari sekali
kemudian disentrifugasi pada 4000 g selama 10 menit, supernatan yang didapatkan digunakan sebagai sampel. Dua ml sampel dan larutan standar diuji
konsentrasi ammoniumnya menggunakan spektrofotometer dengan panjang gelombang 640 nm (Hans 1998). Densitas sel dihitung pada panjang gelombang 620 nm.
Isolasi DNA, Amplifikasi Gen nifH dan nifD, dan Visualisasi Amplikon
Isolasi DNA genom dilakukan dengan metode Lazo (Lazo et al. 1987). Amplifikasi gen nifHdan nifD menggunakan primer spesifik. Primer spesifik untuk gen nifH yang digunakan adalah nH17K-F (TAYGGNAASGGCGGTATCGG YAA) dan nH139P-R (TGGCATSGCRAARCCRCCGCAMACMACGTC) (Elbetagy & Ando 2008). Sedangkan primer spesifik untuk gen nifD yang digunakan adalah primer nifHD-F (CAGGAAATCTACATCGTCATGTC) dan nifD-R (TCCCANGARTGCATCTGRCGGA) (Dedysh et al. 2004).
Reaksi PCR dengan menggunakan volume campuran 50µL. Komposisi reaksi PCR yang digunakan adalah sebagai berikut: 10x KOD Hot Start DNA Polymerase Buffer (konsentrasi akhir 1x) sebanyak 5µL, 25mM MgSO4 (konsentrasi akhir 1.5mM) 3 µL, 2mM dNTPs (konsentrasi akhir 0.2mM) 5µL, 10µM primer (konsentrasi akhir 0.3µM) 1.5µL, DNA cetakan (100ng) 1µL, dan 1µL KOD Hot Start DNA Polymerase (1U/µL). Elektroforesis dilakukan dengan menggunakan agarose 1% pada tegangan listrik 70V selama 45 menit. Visualisasi menggunakan Ethidium Bromide (EtBr) dan diamati di bawah UV transluminator. Sekuensing DNA dan Analisis Bioinformatika
HASIL DAN PEMBAHASAN
Hasil
Pertumbuhan dan Aktivitas Oksidasi Metan
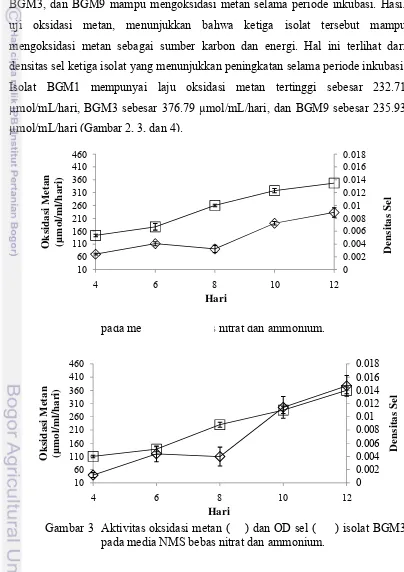
Uji oksidasi metan dilakukan untuk menentukan apakah isolat BGM1, BGM3, dan BGM9 mampu mengoksidasi metan selama periode inkubasi. Hasil uji oksidasi metan, menunjukkan bahwa ketiga isolat tersebut mampu mengoksidasi metan sebagai sumber karbon dan energi. Hal ini terlihat dari densitas sel ketiga isolat yang menunjukkan peningkatan selama periode inkubasi. Isolat BGM1 mempunyai laju oksidasi metan tertinggi sebesar 232.71 µmol/mL/hari, BGM3 sebesar 376.79 µmol/mL/hari, dan BGM9 sebesar 235.93 µmol/mL/hari (Gambar 2, 3, dan 4).
Gambar 2 Aktivitas oksidasi metan ( ) dan OD sel ( ) isolat BGM1 pada media NMS bebas nitrat dan ammonium.
Gambar 3 Aktivitas oksidasi metan ( ) dan OD sel ( ) isolat BGM3 pada media NMS bebas nitrat dan ammonium.
0 0.002 0.004 0.006 0.008 0.01 0.012 0.014 0.016 0.018 10 60 110 160 210 260 310 360 410 460
4 6 8 10 12
Densitas Sel
Oksidasi Metan (µ
mol/ml/hari) Hari 0 0.002 0.004 0.006 0.008 0.01 0.012 0.014 0.016 0.018 10 60 110 160 210 260 310 360 410 460
4 6 8 10 12
Densitas Sel
Oksidasi Metan (µ
mol/ml/hari)
Gambar 4 Aktivitas oksidasi metan ( ) dan OD sel ( ) isolat BGM9 pada media NMS bebas nitrat dan ammonium.
Kinetika pertumbuhan sel dapat memberikan informasi tentang kecepatan pertumbuhan sel. Parameter yang dihitung dalam kinetika pertumbuhan sel adalah laju pertumbuhan spesifik (µ) dan percepatan pertumbuhan maksimum (Vmax). Laju pertumbuhan spesifik isolat BGM1, BGM3, dan BGM9 masing-masing sebesar 0.134 hari-1(r2 = 0.97), 0.151 hari-1 (r2 = 0.97), dan 0.130 hari-1 (r2 = 0.98). Isolat BGM1 mempunyai nilai Vmax sebesar 0.51 hari-1 (r2 = 0.74), BGM3 sebesar 0.53 hari-1 (r2 = 0.86), dan BGM9 sebesar 0.54 hari-1 (r2 = 0.81).
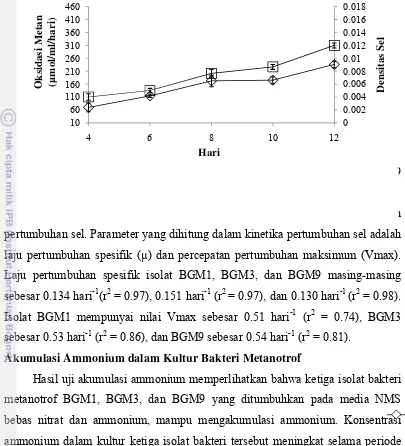
Akumulasi Ammonium dalam Kultur Bakteri Metanotrof
Hasil uji akumulasi ammonium memperlihatkan bahwa ketiga isolat bakteri metanotrof BGM1, BGM3, dan BGM9 yang ditumbuhkan pada media NMS bebas nitrat dan ammonium, mampu mengakumulasi ammonium. Konsentrasi ammonium dalam kultur ketiga isolat bakteri tersebut meningkat selama periode inkubasi dan mencapai konsentrasi tertinggi pada hari terakhir inkubasi. Konsentrasi ammonium tertinggi pada isolat BGM1, BGM3, dan BGM9 masing-masing sebesar 24.79 µM, 17.77 µM, dan 13.98 µM (Gambar 5, 6, dan 7).
0 0.002 0.004 0.006 0.008 0.01 0.012 0.014 0.016 0.018
10 60 110 160 210 260 310 360 410 460
4 6 8 10 12
Densitas Sel
Oksidasi Metan (µ
mol/ml/hari)
Gambar 5 Konsentrasi ammonium ( ) dan OD sel ( ) isolat BGM1 pada media NMS bebas nitrat dan ammonium.
Gambar 6 Konsentrasi ammonium ( ) dan OD sel ( ) isolat BGM3 pada media NMS bebas nitrat dan ammonium.
Gambar 7 Konsentrasi ammonium ( ) dan OD sel ( ) isolat BGM9 pada media NMS bebas nitrat dan ammonium.
0 0.01 0.02 0.03 0.04 0.05 0.06 0.07 0.08 0.09 0.1 0.11 0 5 10 15 20 25 30
1 4 7 10 13 16 19
Densitas Sel Konsentrasi Ammonium (µ M) Hari 0 0.01 0.02 0.03 0.04 0.05 0.06 0.07 0.08 0.09 0.1 0.11 0 5 10 15 20 25 30
1 4 7 10 13 16 19
Densitas Sel Konsentrasi Ammonium (µ M ) Hari 0 0.01 0.02 0.03 0.04 0.05 0.06 0.07 0.08 0.09 0.1 0.11 0 5 10 15 20 25 30
1 4 7 10 13 16 19
Densitas Sel
Konsentrasi Ammonium
(µ
M)
2.69
1.73
0.92
0 0.5 1 1.5 2 2.5 3 3.5 4
BGM1 BGM3 BGM9
Laju Akumulasi
Ammonium
(µ
mol/ml/hari)
Isolat
Isolat BGM1 mempunyai laju akumulasi ammonium tertinggi sebesar 2.69 ± 0.75 µmol/mL/hari (Gambar 8).
Gambar 8 Laju akumulasi ammonium isolat BGM1, BGM3, dan BGM9. Karakteristik nifD dan nifH dari Bakteri Metanotrof
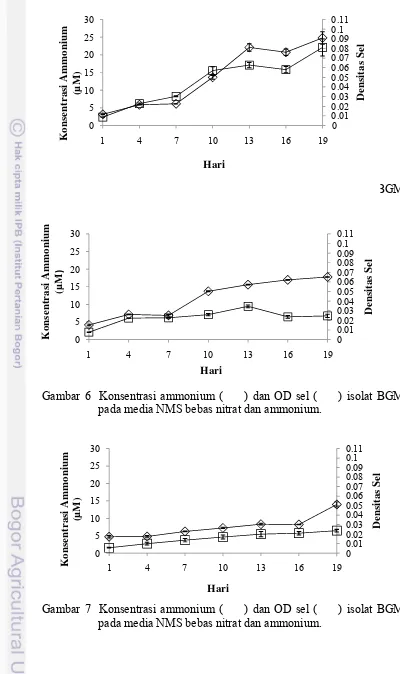
Gambar 9 Elektroforesis gel agarose 1% gen nifD berukurun 1900 bp yang diamplifikasi dengan PCR (Keterangan : M= 1 kb ladder, Sumur 1= BGM3; 2= BGM9; 3= SS1; 4= SS3; 5= SS10; 6= ST18; 7= INP4).
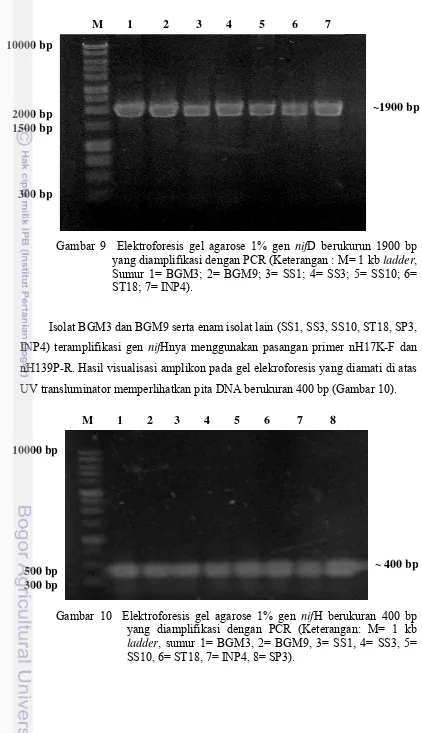
Isolat BGM3 dan BGM9 serta enam isolat lain (SS1, SS3, SS10, ST18, SP3, INP4) teramplifikasi gen nifHnya menggunakan pasangan primer nH17K-F dan nH139P-R. Hasil visualisasi amplikon pada gel elekroforesis yang diamati di atas UV transluminator memperlihatkan pita DNA berukuran 400 bp (Gambar 10).
[image:31.595.93.515.76.809.2]
Gambar 10 Elektroforesis gel agarose 1% gen nifH berukuran 400 bp yang diamplifikasi dengan PCR (Keterangan: M= 1 kb ladder, sumur 1= BGM3, 2= BGM9, 3= SS1, 4= SS3, 5= SS10, 6= ST18, 7= INP4, 8= SP3).
M 1 2 3 4 5 6 7
~1900 bp
~ 400 bp M 1 2 3 4 5 6 7 8
10000 bp
2000 bp 1500 bp
300 bp
10000 bp
500 bp 300 bp
M 1 2 3 4 5 6 7
[image:32.595.100.525.257.750.2]
Produk amplifikasi gen nifD dan nifH disekuen untuk mengetahui urutan nukleotidanya. Sekuen yang diperoleh dianalisis kemiripannya dengan data di GenBank menggunakan program Blast-X. Hasil analisis protein NifD menunjukkan bahwa isolat SS1, SS3, SS10, ST18 homolog dengan Beijerinckia indica subsp. indica ATCC 9039, sedangkan INP4, BGM3, dan BGM9 homolog dengan Xanthobacter autotrophicus Py2 (Tabel 2). Analisis protein NifH memperlihatkan homologi isolat SS1, SS3, SS10, ST18 dengan B. mobilis DSM 2326 dan B. indica subsp. indica ATCC 9039. Sedangkan INP4, BGM3, dan BGM9 homolog dengan uncultured nitrogen fixing bacterium dan SP3 mempunyai homologi dengan BchX (bacteriochlorophyllide reductase)(Tabel 3).
Tabel 2 Hasil analisis sekuen gen nifD dengan menggunakan program BLAST-X
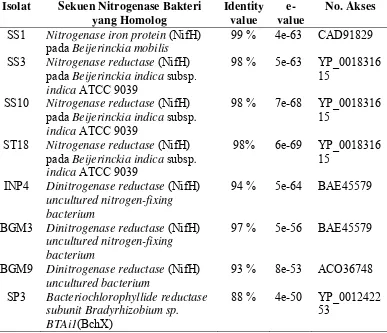
Isolat Sekuen Nitrogenase Bakteri yang Homolog Identity value e-value No. Akses
SS1 Nitrogenase molybdenum-iron protein alpha chain (NifD) pada Beijerinckia indica subsp. indica ATCC 9039
97 % 0.0 YP
001831616 SS3 Nitrogenase molybdenum-iron protein
alpha chain (NifD) pada Beijerinckia indica subsp. indica ATCC 9039
84 % 0.0 YP
001831616 ST18 Nitrogenase molybdenum-iron protein
alpha chain (NifD) pada Beijerinckia indica subsp. indica ATCC 9039
99 % 0.0 YP
001831616 SS10 Nitrogenase molybdenum-iron protein
alpha chain (NifD) pada Beijerinckia indica subsp. indica ATCC 9039
73 % 1e-40 YP
001831616 INP4 Nitrogenase molybdenum-iron protein
alpha chain (NifD) pada Xanthobacter autotrophicus Py2
97 % 0.0 YP
001415005 BGM3 Nitrogenase molybdenum-iron protein
alpha chain (NifD) pada Xanthobacter autotrophicus Py2
95 % 0.0 YP
001415005 BGM9 Nitrogenase molybdenum-iron protein
alpha chain (NifD) pada Xanthobacter autotrophicus Py2
94 % 0.0 YP
Tabel 3 Hasil analisis sekuen gen nifH dengan menggunakan program BLAST-X
Isolat Sekuen Nitrogenase Bakteri yang Homolog Identity value e-value No. Akses
SS1 Nitrogenase iron protein (NifH) pada Beijerinckia mobilis
99 % 4e-63 CAD91829 SS3 Nitrogenase reductase (NifH)
pada Beijerinckia indica subsp. indica ATCC 9039
98 % 5e-63 YP_0018316 15
SS10 Nitrogenase reductase (NifH) pada Beijerinckia indica subsp. indica ATCC 9039
98 % 7e-68 YP_0018316 15
ST18 Nitrogenase reductase (NifH) pada Beijerinckia indica subsp. indica ATCC 9039
98% 6e-69 YP_0018316 15
INP4 Dinitrogenase reductase (NifH) uncultured nitrogen-fixing bacterium
94 % 5e-64 BAE45579
BGM3 Dinitrogenase reductase (NifH) uncultured nitrogen-fixing bacterium
97 % 5e-56 BAE45579
BGM9 Dinitrogenase reductase (NifH) uncultured bacterium
93 % 8e-53 ACO36748 SP3 Bacteriochlorophyllide reductase
subunit Bradyrhizobium sp. BTAi1(BchX)
88 % 4e-50 YP_0012422 53
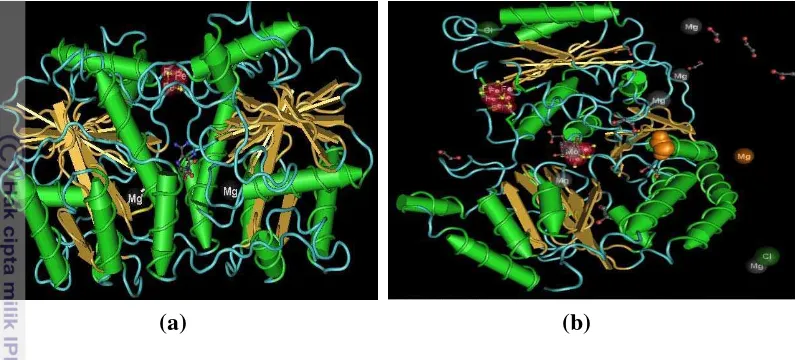
Analisis Conserved Domain (CDD) untuk NifH menunjukkan bahwa protein tersebut termasuk ke dalam superfamili Ras_like_GTPase. Struktur kuartener NifH menunjukkan dua subunit identik, masing-masing subunit terdiri dari lembar beta yang diapit oleh heliks alfa. Terdapat gugus 4Fe-4S ditengah yang menghubungkan kedua subunit serta memiliki dua situs pengikatan Mg-ATP yang terletak di setiap subunit (Gambar 11a). 4Fe-4S adalah donor elektron obligat kepada komplek Fe-Mo atau NifD. NifH mempunyai kemiripan struktural dengan molekul transduksi sinyal seperti G-protein dan ras. Hal ini dapat dilihat dari susunan elemen inti yang sama yaitu (1) lembar beta paralel yang diapit oleh heliks alfa; (2) walker A atau p-loop; (3) dua switch region, switch I dan II (Schlessman et al. 1998).
[image:34.595.113.511.136.316.2]
berada ditengah dan klaster P (8Fe-7S) di luar yang menghubungkan antara subunit alfa dengan subunit beta (Gambar 11b).
Gambar 11 Prediksi struktur tiga dimensi protein (a) NifH: kuning= lembar beta, hijau= heliks alfa, merah= klaster 4Fe-4S dan (b) NifD: kuning= lembar beta, hijau= heliks alfa, A= klaster FeMo-co, B= klaster P.
Penjajaran sekuen asam amino NifH isolat-isolat uji dengan sekuen asam amino NifH bakteri diazotrof yang diambil dari GenBank, menunjukkan daerah-daerah yang konserv. Dari hasil penjajaran sekuen tersebut menunjukkan bahwa NifH mempunyai tiga motif region yang penting dalam fungsi enzim nitrogenase. Ketiga motif region tersebut adalah p-loop atau walker A, switch I, dan switch II (Gambar 12). NifH atau protein Fe mempunyai tiga fungsi utama dalam sistem enzim nitrogenase yaitu sebagai donor elektron obligat untuk protein FeMo atau NifDK, ikut terlibat dalam biosintesis FeMo-co dari protein FeMo, dan terlibat dalam penyisipin FeMo-co. Hasil penjajaran sekuen asam amino NifD juga menunjukkan adanya daerah-daerah yang conserved, diantaranya adalah situs-situs pengikatan klaster FeMo-co dan klaster P (Gambar 13).
(a) (b)
[image:35.842.149.784.78.387.2]
Cys97 Arg100 Cys132
Gambar 12 Penjajaran sekuen asam amino NifH isolat BGM3, BGM9, SS1, SS3, SS10, ST18, INP4, dan SP3 dengan sekuen asam amino NifH bakteri pembanding dari GenBank: 1. Beijerinckia indica subsp. indica ATCC 9039, 2. B. indica subsp. lacticogenes, 3. B. mobilis, 4. Methylocapsa acidiphila B2, 5. Methylocella tundrae, 6. M. palustris, 7. M. silvestris BL2, 8. Bradyrhizobium japonicum, 9. Azospirillum brasilense, 10. Rhodobacter capsulatus. (Keterangan: segitiga terbuka adalah Cys97 dan Cys132 yang merupakan residu pengikatan kalster 4Fe-4S, segitiga tertutup adalah Arg100 yaitu residu yang terlibat dalam penghambatan nitrogenase sebagai respon terhadap ketersediaan ammonium).
p-loop Switch I
[image:37.842.195.792.109.390.2]
lanjutan
Filogeni Isolat berdasarkan NifH, NifD, dan gen 16S rRNA
Analisis filogenetik berdasarkan sekuen asam amino NifH memperlihatkan bahwa isolat SS1, SS3, SS10, ST18, INP4, BGM3, dan BGM9 tergolong dalam kelompok I yang merupakan nitrogenase molibdenum konvensional seperti yang terdapat pada proteobakteria (α, , dan ). Sedangkan isolat SP3 termasuk ke dalam kelompok IV yang terdiri dari nifH dari arkhea dan nifH-like sequences. Isolat SS1, SS3, SS10, dan ST18 satu kelompok dengan Beijerinckia dan berkerabat dekat dengan Methylocapsa acidiphila B2 dengan nilai identitas sebesar 87%. Isolat BGM3 dan INP4 menunjukkan kekerabatan yang sangat dekat dengan nilai identitas 92% dan bersama-sama dengan isolat BGM9 berada dalam satu kelompok dengan Methylocystis echinoides, Azorhizobium caulinodans, dan Bradyrhizobium japonicum. Isolat SP3 berkerabat dekat dengan Rhodobacter capsulatus sebesar 100% (Gambar 14).
Gambar 14 Filogenetik berdasarkan sekuen asam amino NifH isolat metanotrof yang dibandingkan dengan beberapa bakteri diazotrof dengan metode NJ dan bootstrap1000x.
Kelompok I
Kelompok III
Kelompok IV Kelompok II
SS10
Beijerinckia mobilis CAD91829 Beijerinckia derxii subsp. derxii ST18
SS1 SS3
Beijerinckia indica subsp. indica Methylocapsa acidiphila B2 CAD91842
BGM9
Methylocystis echinoides AAO49388 Azorhizobium caulinodans ORS 571 Bradyrhizobium japonicum AAG60754 INP4
BGM3
Methylocystis sp. H9a CAD91844 Burkholderia fungorum CAJ33842
Methylosinus trichosporium CAD91846 Methylosinus trichosporium OB3b Methylocella silvestris BL2 YP 002363879
Methylococcus capsulatus str. Bath Methylococcus capsulatus CAD91850 Rhizobium etli CIAT 652 YP 001984599 Azospirillum brasilense CAA35868
Methylobacter luteus CAD91849 Methylomonas methanica AAK97417
Methylomonas rubra AAO49403 Klebsiella pneumoniae ABG91761 Azotobacter chroococcum AAR11505 Azotobacter vinelandii AAA64709
Rhodobacter capsulatus anfH CAA49624 Azotobacter vinelandii anfH AAA82508 Desulfomicrobium baculatum AAL06265 Clostridium pasteurianum nifH6 CAA30364
Clostridium pasteurianum nifH4 CAA30362 Clostridium pasteurianum nifH1 CAA30359 Clostridium pasteurianum nifH5 CAA30363
Methanobacterium ivanovii CAA30384
Rhodobacter capsulatus bchX CAA77548 SP3
Methanococcus voltae CAA27407
Methanothermococcus thermolithotrophicus
INP4
Xanthobacter autotrophicus Py2
Methylococcus capsulatus str. Bath Methylosinus trichosporium OB3b
Methylocella palustris CAE55883
Sinorhizobium meliloti 1021 AAK65108 Rhizobium sp. A23874
BGM3
Beijerinckia mobilis CAE55877 Beijerinckia indica subsp. indica Methylocapsa acidiphila B2 CAE55881
ST18 SS1
Beijerinckia derxii subsp. venezuelae Methylocella silvestris BL2 YP 002363878
Methylocystis sp. H9a CAE55887 SS10
Methylobacter luteus CAE55888 BGM9
SS3
98
64
95
61 52
24 55
14
13
20
41
[image:40.595.109.504.89.571.2]0.1
Gambar 15 Filogenetik berdasarkan sekuen asam amino NifD isolat metanotrof yang dibandingkan dengan beberapa bakteri diazotrof dengan metode NJ dan bootstrap1000x.
SS1 SS10
Beijerinckia sp. p310-1 GU138101 SS3
ST18
Beijerinckia mobilis DSM 2326 AJ563932 Beijerinckia mobilis AB119200
Beijerinckia derxii subsp. venezuelae Beijerinckia derxii subsp. derxii Beijerinckia indica subsp. lacticogenes
Beijerinckia indica subsp. indica Methylocella silvestris BL2 AJ491847
Methylocella tundrae T4 AJ555244 Methylocapsa sp. KYG FN433469
Methylocella palustris K Y17144 Methylocapsa acidiphila B2 AJ278726 Methylosinus trichosporium SM6 AJ458477
Methylosinus trichosporium Y18947 Methylosinus sporium Y18946
Methylocystis parvus Y18945
Rhodopseudomonas palustris D25312 B.japonicum X87272
Azorhizobium caulinodans LMG 6465 X67221 INP4
Xanthobacter sp. M5C24 HQ025924
Rhodobacter capsulatus ATCC 11166 D16428 Rhodospirillum rubrum D30778
Klebsiella pneumoniae AF130981 Methylomonas methanica S1 AF304196 Methylobacter luteus NCIMB 11914 AF30419 100 100 100 100 100 100 98 44 74 100 95 96 99 64 70 65 96 93 43 91 96 67 100 63 0.02
[image:41.595.106.507.118.803.2]rosea SV97T, Methylocystis parvus 57, dan Methylococcus capsulatus Texas (Astuti 2009).
Gambar 16 Filogenetik berdasarkan sekuen gen 16S rRNA isolat metanotrof yang dibandingkan dengan beberapa bakteri diazotrof dengan metode NJ dan bootstrap 1000x.
Pembahasan
molekul ammonium memiliki kesamaan dengan metan, sehingga enzim MMO dapat mengikat dan bereaksi dengan ammonium. Hal ini disebabkan enzim MMO mempunyai spesifisitas substrat yang luas. Ammonium dapat dioksidasi baik oleh enzim sMMO maupun pMMO dan penambahan ammonium dalam kultur mengakibatkan penurunan laju pertumbuhan bakteri metanotrof yang diuji (Hanson & Hanson 1996).
Oksidasi metan pada isolat BGM1, BGM3, dan BGM9 cenderung meningkat selama inkubasi, akan tetapi terlihat penurunan di titik tertentu. Penurunan tersebut terdeteksi pada jam ke-8 pada kultur isolat BGM1 dan BGM3. Hal ini dapat disebabkan adanya perbedaan saat penginjeksian sampel dan pengukuran per hari menggunakan kromatografi gas. Terdapat parameter-parameter penting yang harus diperhatikan saat pengukuran konsentrasi metan menggunakan kromatografi gas antara lain temperatur dan tekanan saat pengukuran, jumlah sampel yang diinjeksikan, dan standard yang harus diinjeksikan sebelum pengukuran sampel. Temperatur dan tekanan pada saat pengukuran selama periode inkubasi tidak mengalami perubahan yang signifikan yaitu berkisar antara 22-23 °C dan tekanan 763-765 mmHg. Kemungkinan turunnya oksidasi metan pada jam ke-8 disebabkan jumlah penginjeksian sampel yang kurang tepat.
sesuai dengan penelitian Koh et al. (1993) yang melaporkan bahwa metanotrof tipe II genus Methylocystis yaitu M. pyriformis dan M. parvus diketahui tidak mempunyai aktivitas enzim sMMO.
Metanotrof tipe II dan tipe X selain mengoksidasi metan juga mempunyai kemampuan dalam memfiksasi nitrogen menjadi ammonium. Isolat BGM1, BGM3, dan BGM 9 diuji kemampuan fiksasi nitrogennya menggunakan metode langsung dengan menghitung konsentrasi ammonium yang terakumulasi di dalam media NMS bebas nitrat dan ammonium. Hasil yang didapatkan menunjukkan bahwa ketiga isolat tersebut mampu memfiksasi nitrogen menjadi ammonium. Hal ini ditunjukkan dengan adanya ammonium yang terdeteksi di dalam media dan konsentrasinya meningkat selama periode inkubasi. Selain itu kemampuan fiksasi nitrogen juga bisa dilihat dari peningkatan densitas sel yang menggambarkan pertumbuhan bakteri pada media NMS bebas nitrat dan ammonium, padahal apabila tidak ada sumber nitrogen bakteri tidak akan tumbuh. Khadem et al. (2010) mengatakan bahwa bakteri akan berhenti tumbuh ketika jumlah ammonium kurang dari 5 µM. Hal ini mengindikasikan bahwa ketiga isolat mendapatkan sumber nitrogennya dengan cara memfiksasi nitrogen. Kultur isolat BGM 1 mempunyai konsentrasi ammonium dan densitas sel yang tinggi selama inkubasi jika dibandingkan dengan isolat BGM3 dan BGM9. Walaupun konsentrasi ammonium mengalami peningkatan, akan tetapi pada beberapa titik terjadi penurunan seperti pada kultur isolat BGM1 terlihat penurunan konsentrasi ammonium pada hari ke-16. Hal ini kemungkinan ammonium yang dikeluarkan oleh isolat tersebut ke media, sebagian digunakan untuk pertumbuhannya. Peningkatan densitas sel yang rendah selama inkubasi pada isolat BGM3 dan BGM9 menunjukkan pertumbuhan yang sangat lambat yang disebabkan bakteri membutuhkan fase adaptasi yang lama untuk mensintesis enzim nitrogenase. Hal ini karena di dalam media tidak mengandung sumber nitrogen yang dibutuhkan bakteri untuk sintesis protein dan asam-asam amino termasuk enzim.
protein untuk transkripsi, regulatori, dan transduksi sinyal; 39 % protein transpor dan enzim-enzim untuk metabolisme; 16 % protein yang terlibat dalam konversi dan produksi energi; dan 16 %nya lagi belum diketahui fungsinya (Yan et al. 2010). Semua ini mendukung fakta bahwa proses fiksasi nitrogen secara biologis adalah proses yang sangat bergantung energi dan membutuhkan ATP serta tenaga pereduksi dalam jumlah yang besar, sehingga mengakibatkan pertumbuhan bakteri dalam kondisi fiksasi nitrogen ini sangat lambat.
Dua hal utama yang dapat mempengaruhi proses fiksasi nitrogen adalah konsentrasi oksigen dan ammonium. Oksigen adalah repressor penting bagi transkripsi gen nif yang menyandikan nitrogenase, oksigen juga dapat merusak metalocenters dari enzim nitrogenase. Padahal oksigen juga dibutuhkan oleh metanotrof untuk menghasilkan energi yang akan digunakan dalam proses fiksasi nitrogen. Oleh karena itu bakteri metanotrof membutuhkan konsentrasi oksigen yang rendah selama proses fiksasi nitrogen. Konsentrasi oksigen yang bisa ditoleransi oleh bakteri metanotrof berbeda-beda. Metanotrof yang membutuhkan oksigen konsentrasi rendah antara lain: Methylobacter luteus kurang dari 2 % (v/v), Methylocystis T1 kurang dari 6 % (v/v), M. capsulatus Batch kurang dari 10 % (v/v). Namun beberapa metanotrof diketahui bisa memfiksasi nitrogen pada konsentrasi oksigen yang lebih tinggi yaitu Methylosinus trichosporium OB3b pada konsentrasi oksigen 15-17 % (v/v) dan Methylocapsa acidiphila B2T pada konsentrasi oksigen atmosfer (Khadem et al. 2010; Dedysh et al. 2004). Pada penelitian ini isolat BGM1, BGM3, dan BGM 9 ditumbuhkan pada kultur batch tanpa pengaturan konsentrasi oksigen. Akan tetapi ketiga isolat tersebut mampu memfiksasi nitrogen serta mengakumulasi ammonium. Kemungkinan ketiga isolat tersebut mempunyai aktivitas metabolik untuk mengurangi konsentrasi oksigen di dalam sel.
teraktivasi selama kondisi fiksasi nitrogen dan 166 gen termasuk gen untuk global regulation nitrogen (Ntr) dan protein regulator spesifik Nif menjadi tidak aktif setelah diberi shock ammonium selama sepuluh menit. Hal ini karena proses fiksasi nitrogen sangat dikontrol pada level transkripsi dan posttranslasi yang berkaitan dengan respon ketersediaan nitrogen.
Karakterisasi gen nif dilakukan untuk mempelajari karakter gen yang berperan penting dalam proses fiksasi nitrogen tersebut. Gen-gen yang terlibat dalam proses fiksasi nitrogen ini sangat conserved sepanjang sejarah evolusi. Gen yang berperan penting dalam struktural enzim nitrogenase adalah gen nifH dan nifD. Karena sifatnya yang conserved, menyebabkan kedua gen tersebut menjadi alat molekuler yang ideal untuk mendeteksi kemampuan fiksasi nitrogen pada suatu mikroorganisme. Pada penelitian ini selain tiga isolat uji yang telah diketahui mampu memfiksasi nitrogen yaitu BGM1, BGM3, dan BGM9, terdapat enam isolat lain yang akan dikarakterisasi gen nifnya yaitu SS1, SS3, SS10, ST18, INP4, dan SP3. Semua isolat kecuali isolat BGM1 berhasil teramplifikasi gen nifHnya dengan menggunakan pasangan primer nH17K-F dan nH139P-R yang diambil dari publikasi Elbetagy dan Ando (2008). Hasil amplikon menunjukkan pita berukuran sekitar 400 bp. Hal ini sesuai dengan penelitian Elbetagy dan Ando (2008) yang mendapatkan hasil amplifikasi gen nifH berukuran 393 bp pada sampel akar dan batang padi menggunakan pasangan primer yang sama.
kebanyakan diazotrof Alphaproteobacteria dan Gammaproteobacteria berada dalam operon yang sama (nifHDK). Pada isolat SP3, gen nifHnya telah berhasil teramplifikasi namun tidak dengan gen nifDnya. Kemungkinan gen nifH dan nifD isolat SP3 ini tidak terletak dalam satu operon. Pada beberapa Alphaproteobacteria seperti bakteri rhizobia yang tumbuh lambat, gen pengkode enzim nitrogenasenya terpisah dalam dua operon sehingga gen pengkode NifDK ditranskripsikan dari promotor yang berbeda dengan gen pengkode NifH (Dedysh et al. 2004).
Isolat BGM1 pada uji akumulasi ammonium menunjukkan bahwa isolat tersebut mampu memfiksasi nitrogen. Akan tetapi isolat BGM1 tidak berhasil teramplifikasi baik gen nifH maupun gen nifDnya. Hal ini bukan berarti isolat tersebut tidak mempunyai gen nifH dan D yang mengkodekan enzim nitrogenase. Kemungkinan adalah kedua pasang primer yang digunakan tidak dapat mengamplifikasi gen nifH dan D dari isolat BGM1 karena kedua pasang primer tersebut didesain dari isolat-isolat subtropis yang berbeda dengan isolat tropis dari sawah di Indonesia. Primer biasanya didesain dari daerah-daerah conserved pada sekuen nukleotida suatu gen dari spesies tertentu. Pasangan primer nifHD-F dan nifD-R untuk amplifikasi gen nifD yang didesain Dedysh et al. (2004) mengandung sekuen gen nifH dari B. japonicum USDA 110, kemungkinan sekuen nifHD dari isolat BGM1 tidak conserved dan terdapat variasi sehingga tidak bisa teramplifikasi.
9039 dan isolat BGM3, BGM9 serta INP4 homolog dengan NifD dari Xanthobacter autotrophicus Py2.
Hasil penjajaran sekuen asam amino NifH isolat SS1, SS3, SS10, ST18, BGM3, BGM9, INP4, dan SP3 dengan beberapa genus Beijerinckia, Methylocapsa, Methylocystis, Bradyrhizobium, dan Azospirillum memperlihatkan kesamaan yang tinggi. Terdapat motif-motif conserved yaitu situs pengikatan Mg-ATP (p-loop) atau walker A dengan motif GKXXXXKS, region switch I dengan motif CDPKAD, dan switch II atau walker B dengan motif DXXG. Kedua switch region ini penting dalam perubahan konformasi nitrogenase saat hidrolisis ATP. Residu asam amino Cys97 dan Cys132 adalah situs pengikatan klaster 4Fe-4S, sedangkan Arg100 terlibat dalam penghambatan aktivitas nitrogenase sebagai respon adanya ammonium melalui modifikasi pascatranskripsi (Lahiri et al. 2008). Sekuen BchX dengan Rhodobacter capsulatus sebagai sekuen referensinya juga memperlihatkan homologi dengan sekuen-sekuen asam amino NifH. Lahiri et al. (2008) dan Yan et al. (2010) mengatakan bahwa sekuen asam amino NifH dan BchX sangat homolog dengan persentase sebesar 63.8 %, sehingga diduga gen-gen penyandi kedua asam amino tersebut berasal dari gen nenek moyang yang sama kemudian terjadi duplikasi serta perbedaan fungsi sehingga menghasilkan enzim yang digunakan untuk mereduksi substrat yang sangat berbeda.
Penjajaran sekuen asam amino NifD isolat SS1, SS3, SS10, ST18, BGM3, BGM9, dan INP4 yang dibandingkan dengan bakteri Beijerinckia indica subsp. indica, B. mobilis, Methylocella silvestris BL2, dan Xanthobacter autotrophicus Py2 juga memperlihatkan kesamaan sekuen yang tinggi. Residu-residu penting untuk NifD adalah αCys275 dan αHis442 yaitu situs pengikatan klaster FeMo-co dan αCys62, αCys88, αCys154, Cys70, Cys95, Cys153 yang merupakan situs pengikatan klaster P. Klaster FeMo-co merupakan situs aktif pereduksian substrat, sedangkan klaster P berfungsi untuk mentransfer elektron dari klaster 4Fe-4S kepada klaster FeMo-co (Raymond et al. 2004).
isolat-
isolat SS1, SS3, SS10, ST18 berada dalam satu kelompok dengan Beijerinckia dan berkerabat dengan metanotrof tipe II genus Methylocapsa. Beijerinckia merupakan anggota bakteri metilotrof yaitu kelompok bakteri yang dapat menggunakan senyawa C1 sebagai sumber karbon dan energi. Senyawa C1 yang dapat digunakan antara lain metan, metanol, dan metilamin.
Hasil analisis filogenetik berdasarkan sekuen asam amino NifH memperlihatkan bahwa semua isolat kecuali isolat SP3 termasuk ke dalam kelompok I. Bakteri diazotrof yang tergolong ke dalam kelompok I ini berarti memiliki enzim nitrogenase konvensional yang mengandung molibdenum (nifH) atau vanadium sebagai pengganti molibdenum (vnfH). Belum diketahui secara pasti bagaimana membedakan vnfH dari nifH yang berada dalam kelompok yang sama, namun vnfH Azotobacter membentuk kelompok sendiri dalam pohon filogeni yang memungkinkan untuk membedakannya dengan sekuen nifH (Zehr et al. 2003). Selain kelompok I, juga terdapat kelompok II, III, dan IV. Kelompok II adalah nitrogenase yang tidak mengandung molibdenum maupun vanadium tetapi hanya besi saja (anfH) dan juga nitrogenase dari beberapa arkhea. Sekuen nifH dari beberapa diazotrof anaerob obligat, Gram positif, persentase GC rendah seperti Clostridium dan bakteri pereduksi sulfat dikelompokkan dalam kelompok III. Kelompok IV adalah sekuen yang menyerupai nifH dari beberapa arkhea seperti metanogen dan bakteri yang mempunyai gen chlorophyllide reductase (Zehr et al. 2003; Raymond et al. 2004).
terpisah yaitu ptotein X (BchX homodimer) yang homolog dengan protein Fe (NifH homodimer) dan protein YZ (BchY-BchZ heterotetramer) yang homolog dengan protein FeMo (NifD-NifK heterotetramer). Hal ini membuktikan bahwa protein X adalah reduktase spesifik bergantung ATP seperti protein Fe, begitu juga protein YZ menunjukkan adanya situs katalitik untuk mereduksi ikatan ganda cincin Pchlide D sama seperti protein FeMo (Nomata et al. 2006).
Analisis filogenetik berdasarkan NifD memperlihatkan isolat SS1, SS10, dan ST18 juga berada dalam satu kelompok dengan Beijerinckia dan berkerabat dengan Methylocapsa, Methylocella, dan Methylocystis. Isolat INP4 berada dalam klaster yang sama dengan Xanthobacter sama seperti hasil analisis sekuen dengan blastX. Sedangkan filogeni isolat SS3, BGM3, dan BGM9 berbeda dengan hasil blastX. Sebagian besar penelitian yang mempelajari tentang ekologi mikroba sejauh ini terfokus pada deteksi dan analisis sekuen nifH yang mengakibatkan terbatasnya jumlah sekuen gen nifD yang ada di basis data. Sedangkan jumlah sekuen nifH di basis data mengalami peningkatan yang signifikan dan didominasi oleh sekuen-sekuen nifH dari bakteri pemfiksasi nitrogen yang tidak bisa dikulturkan. Dedysh et al. (2004) mengatakan bahwa terbatasnya jumlah sekuen gen nif dari mikroorganisme yang dapat dikulturkan, mengakibatkan sulitnya interpretasi dan menarik kesimpulan dari hasil analisis filogenetik.
isolat-
SIMPULAN DAN SARAN
Simpulan
Ketiga isolat metanotrof BGM1, BGM3, dan BGM9 mampu memfiksasi nitrogen menjadi ammonium dan mengoksidasi metan. Laju akumulasi ammonium tertinggi ditunjukkan oleh isolat BGM1 sebesar 2.77 ± 0.75
μmol/mL/hari. Isolat BGM3 mempunyai laju oksidasi metan tertinggi sebesar 376.79 µmol/mL/hari. Amplifikasi gen nifD dan nifH menggunakan pasangan primer nifHD-F, nifD-R dan nH17K-F, nH139P-R masing-masing menghasilkan amplikon berukuran 1.9 kb dan 400 bp. Berdasarkan sekuen nifD dan nifH isolat SS1, SS3, SS10, dan ST18 mempunyai kemiripan dengan nifD dari B. Indica subsp. indica dan nifH dari B. mobilis. Berdasarkan sekuen nifD isolat INP4, BGM3, dan BGM9 homolog dengan nifD X. autotrophicus Py2, sedangkan berdasarkan sekuen nifH isolat-isolat tersebut homolog dengan nifH dari uncultured nitrogen fixing bacterium. Isolat BGM3, BGM9, SS1, SS3, SS10, ST18, dan INP4 tergolong ke dalam diazotrof kelompok I yaitu mempunyai nitrogenase konvensional dengan molibdenum. Isolat BGM1, BGM3, dan BGM9 merupakan metan