PRODUK FERMENTASI IKAN (BEKASAM)
DESNIAR
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi “Karakterisasi Bakteri Asam Laktat dari Produk Fermentasi Ikan (Bekasam)” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal dan dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Product (Bekasam). Under supervisions of IMAN RUSMANA, ANTONIUS SUWANTO, and NISA RACHMANIA MUBARIK.
Bekasam is an Indonesian fermented fish product that has sour taste and mostly contain lactic acid bacteria (LAB). This study aimed to obtain and characterize LAB isolates from bekasam and to study their potency in inhibiting the growth of pathogenic bacteria, i.e. Escherichia coli, Salmonella typhimurium ATCC 14028, Bacillus cereus, Staphylococcus aureus, and Listeria monocytogenes. LAB were isolated from bekasam using MRSA media supplemented with CaCO3 0.5%. Incubation was done at 37°C for 48 hours. The pure cultures were verified as LAB based on morphological and biochemical characteristics. LAB were obtained, then they were selected for their antimicrobial activity and further the determination of their antimicrobial compounds. Identification for the selected isolates was based on 16S rDNA sequences, followed by production of organic acids. From eight bekasam samples, total of LAB was 1.4 x108-9.0x108 CFU/g. Seventy four isolates were successfully isolated. It was found that 62 isolates (84%) belonged to LAB. Twenty three isolates could inhibit the growth of the five pathogenic bacteria in vitro. The highest inhibition zone was on S. aureus. However, neutralized supernatant of the LAB culture did not inhibit the growth of the pathogenic bacteria. While, cell free supernatant at pH 5 and 6 from 11 isolates did inhibit the growth of the pathogenic bacteria. BI(3), BP(3), BP(20) and SK(5) isolates growed in MRSB medium in vitro, They produced H2O2 concentrations are much smaller than the production of organic acids. The highest of antimicrobial activity was SK(5) isolates. Pellet of protein precipated from fourth isolates showed inhibitory zone against pathogenic bacteria, this inhibition is thought to have come from the bacteriocin, but will need more detailed testing. BI (3), BP (3) and BP (20) isolates showed antimicrobial activity of precipitated protein against E. coli, L. monocytogenes, and S. typhimurium, respectively, with concentration of ammonium sulfate at 40%, 10% and 70-80%, respectively. While SK (5) isolates showed antimicrobial activity only against S. typhimurium with concentration of ammonium sulfat at 40%, 60% and 70%. Molecular identification based on 16S rDNA sequence revealed that BI(3), BP(3), and BP(20) isolates were Pediococcus pentosaceusi IE 3 with similarity of 98%, 97%, and 98%, respectively. While SK(5) isolates showed 93% similarity to Lactobacillus plantarum subsp. plantarum NC 8. Productivity of organic acids from BI(3) isolates was the best than the other three isolates. The dominant organic acid content of BP (3) and SK (5) isolates were lactic acid while the BI (3) and BP (20) isolates were acetic acid. Thus BI (3), BP (3), BP (20) and SK (5) showed antimicrobial activity which could be useful in food preservation.
DESNIAR. Karakterisasi Bakteri Asam Laktat dari Produk Fermentasi Ikan (Bekasam). Dibimbing oleh IMAN RUSMANA, ANTONIUS SUWANTO, dan NISA RACHMANIA MUBARIK.
Indonesia kaya akan produk-produk olahan tradisional. Salah satunya adalah bekasam. Bekasam adalah produk fermentasi ikan yang rasanya asam dan banyak mengandung bakteri asam laktat (BAL). Sebagian besar dari produk fermentasi ikan ini belum dipelajari secara terperinci, sehingga hampir tidak ada laporan ilmiah yang berhubungan dengan bekasam. Tujuan penelitian ini adalah untuk mendapatkan dan mengkarakterisasi BAL asal bekasam dan mengetahui potensinya sebagai penghasil senyawa antimikrob terhadap bakteri patogen yang berhubungan dengan makanan, yaitu Escherichia coli, Salmonella typhimurium ATCC 14028, Bacillus cereus, Staphylococcus aureus dan Listeria monocytogenes.
Sampel bekasam dilakukan analisis kimia (pH, kadar garam dan total asam) dan mikrobiologi (total bakteri aerob dan total bakteri asam laktat). BAL asal bekasam diisolasi dari cawan hasil penghitungan total BAL menggunakan medium MRSA yang ditambah dengan CaCO3 0,5%. Inkubasi dilakukan pada 37°C selama 48 jam. Kultur murni diverifikasi sebagai BAL berdasarkan karakteristik morfologi dan biokimia. BAL yang didapatkan kemudian diseleksi kemampuannya dalam menghasilkan antimikrob menggunakan metode double layer dan difusi sumur agar. Kemudian dipilih 4 isolat dan ditentukan substansi senyawa antimikrob yang dihasilkannya. Identifikasi untuk isolat terpilih berdasarkan pada sekuen 16S rDNA. Terakhir dilakukan produksi total asam dan menentukan kandungan asam organik yang dihasilkan oleh isolat terpilih.
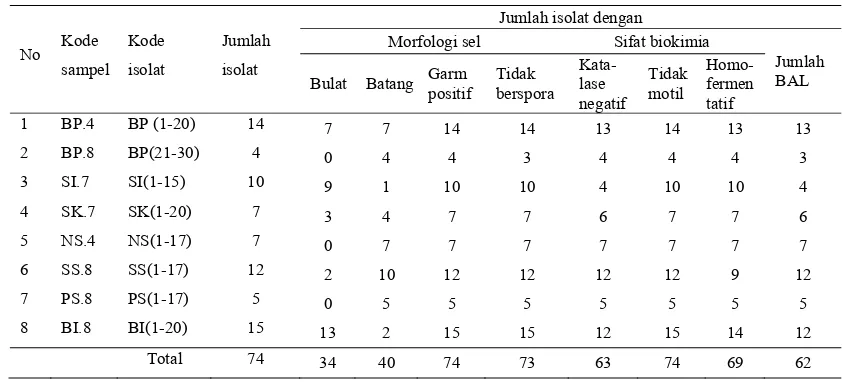
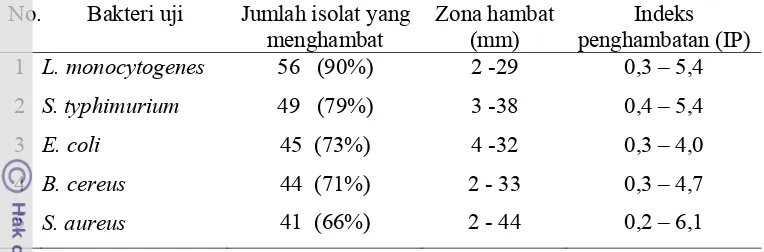
Total BAL dari delapan sampel bekasam ialah 1,4 x 108 – 9,0 x 108 CFU/g. Tujuh puluh empat isolat telah berhasil diisolasi dari bekasam. Ditemukan 62 isolat (84%) termasuk ke dalam kelompok BAL. Duapuluh tiga isolat darinya dapat menghambat kelima bakteri patogen. Indeks penghambatan yang paling besar ialah pada S. aureus. Akan tetapi supernatan bebas sel yang dinetralkan dari kultur BAL tidak menghambat pertumbuhan kelima bakteri patogen. Sedangkan supernatan bebas sel dengan pH 5 dan 6 dari 11 isolat dapat menghambat pertumbuhan bakteri patogen. Hasil ini menunjukkan bahwa penghambatan oleh BAL terhadap bakteri patogen karena asam organik dan selain asam organik yang dihasilkannya.
Isolat BI(3), BP(3), BP(20) dan SK(5) yang ditumbuhkan dalam medium MRSB secara in vitro menghasilkan H2O2 dengan konsentrasi yang jauh lebih kecil daripada produksi asam organik. Aktivitas antimikrob tertinggi pada isolat SK(5). Endapan dari hasil pengendapan protein keempat isolat menghasilkan zona hambat terhadap bakteri patogen, hambatan ini kemungkinan berupa antimikrob peptida atau bakteriosin, akan tetapi perlu pengujian lebih rinci dan mendalam. Isolat BI(3), BP(3) dan BP(20) menunjukkan aktivitas antimikrob dari
endapan proteinnya masing-masing terhadap L. monocytogenes, E. coli, dan S. typhimurium, dengan masing-masing pengendapan pada konsentrasi amonium
merupakan yang pertama dilaporkan tentang BAL pada produk bekasam yang ada di Indonesia dan potensi antimikrobnya.
Identifikasi molekuler berdasarkan sekuen 16S rDNA menunjukkan bahwa isolat BI(3), BP(3) dan BP(20) adalah Pediococcus pentosaceus IE 3 dengan kemiripan masing-masing 98%, 97% dan 98%. Sedangkan isolat SK(5) menunjukkan kemiripan 93% dengan Lactobacillus plantarum subsp. plantarum NC 8.
Produktivitas total asam organik terbaik ialah pada isolat BI(3). Kandungan asam organik yang dominan pada isolat BP(3) dan SK(5) ialah asam laktat sedangkan isolat BI(3) dan BP(20) ialah asam asetat. Dengan demikian isolat BI(3), BP(3), BP(20) dan SK(5) berpotensi untuk digunakan dalam pengawetan makanan.
©Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh Karya tulis dalam bentuk apa pun tanpa izin IPB
DESNIAR
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar
Doktor pada
Program Studi Mikrobiologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji pada Ujian Tertutup : Dr. Ir. Lilis Nuraida, MSc (Staf Pengajar Departemen Ilmu dan Teknologi Pangan, FATETA, IPB)
Dr. Ir. Fitri Fegatella (PT. Charoen Pokphand, Jakarta)
Ikan (Bekasam)
Nama : Desniar
NIM : G361070011
Disetujui Komisi Pembimbing
Dr. Ir. Iman Rusmana, M.Si. Ketua
Prof. Dr. Ir. Antonius Suwanto, M.Sc. Dr. Nisa Rachmania M, M.Si.
Anggota Anggota
Diketahui
Ketua Program Studi Mikrobiologi Dekan Sekolah Pascasarjana
Dr. Ir. Gayuh Rahayu Dr. Ir. Dahrul Syah, M.Sc. Agr.
memberikan rahmat dan karuniaNya, sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Oktober 2009 ini ialah bakteri asam laktat, dengan judul Karakterisasi Bakteri Asam Laktat dari Produk Fermentasi Ikan (Bekasam).
Pada kesempatan ini penulis mengucapkan terima kasih kepada Dr. Ir. Iman Rusmana, M.Si, dan Prof. Dr. Ir. Antonius Suwanto, M.Sc serta Dr. Nisa Rachmania M, M.Si selaku komisi pembimbing yang tak henti-hentinya memberikan masukan, motivasi dan semangat kepada penulis sehingga karya ilmiah ini dapat diselesaikan. Di samping itu, penghargaan penulis sampaikan kepada Ibu Karmawati, Ibu Yauma, dan Ibu Siti para pengolah bekasam di Sumatera Selatan dan Bapak Fakhrul Rozi dan Bapak Nazirin dari DKP Sumatera Selatan serta Ibu Warmi pengolah bekasam di Indramayu, Bu Ika, Alim, Santi dan Barlian yang telah membantu penulis selama pengambilan sampel. Ucapan terima kasih juga penulis sampaikan kepada Bapak Imran di Balai Pengujian Mutu Produk Peternakan, Bogor yang telah membantu penulis dalam penelitian serta Mbak Ari, Pepi, Bu Ema, Bu Butet dan dini serta semua pihak yang telah membantu penulis dalam menyelesaikan penelitian ini. Ucapan terima kasih juga penulis sampaikan kepada teman-teman seperjuangan Pak Puji dan Bu Ratih atas bantuan, semangat dan kebersamaannya. Kepada teman-teman di Departemen THP, FPIK, IPB yang selalu memberi doa, dorongan dan semangat untuk segera menyelesaikan studi S3 ini penulis ucapkan terima kasih atas semuanya. Ungkapan terima kasih yang tak tehingga juga disampaikan kepada Bapak, Ibu, Suami, adikku Eva serta seluruh keluarga atas segala doa dan kasih sayangnya.
Bogor, Agustus 2012
kedua dari pasangan Basri (Almarhum) dan Rohanis. Pendidikan sarjana ditempuh di Program Studi Teknologi Pengolahan Hasil Perikanan, Fakultas Perikanan IPB, lulus pada tahun 1995. Pada tahun 1998, penulis diterima di Program Studi Bioteknologi pada Program Pascasarjana IPB dan menamatkannya pada tahun 2003. Selanjutnya, penulis mendapatkan kesempatan untuk melanjutkan program doktor pada program studi Mikrobiologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor, diperoleh pada tahun 2007 melalui program Beasiswa Pendidikan Pasca Sarjana (BPPS) Direktorat Jenderal Pendidikan Tinggi.
Penulis bekerja sebagai staf pengajar di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan IPB, sejak tahun 1998. Bidang penelitian yang menjadi kompetensi penulis adalah Mikrobiologi dan Bioteknologi Hasil Perairan.
Halaman
Aplikasi BAL dan Senyawa Antimikrob yang Dihasilkannya dalam Pengawetan Makanan ... 29
BAHAN DAN METODE Waktu dan Tempat Penelitian ... 33
Bahan dan Alat ... 33
Prosedur Penelitian ... 30
Analisis Mikrobiologi dan Kimia Sampel Bekasam, Isolasi dan Verifikasi BAL ... 34
Seleksi dan dan Uji Aktivitas Antimikrob yang Dihasilkan oleh BAL ... 37
Penentuan Substansi Antimikrob yang Dihasilkan oleh BAL .... 38
Karakterisasi dan Identifikasi Bakteri Asam Laktat ... 40
Produksi Asam dan Kandungan Asam Organik yang Dihasilkan oleh BAL ... 41
HASIL Bakteri Asam Laktat dari Bekasam ... 43
Aktivitas Antimikrob dari Isolat BAL ... 45
Substansi Senyawa Antimikrob dari BAL ... 46
Karakterisasi dan Identifikasi Isolat BAL ... 50
Substansi Antimikrob dari Isolat BAL ... 66
Karakterisasi dan Identifikasi Isolat BAL ... 71
Produksi Asam Organik dan Aktivitas Antimikrobnya Selama Pertumbuhan ... 77
SIMPULAN DAN SARAN Simpulan ... 85
Saran ... 85
DAFTAR PUSTAKA ... 87
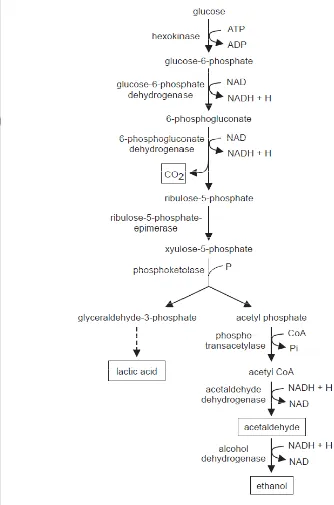
1 Embden–Meyerhof–Parnas pathway yang digunakan oleh BAL
homofermentatif ... 10 2 Jalur fosfoketolase yang digunakan oleh BAL heterofermentatif .. 11 3 Jalur alternatif piruvat ... 13
penyandi 16S rRNA hasil amplifikasi PCR ... 54 18 Dendogram pohon filogenetik isolat BAL dengan bootstrap dan
disejajarkan dengan isolat Genbank ... 55 19 Hubungan perubahan pH dan optical dencity (OD) dengan lama
inkubasi selama 48 jam pertumbuhan pada isolat BI(3), BP(3),
BP(20), dan SK(5) dengan lama inkubasi 48 jam terhadap bakteri uji L. monocytogenes, S. typhimurium, E. coli, B. cereus, dan
S. aureus ... 59
DAFTAR TABEL
Halaman
1 Bakteriosin bakteri asam laktat dan karakteristik utamanya (Parada et al. 2007) ... 22 2 Karakteristik bekasam dengan parameter kimia dan mikrobiologinya 44 3 Jumlah bakteri asam laktat yang diisolasi dari bekasam dengan
karakteristik mofologi dan biokimianya ... 45 4 Kisaran zona hambat dan indeks penghambatan pada masing-
masing bakteri uji ... 46 5 Karakterisasi isolat BI(3), BP(3), BP(20), dan SK(5) ... 52 6 Hasil uji fermentasi gula dengan API 50 CHL ... 53 7 Perbandingan hasil identifikasi menggunakan API 50 CHL dan
sekuen 16S rRNA dari isolat BI(3), BP(3), BP(20) dan SK(5) ... 54 8 Kecepatan pertumbuhan maksimum (µmax) , laju pembentukan
produk (qp) dan waktu generasi (g) isolat BI(3), BP(3), BP(20)
dan SK(50) ... 57 9 Kandungan asam organik setelah inkubasi 48 jam pada isolat BI(3),
BP(3), BP(20), dan SK(5) ... 58
Halaman 1 Kurva standar protein dengan Bovine Serum Albumin (BSA) ... 97 2 Hasil verifikasi isolat BAL ... 97 3 Hasil seleksi dan uji aktivitas antimikrob dengan metode double layer 100 4 Hasil seleksi dan uji aktivitas senyawa antimikrob supernatan tanpa
dinetralkan dan yang dinetralkan dengan metode difusi sumur agar
terhadap lima bakteri uji... 103 5 Hasil seleksi dan uji aktivitas antimikrob dengan perlakuan supernatan
yang tidak dintralkan dan ditetapkan pada pH 5 dan 6 ... 106 6 Pengukuran pH, OD660, konsentrasi asam laktat, dan konsentrasi
H2O2 pada kultur MRSB dari empat isolat BAL setelah inkubasi 24, 48, dan 72 jam ... 108 7 Gambar zona hambat dari keempat isolat dengan inkubasi 24, 48 dan
72 jam terhadap L. Monocytogenes ... 108 8 Hasil uji API KIT CHL 50 pada isolat BI(3), BP(3), BP(20) dan SK(5) dengan lama inkubasi 48 jam ... 109 9 Pertumbuhan dan pembentukan produk asam pada keempat isolat
PENDAHULUAN
Latar Belakang
Indonesia kaya akan produk-produk indigineous olahan tradisional. Salah satunya adalah bekasam. Bekasam merupakan produk fermentasi ikan Indonesia yang rasanya asam, banyak dikenal di daerah Jawa Tengah, Sumatera Selatan dan Kalimantan Selatan. Proses pembuatan bekasam umumnya masih menggunakan proses fermentasi secara spontan dengan bahan baku ikan air tawar, garam dan sumber karbohidrat seperti nasi atau tape dengan lama fermentasi sekitar 4-10 hari. Sebagian besar dari produk fermentasi ikan ini belum dipelajari secara terperinci, sehingga hampir tidak ada laporan ilmiah yang berhubungan dengan bekasam.
Bakteri asam laktat (BAL) merupakan mikroorganisme dominan yang ditemukan dalam produk fermentasi ikan (Ostergaard et al. 1998). BAL memainkan peran penting di dalam fermentasi makanan yang menyebabkan perubahan aroma dan tekstur bersamaan dengan pengaruh pengawetan dengan hasil peningkatan daya awet pada produk akhir (Hugas 1998). Bakteri asam laktat ini mempunyai potensi besar dalam menghasilkan senyawa antimikrob. Sebagaimana yang telah dilaporkan bahwa BAL dapat memproduksi beberapa metabolit yang mempunyai aktivitas sebagai antimikrob seperti asam organik (asam laktat dan asetat), hidrogen peroksida, diasetil dan bakteriosin (Ross et al. 2002, Diop et al. 2007, Galvez et al. 2007).
(Paludan-Muller et al. 1999). Weissella cibaria 110 (plaa-som) menghasilkan bakteriosin yang dikenal sebagai weissellicin 110 (Srionnual et al. 2007), dan plantaricin W yang dihasilkan oleh Lactobacillus plantarum PMU33 (som-fak) (Noonpakdee et al. 2009).
Bakteriosin yang berasal dari BAL atau BAL yang menghasilkan bakteriosin secara umum dianggap aman untuk konsumsi manusia. Oleh karena itu bakteriosin dari BAL berpotensi sebagai pengawet makanan alami (biopreservatif). Hugas (1998) menyatakan bahwa saat ini sistem biopreservatif seperti kultur BAL bakteriosinogenik dan/atau bakteriosinnya telah diterima dan dikembangkan sebagai pendekatan baru untuk mengendalikan mikroorganisme patogen dan pembusuk.
Selain menghasilkan bakteriosin BAL juga berpotensi menghasilkan senyawa antimikrob lain seperti asam organik (terutama asam laktat), diasetil dan hidrogen peroksida. Berbagai jenis asam organik beserta komponennya digunakan sebagai bahan tambahan pangan (food additives) yang dapat dimasukkan secara langsung pada makanan manusia. Asam organik ini faktanya adalah preservatif yang paling umum digunakan dalam makanan, memiliki status GRAS (generally recognized as safe), dan memiliki spektrum yang luas sebagai agen antibakteri. Asam organik efektif untuk mengawetkan makanan karena selain aktivitas antibakteri, mereka juga bertindak sebagai penambah rasa asam (acidulants) (Theron & Lues 2011).
Beberapa bakteri asam laktat memproduksi H2O2 dalam kondisi pertumbuhan aerobik. H2O2 adalah bahan pengoksidasi yang kuat dan dapat bersifat antimikrob terhadap bakteri, jamur, dan virus (juga bakteriofag). Dalam kondisi anaerobik, sangat sedikit H2O2 yang diharapkan akan dihasilkan oleh galur tersebut (Ray 2004).
tetapi pada tahun 1995 pernah dilaporkan bahwa di USA 85% asam laktat digunakan dalam makanan dan aplikasi yang berkaitan dengan makanan (Theron & Lues 2011).
Asam laktat adalah produk akhir yang banyak dari fermentasi karbohidrat oleh BAL. Akan tetapi, dapat dihasilkan secara komersial dengan sintesis kimia dan fermentasi. Sintesis kimia menghasilkan campuran dari dua isomer sedangkan selama fermentasi bentuk murni optik dari asam laktat dihasilkan. Kira-kira 90% total asam laktat dunia diproduksi dengan fermentasi bakteri. Total nilai pasar asam organik pada tahun 2009 sebesar 3 juta $ (Theron & Lues 2011).
Akan tetapi informasi aspek mikrobiologi fermentasi bekasam masih terbatas karena belum dipelajari secara terperinci dan hampir tidak ada laporan ilmiah yang behubungan dengan bekasam khususnya bekasam hasil olahan dari pengolah lokal yang ada di Indonesia. Oleh karena itu perlu dilakukan penelitian untuk mengetahui dan mendapatkan isolat BAL dari bekasam dan menggali potensinya dalam menghambat pertumbuhan bakteri patogen yang berhubungan dengan makanan.
Tujuan Penelitian
Tujuan penelitian secara umum ialah untuk mendapatkan BAL asal bekasam dan mengetahui potensinya sebagai penghasil senyawa antimikrob terhadap bakteri patogen yang berhubungan dengan makanan. Secara khusus, tujuan penelitian ini adalah sebagai berikut:
1. Mengisolasi dan menyeleksi BAL dari bekasam sebagai penghasil antimikrob. 2. Memproduksi dan mengkarakterisasi substansi senyawa antimikrob yang
dihasilkan oleh isolat BAL asal bekasam.
3. Mengkarakterisasi dan mengidentifikasi isolat BAL terpilih secara morfologis, fisiologis dan genetik.
Manfaat Penelitian
TINJAUAN PUSTAKA
Bakteri Asam Laktat dalam Fermentasi
Bakteri asam laktat (BAL) umumnya didefinisikan sebagai kelompok penghasil asam laktat, %G+C rendah, tidak berspora, Gram positif batang dan kokus, bersifat fermentatif, katalase negatif, anaerob fakultatif, tidak motil dan toleran terhadap asam. Bakteri asam laktat dibedakan dari bakteri Gram positif lain yang juga menghasilkan asam laktat (seperti, Bacillus, Listeria, dan Bifidobacterium) berdasarkan atas sejumlah perbedaan (Hutkins 2006), antara lain sebagian besar mesofilik, tetapi ada beberapa yang dapat tumbuh pada suhu 4 oC atau suhu tinggi (45 oC), pH pertumbuhan 4,0–4,5, tetapi galur tertentu dapat toleran dan tumbuh pada pH di atas 9,0 atau pH rendah 3,2 (Bamforth 2005).
Ada 16 genus BAL, 12 diantaranya aktif di dalam konteks makanan (Bamforth 2005). Bakteri asam laktat biasanya diketahui aman berdasarkan status yang diberikan oleh Generally Regarded As Safe (GRAS), dan mempunyai peran penting dalam pengawetan makanan dan produk fermentasi. Bakteri ini dapat digunakan sebagai mikrobiota kompetitif alami atau sebagai kultur starter spesifik di bawah kondisi yang terkendali (Cintas et al. 2001; Papagianni et al. 2006). Bakteri asam laktat mempunyai potensi yang besar untuk digunakan dalam biopreservasi karena bakteri ini aman untuk dikonsumsi dan selama penyimpanan bakteri ini secara alami mendominasi mikrobiota dari beberapa makanan (Stiles 1996).
enzim seperti enzim malolaktik, proteolitik, peptidolitik, glikosidase, pendegradasi polisakarida, urease, fenoloksidase, dan lipase (Matthews et al. 2004).
Bakteri asam laktat digunakan dalam makanan fermentasi karena kemampuannya untuk melakukan metabolisme gula dan membuat produk akhir asam laktat dan asam yang lainnya. Ada dua jalur fermentatif, yaitu homofermentatif dan heterofermentatif. Jalur homofermentatif, lebih dari 90% substrat gula di ubah menjadi asam laktat. Berlawanan dengan jalur heterofermentatif menghasilkan kurang lebih 50% asam laktat dan 50% sebagai asam asetat, etanol dan karbon dioksida. Bakteri asam laktat mempunyai satu atau dua jalur ini (yaitu obligat homofermentatif atau obligat heterofermentatif), meskipun ada beberapa spesies yang mempunyai metabolisme yang memerlukan keduanya (fakultatif homofermentatif) ( Ross et al. 2002; Hutkins 2006).
Kelompok homofermentatif terdiri dari Lactocococcus, Pediococcus, Enterococcus, Streptococcus dan beberapa Lactobacillus menggunakan Embden– Meyerhof–Parnas pathway untuk merubah 1 mol glukosa menjadi 2 mol laktat. Sedangkan bakteri heterofermentatif menghasilkan jumlah laktat, CO2, dan etanol dengan molar yang sama dari glukosa menggunakan jalur heksosa monophosphat atau pentose, dan menghasilkan hanya setengah energi dari kelompok homofermentatif. Anggota kelompok ini meliputi Leuconostoc, Weissella dan beberapa Lactobacillus (Ross et al. 2002).
Bakteri asam laktat homofermentatif sering digunakan dalam pengawetan makanan karena memproduksi asam laktat dalam jumlah besar dan mampu menghambat bakteri penyebab kebusukan makanan dan bakteri patogen lainnya, sedangkan bakteri heterofermentatif lebih ditujukan kepada pembentukan flavor dan komponen aroma, seperti asetaldehida dan diasetil (Fardiaz 1989).
(digunakan dalam fermentasi susu), L. mesenteroides subsp. mesenteroides dan Leuconostoc kimchii (digunaka dalam fermentasi sayuran), O. oeni (digunakan dalam fermentasi anggur) dan Lactobacillus sanfranciscensis (digunakan dalam roti sourdough) (Hutkins 2006).
Isolasi BAL dari produk fementasi telah banyak dilakukan. Bakteri ini ada secara alami dengan mikroorganisme lain dan bertanggungjawab untuk pengasaman dan pematangan. Selain itu ada khamir dan bakteri lain juga diisolasi, akan tetapi jumlahnya lebih sedikit daripada BAL. Bakteri asam laktat paling banyak tersebar luas dan merupakan mikroorganisme yang diinginkan dalam fermentasi makanan. Bakteri ini mengubah karbohidrat yang ada menjadi asam laktat, dengan jumlah asam asetat yang kecil, menghasilkan penurunan pH (Tanasupawat & Visessanguan 2008).
Kelly et al. (1996) telah melakukan isolasi BAL dari berbagai bentuk makanan yang dijual siap saji (daging, ikan dan produk susu), dan isolat penghasil bakteriosin yang khusus ditemukan dalam produk ini adalah spesies Lactobacillus dan Leuconostok. Sedangkan pada produk buah dan sayuran sebagian besar isolat penghasil bakteriosin yang ditemukan adalah Lactococcus.
Coventry et al. (1997) juga telah melakukan isolasi BAL dari 72 sampel produk susu dan daging diperoleh 663.533 koloni, yang terdeteksi rata-rata 0,2% penghasil bakteriosin. Isolasi juga dilakukan terhadap 40 sampel ikan dan sayuran diperoleh 83.000 koloni yang terdeteksi rata-rata 3,4 % penghasil bakteriosin. Isolat penghasil bakteriosin dikarakterisasi dengan reaksi biokimia dan dengan profil enzim restriksi DNA dan identifikasi taksonomi menunjukkan spesies Lactobacillus, Carnobacterium dan Lactococcus berdasarkan pada sekuen 16S rDNA.
laktat ini menghasilkan spektrum enzim yang luas dan menunjukkan aktivitas galaktosidase, leusine-acrylamidase dan phosphatase yang tinggi.
Bakteri asam laktat juga telah ditemukan sebagai mikroorgansime dominan dalam beberapa produk fermentasi ikan (Ostergaard et al. 1998), seperti telah diisolasi di dalam fish sauce, yaitu Lactobacillus sp. (Ijong & Ohta 1995), L. acidipiscis dan Weissella thailandensis (Tanasupawat et al. 2000), Tetragenococcus halophilus dan Tetragenococcus muriaticus (Thongsanit et al. 2002) dan Lactobacillus dan Lactococcus lactis (Miao-xia et al. 2009). Selain BAL dalam fish sauce di Thailand (nam-pla) juga ditemukan archaea ekstrim halofilik, Halobacterium salinarum (Thongthai et al. 1992) dan bakteri ekstrim halofilik, Lentibacillus halophilus sp.nov (Tanasupawat et al. 2006).
Isolasi BAL dari dari produk fermentasi ikan plaa-som di Thailand juga
telah dilakukan oleh Paludan-Muller et al. (2002), yaitu P. pentosaceus, L. alimentarius/farciminis, Weisella confusa, L. plantarum dan Lactococcus
garviae. Selain itu BAL juga telah telah diisolasi dari bahan baku dan selama proses fermentasi som-fak oleh Paludan-Muller et al. (1999), meliputi Lactococcus lactis subsp. lactis, Leuconostoc citreum, L. paracasei subsp. paracasei, Weisella confusa,L. plantarum, L. pentosus dan P. pentosaceus.
Tanasupawat et al. (1998) menyatakan bahwa ada 47 galur BAL homofermentatif berbentuk batang dan 5 heterofermentatif bentuk bulat yang diisolasi dari 4 jenis fermentasi ikan (pla-ra, pla-chom, kung-chom dan hoi-dong). Diop et al. (2007) telah berhasil mengisolasi 220 galur BAL dari 32 sampel makanan fermentasi tradisional di Sinegal.
Metabolisme Karbohidrat oleh BAL
hanya menggunakan jalur 6-PG/PK dan BAL fakultatif heterofermentatif mempunyai kemampuan untuk menggunakan kedua jalur (Aarnikunnas 2006).
Tahap pertama glikolisis adalah fosforilasi glukosa menjadi fruktosa 1,6-difosfat (FDP) dan memisahkannya menjadi dihidroksiasetonfosfat (DHAP) dan giseraldehid-3-fosfat (GAP), (bentuk DHAP juga dirubah menjadi GAP). GAP kemudian dirubah menjadi piruvat melalu jalan yang meliputi dua tahap fosforilasi level substrat. Terakhir, piruvat direduksi menjadi asam laktat oleh laktat dehidrogenase (LDH) menggunakan NADH sebagai kofaktor. Dalam glikolisis reduksi kofaktor NADH adalah dioksidasi ulang menjadi NAD+ dan kemudian kesetimbangan redoks dihasilkan (Gambar 1). Dalam glikolisis (jalur Embden-Meyerhof-Parnas), dibawah kondisi normal, yaitu gula tidak dibatasi dan oksigen dibatasi, satu molekul glukosa secara teori difermentasi menjadi dua molekul asam laktat yang menghasilkan perolehan bersih dua molekul ATP (adenosin trifosfat) (Axelsson 2004).
Gambar 2 Jalur fosfoketolase yang digunakan oleh BAL heterofermentatif (Hutkins 2006).
bagian bahwa jalur 6-PG/PK. Fermentasi pentosa menghasilkan produk akhir yang berbeda dibandingkan dengan fermentasi heksosa melalui jalur 6-PG/PK. Tidak ada tahap dekarboksilasi yang dibutuhkan dan tidak ada CO2 yang terbentuk. Karena reaksi dehidrogenasi tidak diperlukan dalam reaksi yang menghasilkan produk perantara silulosa-5-fosfat, redukasi asetil fosfat menjadi etanol menjadi berlebihan. Sebaliknya asetil fosfat digunakan oleh enzim asetat kinase dalam suatu tahap fosforilasi level substrat menghasilkan asetat dan ATP. Fermentasi pentosa menghasilkan produksi jumlah molar yang sama dari asam laktat dan asam asetat (Axelsson 2004).
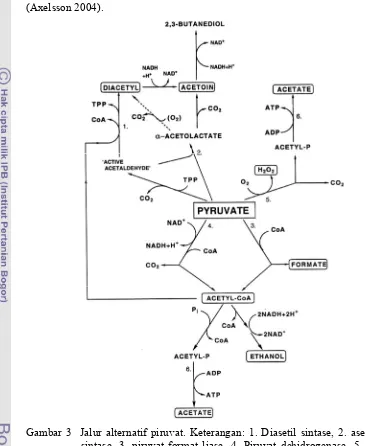
BAL diketahui mampu merubah metabolismenya dalam merespon berbagai macam kondisi, yang mengakibatkan pola produk akhirnya berbeda daripada yang tampak dengan fermentasi glukosa dibawah kondisi normal. Piruvat mempunyai posisi kunci dalam fermentasi dimana mampu menghasilkan NAD+ supaya melanjutkan fermentasi. Tergantung pada kondisi tertentu, piruvat dapat digunakan dalam cara laternatif lain daripada mereduksinya menjadi laktat (Gambar 3). Kemampuan menggunakan jalur piruvat yang berbeda ini adalah spesifik galur (Hutkin 2006, Axelsson 2004).
dengan jumlah maksimum pada penurunan kecepatan pertumbuhan menurun, yaitu pada dilution rate yang lebih rendah dalam kultur kontinius (Axelsson 2004).
Gambar 3 Jalur alternatif piruvat. Keterangan: 1. Diasetil sintase, 2. asetolaktat sintase, 3. piruvat-format liase, 4. Piruvat dehidrogenase, 5. Piruvat oksidase dan 6. Asetat kinase (Axelsson 2004).
tersedia untuk reaksi laktat dehidrogenase. Secara khusus, piruvat dapat berfungsi sebagai substrat untuk α-asetolaktat sintase untuk membentuk α-asetolaktat. Asetolaktat kemudian lebih jauh dioksidasi untuk membentuk diasetil, yang memiliki sifat aroma yang diinginkan (Hutkins 2006).
Fermentasi Ikan : Bekasam
Selain pengeringan, fermentasi adalah metode pengawetan yang paling tua didunia. Fermentasi menjadi populer dengan gambaran peradaban karena tidak hanya mengawetkan makanan tetapi juga memberikan bermacam-macam rasa, bentuk, dan sensasi rasa lainnya. Perlahan orang menyadari nilai nutrisi dan terapeutik dari makanan dan minuman fermentasi yang membuat makanan fermentasi saat ini menjadi lebih populer (Prajapati & Nair 2003).
Sebagai sebuah proses, fermentasi terdiri atas transformasi sederhana bahan baku menjadi produk yang memiliki nilai tambah dengan menggunakan fenomena pertumbuhan mikroorganisme dan/atau aktivitasnya pada bermacam-macam substrat. Ini berarti bahwa pengetahuan tentang mikroorganisme menjadi penting untuk memahami proses fermentasi (Prajapati & Nair 2003). Makanan fermentasi terus menerus popular, karena beberapa alasan, yaitu dapat meningkatkan daya awet, nilai nutrisi, fungsionalitas dan sifat-sifat organoleptik, unik serta dapat meningkatkan nilai ekonomi (Hutkins 2006).
Makanan fermentasi mengandung bermacam-macam komponen fungsional yang berasal dari bahan atau yang terbentuk selama fermentasi.
Keuntungan makanan fermentasi yang dapat mendukung kesehatan yaitu (Tanasupawat & Visessanguan 2008):
1. Meningkatkan digestibility (daya cerna) 2. Meningkatkan bioavailability
3. Meningkatkan kandungan mikronutrisi seperti, vitamin dan kofaktor 4. Sifat-sifat probiotik dan prebiotik
5. Produk mikrob seperti, enzim, metabolit dan bioaktif peptida yang dikeluarkan setelah pencernaan protein makanan secara enzimatik.
penggaraman, pemindangan, pengeringan dan pengasapan. Fermentasi ikan menggunakan garam dengan konsentrasi tinggi untuk menyeleksi mikrob tertentu dan menghambat pertumbuhan mikrob yang menyebabkan kebusukan sehingga hanya mikrob tahan garam yang hidup. Jenis mikrob yang ada sangat menentukan senyawa-senyawa yang terbentuk dalam produk fermentasi. Akan tetapi fermentasi ikan dengan menggunakan sumber karbohidrat seperti bekasam, pada umumnya membutuhkan garam dalam jumlah yang rendah dibandingkan dengan fermentasi yang menggunakan ikan dan garam saja (Murtini et al. 1997).
Produk fermentasi ikan Indonesia memiliki bentuk, bahan baku dan tipe fermentasi yang beragam serta umumnya masih menggunakan proses fermentasi secara spontan. Sebagian besar dari produk fermentasi ikan ini belum dipelajari secara terperinci, oleh karena itu informasi ilmiah yang berhubungan dengan produk tersebut sulit ditemukan.Studi lanjut dengan mengidentifikasi BAL yang terlibat dalam fermentasi disarankan untuk meningkatkan kualitas produk yang dapat dicapai dengan penggunaan BAL yang terpilih (Irianto & Irianto 2009).
Bekasam merupakan salah satu produk olahan fermentasi ikan yang rasanya asam, banyak dikenal di daerah Sumatera Selatan dan Kalimantan Selatan. Bahan baku yang digunakan dalam pembuatan bekasam pada umumnya ialah ikan air tawar, garam dan bahan tambahan berupa karbohidrat seperti nasi, tepung tapioka, beras sangrai dan tape ketan. Hasil fermentasi inilah yang akan menjadi bahan pengawet ikan dan memberikan rasa aroma yang khas. Bahan makanan ini biasanya dibumbui lagi dengan cabai dan gula, sebelum disajikan sebagai lauk-pauk (Murtini et al. 1997).
baru ditiriskan dan diberi nasi, kemudian dimasukkan kedalam plastik, diikat dan disimpan dalam wadah tertutup misalnya toples/tong, setelah itu difermentasi selama kurang lebih satu minggu (Irianto & Irianto 2009).
Burongisda adalah produk sejenis bekasam yang berasal dari Philipina. Burongisda ini dibuat dari campuran ikan air tawar, nasi, garam dan angkak (beras merah sebagai pewarna). Proses fermentasi burongisda berlangsung selama satu minggu sampai daging ikan menjadi lembut serta rasa dan bau asam mulai berkembang. Bakteri asam laktat yang dominan pada produk ini ialah Leuconostoc mesenteroides, Pediococcus cereviciae, dan Lactobacillus plantarum (Olympia 1992).
Som-fak, plaa-som, pla-ra dan pla-chom ialah produk sejenis bekasam yang berasal dari Thailand. Som-fak adalah produk fermentasi yang terdiri atas fillet ikan, garam (2-5 %), nasi (2-12 %), dan irisan bawang putih (4 %) yang dicampur dan dibungkus dengan daun pisang atau kantong plastik kemudian difermentasi pada suhu 30 oC selama 2-5 hari. Mikroflora yang akan mendominasi yaitu BAL. Lactococcus lactis subsp.lactis, Leuconostoc citreum, Lactobacillus paracasei subsp. paracasei, Weisella confusa, Lactobacillus plantarum, Lactobacillus pentosus dan Pediococcus pentosaceus telah diisolasi dari bahan baku dan selama proses fermentasi som-fak (Paludan-Muller et al. 1999).
Plaa-som terdiri dari ikan air tawar, garam, nasi dan bawang putih Bakteri asam laktat yang diisolasi dari produk ini ialah Pediococcus pentosaceus, Lactabacillus alimentarius/farciminis, Weisella confusa, L. plantarum dan Lactococcus garviae (Paludan-Muller et al. 2002). Kopersumb et al. (2006) juga mengisolasi bakteri asam laktat dari produk plaa-som, yaitu Lactobacillus spp., Pediococcus spp., Aerococcus spp., Cornobacterium spp. dan Enterococcus spp.
Pla-ra dan pla-chom ialah produk fermentasi ikan yang terdiri atas ikan, garam, dan tepung nasi panggang akan tetapi pada pla-chom ditambah dengan bawang putih (Tanasupawat & Visessanguan 2008). Lactobacillus acidipiscis sp. nov dan Weissella thailandensis sp. nov telah
Senyawa Antimikrob yang Dihasilkan oleh BAL
Karena metabolisme fermentatifnya, BAL menghasilkan asam organik, yaitu substansi antimikrob yang penting. Substansi antimikrobial lainnya yang dihasilkan BAL adalah hidrogen peroksida, CO2, diasetil dan bakteriosin (Ouwehand & Vesterlund 2004)
Asam Organik. Asam organik merupakan sunstansi antimikrob yang telah digunakan paling lama dan paling luas dan telah menyediakan suatu keamanan dalam pengawetan makanan (Ouwehand & Vesterlund 2004). Ross et al. (2002) menyimpulkan dari beberapa laporan bahwa beberapa asam organik seperti asam laktat, asetat dan propionat dihasilkan sebagai produk akhir yang memberikan lingkungan asam sehingga tidak menguntungkan untuk pertumbuhan beberapa mikroorganisme patogen dan pembusuk. Pengaruh antimikrob dari asam organik umumnya mengganggu potensial membran sel, menghambat transpor aktif, mengurangi pH intraseluler, dan penghambatan bermacam-macam fungsi metabolik. Asam organik mempunyai aksi yang luas dan dapat menghambat bakteri Gram positif dan Gram-negatif, khamir dan kapang.
Asam organik lemah memiliki sejarah yang cukup panjang sebagai pengawet makanan karena sifat aktivitas antibakterinya. Asam organik ini faktanya adalah preservatif yang paling umum digunakan dalam makanan, berstatus GRAS, memiliki spektrum yang luas sebagai bahan antibakteri. Asam organik sangat efektif untuk mengawetkan makanan karena selain aktivitas antibakteri, mereka juga bertindak sebagai penambah rasa asam (acidulants). Asam organik dapat mengurangi pertumbuhan bakteri dengan menurunkan pH dari produk makanan ke tingkat yang dapat menghambat pertumbuhan bakteri (Theron & Lues 2011).
Menurut Alakomi et al. (2000) bahwa sifat antimikrob asam laktat karena rendahnya pH. Asam laktat pada konsentrasi 5mM atau pH 4 dapat menyebabkan gangguan pada permeabilitas membran luar bakteri Escherichia coli O157:H7, Pseudomonas aeruginosa, and Salmonella enterica serovar typhimurium.
4,9 untuk asam propionat dan 3,8 untuk asam laktat. Dengan demikian, sebagian besar pH makanan (5.0 dan di atasnya), fraksi tak terdisosiasi dari ketiga asam ini bisa sangat rendah, dan paling rendah adalah untuk asam laktat. Efektivitas antimikrob asam laktat lebih rendah mungkin karena pKanya rendah (Ray 2004).
Setiap bakteri memiliki ketahanan masing-masing terhadap jenis asam organik yang berbeda. L. monocytogenes memiliki kerentanan yang lebih besar terhadap asam laktat dibandingkan dengan asam asetat. E. coli dan S. typhimurium memiliki kerentanan yang tinggi terhadap asam laktat dan asam asetat. B. cereus yang merupakan golongan bakteri Gram positif memiliki kerentanan yang tinggi terhadap asam laktat dan asam propionat (Theron & Lues 2011). Charlier et al. (2009) menyatakan bahwa S. aureus akan bertambah rentan terhadap asam apabila terjadi peningkatan kadar garam. Bakteri S. aureus juga sangat peka terhadap aktivitas asam asetat.
Hidrogen Peroksida. Beberapa BAL menghasilkan H2O2 di bawah kondisi pertumbuhan aerob dan karena kekurangan katalase selular, pseudokatalase atau peroksidase, BAL ini melepaskannya ke dalam lingkungan untuk mencegah dirinya sendiri dari antimikrobnya. Beberapa galur BAL dapat memproduksi H2O2 pada kondisi pertumbuhan yang cocok. H2O2 cukup menyebabkan bakteriostatik (6-8 µg/ml) tapi jarang bersifat bakterisidal (30-40 µg/ml). Hidrogen peroksida merupakan agen pengoksidasi kuat dan dapat menjadi antimikroba terhadap bakteri, jamur dan virus (juga bakteriofage). Pada kondisi anaerob, sangat sedikit H2O2 yang dapat dihasilkan dari strain ini. Aksi antibakteri ini dihasilkan dari sifat pengoksidasi kuat dan kemampuannya untuk merusak komponen selular, khususnya membran. Karena sifat oksidasinya, maka dapat menyebabkan efek yang tidak diinginkan dalam mutu pangan, seperti diskolorasi pada daging yang diproses, sehingga penggunaannya terbatas dalam pengawetan pangan (Ray 2004). Aktivitas H2O2 terhadap bakteri Gram positif, termasuk BAL, umumnya bakteristatik, sedangkan beberapa bakteri Gram negatif lebih cepat terbunuh (Ouwehand & Vesterlund 2004).
ganda. Bentuk ini membuat lingkungan anaerob dan CO2 dalam lingkungannnya sendiri mempunyai aktivitas antimikrob. Mekanisme aktivitas ini tidak diketahui, tetapi dinytakan bahwa dekarboksilasi secara enzimatik dihambat dan bahwa akumulasi CO2 di lipid bilayer menyebabkan disfungsi permeabilitas membrane. Pada konsentrasi rendah CO2 dapat merangsang pertumbuhan beberapa mikroorganisme sedangkan pada konsentrasi tinggi dapat mencegah pertumbuhan. Karena aktivitas antimikrobnya, CO2 sekarang umum digunakan sebagai komponen dari modified atmosphere packages. Bakteri Gram negatif dilaporkan lebih sensitif terhadap CO2 daripada bakteri Gram positif (Ouwehand & Vesterlund 2004).
Diasetil. Diasetil dihasilkan oleh beberapa spesies BAL dalam jumlah yang banyak terutama melalui metabolism sitrat. Beberapa studi menunjukkan bahwa diaseti bersifat antibakteri terhadap bakteri Gram positif dan Gram negatif. Bakteri Gram negatif lebih sensitif pada pH 5,0 atau lebih rendah. Diasetil efektif pada konsentrasi 0,1 - 0,25%. Studi terakhir menunjukkan bahwa kombinasi dengan panas, diasetil lebih bakterisidal daripada digunakan sendiri. Aksi antimikrobnya dihasilkan oleh penginaktifan beberapa enzim penting. Grup dikarboksil (-CO-CO-) bereaksi dengan arginin dalam enzim dan memodifikasi situs katalitiknya (Ray 2004). Diasetil dihasilkan oleh spesies dan galur dari genus Lactobacillus, Leuconostoc, Pediococcus, dan Streptococcus sama seperti organism lainnya. Ketika heksosa dimetabolisme, pembentukan diasetil akan ditekan. Akan tetapi, asetil dapat diproduksi lebih jika sitrat dimetabolisme. Sitrat dirubah melalui piruvat menjadi diasetil (Ouwehand & Vesterlund 2004).
Galvez et al. (2007) menyatakan bahwa bakteriosin dari BAL atau BAL yang menghasilkan bakteriosin secara umum dianggap aman untuk konsumsi manusia dan dan dapat diaplikasikan dalam pengawetan makanan. Penggunaan bakteriosin dalam industri makanan dapat membantu untuk mengurangi penambahan pengawet kimia sama seperti mengurangi intensitas perlakuan panas, dan pada akhirnya akan menghasilkan makanan yang lebih awet secara alami dan lebih kaya akan sifat-sifat organoleptik dan nutrisinya.
Bakteriosin yang dihasilkan oleh bakteri asam laktat telah banyak diisolasi dan dipelajari, antara lain ialah plantaricin D dihasilkan oleh Lactobacillus plantarum BFE 905 (Franz et al. 1998); amylovorin L471 dihasilkan oleh Lactobacillus amylovorus DCE 471 (Callewaert el al. 1999); propionicin T1 yang dihasilkan oleh Propionibacterium thoenii (Faye et al. 2000); sakacin G yang dihasilkan oleh Lactobacillus sake 251 (Simon et al. 2002); lactococcin Q yang dihasilkan oleh Lactococcus lactis QU 4 (Zendo et al. 2007); lacticin Q yang dihasilkan oleh Lactococcus lactis QU 5 (Fujita et al. 2007); paraplantaricin C7 yang dihasilkan oleh Lactobacillus paraplantarum C7 (Lee et al. 2007); weisellicin cibaria 110 yang dihasilkan oleh Weissella cibaria 110 yang diisolasi dari produk fermentasi ikan Thai plaa-som (Srionnual et al. 2007), plantaricin W yang dihasilkan oleh Lactobacillus plantarum PMU33 yang diisolasi dari produk fermentasi ikan som-fak (Noonpakdee et al. 2009) dan plantaricin ASM1 yaitu
bakteriosin baru yang dihasilkan oleh Lactobacillus plantarum A-1
(Hata et al. 2010).
Diop et al. (2007) menyatakan bahwa dari total 220 galur BAL yang diisolasi dari 32 sampel makanan fermentasi tradisional di Sinegal diperoleh dua penghasil bakteriosin terbaik, Lactococcus lactis subsp. lactis dan Enterococcus faecium, dari 12 isolat penghasil bakteriosin yang telah diidentifikasi berdasarkan pada analisis sekuens 16S rDNA. Bakteriosin yang dihasilkan oleh kedua isolat baru ini menunjukkan aktivitas antimikrob terhadap Listeria monocytogenes dan Bacillus coagulans sedangkan yang dihasilkan oleh Lactococcus lactis hanya mempunyai aktivitas terhadap Bacillus cereus.
aman; (ii) tidak aktif dan tidak beracun bagi sel eukariot; (iii) tidak aktif oleh enzim protease, mempunyai sedikit pengaruh pada mikrobiota lambung; (iv) biasanya toleran terhadap pH dan panas; (v) mempunyai spektrum antimikrob yang relatif luas terhadap beberapa patogen yang berasal dari makanan dan bakteri pembusuk; (vi) model aksi antibakterialnya berlangsung pada membran sitoplasma bakteri: tidak resisten silang dengan antibiotik, dan (vii) determinan genetiknya biasanya disandikan oleh plasmid (Galvez et al. 2007).
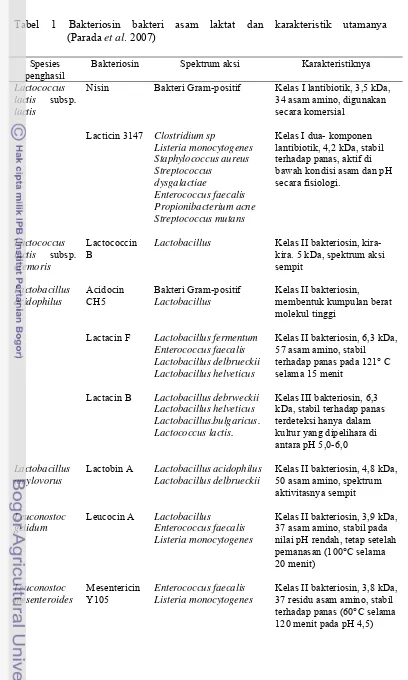
Bakteriosin dari BAL diklasifikasikan ke dalam empat kelas berdasarkan strukturnya, yaitu kelas I, II, III dan IV. Kelas I dan II adalah bakteriosin dengan berat molekul kecil, terutama hidrofobik dan merupakan peptida tahan panas. Kelas I disebut juga lantibiotik, yaitu dimodifikasi pascatranslasi, sedangkan Kelas II, bakteriosin non-lantibiotik, yang dibagi dalam tiga subkategori: Kelas IIa adalah bakteriosin seperti pediosin dengan pengaruh antilisteria yang kuat; Kelas IIb bakteriosin yang mengandung dua peptida, keduanya dibutuhkan untuk aktivitas antimikrob penuh dan Kelas IIc bakteriosin yang disekresikan oleh sec-dependent mechanism. Kelas III adalah bakteriosin dengan berat molekul yang besar, protein yang labil terhadap panas. Kelas IV adalah bakteriosin kompleks, yang terdiri atas separuh protein dan ditambah satu atau lebih tambahan yang bukan protein, seperti gugus lemak atau karbohidrat yang dibutuhkan untuk aktivitas (De Vuyst & Leroy 2007). Parada et al. (2007) telah mengumpulkan dari beberapa hasil penelitian bahwa ada sejumlah bakteriosin dari BAL yang berbeda yang diklasifikasikan berdasarkan karakteristik biokimia dan genetiknya (Tabel 1). Bakteriosin BAL kelas I dan II yang paling banyak dipelajari, karena kedua kelas ini yang paling berlimpah dan kandidat yang paling menonjol untuk
aplikasi industri (Moncheva 2001).
Tabel 1 Bakteriosin bakteri asam laktat dan karakteristik utamanya (Parada et al. 2007)
Spesies penghasil
Bakteriosin Spektrum aksi Karakteristiknya
Lactococcus lactis subsp. lactis
Nisin Bakteri Gram-positif Kelas I lantibiotik, 3,5 kDa, 34 asam amino, digunakan secara komersial
Lacticin 3147 Clostridium sp
Listeria monocytogenes
Kelas I dua- komponen lantibiotik, 4,2 kDa, stabil terhadap panas, aktif di bawah kondisi asam dan pH secara fisiologi.
Lactobacillus Kelas II bakteriosin, kira-kira. 5 kDa, spektrum aksi sempit
Lactacin F Lactobacillus fermentum Enterococcus faecalis Lactobacillus delbrueckii Lactobacillus helveticus
Kelas II bakteriosin, 6,3 kDa, 57 asam amino, stabil terhadap panas pada 121° C selama 15 menit
Lactacin B Lactobacillus debrweckii Lactobacillus helveticus Lactobacillus.bulgaricus. Lactococcus lactis.
Kelas III bakteriosin, 6,3 kDa, stabil terhadap panas terdeteksi hanya dalam kultur yang dipelihara di antara pH 5,0-6,0
Lactobacillus amylovorus
Lactobin A Lactobacillus acidophilus Lactobacillus delbrueckii
Kelas II bakteriosin, 4,8 kDa, 50 asam amino, spektrum aktivitasnya sempit
Leuconostoc gelidum
Leucocin A Lactobacillus
Enterococcus faecalis Listeria monocytogenes
Kelas II bakteriosin, 3,9 kDa, 37 asam amino, stabil pada nilai pH rendah, tetap setelah pemanasan (100°C selama
Lanjutan Tabel 1 Bakteriosin bakteri asam laktat dan karakteristik utamanya (Parada et al. 2007)
Spesies penghasil
Bakteriosin Spektrum aksi Karakteristiknya
Pediococcus acidilactici
Pediocin F Bakteri Gram-positif Kelas II bakteriosin, 4,5 kDa, sensitif terhadap enzim proteolitik, resisten terhadap panas dan pelarut organik, aktif di bawah kisaran pH yang luas
Pediocin PA-1
Listeria monocytogenes Kelas II bakteriosin, 4,6 kDa, 44 asam amino
Pediocin AcH
positif dan Gram-negatif
Bakteri di bawah kondisi stress
Kelas II bakteriosin, 4,6 kDa, 44 asam amino, spektrum aksi luas
Pediococus pentosaceous
Pediocin A Lactobacillus Lactococcus
Kelas II bakteriosin, 2,7 kDa, sensitif terhadap enzim proteolitik dan stabil terhadap panas (10 menit 100°C)
Enterococcus faecium
Enterocin A Listeria monocytogenes Pediococcus
Kelas II bakteriosin, 4,8 kDa, 47 residu asam amino, stabil terhadap panas
Lactobacillus sake
Lactocin S Lactobacillus Leuconostoc Pediococcus
Kelas I bakteriosin, 3,7 kDa, aktif antara pH 4,5 dan 7,5
Sakacin P Listeria monocytogenes Kelas II bakteriosin, 4,4 kDa, stabil terhadap panas
Lactobacillus curvatus
Curvacin A Listeria monocytogenes Enterococcus faecalis
Kelas II bakteriosin, 4,3 kDa
Lactobacillus helveticus
Helveticin J Lactobacillus bulgaricus Lactococcus lactis
Isolasi Bakteriosin
Bakteriosin disekresikan ke dalam medium kultur, oleh karena itu sebagian besar strategi dimulai dengan tahap pemekatan bakteriosin dari supernatan kultur, dengan beberapa metode seperti pengendapan dengan amonium sulfat, metode adsorpsi-desorpsi dan ekstraksi dengan pelarut organik (etanol atau aseton) (Pingitore et al. 2007).
Bakteriosin merupakan protein alami sehingga dapat dikonsentratkan dengan aplikasi metode salting-out, menggunakan amonium sulfat. Dalam prosedur ini garam padat ditambahkan ke dalam sampel secara perlahan sampai persentase amonium sulfat jenuh yang diinginkan tercapai (Pingitore et al. 2007).
Salting out sangat tergantung kepada hidrofobisitas protein, sedangkan salting tergantung pada distribusi serangan permukaan dan interaksi polar dengan pelarut. Tipe protein dalam larutan mempunyai bidang hidrofobik pada permukaannya. Gaya ini kontak dengan pelarut cairan yang menyebabkan suatu tingkatan molekul air, secara efektif membekukannya disekitar rantai sisi (Scopes 1994) (Gambar 4).
Gambar 4 Tingkatan molekul air di sekitar residu hidrofobik pada permukaan suatu protein.
biasanya paling tinggi pada pH sekitar 7. Kelarutan protein umumnya menurun apabila terjadi peningkatan suhu. Aplikasi penting dari prosedur salting out tidak hanya untu sampel fraksionasi, akan tetapi juga mnekonsentratkannya. Salting out dengan penambahan amonium sulfat yang cukup untuk mengendapkan semua protein adalah satu cara yang efisien dilakukan ini, menyediakan sampel tidak terlalu encer untuk dimulai (Scopes 1994).
Metode adsorpsi-desorpsi dikembangkan oleh Yang et al. (1992) bersandarkan pada sifat beberapa bakteriosin untuk mengadsorpi sel penghasil pada pH netral dan diikuti dengan ekstraksi pada pH rendah (pH 2-2,5). Akan tetapi aktivitas bakteriosin dengan metode ini tidak lebih dari 10%. Namun satu keuntungan metode ini ialah kontaminasi proteinnya lebih rendah dibandingkan dengan pengendapan menggunakan ammonium sulfat. Pengembangan metode adsorpsi-desorpsi dilakukan oleh Coventry et al. (1996) dengan cara bakteriosin diekstrak dari media fermentasi dengan mengadsorpsi ke dalam Micro-Cel (bahan antilengket diatomite kalsium silikat yang food grade) kemudian dilanjutkan desorpsi dengan pelarut organik, surfaktan, bufer fosfat dan bahan pengkelat. Tingkat desorpsi yang paling tinggi (100 %) dicapai dengan peningkatan konsentrasi surfaktan.
protein-protein kaya akan residu hidrofobik yang lokasinya disekitar membran (protein plasma) (Scopes 1994).
Mekanisme Antimikrob yang Dihasilkan oleh BAL
Aksi antimikrob dari asam organik lemah dihasilkan oleh kombinasi aksi dari molekul tidak terdisosiasi dan ion yang disosiasi. Mekanisme penghambatan pertumbuhan bakteri oleh asam organik diawali ketika asam lemah ditambahkan ke dalam lingkungan (dalam makanan), tergantung pada pH makanan, pK asam, dan suhu, beberapa molekul disosiasi dan molekul tidak terdisosiasi. Pada pH sebagian besar makanan (pH 5-8), molekul asam organik biasanya dalam bentuk disosiasi, akibatnya [H+] dalam lingkungan (makanan) meningkat, hal ini mempengaruhi gradien proton transmembran sel mikrob. Untuk mengatasi ini, sel akan mentranspor proton melalui pompa proton, yang menyebabkan kehabisan energi dan penurunan pH internal. Struktur pada permukaan sel, membran luar atau dinding sel, membran dalam atau membran sitoplasma, dan periplasma juga dikenai oleh [H+]. Hal ini dapat berpengaruh merugikan ikatan ion makromolekul yang kemudian dapat mempengaruhi struktur tiga dimensinya dan beberapa fungsi terkait. Secara keseluruhan perubahan ini dapat mempengaruhi transpor nutrisi dan pembangkitan energi, dann akhirnya mempengaruhi pertumbuhan mikrob (Ray 2004).
Asam organik lemah yang digunakan dalam makanan bervariasi keefektifan antimikobnya karena perbedaan pKa-nya. Asam dengan pK yang lebih tinggi secara proposional jumlah molekul tidak terdisosiasi lebih tinggi pada pH makanan dan lebih bersifat antimikrob. Sama halnya pada pH yang lebih rendah dan konsentrasi yang lebih tinggi suatu asam lebih bersifat antimikrob. Kelarutan asam dalam air juga penting untuk pengaruh yang diinginkan (Ray 2004).
Aktivitas terhadap bakteri Gram positif, termasuk BAL, adalah umumnya bakteristatik, sedangkan beberapa Gram negatif dibunuh dengan cepat (Ouwehand & Vesterlund 2004).
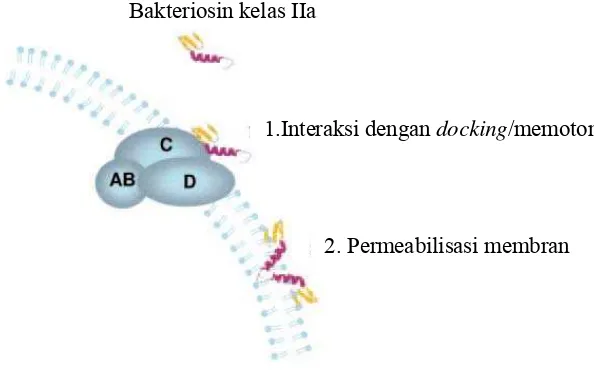
Mekanisme penghambatan oleh bakteriosin ada dua tahap. Tahap pertama, bakteriosin berinteraksi dengan struktur permukaan sel, seperti membran dan/atau molekul reseptor. Tahap kedua bakteriosin membuat permeabilisasi membran melalui pembentukan lubang (Gambar 5). Pengikatan awal dipengaruhi oleh komposisi membran, muatan membran, dan adanya struktur molekul target
(reseptor). Tahap kedua dipengaruhi oleh komposisi membran, struktur C-terminal pada bagian membran yang terpermeabilisasi dan adanya protein
imunitas (Drider et al. 2006).
Gambar 5 Skema dua tahap yang terlibat dalam mekanisme aksi dari bakteriosin klass IIa (Drider et al. 2006).
Bakteriosin memiliki mekanisme aksi yang berbeda diantaranya: perubahan aktivitas enzim; penghambatan germinasi spora dan menginaktifkan pembawa anion melalui pembentukan pore (lubang) selektif dan tidak selektif (Parada et al. 2007).
Sebagian besar bakteriosin adalah amphiphilik dan kationik. Berdasarkan karakteristik amphiphiliknya bakteriosin, ada dua mekanisme berbeda yang dapat menerangkan aksi permeabilisasi membrannya. Bakteriosin beraksi dengan satu komplek porasi dimana monomer bakteriosin berikatan, menyisip dan
Bakteriosin kelas IIa
1.Interaksi dengan docking/memotong
beroligomer dalam membran sel membentuk lubang dengan permukaan residu hidrofilik pada sisi dalam dan permukaan residu hidrofobik dari daerah hidrofobik molekul fosfolipid dalam interior membran (Drider et al. 2006). Hal yang sama juga disampaikan oleh Cleveland et al. (2001) bahwa terjadinya interaksi elektrostatik antara molekul bakteriosin yang bermuatan positif dengan grup fosfat bermuatan negatif pada membran sel diduga berkontribusi dalam memulai pengikatan dengan membran target. Asosiasi bagian hidrofobik bakteriosin dengan hidrofobik membran yang akhirnya membentuk lubang.
Beberapa bakteriosin (seperti: nisin) aktif pada sel dan lipid bilayer, sedangkan yang lain meliputi lactococcin A, lactacin F dan pediocin PA-1 hanya aktif pada seluruh sel atau vesicle (gelembung) membran, yang membutuhkan reseptor untuk menggunakan aksi antimikrobnya. Sampai saat ini, tidak ada reseptor bakteriosin yang diidentifikasi, juga tidak ada domain aktif dari molekul bakteriosin yang diidentifikasi sebagai situs pengikatan reseptor (Rotriguez et al. 2002). Hal yang sama dan sedikit berbeda juga dinyatakan oleh Eijsink et al. (1998) bahwa pada bakteriosin kelas I, nisin tidak membutuhkan reseptor pada membran sel, karena nisin mengenali komposisi fosfolipid sel. Lactococin A dan lactoestrepcin membutuhkan pengikatan terhadap reseptor spesifik. Pada bakteriosin kleas IIa, daerah ujung amino berperan penting didalam kemampuannya mengenali komponen membran sel dan mereka beraksi terhadap permeabilisasi membran dari sel targetnya. Sebaliknya Ennahar et al. (2000) menyatakan bahwa studi model aksi dari bakteriosin ini menunjukkan bahwa aktivitas antimikrob tidak membutuhkan suatu reseptor spesifik dan aktivitas antimikrob ditingkatkan dengan menentukan potensial membran.
Bakteriosin dapat memiliki mekanisme aksi bakterisidal atau bakteriostatik pada sel sensitif, dan perbedaan ini secara umum dipengaruhi oleh beberapa faktor seperti dosis bakteriosin dan tingkat purifikasinya serta kondisi fisiologi sel indikator dan kondisi percobaan (Cintas et al. 2001).
digerakkan oleh pH dan komposisi fosfolipid. Monomer bakteriosin membentuk kumpulan protein yang menghasilkan pembentukan lubang dengan konsekuensi kehilangan ion (terutama kalium dan magnesium), kehilangan proton motive force, serta keluarnya ATP dan asam amino. Proton motive force mempunyai peran pokok dalam mensintesis ATP, transpor aktif dan pergerakan sel; oleh karena itu sintesis makromolekul terhambat, sama seperti produksi energi, yang akhirnya mengakibatkan kematian sel (Bruno & Montville 1993)
Aplikasi BAL dan Senyawa Antimikrob yang Dihasilkannya dalam Pengawetan Makanan
Hidrogen peroksida dengan konsentrasi 6 - 8 µg/ml dapat menyebabkan bakteriostatik, tetapi aksi bakterisidal jarang (30 - 40 µg/ml). Hidrogen peroksida adalah bahan pengoksidasi kuat dan dapat bersifat antimikrob terhadap bakteri, jamur, dan virus (juga bakteriophage). Hidrogen peroksida diperbolehkan pada bahan baku susu refrigerasi dan bahan telur cair (25 ppm) untuk mengontrol bakteri pembusuk dan patogen. Sebelum pasteurisasi, katalase (0,1- 0,5 g/1000 lb [455 kg] ) ditambahkan untuk menghilangkan residu H2O2 (Ray 2004).
Asam organik dapat diaplikasikan pada bahan makanan seperti daging, permen, buah-buahan, sayuran, susu dan produk susu, soft drink, sport drink, dan lain-lain. Contohnya Salmon slices diberi perlakuan dengan garam organik yang berbeda juga mengandung jumlah bakteri penghasil H2S yang lebih rendah selama penyimpanan. Penghambatan bakteri ini secara sempurna telah dilaporkan juga pada fillet ikan cod segar setelah aplikasi penyemprotan 10% buffer asetat selama penyimpanan 12 hari pada suhu 7oC (Theron & Lues 2011).
Beberapa bakteriosin BAL memiliki aplikasi yang potensial dalam pengawetan makanan. Penggunaan bakteriosin dalam industri makanan dapat membantu mengurangi penambahan pengawet kimia sama dengan pengurangan intensitas perlakuan panas, yang dapat menghasilkan makanan lebih awet secara alami dan lebih kaya dengan sifat-sifat organoleptik dan nutrisi. Hal ini dapat menjadi satu alternatif untuk mencukupi peningkatan permintaan konsumen untuk keamanan makanan, fresh-tasting, ready-to-eat, makanan dengan proses yang minimal dan juga untuk pengembangan produk makanan ‘baru’ (seperti sedikit asam atau dengan kandungan garam yang lebih rendah). Penggunaan secara komersial yang sudah ada adalah nisin dan pediosin PA-1/AcH, bakteriosin lain (seperti lactisin 3147, enterosin AS-48 atau variasin) juga memiliki perspektif yang menjanjikan (Galvez et al. 2007).
Bakteriosin dengan spektrum luas memiliki potensi lebih luas, sedangkan bakteriosin dengan spektrum sempit dapat digunakan lebih spesifik untuk secara selektif menghambat bakteri tertentu yang sangat berbahaya dalam makanan seperti Listeria monocytogenes tanpa mempengaruhi mikrobiota yang tidak berbahaya. Bakteriosin dapat ditambahkan ke makanan dalam bentuk konsentrat
makanan, atau dapat dihasilkan in situ dengan starter bakteriosigenik, penambah dan pencegah kultur (Hugas 1998; Chen & Hoover 2003; Galvez et al. 2007).
Bakteriosin yang diimobilisasi dapat juga ditemukan aplikasinya untuk
pengembangan pengemasan makanan yang mengandung bioaktif (Galvez et al. 2007). Scannella et al. (2000) menyatakan bahwa imobilisasi nisin
dan lacticin 3147 pada bahan pengemas mampu mergurangi Listeria innocua sebesar ≥2 log unit pada produk keju dan daging babi dan Staphylococcus aureus
sebesar ~1.5 log unit pada keju dan ~2.8 log unit pada daging babi. Iseppi et al. (2008) juga malakukan penelitian terhadap Enterocin 416K1, yang
dihasilkan oleh Enterococcus casseliflavus IM 416K1, yang dijebak dalam pelapis hybrid organik–anorganik yang diaplikasikan pada film LDPE (low-density polyethylene) untuk pengemas makanan. Semua perlakuan yang diberi enterocin-activated coatings mempunyai aktivitas anti-listeria yang bagus. Selama evaluasi antibakteri secara quantitatif jumlah sel L. monocytogenes menurun 1.5 log unit dibandingkan kontrol. Semua sampel makanan yang dikemas dengan film significant menurunkan jumlah sel L. monocytogenes selama 24 jam dibandingkan dengan kontrol.
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Oktober 2009 - April 2012, bertempat di Laboratorium Mikrobiologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam dan Laboratorium Mikrobiologi Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor, Bogor.
Bahan dan Alat
Bahan baku yang digunakan pada penelitian ini adalah produk fermentasi ikan, yaitu bekasam. Bahan baku diperoleh dari Panganjang, Kabupaten Indramayu (Jawa Barat), Indralaya dan Desa Sungai Pasir, Kabupaten Ogan Komiring Ilir, dan Kayu Agung, Kabupaten Ogan Ilir (Sumatera Selatan). Bakteri indikator yang digunakan untuk pengujian aktivitas antimikrob meliputi Escherichia coli, Salmonella typhimurium ATCC 14028, Bacillus cereus, Staphylococcus aureus, dan Listeria monocytogenes.
Media yang digunakan untuk analisis mikrobiologi dan pertumbuhan BAL serta untuk uji aktivitas adalah Plate Count Agar (PCA), Nutrient Agar (NA), Nutrien Broth (NB), Man Rogosa Sharpe Agar (MRSA), Man Rogosa Sharpe Broth (MRSB), Mueller Hinton Agar (MHA) dan Sulfid Indol Motility (SIM). Bahan kimia yang digunakan untuk analisis adalah kalium khromat 5 %, AgNO3 0,1 N, Lugol, kristal ungu, Paradimethylanilin Oxalat 1 g, alkohol96 %, safranin, malacite green, 3 % H2O2, 3 % KOH, NaOH, CaCO3, K2HPO4, KH2PO4. Medium CHL 50 (Carbohydrate, Lactobacillus), mineral oil serta bahan-bahan untuk isolasi DNA dan untuk PCR.
Prosedur Penelitian
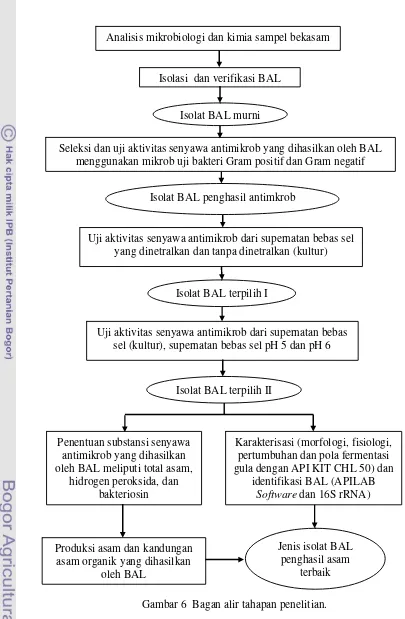
Penelitian ini terdiri atas 5 tahapan, yaitu: (1) analisis mikrobiologi dan kimia sampel bekasam, isolasi dan verifikasi BAL, (2) seleksi dan uji aktivitas senyawa antimikrob yang dihasilkan oleh BAL, (3) Penentuan substansi antimikrob yang dihasilkan oleh BAL, (4) Karakterisasi dan identifikasi isolat BAL, dan (5) Produksi asam dan kandungan asam organik yang dihasilkan oleh BAL. Diagram alir tahapan penelitian dapat dilihat pada Gambar 6.
Analisis Mikrobiologi dan Kimia Sampel Bekasam, Isolasi, dan Verifikasi BAL
Delapan sampel bekasam diambil langsung dari pengolah lokal skala kecil di 4 lokasi. Kedelapan sampel dilakukan analisis mikrobiologi meliputi penghitungan total mikrob aerob dan total bakteri asam laktat, dan analisis kimia meliputi pengukuran pH, kadar NaCl dan kadar asam laktat sampel bekasam.
Gambar 6 Bagan alir tahapan penelitian. Analisis mikrobiologi dan kimia sampel bekasam
Isolasi dan verifikasi BAL
Seleksi dan uji aktivitas senyawa antimikrob yang dihasilkan oleh BAL menggunakan mikrob uji bakteri Gram positif dan Gram negatif
Karakterisasi (morfologi, fisiologi, pertumbuhan dan pola fermentasi gula dengan API KIT CHL 50) dan
identifikasi BAL (APILAB Software dan 16S rRNA) Penentuan substansi senyawa
antimikrob yang dihasilkan oleh BAL meliputi total asam,
hidrogen peroksida, dan bakteriosin
Uji aktivitas senyawa antimikrob dari supernatan bebas sel yang dinetralkan dan tanpa dinetralkan (kultur)
Uji aktivitas senyawa antimikrob dari supernatan bebas sel (kultur), supernatan bebas sel pH 5 dan pH 6
Produksi asam dan kandungan asam organik yang dihasilkan
oleh BAL
Isolat BAL murni
Isolat BAL penghasil antimkrob
Isolat BAL terpilih I
Isolat BAL terpilih II
Jenis isolat BAL penghasil asam
Jumlah koloni per gram sampel = Jumlah koloni per cawan x
Pengukuran pH, Total Asam, dan Kadar Garam (NaCl). Pengukuran pH menggunakan pH meter. Kadar garam dan asam laktat menggunakan metode titrasi.
Pengukuran total asam (AOAC 1995) dilakukan dengan cara sebanyak 10 gram sampel bekasam dihancurkan dengan menggunakan mortar. Sampel yang telah homogen dilarutkan dengan akuades dalam gelas piala sampai tanda tera 100 ml. Kemudian sampel didiamkan selama 30 menit dan diaduk. Larutan yang berisi sampel tersebut disaring dan di pipet sebanyak 10 ml untuk dimasukkan ke dalam beaker glass, ke dalam larutan tersebut ditambahkan 2-3 tetes fenoftalein dan dititrasi dengan NaOH 0,1 N sampai warna berubah menjadi merah muda. Persentase total asam yang terbentuk dihitung berdasarkan rumus :
% Total asam =
x 100%
Keterangan:
V NaOH = Volume NaOH yang terpakai
N NaOH = Normalitas NaOH yang terukur (0,1091) FP = Faktor Pengencer (1)
Bobot sampel = 1000 mg 90 = BM Asam laktat
Pengukuran kadar garam (NaCl) dari sampel ditetapkan berdasarkan metode Mohr (AOAC 1995). Sebanyak 5 g sampel dimasukkan ke dalam cawan porselin untuk diabukan pada suhu 600 oC selama 12 jam. Abu yang diperoleh tersebut dilarutkan dengan aquades sampai volumenya mencapai 100 ml dan kemudian disaring. Hasil dari penyaringan tersebut dipipet sebanyak 10 ml ke dalam beaker glass 50 ml, kemudian ditambahkan 3 ml K2CrO4 (kalium khromat) 5 %. Beaker glass dititrasi dengan larutan perak nitrat (AgNO3) 0,2 N. Titik akhir titrasi tercapai setelah terbentuk endapan perak khromat (Ag2CrO4) yang berwarna oranye atau jingga. Rumus yang digunakan untuk menghitung kadar NaCl yaitu:
Keterangan:
V AgNO3 = jumlah perak nitrat yang dibutuhkan dalam titrasi (ml)
N AgNO3 = Normalitas AgNO3 adalah 0,1 N
FP = faktor pengenceran 58,5 = bobot setara NaCl
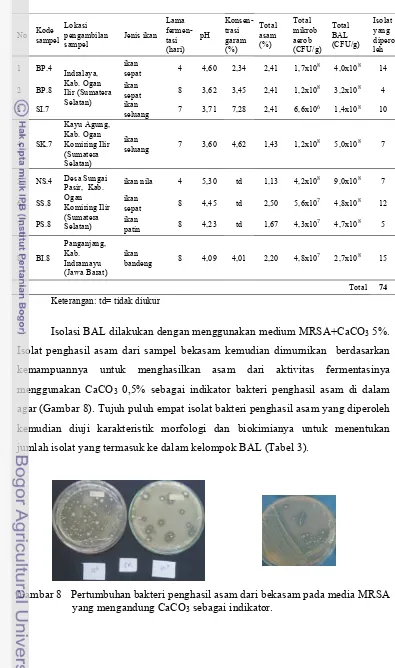
Isolasi dan Verifikasi BAL. Isolasi BAL dilakukan dari hasil penghitungan total BAL dengan memilih 20-30 koloni. Isolasi menggunakan metode cawan gores menggunakan medium MRSA ditambah dengan CaCO3 0,5 %. Kemudian diinkubasi dengan kondisi mikroerofilik pada suhu 37oC selama 48 jam. Isolat murni dilakukan verifikasi untuk menentukan bahwa isolat termasuk kedalam kelompok BAL. Verifikasi meliputi pewarnaan Gram, bentuk sel, motilitas, uji katalase, pewarnaan spora, produksi gas dari glukosa dengan menggunakan MRSB yang ditambah 1 % glukosa yang mengandung tabung durham yang dibalikkan pada 37oC selama 48 jam. Isolat BAL disimpan dalam media MRSB yang mengandung gliserol 20% (v/v) dan disimpan di dalam freezer (Tanasupawat et al. 1998, Paludan-Muller et al. 2002, Kopermsub et al. 2006, Veljovik et al. 2007).
Seleksi dan Uji Aktivitas Senyawa Antimikrob yang Dihasilkan oleh BAL Senyawa antimikrob yang dihasilkan oleh BAL ditentukan dengan metode double layer terhadap bakteri uji Eschericia coli, Salmonella typhimurium ATTC 14038, Basillus cereus, Staphylococcus aureus dan Listeria monocytogenes (Nurhasanah 2004). Sebanyak 50 µl bakteri uji (kepadatan sel 108 CFU/ml) disuspensikan dalam 50 ml media NA (kandungan agar-agar 0,75%) dituang sekitar 10 ml pada permukaan media MRSA yang sudah diinokulasikan isolat bakteri asam laktat. Nutrient Agar yang sudah padat kemudian diinkubasi selama 24 jam pada suhu 37oC. Bakteri yang memiliki kemampuan dalam menghasilkan senyawa antimikrob menunjukkan zona bening (zona hambatan) di sekitar koloni. Indeks penghambatan dihitung dengan menggunakan rumus sebagai berikut :
Indeks penghambatan =
Isolat dikultivasi dalam media MRSB kemudian diinkubasi pada kondisi mikroerofilik selama 24 jam pada suhu 37oC . Supernatan bebas sel diperoleh dengan melakukan sentrifugasi kultur cair pada kecepatan 8260 x g (10000 rpm) selama 10 menit pada suhu 4oC dengan sentrifuge Jouan CR 3. Supernatan bebas sel diberi dua perlakuan yaitu tanpa dinetralkan dan dinetralkan (pH 7±0,24) dengan menambahkan NaOH 1N. Kemudian disaring menggunakan mikrofilter dengan diameter saringan 0,22 µm. Uji aktivitas antimikrob menggunakan metode difusi sumur agar. Sebanyak 20 µl kultur bakteri uji diinokulasikan dalam 20 ml media MHA, dan setelah beku dibuat sumur menggunakan pipet Pasteur steril (diameter 5 mm). Sebanyak 70 µl supernatan bebas sel dimasukan ke dalam sumur. Semua cawan diinkubasi selama 18-24 jam pada suhu 37°C. Zona penghambatan ditentukan dengan pengukuran zona bening disekitar sumur (modifikasi Diop et al. 2007). Pada tahap ini diperoleh isolat BAL terpilih I.
Isolat BAL terpilih I ditumbuhkan dalam medium MRSB yang diinkubasi pada suhu 37oC selama 18 jam dengan kondisi mikroerofilik. Supernatan bebas sel diperoleh dengan melakukan sentrifugasi kultur cair pada kecepatan 8260 x g selama 10 menit pada suhu 4oC dengan sentrifuge Jouan CR 3. Supernatan bebas sel diberi tiga perlakuan yaitu supernatan bebas sel (kultur), supernatan bebas sel dengan pH 5 dan pH 6, dengan menambahkan NaOH 1N. Sebagai kontrol positif adalah larutan asam laktat pada pH 4, 5 dan 6. Kemudian disaring menggunakan mikrofilter dengan diameter saringan 0,22 µm. Uji aktivitas antimikrob menggunakan metode difusi sumur agar (modifikasi Diop et al. 2007). Pada tahap ini diperoleh isolat BAL terpilih II.
Penentuan Substansi Antimikrob yang Dihasilkan oleh BAL
dilakukan dengan metode difusi sumur agar (modifikasi Diop et al. 2007). Selain itu dilakukan juga produksi bakteriosin.
Perkiraan Kuantitatif Total Asam (AOAC 1990). Sebanyak 25 ml supernatan bebas sel ditetesi dengan 3 tetes phenolptalein sebagai indikator. Kemudian dilakukan titrasi dengan menggunakan NaOH 1N secara perlahan sampai terjadi perubahan warna menjadi merah muda (pink). Setiap mL dari NaOH 1N equivalen dengan 90.08 mg asam laktat. Total asam dihitung dalam bentuk asam laktat.
Perkiraan Kuantitatif H2O2 (AOAC 1990). Sebanyak 25 ml larutan
asam sulfat ditambahkan ke dalam 5 ml supernatan bebas sel. Kemudian dilakukan titrasi dengan kalium permanganate 0,1 N. Setiap mL kalium permanganat 0,1 N equivalen dengan 1,701 mg hidrogen peroksida. Hilangnya perubahan warna sampel menunjukkan titik akhir titrasi.