PERTUMBUHAN DAN OKSIDASI METAN
BAKTERI METANOTROF PADA BEBERAPA
MEDIA
SARI WIRYANINGTYAS
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan dengan sebenarnya bahwa tesis yang berjudul, Pertumbuhan dan Aktivitas Oksidasi Metan Bakteri Metanotrof pada Beberapa Media adalah hasil karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, September 2011
ABSTRACT
SARI WIRYANINGTYAS. Growth and Methane Oxidation Activity of Methanotrophic Bacteria in Different Media. Supervised by IMAN RUSMANA AND NISA RACHMANIA MUBARIK
Methanotrophs are bacteria that can utilize methane or C1 compounds as their sole carbon and energy source. Previous study resulted that BGM 1, BGM 3, BGM 9, and SKM 14 isolates could oxidized CH4. Objective of this
research was to formulate medium composition for production of methanotrophic bacteria. The substances that we used as carbon sources were methanol, mollase. And a nitrate was as a nitrogen source. Specific growth rate of bacteria in methanol and nitrate was different for each isolate. The best carbon and nitrogen sources of medium for bacterial growth was methanol 2% and nitrate 1 g/L. Methane oxidation rate of BGM 1, BGM 3, BGM 9, and SKM 14 isolates was 0.01, 0.04, 0.03, and 0.03 mol/ml culture/day respectively. The highest activity of methane oxidation was perfomed by BGM 3 isolate, and the highest ammonium accumulation was perfomed by BGM 9 isolate. The bacterial cells produced by medium of combination methanol 2% and nitrate 1 g/L were tested in soil of a rice field in laboratorium scale. The result showed that methane concentration was decreased in twelveth days of incubation. The methane reduction activity of the isolates during incubation of 8 to 12 days was 88.5%, 85.1%, 47.8%, and 66.4% for BGM 1, BGM 3, BGM 9, and SKM 14 isolates respectively.
RINGKASAN
SARI WIRYANINGTYAS. Pertumbuhan dan Aktivitas Oksidasi Metan pada Beberapa Media. Dibimbing oleh IMAN RUSMANA dan NISA RACHMANIA MUBARIK.
Metan (CH4) merupakan salah satu gas rumah kaca yang berpotensi
menyebabkan pemanasan global. Gas metan (CH4) di atmosfer menunjukkan
peningkatan konsentrasi sebesar 715 hingga 1732 ppb pada awal tahun 1990, dan telah meningkat lagi sebesar 1774 ppb pada tahun 2005. Penggenangan seperti pada tanah sawah dan lahan basah lainnya merupakan salah satu sumber munculnya emisi CH4. Salah satu upaya untuk menekan emisi CH4
yaitu dengan pemanfaatan mikrob metanotrof. Mikrob ini akan memanfaatkan metan sebagai sumber karbon dan energinya.
Bakteri metanotrof dapat tumbuh optimum pada media NMS (nitrate mineral salt), dapat juga tumbuh pada media NMS dengan modifikasi penambahan kalium nitrat. Metanotrof dapat memanfaatkan berbagai senyawa karbon yang berbeda, seperti metanol, metil amin, halometan sebagai sumber karbon dan energi. Penelitian ini bertujuan untuk memformulasi media produksi bakkteri metanotrof yang memiliki aktivitas oksidasi CH4dan fiksasi
N2yang tinggi.
Isolat BGM 1, BGM 3, BGM 9, SKM 14 diremajakan dengan media NMS (nitrate mineral salt) dengan metode gores kuadran dan diinkubasi selama tujuh hari pada suhu kamar (28-300 C). Masing-masing isolat ditumbuhkan pada media NMS dengan dengan ditambahkan : 1) metanol dengan konsentrasi 2%, 5%, 10% dan 15%, 2) molase dengan selang konsentrasi 1%, 2%, 3%, 4%, dan 5%, 3) nitrat dengan konsentrasi 0,5 g/L, 1 g/L , 1,5 g/L , 2 g/L . Kemudian diinkubasi selama 13 hari pada suhu ruang. Pertumbuhan bakteri diukur dengan optical density (OD) menggunakan spektrofotometer dengan panjang gelombang 620 nm setiap 2 hari sekali.
Pengukuran oksidasi metan dilakukan menggunakan alat kromatografi gas. Sebanyak tiga lup isolat diambil dari media padat produksi yang terbaik, kemudian dimasukkan ke dalam tabung mikro yang berisi garam fisiologis steril 1500 ul dan dikocok dengan vorteks hingga homogen. Setelah itu disentrifugasi pada 4000 g selama 10 menit. Supernatan dibuang kemudian ditambahkan garam fisiologis 1500 µl, dikocok dengan vorteks, dan diinokulasikan ke 50 ml medium NMS cair bebas bebas N dan metanol dalam botol serum steril yang ditutup dengan sumbat karet. Komposisi udara saturasi 50% gas metan dibuat dengan mengeluarkan gas 37,5 ml dari media, dan dimasukkan gas metan sebanyak 37,5 ml. Inkubasi dilakukan selama 12 hari pada kondisi gelap. Pada akhir inkubasi dilakukan pengukuran OD sel dan oksidasi metan.
dari Na-sitrat dan Na hipoklorit ditambahkan dengan perbandingan 1:4. Setelah itu campuran didiamkan selama satu jam hingga campuran berubah warna menjadi biru. Selanjutnya pengukuran kadar amoniumnya dilakukan dengan menggunakan spektrofotometer pada panjang gelombang 640 nm dan sebagai blanko ialah aquabides. Setelah diperoleh konsentrasi optimum pada perlakuan sumber karbon dan nitrogen, dilakukan perlakuan kombinasi antara kedua perlakuan yang terbaik. Kemudian diuji dengan menggunakan tanah sawah.
Sampel air sawah dan lumpurnya diambil dari tiga titik dan ditempatkan ke dalam erlenmeyer 1000 ml. Inkubasi dilakukan di atas shaker selama 24 jam. Setelah itu dibagi ke dalam botol-botol serum berukuran 125 ml sebanyak 50 ml, lalu sebanyak 25 ml media yang berisi kultur isolat dicampurkan. Botol ditutup rapat dan diinkubasi dalam inkubasi bergoyang. Setiap 4 hari sekali diambil sampel gasnya untuk dilakukan pengukuran konsentrasi gas metannya selama 12 hari inkubasi.
Laju pertumbuhan spesifik (µ) ke empat isolat bakteri metanotrof pada perlakuan dengan metanol dan nitrat menghasilkan laju yang berbeda-beda tiap isolatnya. Kombinasi antara metanol 2% dan 1 g/L nitrat dalam media NMS mampu menghasilkan aktivitas oksidasi metan, yaitu sebesar 0,01 mol/ml kultur/hari untuk BGM 1, 0,04 mol/ml kultur/hari untuk BGM 3, 0,03 mol/ml kultur/hari untuk BGM 9, dan 0,03 mol/ml kultur/hari untuk SKM 14. Sedangkan akumulasi amonium tertinggi yaitu pada isolat BGM 3 dan SKM 14 sebesar 22,33 µM dan 5,33 µM pada hari ke-9 inkubasi, dan isolat BGM 1 dan BGM 9 pada inkubasi hari ke-11 yaitu sebesar 28,17 µM dan 47,67 µM. Kombinasi metanol 2% dan nitrat 1g/L diujikan pada tanah sawah dalam skala laboratorium, dan dihasilkan konsentrasi metan yang mengalami penurunan pada hari ke 12 inkubasi. Aktivitas reduksi metan selama inkubasi dari hari ke-8 hingga ke-12 dihasilkan 88,5%, 85,1%, 47,8%, and 66,4% untuk BGM 1, BGM 3, BGM 9, dan SKM 14 secara berturut-turut.
©Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
PERTUMBUHAN DAN OKSIDASI METAN
BAKTERI METANOTROF PADA BEBERAPA
MEDIA
SARI WIRYANINGTYAS
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Mayor Mikrobiologi
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
Judul Penelitian : Pertumbuhan dan Oksidasi Metan Bakteri Metanotrof pada Beberapa Media
Nama : Sari Wiryaningtyas
NIM : G351090221
Disetujui,
Komisi Pembimbing
Dr. Ir. Iman Rusmana, M.Si Dr. Nisa Rachmania Mubarik, M.Si
Ketua Anggota
Diketahui
Ketua Program Studi Dekan
Mikrobiologi Sekolah Pascasarjana
Dr. Gayuh Rahayu, M.Si Dr. Ir.Dahrul Syah, M.Sc.Agr
PRAKATA
Puji syukur Alhamdulillah penulis panjatkan kehadirat Allah SWT atas berkah dan rahmat-Nya sehingga penulis dapat menyelesaikan karya ilmiah yang berjudul Pertumbuhan dan Aktivitas Oksidasi Metan pada Beberapa Media tepat pada waktunya. Penelitian ini dilakukan pada bulan September sampai Mei 2011 di Laboratorium Mikrobiologi Departemen Biologi FMIPA Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada berbagai pihak yang telah banyak membantu selama kegiatan penelitian berlangsung. Ucapan terima kasih penulis ucapkan kepada Dr. Ir. Iman Rusmana,M.Si dan Dr. Nisa Rachmania Mubarik,M.Si atas bimbingan dan arahannya.
Terima kasih kepada Kepala dan Staf Laboratorium Mikrobiologi Departemen Biologi IPB, Kepala dan Staf Laboratorium Gas Rumah Kaca Balai Penelitian Lingkungan Pertanian yang telah membantu penulis selama penelitian. Kedua orang tua, suami, dan keluarga besar tercinta atas doa dan dukungannya, teman-teman seperjuangan di Lab Mikro, Fina, Didi, Bang Jo, IRcrewssemuanya, teman-teman mikrobiologi 2009, keluarga B2 atas semua bantuan dan kerjasamanya.
Bogor, September 2011
RIWAYAT HIDUP
Penulis dilahirkan di Kendal pada tanggal 9 Mei 1985, putri sulung dari empat bersaudara dari pasangan Bapak Bambang Iriyanto dengan Ibu Nina Nurkania.
DAFTAR ISI
Karakteristik dan Klasifikasi Bakteri Metanotrof ... 3Metanotrof sebagai Bakteri Pengoksidasi Metan... 3
Emisi Metan (CH4) dari Lahan Sawah ... 6
Faktor-Faktor yang Mempengaruhi Emisi Metan... 7
BAHAN DAN METODE Bahan Penelitian... 9
Peremajaan Isolat ... 9
Penentuan Konsentrasi Optimum Sumber Karbon ... 9
Penentuan Konsentrasi Optimum Sumber Nitrogen ... 10
Pengukuran Laju Spesifik Pertumbuhan Bakteri ... 10
Pengukuran Akumulasi Amonium... 10
Uji Aktivitas Oksidasi Metan... 10
Kombinasi Sumber Karbon dan Nitrogen Terbaik ... 11
Uji Oksidasi Metan Menggunakan Tanah Sawah ... 11
H A S I L Pertumbuhan Bakteri Metanotrof pada Media Produksi... 12
Laju Pertumbuhan Spesifik Isolat Bakteri Metanotrof ... 13
Pertumbuhan Bakteri Metanotrof Hasil Produksi pada Media dengan Sumber Karbon Metan... 14
Aktivitas Oksidasi Metan Isolat Bakteri Metanotrof Hasil Produksi dengan Media Terpilih... 15
Aktivitas Oksidasi Metan Sumber Karbon dan Nitrogen Terpilih... 16
Uji Kultur Kombinasi Media pada Tanah Sawah ... 18
DAFTAR TABEL
Halaman
1. Karakteristik metanotrof tipe I, tipe II, dan tipe X... 4 2. Laju pertumbuhan spesifik isolat metanotrof pada media
NMS dengan konsentrasi substrat metanol berbeda pada suhu
ruang (±280C)... 13 3. Laju pertumbuhan spesifik isolat metanotrof pada media
NMS dengan metanol 1% pada konsentrasi nitrat berbeda pada
suhu ruang (±280C) ... 14
DAFTAR GAMBAR
Halaman
1. Proses oksidasi metan oleh metanotrof ... 5 2. Pertumbuhan sel kultur selama 14 hari pada media NMS
cair dengan empat perlakuan konsentrasi metanol (%)... 12 3. Pertumbuhan sel kultur selama 14 hari pada media NMS
cair dengan empat perlakuan nitrat (g/L) ... 13 4. Pertumbuhan isolat bakteri metanotrof yang berasal dari
Inokulan kultur metanol berbeda selama 12 hari inkubasi dengan sumber karbon metan. A: inokulan yang diproduksi dengan metanol 2%, B: inokulan yang diproduksi dengan metanol 5%, C: inokulan yang diproduksi dengan metanol 10%,
D: inokulan yang diproduksi dengan metanol 15% ... 14 5. Pertumbuhan isolat bakteri metanotrof yang berasal dari
Inokulan kultur nitrat berbeda selama 12 hari inkubasi dengan sumber karbon metan. A: inokulan yang diproduksi dengan nitrat 0,5 g/L, B: inokulan yang diproduksi dengan nitrat 1 g/L,
C: inokulan yang diproduksi dengan nitrat 1,5 g/L,
D: inokulan yang diproduksi dengan nitrat 2 g/L ... 15 6. Aktivitas oksidasi metan pada konsentrasi metanol yang
Berbeda. A: inokulan yang diproduksi dengan metanol 2%, B: inokulan yang diproduksi dengan metanol 5%, C: inokulan yang diproduksi dengan metanol 10%, D: inokulan yang
diproduksi dengan metanol 15%... 16 7. Aktivitas oksidasi metan pada konsentrasi nitrat yang
Berbeda. A: inokulan yang diproduksi dengan nitrat 0,5 g/L, B: inokulan yang diproduksi dengan nitrat 1 g/L, C: inokulan yang diproduksi dengan nitrat 1,5 g/L, D: inokulan yang
8. Pertumbuhan sel isolat bakteri metanotrof selama 13 hari
inkubasi pada media NMS cair dengan penambahan metanol 2%
dan nitrat 1 g/L ... 17 9. Akumulasi amonium isolat bakteri metanotrof selama 13 hari
inkubasi pada media NMS cair dengan penambahan metanol 2%
dan nitrat 1 g/L ... 17 10. Aktivitas oksidasi metan isolat bakteri metanotrof
pada perlakuan kombinasi metanol 2% dan nitrat ... 18 11. Konsentrasi metan masing-masing isolat metanotrof pada tanah
DAFTAR LAMPIRAN
Halaman
1. Hasil uji aktivitas oksidasi metan pada perlakuan
metanol dengan menggunakan kromatografi gas... 31 2. Hasil uji aktivitas oksidasi metan pada perlakuan nitrat dengan
menggunakan kromatografi gas ... 32 3. Pertumbuhan isolat bakteri metanotrof pada konsentrasi
metanol dan nitrat berbeda selama 12 hari inkubasi dengan
PENDAHULUAN
Latar Belakang
Pemanasan global yang disebabkan oleh emisi gas rumah kaca semakin meningkat persentasenya hingga 70% antara tahun 1970 hingga 2004 (Shrestha et al.2008). Gas-gas rumah kaca penyebab pemanasan global ini ialah CH4, CO2, N2O, dan CFC. Gas metan (CH4) di atmosfer menunjukkan
peningkatan konsentrasi dari 715 ppb hingga 1732 ppb dari tahun 1970 hingga awal tahun 1990, dan telah meningkat lagi sebesar 1774 ppb pada tahun 2005 (Qin et al. 2007). Gas CH4 dapat menyerap radiasi infra merah 25 kali lebih
efektif jika dibandingkan dengan CO2. Menurut Setyanto (2004),
penggenangan seperti pada tanah sawah dan lahan basah lainnya merupakan salah satu sumber munculnya emisi CH4. Kondisi tanah yang tergenang
menyebabkan suasana reduktif di dalam tanah sehingga pertumbuhan bakteri metanogen meningkat. Seiring dengan peningkatan produksi padi, emisi CH4
juga semakin meningkat jika di dalam pengelolaannya tidak diiringi dengan upaya penurunan emisi. Salah satu upaya untuk menekan emisi CH4 yaitu
dengan pemanfaatan mikrob metanotrof. Mikrob ini akan memanfaatkan metan sebagai sumber karbon dan energinya.
Emisi CH4pada dasarnya ditentukan oleh dua proses mikrob yang berbeda,
yaitu produksi CH4 oleh bakteri metanogen dan konsumsi CH4 oleh bakteri
metanotrof. Sebagian dari metan yang telah diproduksi akan dioksidasikan oleh bakteri metanotrof di lapisan permukaan tanah dan di zona perakaran (Bedard & Knowles 1990). Beberapa faktor lingkungan seperti pH tanah, bahan organik tanah, suhu, potensial redoks tanah mempengaruhi produksi CH4 pada lahan sawah. Penelitian Hanson dan Hanson (1996) menunjukkan
Pada penelitian sebelumnya telah berhasil diisolasi bakteri metanotrof dari sawah asal Bogor dan Sukabumi (Hapsary 2008). Di antara beberapa isolat yang diperoleh, terdapat 4 isolat terbaik dalam mengoksidasi metan. Isolat tersebut ialah BGM 1, BGM 3, BGM 9, dan SKM 14. Keempat isolat ini telah didentifikasi oleh Astuti (2009) sebagai Methylococcus rosea, Methylocystis rosea, Methylococcus capsulatus, dan Methylobacter sp. Maisaroh (2009) melaporkan bahwa isolat BGM 1, BGM 3, dan BGM 9 menunjukkan adanya aktivitas nitrogenase, sehingga isolat tersebut memiliki kemampuan untuk melakukan fiksasi nitrogen. Isolat BGM 9 dan SKM 14 selain mampu mengoksidasi metan dan fiksasi nitrogen, juga berpotensi mengurangi residu organoklorin dari lahan sawah (Nurhasanah 2009). Untuk mengaplikasikan bakteri metanotrof tersebut pada lahan pertanian maka diperlukan produksi bakteri tersebut pada media yang ekonomis dan optimum.
Tujuan Penelitian
Penelitian ini bertujuan untuk memformulasi media produksi bakteri metanotrof yang memiliki aktivitas oksidasi CH4dan fiksasi N2yang tinggi.
Manfaat Penelitian
TINJAUAN PUSTAKA
Karakteristik dan Klasifikasi Bakteri Metanotrof
Bakteri metanotrof adalah bakteri Gram negatif, bersifat aerob dan menggunakan metan sebagai sumber karbon dan energi (Auman 2001). Karakteristik penting dari metanotrof ini ialah memiliki enzim metan mono-oksigenase yang dapat mengkatalisis metan menjadi metanol. Jenis metanotrof yang telah dilaporkan ialah metanotrof obligat dan fakultatif. Metanotrof obligat hanya tumbuh dengan menggunakan metan (CH4) dan metanol
(CH3OH), sedangkan metanotrof fakultatif dapat tumbuh dengan
menggunakan senyawa multikarbon seperti etanol dan propanol (Lynch et al.
1982). Whittenburyet al.(1970) menggolongkan bakteri pengoksidasi CH4 ke
dalam lima genus berdasarkan perbedaan morfologi, tipe bentuk fase istirahat, struktur membran intrasitoplasma, dan beberapa karakteristik fisiologi. Kelima genus tersebut ialah Methylomonas, Methylobacter, Methylococcus,
Methylosistis,danMethylosinus.
Berdasarkan perbedaan jalur biosintesis dan morfologinya, bakteri metanotrof dibagi 3 tipe (Tabel 1). Tipe I mensintesis formaldehida dengan menggunakan jalur Ribulosa Monofosfat (RuMP), contohnya dari genus
Methylomonas dan Methylobacter. Tipe II mensintesis formaldehida melalui jalur serin, contohnya dari genus Methylosinus dan Methylocystis. Tipe X metanotrof mensintesis formaldehida menggunakan jalur RuMP dan dihasilkan juga enzim ribulosa-bifosfat karboksilase meskipun hanya dalam konsentrasi yang sedikit. Perbedaan lain dari ketiga jenis metanotrof tersebut dilihat dari kemampuan hidup pada suhu tinggi. Metanotrof tipe X mampu hidup pada suhu tinggi (lebih dari 45 0C) daripada tipe I dan II (Hanson & Hanson 1996).
Metanotrof sebagai Bakteri Pengoksidasi Metan
oksigennya akan berikatan dengan metan membentuk metanol, sedangkan atom oksigen yang lain akan direduksi menjadi H2O. Terdapat dua jenis enzim
metan monooksigenase yaitu enzim metan monooksigenase terlarut (sMMO) dan enzim metan monooksigenase terikat membran (pMMO).
Tabel 1 Karakteristik metanotrof tipe I, tipe II, dan tipe X (Hanson & Hanson 1996)
Karakteristik Tipe I Tipe II Tipe X
Hampir semua metanotrof memiliki pMMO kecuali Methylocella, sedangkan sMMO tidak ada di semua metanotrof tetapi dimiliki oleh sebagian metanotrof tipe II dan metanotrof tipe X (Mancinelli 1995). Proses oksidasi metan lebih dominan dikatalisis oleh enzim pMMO (Lieberman & Rosenzweig 2004). Untuk mengekspresikan aktivitas enzim pMMO dibutuhkan ion Cu (tembaga) dalam media tumbuhnya. Konsentrasi Cu yang dibutuhkan lebih dari 0,85 sampai 1 mol/ bobot kering sel. Enzim pMMO telah ditemukan pada semua bakteri metanotrof (Zahn & Dispirito 1996) dari sekitar 130 bakteri yang telah diisolasi (Bowman et al. 1993; Hanson & Hanson 1996).
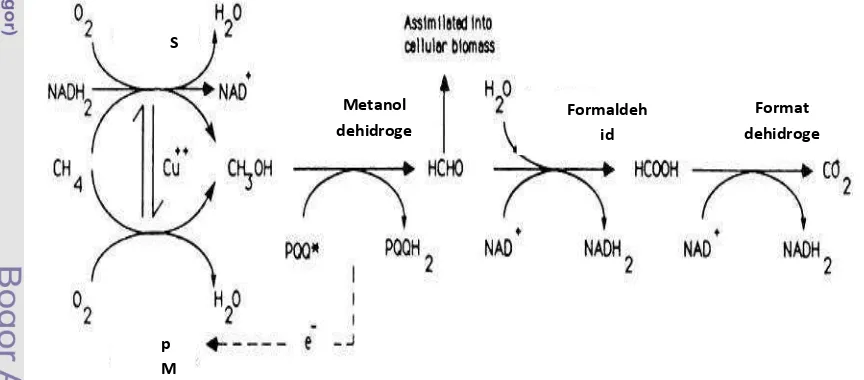
Metanol akan dioksidasi oleh enzim metanol dehidrogenase menjadi formaldehida. Enzim formaldehida dehidrogenase mengoksidasi formaldehida menjadi format, dan kemudian dioksidasi lagi oleh format dehidrogenase menjadi CO2(Gambar 1).
Asimilasi formaldehida juga dapat digunakan untuk sintesis senyawa multikarbon. Jalur ini terdapat dua jenis yaitu jalur serin dan jalur RuMP (ribulosa monofosfat). Jalur serin digunakan oleh metanotrof tipe II. Senyawa asetil ko-A disintesis dari satu molekul formaldehida dan satu molekul CO2.
molekul NADH dan ATP untuk setiap pembentukan satu molekul asetil ko-A. Asetil ko-A digunakan untuk membentuk materi sel yang baru.
Jalur asimilasi formaldehida yang lain ialah RuMP. Jalur ini digunakan oleh bakteri metanotrof tipe I. Jalur ini lebih efisien dari jalur serin karena semua karbon yang diperoleh dari formaldehida digunakan untuk materi sel. Oksidasi formaldehida pada jalur ini tidak membutuhkan kekuatan reduksi sehingga seluruhnya digunakan sebagai bahan untuk membuat materi sel. Jalur RuMP membutuhkan satu molekul ATP untuk setiap pembentukan satu molekul gliseraldehida-3- fosfat. Dengan demikian bakteri metanotrof tipe I memiliki jumlah sel yang lebih besar dibandingkan metanotrof tipe II. Hal ini sesuai dengan rendahnya energi yang diperlukan pada jalur ini (Madiganet al. 2006).
Emisi Metan (CH4) dari Lahan Sawah
Menurut Hanson dan Hanson (1996), CH4 menjadi salah satu penyebab
pemanasan global karena kemampuannya dalam menyerap radiasi infra merah 30 kali lebih besar dibandingkan dengan karbondioksida. Gas CH4mempunyai
kapasitas pemanasan global 21 lebih besar daripada CO2 dan 206 kali lebih
besar dari N2O. Menurut Ciceron dan Oremland (1998), pembentukan CH4
terjadi melalui dua cara yaitu degradasi bahan organik secara anaerob (biogenik) dan pembebasan langsung melalui produksi dan pembakaran bahan bakar minyak atau kebocoran gas alam (nonbiogenik). Gas CH4 dihasilkan
dari proses dekomposisi bahan organik oleh bakteri metanogen pada lahan yang tergenang. Bakteri metanogen memiliki pH yang sensitif. Bakteri metanogen ini hidup pada pH 6-8 dengan pH optimumnya sekitar 7, dan suhu optimumnya dalam menghasilkan CH4ialah 25 oC (Conrad 1996). Metanogen
dapat memanfaatkan H2, CO2, asam format, asam asetat sebagai sumber
karbon dan energinya. Metanogenesis terjadi pada kondisi anaerob, tersedianya bahan organik dari akar, dan pH tanah mendekati netral (Neue & Roger 1994).
Tanaman padi juga memegang peranan penting dalam melepaskan metan (CH4) ke atmosfer dari lahan sawah. Ruang udara pada pembuluh aerenkim
utama terjadinya pertukaran gas dari dalam tanah ke udara. Perbedaan gradien konsentrasi air di sekitar akar dengan ruang antar sel pada akar menyebabkan CH4 terlarut terdifusi. Pada dinding korteks, metan terlarut berubah menjadi
gas dan disalurkan ke batang melalui pembuluh aerenkim (IRRI 1998). Faktor-Faktor yang Mempengaruhi Emisi Metan
Perombakan bahan organik secara anaerobik dikendalikan oleh karakteristik fisik, kimia dan mikrobiologi lingkungan tanaman padi, yang berpengaruh terhadap aktivitas bakteri penghasil metan. Faktor-faktor yang mempengaruhi emisi metan dari lahan sawah sebagai berikut:
1. Potensial redoks (Eh) tanah
Potensial redoks (Eh) tanah merupakan faktor penting dalam produksi metan. Potensial redoks (Eh) menunjukkan status reaksi oksidasi dan reduksi oksidan-oksidan tanah sebagai penyedia oksigen dalam tanah. Aktivitas bakteri metanogen dan metanotrof sangat tergantung dengan ketersediaan oksigen dalam kondisi tanah jenuh air. Produksi CH4terjadi pada kisaran nilai
Eh -150 mV (Hou et al. 2000) dan bergerak sampai di bawah -300 mV (Minamikawa et al. 2006) karena bakteri metanogen sebagai penghasil CH4
bekerja optimal pada nilai Eh kurang dari -150 mV (Setyanto 2004). 2. pH tanah
Sifat reaksi tanah yang dinyatakan dengan pH didasarkan pada jumlah ion H+atau OH
-dalam larutan tanah. Sebagian besar bakteri metanogen bersifat neutrofilik, yaitu hidup pada kisaran pH antara 6 sampai 8 (Setyanto 2004). Pembentukan CH4maksimum terjadi pada pH 6,9 hingga 7,1 (Wang 1993).
3. Suhu tanah
Suhu tanah berkaitan erat dengan aktivitas mikrob di dalam tanah. Sebagian besar bakteri metanogen bersifat mesofilik yang beraktivitas optimal pada suhu 25 oC (Conrad 1996). Perubahan suhu akan mempengaruhi produksi CH4pada tanah sawah. Pada kondisi tersedia substrat, peningkatan suhu dari
17-30oC menyebabkan peningkatan produksi CH42,5 sampai 3,5 kali lipat.
4. Varietas padi
Tanaman padi bertindak sebagai media bagi pelepasan CH4yang dihasilkan
akar padi. Selanjutnya CH4 akan dilepaskan melalui pori-pori mikro pada
pelepah daun bagian bawah. Varietas padi mempunyai bentuk, kerapatan dan jumlah pembuluh aerenkima yang berbeda. Perbedaan ini akan mempengaruhi kemampuan tanaman padi mengemisikan CH4(Setyanto 2004).
Biomasa akar dan tanaman juga berpengaruh terhadap emisi CH4terutama
pada stadium awal. Pada fase awal pertumbuhan tanaman padi banyak eksudat akar yang dilepas ke rizosfir sebagai hasil samping metabolisme karbon oleh tanaman (Setyanto 2004). Semakin banyak eksudat akar, emisi CH4 makin
tinggi. Jumlah biomasa akar juga mempengaruhi emisi CH4, makin banyak
biomasa akar yang terbentuk maka emisi CH4 makin tinggi pula. Jumlah
anakan juga merupakan faktor penentu besarnya pelepasan CH4. Semakin
banyak anakan maka kerapatan dan jumlah pembuluh aerinkima meningkat (Wihardjaka 2001).
5. Bahan organik tanah
Bahan organik tanah memberikan sumbangan terhadap kesuburan pertumbuhan tanaman baik secara fisik, kimia dan biologi. Bahan organik merupakan penyedia unsur-unsur N, P, dan S untuk tanaman. Ketersediaan substrat organik mempengaruhi aktivitas mikroorganisme dalam tanah karena bertindak sebagai sumber energi dan secara fisik berperan dalam memperbaiki struktur tanah. Sumber bahan organik yang ditambahkan sangat menentukan pembentukan CH4 di lahan sawah. Penelitian Wihardjaka (2001) dengan
menggunakan beberapa jenis bahan organik pada tanah sawah memberikan hasil bahwa emisi CH4 terbesar didapat dari penambahan pupuk kandang,
BAHAN DAN METODE
Bahan Penelitian
Isolat yang digunakan dalam penelitian ini ialah koleksi bakteri metanotrof Laboratorium Mikrobiologi Departemen Biologi FMIPA IPB, yang diisolasi dari sawah di Bogor dan Sukabumi Jawa Barat, yang diberi kode nama BGM 1, 3, 9 dan SKM 14 (Hapsary 2008). Media selektif yang digunakan ialah
nitrate mineral salts (NMS) dengan komposisi media sebagai berikut: MgSO4 .
7H2O 1,0 g, KNO3atau (NaNO3): 1,0 g, Na2HP04.12H2O 0,717 g, KH2P04
0,272 g, CaCl2 . 6H2O 0,2 g, NH4Cl 4,0 mg, trace element solution (bentuk
larutan) 0,5 ml.
Komposisi trace element solution per 1 liter aquades ialah: Na2EDTA 0,5
g, FeSO4. 7H2O 0,2 g, H3BO3 0,03 g, CoCl2. 6H2O 0,02 g, ZnSO4. 7H2O
0,01 g, MnCl2 .4H2O 3,0 mg, Na2MoO4 .2H2O 3,0 mg, NiCl2. 6H2O 2,0 mg,
CaCl2.2H2O 1,0 mg.
Peremajaan Isolat
Isolat bakteri ditumbuhkan pada medium agar NMS (Hanson & Hanson 1996) dengan teknik gores kuadran dan diinkubasi selama 7 hari pada suhu kamar (28-30 oC). Koloni-koloni yang terpisah kemudian digores kuadran kembali sampai diperoleh koloni murni. Isolat murni yang diperoleh disimpan pada medium agar-agar miring yang diberi 1% metanol sebagai biakan stok. Penentuan Konsentrasi Optimum Sumber Karbon
Penentuan Konsentrasi Optimum Sumber Nitrogen
Bakteri ditumbuhkan pada media NMS dengan penambahan sumber nitrogen (NaNO3) dengan beberapa konsentrasi (0,5 g/L ; 1 g/L; 1,5 g/L; 2
g/L). Kemudian diinkubasi selama 10 hari pada suhu ruang. Pertumbuhan bakteri diukur dengan optical density (OD) menggunakan spektrofotometer pada panjang gelombang 620 nm, mulai dari 0, 2, 4, 6, 8, dan 10 hari masa inkubasi. Selanjutnya dilakukan pengukuran oksidasi metan.
Pengukuran Laju Spesifik Pertumbuhan Bakteri
Laju pertumbuhan spesifik bakteri (µ) diukur dari fase logaritmik bakteri terhadap waktu inkubasinya. Kemudian dibuat grafik antara ln OD sel bakteri sebagai sumbu y, dan waktu inkubasi sebagai sumbu x. Kemiringan (slope) yang dihasilkan dari persamaan regresi garis tersebut merupakan laju pertumbuhan spesifik bakteri.
Pengukuran Akumulasi Amonium
Sebanyak 1 ml sampel kultur diencerkan dengan 4 ml aquabides dalam botol serum bertutup karet dengan ditambah 0,2 ml fenol-alkohol 10 % kemudian dikocok dengan alat vorteks sampai homogen. Na-nitroprusid 0,5 % sebanyak 0,2 ml ditambahkan, kemudian dikocok dengan vorteks. Sebanyak 0,5 ml campuran dari Na-sitrat dan Na hipoklorit ditambahkan dengan perbandingan 1:4. Setelah itu campuran didiamkan selama satu jam hingga campuran berubah warna menjadi biru. Selanjutnya pengukuran kadar amoniumnya dilakukan dengan menggunakan spektrofotometer pada panjang gelombang 640 nm dan sebagai blanko ialah aquabides.
Uji Aktivitas Oksidasi Metan
Setelah dilakukan pengukuran amonium terakumulasi, dilakukan pengukuran kemampuan oksidasi metan dari isolat tersebut. Pengukuran oksidasi metan dilakukan menggunakan alat kromatografi gas (Kumaraswary
vorteks, dan diinokulasikan ke dalam 50 ml medium NMS cair bebas bebas N dan metanol dalam botol serum steril yang ditutup dengan sumbat karet. Komposisi udara saturasi 50% gas metan dibuat dengan mengeluarkan gas 37,5 ml dari media, dan dimasukkan gas metan sebanyak 37,5 ml. Inkubasi dilakukan selama 12 hari pada kondisi gelap. Pada akhir inkubasi dilakukan pengukuran OD sel dan oksidasi metan.
Kombinasi Sumber Karbon dan Nitrogen Terbaik
Setelah diperoleh konsentrasi optimum pada perlakuan sumber karbon dan nitrogen, dilakukan perlakuan kombinasi antara kedua perlakuan yang terbaik. Pertumbuhan bakteri dan akumulasi amonium diukur setiap 2 hari sekali selama 13 hari inkubasi. Pada akhir inkubasi dilakukan pengukuran aktivitas oksidasi CH4.
Uji Oksidasi Metan Menggunakan Tanah Sawah
HASIL
Pertumbuhan Bakteri Metanotrof pada Media Produksi
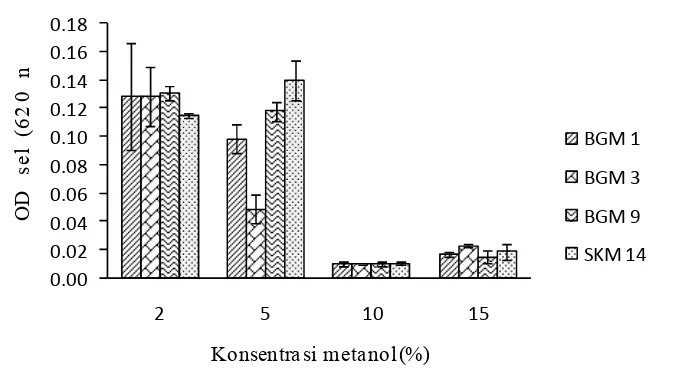
Pengukuran suspensi sel bakteri metanotrof (OD) menunjukkan pertumbuhan yang berbeda-beda setiap isolatnya. Penambahan metanol sebagai sumber karbon menunjukkan isolat bakteri metanotrof mampu tumbuh dengan menggunakan sumber karbon berupa metanol, meskipun pada konsentrasi metanol 10% dan 15% menunjukkan pertumbuhan yang kecil (Gambar 2).
Pertumbuhan keempat isolat bakteri metanotrof pada media NMS menunjukkan pertumbuhan sel yang terbaik pada konsentrasi metanol 2% jika dibandingkan dengan konsentrasi metanol yang lain. Isolat BGM 1, BGM 3, BGM 9 memiliki kerapatan sel yang tertinggi pada konsentrasi metanol 2%. SKM 14 memiliki kerapatan sel paling tinggi pada konsentrasi metanol 5% (Gambar 2). Isolat BGM 1, BGM 3, BGM 9, dan SKM 14 menunjukkan kerapatan sel yang tinggi selama 14 hari inkubasi (Gambar 2). BGM 9 memiliki pertumbuhan tertinggi diantara isolat yang lain pada konsentrasi metanol 2%.
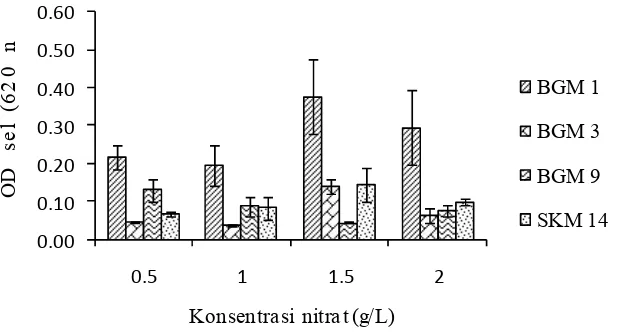
Perlakuan penambahan konsentrasi nitrat menunjukkan pertumbuhan bakteri metanotrof yang cukup bervariasi. Isolat BGM 1, BGM 3, dan SKM
Gambar 2 Pertumbuhan sel kultur selama 14 hari pada media NMS cair dengan empat perlakuan konsentrasi metanol.
Gambar 1 Pertumbuhan sel kultur selama 14 hari pada media NMS cair dengan 4 perlakuan konsentrasi metanol (%).
Gambar 1 Pertumbuhan sel kultur selama 14 hari pada media NMS cair dengan 4 perlakuan konsentrasi metanol (%).
Gambar 1 Pertumbuhan sel kultur selama 14 hari pada media NMS cair dengan 4 perlakuan konsentrasi metanol (%).
0.00
Konsentra si meta nol (%)
BGM 1
BGM 3
BGM 9
14 memiliki nilai OD sel yang tinggi pada perlakuan 1,5 g/L nitrat sebesar 0,38, 0,14, dan 0,15. Sedangkan BGM 9 pada perlakuan 0,5 g/L nitrat memiliki kerapatan sel yang tinggi sebesar 0,13 (Gambar 3).
Laju Pertumbuhan Spesifik Isolat Bakteri Metanotrof
Laju pertumbuhan pada perlakuan konsentrasi metanol dan nitrat yang berbeda menghasilkan laju yang fluktuatif. Isolat BGM 1 menunjukkan laju yang relatif meningkat seiring peningkatan konsentrasi substrat, tetapi turun pada konsentrasi substrat 15% (Tabel 2). Berbeda dengan isolat-isolat yang lain menunjukkan pola yang fluktuatif. Demikian pula dengan perlakuan konsentrasi nitrat, laju pertumbuhan isolat BGM 1 meningkat kemudian turun pada konsentrasi 1,5 g/L, kemudian naik kembali pada konsentrasi 2 g/L (Tabel 3). Isolat BGM 3, BGM 9, dan SKM 14 menunjukkan pola yang fluktuatif pada perlakuan konsentrasi nitrat berbeda (Tabel 3).
Gambar 3 Pertumbuhan sel kultur selama 14 hari pada media NMS cair dengan empat perlakuan konsentrasi nitrat.
Gambar 1 Pertumbuhan sel kultur selama 14 hari pada media NMS cair dengan 4 perlakuan konsentrasi metanol (%).
Gambar 1 Pertumbuhan sel kultur selama 14 hari pada media NMS cair dengan 4 perlakuan konsentrasi metanol (%).
Gambar 1 Pertumbuhan sel kultur selama 14 hari pada media NMS cair dengan 4 perlakuan konsentrasi metanol (%).
0.00
Konsentra si nitra t (g/L)
BGM 1
BGM 3
BGM 9
SKM 14
Tabel 2 Laju pertumbuhan spesifik isolat metanotrof pada media NMS dengan konsentrasi substrat metanol berbeda pada suhu ruang (± 280C)
BGM 1 BGM 3 BGM 9 SKM 14
2 0,12 0,31 0,376 0,23
5 0,23 0,26 0,212 0,83
10 0,75 0,75 0,313 0,09
15 0,14 0,36 0,447 0,51
Pertumbuhan Bakteri Metanotrof Hasil Produksi pada Media dengan
Sumber Karbon Metan
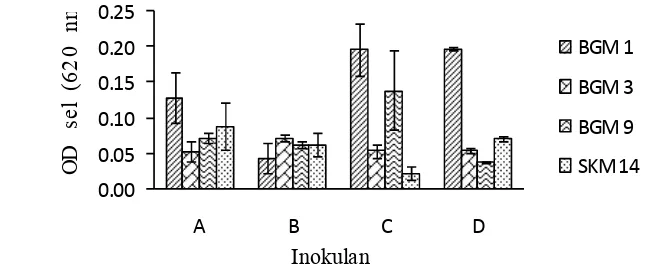
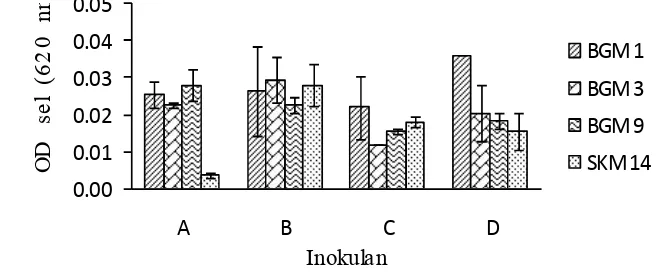
Kerapatan sel inokulan isolat bakteri metanotrof yang berasal dari kultur metanol cenderung bervariasi selama diinkubasi dengan metan sebagai sumber karbon. Isolat BGM 1 memiliki kerapatan sel tertinggi pada inokulan C dan D yang berasal dari kultur metanol 10% dan 15%. Isolat BGM 3, BGM 9, dan SKM 14 memiliki kerapatan sel yang tinggi pada inokulan B (dari kultur metanol 5%) , inokulan C (dari kultur metanol 15%), dan inokulan A (dari kultur metanol 2%) (Gambar 4). Pertumbuhan keempat isolat bakteri metanotrof cenderung stabil pada inokulan A, yang berasal dari kultur metanol 2% (Gambar 4).
Tabel 3 Laju pertumbuhan spesifik isolat metanotrof pada media NMS dengan metanol 1% pada konsentrasi nitrat berbeda pada suhu ruang (± 280C)
BGM 1 BGM 3 BGM 9 SKM 14
0,5 0,25 1,05 0,08 0,86
1,0 0,29 0,24 1,39 0,58
1.5 0,17 0,69 0,06 1,18
2,0 0,41 0,53 1,01 0,33
Konsentrasi Nitrat (g/L) Laju pertumbuhan spesifik µ (per hari)
Perlakuan inokulan yang berasal dari kultur penambahan nitrat pada konsentrasi berbeda menunjukkan kerapatan sel yang cenderung tinggi pada inokulan B (dari kultur nitrat 1g/L) selama 14 hari inkubasi dengan sumber karbon berupa metan (Gambar 5). Keempat isolat tersebut masing-masing memiliki kerapatan sel 0,03 dan 0,03 untuk BGM 1 dan BGM 3, sedangkan BGM 9 dan SKM 14 adalah 0,02 dan 0,03 pada inokulan B. Sedangkan pada perlakuan inokulan yang lain juga memiliki pertumbuhan yang baik tetapi tidak sebaik jika dibandingkan dengan perlakuan inokulan B.
Aktivitas Oksidasi Metan Isolat Bakteri Metanotrof Hasil Produksi
dengan Media Terpilih
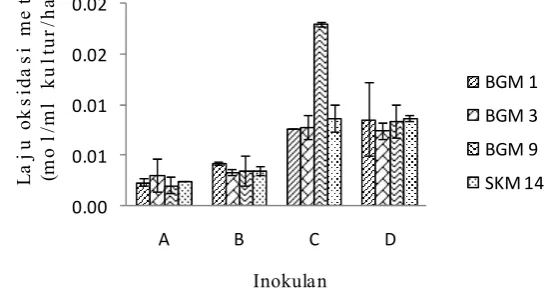
Pengaruh modifikasi metanol dan nitrat memiliki aktivitas oksidasi metan yang berbeda-beda tiap perlakuannya. Penambahan konsentrasi metanol menunjukkan peningkatan aktivitas oksidasi metan seiring dengan peningkatan konsentrasi metanol (Gambar 6). Konsentrasi metanol 10% dan 15% cenderung memiliki aktivitas oksidasi metan yang hampir sama, tetapi pada isolat BGM 9 menunjukkan aktivitas yang tinggi pada konsentrasi metanol 10% yaitu sebesar 0,02 mol/ml kultur/hari (Gambar 6).
Hasil uji aktivitas oksidasi metan pada isolat yang diberikan perlakuan konsentrasi nitrat menunjukkan kemampuan isolat dalam mengkonsumsi metan cukup tinggi. Perlakuan dengan nitrat 1 g/L dan 1,5 g/L memiliki Gambar 5 Pertumbuhan isolat bakteri metanotrof yang berasal dari inokulan
aktivitas yang baik dalam mengoksidasi metan jika dibandingkan dengan isolat lainnya. Isolat BGM 1 dan SKM 14 mengoksidasi metan paling tinggi pada perlakuan nitrat 1,5 g/L dan 1 g/L, yaitu sebesar 0,02 mol/ml kultur/hari dan 0,01 mol/ml kultur/hari (Gambar 7). Berdasarkan hasil uji pertumbuhan dan aktivitas oksidasi metan pada perlakuan konsentrasi metanol dan nitrat yang berbeda maka dipilih konsentrasi metanol 2% dan nitrat 1 g/L untuk diuji lebih lanjut, karena melihat pertumbuhannya dan keefisienan bahan yang digunakan.
Gambar 7 Aktivitas oksidasi metan pada konsentrasi nitrat yang berbeda. A: inokulan yang diproduksi dengan nitrat 0,5 g/L, B: inokulan yang diproduksi dengan nitrat 1 g/L, C: inokulan yang diproduksi dengan nitrat 1,5 g/L, D: inokulan yang diproduksi dengan nitrat 2 g/L.
0.00
Gambar 6 Aktivitas oksidasi metan pada konsentrasi metanol yang berbeda. A: inokulan yang diproduksi dengan metanol 2%, B: inokulan yang diproduksi dengan metanol 5%, C: inokulan yang diproduksi dengan metanol 10%, D: inokulan yang diproduksi dengan metanol 15%.
Aktivitas Oksidasi Metan Sumber Karbon dan Nitrogen Terpilih
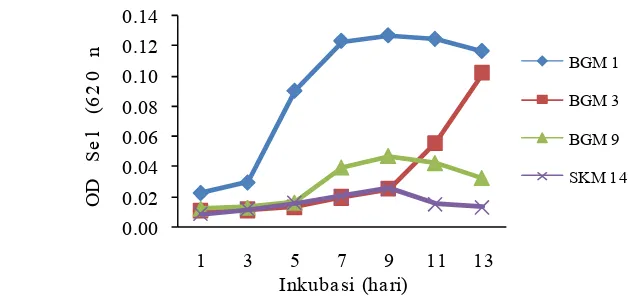
Kombinasi antara sumber karbon berupa metanol 2% dan sumber nitrogen berupa nitrat 1 g/L menghasilkan pertumbuhan sel isolat metanotrof yang memiliki densitas kerapatan sel yang berbeda tiap isolatnya (Gambar 8). Pertumbuhan sel isolat BGM 1, BGM 9, dan SKM 14 pada hari kesembilan inkubasi menunjukkan pertumbuhan sel maksimum, dengan nilai OD berturut-turut 0,13; 0,05; dan 0,03. Sedangkan pada isolat BGM 3 masih menunjukkan pertumbuhan yang terus meningkat hingga akhir inkubasi dengan OD sebesar 0,10 (Gambar 8).
Akumulasi amonium mulai terjadi peningkatan pada hari ke-3 inkubasi kemudian menurun pada hari ke-5 inkubasi (Gambar 9). Pada hari ke-3 inkubasi, BGM 1 memiliki akumulasi amonium sebesar 6,50 µM, BGM 3 sebesar 0,67 µM, dan BGM 9 sebesar 18,0 µM, sedangkan pada SKM 14 belum menunjukkan akumulasi amonium (Gambar 9).
Gambar 9 Akumulasi amonium isolat bakteri metanotrof selama 13 hari inkubasi pada media NMS cair dengan penambahan metanol 2% dan nitrat 1g/L.
0.00
Gambar 8 Pertumbuhan sel isolat bakteri metanotrof selama 13 hari inkubasi pada media NMS cair dengan penambahan metanol 2% dan nitrat 1 g/L.
Pada hari ke-9 inkubasi, isolat BGM 3 dan SKM 14 mulai terjadi kenaikan akumulasi amonium sebesar 22,33 µM dan 5,33 µM. Sedangkan pada isolat BGM 1 dan BGM 9, kenaikan akumulasi amonium terjadi pada inkubasi hari ke-11 yaitu sebesar 28,17 µM dan 47,67 µM (Gambar 9).
Aktivitas oksidasi metan pada isolat bakteri metanotrof menunjukkan kemampuan isolat dalam mengkonsumsi metan lebih tinggi jika dibandingkan dengan tanpa perlakuan kombinasi. Isolat BGM 3 memiliki aktivitas oksidasi metan tertinggi yaitu sebesar 0,04 mol/ml kultur/hari, sedangkan BGM 1 memiliki aktivitas terendah yaitu sebesar 0,01 mol/ml kultur/hari. BGM 9 dan SKM 14 mengoksidasi metan sebesar 0,03 mol/ml kultur/hari (Gambar 10).
Uji Kultur Kombinasi Media pada Tanah Sawah
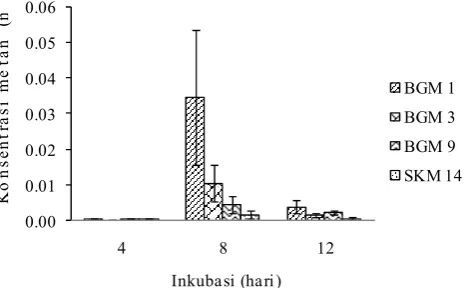
Kombinasi metanol 2% dan nitrat 1 g/L diujikan pada tanah sawah dalam skala laboratorium, dan dihasilkan konsentrasi metan yang mengalami penurunan dari hari ke-8 hingga ke-12 inkubasi (Gambar 11). BGM 1 pada hari ke-8 hingga ke-12 mengalami penurunan sebesar 88,5%, BGM 3 85,1%, BGM 9 47,8%, dan SKM 14 sebesar 66,4%.
Gambar 11 Konsentrasi metan masing-masing isolat metanotrof pada tanah sawah selama 12 hari inkubasi.
0.00
Gambar 10 Aktivitas oksidasi metan isolat bakteri metanotrof pada perlakuan kombinasi metanol 2% dan nitrat 1g/L.
PEMBAHASAN
Isolat bakteri metanotrof BGM 1, BGM 3, BGM 9, dan SKM 14 telah diidentifikasi secara molekuler pada penelitian Astuti (2009). BGM 1 merujuk pada Methylocystis rosea, BGM 3 Methylocystis parvus, BGM 9
Methylococcus parvus, dan SKM 14 Methylobacter sp. SKM 14 termasuk ke dalam tipe I metanotrof, BGM 1 dan BGM 3 termasuk ke dalam tipe II, sedangkan BGM 9 termasuk ke dalam tipe X. Bakteri metanotrof mampu tumbuh pada sumber karbon berupa metanol dan sumber nitrogen berupa nitrat. Beberapa konsentrasi metanol dan nitrat yang berbeda menunjukkan pertumbuhan isolat metanotrof yang variatif pada panjang gelombang 620 nm (Gambar 3 dan 4). Penambahan beberapa konsentrasi metanol dari tingkat rendah ke tinggi menyebabkan pertumbuhan bakteri metanotrof cenderung kurang baik pada tingkat konsentrasi tinggi yaitu sekitar 10-15% (Gambar 3). Hal ini kemungkinan disebabkan bakteri metanotrof tersebut beradaptasi pada konsentrasi metanol yang tinggi. Pertumbuhan isolat bakteri metanotrof dari kultur konsentrasi metanol yang berbeda selama menggunakan sumber karbon metan menunjukkan pertumbuhan yang lebih baik jika dibandingkan dengan kultur dari penambahan nitrat diamati dari nilai OD sel (Gambar 4 dan 5). Hal itu dapat disebabkan oleh penggunaan sumber nitrogen yang berbeda. Inokulan yang berasal dari kultur konsentrasi metanol menggunakan amonium klorida (NH4Cl) sebagai sumber nitrogennya, sedangkan inokulan yang
termasuk senyawa karbon kompleks yang susah didegradasi oleh metanotrof. Hal ini membuktikan bahwa bakteri metanotrof hanya mampu tumbuh dengan menggunakan sumber karbon berupa senyawa C1, seperti metanol, metan, metil amin, format sebagai donor elektron untuk pembentukan energi (Patt et al. 1974). Menurut Whittenbury dan Dalton (1981), bakteri metanotrof merupakan obligat metabolisme senyawa C1 dan mampu menggunakan nitrat dan amonium sebagai sumber nitrogen.
Metanol dapat menjadi salah satu sumber karbon dan energi bagi metanotrof. Tipe I metanotrof menunjukkan pertumbuhan yang baik. Meskipun metanol dapat menjadi toksik bagi tipe II metanotrof, tetapi tipe ini mampu beradaptasi tumbuh pada konsentrasi metanol yang tinggi (Bensteadet al. 1998). Kemampuan tipe II metanotrof menggunakan metanol sangat signifikan karena kelompok dari tipe ini merupakan populasi yang dominan di tanah (Hanson & Hanson 1996). Benstead et al. (1998) melaporkan
Methylobacter albus BG8 mampu mengoksidasi metan di atmosfer ketika ditumbuhkan di kultur dengan penambahan metanol. Metanol menjadi sumber karbon pendukung untuk metanotrof yang dapat diperoleh dari turunan gula metoksilat (pektin) dan senyawa aromatik pada lignin (King 1993).
Laju pertumbuhan spesifik (µ) pada perlakuan metanol dan nitrat berbeda tiap isolatnya (Tabel 2 dan 3). Hal ini disebabkan bakteri masih beradaptasi dengan pemberian sumber karbon dan nitrogen yang diberikan sebagai substrat tumbuhnya. Laju pertumbuhan ini dipengaruhi oleh jenis substrat yang digunakan, dan konsentrasi substrat. Laju pertumbuhan spesifik merupakan salah satu parameter dari kinetika pertumbuhan bakteri. Laju pertumbuhan spesifik akan menurun pada konsentrasi substrat yang tinggi karena telah mengalami kejenuhan dalam memanfaatkan substrat yang ada (Lehninger 1982).
sumber nitrogen yang digunakan pada media dengan penambahan metanol berupa amonium klorida (NH4Cl). Struktur dari ion NH4+memiliki kemiripan
dengan CH4, sehingga terjadi kompetitif inhibitor antara keduanya yang
menyebabkan aktivitas enzim metan monooksigenase (MMO) terganggu. Adanya kompetitif inhibitor antara NH4+ dan CH4 dalam kerja enzim MMO
ini juga dilaporkan oleh Bedard dan Knowles (1990). Bakteri metanotrof merupakan bakteri yang mengoksidasi metan melalui proses aerobik dan oksigen sebagai elektron akseptor terminalnya. Bakteri ini memiliki enzim metan monooksigenase (MMO) sehingga dapat mengoksidasi metan sebagai sumber karbonnya. Enzim tersebut melepaskan ikatan dioksigen, satu atom oksigen akan berikatan dengan metan membentuk metanol dan satu atom oksigen lainnya akan direduksi membentuk H2O. Metanol dioksidasi
membentuk formaldehida oleh enzim metanol dehirogenase. Formaldehida dioksidasi menjadi format oleh enzim formaldehida dehidrogenase. Selanjutnya format dioksidasi menjadi karbondioksida oleh enzim format dehidrogenase (Hanson & Hanson 1996).
Bakteri metanotrof termasuk bakteri obligat aerob, sehingga dibutuhkan oksigen dalam mengoksidasi metan. Meskipun demikian bakteri ini mampu mengoksidasi metan pada konsentrasi oksigen yang rendah (Charlotte et al. 2009). Penelitian Wilshusen et al. (2004) melaporkan bahwa pada kultur alami metanotrof mampu mengoksidasi metan pada kisaran oksigen 0,45 sampai 20%, baik pada tipe 1 dan tipe II bakteri metanotrof. Amaral dan Knowles (1995) menemukan pada bakteri metanotrof tipe I mampu tumbuh dan beradaptasi baik pada konsentrasi CH4 yang rendah dan
konsentrasi O2 yang tinggi, sedangkan tipe II pada konsentrasi CH4tinggi dan
konsentrasi O2yang rendah. Khairani (2009) melaporkan bahwa isolat BGM 9
dan SKM 14 memiliki aktivitas oksidasi metan yang tinggi pada konsentrasi udara saturasi 50% dan 20%.
Penggantian sumber nitrogen dari NH4Cl dengan nitrat (NaNO3)
menyebabkan aktivitas enzim metan monooksigenase tidak terhambat dalam mengoksidasi metan menjadi karbondioksida. Ion NH4+ yang berasal dari
NH4Cl dapat mengurangi pertumbuhan pada bakteri metanotrof dengan cara
menghambat proses oksidasi metan. Tingkat penghambatannya bervariasi tergantung dari spesies dan galurnya (Bedard & Knowles 1989).
Pertumbuhan bakteri metanotrof pada perlakuan kombinasi antara metanol 2% dan nitrat 1 g/L menghasilkan kerapatan sel yang berbeda tiap isolatnya. Keempat isolat metanotrof menunjukkan pertumbuhan yang tidak relatif tinggi pada hari ke-3 inkubasi, sedangkan amonium akumulasinya mengalami peningkatan (Gambar 8 dan 9). Hal ini menunjukkan sumber nitrogen bakteri untuk biosintesis masih cukup, sehingga amonium yang dihasilkan dari proses fiksasi nitrogen terakumulasi di dalam media. BGM 1 menunjukkan pertumbuhan logaritmik dari hari ke-3 hingga ke-7 inkubasi, sedangkan akumulasi amoniumnya turun pada hari ke-5 inkubasi (Gambar 8 dan 9). Hal ini menunjukkan sumber nitrogen digunakan oleh bakteri untuk tumbuh. Demikian pula pada isolat BGM 3 yang menunjukkan fase logaritmik dari hari ke-9 hingga ke-11 inkubasi, sedangkan akumulasi amoniumnya mengalami penurunan. Hasil uji akumulasi amonium pada perlakuan kombinasi sumber karbon dan nitrogen diperoleh isolat BGM 9 dengan akumulasi amonium tertinggi jika dibandingkan dengan isolat yang lain, yaitu sebesar 47.67 µM pada hari ke-11 inkubasi dan pertumbuhan selnya mengalami penurunan (Gambar 9). Amonium yang terakumulasi di dalam media kultur merupakan hasil dari fiksasi nitrogen yang dilakukan oleh bakteri. Oleh karena itu kadar amonium yang terdapat di dalam media dapat digunakan untuk memperkirakan kemampuan fiksasi nitrogen oleh bakteri.
Fiksasi nitrogen dikatalisis oleh suatu kompleks enzim yaitu sistem nitrogenase. Proses ini dihambat oleh oksigen, termasuk NH3dan asam amino
tertentu (Madigan et al.2006). Beberapa tipe bakteri metanotrof memiliki aktivitas nitrogenase sehingga mampu mengikat N2 pada kondisi mikroaerob.
metanotrof, dan BGM 9 termasuk tipe X metanotrof. Penelitian Maisaroh (2009) menunjukkan bahwa BGM 1, BGM 3, dan BGM 9 memiliki aktivitas nitrogenase. Aktivitas nitogenase tertinggi pada isolat BGM 9 dan terendah pada isolat BGM 3. Pada penelitian ini isolat SKM 14 tidak menunjukkan akumulasi amonium yang meningkat signifikan dan bahkan cenderung menurun (Gambar 9). Berdasarkan karakterisasinya, isolat SKM 14 ini diduga merupakan tipe I metanotrof yang tidak memiliki kemampuan memfiksasi nitrogen. Amonium yang terakumulasi di dalam medianya kemungkinan berasal dari sisa metabolisme nitrogen untuk pertumbuhan sel. Proses fiksasi nitrogen, N2direduksi menjadi amonium kemudian amonium diubah menjadi
bentuk organik dan digunakan dalam biosintesis. Amonium dihasilkan oleh nitrogenase, tetapi tidak menekan enzim. Tetapi pada saat jumlah amonium berlebihan sintesis nitrogenase ditekan dengan cepat.
Oksigen dibutuhkan oleh bakteri metanotrof untuk menghasilkan energi yang akan digunakan dalam proses fiksasi nitrogen. Oleh karena itu bakteri metanotrof membutuhkan konsentrasi oksigen yang rendah selama proses fiksasi nitrogen agar proses fiksasi tidak dihambat. Konsentrasi oksigen yang dapat ditoleransi metanotrof untuk melakukan fiksasi nitrogen berbeda-beda tergantung dari jenis galurnya. Berdasarkan penelitian Ahmad et al. (2010), konsentrasi oksigen optimal untuk aktivitas nitrogenase pada
Methylacidiphilum fumariolicum galur SolV sebesar 0,5% (v/v).
Methylococcus capsulatus Bath memerlukan konsentrasi oksigen sebesar <10% (v/v), 2% (v/v) untuk Methylosinus galur 6, 0,5 1% (v/v) untuk
Methylocystis galur T-1, dan Methylobacter luteus < 2% (v/v). Beberapa bakteri metanotrof lain dilaporkan dapat memfiksasi nitrogen pada konsentrasi oksigen yang tinggi, seperti Methylosinus trichosporium OB3b (15 17%, v/v) dan Methylocapsa acidiphila B2T (konsentrasi oksigen atmosfer) (Dedyshet al.2004).
KESIMPULAN DAN SARAN
Kesimpulan
Laju pertumbuhan spesifik (µ) dari empat isolat bakteri metanotrof yaitu BGM 1 (Methylocystis rosea), BGM 3 (Methylocystis parvus), BGM 9 (Methylococcus parvus), dan SKM 14 (Methylobacter sp.) masing-masing pada perlakuan dengan metanol dan nitrat menunjukkan laju yang berbeda. Kombinasi antara metanol 2% dan 1 g/L nitrat dalam media NMS mampu menghasilkan aktivitas oksidasi metan, yaitu sebesar 0,01 mol/ml kultur/hari untuk BGM 1, 0,04 mol/ml kultur/hari untuk BGM 3, 0,03 mol/ml kultur/hari untuk BGM 9, dan 0,03 mol/ml kultur/hari untuk SKM 14. Akumulasi amonium tertinggi dihasilkan oleh isolat BGM 3 dan SKM 14 sebesar 22,33 µM dan 5,33 µM pada hari ke-9 inkubasi, dan isolat BGM 1 dan BGM 9 pada inkubasi hari ke-11 yaitu sebesar 28,17 µM dan 47,67 µM. Kombinasi metanol 2% dan nitrat 1g/L diujikan pada tanah sawah dalam skala laboratorium mampu menurunkan konsentrasi metan tertinggi sebesar 88,5% pada BGM 1.
Saran.
DAFTAR PUSTAKA
Agus F, Irawan. 2004. Alih guna dana lingkungan lahan sawah. Di dalam: Agus F, Adimihardja A, Hardjowigeno S, Fagi AM, Hartatik W, editor. Tanah Sawah dan Teknologi Pengelolaannya. Bogor: Pusat Penelitian dan Pengembangan Tanah dan Agroklimat.hal 24-28.
Amaral JA, Knowles R. 1995. Growth of methanotrophs in methane and oxygen counter gradients.FEMS Microbiol Letters126: 215-220.
Astuti DD. 2009. Karakterisasi fisiologi dan identifikasi molekuler isolat-isolat bakteri metanotrof asal sawah wilayah Bogor dan Sukabumi. [Skripsi]. Bogor: Departemen Biologi, Institut Pertanian Bogor.
Auman AJ, Speake C, Lidstrom M. 2001.nifHsequences and nitrogen fixation in type I and type II methanotrophs.Appl Environ Microbiol67:4009-4016. Bedard C, Knowles R. 1990. Physiology, biochemistry, and specific inhibitors of
CH4, NH4, and CO oxidation by methanotroph and nitrifiers. Microbiol Rev
53:68-84.
Begonja A, Hrsak D.1998. Growth characteristics and metabolic activities of the methanotrophic-heterotrophic groundwater community. J Appl Microbiol
85:448-456.
Begonja A, Hrsak D. 2001. Effect of growth conditions on the expression of soluble methane monooxygenase.Food Technol Biotechnol39:29-35.
Benstead J, King GM, Williams HG. 1998. Methanol promotes atmospheric methane oxidation by methanotrophic cultures and soils. Appl Environ Microbiol64: 1091-1098.
Budihartono S, Soetaredjo F, Setiawan LE, Nugraheni, Adinugraha. 2009. Pengaruh perbedaan bakteri dan nutrien terhadap penurunan konsentrasi Cr (VI) di tanah menggunakan metode slurry phase bioremediation. Prosiding Seminar Nasional Ilmiah Teknik Kimia Indonesia; Bandung, 19-20 Oktober 2009.
Charlotte S, Jean B, Julia G, Helene A, Kurt S. 2009. Microbial methane oxidation processes and technologies for mitigation of landfill gas emissions.
Ciceron RJ, Oremland RS. 1998. Biogeochemical aspects of atmospheric methane.Glob Biogeochem: 299-327.
Conrad R. 1996. Soil microorganism as controllers of atmospheric trace gases (H2, CO, CH4, OCS, N2O, and NO).Microbial Rev60: 609-640.
Dalton H, Whittenbury R .1976. The acetylene reduction technique as an assay for the nitrogenase activity in the methane oxidizing bacterium Methylococcus capsulatusstrain Bath.Arch Microbiol 109: 147-151.
Dedysh S. N, Ricke P, Liesack W. 2004. NifH and NifD phylogenies: an evolutionary basis for understanding nitrogen fixation capabilities of methanotrophic bacteria.Microbiology150: 1301 1313.
Hanson RS, Hanson T. 1996. Methanotrophic bacteria. Microbiol Rev 60: 439-471.
Hapsary W. 2008. Isolasi dan karakterisasi bakteri metanotrof asal sawah di Bogor dan Sukabumi [skripsi]. Bogor: Departemen Biologi Institut Pertanian Bogor.
Houet al. 2000. Methane and nitrous oxide emissions from a rice field in relation to soil redox and microbial and microbiological processes. Soil Sci Soc Am
64:2180-2186.
Qin D, Chen Z, Marquis M, Averyt KB, Tignor M, Miller H. 2007. Summary for Policymarkers. Contribution of Working Group I due to the Fourth
Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge: University Press.
[IRRI] International Rice Research Institute. 1998. Methane Emission from Ricefields. Manila: IRRI.
Khairani. 2009. Aktivitas oksidasi metan bakteri metanotrof asal lahan sawah pada konsentrasi oksigen yang berbeda. [Tesis]. Bogor: Departemen Biologi, Institut Pertanian Bogor.
King GM. 1992. Ecophysiological characteristics of obligate methanotrophic bacteria and methane oxidation in situ.J Appl Environ Microbiol303-313. Kumaraswary P, Ramakhrisnan B, Sethunathan N.2001. Methane production and
oxidation in anoxic rice soil as influenced by inorganic redox species.
Lehninger AL. 1982. Dasar-Dasar Biokimia. Thenawidjaja M, penerjemah. Jakarta: Erlangga. Terjemahan dari:Principles of Biochemistry.
Lynch M, Wopat A, O Connor M. 1982. Characterization of two new facultative methanotrophs.J App Environ Microbiol 40: 400-407.
Madigan MT, Martinko JM, Parker J. 2006.Brock Biology of Microorganisms. Ed ke-11. New Jersey: Prentice Hall.
Maisaroh. 2009. Aktivitas enzim nitrogenase dan oksidasi metan bakteri metanotrof asal sawah. [Tesis]. Bogor: Departemen Biologi, Institut Pertanian Bogor.
Minamikawa M, KN Sakai. 2006. Mitigation and measurement of methane emission from paddy field. Final Report of International Symposium (Food and Environmental Preservation in Asian Agriculture).
Murrel C, Dalton H. 1983. Nitrogen fixation in obligate methanotrophs. J Gen Microbiol129: 3481-3486.
Neue HU, Roger PA.1994. Potential of Methane Emission in Major Rice Ecologies. Climate Biosphere Interaction :Biogenic Emission & Environmental Effects of Climate Change.Manila: IRRI.
Nurhasanah. 2009. Eksplorasi dan karakterisasi bakteri metanotrof toleran senyawa organoklorin dari lahan sawah di Bogor. [Tesis]. Bogor: Departemen Biologi, Institut Pertanian Bogor.
Patt T, Cole GC, Bland J, Hanson RS. 1974. Isolation and characterization of bacteria that grow on methane and organic compounds as sole sources of carbon and energy.J Bacteriol120:955-964.
Shrestha, M., W. R. Abraham, P. M. Shrestha, M. Noll, and R. Conrad. 2008. Activity and composition of methanotrophic bacterial communities in planted rice soil studied by flux measurements, analyses of pmoA gene and stable isotope probing of phospholipid fatty acids.Environ Microbiol10: 400 412. Setyanto P. 2004. Mitigasi gas metana dari lahan sawah. Di dalam Agus F,
Wang ZP, De Laune RD, Masscheleyn PB, Patrick Jr WH. 1993. Soil redox and pH effects on methane production in a flooded rice soils.Soil Sci Soc57: 382-385.
Whittenbury R, Dalton H. 1981. The methylotrophic bacteria. InThe prokaryotes, a handbook on habits, isolation, and identification of bacteria. New York: SpringerVerlag.
Wihardjaka A. 2001. Emisi gas metan di tanah sawah irigasi dengan pemberian beberapa bahan organik.Agrivita23: 43-51.
Wilshusen JH, Hettiaratchi JPA, Visscher A, Saint Fort R. 2004. Methane oxidation and formation of EPS in compost:Effect of oxygen concentration.
Lampiran 1 Hasil uji aktivitas oksidasi metan pada perlakuan metanol dengan
BGM 1 4343,29 43,45 0,0027 0,0024 0,0004
4452,13 31,91 0,0020
BGM 3 4550,40 21,48 0,0013 0,0030 0,0017
4045,11 75,08 0,0047
BGM 9 4327,67 45,11 0,0028 0,0020 0,0008
4575,38 18,83 0,0012
SKM 14 4381,38 39,41 0,0025 0,0024 0,0000
4386,69 38,85 0,0024
Perlakuan metanol 5%
BGM 1 4098,93 69,37 0,0043 0,0042 0,0001
4140,78 64,93 0,0041
BGM 3 4195,72 59,10 0,0037 0,0034 0,0003
4288,83 49,23 0,0031
BGM 9 4007,19 79,10 0,0049 0,0035 0,0015
4449,43 32,19 0,0020
SKM 14 4166,66 62,18 0,0039 0,0035 0,0004
4292,77 48,81 0,0031
Perlakuan metanol 10%
BGM 1 3607,80 121,46 0,0076 0,0076 0,0000
3594,57 122,86 0,0077
BGM 3 3392,95 144,24 0,0090 0,0078 0,0012
3753,06 106,05 0,0066
BGM 9 2010,36 290,88 0,0182 0,0180 0,0002
2066,48 284,93 0,0178
SKM 14 3251,63 159,23 0,0100 0,0087 0,0013
3643,23 117,70 0,0074
Perlakuan metanol 15 %
BGM 1 2911,24 195,33 0,0122 0,0086 0,0037
4014,68 78,30 0,0049
BGM 3 3508,08 132,03 0,0083 0,0074 0,0008
3750,95 106,27 0,0066
BGM 9 3233,49 161,16 0,0101 0,0084 0,0016
3726,70 108,85 0,0068
SKM 14 3495,54 133,36 0,0083 0,0086 0,0003
Lampiran 2 Hasil uji aktivitas oksidasi metan pada perlakuan nitrat dengan
BGM 1 2839,82 202,91 0,0127 0,0126 0,0001
2866,46 200,08 0,0125
BGM 3 3096,75 175,66 0,0110 0,0120 0,0010
2801,47 206,98 0,0129
BGM 9 3258,68 158,48 0,0099 0,0091 0,0008
3512,69 131,54 0,0082
SKM 14 3206,27 164,04 0,0103 0,0110 0,0008
2965,72 189,56 0,0118
Perlakuan nitrat 1 g/L
BGM 1 2877,83 198,88 0,0124 0,0128 0,0003
2772,29 210,07 0,0131
BGM 3 2906,13 195,88 0,0122 0,0107 0,0015
3357,11 148,04 0,0093
BGM 9 3034,15 182,30 0,0114 0,0116 0,0002
2981,43 187,89 0,0117
SKM 14 2833,34 203,60 0,0127 0,0147 0,0020
2234,14 267,15 0,0167
Perlakuan nitrat 1,5 g/L
BGM 1 1585,51 335,94 0,0210 0,0167 0,0043
2884,18 198,20 0,0124
BGM 3 3057,17 179,86 0,0112 0,0116 0,0003
2962,25 189,92 0,0119
BGM 9 3257,94 158,56 0,0099 0,0094 0,0006
3425,71 140,77 0,0088
SKM 14 3297,05 154,41 0,0097 0,0109 0,0012
2927,17 193,64 0,0121
Perlakuan nitrat 2 g/L
BGM 1 3112,95 173,94 0,0109 0,0111 0,0003
3030,92 182,64 0,0114
BGM 3 2982,66 187,76 0,0117 0,0114 0,0003
3073,38 178,14 0,0111
BGM 9 3286,58 155,53 0,0097 0,0095 0,0002
3349,30 148,87 0,0093
SKM 14 3281,75 156,04 0,0098 0,0096 0,0002
Lampiran 3 Pertumbuhan isolat bakteri metanotrof pada konsentrasi metanol dan nitrat berbeda selama 12 hari inkubasi dengan sumber karbon metan
Perlakuan Nilai Optical Density ( = 620 nm) BGM
1
BGM 3
BGM 9
SKM 14 Konsentrasi metanol
(%)
2 0.129 0.053 0.072 0.089
5 0.044 0.072 0.063 0.062
10 0.197 0.054 0.139 0.022
15 0.197 0.055 0.037 0.071
Modifikasi nitrat (g/L)
0.5 0.026 0.023 0.028 0.004
1 0.027 0.030 0.023 0.028
1.5 0.022 0.012 0.016 0.018
ABSTRACT
SARI WIRYANINGTYAS. Growth and Methane Oxidation Activity of Methanotrophic Bacteria in Different Media. Supervised by IMAN RUSMANA AND NISA RACHMANIA MUBARIK
Methanotrophs are bacteria that can utilize methane or C1 compounds as their sole carbon and energy source. Previous study resulted that BGM 1, BGM 3, BGM 9, and SKM 14 isolates could oxidized CH4. Objective of this
research was to formulate medium composition for production of methanotrophic bacteria. The substances that we used as carbon sources were methanol, mollase. And a nitrate was as a nitrogen source. Specific growth rate of bacteria in methanol and nitrate was different for each isolate. The best carbon and nitrogen sources of medium for bacterial growth was methanol 2% and nitrate 1 g/L. Methane oxidation rate of BGM 1, BGM 3, BGM 9, and SKM 14 isolates was 0.01, 0.04, 0.03, and 0.03 mol/ml culture/day respectively. The highest activity of methane oxidation was perfomed by BGM 3 isolate, and the highest ammonium accumulation was perfomed by BGM 9 isolate. The bacterial cells produced by medium of combination methanol 2% and nitrate 1 g/L were tested in soil of a rice field in laboratorium scale. The result showed that methane concentration was decreased in twelveth days of incubation. The methane reduction activity of the isolates during incubation of 8 to 12 days was 88.5%, 85.1%, 47.8%, and 66.4% for BGM 1, BGM 3, BGM 9, and SKM 14 isolates respectively.
PENDAHULUAN
Latar Belakang
Pemanasan global yang disebabkan oleh emisi gas rumah kaca semakin meningkat persentasenya hingga 70% antara tahun 1970 hingga 2004 (Shrestha et al.2008). Gas-gas rumah kaca penyebab pemanasan global ini ialah CH4, CO2, N2O, dan CFC. Gas metan (CH4) di atmosfer menunjukkan
peningkatan konsentrasi dari 715 ppb hingga 1732 ppb dari tahun 1970 hingga awal tahun 1990, dan telah meningkat lagi sebesar 1774 ppb pada tahun 2005 (Qin et al. 2007). Gas CH4 dapat menyerap radiasi infra merah 25 kali lebih
efektif jika dibandingkan dengan CO2. Menurut Setyanto (2004),
penggenangan seperti pada tanah sawah dan lahan basah lainnya merupakan salah satu sumber munculnya emisi CH4. Kondisi tanah yang tergenang
menyebabkan suasana reduktif di dalam tanah sehingga pertumbuhan bakteri metanogen meningkat. Seiring dengan peningkatan produksi padi, emisi CH4
juga semakin meningkat jika di dalam pengelolaannya tidak diiringi dengan upaya penurunan emisi. Salah satu upaya untuk menekan emisi CH4 yaitu
dengan pemanfaatan mikrob metanotrof. Mikrob ini akan memanfaatkan metan sebagai sumber karbon dan energinya.
Emisi CH4pada dasarnya ditentukan oleh dua proses mikrob yang berbeda,
yaitu produksi CH4 oleh bakteri metanogen dan konsumsi CH4 oleh bakteri
metanotrof. Sebagian dari metan yang telah diproduksi akan dioksidasikan oleh bakteri metanotrof di lapisan permukaan tanah dan di zona perakaran (Bedard & Knowles 1990). Beberapa faktor lingkungan seperti pH tanah, bahan organik tanah, suhu, potensial redoks tanah mempengaruhi produksi CH4 pada lahan sawah. Penelitian Hanson dan Hanson (1996) menunjukkan
Pada penelitian sebelumnya telah berhasil diisolasi bakteri metanotrof dari sawah asal Bogor dan Sukabumi (Hapsary 2008). Di antara beberapa isolat yang diperoleh, terdapat 4 isolat terbaik dalam mengoksidasi metan. Isolat tersebut ialah BGM 1, BGM 3, BGM 9, dan SKM 14. Keempat isolat ini telah didentifikasi oleh Astuti (2009) sebagai Methylococcus rosea, Methylocystis rosea, Methylococcus capsulatus, dan Methylobacter sp. Maisaroh (2009) melaporkan bahwa isolat BGM 1, BGM 3, dan BGM 9 menunjukkan adanya aktivitas nitrogenase, sehingga isolat tersebut memiliki kemampuan untuk melakukan fiksasi nitrogen. Isolat BGM 9 dan SKM 14 selain mampu mengoksidasi metan dan fiksasi nitrogen, juga berpotensi mengurangi residu organoklorin dari lahan sawah (Nurhasanah 2009). Untuk mengaplikasikan bakteri metanotrof tersebut pada lahan pertanian maka diperlukan produksi bakteri tersebut pada media yang ekonomis dan optimum.
Tujuan Penelitian
Penelitian ini bertujuan untuk memformulasi media produksi bakteri metanotrof yang memiliki aktivitas oksidasi CH4dan fiksasi N2yang tinggi.
Manfaat Penelitian
TINJAUAN PUSTAKA
Karakteristik dan Klasifikasi Bakteri Metanotrof
Bakteri metanotrof adalah bakteri Gram negatif, bersifat aerob dan menggunakan metan sebagai sumber karbon dan energi (Auman 2001). Karakteristik penting dari metanotrof ini ialah memiliki enzim metan mono-oksigenase yang dapat mengkatalisis metan menjadi metanol. Jenis metanotrof yang telah dilaporkan ialah metanotrof obligat dan fakultatif. Metanotrof obligat hanya tumbuh dengan menggunakan metan (CH4) dan metanol
(CH3OH), sedangkan metanotrof fakultatif dapat tumbuh dengan
menggunakan senyawa multikarbon seperti etanol dan propanol (Lynch et al.
1982). Whittenburyet al.(1970) menggolongkan bakteri pengoksidasi CH4 ke
dalam lima genus berdasarkan perbedaan morfologi, tipe bentuk fase istirahat, struktur membran intrasitoplasma, dan beberapa karakteristik fisiologi. Kelima genus tersebut ialah Methylomonas, Methylobacter, Methylococcus,
Methylosistis,danMethylosinus.
Berdasarkan perbedaan jalur biosintesis dan morfologinya, bakteri metanotrof dibagi 3 tipe (Tabel 1). Tipe I mensintesis formaldehida dengan menggunakan jalur Ribulosa Monofosfat (RuMP), contohnya dari genus
Methylomonas dan Methylobacter. Tipe II mensintesis formaldehida melalui jalur serin, contohnya dari genus Methylosinus dan Methylocystis. Tipe X metanotrof mensintesis formaldehida menggunakan jalur RuMP dan dihasilkan juga enzim ribulosa-bifosfat karboksilase meskipun hanya dalam konsentrasi yang sedikit. Perbedaan lain dari ketiga jenis metanotrof tersebut dilihat dari kemampuan hidup pada suhu tinggi. Metanotrof tipe X mampu hidup pada suhu tinggi (lebih dari 45 0C) daripada tipe I dan II (Hanson & Hanson 1996).
Metanotrof sebagai Bakteri Pengoksidasi Metan
oksigennya akan berikatan dengan metan membentuk metanol, sedangkan atom oksigen yang lain akan direduksi menjadi H2O. Terdapat dua jenis enzim
metan monooksigenase yaitu enzim metan monooksigenase terlarut (sMMO) dan enzim metan monooksigenase terikat membran (pMMO).
Tabel 1 Karakteristik metanotrof tipe I, tipe II, dan tipe X (Hanson & Hanson 1996)
Karakteristik Tipe I Tipe II Tipe X
Hampir semua metanotrof memiliki pMMO kecuali Methylocella, sedangkan sMMO tidak ada di semua metanotrof tetapi dimiliki oleh sebagian metanotrof tipe II dan metanotrof tipe X (Mancinelli 1995). Proses oksidasi metan lebih dominan dikatalisis oleh enzim pMMO (Lieberman & Rosenzweig 2004). Untuk mengekspresikan aktivitas enzim pMMO dibutuhkan ion Cu (tembaga) dalam media tumbuhnya. Konsentrasi Cu yang dibutuhkan lebih dari 0,85 sampai 1 mol/ bobot kering sel. Enzim pMMO telah ditemukan pada semua bakteri metanotrof (Zahn & Dispirito 1996) dari sekitar 130 bakteri yang telah diisolasi (Bowman et al. 1993; Hanson & Hanson 1996).
Metanol akan dioksidasi oleh enzim metanol dehidrogenase menjadi formaldehida. Enzim formaldehida dehidrogenase mengoksidasi formaldehida menjadi format, dan kemudian dioksidasi lagi oleh format dehidrogenase menjadi CO2(Gambar 1).
Asimilasi formaldehida juga dapat digunakan untuk sintesis senyawa multikarbon. Jalur ini terdapat dua jenis yaitu jalur serin dan jalur RuMP (ribulosa monofosfat). Jalur serin digunakan oleh metanotrof tipe II. Senyawa asetil ko-A disintesis dari satu molekul formaldehida dan satu molekul CO2.