AKTIVITAS OKSIDASI METAN DAN REDUKSI
DINITROGEN OKSIDA (N2O) KULTUR KOMBINASI
BAKTERI METANOTROF DAN Ochrobactrum anthropi
RANI MAHARANI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
RANI MAHARANI. Aktivitas Oksidasi Metan dan Reduksi Dinitrogen Oksida (N2O) Kultur
Kombinasi Bakteri Metanotrof dan Ochrobactrum anthropi. Dibimbing oleh IMAN RUSMANA dan ALINA AKHDIYA.
Lahan sawah merupakan salah satu sumber emisi metan (CH4) dan dinitrogen oksida
(N2O). Bakteri metanotrof dan bakteri denitrifikasi yang memiliki aktivitas tinggi dalam oksidasi
metan dan reduksi N2O berperan sangat penting untuk mengendalikan emisi CH4 dan N2O dari
lahan sawah. Penelitian ini dilakukan untuk menguji aktivitas oksidasi metan dan reduksi N2O dari
empat bakteri metanotrof (BGM 1, BGM 5, BGM 9, dan SKM 14) dan dua isolat Ochrobactrum anthropi (BL 1 dan BL 2). Sebanyak enam kombinasi diinokulasikan ke dalam campuran media
Nitrate Mineral Salt (NMS) dan media denitrifikasi, kemudian diuji aktivitas oksidasi metan, reduksi N2O, akumulasi amonium, nitrit, dan nitrat. Kultur kombinasi isolat BGM 1, SKM 14, BL
1, dan BL 2 memiliki aktivitas oksidasi CH4 (2,9 x 10-8 µM/sel/hari), reduksi N2O (0,15 x 10-9
µM/sel/hari), dan akumulasi amonium (19,3 x 10-8 µM/sel/hari) tertinggi dibandingkan kultur kombinasi lainnya. Kultur kombinasi isolat BGM 1, SKM 14, dan BL 1 memiliki akumulasi nitrat tertinggi (17,6 µM) dan kultur kombinasi isolat BGM 5, BGM 9, BL 1, dan BL 2 memiliki akumulasi nitrit tertinggi (10,9 µM).
Kata kunci: Metan, N2O, bakteri metanotrof, Ochrobactrum anthropi, oksidasi metan, reduksi
N2O, akumulasi amonium, akumulasi nitrit, akumulasi nitrat
ABSTRACT
RANI MAHARANI. Methane Oxidation and Nitrous Oxide (N2O) Reduction Activity on
Combination Culture of Methanotrophic Bacteria and Ochrobactrum anthropi. Under supervision of IMAN RUSMANA and ALINA AKHDIYA.
Rice fields are one source of methane (CH4) and nitrous oxide (N2O) emission.
Methanotrophic bacteria and denitrifying bacteria possesing high methane oxidation and N2O
reduction activity are very important for controlling CH4 and N2O emission from rice fields. This
research was conducted to test the activity of methane oxidation and N2O reduction from four
methanotrophic bacteria (BGM 1, BGM 5, BGM 9, and SKM 14 isolates) and two Ochrobactrum anthropi isolates (BL 1 and BL 2 isolates). Six combination were inoculated into Nitrate Mineral Salt (NMS) media mixed with denitrification media, then the activity of methane oxidation, N2O
reduction, accumulation of ammonium, nitrite, and nitrate was analyzed. Combination culture E of BGM 1, SKM 14, BL 1, and BL 2 isolates had the highest CH4 oxidation (2,9 x 10
-8
µM/cell/day), N2O reduction activities (0,15 x 10-9 µM/cell/day), and accumulation of ammonium (19,3 x 10-8
µM/cell/day) than the other combination cultures. Combination culture of BGM 1, SKM 14, and BL 1 isolates had the highest accumulation of nitrate (17,6 µM) and combination culture of BGM 5, BGM 9, BL 1, and BL 2 isolates had the highest accumulation of nitrite (10,9 µM).
Keyword: Methane, N2O, methanotrophic bacteria, Ochrobactrum anthropi, accumulation of
AKTIVITAS OKSIDASI METAN DAN REDUKSI
DINITROGEN OKSIDA (N2O) KULTUR KOMBINASI
BAKTERI METANOTROF DAN Ochrobactrum anthropi
RANI MAHARANI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul
: Aktivitas Oksidasi Metan dan Reduksi Dinitrogen Oksida (N
2O)
Kultur Kombinasi Bakteri Metanotrof dan
Ochrobactrum
anthropi
.
Nama
: Rani Maharani
NIM
: G34070011
Menyetujui:
Pembimbing I,
Pembimbing II,
(Dr. Ir. Iman Rusmana, M.Si)
(Alina Akhdiya, M.Si)
NIP 19650720 199002 1 002
NIP 19681208 200112 2 001
Mengetahui:
Ketua Departemen Biologi
Fakultas Matematika dan Ilmu Pengetahuan Alam
(Dr. Ir. Ence Darmo Jaya Supena, M.S.)
NIP 19641002 198903 1 002
PRAKATA
Puji syukur kepada ALLAH SWT atas rahmat dan kasih sayang-Nya sehingga penulis dapat menyelesaikan karya ilmiah ini. Penelitian ini dilaksanakan pada bulan Januari 2011 sampai Mei 2011 dengan judul Aktivitas Oksidasi Metan dan Reduksi Dinitrogen Oksida (N2O) Kultur
Kombinasi Bakteri Metanotrof dan Ochrobactrum anthropi.
Penulis mengucapkan terima kasih kepada Bapak Dr. Ir. Iman Rusmana, M.Si dan Ibu Alina Akhdiya, M.Si atas bimbingan, masukan, dan arahan yang diberikan sehingga penulis dapat menyelesaikan penelitian dan penulisan karya ilmiah ini. Terima kasih kepada keluarga, seluruh staf Laboratorium Mikrobiologi, dan rekan-rekan yang melaksanakan penelitian di Laboratorium Mikrobiologi atas dukungan yang diberikan. Selain itu, terima kasih kepada DIKTI yang telah memberikan beasiswa sejak tahun 2007 sampai tahun 2011 sehingga penulis dapat menyelesaikan pendidikan di IPB. Terima kasih pula penulis ucapkan kepada semua pihak yang telah membantu dalam pengumpulan data karya ilmiah ini serta seluruh rekan Biologi angkatan 44 atas kebersamaan dan dukungan yang diberikan kepada penulis.
Semoga karya ilmiah ini dapat bermanfaat bagi yang memerlukannya.
Bogor, Juli 2011
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 4 Maret 1989 dari ayahanda Jarkasih dan ibunda Arnayuwenti. Penulis merupakan anak kedua dari dua bersaudara. Tahun 2007 penulis lulus dari SMA Negeri 1 Ciampea. Pada tahun yang sama, penulis diterima sebagai mahasiswi program studi Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI). Pada tahun 2007-2011 penulis terdaftar sebagai penerima beasiswa Peningkatan Prestasi Akademik (PPA) dari DIKTI.
Selama mengikuti perkuliahan, penulis aktif dalam beberapa organisasi kemahasiswaan dan berbagai kepanitiaan yang diselenggarakan di IPB. Penulis pernah menjadi staf divisi Biosains Himabio IPB tahun 2008-2009, sekretaris pada kepanitiaan Revolusi Sains 1 dan Workshop Karya Ilmiah Populer, koordinator divisi kesekretariatan Lomba Cepat Tepat Biologi (LCTB) dan staf divisi kesekretariatan Biologi Interaktif pada tahun 2009, staf divisi Penanggung Jawab Keluarga (PJK) dalam kepanitiaan Masa Perkenalan Kampus Mahasiswa Baru (MPKBM) tahun 2008 yang diselenggarakan oleh BEM TPB, serta beberapa kepanitiaan lainnya. Penulis juga aktif sebagai asisten praktikum Ilmu Lingkungan dan Biologi Dasar pada tahun ajaran 2010/2011.
Pada tahun 2009, penulis melaksanakan studi lapang di Wana Wisata Cangkuang, Sukabumi dengan judul laporan “Laju Denitrifikasi dan Nitrifikasi Mikroba Tanah Hutan Cangkuang” di bawah bimbingan Bapak Dr. Ir. Iman Rusmana, M.Si. Pada tahun 2010, penulis melaksanakan praktik lapangan di Laboratorium Kultur Jaringan Kebun Raya Bogor dengan judul laporan “Potensi Pengembangan Kultur Jaringan dan Semai Biji Nepenthes di Kebun Raya Bogor”
DAFTAR ISI
Halaman
DAFTAR TABEL ...viii
DAFTAR GAMBAR ...viii
DAFTAR LAMPIRAN ...viii
PENDAHULUAN... 1
Latar Belakang ... 1
Tujuan... 1
Waktu dan Tempat ... 1
BAHAN DAN METODE ... 1
Bahan ... 1
Metode ... 1
Peremajaan dan Perbanyakan Isolat ... 1
Formulasi Kultur Bakteri Metanotrof dan Ochrobactrum anthropi ... 1
Penghitungan Pertumbuhan Bakteri pada Kultur Kombinasi ... 2
Pengukuran Aktivitas Oksidasi CH4 dan Reduksi N2O ... 2
Pengukuran Aktivitas Fiksasi N2 ... 2
Pengukuran Aktivitas Akumulasi Nitrat dan Nitrit... 2
HASIL ... 2
Pertumbuhan Bakteri pada Kultur Kombinasi ... 2
Aktivitas Oksidasi CH4 dan Reduksi N2O pada Kultur Kombinasi ... 3
Aktivitas Fiksasi N2, Akumulasi Nitrat, dan Akumulasi Nitrit dalam Kultur Kombinasi ... 3
PEMBAHASAN ... 4
SIMPULAN ... 6
SARAN ... 6
DAFTAR PUSTAKA ... 6
DAFTAR TABEL
Halaman
1 Pertumbuhan bakteri metanotrof dan Ochrobactrum anthropi dalam kultur kombinasi... 3
2 Aktivitas reduksi N2O pada kultur kombinasi ... 3
DAFTAR GAMBAR
Halaman 1 Aktivitas oksidasi CH4 pada kultur kombinasi ... 32 Konsentrasi amonium terakumulasi pada kultur kombinasi ... 4
3 Laju akumulasi amonium pada kultur kombinasi ... 4
4 Konsentrasi nitrit terakumulasi pada kultur kombinasi ... 4
5 Konsentrasi nitrat terakumulasi pada kultur kombinasi ... 4
DAFTAR LAMPIRAN
Halaman 1 Kurva standar amonium ... 92 Kurva standar nitrit ... 9
PENDAHULUAN
Latar Belakang
Perubahan iklim yang terjadi beberapa tahun terakhir merupakan dampak pemanasan global yang disebabkan oleh peningkatan gas rumah kaca di atmosfer seperti karbon dioksida (CO2), chloro flourocarbon (CFC),
metan (CH4), dan dinitrogen oksida (N2O).
Berdasarkan konsentrasinya, kontribusi CO2,
CFC, CH4 dan N2O terhadap pemanasan
global berturut-turut sebesar 55%, 24%, 15%, dan 6% (IPCC 1992). Gas CH4 dan N2O
memiliki potensi penyerapan panas yang lebih tinggi dibandingkan dengan CO2 karena CH4
dan N2O lebih efektif dalam menyerap radiasi
pada panjang gelombang 4 sampai 100 nm (iradiasi sinar infra merah). Metan dan N2O
masing-masing mengabsorbsi panas sebesar 25 dan 150 kali lebih tinggi dibandingkan dengan CO2 (Lelieveld et al. 1993; Paul &
Clark 1996).
Tanah sawah merupakan salah satu sumber utama gas CH4 dan N2O. CH4
dihasilkan oleh bakteri metanogen pada kondisi anaerob, sedangkan N2O dihasilkan
dalam tanah melalui proses reduksi nitrat oleh bakteri denitrifikasi pada kondisi anaerob dan oksidasi hydroxylamine (NH2OH) menjadi
nitrit pada kondisi aerob (Bremner 1997; Falcone et al. 1962; Ritchie & Nicholas 1974). Emisi CH4 dapat direduksi oleh bakteri
metanotrof karena memiliki aktivitas enzim
Methane Monooxygenase (MMO), sedangkan emisi N2O dapat direduksi oleh bakteri
denitrifikasi yang memiliki aktivitas enzim
N2O reductase seperti Ochrobactrum
anthropi. Oksidasi CH4 oleh bakteri
metanotrof di lahan sawah dapat mencapai 80% dari total CH4 yang diproduksi oleh
bakteri metanogen (Conrad & Rothfus 1991). Beberapa isolat bakteri metanotrof dan bakteri O. anthropi masing-masing telah diuji aktivitas oksidasi CH4 dan reduksi N2O di
Laboratorium Mikrobiologi Departemen Biologi FMIPA IPB. Hasil penelitian Hanif (2010) dan Chatrina (2010) menunjukkan bahwa beberapa kombinasi bakteri metanotrof memiliki aktivitas oksidasi CH4 yang tinggi
serta mampu menambat nitrogen dari udara. Pengujian yang dilakukan terhadap
O.anthropi BL 1 dan BL 2 menunjukkan kedua bakteri ini memiliki aktivitas reduksi N2O yang tinggi (Setyaningsih et al. 2010).
Kemampuan bakteri metanotrof dan
O.anthropi tersebut berpotensi untuk
dikembangkan sebagai agen pereduksi emisi metan dan N2O di lahan sawah.
Tujuan
Penelitian ini bertujuan untuk menguji aktivitas kombinasi isolat bakteri metanotrof
dan Ochrobactrum anthropi dalam
mengoksidasi CH4 dan mereduksi N2O.
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Januari 2011 sampai Mei 2011 di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA IPB.
BAHAN DAN METODE
Bahan
Isolat bakteri yang digunakan dalam penelitian ini adalah 4 isolat bakteri metanotrof BGM 1, BGM 5, BGM 9, dan SKM 14 (Hapsari 2008) dan 2 isolat bakteri
Ochrobactrum anthropi BL 1 dan BL 2 (Setyaningsih et al. 2010). Bahan yang digunakan adalah media Nitrate Mineral Salts
(MgSO4.7H2O 1,0 g/L; CaCl2.6H2O 0,2 g/L;
KNO3 1,0 g/L; KH2PO4 0,272 g/L; Na2HPO4
4,0 g/L; NH4Cl 4,0 mg/L; Na2EDTA 0,5 g/L;
FeSO4.7H2O 0,2 g/L; H3BO4 0,03 g/L;
CoCl2.6H2O 0,02 g/L; ZnSO4.7H2O 0,01 g/L;
MnCl2.4H2O 3,0 mg/L; Na2MoO4. 2H2O 3,0
mg/L; NiCl2.6H2O 2,0 mg/L; CaCl2.2H2O 1,0
mg/L), media denitrifikasi (2,72 g/L CH3COONa.3H2O; 0,8 g/L K2HPO4; 0,3 g/L
KH2PO4; 0,4 g/L NH4Cl; 5,2 g/L
MgSO4.7H2O; 3 g/L yeast extract), Bacto agar
20 g/L, metanol 1 %, larutan NH4Cl 100 μM,
NaNO2 100 μM, fenol alkohol 10%, Natrium
dihidro nitroprusid 0,5 %, Natrium sitrat 20%, Natrium hipoklorit 5,25%, Sulfanilamide 1%, dan NED 0,1%.
Metode
Peremajaan dan Perbanyakan Isolat.
Isolat BGM 1, BGM 5, BGM 9, dan SKM 14 diremajakan pada media agar NMS + 1% metanol, sedangkan isolat BL 1 dan BL 2 diremajakan pada media denitrifikasi dan diinkubasi selama 5-7 hari pada suhu ruang. Koloni tunggal yang tumbuh dipilih dan digoreskan pada media yang sama. Perbanyakan kultur dilakukan dengan menggunakan media cair yang sesuai.
Formulasi Kultur Bakteri Metanotrof
dan Ochrobactrum anthropi. Pengujian
2
dan kombinasi F (BGM 5, BGM 9, BL 1, BL 2). Masing-masing bakteri diinokulasi sebanyak 2% ke campuran media cair NMS dan media denitrifikasi bebas N dalam tabung reaksi dengan sumbat karet. Komposisi gas di
headspace tabung dibuat 20% N2O, 30% CH4,
dan 50% udara, kemudian diinkubasi di atas mesin penggoyang pada suhu ruang. Setelah 15 hari inkubasi dilakukan penghitungan jumlah sel bakteri, pengukuran aktivitas oksidasi CH4, reduksi N2O, akumulasi nitrat,
nitrit, dan amonium. Setiap kombinasi dibuat menjadi tiga kali ulangan.
Penghitungan Pertumbuhan Bakteri pada Kultur Kombinasi. Pada akhir masa inkubasi, masing-masing kultur kombinasi diencerkan dengan metode pengenceran serial. Sebanyak 1 ml kultur kombinasi dicampurkan ke dalam 9 ml larutan NaCl 0,85% untuk memperoleh faktor pengenceran 10-1. Pengenceran dilanjutkan hingga diperoleh faktor pengenceran 10-5. Setelah itu, sebanyak 0,1 ml hasil pengenceran terakhir disebar ke cawan dengan media yang sesuai. Koloni-koloni tunggal yang terbentuk dihitung, kemudian dikonversi ke dalam jumlah sel relatif.
Pengukuran Aktivitas Oksidasi CH4
dan Reduksi N2O. Aktivitas oksidasi CH4
dan reduksi N2O diukur dengan cara
mengukur konsentrasi gas CH4 dan N2O
tersisa pada bagian headspace menggunakan teknik kromatografi gas seperti yang dipaparkan oleh Kumaraswamy et al. (2001). Pengukuran gas ini dilakukan di Balai Penelitian Lingkungan Pertanian di Jakenan Pati, Jawa Tengah.
Pengukuran Aktivitas Fiksasi N2. Kemampuan fiksasi nitrogen kultur kombinasi diukur berdasarkan amonium yang diakumulasikan dalam media pertumbuhan. Sebanyak 5 ml sampel disentrifuse pada kecepatan 4000 rpm selama 10 menit. Setelah itu, 3 ml sampel tersebut ditambah dengan 0,12 ml fenol alkohol 10% dan dicampur hingga homogen. Sampel ditambah dengan 0,12 ml larutan Na-Dihidronitroprusid 0,5%, dan dicampur kembali hingga homogen, kemudian direaksikan dengan 0,3 ml campuran Na-sitrat : Na-hipoklorit (1:4) dan didiamkan selama satu jam sampai berubah warna menjadi biru. Setelah itu, campuran tersebut diukur Optical Density (OD) pada panjang gelombang 640 nm (Cleseri et al.
1989). Sebagai standar digunakan larutan NH4Cl dengan konsentrasi 0, 5, 10, 20, 50,
dan 100 µM. Kurva standar amonium dapat dilihat pada lampiran 1.
Pengukuran Aktivitas Akumulasi Nitrat dan Nitrit. Reduksi nitrat dianalisis menggunakan metode Greenberg et al.(1992). Sebanyak 20 ml sampel yangtelah diencerkan dimasukkan ke dalam kolom reduksi yang berisi Cadmium. Pada saat sampel melewati kolom reduksi, Cadmium akan mereduksi nitrat menjadi nitrit. Setelah itu, sampel dianalisis kadar nitritnya berdasarkan metode Sulfanilamide. Sebanyak 5 ml sampel direaksikan dengan 0,1 ml larutan sulfanilamide 1 % dan dicampur hingga homogen. Campuran tersebut selanjutnya direaksikan dengan 0,1 ml larutan NED 0,1 % dan dicampur hingga homogen. Uji positif nitrit ditandai dengan perubahan warna menjadi merah muda dan diukur OD-nya pada panjang gelombang 540 nm (Cleseri et al. 1989). Nilai konsentrasi nitrat diperoleh melalui selisih antara konsentrasi nitrit yang dilewatkan pada kolom reduksi dengan konsentrasi nitrit yang tidak dilewatkan pada kolom reduksi. Sebagai standar digunakan larutan NaNO2 dengan konsentrasi 0, 5, 10,
20, 50, dan 100 µM. Kurva standar nitrit dapat dilihat pada lampiran 2.
HASIL
Pertumbuhan Bakteri pada Kultur Kombinasi
Masing-masing bakteri dalam kultur kombinasi menunjukkan pertumbuhan yang berbeda (Tabel 1). Jumlah sel tertinggi terdapat pada kombinasi B yaitu 175 x 106 sel/ml untuk bakteri metanotrof dan 124 x 106 sel/ml untuk O. anthropi BL2, sedangkan jumlah sel terendah terdapat pada kombinasi C yaitu 63 x 106 sel/ml untuk bakteri metanotrof dan 51 x 106 sel/ml untuk bakteri
3
Tabel 1 Pertumbuhan bakteri metanotrof dan
Ochrobactrum anthropi dalam kultur kombinasi Kode kombinasi isolat Isolat Kepadatan Sel ( x 106
sel/ml)
Persentase (%)
A BGM 1 56 32,8
SKM 14 72 42,1
BL 1 43 25,1
B BGM 1 84 28,1
SKM 14 91 30,4
BL 2 124 41,5
C BGM 5 44 38,6
BGM 9 19 16,7
BL 1 51 44,7
D BGM 5 100 35,7
BGM 9 62 22,1
BL 2 118 42,2
E BGM 1 38 24,5
SKM 14 41 26,5
BL 1 33 21,3
BL 2 43 27,7
F BGM 5 63 23,8
BGM 9 50 18,9
BL 1 63 23,8
BL 2 89 33,5
Aktivitas Oksidasi CH4 dan Reduksi N2O
pada Kultur Kombinasi
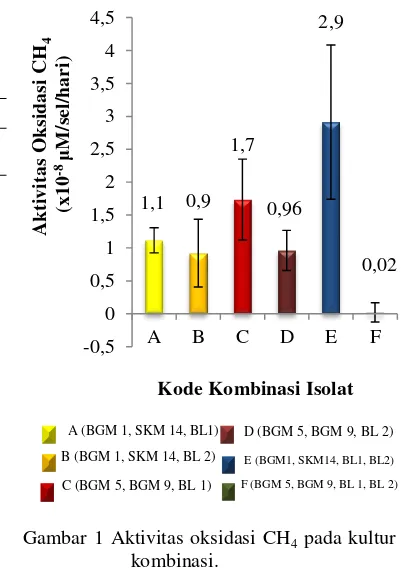
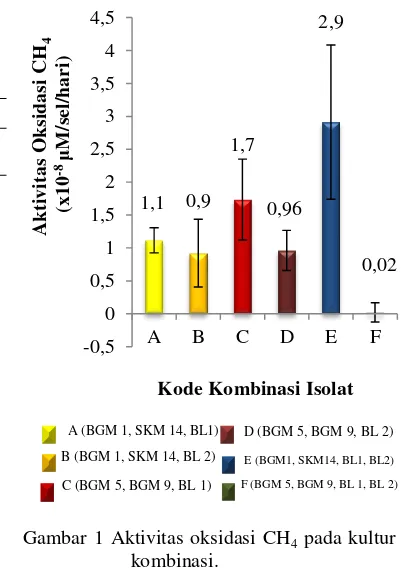
Masing-masing kultur kombinasi menunjukkan aktivitas oksidasi CH4 dan
reduksi N2O yang berbeda. Kombinasi E
(BGM 1, SKM 14, BL 1, BL 2) menghasilkan aktivitas oksidasi CH4 tertinggi yaitu 2,9x10
-8
μM/sel/hari, sedangkan aktivitas oksidasi CH4
terendah dihasilkan oleh kombinasi F (BGM5, BGM 9, BL 1, BL 2) yaitu 0,02 x 10-8 μM/sel/hari (Gambar 1).
Kombinasi E selain menghasilkan aktivitas oksidasi CH4 tertinggi juga
menunjukkan aktivitas reduksi N2O tertinggi
yaitu 0,15 x 10-9 μM/sel/hari. Aktivitas reduksi N2O juga ditunjukkan oleh
kombinasi F (BGM 5, BGM 9, BL 1, BL 2) yaitu 0,02 x 10-9 μM/sel/hari, sedangkan empat kombinasi lainya tidak menunjukkan aktivitas reduksi N2O (Tabel 2).
Gambar 1 Aktivitas oksidasi CH4 pada kultur
kombinasi.
Tabel 2 Aktivitas reduksi N2O pada kultur
kombinasi
Kode isolat
Aktivitas reduksi N2O
( x 10-9 μM/sel/hari) A -1,76 ± 0,25 * B -0,48 ± 0,09 * C -1,80 ± 0,28 * D -0,0002 ± 0,03*
E 0,15 ± 0,01
F 0,02 ± 0,05
* Nilai negatif menunjukkan terdapat produksi N2O.
Aktivitas Fiksasi N2, Akumulasi Nitrat, dan
Akumulasi Nitrit dalam Kultur Kombinasi
Kemampuan masing-masing kultur kombinasi dalam fiksasi N2 bervariasi yang
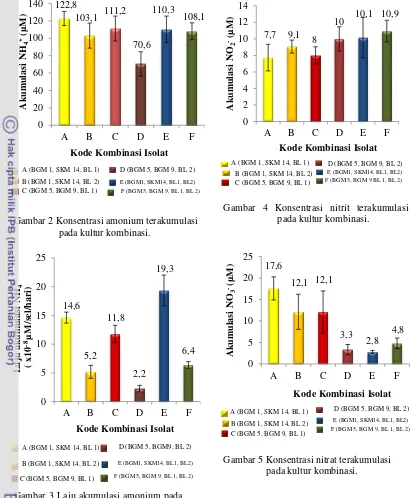
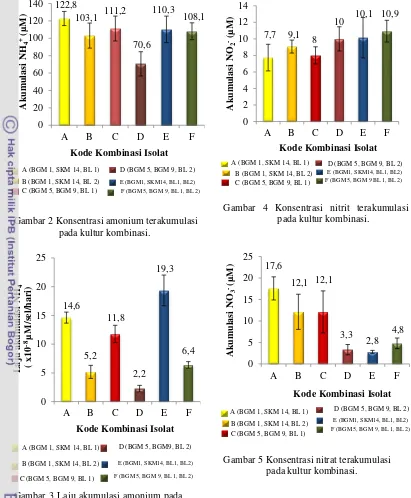
ditunjukkan oleh konsentrasi amonium yang terakumulasi dalam media pertumbuhannya. Akumulasi amonium tertinggi terdapat pada kultur kombinasi A sebesar 122,8 μM (Gambar 2). Akan tetapi, kultur kombinasi E menghasilkan laju akumulasi amonium tertinggi yang merupakan aktivitas setiap sel perharinya sebesar 19,3 x 10-8 μM/sel/hari (Gambar 3).
1,1 0,9 1,7 0,96 2,9 0,02 -0,5 0 0,5 1 1,5 2 2,5 3 3,5 4 4,5
A B C D E F
Ak tiv it a s O k sida si CH 4 ( x 1 0
-8 μ
M
/s
el/ha
ri)
Kode Kombinasi Isolat
A (BGM 1, SKM 14, BL1)
B (BGM 1, SKM 14, BL 2)
C (BGM 5, BGM 9, BL 1)
D (BGM 5, BGM 9, BL 2)
4
Kombinasi F yang menunjukkan aktivitas oksidasi CH4 terendah, kombinasi tersebut
menghasilkan akumulasi nitrit tertinggi yaitu 10,9 μM. Nitrit terakumulasi yang terendah terdapat pada kultur kombinasi A sebesar 7,7 μM (Gambar 4). Akan tetapi, kombinasi A menunjukkan akumulasi nitrat teringgi yaitu 17,6 μM, sedangkan akumulasi nitrat terendah terdapat pada kultur kombinasi E sebesar 2,8 μM (Gambar 5).
PEMBAHASAN
Lahan sawah secara alami akan terbentuk dua lapisan yaitu lapisan oksidatif (lapisan dengan oksigen yang cukup) dan lapisan reduktif (lapisan dengan oksigen terbatas atau tanpa oksigen). Suasana anaerob pada lapisan reduktif merupakan habitat bagi bakteri metanogen. Bakteri metanogen adalah bakteri yang dapat menggunakan sumber karbon berupa karbon dioksida (CO2), metil (seperti
CH3OH), dan asetat (CH3COO-) dan
mengubahnya menjadi metan melalui proses yang disebut metanogenesis. Metan yang 122,8
103,1 111,2
70,6 110,3 108,1 0 20 40 60 80 100 120 140
A B C D E F
Ak um ula si NH 4 + ( µ M )
Kode Kombinasi Isolat
A (BGM 1, SKM 14, BL 1)
B (BGM 1, SKM 14, BL 2) C (BGM 5, BGM 9, BL 1)
D (BGM 5, BGM 9, BL 2)
E (BGM1, SKM14, BL1, BL2) F (BGM 5, BGM 9, BL 1, BL 2)
14,6 5,2 11,8 2,2 19,3 6,4 0 5 10 15 20 25
A B C D E F
L a ju a k um ula si NH 4 + ( x 1 0 -8 µ M /s el/ha ri)
Kode Kombinasi Isolat
A (BGM 1, SKM 14, BL 1)
B (BGM 1, SKM 14, BL 2)
C (BGM 5, BGM 9, BL 1)
D (BGM 5, BGM9, BL 2)
E (BGM1, SKM14, BL1, BL2) F (BGM 5, BGM 9, BL 1, BL 2)
7,7 9,1 8
10 10,1 10,9
0 2 4 6 8 10 12 14
A B C D E F
Ak um ula si NO 2 - ( µ M )
Kode Kombinasi Isolat
A (BGM 1, SKM 14, BL 1) B (BGM 1, SKM 14, BL 2) C (BGM 5, BGM 9, BL 1)
D (BGM 5, BGM 9, BL 2)
E (BGM1, SKM14, BL1, BL2) F (BGM 5, BGM 9 BL 1, BL 2)
17,6
12,1 12,1
3,3 2,8 4,8 0 5 10 15 20 25
A B C D E F
Ak um ula si NO 3 - (µ M )
Kode Kombinasi Isolat
A (BGM 1, SKM 14, BL 1)
B (BGM 1, SKM 14, BL 2) C (BGM 5, BGM 9, BL 1)
D (BGM 5, BGM 9, BL 2)
E (BGM1, SKM14, BL1, BL2) F (BGM 5, BGM 9, BL 1, BL 2)
Gambar 5 Konsentrasi nitrat terakumulasi pada kultur kombinasi.
Gambar 4 Konsentrasi nitrit terakumulasi pada kultur kombinasi.
Gambar 3 Laju akumulasi amonium pada kultur kombinasi.
5
dihasilkan oleh bakteri metanogen dapat dioksidasi oleh bakteri metanotrof pada lapisan oksidatif (Frenzel et al. 1992). Selain bakteri metanogen, pada lapisan reduktif terdapat bakteri denitrifikasi yang berperan dalam reduksi N2O.
Bakteri metanotrof yang digunakan adalah isolat BGM 1, BGM 5, BGM 9, dan SKM 14, sedangkan bakteri denitrifikasi yang digunakan adalah Ochrobactrum anthropi
isolat BL 1 dan BL 2. Kombinasi isolat BGM1 dan SKM 14 serta kombinasi isolat BGM 5 dan BGM 9 merupakan kombinasi yang menghasilkan aktivitas oksidasi metan tertinggi pada penelitian sebelumnya (Chatrina 2010; Hanif 2010). Pada penelitian ini, kedua kombinasi bakteri metanotrof tersebut dikombinasikan kembali dengan isolat O. anthropi. Hasil yang diperoleh menunjukkan aktivitas yang bervariasi dalam kepadatan sel, oksidasi metan, reduksi N2O,
akumulasi amonium, laju akumulasi amonium, akumulasi nitrit, dan akumulasi nitrat.
Enam kombinasi kultur antara bakteri metanotrof dan Ochrobactrum anthropi
menunjukkan pertumbuhan yang bervariasi. Kepadatan sel tertinggi terdapat pada kultur kombinasi B (BGM 1, SKM 14, dan BL 2). Pada kultur kombinasi B tersebut, pertumbuhan isolat BL 2 lebih dominan (41,5%) dibandingkan dengan isolat BGM 5 dan BGM 9 (28,1% dan 30,4%). Berbeda dengan lima kombinasi lainnya, persentase kepadatan sel antara bakteri metanotrof dan
O. anthropi pada kultur kombinasi E dan F lebih seimbang.
Oksidasi CH4 merupakan proses awal
pemanfaatan CH4 oleh bakteri metanotrof.
Metan dioksidasi menjadi metanol melalui pemutusan ikatan dioksida (O2) oleh aktivitas
enzim methane monooxygenase (MMO). Perbedaan aktivitas oksidasi CH4
masing-masing kultur kombinasi di antaranya dapat disebabkan oleh perbedaan aktivitas enzim MMO yang dimiliki oleh bakteri metanotrof.
Hasil yang diperoleh menunjukkan kombinasi F (BGM 5, BGM 9, BL 1, BL 2) memiliki aktivitas oksidasi CH4 terendah
(0,02 x 10-8 µM/se/hari) dan kadar nitrit yang tinggi dalam kultur (10,9 µM). Tingginya kadar nitrit dapat disebabkan oleh adanya aktivitas oksidasi amonium. Menurut Knowles et al. (2006) bakteri metanotrof juga dapat mengoksidasi amonium menjadi nitrit.
Tingginya aktivitas oksidasi amonium pada kombinasi F diduga disebabkan oleh keberadaan isolat BGM 9. Isolat tersebut telah
diidentifikasi sebagai Methylococcus capsulatus (Astuti 2009). Enzim sMMO
(soluble MMO) pada Methylococcus
capsulatus dapat mengkatalisis aktivitas oksidasi amonium menjadi NH2OH yang
kemudian dioksidasi menjadi nitrit (Dalton 1997). Aktivitas oksidasi amonium dan konsentrasi nitrit yang tinggi dapat mempengaruhi aktivitas oksidasi CH4 (Charles
& Knowles 1989; Schnell & King 1994). Nitrit dapat menghambat aktivitas enzim
formate dehydrogenase yang merupakan salah satu enzim yang berperan dalam lintasan oksidasi CH4 (Whittenbury et al. 1970).
Di antara enam kombinasi yang dibuat, hanya kombinasi E dan F yang memiliki nilai aktivitas reduksi N2O positif. Hal ini
menunjukkan bahwa reduksi N2O yang tinggi
terdapat pada kultur kombinasi yang mengandung kedua galur Ochrobactrum anthropi (BL 1 dan BL 2). Sebaliknya, empat kombinasi lainnya (kombinasi A, B, C, dan D) menunjukkan peningkatan konsentrasi N2O
dalam kultur sehingga nilai aktivitas reduksi N2O-nya menjadi negatif.
Peningkatan konsentrasi N2O tersebut
dapat disebabkan oleh akumulasi N2O yang
dihasilkan melalui aktivitas oksidasi amonium menjadi nitrit, serta aktivitas reduksi nitrat menjadi nitrit. Selain itu, aktivitas reduksi N2O sangat dipengaruhi oleh perbedaan
aktivitas enzim nitrous oxide reductase dan konsentrasi oksigen. Menurut Knowles et al. (2006), aktivitas bakteri metanotrof dapat mempengaruhi aktivitas bakteri denitrifikasi melalui penurunan tekanan oksigen dan penyediaan komponen organik dalam proses denitrifikasi. Pada kondisi anaerob, aktivitas enzim denitrifikasi lebih tinggi, sedangkan dalam kondisi oksigen terbatas aktivitas denitrifikasi hanya mencapai 60% (Song et al. 2002).
Selain dapat mengoksidasi CH4, bakteri
metanotrof juga memiliki kemampuan untuk melakukan fiksasi nitrogen. Dari empat isolat bakteri metanotrof yang digunakan, tiga isolat (BGM 1, BGM 5, dan BGM 9) telah diketahui mampu memfiksasi N2 (Sagala 2009).
Kemampuan suatu bakteri dalam melakukan fiksasi N2 dapat dilihat berdasarkan kadar
6
aktivitas enzim nitrogenase dan akumulasi amonium yang tinggi. Laju akumulasi amonium yang tinggi pada kombinasi E tersebut dapat disebabkan oleh tingginya aktivitas enzim nitrogenase.
Selain amonium, di dalam kultur juga terdapat nitrat dan nitrit. Konsentrasi nitrat dan nitrit yang terakumulasi pada masing-masing kultur kombinasi sangat dipengaruhi oleh aktivitas oksidasi amonium dan enzim-enzim yang berperan dalam proses denitrifikasi yaitu enzim nitrate reductase
(enzim pereduksi NO3- menjadi NO2-), nitrite
reductase (enzim pereduksi NO2- menjadi
NO), nitro oxide reductase (enzim pereduksi NO menjadi N2O), dan enzim nitrous oxide
reductase yang berperan dalam mereduksi N2O menjadi N2 (Zumft 1997).
Di antara 6 kultur kombinasi yang diuji, kombinasi E (BGM 1, SKM 14, BL 1, BL 2) merupakan kombinasi terbaik. Kultur kombinasi E menunjukkan aktivitas tertinggi dalam oksidasi CH4, reduksi N2O, dan laju
akumulasi amonium. Selain itu, kepadatan sel pada kultur kombinasi E menunjukkan adanya keseimbangan antara jumlah isolat bakteri metanotrof dan Ochrobactrum anthropi. Kombinasi E juga menghasilkan akumulasi nitrat terendah. Hal tersebut mengindikasikan bahwa enzim nitrate reductase pada kedua isolat O. anthropi, dan enzim MMO serta
nitrogenase pada bakteri metanotrof pada kombinasi E bekerja secara optimum.
SIMPULAN
Kombinasi E (BGM 1, SKM 14, BL1, dan BL2) merupakan formulasi terbaik karena menghasilkan aktivitas oksidasi CH4, reduksi
N2O, serta laju akumulasi amonium tertinggi
dibandingkan dengan kombinasi lainnya. Aktivitas oksidasi CH4, reduksi N2O, dan laju
akumulasi amonium formulasi ini berturut-turut adalah sebesar 2,9 x 10-8, 0,15 x 10-9, dan 19,3 x 10-8μM/sel/hari. Kadar nitrat yang rendah dan aktivitas reduksi N2O yang tinggi
menunjukkan bahwa kombinasi ini juga memiliki aktivitas denitrifikasi yang baik.
SARAN
Perlu dilakukan penelitian lebih lanjut untuk mengukur aktivitas oksidasi metan dan reduksi N2O formulasi isolat BGM 1, SKM
14, BL 1, dan BL 2 pada tanah sawah.
DAFTAR PUSTAKA
Astuti DD. 2009. Karakterisasi fisiologi dan identifikasi molekuler isolat-isolat bakteri metanotrof asal sawah wilayah Bogor dan Sukabumi [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Bremner JM. 1997. Sources of nitrous oxide in soils. Nutri Cycl Agroecos 49: 7-16. Charles B, Knowles R. 1989. Physiology,
biochemistry, and specific inhibitors of CH4, NH4+, and CO oxidation by
methanotrophs and nitrifiers. Microbiol Rev 53: 68-84.
Chatrina V. 2010. Efektivitas fiksasi N2 dan
oksidasi metan kultur campuran bakteri metanotrof asal sawah [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Cleseri LS, Greenberg AE, Trussel RR. 1989.
Standard Method for The Examination of Water and Wastewater. Baltimore: Port City Press.
Conrad R, Rothfus F. 1991. Methane oxidation in the soil surface layer of a flooded rice field and the effect of ammonium. Biol Fertil Soil 12:28-32. Dalton H. 1977. Ammonia oxidation by the
methane oxidising bacterium
Methylococcus capsulatus strain Bath Arch. Microbiol 114: 273-279.
Falcone et al. 1962. Oxidation of hydroxylamine by particles from
Nitrosomonas. Biochem J 9: 126-131. Frenzel P, Rothfus BF, Conrad R. 1992.
Oxygen profiles and methane turn over in flooded rice microcosm. Biol Fertil Soils
14: 84-89.
Greenberg AE, Cleseri LS, Eaton AD. 1992.
Standard Methods for Examination of Water and Wastewater. 18th Edition. Washington DC: Publication Office American Public Health Association Hanif NH. 2010. Aktivitas fiksasi nitrogen
dan oksidasi metan kultur campuran bakteri metanotrof pada lumpur sawah [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Hapsari W. 2008. Isolasi dan karakterisasi bakteri metanotrof asal sawah di Bogor dan Sukabumi [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
7
to The IPCC Scientific. Cambridge: Cambridge Univ Press.
Knowles R, Amaral JA, Archambault C, Richards SR. 2006. Denitrification associated with group I and II methanotrophs in a gradient enrichment system. FEMS Microbiol Ecol 18: 289-298.
Kumaraswamy S, Ramakrishnan B, Sethunathan N. 2001. Methane production and oxidation in annoxic rice soil as influenced by inorganic redox species. J Environ Quality 30: 2195-2201.
Lelieveld J, Crutzen PJ, Bruhl C. 1993. Climate effects of atmospheric methane.
Chemosphere 26: 739-768.
Paul EA, Clark FE. 1996. Soil Microbiology and Biochemistry. London: Academic Press.
Ritchie GA, Nicholas DJD. 1974. The partial characterization of purified nitrite reductase and hydroxylamine oxidase from Nitrosomona europaea. Biochem J
138: 471–480.
Sagala BT. 2009. Seleksi dan uji aktivitas fiksasi nitrogen (N2) bakteri metanotrof
asal sawah pada konsentrasi oksigen (O2)
yang berbeda [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Setyaningsih R, Rusmana I, Setyanto P, Suwanto A. 2010. Physiological characterization and molecular identification of denitrifying bacteria possessing nitrous oxide high reduction activity isolated from rice soils. Microbiol Indones 4: 75-78.
Schnell S, King GM. 1994. Mechanistic analysis of ammonium inhibitor of atmospheric methane consumtion in forest soil. J Appl Environ Microbiol 60: 3514 – 3521.
Song SE, Yeom SH, Choi SS. 2002. Effect of aeration on denitrification by
Ochrobactrum anthropi SY509.
Biotechnol Bioprocess Eng 7: 352-356. Whittenbury R, Phillips KC, Wilkinson JF.
1970. Enrichment, isolation and some properties of methane-utilizing bacteria. J Gen Microbiol 61: 205-218.
9
Lampiran 1 Kurva standar amonium
Lampiran 2 Kurva standar nitrit
Lampiran 3 Aktivitas reduksi N2O pada kultur kombinasi
Kode [N2O](ppb) [N2O] (μM)
(Kontrol-Sampel)
μM Jumlah Sel (106)
Aktivitas Reduksi N2O
(x 10-9μM/sel/hari)
A 5019177,85 114,072 -113,804 43 -1,76
B 3906942,95 88,794 -88,526 124 -0,48
C 6055082,1 137,616 -137,348 51 -1,80
D 13455,8 0,306 -0,038 118 -0,0002
E 4324,35 0,098 0,17 76 0,15
F 10311,7 0,234 0,034 152 0,015
KT 11801,9 0,268
y = 0,0067x + 0,0531 R² = 0,9994
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8
0 20 40 60 80 100 120
Abs
o
rba
ns
i
Konsentrasi NH4Cl (µM)
y = 0.013x + 0.030 R² = 0.996
-0,2 0 0,2 0,4 0,6 0,8 1 1,2 1,4
0 20 40 60 80 100 120
Abs
o
rba
ns
i
ABSTRAK
RANI MAHARANI. Aktivitas Oksidasi Metan dan Reduksi Dinitrogen Oksida (N2O) Kultur
Kombinasi Bakteri Metanotrof dan Ochrobactrum anthropi. Dibimbing oleh IMAN RUSMANA dan ALINA AKHDIYA.
Lahan sawah merupakan salah satu sumber emisi metan (CH4) dan dinitrogen oksida
(N2O). Bakteri metanotrof dan bakteri denitrifikasi yang memiliki aktivitas tinggi dalam oksidasi
metan dan reduksi N2O berperan sangat penting untuk mengendalikan emisi CH4 dan N2O dari
lahan sawah. Penelitian ini dilakukan untuk menguji aktivitas oksidasi metan dan reduksi N2O dari
empat bakteri metanotrof (BGM 1, BGM 5, BGM 9, dan SKM 14) dan dua isolat Ochrobactrum anthropi (BL 1 dan BL 2). Sebanyak enam kombinasi diinokulasikan ke dalam campuran media
Nitrate Mineral Salt (NMS) dan media denitrifikasi, kemudian diuji aktivitas oksidasi metan, reduksi N2O, akumulasi amonium, nitrit, dan nitrat. Kultur kombinasi isolat BGM 1, SKM 14, BL
1, dan BL 2 memiliki aktivitas oksidasi CH4 (2,9 x 10-8 µM/sel/hari), reduksi N2O (0,15 x 10-9
µM/sel/hari), dan akumulasi amonium (19,3 x 10-8 µM/sel/hari) tertinggi dibandingkan kultur kombinasi lainnya. Kultur kombinasi isolat BGM 1, SKM 14, dan BL 1 memiliki akumulasi nitrat tertinggi (17,6 µM) dan kultur kombinasi isolat BGM 5, BGM 9, BL 1, dan BL 2 memiliki akumulasi nitrit tertinggi (10,9 µM).
Kata kunci: Metan, N2O, bakteri metanotrof, Ochrobactrum anthropi, oksidasi metan, reduksi
N2O, akumulasi amonium, akumulasi nitrit, akumulasi nitrat
ABSTRACT
RANI MAHARANI. Methane Oxidation and Nitrous Oxide (N2O) Reduction Activity on
Combination Culture of Methanotrophic Bacteria and Ochrobactrum anthropi. Under supervision of IMAN RUSMANA and ALINA AKHDIYA.
Rice fields are one source of methane (CH4) and nitrous oxide (N2O) emission.
Methanotrophic bacteria and denitrifying bacteria possesing high methane oxidation and N2O
reduction activity are very important for controlling CH4 and N2O emission from rice fields. This
research was conducted to test the activity of methane oxidation and N2O reduction from four
methanotrophic bacteria (BGM 1, BGM 5, BGM 9, and SKM 14 isolates) and two Ochrobactrum anthropi isolates (BL 1 and BL 2 isolates). Six combination were inoculated into Nitrate Mineral Salt (NMS) media mixed with denitrification media, then the activity of methane oxidation, N2O
reduction, accumulation of ammonium, nitrite, and nitrate was analyzed. Combination culture E of BGM 1, SKM 14, BL 1, and BL 2 isolates had the highest CH4 oxidation (2,9 x 10
-8
µM/cell/day), N2O reduction activities (0,15 x 10-9 µM/cell/day), and accumulation of ammonium (19,3 x 10-8
µM/cell/day) than the other combination cultures. Combination culture of BGM 1, SKM 14, and BL 1 isolates had the highest accumulation of nitrate (17,6 µM) and combination culture of BGM 5, BGM 9, BL 1, and BL 2 isolates had the highest accumulation of nitrite (10,9 µM).
Keyword: Methane, N2O, methanotrophic bacteria, Ochrobactrum anthropi, accumulation of
PENDAHULUAN
Latar Belakang
Perubahan iklim yang terjadi beberapa tahun terakhir merupakan dampak pemanasan global yang disebabkan oleh peningkatan gas rumah kaca di atmosfer seperti karbon dioksida (CO2), chloro flourocarbon (CFC),
metan (CH4), dan dinitrogen oksida (N2O).
Berdasarkan konsentrasinya, kontribusi CO2,
CFC, CH4 dan N2O terhadap pemanasan
global berturut-turut sebesar 55%, 24%, 15%, dan 6% (IPCC 1992). Gas CH4 dan N2O
memiliki potensi penyerapan panas yang lebih tinggi dibandingkan dengan CO2 karena CH4
dan N2O lebih efektif dalam menyerap radiasi
pada panjang gelombang 4 sampai 100 nm (iradiasi sinar infra merah). Metan dan N2O
masing-masing mengabsorbsi panas sebesar 25 dan 150 kali lebih tinggi dibandingkan dengan CO2 (Lelieveld et al. 1993; Paul &
Clark 1996).
Tanah sawah merupakan salah satu sumber utama gas CH4 dan N2O. CH4
dihasilkan oleh bakteri metanogen pada kondisi anaerob, sedangkan N2O dihasilkan
dalam tanah melalui proses reduksi nitrat oleh bakteri denitrifikasi pada kondisi anaerob dan oksidasi hydroxylamine (NH2OH) menjadi
nitrit pada kondisi aerob (Bremner 1997; Falcone et al. 1962; Ritchie & Nicholas 1974). Emisi CH4 dapat direduksi oleh bakteri
metanotrof karena memiliki aktivitas enzim
Methane Monooxygenase (MMO), sedangkan emisi N2O dapat direduksi oleh bakteri
denitrifikasi yang memiliki aktivitas enzim
N2O reductase seperti Ochrobactrum
anthropi. Oksidasi CH4 oleh bakteri
metanotrof di lahan sawah dapat mencapai 80% dari total CH4 yang diproduksi oleh
bakteri metanogen (Conrad & Rothfus 1991). Beberapa isolat bakteri metanotrof dan bakteri O. anthropi masing-masing telah diuji aktivitas oksidasi CH4 dan reduksi N2O di
Laboratorium Mikrobiologi Departemen Biologi FMIPA IPB. Hasil penelitian Hanif (2010) dan Chatrina (2010) menunjukkan bahwa beberapa kombinasi bakteri metanotrof memiliki aktivitas oksidasi CH4 yang tinggi
serta mampu menambat nitrogen dari udara. Pengujian yang dilakukan terhadap
O.anthropi BL 1 dan BL 2 menunjukkan kedua bakteri ini memiliki aktivitas reduksi N2O yang tinggi (Setyaningsih et al. 2010).
Kemampuan bakteri metanotrof dan
O.anthropi tersebut berpotensi untuk
dikembangkan sebagai agen pereduksi emisi metan dan N2O di lahan sawah.
Tujuan
Penelitian ini bertujuan untuk menguji aktivitas kombinasi isolat bakteri metanotrof
dan Ochrobactrum anthropi dalam
mengoksidasi CH4 dan mereduksi N2O.
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Januari 2011 sampai Mei 2011 di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA IPB.
BAHAN DAN METODE
Bahan
Isolat bakteri yang digunakan dalam penelitian ini adalah 4 isolat bakteri metanotrof BGM 1, BGM 5, BGM 9, dan SKM 14 (Hapsari 2008) dan 2 isolat bakteri
Ochrobactrum anthropi BL 1 dan BL 2 (Setyaningsih et al. 2010). Bahan yang digunakan adalah media Nitrate Mineral Salts
(MgSO4.7H2O 1,0 g/L; CaCl2.6H2O 0,2 g/L;
KNO3 1,0 g/L; KH2PO4 0,272 g/L; Na2HPO4
4,0 g/L; NH4Cl 4,0 mg/L; Na2EDTA 0,5 g/L;
FeSO4.7H2O 0,2 g/L; H3BO4 0,03 g/L;
CoCl2.6H2O 0,02 g/L; ZnSO4.7H2O 0,01 g/L;
MnCl2.4H2O 3,0 mg/L; Na2MoO4. 2H2O 3,0
mg/L; NiCl2.6H2O 2,0 mg/L; CaCl2.2H2O 1,0
mg/L), media denitrifikasi (2,72 g/L CH3COONa.3H2O; 0,8 g/L K2HPO4; 0,3 g/L
KH2PO4; 0,4 g/L NH4Cl; 5,2 g/L
MgSO4.7H2O; 3 g/L yeast extract), Bacto agar
20 g/L, metanol 1 %, larutan NH4Cl 100 μM,
NaNO2 100 μM, fenol alkohol 10%, Natrium
dihidro nitroprusid 0,5 %, Natrium sitrat 20%, Natrium hipoklorit 5,25%, Sulfanilamide 1%, dan NED 0,1%.
Metode
Peremajaan dan Perbanyakan Isolat.
Isolat BGM 1, BGM 5, BGM 9, dan SKM 14 diremajakan pada media agar NMS + 1% metanol, sedangkan isolat BL 1 dan BL 2 diremajakan pada media denitrifikasi dan diinkubasi selama 5-7 hari pada suhu ruang. Koloni tunggal yang tumbuh dipilih dan digoreskan pada media yang sama. Perbanyakan kultur dilakukan dengan menggunakan media cair yang sesuai.
Formulasi Kultur Bakteri Metanotrof
dan Ochrobactrum anthropi. Pengujian
PENDAHULUAN
Latar Belakang
Perubahan iklim yang terjadi beberapa tahun terakhir merupakan dampak pemanasan global yang disebabkan oleh peningkatan gas rumah kaca di atmosfer seperti karbon dioksida (CO2), chloro flourocarbon (CFC),
metan (CH4), dan dinitrogen oksida (N2O).
Berdasarkan konsentrasinya, kontribusi CO2,
CFC, CH4 dan N2O terhadap pemanasan
global berturut-turut sebesar 55%, 24%, 15%, dan 6% (IPCC 1992). Gas CH4 dan N2O
memiliki potensi penyerapan panas yang lebih tinggi dibandingkan dengan CO2 karena CH4
dan N2O lebih efektif dalam menyerap radiasi
pada panjang gelombang 4 sampai 100 nm (iradiasi sinar infra merah). Metan dan N2O
masing-masing mengabsorbsi panas sebesar 25 dan 150 kali lebih tinggi dibandingkan dengan CO2 (Lelieveld et al. 1993; Paul &
Clark 1996).
Tanah sawah merupakan salah satu sumber utama gas CH4 dan N2O. CH4
dihasilkan oleh bakteri metanogen pada kondisi anaerob, sedangkan N2O dihasilkan
dalam tanah melalui proses reduksi nitrat oleh bakteri denitrifikasi pada kondisi anaerob dan oksidasi hydroxylamine (NH2OH) menjadi
nitrit pada kondisi aerob (Bremner 1997; Falcone et al. 1962; Ritchie & Nicholas 1974). Emisi CH4 dapat direduksi oleh bakteri
metanotrof karena memiliki aktivitas enzim
Methane Monooxygenase (MMO), sedangkan emisi N2O dapat direduksi oleh bakteri
denitrifikasi yang memiliki aktivitas enzim
N2O reductase seperti Ochrobactrum
anthropi. Oksidasi CH4 oleh bakteri
metanotrof di lahan sawah dapat mencapai 80% dari total CH4 yang diproduksi oleh
bakteri metanogen (Conrad & Rothfus 1991). Beberapa isolat bakteri metanotrof dan bakteri O. anthropi masing-masing telah diuji aktivitas oksidasi CH4 dan reduksi N2O di
Laboratorium Mikrobiologi Departemen Biologi FMIPA IPB. Hasil penelitian Hanif (2010) dan Chatrina (2010) menunjukkan bahwa beberapa kombinasi bakteri metanotrof memiliki aktivitas oksidasi CH4 yang tinggi
serta mampu menambat nitrogen dari udara. Pengujian yang dilakukan terhadap
O.anthropi BL 1 dan BL 2 menunjukkan kedua bakteri ini memiliki aktivitas reduksi N2O yang tinggi (Setyaningsih et al. 2010).
Kemampuan bakteri metanotrof dan
O.anthropi tersebut berpotensi untuk
dikembangkan sebagai agen pereduksi emisi metan dan N2O di lahan sawah.
Tujuan
Penelitian ini bertujuan untuk menguji aktivitas kombinasi isolat bakteri metanotrof
dan Ochrobactrum anthropi dalam
mengoksidasi CH4 dan mereduksi N2O.
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Januari 2011 sampai Mei 2011 di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA IPB.
BAHAN DAN METODE
Bahan
Isolat bakteri yang digunakan dalam penelitian ini adalah 4 isolat bakteri metanotrof BGM 1, BGM 5, BGM 9, dan SKM 14 (Hapsari 2008) dan 2 isolat bakteri
Ochrobactrum anthropi BL 1 dan BL 2 (Setyaningsih et al. 2010). Bahan yang digunakan adalah media Nitrate Mineral Salts
(MgSO4.7H2O 1,0 g/L; CaCl2.6H2O 0,2 g/L;
KNO3 1,0 g/L; KH2PO4 0,272 g/L; Na2HPO4
4,0 g/L; NH4Cl 4,0 mg/L; Na2EDTA 0,5 g/L;
FeSO4.7H2O 0,2 g/L; H3BO4 0,03 g/L;
CoCl2.6H2O 0,02 g/L; ZnSO4.7H2O 0,01 g/L;
MnCl2.4H2O 3,0 mg/L; Na2MoO4. 2H2O 3,0
mg/L; NiCl2.6H2O 2,0 mg/L; CaCl2.2H2O 1,0
mg/L), media denitrifikasi (2,72 g/L CH3COONa.3H2O; 0,8 g/L K2HPO4; 0,3 g/L
KH2PO4; 0,4 g/L NH4Cl; 5,2 g/L
MgSO4.7H2O; 3 g/L yeast extract), Bacto agar
20 g/L, metanol 1 %, larutan NH4Cl 100 μM,
NaNO2 100 μM, fenol alkohol 10%, Natrium
dihidro nitroprusid 0,5 %, Natrium sitrat 20%, Natrium hipoklorit 5,25%, Sulfanilamide 1%, dan NED 0,1%.
Metode
Peremajaan dan Perbanyakan Isolat.
Isolat BGM 1, BGM 5, BGM 9, dan SKM 14 diremajakan pada media agar NMS + 1% metanol, sedangkan isolat BL 1 dan BL 2 diremajakan pada media denitrifikasi dan diinkubasi selama 5-7 hari pada suhu ruang. Koloni tunggal yang tumbuh dipilih dan digoreskan pada media yang sama. Perbanyakan kultur dilakukan dengan menggunakan media cair yang sesuai.
Formulasi Kultur Bakteri Metanotrof
dan Ochrobactrum anthropi. Pengujian
2
dan kombinasi F (BGM 5, BGM 9, BL 1, BL 2). Masing-masing bakteri diinokulasi sebanyak 2% ke campuran media cair NMS dan media denitrifikasi bebas N dalam tabung reaksi dengan sumbat karet. Komposisi gas di
headspace tabung dibuat 20% N2O, 30% CH4,
dan 50% udara, kemudian diinkubasi di atas mesin penggoyang pada suhu ruang. Setelah 15 hari inkubasi dilakukan penghitungan jumlah sel bakteri, pengukuran aktivitas oksidasi CH4, reduksi N2O, akumulasi nitrat,
nitrit, dan amonium. Setiap kombinasi dibuat menjadi tiga kali ulangan.
Penghitungan Pertumbuhan Bakteri pada Kultur Kombinasi. Pada akhir masa inkubasi, masing-masing kultur kombinasi diencerkan dengan metode pengenceran serial. Sebanyak 1 ml kultur kombinasi dicampurkan ke dalam 9 ml larutan NaCl 0,85% untuk memperoleh faktor pengenceran 10-1. Pengenceran dilanjutkan hingga diperoleh faktor pengenceran 10-5. Setelah itu, sebanyak 0,1 ml hasil pengenceran terakhir disebar ke cawan dengan media yang sesuai. Koloni-koloni tunggal yang terbentuk dihitung, kemudian dikonversi ke dalam jumlah sel relatif.
Pengukuran Aktivitas Oksidasi CH4
dan Reduksi N2O. Aktivitas oksidasi CH4
dan reduksi N2O diukur dengan cara
mengukur konsentrasi gas CH4 dan N2O
tersisa pada bagian headspace menggunakan teknik kromatografi gas seperti yang dipaparkan oleh Kumaraswamy et al. (2001). Pengukuran gas ini dilakukan di Balai Penelitian Lingkungan Pertanian di Jakenan Pati, Jawa Tengah.
Pengukuran Aktivitas Fiksasi N2. Kemampuan fiksasi nitrogen kultur kombinasi diukur berdasarkan amonium yang diakumulasikan dalam media pertumbuhan. Sebanyak 5 ml sampel disentrifuse pada kecepatan 4000 rpm selama 10 menit. Setelah itu, 3 ml sampel tersebut ditambah dengan 0,12 ml fenol alkohol 10% dan dicampur hingga homogen. Sampel ditambah dengan 0,12 ml larutan Na-Dihidronitroprusid 0,5%, dan dicampur kembali hingga homogen, kemudian direaksikan dengan 0,3 ml campuran Na-sitrat : Na-hipoklorit (1:4) dan didiamkan selama satu jam sampai berubah warna menjadi biru. Setelah itu, campuran tersebut diukur Optical Density (OD) pada panjang gelombang 640 nm (Cleseri et al.
1989). Sebagai standar digunakan larutan NH4Cl dengan konsentrasi 0, 5, 10, 20, 50,
dan 100 µM. Kurva standar amonium dapat dilihat pada lampiran 1.
Pengukuran Aktivitas Akumulasi Nitrat dan Nitrit. Reduksi nitrat dianalisis menggunakan metode Greenberg et al.(1992). Sebanyak 20 ml sampel yangtelah diencerkan dimasukkan ke dalam kolom reduksi yang berisi Cadmium. Pada saat sampel melewati kolom reduksi, Cadmium akan mereduksi nitrat menjadi nitrit. Setelah itu, sampel dianalisis kadar nitritnya berdasarkan metode Sulfanilamide. Sebanyak 5 ml sampel direaksikan dengan 0,1 ml larutan sulfanilamide 1 % dan dicampur hingga homogen. Campuran tersebut selanjutnya direaksikan dengan 0,1 ml larutan NED 0,1 % dan dicampur hingga homogen. Uji positif nitrit ditandai dengan perubahan warna menjadi merah muda dan diukur OD-nya pada panjang gelombang 540 nm (Cleseri et al. 1989). Nilai konsentrasi nitrat diperoleh melalui selisih antara konsentrasi nitrit yang dilewatkan pada kolom reduksi dengan konsentrasi nitrit yang tidak dilewatkan pada kolom reduksi. Sebagai standar digunakan larutan NaNO2 dengan konsentrasi 0, 5, 10,
20, 50, dan 100 µM. Kurva standar nitrit dapat dilihat pada lampiran 2.
HASIL
Pertumbuhan Bakteri pada Kultur Kombinasi
Masing-masing bakteri dalam kultur kombinasi menunjukkan pertumbuhan yang berbeda (Tabel 1). Jumlah sel tertinggi terdapat pada kombinasi B yaitu 175 x 106 sel/ml untuk bakteri metanotrof dan 124 x 106 sel/ml untuk O. anthropi BL2, sedangkan jumlah sel terendah terdapat pada kombinasi C yaitu 63 x 106 sel/ml untuk bakteri metanotrof dan 51 x 106 sel/ml untuk bakteri
6
aktivitas enzim nitrogenase dan akumulasi amonium yang tinggi. Laju akumulasi amonium yang tinggi pada kombinasi E tersebut dapat disebabkan oleh tingginya aktivitas enzim nitrogenase.
Selain amonium, di dalam kultur juga terdapat nitrat dan nitrit. Konsentrasi nitrat dan nitrit yang terakumulasi pada masing-masing kultur kombinasi sangat dipengaruhi oleh aktivitas oksidasi amonium dan enzim-enzim yang berperan dalam proses denitrifikasi yaitu enzim nitrate reductase
(enzim pereduksi NO3- menjadi NO2-), nitrite
reductase (enzim pereduksi NO2- menjadi
NO), nitro oxide reductase (enzim pereduksi NO menjadi N2O), dan enzim nitrous oxide
reductase yang berperan dalam mereduksi N2O menjadi N2 (Zumft 1997).
Di antara 6 kultur kombinasi yang diuji, kombinasi E (BGM 1, SKM 14, BL 1, BL 2) merupakan kombinasi terbaik. Kultur kombinasi E menunjukkan aktivitas tertinggi dalam oksidasi CH4, reduksi N2O, dan laju
akumulasi amonium. Selain itu, kepadatan sel pada kultur kombinasi E menunjukkan adanya keseimbangan antara jumlah isolat bakteri metanotrof dan Ochrobactrum anthropi. Kombinasi E juga menghasilkan akumulasi nitrat terendah. Hal tersebut mengindikasikan bahwa enzim nitrate reductase pada kedua isolat O. anthropi, dan enzim MMO serta
nitrogenase pada bakteri metanotrof pada kombinasi E bekerja secara optimum.
SIMPULAN
Kombinasi E (BGM 1, SKM 14, BL1, dan BL2) merupakan formulasi terbaik karena menghasilkan aktivitas oksidasi CH4, reduksi
N2O, serta laju akumulasi amonium tertinggi
dibandingkan dengan kombinasi lainnya. Aktivitas oksidasi CH4, reduksi N2O, dan laju
akumulasi amonium formulasi ini berturut-turut adalah sebesar 2,9 x 10-8, 0,15 x 10-9, dan 19,3 x 10-8μM/sel/hari. Kadar nitrat yang rendah dan aktivitas reduksi N2O yang tinggi
menunjukkan bahwa kombinasi ini juga memiliki aktivitas denitrifikasi yang baik.
SARAN
Perlu dilakukan penelitian lebih lanjut untuk mengukur aktivitas oksidasi metan dan reduksi N2O formulasi isolat BGM 1, SKM
14, BL 1, dan BL 2 pada tanah sawah.
DAFTAR PUSTAKA
Astuti DD. 2009. Karakterisasi fisiologi dan identifikasi molekuler isolat-isolat bakteri metanotrof asal sawah wilayah Bogor dan Sukabumi [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Bremner JM. 1997. Sources of nitrous oxide in soils. Nutri Cycl Agroecos 49: 7-16. Charles B, Knowles R. 1989. Physiology,
biochemistry, and specific inhibitors of CH4, NH4+, and CO oxidation by
methanotrophs and nitrifiers. Microbiol Rev 53: 68-84.
Chatrina V. 2010. Efektivitas fiksasi N2 dan
oksidasi metan kultur campuran bakteri metanotrof asal sawah [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Cleseri LS, Greenberg AE, Trussel RR. 1989.
Standard Method for The Examination of Water and Wastewater. Baltimore: Port City Press.
Conrad R, Rothfus F. 1991. Methane oxidation in the soil surface layer of a flooded rice field and the effect of ammonium. Biol Fertil Soil 12:28-32. Dalton H. 1977. Ammonia oxidation by the
methane oxidising bacterium
Methylococcus capsulatus strain Bath Arch. Microbiol 114: 273-279.
Falcone et al. 1962. Oxidation of hydroxylamine by particles from
Nitrosomonas. Biochem J 9: 126-131. Frenzel P, Rothfus BF, Conrad R. 1992.
Oxygen profiles and methane turn over in flooded rice microcosm. Biol Fertil Soils
14: 84-89.
Greenberg AE, Cleseri LS, Eaton AD. 1992.
Standard Methods for Examination of Water and Wastewater. 18th Edition. Washington DC: Publication Office American Public Health Association Hanif NH. 2010. Aktivitas fiksasi nitrogen
dan oksidasi metan kultur campuran bakteri metanotrof pada lumpur sawah [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Hapsari W. 2008. Isolasi dan karakterisasi bakteri metanotrof asal sawah di Bogor dan Sukabumi [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
2
dan kombinasi F (BGM 5, BGM 9, BL 1, BL 2). Masing-masing bakteri diinokulasi sebanyak 2% ke campuran media cair NMS dan media denitrifikasi bebas N dalam tabung reaksi dengan sumbat karet. Komposisi gas di
headspace tabung dibuat 20% N2O, 30% CH4,
dan 50% udara, kemudian diinkubasi di atas mesin penggoyang pada suhu ruang. Setelah 15 hari inkubasi dilakukan penghitungan jumlah sel bakteri, pengukuran aktivitas oksidasi CH4, reduksi N2O, akumulasi nitrat,
nitrit, dan amonium. Setiap kombinasi dibuat menjadi tiga kali ulangan.
Penghitungan Pertumbuhan Bakteri pada Kultur Kombinasi. Pada akhir masa inkubasi, masing-masing kultur kombinasi diencerkan dengan metode pengenceran serial. Sebanyak 1 ml kultur kombinasi dicampurkan ke dalam 9 ml larutan NaCl 0,85% untuk memperoleh faktor pengenceran 10-1. Pengenceran dilanjutkan hingga diperoleh faktor pengenceran 10-5. Setelah itu, sebanyak 0,1 ml hasil pengenceran terakhir disebar ke cawan dengan media yang sesuai. Koloni-koloni tunggal yang terbentuk dihitung, kemudian dikonversi ke dalam jumlah sel relatif.
Pengukuran Aktivitas Oksidasi CH4
dan Reduksi N2O. Aktivitas oksidasi CH4
dan reduksi N2O diukur dengan cara
mengukur konsentrasi gas CH4 dan N2O
tersisa pada bagian headspace menggunakan teknik kromatografi gas seperti yang dipaparkan oleh Kumaraswamy et al. (2001). Pengukuran gas ini dilakukan di Balai Penelitian Lingkungan Pertanian di Jakenan Pati, Jawa Tengah.
Pengukuran Aktivitas Fiksasi N2. Kemampuan fiksasi nitrogen kultur kombinasi diukur berdasarkan amonium yang diakumulasikan dalam media pertumbuhan. Sebanyak 5 ml sampel disentrifuse pada kecepatan 4000 rpm selama 10 menit. Setelah itu, 3 ml sampel tersebut ditambah dengan 0,12 ml fenol alkohol 10% dan dicampur hingga homogen. Sampel ditambah dengan 0,12 ml larutan Na-Dihidronitroprusid 0,5%, dan dicampur kembali hingga homogen, kemudian direaksikan dengan 0,3 ml campuran Na-sitrat : Na-hipoklorit (1:4) dan didiamkan selama satu jam sampai berubah warna menjadi biru. Setelah itu, campuran tersebut diukur Optical Density (OD) pada panjang gelombang 640 nm (Cleseri et al.
1989). Sebagai standar digunakan larutan NH4Cl dengan konsentrasi 0, 5, 10, 20, 50,
dan 100 µM. Kurva standar amonium dapat dilihat pada lampiran 1.
Pengukuran Aktivitas Akumulasi Nitrat dan Nitrit. Reduksi nitrat dianalisis menggunakan metode Greenberg et al.(1992). Sebanyak 20 ml sampel yangtelah diencerkan dimasukkan ke dalam kolom reduksi yang berisi Cadmium. Pada saat sampel melewati kolom reduksi, Cadmium akan mereduksi nitrat menjadi nitrit. Setelah itu, sampel dianalisis kadar nitritnya berdasarkan metode Sulfanilamide. Sebanyak 5 ml sampel direaksikan dengan 0,1 ml larutan sulfanilamide 1 % dan dicampur hingga homogen. Campuran tersebut selanjutnya direaksikan dengan 0,1 ml larutan NED 0,1 % dan dicampur hingga homogen. Uji positif nitrit ditandai dengan perubahan warna menjadi merah muda dan diukur OD-nya pada panjang gelombang 540 nm (Cleseri et al. 1989). Nilai konsentrasi nitrat diperoleh melalui selisih antara konsentrasi nitrit yang dilewatkan pada kolom reduksi dengan konsentrasi nitrit yang tidak dilewatkan pada kolom reduksi. Sebagai standar digunakan larutan NaNO2 dengan konsentrasi 0, 5, 10,
20, 50, dan 100 µM. Kurva standar nitrit dapat dilihat pada lampiran 2.
HASIL
Pertumbuhan Bakteri pada Kultur Kombinasi
Masing-masing bakteri dalam kultur kombinasi menunjukkan pertumbuhan yang berbeda (Tabel 1). Jumlah sel tertinggi terdapat pada kombinasi B yaitu 175 x 106 sel/ml untuk bakteri metanotrof dan 124 x 106 sel/ml untuk O. anthropi BL2, sedangkan jumlah sel terendah terdapat pada kombinasi C yaitu 63 x 106 sel/ml untuk bakteri metanotrof dan 51 x 106 sel/ml untuk bakteri
3
Tabel 1 Pertumbuhan bakteri metanotrof dan
Ochrobactrum anthropi dalam kultur kombinasi Kode kombinasi isolat Isolat Kepadatan Sel ( x 106
sel/ml)
Persentase (%)
A BGM 1 56 32,8
SKM 14 72 42,1
BL 1 43 25,1
B BGM 1 84 28,1
SKM 14 91 30,4
BL 2 124 41,5
C BGM 5 44 38,6
BGM 9 19 16,7
BL 1 51 44,7
D BGM 5 100 35,7
BGM 9 62 22,1
BL 2 118 42,2
E BGM 1 38 24,5
SKM 14 41 26,5
BL 1 33 21,3
BL 2 43 27,7
F BGM 5 63 23,8
BGM 9 50 18,9
BL 1 63 23,8
BL 2 89 33,5
Aktivitas Oksidasi CH4 dan Reduksi N2O
pada Kultur Kombinasi
Masing-masing kultur kombinasi menunjukkan aktivitas oksidasi CH4 dan
reduksi N2O yang berbeda. Kombinasi E
(BGM 1, SKM 14, BL 1, BL 2) menghasilkan aktivitas oksidasi CH4 tertinggi yaitu 2,9x10
-8
μM/sel/hari, sedangkan aktivitas oksidasi CH4
terendah dihasilkan oleh kombinasi F (BGM5, BGM 9, BL 1, BL 2) yaitu 0,02 x 10-8 μM/sel/hari (Gambar 1).
Kombinasi E selain menghasilkan aktivitas oksidasi CH4 tertinggi juga
menunjukkan aktivitas reduksi N2O tertinggi
yaitu 0,15 x 10-9 μM/sel/hari. Aktivitas reduksi N2O juga ditunjukkan oleh
kombinasi F (BGM 5, BGM 9, BL 1, BL 2) yaitu 0,02 x 10-9 μM/sel/hari, sedangkan empat kombinasi lainya tidak menunjukkan aktivitas reduksi N2O (Tabel 2).
Gambar 1 Aktivitas oksidasi CH4 pada kultur
kombinasi.
Tabel 2 Aktivitas reduksi N2O pada kultur
kombinasi
Kode isolat
Aktivitas reduksi N2O
( x 10-9 μM/sel/hari) A -1,76 ± 0,25 * B -0,48 ± 0,09 * C -1,80 ± 0,28 * D -0,0002 ± 0,03*
E 0,15 ± 0,01
F 0,02 ± 0,05
* Nilai negatif menunjukkan terdapat produksi N2O.
Aktivitas Fiksasi N2, Akumulasi Nitrat, dan
Akumulasi Nitrit dalam Kultur Kombinasi
Kemampuan masing-masing kultur kombinasi dalam fiksasi N2 bervariasi yang
ditunjukkan oleh konsentrasi amonium yang terakumulasi dalam media pertumbuhannya. Akumulasi amonium tertinggi terdapat pada kultur kombinasi A sebesar 122,8 μM (Gambar 2). Akan tetapi, kultur kombinasi E menghasilkan laju akumulasi amonium tertinggi yang merupakan aktivitas setiap sel perharinya sebesar 19,3 x 10-8 μM/sel/hari (Gambar 3).
1,1 0,9 1,7 0,96 2,9 0,02 -0,5 0 0,5 1 1,5 2 2,5 3 3,5 4 4,5
A B C D E F
Ak tiv it a s O k sida si CH 4 ( x 1 0
-8 μ
M
/s
el/ha
ri)
Kode Kombinasi Isolat
A (BGM 1, SKM 14, BL1)
B (BGM 1, SKM 14, BL 2)
C (BGM 5, BGM 9, BL 1)
D (BGM 5, BGM 9, BL 2)
4
Kombinasi F yang menunjukkan aktivitas oksidasi CH4 terendah, kombinasi tersebut
menghasilkan akumulasi nitrit tertinggi yaitu 10,9 μM. Nitrit terakumulasi yang terendah terdapat pada kultur kombinasi A sebesar 7,7 μM (Gambar 4). Akan tetapi, kombinasi A menunjukkan akumulasi nitrat teringgi yaitu 17,6 μM, sedangkan akumulasi nitrat terendah terdapat pada kultur kombinasi E sebesar 2,8 μM (Gambar 5).
PEMBAHASAN
Lahan sawah secara alami akan terbentuk dua lapisan yaitu lapisan oksidatif (lapisan dengan oksigen yang cukup) dan lapisan reduktif (lapisan dengan oksigen terbatas atau tanpa oksigen). Suasana anaerob pada lapisan reduktif merupakan habitat bagi bakteri metanogen. Bakteri metanogen adalah bakteri yang dapat menggunakan sumber karbon berupa karbon dioksida (CO2), metil (seperti
CH3OH), dan asetat (CH3COO-) dan
mengubahnya menjadi metan melalui proses yang disebut metanogenesis. Metan yang 122,8
103,1 111,2
70,6 110,3 108,1 0 20 40 60 80 100 120 140
A B C D E F
Ak um ula si NH 4 + ( µ M )
Kode Kombinasi Isolat
A (BGM 1, SKM 14, BL 1)
B (BGM 1, SKM 14, BL 2) C (BGM 5, BGM 9, BL 1)
D (BGM 5, BGM 9, BL 2)
E (BGM1, SKM14, BL1, BL2) F (BGM 5, BGM 9, BL 1, BL 2)
14,6 5,2 11,8 2,2 19,3 6,4 0 5 10 15 20 25
A B C D E F
L a ju a k um ula si NH 4 + ( x 1 0 -8 µ M /s el/ha ri)
Kode Kombinasi Isolat
A (BGM 1, SKM 14, BL 1)
B (BGM 1, SKM 14, BL 2)
C (BGM 5, BGM 9, BL 1)
D (BGM 5, BGM9, BL 2)
E (BGM1, SKM14, BL1, BL2) F (BGM 5, BGM 9, BL 1, BL 2)
7,7 9,1 8
10 10,1 10,9
0 2 4 6 8 10 12 14
A B C D E F
Ak um ula si NO 2 - ( µ M )
Kode Kombinasi Isolat
A (BGM 1, SKM 14, BL 1) B (BGM 1, SKM 14, BL 2) C (BGM 5, BGM 9, BL 1)
D (BGM 5, BGM 9, BL 2)
E (BGM1, SKM14, BL1, BL2) F (BGM 5, BGM 9 BL 1, BL 2)
17,6
12,1 12,1
3,3 2,8 4,8 0 5 10 15 20 25
A B C D E F
Ak um ula si NO 3 - (µ M )
Kode Kombinasi Isolat
A (BGM 1, SKM 14, BL 1)
B (BGM 1, SKM 14, BL 2) C (BGM 5, BGM 9, BL 1)
D (BGM 5, BGM 9, BL 2)
E (BGM1, SKM14, BL1, BL2) F (BGM 5, BGM 9, BL 1, BL 2)
Gambar 5 Konsentrasi nitrat terakumulasi pada kultur kombinasi.
Gambar 4 Konsentrasi nitrit terakumulasi pada kultur kombinasi.
Gambar 3 Laju akumulasi amonium pada kultur kombinasi.
5
dihasilkan oleh bakteri metanogen dapat dioksidasi oleh bakteri metanotrof pada lapisan oksidatif (Frenzel et al. 1992). Selain bakteri metanogen, pada lapisan reduktif terdapat bakteri denitrifikasi yang berperan dalam reduksi N2O.
Bakteri metanotrof yang digunakan adalah isolat BGM 1, BGM 5, BGM 9, dan SKM 14, sedangkan bakteri denitrifikasi yang digunakan adalah Ochrobactrum anthropi
isolat BL 1 dan BL 2. Kombinasi isolat BGM1 dan SKM 14 serta kombinasi isolat BGM 5 dan BGM 9 merupakan kombinasi yang menghasilkan aktivitas oksidasi metan tertinggi pada penelitian sebelumnya (Chatrina 2010; Hanif 2010). Pada penelitian ini, kedua kombinasi bakteri metanotrof tersebut dikombinasikan kembali dengan isolat O. anthropi. Hasil yang diperoleh menunjukkan aktivitas yang bervariasi dalam kepadatan sel, oksidasi metan, reduksi N2O,
akumulasi amonium, laju akumulasi amonium, akumulasi nitrit, dan akumulasi nitrat.
Enam kombinasi kultur antara bakteri metanotrof dan Ochrobactrum anthropi
menunjukkan pertumbuhan yang bervariasi. Kepadatan sel tertinggi terdapat pada kultur kombinasi B (BGM 1, SKM 14, dan BL 2). Pada kultur kombinasi B tersebut, pertumbuhan isolat BL 2 lebih dominan (41,5%) dibandingkan dengan isolat BGM 5 dan BGM 9 (28,1% dan 30,4%). Berbeda dengan lima kombinasi lainnya, persentase kepadatan sel antara bakteri metanotrof dan
O. anthropi pada kultur kombinasi E dan F lebih seimbang.
Oksidasi CH4 merupakan proses awal
pemanfaatan CH4 oleh bakteri metanotrof.
Metan dioksidasi menjadi metanol melalui pemutusan ikatan dioksida (O2) oleh aktivitas
enzim methane monooxygenase (MMO). Perbedaan aktivitas oksidasi CH4
masing-masing kultur kombinasi di antaranya dapat disebabkan oleh perbedaan aktivitas enzim MMO yang dimiliki oleh bakteri metanotrof.
Hasil yang diperoleh menunjukkan kombinasi F (BGM 5, BGM 9, BL 1, BL 2) memiliki aktivitas oksidasi CH4 terendah
(0,02 x 10-8 µM/se/hari) dan kadar nitrit yang tinggi dalam kultur (10,9 µM). Tingginya kadar nitrit dapat disebabkan oleh adanya aktivitas oksidasi amonium. Menurut Knowles et al. (2006) bakteri metanotrof juga dapat mengoksidasi amonium menjadi nitrit.
Tingginya aktivitas oksidasi amonium pada kombinasi F diduga disebabkan oleh keberadaan isolat BGM 9. Isolat tersebut telah
diidentifikasi sebagai Methylococcus capsulatus (Astuti 2009). Enzim sMMO
(soluble MMO) pada Methylococcus
capsulatus dapat mengkatalisis aktivitas oksidasi amonium menjadi NH2OH yang
kemudian dioksidasi menjadi nitrit (Dalton 1997). Aktivitas oksidasi amonium dan konsentrasi nitrit yang tinggi dapat mempengaruhi aktivitas oksidasi CH4 (Charles
& Knowles 1989; Schnell & King 1994). Nitrit dapat menghambat aktivitas enzim
formate dehydrogenase yang merupakan salah satu enzim yang berperan dalam lintasan oksidasi CH4 (Whittenbury et al. 1970).
Di antara enam kombinasi yang dibuat, hanya kombinasi E dan F yang memiliki nilai aktivitas reduksi N2O positif. Hal ini
menunjukkan bahwa reduksi N2O yang tinggi
terdapat pada kultur kombinasi yang mengandung kedua galur Ochrobactrum anthropi (BL 1 dan BL 2). Sebaliknya, empat kombinasi lainnya (kombinasi A, B, C, dan D) menunjukkan peningkatan konsentrasi N2O
dalam kultur sehingga nilai aktivitas reduksi N2O-nya menjadi negatif.
Peningkatan konsentrasi N2O tersebut
dapat disebabkan oleh akumulasi N2O yang
dihasilkan melalui aktivitas oksidasi amonium menjadi nitrit, serta aktivitas reduksi nitrat menjadi nitrit. Selain itu, aktivitas reduksi N2O sangat dipengaruhi oleh perbedaan
aktivitas enzim nitrous oxide reductase dan konsentrasi oksigen. Menurut Knowles et al. (2006), aktivitas bakteri metanotrof dapat mempengaruhi aktivitas bakteri denitrifikasi melalui penurunan tekanan oksigen dan penyediaan komponen organik dalam proses denitrifikasi. Pada kondisi anaerob, aktivitas enzim denitrifikasi lebih tinggi, sedangkan dalam kondisi oksigen terbatas aktivitas denitrifikasi hanya mencapai 60% (Song et al. 2002).
Selain dapat mengoksidasi CH4, bakteri
metanotrof juga memiliki kemampuan untuk melakukan fiksasi nitrogen. Dari empat isolat bakteri