NIA INDRIANI
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
NIA INDRIANI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
[L.] Spr.). Dibimbing oleh MARIA BINTANG dan MEGA SAFITHRI.
Salah satu tanaman obat yang sering digunakan masyarakat untuk
mengobati penyakit adalah senggugu. Seluruh bagian tanaman senggugu hampir
semuanya digunakan untuk mengobati penyakit. Penelitian ini
mempelajari
aktivitas antibakteri dari daun senggugu tehadap bakteri uji (Staphylococcus
aureus, Bacillus subtilis, Escherichia coli, Pseudomonas aeruginosa),
menentukan Konsentrasi Hambat Tumbuh Minimumnya (KHTM), serta
melakukan uji kualitatif fitokimia.
Daun senggugu dimaserasi dengan menggunakan pelarut metanol, aseton,
dan heksana. Konsentrasi yang digunakan untuk menentukan KHTM bervariasi
dari 500 mg/mL sampai 1 mg/mL. Ampisilin 0.4 mg/mL digunakan sebagai
pembanding. Uji kualitatif fitokimia dilakukan untuk mengetahui golongan
senyawa aktif yang diharapkan berpotensi sebagai antibakteri.
NIA INDRIANI
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
NIA INDRIANI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN
ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
NIM
: G44103024
Disetujui
Komisi Pembimbing
Prof. Dr. drh. Maria Bintang, M.S.
Mega Safithri, M.Si
Ketua
Anggota
Diketahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Prof. Dr. Ir. Yonny Koesmaryono, M.S.
NIP 131 473 999
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Senggugu (
Clerodendron serratum
[L.] Spr.) ... 1
Ekstraksi Maserasi ... 2
Antibakteri ... 2
Bakteri Uji ... 3
BAHAN DAN METODE PERCOBAAN
Bahan dan Alat ... 4
Metode ... 4
HASIL DAN PEMBAHASAN
Aktivitas Antibakteri Filtrat Daun Senggugu ... 6
Ekstraksi dan Rendemen Hasil Ekstraksi ... 6
Analisis Kadar Air dan Fitokimia ... 7
Penentuan KHTM ... 8
Efektivitas Penghambatan Ekstrak Daun Senggugu Terhadap Ampisilin
0.4 mg/mL ... ... 9
SIMPULAN DAN SARAN
Simpulan ... 10
Saran ... 10
DAFTAR PUSTAKA ... 10
Halaman
1 Aktivitas antibakteri filtrat daun sengggugu ... 6
2 Polaritas beberapa pelarut ... 6
3 Rendemen daun senggugu hasil maserasi metanol, aseton, dan heksana .... 7
4 Hasil uji fitokimia ekstrak aseton daun senggugu kering ... 8
5 Aktivitas antibakteri berdasarkan diameter zona hambat ... 9
DAFTAR GAMBAR
Halaman
1 Daun senggugu ... 2
2 Aktivitas antibakteri berbagai ekstrak daun senggugu kering ... 7
3 KHTM ekstrak daun senggugu kering terhadap bakteri
S. aureus
,
B. subtilis, E. coli, dan P. aeruginosa
... 9
4 Perbandingan daya hambat ekstrak daun senggugu terhadap ampisilin
Halaman
1 Tahapan penelitian ... 13
2 Metode pembuatan filtrat daun senggugu ... 13
3 Metode pembuatan ekstrak dari daun senggugu kering ... 14
4 Nilai rendemen ekstrak daun senggugu kering ... 14
5 Kadar air daun senggugu... 15
6 Diameter zona hambat filtrat daun senggugu ... 15
7 Diameter zona hambat ekstrak daun senggugu kering 250 mg/mL ... 15
8 Diameter zona hambat ampisilin 0.4 mg/mL ... 15
9 KHTM ekstrak aseton daun senggugu kering ... 16
10 ANOVA KHTM ... 17
11 Analisis Tukey KHTM ... 17
12 Foto zona hambat filtrat daun se nggugu ... 19
13 Foto zona hambat ekstrak metanol, aseton, heksana, dan ampisilin
dari daun senggugu kering ... 20
14 Foto penentuan KHTM ... 20
15 Foto uji fitokimia ... 22
Nya penulis dapat menyelesaikan karya ilmiah ini. Karya ilmiah ini merupakan
salah satu syarat memperoleh gelar Sarjana Sains pada Program Studi Biokimia
Fakultas Matematika dan Ilmu Pengetahuan Alam. Penelitian ini dilaksanakan
dari bulan April 2007 sampai Juni 2007 dengan judul Aktivitas Antibakteri Daun
Senggugu (
Clerodendron serratum
[L.] Spr.).
Terimakasih penulis sampaikan kepada Ibu Prof. Dr. drh. Maria Bintang,
M.S selaku pembimbing pertama, dan Ibu Mega Safithri, M.Si selaku
pembimbing kedua yang telah membimbing dengan penuh kesabaran, memberi
masukan, dan mengajarkan penulis banyak hal hingga terselesaikannya karya
ilmiah ini. Ucapan terimakasih juga penulis sampaikan untuk teman-teman
biokimia 40, Ratna, Hurri, Tati, Nuri, Dewi, Uci dan Adie atas semua bantuan,
dukungan dan keceriaannya. Bapak, Mamah, Teh Lela dan Indra atas semua kasih
sayang, perhatian, semangat dan doanya. Tak lupa penulis sampaikan terimakasih
kepada seluruh laboran dan staf biokimia atas kerjasama dan kemudahan fasilitas
yang telah diberikan.
Penulis menyadari bahwa karya ilmiah ini masih jauh dari sempurna.
Mudah-mudahan karya ilmiah ini dapat berguna bagi pihak yang membutuhkan.
Wassalamu’alaikum wr. wb
.
Bogor, Agustus 2007
putri kedua dari tiga bersaudara dari pasangan Suhaedin dan Entin Rohatin.
Penulis menamatkan sekolahnya di SMUN 47 Jakarta. Tahun 2003 penulis
melanjutkan sekolahnya di Institut Pertanian Bogor melalui jalur Ujian Seleksi
Masuk IPB (USMI) dengan jur usan Biokimia fakultas Matematika dan Ilmu
Pengetahuan Alam. Selama kuliah, penulis aktif di berbagai kepanitiaan dan ikut
dalam organisasi. Tahun 2003/2004 penulis menjadi anggota IMASIKA
(Himpunan Mahasiswa Kimia) di bidang Rohani Islam. Tahun 2005 penulis
pernah menjadi panitia Seminar Nasional Kimia Populer sebagai koordinator
bidang kesekretariatan.
PENDAHULUAN
Banyak tanaman obat yang telah diteliti dan digunakan sebagai antimikrob. Para ilmuwan terus berusaha untuk mencari sumber dan pengetahuan baru mengenai senyawa antimikrob dalam tanaman baik akar, batang, bunga, biji, dan daun. Tanaman yang diketahui berpotensi sebagai antimikrob sangat berperan dalam kehidupan manusia terutama untuk kemajuan di bidang kesehatan, selain itu tanaman-tanaman tersebut dapat dijadikan sebagai alternatif obat-obatan komersial.
Menurut Wahid (1993), kegunaan tanaman obat selain untuk bahan baku obat, juga untuk parfum, bumbu masak, makanan, dan minuman. Kenyataannya, di Indonesia tanaman obat masih saja digunakan untuk mengobati berbagai penyakit walaupun belum terbukti secara ilmiah. Untuk itulah perlu dilakukan penelitian-penelitian ilmiah sehingga pengobatan secara tradisional dapat dipertanggung jawabkan penggunaanya. Salah satu tanaman obat yang sering digunakan masyarakat untuk mengobati
penyakit adalah senggugu (Clerodendron
serratum [L.] Spr.). Senggugu tumbuh liar di tempat terbuka atau agak terlindung. Bisa ditemukan di hutan sekunder, padang alang-alang, tepi jalan, sering ditanam di pekarangan rumah.
Seluruh bagian tanaman senggugu hampir semuanya digunakan untuk mengobati penyakit. Daunnya digunakan untuk mengobati luka, bisul, borok berair, rematik, dan cacingan; akarnya digunakan untuk wasir, gurah, menjernihkan suara, asma, dan batu ginjal; sedangkan buahnya digunakan untuk menggobati batuk (Dalimartha 1999). Mengingat banyaknya khasiat dan kegunaan tanaman ini, besar kemungkinan daun senggugu ini memiliki aktivitas antibakteri.
Penelitian ini bertujuan untuk mengetahui golongan senyawa aktif yang terdapat dalam daun senggugu yang diduga bertanggung jawab sebagai antimikrob, mempelajari aktivitas antibakteri dari daun senggugu tehadap bakteri uji Gram positif (Staphylococcus aureus, Bacillus subtilis),
dan bakteri Gram negatif (Escherichia coli,
Pseudomonas aeruginosa), serta menentukan
Konsentrasi Hambat Tumbuh Minimum (KHTM) dari ekstrak daun senggugu. Hipotesis dari penelitian ini adalah ekstrak daun senggugu mampu menghambat pertumbuhan atau mematikan bakteri Staphylococcus aureus, Bacillus subtilis,
Escherichia coli, dan Pseudomonas
aeruginosa. Hasil dari penelitian ini
diharapkan dapat memberikan informasi ilmiah di bidang kimia, kedokteran, farmasi, dan kesehatan mengenai aktivitas antibakteri ekstrak daun senggugu, serta memberikan informasi kepada masyarakat bahwa tanaman ini dapat digunakan sebagai antibakteri sehingga dapat meningkatkan nilai guna tanaman tersebut.
TINJAUAN PUSTAKA
Senggugu
(Clerodendron serratum [L.] Spr.)
Senggugu merupakan tanaman perdu, tinggi 1-3 m, batang berongga, berbongkol besar, akar berwarna abu kehitaman. Daun senggugu tunggal, tebal, kaku, bertangkai pendek dengan letak berhadapan, bentuk bulat telur sampai lonjong, ujung dan pangkal runcing, dan tepi bergerigi. Panjang daun 8- 30 cm, lebar 4-14 cm. Bunga majemuk berwarna putih keunguan, keluar dari ujung-ujung tangkai. Senggugu tumbuh liar pada tempat-tempat terbuka, bisa ditemukan di padang alang-alang, tepi jalan atau dekat air yang tanahnya agak lembab dari dataran rendah sampai 1700 dpl. Senggugu juga biasanya ditanam di pekarangan rumah. Senggugu ini dapat diperbanyak dengan biji (Dalimartha 1999).
Nama lain senggugu adalah singgugu (Sunda), srigunggu, sagunggu (Jawa Tengah), sinar baungkudu (batak Toba), kertase, pinggir tosek (Madura). Sinonim dari
senggugu (C. serratum [L.] Spr.) adalah C.
javanicum Walp. Senggugu diklasifikasikan
ke dalam dunia Tumbuhan, filum Spermatophyta, subfilum Angiospermae, kelas Dicotyledoneae, ordo Solanales, famili
Verbenaceae, genus Clerodendron, spesies
Clerodendron serratum (Widowati et al.
1995)
Daun senggugu pahit, pedas, dan sejuk. Daun banyak mengandung kalium, sedikit natrium, alkaloid, dan flavonoid. Berkhasiat
sebagai penghilang nyeri (analgesik), obat
luka, bisul, borok berair, rematik, dan cacingan. Kulit batangnya mengandung senyawa triterpenoid dan asam oleanolat, sedangkan kulit akar mengandung glikosida fenol, manitol, sitosterol (Dalimartha 1999). Senggugu juga merupakan salah satu dari beberapa tanaman obat yang digunakan untuk mengobati alergi, asma, dan bronkhitis
Gambar 1 Daun Senggugu.
Ekstraksi Maserasi
Ekstraksi tumbuhan adalah proses penarikan zat aktif dalam tumbuhan dengan menggunakan pelarut tertentu. Ekstraksi tergantung pada tekstur dan kandungan bahan dalam tumbuhan. Senyawa/kandungan dalam tumbuhan memiliki kelarutan yang berbeda-beda dalam pelarut yang berberbeda-beda. Pelarut-pelarut yang biasa digunakan antara lain kloroform, eter, aseton, alkohol, metanol,
etanol, dan etilasetat. Ekstraksi biasanya
dilakukan secara bertahap dimulai dengan pelarut yang nonpolar (kloroform atau n-heksana), semipolar (etilasetat atau dietil eter), dan pelarut polar (metanol atau etanol) (Harborne 1996). Pelarut yang dapat digunakan untuk ekstraksi harus memenuhi dua syarat, yaitu pelarut tersebut harus merupakan pelarut yang terbaik untuk bahan yang diekstraksi dan pelarut tersebut harus terpisah dengan cepat setelah pengocokan
(Winarno et al. 1973)
Maserasi adalah metode ekstraksi dengan cara merendam sampel dalam pelarut tertentu dengan atau tanpa pengadukan. Maserasi merupakan metode yang paling banyak dilakukan dibandingkan dengan metode lainnya. Maserasi dibedakan menjadi maserasi sederhana, kinetika maserasi, dan maserasi dengan menggunakan tekanan (List 1989).
Maserasi sederhana dilakukan dengan cara merendam sampel dengan pelarut dalam waktu tertentu dengan atau tanpa pengadukan. Kinetika maserasi sama seperti kinetika sederhana, namun pengadukannya konstan. Sedangkan maserasi dengan menggunakan tekanan, yaitu maserasi menggunakan tekanan tertentu, bukan tekanan ruang sehingga proses ekstraksi lebih efektif (List 1989).
Kelebihan metode maserasi dibanding metode ekstrasi lainnya antara lain, metodenya sederhana, tidak memerlukan alat-alat yang rumit, relatif murah, dan bisa menghindari kerusakan komponen senyawa yang tidak tahan panas yang terkandung
dalam sampel (Meloan 1999 diacu dalam Wulandari 2005).
Antibakteri
Menurut Gan et al. (1980), antibakteri
adalah antimikrob yang dapat menghambat pertumbuhan bakteri. Pengertian antimikrob secara umum adalah zat yang dapat menghambat pertumbuhan mikrob, dan digunakan untuk kepentingan pengobatan infeksi pada manusia dan hewan.
Berdasarkan cara kerjanya antibakteri
dibedakan menjadi bakterisidal dan bakteriostatik. Bakterisidal bersifat mematikan bakteri, sedangkan bakteriostatik bersifat menghambat bakteri. Beberapa zat antibakteri bersifat bakteriostatik pada konsentrasi rendah dan bersifat bakterisidal
pada konsentrasi tinggi (Wattimena et al.
1991).
Menurut Jawetz et al. (1996), mekanisme
kerja antibakteri dibedakan menjadi lima secara umum: Antibakteri yang menghambat sintesis dinding sel bakteri, menghambat keutuhan permeabilitas dinding sel bakteri, menghambat sintesis protein sel bakteri, dan menghambat sintesis asam nukleat.
Antibakteri yang menghambat sintesis dinding sel bakteri. Antibakteri terikat pada reseptor sel (beberapa diantaranya adalah enzim transpeptidase), kemudian terjadi reaksi transpeptidase sehingga sintesis peptidoglikan terhambat. Mekanisme diakhiri dengan penghentian aktivitas penghambat enzim autolisis pada dinding sel.
Antibakteri yang menghambat keutuhan
permeabilitas dinding sel bakteri.
Terganggunya membran sitoplasma oleh zat yang bersifat surfaktan, menyebabkan permeabilitas dinding sel berubah dan menjadi rusak. Komponen-komponen penting yang berada di dalam sel seperti protein, asam nukleat, nukleotida keluar dari sel dan berangsur-angsur sel akan mati.
Antibakteri yang menghambat sintesis protein sel bakteri. Suhu dan konsentrasi tinggi zat kimia dapat mendenaturasi protein yang merupakan komponen esensial bagi berlangsungnya kehidupan sel. Senyawa penghambat sintesis protein juga dapat menyebabkan kesalahan dalam pembacaan kode pada mRNA sehingga protein tidak terbentuk, dan sel akan mati.
Antibakteri yang menghambat sintesis
asam nukleat. Senyawa penghambat akan
sintesis asam nukleat, sehingga akhirnya reaksi terhenti karena substrat yang direaksikan dan asam nukleat tidak terbentuk.
Berdasarkan efektivitas kerjanya terhadap mikroorganisme, senyawa antibakteri dikelompokkan menjadai dua, yaitu antibakteri berspektrum luas dan antibakteri
berspektrum sempit (Schunack et al. 1990).
Banyak faktor yang dapat mempengaruhi kerja antibakteri, diantaranya konsentrasi antibakteri, jumlah bakteri, spesies bakteri, suhu, dan pH (Pelczar dan Chan 1986).
Bakteri Uji
Staphylococcus aureus
S. aureus ditemukan pertama kali oleh
Koch tahun 1878. Aureus dalam bahasa
Yunani berarti “emas”, hal ini dikarenakan S.
aureus memiliki pigmen karotenoid berwarna
kuning muda sampai jingga tua. S. aureus ini
termasuk ke dalam familia Micrococcacea,
merupakan bakteri Gram positif dan
berbentuk kokus dengan diameter 0.5-1.5 μm
baik berpasangan maupun gerombol. Bakteri ini bersifat tidak motil, dapat hidup secara aerob dan anaerob fakultatif, pertumbuhan paling cepat pada temperatur 37 ºC. Pembentukan pigmen paling baik pada bakteri in adalah di suhu kamar, yaitu berkisar antara 20-25 °C, serta memiliki pH optimum 7.0-7.5 (Lay dan Hastowo 1994, Pelczar dan Chan 1986).
S. aureus merupakan penyebab berbagai
infeksi pada manusia dan hewan. Bakteri ini dapat menyebabkan penyakit pneumonia (infeksi paru-paru), osteomyelitis (infeksi pada tulang), sinusitis, tonsillitis (radang amandel), dan abses (penimbunan nanah akibat infeksi bakteri), sedangkan pada hewan
S. aureus menyebabkan penyakit mastitis
(pembengkakan payudara) pada sapi dan biri-biri, pustular dermatitis (radang kulit) pada anjing, serta abses pada unggas (Todar 2002).
Bacillus subtilis
Menurut Holt et al. (1994), B. subtilis
merupakan bakteri Gram positif. Bakteri ini berbentuk batang dengan ukuran 0.5-2.5 x
1.2-10 μm, menyendiri, berpasangan atau
membentuk rantai. Bakteri ini mempunyai suhu optimum 25-37 ºC, berkembang biak
dengan endospora 0.6-0.9 x 1.0-1.5 μm yang
berbentuk bulat telur sampai selindris. B.
subtilis memproduksi nitrit dari nitrat, asam dari dekstrin, xiklosa, arabinosa, glukosa, fruktosa, galaktosa, manosa, maltosa, sukrosa,
gliserol, dan manitol, selain itu bakteri ini dapat menghidrolisis pati.
B. subtilis menggunakan sumber C dan N
untuk energi pertumbuhan. Bakteri ini tahan terhadap panas, kering, dan desinfektan kimia tertentu dalam waktu yang cukup lama. Bakteri ini bersifat patogen oportunitis, dapat menyebabkan penyakit pada manusia, seperti hemolisis (dapat melisiskan darah), septikimia (berkembang dalam aliran darah dan menyebabkan penyakit), bakteri ini juga menyebabkan fungsi imun seseorang terganggu sehingga menyebabkan meningitis dan gastroenteritis akut (Jawetz 1996).
Escherichia coli
E. coli merupakan bakteri penghuni usus besar manusia dan hewan tingkat tinggi
lainnya. E. coli adalah mikroflora normal
dalam tubuh manusia dengan menghasilkan bakteriosin sebagai pelindung terhadap terjadinya kolonisasi bakteri patogen.
Galur-galur tertentu dari E. coli ini dapat
menyebabkan penyakit pada manusia dan hewan. Penyakit yang disebabkan oleh bakteri ini antara lain gastroenteritis, diare dan infeksi saluran urin (Fardiaz 1983; Pelczar dan Chan 1986).
E. coli termasuk ke dalam famili
Enterobacteriaceae, merupakan bakteri Gram negatif, bersifat anaerob fakultatif. Bakteri ini berbentuk batang pendek dengan lebar kurang
dari 1.1-1.5 μm dan panjang sekitar 2.0-6.0
μm. Nilai pH optimumnya 7.0-7.5 dan suhu
optimum 37 ºC dengan kisaran suhu
pertumbuhan 10-40 ºC (Holt et al. 1994)
Pseudomonas aeruginosa
P. aeruginosa merupakan bakteri Gram
negatif, bersifat aerob, termasuk ke dalam
famili Pseudomonadaceae. Bakteri ini
berbentuk batang kecil, berdiameter 0.5-1.0
μm dan panjang 1.5-4.0 μm. Bakteri ini motil
dan tumbuh baik pada media N dengan bermacam-macam senyawa karbon. Bakteri ini merupakan flora normal pada tanah, air, dan sering ditemukan pada makanan. Bakteri ini dapat menimbulkan kebusukan pada makanan, mempunyai suhu optimum 37 ºC, tidak tahan terhadap panas dan kering, sehingga untuk membunuhnya dilakukan
pemanasan dan pengeringan (Holt et al. 1994;
Fardiaz 1989).
Menurut Jawetz (1996), P aeruginosa
fluoresensi kehijauan dengan bau aromatik enak. Bakteri ini hanya bersifat patogen dalam tubuh bila masuk ke daerah yang pertahanan normalnya tidak ada atau berperan dalam infeksi campuran.
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah daun
senggugu, bakteri Gram positif (S. aureus dan
B. subtilis), bakteri Gram negatif (E. coli dan P. aeruginosa), ekstrak yeast, bacto pepton, glukosa, nutrient broth, nutrient agar, metanol, heksana, aseton, pereaksi-pereaksi uji
fitokimia (kloroform, H2SO4, amoniak,
pereaksi Mayer, pereaksi Dragendorf, NaOH
10%, FeCl3 1%, eter, pereaksi
Liebermann-Buchard, dan etanol) dan akuades.
Alat-alat yang digunakan adalah otoklaf, inkubator, pemanas, oven, evaporator vakum, laminar air flow hood, spektrofotometer, hot plate stirrer, pinggan porselin, autopipet, cawan petri, aluminium foil, lemari es, pH meter, jarum ose, neraca analitik, dan alat-alat gelas lainnya.
Metode
Persiapan Sampel dan Uji Pendahuluan
Daun segar senggugu dicuci bersih, kemudian dipotong kecil-kecil dan digerus dengan mortar. Filtrat lalu disaring dengan menggunakan kain kassa dan diuji aktivitas antibakterinya.
Penentuan Kadar Air
Penentuan kadar air dilakukan dengan cara mengeringkan daun senggugu yang diletakkan di dalam pinggan porselin, kemudian dimasukkan ke dalam oven selama 3 jam pada suhu 100ºC, lalu didinginkan dalam eksikator, dan ditimbang hingga bobotnya konstan. Pinggan porselin yang digunakan juga harus dalam keadaan benar-benar kering, yaitu dengan cara memasukkan pinggan porselin ke dalam oven selama 30 menit pada suhu 105ºC, kemudian didinginkan dalam eksikator, dan ditimbang bobotnya hingga konstan. Kadar air dihitung dengan persamaan:
Kadar air = W1 – W2 , dengan
W
W1 : bobot pinggan porselin ditambah bobot daun sebelum dikeringkan W2 : bobot pinggan porselin ditambah
bobot daun setelah dikeringkan W : bobot daun
Ekstraksi Daun Senggugu Kering
Daun senggugu dihilangkan airnya dengan
menggunakan oven pada suhu ± 50 oC, setelah
bobotnya konstan lalu dipotong kecil-kecil atau diblender. Setelah itu daun diekstraksi dengan metode maserasi, yaitu sampel direndam dengan pelarut heksana, aseton, dan metanol dengan perbandingan 1:10 selama 18-24 jam pada suhu ruang. Ekstraksi ini dilakukan tiga kali. Setelah itu sampel tersebut disaring. Filtrat yang didapat kemudian dievaporasi agar terpisah dari pelarutnya, sehingga didapatkan ekstraknya. Ekstrak kemudian digunakan untuk uji antibakteri. Ekstrak yang menunjukkan aktivitas antibakteri dibuat menjadi bubuk dengan cara mengeringkannya dalam oven pada suhu ± 50
o
C sampai bobot konstan. Bubuk ini digunakan untuk uji fitokimia dan penentuan KHTM (Konsentrasi Hambat Tumbuh
Minimum). Rendemen ekstrak dihitung
dengan cara sebagai berikut:
Rendemen = bobot ekstrak x 100% (%b/b) bobot kering sampel
Uji Fitokimia (Harborne 1987)
Uji Flavonoid. Sebanyak 0.5 gram sampel
dilarutkan dalam metanol kemudian dipanaskan. Filtrat kemudian ditambahkan
dengan H2SO4 pekat. Terbentuknya warna
merah menunjukkan adanya flavonoid.
Uji Alkaloid. Sebanyak 0.5 gram sampel
digerus dengan mortar kemudian ditambahkan dengan 10 mL kloroform dan beberapa tetes amoniak. Akan terbentuk dua fase. Fase kloroform kemudian dipisahkan dan
diasamkan dengan H2SO4 sebanyak 10 tetes.
Bagian asamnya dipisahkan dan diuji dengan tiga pereaksi, yaitu pereaksi Dragendorf, Mayer dan Wagner. Adanya alkaloid ditandai dengan terbentuknya endapan warna merah dengan penambahan pereaksi Dragendorf, endapan putih dengan pereaksi Mayer, dan endapan cokelat dengan pereaksi Wagner.
Uji Steroid dan Triterpenoid. Sebanyak
0.5 gram sampel ditambahkan 25 mL etanol kemudian dipanaskan dan disaring. Filtratnya diuapkan dan ditambahkan eter. Lapisan eter direaksikan dengan pereaksi Liebermann-Buchard (3 tetes asam asetat anhidrat dan 1
tetes H2SO4 pekat). Terbentuknya warna hijau
atau biru menunjukkan adanya steroid dan terbentuknya warna merah atau ungu menunjukkan adanya triterpenoid.
Uji Saponin. Sebanyak 0.5 gram sampel
selama 5 menit, lalu didinginkan. Filtrat kemudian dikocok selama ± 5 menit. Busa yang terbentuk tidak kurang dari 1 cm dan stabil setelah 15 menit menunjukkan bahwa terdapatnya senyawa saponin.
Uji Tanin. Sebanyak 0.5 gram sampel
ditambahkan air ± 2 mL kemudian dididihkan dan disaring filtratnya. Filtratnya ditambah
dengan FeCl3 1% (b/v). Terbentuknya warna
biru atau hijau kehitaman menunjukkan adanya senyawa tanin.
Pembuatan Media
Media Nutrient Agar (NA). Formulasi
Media NA DIFCO per liter adalah 5 gram
bacto pepton, 3 gram beef extract, 5 gram
NaCl, dan 15 gram bacto agar. Sebanyak 23 gram NA dilarutkan dalam 1 L akuades, lalu dihomogenkan dengan menggunakan
magnetic stirrer sambil dipanaskan.
Kemudian sebanyak 5 ml media yang masih dalam bentuk cair ini dimasukkan ke dalam tabung-tabung reaksi. Media ini disterilkan menggunakan otoklaf pada tekanan 1.5 atm,
121 oC selama 15 menit. Sebelum mengeras
tabung-tabung tersebut dimiringkan lalu biarkan hingga mengeras. Media ini merupakan media agar miring yang digunakan untuk pertumbuhan bakteri.
Media cair Nutrient Broth (NB).
Sebanyak tiga gram beef ekstract, 5 gram
bacto pepton, 5 gram NaCl dilarutkan dalam 1 liter akuades. Kemudian dipanaskan sambil dihomogenkan dengan menggunakan magnetic stirrer. Larutan tersebut dimasukkan ke dalam labu Erlenmeyer sebanyak 10 mL dan ditutup dengan kapas dan alumunium foil. Media ini disterilkan menggunakan otoklaf
pada tekanan 1.5 atm, 121 oC selama 15
menit.
Media agar Pepton Yeast Glukosa
(PYG). Sebanyak 20 gram pepton, 10 gram
ekstrak yeast, 20 gram glukosa, dan 10 gram
agar dilarutkan dalam 1 liter akuades, lalu
dihomogenkan dengan magnetic stirrer dan
pemanasan. Kemudian sebanyak 20 mL masing-masing dimasukkan ke dalam tabung reaksi, lalu disterilkan dengan otoklaf pada tekanan 1.5 atm, suhu 121ºC selama 15 menit. Media ini digunakan untuk pembuatan agar cawan.
Regenerasi Bakteri
Hal pertama yang harus dilakukan adalah membiakkan bakteri dalam agar miring. Biakan digoreskan dari stok ke agar miring, ldiinkubasi pada suhu 37 ºC selama 24 jam.
Biakan ini merupakan biakan awal bakteri yang kemudian disimpan pada suhu 4-5 ºC.
Sebanyak satu mata ose bakteri diambil dari agar miring dan diinokulasikan ke dalam Erlenmeyer yang berisi 10 mL media NB steril. Kemudian diinkubasi dalam inkubator bergoyang pada suhu 37 ºC selama 24 jam,
lalu diukur Optical Density (OD) 25% T pada
panjang gelombang maksimum 600 nm.
Uji Aktivitas Antibakteri (Bintang 1993)
Sebanyak 50 μL biakan bakteri yang telah
diregenerasi diambil dan dipindahkan ke dalam cawan petri, Setelah itu sebanyak 20 mL media agar PYG bersuhu ± 45 ºC dituangkan ke dalam cawan petri. Cawan digoyangkan agar bakteri tersebar merata dan dibiarkan pada suhu kamar hingga media agar memadat. Selanjutnya media dilubangi dengan diameter ± 5.5 mm, kemudian ekstrak
daun senggugu sebanyak 50 μL dimasukkan
ke dalam lubang tersebut, lalu diinkubasi pada suhu 37ºC selama 24 jam. Zona bening yang terlihat di sekeliling lubang menandakan adanya aktivitas antibakteri ekstrak daun
senggugu. Antibiotik ampisilin 0.4 mg/mL
digunakan sebagai kontrol positif.
Penentuan KHTM
KHTM adalah konsentrasi terendah dari
senyawa antibakteri terhadap pertumbuhan
bakteri. Metode yang digunakan adalah metode Bintang (1993). Cara kerjanya adalah dengan membuat berbagai konsentrasi dari ekstrak daun senggugu yang telah dikeringkan, yaitu 500, 250, 125, 100, 50, 40,
30, 20, dan 10 mg/mL. Sebanyak 50 μL
diambil dari masing-masing konsentrasi tersebut dan dimasukkan ke dalam lubang pada media agar PYG yang telah diinokulasi dengan bakteri uji. Kemudian diinkubasi pada suhu 37 ºC selama 24 jam. Aktivitas antibakteri diukur dengan melihat zona bening disekitar lubang sampel. Zona bening menunjukkan bahwa bakteri tidak tumbuh di sekitar filtrat yang terdapat di lubang agar, dan hal tersebut menandakan bahwa ada aktivitas antibakteri dari daun senggugu. Zona bening diukur diameternya sebanyak empat kali ulangan dengan menggunakan jangka sorong dan nilainya dirata-ratakan.
Analisis Statistik
Model rancangannya adalah sebagai berikut:
Yij = µ + τi + εij
Yij = Diameter zona hambat pada dosis ke-i dan ulangan ke-j
µ = Pengaruh rataan umum
τ = Pengaruh dosis ke-i
ε =Pengaruh acak pada dosis ke-i ulangan
ke-j dengan
i: 1 = 500 mg/mL 2 = 250 mg/mL
3 = 125 mg/mL 4 = 75 mg/mL
5 = 30 mg/mL 6 = 15 mg/mL
7 = 10 mg/mL 8 = 5 mg/mL
9 = 2 mg/mL 10 = 1 mg/mL
11= 0.8 mg/mL 12= 0.5 mg/mL 13= 0.2 mg/mL 14= 0.1 mg/mL
15= 0.05 mg/mL
j: 1, 2.
Rancangan ini digunakan pada uji
antibakteri penentuan KHTM menggunakan metode Bintang. Data yang diperoleh
dianalisis dengan ANOVA (analysis of
variance) pada tingkat kepercayaan 95% dan
taraf α 0.05. Uji lanjut yang digunakan adalah
uji Tukey. Semua data dianalisis dengan program SPSS 13.0.
HASIL DAN PEMBAHASAN
Aktivitas Antibakteri Filtrat Daun Senggugu
Uji pendahuluan yang dilakukan adalah uji aktivitas antibakteri dari filtrat daun senggugu. Daun senggugu dipisahkan antara daun tua dengan daun muda. Hal ini dilakukan untuk melihat daun mana yang lebih besar aktivitas antibakterinya, yang nantinya digunakan untuk penelitian selanjutnya, yaitu uji aktivitas antibakteri dan uji fitokimia. Dapat dilihat pada Tabel 1 bahwa diameter zona hambat antara daun muda dan daun tua tidak terlalu berbeda. Daun yang dipilih untuk penelitian selanjutnya adalah daun tua, karena ketersediannya yang lebih banyak dibandingkan dengan daun muda.
Tabel 1 Aktivitas antibakteri filtrat daun sengggugu
Bakteri Uji
Diameter zona hambat daun (mm)
Tua Muda
E. coli 9.00 9.00
P. aeruginosa 9.88 9.38
S. aureus 9.38 9.00
B. subtilis 9.13 9.88
Ekstraksi dan Rendemen Hasil Ekstraksi
Penelitian ini menggunakan metode maserasi untuk mengekstrak daun senggugu. Metode ini dipilih karena sederhana. Untuk zat-zat yang tidak tahan panas, maserasi merupakan metode yang cocok digunakan. Proses maserasi itu sendiri adalah perendaman sampel dengan pelarut dalam jangka waktu tertentu dengan atau tanpa pengadukan. Proses maserasi pada penelitian ini selama 24
jam dengan menggunakan shaker dengan
kecepatan 100 rpm secara terus menerus. Pelarut yang digunakan untuk ekstraksi dalam penelitian ini adalah heksana, aseton, dan metanol.
Pemilihan ketiga pelarut ini dimaksudkan untuk mencari senyawa yang terdapat dalam daun senggugu baik polar, semipolar, atau nonpolar yang aktivitas antibakterinya paling besar. Salah satu ekstrak dari ketiga pelarut yang aktivitas antibakterinya paling besar nantinya digunakan untuk penelitian selanjutnya, yaitu untuk penentuan Konsentrasi Hambat Tumbuh Minimum (KHTM) dan uji fitokimia. Ekstraksi dengan pelarut-pelarut ini didasarkan pada prinsip
ekstraksi yang disebut like disolve like, pelarut
akan melarutkan senyawa sesuai dengan kepolarannya (Khopkar 1990). Tabel 2 menunjukkan tingkat kepolaran masing-masing pelarut.
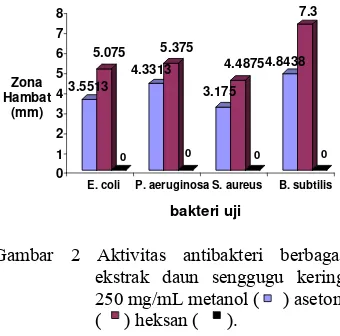
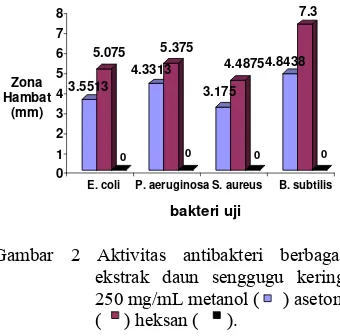
Ekstrak yang digunakan pada penelitian ini yaitu ekstrak dari daun senggugu kering. Daun senggugu kering ini dipakai karena daya tahan penyimpanannya yang lebih lama dibandingkan dengan yang segar, sehingga rusak akibat jamur dan mikroba lainnya dapat diperkecil. Daun senggugu kering ini diekstraksi dengan ketiga macam pelarut, kemudian dirotavaporasi pada suhu 50°C sehingga semua pelarut hilang, dan akhirnya didapatkan ekstrak. Zona hambat ekstrak daun senggugu kering dari ketiga macam pelarut dapat dilihat pada Gambar 2. Konsentrasi masing-masing ekstrak daun senggugu adalah sebesar 25% atau 250 mg/mL, yaitu 25 mg ekstrak dalam 1 mL pelarut.
Tabel 2 Polaritas beberapa pelarut
Gambar 2 Aktivitas antibakteri berbagai ekstrak daun senggugu kering 250 mg/mL metanol ( ) aseton ( ) heksan ( ).
Ekstrak aseton memiliki zona hambat paling besar, yaitu sebesar 5.0750 mm pada
bakteri E. coli, 5.3750 mm pada P.
aeruginosa, 4.4875 mm pada S. aureus, dan
7.3000 mm pada B. subtilis. Hal ini mungkin
karena senyawa yang diduga sebagai antibakteri merupakan senyawa semipolar yang dapat dilarutkan oleh aseton, sedangkan aseton sendiri tidak memiliki aktivitas antibakteri. Selanjutnya ekstrak aseton digunakan untuk menentukan KHTM dan untuk uji fitokimia.
Gambar 2 juga menunjukkan bahwa ekstrak heksana tidak memiliki aktivitas antibakteri, ditunjukkan dengan zona hambat yaitu sebesar 0.00 mm. Hal ini terjadi mungkin karena senyawa nonpolar dalam daun senggugu, yang diduga sebagai senyawa antibakteri menguap akibat pemanasan. Selain itu, hal ini diduga karena metode ekstraksi dan jenis pelarut yang digunakan dalam mengekstrak daun senggugu untuk menghasilkan ekstrak non polar juga belum tepat, sehingga senyawa non polar yang aktif tidak terekstrak bersama pelarut.
Rendemen yang dihasilkan dari hasil ekstraksi metanol, heksana, dan aseton dapat dilihat pada Tabel 3. Metanol menghasilkan rendemen ekstrak paling besar dibandingkan dengan pelarut lainnya yaitu sebesar 19.3316 %. Hal ini menunjukkan bahwa senyawa yang paling banyak terdapat pada daun senggugu adalah senyawa polar. Jumlah rendemen dari daun senggugu dengan ketiga pelarut adalah kecil. Jumlah rendemen yang terhitung besar yaitu diatas 20%. Jumlah rendemen yang banyak, belum tentu menghasilkan aktivitas antibakteri yang besar pula. Karena rendemen yang banyak belum tentu semuanya senyawa aktif yang berpotensi sebagai antibakteri. Untuk itu perlu dilakukan metode dan
penggunaan jenis pelarut lainnya untuk menghasilkan rendemen yang banyak dengan aktivitas yang besar.
Tabel 3 Rendemen daun senggugu hasil maserasi metanol, aseton, dan heksana
Pelarut Bobot ekstrak Rendemen
Metanol 5.8272 g 19.33 %
Aseton 1.7767 g 5.87 %
Heksana 0.9725 g 3.22 %
Analisis Kadar Air dan Fitokimia
Kadar air pada tumbuhan menunjukkan persen bahan kering pada tumbuhan dan menyatakan ketahanan tumbuhan dalam penyimpanan (Haryadi 1993). Daun senggugu memiliki kadar air sebesar 78.44%.Kadar air daun senggugu yang begitu besar menunjukkan bahwa daun senggugu tidak bisa disimpan terlalu lama, kemungkinan rusak karena jamur sangat besar. Kadar air yang baik bagi tumbuhan untuk penyimpanan yang cukup lama adalah sebesar 10% (Tiagarna 2004). Oleh karena itu dalam penelitian ini digunakan daun kering.
Uji fitokimia dilakukan untuk mengetahui secara kualitatif adanya golongan senyawa aktif dalam tumbuhan yang diharapkan dapat berperan sebagai senyawa antibakteri. Menurut Pelczar dan Chan (1988), senyawa-senyawa metabolit seperti flavonoid, tanin,
alkohol, klor, iodium, dan etilen oksida, dapat
bersifat sebagai antimikrob.
Hasil dari uji fitokimia ekstrak aseton daun senggugu dapat dilihat pada Tabel 4. Daun senggugu pada penelitian ini hanya memiliki senyawa alkaloid dan steroid. Adanya senyawa alkaloid ini ditandai dengan terbentuknya endapan cokelat pada pereaksi Wagner, endapan putih pada pereaksi Mayer, dan endapan merah pada pereaksi Dragendorf. Hasil positif steroid ditandai dengan terbentuknya warna hijau kebiruan. Gambar uji fitokimia dapat dilihat pada lampiran 15. Berbeda dengan penelitian ini, Dalimarta (2000), menyatakan bahwa daun senggugu mengandung senyawa alkaloid, flavonoid, dan triterpenoid.
Dalimarta (2000) dalam bukunya tidak menyebutkan bagaimana daun senggugu itu diekstraksi, dengan pelarut apa, dan dengan kondisi daun yang bagaimana. Jadi mungkin saja bila hasil uji fitokimia anatara Dalimarta (2000) dengan penelitian yang dilakukan kali ini berbeda. 3.5513 5.075 0 4.3313 5.375 0 3.175 4.4875 0 4.8438 7.3 0 0 1 2 3 4 5 6 7 8 Zona Hambat (mm)
E. coli P. aeruginosa S. aureus B. subtilis
Tabel 4 Hasil uji fitokimia ekstrak aseton daun senggugu kering
Senyawa Hasil
Sampel Dalimarta (2000) Pembanding
Alkaloid + + Daun tapak dara
Flavonoid - + Buah pinang
Steroid + - -
Triterpenoid - + -
Saponin - - Som Jawa
Tanin - - Daun teh
Penelitian ini menggunakan pelarut aseton yang sifatnya semipolar, jadi ekstrak yang dihasilkan hanya mengandung senyawa-senyawa semipolar, sedangkan flavonoid merupakan senyawa larut air yang sifatnya polar, baik diekstraksi dengan etanol 70% (Suradikusumah 1989). Jadi pada penelitian ini tidak ditemukan senyawa flavonoid, atau mungkin bila ditemukan, jumlahnya sangat kecil.
Triterpenoid merupakan golongan senyawa terpen. Penelitian ini tidak menemukan adanya senyawa triterpenoid dalam daun senggugu, berbeda dengan Dalimarta (2000) yang menyatakan bahwa daun senggugu mengandung senyawa triterpenoid. Hal ini mungkin disebabkan karena ada beberapa senyawa triterpenoid seperti monoterpenoid dan sisterpenoid yang merupakan salah satu senyawa yang diduga sebagai antibakteri hilang pada saat proses pengeringan daun.
Menurut Harborne (1987), alkaloid merupakan senyawa metabolit terbesar yang terdapat dalam tumbuhan. Alkaloid mengandung atom nitrogen dan sering digunakan dalam bidang pengobatan. Alkaloid biasanya berbentuk kristal, bersifat optis aktif, dan tidak berwarna. Fungsi alkaloid dalam tumbuhan belum begitu jelas, namun menurut
Dzulkarnaen et.al (1996), alkaloid dalam daun
Psidium guajava dapat bersifat sebagai
antibakteri.
Steroid banyak terdapat di alam sebagai fraksi lipid dari tanaman atau hewan. Zat ini penting sebagai pengatur aktivitas biologis dalam organisme hidup. Steroid dibentuk oleh bahan yang disebut sterol. Sterol yang terdapat dalam jaringan tumbuhan sering dinamakan fitosterol (Martin 1987). Steroid pada tumbuhan terdapat dalam lapisan lilin daun yang berfungsi sebagai pelindung dari
serangga. Menurut Zhu et al. (2000), steroid
dapat menghambat pertumbuhan bakteri Gram positif.
Senyawa yang juga berperan dalam pertahanan tumbuhan adalah flavonoid
(Harborne 1987). Flavonoid merupakan senyawa fenol terbesar di alam. Flavonoid merupakan turunan dari flavon. Flavonoid terutama larut dalam air, dan dapat diekstraksi dengan etanol 70%. Flavonoid dalam tumbuhan terikat dalam gula sebagai glikosida (Suradikusumah 1989). Menurut Dzulkarnaen
et al. (1996), flavonoid dapat menghambat
pertumbuhan bakteri S. aureus.
Penentuan Konsentrasi Hambat Tumbuh Minimum (KHTM)
KHTM ditentukan untuk mengetahui konsentrasi terkecil yang masih bisa menghambat pertumbuhan bakteri uji. Ekstrak yang digunakan dalam penentuan KHTM ini adalah ekstrak aseton dari daun senggugu kering. Alasan memakai ekstrak aseton karena zona hambat pertumbuhan bakterinya paling besar.
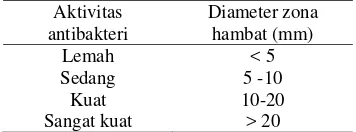
Menurut Suryawiria (1978), aktivitas antibakteri dapat digolongkan berdasarkan besarnya zona hambat yang terbentuk (Tabel 5). Aktivitas antibakteri yang tergolong lemah adalah yang memiliki zona hambat kurang dari 5 mm, sedangkan yang yang tergolong sedang zona hambatnya berkisar antara 5 mm sampai 10 mm, yang tergolong kuat zona hambatnya berkisar antara 10 sampai 20 mm, dan yang tergolong sangat kuat zona hambatnya lebih dari 20 mm.
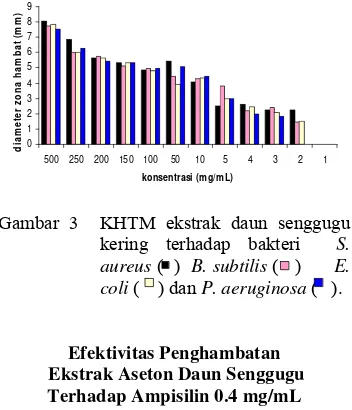
Konsentrasi yang dipakai dalam penentuan KHTM ini bervariasi, yaitu dari 1 mg/mL sampai 500 mg/mL. Tiap-tiap bakteri memiliki konsentrasi hambat tumbuh minimum yang berbeda-beda. Ekstrak daun senggugu pada konsentrasi 2 mg/mL dapat
menghambat bakteri P. aeruginosa dengan
zona hambat 0.00 mm. Jadi konsentrasi terkecil ekstrak daun senggugu kering yang
masih bisa menghambat bakteri P. aeruginosa
adalah 3 mg/mL, dengan zona hambat sebesar 1.85 mm. Sedangkan pada konsentrasi 1 mg/mL, ekstrak daun senggugu dapat
Tabel 4 Hasil uji fitokimia ekstrak aseton daun senggugu kering
Senyawa Hasil Sampel Dalimarta (2000) Pembanding
Alkaloid + + Daun tapak dara
Flavonoid - + Buah pinang
Steroid + - -
Triterpenoid - + -
Saponin - - Som Jawa
Tanin - - Daun teh
Penelitian ini menggunakan pelarut aseton yang sifatnya semipolar, jadi ekstrak yang dihasilkan hanya mengandung senyawa-senyawa semipolar, sedangkan flavonoid merupakan senyawa larut air yang sifatnya polar, baik diekstraksi dengan etanol 70% (Suradikusumah 1989). Jadi pada penelitian ini tidak ditemukan senyawa flavonoid, atau mungkin bila ditemukan, jumlahnya sangat kecil.
Triterpenoid merupakan golongan senyawa terpen. Penelitian ini tidak menemukan adanya senyawa triterpenoid dalam daun senggugu, berbeda dengan Dalimarta (2000) yang menyatakan bahwa daun senggugu mengandung senyawa triterpenoid. Hal ini mungkin disebabkan karena ada beberapa senyawa triterpenoid seperti monoterpenoid dan sisterpenoid yang merupakan salah satu senyawa yang diduga sebagai antibakteri hilang pada saat proses pengeringan daun.
Menurut Harborne (1987), alkaloid merupakan senyawa metabolit terbesar yang terdapat dalam tumbuhan. Alkaloid mengandung atom nitrogen dan sering digunakan dalam bidang pengobatan. Alkaloid biasanya berbentuk kristal, bersifat optis aktif, dan tidak berwarna. Fungsi alkaloid dalam tumbuhan belum begitu jelas, namun menurut Dzulkarnaen et.al (1996), alkaloid dalam daun
Psidium guajava dapat bersifat sebagai
antibakteri.
Steroid banyak terdapat di alam sebagai fraksi lipid dari tanaman atau hewan. Zat ini penting sebagai pengatur aktivitas biologis dalam organisme hidup. Steroid dibentuk oleh bahan yang disebut sterol. Sterol yang terdapat dalam jaringan tumbuhan sering dinamakan fitosterol (Martin 1987). Steroid pada tumbuhan terdapat dalam lapisan lilin daun yang berfungsi sebagai pelindung dari serangga. Menurut Zhu et al. (2000), steroid dapat menghambat pertumbuhan bakteri Gram positif.
Senyawa yang juga berperan dalam pertahanan tumbuhan adalah flavonoid
(Harborne 1987). Flavonoid merupakan senyawa fenol terbesar di alam. Flavonoid merupakan turunan dari flavon. Flavonoid terutama larut dalam air, dan dapat diekstraksi dengan etanol 70%. Flavonoid dalam tumbuhan terikat dalam gula sebagai glikosida (Suradikusumah 1989). Menurut Dzulkarnaen
et al. (1996), flavonoid dapat menghambat
pertumbuhan bakteri S. aureus.
Penentuan Konsentrasi Hambat Tumbuh Minimum (KHTM)
KHTM ditentukan untuk mengetahui konsentrasi terkecil yang masih bisa menghambat pertumbuhan bakteri uji. Ekstrak yang digunakan dalam penentuan KHTM ini adalah ekstrak aseton dari daun senggugu kering. Alasan memakai ekstrak aseton karena zona hambat pertumbuhan bakterinya paling besar.
Menurut Suryawiria (1978), aktivitas antibakteri dapat digolongkan berdasarkan besarnya zona hambat yang terbentuk (Tabel 5). Aktivitas antibakteri yang tergolong lemah adalah yang memiliki zona hambat kurang dari 5 mm, sedangkan yang yang tergolong sedang zona hambatnya berkisar antara 5 mm sampai 10 mm, yang tergolong kuat zona hambatnya berkisar antara 10 sampai 20 mm, dan yang tergolong sangat kuat zona hambatnya lebih dari 20 mm.
Konsentrasi yang dipakai dalam penentuan KHTM ini bervariasi, yaitu dari 1 mg/mL sampai 500 mg/mL. Tiap-tiap bakteri memiliki konsentrasi hambat tumbuh minimum yang berbeda-beda. Ekstrak daun senggugu pada konsentrasi 2 mg/mL dapat menghambat bakteri P. aeruginosa dengan zona hambat 0.00 mm. Jadi konsentrasi terkecil ekstrak daun senggugu kering yang masih bisa menghambat bakteri P. aeruginosa
coli dengan zona hambat 0.00 mm. Jadi konsentrasi terkecil ekstrak daun senggugu kering yang masih bisa menghambat bakteri S. aureus, B. subtilis, E. coli adalah 2 mg/mL. Ekstrak daun senggugu yang tergolong lemah dalam menghambat pertumbuhan bakteri P. aeruginosa yaitu pada konsentrasi 3 mg/mL sampai 10 mg/mL dengan zona hambat berkisar dari 1.85 mm sampai 4.43 mm, sedangkan pada konsentrasi 50 mg/mL sampai 500 mg/mL, aktivitas antibakteri ekstrak daun senggugu tergolong sedang dengan zona hambat berkisar dari 5.08 mm sampai 7.54 mm. Namun berdasarkan statistik (P<0.05), konsentrasi 1 sampai 4, 3 sampai 10, 5 sampai 200, 10 sampai 250, dan 100 sampai 500 mg/mL menghasilkan zona hambat yang tidak berbeda nyata, artinya ekstrak daun senggugu dengan konsentrasi-konsentrasi tersebut menghasilkan penghambatan pertumbuhan yang tidak terlalu berbeda terhadap bakteri P. aeruginosa. Bakteri S. aureus, B. subtilis, E. coli
memiliki konsentrasi hambat tumbuh minimum yang sama yaitu 2 mg/mL, dengan masing-masing zona hambat 2.24 mm, 1.48 mm, dan 1.50 mm. Berdasarkan statistik (P<0.005), konsentrasi ekstrak daun senggugu 1 mg/mL pada bakteri S. aureus dan B.
subtilis memang berbeda nyata dalam hal
penghambatan pertumbuhannya dengan ekstrak daun senggugu 2 mg/mL Berbeda pada E. coli, konsentrasi daun senggugu 1 mg/mL dengan 2 mg/mL tidak berbeda nyata. Aktivitas antibakteri ekstrak daun senggugu dalam menghambat bakteri S.
aureus pada konsentrasi 2-10 mg/mL
tergolong lemah, yaitu dengan zona hambat berkisar antara 2.24-4.09 mm, sedangkan pada konsentrasi 50-500 mg/mL, ekstrak daun senggugu tergolong sedang dengan zona hambat berkisar antara 5.43-8.04 mm. Berdasarkan statistik (P<0.05), konsentrasi 2 sampai 4, 3 sampai 10, 10 sampai 200, 150 sampai 250, dan 250 sampai 500 mg/mL menghasilkan zona hambat yang tidak berbeda nyata.
Tabel 5 Aktivitas antibakteri berdasarkan diameter zona hambat
Aktivitas antibakteri
Diameter zona hambat (mm)
Lemah < 5
Sedang 5 -10
Kuat 10-20 Sangat kuat > 20
(Suryawiria 1978)
Aktivitas antibakteri ekstrak daun senggugu dalam menghambat bakteri B.
subtilis pada konsentrasi 2-100 mg/mL
tergolong lemah, yaitu dengan zona hambat berkisar antara 1.48-4.95 mm, sedangkan pada konsentrasi 150-500 mg/mL, ekstrak daun senggugu tergolong sedang dengan zona hambat berkisar antara 5.13-7.73 mm. Berdasarkan statistik (P<0.05), konsentrasi 2 sampai 3, 5 sampai 50, 10 sampai 150, 100 sampai 200, dan 150 sampai 250 mg/mL menghasilkan zona hambat yang tidak berbeda nyata. Hasil statistik dapat dilihat pada lampiran 11. Semakin tinggi konsentrasi ekstrak daun senggugu, maka semakin besar pula zona hambat yang terbentuk. Hal ini terjadi untuk semua bakteri uji.
0 1 2 3 4 5 6 7 8 9
500 250 200 150 100 50 10 5 4 3 2 1 konsentrasi (mg/mL) di a m e te r z ona ha m ba t (m m )
Gambar 3 KHTM ekstrak daun senggugu kering terhadap bakteri S. aureus ( ) B. subtilis ( ) E. coli ( ) dan P. aeruginosa ( ).
Efektivitas Penghambatan Ekstrak Aseton Daun Senggugu
Terhadap Ampisilin 0.4 mg/mL
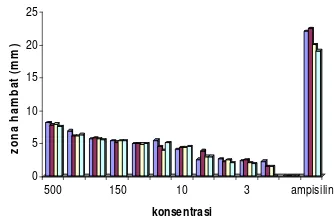
Efektivitas ekstrak aseton daun senggugu jika dibandingkan dengan ampisilin masih sangat jauh. Jika konsentrasi tertinggi dari penelitian ini yaitu 500 mg/mL, dibandingkan dengan konsentrasi ampisilin 0.4 mg/mL, efektivitas penghambatan ekstrak daun senggugu terhadap bakteri uji masih tergolong lemah. Besarnya efektivitas penghambatan ekstrak aseton daun senggugu terhadap ampisilin 0.4 mg/mL pada bakteri S. aureus, B. subtilis, E. coli, P. aeruginosa, masing-masing adalah sebesar 36.51%, 34.57%, 39.36%, dan 39.68%. Perhitungan dapat dilihat pada lampiran 17.
efektivitas antara ampisilin 0.4 mg/mL dengan ekstrak daun senggugu dapat dilihat pada Gambar 4.
Ampisilin digunakan sebagai kontrol positif pada penelitian ini karena spektrumnya yang luas, dan mekanisme kerja dari ampisilin yaitu dapat menghambat pertumbuhan bakteri, baik bakteri Gram positif maupun bakteri Gram negatif sama dengan senyawa antibakteri yang dimiliki oleh daun senggugu.
0 5 10 15 20 25 z o n a h a mb a t ( mm)
500 150 10 3 ampisilin
konsentrasi
Gambar 4
Perbandingan daya hambat ekstrak daun senggugu terhadap ampisilin 0.4 mg/mL. S. aureus ( ) B. subtilis ( ) E. coli ( ) dan P. aeruginosa ( ).
SIMPULAN DAN SARAN
Simpulan
Metanol menghasilkan rendemen ekstrak paling besar yaitu 19.3316%, namun ekstrak aseton menghasilkan zona hambat paling besar. Selanjutnya penelitian menggunakan ekstrak aseton daun senggugu kering. Daun senggugu memiliki kadar air sebesar 78.44%, menunjukkan bahwa daun senggugu tidak bisa disimpan terlalu lama.
Senyawa aktif yang diduga berpotensi sebagai antibakteri yang dimiliki oleh daun senggugu pada penelitian ini antara lain alkaloid, dan steroid. Konsentrasi terkecil ekstrak daun senggugu kering yang masih bisa menghambat bakteri P. aeruginosa adalah 3 mg/mL, dengan zona hambat sebesar 1.85 mm, sedangkan pada S. aureus, B. subtilis, E. coli memiliki konsentrasi hambat tumbuh minimum yaitu 2 mg/mL, dengan masing-masing zona hambat 2.24 mm, 1.48 mm, dan 1.50 mm. Secara umum hubungan konsentrasi dengan zona hambat untuk semua bakteri uji berbanding lurus, yaitu semakin tinggi konsentrasi ekstrak daun senggugu kering, maka semakin tinggi zona hambat yang dihasilkan.
Efektivitas daun senggugu 500 mg/mL dibandingkan dengan ampisilin 0.4 mg/mL
terhadap bakteri S. aureus, B. subtilis, E. coli, P. aeruginosa, yaitu sebesar 36.51%, 34.57%, 39.36%, dan 39.68%. Potensi yang dimiliki oleh ekstrak daun senggugu kering adalah lemah.
Saran
Perlu dilakukan metode ekstraksi selain maserasi. Perlu dilakukan penelitian lanjutan tentang pemurnian ekstrak kasar dari daun senggugu, mekanisme penghambatan bakteri oleh ekstrak daun senggugu, serta perlu juga diadakan penelitian mengenai potensi-potensi lainnya dari daun senggugu selain sebagai antibakteri, seperti senggugu sebagai analgesik, antiasma, dan sebagainya.
DAFTAR PUSTAKA
Bintang M. 1993. Studi antimikroba dari
Streptococcus lactis BCC 2259 [disertasi]. Bandung: Institut Teknologi Bandung.
Dalimarta S. 1999. Atlas Tumbuhan
Indonesia. Jilid ke-1. Jakarta: Trubus
Agriwidya.
Dzulkarnain B, Sundarl D, Chozin A. 1996. Tanaman obat bersifat antibakteri. Cermin Dunia Kedokteran 110:35-48.
Fardiaz S. 1983. Bakteriologi Keamanan Pangan. Jilid I. Bogor: Jurusan Teknologi Pangan dan Gizi, Institut Pertanian Bogor.
Fardiaz S. 1989. Mikrobiologi Pangan Pusat Antar Universitas. Bogor: IPB Pr.
Gan S et al. 1980. Farmakologi dan Terapi. Ed ke-2. Jakarta: Farmakologi FKUI, Universitas Indonesia.
Haryadi W. 1993. Ilmu Kimia Analitik Dasar. Jakarta: Gramedia
Harborne JB. 1996. Metode Fitokimia Penuntun Cara Modern Menganalisis
Tumbuhan. Padmawinata K, Soediro I,
penerjemah; Niksolihin S, editor. Bandung: ITB. Terjemahan dari:
Phtochemical Methodes.
Holt JG, Krieg NR, Sneath PH, Stanley JT, Williams ST. 1994. Burgey’s Mannual of
Determinative Bacteriology. Ed ke-9.
Jawetz E, Melnick JL, Adelberg EA. 1996.
Mikrobiologi Kedokteran. Ed ke-20.
Nugroho E, Maulany RF, penerjemah; Jakarta: Kedokteran EGC. Terjemahan dari: Review of Medical Microbiology.
Khopkar SM. 1990. Konsep Dasar Kimia
Analitik. Saptoraharjo A, penerjemah.
Jakarta: UI Pr. Terjemahan dari: Basic Concepts of Analytical Chemistry.
Lay W, Hastowo S. 1994. Mikrobiologi. Jakarta: Rajawali.
Martin DW Jr. 1987. Biokimia: Harper’s
Review of Biochemistry. Jakarta: EGC
Buku Kedokteran.
Melawati. 2006. Optimasi proses maserasi panili (Vanilla planifolia A) hasil modifikasi proses kuring [skripsi]. Bogor: Fakultas Teknik Pertanian, Institut Pertanian Bogor.
Padmalatha K, BV Venkataraman, R Roopa. 2000. Effect of 721A and DLH-721B (Polyherbal Formulations) on Rat mesenteric mast cell degranulation. Indian Journal of Pharmacology 32:7-10.
Pelczar MJJr, Chan ECS. 1986. Dasar- Dasar
Mikrobiologi. Hadioetomo RS, Imas T,
Tjitrosomo SS, Angka SL, penerjemah; Jakarta: UI Pr. Terjemahan dari: Elements of Microbiology.
Suradikusumah E. 1989. Kimia Tumbuhan. Bogor: Pusat Antar Universitas Ilmu Hayati, Institut Pertanian Bogor.
Schunack W, Mayer K, Haake M. 1990.
Senyawa Obat. Ed ke-2. Wattimena JR,
Subino, penerjemah; Yogyakarta: UGM Pr.
Suryawiria U. 1978. Mikroba Lingkungan. Ed ke-2. Bandung: Institut Teknologi Bandung.
Tiagarna P. 2004. Uji toksisitas akut ekstrak air dan ekstrak etanol 30% dari buah mahkota dewa (Phaleria macrocarpa
(Scheff.) (Boerl.) pada mencit [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Todar K. 2002. The Control of Microbial
Growth. Wisconsin: University of
Wisconsin.
Wahid P. 1993. Medicinal and Aromatic plant
in Indonesia. Bangkok : RAPA
Publication.
Wattimena JR et al. 1991. Farmakodinami dan Terapi Antibiotik. Yogyakarta: UGM Pr.
Widowati L et al. 1995. Penelitian Tanaman Obat di Beberapa Perguruan Tinggi di Indonesia. Jakarta: Pusat Penelitian dan Pengembangan Farmasi Badan Penelitian dan Pengembangan Kesehatan Departemen Kesehatan RI.
Winarno, Fardiaz D, Fardiaz S. 1973.
Ekstraksi, Kromatografi, dan Elektroforesis. Bogor: Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Wulandari NDM. 2005. Perbandingan metode ekstraksi buah mahkota dewa (Phaleria macrocarpa) dan uji toksisitas subkronis pada tikus putih [Skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
coli dengan zona hambat 0.00 mm. Jadi konsentrasi terkecil ekstrak daun senggugu
kering yang masih bisa menghambat bakteri S.
aureus, B. subtilis, E. coli adalah 2 mg/mL. Ekstrak daun senggugu yang tergolong lemah dalam menghambat pertumbuhan
bakteri P. aeruginosa yaitu pada konsentrasi 3
mg/mL sampai 10 mg/mL dengan zona hambat berkisar dari 1.85 mm sampai 4.43 mm, sedangkan pada konsentrasi 50 mg/mL sampai 500 mg/mL, aktivitas antibakteri ekstrak daun senggugu tergolong sedang dengan zona hambat berkisar dari 5.08 mm sampai 7.54 mm. Namun berdasarkan statistik (P<0.05), konsentrasi 1 sampai 4, 3 sampai 10, 5 sampai 200, 10 sampai 250, dan 100 sampai 500 mg/mL menghasilkan zona hambat yang tidak berbeda nyata, artinya ekstrak daun senggugu dengan konsentrasi-konsentrasi tersebut menghasilkan penghambatan pertumbuhan yang tidak terlalu
berbeda terhadap bakteri P. aeruginosa.
Bakteri S. aureus, B. subtilis, E. coli
memiliki konsentrasi hambat tumbuh minimum yang sama yaitu 2 mg/mL, dengan masing-masing zona hambat 2.24 mm, 1.48 mm, dan 1.50 mm. Berdasarkan statistik (P<0.005), konsentrasi ekstrak daun senggugu
1 mg/mL pada bakteri S. aureus dan B.
subtilis memang berbeda nyata dalam hal
penghambatan pertumbuhannya dengan ekstrak daun senggugu 2 mg/mL Berbeda
pada E. coli, konsentrasi daun senggugu 1
mg/mL dengan 2 mg/mL tidak berbeda nyata. Aktivitas antibakteri ekstrak daun
senggugu dalam menghambat bakteri S.
aureus pada konsentrasi 2-10 mg/mL
tergolong lemah, yaitu dengan zona hambat berkisar antara 2.24-4.09 mm, sedangkan pada konsentrasi 50-500 mg/mL, ekstrak daun senggugu tergolong sedang dengan zona hambat berkisar antara 5.43-8.04 mm. Berdasarkan statistik (P<0.05), konsentrasi 2 sampai 4, 3 sampai 10, 10 sampai 200, 150 sampai 250, dan 250 sampai 500 mg/mL menghasilkan zona hambat yang tidak berbeda nyata.
Tabel 5 Aktivitas antibakteri berdasarkan diameter zona hambat
Aktivitas antibakteri
Diameter zona hambat (mm)
Lemah < 5
Sedang 5 -10
Kuat 10-20
Sangat kuat > 20
(Suryawiria 1978)
Aktivitas antibakteri ekstrak daun
senggugu dalam menghambat bakteri B.
subtilis pada konsentrasi 2-100 mg/mL
tergolong lemah, yaitu dengan zona hambat berkisar antara 1.48-4.95 mm, sedangkan pada konsentrasi 150-500 mg/mL, ekstrak daun senggugu tergolong sedang dengan zona hambat berkisar antara 5.13-7.73 mm. Berdasarkan statistik (P<0.05), konsentrasi 2 sampai 3, 5 sampai 50, 10 sampai 150, 100 sampai 200, dan 150 sampai 250 mg/mL menghasilkan zona hambat yang tidak berbeda nyata. Hasil statistik dapat dilihat pada lampiran 11. Semakin tinggi konsentrasi ekstrak daun senggugu, maka semakin besar pula zona hambat yang terbentuk. Hal ini terjadi untuk semua bakteri uji.
0 1 2 3 4 5 6 7 8 9
500 250 200 150 100 50 10 5 4 3 2 1 konsentrasi (mg/mL) di a m e te r z ona ha m ba t (m m )
Gambar 3 KHTM ekstrak daun senggugu
kering terhadap bakteri S.
aureus ( ) B. subtilis ( ) E. coli ( ) dan P. aeruginosa ( ).
Efektivitas Penghambatan Ekstrak Aseton Daun Senggugu
Terhadap Ampisilin 0.4 mg/mL
Efektivitas ekstrak aseton daun senggugu jika dibandingkan dengan ampisilin masih sangat jauh. Jika konsentrasi tertinggi dari penelitian ini yaitu 500 mg/mL, dibandingkan dengan konsentrasi ampisilin 0.4 mg/mL, efektivitas penghambatan ekstrak daun senggugu terhadap bakteri uji masih tergolong lemah. Besarnya efektivitas penghambatan ekstrak aseton daun senggugu terhadap
ampisilin 0.4 mg/mL pada bakteri S. aureus,
B. subtilis, E. coli, P. aeruginosa,
masing-masing adalah sebesar 36.51%, 34.57%,
39.36%, dan 39.68%. Perhitungan dapat dilihat pada lampiran 17.
efektivitas antara ampisilin 0.4 mg/mL dengan ekstrak daun senggugu dapat dilihat pada Gambar 4.
Ampisilin digunakan sebagai kontrol positif pada penelitian ini karena spektrumnya yang luas, dan mekanisme kerja dari ampisilin yaitu dapat menghambat pertumbuhan bakteri, baik bakteri Gram positif maupun bakteri Gram negatif sama dengan senyawa antibakteri yang dimiliki oleh daun senggugu.
0 5 10 15 20 25 z o n a h a mb a t ( mm)
500 150 10 3 ampisilin
konsentrasi
Gambar 4
Perbandingan daya hambat ekstrak
daun senggugu terhadap ampisilin
0.4 mg/mL. S. aureus ( ) B.
subtilis ( ) E. coli ( ) dan P. aeruginosa ( ).
SIMPULAN DAN SARAN
Simpulan
Metanol menghasilkan rendemen ekstrak paling besar yaitu 19.3316%, namun ekstrak aseton menghasilkan zona hambat paling besar. Selanjutnya penelitian menggunakan ekstrak aseton daun senggugu kering. Daun senggugu memiliki kadar air sebesar 78.44%, menunjukkan bahwa daun senggugu tidak bisa disimpan terlalu lama.
Senyawa aktif yang diduga berpotensi sebagai antibakteri yang dimiliki oleh daun senggugu pada penelitian ini antara lain alkaloid, dan steroid. Konsentrasi terkecil ekstrak daun senggugu kering yang masih bisa
menghambat bakteri P. aeruginosa adalah 3
mg/mL, dengan zona hambat sebesar 1.85
mm, sedangkan pada S. aureus, B. subtilis, E.
coli memiliki konsentrasi hambat tumbuh
minimum yaitu 2 mg/mL, dengan masing-masing zona hambat 2.24 mm, 1.48 mm, dan 1.50 mm. Secara umum hubungan konsentrasi dengan zona hambat untuk semua bakteri uji berbanding lurus, yaitu semakin tinggi konsentrasi ekstrak daun senggugu kering, maka semakin tinggi zona hambat yang dihasilkan.
Efektivitas daun senggugu 500 mg/mL dibandingkan dengan ampisilin 0.4 mg/mL
terhadap bakteri S. aureus, B. subtilis, E. coli,
P. aeruginosa, yaitu sebesar 36.51%, 34.57%, 39.36%, dan 39.68%. Potensi yang dimiliki oleh ekstrak daun senggugu kering adalah lemah.
Saran
Perlu dilakukan metode ekstraksi selain maserasi. Perlu dilakukan penelitian lanjutan tentang pemurnian ekstrak kasar dari daun senggugu, mekanisme penghambatan bakteri oleh ekstrak daun senggugu, serta perlu juga diadakan penelitian mengenai potensi-potensi lainnya dari daun senggugu selain sebagai antibakteri, seperti senggugu sebagai analgesik, antiasma, dan sebagainya.
DAFTAR PUSTAKA
Bintang M. 1993. Studi antimikroba dari Streptococcus lactis BCC 2259 [disertasi]. Bandung: Institut Teknologi Bandung.
Dalimarta S. 1999. Atlas Tumbuhan
Indonesia. Jilid ke-1. Jakarta: Trubus
Agriwidya.
Dzulkarnain B, Sundarl D, Chozin A. 1996.
Tanaman obat bersifat antibakteri. Cermin
Dunia Kedokteran 110:35-48.
Fardiaz S. 1983. Bakteriologi Keamanan
Pangan. Jilid I. Bogor: Jurusan Teknologi Pangan dan Gizi, Institut Pertanian Bogor.
Fardiaz S. 1989. Mikrobiologi Pangan Pusat
Antar Universitas. Bogor: IPB Pr.
Gan S et al. 1980. Farmakologi dan Terapi.
Ed ke-2. Jakarta: Farmakologi FKUI, Universitas Indonesia.
Haryadi W. 1993. Ilmu Kimia Analitik Dasar.
Jakarta: Gramedia
Harborne JB. 1996. Metode Fitokimia
Penuntun Cara Modern Menganalisis
Tumbuhan. Padmawinata K, Soediro I,
penerjemah; Niksolihin S, editor. Bandung: ITB. Terjemahan dari: Phtochemical Methodes.
Holt JG, Krieg NR, Sneath PH, Stanley JT,
Williams ST. 1994. Burgey’s Mannual of
Determinative Bacteriology. Ed ke-9.
Jawetz E, Melnick JL, Adelberg EA. 1996.
Mikrobiologi Kedokteran. Ed ke-20.
Nugroho E, Maulany RF, penerjemah; Jakarta: Kedokteran EGC. Terjemahan
dari: Review of Medical Microbiology.
Khopkar SM. 1990. Konsep Dasar Kimia
Analitik. Saptoraharjo A, penerjemah.
Jakarta: UI Pr. Terjemahan dari: Basic
Concepts of Analytical Chemistry.
Lay W, Hastowo S. 1994. Mikrobiologi.
Jakarta: Rajawali.
Martin DW Jr. 1987. Biokimia: Harper’s
Review of Biochemistry. Jakarta: EGC
Buku Kedokteran.
Melawati. 2006. Optimasi proses maserasi
panili (Vanilla planifolia A) hasil
modifikasi proses kuring [skripsi]. Bogor: Fakultas Teknik Pertanian, Institut Pertanian Bogor.
Padmalatha K, BV Venkataraman, R Roopa. 2000. Effect of 721A and DLH-721B (Polyherbal Formulations) on Rat
mesenteric mast cell degranulation. Indian
Journal of Pharmacology 32:7-10.
Pelczar MJJr, Chan ECS. 1986. Dasar- Dasar
Mikrobiologi. Hadioetomo RS, Imas T,
Tjitrosomo SS, Angka SL, penerjemah;
Jakarta: UI Pr. Terjemahan dari: Elements
of Microbiology.
Suradikusumah E. 1989. Kimia Tumbuhan.
Bogor: Pusat Antar Universitas Ilmu Hayati, Institut Pertanian Bogor.
Schunack W, Mayer K, Haake M. 1990.
Senyawa Obat. Ed ke-2. Wattimena JR,
Subino, penerjemah; Yogyakarta: UGM Pr.
Suryawiria U. 1978. Mikroba Lingkungan. Ed
ke-2. Bandung: Institut Teknologi Bandung.
Tiagarna P. 2004. Uji toksisitas akut ekstrak air dan ekstrak etanol 30% dari buah
mahkota dewa (Phaleria macrocarpa
(Scheff.) (Boerl.) pada mencit [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Todar K. 2002. The Control of Microbial
Growth. Wisconsin: University of
Wisconsin.
Wahid P. 1993. Medicinal and Aromatic plant
in Indonesia. Bangkok: RAPA
Publication.
Wattimena JR et al. 1991. Farmakodinami
dan Terapi Antibiotik. Yogyakarta: UGM Pr.
Widowati L et al. 1995. Penelitian Tanaman
Obat di Beberapa Perguruan Tinggi di Indonesia. Jakarta: Pusat Penelitian dan Pengembangan Farmasi Badan Penelitian dan Pengembangan Kesehatan Departemen Kesehatan RI.
Winarno, Fardiaz D, Fardiaz S. 1973. Ekstraksi, Kromatografi, dan Elektroforesis. Bogor: Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Wulandari NDM. 2005. Perbandingan metode
ekstraksi buah mahkota dewa (Phaleria
macrocarpa) dan uji toksisitas subkronis pada tikus putih [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Zhu Y, Qi XZ, Zhong JJ. 2000. Epoxide Sesquiterpenes and Steroids from
Cremanthodium Discoideum. Australian
Lampiran 1 Tahapan penelitian
Lampiran 2 Metode pembuatan filtrat daun senggugu
Daun senggugu
Tua
Dihaluskan
Disaring
Filtrat daun senggugu Muda
kering segar
maserasi
Uji aktivitas antibakteri
ekstrak
KHTM Fitokimia
Daun Senggugu
Filtrat
Uji aktivitas antibakteri
ditimbang rendemen
Lampiran 3 Metode pembuatan ekstrak dari daun senggugu kering
Lampiran 4 Nilai rendemen ekstrak daun senggugu kering
Pelarut
Bobot kering sampel (g)
Bobot kosong labu (g)
Bobot labu + ekstrak (g)
Ekstrak (g)
Rendemen (%)
Metanol 30.1434 79.3162 85.1434 5.8272 19.33
Aseton 30.2434 109.6261 111.4028 1.7767 5.87
Heksana 30.1712 112.6257 113.5982 0.9725 3.22
Contoh perhitungan
►Rendemen metanol
Rendemen = (Bobot labu+ekstrak) - (Bobot kosong labu) x 100 %
Bobot kering sampel
= 85.1434 – 79.3162 x 100%
30.1434
= 19.33 %
Daun senggugu
Maserasi 24 jam dengan metanol, aseton, dan heksana
Disaring
Filtrat
Epavorasi 40 ºC sampai pekat
Ekstrak Dikeringkan pada
Lampiran 5 Kadar air daun senggugu
Ulangan
Bobot cawan + sampel sebelum dikeringkan
(W1) (g)
Bobot cawan + sampel setelah dikeringkan
(W2) (g)
Bobot sampel (W) (g)
Kadar Air (%)
Simplo 33.0042 30.6824 3.0258 76.73
Duplo 34.4681 32.0472 3.0257 79.80
Triplo 39.7712 37.2884 3.1573 78.78
Rataan 78.44
Contoh perhitungan
►Kadar air ulangan 1
% kadar air = W1 – W2 x 100 %
W
= 33.0042 – 30.6824 x 100% 3.0258
= 76.73 %
Lampiran 6 Diameter zona hambat filtrat daun senggugu
Daun Ulangan Diameter zona hambat (mm)
E. coli P. aeruginosa B. subtilis S. aureus
Tua 1 9.00 10.75 9.25 9.50
2 9.00 9.00 9.00 9.25
Rataan 9.00 9.88 9.13 9.38
Muda 1 9.00 9.50 10.75 9.00
2 9.00 9.25 9.00 9.00
Rataan 9.00 9.375 9.88 9.00
Lampiran 7 Diameter zona hambat ekstrak daun senggugu kering 250 mg/mL
Pelarut Ulangan Diameter zona hambat (mm)
E. coli P.aeruginosa B. subtilis S. aureus
Metanol 1 3.32 5.22 5.27 4.03
2 3.79 3.44 4.43 2.33
Rataan 3.55 4.33 4.84 3.18
Aseton 1 5.43 5.33 7.59 4.80
2 4.73 5.43 7.01 4.18
Rataan 5.08 5.38 7.30 4.49
Heksana 1 0.00 0.00 0.00 0.00
2 0.00 0.00 0.00 0.00
Rataan 0.00 0.00 0.00 0.00
Lampiran 8 Diameter zona hambat ampisilin 0.4 mg/25 mL
Kontrol positif Ulangan Diameter zona hambat (mm)
E. coli P.aeruginosa B. subtilis S. aureus
Ampisilin
1 20.35 23.99 27.03 23.00
2 19.58 14.01 17.69 21.03
Lampiran 9 KHTM ekstrak aseton daun senggugu kering
Konsentrasi(mg/mL)
Ulangan Diameter zona hambat (mm)
E. coli P.aeruginosa B. subtilis S. aureus
500 1 8.13 7.60 7.58 8.72
2 7.60 7.13 7.88 8.33
Rataan 7.86 7.54 7.73 8.04
250 1 6.33 6.81 5.93 6.88
2 5.73 5.75 6.13 6.83
Rataan 6.02 6.28 6.03 6.85
200 1 5.55 5.38 5.83 5.60
2 5.75 5.53 5.73 5.73
Rataan 5.65 5.45 5.78 5.66
150 1 5.38 5.30 5.23 5.35
2 5.35 5.40 5.03 5.28
Rataan 5.36 5.35 5.13 5.31
100 1 4.98 5.13 5.03 4.91
2 4.69 4.78 4.88 4.83
Rataan 4.83 4.95 4.95 4.87
50 1 4.85 6.64 4.14 4.33
2 2.98 3.53 4.79 6.53
Rataan 3.91 5.08 4.46 5.43
10 1 3.74 4.66 4.58 4.05
2 4.98 4.20 3.99 4.13
Rataan 4.36 4.43 4.28 4.09
5 1 2.40 3.55 4.23 2.63
2 2.65 2.75 3.43 2.56
Rataan 2.96 2.98 3.83 2.54
4 1 2.43 1.98 2.18 2.60
2 2.50 1.91 2.24 2.70
Rataan 2.46 1.98 2.18 2.60
3 1 2.13 1.63 2.40 2.43
2 2.03 2.08 2.20 2.13
Rataan 2.08 1.85 2.40 2.28
2 1 1.63 0.00 1.48 2.28
2 1.38 0.00 1.53 2.20
Rataan 1.50 0.00 1.48 2.24
1 1 0.00 0.00 0.00 0.00
2 0.00 0.00 0.00 0.00
Lampiran 10 ANOVA KHTM
Sum of Squares
Df Mean Square F Sig.
B.subtilis Between Groups 103.947 11 9.450 136.906 .000
Within Groups .828 12 .069
Total 104.776 23
S.aureus Between Groups 83.789 10 8.379 35.872 .000
Within Groups 2.569 11 .234
Total 86.358 21
P.aeruginosa Between Groups 127.762 11 11.615 22.741 .000
Within Groups 6.129 12 .511
Total 133.891 23
E.coli Between Groups 109.494 11 9.954 40.174 .000
Within Groups 2.973 12 .248
Total 112.467 23
Lampiran 11 Analisis Tukey KHTM
B.subtilis
konsentrasi
N
Subset for alpha = .05
1 2 3 4 5 6 7
1 2 .0000
2 2 1.5000
4 2 2.2063
3 2 2.3000
5 2 3.8250
10 2 4.2813 4.2813
50 2 4.4625 4.4625
100 2 4.9500 4.9500
150 2 5.1250 5.1250 5.1250
200 2 5.7750 5.7750
250 2 6.0250
500 2 7.7250
Lanjutan lampiran 11
S.aureus
konsentrasi
N
Subset for alpha = .05
1 2 3 4 5 6
1 2 .0000
2 2 2.2375
3 2 2.2750 2.2750
5 2 2.5938 2.5938
4 2 2.6500 2.6500
10 2 4.0875 4.0875
100 2 4.8688
150 2 5.3125 5.3125
50 2 5.4250 5.4250
200 2 5.6625 5.6625
250 2 6.8500 6.8500
500 2 8.5200
Sig. 1.000 .998 .054 .120 .136 .088
P.aeruginosa
konsentrasi
N
Subset for alpha = .05
1 2 3 4 5
1 2 .0000
2 2 .0000
3 2 1.8500 1.8500
4 2 1.9438 1.9438
5 2 3.1500 3.1500
10 2 4.4313 4.4313 4.4313
100 2 4.9500 4.9500 4.9500
50 2 5.0813 5.0813 5.0813
150 2 5.3500 5.3500 5.3500
200 2 5.4500 5.4500 5.4500
250 2 6.2813 6.28