Pseudomonas
sp. SEBAGAI PEMACU PERTUMBUHAN DAN
PENGENDALI HAYATI FUNGI PATOGEN AKAR
TANAMAN KEDELAI
PARJONO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan dengan sebenarnya bahwa tesis Pseudomonas sp. sebagai Pemacu Pertumbuhan dan Pengendali Hayati Fungi Patogen Akar Tanaman Kedelaiadalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juli 2008
ABSTRACT
PARJONO. Pseudomonas sp. as Growth Promoting and Biological Control Agents of Pathogenic Fungi of Soybean Root. Under the direction of ARIS TRI WAHYUDI and ABDJAD ASIH NAWANGSIH.
Plant growth promoting rhizobacteria (PGPR) are the groups of root-colonizing isolates from the rhizosphere, which have been shown to promote plant growth. Some of the rhizobacteria have been used as diseases control agents and plant growth enhancement. The aim of this study is to examinePseudomonas sp. isolated from soybean rhizosphere that are potential as growth promoting of plant and biocontrol of pathogenic fungi causing root-rot diseases. Fifteen isolates of Pseudomonas sp. were observed on soybean seedlings as plant growth promoting and tested for their hypersensitive reaction. Three isolates, i.e. Pseudomonas sp. Crb97, Crb102, and Crb106 were significantly promote shoot growth and number of lateral roots. Furthermore 8 isolates (Crb102, Crb109, Crb110, Crb111, Crb112, Crb113, Crb114, and Crb115) were classified as pathogenic. Three isolates (Crb3, Crb17, and Crb102) were categorized as non-pathogenic strains and they did not produce antibacterial compound against Bradyrhizobium japonicum Bj11. These Pseudomonas sp. isolates Crb3, Crb17, and Crb102 were subsquently examined to control the phytopathogenic fungi, i.e. Rhizoctonia solani, Fusarium oxysporum, and Sclerotium rolfsii in the green house. Pseudomonas sp. Crb3 and Crb102 were able to promote plant growth and suppress root-rot diseases caused by fungi, significantly. Co-inoculation with B. japonicum Bj11, Crb3, Crb17, or Crb102 revealed that Pseudomonas sp. Crb3, Crb17, and Crb102 were able to enhance colonization/nodulation of soybean plant. Based on the result we suggest Pseudomonas sp. Crb3 and Crb102 can be recommended as potential strains to promote plant growth and control root-rot diseases as well as root nodulation promotion of soybean plant.
RINGKASAN
PARJONO. Pseudomonas sp. sebagai Pemacu Pertumbuhan dan Pengendali Hayati Fungi Patogen Akar Tanaman Kedelai. Dibimbing oleh ARIS TRI WAHYUDI dan ABDJAD ASIH NAWANGSIH
Pengendalian secara hayati merupakan salah satu alternatif dalam meningkatkan pertumbuhan tanaman dan produksi kedelai. Rizobakteri pemacu pertumbuhan tanaman (RPPT) merupakan bakteri rizosfer yang memberikan pengaruh positif bagi pertumbuhan tanaman untuk pemacuan pertumbuhan dengan menyediakan nutrisi dan hormon serta dapat bersifat antagonis terhadap bakteri dan fungi fitopatogen. Salah satu kelompok rizobakteri yang berperan dalam pemacuan pertumbuhan dan pengendali hayati diantaranya Pseudomonas sp. Peran rizobakteri dalam meningkatkan pertumbuhan dan produksi kedelai berhubungan dengan kemampuannya memproduksi hormon, antibiotik, siderofor, HCN, enzim, dan memfiksasi nitrogen, serta melarutkan posfat.
Telaah pemacuan pertumbuhan kecambah dilakukan dengan menginokulasikan suspensi sel Pseudomonas sp. pada kecambah kedelai, setelah berumur 7 hari diamati dan diukur pertumbuhannya. Patogenisitas RPPT dideteksi menggunakan uji hipersensitivitas yaitu dengan menginjeksikan isolat Pseudomonas sp. pada permukaan bawah helaian daun tembakau. Setelah 24-48 jam, diamati adanya bercak nekrosis kecoklatan disekitar tempat injeksi yang menunjukkan reaksi hipersensitif positif atau isolatnya bersifat patogen. Sifat antagonis agens pengendali hayati dideteksi menggunakan uji aktivitas produksi senyawa anti bakteri yaitu dengan menumbuhkan bakteri Pseudomonas sp. pada media King’s B kemudian kertas saring bulat dicelupkan pada suspensi Bradyrhizobium japonicum dan diletakkan pada permukaan cawan berisi Pseudomonas sp.. Setelah 1-5 hari diamati ada atau tidaknya zona bening disekitar kertas saring bulat. Uji biokontrol di rumah kaca dilakukan dengan menanam kedelai yang diberi agens biokontrol dan fungi patogen akar menggunakan botol Leonard selama 42 hari. Peubah pertumbuhuhan yang diamati adalah berat kering akar, jumlah bintil, aktivitas enzim peroksidase dan kejadian penyakit. Kejadian penyakit dihitung berdasarkan jumlah tanaman yang mati pada waktu panen. Pengukuran aktivitas peroksidase dilakukan pada akar tanaman kedelai yang berumur 45 hari. Akar dicampur bufer fosfat dan dihancurkan kemudian disentrifugasi. Supernatan yang diperoleh kemudian ditambah pirogalol dan H2O2 dan diukur nilai absorbansinya setiap 30 detik selama 150 detik menggunakan spektrofotometer. Rata-rata nilai absorban (∆OD = b) dari suatu pengamatan dicari dengan menggunakan persamaan regresi (Y=a+bx). Unit aktivitas enzim (UAE) dihitung dengan rumus: UAE = ∆OD x sumber enzim (ml)/ bobot basah sample (g).
Aplikasi isolat campuran Pseudomonas sp. Crb3 + B. japonicum Bj11 mampu meningkatkan secara nyata rata-rata berat kering akar dan jumlah bintil dibandingkan dengan perlakuan tunggal B. japonicum Bj11. Perlakuan campuran Pseudomonas sp. Crb17 + B. japonicumBj11 mampu meningkatkan secara nyata rata-rata berat kering akar dan jumlah bintil dibandingkan dengan perlakuan tunggal B. japonicumBj11. Aplikasi campuran isolat Pseudomonas sp. Crb102 + B. japonicum Bj11 mampu meningkatkan rata-rata berat kering akar dan jumlah bintil dibandingkan dengan perlakuan tunggal B. japonicum Bj11, tetapi tidak berbeda nyata. Campuran Pseudomonas sp.Crb3 + R. solani dan campuran Pseudomonas sp.Crb3 + R. Solani + B. japonicum mampu menekan kejadian penyakit sebesar 83.33% dibandingkan dengan perlakuan tunggal R. solani. Tanaman yang diinokulasi dengan Pseudomonas sp. Crb102 tingkat kejadian penyakitnya 66.67% lebih rendah dibandingkan dengan tanaman yang mendapat perlakuan tunggal S. rolfsii. Pada tanaman yang mendapat aplikasi Pseudomonas sp. Crb102 + S. rolfsii + B. japonicum Bj11 hanya mampu menekan kejadaian penyakit sebesar 50% dibanding dengan tanaman yang mendapat perlakuan tunggal S. Rolfsii. Perlakuan menggunakan Pseudomonas sp.Crb3+ R. solani + B. japonicum Bj11dan Pseudomonas sp.Crb3 + R. solani mampu meningkatkan aktifitas peroksidase dan berbeda nyata dibandingkan dengan perlakuan tunggal R. solani. Perlakuan menggunakan Pseudomonas sp.Crb17 + F. oxysporum + B. japonicum Bj11 dan Pseudomonas sp.Crb17 + F. Oxysporum mampu meningkatkan aktifitas peroksidase tetapi tidak berbeda nyata dibandingkan dengan perlakuan F. oxysporum. Pada tanaman yang diberi perlakuan campuran Pseudomonas sp.Crb102 + S. rolfsii + B. japonicum Bj11 atau Pseudomonas sp.Crb102 + S. rolfsii aktifitas enzim peroksidasenya lebih rendah dibandingkan dengan tanaman yang hanya mendapat perlakuan tunggal S. rolfsii
Hasil penelitian menunjukan bahwa isolat Pseudomonas sp. Crb3, dan Crb102 yang diaplikasikan pada tanaman kedelai di rumah kaca dapat meningkatan berat kering akar dan jumlah bintil serta menekan kejadian penyakit. Isolat Pseudomonas sp. Crb17 mampu meningkatkan rata-rata berat kering akar dan jumlah bintil secara signifikan dibandingkan dengan kontrol.
© Hak Cipta milik IPB tahun 2008
Hak Cipta dilindungi Undag-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; Pengutipan tidak merugikan kepentingan yang wajar IPB.
Pseudomonas
sp. SEBAGAI PEMACU PERTUMBUHAN DAN
PENGENDALI HAYATI FUNGI PATOGEN AKAR
TANAMAN KEDELAI
PARJONO
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Biologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Penelitian : Pseudomonas sp. sebagai Pemacu Pertumbuhan dan Pengendali Hayati Fungi Patogen Akar Tanaman Kedelai.
Nama : Parjono
NRP : G 351060021
Disetujui Komisi Pembimbing
Dr. Drs. Aris Tri Wahyudi, M.Si Dr. Ir. Abdjad Asih Nawangsih, M.Si Ketua Anggota
Diketahui
Ketua Program Studi Biologi Dekan Sekolah Pascasarjana
Dr. Ir. Dedy Duryadi Solihin, DEA Prof. Dr. Ir. Khairil A. Notodiputro, M.S
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karuniaNya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Agustus 2007 sampai April 2008 ialah Rizobakteri Pemacu Pertumbuhan Tanaman (RPPT), dengan judul Pseudomonas sp. sebagai Pemacu Pertumbuhan dan Pengendali Hayati Fungi Patogen Akar Tanaman Kedelai.
Penulis menyampaikan penghargaan dan ucapan terima kasih yang sebesar-besarnya terutama kepada Pembimbing, yaitu Bapak Dr. Drs. Aris Tri Wahyudi, M.Si dan Ibu Dr. Ir. Abdjad Asih Nawangsih, M.Si yang telah banyak memberikan bimbingan dan saran selama penulis menempuh studi S2. Terima kasih juga penulis sampaikan kepada Dr. Ir. Sugiyanta, M.Si selaku Penguji Luar Komisi yang telah banyak memberikan koreksi dan arahan untuk perbaikan tesis. Terima kasih yang sebesar-besarnya penulis sampaikan kepada Departemen Agama Republik Indonesia yang telah mengadakan program beasiswa pascasarjana dengan IPB dan Kerjasama Kemitraan Penelitian Pertanian Perguruan Tinggi (KKP3T) Departemen Pertanian kepada Aris Tri Wahyudi yang teleh mendanai penelitian ini. Penulis juga mengucapkan banyak terima kasih kepada Jajaran Pimpinan di Pemerintah Daerah Kabupaten Kebumen, Bapak-Ibu karyawan/wati MAN 1 Kebumen dan staf Unit Pelaksana Teknik Laboratorium Biologi yang telah mendukung dan mengijinkan untuk menyelesaikan studi. Ungkapan terima kasih juga penulis sampaikan kepada Bapak (alm), Ibu, Bapak/Ibu Mertua, istri, anak-anak dan seluruh keluarga atas doa dan kasih sayangnya. Tidak lupa kepada rekan-rekan yang tidak dapat saya sebutkan satu persatu, penulis mengucapkan banyak terima kasih atas bantuan dan kebersamaannya.
Penulis menyadari bahwa tesis ini masih jauh dari sempurna, oleh karena itu kritik dan saran sangat diharapkan. Penulis berharap semoga karya ilmiah ini bermanfaat bagi pembaca.
Bogor, Juli 2008
RIWAYAT HIDUP
Penulis dilahirkan di Kebumen pada tanggal 8 September 1967 sebagai anak ketiga dari lima bersaudara pasangan Dasingoen (alm.) dan Soewarsih. Pendidikan Dasar sampai Menegah Atas diselesaikan di Kebumen. Pendidikan sarjana ditempuh di Jurusan Biologi pada Institut Keguruan dan Ilmu Pendidikan (IKIP) Muhammadiyah Purwokerto (sekarang UMP), lulus pada tahun 1992. Pada tahun 2006, penulis mendapatkan beasiswa dari Departemen Agama Republik Indonesia untuk melanjutkan studi di Program Studi Biologi pada Sekolah Pascasarjana IPB.
Penulis bekerja sebagai guru di lingkungan Dinas P dan K Kabupaten Kebumen sejak tahun 1997 dan di tempatkan di MAN 1 Kebumen. Mata pelajaran yang diampu ialah biologi.
Pseudomonas
sp. SEBAGAI PEMACU PERTUMBUHAN DAN
PENGENDALI HAYATI FUNGI PATOGEN AKAR
TANAMAN KEDELAI
PARJONO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan dengan sebenarnya bahwa tesis Pseudomonas sp. sebagai Pemacu Pertumbuhan dan Pengendali Hayati Fungi Patogen Akar Tanaman Kedelaiadalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juli 2008
ABSTRACT
PARJONO. Pseudomonas sp. as Growth Promoting and Biological Control Agents of Pathogenic Fungi of Soybean Root. Under the direction of ARIS TRI WAHYUDI and ABDJAD ASIH NAWANGSIH.
Plant growth promoting rhizobacteria (PGPR) are the groups of root-colonizing isolates from the rhizosphere, which have been shown to promote plant growth. Some of the rhizobacteria have been used as diseases control agents and plant growth enhancement. The aim of this study is to examinePseudomonas sp. isolated from soybean rhizosphere that are potential as growth promoting of plant and biocontrol of pathogenic fungi causing root-rot diseases. Fifteen isolates of Pseudomonas sp. were observed on soybean seedlings as plant growth promoting and tested for their hypersensitive reaction. Three isolates, i.e. Pseudomonas sp. Crb97, Crb102, and Crb106 were significantly promote shoot growth and number of lateral roots. Furthermore 8 isolates (Crb102, Crb109, Crb110, Crb111, Crb112, Crb113, Crb114, and Crb115) were classified as pathogenic. Three isolates (Crb3, Crb17, and Crb102) were categorized as non-pathogenic strains and they did not produce antibacterial compound against Bradyrhizobium japonicum Bj11. These Pseudomonas sp. isolates Crb3, Crb17, and Crb102 were subsquently examined to control the phytopathogenic fungi, i.e. Rhizoctonia solani, Fusarium oxysporum, and Sclerotium rolfsii in the green house. Pseudomonas sp. Crb3 and Crb102 were able to promote plant growth and suppress root-rot diseases caused by fungi, significantly. Co-inoculation with B. japonicum Bj11, Crb3, Crb17, or Crb102 revealed that Pseudomonas sp. Crb3, Crb17, and Crb102 were able to enhance colonization/nodulation of soybean plant. Based on the result we suggest Pseudomonas sp. Crb3 and Crb102 can be recommended as potential strains to promote plant growth and control root-rot diseases as well as root nodulation promotion of soybean plant.
RINGKASAN
PARJONO. Pseudomonas sp. sebagai Pemacu Pertumbuhan dan Pengendali Hayati Fungi Patogen Akar Tanaman Kedelai. Dibimbing oleh ARIS TRI WAHYUDI dan ABDJAD ASIH NAWANGSIH
Pengendalian secara hayati merupakan salah satu alternatif dalam meningkatkan pertumbuhan tanaman dan produksi kedelai. Rizobakteri pemacu pertumbuhan tanaman (RPPT) merupakan bakteri rizosfer yang memberikan pengaruh positif bagi pertumbuhan tanaman untuk pemacuan pertumbuhan dengan menyediakan nutrisi dan hormon serta dapat bersifat antagonis terhadap bakteri dan fungi fitopatogen. Salah satu kelompok rizobakteri yang berperan dalam pemacuan pertumbuhan dan pengendali hayati diantaranya Pseudomonas sp. Peran rizobakteri dalam meningkatkan pertumbuhan dan produksi kedelai berhubungan dengan kemampuannya memproduksi hormon, antibiotik, siderofor, HCN, enzim, dan memfiksasi nitrogen, serta melarutkan posfat.
Telaah pemacuan pertumbuhan kecambah dilakukan dengan menginokulasikan suspensi sel Pseudomonas sp. pada kecambah kedelai, setelah berumur 7 hari diamati dan diukur pertumbuhannya. Patogenisitas RPPT dideteksi menggunakan uji hipersensitivitas yaitu dengan menginjeksikan isolat Pseudomonas sp. pada permukaan bawah helaian daun tembakau. Setelah 24-48 jam, diamati adanya bercak nekrosis kecoklatan disekitar tempat injeksi yang menunjukkan reaksi hipersensitif positif atau isolatnya bersifat patogen. Sifat antagonis agens pengendali hayati dideteksi menggunakan uji aktivitas produksi senyawa anti bakteri yaitu dengan menumbuhkan bakteri Pseudomonas sp. pada media King’s B kemudian kertas saring bulat dicelupkan pada suspensi Bradyrhizobium japonicum dan diletakkan pada permukaan cawan berisi Pseudomonas sp.. Setelah 1-5 hari diamati ada atau tidaknya zona bening disekitar kertas saring bulat. Uji biokontrol di rumah kaca dilakukan dengan menanam kedelai yang diberi agens biokontrol dan fungi patogen akar menggunakan botol Leonard selama 42 hari. Peubah pertumbuhuhan yang diamati adalah berat kering akar, jumlah bintil, aktivitas enzim peroksidase dan kejadian penyakit. Kejadian penyakit dihitung berdasarkan jumlah tanaman yang mati pada waktu panen. Pengukuran aktivitas peroksidase dilakukan pada akar tanaman kedelai yang berumur 45 hari. Akar dicampur bufer fosfat dan dihancurkan kemudian disentrifugasi. Supernatan yang diperoleh kemudian ditambah pirogalol dan H2O2 dan diukur nilai absorbansinya setiap 30 detik selama 150 detik menggunakan spektrofotometer. Rata-rata nilai absorban (∆OD = b) dari suatu pengamatan dicari dengan menggunakan persamaan regresi (Y=a+bx). Unit aktivitas enzim (UAE) dihitung dengan rumus: UAE = ∆OD x sumber enzim (ml)/ bobot basah sample (g).
Aplikasi isolat campuran Pseudomonas sp. Crb3 + B. japonicum Bj11 mampu meningkatkan secara nyata rata-rata berat kering akar dan jumlah bintil dibandingkan dengan perlakuan tunggal B. japonicum Bj11. Perlakuan campuran Pseudomonas sp. Crb17 + B. japonicumBj11 mampu meningkatkan secara nyata rata-rata berat kering akar dan jumlah bintil dibandingkan dengan perlakuan tunggal B. japonicumBj11. Aplikasi campuran isolat Pseudomonas sp. Crb102 + B. japonicum Bj11 mampu meningkatkan rata-rata berat kering akar dan jumlah bintil dibandingkan dengan perlakuan tunggal B. japonicum Bj11, tetapi tidak berbeda nyata. Campuran Pseudomonas sp.Crb3 + R. solani dan campuran Pseudomonas sp.Crb3 + R. Solani + B. japonicum mampu menekan kejadian penyakit sebesar 83.33% dibandingkan dengan perlakuan tunggal R. solani. Tanaman yang diinokulasi dengan Pseudomonas sp. Crb102 tingkat kejadian penyakitnya 66.67% lebih rendah dibandingkan dengan tanaman yang mendapat perlakuan tunggal S. rolfsii. Pada tanaman yang mendapat aplikasi Pseudomonas sp. Crb102 + S. rolfsii + B. japonicum Bj11 hanya mampu menekan kejadaian penyakit sebesar 50% dibanding dengan tanaman yang mendapat perlakuan tunggal S. Rolfsii. Perlakuan menggunakan Pseudomonas sp.Crb3+ R. solani + B. japonicum Bj11dan Pseudomonas sp.Crb3 + R. solani mampu meningkatkan aktifitas peroksidase dan berbeda nyata dibandingkan dengan perlakuan tunggal R. solani. Perlakuan menggunakan Pseudomonas sp.Crb17 + F. oxysporum + B. japonicum Bj11 dan Pseudomonas sp.Crb17 + F. Oxysporum mampu meningkatkan aktifitas peroksidase tetapi tidak berbeda nyata dibandingkan dengan perlakuan F. oxysporum. Pada tanaman yang diberi perlakuan campuran Pseudomonas sp.Crb102 + S. rolfsii + B. japonicum Bj11 atau Pseudomonas sp.Crb102 + S. rolfsii aktifitas enzim peroksidasenya lebih rendah dibandingkan dengan tanaman yang hanya mendapat perlakuan tunggal S. rolfsii
Hasil penelitian menunjukan bahwa isolat Pseudomonas sp. Crb3, dan Crb102 yang diaplikasikan pada tanaman kedelai di rumah kaca dapat meningkatan berat kering akar dan jumlah bintil serta menekan kejadian penyakit. Isolat Pseudomonas sp. Crb17 mampu meningkatkan rata-rata berat kering akar dan jumlah bintil secara signifikan dibandingkan dengan kontrol.
© Hak Cipta milik IPB tahun 2008
Hak Cipta dilindungi Undag-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; Pengutipan tidak merugikan kepentingan yang wajar IPB.
Pseudomonas
sp. SEBAGAI PEMACU PERTUMBUHAN DAN
PENGENDALI HAYATI FUNGI PATOGEN AKAR
TANAMAN KEDELAI
PARJONO
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Biologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Penelitian : Pseudomonas sp. sebagai Pemacu Pertumbuhan dan Pengendali Hayati Fungi Patogen Akar Tanaman Kedelai.
Nama : Parjono
NRP : G 351060021
Disetujui Komisi Pembimbing
Dr. Drs. Aris Tri Wahyudi, M.Si Dr. Ir. Abdjad Asih Nawangsih, M.Si Ketua Anggota
Diketahui
Ketua Program Studi Biologi Dekan Sekolah Pascasarjana
Dr. Ir. Dedy Duryadi Solihin, DEA Prof. Dr. Ir. Khairil A. Notodiputro, M.S
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karuniaNya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Agustus 2007 sampai April 2008 ialah Rizobakteri Pemacu Pertumbuhan Tanaman (RPPT), dengan judul Pseudomonas sp. sebagai Pemacu Pertumbuhan dan Pengendali Hayati Fungi Patogen Akar Tanaman Kedelai.
Penulis menyampaikan penghargaan dan ucapan terima kasih yang sebesar-besarnya terutama kepada Pembimbing, yaitu Bapak Dr. Drs. Aris Tri Wahyudi, M.Si dan Ibu Dr. Ir. Abdjad Asih Nawangsih, M.Si yang telah banyak memberikan bimbingan dan saran selama penulis menempuh studi S2. Terima kasih juga penulis sampaikan kepada Dr. Ir. Sugiyanta, M.Si selaku Penguji Luar Komisi yang telah banyak memberikan koreksi dan arahan untuk perbaikan tesis. Terima kasih yang sebesar-besarnya penulis sampaikan kepada Departemen Agama Republik Indonesia yang telah mengadakan program beasiswa pascasarjana dengan IPB dan Kerjasama Kemitraan Penelitian Pertanian Perguruan Tinggi (KKP3T) Departemen Pertanian kepada Aris Tri Wahyudi yang teleh mendanai penelitian ini. Penulis juga mengucapkan banyak terima kasih kepada Jajaran Pimpinan di Pemerintah Daerah Kabupaten Kebumen, Bapak-Ibu karyawan/wati MAN 1 Kebumen dan staf Unit Pelaksana Teknik Laboratorium Biologi yang telah mendukung dan mengijinkan untuk menyelesaikan studi. Ungkapan terima kasih juga penulis sampaikan kepada Bapak (alm), Ibu, Bapak/Ibu Mertua, istri, anak-anak dan seluruh keluarga atas doa dan kasih sayangnya. Tidak lupa kepada rekan-rekan yang tidak dapat saya sebutkan satu persatu, penulis mengucapkan banyak terima kasih atas bantuan dan kebersamaannya.
Penulis menyadari bahwa tesis ini masih jauh dari sempurna, oleh karena itu kritik dan saran sangat diharapkan. Penulis berharap semoga karya ilmiah ini bermanfaat bagi pembaca.
Bogor, Juli 2008
RIWAYAT HIDUP
Penulis dilahirkan di Kebumen pada tanggal 8 September 1967 sebagai anak ketiga dari lima bersaudara pasangan Dasingoen (alm.) dan Soewarsih. Pendidikan Dasar sampai Menegah Atas diselesaikan di Kebumen. Pendidikan sarjana ditempuh di Jurusan Biologi pada Institut Keguruan dan Ilmu Pendidikan (IKIP) Muhammadiyah Purwokerto (sekarang UMP), lulus pada tahun 1992. Pada tahun 2006, penulis mendapatkan beasiswa dari Departemen Agama Republik Indonesia untuk melanjutkan studi di Program Studi Biologi pada Sekolah Pascasarjana IPB.
Penulis bekerja sebagai guru di lingkungan Dinas P dan K Kabupaten Kebumen sejak tahun 1997 dan di tempatkan di MAN 1 Kebumen. Mata pelajaran yang diampu ialah biologi.
DAFTAR ISI
Halaman
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
PENDAHULUAN Latar Belakang………. 1
Tujuan……….. 2
TINJAUAN PUSTAKA Bakteri Rizosfer Pemacu Pertumbuhan Tanaman………... 3
Rizobakteria Pseudomonas sp………. 4
Respon Hipersensitif……… 4
Biokontrol Fitopatogen……… 6
BAHAN DAN METODE Bahan……….... 13
Uji Pemacuan Pertumbuhan Kecambah Kedelai………. 13
Uji Hipersensitivitas ……… 14
Uji Aktivitas Produksi Senyawa Anti Bakteri………. 15
Uji Biokontrol pada Tanaman Kedelai di Rumah Kaca……….. 16
Pengendalian Fungi Patogen Akar... 18
Induksi Resistensi Sistemik... 19
HASIL Uji Pemacuan Pertumbuhan Kecambah Kedelai... 20
Uji Hipersensitivitas … ……….. 22
Uji Aktivitas Produksi Senyawa Anti Bakteri………. 22
Uji Biokontrol pada Tanaman Kedelai di Rumah Kaca……….. 22
Pengendalian Fungi Patogen Akar... 27
Induksi Resistensi Sistemik... 27
PEMBAHASAN Uji Pemacuan Pertumbuhan Kecambah Kedelai... 30
Uji Hipersensitivitas … ……….. 30
Uji Aktivitas Produksi Senyawa Anti Bakteri………. 31
Uji Biokontrol pada Tanaman Kedelai di Rumah Kaca……….. 31
Pengendalian Fungi Patogen Akar... 32
Induksi Resistensi Sistemik... 34
KESIMPULAN DAN SARAN... 36
DAFTAR PUSTAKA... 37
DAFTAR TABEL
Halaman 1. Pengaruh inokulasi Pseudomonas sp dalam memacu pertumbuhan batang,
akar, dan jumlah akar lateral kecamabah kedelai... 20 2. Respon hipersensitif tanaman tembakau terhadap isolat Pseudomonas sp.. 22 3. Pengaruh Pseudomonas sp.Crb3 terhadap berat kering akar dan jumlah
bintil akar... 23 4. Pengaruh Pseudomonas sp.Crb17 terhadap berat kering akar dan jumlah
bintil akar... 24 5. Pengaruh Pseudomonas sp.Crb102 terhadap berat kering akar dan jumlah
bintil akar.………... 25 6. Pengaruh Pseudomonas sp.Crb3 terhadap kejadian penyakit busuk akar
tanaman kedelai ... 27 7. Pengaruh agens biokontrol terhadap unit aktivitas enzim peroksidase pada
akar tanaman kedelai... 29
DAFTAR GAMBAR
Halaman 1. Pertumbuhan kecambah kedelai yang berumur satu minggu pada tempat
gelap... 20 2. Respon tanaman kedelai terhadap Pseudomonas sp. Crb3 dan B.
japonicum Bj11... 23 3. Respon tanaman kedelai terhadap Pseudomonas sp. Crb17 dan B.
japonicum Bj11... 24 4. Respon tanaman kedelai terhadap Pseudomonas sp. Crb102 dan B.
japonicum Bj11... 25 5. Pertumbuhan akar tanaman kedelai pada berbagai perlakuan... 26 6. Aktivitas enzim peroksidase pada akar tanaman kedelai yang diberi
perlakuan Pseudomonas sp. dan B. japonicum Bj11... 28
DAFTAR LAMPIRAN
Halaman 1. Komposisi media dan larutan hara... 42 2. Tanaman kedelai di rumah kaca... 43
PENDAHULAN
Latar Belakang
Konsumsi kedelai terus meningkat sejalan dengan meningkatnya jumlah penduduk dimana kedelai merupakan komoditas pangan bagi berbagai lapisan masyarakat. Selain untuk pangan, kedelai banyak digunakan untuk pakan ternak dan bahan baku industri. Produksi kedalai nasional belum cukup untuk memenuhi kebutuhan sendiri sehingga mengimpor kedelai dari luar negeri dengan jumlah yang cukup besar untuk memenuhi kebutuhan.
Indonesia merupakan negara yang kaya akan biodiversitas, terutama keanekaan hewan, tanaman, dan mikroba. Keanekaan mikroba ternyata jauh lebih luas dari pada keanekaan hewan dan tanaman. Hanya karena kurang adanya paparan yang cukup mengenai dunia mikroba, kebanyakan para pakar ilmu pengetahuan alam kurang memberi perhatian atau bahkan tidak menyadari peranan yang luar biasa dari mikroba tersebut terhadap berbagai bidang kehidupan manusia. Banyak mikroba simbiotik atau nonsimbiotik baik berupa bakteri ataupun fungi merupakan contoh mikroba yang prospektif di bidang pertanian.
efektif dalam mengendalikan penyakit tanaman, tidak menimbulkan dampak negatif terhadap lingkungan, efektif selama masa hidup tanaman dan beberapa jenis agens dapat menghasilkan senyawa tertentu yang berfungsi sebagai hormon tumbuh sehingga memberi manfaat ganda bagi tanaman (Silva et al 2004). Oleh karena itu usaha untuk menggali potensi mikroba dan meniadakan kendala secara biologi dalam memproduksi kedelai perlu dilakukan. Salah satu kelompok bakteri yang berperan dalam pemacuan pertumbuhan dan pengendali hayati ialah Pseudomonas sp.. Pseudomonas sp. telah banyak diketahui sebagai Rizobakteri Pemacu Pertumbuhan Tanaman (RPPT) atau Plant Growth Promoting Rhizobacteria (PGPR) yang hidup disekitar perakaran tanaman, namun informasi tentang Pseudomonas sp. non-patogenik yang berpotensi sebagai biokontrol tanaman kedelai belum banyak diketahui. Oleh karena itu perlu untuk mengkaji dan meneliti lebih jauh tentang peran Pseudomonas sp. yang berpotensi sebagai pemacu pertumbuhan dan biokontrol fungi patogen akar.
Tujuan
TINJAUAN PUSTAKA
Bakteri Rizosfer Pemacu Pertumbuhan Tanaman
Mikroorganisme yang berada di dalam tanah atau rizosfer tanaman telah diketahui memegang peranan penting dalam berbagai proses di dalam tanah yang secara tidak langsung mempengaruhi pertumbuhan tanaman (Tilak et al. 2005). Interaksi mikroba dengan tanaman di rizosfer dapat berupa hubungan yang menguntungkan, netral, atau menggangu pertumbuhan tanaman (Husen 2003). Plant Growth Promoting Rhizobacteria (PGPR) atau Rizobakteri Pemacu Pertumbuhan Tanaman (RPPT) berpotensi meningkatkan produktivitas dan pertumbuhan tanaman. Terdapat berbagai mekanisme PGPR dalam menstimulasi pertumbuhan tanaman. Mekanisme ini dikelompokkan menjadi dua yaitu secara langsung dan tidak langsung. Secara tidak langsung rizobakteri terkait dengan produksi metabolit seperti antibiotik dan siderofor, yang dapat berfungsi menurunkan pertumbuhan fitopatogen. Secara langsung PGPR mampu memproduksi zat pengatur tumbuh dan meningkatkan pengambilan nutrisi oleh tumbuhan (Kloepper 1993).
Menurut Kusumadewi (1999) rizobakteri memungkinkan penyediaan unsur hara tertentu dari lingkungannya yaitu menambat N2 dan mensuplai ketanaman. Rizobakteri juga mampu menghasilkan siderofor yang dapat melarutkan dan memisahkan besi dari tanah serta menyediakannya untuk tanaman. Genus yang banyak diketahui sebagai pemacu pertumbuhan antara lain Pseudomonas sp., Bacillus sp., dan Rhizobium sp.
Rizobakteri Pseudomonas sp.
Genus Pseudomonas adalah bakteri yang dapat ditemukan pada hampir semua media alami dan tahan terhadap senyawa yang bersifat menghambat pertumbuhan bakteri lain sehingga mudah diisolasi. Bakteri ini mampu mendominasi daerah rizosfer dan berkembang secara cepat, bersifat gram negatif, motil, aerob/ anaerob fakultatif (Pelczar & Chan 1986). Salah satu bakteri yang ditemukan secara luas di dalam ekosistem tanah rizosfer adalah Pseudomonas sp., yang mampu mendegradasi dan menggunakan sejumlah besar senyawa organik dan anorganik, berinteraksi dengan tanaman dan berasosiasi dalam rizosfer yang menguntungkan bidang pertanian (Palleroni & Moore 2004). Bakteri Pseudomonas sp. kelompok fluoresen dapat memproduksi IAA, sitokinin, isopentenyl adenosine, dan zeatin ribose (Salamone et al. 2001). Pseudomonas sp. banyak dilaporkan sebagai penghasil fitohormon dalam jumlah yang besar khususnya IAA untuk merangsang pertumbuhan (Watanabe et al. 1987.). IAA merupakan hormon pertumbuhan kelompok auksin yang berguna untuk merangsang pertumbuhan tanaman. Auksin berguna untuk meningkatkan pertumbuhan sel batang, menghambat proses pengguguran daun, merangsang pembentukan buah, serta merangsang pertumbuhan kambium, dan menghambat pertumbuhan tunas ketiak (Tjondronegoro et al. 1989). Pseudomonas sp. juga diketahui memproduksi asam silikat yang mampu mengendalikan tobacco necrosis virus pada tembakau (Maurhofer et al.1994).
Respon Hipersensitif
hipersensitif dibagi menjadi tiga tahap yaitu tahap terinduksi, periode laten dan kematian sel atau jaringan. Tahap induksi terjadi 1,5-3 jam setelah daun diinjeksi dengan suspensi bakteri. Pada tahap ini bakteri mengalami multiplikasi yang dilanjutkan dengan kontak sel dan pengenalan sel bakteri dengan sel tanaman. Tahap laten 7-10 jam setelah injeksi. Pada tahap ini terjadi peningkatan laju respirasi, peningkatan permeabilitas membran sel tanaman dan kerusakan organel-organel sel. Pada kedua tahap ini daun belum menunjukan gejala nekrotik. Kematian sel merupakan tahap akhir yang terjadi 8-12 jam setelah injeksi. Pada tahap ini terjadi reaksi antara senyawa fenol yang terdapat dalam vakuola dengan substansi yang ada di dalam sitoplasma dan terbentuk senyawa sitolitik. Pada tahap ini mulai terjadi gejala nekrosis (Klement et al. 1990).
nematoda juga mati. Lebih cepat sel-sel inang mati setelah infeksi nematoda, maka tanaman terlihat lebih tahan (Agrios 1997).
Pseudomonas sp. yang berasal dari daerah perakaran mempunyai sifat yang beragam, dimana terdapat bakteri yang menguntungkan maupun yang merugikan tanaman itu sendiri. Pseudomonas sp. bersifat menguntungkan karena mampu menghasilkan zat yang dibutuhkan tanaman dan mampu menekan kejadian penyakit, bersifat merugikan karena merusak sel-sel tanaman dan mengeluarkan zat yang bersifat toksik bagi tanaman. Oleh karena itu untuk mengetahui rizobakteria Pseudomonas sp. bersifat patogen atau nonpatogen perlu dilakukan uji hipersensitifitas.
Biokontrol Fitopatogen
Biokontrol merupakan kemampuan suatu mikroba untuk menekan kejadian suatu penyakit tanaman. Interaksi mikroorganisme yang antagonis terhadap berbagai macam patogen tanaman memiliki peranan penting dalam keseimbangan mikroorganisme di dalam tanah, serta memberikan kontribusi sebagai agens biokontrol penyakit tanaman. Biokontrol tanaman bermanfaat dalam menurunkan dampak buruk pada tanaman akibat penggunaan bahan kimiawi seperti pestisida. Penggunaan fungisida dapat menyebabkan polusi lingkungan dan menginduksi resistensi pada patogen. Bahan kimia ini juga dapat menyebabkan klorosis dan kelayuan pada semaian muda ( Jones 1985).
mikroba menyesuaikan diri. Tidak kalah penting adalah sterilisasi permukaan benih dengan natrium hipoklorit sebelum aplikasi dengan agens biokontrol. Hal ini untuk menghindari patogen lain yang dapat berkompetisi dengan agens biokontrol (Copeland & McDonald 1995).
Pada umumnya pengendalian hayati melibatkan penggunaan cendawan atau bakteri sebagai agens antagonis untuk mengendalikan patogen tular benih (seedborne), tular tanah (soilborne), atau tular udara (airborne). Perlakuan ini semakin populer dengan semakin meningkatnya kepedulian akan keamanan lingkungan dan kesehatan serta masalah fitotoksisitas sehubungan dengan penggunaan pestisida yang berlebihan. Pengendalian hayati dapat memberikan perlindungan selama siklus hidup tanaman (Silva et al. 2004). Pengendalian hayati juga dilaporkan dapat memacu peningkatan pertumbuhan tanaman yang pada akhirnya meningkatkan hasil tanaman sebagai akibat dari pengendalian penyakit jangka panjang (Zhang et al. 2002). Agens biokontrol yang memiliki kemampuan menghasilkan senyawa antibiotik dapat menghambat pertumbuhan patogen melalui kontak langsung antara agens dan patogen. Senyawa antibiotik zwitermisin A yang dikeluarkan oleh B.cereus dilaporkan efektif menghambat pertumbuhan koloni Phytophthora madicaginis (Silo-Suh et al. 1998).
Mekanisme kompetisi antara agens biokontrol dan patogen umumnya terjadi karena keterbatasan salah satu faktor yang dibutuhkan untuk pertumbuhan dan perkembangan agens atau patogen, seperti nutrisi atau unsur hara tertentu. Kemampuan P. fluorescens memproduksi senyawa siderofor yang mampu mengkelat besi dalam kondisi lingkungan yang kekurangan Fe mengakibatkan terhambatnya pertumbuhan patogen karena Fe menjadi tidak tersedia bagi patogen (Dwivedi & Jori 2003). Agens biokontrol juga mampu memparasit patogen secara langsung dengan cara mensekresikan enzim ekstraseluler (kitinase, protease, dan selulose) yang dapat melisis atau mendegradasi dinding sel patogen sehingga perkembangan patogen menjadi terhambat (Singh et al. 1999). Disamping itu berbagai jenis biokontrol mampu menghasilkan HCN yang bersifat toksik terhadap sejumlah patogen tanaman (Munif 2001).
tanaman. Berbagai isolat Pseudomonas sp., Azospirillum sp., Azotobacter sp., Enterobacter sp., Bacillus sp., dan Serratia sp. diketahui sebagai RPPT. Peran RPPT dalam meningkatkan pertumbuhan dan produksi tanaman berhubungan dengan kemampuannya memproduksi hormon tumbuh, memfiksasi nitrogen atau melarutkan fosfat (Thakuria et al. 2004). Dari hasil penelitian dilaporkan bahwa senyawa siderofor yang diproduksi oleh P. aeruginosa mampu meningkatkan biomassa bibit Hydrangea sebesar 30% dibandingkan dengan kontrol (Ryder et al. 1994).
Pengetahuan tentang pertahanan tanaman sangat cepat berkembang. Tanaman menggunakan berbagai sistem untuk menghambat, membatasi atau mencegah pertumbuhan parasit. Semua tanaman mempunyai potensi secara genetik untuk mekanisme resistensi terhadap cendawan, bakteri, virus, dan nematoda patogen. Mekanisme tersebut pada tanaman yang resisten cepat terjadi setelah patogen muncul, sehingga dapat menghambat atau mencegah perkembangan patogen, sebaliknya pada tanaman yang rentan, mekanisme tersebut lebih lambat terjadi sehingga patogen telah berkembang terlebih dahulu. Keberhasilan patogen berkembang di dalam inang sangat tergantung dari pengenalan inang terhadap patogen, suatu interaksi yang kompatibel antara inang dan patogen akan menyebabkan patogen mampu menekan kemampuan tanaman untuk menghambat inokulasi berikutnya dari patogen yang tidak kompatibel dan sebaliknya interaksi yang tidak kompatibel dapat melidungi tanaman dari infeksi patogen yang kompatibel (Andrew 1996).
senyawa kalium fosfat dapat mengiduksi resistensi sistemik tanaman melon terhadap infeksi cendawan, bakteri, dan virus patogen.
Imunisasi atau induksi resistensi atau resistensi buatan adalah suatu proses stimulasi resistensi tanaman inang terhadap patogen tanaman tanpa introduksi gen-gen baru. Teknologi immunisasi atau proteksi silang merupakan salah satu cara pengendalian penyakit tanaman dengan menstimulasi aktivitas mekanisme resistensi melalui inokulasi mikroorganisme nonpatogenik atau patogen avirulen maupun strain hipovirulen serta perlakuan substrat dari mikroorganisme dan tumbuhan pestisida nabati. Mekanisme induksi resistensi (immunisasi) menyebabkan kondisi fisiologis yang mengatur sistem ketahanan menjadi aktif atau menstimulasi mekanisme resisten yang dimiliki oleh tanaman. Imunisasi tidak menghambat pertumbuhan tanaman, bahkan dapat meningkatkan produksi pada beberapa tanaman meskipun tanpa adanya patogen dan memberikan suatu cara untuk bertahan terhadap stres lingkungan (Kloepper 1997). Sinyal penginduksi resisten dapat berupa agens penginduksinya atau sinyal yang disintetis tanaman akibat adanya agens penginduksi. Sinyal tersebut diproduksi pada suatu bagian tanaman, namun dapat berperanan pada bagian lainnya. Transinduksi sinyal dapat ditransfer secara intraseluler sehingga menimbulkan sistem ketahan tanaman secara sistemik (Mucharromah & Kuc 1991).
asam silsilat, yang dapat terjadi secara langsung oleh bakteri ataupun secara tidak lansung (Van Loon et al. 1998). Menurut Ouchi (1983) induksi resistensi tanaman merupakan aktivitas pertahanan tanaman untuk melindungi diri dari patogen atau hama. Dasar pemikiran dari induksi resistensi adalah bahwa gen untuk ketahanan atau reaksi pertahanan ada pada semua tanaman. Gen tersebut tidak diekspresikan sebelum induksi resistensi diberikan, ekspresi ketahanan baru akan muncul setelah adanya inokulasi challenge ( infeksi susulan) pada waktu dan lokasi yang berbeda. Reuvani et al. (1997) melaporkan bahwa aktivasi gen untuk melindungi tanaman dapat diinduksi secara sistemik dengan signalling mollecules yang dihasilkan pada tempat agens Inducer Sistemic Resistance dan ditransportasi dengan difusi atau melalui sistem pembuluh tanaman inang.
Serratia plymuthica. Terjadi peningkatan β-1,3 glukanase pada dinding sel kedua tanaman contoh yang diduga berperan dalam pertahanan dinding sel tanaman terhadap invasi patogen (Benhamaou et al. 2000). PR-protein yang juga berperan dalam meningkatkan resistensi tanaman terhadap infeksi patogen adalah peroksidase. Enzim peroksidase berperan mengkatalisis reaksi akhir dalam proses pembentukan lignin dan fenol oksidatif lain yang berhubungan dengan pembentukan pertahanan untuk penguatan struktur sel (Chen et al. 2000). Kontak antar hidrogen peroksida dan peroksidase dapat menghentikan infeksi patogen melaluli inaktivasi enzim pendegradasi dinding sel yang dikeluarkan oleh patogen (Silva et at. 2004). Inokulasi tanaman dengan P. fluorescens secara nyata meningkatkan aktivitas enzim peroksidase yang berhubungan dengan penyakit layu Fusarium axysporum (Ramamoorthy et at. 2002). Enzim peroksidase berperan sebagai katalisator oksidasi senyawa fenol menjadi quinon yang sangat toksik terhadap patogen (Srivastava 1987). Peroksidase mempunyai beberapa fungsi yang mempengaruhi resistensi tanaman. Salah satu fungsinya adalah berperan sebagai polimerisasi oksidatif dari hidroksisinamil alkohol untuk membentuk lignin. Proses ini merupakan salah satu mekanisme ketahanan tanaman. Fungsi lain dari peroksidase adalah memperkuat diding sel terhadap degradasi enzim yang dihasilkan oleh patogen melalui pembentukan protein struktural pada dinding sel (Vance et al. 1980). Hasil analisis biokimia menunjukan bahwa peroksidase, khitinase, dan 1,3 glukanase terlibat dalam mekanisme resistensi yang terinduksi pada tanaman dikotil terhadap cendawan biotrop. Khitinase dan 1,3 glukanase berperan aktif terhadap penekanan cendawan melalui hidrolisis polimer dinding sel, sedangkan peroksidase berperan dalam lignifikasi dan pembentukan senyawa metabolit sekunder (Park & Kloepper 2000). Xue et al. (1999) menyatakan bahwa Binucleate Rhizoctonia menginduksi resistensi tanaman dan ada korelasi positif yang nyata antara aktivitas 1,3-β-glucanase dan peroksidase dengan meningkatnya resistensi terinduksi.
BAHAN DAN METODE
Bahan
Bahan yang digunakan berupa isolat rhizobakteria Pseudomonas sp. dan Bradyrhizobium japonicum koleksi Laboratorium Mikrobiologi Departemen Biologi FMIPA IPB. Fungi penyebab panyakit akar tanaman kedelai Fusarium oxysporum, Sclerotium rolfsii diperoleh dari Laboratorium Bakteriologi, Departemen Proteksi Tanaman IPB, dan Rhizoctonia solani diperoleh dari Balai Penelitian Tanah Bogor. Kedelai varitas Slamet diperoleh dari Balai Penelitian Bioteknologi dan Sumber Daya Genetik (Balitbiogen) Bogor dan tanaman tembakau koleksi Laboratorium Mikrobiologi, Departemen Biologi FMIPA IPB. Pseudomonas sp. Crb-3, dan Pseudomonas sp. Crb-17 diperoleh dari hasil penelitian pendahuluan dimana kedua isolat tersebut bersifat memacu pertumbuhan secara signifikan, non patogenik, dan penghasil senyawa anti fungi (Wahyudi et al. 2007).
Uji Pemacuan Pertumbuhan Kecambah Kedelai
Uji pemacuan pertumbuhan isolat-isolat Pseudomonas sp. dilakukan untuk mengetahui jenis isolat yang dapat memacu pertumbuhan akar dan batang pada kecambah kedelai. Bioesai ini dengan menggunakan media agar cawan dan kedelai varitas Slamet.
Penyiapan Kecambah. Biji kedelai yang mempunyai ukuran seragam, tidak luka, tidak keriput dan tidak terapung dalam air dipilih untuk dikecambahkan. Biji kedelai disterilisasi permukaannya dengan cara merendam dalam larutan alkohol 95% selama 10 detik, kemudian direndam dalam H2O2 5% selama 5 menit sambil kocok, selanjutnya dibilas dengan aquades steril sebanyak 7 kali untuk menghilangkan residu hydrogen peroksida. Biji-biji tersebut dikecambahkan pada cawan petri yang beralaskan kertas tissue basah steril selama 1-2 hari ditempat gelap pada suhu kamar (Wahyudi 1998).
dilepaskan dengan bantuan lup inokulasi lalu divorteks. Suspensi dihitung jumlah selnya sehingga konsentraasinya 109 sel/ml. Inokulasi dilakukan dengan cara meneteskan pada masing-masing kecambah kedelai dengan suspensi Pseudomonas sp. sebanyak masing-masing 100 µl untuk setiap kecambah pada waktu kecambah dipindahkan kecawan media water agar lalu diinkubasi selama 7 hari ditempat gelap pada suhu kamar (Dey et al. 2004).
Rancangan percobaan yang dipergunakan adalah rancangan acak lengkap, setiap cawan ditanam 9 kecambah dan masing-masing diulang 3 kali. Setelah kecambah berumur 7 hari pada media agar kemudian diukur panjang batang, panjang akar utama dan dihitung jumlah akar lateral dan akar sub-lateral. Hasil pengukuran dan penghitungan dianalisis secara statistik dengan one-way Analysis of Variance (ANOVA) mengunakan program SPSS.
Uji Hipersensitivitas
Untuk mengetahui rizhobakteri Pseudomonas sp. bersifat patogen atau nonpatogen dilakukan dengan uji hipersensitifitas.
Penyiapan Inokulum. Suspensi bakteri inokulum disiapkan dengan cara meremajakan Pseudomonas sp. pada media King’s B cair (tanpa agar). Cara peremajaannya adalah dengan menginokulasikan masing-masing isolat sebanayak 1 lup ke dalam 5 ml media untuk tiap isolat kemudian diinkubasi selama 12-24 jam pada suhu kamar dan dishaker (mesin pengocok horizontal) dengan kecepatan 60-80 rpm. Inokulum yang dipakai adalah inokulum yang menunjukan kekeruhan yang sama dengan kontrol biakan yang mempunyai kerapatan 109 sel/ ml. Kontrol biakan terdiri dari beberapa isolat yang masing masing konsentrasi selnya ditentukan dengan metode pengenceran serial dan pencawanan.
diinjeksikan. Pada sisi lain dari daun juga diinjeksikan aquades dan bakteri E. coli sebagai kontrol negatif sedangkan kontrol positifnya menggunakan Ralstonia solanacearum. Tanaman yang diinjeksi ditempatkan pada rumah kaca dengan diberi naungan pada suhu ruang.
Rancangan percobaan yang dipergunakan adalah rancangan acak lengkap dengan 3 kali ulangan. Pengamatan dilakukan 1-2 hari setelah injeksi. Bakteri yang bersifat virulen akan menimbulkan bercak disekitar tempat injeksi sedangkan suspensi bakteri yang tidak virulen tidak akan menimbulkan bercak (Lelliott & Stead 1987).
Uji Aktivitas Produksi Senyawa Anti Bakteri
Uji aktivitas anti bakteri dilakukan untuk mengetahui kemampuan Bradyrhizobium japonicum dan Pseudomonas sp. hidup bersama di satu tempat pada waktu yang sama. Uji aktivitas produksi anti bakteri dilakukan menggunakan metode Kirby-Bauer seperti yang disebutkan dalam Sunatmo (2007).
Penyiapan Inokulum. Suspensi bakteri inokulum B. japonicum disiapkan dengan meremajakan dalam agar miring YMA selama 7 hari. Selanjutnya ke dalam biakan ini dituang 5 ml garam fisiologis (Na Cl 0.85 %) steril, dan biakan dilepaskan dengan bantuan lup inokulasi. Suspensi bakteri Pseudomonas sp. disiapkan dengan meremajakan dalam agar miring King’s B selama 24 jam. Selanjutnya ke dalam biakan ini dituang 5 ml garam fisiologis (Na Cl 0.85 %) steril, dan biakan dilepaskan dengan bantuan lup inokulasi.
sel/ml lalu ditiriskan dan diletakan pada cawan sebar B. japonicum. Pseudomonas sp. Crb-3, dan Pseudomonas sp. Crb-17 diperoleh dari hasil penelitian terdahulu dimana kedua isolat tersebut bersifat memacu pertumbuhan secara signifikan, non patogenik, dan penghasil senyawa anti fungi (Wahyudi et al. 2007).
Pengamatan dilakukan 1-5 hari dari waktu inokulasi dengan cara melihat ada atau tidaknya zona bening disekitar kertas saring bulat (paper disk), jika terbentuk zona bening menunjukan bakterinya bersifat antagonis begitu sebaliknya.
Uji Biokontrol pada Tanaman Kedelai di Rumah Kaca
Isolat bakteri Pseudomonas sp dan B. japonicum diuji kemampuannya sebagai biokontrol dan pemacu pertumbuhannya pada tanaman kedelai varitas slamet. Mikroba patogen akar yang digunakan berupa F. oxysporum, R. solani dan S. rolfsii. Media pernumbuhannya menggunakan botol Leonard yang berisi larutan hara, campuran pasir dan arang dengan perbandingan 3:1.
Penyiapan Kecambah. Biji kedelai yang mempunyai ukuran seragam, tidak luka, tidak keriput dan tidak terapung dalam air dipilih untuk dikecambahkan. Biji kedelai disterilisasi permukaannya dengan cara merendam dalam larutan alkohol 95% selama 10 detik, kemudian direndam dalam H2O2 5% selama 5 menit sambil kocok, selanjutnya dibilas dengan aquades steril sebanyak 7 kali untuk menghilangkan residu hydrogen peroksida. Biji-biji tersebut dikecambahkan pada cawan petri yang beralaskan kertas tissue basah steril selama 1-2 hari ditempat gelap pada suhu kamar (Wahyudi 1998). Kecamabah tersebut selanjutnya siap untuk ditanam pada botol Leonard.
kemudian dibalik dan digunakan sebagai tempat media penumbuhan yang berupa pasir dan arang. Botol lainya dipotong pada bagian leher dan digunakan sebagai wadah larutan hara. Larutan hara yang digunakan adalah larutan hara bebas N dengan pH netral menggunakan komposisi mengikuti Alva et al. (1988) seperti pada Lampiran 1. Masing-masing botol wadah larutan hara diisi 300ml dan 100 ml disiramkan ke atas campuran pasir dan arang. Botol bagian atas ditutup dengan alumunium foil. Selanjutnya seluruh botol ditutup dengan kertas semen dan disterilkan pada suhu 121oC selama 2 jam (Wahyudi 1998).
Penyiapan Inokulum. Suspensi inokulum B. japonicum dan Pseudomonas sp. disiapkan seperti pada penyiapan inokulum Uji Produksi Senyawa Antibakteri. Inokulum F. oxysporum, R. solani dan S. rolfsii disiapkan dengan cara meremajakan pada media cair PDB ( Potato Dextrose Broth) sebanyak 100 ml pada tabung erlenmeyer selama 7 hari pada suhu kamar dan dishaker (mesin pengocok horizontal) dengan kecepatan 60-80 rpm kemudian dicuci dengan cara disaring menggunakan kertas saring sebanyak 3 kali lalu dihomogenitaskan dengan cara diencerkan menggunakan aquades steril 100 ml dan diblander.
Inokulasi dan Penanaman Kecambah. Inokulasi dengan fungi patogen akar dilakukan dengan cara menyiramkan suspensi inokulum pada 266 g media pasir arang di dalam botol Leonard dengan konsentrasi 103cfu/g kemudian ditutup dengan media pasir arang steril 134 g dan diinkubasi selama 3 hari. Setelah inkubasi 3 hari kemudian biji kedelai yang telah dikecambahkan ditanam secara aseptik pada media pasir-arang dalam botol Leonard, untuk tiap botol ditanam 3 kecambah. Bersamaan dengan penanaman juga diinokulasikan Pseudomonas sp. dan B. japonicum sebanyak masing-masing 1 ml pada kecambah dengan konsentrasi 108-109 se/ml . Permukaan botol selanjutnya ditutup kembali dengan alumunium foil, kemudian diletakan dalam ruangan pada suhu kamar sampai ujung atas kecamabah menyentuh tutup aluminium foil. Setelah aluminium foil dibuka kemudian ditutup dengan pasir berparafin steril yang berfungsi mencegah kontamionasi.
lalu dicampur dengan 10 kg pasir. Campuran ini dikeringkan sampai semua benzol menguap lalu disterilisasi kering pada suhu 170 oC selama 2 jam.
Rancangan percobaan di rumah kaca menggunakan Rancangan Acak Lengkap dengan 3 ulangan dan 14 perlakuan yang terdiri dari:
1. Tanaman tanpa bakteri dan agens biokontrol (K). 2. R. solani ( R ).
3. Pseudomonas sp. Crb3 + R. solani (Crb3+R).
4. Pseudomonas sp. Crb 3+ R. solani + B. japonicum Bj11 (Crb3 + R + Bj). 5. F. oxysporum (F).
6. Pseudomonas sp.Crb17 + F. oxysporum (Crb17 + F).
7. Pseudomonas sp.Crb17+F. oxysporum + B. japonicum Bj11 (Crb17+ F + Bj). 8. S. rolfsii (S).
9. Pseudomonas sp. Crb102 + S. rolfsii (Crb102 + S).
10. Pseudomonas sp.Crb102+ S. rolfsii + B. japonicum Bj11 (Crb102 + S + Bj) 11. B. japonicum Bj11 (Bj).
12. Pseudomonas sp. Crb3+ B. japonicum Bj11 (Crb3+Bj). 13. Pseudomonas sp.Crb17 + B. japonicum Bj11 (Crb17+Bj). 14. Pseudomonas sp.Crb102 + B. japonicum Bj11 (Crb102+Bj).
Pemeliharaan Tanaman. Botol-botol diletakan di rumah kaca dengan jarak 25 cm x 25 cm antara botol yang satu dengan lainya. Setelah muncul daun dilakukan penjarangan dengan mengambil satu kecambah yang pertumbuhannya lambat sedangkan larutan hara ditambahkan setiap 2-3 hari sekali dan tanaman dipelihara selama 42 hari. Panen dilakukan dengan cara tanaman bagian atas dan akar dipisahkan kemudian dimasukan kekantong-kantong kertas untuk dikeringkan di oven pada suhu 70oC selama 48 jam. Peubah yang diamati adalah berat kering akar, jumlah bintil, kejadian penyakit dan aktivitas enzim peroksidase. Data dianalisis dengan one-way Analysis of Variance (ANOVA) mengunakan uji lanjut Duncan.
Pengendalian Fungi Patogen Akar
mati pada waktu panen. Tingkat kejadian penyakit dihitung dengan menggunakan rumus sebagai berikut:
Induksi Resistensi Sistemik
Resistensi terinduksi adalah suatu mekanisme yang secara normal berfungsi membatasi pertumbuhan dan penyebaran patogen dan efektifitas mekanisme ini ditingkatkan oleh infeksi primer dan agen penginduksi (biotik atau abiotik) berupa mikroorganisme patogen, non patogen, metabolit mikrob, ekstrak tumbuhan atau senyawa sintetik seperti asam salisilat. Peroksidase adalah salah satu enzim yang berhubungan dengan ketahanan tanaman terhadap infeksi patogen. Pengukuran aktivitas peroksidase dilakukan pada akar tanaman kedelai yang berumur 42 hari di rumah kaca. Akar tanaman kedelai dari masing-masing perlakuan dicuci hingga bersih kemudian dihancurkan dengan mortar dalam bufer fosfat 0.01 M pH 6.0 dengan perbandingan 1:4 (g/ml). Hasil hancuran disaring dengan kertas whatman dan disentrifugasi selama 30 menit dengan kecepatan 5000 rpm pada suhu 4 oC . Supernatan (sebagai sumber enzim) diencerkan dengan buffer fosfat 0.01 pH 6.0 (1:3) dan dihomogenkan. Untuk pengamatan aktivitas enzim 0.2 ml sumber enzim ditambahkan pada pereaksi yang terdiri dari 5 ml larutan pirogalol 0.5 M (terbuat dari 10 ml pirogalol 0.5 M ditambah dengan 12.5 ml buffer fosfat 0.066 M ph 6.0 dan diencerkan dengan aquades hingga volumenya menjadi 100 ml ) dan 0.5 ml H2O2 1% didalam kuvet. Blanko dibuat dengan memasukan bahan-bahan di atas ke dalam kuvet tanpa sumber enzim. Campuran tersebut dihomogenkan selama 5 hingga 10 detik dan diamati nilai absorbansinya dengan spektrofotometer pada panjang gelombang 420 nm. Apabila nilai absorbansi terlalu tinggi maka sediaan enzim diencerkan dengan bufer fosfat. Unit aktivitas enzim (UAE) dihitung dengan menggunakan rumus:
n
I = --- x 100% N
Keterangan :
I = Prosentase kejadian penyakit n = Jumlah tanaman yang terserang ( mati / terkena busuk akar ) N = Jumlah tanaman yang diamati
∆OD x sumber enzim (ml) UAE =--- bobot basah contoh (g)
HASIL
Uji Pemacuan Pertumbuhan Kecambah Kedelai
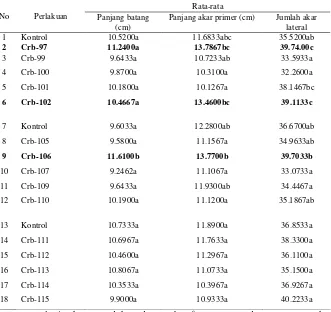
[image:44.612.168.499.353.665.2]Sebanyak 15 isolat Pseudomonas sp. diuji pemacuan pertumbuhannya terhadap pertumbuhan kencambah kedelai. Berdasarkan uji pemacuan pertumbuhan diketahui bahwa terdapat 3 isolat Pseudomonas sp. yang secara signifikan mampu memacu pertumbuhan kecambah kedelai jika dibandingkan dengan kontrol, yakni Pseudomonas sp. Crb97, Crb102 memacu pertumbuhan akar lateral sedangkan Pseudomonas sp. Crb106 memacau pemanjangan batang (Tabel 1). Penampilan kecambah tanaman kedelai yang diinokulasi dengan isolat Pseudomonas sp. Crb-102 terlihat pada Gambar 1.
Tabel 1. Pengaruh inokulasi Pseudomonas sp. dalam memacu pertumbuhan batang, akar, dan jumlah akar lateral kecambah kedelai.
Rata-rata No Perlakuan Panjang batang
(cm)
Panjang akar primer (cm) Jumlah akar lateral 1 Kontrol 10.5200a 11.6833abc 35.5200ab 2 Crb-97 11.2400a 13.7867bc 39.74.00c
3 Crb-99 9.6433a 10.7233ab 33.5933a
4 Crb-100 9.8700a 10.3100a 32.2600a
5 Crb-101 10.1800a 10.1267a 38.1467bc
6 Crb-102 10.4667a 13.4600bc 39.1133c
7 Kontrol 9.6033a 12.2800ab 36.6700ab
8 Crb-105 9.5800a 11.1567a 34.9633ab
9 Crb-106 11.6100b 13.7700b 39.7033b
10 Crb-107 9.2462a 11.1067a 33.0733a
11 Crb-109 9.6433a 11.9300ab 34.4467a
12 Crb-110 10.1900a 11.1200a 35.1867ab
13 Kontrol 10.7333a 11.8900a 36.8533a
14 Crb-111 10.6967a 11.7633a 38.3300a
15 Crb-112 10.4600a 11.2967a 36.1100a
16 Crb-113 10.8067a 11.0733a 35.1500a
17 Crb-114 10.3533a 10.3967a 36.9267a
18 Crb-115 9.9000a 10.9333a 40.2233a
[image:45.792.202.610.201.429.2]
Gambar 1. Pertumbuhan kecambah kedelai yang berumur satu minggu pada tempat gelap A) Kontrol B) Kecambah yang diinokulasi isolat Pseudomonas sp. Crb102.
Uji Reaksi Hipersensitivitas
Sebanyak 15 isolat Pseudomonas sp. diuji reaksi hipersensitivitasnya dan 8 isolat yakni Pseudomonas sp. Crb102, Crb109, Crb110, Crb111, Crb112, Crb113, Crb114, dan Crb115 reaksi hipersensitivitasnya negatif sedangkan 7 isolat reaksi hipersensitivitasnya positif yang ditunjukkan dengan kematian cepat, kekeringan dan nekrosis kecoklatan pada jaringan daun tembakau setelah 24 sampai 48 jam (Tabel 2).
Tabel 2. Respon hipersensitif tanaman tembakau terhadap isolat-isolat Pseudomonas sp.
No Isolat Reaksi
Hipersensitivitas No Isolat
Reaksi Hipersensitivitas
1 Crb-97 + 9 Crb 109 -
2 Crb-99 + 10 Crb 110 -
3 Crb-100 + 11 Crb 111 -
4 Crb-101 + 12 Crb 112 -
5 Crb-102 - 13 Crb 113 -
6 Crb-105 + 14 Crb 114 -
7 Crb-106 + 15 Crb 115 -
8 Crb 107 +
Keterangan : + : isolat memberi reaksi hipersensitif pada daun tembakau. - : isolat tidak memberi reaksi hipersensitif pada daun tembakau
Uji Aktivitas Produksi Senyawa Anti Bakteri
Penggunaan lebih dari satu rizobakteri diharapkan dapat meningkatkan keefektifan pengendalian hayati yang dilakukan. Peningkatan keefektifan pengendalian tidak dapat direalisasikan jika antar rizobakteri yang digunakan bersifat antagonis. Berdasarkan uji aktivitas produksi senyawa anti bakteri pada percobaan ini diketahui bahwa isolat Pseudomonas sp. Crb3, Crb17 dan Crb102 tidak membentuk zona hambatan disekitar kertas saring yang mengandung suspensi bakateri. Begitu juga dengan B. japonicum Bj11, tidak membentuk zona hambatan disekitar kertas saring yang mengandung suspensi bakateri.
Uji Biokontrol pada Tanaman Kedelai di Rumah Kaca
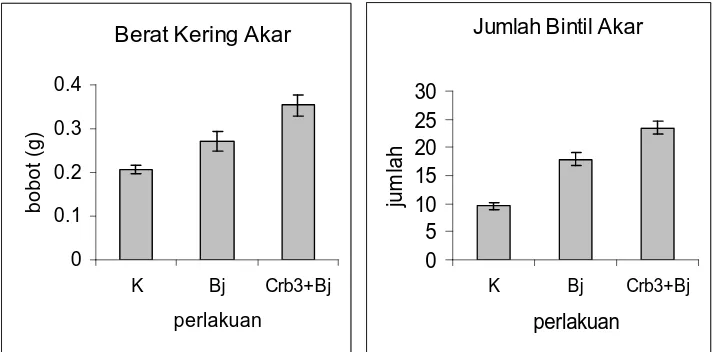
[image:46.612.146.508.233.392.2]perlakuan tunggal B. japonicum Bj11, perlakuan campuran Pseudomonas sp. Crb3 + B. japonicum Bj11 juga mampu meningkatkan secara nyata rata-rata berat kering akar dan jumlah bintil (Gambar 2 dan Tabel 3). Penampilan akar tanaman kedelai berumur 42 hari pada botol Leonard di rumah kaca yang diinokulasi dengan isolat Pseudomonas sp. Crb3 + B. japonicum Bj11 (Gambar 5).
Berat Kering Akar
0 0.1 0.2 0.3 0.4
K Bj Crb3+Bj
perlakuan b o b o t (g )
Jumlah Bintil Akar
0 5 10 15 20 25 30
K Bj Crb3+Bj
[image:47.612.146.505.199.375.2]perlakuan ju m la h Gambar 2. Respon tanaman kedelai terhadap Pseudomonas sp dan B. japonicum
Bj11.
Tabel 3. Pengaruh Pseudomonas sp. Crb3 terhadap berat kering akar dan jumlah bintil akar tanaman kedelai.
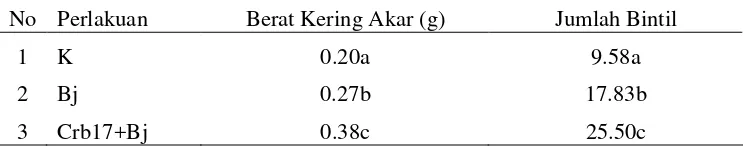
No Perlakuan Berat Kering Akar (g) Jumlah Bintil
1 K 0.20a 9.58a
2 Bj 0.27b 17.83b
3 Crb3+Bj 0.35c 23.50c
Keterangan: K = tanaman tanpa perlakuan fungi dan agens biokontrol; Bj=B.japonicum Bj11; Crb3+Bj= Pseudomonas sp Crb3 + B. japonicum Bj11. Angka yang diikuti dengan huruf yang sama menunjukkan tidak signifikan pada tingkat 5% dengan uji Duncan.
[image:47.612.147.510.461.535.2]berat kering akar dan jumlah bintil. Penampilan akar tanaman kedelai berumur 42 hari pada botol Leonard di rumah kaca yang diinokulasi dengan isolat Pseudomonas sp. Crb17 + B. japonicum Bj11 terdapat pada Gambar 5.
Berat Kering Akar
0 0.1 0.2 0.3 0.4 0.5
K Bj
Crb 17+B j perlakuan b o b o t (g )
Jumlah Bintil Akar
0 5 10 15 20 25 30
K Bj
Crb 17+B j perlakuan ju m la h
[image:48.612.145.508.153.328.2]Gambar 3. Respon tanaman kedelai terhadap Pseudomonas sp. Crb17 dan B. japonicum Bj11.
Tabel 4. Pengaruh Pseudomonas sp. Crb17 terhadap berat kering akar dan jumlah bintil akar tanaman kedelai.
No Perlakuan Berat Kering Akar (g) Jumlah Bintil
1 K 0.20a 9.58a
2 Bj 0.27b 17.83b
3 Crb17+Bj 0.38c 25.50c
Keterangan: K = tanaman tanpa perlakuan fungi dan agens biokontrol ; Bj= Bradyrhizobium japonicum Bj11; Crb17+Bj = Pseudomonas sp Crb17+B.japonicum Bj11. Angka yang diikuti dengan huruf yang sama menunjukkan tidak signifikan pada tingkat 5% dengan uji Duncan.
[image:48.612.144.516.411.484.2]Berat Kering Akar 0 0.1 0.2 0.3 0.4
K Bj
Crb 102+ Bj perlakuan b o b o t (g )
Jumlah Bintil Akar
0 5 10 15 20 25
K Bj
Crb 102+ Bj perlakuan ju m la h
Gambar 4. Respon tanaman kedelai terhadap Pseudomonas sp. Crb102 dan B. japonicum Bj11.
Tabel 5. Pengaruh Pseudomonas sp. Crb102 terhadap berat kering akar dan jumlah bintil akar tanaman kedelai.
No Perlakuan Berat Kering Akar (g) Jumlah Bintil
1 K 0.20a 9.58a
2 Bj 0.27bc 17.83bc
3 Crb102+Bj 0.30c 19.16c
[image:49.612.145.507.101.277.2] [image:49.612.143.515.361.435.2][image:50.792.141.626.147.440.2]
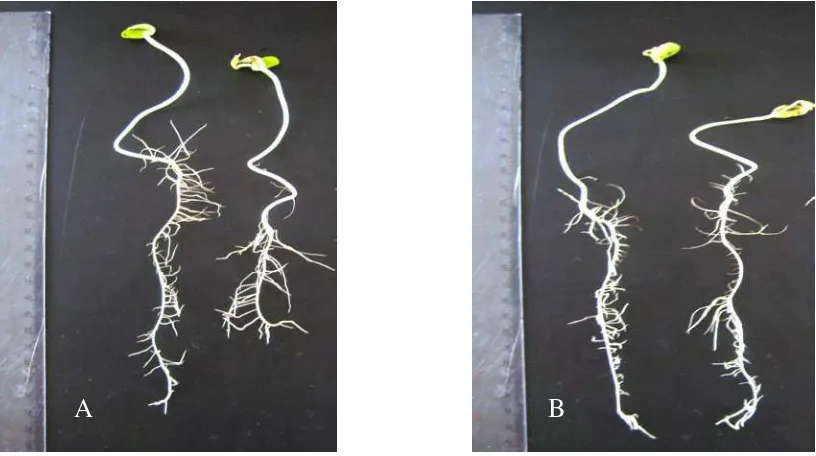
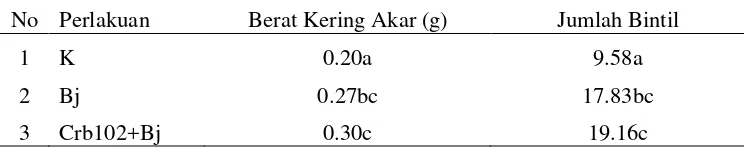
Gambar 5. Pertumbuhan akar tanaman kedelai pada berbagai perlakuan: A) Akar tanpa perlakuan fungi dan agens biokontrol. B) Akar yang diinokulasi
B. japonicum Bj11. C). Akar yang diinokulasi Pseudomonas sp Crb3+
B. japonicum Bj11. D) Akar yang diinokulasi Pseudomonas sp Crb17 +
B. japonicum Bj11. E) Akar yang diinokulasi Pseudomonas sp Crb102 + B.japonicum Bj11.
A
B
C
Pengendalian Fungi Patogen Akar
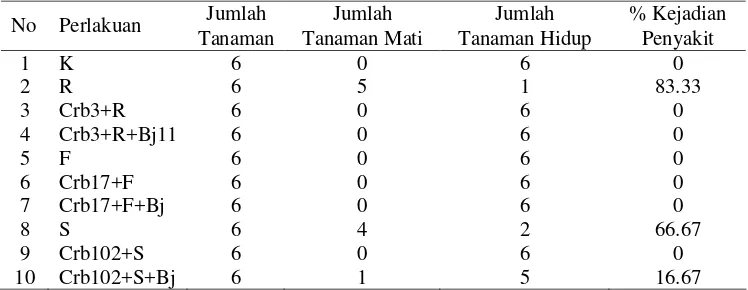
Pengamatan pengendalian fungi patogen akar dilakukan dengan cara menghitung tanaman yang mati pada waktu panen. Berdasarkan percobaan ini diketahui bahwa perlakuan campuran Pseudomonas sp.Crb3 + R. solani dan campuran Pseudomonas sp.Crb3 + R. solani + B. japonicum mampu menekan kejadian penyakit sebesar 83.33% dibandingkan dengan perlakuan tunggal R. solani (Tabel 6). Aplikasi fungi F. oxysporum pada tanaman tidak menimbulkan kejadian penyakit (Tabel 6). Tanaman yang menggunakan isolat Pseudomonas sp. Crb102 mampu menurunkan tingkat kejadian penyakit sebesar 66.67% dibandingkan dengan tanaman yang mendapat perlakuan tunggal S. rolfsii. Pada tanaman yang mendapat aplikasi Pseudomonas sp. Crb-102 + S. rolfsii + B. japonicum Bj11 hanya mampu menekan kejadian penyakit sebesar 50% dibandingkan dengan tanaman yang mendapat perlakuan tunggal S. rolfsii seperti terdapat pada Tabel 6.
Tabel 6. Pengaruh Pseudomonas sp. dan B. japonicum terhadap kejadian penyakit busuk akar pada tanaman kedelai.
Jumlah Jumlah Jumlah % Kejadian
No Perlakuan
Tanaman Tanaman Mati Tanaman Hidup Penyakit
1 K 6 0 6 0
2 R 6 5 1 83.33
3 Crb3+R 6 0 6 0
4 Crb3+R+Bj11 6 0 6 0
5 F 6 0 6 0
6 Crb17+F 6 0 6 0
7 Crb17+F+Bj 6 0 6 0
8 S 6 4 2 66.67
9 Crb102+S 6 0 6 0
10 Crb102+S+Bj 6 1 5 16.67
Keterangan: K = tanaman tanpa perlakuan fungi dan agens biokontrol; R.=R. solani; Crb3+R= Pseudomonas sp Crb3 + R. solani; Crb3+R+Bj= Pseudomonas sp Crb3 + R. solani + B. japonicum Bj11; F=F. oxysporum; Crb17+F=Pseudomonas sp Crb-17+ F. oxysporum; Crb17+F+Bj= Pseudomonas sp Crb17 + F. oxysporum + B.japonicum Bj11: S= S. rolfsii ; Crb102+S=. Pseudomonas sp Crb102 + S.rolfsii; Crb102+S+Bj = Pseudomonas sp Crb102+ S. rolfsii + B. japonicum Bj11.
Induksi Resistensi Sistemik
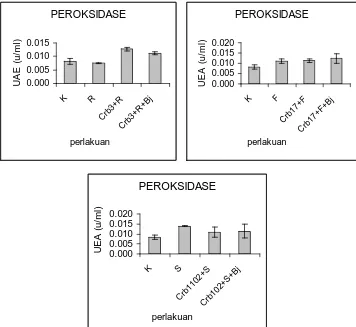
[image:51.612.143.517.391.536.2]fungi. Perlakuan menggunakan Pseudomonas sp.Crb3+ R. solani + B. japonicum Bj11dan Pseudomonas sp.Crb3 + R. solani keduanya mampu meningkatkan aktifitas peroksidase dan berbeda nyata dibandingkan dengan tanaman yang hanya mendapat perlakuan tumggal R. solani (Gambar 6 dan Tabel 7). Perlakuan menggunakan Pseudomonas sp.Crb17 + F. oxysporum + B. japonicum Bj11 dan Pseudomonas sp.Crb17 + F. oxysporum keduanya mampu meningkatkan aktifitas peroksidase tapi tidak berbeda nyata dibandingkan dengan tanaman yang hanya mendapat perlakuan F. oxysporum (Gambar 6 dan Tabel 7).
PEROKSIDASE 0.000 0.005 0.010 0.015 K R Crb 3+R Crb 3+R +Bj perlakuan U A E ( u /m l) PEROKSIDASE 0.000 0.005 0.010 0.015 0.020 K F Crb 17+F Crb 17+F +Bj perlakuan U E A ( u /m l) PEROKSIDASE 0.000 0.005 0.010 0.015 0.020 K S Crb 1102 +S Crb 102+ S+B j perlakuan U E A ( u /m l)
[image:52.612.149.505.237.564.2]Pada perlakuan campuran Pseudomonas sp.Crb102 + S. rolfsii + B. japonicum Bj11 dan Pseudomonas sp.Crb102 + S. rolfsii aktifitas enzim peroksidasenya lebih rendah dibandingkan dengan tanaman yang hanya mendapat perlakuan tunggal S. rolfsii (Gambar 6 dan Tabel 7).
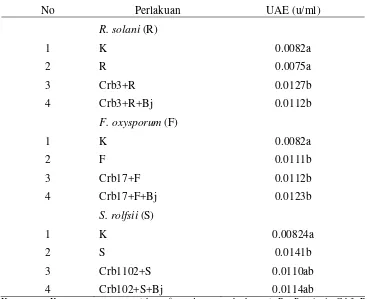
Tabel 7. Pengaruh patogen, agens biokontrol, dan B. japonicum terhadap unit aktivitas enzim peroksidase pada akar tanaman kedelai.
No Perlakuan UAE (u/ml)
R. solani (R)
1 K 0.0082a
2 R 0.0075a
3 Crb3+R 0.0127b
4 Crb3+R+Bj 0.0112b
F. oxysporum (F)
1 K 0.0082a
2 F 0.0111b
3 Crb17+F 0.0112b
4 Crb17+F+Bj 0.0123b
S. rolfsii (S)
1 K 0.00824a
2 S 0.0141b
3 Crb1102+S 0.0110ab
4 Crb102+S+Bj 0.0114ab
[image:53.612.142.509.199.498.2]PEMBAHASAN
Uji Pemacuan Pertumbuhan Kecambah Kedelai
Isolat Pseudomonas sp Crb97, Crb102 dan Crb106 dapat memacu pertumbuhan kecambah kemungkinan karena isolat Pseudomonas sp. tersebut dalam percobaan ini memproduksi hormon tumbuh yang dapat dimanfaatkan oleh kecambah dimana keterlibatan hormon merupakan salah satu faktor penting dalam pemacuan pertumbuhan. Menurut Wahyudi et al. (2007) isolat Pseudomonas sp. Crb97 Crb102 dan Crb106 dapat menghasilkan indol acetic acid (IAA). Fungsi utama auksin (misalnya IAA) adalah untuk merangsang pemanjangan batang, pertumbuhan, diferensiasi, percabangan akar, perkembangan buah, dominasi apikal, fototropisme dan gravitropisme (Campbell & Reece 2002). Akar merupakan organ tanaman yang paling sensitif terhadap fluktuasi kadar IAA dan responnya terhadap peningkatan jumlah IAA eksogenous meluas dari pemanjangan akar primer, pembentukan akar lateral dan akar adventif hingga penghentian pertumbuhan (Laveau & Lindow 2005).
Uji Hipersensitivitas
Campbell & Reece (2002) setelah sel-sel pada tempat infeksi mengeluarkan senyawa kimia pertahanannya dan menutup daerah infeksi, sel-sel tersebut merusakan dirinya sendiri sehingga terbentuk lesio atau luka pada daerah yang terinfeksi yang akan bertahan hidup dan pertahanannya akan membantu melindungi bagian tumbuhan yang lain. Respon