ANALISIS KERAGAMAN GENETIK KERBAU LOKAL
(
Bubalus bubalis
) BERDASARKAN HAPLOTIPE
DNA MITOKONDRIA
SKRIPSI
WIWIN TARWINANGSIH
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
RINGKASAN
WIWIN TARWINANGSIH. 2009. Analisis Keragaman Genetik Kerbau Lokal (Bubalus bubalis) Berdasarkan Haplotipe DNA Mitokondria. Skripsi. Mayor Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor.
Pembimbing Utama : Dr. Ir. Cece Sumantri, M.Agr.Sc. Pembimbing Anggota : Dr. Ir. Achmad Farajallah, M.Si.
Perkembangan ilmu dan pengetahuan dalam biologi molekuler, khususnya pada pengkajian karakter bahan genetik telah menghasilkan kemajuan yang sangat pesat untuk perkembangan identifikasi organisme dan pemanfaatannya bagi kesejahteraan manusia. Pengetahuan dari tingkat keragaman genetik dapat menyediakan bahan dasar untuk keputusan dalam konservasi dan menjaga serta memanfatkan ternak sebagai kekayaan bangsa. Analisis DNA mitokondria sering digunakan untuk mempelajari keragaman genetik populasi dan hubungan filogenetik. Genom mitokondria memiliki pewarisan sifat yang murni dari ibu/maternal. Salah satu cara untuk melihat keragaman genetik adalah melalui pengamatan polimorfisme DNA mitokondria (mtDNA) dengan mengggunakan teknik Polymerase Chain Reaction- Restriction Fragment Length Polymorphism (PCR-RFLP).
Penelitian ini bertujuan mempelajari dan membandingkan keragaman genetik berdasarkan daerah d-loop genom mitokondria kerbau lokal (Bubalus bubalis) dan mengkaji pola hubungan kekerabatan antar populasi daerah pengambilan sampel, yaitu Jawa Tengah, Nusa Tenggara Barat, Sumatera Utara dan Banten. Penelitian ini dilaksanakan pada bulan September 2008 sampai dengan Januari 2009 di Laboratorium Zoologi dan Laboratorium Terpadu, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Sampel darah kerbau yang digunakan dalam penelitian ini adalah 44 sampel yang dikumpulkan dari beberapa tempat di Indonesia, masing-masing sebanyak 10 sampel dari Jawa Tengah, 12 sampel dari Nusa Tenggara Barat, 10 sampel dari Sumatera Utara dan 12 sampel dari Banten.
Hasil amplifikasi PCR menggunakan primer AF22 dan AF23 terhadap genom mtDNA Bubalus bubalis adalah 1145 pasang basa (pb). Bagian yang digandakan bermula dari ujung cyt-b hingga daerah pengendali (d-loop). Hasil pemotongan dengan empat enzim restriksi (AluI, HaeIII, HinfI dan MspI) ditemukan dua haplotipe mtDNA. Haplotipe pertama memiliki pola penyebaran luas di seluruh wilayah pengambilan sampel, sedangkan haplotipe kedua hanya ditemukan pada satu sampel dari wilayah Sumatera Utara. Berdasarkan ada tidaknya situs restriksi dari dua haplotipe, diperoleh nilai keragaman nukleotida ( ) sebesar 0,17%. Perhitungan jarak genetik dalam bentuk dendrogram menunjukkan bahwa sampel kerbau yang berasal dari Jawa Tengah, Nusa Tenggara Barat dan Banten diduga berasal dari nenek moyang yang sama (D=0,0000). Begitu pula dengan sampel kerbau dari Sumatera Utara berkerabat dekat dengan ketiga wilayah tersebut (D=0,0061).
ABSTRACT
Genetic Diversity of Mitochondrial DNA of Local Buffalo (Bubalus bubalis)
Tarwinangsih, W., C. Sumantri and A. Farajallah
Mitochondrial genome (mtDNA) in vertebrate is a circular double stranded DNA molecule. It has a high mutation rate and strictly maternally inherited. This research was conducted to investigate the diversity among local buffalos based on mtDNA’s control region. Samples that were used in this research were native buffalos from 10 Jawa Tengah, 12 Nusa Tenggara Barat, 10 Sumatera Utara and 12 Banten. By in vitro amplification with Polymorphism Chain Reaction method (PCR) using a pair of primer AF22 and AF23, yielded 1145 base pair long. The selected region is a segment spanning the region of end part 3’ cyt-b gene through the partial of the 3’ control region (d-loop). The PCR product was digested with four restriction enzymes, which were AluI (AG CT), HaeIII (GG CC), HinfI (G AnTC) and MspI (C CGG). Two haplotypes were detected among 44 samples. The nucleotide diversity among these haplotypes is 0,17%. Haplotype 1 found in all sample locations, while haplotype 2 was only found in one sample from Sumatera Utara. Genetically, the buffalos from Jawa Tengah, Nusa Tenggara Barat and Banten guessed have a same origin heredity (D = 0,000) and they have a near kinship with Sumatera Utara’s buffalo (D= 0,0061).
ANALISIS KERAGAMAN GENETIK KERBAU LOKAL
(
Bubalus bubalis
) BERDASARKAN HAPLOTIPE
DNA MITOKONDRIA
WIWIN TARWINANGSIH
D14052420
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
ANALISIS KERAGAMAN GENETIK KERBAU LOKAL
(
Bubalus bubalis
) BERDASARKAN HAPLOTIPE
DNA MITOKONDRIA
Oleh
WIWIN TARWINANGSIH
D14052420
Skripsi ini telah disetujui dan disidangkan di hadapan Komisi Ujian Lisan pada tanggal 07 April 2009
Pembimbing Utama Pembimbing Anggota
Dr. Ir. Cece Sumantri, M. Agr. Sc Dr. Ir. Achmad Farajallah, M. Si
Dekan Ketua Departemen
Fakultas Peternakan Ilmu Produksi dan Teknologi Peternakan Institut Pertanian Bogor Fakultas Peternakan
Institut Pertanian Bogor
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 8 Juli 1987 di Kota Tasikmalaya, Provinsi Jawa Barat. Penulis adalah putri pertama dari tiga bersaudara pasangan Bapak Nanang Ruhyana dan Ibu Euis Rayaningsih.
Pendidikan kanak-kanak diselesaikan di TK PGRI Galunggung pada tahun 1993. Pendidikan dasar diselesaikan pada tahun 1998 di SDN Indihiang Gadis. Pendidikan lanjutan tingkat pertama diselesaikan pada tahun 2002 di SLTPN 1 Indihiang dan pendidikan lanjutan tingkat atas diselesaikan pada tahun 2005 di SMAN 6 Kota Tasikmalaya.
Penulis diterima sebagai mahasiswa Institut Pertanian Bogor pada tahun 2005 melalui jalur Undangan Seleksi Masuk IPB (USMI). Penulis kembali diterima sebagai mahasiswa Mayor Ilmu Produksi dan Teknologi Peternakan, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor pada tahun 2006.
KATA PENGANTAR
Puji syukur kehadirat ALLAH AWT. atas segala rahmat, karunia, hidayah serta kasing sayang-Nya sehingga Penulis diberi kemampuan untuk menyelesaikan sripsi ini. Shalawat dan salam semoga tetap tercurah kepada Rasulullah Muhammad SAW, keluarga, sahabat serta umatnya yang istiqomah di jalan-Nya.
Tulisan ini berjudul Analisis Keragaman Genetik Kerbau Lokal (Bubalus bubalis) Berdasarkan Haplotipe DNA Mitokondria. Kerbau merupakan salah satu jenis ternak ruminansia Indonesia yang mempunyai kelebihan untuk ditingkatkan perannya terutama berkaitan dengan potensi genetik dan aspek lingkungannya.
Tujuan penelitian ini adalah untuk mempelajari dan membandingkan keragaman genetik berdasarkan daerah d-loop genom mitokondria kerbau lokal (Bubalus bubalis) dan mengkaji pola hubungan kekerabatan antar populasi daerah pengambilan sampel, yaitu populasi Jawa Tengah, Nusa Tenggara Barat, Sumatera Utara dan Banten. Hasil yang diperoleh dari penelitian ini perlu dilakukan tahap pendeteksian keragaman yang lebih lanjut guna mendapatkan hasil yang lebih jelas. Skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana Peternakan (SPt.) di Fakultas Peternakan Institut Pertanian Bogor. Sepenuhnya Penulis menyadari bahwa masih terdapat berbagai kekurangan dan kelemahan dalam tulisan ini. Sesungguhnya kesalahan dalam tulisan ini datang dari Penulis dan kebenarannya datang dari Allah SWT. Penulis berharap, semoga tulisan ini dapat memberikan sumbangan yang berarti bagi kemajuan dunia peternakan di Indonesia. Amin.
Bogor, April 2009
DAFTAR ISI
Amplifikasi teknik Polymerase Chain Reaction-Restriction Fragment Length Polymorphment (PCR-RFLP) ... 13
Elektroforesis ... 13
Halaman
Rancangan ... 13
Keragaman Haplotipe (h) ... 14
Keragaman Nukleotida ( )... 14
Jarak Genetik (D) ... 14
Prosedur ... 15
Pengambilan Sampel Darah ... 15
Isolasi DNA dari Sampel Darah ... 15
Amplifikasi mtDNA dengan Teknik Polymerase Chain Rection-Restriction Fragment Lengh Polymorphism (PCR-RFLP) ... 15
Elektroforesis Produk PCR ... 15
Pewarnaan Perak ... 16
Pemotongan dengan Enzim Restriksi ... 16
HASIL DAN PEMBAHASAN ... 17
Amplifikasi Ruas Target ... 17
Polymerase Chain Reaction-Restriction Fragment LengthPolymorphment (PCR-RFLP) ... 18
Keragaman Haplotipe (h) dan Nukleotia ( ) ... 24
Jarak Genetik ... 25
Manajemen Konservasi Genetik ... 28
KESIMPULAN DAN SARAN ... 29
Kesimpulan ... 29
Saran ... 29
UCAPAN TERIMAKASIH ... 30
DAFTAR PUSTAKA ... 31
DAFTAR TABEL
Nomor Halaman
1. Pola Pemotongan Enzim Restriksi ... 19 2. Haplotipe mtDNA Masing-masing Populasi. ... 24 3. Keragaman Haplotipe mtDNA Bubalus bubalis di Wilayah Jawa
ANALISIS KERAGAMAN GENETIK KERBAU LOKAL
(
Bubalus bubalis
) BERDASARKAN HAPLOTIPE
DNA MITOKONDRIA
SKRIPSI
WIWIN TARWINANGSIH
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
RINGKASAN
WIWIN TARWINANGSIH. 2009. Analisis Keragaman Genetik Kerbau Lokal (Bubalus bubalis) Berdasarkan Haplotipe DNA Mitokondria. Skripsi. Mayor Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor.
Pembimbing Utama : Dr. Ir. Cece Sumantri, M.Agr.Sc. Pembimbing Anggota : Dr. Ir. Achmad Farajallah, M.Si.
Perkembangan ilmu dan pengetahuan dalam biologi molekuler, khususnya pada pengkajian karakter bahan genetik telah menghasilkan kemajuan yang sangat pesat untuk perkembangan identifikasi organisme dan pemanfaatannya bagi kesejahteraan manusia. Pengetahuan dari tingkat keragaman genetik dapat menyediakan bahan dasar untuk keputusan dalam konservasi dan menjaga serta memanfatkan ternak sebagai kekayaan bangsa. Analisis DNA mitokondria sering digunakan untuk mempelajari keragaman genetik populasi dan hubungan filogenetik. Genom mitokondria memiliki pewarisan sifat yang murni dari ibu/maternal. Salah satu cara untuk melihat keragaman genetik adalah melalui pengamatan polimorfisme DNA mitokondria (mtDNA) dengan mengggunakan teknik Polymerase Chain Reaction- Restriction Fragment Length Polymorphism (PCR-RFLP).
Penelitian ini bertujuan mempelajari dan membandingkan keragaman genetik berdasarkan daerah d-loop genom mitokondria kerbau lokal (Bubalus bubalis) dan mengkaji pola hubungan kekerabatan antar populasi daerah pengambilan sampel, yaitu Jawa Tengah, Nusa Tenggara Barat, Sumatera Utara dan Banten. Penelitian ini dilaksanakan pada bulan September 2008 sampai dengan Januari 2009 di Laboratorium Zoologi dan Laboratorium Terpadu, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Sampel darah kerbau yang digunakan dalam penelitian ini adalah 44 sampel yang dikumpulkan dari beberapa tempat di Indonesia, masing-masing sebanyak 10 sampel dari Jawa Tengah, 12 sampel dari Nusa Tenggara Barat, 10 sampel dari Sumatera Utara dan 12 sampel dari Banten.
Hasil amplifikasi PCR menggunakan primer AF22 dan AF23 terhadap genom mtDNA Bubalus bubalis adalah 1145 pasang basa (pb). Bagian yang digandakan bermula dari ujung cyt-b hingga daerah pengendali (d-loop). Hasil pemotongan dengan empat enzim restriksi (AluI, HaeIII, HinfI dan MspI) ditemukan dua haplotipe mtDNA. Haplotipe pertama memiliki pola penyebaran luas di seluruh wilayah pengambilan sampel, sedangkan haplotipe kedua hanya ditemukan pada satu sampel dari wilayah Sumatera Utara. Berdasarkan ada tidaknya situs restriksi dari dua haplotipe, diperoleh nilai keragaman nukleotida ( ) sebesar 0,17%. Perhitungan jarak genetik dalam bentuk dendrogram menunjukkan bahwa sampel kerbau yang berasal dari Jawa Tengah, Nusa Tenggara Barat dan Banten diduga berasal dari nenek moyang yang sama (D=0,0000). Begitu pula dengan sampel kerbau dari Sumatera Utara berkerabat dekat dengan ketiga wilayah tersebut (D=0,0061).
ABSTRACT
Genetic Diversity of Mitochondrial DNA of Local Buffalo (Bubalus bubalis)
Tarwinangsih, W., C. Sumantri and A. Farajallah
Mitochondrial genome (mtDNA) in vertebrate is a circular double stranded DNA molecule. It has a high mutation rate and strictly maternally inherited. This research was conducted to investigate the diversity among local buffalos based on mtDNA’s control region. Samples that were used in this research were native buffalos from 10 Jawa Tengah, 12 Nusa Tenggara Barat, 10 Sumatera Utara and 12 Banten. By in vitro amplification with Polymorphism Chain Reaction method (PCR) using a pair of primer AF22 and AF23, yielded 1145 base pair long. The selected region is a segment spanning the region of end part 3’ cyt-b gene through the partial of the 3’ control region (d-loop). The PCR product was digested with four restriction enzymes, which were AluI (AG CT), HaeIII (GG CC), HinfI (G AnTC) and MspI (C CGG). Two haplotypes were detected among 44 samples. The nucleotide diversity among these haplotypes is 0,17%. Haplotype 1 found in all sample locations, while haplotype 2 was only found in one sample from Sumatera Utara. Genetically, the buffalos from Jawa Tengah, Nusa Tenggara Barat and Banten guessed have a same origin heredity (D = 0,000) and they have a near kinship with Sumatera Utara’s buffalo (D= 0,0061).
ANALISIS KERAGAMAN GENETIK KERBAU LOKAL
(
Bubalus bubalis
) BERDASARKAN HAPLOTIPE
DNA MITOKONDRIA
WIWIN TARWINANGSIH
D14052420
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
ANALISIS KERAGAMAN GENETIK KERBAU LOKAL
(
Bubalus bubalis
) BERDASARKAN HAPLOTIPE
DNA MITOKONDRIA
Oleh
WIWIN TARWINANGSIH
D14052420
Skripsi ini telah disetujui dan disidangkan di hadapan Komisi Ujian Lisan pada tanggal 07 April 2009
Pembimbing Utama Pembimbing Anggota
Dr. Ir. Cece Sumantri, M. Agr. Sc Dr. Ir. Achmad Farajallah, M. Si
Dekan Ketua Departemen
Fakultas Peternakan Ilmu Produksi dan Teknologi Peternakan Institut Pertanian Bogor Fakultas Peternakan
Institut Pertanian Bogor
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 8 Juli 1987 di Kota Tasikmalaya, Provinsi Jawa Barat. Penulis adalah putri pertama dari tiga bersaudara pasangan Bapak Nanang Ruhyana dan Ibu Euis Rayaningsih.
Pendidikan kanak-kanak diselesaikan di TK PGRI Galunggung pada tahun 1993. Pendidikan dasar diselesaikan pada tahun 1998 di SDN Indihiang Gadis. Pendidikan lanjutan tingkat pertama diselesaikan pada tahun 2002 di SLTPN 1 Indihiang dan pendidikan lanjutan tingkat atas diselesaikan pada tahun 2005 di SMAN 6 Kota Tasikmalaya.
Penulis diterima sebagai mahasiswa Institut Pertanian Bogor pada tahun 2005 melalui jalur Undangan Seleksi Masuk IPB (USMI). Penulis kembali diterima sebagai mahasiswa Mayor Ilmu Produksi dan Teknologi Peternakan, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor pada tahun 2006.
KATA PENGANTAR
Puji syukur kehadirat ALLAH AWT. atas segala rahmat, karunia, hidayah serta kasing sayang-Nya sehingga Penulis diberi kemampuan untuk menyelesaikan sripsi ini. Shalawat dan salam semoga tetap tercurah kepada Rasulullah Muhammad SAW, keluarga, sahabat serta umatnya yang istiqomah di jalan-Nya.
Tulisan ini berjudul Analisis Keragaman Genetik Kerbau Lokal (Bubalus bubalis) Berdasarkan Haplotipe DNA Mitokondria. Kerbau merupakan salah satu jenis ternak ruminansia Indonesia yang mempunyai kelebihan untuk ditingkatkan perannya terutama berkaitan dengan potensi genetik dan aspek lingkungannya.
Tujuan penelitian ini adalah untuk mempelajari dan membandingkan keragaman genetik berdasarkan daerah d-loop genom mitokondria kerbau lokal (Bubalus bubalis) dan mengkaji pola hubungan kekerabatan antar populasi daerah pengambilan sampel, yaitu populasi Jawa Tengah, Nusa Tenggara Barat, Sumatera Utara dan Banten. Hasil yang diperoleh dari penelitian ini perlu dilakukan tahap pendeteksian keragaman yang lebih lanjut guna mendapatkan hasil yang lebih jelas. Skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana Peternakan (SPt.) di Fakultas Peternakan Institut Pertanian Bogor. Sepenuhnya Penulis menyadari bahwa masih terdapat berbagai kekurangan dan kelemahan dalam tulisan ini. Sesungguhnya kesalahan dalam tulisan ini datang dari Penulis dan kebenarannya datang dari Allah SWT. Penulis berharap, semoga tulisan ini dapat memberikan sumbangan yang berarti bagi kemajuan dunia peternakan di Indonesia. Amin.
Bogor, April 2009
DAFTAR ISI
Amplifikasi teknik Polymerase Chain Reaction-Restriction Fragment Length Polymorphment (PCR-RFLP) ... 13
Elektroforesis ... 13
Halaman
Rancangan ... 13
Keragaman Haplotipe (h) ... 14
Keragaman Nukleotida ( )... 14
Jarak Genetik (D) ... 14
Prosedur ... 15
Pengambilan Sampel Darah ... 15
Isolasi DNA dari Sampel Darah ... 15
Amplifikasi mtDNA dengan Teknik Polymerase Chain Rection-Restriction Fragment Lengh Polymorphism (PCR-RFLP) ... 15
Elektroforesis Produk PCR ... 15
Pewarnaan Perak ... 16
Pemotongan dengan Enzim Restriksi ... 16
HASIL DAN PEMBAHASAN ... 17
Amplifikasi Ruas Target ... 17
Polymerase Chain Reaction-Restriction Fragment LengthPolymorphment (PCR-RFLP) ... 18
Keragaman Haplotipe (h) dan Nukleotia ( ) ... 24
Jarak Genetik ... 25
Manajemen Konservasi Genetik ... 28
KESIMPULAN DAN SARAN ... 29
Kesimpulan ... 29
Saran ... 29
UCAPAN TERIMAKASIH ... 30
DAFTAR PUSTAKA ... 31
DAFTAR TABEL
Nomor Halaman
1. Pola Pemotongan Enzim Restriksi ... 19 2. Haplotipe mtDNA Masing-masing Populasi. ... 24 3. Keragaman Haplotipe mtDNA Bubalus bubalis di Wilayah Jawa
DAFTAR GAMBAR
Nomor Halaman
1. Genom Mitokondria Mamalia ... 8 2. Hasil Amplifikasi Daerah Pengendali mtDNA (Kolom M =
Marker (Penanda) 100 pb, Kolom 1-7= Pasangan Primer
AF22 dan AF23 ... 17 3. Fragmen Gen D-loop (Cetak Hitam) dan Cyt-b (Cetak Biru)
Didasarkan pada Sekuens Gen mtDNA di GenBank (No Akses Genbank AY702618) Hasil Amplifikasi PCR dengan
Menggunakan Pasangan Primer AF22_23 (Cetak Merah). ... 18 4. Posisi Situs Potong Enzim RestriksiAlu1(AG CT), HaeIII
(GG CC), Hinf1 (G AnTC) dan Msp1 (C CGG). Mutasi (Delesi) Terjadi pada Pirimidin T (Cetak Merah) dan (Transvesi)
Perubahan dari Basa Purin A Menjadi G (Cetak Biru).. ... 19 5. Peta Situs Restriksi Dua Haplotipe mtDNA Bubalus bubalis
yangDianalisis ... 20 6. Pola Migrasi PCR-RFLP Menggunakan Enzim AluI. A= 423,
356, 182, 84, 57 dan 43 pb.. ... 22 7. Pola Migrasi PCR-RFLP Menggunakan Enzim HaeIII. A= 609,
151, 145, 126, 63, 41 dan 10 pb. ... 22 8. Pola Migrasi PCR-RFLP Menggunakan Enzim Hinf1. A= 700,
382 dan 63 pb, B= 700, 233,149 dan 63 pb. ... 23 9. Pola Migrasi PCR-RFLP Menggunakan Enzim MspI. A= 499,
260, 230, 123 dan 33 pb……….. 23 10. Dendogram Populasi Bubalus bubalis Wilayah Jawa Tengah (1),
DAFTAR LAMPIRAN
Nomor Halaman
1. Modifikasi Metode Isolasi DNA Menggunakan GenomicDNA
Mini Kit Geneiad ... 34 2. Hasil Penjajaran (Alignment) DNA d-loop Genom Mitokondria
PENDAHULUAN
Latar Belakang
Berbagai usaha telah dilakukan pemerintah untuk meningkatkan produktivitas ternak di Indonesia termasuk ternak kerbau. Populasi ternak kerbau dari data statistik peternakan sampai tahun 2006 adalah 2,201 juta ekor (Badan Pusat Statistik, 2006). Informasi yang diketahui mengenai jumlah populasi ternak kerbau pada tahun 2007 adalah 2,5 juta ekor. Namun jika dilihat dari sumbangan daging, kontribusi kerbau sejumlah 41 ribu ton per tahun, maka peran kerbau dalam suplai daging hanya sekitar 8%. Hal ini terjadi karena budidaya ternak kerbau masih dipelihara secara ekstensif dan masyarakat Indonesia secara umum hanya menjadikan ternak kerbau sebagai usaha sampingan saja. Pemahaman ini harus diubah kerena produktivitas kerbau sebenarnya tidak lebih rendah daripada sapi. Selain itu dagingnya juga memiliki nilai gizi yang cukup tinggi.
Keragaman genetik ternak baru-baru ini sangat diminati oleh peneliti dan praktisi yang menyadari efek negatif dari hilangannya sumber daya genetik. Isolasi keragaman kerbau dari populasi terjadi selama beberapa abad, bersamaan dengan adopsi manajemen lokalisasi dan metode seleksi menjadikan keragaman genetik menjadi suatu subjek yang harus diperhatikan untuk diselidiki dalam mengetahui asal keturunan, sejarah dan evolusi, penyakit, ketahanan terhadap stres, kualitas dan komposisi dari produk, serta adaptasi terhadap lingkungan yang berbeda. Oleh karena itu, pengetahuan dari tingkat keragaman genetik dapat menyediakan bahan dasar untuk keputusan dalam konservasi serta menjaga dan memanfaatkan ternak kerbau sebagai kekayaan bangsa (Moioli et al., 2001).
Umumnya keragaman genetik dari suatu populasi dapat terjadi karena adanya mutasi, rekombinasi, atau migrasi gen dari satu tempat ke tempat lain. Perkembangan ilmu dan pengetahuan dalam biologi molekuler, khususnya pada pengkajian karakter bahan genetik telah menghasilkan kemajuan yang sangat pesat bagi perkembangan penelaahan suatu organisme dan pemanfaatannya bagi kesejahteraan manusia. Secara umum penggunaan teknik molekuler untuk tujuan identifikasi suatu organisme mempunyai keunggulan yaitu lebih akurat dan lebih cepat. (Moioli et al., 2001).
(mtDNA). Metode ini banyak digunakan untuk mempelajari keragaman genetik hewan dan hubungan sistematis pada berbagai tingkat hierarki (Lamb dan Osentoski, 1995) dikarenakan mtDNA bersifat maternal, yaitu murni diturunkan dari induk betina. Genom mitokondria juga memiliki ukuran yang relatif kecil yaitu ± 16500 pb dan memiliki laju evolusi yang cepat terutama pada daerah pengendali (d-loop) sehingga menimbulkan keragaman yang tinggi pada sekuen mtDNA intraspesies (Avise, 1994). Untuk mengetahui keragaman genetik daerah pengendali mtDNA dapat dilakukan dengan mengggunakan teknik Polymerase Chain Reaction – Restrictsion Fragment Length Polymorphism (PCR-RFLP).
Tujuan
Tujuan penelitian ini adalah mempelajari dan membandingkan keragaman genetik berdasarkan daerah d-loop genom mitokondria kerbau lokal (Bubalus bubalis) dan mengkaji pola hubungan kekerabatan antar populasi daerah pengambilan sampel, yaitu Jawa Tengah, Nusa Tenggara Barat, Sumatera Utara dan Banten.
Manfaat
TINJAUAN PUSTAKA
Kerbau
Berdasarkan klasifikasi taksonomi Bubalus bubalis, termasuk famili Bovidae, dan subfamily Bovinae, genus Bubalus. Dari genus Bubalis ini terdapat 4 species yaitu: Bubalus bubalis (Wild Asian Buffalo), Bubalus mindorensis (Tamaraw), Bubalus depressicornis (Lowland Anoa), dan Bubalus quariesi (Mountain Anoa). Kerbau Asia pada saat ini dalam kondisi endangered dan kemungkinan terancam akan punah dalam waktu dekat, kecuali ada upaya efektif konservasi yang segera dilakukan. (Hasinah dan Handiwirawan, 2006).
Menurut sejarah perkembangan domestikasi, ternak kerbau yang berkembang di seluruh dunia berasal dari daerah sekitar India. Diduga kerbau telah lama dibawa ke Jawa, yaitu pada saat perpindahan nenek moyang kita dari India ke Jawa pada tahun 1.000 SM (Hardjosubroto dan Astuti, 1993). Umumnya semua tipe kerbau domestik (Bubalus bubalis) dibagi menjadi dua kelompok yaitu kerbau sungai (riverine buffalo) dan kerbau rawa atau kerbau lumpur (swamp buffalo). Kromosom kerbau liar Asia maupun kerbau domestik (kerbau rawa) adalah 2n = 48, sedangkan kerbau sungai (riverine buffalo) adalah 2n = 50. Kedua kelompok kerbau ini mempunyai sifat biologis yang berbeda. Kerbau tipe lumpur biasa digunakan sebagai ternak kerja, untuk nantinya dipotong sebagi penghasil daging dan tidak pernah sebagai penghasil susu, sedangkan kerbau sungai merupakan tipe penghasil susu (Hasinah dan Handiwirawan, 2006).
Populasi Kerbau di Indonesia
Barat dan Nusa Tenggara Barat, yang masing-masing berjumlah 340.031, 261.308, 211.008, 156.570 dan 156.568 ekor.
Populasi kerbau di Indonesia sebagian besar merupakan kerbau lumpur dan hanya sedikit kerbau sungai di Sumatera Utara yaitu kerbau Murrah yang dipelihara oleh masyarakat keturunan India dan digunakan sebagai penghasil susu (Hasinah dan Handiwirawan, 2006). Kerbau lumpur yang berkembang dan dibentuk menurut agroekosistem memunculkan berbagai tipe kerbau. Indonesia mempunyai berbagai bangsa kerbau yang karena lama terpisah dari tempat asalnya kemudian beradaptasi dengan lingkungan setempat dan diberi nama sesuai dengan nama tempat. Di Toraja ada kerbau Tedong Bonga, di daerah Alabio ada kerbau Rawa, di Tapanuli Selatan ada kerbau Binanga, di Kalimantan Selatan ada kerbau Kalang dan di Maluku ada kerbau Moa. Disamping itu di daerah Taman Nasional Baluran didapatkan pula kerbau liar. Hanya sedikit sekali kerbau lumpur yang dimanfaatkan air susunya, karena produksi susunya sangat rendah yaitu hanya 1-1,5 l/hari, dibandingkan dengan tipe sungai yang mampu menghasilkan susu sebanyak 6-7 l/hari. Terdapat pula jenis kerbau sungai yang hidup di Sumatera Utara yang dikenal sebagai Murrah yang memiliki kemampuan produksi susu sekitar 8 liter per hari (Subandryo, 2008).
merah dan coklat memiliki ukuran relatif lebih kecil dari hasil penelitian yang dilakukan oleh Asoen (2008).
Garis kalung merupakan ciri spesifik kerbau rawa. Berdasarkan hasil penelitian Sitorus (2008) ditemukan lima variasi garis kalung pada kerbau rawa yaitu tunggal di bagian atas, tunggal di bagian bawah, tunggal di bagian bawah dan bercabang, double yaitu di leher bagian atas dan bawah, serta double dengan bagian bawah yang bercabang. Hasil penelitian Erdiansyah (2008) adalah terdapat 1,5% kerbau lokal di Nusa Tenggara Barat tidak memiliki chevron dan 18,5% yang memiliki chevron tunggal.
Kaki kerbau lokal umumnya berwarna terang. Hasil penelitian yang diperoleh Sitorus (2008) terdapat dua variasi warna kaki kerbau rawa yaitu 94,12% berwarna abu–abu muda dan hanya 5,88% berwarna abu-abu. Warna hitam pada kaki ditemukan hanya 4% dari populasi kerbau lokal yang diamati. Kerbau rawa umumnya memiliki jenis teracak mangkok sehingga banyak digunakan untuk mengolah lahan pertanian karena kemampuannya menekan keras ke bawah (Erdiansyah, 2008).
Penelitian yang dilakukan Hidayat (2007) menunjukkan bahwa antara kerbau Banten dan Sumatera Utara mempunyai ukuran tubuh yang berbeda, kerbau Sumatera Utara mempunyai tinggi pundak dan lingkar dada yang lebih besar dibandingkan kerbau Banten. Rataan tinggi pundak kerbau Banten adalah 120 cm dan Sumaera Utara 126 cm. Rataan lingkar dada kerbau Banten adalah 170 cm dan Sumatra Utara 182 cm. Rataan panjang badan kerbau Banten 121 cm dan kerbau Sumatera Utara yaitu 118 cm.
Potensi Ternak Kerbau
Indonesia dengan memperhatikan jenis kerbau dan daya adaptasinya (Diwyanto dan Handiwirawan, 2006).
Daging kerbau lebih merah dibanding daging sapi karena mempunyai pigmentasi yang lebih banyak dan kurang lemak intramuskuler. Kondisi ini menyebabkan daging kerbau relatif lebih keras dibanding sapi, tetapi justru disukai sebagian konsumen yang memiliki resep masakan tradisional yang unik. Secara umum harga daging dan kerbau hidup lebih rendah dibandingkan sapi, kecuali di beberapa daerah yang memang menyukai daging kerbau. Dengan harga yang lebih rendah maka pasar bagi daging kerbau menjadi lebih luas, banyak konsumen yang mampu untuk membelinya sehingga peluang pengembangannya menjadi lebih terbuka (Diwyanto dan Handiwirawan, 2006).
Keragaman Genetika Ternak
Keragaman genetik adalah hirarki yang paling rendah dalam tingkatan keragaman hayati. Hal ini mencakup area yang meliputi keragaman habitat, komunitas, populasi sampai dengan spesies. Keragaman genetik merupakan cerminan keragaman di dalam spesies yang secara umum disebut subspesies. Terminologi sumberdaya genetik diartikan untuk merefleksikan adanya keragaman genetik di dalam satu spesies sampai pada tingkat DNA. Semakin beragam sumberdaya genetik, akan semakin tahan populasi tersebut untuk hidup dalam jangka yang lama serta semakin tinggi daya adaptasi populasi terhadap perubahan lingkungan (Frankham et al., 2002).
Keragaman genetika dihasilkan oleh mutasi, sedangkan perubahan frekuensi alel disebabkan oleh migrasi, seleksi dan penghanyutan gen (genetic drift). Berkurangnya keragaman genetika atau terlalu banyaknya kondisi homozigot dapat membahayakan daya tahan dan fitness suatu spesies atau populasi. Hal ini dikarenakan setiap kombinasi gen memiliki respon berbeda-beda terhadap kondisi lingkungan. Adanya berbagai macam gen dari individu-individu di dalam populasi, berbagai perubahan lingkungan dapat direspon lebih baik (Frankham et al., 2002).
dan (5) silang dalam (inbreeding) di dalam populasi yang dapat mengurangi heterozigositas. Pemeliharaan keragaman genetika merupakan fokus utama dalam konservasi biologi. Hal ini dikarenakan: (1) perubahan lingkungan merupakan proses yang berkelanjutan sehingga keragaman genetika diperlukan populasi untuk berkembang dan beradaptasi terhadap perubahan; dan (2) kehilangan keragaman genetika berhubungan dengan silang dalam (inbreeding) dan pengurangan dalam fitness reproduksi. Aktivitas yang berlangsung dalam konservasi biologi (genetika) ini meliputi: (1) manajemen genetika populasi kecil untuk memaksimalkan daya tahan keragaman genetika dan meminimalkan silang dalam (inbreeding); (2) memecahkan kembali permasalahan taksonomi dan juga mengggambarkan unit manajemennya; dan (3) penggunaan analisa genetika molekular dalam forensik dan untuk memahami biologi suatu spesies (Frankham et al., 2002).
Pelestarian Sumber Daya Genetik Ternak
Semakin berkembangnya ilmu pengetahuan dan teknologi pemuliaan ternak, bioteknologi, permintaan pasar, mekanisme pertanian dan produksi ternak, akan mendorong eksploitasi ternak melalui persilangan, penggantian breed baru, maupun pengurasan stock secara berlebihan, dan pada gilirannya akan mengancaam keragaman genetik ternak. Di lain pihak pelestarian keragaman genetik ternak akan selalu diperlukan dalam pemuliaan di masa mendatang, karena tanpa adanya keragaman genetik, pemuliaan ternak tidak mungkin dilaksanakan untuk mengantisipasi keperluan di masa mendatang (Subandriyo dan Setiadi, 2003).
Karakteristik DNA Mitokondria
Sumber DNA dapat diperoleh dari organel-organel sitoplasmik antara lain DNA mitokondria. Genom mitokondria memiliki karakteristik, dan memiliki molekul DNA yang diturunkan secara utuh tanpa adanya rekombinasi, ukuran molekulnya kecil/pendek yang susunannya berbeda dengan DNA inti, dan memiliki variasi basa nukleotida yang lebih tinggi dibandingkan DNA inti. Tingginya variasi nulkeotida disebabkan DNA mitokondria memiliki laju perubahan 5-10 kali lebih tinggi dibandingkan dengan DNA inti (Muladno, 2006). Ilustrasi peta genetik mtDNA mamalia dapat dijelaskan pada Gambar 1.
Gambar 1. Genom Mitokondria Mamalia (http://commons.wikimedia.org/wiki/ Image: Mitochondrial_DNA_it.png)
DNA inti. Ukuran genom mitokondria relatif sangat kecil bila dibandingkan dengan ukuran genom intinya (Solihin, 1994).
Karakteristik mtDNA berbeda dari DNA inti antara lain hampir pada semua aspek. Ditinjau dari aspek pewarisan, DNA inti diwariskan dari kedua orang tua dan gen-gennya ditata ulang dalam proses rekombinasi, sementara mtDNA hanya diwarisi dari ibu (matrilineal) dan biasanya tidak ada perubahan dari orang tua ke keturunannya. Walaupun mtDNA juga mengalami rekombinasi, hal ini dilakukan dengan mengkopi dirinya sendiri di dalam mitokondrion yang sama. Karena itu, ditambah dengan laju mutasi mtDNA yang lebih tinggi daripada DNA inti, mtDNA merupakan alat yang ampuh untuk mencari jejak nenek moyang melalui garis keturunan perempuan (matrilineage) dan telah digunakan untuk melacak nenek moyang spesies makhluk hidup serta dapat digunakan untuk mengidentifikasi suatu individu (Solihin, 1994).
Oleh karena mtDNA berevolusi sangat cepat, maka dapat digunakan untuk melacak kejadian yang relatif baru seperti pada studi alami antara dua subspesies. Adanya sifat yang menurun dari induk betina tanpa rekombinasi, mendukung penggunaan mtDNA dalam mempelajari asal muasal dan biologi populasi suatu hibrid. Studi keragaman genetik interspesifik berdasarkan perbedaan dan persamaan mtDNA dapat menghasilkan konstruksi filogenik dari beberapa spesies yang saling berdekatan. Berdasarkan penanda mtDNA, dapat diketahui proses terjadinya pemecahan dari spesies yang satu terhadap yang lain. Dengan demikian, genom mitokondria memiliki banyak sifat khusus dan positif yang dapat dijadikan sebagai penanda genetik sehingga besar sekali manfaatnya untuk studi keragaman genetik dan biologi populasi. Oleh karena mtDNA hewan relatif kecil dan terdapat dalam jumlah banyak maka eksplorasi dan penelaahannya lebih mudah (Solihin, 1994).
Metode PCR-RFLP(Polymerase Chain Reaction-Restriction Fragment Lenght Polymorpmism)
PCR untuk memperbanyak DNA melibatkan serangkaian siklus temperatur yang berulang dan masing-masing siklus terdiri atas tiga tahapan. Tahapan yang pertama adalah denaturasi cetakan DNA (DNA template) pada temperatur 94-96°C, yaitu pemisahan utas ganda DNA menjadi dua utas tunggal. Sesudah itu, dilakukan penurunan temperatur pada tahap kedua sampai 45-60°C yang memungkinkan terjadinya penempelan (annealing) atau hibridisasi antara oligonukleotida primer dengan utas tunggal cetakan DNA. Primer merupakan oligonukelotida utas tunggal yang sekuens-nya dirancang komplementer dengan ujung fragmen DNA yang ingin disalin, primer menentukan awal dan akhir daerah yang hendak disalin. Tahap yang terakhir adalah tahap ekstensi atau elongasi (elongation), yaitu pemanjangan primer menjadi suatu utas DNA baru oleh enzim DNA polimerase. Temperatur pada tahap ini bergantung pada jenis DNA polimerase yang digunakan. Pada akhirnya, satu siklus PCR akan menggandakan jumlah molekul cetakan DNA atau DNA target, sebab setiap utas baru yang disintesis akan berperan sebagai cetakan pada siklus selanjutnya (Ausubel, 1995).
Perbedaan pola pemotongan DNA dari jenis gen yang sama antar beberapa ternak disebut Restriction Fragment Lenght Polymorphism (RFLP). Pada prinsipnya, RFLP merupakan semua mutasi yang menghilangkan atau menciptakan sekuen rekognisi subtitusi nukleotida yang terjadi pada daerah rekognisi suatu enzim restriksi menyebabkan tidak lagi dikenalinya situs pemotongan enzim restriksi dan terjadinyan perbedaan pola pemotongan DNA (Lewin, 1994). Metode RFLP telah diterapkan untuk mendeteksi Quantitative Traits Loci (QTL) pada ternak. Pendeteksian RFLP dilakukan pada sekuen DNA yang telah diketahui fungsinya, misalnya gen (penyandi protein), dan juga pada sekuen DNA yang belum jelas fungsinya (Montgomery dan Kinghorn, 1997).
Sekuensing DNA
-Gilbert adalah menggunakan pendekatan degradasi fragmen DNA secara kimiawi, sedangkan metode Sanger menggunakan pendekantan sintesis molekul DNA baru dan pemberhentian sintesis tersebut pada basa tertentu (Muladno, 2002).
METODE
Lokasi dan Waktu
Penelitian ini dilaksanakan pada bulan September 2008 sampai dengan Januari 2009. Lokasi yang dijadikan tempat melakukan penelitian ini adalah Laboratorium Zoologi dan Laboratorium Terpadu Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Materi
Sampel Darah
Sampel darah kerbau yang digunakan dalam penelitian ini yaitu 44 sampel yang dikumpulkan dari beberapa tempat di Indonesia, yaitu 10 sampel dari Jawa Tengah, 12 sampel dari Nusa Tenggara Barat, 10 sampel dari Sumatera Utara dan 12 sampel dari Banten. Sampel darah disimpan dalam alkohol 70% yang mengandung etilendiamintetraasetat (EDTA) 1%. Isolasi DNA dilakukan menggunakan Genomic DNA mini kit (Geneaid).
Ekstraksi DNA
Bahan - bahan yang digunakan untuk mengekstraksi DNA adalah 5 M NaCl, 0,001M EDTA, NaCl 0,2 µl dan 0,9 % proteinase K (5 mg/ml), 1 x STE (sodium tris EDTA), 10 dan 20% sodium dodesil sulfat (SDS), fenol, kloroform iso amil alkohol, 70% etanol, dan 80% buffer TE (tris EDTA).
Alat-alat yang digunakan antara lain tabung vaccutainer (penampung darah), tabung Eppendorf ukuran 0,5 dan 1,5 ml, pipet mikro Eppendorf ukuran 10 µl-1 ml, tips Eppendorf, vortex mixer, vacuum desicator, alat sentrifugasi makro dan mikro, refrigerator (4oC), freezer (-20oC), autoclave, sarung tangan plastik dan kertas tisu.
Primer
Amplifikasi DNA dengan Teknik Polymerase Chain Reaction-Restriction Fragment Lenght Polymorphment (PCR-RFLP)
Bahan-bahan yang digunakan adalah sampel DNA, air bebas ion steril, GoTaq®PCR Core System 1 (Promega) yang terdiri dari enzym taq polymerase (NEB) dan buffernya, MgCl2 (NEB) dan dNTP, pasangan primer (Forward Reverse), enzim restriksi (AluI, HaeIII, Hinf I dan MspI) dengan buffernya, dan air destilata.
Alat–alat yang digunakan antara lain tabung PCR, mesin Thermocycler (TaKaRa PCR Thermal Cycler MP4 – TaKaRa Biomedicals), alat sentrifugasi, pipet mikro Eppendorf 2 µl dengan tipsnya, vortex, deep freezer dan power supply 500VA.
Elektroforesis
Bahan – bahan yang digunakan untuk membuat satu lembar gel poliakrilamida 6% non denaturasi adalah sebagai berikut: air destilata steril 12 ml, akrilamida 30% (akrilamida:bis = 29:1), larutan 5xTBE 4ml, tetramethylendiamine (TEMED) 15µl dan 10% ammonium persulfat (APS) sebanyak 160 µl, loading dye, dan marker 100 pb (biorad).
Alat – alat yang digunakan antara lain dua lempeng kaca untuk cetakan gel, pipet Mohr, tabung reaksi, sisir khusus untuk sumur, pipet mikro 2µl dengan tipsnya, tangki elektroforesis vertikal dan power supply 500VA.
Pewarnaan Perak
Bahan – bahan yang digunakan adalah air destilata, Cetyl Trimetil Ammonium Bromide (CTAB) 0,2 g/200 ml DW, NH4OH 2,4 ml/200 ml DW, larutan yang terdiri dari AgNO3 0,32 g, 10 N NaOH 0,08 ml, NH4OH 0,8 ml dalam air destilata 200 ml, larutan Na2CO3 4 g dengan formaldehida 0,1 ml dan asam asetat glacial 1%. Alat-alat yang digunakan antar lain nampan, gelas ukur, labu Erlenmeyer, dan water-bath shaker.
Rancangan
< < variasi dari DNA. Perhitungan nilai h berdasarkan persamaan (Nei, 1987) :
Keterangan: ada atau tidaknya situs restriksi. Perhitungan nilai ini berdasarkan persamaan (Nei dan Kumar, 2000) :
; = (- ln S)/b
Keterangan :
= keragaman nukleotida
Keterangan :
Pix = frekuensi alel ke-i dari populasi X Piy = frekuensi alel ke-i dari populasi Y D = jarak genetik
Prosedur
Pengambilan Sampel Darah
Sampel darah kerbau diambil dengan menggunakan tabung vakum yang mengandung antikoagulan, kemudian ditambahkan alkohol 75% dan dikocok membentuk angka delapan dan disimpan dalam suhu ruang sampai dilakukan ekstraksi DNA.
Isolasi DNA dari Sampel Darah
Isolasi DNA dilakukan dari sampel darah yang disimpan dalam alkohol 70% menggunakan metode isolasi mengikuti petunjuk produsen Genomic DNA mini kit Geneaid (Lampiran 1).
Amplifikasi mtDNA dengan Teknik Polymerase Chain Reaction–Restriction Fragment Lenght Polymorphism (PCR-RFLP)
Proses amplifikasi DNA secara umum menggunakan metode sebagai berikut: sampel DNA 2 µl dimasukkan kedalam tabung PCR, kemudian ditambah larutan premix 23 µl yang terdiri dari primer 1 µl, air destilata 16,35 µl, 10 x buffer sebanyak 2,5 µl, MgCl2 2 µl, 2 mM dNTP 1 µl, dan enzim taq polymerase Promega 0,15 µl. Amplifikasi DNA dilakukan dengan menggunakan mesin TaKaRa Thermal Cycler dengan kondisi predenaturasi 940C selama 5 menit yang kemudian diikuti dengan denaturasi 940C selama 1 menit, penempelan (annealing) 580C selama 2 menit dan pemanjangan (elongation) 720C selama 2 menit yang diulang 30 kali.
ElektroforesisProduk PCR
bromtimol blue mencapai bagian bawah gel. Setelah elektroforesis selesai, gel diambil untuk dilakukan pewarnaan perak.
Pewarnaan Perak
Pewarnaan perak (silver staining) dilakukan dengan langkah sebagai berikut: gel dimasukan kedalam larutan CTAB 0,2 g/200 ml air destilata selama 8 menit sambil digoyang, kemudian dicuci dengan air destilata selama 2 x 2 menit. Air tersebut dibuang dan ditambahkan larutan NH4OH selama 6 menit sambil digoyang. Kemudian dilanjutkan dengan larutan AgNO3 selama 10 menit sambil digoyang. Kemudian gel dicuci kembali dengan air destilata 2 x 2 menit. Pemunculan pita dilakukan dengan cara perendaman gel dalam larutan Na2CO3. Setelah pita muncul, ditambahkan larutan asam asetat.
Pemotongan dengan Enzim Restriksi
Metode Restriction Fragment Length Polymorphism (RFLP) digunakan untuk mengetahui keragaman ruas target berdasarkan ada tidaknya situs restriksi. Enzim yang digunakan dalam penelitian ini adalah AluI (AG CT), HaeIII (GG CC), Hinf I (G AnTC), dan MspI (G CGG). Kondisi reaksi pemotongan pada setiap enzim restriksi mengikuti petunjuk teknis produsen, yaitu produk PCR sebanyak 3 µl ditambahkan enzim restriksi sebanyak 1 unit dengan menggunakan buffer (New England Biolabs) yang menyertai setiap enzim restriksi. Kemudian campuran tersebut diinkubasi dalam inkubator pada suhu 370C selama semalam.
HASIL DAN PEMBAHASAN
Amplifikasi Ruas Target
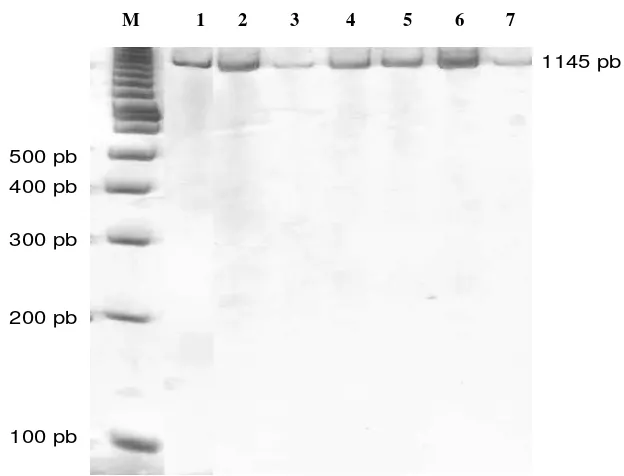
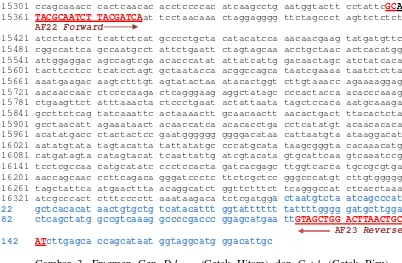
Ruas pengendali mtDNA kerbau lokal (Bubalus bubalis) yang diamplifikasi menggunakan pasangan primer AF22_23 sebesar 1145 pasang basa (pb) (Gambar 2). Kerbau lokal (Bubalus bubalis) memiliki ukuran mtDNA sekitar 16359 pb (Qian et al., 2004). Panjang fragmen hasil amplifikasi dapat lebih dipastikan dengan cara mencocokkan situs penempelan pasangan primer pada sekuen gen mtDNA Bubalus bubalis (GenBank No. Acc. AY702618).
M 1 2 3 4 5 6 7
Gambar 2. Hasil Amplifikasi Daerah Pengendali mtDNA (Kolom M= Marker (Penanda) 100 pb, Kolom 1-7= Pasangan Primer AF22 dan AF23
Produk amplifikasi dengan menggunakan pasangan primer ini meliputi ujung cyt-b sampai daerah d-loop. Tempat penempelan primer disajikan pada Gambar 3. Ruas mtDNA target yang diamplifikasi adalah ruas pengontrol yang hipervariabel dan memiliki laju mutasi yang relatif cepat dibanding bagian lain di genom mitokondria. Pada dasarnya, bagian tengah control region (CR) ini sangat stabil yang kemungkinan bersifat fungsional dalam kontrol ekspresi dan replikasi mtDNA (Avise, 1994). Ukuran DNA hasil amplifikasi tersebut sesuai dengan perkiraan hasil amplifikasi dari desain primer.
100 pb 500 pb
400 pb
200 pb 300 pb
15301 ccagcaaacc cactcaacac acctccccac atcaagcctg aatggtactt cctattcGCA
15361 TACGCAATCT TACGATCAat tcctaacaaa ctaggagggg ttctagccct agttctctct AF22 Forward
15421 atcctaatcc tcattctcat gcccctgcta catacatcca aacaacgaag tatgatgttc 15481 cggccattca gccaatgcct attctgaatt ctagtagcaa acctgctaac actcacatgg 15541 attggaggac agccagtcga acacccatat attatcattg gacaactagc atctatcaca 15601 tacttcctcc tcatcctagt gctaatacca acggccagca taatcgaaaa taatctctta 15661 aaatgaagac aagtctttgt agtatactaa atacactggt cttgtaaacc agaaaaggag 15721 aacaaccaac ctccccaaga ctcagggaag aggctatagc cccactacca acacccaaag 15781 ctgaagttct atttaaacta ctccctgaat actattaata tagctccaca aatgcaaaga 15841 gccttctcag tatcaaattc actaaaactt gcaacaactt aacactgact ttacactcta 15901 gcctaacatt agaaataact acaaccatca acacacctga cctcatatgt acaacacaca 15961 acatatgacc ctactactcc gaatgggggg ggggacataa cattaatgta ataaggacat 16021 aatatgtata tagtacatta tattatatgc cccatgcata taagcgggta cacaaacatg 16081 catgatagta catagtacat tcaattattg atcgtacata gtgcattcaa gtcaaatccg 16141 tcctcgccaa catgcatatc ccctccacta gatcacgagc ttggtcacca tgccgcgtga 16201 aaccagcaac ccttcagaca gggatccctc ttctcgctcc gggcccatgt cttgtggggg 16261 tagctattca atgaacttta acaggcatct ggttctttct tcagggccat ctcacctaaa 16321 atcgcccact ctttcccctt aaataagaca tctcgatgga ctaatgtcta atcagcccat 22 gctcacacat aactgtgctg tcatacattt ggtatttttt tattttgggg gatgcttgga 82 ctcagctatg gccgtcaaag gccccgaccc ggagcatgaa ttGTAGCTGG ACTTAACTGC
AF23 Reverse
142 ATcttgagca ccagcataat ggtaggcatg ggacattgc
Gambar 3. Fragmen Gen D-loop (Cetak Hitam) dan Cyt-b (Cetak Biru) Didasarkan pada Sekuens Gen mtDNA di GenBank (No Akses Genbank AY702618) Hasil Amplifikasi PCR dengan Menggunakan Pasangan Primer AF22_23 (Cetak Merah).
Kesesuaian penempelan primer forward adalah 95,24% karena terdapat satu jenis basa yang berbeda dengan fragmen dari primer AF22. Perbedaan ini terdapat pada basa ke 15360 dari mtDNA yaitu terjadi mutasi dari basa guanine (G) menjadi basa adenin (A), demikian pula dengan kerbau sungai (Water buffalo), sapi Bos indicus dan Bos taurus. Pada domba, primer forward AF22 dapat menempel secara sempurna (100%), sedangkan pada yak dan kambing terdapat perbedaan pada dua basa yaitu terjadi transisi purin (G ke A) dan pirimidin (C ke T). Penelusuran dilakukan dengan menggunakan bantuan Genetyx-Win (software) dan untuk meyakinkan ketepatan maka dilakukan kembali penelusuran secara manual (Lampiran 2). Penempelan primer reverse AF23 terjadi secara sempurna (100%). Demikian pula terjadi pada kerbau sungai, sapi Bos indicus dan Bos taurus, kambing dan yak.
Polymerase Chain Reaction-Restriction Fragment LengthPolymorphment (PCR-RFLP)
amplifikasi disajikan dalam Tabel 1. Posisi situs potong masing-masing enzim restriksi ditunjukkan pada Gambar 4, sedangkan peta situs restriksi dua haplotipe mtDNA Bubalus bubalis yang dianalisis ditunjukkan pada Gambar 5.
Tabel 1. Pola Pemotongan Enzim Restriksi Enzim Pemotong
1 gcatacgcaa tcttacgatc aattcctaac aaactaggag gggttctagc cctagttctc 61 tctatcctaa tcctcattct catgcccctg ctacatacat ccaaacaacg aagtatgatg 121 ttCCGGCCat tcagccaatg cctattctGA ATTCtagtag caaacctgct aacactcaca
MspI HaeIII HinfI
181 tggattggag gacagccagt cgaacaccca tatattatca ttggacaact agcatctatc 241 acatacttcc tcctcatcct agtgctaata ccaacGGCCa gcataatcga aaataatctc
HaeIII
301 ttaaaatgaa gacaagtctt tgtagtatac taaatacact ggtcttgtaa accagaaaag 361 gagaacaacc aacctcccca aGACTCaggg aagaggctat agccccacta ccaacaccca
HinfI
421 aAGCTgaagt tctatttaaa ctactccctg aatactatta atatAGCTcc acaaatgcaa
AluI AluI
481 agagccttct cagtatcaaa ttcactaaaa cttgcaacaa cttaacactg actttacact 541 ctagcctaac attagaaata actacaacca tcaacacacc tgacctcata tgtacaacac 601 acaacatatg accctactac tCCGGatggg gggggggata taacattaat gtaataagga
MspI
661 cataatatgt atatagtaca ttatattata tgccccatgc atataagcgg gtacacaaac 721 atgcatgata gtacatagta cattcaatta ttgatcgcat atagtccatt caagtcaaat 781 ccgtcctcgc caacatgcat atcccctcca ctagatcacg AGCTtggtca ccatgccgcg
AluI
841 tgaaaccagc aacccttcag acagggatcc ctcttctcgc tCCGGGCCca tgtcttgtgg
MspI HaeIII
901 gggtAGCTat tcaatgaact ttaacaggca tctggttctt tcttcagGGC Catctcacct
AluI HaeIII
961 aaaatcgccc actctttccc cttaaataag acatctcgat ggactaatgt ctaatcagcc 1021 catgctcaca cataactgtg ctgtcataca tttggtattt ttttattttg ggggatgctt 1081 gGACTCAGCT atGGCCGTca aaGGCCCcga cCCGGagcat gaattgtagc tggacttaac
HinfI AluI HaeIII HaeIII MspI 1141 tgcat
Prinsip kerja dari metode PCR-RFLP adalah pemotongan suatu ruas DNA dengan beberapa enzim restriksi. Enzim restriksi ini dapat memotong DNA pada sekuen spesifik yang disebut situs pemotongan. Penjumlahan panjang potongan setiap ruas (pita DNA di atas gel poliakrilamid) akan berjumlah sama dengan panjang ruas DNA sebelum dipotong. Banyaknya potongan ini menggambarkan adanya situs pemotongan. Jika dalam suatu populasi ditemukan adanya panjang pemotongan yang berbeda, hal itu menggambarkan adanya situs pemotongan yang berbeda pula. (Lewin, 1994). Dari empat enzim yang digunakan menghasilkan tipe pemotongan yang monomorfik pada tiga enzim restriksi (AluI, HaeIII dan MspI) dan polimorfik pada Hinf1 .
Posisi situs restriksi (Gambar 4) untuk setiap enzim restriksi bervariasi yang disebabkan adanya perbedaan pola runutan pada DNA. Situs restriksi umumnya terdiri atas 4-6 nukleotida atau lebih yang mempunyai urutan basa yang spesifik (Ausabel, 1995). Setiap pola situs restriksi disebut haplotipe. Ada dua haplotipe kerbau yang ditemukan berdasarkan empat enzim restriksi. Haplotipe pertama mewakili hampir semua wilayah, yaitu 43 sampel dari 44 sampel yang dianalisis, diantaranya 10 sampel dari Jawa Tengah, 12 sampel dari Nusa Tenggara Barat, 9 sampel dari Sumatera Utara dan 10 sampel dari Banten. Haplotipe kedua hanya terdapat pada satu wilayah yaitu Sumatera Utara sebanyak satu sampel. Dengan kata lain, sebagian besar (97,73% dari sampel yang digunakan) ternak kerbau lokal Indonesia bersifat monomorfik berdasarkan situs-situs pemotongan yang digunakan dalam penelitian ini.
100 pb menunjukkan pola pemotongan mtDNA menggunakan enzim AluI. Pemotongan ini menghasilkan fragmen (potongan) berukuran 423, 356, 182, 84, 57 dan 43 pb.
M M Alel A
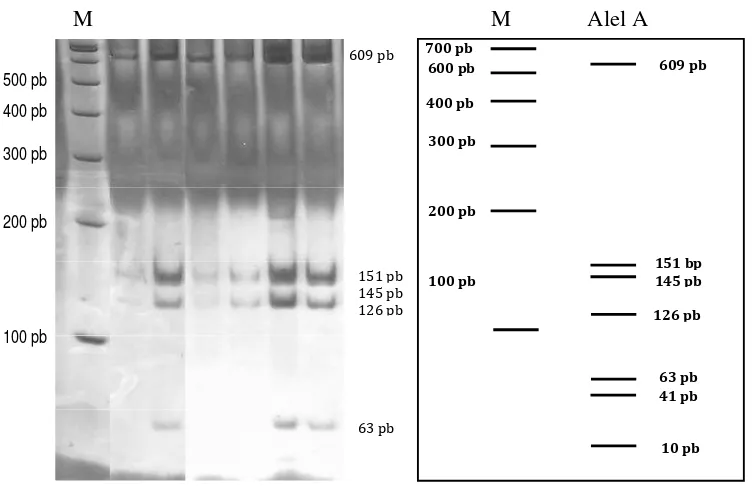
Enzim HaeIII menghasilkan pola pemotongan yang seragam. Pola pemotongan mtDNA menggunakan enzim HaeIII ditunjukkan oleh Gambar 7. Enzim ini menghasilkan fragmen berukuran 609, 151, 145, 126, 63, 41 dan 10 pb.
M M Alel A Alel B
Gambar 8. Pola Migrasi PCR-RFLP Menggunakan Enzim Hinf1. A= 700, 382 dan 63 pb, B= 700, 233,149 dan 63 pb.
Enzim Hinf1 menghasilkan dua pola fragmen, fragmen pertama berukuran 700, 382 dan 63 pb. Sedangkan fragmen kedua berukuran 700, 233, 149 dan 63 bp (Gambar 8). Telah terjadi mutasi (delesi) pada fragmen kedua (Alel B) yaitu kehilangan basa pirimidin (T) pada posisi basa ke 152 (Gambar 4).
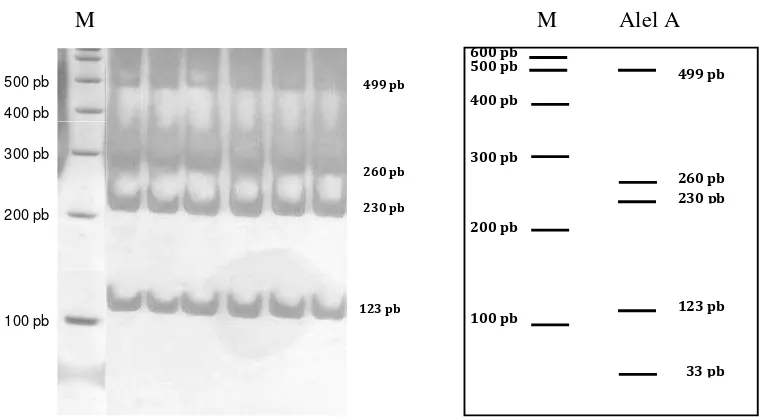
Enzim MspI menghasilkan fragmen berukuran 490, 260, 230 dan 33 pb (Gambar 9). Mutasi (transversi) terjadi pada basa ke 625 dari daerah control region (CR), yaitu perubahan basa purin dari A menjadi G (Gambar 4).
Keragaman Haplotipe (h) dan Nukleotida ( )
Tinggi rendahnya keragaman genetik, dapat diindikasikan dari jumlah maupun keragaman haplotipe (h) dan nukleotida ( ). Hasil yang diperoleh dalam penelitian ini teridentifikasi dua tipe komposit haplotipe (Tabel 1). Jumlah haplotipe mtDNA dan keragamannya pada masing-masing populasi disajikan pada Tabel 2 dan Tabel 3.
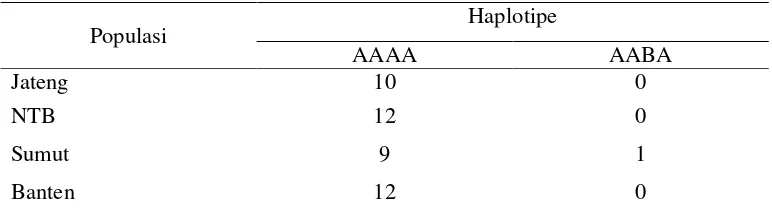
Tabel 2. Haplotipe mtDNA Masing-masing Populasi
Populasi Haplotipe
AAAA AABA
Jateng 10 0
NTB 12 0
Sumut 9 1
Banten 12 0
Keterangan : Haplotipe AAAA untuk enzim restriksi AluI, HaeIII, HinfI dan MspI adalah Tipe A. Haplotipe AABA untuk enzim restriksi AluI, HaeIII dan MspI adalah Tipe A, sedangkan HinfI adalah Tipe B.
Tabel 3. Keragaman Haplotipe mtDNA Bubalus bubalis di Wilayah Jawa Tengah, Nusa Tenggara Barat, Sumatera Utara dan Banten.
Asal Sampel Nilai h Sampel Haplotipe
Jawa Tengah 0,0 10 1
Nusa Tenggara Barat 0,0 12 1
Sumatera Utara 0,2 10 2
Banten 0,0 12 1
Tenggara Barat dan Banten adalah 0,0 (seragam), sedangkan untuk wilayah Sumatera Utara memiliki nilai keragaman haplotipe (h) 0,2. Nilai keragaman haplotipe yang terdapat pada sampel kerbau dari Sumatera Utara tergolong rendah, sehingga dapat pula dikatakan keragaman genetik berdasarkan keragaman haplotipe sampel kerbau lokal (Bubalus bubalis) relatif rendah. Ditinjau dari komposisi haplotipenya, terdapat kesamaan haplotipe antar populasi. Hal ini diduga karena adanya proses migrasi ternak kerbau terkait lokasi yang berdekatan. Nilai keragaman genetik yang rendah berdasarkan keragaman haplotipe pada penelitian ini diduga karena sampel kerbau yang dijadikan objek penelitian dari keempat populasi memiliki jenis yang sama yaitu kerbau rawa (lumpur).
Berdasarkan ada tidaknya situs restriksi dari dua haplotipe, diperoleh nilai keragaman nukleotida ( ) untuk populasi adalah 0,17%. Nilai ini relatif rendah jika dibandingkan dengan hasil penelitian yang dilaporkan Tanaka et al. (1995) yang melakukan studi pola pemotongan DNA mitokondria pada kerbau lumpur dan kerbau sungai menggunakan 15 enzim restriksi endonuklease. Lima tipe DNA mitokondria teridentifikasi yaitu tiga tipe pada kerbau lumpur dan dua tipe pada kerbau sungai. Keragaman nukleotida bervariasi dari 0,2-0,6% di dalam kelompok kerbau lumpur dan kerbau sungai dan bervariasi antara 1,9-2,4% antara kerbau lumpur dan kerbau sungai.
Jarak Genetik
Keragaman genetik antar populasi dapat dicirikan dari jarak genetik. Jarak populasi dalam klasifikasi atau pengelompokan ternak menggambarkan perbedaan nilai suatu ciri antara kelompok ternak yang dibandingkan. Semakin kecil nilai jarak genetik, semakin kecil pula keragaman antar populasi tersebut, demikian pula sebaliknya. Nilai jarak genetik disajikan dalam bentuk matriks seperti tertera pada Tabel 4, sedangkan ilustrasi dendrogram ditampilkan pada Gambar 10.
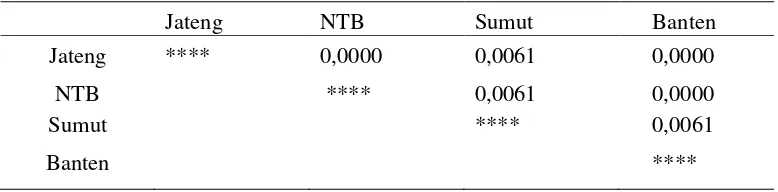
Tabel 4. Jarak Genetik Berdasarkan Haplotipe
Jateng NTB Sumut Banten
Jateng **** 0,0000 0,0061 0,0000
NTB **** 0,0061 0,0000
Sumut **** 0,0061
0,0000
0,0061
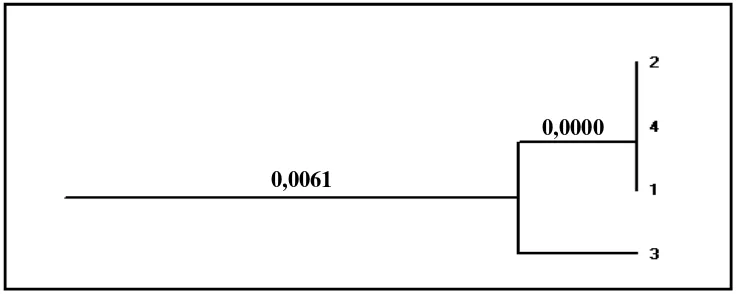
Gambar 10. Dendogram Populasi Bubalus bubalis Wilayah Jawa Tengah (1), Nusa Tenggara Barat (2), Sumatera Utara (3) dan Banten (4). Hasil analisis memperlihatkan adanya penstrukturan genetik sebagai gambaran pemisahan populasi menjadi dua unit populasi, yaitu unit populasi Jawa Tengah-Nusa Tenggara Barat-Banten, dan unit populasi Sumatera Utara (Gambar 10). Secara berturut-turut nilai jarak genetik kedua unit populasi tersebut adalah 0,0000 dan 0,0061 (Tabel 4). Berdasarkan hasil yang diperoleh dari penelitian ini ternyata sampel kerbau dari Jawa Tengah, Nusa Tenggara Barat dan Banten diduga memiliki genetik yang sama.
dan kerbau sungai di Indonesia mempunyai jarak genetik yang jauh, sehingga diasumsikan bahwa kerbau lumpur dan kerbau sungai didomestikasi dari nenek moyang yang berbeda. Begitu pula dengan penelitian yang dilakukan oleh Tanaka et al. (1995) , berdasarkan pola pemotongan DNA mitokondria dengan dendogram, memperlihatkan bahwa kelompok kerbau lumpur merupakan kelompok yang berbeda dengan kerbau sungai.
Proses evolusi suatu organisme berkaitan erat dengan perubahan genetik yang terjadi, dimana perubahan genetik tersebut dapat terjadi karena adanya perubahan pada frekuensi gen. Elseth dan Baumgerner (1984) menyatakan bahwa ada 4 faktor dasar yang menyebabkan terjadinya perubahan pada frekuensi gen, yaitu seleksi alam, mutasi, migrasi dan penyimpangan genetik. Seleksi alam merupakan sebuah proses alamiah dimana beberapa individu memiliki keterkaitan dasar secara genetik (kemampuan) yang dapat memperbaiki ketahanan hidup atau reproduksi untuk beradaptasi dan memiliki keturunan yang dapat bertahan hidup dalam lingkungan. Hal ini dapat dijadikan pendugaan bahwa di wilayah Sumatera Utara masih ada beberapa spesies kerbau yang bertahan hidup sehingga mengakibatkan keragaman genetik pada wilayah tersebut.
dengan hewan air (misal: ikan) memungkinkan untuk melakukan migrasi ke tempat yang lebih jauh dari asalnya melalui aliran atau arus air.
Manajemen Konservasi Genetik
KESIMPULAN DAN SARAN
Kesimpulan
Keragaman genetik kerbau lokal berdasarkan haplotipe DNA mitokondria masih sangat rendah. Hasil pemotongan dengan empat enzim restriksi (AluI, HaeIII, HinfI dan MspI) ditemukan dua haplotipe mtDNA. Haplotipe pertama memiliki pola penyebaran luas di seluruh wilayah pengambilan sampel (Jawa Tengah, Nusa Tenggara Barat, Sumatera Utara dan Banten), sedangkan haplotipe kedua hanya ditemukan pada satu sampel dari wilayah Sumatera Utara. Berdasarkan ada tidaknya situs restriksi dari dua haplotipe, diperoleh nilai keragaman nukleotida ( ) untuk populasi adalah 0,17%. Perhitungan jarak genetik dalam bentuk dendrogram menunjukkan bahwa sampel kerbau yang berasal dari Jawa Tengah, Nusa Tenggara Barat dan Banten diduga berasal dari nenek moyang yang sama (D=0,0000). Begitu pula dengan kerbau lokal Sumatera Utara berkerabat dekat dengan ketiga wilayah tersebut (D=0,0061).
Saran
UCAPAN TERIMAKASIH
Alhamdulillahirobbil’alamin...Puji syukur dan sembah sujud Penulis panjatkan ke hadirat Allah SWT, karena atas nikmat, rahmat dan karunia-Nya penulis dapat menyelesaikan skripsi ini.
Rasa hormat serta terima kasih yang tak terhingga Penulis sembahkan untuk Mamah dan Bapak yang dengan kesabaran dan ketulusan hatinya selalu memberikan dorongan baik berupa materil, kasih sayang, doa dan selalu bersedia mendengarkan segala keluh kesah sehingga menjadikan sumber motivasi utama untuk senantiasa sabar dan semangat untuk menjalankan perjuangan ini. Penulis juga mengucapkan terima kasih kepada adik-adikku tersayang Yandi dan Lia yang telah memberikan semangat, doa dan perhatiannya.
Penulis mengucapkan terima kasih yang sebesar-besarnya kepada Bapak Dr. Ir. Cece Sumantri, M.Agr. Sc. sebagai pembimbing utama dan Bapak Dr. Ir. Achmad Farajallah, M.Si. sebagai pembimbing anggota yang dengan sabar membimbing, memberi motivasi dan masukan berarti bagi Penulis dalam menyelesaikan skripsi ini. Terima kasih kepada Ir. Sri Darwati, M.Si sebagai dosen penguji seminar dan Prof. Dr. Ir. Pollung H. Siagian, MS. serta Ir. Kukuh Budi Satoso, MS. sebagai dosen penguji sidang atas kritik dan masukannya. Terimakasih kepada Ir. Sri Rahayu, M.Si sebagai dosen pembimbing akademik Penulis selama menjadi mahasiswa di FAPET IPB. Kepada teman-teman sepenelitian (Neng, Lidi dan Ires) Penulis ucapkan terima kasih yang sebesar-besarnya atas kebersamaan, semangat dan dukungan yang diberikan kepada Penulis. Terima kasih kepada rekan-rekan Lab Zoologi (Pak Khoirul, Bu Bibah, Bu Ria, Kak Wildan, Kak Ogi, Mba Muli) dan A’Eryk Andreas yang telah membimbing dan membantu Penulis selama penelitian. Sahabatku tercinta (Anggie, Rina dan Adri) yang teramat berarti bagi Penulis, terimakasih atas semua kasih sayang, dukungan dan doa yang kalian berikan. Tak lupa Penulis ucapkan terima kasih kepada teman-teman seperjuangan IPTP 42. Mudah-mudahan kebersamaan selama ini menjadi kenangan yang berharga untuk masa depan kita.
Bogor, April 2009
Amano, T., Katsumata, S. Suzuki, K. Nozawa. Y., Kawamoto, T. Namikawa, H. Martojo, I.K. Abdulgani dan H. Nadjib. 1981. Morphological and geneticals survey of water buffalous in Indonesia. The origin and phylogeny of Indonesia native livestock. Report by Grant-in-Aid for Overseas Scientific Survey, No. 504353. Hal : 31 - 54.
Asoen, N.J.F. 2008. Studi craniometrics dan pendugaan jarak genetik kerbau sungai, kerbau rawa dan silangannya di Sumatera Utara. Skripsi. Fakultas Peternakan Institut Pertanian Bogor, Bogor.
Avise J.C. 1994. Molecular Markers, Natural History and Evolution. New York: Chapman and Hall : 361-380p.
Ausabel. 1995. Short Protocol in Molecular Biology. 3rd edition, New York.
Badan Pusat Statistik. 2006. Statistik Peternakan 2006. Direktorat Jendral Peternakan, Jakarta.
Diwyanto, K. dan E. Handiwirawan. 2006. Strategi pengembangan ternak kerbau: Aspek penjaringan dan distribusi. Prosiding lokakarya nasional usaha ternak kerbau mendukung program kecukupan daging sapi. Pusat Penelitian dan Pengembangan Peternakan, Bogor.
Elseth, G. D. dan Kandy, D. Baumgerner . 1984. Genetics. Adison-Wealey Publishing, USA.
Erdiansyah, E. 2008. Studi keragaman fenotipe dan pendugaan jarak genetik antara kerbau lokal di Kabupaten Dompu Nusa Tenggara Barat. Skripsi. Fakultas Peternakan Institut Pertanian Bogor, Bogor.
Frankham, R., J.D. Ballou dan D.A. Briscoe. 2002. Introduction to conservation genetics. Cambrigde University Press. 100-105p.
Hardjosubroto, W. 2006. Kerbau, Mutiara yang Terlupakan. Fakultas Peternakan Universitas Gadjah Mada, Yogyakarta.
Hardjosubroto, W. dan J.M. Astuti. 1993. Buku Pintar Peternakan. PT Gramedia Widiasarana Indonesia, Jakarta.
Hasinah. H. dan E. Handiwirawan. 2006. Keragaman genetik ternak kerbau di Indonesia. Prosiding lokakarya nasional usaha ternak kerbau mendukung program kecukupan daging sapi. Pusat Penelitian dan Pengembangan Peternakan, Bogor.
Hidayat, U. 2007. Karakteristik fenotipik kerbau Banten dan Sumatera Utara. Skripsi. Fakultas Peternakan Institut Pertanian Bogor, Bogor.
Lamb, T. dan M.F. Osentoski. 1995. Intraspesifik phylogeography of the gopher tortoise, gopher polyphemus : RFLP analysis of amplified mtDNA segments. Molecular Ecology 4:709-718.
Lewin, B. 1994. Genes V. Oxford University Press, New York.
Montgomery, G.W. dan Kinghorn. 1997. Recent developments in gene mapping and progress towards marker-assisted selection in sheep. Aust. J. Agric. Res. 48:729-741.
Mukherjee, T.K., J.S.F. Baker, S.G. Tan, O.S. Salvaraj, J.M. Panadm, Y. Yusharyati dan Sreetaram. 1991. Genetic relationships among population of swamp buffalo in Southeast Asia, Australia.
Muladno. 2002. Teknologi Rekayasa Genetik. Pustaka Wirausaha Muda, Bogor. Muladno. 2006. Polimorfisme dan analisis keterpautan mikrosatelit pada genom
babi. Hayati, Bogor.
Nataraj, A. J., I. O. Glander, N. Kusukawa, dan W. E. Highsmith Jr. 1999. Single-strand conformation polymorphism and heteroduplex analysis for gel-based mutation detection. Electrophoresis. 20:1177-1185.
Nei, M. 1987. Moleculer Evolutionary Genetics. Columbia University Press, New York.
Nei, M. dan S. Kumar. 2000. Molecular Evolution and Phylogenetics. Oxford University Press, United States.
Qian, J.X., K.J. Dong, , Y.J. Huang, B.Z. Yang, , M. He, Z.J. Liu, dan J. Li, 2004. [Unplubish]. Laboratory, Hainan Medical College, Chengxi Road, Haikou, Hainan, China.
Sitorus, A.J. 2008. Studi keragaman fenotipe dan pendugaan jarak genetik kerbau sungai, kerbau rawa dan silangannya di Sumatera Utara. Skripsi. Fakultas Peternakan Institut Pertanian Bogor, Bogor.
Solihin, D. 1994. Peran DNA mitokondria (mtDNA) dalam studi keragaman genetik dan biologi populasi pada hewan. Jurnal Hayati. 1:(1):1-4.
Subandryo, 2008. Pengelolaan dan pemanfaatan data plasma nutfah ternak kerbau. Balai Penelitian Ternak, Bogor.
Subandriyo dan B. Setiadi, 2003. Pengelolaan plasma nutfah hewani sebagai aset dalam pemenuhan kebutuhan manusia. Komisi Nasional Plasma Nutfah, Bogor.
Tanaka, K., T. Yamagata, S. Masangkay, M. O. Faruque, Salundik, S. S. Mansjoer, Y. Kawamoto dan T. Namikawa. 1995. Nucleotide diversity of mitochondrial DNA between the swamp and the river types of domestic water buffaloes, Bubalus bubalis, based on restrcition endonuclease cleavage patterns. Biochemical Genetics. 33 (5/6) : 137-148.
Lampiran 1. Modifikasi Metode Isolasi DNA Menggunakan GenomicDNA Mini Kit Geneiad
Sampel darah
Sentrifugasi 3500 rpm, 10 menit Sel darah putih dipindahkan ke tabung 1,5 ml
+ Etoh absolut sampai 1 ml Pindahkan GD Column ke tabung 1,5 ml
+ Bufer pengelusi 100 l
Sentrifugasi 10000 rpm, 1 menit