OPTIMASI EKSPRESI PLANTARISIN W REKOMBINAN
SEBAGAI INHIBITOR
Salmonella typhi
ANDINI SETYANTI PUTRI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Optimasi Ekspresi Plantarisin W Rekombinan sebagai Inhibitor Salmonella typhi adalah benar karya saya dan pembimbing serta belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor dan Lembaga Ilmu Pengetahuan Indonesia.
RINGKASAN
ANDINI SETYANTI PUTRI. Optimasi Ekspresi Plantarisin W Rekombinan sebagai Inhibitor Salmonella typhi. Dibimbing oleh HASIM DANURI dan APON ZAENAL MUSTOPA.
Demam tifoid merupakan infeksi sistemik yang disebabkan oleh Salmonella typhi. Diperkirakan terdapat 21.6 juta kasus demam tifoid di dunia dan 216 500 orang di antaranya meninggal pada tahun 2000. Indonesia menempati urutan ketiga terbanyak kejadian tifoid, dengan 180.3 kasus/100 000/tahun. Pengobatan yang banyak dilakukan adalah dengan antibiotik. Namun, dilaporkan 37.5% strain S. typhi di Indonesia mengalami multidrug resistance, sehingga diperlukan alternatif pengobatan lain. Salah satu alternatifnya adalah peptida antimikroba kelas I (lantibiotik) yang dihasilkan oleh Lactobacillus plantarum, yaitu plantarisin W. Plantarisin W berpotensi sebagai alternatif pengobatan demam tifoid. Oleh karena itu, penelitian ini bertujuan mengoptimasi ekspresi plantarisin W rekombinan di Escherichia coli, memurnikan, dan mengevaluasi aktivitas inhibisi plantarisin W rekombinan terhadap S. typhi.
Plantarisin W rekombinan diekspresikan sebagai protein fusi menggunakan vektor pET-32a dalam inang Escherichia coli BL21 (DE3) (pLysS). Metode ekspresi diawali dengan optimasi induksi ekspresi, suhu induksi, lisis sel, dan solubilisasi. Setelah didapatkan kondisi optimum ekspresi plantarisin W rekombinan, dilakukan pemurnian plantarisin W rekombinan menggunakan kromatografi afinitas logam untuk fraksi terlarut dan elektroelusi untuk fraksi tidak larut. Setiap tahapan optimasi ekspresi plantarisin W rekombinan dievaluasi menggunakan SDS-PAGE, dilanjutkan dengan konfirmasi ekspresi menggunakan western blot. Metode difusi agar dan uji mikrodilusi digunakan untuk uji aktivitas antibakteri. Selain itu, konsentrasi protein murni ditentukan dengan metode BCA. Hasil penelitian ini menunjukkan bahwa metode ekspresi plantarisin W rekombinan optimum dengan penambahan 0.5 mM IPTG, suhu induksi pada 22 o
C, menggunakan metode lisis beku–cair dan sonikasi serta solubilisasi dengan bufer Tris pH 12.5 dan 2 M urea. Plantarisin W rekombinan diketahui terdapat dalam sitoplasma dan membentuk badan inklusi (fraksi tidak larut). Berdasarkan hasil SDS-PAGE dan western blot, plantarisin W berhasil diekspresikan di E. coli dengan ukuran ± 33 kDa. Hasil uji aktivitas antibakteri dengan metode difusi agar menunjukkan bahwa plantarisin W rekombinan yang dimurnikan dari fraksi terlarut memiliki aktivitas terhadap S. typhi dan S. aureus yang ditunjukkan dengan adanya zona bening. Sedangkan plantarisin W rekombinan yang dimurnikan dari fraksi tidak larut menghasilkan 8 mg/L kultur dengan rendemen 16.96%, dengan nilai aktivitas spesifik terhadap penghambatan S. typhi dan S. aureus masing-masing sebesar 0.34 %/µg protein dan 0.66 %/µg protein berdasarkan metode uji mikrodilusi. Plantarisin W rekombinan dapat diekspresikan di Escherichia coli dan berpotensi sebagai antibakteri terhadap S. typhi. Akan tetapi, untuk diaplikasikan dalam bidang medis, diperlukan inang ekpresi yang lebih aman, seperti bakteri asam laktat.
SUMMARY
ANDINI SETYANTI PUTRI. Expression Optimization of Recombinant Plantaricin W as Inhibitor Towards Salmonella typhi. Supervised by HASIM DANURI dan APON ZAENAL MUSTOPA.
Typhoid fever is a systemic infection caused by Salmonella typhi. There are estimated 21.6 million cases of typhoid fever in the world and 216 500 of whom died in 2000. Indonesia place third ranks the highest incidence of typhoid, with 180.3 events/100 000/year. The most common treatment is by using antibiotic agents. However, it has been reported that 37.5% S. typhi strain in Indonesia are multidrug resistance. Therefore, it is important to looking for the other treatments. One of which is by application of antimicrobial peptide class I (lantibiotic) produced by Lactobacillus plantarum, namely plantaricin W. Plantaricin W has potential as antimicrobial agent. Therefore, this study was aimed to optimize the expression of recombinant plantaricin W in Escherichia coli, to purify recombinant plantaricin W, and also to evaluate the inhibition activity of recombinant plantaricin W towards S. typhi.
Recombinant plantaricin W was expressed as fusion protein using pET-32a in E. coli BL21 (DE3) (pLysS) as host. The expression method started with optimizing induction of expression, induction temperature, lysis cell, and solubilization. After the optimum condition to express recombinant plantarisin W has been obtained, then proceed with purification of recombinant plantaricin W by using affinity chromatography for soluble fraction and by using electroelution for insoluble fraction. Each stage of optimization of expression was evaluated using SDS-PAGE and followed by western blot to confirm the expression of recombinant plantaricin W. Moreover, diffusion agar and microdillution method were both used to evaluated antimicrobial activity of recombinant plantaricin W. In addition, the concentration of purified protein was calculated by BCA assay.
The result showed that the expression method for recombinant plantaricin W was optimum with addition of 0.5 mM IPTG, induction temperature at 22 oC, using freeze thaw and sonication as lysis method, and solubilization with Tris buffer pH 12.5 and 2 M urea. Recombinant plantaricin W was accumulated in the cell cytoplasm and based on western blot result, recombinant plantaricin W was succesfully expressed in E. coli with ± 33 kDa in size and was forming inclusion bodies (insoluble fraction). Based on antimicrobial assay using diffusion agar method showed that recombinant plantaricin W purified from soluble fraction had activity against S. typhi and S. aureus as shown by clear zone formation. While plantaricin W recombinant purified from the insoluble fraction (8 mg/L culture with 16.96% yield) showed antibacterial activity against S. typhi and S. aureus by 0.34 % inhibition/mg protein and 0.66 % inhibition/mg protein based on microdillution assay respectively. Recombinant plantaricin W has been expressed in E . coli and has potential as antibacterial agent againts S. typhi. However, to be applied in medical application, required non-pathogenic host expression, such as lactic acid bacteria.
Hak Cipta Milik IPB dan LIPI, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB dan LIPI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biokimia
OPTIMASI EKSPRESI PLANTARISIN W REKOMBINAN
SEBAGAI INHIBITOR
Salmonella typhi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Optimasi Ekspresi Plantarisin W Rekombinan sebagai Inhibitor Salmonella typhi
Nama : Andini Setyanti Putri NIM : G851130456
Disetujui oleh Komisi Pembimbing
Dr drh Hasim Danuri, DEA Ketua
Dr Apon Zaenal Mustopa, MSi Anggota
Diketahui oleh
Ketua Program Studi Biokimia
Prof Dr drh Maria Bintang, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWT karena atas rahmat, karunia, dan hidayah-Nyalah penulis dapat menyelesaikan tesis yang berjudul Optimasi Ekspresi Plantarisin W Rekombinan sebagai Inhibitor Salmonella typhi. Penelitian ini dilaksanakan dari bulan Januari 2014 hingga November 2014 di Laboratorium Aplikasi Rekayasa Genetika dan Desain Protein, Pusat Penelitian Bioteknologi-Lembaga Ilmu Pengetahuan Indonesia (LIPI).
Terima kasih, penghargaan, dan apresiasi penulis ucapkan kepada Dr drh Hasim, DEA sebagai pembimbing utama dan Dr A. Zaenal Mustopa, MSi sebagai pembimbing kedua atas arahan, bimbingan, motivasi dan masukkannya selama penelitian serta dalam penyusunan tesis ini. Terima kasih penulis ucapkan kepada Rifqiyah Nur Umami, MS yang telah membantu penulis selama penelitian dan penulisan tesis.Terima kasih kepada Dr Suryani, SP, MSc dan Dr Mega Safitri yang telah menguji, membimbing, dan memberikan saran dalam penulisan tesis ini. Serta terima kasih kepada Dr. Bambang Sunarko selaku Kepala Pusat Penelitian Bioteknologi LIPI yang telah mengizinkan penulis untuk melakukan penelitian di Pusat Penelitian Bioteknologi LIPI. Penelitian ini didanai oleh LIPI melalui mekanisme hibah bersaing kompetitif LIPI 2014. Tidak lupa juga terima kasih penulis ucapkan kepada keluarga, teman-teman Laboratorium Aplikasi Rekayasa Genetika dan Desain Protein, Bioteknologi-LIPI, teman-teman program sinergi S1-S2, Rega, teman-teman Biokimia 46 dan kakak SPs Biokimia 2012-2013 yang selalu mendukung penulis. Semoga tesis ini memberikan manfaat dalam khazanah ilmu pengetahuan.
DAFTAR ISI
DAFTAR GAMBAR vi
DAFTAR TABEL vi
DAFTAR LAMPIRAN vii
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Hipotesis 3
2 METODE PENELITIAN 3
Waktu dan Tempat 3
Bahan 3
Alat 4
Prosedur Penelitian 4
3 HASIL DAN PEMBAHASAN 8
Optimasi Ekspresi Plantarisin W Rekombinan 8
Plantarisin W Rekombinan Tersolubilisasi 11
Plantarisin W Rekombinan Murni 13
Aktivitas Inhibisi 17
4 SIMPULAN DAN SARAN 21
Simpulan 21
Saran 21
5 DAFTAR PUSTAKA 21
LAMPIRAN 28
vi
DAFTAR GAMBAR
1 Pertumbuhan transforman E. coli BL21 (DE3) pLySs pada suhu inkubasi
37 oC tanpa induksi. 9
2 Hasil SDS-PAGE optimasi ekspresi plantarisin W rekombinan di E. coli. 9 3 Hasil SDS-PAGE solubilisasi plantarisin W rekombinan. 12 4 Hasil SDS-PAGE purifikasi plantarisin W rekombinan. 14 5 Hasil SDS-PAGE pemotongan plantarisin W rekombinan dengan
enterokinase (pewarnaan silver staining). 14
6 Hasil western blot plantarisin W rekombinan ( membran nitroselulosa
dan gel SDS-PAGE). 16
7 Aktivitas antibakteri plantarisin W rekombinan tersolubilisasi dengan
bufer solubilisasi I 19
DAFTAR TABEL
1 Konsentrasi protein setiap tahapan pemurnian plantarisin W dari fraksi
tidak larut 16
2 Aktivitas inhibisi plantarisin W rekombinan hasil pemurnian fraksi
terlarut terhadap S. typhi dan S. aureus 18
vii
DAFTAR LAMPIRAN
1 Diagram Alir Penelitian 29
2 Komposisi Media Luria Bertani 30
3 Komposisi Media Nutrien Broth 30
4 Komposisi Media Nutrient Agar 30
5 Komposisi Bufer Purifikasi Kromatografi Afinitas 30 6 Komposisi Bufer Solubilisasi dan Renaturasi 31
7 Komposisi Bufer Elusi Gel 31
8 Komposisi Larutan Elektroforesis SDS-PAGE 32
9 Komposisi Gel SDS-PAGE (akrilamid 12%) 32
10 Komposisi Larutan Silver Staining 33
11 Komposisi Larutan Western Blot 33
12 Komposisi Bufer Pemotongan dengan Enterokinase (10x EK Max) 34
13 Komposisi bufer fosfat (pH 7.2) 34
14 Komposisi Reagen BCA Assay 34
15 Kurva Standar BSA 34
16 Kadar Protein Setiap Tahap Pemurnian 35
17 Aktivitas Spesifik Setiap Tahap Pemurnian 35
18 Peta Plasmid pET-32a 36
1 PENDAHULUAN
Latar Belakang
Demam tifoid merupakan infeksi sistemik yang disebabkan oleh Salmonella enterica serotipe Typhi (S. typhi) (Bhan et al. 2005). Kasus demam tifoid mencapai 21.6 juta kasus di dunia pada tahun 2000. Penyakit ini ditularkan melalui rute fekal-oral, yaitu melalui makanan dan air yang terkontaminasi. Demam tifoid umumnya terjadi pada negara berkembang dan padat penduduk dengan sanitasi yang kurang baik. Asia merupakan wilayah dengan kejadian tifoid terbesar di dunia, yaitu 90% dari kasus tifoid di dunia (Crump et al. 2004). Menurut Ochiai et al. (2008), Indonesia menempati urutan ketiga kejadian tifoid terbanyak di Asia, dengan 180.3 kejadian/100 000/tahun.
Pengobatan yang banyak digunakan adalah dengan antibiotik, di antaranya yaitu ampisilin, kloramfenikol, streptomisin, tetrasiklin, florokuinolon, dan monobaktum beta-laktam (WHO 2003). Penggunaan antibiotik memicu resistansi pada S. typhi (multidrug resistance). Menurut Yanagi et al. (2009), terdapat 37.5% strain S. typhi yang mengalami multidrug resistance di Surabaya, Indonesia. S. typhi resistant terhadap 200 g/ml kloramfenikol. Resistansi ini terjadi karena S. typhi tidak memiliki gen OmpF (Toro et al. 1990), oleh karena itu diperlukan alternatif pengobatan yang tidak menginduksi resistansi pada S. typhi.
Salah satu alternatif pengobatan demam tifoid adalah antimicrobial peptide (AMP). AMP merupakan molekul biologis yang disintesis oleh ribosom, memiliki aktivitas antimikroba, dan berfungsi sebagai pertahanan terhadap mikroba (Sang dan Blecha 2008). Menurut Gong et al. (2010), plantarisin yang diisolasi dari Jiaoke (makanan tradisional Cina) memiliki aktivitas antibakteri terhadap S. typhimurium. Plantarisin merupakan peptida antimikroba yang berperan sebagai penekan spesies kompetitor, membunuh bakteri dengan cara merusak integritas membran sehingga tidak menginduksi terjadinya resistansi (Sang dan Blecha 2008; Gong et al. 2010).
Peptida antimikroba yang dihasilkan oleh bakteri (bakteriosin) terbagi menjadi beberapa kelas. Menurut Cotter et al. (2005), bakteriosin dibagi menjadi tiga kelas yaitu, kelas I (lantibiotik) peptida kecil, mengandung residu asam amino termodifikasi (lantionin, β-metil-lantionin), kelas II bakteriosin kecil dan tidak memiliki asam amino termodifikasi, serta kelas III (bakteriolisin) berukuran besar, tidak tahan panas, mengkatalisis hidrolisis dinding sel bakteri sehingga menyebabkan autolisis. Salah satu bakteriosin kelas I adalah plantarisin W (Holo et al. 2001). Plantarisin W merupakan lantibiotik yang dihasilkan dari Lactobacillus plantarum dan mampu menghambat berbagai spesies bakteri Gram positif (Holo et al. 2001).
2
dan virus. Plantarisin W berpotensi dikembangkan sebagai alternatif pengobatan demam tifoid, namun produksi plantarisin W yang diisolasi dari sumber alami (L. plantarum) sulit dilakukan karena rendemen yang dihasilkan rendah dan aktivitas antimikroba nya tidak stabil. Salah satu pendekatan yang dapat dilakukan adalah dengan membuat plantarisin W rekombinan. Menurut Ma et al. (2003), protein rekombinan dapat digunakan untuk produksi dalam skala besar karena dapat diproduksi dengan lebih mudah dan lebih stabil. Volzing et al. (2013), melaporkan bahwa terdapat peptida antimikroba A3-APO dan Alyteserin rekombinan yang memiliki aktivitas terhadap S. typhi dan E. coli. Protein A3-APO merupakan analog pyrrhocoricin, peptida antimikroba yang diisolasi dari kutu daun Pyrrhocoris apterus (Ostorházi 2011). Sedangkan, Alyteserin merupakan peptida antimikroba yang disekresikan pada kulit kodok Alytes obstetricans (Conlon et al. 2009).
Studi ekspresi heterolog bakteriosin telah banyak dilakukan, terutama ekspresi bakteriosin rekombinan di E. coli, di antaranya yaitu plantarisin -E, -F, -J, -K rekombinan (Pal dan Srivastava 2013), glisinesin rekombinan (Heu et al. 2001), diversin rekombinan (Richard et al. 2004), piskikolin rekombinan (Gibbs et al. 2004), sakasin P, pediosin PA-1, dan piskikolin 61 (Axelsson et al. 1998). Mustopa et al. (2013) telah mengisolasi gen penyandi plantarisin W dari L. plantarum S34, melakukan kloning plantarisin W ke vektor pGEM-T dan subkloning ke vektor ekspresi pET-32a serta diintroduksikan ke E. coli BL21(DE3) pLysS. Metode ekspresi optimum plantarisin W rekombinan belum diketahui terutama ekspresi plantarisin W rekombinan yang diisolasi dari isolat lokal potensial asal Indonesia. Oleh karena itu, perlu dilakukan penelitian mengenai optimasi ekspresi plantarisin W rekombinan serta mengevaluasi aktivitas inhibisinya terhadap Salmonella typhi.
Perumusan Masalah
Adanya kejadian resistansi Salmonella typhi terhadap antibiotik membutuhkan strategi lain untuk mengatasi demam tifoid tanpa menyebabkan resistansi pada Salmonella typhi. Plantarisin W rekombinan diharapkan dapat menjadi alternatif untuk mengatasi Salmonella typhi. Namun, studi ekspresi plantarisin W rekombinan belum diketahui. Oleh karena itu, penelitian mengenai optimasi ekspresi plantarisin W rekombinan serta aktivitas inhibisinya terhadap Salmonella typhi perlu dilakukan.
Tujuan Penelitian
3
Hipotesis
Plantarisin W rekombinan memiliki bobot molekul ± 33 kDa dapat diekspresikan di Escherichia coli. Ekspresi plantarisin W rekombinan dapat ditingkatkan dengan berbagai perlakuan optimasi. Selain itu, plantarisin W rekombinan dapat dimurnikan dengan teknik kromatografi afinitas dan memiliki aktivitas inhibisi terhadap Salmonella typhi.
2 METODE PENELITIAN
Waktu dan Tempat
Penelitian dilakukan pada Januari - November 2014 di Laboratorium Aplikasi Rekayasa Genetika dan Desain Protein, Pusat Penelitian Bioteknologi - LIPI, Cibinong.
Bahan
4
Alat
Adapun alat yang digunakan dalam penelitian ini adalah sebagai berikut sentrifus (Hermle), sonikator (Lab Sonic), elektroforator SDS PAGE (ATTO), shaker inkubator (N-Biotek Inc.), rotator (N-Biotek Inc.), set blotting (Bio Rad), inkubator (Firlabo), laminar air flow (ESCO), pH meter (Eutech Instruments), spektrofotometer UV-VIS (Gene Quant), microplate 96-well (Nunc), ELISA reader (Thermo multiscan ex), membran dialisis (MWCO 11 463, Sigma), mikropipet (Gilson), tip (Axygen), dan alat-alat gelas lainnya (Pyrex).
Prosedur Penelitian
Optimasi Ekspresi Plantarisin W (Birdsell dan Cota-Robles 1967, Utama et al. 2000)
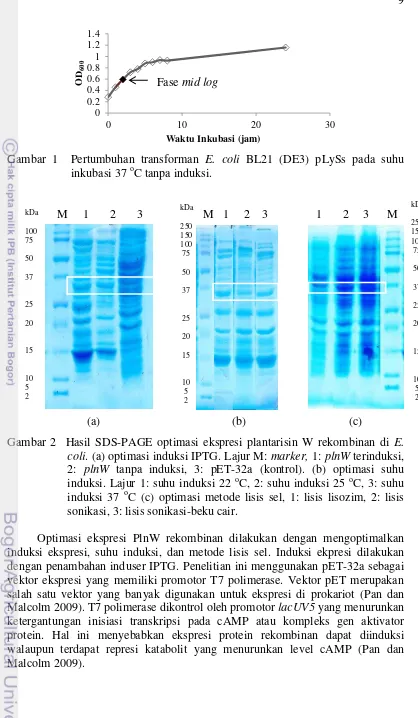
Metode ekspresi plantarisin W dilakukan berdasarkan Utama et al. (2000). Kultivasi dilakukan dengan menambahkan 10% kultur (starter) transforman E. coli BL21 (DE3) pLysS ke dalam 200 mL media luria bertani (LB) yang telah ditambahkan ampisilin 100 μg/mL. Kultur diinkubasi pada suhu 37 °C dengan goyangan 150 rpm, hingga OD600 mencapai fase mid log. Selanjutnya, ditambahkan 0.5 mM isopropil β-D-tio galaktopiranosida (IPTG) ke dalam kultur. Dilakukan optimasi suhu induksi yaitu pada suhu 20, 25, dan 37 °C. Inkubasi dilakukan selama 5 jam, dengan goyangan 150 rpm. Setelah OD600 mencapai 0.8-1, kultur disentrifugasi pada 8 000 g, suhu 4 °C, selama 10 menit. Supernatan dibuang, pelet disimpan pada suhu -20 °C. Optimasi pemecahan sel transforman E. coli BL21 (DE3) pLysS yang mengandung gen pln W dilakukan dengan beberapa metode yaitu, sonikasi, lisozim, dan kombinasi metode sonikasi-beku cair (freeze thaw). Pemecahan sel menggunakan lisozim dilakukan berdasarkan metode Birdsell dan Cota-Robles (1967). Pelet ditambahkan 10 mL bufer lisis lisozim (20 g/mL lisozim, 0.5 M sukrosa, 1 mM EDTA) dan diinkubasi selama 1 jam pada suhu 37 oC. Pemecahan sel dengan metode sonikasi dilakukan dengan meresuspensi pelet dalam 10 mL bufer B (Tris HCl 10 mM pH 8.5, NaCl 100 mM, dan Tween-20 0.25%), kemudian disonikasi dalam es dengan amplitudo 30 A, 0.5 siklus, detakan 15 detik dan interval satu menit. Siklus sonikasi diulang hingga visibilitas yang diinginkan tercapai. Pada pemecahan sel dengan kombinasi beku cair dan sonikasi, dilakukan tahapan beku-cair sebanyak tiga ulangan dengan masing-masing pengulangan 1 jam (30 menit pembekuan dan 30 menit pencairan). Selanjutya dilakukan tahapan lisis dengan metode sonikasi (Utama et al. 2000). Suspensi setelah perlakuan lisis sel disentrifugasi pada 17 000 g, 4 °C, selama 30 menit. Pelet (fraksi tidak larut) disolubilisasi, dan supernatan (fraksi terlarut) dimurnikan dengan kromatografi afinitas logam.
Solubilisasi Plantarisin W (Patra et al. 2000, Kohyama et al. 2010, Liu et al.
2011, Ningrum et al. 2011, Yamaguchi dan Miyazaki 2014)
5 Patra et al. (2000). Fraksi tidak larut dipisahkan dari fraksi terlarut dengan sentrifugasi 30 menit, 17 000 g, 4 oC. Pelet dicuci dengan bufer pencuci (50 mM Tris HCl pH 8, 100 mM NaCl, 2 M urea, dan 1% Triton X-100) kemudian disentrifus pada 17 000 g, 5 menit, 4 oC. Pencucian dilakukan sebanyak tiga kali (Liu et al. 2011). Pelet yang telah dicuci diresuspensi menggunakan bufer solubilisasi sebanyak 750 l untuk setiap 0.1 g pelet basah. Optimasi solubilisasi dilakukan dengan membandingkan aktivitas antibakteri hasil solubilisasi dari kedua bufer solubilisasi. Bufer solubilisasi I mengandung 2 M urea dan 100 mM Tris pH 12.5 (Patra et al. 2000), buffer solubilisasi II mengandung 8 M urea, 50 mM Tris HCl pH 8, dan 800 mM merkaptoetanol (Ningrum et al. 2011). Pelet diinkubasi ± 16 jam di rotator 4 oC. Kemudian disentrifus pada 17 000 g selama 15 menit 4 oC. Selanjutnya dilakukan dialisis secara bertahap (step wise dialysis) (Yamaguchi dan Miyazaki 2014; Kohyama et al. 2010). Dialisis pertama (removing denaturing agent) menggunakan bufer dialisis 1a (50 mM Tris HCl pH 8, 0.2 mM EDTA, 1 M urea), dilanjutkan dengan bufer dialisis 1b (50 mM Tris HCl pH 8, 0.2 mM EDTA, 0.5 M urea). Dialisis kedua (refolding) dengan bufer 2a (0.4 M urea, 0.2 mM EDTA, 50 mM Tris HCl pH 8, 0.25 mM merkaptoetanol) dan dilanjutkan dengan dialisis menggunakan bufer 2b (0.2 M urea, 0.2 mM EDTA, 50 mM Tris HCl pH 8, 0.25 mM merkaptoetanol, 1% gliserol) (Kohyama et al. 2010). Masing-masing tahapan dialisis dilakukan menggunakan kantung dialisis (MWCO ± 12 000 kDa) dalam 500 mL bufer dengan agitasi, suhu 4 oC selama 24 jam. Sebelum dilakukan dialisis, membran dialisis diberi perlakuan untuk menghilangkan logam yang terdapat pada membran dialisis. Membran dialisis didihkan dalam 1 mM EDTA selama 10 menit, kemudian membran dialisis dipanaskan kembali dalam akuades steril mendidih selama 10 menit.
Purifikasi Plantarisin W
Kromatografi Afinitas (Utama et al. 2000)
6
Elektroelusi Protein (Holifah 2012, Burgess 2009)
Plantarisin W rekombinan hasil solubilisasi diseparasi menggunakan elektroforesis SDS-PAGE preparatif dengan sampel tanpa perlakuan denaturasi (bufer loading non reducing non denaturing). Gel SDS-PAGE preparatif diwarnai dengan Commasie Brilliant Blue G-250 0.5%. Protein target yang terdapat pada gel SDS-PAGE preparatif dipotong menjadi bagian yang lebih kecil dan dimasukkan ke dalam membran dialisis yang telah mengandung bufer elektroelusi (25 mM Tris, 0.192 M glisin, 0.1% SDS). Gel yang mengandung protein dielusi dengan tegangan listrik 60 V hingga gel SDS-PAGE menjadi bening dan bufer dalam membran dialisis berwarna biru (Holifah 2012). Hasil elusi dipresipitasi dengan empat kali volume aseton dingin selama 30 menit dalam es. Aseton dan SDS yang tersisa dipisahkan dengan sentrifus 17 000 g selama 5 menit pada suhu 4 oC. Protein hasil presipitasi direnaturasi dengan 20 l 8 M urea dalam bufer dilusi (50 mM Tris pH 7.9, 20% gliserol, 0.1 mM EDTA, 1 mM DTT, 0.15 M NaCl, 0.1% SDS) selama 20 menit dalam suhu ruang, kemudian protein tersolubilisasi diencerkan 10 kali dengan menambahkan bufer dilusi dan diinkubasi selama 1 jam di suhu ruang (Burgess 2009).
Pemotongan Fusi Protein (Gasparian et al. 2011)
Plantarisin W rekombinan yang telah dimurnikan dipotong fusi proteinnya dengan menggunakan enzim enterokinase. Sebanyak 20 g protein ditambahkan dengan 3 l 10x bufer EKMaxTM, 1 unit enterokinase, dan ditambahkan ddH2O hingga 30 l. Inkubasi pemotongan enterokinase dilakukan selama ± 16 jam pada suhu 22 oC. Hasil pemotongan enterokinase dievaluasi dengan elektroforesis SDS-PAGE dan diwarnai dengan silver stain.
Karakterisasi Bobot Molekul dan Penentuan Konsentrasi Protein
Elektroforesis SDS-PAGE (Laemmli 1970)
7 yang telah difiksasi dicuci dengan etanol 10% selama 5 menit (2x) dan akuades steril 5 menit (2x). Gel ditingkatkan sensitifitasnya dengan larutan sensitizer selama 1 menit, kemudian gel dicuci 1 menit dengan akuades steril (2x). Pewarnaan dilakukan dengan merendam gel pada larutan stain selama 30 menit, kemudiaan dicuci selama 20 detik dengan akuades steril (2x). Gel direndam pada larutan developer hingga muncul pita. Setelah pita protein muncul, reaksi dihentikan dengan menambahkan asam asetat 5% selama 10 menit.
Penentuan Konsentrasi Protein (Pierce Biotechnology 2013)
Penentuan konsentrasi protein dilakukan secara kuantitatif menggunakan bicinchoninic acid (BCA) kit dengan BSA (bovine serum albumin) sebagai standar protein. Konsentrasi BSA yang digunakan sebagai standar yaitu 2000 g/ml, 1500 g/ml, 1000 g/ml, 750 g/ml, 500 g/ml, 250 g/ml, 125 g/ml, dan 25 g/ml. Working reaction dibuat dengan mencampurkan reagen A dan B (perbandingan 50:1). Selanjutnya sampel dan working reaction ditambahkan dalam microplate 96-well dengan perbandingan sampel:reagen (1:20). Microplate diinkubasi pada suhu 37 °C selama 30 menit, kemudian hasil reaksi dibaca pada panjang gelombang 540 nm dengan menggunakan ELISA reader.
Analisis Western Blot (Richard et al. 2004)
Western blot dilakukan untuk mendeteksi adanya protein target. Proses western blot dilakukan beberapa tahap, yaitu separasi sampel dengan elektroforesis PAGE tanpa pewarnaan gel, transfer protein pada gel SDS-PAGE ke membran nitroselulosa (blotting) selama semalaman. Blocking dengan merendam membran nitroselulosa dalam 5% susu skim. Probing dilakukan dengan menggunakan antibodi anti his yang telah dikonjugasi dengan horseradish peroxidase (HRP) (anti-his-HRP-Cterm) sehingga antibodi akan berikatan dengan protein yang mengandung his-tag. Sebanyak 3L antibodi ditambahkan pada 10 mL larutan blocking, kemudian ditambahkan pada membran nitroselulosa dan disimpan di rotator 4 oC semalaman. Deteksi dilakukan dengan menambahkan TMB (3,3’,5,5’-Tetramethylbenzidine) yang akan bereaksi dengan HRP dan memberikan perubahan warna pada pita yang mengandung his-tag.
Aktivitas Inhibisi (Arief et al. 2013, Davis dan Stout 1971, EUCAST 2003)
8
suhu 37 oC selama 18 jam. Aktivitas inhibisi ditunjukkan dengan adanya zona bening disekitar sumur. Penentuan daya aktivitas antibakteri dilakukan berdasarkan Davis dan Stout (1971). Aktivitas inhibisi secara kuantitatif dilakukan dengan metode uji mikrodilusi (EUCAST 2013). Isolat bakteri indikator ditumbuhkan dalam media NB (nutrient broth) suhu 37 oC selama ± 16 jam. Sebanyak 50 L sampel ditambahkan pada microplate yang telah mengandung 100 L suspensi bakteri (5 x 105 CFU mL-1), kemudian diinkubasi pada suhu 37 oC dengan kecepatan goyangan 150 rpm selama 24 jam. Setelah 24 jam, ditambahkan 50 l TBC (tetrazolium blue chloride) (0.025% (w/v) dalam bufer fosfat pH 7.2), kemudian diinkubasi pada suhu 37 oC selama 30 menit. Absorbansi dibaca pada panjang gelombang 540 nm. Rumus perhitungan persentase inhibisi adalah sebagai berikut,
inhibisi total patogen sampel
total patogen
Prosedur Analisis Data
Analisis statistik dilakukan terhadap hasil uji mikrodilusi inhibisi S. typhi dan S. aureus. Uji statistik dilakukan menggunakan rancangan acak lengkap (RAL), yaitu dengan uji Duncan pada tingkat kepercayaan 95 dan taraf α = 0.05.
3 HASIL DAN PEMBAHASAN
Optimasi Ekspresi Plantarisin W Rekombinan
Plantarisin W (PlnW) tersusun atas 135 asam amino dan protein mitra tersusun atas 165 asam amino sehingga protein fusi PlnW rekombinan diekspresikan dengan bobot molekul ± 33 kDa. Inang yang digunakan untuk mengekspresikan gen plantarisin W adalah E. coli BL21 (DE3) pLySs. E. coli sering digunakan sebagai inang untuk memproduksi protein rekombinan karena dapat ditumbuhkan dengan mudah, cepat dan ekonomis (Yuan dan Hua 2002). E. coli BL21 (DE3) pLySs merupakan strain E. coli mutan yang dapat mengekspresikan protein heterolog (Dumon-Seignovert et al. 2004). Menurut Pan dan Malcolm (2000), strain E. coli ini dapat mengekspresikan gen toksik dengan ekspresi yang konsisten, menurunkan ekspresi basal (tanpa induksi) dan meningkatkan stabilitas vektor dalam inang.
9
Gambar 1 Pertumbuhan transforman E. coli BL21 (DE3) pLySs pada suhu inkubasi 37 oC tanpa induksi.
(a) (b) (c)
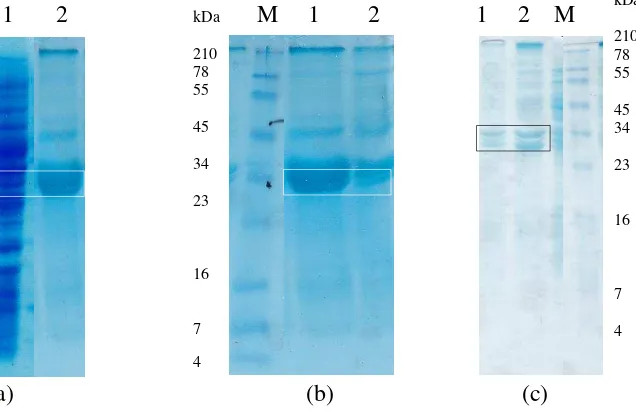
Gambar 2 Hasil SDS-PAGE optimasi ekspresi plantarisin W rekombinan di E. coli. (a) optimasi induksi IPTG. Lajur M: marker, 1: plnW terinduksi, 2: plnW tanpa induksi, 3: pET-32a (kontrol). (b) optimasi suhu induksi. Lajur 1: suhu induksi 22 oC, 2: suhu induksi 25 oC, 3: suhu induksi 37 oC (c) optimasi metode lisis sel, 1: lisis lisozim, 2: lisis sonikasi, 3: lisis sonikasi-beku cair.
10
Ekspresi PlnW rekombinan meningkat dengan induksi 0.5 mM IPTG dibandingkan dengan kultur yang tidak diinduksi (Gambar 2a). IPTG merupakan induser yang umum digunakan untuk sistem promoter tipe lac (Hansen et al. 1998). IPTG dapat meningkatkan ekspresi dengan berikatan secara langsung pada protein lac repressor sehingga transkripsi gen dapat berjalan (Weng et al. 2006). Penelitian ini menggunakan induksi IPTG dengan konsentrasi 0.5 mM. Hal ini sesuai dengan penelitian Yildrim et al. (2007) yang mengoptimalkan ekspresi diversin V41 rekombinan dengan induksi 0.5 mM IPTG. Selain itu, menurut Weng et al. (2012), konsentrasi IPTG harus sesuai (optimum) karena konsentrasi IPTG yang tinggi dapat menurunkan jumlah sel atau mengganggu pertumbuhan sel. Berdasarkan Gambar 2a diketahui plantarisin W rekombinan telah diekspresikan di E. coli dengan ukuran ± 33 kDa.
Optimasi suhu inkubasi setelah induksi dilakukan karena suhu merupakan salah satu faktor yang menentukan jumlah protein rekombinan yang dihasilkan. E. coli termasuk organisme mesofil yang dapat tumbuh pada suhu 20 oC – 45 oC (Goldstein 2007), sehingga optimasi suhu induksi dilakukan pada suhu 22, 25, dan 37 oC. Berdasarkan Gambar 2b, diketahui inkubasi pada suhu 22 oC meningkatkan ekspresi PlnW rekombinan. Menurut Weng et al. (2006), penurunan suhu induksi pada ekspresi komponen glutamat mutase-S rekombinan hingga 20 oC menghasilkan protein rekombinan tiga kali lipat lebih banyak dibandingkan dengan menggunakan suhu induksi 37 oC. Selain itu, menurut Peti dan Page (2007) serta Berrow et al. (2006), menyatakan bahwa ekspresi protein rekombinan lebih efektif dilakukan pada suhu rendah (hingga 17 oC) untuk meningkatkan solubilitas protein rekombinan yang dihasilkan.
Suhu 22 oC merupakan suhu inkubasi yang rendah untuk pertumbuhan E. coli. Suhu inkubasi rendah akan menurunkan laju sintesis protein, namun meningkatkan pelipatan protein dan menurunkan laju proteolisis, baik ATP-dependent maupun ATP-independent (Weng et al. 2006). Ekspresi PlnW rekombinan dengan inkubasi pada suhu 25 oC dan 37 oC menghasilkan PlnW rekombinan yang lebih rendah dibandingkan dengan inkubasi pada suhu 22 oC. Hal ini dapat terjadi karena laju proteolisis lebih tinggi dibandingkan dengan laju pelipatan protein sehingga menghasilkan rendemen yang rendah. Menurut Georgiou dan Valax (1996) pada suhu inkubasi 37 oC tidak ditemukan adanya Gro ES/EL, yaitu suatu caperon yang meningkatkan ekspresi protein dengan membantu pelipatan protein dan mencegah protein beragregasi selama refolding.
11 dan kavitasi. Selain itu, pengulangan siklus beku-cair dapat meningkatkan jumlah sel yang terlisis (Peti dan Page 2007).
Bufer yang digunakan untuk melisis sel merupakan bufer Tris yang mengandung Tween-20 dan garam. Umumnya bufer lisis mengandung garam berfungsi untuk menjaga osmolaritas lisat. Tween-20 merupakan deterjen non-ionik yang umum dipakai untuk solubilisasi protein membran. Deterjen non-non-ionik memiliki kemampuan untuk memutuskan interaksi antara lipid dan lipid-protein (Hansson 2012). Bufer lisis lisozim menggunakan sukrosa berkonsentrasi tinggi dan EDTA. Penambahan sukrosa dilakukan agar sel mengalami plasmolisis karena kejut osmosis (osmotic shock). Selain itu, EDTA berfungsi melemahkan membran luar sehingga menghasilkan rusaknya membran karena perbedaan tekanan di dalam dan di luar membran (Birdsell dan Cota-Robles 1967).
Plantarisin W Rekombinan Tersolubilisasi
Plantarisin W diekspresikan sebagai protein fusi dengan protein mitra tioredoksin-tag, S-tag, dan his-tag. Tioredoksin-tag (Trx-tag) merupakan oksido-reduktase yang dapat mereduksi ikatan disulfida melalui perubahan tio-disulfida. Trx-tag bersifat hidrofilik, sehingga memiliki solubilitas yang tinggi dalam sitoplasma E. coli dan stabil terhadap suhu (Young et al. 2012). S-tag merupakan fusi peptida yang tersusun atas empat residu kationik, tiga residu anionik, tiga residu polar tidak bermuatan, dan lima residu non polar. Komposisi residu asam amino tersebut membuat S-tag menjadi soluble (Terpe 2003). Sementara his-tag memiliki efek negatif terhadap solubilitas protein (Woestenenk et al. 2004).
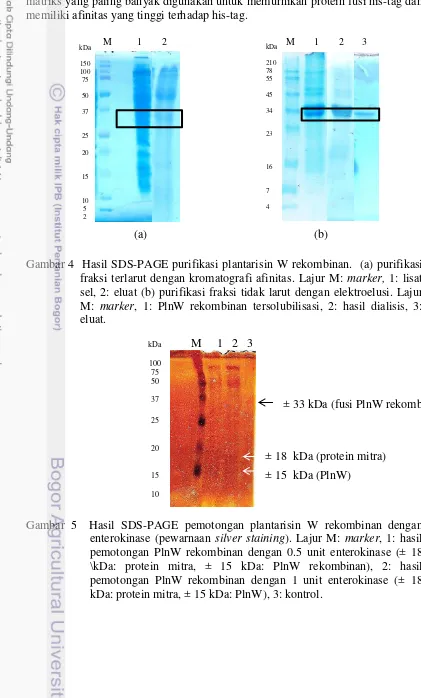
PlnW rekombinan memiliki fusi yang berfungsi meningkatkan solubilitas protein, akan tetapi berdasarkan hasil penelitian, PlnW rekombinan membentuk badan inklusi (Gambar 3a). Berdasarkan Gambar 3a, diketahui bahwa PlnW rekombinan lebih banyak terdapat pada fraksi tidak larut (pelet) dibandingkan dengan fraksi terlarut (lisat sel). Hal ini menunjukkan bahwa PlnW rekombinan diekspresikan dalam bentuk badan inklusi. Selain itu, terjadi overexpression pada fraksi tidak larut (pelet) yang ditunjukkan dengan adanya perbedaan pita PlnW rekombinan yang dihasilkan setelah induksi dengan 0.5 mM IPTG dan tanpa induksi (Gambar 3b). Terbentuknya badan inklusi juga dilaporkan pada ekspresi pediosin PA-1 (Liu et al. 2011), propionisin F (Balvir et al. 2012), dan pediosin CP2 (Brede et al. 2004) dalam vektor pET-32a.
Fraksi tidak larut merupakan badan inklusi yang terakumulasi dalam sel. Menurut Singh dan Panda (2005), ekspresi berlebih (overexpression) protein rekombinan di E.coli dapat menghasilkan pembentukan protein inaktif yang diakumulasikan dalam sel yang disebut badan inklusi (inclusion bodies). Protein dapat membentuk badan inklusi karena protein rekombinan tersebut bersifat toksik atau letal untuk sel inang, sehingga pembentukan badan inklusi merupakan metode ekspresi yang dapat dilakukan oleh inang (Clark 2001).
12
solubilisasi dengan bufer I memiliki kemurnian yang lebih baik dibandingkan dengan solubilisasi menggunakan bufer II (Gambar 3c).
Pemurnian protein merupakan tahap esensial pertama yang harus dilakukan untuk mempelajari fungsi protein (Berg et al. 2002), oleh karena itu bufer solubilisasi I digunakan untuk solubilisasi pada tahapan selanjutnya. Kemurnian solubilisasi dengan bufer II lebih rendah dibandingkan dengan solubilisasi menggunakan bufer solubilisasi I. Hal ini terjadi karena PlnW rekombinan membentuk agregat (polimer). Patra et al. (2000) melakukan optimasi solubilisasi menggunakan merkaptoetanol. Menurut Patra et al. (2000), solubilisasi pada pH alkali akan menghasilkan pembentukan dimer dan penambahan merkaptoetanol hanya memberikan efek yang kecil untuk disosiasi dimer menjadi monomer.
Protein tersolubilisasi akan menghasilkan monomolekular dispersi dan interaksi intra atau antar molekul yang minimum (Tsumoto et al. 2003). Protein tersolubilisasi tersebut memerlukan tahapan refolding untuk mengembalikan protein inaktif (unfolded) menjadi protein aktif (folded) dengan menghilangkan agen denaturan (Yamaguchi dan Miyazaki 2014). Agen denaturan yang digunakan dalam penelitian ini adalah urea. Urea merupakan protein destabilizer yang mereduksi interaksi molekul protein (Tsumoto et al. 2003).
Metode penghilangan agen denaturan dari protein terdenaturasi merupakan langkah penting untuk mengembalikan protein aktif (Yamaguchi dan Miyazaki 2014). Penelitian ini menggunakan metode step-wise dialysis untuk menghilangkan agen denaturan protein. Metode ini dilakukan dengan menurunkan konsentrasi urea secara bertahap. Hal ini dilakukan untuk menurunkan laju misfolding atau agregasi protein sehingga protein dapat melipat dengan benar (Tsumoto et al. 2003).
(a) (b) (c)
13 Bufer dialisis yang digunakan dalam penelitian ini mengandung EDTA untuk menangkap ion logam yang dapat menyebabkan reaksi oksidasi yang tidak diinginkan (Clark 1998). Selain itu, dalam bufer refolding terdapat merkaptoetanol yang berfungsi mengurangi interaksi ikatan disulfida intra- dan intermolekuler (Yamaguchi dan Miyazaki 2014). Gliserol yang digunakan pada tahap akhir dialisis berfungsi sebagai penstabil protein dengan meningkatkan interaksi hidrofobik pada pelarut dan protein (Yamaguchi dan Miyazaki 2014).
Plantarisin W Rekombinan Murni
Purifikasi PlnW rekombinan dilakukan pada fraksi terlarut (soluble) dan fraksi tidak larut (insoluble). Purifikasi fraksi terlarut dilakukan menggunakan kromatografi afinitas logam karena PlnW rekombinan mengandung fusi his-tag yang memiliki afinitas terhadap Ni2+-NTA atau Co2+-CMA. Penelitian ini menggunakan Co2+ sebagai ligan his-tag, karena bersifat lebih spesifik dibandingkan dengan Ni2+-NTA sehingga menghasilkan eluat yang lebih murni (Terpe 2003). Protein yang memiliki fusi his-tag akan berikatan dengan ligan pada tahapan binding dan protein non-spesifik akan terlepas dari ligan pada tahap pencucian. PlnW rekombinan dapat berikatan dengan resin Co2+, karena PlnW rekombinan bermuatan negatif pada saat binding. Hal ini disebabkan oleh kondisi binding yang dilakukan dalam keadaan alkali (pH 8.5). PlnW rekombinan memiliki titik isoelektrik teoritis 6.65, sehingga akan bermuatan negatif saat pH bufer > 6.65. Menurut Salgin et al. (2012), protein akan bermuatan negatif jika berada pada pH diatas titik isoelektriknya. Selain itu, untuk meningkatkan kemurnian hasil purifikasi ditambahkan Tween-20 dan garam pada bufer binding. Adanya Tween-20 dan garam berfungsi menghambat protein non spesifik berikatan pada resin dengan menurunkan interaksi hidrofobik pada matriks (Bornhorst dan Falke 2000).
Elusi dan pencucian protein dilakukan dengan imidazol. Imidazol berkonsentrasi rendah akan menghilangkan protein non spesifik yang berikatan lemah dengan resin, sehingga imidazol dalam konsentrasi rendah digunakan pada tahap pencucian. Sedangkan pada tahap elusi digunakan imidazol berkonsentrasi tinggi. Imidazol berkonsentrasi tinggi akan mengelusi protein yang memiliki polihistidin (Bornhorst dan Falke 2000). Imidazol merupakan analog histidin, sehingga dapat berkompetisi dengan his-tag untuk berikatan dengan resin (Litchy et al. 2005).
14
rekombinan dengan kemurnian yang lebih baik dibandingkan dengan hasil purifikasi PlnW rekombinan. Menurut Arnau et al. (2006), Ni2+-NTA merupakan matriks yang paling banyak digunakan untuk memurnikan protein fusi his-tag dan memiliki afinitas yang tinggi terhadap his-tag.
M 1 2 M 1 2 3
(a) (b)
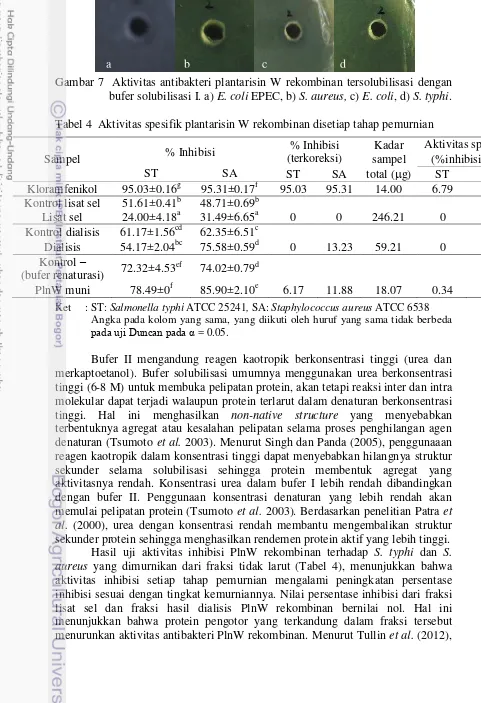
Gambar 4 Hasil SDS-PAGE purifikasi plantarisin W rekombinan. (a) purifikasi fraksi terlarut dengan kromatografi afinitas. Lajur M: marker, 1: lisat sel, 2: eluat (b) purifikasi fraksi tidak larut dengan elektroelusi. Lajur M: marker, 1: PlnW rekombinan tersolubilisasi, 2: hasil dialisis, 3: kDa: protein mitra, ± 15 kDa: PlnW), 3: kontrol.
kDa
± 33 kDa (fusi PlnW rekombinan)
15 Purifikasi yang dilakukan pada fraksi terlarut belum optimum berdasarkan kemurniannya, oleh karena itu purifikasi dilakukan pada fraksi tidak larut (insoluble) dengan elektroelusi. Fraksi tidak larut merupakan fraksi yang membentuk badan inklusi. Sebelum dilakukan elektroelusi, pemurnian badan inklusi dilakukan dengan pencucian (washing) menggunakan deterjen, garam konsentrasi rendah, dan urea. Hasil pencucian badan inklusi dapat dilihat pada Gambar 4a (lajur 1 dan 2). Gambar tersebut menunjukkan fraksi PlnW rekombinan yang cukup murni. Menurut Singh dan Panda (2005), pencucian badan inklusi dengan deterjen, garam konsentrasi rendah, dan urea dapat menghasilkan kemurnian hingga 95%. Selanjutnya, PlnW rekombinan (hasil solubilisasi dan refolding) dielusi dari gel untuk mendapatkan pita tunggal (PlnW rekombinan murni).
Hasil pemurnian PlnW rekombinan dengan elektroelusi dapat dilihat pada Gambar 4b (lajur 3). Berdasarkan Gambar 4b telah didapatkan PlnW rekombinan murni dengan ukuran ± 33 kDa. Penelitian ini menggunakan listrik (elektroelusi) untuk mengelusi PlnW rekombinan dari gel. Holifah (2012) mendapatkan protein rekombinan sukrosa transporter 1 murni dengan elektroelusi. Elektroelusi merupakan metode yang mudah dan cepat untuk pemurnian protein (Sa-Pereira et al. 2000). Pemekatan protein hasil elusi dari gel dilakukan menggunakan aseton. Aseton merupakan pelarut organik yang umum digunakan untuk memurnikan protein dengan menghilangkan SDS (Crowell et al. 2013). Renaturasi dilakukan dengan 8 M urea. Urea merupakan agen denaturan untuk solubilisasi protein (Tsumoto et al. 2003). Selanjutnya konsentrasi urea diturunkan dengan dilusi untuk membentuk struktur sekunder dan tersier protein (Hager dan Burgess 1980).
Protein fusi plantarisin W rekombinan memiliki situs pemotongan enterokinase. Situs ini berfungsi menghilangkan protein mitra yang difusikan dengan plantarisin W rekombinan. Hasil pemotongan PlnW rekombinan murni dengan enterokinase ditunjukkan pada Gambar 5. Setelah pemotongan dengan enterokinase, didapatkan pita yang yang berukuran 15 kDa dan 18 kDa. Pita yang berukuran ± 15 kDa merupakan PlnW rekombinan tanpa protein mitra, karena PlnW tersusun atas 135 residu asam amino. Sementara, pita yang berukuran 18 kDa merupakan ukuran protein mitra. Enterokinase merupakan protease yang mengenali DDDDK^X (AspAspAspAspLys^Xaa) dan memotong pada lisin karboksil. Efisiensi pemotongan dengan enterokinase bergantung pada residu asam amino di posisi X (Young et al. 2012).
HRP-16
conjugated goat anti-mouse IgG sebagai antibodi sekunder serta di dapat pita berukuran ± 26 kDa yang positif terwarnai.
Penentuan bobot molekul menggunakan elektroforesis poliakrilamid gel dengan adanya sodium dodesil sulfat (SDS) merupakan metode yang umum digunakan dalam penelitian biomedis. Teknik ini membutuhkan adanya perlakuan SDS pada protein sampel untuk memberikan bentuk dan muatan yang ekuivalen antar protein (Rath et al. 2009). Visualisasi gel SDS-PAGE dilakukan menggunakan commasie blue. Commasie blue merupakan pewarna organik yang dapat berikatan dengan protein. Satu mg protein dapat berikatan dengan 1.4 mg commasie blue G-250. Commasie dapat berikatan secara ionik maupun berinteraksi hidrofobik dengan molekul protein. Molekul commasie dapat membentuk agregat dengan residu Lys, His, dan Arg sehingga intensitas warna yang dihasilkan sebanding dengan jumlah residu asam amino tersebut (Candiano et al. 2004).
Western blot digunakan untuk mengonfirmasi ekspresi PlnW rekombinan. Western blot merupakan metode immunoblotting yang menggunakan prinsip pengikatan antibodi dengan antigen, sehingga dengan menggunakan western blot dapat diketahui protein spesifik dari campuran kompleks protein (Mahmood dan Yang 2012). Western blot memiliki tiga langkah utama yaitu, pemisahan berdasarkan ukuran menggunakan elektroforesis SDS-PAGE, transfer ke media penyangga padat (membran nitroselulosa), menandai protein target dengan menggunakan antibodi primer, dan antibodi sekunder untuk visualisasi (Mahmood dan Yang 2012).
1 M 2 M
Gambar 6 Hasil western blot plantarisin W rekombinan ( membran nitroselulosa dan gel SDS-PAGE). Lajur 1: Solubilisasi PlnW rekombinan (membran nitroselulosa), M: marker, 2: solubilisasi PlnW rekombinan (gel SDS-PAGE), M: marker.
Tabel 1 Konsentrasi protein setiap tahapan pemurnian plantarisin W dari fraksi tidak larut
Sampel Protein total (g) Rendemen tahapan (%) Rendemen total (%)
Lisat sel 61553.33 - -
Pelet 9466.44 100.00 100.00
Hasil dialisis 5920.93 62.55 62.55
PlnW murni 1605.94 27.12 16.96
kDa
78 55 45
34
23
16
7
17 Konsentrasi protein dan rendemen PlnW rekombinan dari setiap tahap pemurnian dapat dilihat pada Tabel 1. Fraksi yang dimurnikan hingga didapatkan pita tunggal berasal dari fraksi tidak larut, sehingga rendemen total merupakan rasio kadar protein setiap tahapan dibandingkan dengan pelet dan rendemen tahapan merupakan rasio kadar protein sampel dibandingkan dengan kadar protein pada tahapan sebelumnya (Patra et al. 2000). Berdasarkan Tabel 1 diketahui PlnW rekombinan murni menghasilkan rendemen total 17%. Sá-Pereira et al. (2000) memurnikan xilanase ekstraseluler menggunakan elektroelusi dan mendapatkan xilanase ekstraseluler murni dengan rendemen 0.5%. Perbedaan rendemen yang dihasilkan dapat disebabkan oleh adanya perlakuan renaturasi terhadap PlnW rekombinan untuk mengembalikan struktur protein setelah elektroelusi. Konsentrasi protein PlnW murni yang didapatkan adalah sebesar 8 mg PlnW rekombinan murni untuk setiap 1L kultur. Ningrum et al. (2011) mendapatkan 28.85 mg interferon manusia 2b rekombinan tersolubilisasi dari 1L kultur. Hasil yang didapat pada penelitian ini lebih kecil dibandingkan dengan penelitian Ningrum et al. (2011). Hal ini disebabkan oleh rendahnya recovery dari hasil elusi gel. Menurut Hager dan Burgess (1980), hasil renaturasi menggunakan urea setelah elusi dari gel hanya menghasilkan 18% protein yang terenaturasi.
Konsentrasi protein ditentukan dengan uji asam bicinchoninat (BCA-bicinchoninic acid assay). BCA merupakan metode yang banyak digunakan untuk menentukan konsentrasi protein karena mudah digunakan, sensitifitasnya tinggi, dan toleran terhadap senyawa pengganggu. Uji ini didasarkan pada dua reaksi kimia. Reaksi pertama adalah reduksi ion Cu2+ menjadi ion Cu+ oleh ikatan peptida dalam kondisi alkali (reaksi biuret). Reaksi kedua adalah satu ion Cu+ dikelat dengan dua molekul BCA sehingga menghasilkan kompleks warna yang berwarna ungu (Huang 2010).
Aktivitas Inhibisi
Penentuan aktivitas inhibisi terhadap hasil pemurnian fraksi terlarut dilakukan dengan metode difusi agar (Arief et al. 2013) dan evaluasi aktivitas PlnW rekombinan yang telah murni digunakan microdillution assay berdasarkan EUCAST (2003). Strain indikator yang digunakan adalah Salmonella typhi ATCC 25241 (Gram negatif), sedangkan Staphylococcus aureus ATCC 6538 (Gram positif) digunakan sebagai strain pembanding, serta EPEC K.1.1 dan E. coli NBRC 14237 digunakan untuk skrining aktivitas antibakteri dari fraksi tidak larut. Berbagai strain indikator tersebut digunakan karena bakteri tersebut merupakan patogen yang menginfeksi saluran pencernaan dan ditransmisikan melalu air maupun makanan (WHO 2008).
18
bening 5 mm. Hal ini sesuai dengan penelitian Holo et al. (2001) yang menyatakan bahwa plantarisin memiliki aktivitas antimikroba yang lemah, namun memiliki aktivitas terhadap berbagai strain Gram positif. Plantarisin W merupakan lantibiotik kelas A yang berbentuk peptida panjang dan bermuatan positif. Peptida ini membunuh sel target dengan membentuk pori untuk meningkatkan permeabilitas membran (Holo et al. 2001).
Pemurnian dari fraksi tidak larut diawali dengan tahapan solubilisasi. Solubilisasi bertujuan memperbaiki pelipatan protein sehingga protein memiliki aktivitas fungsionalnya. Penelitian ini mengevaluasi dua bufer solubilisasi yaitu, bufer yang mengandung urea berkonsentrasi rendah dalam tinggi alkali (bufer I) dan bufer dengan urea berkonsentrasi tinggi dengan kondisi alkali sedang. Evaluasi aktivitas antibakteri hasil solubilisasi dengan kedua bufer dilakukan secara kualitatif menggunakan metode difusi agar dengan beberapa strain indikator. Aktivitas antibakteri dari hasil solubilisasi dengan kedua buffer dapat dilihat pada Tabel 3 dan Gambar 7. Berdasarkan Tabel 3 dan Gambar 7 diketahui bahwa solubilisasi dengan bufer I memiliki aktivitas antibakteri terhadap beberapa strain bakteri Gram positif dan Gram negatif, sementara pada solubilisasi dengan bufer II tidak menunjukkan adanya aktivitas antibakteri.
Tabel 2 Aktivitas inhibisi plantarisin W rekombinan hasil pemurnian fraksi terlarut terhadap S. typhi dan S. aureus
Strain indikator Sampel Zona Bening & Kategori Daya
Hambat Gambar
Tabel 3 Aktivitas antibakteri plantarisin W rekombinan tersolubilisasi
Strain Indikator Gram Escherichia coli NBRC 14237 Salmonella typhi ATCC 25241
19
Gambar 7 Aktivitas antibakteri plantarisin W rekombinan tersolubilisasi dengan bufer solubilisasi I. a) E. coli EPEC, b) S. aureus, c) E. coli, d) S. typhi. Tabel 4 Aktivitas spesifik plantarisin W rekombinan disetiap tahap pemurnian
Sampel % Inhibisi
% Inhibisi (terkoreksi)
Kadar sampel total (g)
Aktivitas spesifik (%inhibisi/g)
ST SA ST SA ST SA
Kloramfenikol 95.03±0.16g 95.31±0.17f 95.03 95.31 14.00 6.79 6.81 Kontrol lisat sel 51.61±0.41b 48.71±0.69b
Lisat sel 24.00±4.18a 31.49±6.65a 0 0 246.21 0 0
Kontrol dialisis 61.17±1.56cd 62.35±6.51c
Dialisis 54.17±2.04bc 75.58±0.59d 0 13.23 59.21 0 0.22 Kontrol –
(bufer renaturasi) 72.32±4.53 ef
74.02±0.79d
PlnW muni 78.49±0f 85.90±2.10e 6.17 11.88 18.07 0.34 0.66
Ket : ST: Salmonella typhi ATCC 25241, SA: Staphylococcus aureus ATCC 6538 Angka pada kolom yang sama, yang diikuti oleh huruf yang sama tidak berbeda
pada uji Duncan pada α = 0.05.
Bufer II mengandung reagen kaotropik berkonsentrasi tinggi (urea dan merkaptoetanol). Bufer solubilisasi umumnya menggunakan urea berkonsentrasi tinggi (6-8 M) untuk membuka pelipatan protein, akan tetapi reaksi inter dan intra molekular dapat terjadi walaupun protein terlarut dalam denaturan berkonsentrasi tinggi. Hal ini menghasilkan non-native structure yang menyebabkan terbentuknya agregat atau kesalahan pelipatan selama proses penghilangan agen denaturan (Tsumoto et al. 2003). Menurut Singh dan Panda (2005), penggunaaan reagen kaotropik dalam konsentrasi tinggi dapat menyebabkan hilangnya struktur sekunder selama solubilisasi sehingga protein membentuk agregat yang aktivitasnya rendah. Konsentrasi urea dalam bufer I lebih rendah dibandingkan dengan bufer II. Penggunaan konsentrasi denaturan yang lebih rendah akan memulai pelipatan protein (Tsumoto et al. 2003). Berdasarkan penelitian Patra et al. (2000), urea dengan konsentrasi rendah membantu mengembalikan struktur sekunder protein sehingga menghasilkan rendemen protein aktif yang lebih tinggi.
Hasil uji aktivitas inhibisi PlnW rekombinan terhadap S. typhi dan S. aureus yang dimurnikan dari fraksi tidak larut (Tabel 4), menunjukkan bahwa aktivitas inhibisi setiap tahap pemurnian mengalami peningkatan persentase inhibisi sesuai dengan tingkat kemurniannya. Nilai persentase inhibisi dari fraksi lisat sel dan fraksi hasil dialisis PlnW rekombinan bernilai nol. Hal ini menunjukkan bahwa protein pengotor yang terkandung dalam fraksi tersebut menurunkan aktivitas antibakteri PlnW rekombinan. Menurut Tullin et al. (2012),
20
protein pengotor tersebut merupakan endotoksin dari sel inang dan menyebabkan protein rekombinan tidak memiliki aktivitas.
Berdasarkan Tabel 4, PlnW rekombinan murni memiliki aktivitas inhibisi terhadap S. typhi dan S. aureus. Namun, hasil analisis statistik menunjukkan fraksi protein tersebut tidak memiliki aktivitas terhadap S. typhi karena aktivitasnya tidak berbeda nyata dengan kontrol (p>0.05). PlnW rekombinan yang dimurnikan dari fraksi terlarut memiliki aktivitas terhadap S. typhi (Tabel 2), akan tetapi kehilangan aktivitasnya ketika dimurnikan dari fraksi tidak larut (Tabel 4). Hal ini disebabkan oleh perlakuan solubilisasi yang merusak bentuk pelipatan protein (Tsumoto et al. 2003).
Aktivitas spesifik PlnW rekombinan merupakan aktivitas inhibisi per g protein (Tabel 4). PlnW rekombinan murni memiliki aktivitas spesifik sebesar 0.34%/g protein terhadap S. typhi dan 0.66%/g protein terhadap S. aureus. Aktivitas antibakteri PlnW rekombinan lebih tinggi terhadap S. aureus dibandingkan dengan S. typhi. Gen plantarisin W yang diekspresikan berasal dari Lactobacillus plantarum (Gram positif) dan plantarisin W termasuk kedalam bakteriosin. Menurut Sang dan Blecha (2008), bakteriosin berfungsi menekan spesies competitor. Sehingga PlnW rekombinan memiliki aktivitas inhibisi terhadap S. aureus yang merupakan bakteri Gram positif.
Penelitian ini menggunakan kloramfenikol sebagai kontrol positif. Kloramfenikol merupakan salah satu antibiotik yang umum digunakan untuk mengatasi demam tifoid (WHO 2003). Kloramfenikol merupakan inhibitor kuat biosintesis protein bakteri dan sangat spesifik, serta memiliki aktivitas bakteriostatik karena dapat berikatan secara reversibel dengan pusat peptidiltransferase pada subunit 50S ribosom (Schwarz et al. 2004). Rendahnya aktivitas plantarisin W rekombinan dapat terjadi karena protein yang diisolasi merupakan protein hasil solubilisasi (telah kehilangan konformasi protein) dan menghasilkan recovery yang rendah selama pelipatan (refolding) sehingga protein kehilangan aktivitasnya (Tsumoto et al. 2003).
4 SIMPULAN DAN SARAN
Simpulan
Rekombinan plantarisin W telah diekspresikan di E. coli dengan ukuran ±33 kDa dan membentuk badan inklusi. PlnW rekombinan murni didapatkan dari fraksi tidak larut menggunakan elusi dari gel dan menghasilkan 8 mg protein/L kultur dengan rendemen 17%. Kondisi optimum ekspresi PlnW rekombinan yaitu, suhu induksi 22 oC, konsentrasi induser 0.5 mM IPTG, menggunakan metode lisis beku-cair dan sonikasi serta solubilisasi dengan 2 M urea pH 12.5. PlnW rekombinan yang dimurnikan dari fraksi terlarut memiliki aktivitas inhibisi terhadap S. typhi dan S. aureus, sedangkan PlnW rekombinan yang dimurnikan dari fraksi tidak terlarut hanya memiliki aktivitas inhibisi terhadap S. aureus.
Saran
Perlu dilakukan karakterisasi (tingkat keasaman, suhu pengujian, dapar) plantarisin W rekombinan sebelum uji aktivitas antibakteri agar diketahui kondisi optimum atau kondisi aktif plantarisin W. Selain itu, plantarisin W perlu diekspresikan dalam inang yang lebih aman, seperti bakteri asam laktat agar dapat diaplikasikan dalam bidang pangan maupun medis.
5 DAFTAR PUSTAKA
Abd AKH, Raghif ARA, Al Azzawi ANF. 2011. The effect of EDTA with single or combination of antibiotics on Pseudomonas aeruginosa isolates in vitro. Iraqi J Med Sci. 9(3):285-291.
Arief I, Jakaria, Suryati T, Wulandari Z, Andreas E. 2013. Isolation and characterization of plantaricin produced by Lactobacillus plantarum strains (IIA-1A5, IIA-1B1, IIA-2B2). Media Petern. 36(2):91-100.doi:10.5398/ medpet.2013.36.2.91.
Arnau J, Lauritzen C, Petersen GE, Pedersen J. 2006. Current strategies for the use of affinity tags and tag removal for the purification of recombinant protein [ulas balik]. Protein Express Purif. 48:1-13.doi:10.1016/j.pep. 2005.12.002.
Axelsson L, Katla T, Bjørnslett M, Eijsink VGH, Holck A. 1998. A system for heterologous expression of bacteriocins in Lactobacillus sake. FEMS Microbiol Lett. 168:137-143.doi:10.1016/S0378-1097(98)00431-5.
22
Berg JM, Tymoczko JL, Stryer L. 2002. The Purification of Proteins Is an Essential First Step in Understanding Their Function. Ed ke-5. New York (US): W H Freeman.
Berrow NS, Bussow K, Coutard B, Diprose J, Ekberg M, Folkers GE, Levy N, Lieu V, Owens RJ, Peleg Y et al. 2006. Recombinant protein expression and solubility screening in Escherichia coli: a comparative study. Acta Cryst. D62:1218-1226.doi:10.1107/S0907444906031337.
Bhan MK, Rajiv B, Shinjini B. 2005. Typhoid and paratyphoid fever [ulas balik]. Lancet 366:749-762.doi:10.1016/s0140-6736(05)67181-4.
Birdsell DC, Cota-Robles EH. 1967. Production and ultrastructure of lysozyme and ethylenediaminetetraacetate-lysozyme spheroplasts of Escherichia coli. J Bacteriol. 93(1):427-437.
Bornhorst JA, Falke JJ. 2000. Purification of proteins using polyhistidine affinity tags. Methods Enzymol. 326:245-254.
Brede DA, Faye T, Johnsborg O, Ødegård I, Nes IF, Holo H. 2004. Molecular and genetic characterization of propionicin F, a bacteriocin from Propionibacterium freudenreichii. Appl Environ Microbiol. 70(12):7303-7310.doi:10.1128/AEM.70.12.7303-7310.2004.
Burgess RR. 2009. Elution of protein from gels. Di dalam: Burgess RR, Deutscher MP, editor. Methods in Enzymology. Guide to Protein Purification. Ed ke-2. Volume 463. San Diego (US): Elsevier. hlm 565-572.
Candiano G, Bruschi M, Musante L, Santucci L, Ghiggeri GM, Carnemolla B, Orrechia P, Zardi L, Righetti PG. Blue silver: a very sensitive colloidal commasie G-250 staining for proteome analysis. Electrophoresis. 25:1327-1333.doi:10.1002/elps.200305844.
Clark EB. 2001. Protein refolding for industrial processes. Curr Opin Biotechnol. 12:202-207.doi:10.1016/s0958-1669(00)00200-7.
Clark EB. 1998. Refolding of recombinant proteins. Curr Opin Biotechnol. 9:157-163.doi:10.1016/s0958-1669(98)80109-2.
Conlon JM. Demandt A, Nielsen PF, Leprince J, Vaudry H, Woodhams DC. 2009. The alyteserins: two families of antimicrobial peptides from the skin secretions of the midwife toad Alytes obstetricans (Alytidae). Peptides. 30:1069-1073.doi:10.1016/j.peptides.2009.03.004.
Cotter PD, Hill C, Ross RP. 2005. Bacteriocins: developing innate immunity for food [ulas balik]. Nat Rev Microbiol. 3:777-788.doi:10.1038/nrmicro1240. Crowell AMJ, Wall MJ, Doucette AA. 2013. Maximizing recovery of water-
soluble proteins through acetone precipitation. Anal Chim Acta. 796:48-54. doi:10.1016/j.aca.2013.08.005.
Crump JA, Luby SP, Mintz ED. 2004. The global burden of typhoid fever. Bull World Health Organ. 82(5): 346-353.
Davis WW, Stout TR. 1971. Disc plate method of microbiological antibiotic assay. J Appl Microbiol. 22(4):659-665.
23 [EUCAST] European Committee for Antimicrobial Susceptibility Testing. 2003. Determination of minimum inhibitory concentration (MICs) of antibacterial agents by broth dilution. CMI. 9(8):1-7.
Gasparian ME, Bychkov ML, Dolgikh DA, Kirpichnikov MP. 2011. Strategy for improvement of enteropeptidase efficiency in tag removal processes. Protein Express Purif. 79:191-196.doi:10.1016/j.pep.2011.04.005.
Georgiou G, Valax P. 1996. Expression of correctly folded proteins in Escherichia coli. Curr Opin Biotechnol. 7:190-197.doi:10.1016/S0958-1669(96)80012-7.
Gibbs GM, Davidson BE, Hillier AJ. 2004. Novel expression system for large-scale production and purification of recombinant class IIa bacteriocins and its application to piscicolin 126. Appl Environ Microbiol. 70(6):3292-3297. doi:10.1128/AEM.70.6.3292–3297.2004.
Goldstein RA. 2007. Amino-acid interaction in psychrophiles, mesophiles, thermophiles, and hyperthermophiles: insight from the quasi-chemical approximation. Prot Sci. 16:1887-1895.doi:10.1110/ps.072947007.
Gong HS, Meng XC, Wang H. 2010. Plantaricin MG active against Gram-negative bacteria produced by Lactobacillus plantarum KLDS1.0391 isolated from “Jiaoke”, a traditional fermented cream from China. Food Cont. 21:89-96.doi:10.1016/j.foodcont.2009.04.005.
Hager DA, Burgess RR. 1980. Elution of proteins from sodium dodecyl sulfate- polyacrylamide gels, removal of sodium dodecyl sulfate, and renaturation of enzymatic activity: result with sigma subunit of Escherichia coli RNA polymerase, wheat germ DNA topoisimerase, and other enzymes. Anal Biochem. 109:76-86.
Hansen LH, Knudsen S, Sorensen SJ. 1998. The effect of the lacY gene on the induction of IPTG inducible promoters, studied in Escherichia coli and Pseudomonas fluorescens. Curr Microbiol. 36:341-347.doi:10.1007/s00284 9900320.
Hansson J. 2012. Microfluidic blood sample preparation for rapid sepsis diagnostic [disertasi]. Stockholm (SE): KTH Albanova University Centre. Heu S, Oh J, Kang Y, Ryu S, Cho SK, Cho Y, Cho M. 2001. gly gene cloning and
expression purification of glycenin A, a bacteriocin produced by Xanthomonas campestris pv. glycines 8ra. Appl Environ Microbiol. 67(9):4105-4110.doi:10.1128/AEM.67.9.4105–4110.2001.
Holifah N. 2012. Pembuatan antibodi poliklonal protein sucrose transporter menggunakan antigen protein rekombinan SUT1 dari tanaman tebu (Saccharum officinarum L.) [skripsi]. Jember (ID): Universitas Jember. Holo H, Jeknic Z, Daeschel M, Stevanovic S, Nes IF. 2001. Plantaricin W from
Lactobacillus plantarum belongs to a new family of two-peptide lantibiotics. Microbiology. 147:643-651.
Huang T, Long M, Huo B. 2010. Competitive binding to cuprous ions of protein and BCA in the bicinchoninic acid protein assay. Open Biomed Eng J. 4:271-278.doi:10.2174/1874120701004010271.
24
Kohyama K, Matsumoto T, Imoto T. 2010. Refolding of an unstable lysozyme by gradient removal of a solubilizer and gradient addition of a stabilizer. J Biochem. 147(3):427-431.doi:10.1093/jb/mvp184.
Kumar R, Xiavour S, Latha S, Kumar V, Sukumaran. 2014. Anti-human IgG-horseradish peroxidase conjugate preparation and its use in ELISA and western blotting experiments. J Chromatograph Separat Techniq. 5(1):211-231.doi:10.4172/2157-7064.1000211.
Laemmli UK. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage. J Biol Chem. 270:680-685.doi:10.1038/227680a0. Litchy JJ, Malecki JL, Agnew HD, Horowitz DJM, Tan S. 2005. Comparison of
affinity tags for protein purification. Protein Express Purif. 41:98-105.doi: 10.1016/j.pep.2005.01.019.
Liu S, Han Y, Zhou Z. 2011. Fusion expression of pedA gene to obtain biologically active pediocin PA-1 in Escherichia coli. J Zhejiang Univ-Sci B. 12(1):65-71.doi:10.1631/jzus.B1000152.
Ma J. Pascal MW, Paul C. 2003. The production of recombinant pharmaceutical proteins in plants [ulas balik]. Nature. 4:794-805.doi:10.1038/nrg1177.
Mahmood T, Yang PC. 2012. Western blot: techniques, theory, and trouble shooting. N Am J Med Sci. 4(9):429-434.doi:10.4103/1947-2714.100998. Mustopa AZ, Balia R, Putranto WS, Ridwan M, Solehudin M. 2010. Penapisan
bakteri asam laktat yang diisolasi dari bekasem daging sapi dalam menghasilkan bacteriosin untuk menghambat bakteri patogen. Di dalam: Hernaman I, Tanuwiria UH, Hendronoto A, Yurmiati LH, Sulistyati M, Hidayati YA, Herlina L, Indrijani H, Sujana E, Putranto WS, Islami RZ, Widiawati Y, Sofjan O, Syamsul JA, editor. Sistem Produksi Berbasis Ekosistem Lokal. Seminar Nasional Peternakan Berkelanjutan; 2010 November 4; Bandung, Indonesia. Bandung (ID): Universitas Padjajaran. hlm 679-685.
Mustopa AZ, Hasim, Sukmarini L, Umami RN. 2012. Karakterisasi dan Produksi Rekombinan Plantaricin Asal Lactobacillus plantarum S34 untuk Inhibisi Salmonella typhi sebagai Alternatif Penanggulangan Penyakit Demam Tifoid. Laporan Teknik. Bogor (ID): LIPI.
Mustopa AZ, Hasim, Sukmarini L, Umami RN. 2013. Karakterisasi dan Produksi Rekombinan Plantaricin Asal Lactobacillus plantarum S34 untuk Inhibisi Salmonella typhi sebagai Alternatif Penanggulangan Penyakit Demam Tifoid. Laporan Teknik. Bogor (ID): LIPI.
Ningrum RA, Debbie SR, Yeyet C, Heni R. 2011. Optimization of human interferon 2b soluble protein overproduction and primary recovery of its inclusion bodies. Microbiol Indones. 5:27-32.doi:10.5454/mi.5.1.5.
Ochiai RL, Acosta CJ, Danovaro-Holliday MC, Bhattacharya, Agtini MD, Bhutta ZA, Canh DG, Ali M, Shin S, Wain J et al. 2008. A study of typhoid fever in five Asian countries: disease burden and implications for controls. Bull World Health Organ. 86(4):260-268.doi:10.2471/BLT.06.039818.
25 Pal G, Srivastava S. 2013. Cloning and heterologous expression of plnE, -F, -J and –K genes derived from soil metagenome and purification of active plantaricin peptides. Appl Microbiol Biotechnol. 98:1441–1447.doi:10. 1007/s00253-013-5097-1.
Pan S, Malcolm BA. 2000. Reduced background expression and improved plasmid stability with pET vectors in BL21 (DE3). BioTechniques. 29(6):1234-1238.
Patra AK, Mukhopadhyay R, Mukhija R, Krishnan A, Garg LC, Panda AK. 2000. Optimization of inclusion body solubilization and renaturation of recombinant human growth hormone from Escherichia coli. Protein Express Purif. 18(2):182-192.doi:10.1006/prep.1999.1179.
Peti W, Page R. 2007. Strategies to maximize heterologous protein expression in Escherichia coli with minimal cost [ulas balik]. Protein Express Purif. 51:1-10.doi:10.1016/j.pep.2006.06.024.
Pierce Biotechnology. 2013. PierceTMBCA Protein Assay Kit. Rockford (US): Thermo Fisher Scientific.
Rath A, Glibowicka M, Nadeau VG, Chen G, Deber CM. 2009. Detergent binding explains anomalous SDS-PAGE migration of membrane protein. PNAS. 106(6):1760-1765.doi:10.1073/pnas.0813167106.
Richard C, Drider D, Elmorjani K, Marion D, Prevost H. 2004. Heterologous expression and purification af active divercin V41, a class IIa bacteriocin encoded by a synthetic gene in Escherichia coli. J Bacteriol. 186(13):4276-4284.doi:10.1128/JB.186.13.4276–4284.2004.
Sa-Pereira PS, Duarte J, Costa-Ferreira M. 2000. Electroelution as a simple and fast protein purification method: isolation of an extracellular xylanase from Bacillus sp. CCMI 966. Enzyme Microb Technol. 27:95-99.doi:10.1016/ s0141-0229(00)00185-x.
Salgin S, Salgin U, Bahadir S. 2012. Zeta potentials and isoelectric points of biomolecules: the effect of ion types and ionic strengths. Int. J. Electrochem. Sci. 7:12404-12414.
Sang Y, Blecha F. 2008. Antimicrobial peptides and bacteriocins: alternatives to traditional antibiotics [ulas balik]. Anim Health Res Rev. 9(2):227-235.doi: 10.1017/S1466252308001497.
Schwarz S, Kehrenberg C, Doublet B, Cloeckaert A. 2004. Molecular basis of baterial resistance to chloramphenicol and florfenicol [ulas balik]. FEMS Microbiol Rev. 28:519-542.doi:10.1016/j.femsre.2004.04.001.
Simoes M, Simoes LC, Pereira OM, Vieira MJ. 2008. Sodium dodecyl sulfate allows the persistance and recovery of biofilms of Pseudomonas fluorescens formed under different hydrodynamic conditions. Biofouling 24(1):35-44. doi:10.1080/08927010701730311.
Singh SM dan Panda AK. 2005. Solubilization and refolding bacterial inclusion body proteins [ulas balik]. J Biosci Bioeng. 99(4):303-310.doi:10.1263/jbb. 99.303.