DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
2014
INDRA WIRIANTO
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
KULTUR BIJI Amorphophallus decus-silvae PADA BEBERAPA KOMBINASI SITOKININ DAN AUKSIN SECARA IN VITRO
Dengan ini saya menyatakan bahwa skripsi berjudul Kultur Biji Amorphophallus decus-silvae pada Beberapa Kombinasi Sitokinin dan Auksin Secara In Vitro adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2014
ABSTRAK
Penelitian ini bertujuan untuk mempelajari komposisi zat pengatur tumbuh yang sesuai untuk kultur biji dan pertumbuhan tunas mikro Amorphophallus decus-silvae. Rancangan yang digunakan adalah RAL satu faktor dengan 9 taraf komposisi media dengan 0.5 MS + B5 sebagai dasar. Setiap perlakuan terdiri dari 20 ulangan, masing-masing ulangan terdiri atas 1 botol kultur yang ditanami satu eksplan, sehingga terdapat total 180 satuan amatan. Eksplan yang digunakan yakni biji Amorphophallus decus-silvae berumur 3-4 minggu setelah antesis. Sterilisasi biji dengan perendaman dalam larutan antiseptik selama 1 menit, dilanjutkan dengan larutan pemutih 15% selama 15 menit menghasilkan 81.67% eksplan steril. Persentase eksplan biji yang berkecambah mencapai 94.1% pada media 2 ppm BAP + 0.1 ppm IBA. Media terbaik pada kultur biji Amorphophallus decus-silvae yakni 2 ppm BAP + 0.1 ppm IBA menghasilkan rata-rata tunas 10.3 (pada eksplan bagian atas) dan 7.3 (pada eksplan bagian bawah) pada 18 minggu setelah tanam. Pada minggu ke 28 total tunas mikro yang dihasilkan dari media 2 ppm BAP + 0.1 ppm IBA sebanyak 30.4 tunas. Tinggi tunas tertinggi 5.4 cm diperoleh pada media 3 ppm GA3 yang berasal dari tunas mikro yang ditanam pada perlakuan tanpa ZPT. Sejumlah planlet Amorphophallus decus-silvae (20 planlet) yang dihasilkan, berhasil hidup setelah aklimatisasi selama 2 minggu setelah tanam.
Kata kunci: Amorphophallus decus-silvae, glukomanan, organogenesis, planlet, tunas mikro
ABSTRACT
Amorphophallus decus-silvae is focused in this research study specifically in plant growth regulator for seed germination and shoot production. The statistic model used was completely randomized design one factor with 9 medium composition with 0.5 MS basal medium + B5. Each medium had 20 bottle culture and totally 180 explants culture. The explants used were 3-4 week after pollination. In Amorphophallus decus-silvae seed tissue culture, 81.67 % sterilization success by using a method of seed immersion for 1 minute in antiseptic liquid and 15 minute in bleach 15 %. Medium 2 ppm BAP + 0.1 ppm IBA resulted in 94.1% explants germination. After 18 weeks planted in medium 2 ppm BAP + 0.1ppm IBA, the seed culture of Amophophallus decus-silvae produced 10.3 (top explants) and 7.3 (bottom explants) shoot. After 28 week, the total number of micro shoot are 30.4 in medium 2 ppm BAP + 0.1 ppm. Explants from 0.5 MS0 without growth regulator had 5.4 cm height after 28 week in 3 ppm GA3 medium. In acclimatization all plant (20 plantlet) could survived for 2 week observation.
2
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Agronomi dan Hortikultura
INDRA WIRIANTO
KULTUR BIJI
Amorphophallus decus-
silvae PADA
BEBERAPA KOMBINASI SITOKININ DAN AUKSIN
SECARA
IN VITRO
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Kultur Biji Amorphophallus decus-silvae pada Beberapa Kombinasi Sitokinin dan Auksin secara in vitro
Nama : Indra Wirianto NIM : A24090030
Disetujui oleh
Dr Ir Diny Dinarti, MSi Pembimbing
Diketahui oleh
Dr Ir Agus Purwito, MScAgr Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan yang Maha Esa atas segala karunia-Nya sehingga skripsi ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari 2013 ini ialah organogenesis, dengan judul Kultur Biji Amorphophallus decus-silvae pada beberapa kombinasi auksin dan sitokinin secara in vitro.
Terima kasih penulis ucapkan kepada Dr Ir Diny Dinarti MSi sebagai dosen pembimbing, Prof Dr Ir Sandra A. Aziz, MS dan Dr Maya Melati, MSc sebagai dosen penguji yang telah banyak memberi saran. Di samping itu, penghargaan penulis sampaikan kepada Bapak Greek Hambali, Kusnadi, Kurnia Ungkul, Cyrille Clude yang telah membantu selama pelaksanaan dan kelangsungan penelitian. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga skripsi ini bermanfaat.
Bogor, Januari 2014
DAFTAR ISI
DAFTAR TABEL x
DAFTAR GAMBAR x
DAFTAR LAMPIRAN x
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Hipotesis 3
TINJAUAN PUSTAKA 3
METODE 5
Lokasi dan Waktu Penelitian 5
Bahan Penelitian 5
Peralatan Penelitian 5
Perosedur Percobaan 5
HASIL DAN PEMBAHASAN 8
Keadaan Umum Kultur 8
Perkecambahan Biji Amorphophallus decus-silvae 8
Tunas Mikro Amorphophallus decus-silvae 9
Subkultur 11
Subkultur tunas mikro ke media dengan GA3 13
Aklimatisasi 16
SIMPULAN DAN SARAN 17
Simpulan 17
DAFTAR PUSTAKA 17
LAMPIRAN 20
DAFTAR TABEL
Tabel 1 Komposisi media perlakuan Amorphophallus decus-silvae 7 Tabel 2 Persentase perkecambahan eksplan biji Amorphophallus
decus-silvae 9
Tabel 3 Jumlah tunas mikro Amorpophallus decus-silvae 2-7 MST 10 Tabel 4 Jumlah tunas pada kultur biji Amorphophallus decus-silvae 10-18
MST. 11
Tabel 5 Pertumbuhan jumlah tunas mikro Amorphophallus decus-silvae
pada 20-28 MST pada media 3 ppm GA3 13
Tabel 6 Pertumbuhan jumlah akar eksplan bagian bawah Amorphophallus
decus silvae pada media 3 ppm GA3 14 Tabel 7 Pertumbuhan tinggi tunas eksplan bagian atas Amorphophallus
decus-silvae pada media 3 ppm GA3 20-28 MST 15 Tabel 8 Persentase plantlet Amorphophallus decus-silvae pada 28 MST
pada media 3 ppm GA3 16
DAFTAR GAMBAR
Gambar 1 Fase vegetatif (kiri) dan generatif (kanan), serta bagian dalam dari
bunga Amorphophallus (Mayo 1997) 3
Gambar 2 Fase generatif Amorphophallus decus-silvae, a. bunga utuh, b. spathe dan spadix, c. bagian dalam spadix setelah spathe dibuang 4 Gambar 3 Buah Amorphophallus decus-silvae yang digunakan sebagai
bahan tanam 6
Gambar 4 Tahap kulturAmorphophallus decus-silvae (a. biji pada awal kultur, b. inisiasi tunas, c. tunas yang membentuk planlet). 8 Gambar 5 Pertumbuhan jumlah akar Amorphophallus decus-silvae 11 Gambar 6 Pertumbuhan jumlah akar eksplan bagian atas Amorphophallus
decus-silvae 12
Gambar 7 Pertumbuhan jumlah akar eksplan bagian bawah Amorphophallus
decus-silvae 12
Gambar 8 Pertumbuhan jumlah akar eksplan bagian atas Amorphophallus decus silvae pada media dengan 3 ppm GA3 14 Gambar 9 Pertumbuhan tinggi tunas eksplan bagian bawah Amorphophallus
decus-silvae pada media 3 ppm GA3 15 Gambar 10 Plantlet Amorphophallus decus-silvae, a. plantlet dalam botol
kultur, b. planlet yang diaklimatisasi, c. plantlet yang bertahan
setelah aklimatisasi 16
Gambar 11 Kristal glukomannan pada Amorphophallus decus-silvae,
pegamatan dengan mikroskop stereo 20
DAFTAR LAMPIRAN
Lampiran 1 Komposisi Media Murashige-Skoog 20
1
PENDAHULUAN
Latar Belakang
Beberapa jenis Amorphophallus telah dikembangkan karena memiliki potensi untuk dijadikan makanan diet disebabkan karena kandungan glukomanannya yang tinggi dan telah dikonsumsi seperti Amorphophallus albus, Amorphophallus bulbifer, Amorphophallus konjac, Amorphophallus muelleri, Amorphophallus prainii, Amorphophallus variabilis (Hu et al.2008, Imelda et al. 2008, Sugiyama dan Santosa 2008, Mayo et al.1997). Di Jepang, tepung umbi Amorphophallus dimanfaatkan sebagai bahan pembuat konyaku dan shirataki atau pengganti agar-agar dan gelatin (Ermiati 1996 dalam Imelda et al. 2008).
Salah satu jenis Amorphophallus yang berpotensi untuk dikembangkan adalah Amorphophallus decus-silvae, sebagai penghasil glukomanan, juga tanaman hias yang unik dan langka. Amorphophallus decus-silvae mengandung glukomanan, berdasarkan pengujian secara sederhana, tetapi pengujian kadar glukomanan secara akurat perlu dibuktikan. Glukomanan pada umbi Amorphophallus dapat dideteksi dengan melukai umbi dan pada perlukaan umbi dapat terlihat lendir kristal yang merupakan glukomanan1).Amorphophallus decus-silvae merupakan tanaman yang tergolong dalam famili Aracea. Amorphophallus decus-silvae termasuk dalam daftar tumbuhan yang dilindungi di Indonesia tercantum dalam peraturan pemerintah no. 7 tahun 1999 tentang pengawetan jenis tumbuhan dan satwa, tetapi tidak terdaftar dalam redlist. Menurut Yuzami (2009) lokasi distribusi Amorphophallus decus-silvae berada di Jawa Barat.
Amorphophallus memiliki potensi sebagai tanaman hias eksotik. Bunga Amorphophallus memiliki bentuk dan bau yang khas. Genus Amorphophallus memiliki ukuran bunga yang beragam, beberapa species memiliki bunga yang kecil, beberapa species memiliki bunga yang besar. Amorphophallus decus-silvae, Amorphophallus gigas, Amorphophallus titanium memiliki bunga yang besar. Bunga Amorphophallus memiliki aroma yang khas seperti bau daging busuk, sehingga dikenal sebagai bunga bangkai. Keunikan dari Amorphophallus menjadi daya tarik tersendiri bagi kalangan kolektor, sehingga potensi pemasaran dengan harga tinggi memungkinkan pada species-species yang langka. Umbi Amorphophallus decus-silvae dengan diameter 5 cm dapat terjual dengan harga $50 US2).
Amorphophallus decus-silvae merupakan tanaman yang perkembang biakannya menggunakan biji serta umbi. Perbanyakan menggunakan biji memiliki kendala, yaitu waktu pembungaan tanaman yang jarang terjadi, serta tipe penyerbukan yang menyerbuk silang. Perbanyakan tanaman menggunakan umbi dapat dilakukan dengan memotong umbi menjadi beberapa bagian (Soesmono 1984). Pembiakan tanaman menggunakan umbi dapat menghasilkan bibit yang seragam, tetapi terdapat kendala dalam jumlah bibit yang dihasilkan. Umbi Amorphophallus memiliki nilai ekonomi sebagai bahan pangan alternatif, sehingga akan lebih baik perbanyakan bahan tanaman ini menggunakan bagian selain umbi. Umbi Amorphophallus umumnya dapat dipanen 1.5-3 tahun setelah penanaman. Umbi Amorphophallus decus-silvae dapat mencapai ukuran diameter 20 cm dalam waktu 4-5 tahun setelah penyemaian dari biji2).
1)
Hasil komunikasi pribadi dengan Dr. Ir. Fred Rumawas, 2013
2
Kultur jaringan merupakan salah satu metode perbanyakan tanaman yang dapat menghasilkan bibit tanaman dalam jumlah besar. Teknik kultur jaringan dapat digunakan untuk mengatasi permasalahan ketersediaan bibit Amorphophallus di lapangan. Bahan tanaman yang dapat digunakan meliputi petiole, seperti yang diteliti pada Amorphophallus muelleri, yang merupakan sumber eksplan terbaik (Imelda et al. 2008). Kultur Amorphophallus decus-silvae diduga dapat dilakukan dengan menggunakan bagian petiole, biji dan umbi sebagai eksplan. Menurut Morel dan Wetmore (1951) biji dan umbi dapat digunakan sebagai eksplan. Sugiyama dan Santosa (2008) menyatakan bahwa perbanyakan Amorphophallus secara in vitro memerlukan waktu yang lama, tetapi akan berguna untuk menghasilkan tanaman bebas patogen.
Perbanyakan in vitro pada beberapa jenis Amorphophallus telah dilakukan oleh beberapa peneliti. Pada Amorphophallus oncophyllus (Amorphophallus bulbifer) diketahui sterilisasi terbaik diperoleh dengan merendam eksplan dalam larutan pemutih dengan konsentrasi 25% v/v selama 15 menit (Chotigamas et al. 2010). Pada Amorphophallus albus diketahui pemunculan tunas dalam jumlah yang cukup banyak terjadi pada konsentrasi 1 ppm BA + 0.2 ppm NAA (Hu et al. 2008). Pada Amorphophallus muelleri pembentukan kalus efektif terjadi pada media dengan penambahan ZPT NAA 0.2 ppm dan BAP 1.5 ppm (Mayasari 2007). Tunas in vitro Amorphophallus muelleri optimum pada media MS yang mengandung 2 ppm BAP (Imelda et al. 2008). Kultur Amorphophallus decus-silvae perlu dilakukan agar diperoleh tanaman steril yang dapat digunakan sebagai sumber plasma nutfah steril untuk perdagangan skala Internasional dan sebagai plasma nutfah dalam bidang konservasi.
Perumusan Masalah
Perbanyakan Amorphophallus decus-silvae perlu dilakukan secara in vitro agar diperoleh tanaman steril, tanaman dapat terlindungi dari kepunahan atau sebagai bentuk konservasi serta untuk mendapatkan informasi pertumbuhan dan perkembangan kultur. Biji Amorphophallus decus-silvae yang matang fisiologis jarang ditemukan, sehingga biji yang belum matang diharapkan mampu menjadi sumber eksplan yang efektif, selain itu biji lebih mudah dalam sterilisasi dibandingkan dengan petiole.
Tujuan Penelitian
Percobaan ini bertujuan untuk mempelajari komposisi zat pengatur tumbuh yang sesuai untuk kultur biji dan pertumbuhan tunas mikro Amorphophallus decus-silvae.
Manfaat Penelitian
3
Hipotesis
Kombinasi auksin dengan sitokinin yang sesuai akan meningkatkan perkecambahan biji, pembentukan dan pertumbuhan tunas Amorphophallus decus-silvae. Penanaman tunas mikro Amorphophallus decus-silvae pada media dengan kandungan GA3 dapat meningkatkan pertumbuhan planlet yang siap diaklimatisasi.
TINJAUAN PUSTAKA
Amorphophallus tergolong dalam famili Araceae tribe Thomsonieae, merupakan tanaman tahunan ( Mayo 1997, Sugiyama dan Santosa 2008, Grayum 1991). Genus Amorphophallus terdiri dari 180 species yang tersebar di berbagai belahan dunia, khususnya wilayah tropis Asia dan Afrika (Sugiyama dan Santosa 2008). Terdapat 25 jenis Amorphophallus di Indonesia, 18 di antaranya merupakan jenis yang endemik; 8 spesies di Sumatra, 3 spesies di Kalimantan, 5 spesies di Jawa, 1 spesies di Sulawesi (Yuzami 2009). Batang tanaman yang terlihat pada Amorphophallus merupakan petiole. Batang yang sesungguhnya merupakan umbi. Amorphophallus memiliki masa dormansi, sehingga terdapat perbedaan antara fase vegetatif dan fase generatif. Amorphophallus memiliki karakteristik protogynous, yakni bunga betina matang terlebih dahulu sebelum bunga jantan mengeluarkan polen (Lebot 2009). Gambar 1 terlihat morfologi umum dari Amorphophallus.
Gambar 1 Fase vegetatif (kiri) dan generatif (kanan), serta bagian dalam dari bunga Amorphophallus (Mayo 1997)
4
Amorphophallus decus-silvae dibandingkan Amorphophallus lainnya memiliki perbedaan morfologi pada bagian generatif. Perbedaan jelas terlihat dari bentuk bunga (Gambar 2a-c) dan perbedaan dari petiole berdasarkan corak warna dan tekstur. Petiole Amorphophallus decus-silvae memiliki corak yang rapat berupa bintik-bintik kecil pada bagian pangkal dan akan menjadi bintik bulat putih jarang pada bagian atas dari petiole. Posisi biji pada tangkai mempengaruhi besarnya daya perkecambahan Amorphophallus (Azmi 2006). Biji Amorphophallus memiliki masa dormansi 5-6 bulan (Ravi 2009). Buah Amorphophallus memiliki beberapa ragam warna seperti biru, ungu, hijau, kuning yang merupakan evolusi dari buah warna merah, orange, putih (Sedayu et al. 2010).
Menurut Yuzammi (2009) Amorphophallus decus-silvae merupakan Amorphophallus terbesar yang ditemukan di Jawa, termasuk jenis yang langka dan endemik Jawa Barat dengan lokasi distribusi yang tercatat seperti hutan Karang dan hutan Lengkong. Amorphophallus memiliki habitat pada hutan tropis, timbunan humus di atas batu, pinggir sungai dan hutan sekunder (Yuzammi 2009, Sugiyama dan Santosa 2008 dan Mayo 1997). Konservasi Amorphophallus decus-silvae perlu dilakukan, agar tanaman terhindar dari kepunahan. Salah satu bentuk konservasi yang dapat dilakukan yakni melalui kultur jaringan, dengan menyimpan eksplan steril.
(a) (b) (c)
Gambar 2 Fase generatif Amorphophallus decus-silvae, a. bunga utuh, b. spathe dan spadix, c. bagian dalam spadix setelah spathe dibuang
Perbanyakan Amorphophallus decus-silvae memiliki perbedaan dengan perbanyakan Amorphophallus muelleri, dimana perbanyakan Amorphophallus muelleri menggunakan stek daun, umbi serta bulbil/umbi daun (Sumarwoto 2007). Pada Amorphophallus decus-silvae bulbil tidak dihasilkan. Ukuran umbi pada Amorphophallus menentukan waktu terjadinya pembungaan, ukuran bunga serta jumlah biji yang akan dihasilkan (Dwiyono 2004). Umbi Amorphophallus decus-silvae tidak terbentuk tunas anakan, berbeda dengan Amorphophallus paeoniifolius yang membentuk tunas anakan dari umbi. Amorphophalllus decus-silvae akan berbunga setelah umbi berdiameter minimal 20 cm, memerlukan waktu 4-5 tahun setelah penyemaian dari biji3).
Perbanyakan secara in vitro telah dilakukan pada beberapa jenis Amorphophallus. Bahan tanaman yang dapat digunakan adalah petiole. Pada Amorphophallus muelleri petiole merupakan sumber eksplan paling baik (Imelda et al. 2008). Petiole yang telah ditanam pada media kultur menghasilkan kalus.
3)
5
Pada media MS dengan penambahan 0.5 mg/l 2,4-D dan 0.75 mg/l 2,4-D dapat mengubah bentuk kalus kompak menjadi kalus remah pada Amorphophallus oncophyllus (Chotigamaset al.2010). Pada Amorphophallus muelleri kalus terbentuk pada media dengan penambahan NAA 0.2 mg/l dan BAP 1.5 mg/l (Mayasari 2007). Pada Amorphophallus albus kalus terbentuk dalam frekuensi yang tinggi pada media MS dengan penambahan 5.37 μM NAA dan 4.44 μM BA ( Huet al. 2008). Kalus yang terbentuk diinduksi untuk menghasilkan tunas. Pada Amorphophallus muelleri pemberian BAP sebesar 2 mg/l memacu pertumbuhan tunas yang paling tinggi (Imelda et al. 2008). Pemberian Triazole (triadimefon (TDM), paclobutrazol (PBZ) dan propiconazole (PCZ)) pada media kultur dapat memberikan dampak terhadap karakteristik anatomi (ketebalan daun, jumlah stomata, lebar stomata, jumlah kloroplas) Amorphophallus campanulatus (Gopi et al. 2008).
METODE
Lokasi dan Waktu Penelitian
Percobaan dilaksanakan di Laboratorium Kultur Jaringan 3 Departemen Agronomi dan Hortikultura Faperta IPB. Periode waktu dilaksanakannya percobaan dari bulan Januari sampai September 2013.
Bahan Penelitian
Bahan tanaman yang digunakan adalah buah Amorphophallus decus-silvae yang memiliki kisaran umur 3-4 minggu setelah antesis. Bahan yang digunakan membuat media dasar adalah larutan 0.5 MS (Murashige and skoog) modifikasi dengan vitamin B5, gula, BAP (Benzylaminopurine), NAA ( 1-Naphthaleneacetic acid), IBA (Indole-3-butyric acid), GA3 dan gerlite. Bahan pendukung lainnya yang dibutuhkan adalah larutan pemutih (bayclin) 25% v/v, disinfekan cair antiseptik (chloroxylenol/C8H9ClO) dan alkohol 96%.
Peralatan Penelitian
Alat yang digunakan dalam percobaan ini antara lain berupa botol kultur, rak kultur yang dilengkapi dengan lampu fluorescence, alat ukur gelas, cawan petri, pipet, autoclaf, pemanas air, pengaduk, alat diseksi, magnetic stirrer, kertas pH, neraca analitik, dan laminar air flow cabinet. Alat analisis data yang digunakan adalah SAS v9 Portable.
Perosedur Percobaan
A. Persiapan bahan tanam
6
B. Pembuatan media tanam
Pembuatan media tanam dilakukan 1 minggu sebelum penanaman. Proses pembuatan media diawali dengan sterilisasi botol dalam autoklaf sebelum media dibuat. Pemipetan larutan stok media dasar dan zat pengatur tumbuh sesuai perlakuan seperti yang tercantum pada Tabel 1. Setelah peracikan media selesai, media dimasak dan dituang ke dalam botol steril sebanyak 25 ml. Botol yang telah berisi media ditutup dengan plastik dan diberi label kode media. Seluruh media yang telah dibuat disterilkan dengan autoklaf selama 15 menit pada suhu 121oC, tekanan 1.5 kg cm-3. Media yang yang telah disterilkan dipindahkan ke ruang penyimpanan.
C. Sterilisasi bahan tanam
Biji yang digunakan hanya biji yang telah diserbuki, terlihat dari ukuran buah yang membesar (Gambar 3). Buah dipetik dari tongkol bunga dan dicuci dengan air bersih. Buah yang telah dicuci direndam dengan disinfektan cair antiseptik (chloroxylenol/C8H9ClO) selama 1 menit, kemudian dibilas dengan air mengalir.
Selajutnya buah direndam dalam larutan pemutih 15% selama 15 menit.
Gambar 3 Buah Amorphophallus decus-silvae yang digunakan sebagai bahan tanam
D. Penanaman bahan tanam
Penanaman eksplan dilakukan didalam Laminar air flow dengan mempersiapakan media tanam dan buah yang telah steril. Buah yang telah steril diambil dengan pinset kemudian dicelupkan kedalam air steril dan diletakkan ke dalam cawan petri. Buah yang telah dibilas kemudian dibelah untuk mendapatkan biji. Biji dilepaskan dari selaput yang melindungi, biji kemudian ditanam ke dalam media yang telah dipersiapkan.
E. Pemeliharaan
7
F. Pengamatan
Pengamatan dilakukan dengan interval setiap 1 minggu, dengan peubah yang diamati yakni jumlah kontaminasi, persentase perkecambahan, jumlah tunas, tinggi tunas dan jumlah akar yang muncul. Keberhasilan aklimatisasi diamati pada 2 minggu setelah aklimatisasi pada 20 planlet yang dihasilkan dari seluruh kultur.
Analisis data
Kultur biji Amorphophallus decus-silvae terbagi dalam 3 tahap yaitu 1) kultur biji utuh hingga 7 MST, 2) subkultur I eksplan dibelah hingga 18 MST dan 3) subkultur II kultur dalam media pemanjangan sel hingga 28 MST. Tahap pertama menggunakan rancangan acak lengkap (RAL), dengan faktor tunggal yang terdiri atas 9 taraf kombinasi zat pengatur tumbuh terlihat pada Tabel 1. Setiap perlakuan terdiri atas 20 ulangan, masing-masing ulangan terdiri atas 1 botol kultur yang ditanami satu eksplan, sehingga terdapat total 180 satuan amatan. Minggu ke 1-4 eksplan ditempatkan pada ruang gelap, pada akhir minggu ke 4 explan dipindahkan ke kondisi terang.
Tahap kedua merupakan lanjutan dari tahap pertama, dengan perbedaan eksplan dari tahap pertama dibelah menjadi 2 bagian secara horizontal sehingga menghasilkan bagian atas yang bermata tunas dan bagian bawah tanpa mata tunas. Rancangan yang digunakan rancangan acak lengkap (RAL), dengan faktor tunggal yang terdiri dari 9 taraf kombinasi media. Setiap perlakuan terdiri dari 20 ulangan untuk tiap bagian, masing-masing ulangan terdiri atas 1 botol kultur yang ditanami satu eksplan, sehingga terdapat total 360 satuan amatan.
Tahap ketiga merupakan lanjutan dari tahap kedua, dengan perbedaan eksplan dari tahap kedua dibelah menjadi 2 bagian secara vertikal. Rancangan yang digunakan rancangan acak lengkap (RAL), dengan faktor tunggal yaitu asal media pada tahap sebelumnya. Setiap perlakuan terdiri dari 20 ulangan untuk tiap bagian, masing-masing ulangan terdiri atas 1 botol kultur yang ditanami dua eksplan, sehingga terdapat total 360 satuan amatan. Tahap ini merupakan tahap pemanjangan sel.
Tabel 1 Komposisi media perlakuan Amorphophallus decus-silvae
Tahapan kultur Media Tahap II (subkultur, multiplikasi
tunas)
8
HASIL DAN PEMBAHASAN
Keadaan Umum Kultur
Eksplan yang steril akan menentukan tingkat keberhasilan dalam kultur jaringan. Sterilisasi buah Amorphophallus decus-silvae dengan peredaman dalam cairan antiseptik selama 1 menit dan larutan pemutih 15% selama 15 menit, menghasilkan eksplan steril sebesar 81.67 % pada 1 minggu setelah tanam (MST). Eksplan steril pada setiap perlakuan adalah 1) 80%, 2) 80%, 3) 85%, 4) 90%, 5) 70%, 6) 80%, 7) 85%, 8) 80%, 9) 85%. Pada minggu ke 7 dilakukan subkultur dan pembelahan eksplan, dengan tingkat keberhasilan sebesar 82.3 %, dihitung dengan asumsi eksplan hasil sterilisasi awal sebagai 100%. Eksplan steril setiap perlakuan pada minggu ke 8 adalah 1) 81.3%, 2) 100%, 3) 88.2%, 4) 88.9%, 5) 85.7%, 6) 68.8%, 7) 93.8%, 8) 82.3%, 9) 52.9%. Pada minggu ke 18 dilakukan subkultur dan pembelahan eksplan, dengan tingkat keberhasilan sebesar 80.9 %, dihitung dengan asumsi eksplan hasil subkultur sebagai 100%. Eksplan steril setiap perlakuan pada minggu ke 19 adalah 1) 76.9%, 2) 93.7%, 3) 86.7%, 4) 50%, 5) 83.3%, 6) 81.8%, 7) 86.7%, 8) 100%, 9) 66.7%. Kontaminasi disebabkan oleh bakteri maupun cendawan, kontamiasi bakteri ditandai dengan timbulnya lendir di sekitar eksplan sedangkan kontaminasi cendawan ditandai dengan munculnya hifa di sekitar eksplan. Munculnya kontaminan pada eksplan yang ditanam dipengaruhi oleh beberapa faktor; eksplan yang berasal dari habitat langsung, sterilisasi yang belum maksimal, serta kecerobohan pada saat penanaman maupun subkultur.
Perkecambahan Biji Amorphophallus decus-silvae
Pertumbuhan kultur Amorphophallus decus-silvae dimulai dengan tahap pembesaran eksplan, sehingga eksplan akan memiliki ukuran beberapa kali lebih besar dari ukuran pada saat ditanam (Gambar 4a, 4b). Pembesaran eksplan terjadi karena adanya absorsi hara dan zat pengatur tumbuh oleh eksplan, sehingga diduga terjadi pembelahan dan pembesaran sel. Pertumbuhan ukuran eksplan Amorphophallus decus-silvae akan meningkat pada minggu-minggu awal dan akan terhenti pada beberapa minggu berikutnya. Pada Feronia limonia eksplan akan membesar setelah 3-4 minggu dalam media kultur (Hiegoudar et al. 2003). Kecepatan perbesaran eksplan dipengaruhi oleh komposisi zat pengatur tumbuh dari media yang digunakan (George et al. 2007). Kalus remah muncul pada beberapa kultur (± 1.3 %), yang disebabkan masih melekatnya testa (selaput pelindung biji) pada biji Amorphophallus decus-silvae yang ikut tertanam di media perlakuan. Eksplan yang tidak memiliki testa tidak membentuk kalus.
(a) (b) (c)
9
Perkecambahan biji Amorphophallus decus-silvae (Gambar 4b) pada media kultur mulai berlangsung dari minggu ke 2 setelah tanam. Data pada Tabel 2 menunjukkan bahwa pada minggu ke 7 persentase perkecambahan terkecil terdapat pada media 2 ppm BAP + 0.05 ppm IBA sebesar 33.3%, sedangkan pada media 2 ppm BAP + 0.1 ppm IBA menunjukkan hasil 94.1%. Pada minggu ke 5 terlihat adanya penurunan persentase perkecambahan pada media 0.5 MS0, 1 ppm BAP + 0.1 ppm NAA dan 1 ppm BAP + 0.1 ppm IBA yang diduga disebabkan oleh proses pemindahan eksplan dari kondisi gelap ke kondisi terang. Eksplan dengan pertumbuhan yang tetap stabil pada media tanpa terpengaruh oleh adanya perubahan cahaya di ruang simpan, diduga disebabkan karena terdapat kesetimbangan (perimbangan) zat pengatur tumbuh pada eksplan. Hingga akhir minggu ke 7 tidak semua eksplan berkecambah, sehingga diduga adanya pengaruh dari dormansi biji. Biji yang belum mengalami kematangan akan mengalami dormansi, pematahan dormansi dapat terjadi dengan penyimpanan benih di tempat dengan suhu 20oC selama 60 hari (Toogood 1999). Usia biji Amorphophallus decus-silvae yang digunakan sebagai eksplan memiliki perbedaan yang disebabkan oleh perbedaan waktu penyerbukan biji yang terjadi secara acak, serta sumber polen yang tidak seragam, sehingga memberikan respon yang beragam pada perkecambahan biji.
Tabel 2 Persentase perkecambahan eksplan biji Amorphophallus decus-silvae
Media MST (%)
*Semua media perlakuan menggunakan media dasar 0.5 MS0 dengan vitamin B5
Tunas Mikro Amorphophallus decus-silvae
10
oksigen maupun oksidasi pada substrat (George et al. 2007). Pada minggu ke 4-5 jumlah tunas menurun karena perubahan lingkungan dari kondisi gelap ke terang, sehingga tunas tertentu mengalami kematian.
Pada akhir minggu ke 7 eksplan yang ditanam pada media 1 ppm BAP + 0.05 ppm IBA menghasilkan jumlah tunas 2.3, sedangkan media 2 ppm BAP + 0.05 IBA menghasilkan jumlah tunas 0.4. Pada eksplan yang ditanam pada media 0.5 MS0 menunjukkan respon pertumbuhan karena adanya kandungan hormon di dalam biji. Biji memiliki kandungan hormon auksin, giberelin, sitokinin dan ABA, biji yang belum matang terutama memiliki kandungan hormon yang banyak (Bewley dan Black 1994).
Tabel 3 Jumlah tunas mikro Amorpophallus decus-silvae 2-7 MST
Media MST
2 3 4 5 6 7
0.5 MS0 0.3bc* 0.4bc 0.7abc 0.6cd 0.6cde 0.6c
1 ppm BAP + 0.1 ppm NAA 0.5abc 1.1a 1.3ab 1.2ab 1.1abcd 1.2bc
1 ppm BAP + 0.05 ppm NAA 0.6ab 1.1a 1.1ab 1abc 1.4abc 1.2bc
2 ppm BAP + 0.1 ppm NAA 0.3bc 0.9ab 1.1ab 0.9abcd 1bcde 1.1bc
2 ppm BAP + 0.05 ppm NAA 0.4bc 0.9ab 1.5a 1.3a 1.6ab 1.6ab
1 ppm BAP + 0.1 ppm IBA 0.3bc 0.5abc 0.5bc 0.5cd 0.5de 0.6c
1 ppm BAP + 0.05 ppm IBA 0.7a 1.1a 1.3ab 1.5a 1.9a 2.3a
2 ppm BAP + 0.1 ppm IBA 0.7a 1ab 1.3ab 1.4a 1.5ab 1.6ab
2 ppm BAP + 0.05 ppm IBA 0.2c 0.2c 0.2c 0.3d 0.3e 0.4c
*angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf 5%. Semua media perlakuan menggunakan media dasar 0.5 MS0
11
Gambar 5 Pertumbuhan jumlah akar Amorphophallus decus-silvae
Subkultur
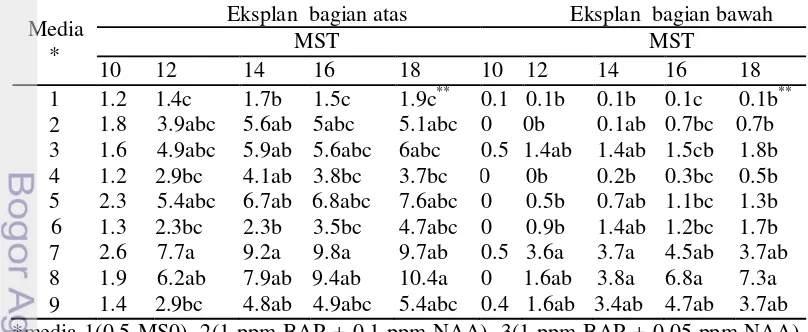
Pada akhir minggu ke 7 eksplan biji dibelah menjadi dua bagian secara horizontal (ada titik tumbuh dan tidak ada titik tumbuh) serta disubkultur pada media yang sama. Pada Tabel 4 terlihat perbedaan pola pertumbuhan dari eksplan yang berbeda bagian. Eksplan yang berasal dari bagian atas memberikan respon pertumbuhan lebih baik dibandingkan eksplan yang berasal dari bagian bawah, terlihat dari jumlah tunas yang lebih banyak. Perbedaan jumlah tunas yang dihasilkan disebabkan karena sumber mata tunas dominan pada bagian atas, sedangkan pada bagian bawah eksplan awal tidak memiliki titik tumbuh tunas. Penurunan jumlah tunas pada 16 MST pada beberapa perlakuan seperti yang terlihat pada Tabel 4 disebabkan karena terjadinya kompetisi antar tunas, sehingga menyebabkan sebagian tunas mengalami kematian. Tunas pada eksplan bagian bawah muncul secara langsung dari biji yang dibelah pada bagian yang berlawanan dengan daerah potongan. Pemunculan tunas diawali dengan munculnya bintik-bintik bakal tunas mikro yang akan membesar serta memanjang pada minggu berikutnya.
Tabel 4 Jumlah tunas pada kultur biji Amorphophallus decus-silvae 10-18 MST. Media
*
Eksplan bagian atas Eksplan bagian bawah
MST MST tidak berbeda nyata berdasarkan uji Duncan pada taraf 5%
12
diperoleh 10.4 (eksplan bagian atas) dan 7.3 (eksplan bagian bawah) tunas. Jumlah tunas paling sedikit dihasilkan pada media 0.5 MS0 sebanyak 1.9 (eksplan bagian atas) dan 0.1 (eksplan bagian bawah) tunas. Pada Tabel 4 terlihat bahwa media 0.5 MS0, eksplan bagian bawah mampu bertunas, hal ini diduga adanya hormon sitokinin pada bagian eksplan tersebut. Sitokinin pada biji mengalami peningkatan saat biji mendekati pematangan (Bewley dan Black 1994). Berdasarkan data pada Tabel 4 kombinasi media BAP dengan IBA memberikan pengaruh yang lebih baik dibandingkan BAP dengan NAA, hal ini sejalan dengan pendapat George et al. (2007) bahwa IBA dengan BAP lebih efektif dibandingkan NAA dengan BAP.
Eksplan yang terpotong (bagian atas dan bawah) selain menghasilkan pertambahan jumlah tunas, juga diikuti oleh pertambahan jumlah akar. Jumlah akar meningkat seiring dengan peningkatan usia dari eksplan. Pada Gambar 6 dan 7 terlihat adanya media terbaik untuk jumlah akar berdasarkan asal eksplan. Media 1 ppm BAP + 0.05 ppm IBA menghasilkan jumlah akar tertinggi pada pertumbuhan eksplan yang berasal dari potongan bagian atas, sedangkan media 1 ppm BAP + 0.1 ppm IBA menghasilkan jumlah akar tertinggi pada pertumbuhan eksplan dari potongan bagian bawah. Pada tunas sempurna (tunas dengan akar yang telah tumbuh), pertumbuhan jumlah akar mengalami peningkatan.
Gambar 6 Pertumbuhan jumlah akar eksplan bagian atas Amorphophallus decus-silvae
13
Subkultur tunas mikro ke media dengan GA3
Tunas mikro yang teramati hingga minggu ke 18 sebagian besar belum menghasilkan planlet yang siap diaklimatisasi.Ukuran tunas mikro hingga minggu ke 18 memiliki tinggi rata-rata 1.5 cm, sehingga perlu dilakukan subkultur ke media yang mengandung giberelin. Pada akhir minggu ke 18 dilakukan pembelahan eksplan secara vertikal mejadi dua bagian dan di subkultur ke media 3 ppm GA3, dengan tujuan terjadi pemanjangan sel, sehingga tunas siap diaklimatisasi. Konsentrasi giberelin pada tanaman diketahui sangat rendah, biasanya giberelin aktif pada bagian vegetatif yakni 1-10 part per billion dan pada biji 1-10 part per million (Taiz dan Zeiger 2002).
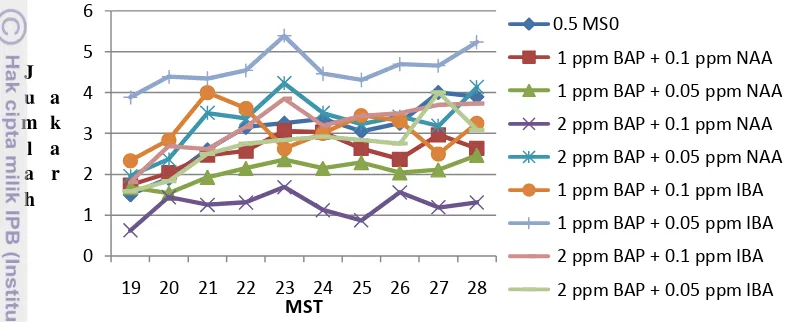
Berdasarkan data Tabel 5 terjadi penurunan pertumbuhan tunas pada beberapa MST yang terjadi karena adanya kompetisi antar tunas. Eksplan yang mengalami peningkatan jumlah tunas dipengaruhi oleh asal media sebelum pemindahan eksplan ke dalam media giberelin. Pertumbuhan jumlah tunas terbanyak terlihat berasal dari eksplan yang memiliki media awal 2 ppm BAP + 0.1 ppm IBA. Eksplan bagian atas memiliki jumlah pertumbuhan tunas yang lebih banyak secara keseluruhan dibandingkan dengan eksplan bagian bawah. Peningkatan pertumbuhan jumlah tunas eksplan bagian atas tidak nyata pada media giberelin, karena pada media ini tahapan pemanjangan sel agar diperoleh tunas normal yang siap di aklimatisasi. Pada Vriesea reitzii pemanjangan tunas terlihat setelah 10 minggu kultur berada pada media GA3, eksplan yang tidak ditanam pada media GA3 menghasilkan tunas-tunas kecil (Vesco dan Guerra 2010).
Tabel 5 Pertumbuhan jumlah tunas mikro Amorphophallus decus-silvae pada 20-28 MST pada media 3 ppm GA3
Media *
Eksplan bagian atas Eksplan bagian bawah
MST MST tidak berbeda nyata berdasarkan uji Duncan pada taraf 5%
14
disebabkan karena adanya akar-akar yang mati dan adanya akar-akar yang baru tumbuh. Jumlah akar yang dihasilkan dari ke dua jenis eksplan berbeda. Eksplan bagian atas menghasilkan jumlah akar terbanyak dari media 1 ppm BAP + 0.05 ppm IBA (Gambar 8), sedangkan eksplan bagian bawah dari media 2 ppm BAP + 0.1 ppm IBA (Tabel 6). Pertumbuhan akar terlihat tidak meningkat nyata pada media giberelin, karena terjadinya pertumbuhan pemanjangan sel yang mengakibatkan akar menjadi memanjang.
Gambar 8 Pertumbuhan jumlah akar eksplan bagian atas Amorphophallus decus silvae pada media dengan 3 ppm GA3
Tabel 6 Pertumbuhan jumlah akar eksplan bagian bawah Amorphophallus decus silvae pada media 3 ppm GA3 tidak berbeda nyata berdasarkan uji Duncan pada taraf 5%
15
28, hal ini terjadi karena jumlah tunas yang dihasilkan cukup sedikit, sehingga proses pertambahan tinggi tunas tidak memiliki saingan.
Kompetisi antar tunas menyebabkan pertumbuhan tunas yang tidak seragam dan mengakibatkan adanya tunas-tunas yang mati. Tunas yang berasal dari eksplan bagian atas pada 1 ppm BAP + 0.05 ppm NAA memiliki tinggi tunas terendah pada akhir pengamatan, sementara media ini memiliki 6.8 tunas (Tabel 7). Terdapat beberapa faktor yang mempengaruhi, diantaranya kondisi tunas dan ukuran tunas. Kondisi tunas yang dimaksud yakni kesehatan dari tunas, beberapa tunas mengalami stress pada saat dipotong sehingga menjadi kecoklatan yang mengakibatkan tunas mengalami pertumbuhan yang lambat bahkan mati. Ukuran tunas akan mempengaruhi daya bersaing tunas untuk menjadi tanaman utuh. Tunas yang muncul terlebih dahulu dan berukuran besar akan memiliki peluang yang lebih besar. Pada Gambar 9 terlihat bahwa tunas yang berasal dari eksplan bagian bawah pada media 1 ppm BAP + 0.05 ppm NAA memiliki tinggi tunas tertinggi. sedangkan eksplan yang berasal dari media 1 ppm BAP + 0.1 ppm NAA tidak bertambah tinggi. Eksplan yang tidak mengalami pertambahan tinggi tunas disebabkan karena eksplan belum memiliki tunas ataupun karena adanya tunas yang mati.
Gambar 9 Pertumbuhan tinggi tunas eksplan bagian bawah Amorphophallus decus-silvae pada media 3 ppm GA3
16
*media 1(0.5 MS0). 2(0.5 MS0 + 1 ppm BAP + 0.1 ppm NAA). 3(0.5 MS0 + 1 ppm BAP + 0.05 ppm NAA). 4(0.5 MS0 + 2 ppm BAP + 0.1 ppm NAA). 5(0.5 MS0 + 2 ppm BAP + 0.05 ppm NAA). 6(0.5 MS0 + 1 ppm BAP + 0.1 ppm IBA). 7(0.5 MS0 + 1 ppm BAP + 0.05 ppm IBA). 8(0.5 MS0 + 2 ppm BAP + 0.1 ppm IBA). 9(0.5 MS0 + 2 ppm BAP + 0.05 ppm IBA. **angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf 5%
Aklimatisasi
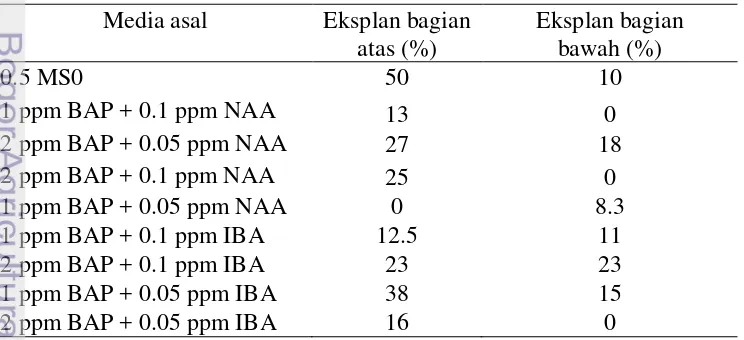
Kultur Amorphophallus decus-silvae dapat menghasilkan plantlet yang siap diaklimatisasi. Plantlet yang siap diaklimatisasi memiliki ciri petiole, akar, serta daun telah membuka sempurna (Gambar 10a). Tabel 8 menunjukkan persentase plantlet terbanyak diperoleh dari media asal 0.5 MS0 sejumlah 50% (eksplan bagian atas) dan 2 ppm BAP + 0.1 ppm IBA sebesar 23% (eksplan bagian bawah). Media MS0 dapat memberikan persentase plantlet terbanyak disebabkan oleh sedikitnya jumlah tunas yang muncul, sehingga tunas dapat mengalami pemanjangan sel dan menjadi tanaman utuh. Media dengan penambahan zat pengatur tumbuh menghasilkan plantlet dalam persentase yang kecil disebabkan oleh banyaknya tunas yang muncul dan tunas belum menjadi plantlet. Jumlah plantlet yang sedikit akan dapat meningkat seiring berjalannya waktu disebabkan tunas mikro belum seluruhnya menjadi plantlet.
(a) (b) (c)
Gambar 10 Plantlet Amorphophallus decus-silvae, a. plantlet dalam botol kultur, b. planlet yang diaklimatisasi, c. plantlet yang bertahan setelah
aklimatisasi
Tabel 8 Persentase plantlet Amorphophallus decus-silvae pada 28 MST pada media 3 ppm GA3
Media asal Eksplan bagian atas (%)
Eksplan bagian bawah (%)
0.5 MS0 50 10
1 ppm BAP + 0.1 ppm NAA 13 0
2 ppm BAP + 0.05 ppm NAA 27 18
2 ppm BAP + 0.1 ppm NAA 25 0
1 ppm BAP + 0.05 ppm NAA 0 8.3
1 ppm BAP + 0.1 ppm IBA 12.5 11
2 ppm BAP + 0.1 ppm IBA 23 23
1 ppm BAP + 0.05 ppm IBA 38 15
17
Tanaman Amorphophallus decus-silvae yang diperoleh dari hasil kultur dapat bertahan 100% setelah 2 minggu aklimatisasi, tanpa ada tanda-tanda kematian (Gambar 10a-c). Syarat tanaman yang digunakan agar keberhasilan dalam aklimatisasi dapat tercapai yakni tunas telah memiliki akar pada bagian bawah tanaman, serta daun telah membuka sempurna. Tanaman dengan tunas yang dilengkapi akar akan memiliki peluang hidup lebih besar dibandingkan dengan tunas tanpa akar yang tidak akan bertahan jika diaklimatisasi. Aklimatisasi planlet Amorphophallus decus-silvae memerlukan kelembaban media serta naungan yang terjaga karena berpengaruh terhadap keberhasilan tumbuh. Menurut Hu et al. (2008), pada kultur Amorphophallus albus lebih dari 90% planlet dapat bertahan setelah 1 bulan aklimatisasi, dan dalam 4 bulan tidak ada perbedaan morfologi dengan tanaman induk. Naungan diperlukan karena Amorphophallus decus-silvae merupakan tanaman yang tidak tahan terhadap panas secara langsung.
SIMPULAN DAN SARAN
Simpulan
Perkecambahan biji tertinggi 94.1% terjadi pada media dengan 2 ppm BAP + 0.1 ppm IBA. Media terbaik untuk menghasilkan tunas pada kultur biji Amorphophallus decus-silvae yakni 2 ppm BAP + 0.1 ppm IBA sebanyak 16.2 tunas pada ekplan bagian atas dan 14.2 tunas pada eksplan bagian bawah selama 28 minggu. Pemindahan eksplan ke media 3 ppm GA3 dapat meningkatkan tinggi tunas mikro. Planlet yang dihasilkan dapat bertahan 100 % setelah 2 minggu aklimatisasi.
DAFTAR PUSTAKA
Azmi C. 2006. Pembentukan buah dan viabilitas benih suweg ( Amorphophallus paeoniifolius (Denst) Nicolson) dari penyerbukan silang buat koleksi plasma nutfah kebun percobaan cikabayan [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Bjowani SS, RazdanMK. 1996. Plant Tissue Culture: Theory and Practice a Reviced Edition. Amsterdam (NL): Elselvier.
Bewley JD, Black M. 1994. Seed Physiology of Development and Germination second edition. New York (US): Plenum Press.
Bradford K, Nonogaki H. 2007. Seed Development, Dormancy and Germination Annual Plant ReviewsVolume 27. Oxford (US): Blackwell.
Chen FC, Wang CY, Fang JY. 2012. Micropropagation of self heading Philodendron via direct shoot regeneration. Scientia Horticulturae 141:23-29.
18
Proceedings TRF-master Research Congress IV (Science and Technology). March 30 april 2010. Pattaya.Cholburi.p.84.
George EF, Hall MA, Klerk GJD. 2007. Plant Propagation by Tissue Culture 3rd edition. Netherland (NL): Springer.
Grayum MH. 1991. Systematic embriology of Araceae. The Botanical Review 57:3
Hiregoudar LV, Murthy HN, Hema BP, Hahn EJ, Paek KY. 2003. Multiple shoot induction and plant regeneration of Feronia limonia (L) Swingle. Scientia Horticulturae 98: 357-364.
Hoover R. 2001. Composition, molecular structure and physicochemical properties of tuber and root strarches: a review. Carbohydrate Polymers 45:253-267.
Hopkins WG, Huner NPA. 2008. Introduction to Plant Physiology 4 ed. United State (US): Wiley.
Hu J,Gao X, Liu J, Xie C, Li J. 2008. Plant regeneration from petiole callus of Amorphophallus albus and analysis of somaclonal variation of regenerated plants by RAPD and ISSR markers. Botanical Studies. 49: 189-197.
Imelda M, Sari AW, Poerba YS. 2008. Regenerasi tunas dari kultur tangkai daun iles-iles (Amorphophallus muelleri Blume). Biodiversitas. 9(3):173-176. Ishida G. 2004. Karyomorphological observation on same aroids cultivated in the
Hiroshima Botanical Garden II. Bull Hiroshima Bot. Gard. 21:7-30.
Jagatheesh K, Arumugam V, Elangovan N, Pavankumar P. 2010. Evaluation of the anti-tumor and antioxidant activity of Amorphophallus paeoniifolius on DMBA induced Mammary Carcinoma. Intl. J of Chem & Pharm Sci 1(2). Kite GC, Hetterschieid WLA. 1997. Inflorescence odours of Amorphophallus and
Pseudodracontium ( Araceae). Phytochem 46(1):71-75.
Lebot V. 2009. Tropical Root and Tuber Crops : Cassava. Sweet Potato. Yams. Aroids. UK(GB): MPG Biddles Ltd.king’s lynn.
Mayasari I. 2007. Perbanyakan iles-iles (Amorphophallus muelleri Blume) secara kultur In Vitro dengan pemberian zat pengatur tumbuh ZAA dan BAP [skripsi]. Bogor(ID): Institut Pertanian Bogor.
Mayo SJ, Bogner J, Boyce PC. 1997. The Genera of Araceae. Belgium (BE): Continental Printing.
Morel G, Wetmore RH. 1951. Tissue culture of monocotyledons. American J Bot 38(2):138-140.
Nagoi R, Purohit SD. 2004. In vitro plantlet regeneration in Annona squamosa throught direct shoot bud differentiation on hypocotyls segments. Scientia Horticulturae 99:89-98.
Ravi V, Ravindran CS, Suja G. 2009. Growth and Productivity of elephant foot yam (Amorphophallus paeoniifolius (Dennst. Nicolson) : on Overview. J of Root Crops 35(2):131-142.
Sedayu A, Eurlingis MCM, Gravendeel B, Hetterscheid WLA. 2010. Morphological character evolution of Amorphophallus (Araceae) base on a combined phylogenetic analysis of trnl, rbcl, and LEAFY second intron sequences. Botanical studies 51:473-490.
19
Singh SK, Rajasekar N, Raj NAV, Paramaguru R. 2011. Hepatoprotective and antioxidant effects of Amorphophallus campanulatus against acetaminophen induced hepatotoxicity in rats. International Journal of Pharmacy and Pharmaceutical Sciences 3(2).
Slabnik E, Caso OH, Pomar MC, Diaz H. 1986. Auxin cytokinin interaction and morphogenic response from leaf sections and shoot meristem cultures of Taraxacum officinale. J Plant Physiol 122(3):227-233.
Soemono S. 1984. Pengaruh bobot bibit terhadap pertumbuhan, hasil dan kualitas umbi suweg (Amorphophallus companulatus Bl) pada berbagai umur[tesis]. Bogor(ID): Institut Pertanian Bogor.
Sugiyama N, Santosa E. 2008. Edible Amorphophallus in Indonesia –potential crops in agroforestry. Yogyakarta (ID): Gadjah Mada University Press. Taiz L, Zeiger E. 2002. Plant Physiology 3rd ed. Sunderland(GB): Sinaeur
Associates
Toogood T. 1999. Plant Propagation. New York (US): America Horticultural Society.
Vesco LLD, Guerra MP. 2010. In vitro morphogenesis and adventitious shoot mass regeneration of Vriesea reitzii from nodular cultures. Scientia Horticulturae 125:748-755.
20
LAMPIRAN
Lampiran 1 Komposisi Media Murashige-Skoog
Stok Bahan
Konsentrasi larutan stok
(g/L)
Volume yang dipipet
(ml/L)
Konsentrasi dalam media (mg/L)
A NH4NO3 82.500 20 1.650.000
B KNO3 95.000 20 1.900.000
C KH2PO4 34.000 5 170.000
H3BO3 1.240 6.200
Na2MoO4.2H2O 0.050 0.250
CoCl2.H2O 0.005 0.020
Kl 0.166 0.830
D CaCl2.2H2O 88.000 5 440.000
E MgSO4.7H2O 74.000 5 370.000
MnSO4.4H2O 4.460 22.300
ZnSO4.7H2O 1.720 8.600
CuSO4.5H2O 0.005 0.025
F Na2EDTA 3.730 10 37.300
FeSO4.7H2O 2.780 27.800
Vitamin Thiamine 2.000 10 10.000
Niacin 0.200 1.000
Pyridoxine 0.200 1.000
Myo Myo inositol 10.000 10 100.000
Lampiran 2 Metode pengujian kadar glukomannan secara visual
Glukomannan pada Amorphophallus decus-silvae dapat dideteksi dengan memberikan perlukaan pada permukaan umbi. Bagian yang mengalami perlukaan akan muncul bintik-bintik kristal yang merupakan glukomannan (Gambar 11). Metode pengujian ini merupakan hasil diskusi dengan Rumawas pada 2 Desember 2013.
21