BIOSENSOR BERBASIS GLUKOSA OKSIDASE TERAMOBIL
NANOPARTIKEL KITOSAN DALAM ELEKTRODA PASTA
KARBON TERMODIFIKASI NANOSERAT POLIANILIN
ANEISTI SEPTIANI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Biosensor Berbasis Glukosa Oksidase Teramobil Nanopartikel Kitosan dalam Elektroda Pasta Karbon Termodifikasi Nanoserat Polianilin adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
Aneisti Septiani
ABSTRAK
ANEISTI SEPTIANI. Biosensor Berbasis Glukosa Oksidase Teramobil Nanopartikel Kitosan dalam Elektroda Pasta Karbon Termodifikasi Nanoserat Polianilin. Dibimbing oleh LAKSMI AMBARSARI dan POPI ASRI KURNIATIN.
Biosensor berbasis glukosa oksidase dikembangkan untuk mendeteksi glukosa secara lebih tepat, cepat, dan sensitif. Pengembangan biosensor yang dilakukan memanfaatkan enzim glukosa oksidase teramobil pada nanopartikel kitosan dalam elektroda pasta karbon termodifikasi. Penelitian bertujuan menentukan kondisi optimum untuk menghasilkan nanopartikel kitosan dan mengetahui karakteristik glukosa oksidase/elektroda pasta karbon termodifikasi. Hasil uji menunjukan kondisi optimum untuk membuat nanopartikel kitosan, yaitu pada volume 300 mL dan waktu sonikasi 10 menit. Penambahan polianilin pada glukosa oksidase/elektroda pasta karbon termodifikasi dapat meningkatkan arus. Glukosa oksidase/elektroda pasta karbon termodifikasi memiliki kondisi optimum pada pH 5.0 dan konsentrasi glukosa sebesar 20 mM. Daerah linier berada pada 0.6-1.8 mM dan nilai sensitivitas elektroda sebesar 0.20 mA/mM. Nilai Km dan Imaks
pada sebesar 1.934 mM dan0.937 mA ditentukan dengan metode Lineweaver-Burk. Hasil penelitian ini akan digunakan selanjutnya untuk pengembangan biosensor glukosa.
Kata kunci: biosensor glukosa, glukosa oksidase, nanopartikel kitosan, polianilin.
ABSTRACT
ANEISTI SEPTIANI. Biosensor Based on Immobilized Glucose Oxidase on Chitosan Nanoparticles in Modified Carbon Pasta Electrode by Polyaniline Nanofibers as Biosensor Applications. Supervised by LAKSMI AMBARSARI and POPI ASRI KURNIATIN.
Biosensor based on glucose oxidase enzyme has been developed to detect glucose levels more precise, rapid, and sensivity. The development of biosensor was used glucose oxidase immobilized on chitosan nanoparticles in modified carbon paste electrode. The purpose of this study were to determine the optimum condition in order to produce chitosan nanoparticles and to obtain characteristic of glucose oxidase/modified carbon pasta electrode. The result showed that optimum conditions were obtained to make chitosan nanoparticles with 300 mL of volume and 10 minutes of ultrasonication time. The addition of polyaniline on glucose oxidase/modified carbon pasta electrode increased the current. Glucose oxidase/modified carbon pasta electrode had optimum conditions at pH 5.0 and glucose concentration was 20 mM. Linier range was 0.6-1.8 mM dan sensitivity value of electrode was 0.20 mA/mM. Km and Imax value were 1.934 mM was 0.937
mA determined by Lineweaver-Burk method. These result will be further used for development of glucose biosensor.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
BIOSENSOR BERBASIS GLUKOSA OKSIDASE TERAMOBIL
NANOPARTIKEL KITOSAN DALAM ELEKTRODA PASTA
KARBON TERMODIFIKASI NANOSERAT POLIANILIN
ANEISTI SEPTIANI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Biosensor Berbasis Glukosa Oksidase Teramobil Nanopartikel Kitosan dalam Elektroda Pasta Karbon Termodifikasi Nanoserat Polianilin
Nama : Aneisti Septiani NIM : G84100087
Disetujui oleh
Dr Laksmi Ambarsari, MS Pembimbing I
Popi Asri Kurniatin, SSi, Apt, MSi Pembimbing II
Diketahui oleh
Dr Ir I Made Artika, MAppSc Ketua Departemen
PRAKATA
Bismillahirrahmannirrahiim
Puji dan syukur penulis panjatkan atas kehadirat Allah SWT atas rahmat yang diberikan-Nya sehingga penulis dapat menyelesaikan karya ilmiah ini dengan baik. Tak lupa penulis menyampaikan terima kasih yang sebesar-besarnya kepada junjungan dan pedoman umat, Nabi Muhammad SAW yang telah membawa umatnya menuju kesempurnaan dalam ibadahnya. Karya Ilmiah yang berjudul Biosensor Berbasis Glukosa Oksidase Teramobil Nanopartikel Kitosan dalam Elektroda Pasta Karbon Termodifikasi Nanoserat Polianilin ini merupakan wujud dari pencapaian ilmu sebelumnya dan pembekalan penulis dalam kehidupan mendatang. Penelitian ini merupakan bagian dari penelitian unggulan Bantuan Operasional Perguruan Tinggi Negeri (BOPTN) atas nama Dr Laksmi Ambarsari, MS. Penelitian ini dilakukan selama 5 bulan dari bulan Januari 2014 sampai Mei 2014 di Laboratorium Penelitian Biokimia IPB, Laboratorium Biofisika Material Fisika IPB, Laboratorium Analisis Bahan Fisika IPB, dan Laboratorium Kimia Bersama IPB.
Banyak bantuan dan bimbingan dari berbagai pihak berupa moril, materil, spiritual, maupun administrasi dalam menyelesaikan karya ilmiah ini. Terima kasih penulis ucapkan kepada Ayahanda Usman Hamzah, Ibunda Erdawati, Ervra Ustika, Juhri, dan Riswan Septiandi atas dukungan, doa, dan kasih sayangnya. Penulis juga menyampaikan terima kasih dan penghargaan kepada Dr Laksmi Ambarsari, MS dan Popi Asri Kurniatin, SSi, Apt, MSi selaku pembimbing atas dukungan, bimbingan, doa, dan sarannya dalam karya ilmiah ini. Penghargaan dan terima kasih juga penulis ucapkan kepada seluruh dosen dan staf Biokimia IPB atas bantuan, saran, dan bimbingannya. Terima kasih juga penulis sampaikan kepada Ibu Henny Purwatiningsih Suyuti, Bapak Eko Firmansyah, dan Bapak Iwan Saskiawan atas bantuannya. Penulis juga menyampaikan terima kasih kepada Subekti Imarwoto atas kesabaran, doa, bantuan, dan dukungannya selama ini. Terima kasih kepada Rini, Ana, Murzani, Putri, Ucin, Irna, Bellen, Lia, Eni, Nazula, Puji, Ziah, Uwi, Ime, Wewen, Emmy, Uti, Nanat, keluarga biokimia 47, Kamar 61, GDYers, dan seluruh teman penulis yang tidak terucapkan atas persahabatan, rasa perjuangan, bantuan, doa, dan dukungannya. Semoga karya ilmiah ini bermanfaat bagi kemajuan ilmu pengetahuan khususnya di bidang biokimia.
Bogor, Agustus 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
METODE 2
Bahan dan Alat 2
Prosedur 3
HASIL 5
Formula dan Ukuran Nanopartikel Kitosan 5
Kinerja Elektroda Pasta Karbon dan Elektroda Pasta karbon Termodifikasi 5
pH Optimum 7
Kinetika Enzim 8
PEMBAHASAN 9
Formula dan Ukuran Nanopartikel Kitosan 11
Kinerja Elektroda Pasta Karbon dan Elektroda Pasta KarbonTermodifikasi 12
pH Optimum 12
Kinetika Enzim 14
SIMPULAN 16
SARAN 16
DAFTAR PUSTAKA 16
LAMPIRAN 20
DAFTAR TABEL
1 Hasil pengukuran nanopartikel kitosan dengan peningkatan volume dan
variasi waktu ultrasonikasi 5
2 Arus puncak anoda EPK dan EPKT 6
DAFTAR GAMBAR
1 Voltamogram siklik EPK dan EPKT 5
2 Voltamogram siklik elektroda enzim termodifikasi pada variasi pH 6 3 Pengaruh pH terhadap nilai arus elektroda glukosa oksidase/EPKT 8 4 Hubungan konsentrasi glukosa dan nilai arus elektroda enzim glukosa
oksidase/EPKT 8
5 Linieritas konsentrasi glukosa dan nilai arus elektroda glukosa
oksidase/EPKT 9
6 Kurva Lineweaver-Burk pada elektroda glukosa oksidase/EPKT 9
DAFTAR LAMPIRAN
1 Diagram alir penelitian 20
2 Karakteristik kitosan 21
3 Perhitungan rendemen nanopartikel kitosan 21
4 Hasil pengukuran nanoserat polianilin dengan uji SEM 21 5 Arus elektroda glukosa oksidase/EPKT variasi pH 21 6 Arus elektroda glukosa oksidase/EPKT variasi konsentrasi 22 7 Analisis nilai sensitivitas elektroda glukosa oksidase/EPKT 22
PENDAHULUAN
Biosensor merupakan alat yang menggunakan reaksi biokimia spesifik yang dimediasi oleh enzim, sistem kekebalan tubuh, jaringan, organel, atau seluruh sel yang diisolasi untuk mendeteksi senyawa kimia oleh sinyal listrik, panas, atau optis (Fadhilah 2013). Teknologi biosensor dihasilkan dari inovasi metode untuk menentukan kadar suatu analat secara lebih tepat, cepat, dan sensitif. Salah satu pengembangan biosensor yang telah ada adalah biosensor glukosa yang pertama kali dikembangkan oleh Leland C. Clark pada tahun 1962. Clark memanfaatkan enzim glukosa oksidase bereaksi spesifik terhadap β-D-glukosa yang banyak dihasilkan dari kelompok fungi genus Penicillium dan genus Aspergillus. Glukosa
oksidase dikenal sebagai β-D-glukosa: oksigen-1-oksidoreduktase (EC 1.1.3.4) merupakan enzim yang mengkatalisis oksidasi β-D-glukosa menjadi D-glukono-δ -lakton yang akan terhidrolisis secara non-enzimatis menjadi asam glukonat dan H2O2 serta memerlukan oksigen sebagai akseptor elektron(Sabir et al. 2007).
Pengembangan biosensor glukosa oksidase terus dilakukan untuk menyempurnakan biosensor yang sudah ada. Pengembangan ini dilakukan untuk mengatasi kelemahan, antara lain tidak dapat digunakan berulang, daya variasi kurang tinggi, waktu respon yang lebih rendah, rentang linear yang sempit, sensitivitas rendah, kurang stabil, serta presisi dan deteksi yang masih rendah (Wang et al. 2008). Kelemahan biosensor ini dapat disebabkan oleh sifat enzim mudah rusak dan harganya mahal. Upaya mengatasi kelemahan tersebut dapat dilakukan dengan teknik amobilisasi yang telah banyak dikembangkan. Beberapa teknik amobilisasi enzim yang telah ada, antara lain pengikatan silang ( cross-linking), penjebakan (entrapment), adsorpsi (adsorption), enkapsulasi, dan pengikatan secara kovalen pada bahan padat pendukung (carrier-binding) (Gorecka dan Jastrzebska 2011). Banyak bahan penyangga atau matriks juga banyak yang dikembangkan untuk meningkatkan teknik amobilisasi. Colak et al. (2012) memanfaatkan glutaraldehida sebagai matriks amobilisasi enzim glukosa oksidase, akan tetapi matriks ini memiliki efek toksik dan harganya mahal untuk digunakan pada biosensor. Oleh karena itu, diperlukan pengembangan matriks amobilisasi alami yang dapat digunakan sebagai aplikasi biosensor adalah kitosan.
2
Perancangan biosensor yang lebih inovatif terus dilakukan untuk menyempurnakan biosensor yang ada. Inovasi lain yang dilakukan pada penelitian ini menggunakan karbon pasta yang dimodifikasi dengan penambahan nanoserat polianilin. Menurut Keyhanpour et al. (2012), polianilin adalah polimer konduktif yang dapat membantu perpindahan pasangan elektron dari hasil reaksi enzimatik dalam elektroda. Hal ini akan menyebabkan biosensor memiliki respon yang cepat dan kestabilan yang tinggi. Penelitian biosensor glukosa oksidase banyak dilakukan, akan tetapi penelitian mengenai perancangan biosensor dengan enzim glukosa oksidase diamobilisasi pada nanopartikel kitosan dalam elektroda pasta karbon termodifikasi polianilin belum pernah dilakukan. Sedangkan inovasi perancangan biosensor glukosa perlu dilakukan untuk mendeteksi glukosa dalam industri farmasi maupun makanan secara lebih tepat, cepat, dan sensitif.
Penelitian ini bertujuan menentukan kondisi optimum berupa volume dan waktu ultrasonikasi optimum untuk menghasilkan nanopartikel kitosan. Selain itu, penelitian ini juga bertujuan mengetahui karakteristik glukosa oksidase/elektroda pasta karbon termodifikasi berupa pH optimum, konsentrasi substrat optimum, sensitivitas, dan kinetika enzim. Penelitian ini diharapkan dapat memberikan informasi mengenai volume dan waktu ultrasonikasi optimum untuk menghasilkan nanopartikel kitosan dan dapat digunakan sebagai matriks amobilisasi enzim alami dan dapat menjadi pengganti matriks amobilisasi enzim komersial yang telah ada. Karakteristik glukosa oksidase teramobil nanopartikel kitosan dalam elektroda pasta karbon termodifikasi pada nanoserat polianilin yang diperoleh dapat menjadi informasi untuk pengujian lebih lanjut pada proses perancangan biosensor.
METODE
Penelitian yang dilakukan meliputi optimasi pembuatan nanopartikel kitosan dan karakterisasi ukuran partikel dengan PSA (particle size analyzer), preparasi elektroda pasta karbon (EPK) dan elektroda pasta karbon termodifikasi (EPKT), amobilisasi glukosa oksidase teramobil pada nanopartikel kitosan dalam elektroda pasta karbon termodifikasi nanoserat polianilin, dan karakterisasi glukosa oksidase teramobil nanopartikel kitosan dalam elektroda pasta karbon termodifikasi nanoserat polianilin.
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini, antara lain kitosan diperoleh dari Fakultas Perikanan dan Ilmu Kelautan IPB, enzim glukosa oksidase (EC.1.1.3.22 dimurnikan dari Aspergillus niger, aktivitas 7200 Unit/mL) dan glukosa diperoleh dari Sigma Aldrich, sodium tripolifosfat (STPP) diperoleh dari Kimia Organik IPB, polianilin diperoleh dari hasil penelitian Akhirudin Maddu (Departemen Fisika IPB tahun 2014), serbuk grafit dan parafin cair diperoleh dari Kimia Fisik IPB, bovine serum albumin (BSA), asam asetat glasial, serbuk natrium asetat, serbuk Na2HPO4, serbuk NaH2PO4, serbuk KCl, dan kalium ferisianida
3 Alat-alat yang digunakan dalam penelitian ini adalah peralatan kaca,
homogenizer (Dispergierstation TB.10 IKA), ultrasonic processor (130 Watt 20 kHz, Cole-Parmer), VASCO particle size analyzer dilengkapi perangkat lunak nanoQ, pH meter (HANNA pH 21), tabung Effendorf, pipet mikro, penangas air, neraca analitik, tabung kaca diameter luar 1.2 cm dan diameter dalam 0.9 cm, tabung teflon diameter 0.9 cm, kawan tembaga, eDAQ Potensiostat-Galvanostat (Ecorder 410) yang dilengkapi perangkat lunak Echem v2.1.0 dengan sistem 3 elektroda (elektroda Ag/AgCl sebagai elektroda pembanding, elektroda karbon pasta sebagai elektroda kerja, elektroda platina sebagai elektroda bantu), dan pengaduk magnet.
Prosedur
Pembuatan Nanopartikel Kitosan (modifikasi Nakorn 2008)
Sebanyak 20 mg kitosan dilarutkan ke dalam 40 mL asam asetat 2 % v/v dengan pengaduk magnet dalam gelas piala 100 mL. Setelah itu, larutan dihomogenisasi dengan kecepatan 13500 rpm selama 10 menit sambil ditambahkan 20 mL tripolifosfat (TPP) 0.75 mg/mL pada suhu ruang. Sebanyak 30 mL larutan kitosan dari stok awal, diletakkan ke dalam gelas piala 100 mL dan diultrasonikasi dengan amplitudo 40 % selama 5 menit. Hal ini dilakukan hingga semua larutan nanopartikel kitosan tersonikasi. Nanopartikel kitosan diperoleh dengan disentrifugasi selama 30 menit pada kecepatan 12000 rpm lalu disimpan dalam akuabides agar tetap stabil pada suhu 4oC. Pembuatan nanopartikel kitosan juga dilakukan dengan 5 kali volume formula awal, yaitu 300 mL dalam gelas piala 600 mL dan divariasikan waktu ultrasonikasi selama 5, 10, dan 15 menit. Karakterisasi yang dilakukan, yaitu analisis ukuran partikel dengan particle size analyzer (PSA).
Preparasi Elektroda Pasta Karbon (Colak et al. 2012)
Elektroda pasta karbon (EPK) terbentuk dari campuran serbuk grafit dan parafin cair. Sebanyak 0.15 gram serbuk grafit dicampurkan sempurna dengan 100 µL parafin cair dalam mortar. Pasta karbon kemudian dimasukkan ke dalam elektroda tabung kaca (diameter 0.9 cm, panjang 4 cm) dengan tinggi 0.7 cm yang telah terhubung dengan kawat tembaga. Elektroda pasta karbon termodifikasi (EPKT) terbentuk dari campuran serbuk grafik, parafin cair, dan polianilin. Sebanyak 2 mg polianilin ditambahkan dengan 0.15 gram serbuk grafit yang telah dicampurkan 100 µL parafin cair di dalam mortar. Setelah itu, permukaan elektroda dihaluskan dengan kertas untuk menghasilkan elektroda kerja yang baik.
Preparasi Glukosa Oksidase/Elektroda Pasta Karbon Termodifikasi (modifikasi Colak et al. 2012)
4
dan nanopartikel kitosan yang tidak teramobilisasi. Elektroda diletakkan pada suhu 4oC di dalam bufer selama tidak digunakan.
Pengukuran Elektrokimia(modifikasi Colak et al. 2012)
Pengukuran elektrokimia dilakukan dengan seperangkat alat eDAQ potensiotat-galvanostat yang dilengkapi perangkat lunak Echem v2.1.0. Elektroda yang digunakan adalah elektroda Ag/AgCl sebagai elektroda pembanding, platina sebagai elektroda bantu, dan elektroda enzim sebagai elektroda kerja. Modifikasi yang dilakukan, yaitu penambahan kalium ferisianida sebagai mediator berdasarkan hasil penelitian Fadhilah (2013). Larutan glukosa yang digunakan diinkubasi pada suhu ruang selama 24 jam sebelum digunakan untuk pengujian.
Sebanyak 1 mL larutan bufer 0.1 M, 1 mL kalium ferisianida 100 mM, dan 180 µL glukosa ditambahkan ke dalam sel elektrokimia. Sel elektrokimia selanjutnya diamati puncak arus anoda dan katoda. Elektroda karbon pasta termodifikasi tanpa enzim digunakan sebagai blanko.
Penentuan pH Optimum (Colak et al. 2012)
Bufer asetat dan fosfat 0.1 M dengan kisaran pH 4-8 digunakan sebagai bufer reaksi dalam pengujian elektroda enzim termodifikasi. Elektroda karbon pasta tanpa enzim digunakan sebagai blanko. Sebanyak 1 mL larutan bufer kisaran pH 4-8, 1 mL kalium ferisianida 100 mM, dan 180 µL larutan glukosa 250 mM ditambahkan ke dalam sel elektrokimia dan diamati puncak arus anoda. Perbedaan puncak arus anoda yang diperoleh dari variasi pH digunakan sebagai parameter penentuan pH optimum elektroda karbon pasta termodifikasi. Puncak arus anoda tertinggi pada pH tertentu digunakan sebagai pH optimum. pH optimum yang diperoleh dari hasil pengukuran digunakan untuk penentuan konsentrasi substrat dan suhu optimum.
Penentuan Konsentrasi Substrat Maksimum (Colak et al. 2012), Sensitivitas
(Fadhilah 2013), dan Parameter Kinetika Enzim(Hoshino et al. 2012)
Konsentrasi substrat enzim glukosa oksidase yang divariasikan, yaitu D-glukosa dengan kisaran 0.1 mM-60 mM. Larutan bufer yang digunakan diperoleh dari hasil penentuan pH optimum, yaitu bufer asetat pH 5.0. Sebanyak 1 mL larutan bufer asetat pH 5.0, 1 mL kalium ferisianida 100 mM, dan 180 µL D-glukosa dengan variasi konsentrasi dimasukkan ke dalam sel elektrokimia dan diamati puncak arus anoda. Puncak arus anoda tertinggi pada konsentrasi substrat tertentu digunakan sebagai parameter penentuan konsentrasi substrat maksimum.
Parameter kinetika enzim glukosa oksidase yang diamobilisasi ditentukan dengan menggunakan persamaan Michaelis-Menten :
I = Imaks [D-glukosa]
Km + [D-glukosa]
dengan Imaks adalah respon arus maksimum yang terukur, Km adalah konstanta
5
HASIL
Formula dan Ukuran Nanopartikel Kitosan
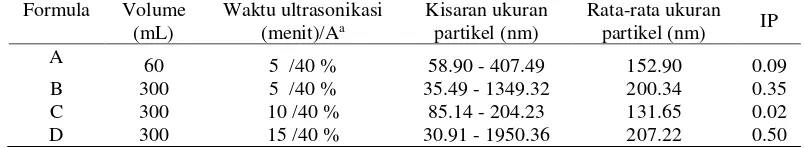
Nanopartikel kitosan diperoleh melalui metode gelasi ionik dengan membentuk emulsi yang stabil dan berwarna agak keruh. Emulsi nanopartikel kitosan yang diperoleh setelah mengalami proses ultrasonikasi cenderung lebih jernih dibandingkan sebelum ultrasonikasi. Hasil pengukuran nanopartikel kitosan dengan peningkatan volume dan variasi waktu ultrasonikasi dapat dilihat pada Tabel 1. Formula A dengan volume 60 mL dan waktu ultrasonikasi 5 menit memiliki rata-rata ukuran partikel sebesar 152.90 nm dengan nilai indeks polidispersitas (IP) sebesar 0.09. Pembuatan nanopartikel dengan peningkatan 5 kali volume dari formula A, yaitu formula B, C, dan D menghasilkan ukuran partikel yang berbeda. Nilai rata-rata ukuran nanopartikel kitosan yang dihasilkan pada formula B, yaitu 200.34 nm dengan nilai IP sebesar 0.35. Nilai rata-rata ukuran partikel yang dihasilkan pada formula C sebesar 131.65 nm dengan nilai IP sebesar 0.02. Formula D menghasilkan rata-rata ukuran partikel sebesar 207.22 nm dengan nilai IP 0.50.
Nilai rata-rata ukuran partikel dan IP dari formula C cenderung lebih kecil dibandingkan dengan formula B dan D. Formula B menunjukkan belum sempurnanya proses ultrasonikasi sehingga partikel yang dihasilkan masih lebih besar dengan nilai IP yang besar. Sedangkan formula D menunjukkan terjadinya ketidakstabilan hasil ultrasonikasi sehingga partikel yang dihasilkan berukuran lebih besar dan nilai IP yang meningkat pula. Hal ini menunjukkan formula terbaik untuk memperoleh nanopartikel kitosan, yaitu formula A dan C.
Proses sentrifugasi dilakukan pada penelitian ini untuk memperoleh nanopartikel kitosan dalam bentuk serbuk. Endapan yang diperoleh disimpan pada suhu 4oC di dalam akuabides untuk menjaga kestabilan nanopartikel kitosan dan
dikeringkan hingga akubides menguap sebelum digunakan. Rendemen nanopartikel kitosan yang diperoleh dari formula A, yaitu 88.89%. Nanopartikel kitosan yang diperoleh dari hasil penelitian yang digunakan pada penelitian selanjutnya adalah formula A. Hal ini disebabkan peningkatan volume dan variasi waktu ultrasonikasi dari formula A yang dilakukan hanya digunakan sebagai referensi untuk produksi nanopartikel kitosan dalam skala besar.
Tabel 1 Hasil pengukuran nanopartikel kitosan dengan peningkatan volume dan variasi waktu ultrasonikasi
aA: amplitudo, IP: indeks polidispersitas.
Kinerja Elektroda Karbon Pasta dan Elektroda Pasta Karbon Termodifikasi
6
terbuat dari serbuk grafit dan parafin cair. Pasta karbon yang dihasilkan pada penelitian ini memiliki karakteristik, antara lain berwarna hitam, lunak, tidak padat, dan dapat dimasukkan ke dalam tabung kaca yang terhubung dengan kawat tembaga.
Modifikasi yang dilakukan elektroda pasta karbon termodifikasi (EPKT) berupa penambahan nanoserat polianilin sebagai polimer bersifat konduktif yang dapat meningkatkan arus pada puncak anoda yang dihasilkan. Nanoserat polianilin yang digunakan pada penelitian ini diperoleh dari hasil penelitian Akhiruddin Maddu (2014). Ukuran nanoserat polianilin yang digunakan pada penelitian ini memiliki ukuran 110-120 nm berdasarkan hasil uji SEM pada perbesaran 7500 kali.
Voltamogram siklik dari EPK dan EPKT terlihat pada Gambar 1 terbentuk dari kinerja kedua elektroda terhadap KCl 3 M dengan kondisi pengukuran yang sama. Berdasarkan voltamogram siklik yang terbentuk, EPK menghasilkan puncak arus anoda yang lebih kecil dari puncak arus anoda yang dihasilkan oleh EPKT. Peningkatan nilai arus puncak anoda pada EPKT menunjukkan bahwa EPKT merupakan elektroda yang lebih baik daripada EPK dan akan digunakan untuk penelitian selanjutnya.
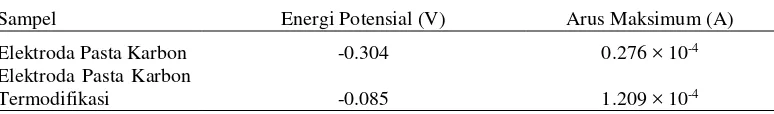
Voltamogram pada Gambar 1 menunjukkan respon EPK dan EPKT terhadap energi potensial yang diberikan yang terlihat dari besaran arus yang dihasilkan. Nilai arus diperoleh dari puncak anoda (reaksi oksidasi) dan puncak katoda (reaksi reduksi) terjadi pada EPK dan EPKT. Besar arus yang dihasilkan oleh EPK pada puncak anoda, yaitu sebesar 0.276 × 10-4 A, sedangkan arus yang dihasilkan oleh EPKT mengalami kenaikan arus pada puncak anoda sebesar 1.209 × 10-4 A (Tabel 2).
Gambar 1 Voltamogram siklik EPK dan EPKT pada laju pemayaran 100 mVs-1, potensial 1 V, Initial E 0 mV, final E 0 mV, upper E 1000 mV, dan lower E -500 mV. elektroda pasta karbon, elektroda pasta karbon termodifikasi.
Tabel 2 Arus puncak anoda elektroda pasta karbon (EPK) dan elektroda pasta karbon termodifikasi (EPKT)
Sampel Energi Potensial (V) Arus Maksimum (A)
7
pH Optimum
Pengaruh pH terhadap respon glukosa oksidase/EPKT memiliki peran penting dalam menentukan penyebaran muatan pada sisi aktif enzim yang berpengaruh pada aktivitas enzim. Enzim glukosa oksidase diamobilisasi terlebih dahulu pada nanopartikel kitosan yang diacu dari hasil penelitian Nakoron (2008). Nanopartikel kitosan yang digunakan pada penelitian ini dilarutkan terlebih dahulu di dalam bufer fosfat pH 7. Hal ini didasarkan pada hasil penelitian Nakorn (2008) yang menjelaskan bahwa enzim glukosa oksidase dapat diamobilisasi secara optimal pada bufer fosfat pH 7. Enzim glukosa oksidase yang telah diamobilisasi dengan nanopartikel kitosan kemudian diamobilisasi kembali pada EPKT.
Penentuan pH optimum pada glukosa oksidase/EPKT akan dilakukan dengan menggunakan bufer pH 4-8 dengan interval 0.5. Nilai arus yang dihasilkan pada puncak anoda akan sebanding aktivitas enzim yang digunakan untuk menentukan pH optimumnya. Voltamogram siklik pengaruh pH terhadap arus yang dihasilkan enzim glukosa oksidase pada EPKT dengan perlakuan suhu 25oC dan
konsentrasi glukosa 0.25 M ditunjukkan pada Gambar 2. Nilai arus yang terlihat pada puncak anoda yang dihasilkan oleh enzim glukosa oksidase pada EPKT dengan variasi pH berbeda juga. Besar arus pada puncak anoda yang paling tinggi dihasilkan enzim glukosa oksidase/EPKT pada bufer pH 5.0 dan terendah pada bufer pH 6.0.
Hubungan pengaruh pH terhadap nilai arus elektroda glukosa oksidase/EPKT ditunjukkan Gambar 3. Nilai arus yang diperoleh pada puncak anoda tersebut pada pH 5.0 sebesar 1.8655 mA. Sedangkan nilai arus terendah dihasilkan pada bufer asetat pH 6.0, yaitu sebesar 0.2898 mA. Nilai arus tertinggi menunjukkan enzim glukosa oksidase yang teramobilisasi pada elektroda pasta karbon termodifikasi memiliki respon maksimum pada bufer pH 5.0. Oleh karena itu, bufer pH 5 yang merupakan pH optimum akan digunakan untuk tahapan selanjutnya pada penelitian selanjutnya dalam aplikasi perancangan biosensor glukosa.
8
Gambar 3 Pengaruh pH terhadap nilai arus elektroda glukosa oksidase/EPKT (suhu 25oC, glukosa 0.25 M).
Kinetika enzim
Pengaruh konsentrasi substrat terhadap aktivitas enzim disebabkan adanya kemampuan sisi aktif enzim berikatan dengan substrat. Regresi non linier hubungan konsentrasi substrat dengan arus yang menunjukkan aktivitas enzim pada elektroda enzim glukosa oksidase/EPKT ditunjukkan Gambar 4. Nilai arus yang diperoleh pada puncak anoda akan sebanding dengan aktivitas enzim glukosa oksidase. Pengaruh konsentrasi substrat yang digunakan terhadap aktivitas enzim yang dihasilkan menggunakan variasi konsentrasi dengan rentang 0.2-60 mM. Ketika konsentrasi glukosa berada di bawah 20 mM, reaksi berada saat enzim belum terikat seluruhnya pada substrat. Ketika konsentrasi glukosa mencapai 20 mM, aktivitas enzim mulai mencapai maksimum sebesar 1.44765 mA yang menunjukkan bahwa enzim sudah terikat semuanya pada substrat sehingga penambahan substrat yang lebih tinggi tidak memberikan pengaruh yang signifikan bahkan menurunkan aktivitas enzim. Hal ini menunjukkan enzim glukosa oksidase telah jenuh dengan substrat.
Regresi non linier pada Gambar 4 menunjukkan representasi hubungan konsentrasi substrat dan aktivitas enzim. Representasi regresi non linier ini memiliki kelemahan, yaitu kemungkinan adanya distorsi dari hiperbola sehingga nilai Km yang dihasilkan dapat 10 kali lebih besar dan 10 kali lebih kecil dari nilai
Km yang sebenarnya (Bisswanger 2002). Oleh karena itu, dilakukan penentuan nilai
Km dari daerah yang linier pada hubungan konsentrasi substrat dan aktivitas enzim
yang ditunjukkan pada Gambar 5.
9 Linieritas konsentrasi substrat dan nilai arus pada elektroda glukosa oksidase/EPKT ditunjukkan pada Gambar 5. Rentang daerah linier konsentrasi glukosa dengan aktivitas enzim berada pada 0.6-1.8 mM yang diperoleh dari nilai koefisien determinasi tertinggi, yaitu 0.9955. Nilai sensitivitas elektroda enzim glukosa oksidase/EPKT yang diperoleh dari kurva linieritas sebesar 0.20 mAmM-1
(Lampiran 7). Analisis kinetika ditentukan melalui turunan dari kurva Michaelis-Menten dengan metode Lineweaver-Burk.
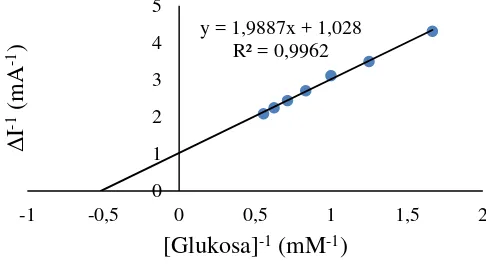
Analisis kinetika enzim glukosa/EPKT dengan metode Lineweaver-Burk ditunjukkan pada Gambar 6. Nilai Km dan Imaks diperoleh dari persamaan regresi y
= 1.9887x + 1.0280 dengan nilai koefisien determinasi (R2) sebesar 0.9962. Nilai Km dan Imaks yang diperoleh masing-masing dari metode Lineweaver-Burk, yaitu
1.934 mM dan 0.973 mA.
Gambar 5 Linieritas konsentrasi glukosa dan nilai arus elektroda glukosa oksidase/EPKT.
Gambar 6 Kurva Lineweaver-Burk pada elektroda glukosa oksidase/EPKT.
PEMBAHASAN
Formula dan Ukuran Nanopartikel Kitosan
10
sodium tripolifosfat (STPP). Kompleksitas interaksi ini menyebabkan kitosan mengalami gelasi ionik dan terpresipitasi membentuk partikel (Xu dan Du 2003).
Bentuk nanopartikel kitosan pada penelitian ini diperoleh dengan melarutkan kitosan ke dalam asam asetat 2 % dan ditambahkan STPP 0.75 mg/mL sebagai agen penaut silang. Metode ini merupakan metode yang dimodifikasi dari penelitian yang dilakukan oleh Nakorn (2008) berupa modifikasi penambahan tahapan homogenisasi. Penambahan asam asetat 2% pada kitosan berfungsi untuk melarutkan kitosan. Hal ini disebabkan adanya gugus amina pada kitosan yang dapat terprotonasi oleh H+ dari asam yang dihasilkan dari polielektrolit kation dalam air (Harahap 2012). Oleh karena itu, kelarutan kitosan akan meningkat seiring dengan penurunan nilai pH. Pelarutan kitosan ke dalam asam asetat 2% menggunakan pengaduk magnetik. Suptijah et al. (2011) menjelaskan bahwa proses pelarutan kitosan dengan pengaduk magnetik dapat dikendalikan secara merata pada kecepatan tinggi sehingga menghasilkan partikel yang homogen dan stabil.
Sodium tripolifosfat (Na5P3O10) yang dilarutkan terdahulu di dalam air
menyebabkan terbentuknya ion hidroksil dan ion tripolifosfat. Kitosan yang dilarutkan di dalam asam akan terprotonasi membentuk -NH3+ dan memberikan
kondisi asam pada proses penautan silang. Bhumkar dan Pokkharkar (2006) menjelaskan bahwa proses penautan silang dapat terjadi pada 2 pH, yaitu pH 3 dan pH 9. Kondisi penautan silang pada pH 3 hanya akan didominasi oleh interaksi ionik antara ion polifosfat dengan –NH3+ dari kitosan. Kondisi yang berbeda pada
pH 9, yaitu ion hidroksil dan ion polifosfat yang dihasilkan akan berkompetisi untuk berinteraksi dengan –NH3+ dan akan didominasi oleh deprotonasi ion hidroksil.
Emulsi nanopartikel kitosan diperoleh dengan penambahan sodium tripolifosfat yang bersifat anion multivalen dapat berfungsi sebagai penaut silang dengan kitosan yang bersifat kationik. Lin et al. (2008) menjelaskan bahwa hasil nanopartikel kitosan yang diperoleh dengan tripolifosfat bersifat lebih stabil dan dapat menembus membran lebih baik. Teknik homogenisasi berfungsi untuk menyatukan larutan kitosan dengan STPP dan membuat partikel menjadi lebih homogen. Teknik homogenisasi yang dilakukan mengacu pada penelitian Hardi (2012) dengan partikel yang dihasilkan berukuran ± 1000 nm. Menurut Ekaputra (2014), homogenisasi bertujuan menyatukan dan menyeragamkan ukuran dalam bentuk nanopartikel.
Hasil homogenisasi selanjutnya diultrasonikasi dengan amplitudo 40% selama 5 menit. Kondisi amplitudo ini merupakan kondisi yang digunakan dalam penelitian Nakorn (2008) yang didukung dengan penelitian Mujib (2011). Hal ini disebabkan emulsi yang dihasilkan dengan kondisi tersebut lebih stabil dan efisien terhadap waktu. Menurut Wahyono et al. (2011), metode ultrasonikasi bertujuan memecah molekul-molekul yang berukuran besar menjadi bagian-bagian lebih kecil. Menurut Nikmatin et al. (2011), prinsip ultrasonikasi berkaitan dengan efek kavitasi akustik.
11 energi ultrasonikasi. Gelembung tersebut selanjutnya memuai yang diikuti dengan mencapai bentuk maksimum hingga akhirnya pecah. Pecahnya gelembung tersebut diikuti dengan pecahnya partikel sehingga ukuran partikel menjadi berkurang. Kavitasi dipengaruhi beberapa faktor, seperti frekuensi ultrasonikasi, suhu, tekanan, konsentrasi, dan viskositas.
Emulsi yang telah diultrasonikasi akan memiliki ukuran yang lebih seragam dan berukuran nanopartikel. Ukuran nanopartikel kitosan pada penelitian ini ditentukan dengan particle size analyzer (PSA). Lidiniyah (2011) menjelaskan bahwa pengukuran partikel dengan PSA lebih akurat untuk partikel berorde nanometer dan submikron yang cenderung beraglomerasi. Menurut Aprianto (2014), prinsip kerja dari PSA menggunakan Dynamic Light Scattering (DLS) dengan metode basah, yaitu menggunakan media pendispersi untuk mendispersikan material uji.
Hasil PSA dari nanopartikel kitosan pada Tabel 1 menunjukkan bahwa emulsi nanopartikel kitosan yang dibuat dalam volume 60 mL dengan waktu ultrasonikasi 5 menit (formula A) menghasilkan rata-rata kitosan masih termasuk ke dalam rentang nanopartikel, yaitu 10-10000 nm (Mohanraj dan Chen 2003). Akan tetapi, nilai rata-rata ukuran dari hasil penelitian ini lebih kecil dibandingkan dengan hasil penelitian yang dilakukan Nakorn (2008), yaitu 215 nm. Nilai rata-rata ukuran partikel kitosan yang lebih kecil dapat disebabkan oleh adanya homogenisasi yang menyebabkan partikel berukuran lebih kecil dan seragam. Selain itu, Mardliyati et al. (2012) juga menjelaskan bahwa karakteristik partikel yang dihasilkan dari metode gelasi ionik dipengaruhi oleh ukuran awal kitosan, konsentrasi kitosan, konsentrasi sodium tripolisfat, dan rasio volume kitosan terhadap sodium tripolifosfat. Nilai indeks polidispersitas (IP) yang dihasilkan dengan formula A sebesar 0.09. Hal ini menunjukkan emulsi memiliki distribusi yang sempit dan berukuran nanopartikel yang seragam karena nilai IP yang diperoleh berada di bawah 0.3 (Yen et al. 2008).
Nilai rata-rata ukuran partikel yang diperoleh pada peningkatan 5 kali volume formula A masih termasuk ke dalam rentang ukuran nano, yaitu 10-10000 nm (Mohanraj dan Chen 2003) dan lebih kecil dibandingkan dengan nilai rata-rata ukuran partikel yang dihasilkan oleh penelitian Nakorn (2008). Nilai rata-rata ukuran partikel yang dihasilkan peningkatan 5 kali volume formula A berbeda sesuai dengan hasil penelitian Tsai et al. (2008) yang menyatakan bahwa semakin lama proses ultrasonikasi pada kitosan-sodium tripolifosfat akan menghasilkan diameter partikel yang semakin berkurang. Hasil penelitian ini juga sejalan dengan hasil penelitian yang dilakukan Ekaputra (2014) menyatakan bahwa energi ultrasonikasi yang terlalu besar dan lama dapat menyebabkan ketidakstabilan nanopartikel lemak padat dan terjadinya aglomerasi. Adanya perbedaan volume ultrasonikasi dan luas permukaan wadah yang digunakan juga berpengaruh terhadap proses kavitasi yang terjadi. Perbedaan fenomena kavitasi yang terjadi akan menghasilkan ukuran rata-rata dan indeks polipdispersitas nanopartikel kitosan yang berbeda. Nilai indeks polidispersitas yang lebih kecil pada formula C menunjukkan partikel yang dihasilkan berukuran nano yang lebih kecil dengan distribusi partikel yang sempit dan seragam (Yen et al. 2008).
12
rendemen yang dihasilkan oleh penelitian Kurniasih et al. (2011) dengan pangadukan dan filtrasi, yaitu 88.49%. Nilai rendemen dari hasil penelitian ini juga lebih tinggi dibandingkan dengan hasil penelitian Suptijah et al. (2011) dengan pengaduk magnetik dan homogenizer, yaitu 81.30% dan 40.00%. Hal ini menunjukkan rendemen yang dihasilkan dengan metode ini lebih tinggi namun tidak berbeda jauh dengan hasil penelitian sebelumnya.
Kinerja Elektroda Pasta Karbon dan Elektroda Pasta Karbon Termodifikasi
Elektroda pasta karbon (EPK) yang diuji pada penelitian ini terbuat dari serbuk grafik dan parafin cair. Serbuk grafit pada komposisi pasta karbon berfungsi sebagai penguat dan memperkecil gesekan serta meningkatkan ketahanan arus (Surianty et al. 2013). Penambahan parafin cair pada pasta karbon digunakan untuk pengikat grafit sehingga campuran menjadi stabil dan sifatnya tidak ikut bereaksi pada pengukuran (Svancara et al. 2002). Karakteristik fisik karbon pasta yang dihasilkan pada penelitian ini sesuai dengan hasil penelitian yang dilakukan oleh Vytras et al (2009), yaitu lunak, tidak padat, dan harus disimpan di dalam badan elektroda yang terhubung dengan kawat tembaga. Kawat tembaga digunakan sebagai penghantar elektron yang dihasilkan pada reaksi biokimia dan menghubungkannya pada sumber listrik.
Elektroda pasta karbon termodifikasi (EPKT) terbuat dari nanoserat polianilin, serbuk grafit, dan parafin cair. Karbon pasta termodifikasi yang dihasilkan juga memiliki karakteristik fisik yang sama dengan karbon pasta yang belum termodifikasi. Surianty et al. (2013) menyatakan bahwa penambahan polianilin pada pasta karbon dilakukan agar tidak ada ruang kosong antara partikel grafit yang satu dengan yang lainnya. Hal ini menyebabkan polianilin yang ditambahkan ke dalam karbon pasta dapat masuk dalam rongga kosong tersebut dan dapat meningkatkan konduktivitas listrik pada elektroda karena jalannya elektron tidak terputus.
Analisis EPK dan EPKT dilakukan dengan menggunakan larutan KCl 3 M. Larutan KCl 3 M berfungsi sebagai larutan elektrolit yang mengurangi gaya tarik-menarik elektrostatik antara muatan elektrode dan muatan ion-ion analit serta mempertahankan kekuatan ion (Wang 2001). Puncak anoda yang terbentuk pada voltamogram adalah representatif pergerakan elektron yang berkala dari reaksi yang terjadi di permukaan elektroda (Surianty et al. 2013). Puncak anoda pada EPKT lebih tinggi dibandingkan dengan puncak anoda pada EPK sesuai dengan hasil penelitian yang dilakukan oleh Surianty et al. (2013) yang menyatakan bahwa EPKT memiliki puncak arus yang lebih tinggi daripada EPK walaupun tidak terlihat terlalu signifikan pada puncak anoda. Peningkatan nilai arus yang dihasilkan oleh EPKT disebabkan penambahan polianilin. Gaikward et al. (2006) menyatakan bahwa polianilin merupakan polimer bersifat konduktif yang memiliki kemampuan untuk menghantarkan elektron dari hasil reaksi biokimia. Konduktivitas polianilin disebabkan oleh penambahan HCl sebagai doping asam protonik pada saat polimerisasi (Maddu et al. 2008).
pH Optimum
13 enzim glukosa oksidase ditentukan dengan metode voltametri siklik. Menurut Liyonawati (2013), metode voltametri siklik merupakan salah satu metode elektroanalitik berdasarkan pada reaksi oksidasi reduksi pada permukaan elektroda kerja. Teknik pengukuran biosensor yang dilakukan selama setengah reaksi oksidasi reduksi berlangsung disebut biosensor amperometrik (Wei dan Ivaska 2006). Kelebihan teknik ini adalah sensitivitasnya yang tinggi, limit deteksi yang rendah, dan memiliki daerah linier yang lebar (Mulyani et al. 2012).
Enzim glukosa oksidase yang digunakan pada penelitian ini diamobilisasi dengan nanopartikel kitosan. Proses amobilisasi glukosa oksidase pada nanopartikel kitosan dilakukan pada pH 7. pH 7 merupakan pH optimum untuk amobilisasi glukosa oksidase pada nanopartikel kitosan dari hasil penelitian yang dilakukan Nakorn (2008). Nakorn (2008) menjelaskan bahwa pH optimum menyebabkan konformasi enzim dapat berikatan dengan kuat dengan nanopartikel kitosan. Glukosa oksidase, bovine serum albumin, dan nanopartikel kitosan yang telah dicampurkan selanjutnya diinkubasi pada suhu 30oC selama 15 menit.
Inkubasi dilakukan untuk mengkondisikan lingkungan yang sesuai agar jumlah glukosa oksidase yang teramobilisasi pada nanopartikel kitosan optimum.
Teknik amobilisasi glukosa oksidase pada nanopartikel kitosan yang dilakukan pada penelitian ini, yaitu amobilisasi enzim pada permukaan nanopartikel kitosan. Polikationik alami pada kitosan dan adanya gugus amina primer pada struktur kimianya menyebabkan kitosan berpotensi untuk mengamobilisasi berbagai jenis enzim (Tang et al. 2006). Selain itu, Nakorn (2008) menjelaskan bahwa ukuran nanopartikel kitosan dapat meningkatkan luas permukaan dan gugus fungsi yang dapat berikatan dengan enzim sehingga meningkatkan amobilisasi enzim pada permukaan.
Glukosa oksidase yang telah diamobilisasi pada nanopartikel kitosan selanjutnya diamobilisasi pada EPKT. Enzim glukosa amobil diletakkan di permukaan EPKT dan dikeringkan di suhu 4oC. Pengeringan pada suhu ini berfungsi untuk menguapkan pelarut, memberikan kondisi yang sesuai untuk amobilisasi enzim, dan mencegah kerusakan aktivitas enzim (Surianty 2014). Enzim glukosa oksidase yang teramobilisasi pada nanopartikel kitosan akan menempel pada permukaan polianilin. Pengukuran aktivitas elektroda kerja enzim didasarkan pada proses transfer elektron yang permukaan elektroda kerja. Enzim glukosa oksidase akan menghasilkan elektron yang dihasilkan dari reaksi enzimatik pada substrat glukosa.
Penelitian ini menggunakan kalium ferisianida [K3(Fe(CN6)] sebagai
mediator yang berperan sebagai fasilitator atau penghubung dari proses transfer elektron tidak mungkin terjadi secara langsung antara permukaan elektroda dengan pusat redoks enzim (Rachmawati 2007). EPKT dengan mediator kalium ferisianida menghasilkan puncak anoda dan katoda sehingga EPKT yang terukur sebelum penambahan enzim dapat menimbulkan arus. Oleh karena itu, arus dari puncak anoda yang terbentuk pada EPKT sebelum penambahan enzim akan digunakan sebagai blanko terhadap elektroda enzim.
14
et al. (2012) dengan matriks amobilisasi berupa glutaraldehida dan polianilin. pH optimum enzim amobil yang dihasilkan pada penelitian ini juga mengalami pergeseran dari pH optimum enzim bebas, yaitu dari 5.5 ke 5.0 (Triana 2013). Optimasi pH yang dilakukan bertujuan mengetahui kondisi lingkungan yang paling sesuai untuk struktur dan sisi aktif enzim berikatan dengan substrat dan melakukan proses katalisis.
Perubahan pH optimum yang terjadi pada penelitian ini dapat disebabkan oleh perubahan konformasi enzim. Menurut Triana (2013), perubahan pH optimum dapat disebabkan oleh perubahan sisi aktif serta struktur enzim akibat adanya perubahan ionisasi pada asam amino penyusunnya. Gugus samping pada asam amino akan mengalami ionisasi akibat adanya pengaruh banyaknya ion H+ dan OH
-pada pH tertentu. Tahap ionisasi -pada pH tertentu akan berpengaruh terhadap pengikatan kompleks enzim dan substrat yang akan meningkatkan arus yang dihasilkan. Selain itu, perubahan pH optimum dapat disebabkan oleh pengaruh penambahan polianilin dalam meningkatkan arus. Colak et al. (2012) menjelaskan bahwa polianilin memiliki daya konduktivitas yang lebih tinggi pada larutan pH 5.2 dan pH 7.3. Hal ini disebabkan oleh aktivitas katalisis dari leukoemeraldin yang telah sebagian tereduksi untuk mereduksi oksigen sehingga daya konduktivitas meningkat pula. pH optimum yang diperoleh digunakan untuk tahap analisis aktivitas enzim selanjutnya.
Kinetika Enzim
Pengukuran elektroda glukosa oksidase/EPKT dengan variasi konsentrasi substrat dilakukan pada suhu ruang untuk memudahkan pada aplikasi bisensor yang lebih praktis. Kurva Michaelis Menten pada Gambar 4 menunjukkan laju pembentukan kompleks enzim-substrat dan laju produk dihasilkan. Kondisi penambahan konsentrasi glukosa sebelum 20 mM menunjukkan enzim belum berikatan secara seluruhnya pada substrat . Penambahan substrat yang lebih dari 20 mM menunjukkan bahwa enzim telah mencapai kondisi jenuh dengan substrat sehingga peningkatan jumlah substrat tidak berpengaruh signifikan (Mikkelsen dan Corton 2004). Lineritas suatu pengukuran digunakan untuk mengetahui daerah kerja maksimum dari elektroda enzim. Nilai koefisien determinasi yang diperoleh hampir memenuhi syarat yang ditetapkan. Menurut Safrizal (2011), nilai koefisien determinasi memenuhi syarat yang ditetapkan ICH (1995), yaitu sebesar 0.9970.
Kinetika enzim glukosa oksidase/EPKT ditentukan dengan metode Lineweaver-Burk berupa konstanta Michaelis-Menten (Km) dan laju reaksi
maksimum yang dinyatakan dalam arus maksimum (Imaks). Nilai Kmmenunjukkan
afinitas enzim terhadap substratnya. Nilai Kmbesar menunjukkan enzim mengikat
substrat lemah sehingga jumlah substrat yang lebih tinggi untuk menjenuhkan enzim. Nilai Kmyang kecil menunjukkan enzim mengikat substrat kuat sehingga
untuk menjenuhkan enzim diperlukan konsentrasi substrat yang rendah yang baik untuk aplikasi biosensor. Hal ini menunjukkan biosensor yang dihasilkan memiliki respon yang lebih cepat dan kemampuan membentuk kompleks enzim-subsrat kuat. Nilai Imaks yang tinggi menunjukkan aktivitas enzim tinggi yang ditunjukkan dalam
arus elektrik dan sebaliknya (Liyonawati 2013).
Nilai Km yang diperoleh dari penelitian ini lebih rendah dibandingkan
dengan Km glukosa oksidase murni, yaitu 33-110 mM (Sigma Aldrich 2014). Nilai
15 diamobilisasi memiliki afinitas yang lebih tinggi terhadap substrat dibandingkan dengan enzim glukosa oksidase murni. Nilai Km yang lebih rendah dipengaruhi oleh
penggunaan nanopartikel kitosan sebagai matriks amobilisasi enzim. Hal ini sesuai dengan hasil penelitian Tang et al. (2006) yang mengamobilisasi enzim lipase murni pada nanopartikel kitosan akan menurunkan nilai Km dari 1.01× 102 g/L
menjadi 0.37 ×102 g/L dan meningkatkan aktivitas katalitik enzimnya. Tang et al.
(2006) juga menjelaskan bahwa peningkatan aktivitas katalitiknya terjadi dengan pengikatan enzim dan nanopartikel kitosan untuk melindungi dari inaktivasi enzim.
Selain itu, nilai Km yang dihasilkan lebih rendah juga dipengaruhi oleh
penggunaan nanoserat polianilin sebagai matriks amobilisasi dan polimer konduktif. Enzim glukosa oksidase yang teramobil pada nanopartikel kitosan kemudian dijerap pada nanoserat polianilin. Nanoserat polianilin memiliki kemampuan sebagai matriks amobilisasi karena memiliki gugus fungsi amina reaktif (NH2) yang dapat berikatan dengan enzim glukosa oksidase. Nanoserat
polianilin selain berperan sebagai matriks amobilisasi juga meningkatkan nilai Imaks
pada elektroda glukosa oksidase/EPKT dengan sifat konduktivitasnya.
Nilai Km yang diperoleh pada penelitian ini dikonversi dalam satuan mg/dL,
yaitu 34.8 mg/dL. Nilai Km yang rendah menunjukkan bahwa elektroda glukosa
oksidase/EPKT cukup berpotensi sebagai biosensor glukosa darah. Berdasarkan nilai Km yang diperoleh, elektroda potensial untuk mendeteksi glukosa darah dalam
hipoglikemia, kondisi normal, dan hiperglikemia. Kadar glukosa darah manusia pada saat hipoglikemia jika berada di bawah 60 mg/dL, glukosa darah normal pada manusia jika berkisar 70 mg/dL–100 mg/dL, dan berada pada kondisi hiperglikemia jika di atas 270 mg/dL (Shan et al. 2010).
Nilai Km yang dihasilkan pada penelitian ini lebih tinggi dibandingkan
dengan nilai Km dari penelitian Colak et al. (2012) dengan matriks amobilisasi
glutaraldehida dan nanoserat polianilin. Hal ini menunjukkan bahwa elektroda glukosa oksidase/EPKT pada penelitian ini kurang efektif untuk mendeteksi glukosa darah jika dibandingkan dengan elektroda enzim yang dihasilkan Colak et al. (2012). Hal ini dapat disebabkan perbedaan matriks amobilisasi yang digunakan, yaitu antara glutaraldehida dan nanopartikel kitosan. Migneault et al. (2004) menjelaskan bahwa enzim yang terikat pada gugus amina (NH2) pada
glutaraldehida memiliki kestabilan tinggi dan tidak mudah larut yang mengurangi resiko inaktivasi enzim akibat pelipatan enzim. Walaupun nilai Km yang dihasilkan
pada penelitian ini lebih tinggi, elektroda glukosa oksidase/EPKT dengan matriks amobilisasi berupa nanopartikel kitosan masih cukup berpotensi untuk mendeteksi glukosa darah karena memiliki nilai Km yang lebih kecil dari kondisi hipoglikemia,
normal, dan hiperglikemia pada manusia.
16
SIMPULAN
Kondisi optimum untuk membuat nanopartikel kitosan berupa volume 300 mL dan waktu sonikasi 10 menit akan menghasilkan ukuran rata-rata sebesar 131.65 nm dengan indeks polidispersitas sebesar 0.02. Elektroda pasta karbon termodifikasi bersifat lebih konduktif dan dapat meningkatkan arus yang baik untuk pengembangan biosensor glukosa. Glukosa oksidase teramobil dalam elektroda pasta karbon termodifikasi nanoserat polianilin memiliki kinerja optimum pada pH 5.0 dan konsentrasi substrat 20 mM. Daerah kerja dan nilai sensitivitas pada glukosa oksidase/elektroda pasta karbon termodifikasi sebesar 0.6-1.8 mM dan 0.20 mA/mM. Nilai Km dan Imaks glukosa oksidase/elektroda pasta karbon termodifikasi
berpotensi untuk biosensor glukosa darah (1.93 mM dan 0.97 mA).
SARAN
Perlu dilakukan penelitian lanjutan mengenai optimasi nanopartikel kitosan untuk meningkatkan nilai rendemen dan menentukan suhu optimum dan efisensi penjerapan pada elektroda glukosa oksidase/EPKT (elektroda pasta karbon termodifikasi).
DAFTAR PUSTAKA
Aprianto D. 2014. Aktivitas antimikrob nanopartikel ekstrak kapang Veronaea sp. KT19 [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Bhumkar DR, Pokharkar VB. 2006. Studies on effect of ph on cross-linking of chitosan with sodium tripolyphosphate: a technical note. AAPS PharmSciTech. 7(2): 1-6.
Bisswanger H. 2002. Enzyme Kinetic: Principles and Methods. Germany (DE): Wiley-VCH.
Colak O, Arslan H, Zengin H, Zengin G. 2012. Amperometric detection of glucose by polyaniline-activated carbon composite carbon pasta electrode. Int. J. Electrochem. Sci. 7:6988-6997.
Ekaputra HR. 2013. Optimasi dan karakterisasi nanokurkuminoid tersalut asam palmintat [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Fadhilah R. 2013. Biosensor glukosa menggunakan GDH-FAD yang diamobilisasi pada nanopartikel zeolit secara elektrokimia [Tesis]. Bogor (ID): Fakultas Matematika dan Ilmu Pengetahuan Alam IPB.
Gaikwad PD, Shirale DJ, Gade VK, Savale VK, Kharat HJ, Kakde KP, Shirsat MD. 2006. Immobilization of GOD on electrochemically synthesized PANI film by cross-linking via glutaraldehyde for determination of glucose. Int. J. Electrochem. Sci. 1:425-434.
Gorecka E, Jastrzebska M. 2011. Immobilization techniques and biopolymer carriers. Biotechnol. Food Sci. 75 (1): 65-86.
17 Hardi J. 2012. Perilaku disolusi, stabilisasi, dan aktivitas antiinflamasi ketoprofen tersalut nanopartikel kitosan termodifikasi tripolifosfat [tesis]. Bogor (ID): Institut Pertanian Bogor.
Hielscher T. 2005. Ultrasonic production of nano-size dispersions and emulsion [internet]. [Diunduh 2014 Okt 25]. Tersedia pada: http://www.hielscher.com .
Hoshino T, Sekiguchi S, Muguruma H. 2012. Amperometric biosensor based on multilayer containing carbon nanotube, plasma-polymerized film, electron transfer mediator phenothiazine, and glucose dehydrogenase.
Bioelectrochemistry. 84:1-5. doi: 10.1016/j.bioelechem.2011.09.001.
Keyhanpour A, Mohaghegh SM, Jamshidi A. 2012. Glucose oxidase modified electrodes of polyaniline and poly (aniline-2-anilinoethanol) as biosensor : a comparative study. J Biosens Bioelectron. 3(1):1-7. doi: 10.4171/2155-6210.1000116.
Krajewska B. 2004. Application of chitin-and chitosanbased materials for enzyme immobilization: A review. Enzyme Microbial. Technol. 35 : 126-139. doi: 10.1016/j.enzmictec.2003.12.013.
Kurniasih M, Aprilita NH, Kartini I. 2011. Sintesis dan karakterisasi crosslink
kitosan dengan tripolifosfat pH 3. Molekul. 6(1):19-24.
Lidiniyah. 2011. Peningkatan jumlah nanopartikel kitosan terisi ketoprofen berdasarkan aragam surfakatan dan kondisi ultrasonikasi [tesis]. Bogor (ID): Institut Pertanian Bogor.
Lin Y, Sonaje K, Lin KM, Juang JH, Mi FL, Yang HW, Sung HW. 2008. Multi-ion-crosslinked nanoparticles with pH-responsive characteristics for oral delivery of protein drugs. J. Contr. Rel. 132: 141-149.
Liyonawati. 2013. Aktivitas dan stabilitas superoksida dismutase dari ekstrak
Escherichia coli diamobilisasi pada zeolit alam sebagai biosensor
antioksidan. [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Maddu A, Wahyudi ST, Kurniati M. 2008. Sintesis dan karakterisasi nanoserat polianilin. J. Nanosains Nanoteknologi. 1(2): 74-78.
Mardliyati E, Muttaqien SE, Setyawati DR, Rosidah I, Sriningsih. 2012. Preparasi dan aplikasi nanopartikel kitosan sebagai sistem penghantar insulin secara oral. Di dalam: Mardliyati E, Muttaqien SE, Setyawati DR, Rosidah I, Sriningsih, editor. Preparasi dan aplikasi nanopartikel kitosan sebagai sistem penghantar insulin secara oral : Prosiding InSiNas 2012 Intern Prosiding [internet]. [Waktu dan tempat pertemuan tidak diketahui]. Bandung (ID): BPPT. Hlm. 25-26; diunduh 2013 Okt 25]. Tersedia pada : http://insentif.ristek.go.id/PROSIDING_PHP/PROSIDING2012/file-MT-Word_04.pdf.
Migneault I, Dartiguenave C, Bertrand MJ, Waldron KC. 2004. Glutaraldehyde : behavior in aquous solution, reactions with protein, and applications to enzyme crosslinking. BioTechniques. 37(5):790-802.
Mikkelsen SR, Corton E. 2004. Bioanalytical Chemistry. Hoboken (US): John Wiley & Sons Inc.
Mohanraj VJ, Chen Y. 2006. Nanoparticles-a review. Tropic. J. Pharm. Research. 5(1): 561-573.
18
Mulyani R, Buchari, Noviandri, Ciptati. 2012. Studi voltametri siklik sodium dodesil benzen sulfonat dalam berbagai elektroda dan elektrolit pendukung.
J. Tekn. Pengelo. Limbah. 15(1): 51-56.
Nakorn PN. 2008. Chitin nanowhisker and chitosan nanoparticles in protein immobilization for biosensor applications. J. Metal. Mater. Mineral. 18(2): 73-77.
Nikmatin S, Maddu A, Purwanto S, Mandang T, Purwanto S. Analisa struktur mikro pemanfaatan limbah kulit rotan menjadi nanopartikel selulosa sebagai pengganti serat sintesis. Jurnal Biofisika 7(1): 41-49.
Rachmawati A. 2007. Modifikasi elektroda Au dengan asam 3-merkaptopropionat dan enzim glukosa oxidase sebagai sensor glukosa dengan mediator p-benzoquinone [skripsi]. Depok (ID): Universitas Indonesia.
Sabir S, Bhatti HN, Zia MA, Sheikh MA. 2007. Enhanced Production of glucose oxidase using Penicillium notatum and rice polish. Food Technol. Biotechnol. 45(4): 443 - 446.
Safrizal BF. 2011. Penentuan konsentrasi optimum superoksida dismutase, lineritas, dan stabilitas biosensor antioksidan menggunakan elektrode pasta karbon [skripsi]. Bogor(ID): Institut Pertanian Bogor.
Sigma Aldrich. 2014. Glucose oxidase from Aspergillu niger [Internet]. [diunduh 2014 Mei 28]. Tersedia dari: www.sigma-aldrich.com.
Shan C, Yang H, Han D, Zhang Q, Ivaskab A, Niu L. 2010. Graphene/AuNPs/chitosan nanocomposite film for glucose biosensing. J.
Biosensors and Bioelectronics 25: 1070-1074.
Shi LE, Tang ZX, Yi Y, Chen JS, Xiong WY, Ying GQ. 2011b. Immobilization of Nuclease p1 on Chitosan Micro-spheres. Chem. Biochem. Eng. Q. 25 (1): 8 3-88.
Suptijah P, Jacoeb AM, Rachmania D. 2011. Karakterisasi nanokitosan cangkang udang vannamei (Litopenaeus vannamei). J. Pengol. Hasil Pangan Ind.
14(2): 78-84.
Surianty, Akhiruddin, Ambarsari L. 2013. Studi elektrokimia polianilin komposit elektroda pasta karbon. J. Biofisika 9(2): 45-53.
Svancara I, Ogorevc B, Hocevar SB, Vytras K. 2002. Prespectives of carbon paste electrode in stripping voltametry. Anal. Sci. 18: 95-100.
Tang ZX, Qian JQ,. Shi LE. 2006. Characterizations of immobilized neutral proteinase on chitosan nano-particles. Process Biochem. 41(5): 1193-1197. doi: 10.1016/ j.Matlet.2006.01.048.
Triana R. 2013. Pemurnian dan karakterisasi enzim glukosa oksidase dari isolat lokal Aspergillus Niger (IPBCC.08.610) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Tsai ML, Bai SW, Chen RH. 2008. Cavitation effects versus stretch effects resulted in different size and polydispersity of ionotropic gelation chitosan-sodium tripolyphospate nanoparticle. Carbohydrate Polymer. 71: 488-457.
Vytras K, Svancara I, Radovan M. 2009. Carbon paste electrodes in electroanalytical chemistry. J. Serb. Chem. Soc. 74(10): 1021-1033. doi: 10.2298/JS0910021V.
19 editor. Sains Sebagai Landasan Inovasi Teknologi dalam Pertanian dan Industri. Seminar Nasional Sains III; 2010 Nov 13; Bogor, Indonesia. Bogor(ID): FMIPA-IPB. Hlm 41-47.
Wang H, Zhou C, Liang J, Yu Hao, Pedng Feng, Yang J. 2008. High sensitivity glucose biosensor based an Pt electrode position onto low-density aligned carbon nanotubes. Int. J. Electrochen. Sci. 3(11):1258-1267.
Wang J. 2001. Analytical Electrochemistry. Ed ke-2. New York (US): J Willey. Wei D, Ivaska A. 2006. Electrochemical Biosensors based on polyaniline. Chem.
Anal. 51: 839-852.
Xu Y, Du Y. 2003. Effect of molecular structure of chitosan on protein delivery properties of chitosan nanoparticles. Int. J. Pharmaceutics 250 (1): 215-226. Yen FL, Wu TH, Lin LT, Cham TM, Lin CC. 2008. Nanoparticles formulation of Cuscuta chinensis prevents acetaminophen-induced hepatotoxicity in rats.
20
Lampiran 1 Diagram alir penelitian
optimasi
Amobilisasi glukosa oksidase pada nanopartikel kitosan Formula A (volume 60 mL,
t ultrasonikasi 5 menit Preparasi nanopartikel
kitosan
Peningkatan volume
Variasi waktu ultrasonikasi
Preparasi elektroda pasta karbon
Elektroda pasta karbon
Elektroda Pasta Karbon Termodifikasi
Elektroda puncak arus tertinggi
Amobilisasi glukosa oksidase teramobil pada
EPKT
Karakterisasi glukosa oksidase/EPKT
pH optimum [substrat]
optimum sensitivitas
21 Lampiran 2 Karakteristik kitosan
Jenis Standar spesifikasi Hasil tes
Sumber Udang, kepiting, dll Kepiting
Penampakan fisik Putih - putih murni putih
Ukuran partikel Serbuk-bubuk #20-30
Derajat destilasi 85-89% 88.16%
Viskositas 10-500 cps 57.30 cps
Kadar air ≤ 10% 7.90%
Kadar abu ≤ 1.5% 0.73%
pH 7-8 sesuai
Lampiran 3 Perhitungan rendemen nanopartikel kitosan
Larutan Bobot tabung
kosong (g)
Bobot tabung + isi (g)
Bobot awal
kitosan (g)
Rendemen (%)
Emulsi nanokitosan
1.0600 1.1000 0.0450 88.889
Contoh perhitungan :
Rendemen = (Bobot tabung+isi)-(bobot tabung kosong) x 100%
Bobot awal kitosan
= 1.1000 -1.0600 x 100%
0.0450
= 88.89%
Lampiran 4 Hasil pengukuran nanoserat polianilin dengan uji SEM
(a) perbesaran 7500X sebelum pengukuran (b) setelah pengukuran Lampiran 5 Arus elektroda glukosa oksidase/EPKT variasi pH
Larutan pH E maks (V) I maks (mA)
asetat 4.0 0.895 0.8203
4.5 0.635 0.4146
5.0 0.800 1.8655
5.5 0.710 0.4739
6.0 0.685 0.2898
fosfat 6.5 0.470 0.4964
7.0 0.385 0.9147
7.5 0.350 0.5519
22
Lampiran 6 Arus elektroda glukosa oksidase/EPKT pada variasi konsentrasi
[Glukosa] (mM) I (mA) ΔI (mA)
Lampiran 7 Analisis nilai sensitivitas elektroda glukosa oksidase/EPKT Konsentrasi
Sensitivitas (S) = (arus [substrat] tertinggi – arus [substrat] terendah) ([substrat tertinggi] – [substrat terendah]) = Δ nilai arus
Δ [substrat]
23 Lampiran 8 Dokumentasi kegiatan
Nanopartikel kitosan Nanopartikel kitosan EPKT Sebelum sonikasi setelah sonikasi
24
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 30 September 1993 dari ayah Usman Hamzah dan Ibu Erdawati di Kelapa Kampit, Belitung Timur. Penulis merupakan putri kedua dari 3 bersaudara. Penulis lulus dari SMA Negeri 1 Pemali, Provinsi Bangka Belitung pada tahun 2010. Setelah itu, penulis melanjutkan pendidikan pada tahun yang sama di Institut Pertanian Bogor (IPB) melalui Jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN) dan diterima di Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis menjadi asisten praktikum Kimia Dasar TPB pada tahun ajaran 2011/2012. Penulis juga menjadi asisten praktikum Struktur dan Fungsi Biomolekul pada tahun ajaran 2012/2013, Biokimia Umum pada tahun ajaran 2013/2014, dan Pengantar Penelitian Biokimia pada tahun 2013/2014. Penulis juga aktif menjadi bendara divisi Creativity-Core di Community
Research and Education in Biochemistry (CREBS) tahun 2012/2013. Bulan
Juli-Agustus 2013, penulis melaksanakan Praktik Lapangan di Laboratorium Biosistematika dan Koleksi Kultur Mikroba Bidang Mikrobiologi yang bertempat di Pusat Penelitian Biologi Lembaga Ilmu Pengetahuan Indonesia (LIPI) dengan judul Pengujian Primer Spesifik untuk Deteksi Keberadaan Pseudomonas sp. dan
Bacillus sp. pada Pupuk Organik Hayati Beyonic- StarTmik LIPI. Penulis juga pernah menjadi penerima dana Program Kreativitas Mahasiswa (PKM) dengan judul Uji Khasiat Leunca (Solanum nigrum L) sebagai Obat Herbal Peluruh Batu Ginjal pada tahun 2012, Kajian In Vitro Takokak (Solanum torvum Swart) sebagai Peluruh Batu Ginjal pada tahun 2013, Aktivitas Ekstrak Kulit Buah Durian (Durio zibethinnus) sebagai Inhibitor α-Glukosidase In Vitro dan Antihiperglikemia pada Tikus Putih pada tahun 2013, dan Aktivitas Antikanker Metabolomik Sirih Merah (Piper Crotatum) terhadap Sel Kanker Serviks tahun 2013. Program Kreativitas Mahasiswa (PKM) dengan judul Aktivitas Antikanker Metabolomik Sirih Merah (Piper Crotatum) terhadap Sel Kanker Serviks menjadi finalis Tanoto Student