BIOSENSOR KOLESTEROL BERBASIS AMOBILISASI
KOLESTEROL OKSIDASE PADA PASTA KARBON
TERMODIFIKASI NANOSERAT POLIANILIN
ANDREA FAADILLAH ARGADANAH
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
i
PERNYATAAN MENGENAI SKRIPSI, SUMBER INFORMASI,
DAN PELIMPAHAN HAK CIPTA*
Saya menyatakan dengan sebenar-benarnya bahwa skripsi dengan judul Biosensor Kolesterol Berbasis Amobilisasi Kolesterol Oksidase pada Pasta Karbon Termodifikasi Nanoserat Polianilin adalah hasil karya saya sendiri dengan arahan Dosen Pembimbing Akademik, dan belum diajukan dalam bentuk apapun pada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Selain itu, saya dengan ini pula melimpahkan hak cipta dari karya tulis ini kepada pihak Institut Pertanian Bogor.
Bogor, Agustus 2015
Andrea Faadillah Argadanah
ii
ABSTRAK
ANDREA FAADILLAH ARGADANAH. Biosensor Kolesterol Berbasis Amobilisasi Kolesterol Oksidase pada Pasta Karbon Termodifikasi Nanoserat Polianilin. Dibimbing oleh LAKSMI AMBARSARI dan AKHIRUDDIN MADDU.
Nanoserat polianilin ditemukan dapat meningkatkan aktivitas enzim glukosa oksidase dalam elektroda sebagai biosensor amperometri glukosa. Oleh sebab itu, penelitian ini bertujuan menguji efek penggunaan nanoserat polianilin terhadap aktivitas kolesterol oksidase teramobil pada elektroda. Metode penelitian meliputi sintesis dan karakterisasi nanoserat polianilin, pengukuran voltamogram siklik elektroda pasta karbon (EPK) dan elektroda pasta karbon termodifikasi (EPKT), amobilisasi enzim, serta optimasi kondisi kerja elektroda. Hasilnya, EPKT sebagai media amobilisasi kolesterol oksidase dengan glutaraldehida sebagai agen pengikat silang dapat mendeteksi kadar kolesterol dalam kondisi hipokolesterolemia (normal <200 mg/dL). Sensitivitasnya sebesar 2.34 mA/mMcm2 pada pH 8 dan suhu 45oC. Afinitas substrat-enzim juga tinggi dengan Km 2.38 mM serta konsentrasi permukaan sebesar 0.002 mol/cm2. Imax yang dihasilkan sebesar 6.15 mA sehingga EPKTChod+Glu yang dihasilkan berpotensi sebagai biosensor kolesterol.
Kata kunci: biosensor, elektroda, kolesterol, kolesterol oksidase, polianilin
ABSTRACT
ANDREA FAADILLAH ARGADANAH. Cholesterol Biosensor Based on Immobilization of Cholesterol Oxidase on Carbon Paste Modified Polyaniline Nanofibre. Supervised by LAKSMI AMBARSARI and AKHIRUDDIN MADDU.
Polyaniline nanofibre was found to increase the activity of the enzyme glucose oxidase in glucose biosensors. Therefore, this study aims to examine the effects of the usage of polyaniline nanofibre as electrode on the amobilized cholesterol oxidase activity. Research methods include synthesis and characterization of polyaniline nanofibre, cyclic voltammogram measurement of carbon paste electrodes (CPE) and a modified carbon paste electrodes (MCPE), immobilization of enzymes, as well as the optimization of the electrode working conditions. The result, MCPE, as immobilization media of cholesterol oxidase with glutaraldehyde as crosslinking agent, can detect levels of cholesterol in hypocholesterolemia conditions (normal <200 mg/dL). Sensitivity of sensor is 2.34 mA/mMcm2 at pH 8 and temperature of 45oC. Affinity of substrate-enzyme is also high with Km and Imax of 2.38 mM and 6.15 mA respectively. Beside that, the surface concentration of 0.002 mol/cm2 so generated MCPEChod+Glu could be potentially as cholesterol biosensor.
i
BIOSENSOR KOLESTEROL BERBASIS AMOBILISASI
KOLESTEROL OKSIDASE PADA PASTA KARBON
TERMODIFIKASI NANOSERAT POLIANILIN
ANDREA FAADILLAH ARGADANAH
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
ii
PRAKATA
Puji syukur kepada Allah SWT yang telah melimpahkan karuniaNya sehingga pelaksanaan dan penyusunan skripsi dapat terselesaikan secara optimal. Skripsi yang berjudul “Biosensor Kolesterol Berbasis Amobilisasi Kolesterol Oksidase pada Pasta Karbon Termodifikasi Nanoserat Polianilin” disusun berdasarkan penelitian yang dilaksanakan pada bulan Januari-Mei 2015. Penelitian bertempat di Laboratorium Departemen Biokimia dan Laboratorium Bersama Departemen Kimia.
Ucapan terima kasih penulis tujukan kepada Dr Laksmi Ambarsari, MS selaku Dosen Pembimbing I dan Dr Akhiruddin Maddu, MSi selaku Pembimbing II. Ucapan terima kasih penulis juga sampaikan kepada Rini Kurniasih yang telah melakukan sintesis nanoserat polianilin dan melatar belakangi penelitian ini, Bapak Ahmad Yani yang telah menyediakan tabung elektroda EPK, serta para sahabat penulis di Departemen Biokimia Angkatan 48 yang selalu memberikan dukungan. Selain itu, penulis juga menyampaikan permohonan maaf atas segala kesalahan yang mungkin terjadi kepada seluruh pihak yang terlibat hingga penyusunan skripsi ini. Harapan penulis, karya tulis ini dapat bermanfaat sebagai dokumentasi tugas akhir bagi penulis serta sebagai referensi penelitian biosensor kolesterol selanjutnya.
Bogor, Agustus 2015
iii
DAFTAR ISI
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
METODE PENELITIAN 2
Waktu dan Tempat 2
Alat 2
Bahan 2
Prosedur Penelitian 2
HASIL 5
Karakter Nanoserat Polianilin 5
Voltamogram Siklik EPK dan EPKT 5
Enzim Teramobilasi pada Elektroda 6
Kondisi Optimum untuk Kinerja EPKTChod+Glu 8
PEMBAHASAN 11
Nanoserat Polianilin 11
Elektroda Pasta Karbon dan Elektroda Pasta Karbon Termodifikasi 12
EPKTChod 13
Pengaruh pH, Suhu, dan Konsentrasi pada Kinerja EPKTChod+Glu 15
SIMPULAN DAN SARAN 16
DAFTAR PUSTAKA 17
iv
DAFTAR TABEL
1 Potensial dan arus oksidasi maksimum pada EPK dan EPKT 6
2 Kadar protein terjerap dalam elektroda 7
DAFTAR GAMBAR
1 Morfologi polianilin dalam SEM 5
2 Voltamogram siklik EPK vs EPKT 6
4 Perbandingan voltamogram siklik EPKTChod+/-Glu 7 5 Voltamogram siklik EPKTChod+Glu terhadap pengaruh pH 8 6 Kurva pengaruh pH terhadap arus maksimum EPKTChod+Glu 8
7 Voltamogram siklik EPKTChod+Glu pengaruh suhu 9
8 Kurva pengaruh suhu terhadap arus maksimum EPKTChod+Glu 9 9 Voltamogram siklik EPKTChod+Glu pengaruh konsentrasi substrat 10
10 Kurva Michaelis Menten EPKTChod+Glu 10
11 Kurva Lineweaver-Burk EPKTChod+Glu 11
12 Reaksi protonasi basa emeraldina dan deprotonasi garam emeraldina 12
13 Konfigurasi elektroda 13
14 Pembentukan kompleks PANi-glutaraldehid-kolesterol oksidase 15 15 Reaksi oksidasi dan isomerisasi yang dikatalis Chod 15
DAFTAR LAMPIRAN
1 Bagan alir penelitian 20
2 Nanoserat polianilin 20
3 EPKTChod+Glu dengan dua kelompok perlakuan berbeda 21 4 Potensial dan arus oksidasi maksimum EPKTChod+/-Glu 21
5 Absorbansi BSA 21
6 Kurva standar BSA dengan metode Bradford 21
7 Perhitungan kadar protein terjerap pada elektroda 21 8 Potensial dan arus oksidasi terhadap variasi pH 22 9 Potensial dan arus oksidasi terhadap pengaruh suhu 22 10 Potensial dan arus oksidasi terhadap pengaruh konsentrasi substrat 22 11 Data kurva linear pengaruh konsentrasi terhadap arus oksidasi maksimum 23 12 Kurva hubungan konsentrasi standar kolesterol terhadap arus oksidasi 23
13 Perhitungan Km dan Imax 23
14 Perhitungan konsentrasi permukaan dan sensitivitas 23
1
1
PENDAHULUAN
Analisis klinis terhadap kolesterol dalam serum darah dianggap penting untuk mendiagnosis dan mencegah sejumlah gangguan kesehatan seperti hipertensi dan arteriosklerosis. Gangguan kesehatan tersebut berkorelasi positif dengan kadar kolesterol total dalam serum darah manusia serta penyakit jantung (Grundy et al. 2004). Saat ini, perkembangan teknologi telah memunculkan metode dan peralatan baru untuk mengukur kadar kolesterol total dalam serum darah. Penentuan kadar kolesterol serum darah secara konvensional pada skala laboratorium menggunakan berbagai metode seperti kromatografi lapis tipis, dan GC-MS. Meter kit yang dilengkapi strip tes berdasarkan reaksi enzimatis dan pengukuran fotometri juga telah beredar di pasaran. Namun, metode biosensor berbasis amobilisasi enzim dianggap sebagai metode paling cepat, spesifik, dan sensitif (Pundir et al. 2010). Biosensor merupakan perangkat yang memanfaatkan komponen biologis untuk menunjukkan jumlah biomaterial. Salah satu tipe biosensor yang banyak diteliti adalah biosensor amperometri. Tipe biosensor ini dapat mengubah informasi tentang konsentrasi senyawa kimia menjadi sinyal elektronika yang dapat dikuantifikasi (Nur et al. 2011). Penelitian-penelitian terhadap biosensor amperometri sejauh ini berkisar pada pencarian dan penentuan variasi metode dan material uji.
Penelitian Singh et al. (2005) menemukan biosensor amperometri kolesterol dengan menggunakan enzim kolesterol oksidase dan kolesterol esterase teramobil pada lapisan polianilin yang disintesis secara elektrokimia. Lapisan polianilin dalam biosensor amperometri berperan sebagai penjerap enzim dan media transfer elektron yang baik pada elektroda karena memiliki konduktivitas tinggi dan stabil dalam reaksi enzimatis. Namun, biosensor hasil penelitian Singh et al.
(2005) tersebut memiliki sensitivitas dan batas deteksi yang rendah, waktu penyimpanan pendek, serta waktu respon yang lama. Sementara itu, penelitian Kurniasih (2014) melaporkan bahwa nanoserat polianilin dapat meningkatkan aktivitas enzim glukosa oksidase dalam elektroda sebagai biosensor amperometri glukosa. Pembentukan polianilin menjadi nanoserat dinyatakan dapat meningkatkan luas permukaan sehingga dapat meningkatkan kemampuannya mentransfer elektron dari reaksi reduksi-oksidasi (Gospodinova dan Terlemezyan 1998). Proses amobilisasi enzim yang tepat dianggap dapat meningkatkan kinerja bisensor karena enzim dapat digunakan secara kontinu tetapi tetap stabil dan pemisahan antara produk dengan enzim dalam larutan terjadi lebih mudah.
2
2 Oleh karena itu, hal-hal tersebut mendasari penelitian ini untuk menguji pengaruh penggunaan nanoserat polianin terhadap aktivitas kolesterol oksidase teramobil pada elektroda. Cakupan tujuan tersebut antara lain menentukan peran polianilin dalam amoblisasi enzim, kondisi kerja optimum elektroda yang terdiri atas pH, suhu, dan parameter kinetika kolesterol oksidase teramobil pada elektroda (Km dan Imax). Dengan demikian, penelitian ini diharapkan dapat menjadi referensi pembuatan kit uji kolesterol yang lebih terjangkau dan akurat.
METODE PENELITIAN
Waktu dan Tempat
Penelitian ini berlangsung selama 5 bulan yakni pada bulan Januari-Mei 2015. Keseluruhan tahap penelitian dan dokumentasi kegiatan terlampir pada Lampiran 1 dan 15. Sebagian besar penelitian dilakukan di Laboratorium Penelitian Departemen Biokimia IPB dan Laboratorium Bersama Departemen Kimia Kampus IPB Dramaga untuk pengukuran voltamogram siklik.
Alat
Pengukuran voltamogram siklik menggunakan potensiostat eDAQ EA163 yang dilengkapi program EChem v2.1.0, e-corder 410, elektroda Ag|AgCl, dan elektroda Pt|Ti. Peralatan lainnya antara lain peralatan gelas, neraca analitik, pipet mikro 20-200 µL dan 0.5-10 µL, mortar, parafilm, pH meter (HANNA pH 21 pH/Mv meter), termometer, penangas air, hot plate, microplate COSTAR, serta SPEKTROstar®Nano BMG LABTECH.
Bahan
Kolesterol oksidase (Chod) diperoleh dari Sigma-Aldrich dengan nomer katalog C8868. Produk berasal dari mikroorganisme rekombinan yang terekspresi dalam E. coli dengan aktivitas spesifik 100U/mg. Sementara itu, nanoserat polianilin yang digunakan diperoleh dari penelitian Kurniasih (2014). Bahan-bahan lainnya terdiri atas bufer potasium fosfat 0.1 dan 0.05 M, kalium ferisianida 0.1 M, kalium klorida 3 M, akuades, parafin, serbuk grafit, glutaraldehida (Glu) 2.5%, standar kolesterol, membran dialisis (molecular-weight cutoffs 10 kDa), kain nilon, serta tabung elektroda (ukuran panjang 3 cm dan diameter 1 cm).
Prosedur Penelitian
Sintesis dan Karakterisasi Nanoserat Polianilin (Kurniasih 2014 Modifikasi Maddu et al. 2008)
3
3 dimasukkan ke dalam tabung eppendorf lalu diinkubasi semalam agar proses polimerisasi sempurna. Bagian larutan dibuang dan endapannya dicampurkan dengan akuabides lalu disentrifugasi. Proses tersebut diulang sebanyak tujuh kali. Selanjutnya, endapan dikeringkan dalam desikator. Pengamatan morfologi nanoserat polianilin dilakukan dengan Scanning Electron Microscope pada perbesaran 500 kali dan 7500 kali.
Voltametri Siklik Elektroda Pasta Karbon (EPK) dan Elektroda Pasta Karbon Termodifikasi (EPKT) (Kurniasih 2014 Modifikasi Colak et al. 2012)
EPK disiapkan dengan mencampurkan 100 µL parafin dan 0.15 gram serbuk grafit di dalam mortar hingga menjadi pasta. Selanjutnya, pasta karbon tersebut dimasukkan ke dalam tabung elektroda yang disiapkan dari kaca dengan diameter 0.8 cm dan panjang 3 cm. Salah satu bagian tabung disumbat dengan teflon yang dapat digerakkan ke luar dan ke dalam tabung kaca. Sementara itu, plat tembaga ditancapkan di bagian tengah teflon sebagai kontak listrik elektroda. Pengisian elektroda dengan pasta karbon dilakukan sebanyak tiga kali ulangan atau hingga memenuhi ¼ bagian tabung. Setelah itu, EPKT disiapkan dengan 2 mg polianilin yang dicampur ke dalam mortar dengan 100 µL parafin dan 0.15 g serbuk grafit. Pasta karbon kemudian dimasukkan ke dalam tabung elektroda lain yang telah disiapkan. Pengukuran elektrokimia dilakukan menggunakan seperangkat potensiostat eDAQ. EPK dan EPKT (elektroda kerja secara bergantian) bersama elektroda Ag|AgCl (elektroda pembanding) dan elektroda platina (elektroda pelengkap) dimasukkan ke dalam gelas kaca 10 mL yang berisi 3 mL larutan kalium klorida 3 M. Ketiga elektroda kemudian disambungkan dengan tiga kabel berbeda yang telah terhubung dengan potensiostat (Lampiran 15). Setelah itu, voltamogram siklik yang terbentuk diamati dan dianalisis nilai arus serta potensial maksimumnya menggunakan menu “Data pad” pada tampilan program EChem v2.1.0.
Amobilisasi Kolesterol Oksidase pada EPKT (Modifikasi Colak et al. 2012
dengan Pundir et al. 2012)
Kolesterol oksidase komersial (100U/mg) pada vial dilarutkan dalam 641 µL bufer potasium fosfat 0.05 M pH 7.5. Suspensi kemudian disimpan pada suhu 4oC hingga digunakan. Larutan standar kolesterol dibuat dengan melarutkan 50 mg kolesterol dalam 10 mL akuades. Selanjutnya, campuran dipanaskan dan diaduk perlahan hingga menjadi larutan. Larutan ini kemudian disimpan dalam pendingin bersuhu 11oC hingga digunakan.
4
4 diikat dengan parafilm pada bagian dinding kaca bagian luar elektroda. Ketika tidak digunakan, elektroda disimpan dalam lemari pendingin pada suhu 11oC dalam bufer potasium fosfat yang sesuai.
Voltamogram siklik EPKTChod+Glu (EPKT dengan Chod teramoil menggunakan glutaraldehida) dan EPKTChod-Glu (EPKT dengan Chod teramoil tanpa menggunakan glutaraldehida) kemudian diukur dalam 1 mL larutan bufer potasium fosfat 0.05 M pH 7.5 yang ditambah 1 mL kalium ferisianida 0.1 M dan 180 µL larutan standar kolesterol 500 mg/dL. Sementara itu, bufer bilasan elektroda ditentukan kadar proteinnya dengan metode Bradford. Larutan BSA 4-9 ppm digunakan sebagai larutan standar dalam pembuatan kurva standar. Pengukuran panjang gelombang maksimum dilakukan dengan konsentrasi standar BSA 6 ppm pada rentang 591-610 nm. Komposisi larutan uji terdiri atas 100 µ L larutan BSA yang ditempatkan dalam microplate dan ditambahkan dengan 100 µL reagen Bradford. Larutan kemudian diinkubasi selama 5 menit dan dikocok dalam SPEKTROstarNano. Larutan blanko dibuat dari campuran 100 µL akuades dengan 100 µL reagen Bradford. Setelah itu, pengujian dilanjutkan terhadap stok larutan amobil dan bufer bilasan elektroda.
Optimasi Kondisi Kerja Elektroda (Modifikasi Kurniasih 2014 dengan Pundir et al. 2012)
Penentuan pH optimum dilakukan dengan memasukkan masing-masing 1 mL larutan bufer potasium fosfat 0.1 M pH 6-9 (interval 0.5), 1 mL larutan kalium ferisianida 0.1 M, dan 180 µ L larutan standar kolesterol 500 mg/dL ke dalam dalam gelas kaca bervolume 5 mL. Elektroda Pt|Ti dan Ag|AgCl kemudian digunakan sebagai elektroda pelengkap dan pembanding. Voltamogram siklik diamati pada laju pemayaran 100 mV/s dengan rentang 1 mA dan 500-1500 mV pemayaran. Nilai puncak arus oksidasi pada voltamogram siklik diplotkan terhadap variasi pH uji untuk menentukan pH optimum kolesterol oksidasi dalam elektroda.
Selanjutnya, nilai pH optimum tersebut digunakan pada penentuan suhu optimum. Mula-mula, sebanyak 1 mL larutan bufer potasium fosfat 0.1 M pH 8, larutan kalium ferisianida 0.1 M, dan 180 µ L standar kolesterol 500 mg/dL, dimasukkan gelas kaca bervolume 5 mL. Aktivitasnya diukur pada suhu 35 oC, 40 o
C, 45 oC, 50 oC, 55 oC, dan 60 oC dengan bantuan penangas dan termometer. Nilai puncak arus oksidasi pada voltamogram siklik diplotkan terhadap variasi suhu uji untuk menentukan suhu optimum kolesterol oksidasi dalam elektroda.
Parameter kinetika enzim kemudian ditentukan dengan menggunakan larutan standar kolesterol. Konsentrasi larutan standar kolesterol yang digunakan dalam kurva Michaelis-Menten antara lain 0.05, 0.1, 0.15, 0.2, 0.4, 0.5, 1, 1.5, 2, dan 2.5 mM. Pengujian menggunakan 180 µL standar kolesterol yang dimasukkan ke dalam gelas kaca bervolume 5 mL lalu ditambah 1 mL bufer potasium fosfat 0.1 M pH 8 dan 1 mL kalium ferisianida 0.1 M. Elektroda Pt|Ti dan Ag|AgCl kemudian digunakan sebagai elektroda pelengkap dan pembanding.Voltamogram siklik yang terbentuk diamati dan diplotkan menjadi kurva Michaelis-Menten. Rentang konsentrasi substrat terhadap arus yang bersifat linier pada kurva tersebut digunakan untuk mendapatkan kurva linier. Selanjutnya, nilai konsentrasi substrat terhadap arus tersebut ditransformasi agar dihasilkan kurva Lineweaver-Burk (1/[S] terhadap 1/I).
5
5
HASIL
Karakter Nanoserat Polianilin
Nanoserat polianilin yang digunakan pada penelitian ini adalah hasil sintesis dari penelitian Kurniasih (2014) dan tidak dilakukan karakterisasi ulang. Polianilin sebagai polimer saling berikatan satu sama lain sehingga memiliki morfologi permukaan yang berserat dan berongga (Gambar 2B). Kurniasih (2014) menyebutkan ukuran nanoserat polianilin ini sekitar 110-120 nm, berbentuk butiran kasar, dan berwarna hijau tua kecoklatan (Lampiran 2).
Gambar 1 Morfologi polianilin dalam SEM dengan perbesaran (a) 500× dan (b) 7500× (Kurniasih 2014)
Voltamogram Siklik EPK dan EPKT
Voltamogram siklik memvisualisasikan besar arus yang yang dihasilkan oleh sel elektrokimia sebagai fungsi potensial. Sel elektrokimia yang dimaksud terdiri atas elektroda kerja (EPK dan EPKT), elektroda pelengkap (Pt|Ti), dan elektroda pembanding (Ag|AgCl) dalam larutan elektrolit yang diberi potensial. Pada setiap siklus dalam voltamogram siklik, puncak arus oksidasi muncul saat pemayaran depan yang dimulai dari titik 0.0 V menuju titik 0.8 V dan berbelok ke titik 0.0 V kembali. Sementara itu, puncak arus reduksi muncul saat pemayaran balik yang dimulai dari titik 0.0 V menuju titik -0.5 V kemudian berbelok kembali ke titik 0.0 V. Voltamogram siklik EPK dan EPKT teramati memiliki sepasang puncak arus redoks dengan peningkatan arus yang lebih besar pada voltamogram siklik EPKT. Peningkatan arus yang lebih besar diikuti dengan perbedaan luas daerah voltamogram siklik (Gambar 2).
6
6
al. 2014). Hal ini menunjukkan EPK dengan luas voltamogram siklik yang sempit bersifat kurang konduktif. Namun, pasta karbon yang dimodifikasi dengan penambahan polianilin menghasilkan voltamogram siklik yang lebih luas sehingga bersifat lebih konduktif dibandingkan EPK (Gambar 2).
Selain luas daerah voltamogram siklik, nilai arus oksidasi maksimum yang dihasilkan menjadi parameter lain untuk menunjukkan kualitas elektroda dalam menghantarkan elektron. Pemilihannya didasarkan reaksi dominan yang terjadi pada reaksi katalitik oleh kolesterol oksidase, yakni reaksi oksidasi (Vrielink dan Ghisla 2009). Peningkatan nilai arus oksidasi pada EPKT dibandingkan EPK diikuti dengan peningkatan potensial. Pada pengujian voltametri siklik dengan EPK, larutan KCl 3 M teroksidasi sempurna pada potensial -0.246 V dan menghasilkan arus 0.0216 mA. Sementara itu, larutan KCl 3 M dengan menggunakan EPKT sebagai elektroda kerja, baru teroksidasi sempurna pada potensial 0.958 V dan menghasilkan arus 0.6710 mA (Tabel 1). Kedua nilai potensial tersebut lebih kecil dibandingkan potensial redoks KCl yakni 1.36 V untuk Cl- dan 2.92 V untuk K+ sehingga arus redoks yang terbaca tidak berasal dari larutan KCl 3 M. Hasil yang didapatkan ini sesuai dengan penelitian Kurniasih (2014) yang menyatakan polianilin pada EPKT dapat meningkatkan kinerja EPK.
Gambar 2 Voltamogram siklik EPK ( ) dan EPKT ( )
Tabel 1 Potensial dan arus oksidasi maksimum pada EPK dan EPKT
Jenis Elektroda Kerja Potensial Maksimum (V) Arus Maksimum (mA)
EPK -0.246 0.0216
EPKT 0.958 0.6710
Enzim Teramobilisasi pada Elektroda
EPKT kemudian digunakan sebagai media amobilisasi enzim yang dibagi dalam dua kelompok perlakuan. Kelompok pertama menguji pengaruh penambahan glutaraldehida (Glu) yang terdiri atas EPKT dengan kolesterol oksidase teramobil menggunakan glutaraldehida (EPKTChod+Glu) dan tanpa glutaraldehida (EPKTChod-Glu). Sementara itu, kelompok kedua menguji pengaruh pH terhadap kinerja elektroda (Lampiran 3). Perbandingan voltamogram siklik EPKTChod+Glu dengan EPKTChod-Glu berada pada jumlah puncak arus
7
7 dan nilai puncak arus oksidasinya. EPKTChod+Glu menghasilkan dua puncak arus okidasi dan satu puncak arus reduksi sementara EPKTChod-Glu hanya menghasilkan satu puncak arus oksidasi pada voltamogram sikliknya (Gambar 4). Puncak arus okidasi EPKTChod+Glu berada pada 0.4811 dan 0.4843 mA sementara EPKTChod-Glu pada 0.9021 mA (Lampiran 4). Nilai kedua arus maksimum EPKTChod+Glu lebih kecil daripada EPKTChod-Glu. Namun, EPKTChod+Glu dipilih sebagai elektroda dengan respon terbaik berdasar kemunculan puncak arus redoks pada voltamogram sikliknya.
Sementara itu, absorbansi larutan standar protein (BSA) pada panjang gelombang 601 nm, dengan konsentrasi 4-9 ppm berada pada selang 0.2-0.8. Nilainya meningkat seiring peningkatan konsentrasi BSA (Lampiran 5). Plot konsentrasi BSA terhadap nilai absorbansinya menghasilkan persamaan linier y = 0.0671 dengan nilai koefisien determinasi 0.9859 (Lampiran 6). Koefisien determinasi merupakan besar keragaman dalam variabel Y (absorbansi) yang dapat diberikan oleh model regresi. Nilainya yang mendekati 1 menunjukkan model regresi yang diperoleh semakin sesuai (Kutner et al. 2004). Substitusi nilai absorbansi sampel ke dalam persamaan kurva standar sehingga kadar protein terlarut terhitung (Lampiran 7) dan rerata persen kadar protein terjerap dalam elektroda sebesar 97% dari larutan stok amobil (Tabel 2).
Gambar 4 Voltamogram siklik EPKTChod+Glu ( ) dan EPKTChod-Glu ( ) Tabel 2 Kadar protein terjerap dalam elektroda
Jenis Sampel ATerbaca ATerkoreksi [Protein]terlarut
(ppm)
Persen [Protein]terjerap (%)
Blanko 1.2234 0.0000 0.0000 -
Stok amobil 2.0425 0.8191 316.607 -
Bufer cucian EPKTChod-Glu 1.7638 0.5404 8.054 97
Bufer cucian EPKTChod+Glu 1.5964 0.3730 5.461 98
8
8 Kondisi Optimum untuk Kinerja EPKTChod+Glu
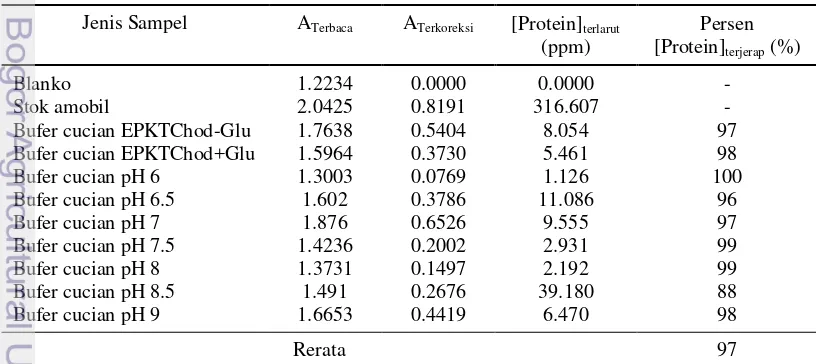
Variasi pH bufer potasium fosfat 0.1 M teramati mempengaruhi reaksi reduksi dalam sel elektrokimia. Pada pH 6, 6.5, 7, dan 9, puncak arus reduksi tidak terbentuk dan luas voltamogram sikliknya dari pH 6 terus mengecil hingga pH 7. Luas voltamogram siklik melebar kembali pada pH 7-8 lalu mengecil kembali setelah pH 8 (Gambar 5). Penyempitan dan pelebaran luas voltamogram siklik menunjukkan penurunan dan peningkatan kinerja elektroda (Zhu et al. 2012). Plot nilai pH uji terhadap nilai arus maksimumnya (Lampiran 8) sehingga didapatkan puncak nilai arus maksimumnya pada pH 8 (Gambar 6).
Gambar 5 Voltamogram siklik EPKTChod+Glu terhadap pengaruh pH. pH 6, pH 6.5, pH 7, pH 7.5, pH 8, pH 8.5, pH 9
9
9
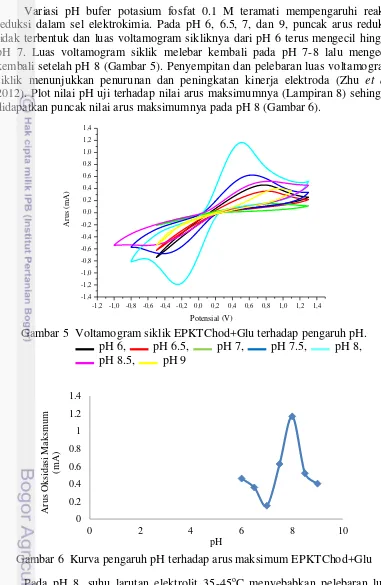
Gambar 7 Voltamogram siklik EPKTChod+Glu pengaruh suhu. 35 oC, 40 oC, 45 oC, 50 oC, 55 oC, 60 oC
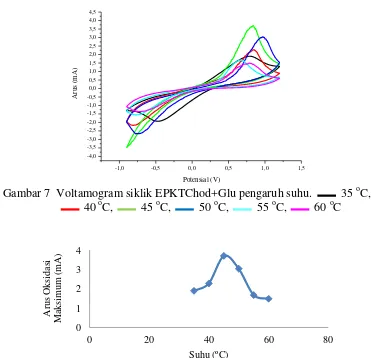
Gambar 8 Kurva pengaruh suhu terhadap arus maksimum EPKTChod+Glu Sementara itu, respon EPKTChod+Glu juga teramati pada konsentrasi substrat 0 mM yang menghasilkan puncak arus oksidasisekitar 1 mA. Luas voltamogram siklik selanjutnya melebar hingga konsentrasi standar kolesterol 1 mM. Namun, luas voltamogram siklik pada konsentrasi dari 0.1 mM ke 0.15-0.2 mM sempat mengalami penyempitan (penurunan kerapatan arus) kemudian melebar kembali dari 0.2 mM ke 0.4-1 mM. Posisi dan voltamogram siklik akhirnya relatif stabil pada konsentrasi standar kolesterol 1-2.5 mM. Selain itu, keseluruhan voltamogram siklik yang dihasilkan pada perlakuan variasi konsentrasi standar kolesterol, teramati memiliki puncak arus redoks (Gambar 9). Hal ini menunjukkan reaksi redoks yang terjadi pada sel elektrokimia tidak dipengaruhi konsentrasi substrat kolesterol oksidase dan tidak seperti pada perlakuan variasi pH dan suhu. Sementara itu, potensial maksimum pada konsentrasi 0-0.15 mM didapatkan menurun dari sekitar 0.8 V menjadi sekitar 0.5 V pada konsentrasi 0.2-2.5 mM sehingga reratanya terhitung 0.639 V (Lampiran 10).
10
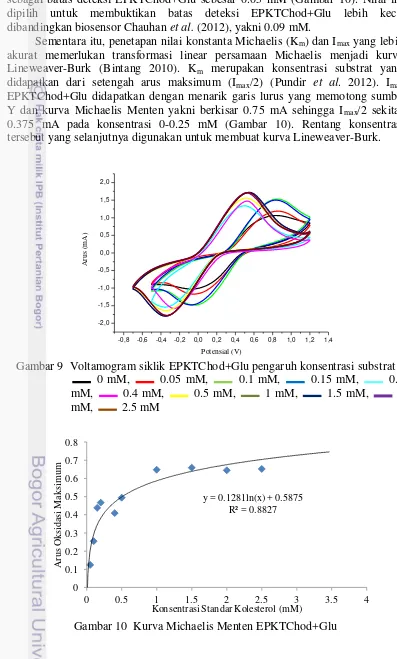
10 Michaelis Menten. Namun, respon elektroda menjadi konstan setelah konsentrasi standar kolesterol 1 mM. Konsentrasi standar kolesterol terkecil yang dicoba sebagai batas deteksi EPKTChod+Glu sebesar 0.05 mM (Gambar 10). Nilai ini dipilih untuk membuktikan batas deteksi EPKTChod+Glu lebih kecil dibandingkan biosensor Chauhan et al. (2012), yakni 0.09 mM.
Sementara itu, penetapan nilai konstanta Michaelis (Km)dan Imax yang lebih akurat memerlukan transformasi linear persamaan Michaelis menjadi kurva Lineweaver-Burk (Bintang 2010). Km merupakan konsentrasi substrat yang didapatkan dari setengah arus maksimum (Imax/2) (Pundir et al. 2012). Imax EPKTChod+Glu didapatkan dengan menarik garis lurus yang memotong sumbu Y dan kurva Michaelis Menten yakni berkisar 0.75 mA sehingga Imax/2 sekitar 0.375 mA pada konsentrasi 0-0.25 mM (Gambar 10). Rentang konsentrasi tersebut yang selanjutnya digunakan untuk membuat kurva Lineweaver-Burk.
Gambar 9 Voltamogram siklik EPKTChod+Glu pengaruh konsentrasi substrat 0 mM, 0.05 mM, 0.1 mM, 0.15 mM, 0.2 mM, 0.4 mM, 0.5 mM, 1 mM, 1.5 mM, 2 mM, 2.5 mM
Gambar 10 Kurva Michaelis Menten EPKTChod+Glu
11
11 Kurva linier antara konsentrasi standar kolesterol terhadap arus oksidasi maksimum diplotkan pada konsentrasi 0-0.3 mM (Lampiran 11). Kurva ini dapat digunakan untuk memplotkan 1/S (10-1 konsentrasi standar kolesterol) terhadap 1/I (10-1 arus). Persamaan linier yang didapatkan yakni y = 2.1286 dengan nilai koefisien determinasi 0.9422 (Lampiran 12). Koefisien determinasi merupakan besar keragaman dalam variabel Y (arus oksidasi maksimum) yang dapat diberikan oleh model regresi. Nilainya yang mendekati 1 menunjukkan model regresi yang diperoleh semakin sesuai (Kutner et al. 2004). Selain itu, persamaan ini juga dapat digunakan untuk menentukan kadar kolesterol serum darah manusia.
Plot 1/S terhadap 1/I disebut sebagai kurva Lineweaver-Burk dengan persamaan linier y = 0.3837x + 0.2112 dan nilai koefisien determinasi 0.9892. Pada kurva ini, nilai -1/Km merupakan titik saat sumbu Y bernilai 0 (Gambar 11). Nilai Km terhitung 2.38 mM sedangkan Imax sebesar 6.15 mA (Lampiran 13).
Gambar 11 Kurva Lineweaver-Burk EPKTChod+Glu
PEMBAHASAN
Nanoserat Polianilin
Sintesis dan karakterisasi nanoserat polianilin dilakukan untuk mendapatkan polimer pemodifikasi EPK yang berpotensi meningkatkan daya hantar listriknya. Polianilin (PANi) sebagai polimer dapat membantu perpindahan pasangan elektron dari hasil reaksi enzimatis dalam elektroda (Keyhanpour et al. 2012). Polianilin dapat disintesis dalam tiga bentuk yakni granuler, nanoserat, dan
nanotube. Namun, Gedela dan Vadali (2013) melaporkan bahwa elektroda yang dilapisi nanoserat PANi memiliki kinetika yang lebih cepat serta konduktivitas listrik yang lebih baik dibandingkan dalam bentuk granuler dan nanotube. Sifat tersebut berasal dari luas permukaan yang besar dan tingkat protonasi (penambahan proton oleh asam kuat terhadap gugus imina basa emeraldina) yang tinggi.
Sintesis nanoserat polianilin dapat menggunakan metode polimerisasi interfasial yang mengacu pada penelitian Maddu et al. (2008). Metode ini berdasarkan proses polimerisasi yang terjadi di antara batas dua fase larutan yakni fase organik dan fase air. Fase organik terdiri atas monomer anilin dalam larutan
12
12 toluena sementara fase air terdiri atas amonium peoksidisulfat dan HCl. Tahapan proses polimerisasi terdiri atas inisiasi, propagansi, dan terminasi. Pembentukan spesies reaktif (radikal) dan pengaktifan monomer oleh radikal terjadi pada tahap inisiasi. Monomer yang telah aktif mengikat monomer lainnya hingga terbentuk rantai polimer dalam bentuk basa emeraldina (EB) pada tahap propagasi dan terminasi. EB bersifat isolatif dan berbentuk cincin benzenoid dan quinoid yang dihubungkan melalui ikatan amin dan imin oleh atom nitogen (Jelle et al. 1993). EB yang terbentuk ditandai dengan endapan halus berwarna hijau kebiruan di lapisan antara kedua fase. Lama polimerisasi merubah warna endapan menjadi kehitaman dan kuantitas yang meningkat pada fase air. Pada tahap ini, EB mengalami protonasi menjadi garam emeraldina akibat penambahan proton oleh asam kuat seperti HCl (Gambar 12). Reaksi ini berlangsung secara reversibel dengan adanya agen reduktan seperti NH4OH. Garam emeraldina (ES) bersifat konduktif dan hidrofilik sehingga dapat berdifusi secara reaktif ke dalam fase air (Do Nascimento 2005). Perubahan warna tersebut menjadi indikator reaksi telah berlangsung sempurna.
Morfologi nanoserat polianilin yang dihasilkan Kurniasih (2014) ini serupa dengan hasil sintesis Surianty et al. (2013) yang menggunakan metode dan komponen senyawa yang sama. Namun, ukuran nanoserat yang didapatkan jauh lebih kecil dibandingkan milik Kurniasih (2014). Perbedaan ini kemungkinan terjadi karena hasil pengamatan SEM yang kurang akurat pada perbesaran yang berbeda sehingga penentuan ukuran nanoserat polianilin kurang tepat. Meskipun begitu, nanoserat polianilin ini berpotensi digunakan sebagai polimer pemodifikasi EPK (Kurniasih 2014). Hal ini didasarkan pada sifat konduktivitas dan luas permukaannya yang besar sehingga dapat meningkatkan peluang interaksi dengan senyawa lain.
Gambar 12 Reaksi protonasi basa emeraldina dan deprotonasi garam emeraldina (Do Nascimento 2005)
Elektroda Pasta Karbon dan Elektroda Pasta Karbon Termodifikasi
13
13 sebagai anoda, komponen larutan elektrolit dioksidasi sempurna menjadi bentuk tereduksi pada potensial tertentu sehingga elektron yang dilepaskan terbaca sebagai puncak arus oksidasi. Selanjutnya, elektron yang dilepaskan tersebut ditransfer menuju elektroda pelengkap (Pt|Ti) dengan bantuan larutan elektrolit (KCl 3M) dan direduksi menjadi bentuk teroksidasi kembali (Wang 2006).
Selain elektroda kerja dan elektroda pelengkap, elektroda pembanding juga diperlukan dalam teknik ini. Elektroda jenis ini nilai potensialnya telah diketahui dan bersifat stabil yakni tidak dipengaruhi oleh komposisi sampel. Elektroda ini berfungsi mengontrol potensial elektroda kerja dalam pengukuran voltametri siklik. Elektroda Ag|AgCl digunakan sebagai elektroda pembanding karena konstruksinya yang sangat sederhana dan bebas dari merkuri. Ketiga elektroda dalam sel elektrokimia berada pada posisi berurutan yakni elekroda Ag|AgCl (R), elektroda kerja (W), dan elektroda Pt|Ti (C) agar antara elektroda kerja dengan elektroda pelengkap dapat membentuk sirkuit elektron dan meminimalkan hambatan serta ketidakstabilan potensial (Gambar 13).
Perbandingan nilai arus oksidasi maksimum antara EPK dengan EPKT pada penelitian ini sesuai dengan penelitian Kurniasih (2014) yakni 1:6 tetapi dengan nilai yang berbeda. Perbedaan dipengaruhi jarak antara elektroda kerja dengan elektroda pelengkap. Jarak keduanya perlu dijaga sedekat mungkin agar meminimalkan hambatan dan ketidakstabilan dalam sel elektrokimia (Scholz et al.
2010). Peningkatan nilai arus oksidasi maksimum EPKT disebabkan nanoserat polianilin yang digunakan sebagai polimer pemodifikasi EPK. Polianilin sebagai polimer konduktif juga meningkatkan luas permukaan dan kepadatan pasta karbon dalam menerima serta mentransfer elektron (Gospodinova dan Terlemezyan 1998). Konduktivitas polianilin dapat ditentukan dengan mengukur tahanan listrik bahan (R) yang dinyatakan sebagai beda potensial setiap satuan arus listrik sementara konduktivitas dapat dinyatakan dengan hubungan R terhadap luas penampang setiap satuan jarak elektroda (Indayaningsih et al. 1997).
Gambar 13 Konfigurasi elektroda. (R) elektroda pembanding, (W) elektroda kerja, (C) elektroda pelengkap (Scholz et al. 2010)
EPKTChod
14
14 Namun, menurut penelitian Torres et al. (2012) yang menggunakan elektroda karbon termodifikasi poly(neutral red) sebagai media amobilisasi kolesterol oksidase, kinerja elektroda lebih tinggi terjadi tanpa penambahan glutaraldehid dibandingkan dengan yang ditambahkan glutaraldehid. Oleh karena itu, pengaruh penambahan glutaraldehid pada EPKTChod diamati untuk menentukan peran PANi sebagai matriks penyangga.
Selain glutaraldehida, komponen lain untuk amobilisasi enzim yakni bufer potasium fosfat dengan variasi pH 6-9 (interval 0.5) dan Bovine Serum Albumine
(BSA). Perlakuan variasi pH dalam amobilisasi bertujuan mengondisikan pH lingkungan enzim yang sesuai dengan penentuan pH optimum elektroda. Hal ini didasarkan proses amobilisasi yang dapat mengubah nilai pH optimum enzim karena perubahan daya terionisasi asam amino pada sisi aktif enzim (Colak et al. 2012). Sementara itu, fungsi penambahan BSA adalah sebagai agen penstabil dan pembawa larutan kolesterol yang sukar larut dalam akuades. Campuran larutan teramobil dalam permukaan pasta karbon melalui peristiwa adsorbsi fisik (Julianus 2009). Hasilnya, permukaan pasta karbon elektroda tampak sebagian terlapisi komponen amobil yang telah kering (Lampiran 3).
Kadar protein yang terjerap dalam elektroda juga ditentukan untuk mengevaluasi proses penetesan dan inkubasi komponen amobil dalam metode amobilisasi enzim. Penentuan kadar protein terjerap dilakukan menggunakan metode Bradford yang didasarkan pada pengikatan zat warna Coomassie Blue G-250 (reagen) oleh protein dan menghasilkan larutan berwarna biru. Panjang gelombang yang digunakan pada percobaan ini adalah 601 nm yang ditentukan pada rentang 501-610 nm. Penentuan ini didasarkan panjang gelombang pada daerah warna komplementer biru. Spektra warna jingga (berkomplementer dengan biru) berada pada panjang gelombang 588-610 nm (Bintang 2010). Spesifitas spektrofotometer dan kuvet yang digunakan juga mempengaruhi nilai panjang gelombang maksimum pada suatu metode pengujian. Persen kadar protein terjerap pada elektroda mendekati 100% (Tabel 2) sehingga menunjukkan keseluruhan proses penetesan dan inkubasi komponen amobil relatif efektif.
Puncak arus oksidasi pada voltamogram siklik EPKTChod menggambarkan reaksi pembentukan kolestenon telah berlangsung sempurna pada elektroda kerja. Sementara itu, puncak arus reduksi menggambarkan pemecahan hidrogen peroksida menjadi oksigen pada elektroda pelengkap (Gambar 15). Jumlah puncak maksimum pada voltamogram siklik EPKTChod+Glu mengindikasikan dua reaksi oksidasi dan satu reaksi reduksi telah terjadi pada sel elektrokimia (Singh et al. 2005) sedangkan reaksi katalitik oleh kolesterol oksidase terdiri atas satu reaksi redoks. Hal ini menunjukkan pembacaan arus oksidasi kurang stabil sehingga muncul puncak arus oksidasi kedua. Pembacaan arus dapat dipengaruhi konfigurasi ketiga elektroda dalam sel eletrokimia. Hambatan dan ketidakstabilan potensial dapat terjadi saat konfigurasi ketiga elektroda kurang tepat sehingga mengganggu pembacaan arus (Scholz et al. 2010). Perbedaan voltamogram siklik menunjukkan kinerja EPKTChod+Glu lebih baik daripada EPKTChod-Glu yang didukung dengan nilai kadar protein terjerapnya dan mewakili konsetrasi enzim yang terjerap pada elektroda. Konsentrasi enzim berbanding lurus dengan aktivitas enzim. Hal ini menguatkan hipotesis pengikatan gugus amina kolesterol oksidase pada PANi memerlukan glutaraldehida sehingga kurang sesuai dengan metode amobilisasi Torres et al. (2012).
15
15 Gambar 14 Pembentukan kompleks PANi-glutaraldehid-kolesterol oksidase
secara kovalen (Singh et al. 2005)
Gambar 15 Reaksi oksidasi yang dikatalis Chod (Singh et al. 2005) Pengaruh pH, Suhu, dan Konsentrasi pada Kinerja EPKTChod+Glu
Tujuan uji pengaruh pH, suhu, dan konsentrasi pada kinerja elektroda adalah menentukan efek amobilisasi terhadap aktifitas kolesterol oksidase. Pada pH optimum, asam amino pada sisi aktif kolesterol oksidase terionisasi sempurna sehingga enzim berada pada konformasi yang tepat dan dapat berinteraksi dengan kolesterol sehingga puncak arus oksidasinya optimum. Kinerja EPKTChod+Glu didapati optimum pada pH 8 (Gambar 6). Sementara itu, kolesterol oksidase dari mikroorganisme rekombinan yang terekspresi dalam E. coli memiliki aktivitas maksimum pada rentang pH 5.3-7.5 sementara pH optimumnya 6.5 (pada informasi produk).
Perubahan tersebut disebabkan oleh penggunaan polimer pada elektroda dan jenis matriks penyangga dalam amobilisasi enzim (Colak et al. 2012). Nanoserat polianilin yang digunakan dari penelitian Kurniasih (2014), dinyatakan sebagai polimer yang positif ([H+] tinggi karena protonasi). Penambahan bufer potasium fosfat pH 8 (basa) mengimbangi muatan polianilin dengan tepat mencapai pH optimum kolesterol oksidase awal.
Pada pH 6-7, puncak arus reduksi tidak terbentuk akibat molekul hasil oksidasi pada pemayaran awal (H2O2) tidak tereduksi. Hal ini disebabkan peningkatan konsentrasi H+ pada permukaan EPKTChod+Glu yang menyebabkan reaksi bergeser ke kiri (tetap pada bentuk H2O2). Sementara itu, ketidakmunculan puncak arus reduksi pada pH 9 disebabkan penurunan interaksi enzim substrat pada elektroda sehingga tidak lagi merespon secara sempurna terhadap reaksi redoks yang harusnya terjadi pada sel elektrokimia. Hal ini menunjukkan proses amobilisasi enzim pada EPKT meningkatkan nilai pH optimum kolesterol oksidase. Menurut Colak et al. (2012), proses amobilisasi dapat merubah daya terionisasi asam amino pada sisi aktif enzim.
16
16 mengubah substrat dan merupakan hasil kesetimbangan antara laju kenaikan aktivitas dan laju perusakan enzim (Bintang 2010). Jika suhu optimum EPKTChod+Glu dibandingkan dengan suhu optimum kolesterol oksidase bebas, suhu 45 oC masih berada pada selang 35-48 oC (Li et al. 2010). Sementara itu, suhu optimum EPKTChod+Glu ini juga sama dengan biosensor polianilin komposit nanotube karbon (Dhand et al. 2008) dan biosensor membran resin epoksi (Pundir et al. 2012).
Konsentrasi substrat dapat mempengaruhi respon elektroda (arus). Pada konsentrasi substrat yang rendah, perubahan respon elektroda akan berhubungan linier dengan konsentrasi substrat. Namun, respon elektroda tidak lagi bergantung dengan konsentrasi substrat saat konsentrasi substrat tinggi (Pundir et al. 2012). Nilai Km berhubungan dengan konstanta disosiasi (pemisahan molekul) dan asosiasi (penggabungan molekul) suatu enzim. Peningkatan nilai Km diikuti dengan peningkatan konstanta disosiasi dan penurunan konstanta asosiasinya sementara konstanta asosiasi relevan dengan ukuran afinitas substrat-enzim (Bintang 2010). EPKTChod+Glu pH 8 memiliki Km 2.38 mM yang lebih kecil dibandingkan Pundir et al. (2012), 5 mM. Hal ini menunjukkan afinitas substrat-enzim pada EPKT tinggi sehingga Imax yang dihasilkan jauh lebih besar (6.15 mA). Nilai Km tersebut setara dengan kadar kolesterol sebesar 92 mg/dL. Kadar kolesterol ini jauh berada pada kadar kolesterol total normal yakni <200 mg/dL atau termasuk dalam rentang keadaan hipokolesterolemia (Muharrami 2011). EPKTChod+Glu yang dihasilkan dapat mengukur kadar kolesterol dalam rentang paling minimum (dalam keadaan hipokolesterolemia) atau dapat dikatakan sensitif.
Selain itu, konsentrasi permukaan juga ditentukan dari plot potensial terhadap arus (voltamogram siklik) menggunakan persamaan Brown-Anson sehingga nilainya terhitung 0.002 mol/cm2 (Lampiran 14). Konsentrasi permukaan dinyatakan sebagai jumlah mol substrat yang dapat terjerap pada permukaan elektroda. Semakin besar nilainya maka performa elektroda tersebut semakin baik (Singh et al. 2005). Nilai sensitivitas juga dapat dihitung dengan menggunakan nilai Imax, Imin, konsentrasi standar kolesterol terbesar dan terkecil yang didapatkan pada kurva linier. Sensitivitas EPKTChod+Glu terhitung 2.34 mA/mMcm2 (Lampiran 14) yang menunjukkan setiap peningkatan 1 mM substrat dan 1 cm2 luas permukaan, maka arus yang dihasilkan sebesar 2.34 mA. Nilai konsentrasi permukaan dan sensitivitas tersebut lebih besar dibandingkan dengan biosensor Singh et al. (2005) dan elektroda Torres et al. (2012). Hal ini menunjukkan EPKTChod+Glu berpotensi sebagai biosensor kolesterol.
SIMPULAN DAN SARAN
Simpulan
17
17 dapat meningkatkan kinerja EPKTChod dibandingkan hanya dengan mengandalkan pengikatan kolesterol oksidase dengan polianilin. EPKTChod+Glu yang dihasilkan bekerja optimum pada pH 8 dan suhu 45oC. EPKTChod+Glu berpotensi dikembangkan menjadi biosensor dengan Km yang kecil 2.38 mM (92 mg/dL), Imax yang dihasilkan besar 6.15 mA, konsentrasi permukaan yang besar 0.002 mol/cm2, dan sensitivitas yang besar 2.34 mA/mMcm2.
Saran
Penelitian ini perlu dikembangkan lagi untuk mendapatkan biosensor yang akurat dan dapat digunakan secara kontinu. Pengembangan tersebut dapat berupa pengujian pengaruh kontaminan substrat dari pengukuran awal, uji kestabilan, dan transformasi bentuk elektroda menjadi strip uji yang praktis. Selain itu, perbaikan untuk metode penelitian serupa berikutnya perlu menggunakan elektroda pelengkap yang memiliki luas permukaan lebih besar dibandingkan dengan elektroda kerja agar tidak mempengaruhi pengukuran arus.
DAFTAR PUSTAKA
Bintang M. 2010. Biokimia Teknik Penelitian. Jakarta (ID): Erlangga.
Colak O, Arslan H, Zengin H, Zengin G. 2012. Amperometric detection of glucose by polyaniline-activated carbon composite carbon paste electrode. Int J Electrochem Sci. 7: 6988-6997.
Dhand C, Arya SK, Datta M, Malhotra BD. 2008. Polyaniline-carbon nanotube composite film for cholesterol biosensor. Anal Biochem. 83: 194-199.
Do Nascimento GM, Corio P, Novicks RW, Temperini MLA, Dresselhaus MS. 2005. Synthesis and characterization of single wall carbon nanotube doped emeraldine salt and base polyaniline nanocomposites. J of Polym Sci. 43: 815-822.
Gedela VR, Vadali VSSS. 2013. Polyaniline nanostuctures expedient as working electrode material in supercapasitors. Applied Phys A. 115: 189-197.
Gospodinova N, Terlemezyan L. 1998. Conducting polymers prepared by oxidative polymerization: polyaniline. Prog Polym Sci. 23: 1443-1484.
Grundy SM, HB Brewer, James IC, Sidney CS, Claude L. 2004. Definition of metabolic syndrome: report of the National Heart, Lung, and Blood, Institute.
Journal of the American Heart Association. 109: 433-438.
Indayaningsih N, Sudjono HK, Sukirman E, Hairudin U. 1997. Pembuatan dan pengukuran sifat listrik bahan Ag-β-Al2O3. Prosiding Pertemuan Ilmiah Sains
Materi [Internet]. Jakarta (ID): BATAN. hlm 296-300; [diunduh 2015 Agus 17]. Tersedia pada: digilib.batan.go.id.
Jelle BP, Hagen G, Hesjevik SM, Odegard R. 1993. Reduction factor for polianiline films on ITO from cyclic voltammetry and visible absorption spectra. Electrochimica Acta. 38: 1643-1647.
18
18 Kurniasih R. 2014. Glukosa oksidase teramobil glutaraldehida pada elektroda
pasta karbon termodifikasi nanoserat polianilin sebagai biosensor glukosa [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Kutner MH, Nachtsheim CJ, Neter J. 2004. Applied Multivariate Statistical Analysis. New York (US): McGraw-Hill.
Li Bo, Wei W, Feng Q W, Dong ZW. 2010. Cholesterol oxidase Chol is a critical enzyme that catalyzes the conversion of diosgenin to 4-ene-3-keto steroid in
Streptomyces virginiae IBL-14. Appl Microbiol Biotechnol. 85: 1831-1838. Maddu A, Wahyudi ST, Kurniati M. 2008. Sintesis dan karakteristik nanoserat
polianilin. Jurnal Nano Saintek. 1(2).
Muharrami LK. 2011. Penentuan kadar kolesterol dengan metode kromatografi gas. Agrointek. 5(1): 28-32.
Nur A, Debora P, Dian N, Arief W, Minta Y. 2011. Biosensor glukosa amperometrik dengan prussian blue/glucose oxidase yang diimobilisasi dengan metode sol-gel berbasis senyawa alkoksida. Di dalam: Heru S, editor.
Prosiding Seminar Nasional Fundamental dan Aplikasi Teknik Kimia
[Internet]. Surabaya (ID): Institut Teknologi Sepuluh November. hlm 1-5; [diunduh 2014 Nov 18]. Tersedia pada: lppm.uns.ac.id/ kinerja/files/pemakalah/lppm-pemakalah-2011-21082013103608.pdf.
Pundir CS, Jagriti N, Nidhi C, Preety, Renu S. 2012. An amperometric cholesterol biosesor based on epoxy resin membrane bound cholesterol oxidase. Indian J Med Res. 136: 633-640.
Singh S, Pratima RS, MK Pandey, BD Malhotra. 2005. Covalent immobilization of cholesterol esterase and cholesterol oxidase on polyaniline films for application to cholesterol biosensor. Analytica Chimica Acta. 568(2006): 126-132.
Scholz F, Bond AM, Compton RG, Fiedler DA, Inzelt G, Kahlert H, Lovric SK, Lohse H, Lovric M, Marken F, Neudeck A, Retter U, Stojek Z. 2010.
Electroanalytical Methods Second Edition. Berlin (DE): Springer.
Torres AC, M Emilia G, Christopher MAB. 2012. Poly(neutral red)/cholesterol oxidase modified carbon film electrode for cholesterol biosensing.
Electroanalysis. 24(7): 1547-1553.
Vrielink A, Ghisla S. 2009. Cholesterol oxidase: biochemistry and structural features. The FEBS Journal. 207(1): 6826-6843.
Wang J. 2006. Analitycal Electrochemistry Third Edition. Hoboken (US): John Wiley & Sons Inc.
Zhang H, Wang J, Gao X, Wang Z, Wang S. 2014. The electrochemical activity of polyaniline: an important issue on its use in electrochemical energy storage devices. SyntheticMetals. 187: 46-51.
Zhu J, Chen M, Qu H, Zhang X, Wei H, Luo Z, Colorado HA, Wei S, Guo Z. 2012. Interfacial polymerized polyaniline/graphite oxide nanocomposites toward electrochemical energy storage. Polymer. 53: 5953-5964.
19
19
20
20 Lampiran 1 Bagan alir penelitian
Lampiran 2 Nanoserat polianilin
Sintesis nanoserat polianilin
Karakterisasi nanoserat polianilin menggunakan SEM
Pembuatan elektroda pasta karbon (EPK) dan elektroda pasta karbon termodifikasi
nanoserat polianilin (EPKT)
Pengukuran voltamogram siklik EPK dan EPKT
EPKT dipilih sebagai media amobilisasi enzim
Penyiapan larutan enzim dan standar kolesterol
Amobilisasi kolesterol oksidase dengan dan tanpa glutaraldehida pada EPKT
Penentuan pH optimum EPKTChod+Glu
Penentuan suhu optimum pada pH optimum
Penentuan parameter kinetika kolesterol oksidase pada EPKT
EPKTChod+Glu dipilih untuk ditentukan kondisi kerja optimumnya
21
21 Lampiran 3 EPKTChod+Glu perlakuan +/-Glu dan +Glu dengan variasi pH
perlakuan +/-Glu perlakuan +Glu dengan variasi pH Lampiran 4 Potensial dan arus oksidasi maksimum EPKTChod+Glu dan
EPKTChod-Glu
Jenis Elektroda Potensial Oksidasi Maksimum (V) Arus Oksidasi Maksimum (mA)
EPKTChod+Glu 0.519
Lampiran 5 Absorbansi BSA
Konsentrasi (ppm) Absorbansi Terbaca Absorbansi Terkoreksi
0 1.1880 0
Lampiran 6 Kurva standar BSA dengan metode Bradford
Lampiran 7 Perhitungan kadar protein terjerap pada elektroda
Absorbansiterkoreksi = Absorbansisampel – Absorbansiblanko y = 0.0671x
y = Absorbansiterkoreksi
x = kadar protein terbaca (ppm)
FP (faktor pengenceran) = volume larutan/volume terpipet [protein]terlarut = kadar protein terbaca × FP
Persen [protein]terjerap =
22
22 Lampiran 8 Potensial dan arus oksidasi maksimum EPKTChod+Glu terhadap
pengaruh pH
Nilai pH Arus Oksidasi Maksimum (mA) Potensial Oksidasi Maksimum (V)
6.0 0.4591 0.774
Lampiran 9 Potensial dan arus oksidasi EPKTChod+Glu terhadap pengaruh suhu
Suhu (oC) Arus Oksidasi Maksimum (mA) Potensial Oksidasi Maksimum (V)
35 1.9002 0.785
Lampiran 10 Potensial dan arus oksidasi maksimum EPKTChod+Glu terhadap apengaruh konsentrasi standar kolesterol
23
23 Lampiran 11 Pengaruh konsentrasi terhadap arus oksidasi maksimum
Konsentrasi (mM) Arus Oksidasi Maksimum (mA) 1/[S] (mM-1) 1/I (mA-1)
Lampiran 12 Kurva hubungan konsentrasi standar kolesterol terhadap arus zoksidasi maksimum
Lampiran 14 Perhitungan konsentrasi permukaan dan sensitivitas
n d lu
0.5833 = d lu
= 0.002 mol/cm2
Sensitivitas = (Iterbesar– Iterkecil)/((Sterbesar– Sterkecil) × Lpermukaan pasta karbon) = (0.5833 – 0.1245)mA/((0.30 – 0.05)mM (3.14 × 0.52) cm2) = 2.34 mA/mMcm2
Keterangan:
Ip = Nilai puncak arus oksidasi terbesar pada kurva linier n = jumlah elektron yang ditransfer
F = konstanta Faraday (C/mol) A = luas permukaan elektroda (cm2) V = laju pemayaran (V/s)
24
24 Lampiran 15 Dokumentasi kegiatan
Proses amobilisasi enzim Sel elektrokimia EPKTChod+Glu
25
25
RIWAYAT HIDUP
Andrea Faadillah Argadanah lahir di Malang, Jawa Timur, pada 6 Februari
dari aya Su dan ibu Lilie Hanny’a Handajani, sebagai anak ketiga
dari tiga bersaudara. Penulis menamatkan SMA pada tahun 2011 dari SMA Negeri 1 Lawang, Malang dan pada tahun yang sama diterima di IPB melalui jalur SNMPTN Tulis. Penulis memilih Program Studi Biokimia, Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.