GLUKOSA OKSIDASE TERAMOBIL GLUTARALDEHIDA
PADA ELEKTRODA PASTA KARBON TERMODIFIKASI
NANOSERAT POLIANILIN SEBAGAI BIOSENSOR
GLUKOSA
RINI KURNIASIH
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul “Glukosa Oksidase Teramobil Glutaraldehida pada Elektroda Pasta Karbon Termodifikasi Nanoserat Polianilin sebagai Biosensor Glukosa” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Mei 2014
Rini Kurniasih
ABSTRAK
RINI KURNIASIH. Glukosa Oksidase Teramobil Glutaraldehida pada Elektroda Pasta Karbon Termodifikasi Nanoserat Polianilin sebagai Biosensor Glukosa. Dibimbing oleh LAKSMI AMBARSARI dan AKHIRUDDIN MADDU.
Enzim glukosa oksidase (GOD) sedang banyak dikembangkan dalam aplikasi sensor glukosa salah satunya untuk mengukur kadar glukosa darah, karena sifatnya yang spesifik terhadap oksidasi glukosa. Penelitian ini bertujuan untuk menentukan kondisi optimum dan parameter kinetika aktivitas enzim glukosa oksidase secara voltametri sebagai biosensor glukosa. Enzim GOD diamobilisasi dengan glutaraldehida secara cross linking pada elektroda pasta karbon termodifikasi polianilin. Polianilin disintesis dengan metode polimerisasi interfasial, menghasilkan morfologi berupa nanoserat berukuran 100-120 nm, dan memiliki konduktivitas yang baik. Kinerja elektroda pasta karbon termodifikasi (EPKT) polianilin lebih baik dibandingkan elektroda pasta karbon (EPK). Pengaruh pH dan suhu pada kinerja elektroda GOD/EPKT dianalisis secara voltametri, yang menunjukkan kinerja optimum GOD pada pH 4.5 bufer asetat konsentrasi 0.1 M dan pada suhu 650C. Parameter kinetika enzim diukur pada kondisi pH optimum, diperoleh nilai Km dan Imaks masing-masing sebesar 0.70
mM dan 4.24 mA dengan sensitivitas sebesar 1.81 mAmM-1.
Kata kunci: glukosa oksidase, polianilin, glutaraldehida, elektroda karbon pasta, biosensor
ABSTRACT
RINI KURNIASIH. Glucose Oxidase immobilizied with Glutaraldehyde on Modified Carbon Paste Electrode by Polyaniline Nanofiber as Biosensor of Glucose. Supervised by LAKSMI AMBARSARI and AKHIRUDDIN MADDU.
Glucose oxidase (GOD) is being developed in many applications such as glucose sensor to measure blood glucose levels, due to the specific activities of the oxidation of glucose. The purpose of this research is to determine optimum and kinetic parameters of glucose oxidase activity as biosensor by voltametry. GOD immobilized by cross linking with glutaraldehyde on polyaniline modified carbon paste electrode. Polyaniline synthesized by interfacial polymerization method, produces morphological form of nanofibers 100-120 nm, and has a good conductivity. The performance of modified carbon paste electrode (EPKT) polyaniline is better than carbon paste electrode (EPK). Effect of pH and temperature on the GOD electrode performance analyzed by voltametry, which showed optimum performance at pH 4.5 0.1 M acetate and at 650C. Enzyme kinetic parameters were measured at optimum pH conditions, and the Km values
obtained Imaks respectively 0.70 mM and 4.24 mA with a sensitivity of 1.81
mAmM-1.
GLUKOSA OKSIDASE TERAMOBIL GLUTARALDEHIDA
PADA ELEKTRODA PASTA KARBON TERMODIFIKASI
NANOSERAT POLIANILIN SEBAGAI BIOSENSOR
GLUKOSA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
RINI KURNIASIH
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Glukosa Oksidase Teramobil Glutaraldehida pada Elektroda Pasta Karbon Termodifikasi Nanoserat Polianilin sebagai Biosensor
Glukosa Nama : Rini Kurniasih NIM : G84100058
Disetujui oleh
Dr Laksmi Ambarsari, MS Pembimbing I
Dr Akhiruddin Maddu, MSi Pembimbing II
Diketahui oleh
Dr Ir I Made Artika, MAppSc Ketua Departemen Biokimia
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas rahmat dan karunia-Nya sehingga penelitian yang berjudul ” Glukosa Oksidase Teramobil Glutaraldehida pada Elektroda Pasta Karbon Termodifikasi Nanoserat Polianilin sebagai Biosensor Glukosa” dapat diselesaikan. Shalawat serta salam selalu tercurah kepada Nabi Muhammad SAW, keluarga, sahabat, dan para pengikutnya hingga akhir zaman. Penelitian ini diajukan sebagai salah satu syarat untuk memperoleh gelar sarjana sains pada Departemen Biokimia, yang dilaksanakan mulai bulan Januari hingga Mei 2014 di Laboratorium Biokimia, Laboratorium Bersama Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor, dan Laboratorium Pengujian Hasil Hutan, Balai Penelitian Kehutanan, Bogor.
Penulis mengucapkan terima kasih kepada Dr. Laksmi Ambarsari, MS dan Dr. Akhiruddin Maddu, MSi selaku pembimbing yang telah memberikan saran, kritik, bantuan dan bimbingannya selama penelitian berlangsung. Ucapan terima kasih juga penulis sampaikan kepada keluarga atas doa, bantuan serta dukungan moril yang telah diberikan selama masa perkuliahan hingga tugas akhir ini. Terima kasih juga penulis sampaikan kepada seluruh staf laboratorium dan staf komisi pendidikan Departemen Biokimia IPB, Kepala laboratorium bersama Dr. Henny Purwaningsih, SSi MSi dan staf laboratorium bersama departemen Kimia IPB atas pemberian izin menggunakan Potentiostat selama penelitian ini berlangsung. Penulis juga menyampaikan terima kasih kepada Surianty, MSi atas bantuan, dukungan serta saran untuk penelitian ini, teman-teman Biokimia 47 atas dukungan yang telah diberikan, teman-teman Kimia 47 atas kerja samanya dalam penggunaan Potentiostat, serta semua pihak yang telah membantu baik secara langsung maupun tidak langsung dalam penelitian ini.
Karya ilmiah ini masih terdapat kekurangan, oleh karena itu penulis menerima kritik dan saran sehingga tercapai hasil yang lebih baik dalam penelitian berikutnya. Semoga karya ilmiah ini bermanfaat bagi penulis, masyarakat, serta negara.
Bogor, Mei 2014
DAFTAR ISI
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
METODE 2
Bahan dan Alat 2
Prosedur Penelitian 3
HASIL 5
Hasil Sintesis dan Morfologi Nanoserat Polianilin 5
Voltamogram Siklik EPK dan EPKT 6
pH Optimum Kinerja Elektroda GOD/EPKT 8
Suhu Optimum Kinerja Elektroda GOD/EPKT 9
Parameter Kinetika Enzim 11
PEMBAHASAN 14
Hasil Sintesis dan Morfologi Nanoserat Polianilin 14
Kinerja Elektroda Pasta Karbon (EPK) dan EPK Termodifikasi (EPKT) 15
pH Optimum Kinerja Elektroda GOD/EPKT 17
Suhu Optimum Kinerja Elektroda GOD/EPKT 19
Parameter Kinetika Enzim 20
SIMPULAN DAN SARAN 22
Simpulan 22
Saran 23
DAFTAR PUSTAKA 23
LAMPIRAN 26
DAFTAR GAMBAR
1 Proses polimerisasi interfasial pada sintesis polianilin 6
2 Morfologi polianilin 6
3 Voltamogram siklik EPKdan EPKT 7
4 Voltamogram siklik GOD/EPKT pada pengaruh pH 8
5 Kurva pengaruh pH terhadap kinerja elektroda GOD/EPKT 9
6 Voltamogram siklik GOD/EPKT pada pengaruh suhu 10
7 Kurva pengaruh suhu terhadap kinerja elektroda GOD/EPKT 11
8 Hubungan ln I dan 1/T 11
9 Voltamogram siklik GOD/ EPKT terhadap konsentrasi glukosa 12 10 Kurva pengaruh konsentrasi glukosa terhadap kinerja GOD/ EPKT 13 11 Linieritas antara konsentrasi glukosa dan kinerja GOD/ EPKT 13
12 Kurva Lineweaver-Burk 14
13 Reaksi sintesis polianilin 15
DAFTAR LAMPIRAN
1 Alur penelitian 26
2 Nilai arus oksidasi glukosa pada pengaruh pH 27
3 Nilai arus oksidasi glukosa pada pengaruh suhu 27
4 Hubungan ln I dan 1/T 27
5 Nilai arus oksidasi glukosa pada pengaruh konsentrasi glukosa 27 6 Nilai arus oksidasi glukosa pada daerah linieritas 28
7 Persamaan Lineweaver-Burk 28
8 Perhitungan sensitifitas elektroda GOD/EPKT 28
PENDAHULUAN
Diabetes melitus (DM) merupakan salah satu penyakit degeneratif yang menjadi permasalahan di berbagai negara, termasuk Indonesia. Menurut data WHO, Indonesia menempati urutan ke-4 terbesar dalam jumlah penderita DM di dunia. Prevalansi DM termasuk tinggi di Indonesia yaitu mencapai 7.5% pada tahun 2001 dan 10.4% pada tahun 2004. DM menyebabkan 4.2% kematian pada kelompok umur 15-44 tahun di daerah perkotaan dan merupakan penyebab kematian tertinggi ke-6. Selain itu, DM juga merupakan penyebab kematian tertinggi ke-2 pada kelompok umur 45-54 tahun di perkotaan (14.7%) dan tertinggi ke-6 di daerah perdesaan (5.8%). Pada tahun 2010, penderita DM tercatat 88.48% diderita oleh perempuan, lebih banyak dibandingkan penderita DM pada laki-laki sebesar 11.52% (Ditjen Bina Upaya Kesehatan, Kemenkes RI 2012).
Agar dapat menekan tingginya prevalensi DM di Indonesia, tindakan pencegahan dan diagnosa dini merupakan langkah awal yang sangat penting untuk dilakukan. Namun hal ini mengalami kendala dikarenakan teknik diagnosa yang umum digunakan memiliki beberapa kekurangan, sehingga belum bisa dimanfaatkan oleh sebagian besar masyarakat. Teknik tersebut diantaranya adalah penggunaan kit diagnostik yang harganya tinggi karena merupakan produk impor. Hal ini mengakibatkan sebagian besar masyarakat maupun penderita Diabetes tidak dapat melakukan tindakan pencegahan maupun diagnosa dini. Selain itu, terdapat salah satu terapi yang paling banyak dilakukan oleh penderita DM yaitu dengan penyuntikan hormon insulin. Penyuntikan insulin harus dilakukan dengan hati-hati, karena jika berlebihan dapat menyebabkan hiperinsulin. Oleh karena itu dibutuhkan suatu alat pengukur kadar glukosa darah yang memiliki sensitifitas yang tinggi serta harga yang ekonomis.
Sensor berbasis enzim merupakan salah satu jenis biosensor, yakni sebagai suatu perangkat sensor yang menggabungkan senyawa hayati dengan suatu tranduser (Wang et al. 2007). Peranan enzim begitu penting dalam biosensor, terutama enzim glukosa oksidase (GOD) yang bersifat sensitif terhadap glukosa dan memiliki kemampuan mengoksidasi glukosa dalam darah menjadi asam glukonat dan hidrogen peroksida, dengan menggunakan molekul oksigen sebagai penerima elektron (Simpson et al. 2007). Kemampuan tersebut menjadikan enzim glukosa oksidase sangat berpotensi digunakan sebagai sensor dalam deteksi kadar glukosa darah. Proses amobilisasi enzim dapat meningkatkan kinerja biosensor karena kelebihan yang dimiliki enzim amobil dibandingkan enzim dalam kondisi bebas, yaitu dapat digunakan secara berulang dan berkesinambungan, memudahkan pemisahan enzim dengan produk dan larutan reaksi, serta meningkatkan kestabilan enzim. Sifat-sifat tersebut sangat diperlukan dalam kinerja enzim sebagai biosensor (Shuler dan Kargi 2012).
2
Polianilin (PANI) merupakan polimer konduktif yang mempunyai ikatan rantai terkonjugasi yang terbuat dari monomer anilin. Polianilin sangat berpotensi diaplikasikan dalam biosensor sebagai konduktor dalam reaksi enzimatis maupun matriks penjerap enzim, karena sifatnya yang mudah disintesis, monomernya murah dan memiliki kestabilan konduktivitas yang lebih baik dibandingkan polimer konduktif lainnya. Polianilin yang berukuran nano memberikan luas permukaan yang memungkinkan untuk bereaksi lebih besar dengan senyawa lain seperti enzim maupun substrat, sehingga polianilin dapat digunakan sebagai media massa elektron karena kemampuannya untuk mentransfer elektron yang dihasilkan oleh reaksi reduksi-oksidasi dari analat sehingga terbaca pada potensiometer (Gospodinova dan Terlemezyan 1998). Proses amobilisasi enzim menggunakan glutaraldehida secara cross linking, yaitu senyawa penjerap yang umum digunakan dalam teknik amobilisasi.
Berdasarkan informasi yang menyatakan bahwa penderita Diabetes Melitus semakin meningkat dari waktu ke waktu, namun upaya pencegahan dan diagnosa dini belum efektif dan optimal yang dikarenakan terdapat kekurangan dalam teknik diagnosa yang ada, maka penelitian mengenai pengembangan glukosa oksidase sebagai biosensor glukosa ini dilakukan. Tujuan penelitian ini adalah menentukan kondisi optimum (pH dan suhu) dan parameter kinetika aktivitas enzim glukosa oksidase sebagai elektroda enzim secara voltametri. Melalui penelitian ini, diharapkan dapat memberikan informasi mengenai kondisi optimum serta parameter kinetika dari kinerja elektroda GOD/EPKT tersebut, sehingga dapat menghasilkan kinerja yang lebih baik lagi sebagai biosensor pada penelitian berikutnya, sehingga dapat diaplikasikan dalam beberapa bidang seperti biomedis berupa biosensor glukosa yang memiliki kinerja sensor yang baik dan harga yang ekonomis untuk masyarakat luas.
Penelitian ini dilaksanakan selama 5 bulan (Januari hingga Mei 2014). Adapun tempat penelitian ini dilaksanakan di Laboratorium Biokimia, Laboratorium bersama Departemen Kimia IPB, serta Laboratorium Pengujian Hasil Hutan Puslitbang Keteknikan Kehutanan dan Pengolahan Hasil Hutan Bogor.
METODE
Bahan dan Alat
Bahan-bahan yang diperlukan dalam penelitian ini, antara lain enzim Glukosa Oksidase (EC 1.1.3.22 dimurnikan dari Aspergillus niger SIGMA, aktivitas 5204,3 Unit/mL), anilin 1 M, Amonium peroxidisulfat ((NH)4)S2O8),
HCl 1 M, toluena, akuabides, parafin, serbuk grafit, glutaraldehida 2.5%, bufer asetat 0.1 M, glukosa, KCl 0.1 M, kalium ferisianida (Fe(CN)6), akuades,
elektroda tembaga, elektroda Pt dan elektroda Ag/AgCl.
3
pipet volumetrik, mortar, parafilm, Potentiostat, desikator, pH meter (HANNA pH 21 pH/Mv meter), mikroskop elektron (SEM), thermometer, penangas dan stirrer.
Prosedur Penelitian
Sintesis dan Karakterisasi Nanoserat Polianilin (Modifikasi Maddu et al 2008)
Nanoserat polianilin disintesis dengan metode polimerisasi interfasial sistem dua fasa larutan organik/air. Fasa organik terdiri dari larutan anilin 1 M dalam toluena sebagai pelarutnya dengan volume total 50 mL. Fase air terdiri dari larutan HCl 1 M sebanyak 50 mL ditambahkan 0.6 gram ammonium peroxydisulfhide ((NH)4S2O8). Kedua larutan fasa tersebut dicampurkan ke dalam
satu botol, tanpa diaduk. Campuran larutan tersebut diinkubasi sepanjang malam agar proses polimerisasi berlangsung sempurna. Endapan yang terbentuk dari proses polimerisasi kemudian dicuci melalui sentrifugasi menggunakan akuabides. Pencucian endapan tersebut dilakukan hingga tujuh kali. Selanjutnya, endapan dikeringkan dalam desikator. Karakterisasi yang dilakukan meliputi uji morfologi dengan SEM (Scanning Electron Microscopy), yang dilakukan di Laboratorium Pengujian Hasil Hutan Puslitbang Keteknikan Kehutanan dan Pengolahan Hasil Hutan Bogor.
Pengukuran Voltamogram Siklik Elektroda Pasta Karbon (EPK) dan Elektroda Pasta Karbon Termodifikasi (EPKT) (Colak et al 2012)
Preparasi EPK dan EPKT. Elektroda Pasta Karbon (EPK) disiapkan dengan 100 µL parafin dicampur dengan 0,15 gram serbuk grafit di dalam mortar. Lalu, tabung elektroda yang telah disiapkan dari teflon (diameter 0,8 cm, panjang 3 cm) diisi dengan karbon pasta tersebut. Campuran parafin dan serbuk grafit dibuat tiga kali untuk dimasukkan ke dalam elektroda karbon pasta hingga tinggi karbon pasta dalam tabung sekitar 0,7 cm. Permukaan elektroda dihaluskan dengan kertas minyak hingga licin. Kontak listrik dibuat dari plat tembaga. Elektroda Pasta Karbon Termodifikasi (EPKT) disiapkan dengan 2 mg polianilin dicampur dalam mortar dengan 100 µL parafin dicampur dengan 0,15 gram serbuk grafit. Campuran parafin, polianilin dan serbuk grafit dalam EPKT juga dibuat tiga kali.
Pengukuran Voltamogram Siklik Kinerja EPK dan EPKT.
4
Uji Akitivas Glukosa Oksidase sebagai Elektroda pada EPKT
Preparasi Elektroda Enzim (GOD/EPKT) (Colak et al 2012). Sebanyak 50 µL enzim glukosa oksidase (5204,3 Unit/Ml), 1 mg bovine serum albumin (BSA), 50 µL 0,1 M bufer asetat pada variasi pH yang diuji (4.0 hingga 6.0), dan 30 µL 2,5% glutaraldehida dicampurkan dalam tabung eppendorf dan dikocok perlahan. Kemudian campuran tersebut diteteskan di atas permukaan EPKT. Elektroda GOD/EPKT tersebut dikeringkan pada suhu -40C. Setelah elektroda GOD/EPKT kering, lalu dicuci beberapa kali dengan bufer asetat pada masing-masing pH yang diuji untuk menghilangkan enzim maupun glutaraldehida yang tidak teramobilisasi. Elektroda disimpan dalam lemari pendingin refrigerator pada suhu 40C dalam bufer asetat 0.1 M sesuai pH ketika tidak sedang digunakan.
Penentuan pH Optimum pada Kinerja Elektroda GOD/EPKT.
Penentuan pH optimum dilakukan secara elektrokimia seperti pengukuran aktivitas EPK dan EPKT. Sebanyak 1 mL larutan bufer asetat 0.1 M pada masing-masing pH yang diuji, larutan kalium ferisianida 0.1 M, dan 180 µL glukosa 0.25 M ditambahkan ke dalam sel elektrokimia. Elektroda GOD/EPKT, Pt, dan Ag/AgCl dimasukkan ke dalam sel elektrokimia tersebut, kemudian voltamogram siklik yang terbentuk diamati.
Penentuan Suhu Optimum pada Kinerja Elektroda GOD/EPKT.
Penentuan suhu optimum dilakukan secara elektrokimia seperti pengukuran aktivitas pH optimum. Penetuan suhu optimum tersebut dilakukan pada kondisi pH optimum yang telah diketahui dari penentuan pH optimum sebelumnya. Sebanyak 1 mL larutan bufer asetat 0.1 M pH 4.0, larutan kalium ferisianida 0.1 M, dan 180 µL glukosa 0.2 mM ditambahkan ke dalam sel elektrokimia, lalu diukur aktivitasnya pada variasi suhu yang diuji yaitu 200C, 350C, 450C, 550C, 650C, dan 750C. Suhu diatur dengan dipanaskannya larutan uji pada penangas yang terus diamati melalui thermometer. Elektroda GOD/EPKT, Pt, dan Ag/AgCl dimasukkan ke dalam sel elektrokimia tersebut, kemudian voltamogram siklik yang terbentuk diamati.
Penentuan Parameter Kinetika. Penentuan parameter kinetika enzim ditentukan dengan penentuan aktivitas enzim pada variasi konsentrasi substrat, dan pH optimum yang telah diketahui. Larutan glukosa digunakan sebagai substrat. Larutan glukosa dibuat dengan beberapa konsentrasi berbeda, yaitu konsentrasi 0.2 – 8.0 mM. Larutan glukosa yang telah dibuat kemudian didiamkan semalam agar terjadi proses mutarotasi, yaitu perubahan glukosa dari α-D-glukosa menjadi β-D-glukosa.
5
Penentuan parameter kinetika elektroda GOD/EPKT ditentukan dengan terlebih dahulu dibuat kurva linieritas dari kurva Michaelis-Menten, lalu daerah linieritas yang diperoleh kemudian dibuat plot Lineweaver-Burk, kemudian ditentukan nilai Km dan Imaks.
HASIL
Hasil Sintesis dan Morfologi Nanoserat Polianilin
Sintesis polianilin bertujuan untuk memperoleh polianilin yang memiliki morfologi yang baik untuk digunakan sebagai bahan modifikasi dalam elektroda pasta karbon (EPK) yang dapat meningkatkan kinerja elektroda. Polianilin disintesis melalui metode polimerisasi interfasial yang mengacu pada penelitian Maddu et al. (2008), yaitu suatu metode sintesis polianilin dalam dua larutan fasa yang berbeda. Proses polimerisasi tersebut berlangsung diantara batas dua fasa larutan, yaitu fasa organik yang terdiri atas monomer anilin dalam larutan toluena sebagai pelarut dan fasa air yang terdiri atas Amonium peroxidisulfat dan HCl.
Toluena dipilih sebagai pelarut dalam fasa organik, dikarenakan anilin merupakan senyawa organik aromatik dengan rumus molekul C6H7N yang larut
dalam senyawa organik. Selain toluena juga dapat menggunakan senyawa organik lain seperti benzena, heksan, karbon tetraklorida, dietil eter, metilen klorida, karbon disulfida, dan kloroform (Huang dan Kaner 2003). Jenis senyawa organik yang digunakan sebagai pelarut dalam sintesis polianilin menurut Huang dan Kaner (2003) tidak terlalu berpengaruh terhadap bentuk dan ukuran polianilin yang dihasilkan. Sesaat setelah pencampuran kedua fasa tersebut, terjadi pemisahan larutan karena perbedaan fasa. Hal ini dapat dilihat pada Gambar 1, fasa organik berada pada lapisan atas (berwarna oranye) dan fasa air berada pada lapisan bawah (berwarna putih).
Proses polimerisasi dicirikan dengan terbentuknya endapan halus berwarna hijau kebiruan diantara batas lapisan fasa tersebut, yang kemudian secara perlahan bermigrasi menuju fasa air. Proses tersebut dapat dilihat pada Gambar 1. Polimerisasi dibiarkan selama 24 jam. Semakin lama waktu polimerisasi, endapan yang terbentuk diantara dua fasa menjadi berwarna hijau kehitaman, dengan jumlah yang semakin banyak pada fasa air. Hal ini menunjukkan bahwa reaksi polimerisasi telah berlangsung sempurna. Endapan tersebut merupakan polianilin yang dihasilkan dari proses polimerisasi interfasial. Setelah dilakukan proses pencucian beberapa kali dengan akuabides melalui sentrifugasi untuk menghilangkan pengotor pada endapan polianilin dan pengeringan dalam desikator, diperoleh endapan polianilin sebanyak 0.4 gram pada setiap pembuatan polianilin.
6
110 – 120 nm. Polianilin tersebut saling berikatan satu sama lain, sehingga membentuk pori dan serat. Morfologi polianilin yang diperoleh pada penelitian ini cukup baik untuk digunakan dalam elektroda GOD.
Gambar 1 Proses polimerisasi interfasial polianilin
Gambar 2 Morfologi polianilin. (a) perbesaran 500 kali, (b) perbesaran 7500 kali
Voltamogram Siklik Elektroda Pasta Karbon(EPK) dan Elektroda Pasta Karbon Termodifikasi (EPKT)
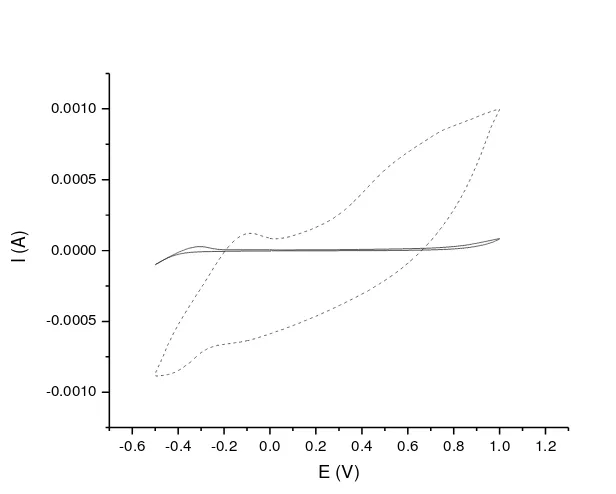
Pengukuran voltamogram siklik Elektroda Pasta Karbon (EPK) dan Elektroda Pasta Karbon Termodifikasi (EPKT) diperlukan untuk mengetahui kinerja elektroda dalam mendeteksi reaksi oksidasi-reduksi yang terjadi dalam teknik sensor. Voltamogram siklik merupakan suatu siklik yang menggambarkan pergerakan elektron yang dihasilkan dari suatu reaksi redoks yang terjadi pada permukaan elektroda kerja, seperti elektroda pasta karbon (EPK) dan elektroda pasta karbon termodifikasi (EPKT) (Zhang et al. 2014).
Pengukuran voltamogram siklik (VC) EPK dan EPKT dilakukan secara siklik voltametri, yaitu suatu metode pengukuran arus pada elektroda kerja sebagai fungsi dari potensial yang dioperasikan. Voltamogram EPK dan EPKT berupa kurva nilai arus terhadap tegangan pada reaksi oksidasi larutan elektrolit, KCl 3 M. Voltamogram siklik yang terbentuk dari EPK dan EPKT menunjukkan kinerja dari kedua elektroda tersebut terhadap larutan KCl 3 M dengan scan rate
7
dan elektroda bantu serta elektroda referensi yang sama. Voltamogram siklik yang terbentuk dari kinerja EPKT memiliki luas daerah siklik yang lebih besar dibandingkan voltamogram siklik EPK, yang dapat dilihat pada Gambar 3. Pada voltamogram siklik EPKT tersebut terbentuk puncak oksidasi yang lebih tinggi dibandingkan puncak oksidasi yang dihasilkan dari kinerja EPK.
Berdasarkan voltamogram siklik yang terbentuk, dapat diketahui nilai arus oksidasi pada puncak oksidasi yang dihasilkan dari kinerja kedua elektroda yang dapat dilihat pada Tabel 1, diketahui bahwa nilai arus oksidasi pada puncak anoda dari EPK diperoleh sebesar 2.76 x 10-5 A pada tegangan sebesar -0.304 V, sedangkan nilai arus oksidasi pada puncak anoda dari EPKT lebih besar dibandingkan EPK yaitu sebesar 12.09 x 10-5 A pada tegangan sebesar -0.085 V.
Terjadi peningkatan arus serta pergeseran nilai tegangan dari reaksi oksidasi pada EPK ketika dimodifikasi dengan penambahan nanoserat polianilin (EPKT). Peningkatan arus serta pergeseran nilai tegangan dari kedua elektroda karbon pasta tersebut jelas terlihat pada Gambar 3. Peningkatan arus pada EPKT tersebut menunjukkan bahwa kinerja EPKT dalam reaksi oksidasi suatu senyawa elektrolit lebih baik dibandingkan EPK. Hal ini dikarenakan pengaruh polianilin yang terdapat dalam EPKT sebagai bahan modifikasi, yang dapat meningkatkan kinerja elektroda.
Tabel 1 Arus oksidasi puncak anoda EPK dan EPKT
Sampel Potensial maksimum (V) Arus maksimum (A)
EPK -0.304 2.76 x 10-5
EPKT -0.085 12.09 x 10-5
Gambar 3 Voltamogram siklik kinerja EPK dan EPKT pada laju pemayaran 100 mVs-1, potensial 1 V, Initial E 0 mV, final E 0 mV, upper E 1000 mV dan lower E -500 mV. E = tegangan, I = arus, EPK, EPKT
-0.6 -0.4 -0.2 0.0 0.2 0.4 0.6 0.8 1.0 1.2 -0.0010
-0.0005 0.0000 0.0005 0.0010
I
(A)
E (V)
8
pH Optimum Kinerja Elektroda GOD/EPKT
Penentuan pH optimum dari aktivitas enzim Glukosa Oksidase (GOD) sebagai elektroda enzim dalam deteksi glukosa merupakan salah satu hal penting untuk mengetahui karakteristik dari enzim tersebut, agar dapat dikembangkan lebih lanjut dalam aplikasinya sebagai biosensor glukosa.
Kinerja elektroda GOD/EPKT dapat dipengaruhi oleh faktor lingkungan seperti kondisi pH dalam suatu reaksi. Penentuan pH optimum dalam kinerja elektroda GOD/EPKT dilakukan secara siklik voltametri dengan larutan kalium ferisianida sebagai mediator dalam reaksi elektrokimia tersebut, serta penggunaan elektroda Pt sebagai elektroda bantu dan Ag/AgCl sebagai elektroda referensi. Pengaruh pH pada kinerja elektroda GOD/EPKT ditentukan pada bufer asetat konsentrasi 0.1 M dengan rentang pH 4.0 – 6.0.
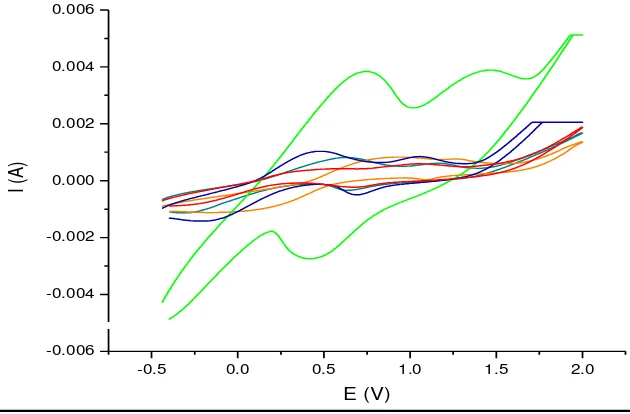
Berdasarkan nilai pH yang diuji (4.0, 4.5, 5.0, 5.5, dan 6.0), hasil voltamogram siklik yang diperoleh dari penentuan pH optimum tersebut menunjukkan terjadi reaksi oksidasi-reduksi dari elektroda GOD/EPKT yang dapat dilihat pada Gambar 4. Reaksi oksidasi lebih mudah diamati dibandingkan reaksi reduksi, melalui puncak oksidasi yang terbentuk pada voltamogram siklik.
Berlangsungnya reaksi oksidasi pada elektroda GOD/EPKT ditandai dengan peningkatan arus pada puncak oksidasi pada voltamogram siklik. Semakin baik kinerja elektroda GOD/EPKT terhadap substrat glukosa konsentrasi 0.25 M, maka puncak oksidasi yang terbentuk semakin tinggi. Berdasarkan hasil voltamogram siklik yang diperoleh, kinerja elektroda GOD/EPKT pada pengaruh pH yang diuji menunjukkan kinerja optimum pada kondisi pH 4.5 yang ditandai dengan terbentuknya puncak oksidasi tertinggi.
Gambar 4 Voltamogram siklik elektroda GOD/EPKT pada pengaruh pH bufer asetat konsentrasi 0.1 M dengan laju pemayaran 100 mVs-1, potensial 5 V, Initial E -500 mV, final E -500 mV, upper E 2000 mV dan lower E -500 mV. E = tegangan, I = arus, bufer Asetat pH 4.0, pH 4.5, pH 5.0, pH 5.5, pH 6.0
-0.5 0.0 0.5 1.0 1.5 2.0
-0.006 -0.004 -0.002 0.000 0.002 0.004 0.006
I (A)
9
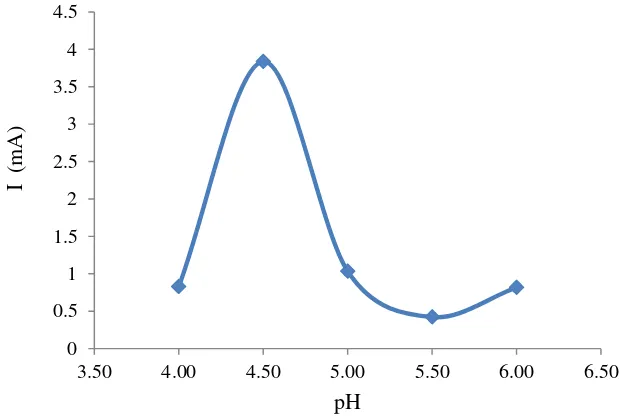
Nilai arus oksidasi pada voltamogram siklik tersebut kemudian dibuat kurva yang menghubungkan pengaruh pH terhadap nilai arus yang dihasilkan dari kinerja elektroda GOD/EPKT, yang dapat dilihat pada Gambar 5. Kurva tersebut menunjukkan bahwa reaksi enzim pada pH di bawah dan di atas 4.5 menghasilkan nilai arus yang rendah, sedangkan reaksi pada pH 4.5 menghasilkan arus tertinggi. Hal ini menunjukkan bahwa pH 4.5 merupakan pH optimum untuk aktivitas GOD sebagai biosensor yang diamobil oleh glutaraldehida pada elektroda pasta karbon termodifikasi nanoserat polianilin secara elektrokimia.
Gambar 5 Pengaruh pH terhadap kinerja elektroda GOD/EPKT dalam glukosa konsentrasi 0.25 M
Suhu Optimum Kinerja Elektroda GOD/EPKT
Penentuan suhu optimum dari aktivitas enzim Glukosa Oksidase (GOD) sebagai elektroda enzim dalam deteksi glukosa juga merupakan salah satu hal penting untuk mengetahui karakteristik dari enzim tersebut selain pH, karena pH dan suhu merupakan faktor penting yang mempengaruhi aktivitas suatu enzim.
Penentuan suhu optimum dalam kinerja elektroda GOD/EPKT dilakukan secara siklik voltametri dengan larutan kalium ferisianida sebagai mediator dalam reaksi elektrokimia tersebut, serta penggunaan sistem tiga elektroda meliputi elektroda Pt sebagai elektroda bantu dan Ag/AgCl sebagai elektroda referensi. Penentuan suhu optimum tersebut dilakukan pada kondisi pH optimum yang telah diperoleh dari pengujian sebelumnya, yaitu dalam bufer asetat pH 4.5 konsentrasi 0.1 M. Variasi suhu yang diuji untuk mengetahui kondisi optimum kinerja elektroda GOD/EPKT yaitu 200C, 350C, 450C, 550C, 650C, dan 750C diuji pada konsentrasi glukosa 0.2 mM.
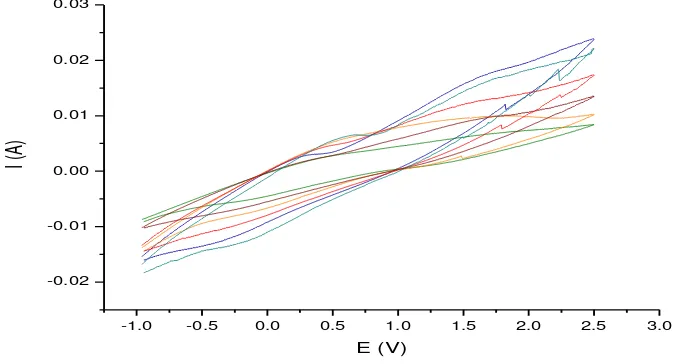
Berdasarkan hasil pengujian pengaruh suhu tersebut, voltamogram siklik yang terbentuk menunjukkan terjadi perbedaan kinerja elektroda GOD/EPKT pada tiap variasi suhu yang diuji. Puncak oksidasi pada voltamogram siklik yang terbentuk menunjukkan kinerja elektroda GOD/EPKT dalam mengoksidasi glukosa yang dinyatakan dalam nilai arus. Puncak oksidasi yang terbentuk pada
0
3.50 4.00 4.50 5.00 5.50 6.00 6.50
10
voltamogram siklik semakin tinggi dengan nilai arus yan semakin besar seiring tercapaikan suhu yang optimum untuk akitivitas enzim GOD (Gambar 6).
Gambar 6 Voltamogram siklik kinerja elektroda GOD/EPKT terhadap pengaruh suhu. Glukosa 0.2 mM. 200C, 350C, 450C, 550C, 650C, 750C
Nilai arus oksidasi pada voltamogram siklik tersebut kemudian dibuat kurva yang menghubungkan pengaruh suhu terhadap nilai arus yang dihasilkan dari kinerja elektroda GOD/EPKT, yang dapat dilihat pada Gambar 7. Kurva tersebut menunjukkan bahwa kinerja elektroda GOD/EPKT optimum pada suhu 650Cdengan menghasilkan nilai arus oksidasi tertinggi yaitu sebesar 18.811 mA. Hal ini menunjukkan bahwa enzim glukosa oksidase yang teramobil oleh glutaraldehid pada elektroda pasta karbon termodifikasi nanoserat polianilin bersifat termostabil, yakni dapat bertahan pada suhu tinggi. Proses amobilisasi menunjukkan dapat meningkatkan kestabilan enzim terhadap faktor lingkungan yang menentukan kinerja enzim tersebut.
Pada pengujian pengaruh suhu ini selain dapat mengetahui suhu optimum kinerja enzim glukosa oksidase sebagai elektroda enzim, juga dapat mengetahui besarnya energi aktivasi reaksi oksidasi glukosa dengan katalis enzim glukosa oksidase tersebut. Energi aktivasi tersebut dapat diperoleh dari slope pada persamaan kurva (Gambar 8) yang menghubungkan ln I dan 1/T, mengikuti persamaan Arhenius :
ln I = ln I0– Ea/RT
Berdasarkan persamaan tersebut, elektroda GOD/EPKT memiliki energi aktivasi reaksi oksidasi glukosa (Ea) sebesar 1.405 kJ/mol. Energi aktivasi oksidasi glukosa dalam katalis enzim GOD sebagai elektroda pada penelitian ini termasuk energy aktivasi yang cukup kecil dibandingkan penelitian lain, sehingga dapat dikatakan bahwa kinerja GOD sebagai katalis reaksi oksidasi memiliki kinerja yang cukup baik yang ditunjukkan dengan rendahnya energi aktivasi yang
-1.0 -0.5 0.0 0.5 1.0 1.5 2.0 2.5 3.0
-0.02 -0.01 0.00 0.01 0.02 0.03
I (A)
11
ditimbulkannya, dapat menurunkan energi aktivasi oksidasi glukosa dengan sangat besar.
Gambar 7 Pengaruh suhu terhadap kinerja elektroda GOD/EPKT dalam glukosa konsentrasi 0.2 mM
Gambar 8 Hubungan ln I dan 1/T
Parameter Kinetika Enzim
Penentuan parameter kinetika enzim GOD diperlukan untuk mengetahui karakteristik dari aktivitas GOD tersebut sebagai elektroda enzim, yang dapat digunakan sebagai informasi dasar untuk pengembangan elektorda GOD tersebut selanjutnya. Parameter kinetika GOD yaitu nilai Km dan Imaks ditentukan
12
voltametri. Voltamogram siklik yang dihasilkan dari kinerja GOD/EPKT terhadap variasi konsentrasi glukosa yang diuji dapat dilihat pada Gambar 9. Voltamogram siklik tersebut menunjukkan terbentuknya puncak oksidasi dari elektroda tersebut.
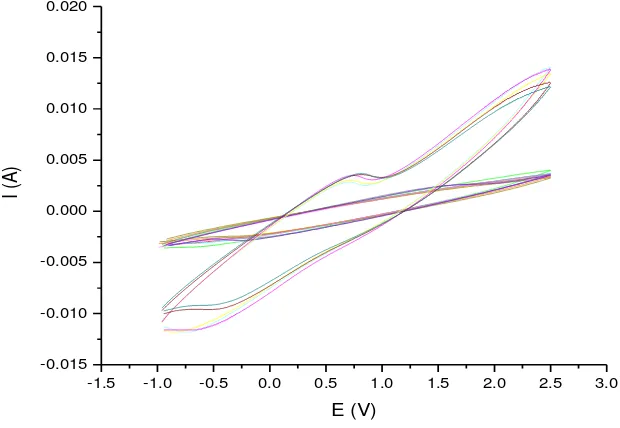
Gambar 9 Voltamogram siklik elektroda GOD/EPKT pada pengaruh konsentrasi glukosa. 0.2 mM, 0.4 mM, 0.6 mM, 0.8 mM, 1.0 mM, 1.2 mM, 1.4 mM, 1.6 mM, 1.8 mM, 2.0 mM, 4.0 mM, 6.0 mM, 8.0 mM
Puncak oksidasi pada voltamogram siklik tersebut menunjukkan terdapat reaksi oksidasi glukosa oleh enzim GOD. Berdasarkan puncak oksidasi pada voltamogram siklik tersebut, dapat diketahui nilai arus oksidasi yang dihasilkan dari reaksi oksidasi glukosa pada setiap konsentrasi.
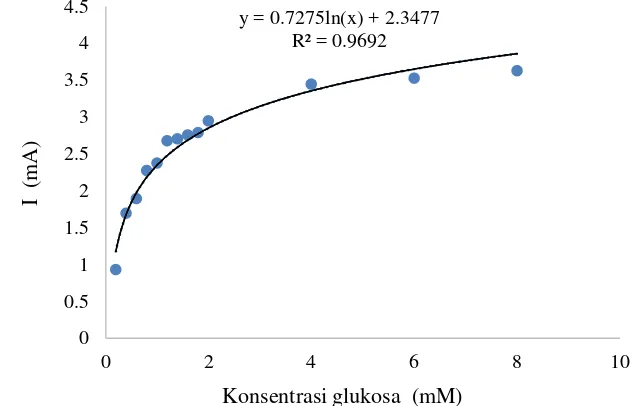
Dalam penentuan parameter kinetika, terlebih dahulu ditentukan kurva Michaelis-Menten dan kurva linieritas hubungan antara konsentrasi glukosa dan nilai arus oksidasi elektroda GOD/EPKT. Kurva Michaelis-Menten diperoleh dengan menghubungkan nilai arus yang dihasilkan pada puncak oksidasi dalam voltamogram siklik elektroda GOD/EPKT terhadap konsentrasi substrat glukosa yang diuji. Berdasarkan kurva Michaelis-Menten yang dapat dilihat pada Gambar 10, ketika konsentrasi glukosa di bawah 4 mM, kinerja elektroda GOD/EPKT terhadap substrat terus mengalami peningkatan seiring dengan peningkatan konsentrasi glukosa, aktivitas enzim meningkat seiring dengan peningkatan konsentrasi substrat. Namun, ketika konsentrasi glukosa mencapai 4 mM aktivitas GOD mulai mencapai maksimum, sehingga peningkatan konsentrasi glukosa yang lebih tinggi dari 4 mM tidak memberi pengaruh yang signifikan terhadap nilai arus oksidasi yang dihasilkan oleh elektroda GOD/EPKT.
Kurva linieritas antara konsentrasi substrat glukosa terhadap nilai arus elektroda GOD/EPKT ditentukan berdasarkan kurva Michaelis-Menten (Gambar 10). Daerah linier dari kinerja elektroda GOD/EPKT berada pada rentang konsentrasi 0.2 – 1.0 mM, dengai nilai regresi (R2) sebesar 0.9851 (Gambar 11). Persamaan Lineweaver-Burk dalam penentuan nilai Km dan Imaks ditentukan
berdasarkan kurva linieritas yang diperoleh (Gambar 12). Berdasarkan persamaan
-1.5 -1.0 -0.5 0.0 0.5 1.0 1.5 2.0 2.5 3.0
-0.015 -0.010 -0.005 0.000 0.005 0.010 0.015 0.020
I (A)
13
tersebut, diketahui bahwa nilai Km dan Imaks untuk aktivitas Glukosa oksidase
dalam elektroda pasta karbon termodifikasi nanoserat polianilin sebagai biosensor glukosa masing-masing sebesar 0.70 mM dan 4.24 mA. Berdasarkan nilai arus dan konsentrasi pada kurva linieritas tersebut juga ditentukan nilai sensitivitasnya, diperoleh sensitivitas untuk kinerja elektroda GOD/EPKT terhadap oksidasi glukosa pada penelitian ini sebesar 1.18 mAmM-1.
Gambar 10 Pengaruh konsentrasi substrat glukosa terhadap nilai arus elektroda GOD/EPKT
Gambar 11 Linieritas antara konsentrasi substrat glukosa dan aktivitas GOD/EPKT
0.000 1.000 2.000 3.000 4.000 5.000 6.000
14
Gambar 12 Kurva Lineweaver-Burk dalam penentuan parameter kinetika
PEMBAHASAN
Hasil Sintesis dan Morfologi Nanoserat Polianilin
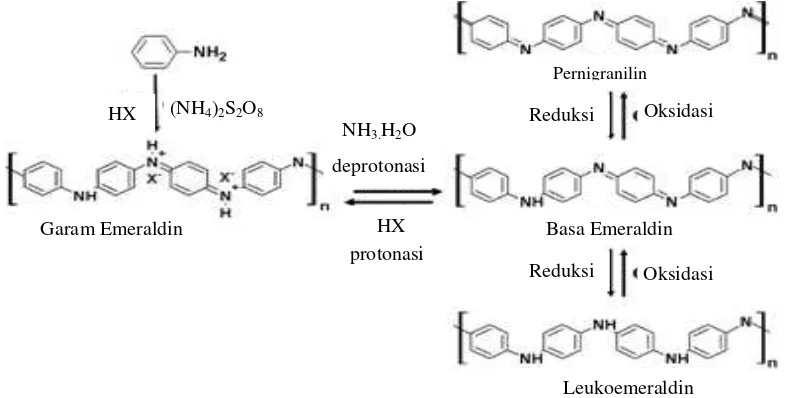
Polianilin yang disintesis pada penelitian ini dengan metode polimerisasi interfasial, merupakan polianilin dalam bentuk garam emeraldin, yang bersifat hidrofilik (Maddu et al. 2008). Sifat hidrofilik tersebut menyebabkan endapan polianilin yang terbentuk berdifusi secara reaktif ke dalam fasa air (Virji et al.
2009; Huang dan Kaner 2004)
Sintesis polianilin dengan metode polimerisasi interfasial berhasil membentuk nanopartikel polianilin dengan morfologi yang menunjukkan berbentuk serat, berpori, dan berukuran sekitar 100-120 nm. Ukuran nanoserat polianilin yang dihasilkan pada penelitian ini berbeda dengan hasil penelitian Huang dan Karen (2003), yang berukuran rata-rata 30 nm. Hal ini dapat dikarenakan rasio konsentrasi Amonium peroksidisulfat sebagai oksidan dan anilin yang digunakan berbeda. Namun, menurut Huang dan Karen (2003), faktor utama yang mempengaruhi bentuk serta ukuran polianilin adalah tingkat polimerisasi polianilin.
Semakin tinggi tingkat polimerisasi, maka polianilin yang terbentuk memiliki struktur yang semakin berserat dan berukuran semakin kecil. Tingkat polimerisasi tersebut dipengaruhi oleh konsentrasi asam yang digunakan, yang berperan penting dalam proses protonasi yang merupakan salah satu tahap dari polimerisasi polianilin. Protonasi tersebut adalah penambahan proton oleh asam kuat terhadap gugus nitrogen imina pada basa emeraldin atau anilin. Gugus imina lebih mudah terserang oleh proton dari asam kuat tersebut (Song dan Choi 2013). Semakin tinggi konsentrasi asam, maka semakin tinggi pula konsentrasi proton yang ditambahkan dalam tahap protonasi tersebut, sehingga semakin banyak terbentuknya radikal aktif kation. Radikal aktif kation mempermudah terjadinya
15
ikatan antara monomer anilin melalui ikatan head-to-tail. Hal ini menyebabkan meningkatnya proses polimerisasi (Li et al. 2008).
Proses polimerisasi yang meningkat, akan meningkatkan pembentukan serat, sehingga polianilin yang dihasilkan memiliki struktur nanoserat yang baik dengan ukuran nano (Nishio et al. 1995; Li et al. 2008). Faktor lain seperti jenis oksidan, suhu, serta metode polimerisasi tidak terlalu berpengaruh besar terhadap sifat dari polianilin (Huang dan Kaner 2003). Sintesis polianilin dengan metode polimerisasi interfasial dapat dilihat pada Gambar 13, yang terdiri dari tahap protonasi dan oksidasi yang bersifat reversibel.
Polianilin berukuran nano memiliki luas daerah permukaan yang lebih luas dibandingkan polianilin berukuran makro (Virji et al. 2009). Luas daerah permukaan yang lebih luas tersebut meningkatkan interaksi antara polianilin dengan senyawa molekul lain, seperti glukosa oksidase (Virji et al. 2009). Glukosa oksidase dapat terikat lebih banyak pada permukaan polianilin tersebut karena permukaannya yang lebih luas, sehingga dapat meningkatkan kinerja elektroda GOD/EPKT dalam mengoksidasi glukosa. Berdasarkan sifat polianilin tersebut, morfologi polianilin yang baik yakni berserat dan berukuran nano merupakan salah satu faktor penting yang diperlukan dalam peningkatan kinerja elektroda, terutama kinerja elektroda GOD/EPKT pada penelitian ini. Selain itu polimer dengan ukuran nano juga memiliki sifat mekanik, katalitik, magnetik, dan optik yang lebih baik dibandingkan polimer dalam bentuk makromolekul (Geneis
et al. 1985).
Gambar 13 Sintesis polianilin secara polimerisasi interfasial. Reaksi reversible garam/basa, protonasi/deprotonasi, dan redoks polimerisasi polianilin (Huang dan Karen 2005)
Kinerja Elektroda Pasta Karbon(EPK) dan Elektroda Pasta Karbon Termodifikasi (EPKT)
Aplikasi glukosa oksidase (GOD) sebagai biosensor untuk deteksi kadar glukosa dilakukan dengan metode elektrokimia voltametri. Dalam pengukuran
HX (NH4)2S2O8
Garam Emeraldin
NH3.H2O
deprotonasi
HX protonasi
Reduksi Oksidasi
Basa Emeraldin
Reduksi Oksidasi
Leukoemeraldin
16
aktivitas GOD sebagai biosensor secara elektrokimia tersebut diperlukan suatu elektroda kerja dengan sifat konduktivitas, kestabilan dan respon yang baik terhadap reaksi elektrokimia yang dihasilkan. Oleh karena itu perlu dilakukan pengukuran kinerja elektroda pasta karbon (EPK) dan elektroda pasta karbon termodifikasi (EPKT) sebelum digunakan sebagai elektroda GOD. Pengukuran kinerja kedua elektroda tersebut dilakukan dengan metode siklik voltametri, dan terbentuk voltamogram siklik yang menggambarkan kinerja elektroda tersebut.
Voltamogram siklik hasil dari pengukuran kinerja kedua elektroda tersebut menunjukkan kinerja yang berbeda antar kedua elektroda. Besar arus yang dihasilkan oleh EPK pada puncak oksidasi sebesar 2.760 x 10-5 A pada tegangan -0.304 V. Nilai tegangan dari reaksi oksidasi pada kinerja EPK yang dihasilkan pada penelitian ini sedikit berbeda dari tegangan yang terukur dalam penelitian Maddu et al. (2013) sebesar -0.2 V, dan nilai tegangan pada penelitian ini juga berada diluar range tegangan berdasarkan literatur, yang menyatakan bahwa
range tegangan untuk EPK dalam larutan netral (KCl merupakan larutan yang bersifat netral) yaitu -1.3 V dan 1.4 V.
Perbedaan nilai tegangan reaksi oksidasi EPK dapat dikarenakan permukaan elektroda yang kurang halus saat preparasi elektroda, maupun pengisian pasta karbon yang kurang padat pada elektroda, sehingga dapat mempengaruhi kinerja elektroda tersebut. Selain itu, jenis karbon yang digunakan juga dapat menghasilkan kinerja elektroda yang berbeda (McCreery 2008). Berdasarkan voltamogram siklik tersebut, dapat dikatakan bahwa EPK yang digunakan memiliki sifat konduktivitas yang cukup baik, namun perlu dilakukan modifikasi dengan penambahan polimer konduktif untuk meningkatkan aktivitasnya.
EPK yang telah diketahui sifat konduktivitasnya tersebut kemudian dimodifikasi dengan penambahan polimer konduktif berupa nanoserat polianilin yang telah disintesis dan diketahui sifat morfologinya, menjadi elektroda pasta karbon termodifikasi (EPKT). Terjadi peningkatan arus oksidasi dari kinerja EPKT dibandingkan EPK, yaitu sebesar 12.09 x 10-5 A pada tegangan sebesar -0.085 V. Peningkatan arus oksidasi yang terjadi pada kinerja EPKT tersebut merupakan pengaruh dari polianilin dalam elektroda. Polianilin merupakan polimer konduktif, yang memiliki sifat konduktivitas elektrik yang sangat baik akibat pengaruh dari proses protonasi oleh asam kuat pada proses polimerisasinya (Reda dan Al Ghannam 2012).
17
Namun pada konsentrasi HCl lebih dari 2 M konduktivitas polianilin yang dihasilkan menurun.
Pengaruh polianilin terhadap kinerja EPKT selain dikarenakan memiliki konduktivitas yang baik, juga dikarenakan sifat morfologi polianilin tersebut yang berserat dengan ukuran nano serta memiliki luas daerah permukaan yang besar. Polianilin yang berserat memiliki kemampuan penghantaran listrik yang lebih baik dibandingkan polianilin dengan bentuk globular. Polianilin yang berukuran nano dan luas permukaan polianilin yang besar akan mempengaruhi luas permukaan elektroda. Penambahan polianilin pada elektroda akan meningkatkan luas permukaan elektroda tersebut. Menurut Zhu (2012), elektroda pasta karbon grafit memiliki luas permukaan yang rendah yaitu sebesar 16.30 m2/g, setelah penambahan polianilin luas permukaan elektroda meningkat secara signifikan menjadi 29.26 m2/g. Hal ini menunjukkan bahwa polianilin yang berukuran nano dapat meningkatkan luas permukaan elektroda, yang berpengaruh terhadap kinerja elektroda tersebut.
Semakin luas permukaan suatu elektroda, maka semakin banyak terjadi interaksi antara larutan elektrolit terhadap permukaan elektroda (Virji et al. 2009). Interaksi tersebut berupa peningkatan difusi ion elektrolit ke dalam bahan elektroda, sehingga terjadi peningkatan efisiensi transfer ion dalam elektroda. Hal ini ditunjukkan dengan arus oksidasi yang dihasilkan pada EPKT lebih besar dibandingkan EPK (Maddu et al. 2013). Oleh karena itu EPKT lebih potensial digunakan sebagai elektroda glukosa oksidase dalam aplikasinya sebagai biosensor glukosa, karena memiliki kinerja yang lebih baik dibandingkan kinerja EPK.
pH Optimum Kinerja Elektroda GOD/EPKT
Aktivitas enzim dipengaruhi oleh beberapa faktor, salah satu faktor penting yang dapat mempengaruhi aktivitas enzim adalah kondisi pH lingkungan atau larutan uji pada reaksi enzimatis. Setiap enzim memiliki kondisi pH optimum dalam aktivitasnya (Fabiano et al. 2002). Berdasarkan hasil pengujian pengaruh pH pada kinerja elektroda GOD/EPKT yang dapat dilihat pada Gambar 5, diperoleh bahwa pH optimum untuk kinerja elektroda GOD/EPKT pada penelitian ini adalah pH 4.5, yang ditunjukkan dengan nilai arus oksidasi yang dihasilkan pada pH tersebut merupakan nilai arus terbesar diantara pH yang diuji lainnya. Perubahan pH larutan uji tersebut dapat mempengaruhi struktur, bentuk, dan ionisasi asam amino suatu enzim, selain itu juga menyebabkan perubahan pada bentuk dan muatan substrat (Fabiano et al. 2002). Hal ini dapat mempengaruhi aktivitas enzim tersebut.
Jika kondisi lingkungan reaksi enzimatis berada pada pH optimum aktivitas enzim, maka enzim akan mengalami ionisasi pada asam-asam amino yang berperan penting dalam aktivitas katalitiknya. Tahap ionisiasi pada pH optimum tersebut meningkatkan interaksi enzim untuk mengikat substrat dan membentuk kompleks enzim-substart (ES), sehingga pembentukan kompleks ES dapat berlangsung lebih cepat dan menyebabkan peningkatan laju pembentukan produk.
18
mengurangi interaksi enzim dalam mengikat substrat, sehingga mekanisme enzim terhadap substrat meliputi mekanisme induced fit maupun lock and key sulit tercapai dengan baik. Hal ini dikarenakan antara sisi aktif enzim dan substrat tidak dapat bersesuaian dengan baik untuk terikat membentuk kompleks enzim-substrat (ES), sehingga laju pembentukkan kompleks ES menurun. Berkurangnya laju pembentukkan kompleks ES tersebut menyebabkan laju reaksi pembentukan produk pun berlangsung lambat, terjadi penurunan aktivitas enzim. Hal ini memungkinkan enzim akan kehilangan aktivitasnya yang disebabkan struktur enzim terdenaturasi secara irreversible pada kondisi pH ekstrim (Price dan Stevens 1988).
pH optimum kinerja elektroda GOD/EPKT yang diperoleh pada penelitian ini berbeda dengan literatur yang menjadi acuan dalam penelitian ini, dimana menurut Colak et al. (2012), pH optimum kinerja elektroda GOD/EPKT yaitu pada pH 5.0 bufer fosfat konsentrasi 0.1 M. Perbedaan pH optimum tersebut dapat dikarenakan berbedanya jenis bufer yang digunakan.
Terdapat faktor lain yang mempengaruhi perubahan pH optimum suatu enzim, yaitu kondisi lingkungan dari polimer konduktif, yaitu suatu polimer yang digunakan dalam modifikasi elektroda enzim dengan sifatnya yang dapat meningkatkan kinerja elektroda. Pada penelitian ini polimer konduktif yang digunakan adalah nanoserat polianilin. Pada enzim yang diamobil dalam elektroda yang terdapat suatu matriks polimer konduktif, molekul enzim dapat dipengaruhi oleh kondisi lingkungan dari pori-pori matriks polimer tersebut. Muatan yang terkandung pada permukaan matriks polimer dapat menyebabkan perubahan pH optimum untuk aktivitas enzim. pH optimum suatu enzim dapat menjadi lebih tinggi atau lebih rendah dari pH optimum sebenarnya (Fabiano et al. 2002).
Suatu polimer yang mengandung banyak muatan positif (H+) dalam strukturnya menyebabkan lingkungan sekitar elektroda enzim menjadi kaya akan H+ tersebut, sehingga hanya perlu sedikit tambahan H+ agar kondisi lingkungan elektroda enzim mencapai kondisi pH optimum bagi aktivitasnya. Hal ini menyebabkan nilai pH optimum yang tercatat pada aktivitas elektroda enzim tersebut meningkat dari kondisi optimum sebenarnya. Namun, jika muatan H+ dalam polimer jumlahnya terbatas, maka perlu tambahan H+ yang lebih banyak untuk mencapai kondisi pH optimum bagi aktivitas enzim, sehingga nilai pH optimum yang tercatat pada pengujian aktivitas elektroda enzim menjadi lebih rendah (Fabiano et al. 2002).
Jika dilihat dari pengaruh kondisi lingkungan matriks polimer pada penelitian ini yaitu polianilin, yang merupakan konduktor positif, maka nilai pH optimum kinerja elektroda GOD/EPKT pada penelitian ini menjadi lebih rendah dibandingkan dengan pH optimum kinerja elektroda GOD/EPKT menurut Colak
et al. (2012). Hal ini dapat dikarenakan perbedaan jumlah muatan positif dari polianilin yang digunakan.
Perbedaan jumlah muatan positif pada struktur polianilin dapat dikarenakan perbedaan jenis asam kuat yang digunakan dalam proses protonasi saat sintesis polianilin. Pada penelitian Keyhanpour et al. (2012), polianilin yang digunakan dalam elektroda GOD disintesis secara elektrokimia menggunakan H2SO4 sebagai
19
elektroda GOD pada umumnya, yaitu sekitar 5.0 hingga 6.0 (Bankar et al. 2009). Hal ini dapat dikarenakan jumlah muatan positif (H+) yang terbentuk dari proses protonasi menggunakan H2SO4 cukup tinggi, sehingga hanya perlu tambahan
sedikit H+ untuk membentuk lingkungan reaksi mencapai kondisi pH optimum aktivitas enzim. Hal ini membuat nilai pH optimum yang tercatat dari hasil pengujian tersebut lebih tinggi.
Sedangkan kinerja elektroda GOD/EPKT pada penelitian ini menggunakan polianilin yang disintesis menggunakan HCl sebagai asam kuat pada proses protonasinya. pH optimum yang diperoleh dari kinerja elektroda tersebut lebih rendah yaitu pH 4,5. Hal ini dapat dikarenakan jumlah muatan positif (H+) yang terbentuk oleh HCl saat protonasi lebih sedikit pada struktur polianilin, sehingga diperlukan lebih banyak tambahan H+ agar lingkungan reaksi mencapai pH optimum. Hal ini menunjukkan bahwa jenis asam kuat yang berbeda dapat menghasilkan sifat elektrik polianilin yang berbed, yang dapat mempengaruhi kinerja elektroda enzim, yaitu terjadi perubahan kondisi optimum kinerja elektroda tersebut.
Suhu Optimum Kinerja Elektroda GOD/EPKT
Suhu merupakan salah satu faktor utama yang mempengaruhi aktivitas atau laju reaksi enzim selain kondisi pH lingkungan. Oleh karena itu, pengujian pengaruh suhu terhadap laju reaksi enzim perlu dilakukan untuk mengetahui suhu optimum yang dapat menghasilkan laju reaksi enzim yang tinggi.
Berdasarkan hasil pengujian pengaruh suhu terhadap kinerja elektroda GOD/EPKT, kinerja elektroda GOD/EPKT tersebut menunjukkan optimum pada suhu 650C yang ditunjukkan dengan nilai arus oksidasi glukosa yang dihasilkan paling besar dibandingkan suhu lainnya. Suhu optimum kinerja elektroda GOD/EPKT pada penelitian ini sama dengan suhu optimum kinerja elektroda GOD/EPKT pada penelitian Colak et al. (2012) yaitu pada suhu 650C dengan penggunaan polianilin sebagai modifikasi dalam elektroda enzim pada bufer yang berbeda, yaitu bufer fosfat.
Proses amobilisasi pada enzim glukosa oksidase terlihat dapat meningkatkan kestabilan aktivitas enzim, yang ditunjukkan dengan aktivitas enzim glukosa oksidase menjadi lebih stabil pada suhu tinggi dengan aktivitas yang optimum dibandingkan enzim dalam kondisi bebas yang optimum pada suhu sekitar 25-370C (Simpson et al.2007). Oleh karena itu, dapat dikatakan bahwa enzim glukosa oksidase yang teramobil glutaraldehida pada elektroda pasta karbon termodifikasi polianilin bersifat termostabil, yaitu dapat bertahan dan memiliki aktivitas yang baik pada suhu tinggi.
Suhu berpengaruh secara langsung terhadap energi kinetik enzim dan pergerakan molekul. Semakin tinggi suhu reaksi enzimatis, maka akan menghasilkan energi kinetik yang lebih tinggi yang menyebabkan semakin besarnya peluang bagi enzim untuk bertumbukan dengan molekul lain seperti substrat. Pergerakan molekul enzim dan substrat semakin meningkat yang dapat meningkatkan terbentuknya kompleks enzim-substrat, sehingga laju reaksi pembentukan produk meningkat. Suhu yang lebih tinggi lagi dapat menyebabkan enzim kehilangan aktivitasnya karena enzim telah terdenaturasi (Keyhanpour et al.
20
Pada pengujian pengaruh suhu terhadap kinerja enzim glukosa oksidase sebagai elektroda enzim, selain dapat mengetahui suhu optimum untuk kinerja enzim tersebut juga dapat mengetahui besarnya energi aktivasi reaksi oksidasi glukosa dengan katalis enzim GOD/EPKT. Energi aktivasi merupakan energi bebas yang diperlukan dalam reaksi oksidasi glukosa membentuk produk berupa asam glukonat. Energi aktivasi (energy bebas) sangat tinggi pada reaksi tanpa katalis enzim. Enzim akan menurunkan energi aktivasi tersebut, sehingga reaksi oksidasi glukosa berlangsung lebih cepat, laju reaksi meningkat.
Energi aktivasi reaksi oksidasi glukosa dibawah katalis enzim GOD dalam polianilin pada penelitian ini sebesar 1.405 kJ/mol. Energi aktivasi reaksi oksidasi glukosa dibawah katalis enzim GOD dalam elektroda termodifikasi polianilin pada penelitian ini lebih kecil dibandingkan energi aktivasi reaksi oksidasi glukosa dibawah katalis yang sama yaitu GOD pada penelitian Keyhanpour et al.
(2012) yaitu sebesar 49.5 kJ/mol. Sehingga dapat dikatakan bahwa elektroda GOD/EPKT pada penelitian ini memiliki kinerja sebagai katalis yang lebih baik.
Walaupun elektroda GOD/EPKT pada penelitian ini memiliki kinerja optimum pada suhu tinggi dengan nilai energi aktivasi yang cukup baik, elektroda GOD/EPKT tersebut tetap memiliki aktivitas yang cukup baik pada suhu 25-350C yang merupakan suhu yang lebih sesuai untuk aplikasi elektroda GOD/EPKT sebagai biosensor glukosa. Hal ini dikarenakan cukup sulit jika mengaplikasikan elektroda GOD/EPKT pada kondisi suhu tinggi sesuai suhu optimumnya.
Parameter Kinetika Enzim
Karakteristik aktivitas GOD dapat diketahui melalui penentuan parameter kinetiknya, yaitu nilai Km dan Imaks. Parameter kinetik tersebut ditentukan melalui
pengujian pengaruh konsentrasi substrat terhadap kinerja elektroda GOD/EPKT yang diamati secara elektrokimia siklik voltametri. Aktivitas GOD sangat memungkinkan untuk diamati secara elektrokimia karena terdapat reaksi reduksi oksidasi yang dikatalisis oleh GOD tersebut, melibatkan transfer elektron sebagai sinyal yang merupakan faktor penting dalam teknik sensor. Sinyal berupa elektron tersebut terdeteksi secara elektrokimia dalam bentuk arus yang tercatat dalam bentuk voltamogram siklik.
Nilai arus menggambarkan laju reaksi katalis enzim terhadap glukosa. Laju reaksi sebenarnya bergantung pada jumlah total enzim yang berada dalam bentuk kompleks enzim-substrat (ES). Terdapat tiga keadaan pengaruh konsentrasi substrat terhadap kinerja elektroda GOD/EPKT. Pertama, Pada konsentrasi substrat yang rendah ([S] < Km), jumlah enzim dalam bentuk
kompleks ES sedikit dan sebagian besar enzim dalam kondisi bebas. Hal ini menyebabkan laju reaksi pembentukan produk berlangsung lambat, yang ditunjukkan dengan nilai arus yang diperoleh kecil (Gilbert 2000; Fadhilah 2013).
Seiring peningkatan konsentrasi substrat, maka jumlah kompleks ES yang terbentuk meningkat, yang menyebabkan terjadi peningkatan laju reaksi pembentukan produk, sehingga nilai arus yang diperoleh semakin besar. Namun, pada konsentrasi substrat yang tinggi ([S] > Km), peningkatan konsentrasi glukosa
21
peningkatan konsentrasi substrat yang lebih tinggi lagi tidak akan menghasilkan peningkatan nilai arus yang signifikan. Dalam kondisi tersebut enzim telah mencapai kondisi jenuh (Gilbert 2000; Fadhilah 2013).
Kurva Michaelis-Menten pada Gambar 10 menggambarkan ketiga keadaan tersebut sebagai pengaruh dari konsentrasi substrat terhadap kinerja elektroda GOD/EPKT, yang menunjukkan bahwa terjadi peningkatan nilai arus yang dihasilkan seiring dengan peningkatan konsentrasi substrat. Hal ini berarti terjadi peningkatan kompleks ES, sehingga laju reaksi enzim masih meningkat. Namun, pada konsentrasi glukosa diatas 4 mM tidak terjadi peningkatan arus yang signifikan, yang berarti laju reaksi telah mencapai maksimum. Hal ini menunjukkan bahwa aktivitas GOD sebagai elektroda enzim mencapai keadaan jenuh saat konsentrasi glukosa sebesar 4 mM.
Berdasarkan kurva Michaelis-Menten tersebut dapat ditentukan nilai Km
dari kinerja elektroda GOD/EPKT. Namun, penentukan Km dari kurva
Michaelis-Menten tersebut memiliki kelemahan yaitu kemungkinan terjadi distorsi dari hiperbola pada kurva tesebut, sehingga nilai Km yang diperoleh dapat sepuluh kali
lebih rendah atau sepuluh kali lebih besar dari nilai Km yang sebenarnya (Fadhilah
2013). Oleh karena itu, penentuan nilai Km dan Imaks berdasarkan daerah linier
pada kurva Michaelis-Menten tersebut. Sehingga dapat diperoleh nilai Km dan
Imaks yang lebih akurat. Daerah linier tersebut berada pada rentang 0.2 -1.0 mM
dengan nilai regresi (r2) sebesar 0.9851.
Daerah linier tersebut kemudian dikonversi ke dalam kurva Lineweaver-Burk (
. Nilai Km dan Imaks yang diperoleh berdasarkan analisis persamaan
Lineweaver-Burk, masing-masing sebesar 0.70 mM dan 4.24 mA. Nilai Km dari
elektroda GOD pada penelitian ini sedikit lebih besar dengan nilai Km dari
elektroda GOD pada penelitian Colak et al. (2012) yaitu sebesar 0.61 mM. Nilai Imaks yang diperoleh pada penelitian ini juga lebih besar dibandingkan nilai Imaks
yang diperoleh Colak et al. (2012) yang sebesar 1.22 µA/min. Hal ini menunjukkan bahwa kinerja elektroda GOD/EPKT pada penelitian ini cukup lebih baik, karena walaupun nilai Km yang sedikit lebih tinggi, tetapi dapat
menghasilkan nilai arus atau laju reaksi maksimum yang lebih besar, yang cukup penting dalam teknik sensor.
Nilai Km merupakan konsentrasi substrat yang diperlukan untuk mencapai
setengah dari laju reaksi maksimum aktivitas enzim terhadap substrat tersebut. Jika nilai Km suatu enzim tinggi, maka diperlukan konsentrasi substrat yang tinggi
untuk mencapai setengah laju reaksi maksimum. Hal ini berarti bahwa enzim tersebut memiliki afinitas atau kemampuan untuk terikat substrat yang rendah, sehingga kurang efisien jika diaplikasikan dalam teknologi sensor. Namun, jika nilai Km suatu enzim rendah, maka dengan konsentrasi substrat yang kecil, reaksi
sudah dapat mencapai setengah laju reaksi maksimum. Hal ini menunjukkan enzim memiliki respon yang lebih cepat dan afinitas yang kuat terhadap substrat (Gilbert 2000; Brown et al. 2010; Gibson et al. 1964), sehingga enzim tersebut berpotensi untuk diaplikasikan dalam teknologi sensor.
Nilai Km pada penelitian ini cukup rendah dengan Imaks yang lebih besar
dibandingkan niai Km dan Imaks yang diperoleh pada beberapa penelitian lain,
22
elektroda GOD/EPKT pada penelitian ini cukup berpotensi untuk diaplikasikan sebagai biosensor glukosa.
Parameter kinetika pada enzim dapat berbeda-beda. Hal ini dapat dikarenakan perbedaan pada sifat morfologi (ukuran, keseragaman, dan bentuk) dan konduktivitas dari polimer, serta perbedaan jenis polimer konduktif yang digunakan, yang mempengaruhi interaksi enzim pada permukaan elektroda dengan molekul substrat. Perbedaan jenis bufer yang digunakan juga dapat menghasilkan nilai Km yang berbeda dalam suatu elektroda enzim. Kinerja
elektroda enzim dalam bufer asetat menghasilkan nilai Km yang lebih besar
dibandingkan nilai Km dari elektroda enzim dalam bufer fosfat (Gaikwad et al.
2006; Shirale et al. 2006; Keyhanpour et al. 2012).
Terdapat penelitian lain yang menunjukkan nilai Km yang lebih rendah dan
Imaks yang lebih tinggi dibandingkan penelitian ini, yaitu sebesar 0.3 mM dan 0.78
V (Gvozdenovic et al. 2011). Hal ini menunjukkan bahwa elektroda GOD/EPKT pada penelitian ini masih dapat dikembangkan lebih baik lagi untuk menghasilkan kinerja yang lebih baik dalam deteksi konsentrasi glukosa, sehingga dapat diaplikasikan dengan baik dalam sensor glukosa.
Nilai Km pada penelitian ini dikonversi ke dalam satuan mg/dL dan
diperoleh nilai Km sebesar 12.6 mg/dL. Jika elektroda GOD/EPKT tersebut akan
diaplikasikan sebagai biosensor glukosa dalam bidang medis seperti pengukuran kadar glukosa darah, maka elektroda ini cukup berpotensi. Hal ini dikarenakan nilai Km nya cukup kecil. Berdasarkan nilai Km tersebut, elektroda GOD/EPKT
potensial untuk dapat mendeteksi kadar glukosa darah dalam kondisi normal, hiperglikemia, hingga kondisi hipoglikemia. Kadar glukosa darah normal manusia sekitar 70 – 110 mg/dL, dan kondisi glukosa darah dikatakan dalam keadaan hipoglikemia jika kadar glukosa dibawah 60 mg/dL dan dalam keadaan hiperglikemia jika kadar glukosa diatas 270 mg/dL.
Kinerja elektroda berbasis enzim pada elektroda GOD/EPKT, selain ditinjau dari kondisi optimum dan parameter kinetikanya, juga perlu diketahui sensitivitasnya dalam kinerjanya sebagai biosensor glukosa. Sensitivitas merupakan rasio selisih nilai arus oksidasi glukosa tertinggi dan terendah yang dihasilkan terhadap selisih konsentrasi glukosa tertinggi dan terendah. Sensitivitas kinerja elektroda GOD/EPKT pada penelitian ini diperoleh sebesar 1.81 mAmM-1. Hal ini berarti setiap kenaikan 1 mM konsentrasi glukosa, menghasilkan peningkatan nilai arus oksidasi sebesar 1.81 mA. Semakin tinggi nilai sensitivitas suatu elektroda, maka semakin bagus kinerja elektroda tersebut sebagai sensor.
SIMPULAN DAN SARAN
Simpulan
23
asetat koonsentrasi 0.1 M dan pada suhu 650C. Daerah linier kinerja elektroda GOD/EPKT yaitu antara 0.2 – 1.0 mM. Elektroda enzim GOD/EPKT memilki nilai Km dan Imaks masing-masing sebesar 0.70 mM dan 4.24 mA dengan nilai
sensitifitas sebesar 1.81 mAmM-1
Saran
Penelitian lanjutan untuk mengetahui pengaruh konsentrasi enzim terhadap kinerja enzim, serta penentuan respon time, dan stabilitas enzim sebagai elektroda enzim perlu dilakukan untuk menghasilkan elektroda GOD/EPKT yang memiliki kinerja yang baik dalam deteksi glukosa. Sehingga dapat diaplikasikan sebagai elektroda sensor glukosa berbasis enzim yang dapat diterapkan dalam berbagai bidang seperti bidang medis.
DAFTAR PUSTAKA
Bankar SB, Bule MV, Singhal RS, Ananthanarayan L. 2009. Glucose oxidase.
Biotechnology advances. 27:489-501. doi:
10.1016/j.biotechadv.2009.04.003.
Brown S, Muhamad N, Simcock DC. 2010. Estimating enzyme kinetic parameters from apperent Km and Vmax. Int J Chem and Bio Engineering. 3(4):195-200.
Colak O, Arslan H, Zengin H, Zengin G. 2012. Amperometric detection of glucose by polyaniline-activated carbon composite carbon paste electrode.
Int J Electrochem Sci. 7:6988-6997.
Ditjen Bina Upaya Kesehatan, Kemenkes RI. 2012. Profil Kesehatan Indonesia Tahun 2012. Jakarta (ID): Kementrian Kesehatan Republik Indonesia. Du XS, Xiao M, Meng YZ. 2004. Synthesis and characterization of
polyaniline/graphite conducting nanocomposites. Journal of Polymer Science Part B:Polymer Physics. 42: 1972–1978. doi: 10.1002/polb.20102. Fabiano S, Minh CT, Piro B, Dang LA, Pham C, Vittori O. 2002. Poly
3,4-ethylenedioxythiophene as an entrapment support for amperometric enzyme sensor. Materials Science and Engineering C. 21(1-2):61-67. doi:10.1016/S0928-4931(02)00060-7.
Fadhilah R. 2013. Biosensor Glukosa Menggunakan GDH-FAD yang Diimobilisasi pada Nanopartikel Zeolit secara Elektrokimia [Tesis]. Bogor (ID): Institut Pertanian Bogor.
Gaikwad PD, Shirale DJ, Gade VK, Savale PA, Kharat HJ, Kakde KP, Shirsat MD. 2006. Immobilization of GOD on electrochemically synthesized PANI films by cross-linking via glutaraldehyde for determination of glucose. Int J Electrochem Sci. 1:425-434.
24
Gibson QH, Bennett, Swoboda EP, Massey V. 1964. J Biol Chem. 239(11):3927-3934.
Gilbert HF. 2000. Basic Concepts in Biochemistry. Edisi ke-2. New York (NY): McGraw-Hill.
Gospodinova N, Terlemezyan L. 1998. Conducting polymers prepared by oxidative polymerization : polyaniline. Prog. Polym. Sci. 23:1443-1484. doi:S0079–6700(98)00008–2.
Gvozdenovic MM, Jugovic BZ, Bezbradica DI, Antov MG, Knezevic ZD, Grgur BN. Food Chemistry. 124:396-400. doi:10.1016/j.foodchem.2010.06.046. Huang J, Kaner RB. 2003. A general chemical route to polyaniline nanofibers.
J.Am.Chem.Soc. 126(3):851-855. doi:10.1021/ja0371754.
Huang J, Kaner RB. 2004. Nanofiber formation in the chemical polymerization of aniline: a mechanistic study. Angewandte Chemie. 43:5817-5821. doi:10.1002/anie.200460616.
Huang J, Kaner RB. 2005. The intrinsic nanofibrillar morphology of polyaniline.
Chemistry Community. 367-376. doi:10.1039/b510956f.
Keyhanpour A, Mohammad S, Mohaghegh S, Jamshidi A. 2012. Glucose oxidase modified electrodes of polyaniline and poly (aniline-co-2-anilinoethanol) as a biosensor : a comparative study. Journal of Biosensor and Bioelectronics. 3(1):1-7. doi:10.4172/2155-6210.1000116.
Li XG, Li A, Huang MR. 2008. Facile high-yield synthesis of polyaniline nanosticks with intrinsic stability and electrical conductivity. Chemistry a European Journal. 14:10309-10317. doi:10.1002/chem.200801025.
Maddu A, Wahyudi ST, Kurniati M. 2008. Sintesis dan karakterisasi nanoserat polianilin. J. Nano Saintek. 1(2).
McCreery RL. 2008. Advanced carbon electrode materials for molecular electrochemistry. Chemical reviews. 108(7):2646-2687. doi:10.1021/cr068076m.
Nishio K, Fujimoto M, Yoshinaga N, Ando O, Ono H. 1995. Electrochemical characteristics of polyaniline synthesized by various method. Journal of Power Source. 56:189-192. doi:0378-7753(95)02223-4.
Price NC, Stevens L. 1988. Fundamentals of Enzymology. New York (NY): Oxford University Pr.
Reda SM, Al-Ghannam SM. 2012. Synthesis and electrical properties of polyaniline composite with silver nanoparticles. Advances in Materials Physics and Chemistry. 2:75-81. doi:10.4236/ampc.2012.22013.
Shirale DJ, Gade VK, Gaikwad PD, Savale PA, Kharat HJ, Kakde KP, Pathan AJ, Shirsat MD. 2006. Studies of immobilized glucose oxidase on galvanostatically synthesized poly(N-metylpyrrole) film with PVS-NaNO3
composite dopant. Int J Electrochem Sci. 1:62-70.
Shuler ML, Kargi F. 2002. Bioprocess Engineering : Basic Concepts. Ed ke-2. Prentice Hall PTR : Upper Saddle River.
25
Song E, Choi JW. 2013. Conducting polyaniline nanowire and its applications in chemiresistive sensing. Nanomaterials. 3:498-523. doi:10.3390/nano3030498.
Stejskal. 2002. Polylanilin, preparation of conductor polymer. Pure Appl Chem.
74:857-867.
Virji S, Kojima R, Fowler JD, Villanueva JG, Kaner RB, Weiller BH. 2009. Polyaniline nanofiber composite with amines: novel materials for phosgene detection. Nano Res. 2:135-142. doi:10.1007/s12274-009-9011-1.
Wang HJ, Zhou CM, Peng F, Yu H. 2007. Glucose biosensor based on platinum nanoparticles supported sulfonated-carbon nanotubes modified glassy carbon electrode. Int J Electrochem Sci. 2:508-516.
Zhang H, Wang J, Gao X, Wang Z, Wang S. 2014. The electrochemical activity of polyaniline : an important issue on its use in electrochemical energy
storage devices. Synthetic Metals. 187:46-51.
doi:10.1016/j.synthmet.2013.10.022.
26
Lampiran 1 Alur penelitian
Pembuatan nanoserat polianilin
Karakterisasi nanoserat polianilin
Uji kinerja elektroda pasta karbon (EPK) dan elektroda pasta karbon termodifikasi (EPKT)
Amobilisasi GOD pada elektroda pasta karbon termodifikasi melalui cross-linking dengan
glutaraldehida
Uji kinerja GOD/EPKT terhadap pengaruh pH (4.0 – 6.0) bufer asetat 0.1 M secara elektrokimia
voltametri
Uji kinerja GOD/EPKT terhadap pengaruh konsentrasi glukosa (0.2 – 8.0 mM) pada pH
optimum secara elektrokimia voltametri
Penentuan parameter kinetika enzim
27
Lampiran 2 Nilai arus oksidasi glukosa oleh elektroda GOD/EPKT pada pengaruh pH bufer asetat 0.1 M
pH Arus (mA)
4.0 0.823
4.5 3.838
5.0 1.035
5.5 0.421
6.0 0.816
Lampiran 3 Nilai arus oksidasi glukosa oleh elektroda GOD/EPKT pada pengaruh suhu
Suhu (0C) Arus (mA)
20 7.199
35 9.973
45 10.334
55 13.524
65 18.811
75 18.270
Lampiran 4 Hubungan ln I dan 1/T
ln I 1/T (K-1)
1.974 0.341 x 10-2
2.299 0.325 x 10-2
2.335 0.315 x 10-2
2.604 0.305 x 10-2
2.934 0.296 x 10-2
2.905 0.2871 x 10-2
Lampiran 5 Nilai arus oksidasi glukosa oleh elektroda GOD/EPKT pada variasi konsentrasi glukosa
[glukosa] (mM) Arus terukur (mA) Arus blanko (mA) Arus terkoreksi (mA)
0.2 0.981 0.052 0.929
0.4 1.745 0.052 1.693
0.6 1.943 0.052 1.891
0.8 2.325 0.052 2.273
1.0 2.426 0.052 2.374
1.2 2.728 0.052 2.676
1.4 2.754 0.052 2.702
1.6 2.808 0.052 2.756
1.8 2.840 0.052 2.788
2.0 3.034 0.088 2.946
4.0 3.496 0.052 3.444
6.0 3.578 0.052 3.526
28
Lampiran 6 Nilai arus pada linieritas antara konsentrasi glukosa dan kinerja elektroda GOD/EPKT
[glukosa] (mM) Arus (mA)
0.2 0.929
0.4 1.693
0.6 1.891
0.8 2.273
1.0 2.374
Lampiran 7 Persamaan Lineweaver-Burk
[glukosa] (mM) Arus (mA) 1/[glukosa] 1/I
0.2 0.929 5.000 1.076
0.4 1.693 2.500 0.591
0.6 1.891 1.667 0.529
0.8 2.273 1.250 0.440
1.0 2.374 1.000 0.421
Lampiran 8 Perhitungan Sensitifitas Elektroda
Nilai arus dan konsentrasi glukosa diambil dari kurva linieritas pada Lampiran 4 Sensitifitas = (Itertinggi – ITerendah)
([S]Tertinggi – [S]Terendah)
= (2.374 – 0.929) (1.0 - 0.2 ) = 1.81 mA/Mm
Lampiran 9 Dokumentasi