KARAKTERISASI BAKTERI PENGHASIL
ASIL HOMOSERIN LAKTON LAKTONASE DAN ASILASE
YANG DIISOLASI DARI LAHAN PERTANIAN
DINA FITRIYAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Karakterisasi Bakteri Penghasil Asil Homoserin Lakton Laktonase dan Asilase yang diisolasi dari Lahan Pertanian adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2015
Dina Fitriyah
RINGKASAN
DINA FITRIYAH. Karakterisasi Bakteri Penghasil Asil Homoserin Lakton Laktonase dan Asilase yang diisolasi dari Lahan Pertanian. Dibimbing oleh IMAN RUSMANA dan ARIS TRI WAHYUDI.
Bakteri Gram negatif melakukan quorum sensing dengan menggunakan sinyal Asil Homoserin Lakton (AHL) untuk meregulasi ekspresi gen tertentu seperti gen untuk transfer plasmid, pembentukan nodul, biofilm, produksi antibiotik, eksopolisakarida, serta produksi faktor virulen. Bakteri fitopatogen menggunakan mekanisme quorum sensing untuk mengekspresikan gen-gen virulennya. Sejauh ini, pengendalian bakteri fitopatogen dilakukan dengan menggunakan senyawa antibiotik maupun pestisida. Penggunaan senyawa ini secara terus menerus dapat menyebabkan resistensi bakteri terhadap senyawa tersebut. Salah satu strategi pengendalian bakteri fitopatogen yang dapat digunakan yaitu dengan degradasi molekul sinyal oleh enzim yaitu AHL laktonase yang dikodekan oleh gen aiiA dan AHL asilase yang dikodekan oleh gen pvdQ.
Penelitian ini bertujuan untuk mengkarakterisasi bakteri yang menghasilkan AHL laktonase dan AHL asilase.
Isolasi bakteri dilakukan pada 11 sampel tanah rizosfer asal lahan pertanian di Jawa. Isolasi bakteri dilakukan dengan metode cawan sebar pada media
Nutrient Agar (NA). Aktivitas degradasi AHL diuji menggunakan bioindikator
Chromobacterium violaceum. Isolat bakteri yang memiliki aktivitas degradasi AHL diidentifikasi secara morfologi, fisiologi dan identifikasi berdasarkan gen 16S rRNA. Verifikasi keberadaan AHL laktonase dan AHL asilase dilakukan dengan amplifikasi gen aiiA menggunakan primer BTFdan BTR, gen pvdQ
diamplifikasi menggunakan primer pvdQF dan pvdQR. Produk PCR disekuensing, kemudian dianalisis menggunakan software MEGA 5.05.
Sebanyak 161 isolat bakteri berhasil diisolasi dari tanah rizosfer asal lahan pertanian di Jawa, enam diantaranya memiliki aktivitas degradasi AHL yaitu isolat BKS-1, BKS-8, BGR-7, CMS-4, JBR1-3 dan JBR2-16. Berdasarkan identifikasi morfologi, satu isolat yaitu BKS-1 merupakan bakteri Gram negatif berbentuk batang pendek, sedangkan lima isolat (BKS-8, BGR-7, CMS-4, JBR1-3 dan JBR2-16) merupakan bakteri Gram positif dengan sel berbentuk batang. Identifikasi bakteri secara fisiologi berdasarkan kemampuan dalam memetabolisme glukosa melalui uji oksidatif fermentatif menunjukkan bahwa BKS-1 bersifat fermentatif yang ditandai dengan perubahan warna media dari hijau menjadi kuning pada tabung yang dikondisikan aerob dan anaerob, sedangkan isolat BKS-8, BGR-7, JBR1-3 dan JBR2-16 tidak menunjukkan perubahan warna media. Analisis sekuen gen 16S rRNA berdasarkan BLAST-N menunjukkan bahwa BKS-1 memiliki kemiripan dengan Serratia marcescens
By2Root2, BKS-8 dengan Bacillus aquimaris JB306, BGR-7 dengan
B. marisflavi GN28, CMS-4 dengan B. altitudinis NIOT-BARREN23, JBR-13 dengan B. aquimaris dengan JP44SK28 dan JBR2-16 dengan B. axarquiensis
CHMS1B6 dengan persentase kemiripan masing-masing 100%. Amplifikasi gen
BKS-1 memiliki kedekatan dengan AHL laktonase kelompok B. cereus dengan persentase kemiripan 99%, AHL laktonase BKS-8 dengan AHL laktonase
Bacillus sp. MBG09, BGR-7 dengan AHL laktonase Bacillus sp.MBG12, CMS-4 dan JBR1-3 dengan AHL laktonase B. cereus, JBR2-16 dengan AHL laktonase
B. firmus dengan persentase kesamaan masing-masing yaitu 92%, 97%, 94%, 98%, dan 99%. Keberadaan AHL laktonase pada B. aquimaris, B. marisflavi, B. altitudinis dan B. axarquiensis belum pernah dilaporkan, sehingga penelitian ini memberikan informasi baru bahwa bakteri tersebut dapat menghasilkan AHL laktonase dan berpotensi sebagai agen biokontrol bakteri fitopatogen.
SUMMARY
DINA FITRIYAH. Characterization of Bacteria Producing Acyl Homoserine Lactone Lactonase and Acylase Isolated from Agricultural Lands. Supervised by IMAN RUSMANA and ARIS TRI WAHYUDI.
Gram negative bacteria perform quorum sensing by using acylhomoserine lactone (AHL) signal to regulate specific gene expression such as,
plasmid transfer, formation of nodule and biofilm, production of antibiotic, exopolysaccharide and virulence factor. Phytopathogenic bacteria use quorum sensing mechanism to express virulence genes. So far, to control of phytopathogenic bacteria has been done using antibiotics and pesticides. The use of antibiotics continously can cause bacterial resistance to these compounds. One of strategy to control phytopathogenic bacteria by degrading signal molecules using enzymes i.e AHL lactonase encoded by aiiA gene and AHL acylase encoded by pvdQ gene. The objective of this research was to characterize bacteria that produce AHL lactonase and AHL acylase.
Isolation of bacteria was done on 11 samples of rhizosphere soils from agricultural lands in Java, Indonesia. Bacterial isolation was carried out by dilution method and inoculated on Nutrient Agar (NA) medium using spread plate method. AHL degrading activities of bacterial isolates were tested using
Chromobacterium violaceum as a bioindicator. AHL degrading bacterial isolates were identified based on morphology, physiology, and 16S rRNA gene. Verification of AHL lactonase and AHL acylase existence was done by amplification of aiiA gene (using BTF and BTR primers) and pvdQ gene (using
pvdQF and pvdQR primers). PCR product were sequenced, and analyzed by MEGA 5.05 bioinformatics software.
A total of 161 bacterial isolates were isolated from rhizosphere, six of them was able to degrade AHL (BKS-1, BKS-8, BGR-7, CMS-4, JBRI-3, and JBR2-16). Based on morphological characteristic of AHL degrading isolates, BKS-1 isolate was Gram negative bacteria with short rod shape, while the others five isolates (BKS-8, BGR-7, CMS-4, JBR1-3 and JBR2-16) were Gram positive bacteria with rod shape cells. Physiological characteristics of AHL degrading bacteria based on the ability to metabolize glucose through oxidation fermentative test showed that BKS-1 was fermentative bacteria indicated by color change of medium from green to yellow in aerobic and anaerobic condition, whereas bacterial isolates of BKS-8, BGR-7, JBR1-3 and JBR2-16 did not showed color change on the medium. BLAST-N analysis of 16S rRNA gene sequences showed that the isolates of BKS-1, BKS-8, BGR-7, CMS-4, JBR1-3 and JBR2-16 had 100% similarity with Serratia marcescens By2Root2, Bacillus aquimaris JB306,
B. marisflavi GN28, B. altitudinis NIOT-BARREN23, B. aquimaris JP44SK28 and B. axarquiensis CHMS1B6, respectively. The aiiA gene amplification showed that all isolates were successfully amplified with PCR products of ±750 bp, whereas pvdQ gene could not be amplified. BLAST-X analysis of aiiA gene showed that AHL lactonase of BKS-1 was closely related with AHL lactonase of
Bacillus sp.MBG12, AHL lactonase CMS-4 and JBR1-3 were closely related with AHL lactonase from B. cereus, AHL lactonase JBR2-16 was closely related with AHL lactonase from B. firmus with 92%, 97%, 94%, 98%, and 99% of maximum identity, respectively. The existence of the AHL lactonase from B. aquimaris, B. marisflavi, B. altitudinis and B. axarquiensis have not been reported yet, this study provide the new information that they could produced AHL lactonase that encode aiiA gene and might have potential as a biocontrol agents against phytopathogen bacteria.
©
Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
KARAKTERISASI BAKTERI PENGHASIL
ASIL HOMOSERIN LAKTON LAKTONASE DAN ASILASE
YANG DIISOLASI DARI LAHAN PERTANIAN
DINA FITRIYAH
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah subhanahu wa ta’ala yang telah melimpahkan rahmat dan karunia-Nya, sehingga penulis dapat menyelesaikan penyusunan tesis yang berjudul “Karakterisasi Bakteri Penghasil Asil Homoserin Lakton Laktonase dan Asilase yang diisolasi dari Lahan Pertanian”. Tesis ini disusun untuk memenuhi salah satu syarat untuk menyelesaikan pendidikan strata dua (S2) Program Studi Mikrobiologi, Departemen Biologi, Fakultas Matematika dan Pengetahuan Alam, Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Bapak Dr Ir Iman Rusmana, MSi dan Prof. Dr. Aris Tri Wahyudi, MSi selaku pembimbing yang telah memberikan pengarahan, bimbingan, saran, motivasi, serta solusi dari setiap permasalahan yang dihadapi penulis selama melaksanakan penelitian dan penyusunan karya ilmiah ini. Selain itu penulis ucapkan terima kasih kepada penguji luar komisi Dr Ir Abdjad Asih Nawangsih, MSi dan Prof. Dr. Anja Meryandini, MS selaku Ketua Program Studi Mikrobiologi IPB, yang telah memberikan masukan pada saat ujian sidang tesis untuk membuat karya ilmiah ini menjadi lebih baik. Ucapan terima kasih kepada DIKTI melalui Beasiswa Unggulan 2012/2013 atas kepercayaannya untuk memberikan beasiswa kuliah selama menempuh pendidikan pascasarjana di IPB, sehingga penelitian yang penulis lakukan dapat terlaksana dengan baik.
Penulis juga ingin menyampaikan terima kasih kepada Bapak Jaka dan Ibu Heni selaku staf Laboratorium Mikrobiologi, Aar, Asril, Bang Risky, Kak Sipri, Randi, Hendri, Anja, Lekta, Mbak Mona, Mbak Anik, Mbak Gege, Mbak Ayun, Mb Rika, Eja, Vita, Antri, serta seluruh teman-teman di Laboratorium Mikrobiologi IPB, atas bantuan dan motivasinya selama penelitian. Terima kasih kepada teman-teman seperjuangan Pascasarjana Mikrobiologi IPB 2012 atas kebersamaan dan persaudaraannya. Ungkapan terima kasih yang tak terhingga juga penulis ucapkan kepada bapak, ibu, saudara Moh. Rosyadi Adnan dan Moh. Ubaidillah serta seluruh keluarga besar tercinta, atas segala doa, semangat, dukungan, motivasi dan kasih sayangnya selama ini. Semoga karya tulis ini bermanfaat bagi kemajuan ilmu pengetahuan selanjutnya.
Bogor, Januari 2015
DAFTAR ISI
DAFTAR TABEL xi
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xi
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
TINJAUAN PUSTAKA 3
Quorum Sensing 3
Acyl Homoserine Lactone (AHL) 3
Strategi Quorum Quenching dengan AHL laktonase dan AHL asilase 5
METODE PENELITIAN 7
Kerangka Penelitian 7
Waktu dan Tempat Penelitian 7
Isolasi Bakteri Asal Lahan Pertanian 7
Bioesei Aktivitas Degradasi AHL 8
Pewarnaan Gram 8
Uji Oksidasi Fermentasi Glukosa 8
Identifikasi Isolat dengan Menggunakan Gen Penyandi 16S rRNA 8 Amplifikasi Gen Penyandi AHL Laktonase dan AHL asilase 9 Analisis Sekuen Gen Penyandi AHL Laktonase dan Asilase 10 Konstruksi Pohon Filogeni 10
HASIL DAN PEMBAHASAN 10
Hasil 10
Pembahasan 16
SIMPULAN DAN SARAN 20
Simpulan 20
Saran 20
DAFTAR PUSTAKA 21
LAMPIRAN 26
DAFTAR TABEL
1 Isolat bakteri dari tanah rizosfer asal lahan pertanian di Jawa yang
mempunyai aktivitas degradasi AHL 11
2 Diameter zona degradasi AHL Chromobacterium violaceum oleh enam
isolat bakteri pendegradasi AHL 12
3 Karakter morfologi bakteri pendegradasi AHL 12 4 Konsentrasi dan kemurnian DNA genom bakteri pendegradasi AHL 13
5 Homologi sekuen gen 16S rRNA enam isolat bakteri pendegradasi AHL dengan menggunakan program BLAST-N 13
6 Homologi sekuen gen aiiA enam isolat bakteri pendegradasi AHL
dengan menggunakan analisis BLAST-X 15
DAFTAR GAMBAR
1 Struktur Acyl Homoserine Lacton 4
2 Mekanisme quorum sensing pada bakteri gram negatif 4 3 Sisi degradasi enzimatik molekul AHL oleh AHL laktonase dan AHL
asilase 5
4 Mekanisme degradasi AHL oleh AHL laktonase 6
5 Mekanisme degradasi molekul AHL oleh AHL asilase 6
6 Tahapan kerja penelitian 7
7 Bioesei aktivitas degradasi AHL kultur Chromobacterium violaceum
oleh isolat bakteri asal tanah rizosfer 11
8 Hasil elektroforesis gel agarose 1% dari gen penyandi 16S rRNA 13 9 Pohon filogenetik gen penyandi 16S rRNA isolat bakteri pendegradasi
AHL 14
10 Hasil elektroforesis gel agarose 0.8% dari gen aiiA 15 11 Pohon filogenetik sekuen asam amino AHL laktonase (AiiA) isolat
bakteri pendegradasi AHL 16
DAFTAR LAMPIRAN
1 Komposisi media 26
2 Gambar hasil pewarnaan Gram enam isolat pendegradasi AHL 27
3 Gambar hasil uji oksidatif fermentatif 28
PENDAHULUAN
Latar Belakang
Quorum Sensing (QS) merupakan mekanisme komunikasi antara sel bakteri sebagai suatu regulasi ekspresi gen tertentu dengan memproduksi dan mengeluarkan molekul-molekul sinyal (autoinduser). Mekanisme ini tergantung pada densitas atau jumlah populasi bakteri (Miller dan Bassler 2001). Bakteri menggunakan mekanisme ini untuk sintesis antibiotik, produksi eksopolisakarida, transfer plasmid, pembentukan nodul, bioluminisensi, pembentukan biofilm serta produksi faktor virulen (de Kievit dan Iglewsky 2000).
Autoinduser merupakan senyawa-senyawa dengan berat molekul rendah yang disekresikan, diakumulasikan dan diserap kembali selama proses QS. Terdapat dua kelompok molekul sinyal dalam mekanisme QS yaitu molekul peptida yang dihasilkan oleh bakteri Gram positif dan Asil Homoserin Lakton (AHL) dihasilkan oleh bakteri Gram negatif (Fuqua dan Greenberg 1998).
Beberapa bakteri patogen mengekspresikan gen-gen virulen dengan mekanisme QS. Sejauh ini pengendalian bakteri fitopatogen dilakukan dengan antibiotik, maupun pestisida. Hal ini dapat menyebabkan timbulnya generasi bakteri patogen yang lebih resisten terhadap senyawa-senyawa tersebut. Alternatif pengendalian bakteri fitopatogen dapat dilakukan dengan mengganggu sistem QS tanpa mempengaruhi pertumbuhan bakteri tersebut. Teknik ini meliputi penghambatan biosintesis molekul sinyal melalui senyawa analog, aplikasi senyawa antagonis QS misalnya furanon terhalogenasi, aplikasi agonis QS, inaktivasi secara kimia terhadap sinyal QS, dan biodegradasi molekul sinyal oleh enzim (Defoirdt et al. 2004).
Degradasi molekul sinyal AHL oleh enzim merupakan cara yang efektif dalam menghambat proses QS. Beberapa enzim pendegradasi AHL yaitu AHL laktonase dan AHL asilase. Enzim tersebut disandikan oleh gen yang berbeda-beda pada masing-masing spesies. AHL laktonase dan AHL asilase dapat dihasilkan oleh bakteri Gram positif maupun Gram negatif. AHL laktonase yang pertama kali dikarakterisasi adalah Aiia240B1 yang merupakan produk dari gen aiiA
oleh Bacillus sp. strain 240B1 (Dong et al. 2000). AHL laktonase juga dihasilkan oleh Agrobacterium tumefaciens, Arthrobacter sp., Rhodococcus erythropolis
berturut-turut disandikan oleh gen attM, ahlD, qsdA (Zhang et al. 2002; Park et al. 2003; Uroz et al. 2008). AHL asilase dihasilkan oleh bakteri Ralstonia eutropha yang disandikan oleh gen aiiD (Lin et al. 2003). Selain itu, bakteri
Pseudomonas aeruginosa juga menghasilkan AHL-asilase yang disandikan oleh gen yang berbeda yaitu pvdQ (Huang et al. 2003) dan quiP (Huang et al. 2006).
Isolasi dan karakterisasi bakteri yang memiliki kemampuan dalam mendegradasi AHL asal lahan pertanian di Jawa merupakan langkah awal untuk memanfaatkan bakteri tersebut sebagai agen biokontrol. Informasi mengenai
2
Perumusan Masalah
Pengendalian bakteri fitopatogen sejauh ini diatasi dengan menggunakan berbagai senyawa antibiotik maupun pestisida. Penggunaan senyawa tersebut dapat menyebabkan timbulnya tekanan seleksi yang dapat menghasilkan generasi patogen yang resisten terhadap antibiotik, sehingga diperlukan suatu alternatif pengendalian bakteri fitopatogen tanpa mempengaruhi pertumbuhannya dengan cara degradasi molekul sinyal AHL oleh enzim, salah satunya AHL laktonase dan AHL asilase. Bakteri penghasil enzim AHL laktonase dan AHL asilase asal lahan pertanian di Indonesia khususnya di Jawa belum banyak dikaji dan dikarakterisasi.
Tujuan Penelitian
Penelitian ini bertujuan mengkarakterisasi bakteri penghasil AHL laktonase dan AHL asilase yang diisolasi dari lahan pertanian di Jawa.
Manfaat Penelitian
Data yang diperoleh dapat memberikan informasi mengenai karakter bakteri penghasil AHL laktonase dan asilase asal lahan pertanian di Indonesia khususnya di Jawa yang merupakan langkah awal dalam pengendalian bakteri fitopatogen. Hasil penelitian ini juga diharapkan memberikan informasi mengenai gen penyandi AHL laktonase dan AHL asilase sehingga dapat ditelaah lebih lanjut mengenai karakter dan fungsi enzim tersebut dalam mendegradasi molekul AHL bakteri fitopatogen.
Ruang Lingkup Penelitian
3
TINJAUAN PUSTAKA
Quorum Sensing
Sel-sel mikroorganisme khususnya bakteri dapat saling berkomunikasi dan dapat memberikan respon terhadap sinyal kimiawi dari lingkungan termasuk produk yang dihasilkan oleh organisme lain. Sel-sel berkomunikasi dan mengontrol berbagai kegiatan (melalui modulasi ekspresi gen) yang menghasilkan perubahan fenotip dan penyesuaian yang lebih baik terhadap kondisi lingkungan selama pertumbuhan. Sel bakteri dapat berkomunikasi dengan mengeluarkan sinyal molekul (autoinduser) yang dapat berdifusi dengan sel dan dapat dikenali oleh sel yang lain disebut dengan quorum sensing (QS). Molekul sinyal tersebut mempunyai berat molekul yang rendah serta dapat terakumulasi di lingkungan luar sel selama pertumbuhan (Fuqua et al. 1994).
QS merupakan regulasi ekspresi gen sebagai respon terhadap fluktuasi kepadatan populasi sel. Mekanisme QS bakteri didasarkan pada dua kelompok molekul sinyal yaitu AHL yang digunakan oleh Gram negatif dan molekul peptida kecil digunakan oleh bakteri Gram positif. Mekanisme QS dapat memodulasi
berbagai proses fisiologis seperti bioluminisensi pada Vibrio fischeri dan
V. harveyi, motilitas, biosintesis antibiotik pada Erwinia carotovora, transfer plasmid (konjugasi) pada Agrobacterium tumefaciens, produksi faktor virulensi dan pembentukan biofilm pada Pseudomonas aeruginosa, sistem kompeten dan sporulasi pada Bacillus subtilis (de Kievit dan Iglewsky 2000; Lazazzera 2000; William et al. 2000; Miller dan Bassler 2001).
Acyl Homoserine Lactone (AHL)
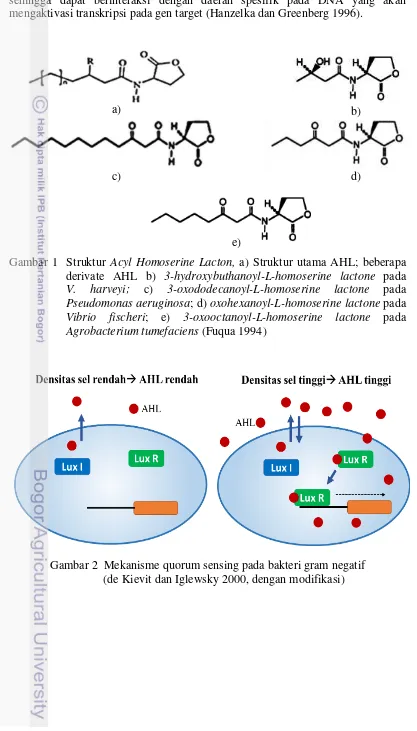
Setiap sel-sel bakteri Gram negatif dalam suatu populasi akan menghasilkan dan mengeluarkan suatu molekul sinyal yaitu AHL. AHL memiliki struktur umum yang terdiri dari cincin homoserin lakton dan rantai samping asil yang dihubungkan oleh ikatan amida (Fuqua dan Greenberg 1998). AHL dihasilkan oleh bakteri Gram negatif dengan bagian homoserin lakton yang sama, akan tetapi berbeda pada gugus asilnya (Gambar 1).
4
Pengikatan AHL membutuhkan perubahan tiga dimensi pada protein regulator, sehingga dapat berinteraksi dengan daerah spesifik pada DNA yang akan mengaktivasi transkripsi pada gen target (Hanzelka dan Greenberg 1996).
Gambar 1 Struktur Acyl Homoserine Lacton, a) Struktur utama AHL; beberapa derivate AHL b) 3-hydroxybuthanoyl-L-homoserine lactone pada
V. harveyi; c) 3-oxododecanoyl-L-homoserine lactone pada
Pseudomonas aeruginosa; d) oxohexanoyl-L-homoserine lactone pada
Vibrio fischeri; e) 3-oxooctanoyl-L-homoserine lactone pada
Agrobacterium tumefaciens (Fuqua 1994)
Gambar 2 Mekanisme quorum sensing pada bakteri gram negatif (de Kievit dan Iglewsky 2000, dengan modifikasi)
)
b)
c) d)
5
Strategi Quorum Quenching dengan AHL laktonase dan AHL asilase
AHL mempunyai peranan penting dalam regulasi faktor virulen pada bakteri patogenik. Pengendalian bakteri patogen dapat dilakukan dengan menggunakan antibiotik, akan tetapi penghambatan dengan antibiotik dapat menimbulkan resistensi bakteri patogen (Defoirdt et al. 2004). Strategi pengendalian bakteri patogen dapat dilakukan dengan pendekatan Quorum Quenching (QQ) yaitu dengan cara mengganggu proses komunikasi sel bakteri melalui penghambatan sinyal, sehingga dapat menghambat mekanisme regulasi faktor virulen. Mekanisme penghambatan dapat dilakukan dengan berbagai cara yaitu dengan penghambatan biosintesis molekul sinyal, aplikasi senyawa analog AHL, biodegradasi molekul sinyal oleh enzim. Substansi alami dapat mengganggu persepsi sinyal yaitu dengan menirukan struktur AHL. Analog AHL dapat memblok protein regulator sehingga dapat mencegah aktivasi ekspresi gen target. Senyawa mirip AHL yang dihasilkan oleh alga merah Delisea pulchra yaitu furanon terhalogenasi dapat meghambat aktivitas AHL (Manafield et al. 1999). Strategi lain yang dapat digunakan untuk menghambat mekanisme QS adalah dengan enzim pendegradasi AHL. Pendekatan ini merupakan paling potensial dalam menghambat QS.
Gambar 3 Sisi degradasi enzimatik molekul AHL oleh AHL laktonase (nomor 1) dan AHL asilase (nomor 3) (Dong dan Zhang 2005)
Enzim pendegradasi AHL antara lain AHL laktonase, AHL asilase, oksidoreduktase dan paraoksonase (Dong et al. 2000; Lin et al. 2003; Uroz et al.
2005; Yang et al. 2005). Enzim yang banyak dipelajari dalam degradasi molekul AHL yaitu AHL-laktonase dan AHL-asilase. Degradasi enzimatik molekul AHL oleh AHL laktonase dapat terjadi dengan cara nomor 1 (Gambar 3). AHL-laktonase dapat menghidrolisis cincin lakton pada bagian homoserin AHL tanpa mempengaruhi struktur molekul sinyal (Dong et al. 2000) (Gambar 4). AHL laktonase memiliki substrat yang bervariasi dan dapat mendegradasi substrat AHL rantai panjang maupun rantai pendek (Wang et al. 2004). Hidrolisis cincin lakton oleh AHL laktonase dipengaruhi oleh pH, AHL laktonase bekerja pada pH 6-8 (Wang et al. 2004). Degradasi AHL oleh AHL laktonase bersifat reversible yaitu cincin lakton dapat terbentuk kembali jika terjadi asidifikasi. AHL laktonase dikelompokkan menjadi 2 klaster yaitu klaster AiiA dan klaster AttM. Klaster AiiA terdiri dari semua AHL laktonase dari spesies Bacillus yang dikodekan oleh gen aiiA, dengan persentase kemiripan sekuen peptidanya lebih dari 90% (Dong et al. 2002; Lee et al. 2002; Ulrich 2004). Klaster AttM terdiri dari enzim AHL laktonase yang dihasilkan oleh A. tumefaciens yang dikodekan oleh gen attM dan
6
Gambar 4 Mekanisme degradasi AHL oleh AHL laktonase (Czajkowski dan Jafra 2009)
AHL asilase merupakan enzim pendegradasi AHL yang bersifat irreversible
yaitu dengan menghidrolisis ikatan amida antara rantai asil dan homoserin lakton pada molekul AHL sehingga dapat menghasilkan asam lemak bebas dan homoserin lakton (Gambar 5) (Leadbetter dan Greenberg 2000). Produk degradasi tersebut dapat dimetabolisasi dan digunakan oleh bakteri sebagai sumber karbon, nitrogen dan energi.
Gambar 5 Mekanisme degradasi molekul AHL oleh AHL asilase (Czajkowski dan Jafra 2009)
Leadbetter dan Greenberg (2000) telah mengisolasi Variovorax paradoxus
VAC-I yang ditumbuhkan dalam medium yang mengandung 500 mg/l 3-oksoheksanoil-L-homoserin lakton dan dapat menggunakan AHL tersebut
sebagai satu-satunya sumber karbon dan nitrogen. Degradasi AHL oleh strain tersebut yaitu dengan menggunakan enzim AHL asilase yang menghasilkan homoserin lakton di dalam medium dan asam lemak yang dapat digunakan untuk menghasilkan energi. Beberapa macam kelompok AHL asilase yang telah diidentifikasi yaitu AiiD yang dihasilkan oleh R. eutropha yang disandikan oleh gen aiiD (Lin et al. 2003). P. aeruginosa menghasilkan AHL asilase PvdQ dan QuiP. PvdQ merupakan AHL asilase yang disandikan oleh gen pvdQ (Huang et al. 2003), sedangkan QuiP merupakan AHL asilase yang dikodekan oleh gen
quiP (Huang et al. 2006). Jenis AHL asilase yang lain yaitu AhlM dari
7
METODE PENELITIAN
Kerangka Penelitian
Penelitian ini terdiri atas beberapa tahap. Tahapan kerja penelitian disajikan pada Gambar 6.
Gambar 6 Tahapan kerja penelitian
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan mulai Oktober 2013 sampai Oktober 2014. Pengambilan sampel tanah rizosfer dilakukan di beberapa lahan pertanian di Jawa
Timur, Jawa Tengah dan Jawa Barat. Isolasi bakteri sampai analisis sekuen gen penyandi AHL laktonase dan asilase dilakukan di Laboratorium Mikrobiologi, Departemen Biologi FMIPA Institut Pertanian Bogor (IPB).
Isolasi Bakteri Asal Lahan Pertanian
Isolasi bakteri dilakukan pada 11 sampel tanah rizosfer asal lahan pertanian di Jawa. Isolasi bakteri dilakukan dengan metode cawan sebar pada media Nutrien Agar (NA). Sebanyak 1 g sampel tanah rizosfer disuspensikan dalam 9 ml larutan NaCl 0.85%. Pengenceran sampel dilakukan secara serial dari pengenceran 10-1 hingga 10-6. Sebanyak 0.1 ml suspensi dari pengenceran 10-3 hingga 10-6 diinokulasikan dengan metode cawan sebar pada media NA, inkubasi pada suhu ruang selama 48 jam. Koloni-koloni bakteri yang tumbuh dan menunjukkan ciri morfologi yang berbeda dimurnikan dengan metode gores kuadran.
Bioesei aktivitas degradasi AHL
Pewarnaan Gram
Uji oksidasi fermentasi
Isolasi dan purifikasi bakteri dari tanah rizosfer asal lahan pertanian
Identifikasi isolat terpilih dengan DNA penyandi 16S rRNA
Amplifikasi gen penyandi AHL laktonase dan asilase
8
Bioesei Aktivitas Degradasi AHL
Isolat bakteri asal lahan pertanian yang telah murni ditumbuhkan dalam media Luria Broth (LB) dan dishaker ± selama 18 jam (sampai nilai Optical Denstity (OD) mencapai 0.8. Kultur yang memiliki OD 0.8 disentrifugasi dengan kecepatan 10.000 rpm selama 10 menit. Sebanyak 100 µl supernatan diteteskan pada paper disk dan diletakkan pada permukaan media Luria Agar (LA) semi solid yang mengandung 1% C. violaceum. Inkubasi dilakukan pada suhu ruang selama 24 jam. Media LB steril digunakan sebagai kontrol. Aktivitas degradasi AHL ditunjukkan dengan zona tidak berwarna ungu di sekitar paper disk.
Pewarnaan Gram
Isolat murni yang memiliki aktivitas degradasi AHL yang berumur 24 jam dalam media LA miring diambil 1 ose dan dipindahkan ke permukaan kaca objek yang telah ditetesi akuades, kemudian difiksasi diatas bunsen yang bertujuan agar bakteri dapat melekat diatas kaca objek dan tidak ikut terbawa saat pencucian. Pewarnaan Gram diawali dengan pemberian pewarna crystal violet sebanyak 1-2 tetes selama 2 menit dan dibilas dengan akuades, kemudian diteteskan iodin selama 1 menit dan dilakukan pencucian. Tahap dekolorisasi dilakukan dengan penambahan etanol 95%, dibiarkan selama 30 detik. Pewarna yang terakhir yaitu safranin sebanyak 1-2 tetes selama 1 menit. Bakteri Gram positif akan menunjukkan warna ungu dan bakteri Gram negatif akan menunjukkan warna merah.
Uji Oksidasi-Fermentasi (OF) Glukosa
Isolat murni yang berumur 24 jam dalam media LA miring diinokulasikan secara tusukan pada medium semisolid dengan glukosa sebagai sumber karbonnya (Lampiran 1) dan bromotimol biru sebagai indikator keasaman pada tabung reaksi dengan tutup ulir. Inkubasi dilakukan dalam kondisi anaerob dengan menambahkan parafin oil steril yang menutupi seluruh permukaan media dan dalam kondisi aerob tanpa penambahan parafin oil (Hugh dan Leifson 1953). Inkubasi pada suhu ruang selama 1-5 hari. Uji positif ditunjukkan dengan berubahnya warna medium dari hijau menjadi kuning.
Identifikasi Isolat Berdasarkan Gen Penyandi 16S rRNA
9 kemudian dihomogenkan dengan vorteks dan diinkubasi pada suhu 55C selama 60 menit. Campuran tersebut ditambahkan 100 µl SDS 10% dan 20 µl proteinase-K (2 mg/ml) dan dihomogenkan dengan vorteks. Inkubasi pada suhu 55C selama 60 menit. Campuran ditambah dengan 100 µl CTAB dan 100 µl NaCl 0.5 M dan di homogenkan dengan vorteks, kemudian diinkubasi pada suhu 65C selama 30 menit. Tahap purifikasi dan pengendapan dilakukan dengan cara menambahkan campuran dengan 600 µl Phenol Chloroform Isoamylalcohol (PCI) 25: 24: 1, kemudian disentrifugasi dengan kecepatan 12.000 rpm selama 10 menit dan akan terbentuk 2 lapisan, lapisan atas dipindahkan pada tabung mikro steril, kemudian ditambahkan CI (24:1) sebanyak 1x volume. Larutan tersebut disentrifugasi dengan kecepatan 12.000 rpm selama 10 menit dan akan menghasilkan 2 lapisan. Lapisan atas ditambah dengan etanol absolute sebanyak 0.6 x volume. Presipitasi dilakukan dengan inkubasi pada suhu ruang selama overnight. Sentrifugasi larutan dengan kecepatan 12.000 rpm selama 10 menit. Pelet ditambah dengan 1 ml etanol dingin 70% dan disentrifugasi dengan kecepatan 12.000 rpm selama 10 menit. Pelet dikeringanginkan dan ditambahkan dengan 50 µl ddH2O dan 1 µl
RNAse 1%. Inkubasi dilakukan pada suhu 370C selama 15 menit. Konsentrasi dan kemurnian DNA diukur dengan menggunakan spektrofotometer Nano drop 2000 (Thermo Scientific, Wilmington, DE, USA).
Amplifikasi gen 16S rRNA dilakukan dengan menggunakan primer 63F (5’-CAG GCC TAA CAC ATG CAA GTC-γ’) dan 1γ87R (5’-GGG CGG WGT GTA CAA GGC-γ’) (Marchesi et al. 1998). Reaksi PCR terdiri dari 25 µl GoTaq Green Master Mix 1X, 5 µl masing-masing primer (10 pmol), 2 µl cetakan DNA (~100 ng/µl) dan nuclease free water sampai mencapai volume 50 µl. Gradien temperatur yang digunakan yaitu pre denaturasi (95oC,5 menit), 30 siklus proses
denaturasi (95oC, 1 menit), penempelan primer (55oC, 1 menit), proses pemanjangan (72oC, 1.5 menit) dan pemanjangan akhir (72oC, 10 menit). Produk
Polymerase Chain Reaction (PCR) dapat dilihat melalui elektroforesis yaitu dengan menambahkan 5 µl produk PCR pada 1% gel agarose. DNA ladder 1kb digunkan sebagai marker. Elektroforesis dilakukan selama 45 menit pada 80 V dengan buffer TAE 1X sebagai running buffer. Visualisasi gel diatas UV transluminator dengan pewarnaan EtBr. Sekuensing dilakukan dengan mengirimkan hasil amplifikasi ke perusahaan jasa sekuensing. Hasil sekuensing dianalisis dengan menggunakan program Bioedit kemudian disejajarkan dengan data base gen 16S rRNA menggunakan program BLAST-N. Basic Local Alignment Search Tool (BLAST) merupakan program dan basis data yang digunakan untuk pensejajaran sekuen. Analisis filogenetik dilakukan dengan menggunakan program MEGA 5.05 dengan metode Neighbour Joining (NJ) dengan bootstrap 1000x.
Amplifikasi Gen Penyandi AHL Laktonase dan AHL Asilase
Amplifikasi gen penyandi AHL laktonase (gen aiiA) menggunakan primer
masing-10
masing primer (10 pmol), 5 µl cetakan DNA (~100 ng/µl), 1.25 U Dream Taq DNA polymerase, nuclease free water sampai mencapai volume 50 µl. Amplifikasi dilakukan sebanyak 35 siklus dengan gradien temperatur pre denaturasi (95oC, 5 menit), denaturasi (95oC, 30 detik), penempelan primer (53oC, 30 detik), pemanjangan (72oC, 1 menit), pemanjangan akhir (72oC, 10 menit).
Amplifikasi gen penyandi AHL-asilase untuk gen pvdQ menggunakan primer pvdQF (5’-AGG CCA AGC TTA TGG GGG ATG CGT ACC GTA
CTG-γ’) dan pvdQR (5’-GTT ATA TAG GGC CGC TAG GCA TTC G-γ’)
(Huang et al. 2003). Reaksi PCR terdiri dari 5 µl 10X Dream Taq Buffer, 8 µl dNTP (2 mM), 2 µl masing-masing primer (10 pmol), 5 µl cetakan DNA (~100 ng/µl), 1.25 U Dream Taq DNA polymerase, nuclease free water sampai mencapai volume 50 µl. Gradien temperatur yang digunakan yaitu pre denaturation (94oC, 10 menit), denaturasi (94oC, 30 detik), penempelan primer (57oC, 30 detik), pemanjangan (72oC, 1 menit) serta pemanjangan akhir (72oC, 5 menit). Proses ini dilakukan sebanyak 35 siklus.
Analisis Sekuen Gen Penyandi AHL Laktonase dan Asilase
Penentuan urutan gen dilakukan dengan mengirimkan DNA hasil amplifikasi ke perusahaan penyedia jasa sekuensing. Software Bioedit digunakan untuk analisis data kasar hasil sekuensing. Sekuen gen penyandi AHL laktonase dan asilase disejajarkan dengan data base gen penyandi AHL laktonase dan asilase di GeneBank menggunakan program BLAST-X online software melalui website (http://www.ncbi.nlm.nih.gov/BLAST).
Konstruksi Pohon Filogeni
Analisis filogenetik bakteri pendegradasi AHL dilakukan berdasarkan pohon filogenetik menggunakan metode NJ dan metode maximum likelihood
menggunakan software MEGA 5.0 (Tamura et al. 2011). Topologi dari konstruksi pohon filogenetik dievaluasi menggunakan analisis bootstrap dengan 1000x.
HASIL DAN PEMBAHASAN
Hasil
Bakteri Hasil Isolasi dan Bioesei Aktivitas Degradasi AHL
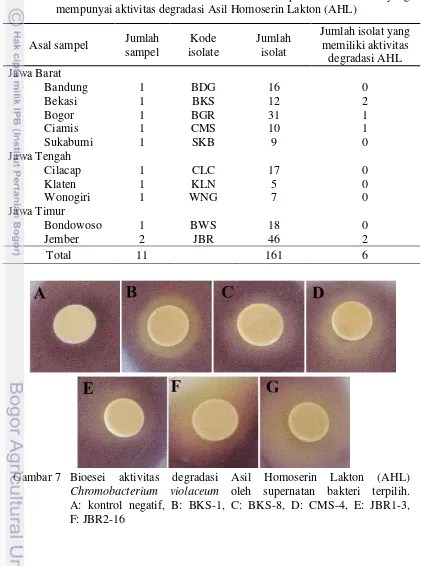
Bakteri yang berhasil diisolasi dari 11 sampel tanah rizosfer asal lahan pertanian di Jawa berjumlah 161 isolat bakteri, enam diantaranya menunjukkan aktivitas degradasi AHL (Tabel 1). Aktivitas degradasi AHL ditandai dengan
11
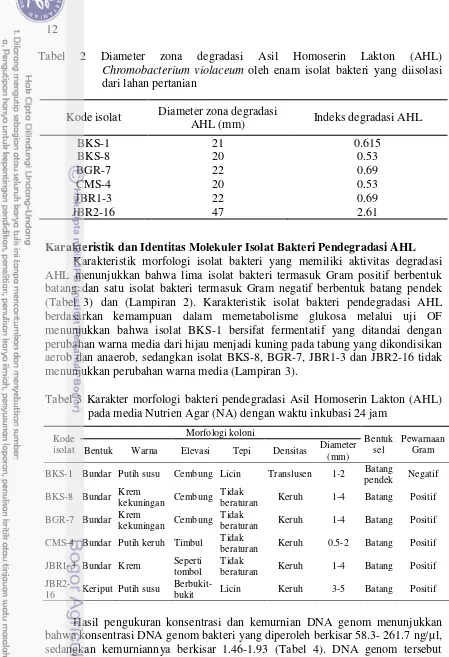
C. violaceum, sedangkan kontrol menunjukkan adanya zona ungu di sekitar kertas cakram (Gambar 7). Aktivitas degradasi AHL oleh keenam bakteri tersebut menghasilkan diameter zona degradasi yang berkisar antara 20 mm sampai 47 mm. Isolat JBR2-16 menunjukkan diameter zona degradasi AHL terbesar, sedangkan isolat yang menunjukkan diameter terkecil adalah isolat BKS-8 dan CMS-4 (Tabel 2).
Tabel 1 Isolat bakteri dari tanah rizosfer asal lahan pertanian di Jawa yang mempunyai aktivitas degradasi Asil Homoserin Lakton (AHL)
Gambar 7 Bioesei aktivitas degradasi Asil Homoserin Lakton (AHL)
12
Tabel 2 Diameter zona degradasi Asil Homoserin Lakton (AHL)
Chromobacterium violaceum oleh enam isolat bakteri yang diisolasi dari lahan pertanian
Karakteristik dan Identitas Molekuler Isolat Bakteri Pendegradasi AHL
Karakteristik morfologi isolat bakteri yang memiliki aktivitas degradasi AHL menunjukkan bahwa lima isolat bakteri termasuk Gram positif berbentuk batang dan satu isolat bakteri termasuk Gram negatif berbentuk batang pendek (Tabel 3) dan (Lampiran 2). Karakteristik isolat bakteri pendegradasi AHL berdasarkan kemampuan dalam memetabolisme glukosa melalui uji OF menunjukkan bahwa isolat BKS-1 bersifat fermentatif yang ditandai dengan perubahan warna media dari hijau menjadi kuning pada tabung yang dikondisikan aerob dan anaerob, sedangkan isolat BKS-8, BGR-7, JBR1-3 dan JBR2-16 tidak menunjukkan perubahan warna media (Lampiran 3).
Tabel 3 Karakter morfologi bakteri pendegradasi Asil Homoserin Lakton (AHL) pada media Nutrien Agar (NA) dengan waktu inkubasi 24 jam
Hasil pengukuran konsentrasi dan kemurnian DNA genom menunjukkan bahwa konsentrasi DNA genom bakteri yang diperoleh berkisar 58.3- 261.7 ng/µl, sedangkan kemurniannya berkisar 1.46-1.93 (Tabel 4). DNA genom tersebut dapat dijadikan DNA cetakan pada proses PCR gen penyandi 16S rRNA, AHL laktonase dan AHL asilase. Visualisasi hasil amplifikasi gen 16S rRNA pada enam isolat bakteri pendegradasi AHL memperlihatkan pita berukuran ± 1300 pb (Gambar 8). Kemiripan sekuen gen 16S rRNA dengan data di GenBank melalui
Kode isolat Diameter zona degradasi
AHL (mm) Indeks degradasi AHL BKS-1
Bentuk Warna Elevasi Tepi Densitas Diameter
(mm)
beraturan Keruh 0.5-2 Batang Positif
13 program BLAST-N menunjukkan bahwa lima isolat termasuk dalam genus
Bacillus dan satu isolat termasuk Serratia marcescens (Tabel 5). Analisis filogenetik gen 16S rRNA keenam isolat bakteri tersebut dibandingkan dengan spesies bakteri pada GeneBank menunjukkan bahwa terdapat dua klaster yaitu klaster pertama adalah golongan Gram positif dan klaster kedua adalah Gram negatif (Gambar 9).
Tabel 4 Konsentrasi dan kemurnian DNA genom bakteri pendegradasi Asil Homoserin Lakton (AHL)
Gambar 8 Hasil elektroforesis gel agarose 1% dari gen penyandi 16S rRNA. M: Marker 1 kb, sumur 1: BKS-1, 2: BKS-8, 3: BGR-7, 4: CMS-4, 5: JBR1-3, 6: JBR2-16 dan 7: kontrol negatif
Tabel 5 Homologi sekuen gen 16S rRNA enam isolat bakteri pendegradasi Asil Homoserin Lakton (AHL) dengan menggunakan program BLAST-N Kode isolate Konsentrasi DNA (ng/µl) A260/A280
BKS-1 170.7 1.93
BKS-8 100.0 1.87
BGR-7 58.3 1.90
CMS-4 261.7 1.46
JBR1-3 166.9 1.57
JBR2-16 130.0 1.89
Kode isolate
Bakteri pembanding
(Database GeneBank) Identity (%)
E-value Nomor akses
BKS-1 Serratia marcescens strain
By2Root2 100 (1221/1221) 0.0 KM099141.1
BKS-8 Bacillus aquimaris strain JB306 100 (1231/1231) 0.0 KJ920932.1 BGR-7 B. marisflavi strain GN28 100 (1232/1232) 0.0 KJ719344.1 CMS-4 B. altitudinis strain
NIOT-BARREN23 100 (1209/1209) 0.0 KM047502.1
JBR1-3 B. aquimaris strain JP44SK28 100 (1226/1226) 0.0 JX144718.1 JBR2-16 B. axarquiensis strain
14
Gambar 9 Pohon filogenetik gen 16S rRNA isolat bakteri pendegradasi Asil Homoserin Lakton (AHL) yang dibandingkan dengan sekuen gen 16S rRNA beberapa spesies bakteri di GeneBank menggunakan metode NJ dengan boostrap 1000x
Gen Penyandi AHL Laktonase dan AHL Asilase
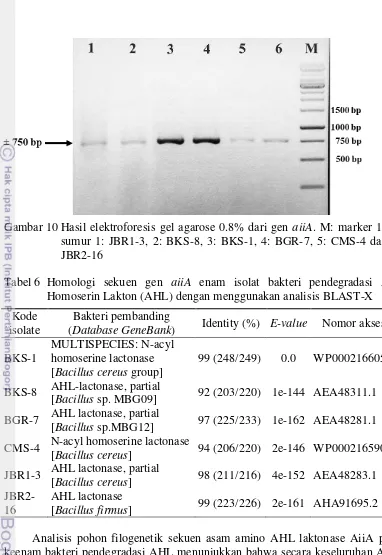
Amplifikasi gen penyandi AHL laktonase (gen aiiA) pada isolat bakteri pendegradasi AHL menunjukkan bahwa keenam isolat bakteri tersebut berhasil teramplifikasi, hal ini ditunjukkan dengan adanya pita DNA berukuran ± 750 pb (Gambar 10). Sedangkan amplifikasi gen penyandi AHL asilase (gen pvdQ) pada enam isolat pendegradasi AHL tidak teramplifikasi. Hal ini dapat diduga bahwa keenam isolat tersebut tidak dapat menghasilkan AHL asilase.
Analisis sekuen gen aiiA isolat bakteri terpilih yang disejajarkan dengan gen
aiiA pada GeneBank menggunakan program BLAST-X menunjukkan bahwa protein yang dikodekan oleh gen aiiA isolat BKS-1 memiliki kemiripan 99% dengan protein N-asil homoserin laktonase kelompok B. cereus, BKS-8 homolog dengan AHL-laktonase Bacillus sp. MBG09 dengan persentase kemiripan 92%, BGR-7 memiliki homologi 97% dengan N-asil homoserin laktonase Bacillus
sp.MBG12, CMS-4 memiliki kemiripan 94% dengan N-asil homoserin laktonase
15
Gambar 10 Hasil elektroforesis gel agarose 0.8% dari gen aiiA. M: marker 1 kb, sumur 1: JBR1-3, 2: BKS-8, 3: BKS-1, 4: BGR-7, 5: CMS-4 dan 6: JBR2-16
Tabel 6 Homologi sekuen gen aiiA enam isolat bakteri pendegradasi Asil Homoserin Lakton (AHL) dengan menggunakan analisis BLAST-X
Analisis pohon filogenetik sekuen asam amino AHL laktonase AiiA pada keenam bakteri pendegradasi AHL menunjukkan bahwa secara keseluruhan AHL laktonase keenam isolat bakteri memiliki kekerabatan yang dekat dengan AHL laktonase bakteri pembandingnya seperti AHL laktonase dari golongan B. cereus,
B. weihenstephanensis, B. firmus, B. thuringiensis serovar kim dan B. subtilis. AHL laktonase keenam isolat tersebut memiliki cabang yang terpisah dengan AHL laktonase Enterobacter asburiae, tetapi masih dalam satu klaster yang sama yaitu klaster AiiA. Keenam isolat bakteri pendegradasi AHL membentuk kelompok terpisah dengan AHL laktonase klaster AttM (Gambar 11).
Kode isolate
Bakteri pembanding
(Database GeneBank) Identity (%) E-value Nomor akses BKS-1
MULTISPECIES: N-acyl homoserine lactonase [Bacillus cereus group]
99 (248/249) 0.0 WP000216605.1 BKS-8 AHL-lactonase, partial
[Bacillus sp. MBG09] 92 (203/220) 1e-144 AEA48311.1 BGR-7 AHL lactonase, partial
[Bacillus sp.MBG12] 97 (225/233) 1e-162 AEA48281.1 CMS-4 N-acyl homoserine lactonase
[Bacillus cereus] 94 (206/220) 2e-146 WP000216590.1 JBR1-3 AHL lactonase, partial
[Bacillus cereus] 98 (211/216) 4e-152 AEA48283.1
JBR2-16
AHL lactonase
16
Gambar 11 Pohon filogenetik sekuen asam amino AHL laktonase (AiiA) isolat bakteri pendegradasi AHL menggunakan metode maximum likelihood
dengan boostrap 1000x
Pembahasan
Bakteri Gram negatif patogen menggunakan sistem QS untuk mengekspresikan gen virulennya dengan cara mengeluarkan molekul sinyal AHL. Degradasi molekul AHL dapat dilakukan untuk menekan virulensi patogen dan mengurangi gejala penyakit (Dong et al. 2000). Salah satu strategi untuk mendegradasi molekul sinyal AHL adalah dengan enzim, antara lain AHL laktonase, AHL asilase, oksidoreduktase dan paraoksonase (Dong et al. 2000; Lin
et al. 2003; Uroz et al. 2005; Yang et al. 2005). Enzim ini berperan sebagai senyawa anti QS (senyawa Quorum Quenching (QQ)). Enzim utama yang banyak dikaji adalah AHL laktonase dan AHL asilase. AHL laktonase bekerja dengan cara menghidrolisis cincin lakton AHL serta memiliki substrat yang bervariasi (Wang et al. 2004). Enzim ini stabil pada suhu 28-50oC dan pH 6-9 (Sakr et al. 2013). Hidrolisis cincin lakton dipengaruhi oleh pH medium dan dapat terbentuk kembali jika terjadi asidifikasi. Hal ini berbeda dengan AHL asilase yang bersifat
17 bebas yang dapat dimetabolisasi dan digunakan oleh bakteri sebagai sumber karbon, nitrogen maupun energi (Leadbetter dan Greenberg 2000).
Beberapa bakteri yang dapat menghasilkan enzim pendegradasi AHL dapat ditemukan pada habitat yang sama dengan bakteri yang ber-quorum sensing
(Chan et al. 2007). Pada penelitian ini, eksplorasi bakteri dari 11 sampel tanah rizosfer asal lahan pertanian di Jawa menghasilkan 6 isolat bakteri yang memiliki aktivitas degradasi AHL. Bioindikator yang digunakan dalam uji aktivitas AHL yaitu C. violaceum. Bakteri tersebut merupakan bakteri Gram negatif yang dapat menghasilkan pigmen ungu (violacein) melalui mekanisme QS yang menggunakan sinyal AHL berupa N-hexanoyl homoserine lactone (HHL) (McClean et al. 1997). McLean et al. (2004) menggunakan C. violaceum ATTC- 12472 sebagai indikator pada uji aktivitas degradasi AHL, karena lebih mudah
diamati fenotipnya tanpa membutuhkan penambahan substrat, selain itu
C. violaceum memberikan pigmentasi yang lebih gelap sehingga lebih mudah diamati dari pada Pseudomonas aureofaciens yang menghasilkan pigmen oranye. Aktivitas degradasi AHL oleh keenam bakteri asal lahan pertanian di Jawa menghasilkan diameter zona degradasi yang bervariasi. Hal ini menunjukkan bahwa kemampuan senyawa yang dihasilkan oleh bakteri dalam mendegradasi AHL C. violaceum berbeda-beda. Chong et al. (2012) melaporkan bahwa terdapat 9 isolat bakteri yang diisolasi dari tanah rizosfer hutan montane Malaysia menunjukkan aktivitas degradasi HHL yang berbeda, enam diantaranya menunjukkan degradasi yang signifikan.
Mikroorganisme yang memiliki aktivitas QQ telah banyak diidentifikasi baik dari bakteri Gram negatif maupun Gram positif (Chen et al. 2013). Berdasarkan identifikasi secara morfologi dan gen penyandi 16S rRNA terhadap keenam isolat bakteri pendegradasi AHL menunjukkan bahwa bakteri yang banyak ditemukan dalam penelitian ini adalah genus Bacillus yang merupakan kelompok bakteri Gram positif. Hal ini sejalan dengan penelitian d’Angelo-Picard
et al. (2005) bahwa bakteri pendegradasi AHL yang diisolasi dari sampel tanah dan rizosfer tanaman tembakau, umumnya adalah kelompok Bacillus. Ma et al. (2013) juga mengemukakan bahwa bakteri pendegradasi AHL yang diisolasi dari sampel filosfer daun tembakau sekitar 75% merupakan kelompok firmicutes yang umumnya adalah Bacillus. Dong et al. (2002) telah mengisolasi bakteri penginaktivasi AHL dari tanah dan tanaman, sebanyak 8 isolat memiliki aktivitas
yang kuat dalam menginaktivasi AHL, isolat tersebut memiliki homologi dengan
B. thuringiensis. Spesies bakteri yang pertama kali ditemukan dapat mendegradasi AHL adalah Bacillus sp. 240B1 (Dong et al. 2000). Beberapa spesies lain dari genus Bacillus yang telah diidentifikasi memiliki aktivitas degradasi AHL adalah
B. thuringiensis, B. cereus, B. mycoides, B. subtilis, B. amyloliquefaciens, B. weihenstephanensis (Dong et al. 2002; Pan et al. 2008; Yin et al. 2010; Sakr et al. 2013).
Aktivitas degradasi AHL oleh spesies B. aquimaris, B. marisflavi, B. altitudinis dan B. axarquensis belum pernah dilaporkan. Sejauh ini,
bakteri-bakteri tersebut telah dilaporkan memiliki peran sebagai bakteri-bakteri Plant Growth Promoting Rhizobacteria (PGPR), biokontrol, pemfiksasi nitrogen serta penghasil biosurfaktan. B. aquimaris yang diisolasi dari rizosfer tanaman dilaporkan sebagai bakteri pemacu pertumbuhan tanaman (Plant Growth Promoting Rhizobacteria
18
sebagai biokontrol terhadap Botrytis cinerea dengan dihasilkan enzim ekstraseluler berupa kitinase dan glukanase (Berrada et al. 2012). B. aquimaris
dan B. marisflavi yang telah diisolasi dari air laut diajukan sebagai spesies baru oleh Yoon et al. (2003). Ding et al. (2005) telah mengisolasi B. marisflavi dari rizosfer tanaman gandum dan jagung, bakteri tersebut memiliki gen nifH dan dapat memfiksasi nitrogen. Potensi B. altitudinis yang diisolasi rizosfer tanaman labu siam di bukit Darjeeling, India adalah sebagai bakteri PGPR yang telah diuji secara invitro dapat memproduksi siderofor, hidrogen sianida, asam indol asetat, kitinase, protease, pelarut fosfat dan juga dapat menghambat fitopatogen (Sunar
et al. 2013). Sedangkan Bhute dan Chandekar (2014) telah mengisolasi bakteri
B. axarquiensis dari Basi Bhat, bakteri tersebut dapat menghasilkan biosurfaktan, memiliki aktivitas protease, lipase serta amilase dan lebih jauh lagi telah dikarakterisasi aktivitas amilasenya. Penelitian ini merupakan pertama kali yang melaporkan bahwa B. aquimaris, B. marisflavi, B. altitudinis dan B. axarquiensis
memiliki aktivitas degradasi AHL. Satu isolat pendegradasi AHL yaitu BKS 1 teridentifikasi sebagai S. marcescens. Ma et al. (2013) melaporkan bahwa delapan isolat bakteri dari genus Serratia yang diisolasi dari filosfer tembakau dapat menginaktivasi AHL, salah satunya termasuk spesies S. marcescens.
Amplifikasi gen aiiA (gen penyandi AHL laktonase) dan gen pvdQ (gen penyandi AHL asilase) dilakukan untuk verifikasi keberadaan AHL laktonase dan AHL asilase pada enam isolat bakteri terpilih. Amplifikasi gen aiiA menggunakan primer BTF dan BTR yang telah didesain spesifik untuk AHL laktonase Bacillus
spp. dengan panjang sekuen gennya 753 bp. Primer ini telah mengamplifikasi gen
aiiAB546 dari Bacillus sp. B546 dan telah diekspresikan pada Pichia pastoris dan
dapat mengontrol penyakit pada ikan yang disebabkan oleh Aeromonas hydrophila (Chen et al. 2010). Gen aiiA merupakan gen penyandi AHL laktonase yang pertama kali ditemukan pada spesies Bacillus sp. strain 240B1 (Dong et al.
2000). Gen aiiA homolog juga banyak ditemukan dan dipelajari pada beberapa
jenis Bacillus, diantaranya adalah B. cereus, B. thuringiensis, B. subtilis, B. amyloliquefaciens (Dong et al. 2002; Pan et al. 2008; Yin et al. 2010), dan
lebih jauh lagi telah dipelajari enzim serta aplikasinya sebagai biokontrol. Gen
aiiA dari bakteri tanah Bacillus sp. A24 telah diintroduksikan pada bakteri rizosfer
P. fluorescens, bakteri transforman ini secara signifikan dapat mengurangi penyakit busuk lunak pada kentang yang disebabkan oleh Erwinia caratovora dan tumor pada tomat yang disebabkan oleh A. tumefaciens (Molina et al. 2003). Isolat BKS 1 yang teridentifikasi sebagai S. marcescens memiliki aktivitas AHL
laktonase yang dikodekan oleh gen aiiA. Hal ini berbeda dengan penelitian Ma et al. (2013) yang menyatakan bahwa S. marcescens memiliki aktivitas AHL
laktonase akan tetapi gen aiiA tidak dapat teramplifikasi.
Berdasarkan analisis pohon filogenetik sekuen asam amino AHL laktonase menunjukkan bahwa AHL laktonase yang dikodekan oleh gen aiiA isolat asal lahan pertanian di Jawa terletak dalam satu klaster yaitu klaster AiiA dan terpisah dengan klaster AttM. Klaster AiiA terdiri dari semua AHL laktonase dari Bacillus
dan memiliki lebih dari 90% kesamaan pada tingkat asam aminonya (Dong et al.
19 yaitu AttM dan AiiB serta AHL laktonase Arthrobacter sp. (AhlD). AHL laktonase dari klaster AttM memiliki persentase kemiripan 30%-58% pada sekuen peptidanya dan memiliki persentase kemiripan dengan klaster AiiA kurang dari 25% (Zhang et al. 2002). AHL laktonase dari keenam isolat secara keseluruhan memiliki kedekatan dengan AHL laktonase pembandingnya seperti AHL
laktonase dari golongan B. cereus, B. weihenstephanensis, B. firmus, B. thuringiensis serovar kim dan B. subtilis. Pada penelitian ini, AHL laktonase
dari B. cereus ditemukan paling dominan. Nusrat et al. (2011) telah melakukan skrining gen aiiA terhadap 800 isolat bakteri asal tanah pertanian, sedimen sungai, tanaman dan makanan yang terkontaminasi, hasil skrining gen aiiA menunjukkan bahwa B. cereus merupakan bakteri yang paling dominan. Chan et al. (2010) telah berhasil mengisolasi bakteri QQ dari tanah hutan hujan Malaysia yaitu isolat KM1S yang memiliki kedekatan dengan B.cereus, isolat tersebut dapat
mendegradasi secara cepat N-3-oxooctanoyl homoserine lactone dan
N-3-oxohexanoyl homoserine lactone. Selain B. cereus, AHL laktonase dari
keenam isolat memiliki kedekatan dengan AHL laktonase B. firmus dan
B. weihenstephanensis. Rajesh dan Rai (2014) melaporkan bahwa B. firmus PT18 memiliki kemampuan mendegradasi AHL yaitu dengan menghambat produksi violacein pada biosensor C. violaceum CV026 sekitar 80%. Sedangkan Sakr et al.
(2013) melaporkan bahwa aktivitas AHL laktonase dari ekstrak kasar
B. weihenstephanensis P65 telah dikarakterisasi dan memiliki kedekatan dengan AHL laktonase B. thuringiensis dan B. cereus. AHL laktonase keenam isolat tersebut juga memiliki kedekatan dengan AHL laktonase B. subtilis. Gen aiiA dari
B. subtilis BS-1 telah diekspresikan dan dikarakterisasi serta menghasilkan AHL laktonase AiiA yang mirip dengan kelompok B. cereus, enzim tersebut dapat menghambat gejala busuk pada kentang (Pan et al. 2008).
Pada penelitian ini, keberadaan gen penyandi AHL asilase tidak terdeteksi pada keenam isolat bakteri pendegradasi AHL. Hal ini diindikasikan bahwa keenam isolat tersebut hanya memiliki homologi dengan gen penyandi AHL laktonase. Distribusi gen yang mengkodekan AHL asilase pada spesies bakteri lebih sempit dibandingkan dengan gen yang mengkodekan AHL laktonase (Kalia
et al. 2011; Chen et al. 2013). Sekuen enzim AHL laktonase terdistribusi pada beberapa mikroorganisme termasuk Actinobacteria, Acidobacteria, Bacteroidetes,
Chloroflexi, Deinococcus-Thermus, Firmicutes, α-Proteobacteria, -Proteobacteria, -Proteobacteria, δ-Proteobacteria, Euryarchaeota,
Crenarchaeota, Sphingo-bacteria, Spirochaetales, Nitrospirales, dan Planctomycetes. Golongan penghasil AHL laktonase yang paling banyak adalah
golongan Firmicutes (kelompok Bacillus) dan α-Proteobacteria, salah satunya
A. tumefaciens. Sekuen enzim AHL asilase terdistribusi pada beberapa mikroorganisme termasuk Actinobacteria, Cyanobacteria, Bacteroidetes,
Deinococcus-Thermus, Firmicutes, α-Proteobacteria, -Proteobacteria, -Proteobacteria, δ-Proteobacteria, Euryarchaeota dan Crenarchaeota. Sedangkan
20
substrat yang luas sehingga penggunaannya lebih efektif (Chen et al. 2010). AHL laktonase dapat mendegradasi AHL dengan rantai asil panjang maupun rantai asil pendek serta dapat mendegradasi AHL yang memiliki substitusi pada C3 rantai asil. Chen et al. (2010) mengemukakan bahwa AHL laktonase AiiAB546 dari
Bacillus sp. B546 memiliki aktivitas katalitik terhadap substrat C4-HSL, C6-HSL, C8-HSL, C10-HSL, C12-HSL, C14-HSL, 3-oxo-C6-HSL, 3-oxo-C8-HSL. AHL laktonase AiiAAI96 dari Bacillus sp. AI96 dapat mendegradasi C4-HSL, C6-HSL,
C7-HSL, C8-HSL, C10-HSL, C12-HSL, C14-HSL, 3-oxo-C10-HSL, 3-oxo-C12-HSL, 3-oxo-C14-HSL (Cao et al 2012). AHL asilase mendegradasi rantai asil tergantung pada panjang pendeknya rantai asil pada sinyal AHL (Huang et al.
2003; Lin et al. 2003). AHL asilase PvdQ dapat mendegradasi AHL rantai panjang 3-oxo-C12HSL, C14-HSL, C12-HSL, C10-HSL dan C8-HSL, tetapi tidak dapat mendegradasi C6-HSL dan 3-oxo-C6-HSL (Huang et al. 2003). Lin et al. (2003) melaporkan bahwa AHL asilase AiiD dapat mengurangi akumulasi 3-oxo-C12-HSL dan C4-HSL secara signifikan. Perbedaan degradasi sinyal oleh enzim AHL laktonase dan AHL asilase dapat menjadi alasan keberadaan QQ bakteri dengan aktivitas AHL laktonase paling banyak ditemukan.
SIMPULAN DAN SARAN
Simpulan
Enam dari 161 isolat asal lahan pertanian memiliki aktivitas degradasi AHL. Berdasarkan identifikasi 16S rRNA, isolat BKS1 memiliki kedekatan dengan S. marcescens By2Root2, isolat BKS-8 dengan B. aquimaris JB306, BGR-7 dengan
B. marisflavi GN28, CMS-4 dengan B. altitudinis NIOT-BARREN23, isolat JBR1-3 dengan B. aquimaris JP44SK28 dan isolat JBR2-16 mirip dengan B. axarquiensis CHMS1B6, masing-masing memiliki persentase kedekatan 100%. Gen aiiA keenam isolat berhasil teramplifikasi, sedangkan gen pvdQ tidak dapat teramplifikasi pada semua isolat. Analisis filogenetik AHL laktonase AiiA menunjukkan bahwa secara umum AHL laktonase dari keenam isolat memiliki
kesamaan dengan AHL laktonase B. cereus, B. weihenstaphenensis,
B. thuringiensis, B. subtilis dan B. firmus. Keberadaan AHL laktonase dari
B. aquimaris, B. marisflavi, B. altitudinis dan B. axarquiensis belum pernah dilaporkan, sehingga penelitian ini memberikan informasi baru bahwa bakteri tersebut memiliki aktivitas AHL laktonase dan memiliki potensi untuk dijadikan sebagai agen biokontrol.
Saran
21
DAFTAR PUSTAKA
Berrada I, Benkhemmar O, Swings J, Bendaou N, Amar M. 2012. Selection of halophilic bacteria for biological control of tomato gray mould caused by
Botrytis cinerea.Phytopathol Mediter. 51(3):625-630.
Bhute RM, Chandekar CJ. 2014. Characteristic of amylase produced by Bacillus axarquiensis isolated from Basi Bhat. Int J Life Sci. Special Issue A2:73-76.
Cao Y, He S, Zhou Z, Zhang M, Mao W, Zhang H, Yao B. 2012. Orally adminstered thermostable N-acyl homoserine lactonase from Bacillus sp. strain AI96 attenuates Aeromonas hydrophila infection in zebrafish. Appl Environ Microbiol. 78(6):1899-1908. doi:10.1128/AEM.06139-11
Chan KG, Tiew SW, Ng CC. 2007. Rapid isolation method of soil bacilli and screening of their quorum quenching activity. Asia J Mol Biol Biotechnol.
15(3):153-156.
Chan KG, Wong CS, Yin WF, Sam CK, Koh CL. 2010. Rapid degradation of N-3-oxo-acylhomoserine lactones by a Bacillus cereus isolate from Malaysian rainforest soil. Antonie van Leeuwenhoek. 98(3):299-305. doi:10.1007/s10482-010-9438-0.
Chen F, Gao Y, Chen X, Yu Z, Li X. 2013. Quorum quenching enzymes and their application in degrading signal molecules to block quorum sensing dependent infection. Int J Mol Sci. 14(9):17477-17500. doi:10.3390/ijms 140917477.
Chen R, Zhou Z, Cao Y, Bai Y, Yao B. 2010. High yield expression of an AHL-lactonase from Bacillus sp. B546 in Pichia pastoris and its application to reduce Aeromonas hydrophila mortality in aquaculture. Microb Cell Fact.
9(39):1-10.
Chong TM, Koh CL, Sam CK, Choo YM, Yin WF, Chan KG. 2012. Characterization of quorum sensing and quorum quenching soil bacteria isolated from Malaysian Tropical Montane Forest. Sensors. 12(4):4846 4859. doi:10.3390/s120404846.
Czajkowski R, Jafra S. 2009. Quenching of acyl-homoserine lactone-dependent quorum sensing by enzimatic disruption of signal molecules. Acta BP.
56(1):1-16.
d’Angelo-Picard C, Faure D, Penot I, Dessaux Y. 2005. Diversity of N-acyl homoserine lactone producing and degrading bacteria in soil and tobacco rhizosphere. Environ Microbiol. 7(11):1796-1808. doi:10.1111/j.1462-2920.2005.00886.x.
Defoirdt T, Boon N, Bossier P, Verstraete W. 2004. Disruption of bacterial quorum sensing: an unexplored strategy to fight infections in aquaculture. Aquaculture. 240(1-4):69-88. doi:10.1016/j.aquaculture.2004. 06.031.
de Kievit TR, Iglewski BH. 2000. Bacterial quorum sensing in pathogenic relationships. Infect Immun. 68(9):4839-4849. doi:10.1128/IAI.68.9.4839-4849.2000.
Ding Y, Wang J, Liu Y, Chen S. 2005. Isolation and identification of nitrogen-fixing bacilli from plant rhizosphere in Beijing region. J Appl Microbiol.
22
Dong YH, Gusti AR, Zhang Q, Xu JL, Zhang LH. 2002. Identification of quorum quenching N-acyl homoserine lactonases from Bacillus species. Appl Environ Microbiol. 68(4):1754-1759. doi:10.1128/AEM.68.4.17541759. 2002.
Dong YH, Xu JL, Li XZ, Zhang LH. 2000. AiiA, an enzyme that inactivates the acyl-homoserine lactone quorum sensing signal and attenuates the virulence of Erwinia carotovora. Proc Natl Acad Sci USA. 97(7):3526-3531. doi:10.1073/ pnas.060023897.
Dong YH, Zhang LH. 2005. Quorum sensing and quorum-quenching enzymes.
J Microbiol. 43:101-109.
Fuqua C, Greenberg EP. 1998. Self perception in bacteria: quorum sensing with acylhomoserine lactones. Curr Opin Microbiol. 1(2):183-189.
Fuqua WC, Winans SC, Greenberg EP. 1994. Quorum sensing in bacteria: the LuxR-LuxI family of cell density-responsive transcriptional regulators.
J Bacteriol. 176(2):269-275.
Hanzelka BL, Greenberg EP. 1996. Quorum sensing in Vibrio fischeri: evidence that S-adenosylmethionine is the amino acid substrate for autoinducer synthesis. J Bacteriol. 178(17):5291-5294.
Huang JJ, Han JI, Zhang LH, Leadbetter JR. 2003. Utilization of acyl-homoserine lactone quorum signals for growth by a soil Pseudomonad and
Pseudomonas aeruginosa PAO1. Appl Environ Microbiol. 69(10):5941-5949. doi:10.1128/AEM.69.10.5941–5949.2003.
Huang JJ, Petersen A, Whiteley M, Leadbetter JR. 2006. Identification of Quip, the product of gene PA1032, as the second acyl-homoserine lactone acylase of Pseudomonas aeruginosa PAO1. Appl Environ Microbiol.
72(2):1190-1197. doi:10.1128/AEM.72.2.1190-1197.2006.
Hugh R, Leifson E. 1953. The taxonomic significance of fermentative versus oxidative metabolism of carbohydrates by various gram negatif bacteria. J Bacteriol. 66(1):24-26.
Kalia VC, Raju SC, Purohit HJ. 2011. Genomic analysis reveals versatile organisms for quorum quenching enzymes: acylhomoserine lactone-acylase and lactonase. Open Microbiol J. 5:1-13.
Kim WI, Cho WK, Kim SN, Chu H, Ryu KY, Yun JC, Park CS. 2011. Genetic diversity of cultivable plant growth-promoting rhizobacteria in Korea.
J Microbiol Biotechnol. 21(8):777-790. doi:10.4014/jmb.1101.01031. Lazazzera BA. 2000. Quorum sensing and starvation: signals for entry into
stationary phase. Curr Opin Microbiol. 3(2):177-182.
Leadbetter JR, Greenberg EP. 2000. Metabolism of acyl-homoserine lactone quorum-sensing signals by Variovorax paradoxus. J Bacteriol.
182(24):6921-6926. Doi: 10.1128/JB.182.24.6921-6926.2000.
Lee SJ, Park SY, Lee JJ, Yum DY, Koo BT, Lee JK. 2002. Genes encoding the N-acyl homoserine lactone-degrading enzyme are widespread in many subspecies of Bacillus thuringiensis. Appl Environ Microbiol. 68(8):3919-3924. doi:10.1128/AEM.68.8. 3919-68(8):3919-3924.2002.
Lin YH, Xu JL, Hu J, Wang LH, Ong SL, Leadbetter JR, Zhang LH. 2003. Acyl-homoserine lactone acylase from Ralstonia strain XJ12B represents a novel and potent class of quorum-quenching enzymes. Mol Microbiol.
23 Ma A, Lv D, Zhuang X, Zhuang G. 2013. Quorum quenching in culturable phyllosphere bacteria from tobacco. Int J Mol Sci. 14(7):14607-14619. doi:10.3390/ijms140714607.
Manafield M, de Nys R, Kumar N, Read R, Givskov M, Steinberg P, Kjelleberg S. 1999. Evidence that halogenated furanones from Delisea pulchra inhibit acylated homoserine lactone (AHL)-mediated gene expression by displacing the signal from its receptor protein. Microbiology. 145(2):283-291.
Marchesi JR, Sato T, Weightman AJ, Martin TA, Fry JC, Hiom SJ, Dymock D, Wade WG. 1998. Design and evaluation of useful bacterium-spesific PCR primer that amplify genes coding for bacterial 16S rRNA. Appl Environ Microbiol. 64(2):795-799.
McClean KH, Winson MK, Fish L, Taylor A, Chhabra SR, Camara M, Daykin M, Lamb JH, Swift S, Bycroft BW, Stewart GSAB, Williams P. 1997. Quorum sensing and Chromobacterium violaceum: exploitation of violacein production and inhibiton for the detection of N-acylhomoserine lactones. Microbiology. 143(12):3703-3711.
McLean RJC, Pierson III LS, Fuqua C. 2004. A simple protocol for the identification of quorum signal antagonists. J Microbiol Methods.
58(3):351-360. doi:10.1016/j.mimet.2004.04.016.
Miller MB, Bassler BL. 2001. Quorum sensing in bacteria. Annu Rev Microbiol.
55(1):165-199.
Molina L, Contanstinescu F, Michel L, Reimman C, Duffy B, Devago G. 2003. Degradation of pathogen quorum-sensing molecules by soil bacteria: a preventive and curative biological control mechanism. FEMS Microbiol Ecol. 45(1):71-81. doi:10.1016/S0168-6496(03)00125-9.
Morohoshi T, Nakazawa S, Ebata A, Kato N, Ikeda T. 2008. Identification and characterization of N-acylhomoserine lactone-acylase from the fish intestinal Shewanella sp. strain MIB015. Biosci Biotechnol Biochem.
72(7):1887-1893. doi:10.1271/bbb.80139.
Nusrat H, Shankar P, Kushwah J, Bhushan A, Joshi J, Mukherjee T, Raju SJ, Purohit HJ, Kalia C. 2011. Diversity and polymorphism in AHL lactonase Gene (aiiA) of Bacillus. J Microbiol Biotechnol. 21(10):1001-1011. doi:10.4014/jmb.1105.05056.
Pan J, Huang T, Yao F, Huang Z, Powell CA, Qiu S, Guan X. 2008. Expression and characterization of aiiA gene from Bacillus subtilis BS-1. Microbiol Res. 163(6):711- 716. doi:10.1016/j.micres.2007.12.002.
Park SY, Lee SJ, Oh TK, Oh JW, Koo BT, Yum DY, Lee JK. 2003. AhlD, an N-acyl homoserine lactonase in Arthrobacter sp. and predicted homologues in other bacteria. Microbiology. 149(6):1541-1550. doi:10.1099/mic.0.26269-0.