PENGARUH EKSTRAK ETANOL KULIT BUAH NANAS
(Ananas comosus (L.) Merr.) TERHADAP GLUKOSA DARAH
DAN KADAR SUPEROKSIDA DISMUTASE (SOD) PADA
MENCIT HIPERGLIKEMIA SECARA IN VIVO
SKRIPSI
OLEH:
ANINDITHA RACHMAH RAMADHIANI
NIM 131524006
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGARUH EKSTRAK ETANOL KULIT BUAH NANAS
(Ananas comosus (L.) Merr.) TERHADAP GLUKOSA DARAH
DAN KADAR SUPEROKSIDA DISMUTASE (SOD) PADA
MENCIT HIPERGLIKEMIA SECARA IN VIVO
SKRIPSI
Diajukan Sebagai Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
ANINDITHA RACHMAH RAMADHIANI
NIM 131524006
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
PENGARUH EKSTRAK ETANOL KULIT BUAH NANAS
(Ananas comosus (L.) Merr.) TERHADAP GLUKOSA DARAH
DAN KADAR SUPEROKSIDA DISMUTASE (SOD) PADA
MENCIT HIPERGLIKEMIA SECARA IN VIVO
OLEH:
ANINDITHA RACHMAH RAMADHIANI
NIM 131524006
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas FarmasiUniversitas Sumatera Utara
Pada tanggal: 3 September 2015
Disetujui Oleh: Dosen Pembimbing I
Prof. Dr. Urip Harahap, Apt. NIP 195301011983031004
Dosen Pembimbing II
D NIP 197506102005012003
Medan, September 2015 Fakultas Farmasi
Universitas Sumatera Utara Pejabat Dekan
Dr. Masfria, M. S., Apt. NIP 1957072319860012001
Panitia Penguji,
Prof. Dr. Rosidah, M.Si., Apt. NIP195103261978022001
Prof. Dr. Urip Harahap, Apt. NIP 195301011983031004
Marianne, S.Si, M.Si, Apt. NIP 198005202005012006
iv
KATA PENGANTAR
Puji dan syukur kehadirat Allah SWT, yang telah melimpahkan rahmat
dankaruniaNya, sehingga penulis dapat menyelesaikan penelitian dan penyusunan
skripsi yang berjudul “Pengaruh Ekstrak Etanol Kulit Buah Nanas (Ananas
comosus (L.) Merr.) Terhadap Glukosa Darah Dan Kadar Superoksida Dismutase
(SOD) Pada Mencit Hiperglikemia Secara In Vivo”, yang merupakan salah satu
syarat memperoleh gelar Sarjana Farmasi di Fakultas Farmasi Universitas
Sumatera Utara.
Pada kesempatan ini penulis menyampaikan terima kasih yang
sebesar-besarnya kepada Bapak Prof. Dr. Urip Harahap, Apt. dan Ibu Dr. Poppy Anjelisa
Z. Hsb, M. Si., Apt. yang telah membimbing dengan penuh kesabaran, tulus dan
ikhlas selama penelitian dan penulisan skripsi ini berlangsung. Ucapan terima
kasih juga disampaikan kepada Pejabat Dekan Fakultas Farmasi Universitas
Sumatera Utara, Ibu Dr. Masfria, M.S., Apt., dan Wakil Dekan IIbu Prof. Dr. Julia
Reveny, M.Si., Apt. yang telah memberikan bantuan dan fasilitas selama masa
pendidikan. Bapak dan Ibu staf pengajar Fakultas Farmasi Universitas Sumatera
Utara yang telah mendidik penulis selama masa perkuliahan. Ibu Dra. Aswita
Hafni Lubis, M.Si., Apt., selaku Kepala Laboratorium Fitokimia dan Ibu
Marianne, S.Si., M.Si., Apt., selaku Kepala Laboratorium Farmakologi yang telah
memberikan fasilitas, petunjuk dan membantu selama penelitian. Ibu Prof. Dr.
Rosidah, M.Si., Apt., Ibu Marianne, S.Si., M.Si., Apt., dan Ibu Aminah
Dalimunthe, S.Si., M.Si., Apt. selaku dosen penguji yang memberikan masukan,
v
Husori, S. Si., M. Sc., Apt. selaku pembimbing akademik yang telah memberikan
bimbingan selama masa pendidikan
Penulis juga ingin mengucapkan terima kasih dan penghargaan yang tulus
kepada orang tua, Ayahanda Drs. Suparman, M. Si dan Ibunda Tita Aryani, S. Pd
tercinta, atas doa dan dukungan baik moril maupun materil, adik-adik tersayang
Amallia Rachma Sari dan MC. Aulia Rahman, keluarga besar, teman-teman
seperjuangan Palembangsss 2013, teman-teman Farmasi Ekstensi stambuk 2012,
stambuk 2013 dan stambuk 2014 serta pihak-pihak yang tidak bisa disebutkan
satu persatu yang memberikan doa, dorongan dan semangat dalam penyelesaian
skripsi ini.
Penulis menyadari bahwa skripsi ini masih banyak kekurangannya, oleh
karena itu sangat diharapkan kritik dan saran yang bersifat membangun dari
semua pihak guna perbaikan skripsi ini. Akhir kata penulis berharap semoga
skripsi ini bermanfaat bagi ilmu pengetahuan khususnya bidang farmasi.
Medan, September 2015 Penulis,
vi
PENGARUH EKSTRAK ETANOL KULIT BUAH NANAS (Ananas
comosus (L.) Merr.) TERHADAP GLUKOSA DARAH DAN KADAR
SUPEROKSIDA DISMUTASE (SOD) PADA MENCIT HIPERGLIKEMIA SECARA IN VIVO
ABSTRAK
Pengobatan diabetes mellitus seperti penggunaan insulin dan obat antidiabetes oral harganya relatif lebih mahal karena penggunaannya dalam jangka waktu lama dan dapat menimbulkan efek samping yang tidak diinginkan. Oleh karena itu, perlu dicari obat yang efektif, efek samping yang relatif rendah dan harga yang relatif murah. Salah satunya adalah menggunakan bahan alam seperti kulit buah nanas Ananas comosus (L.) Merr.
Penelitian ini dimaksudkan untuk mengetahui pengaruh ekstrak etanol kulit buah nanas terhadap penurunan glukosa darah dan kadar superoksida dismutase mencit hiperglikemia yang diinduksi aloksan secara in vivo.
Penelitian ini meliputi penyiapan sampel (pengambilan sampel, identifikasi sampel, pembuatan simplisia), pemeriksaan karakteristik simplisia, skrining fitokimia simplisia, pembuatan ekstrak, pemeriksaan aktivitas penurunan kadar glukosa darah pada mencit dan dilanjutkan dengan pemeriksaan kadar superoksida dismutase pada pankreas mencit dengan metode perbandingan intensitas warna yang bereaksi setelah dilakukan pewarnaan imunohistokimia. Pengujian ini menggunakan 30 ekor mencit dibagi menjadi 6 kelompok yang terdiri dari 1 kelompok normal (tanpa perlakuan) dan 5 kelompok yang diinduksi aloksan dosis 160 mg/kg bb secara intraperitonial. Mencit yang diabetes dibagi dalam kelompok yang diberi natrium carboxy methyl cellulose (Na-CMC) 0,5%, kelompok yang diberi ekstrak etanol kulit buah nanas dengan dosis masing-masing 125 mg/kg bb, 250 mg/kg bb dan 500 mg/kg bb dan kelompok yang diberi metformin dosis 65 mg/kg bb. Setiap kelompok diberi sediaan uji secara peroral selama 14 hari berturut-turut. Selanjutnya, dilakukan pengukuran kadar glukosa darah pada hari 3, 5, 7, 9, 11, 13, dan hari ke-15. Pada hari ke-15 Mencit dibedah dan diambil pankreasnya, lalu dilakukan pemeriksaan kadar superoksida dismutase dengan metode pewarnaan imunohistokimia.
Hasil analisis ANOVA menunjukkan bahwa pemberian ekstrak etanol kulit buah nanas dosis 125 mg/kg bb, 250 mg/kg bb, dan 500 mg/kg bb memberikan penurunan kadar glukosa darah yang berbeda nyata dengan kelompok kontrol natrium carboxy methyl cellulose (CMC). Pemberian ekstrak etanol kulit buah nanas dosis 250 mg/kg bb tidak berbeda nyata dengan pemberian metformin dosis 65 mg/kg bb dan terjadi peningkatan kadar superoksida dismutase seiring dengan pemberian ekstrak etanol kulit buah nanas. Intensitas warna tertinggi terdapat pada kelompok perlakuan hewan coba yang diberi ekstrak etanol kulit buah nanas dosis 250 mg/kg bb.
Berdasarkan uraian di atas dapat disimpulkan bahwa ekstrak etanol kulit buah nanas dapat digunakan untuk menurunkan kadar glukosa darah mencit hiperglikemia dan meningkatkan kadar superoksida dismutase dengan dosis efektif 250 mg/kg bb.
Kata kunci : aloksan, diabetes mellitus, superoksida dismutase, kulit buah nanas
vii
THE EFFECT OF ETHANOL EXTRACT OF PINEAPPLE (Ananas
comosus (L.) Merr.) PEEL ON BLOOD GLUCOSE LEVELS AND
SUPEROXIDE DISMUTASE (SOD) TO HYPERGLYCEMIC MICEIN
VIVO
ABSTRACT
Treatment of diabetes mellitus such as the use of insulin and oral antidiabetic drugs are relatively more expensive because of its use in the long term and it can cause unwanted side effects. Therefore, it is necessary to find effective drugs, that have relatively low side effects and low price. One of them is by using natural materials such as pineapple Ananas comosus (L.) Merr. peel.
This study aims to test the effect of ethanol extract of pineapple peel on blood glucose levels and the levels of superoxide dismutase to hyperglycemic micealloxan-induced in vivo.
This study included sample preparation (sampling, sample identification, simplicia making), characterization of simplicia, phytochemistry screening of simplicia, extract making, the measurement of decreasing blood glucose levels in mice and continued with the examination of superoxide dismutase in the pancreas of mice with color intensity comparison method reacts after immunohistochemical staining. Thirty mice were divided into six groups consist of one normal group (without treatment) and 5 groups of alloxan induced a dose of 160 mg/kg bw by intraperitoneal. Diabetic mice were divided into groups that was given carboxy methyl cellulose natrii 0.5%, the group was given ethanol extract of pineapple peel with each dose of 125 mg/kg bw, 250 mg/kg bw and 500 mg/kg bw and metformin dose group was given 65 mg/kg bw. Each group was given the test preparation orally for 14 days. Furthermore, blood glucose levels was measured on day 3, 5, 7, 9, 11, 13, and day 15. On day 15 mice were dissected and the pancreas were taken and the superoxide dismutase was examined by immunohistochemical staining methods.
ANOVA analysis results indicated that administration of ethanol extract of pineapple peel dose of 125 mg/kg bw, 250 mg/kg bw, and 500 mg/kg bw showed the differences of blood glucose levels decreasing significantly compared with control group of carboxy methyl cellulose. Ethanol extract of pineapple peel administration of a dose of 250 mg/kg bw was not significantly different compared with metformin group dose of 65 mg/kg bw. Superoxide dismutase levels increased with ethanol extract of pineapple peel administration. The highest color intensity was showed by group ethanol extract of pineapple peel dose of 250 mg/kg bw.
Based on the data it can be concluded that the ethanol extract of pineapple peel can be used to reduce blood glucose levels to hyperglycemic mice and increase levels of superoxide dismutase with an effective dose of 250 mg/kg bw.
Keywords: alloxan, diabetes mellitus, superoxide dismutase, pineapple peel
viii
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 4
1.3 Hipotesis ... 4
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 5
1.6 Kerangka Pikir Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 7
2.1 Uraian Tanaman ... 7
2.1.1 Sistematika Tanaman ... 7
2.1.2 Nama Daerah ... 8
ix
2.1.4 Kandungan Kimia ... 8
2.1.5 Khasiat Tanaman ... 8
2.2 Ekstraksi ... 9
2.2.1 Cara dingin ... 9
2.2.2 Cara panas ... 9
2.3 Diabetes Mellitus ... 10
2.4 Klasifikasi Diabetes Mellitus ... 11
2.5 Manifestasi Klinik Diabetes Mellitus ... 12
2.6 Manajemen Pengobatan Diabetes Mellitus ... 12
2.7 Pankreas ... 15
2.8 Insulin ... 15
2.9 Aloksan ... 16
2.10 Antioksidan ... 18
2.11 Superoksida Dismutase ... 19
2.12 Imunohistokimia ... 22
BAB III METODE PENELITIAN... 24
3.1 Lokasi Penelitian ... 24
3.2 Alat dan Bahan ... 24
3.2.1 Alat ... 24
3.2.2 Bahan ... 25
3.2.3 Hewan Uji ... 25
3.3 Pembuatan Pereaksi ... 25
3.3.1 Pereaksi Bouchardat ... 25
x
3.3.3 Pereaksi Mayer ... 26
3.3.4 Pereaksi Besi (III) Klorida 1% ... 26
3.3.5 Pereaksi Molisch ... 26
3.3.6 Pereaksi Timbal II Asetat ... 26
3.3.7 Pereaksi Asam Klorida 2N ... 26
3.3.8 Pereaksi Natrium Hidroksida 2N ... 26
3.3.9 Pereaksi Asam Sulfat 2N ... 27
3.3.10 Pereaksi Liebermann-Burchard ... 27
3.3.11 Larutan Kloralhidrat ... 27
3.4Prosedur Kerja ... 27
3.4.1 Pengumpulan dan Pengolahan Sampel ... 27
3.4.1.1 Pengumpulan Bahan Tanaman ... 27
3.4.1.2 Identifikasi Tanaman ... 27
3.4.1.3 Pembuatan Simplisia ... 27
3.4.1.4 Pemeriksaan Karakteristik Simplisia ... 28
3.4.2 Skrining Fitokimia ... 30
3.4.2.1 Pemeriksaan Flavonoid ... 30
3.4.2.2 Pemeriksaan Alkaloid ... 31
3.4.2.3 Pemeriksaan Saponin ... 31
3.4.2.4 Pemeriksaan Tanin ... 31
3.4.2.5 Pemeriksaan Glikosida ... 32
3.4.2.6 Pemeriksaan Steroid/Triterpenoid ... 32
3.4.2.7 Pemeriksaan Glikosida Antrakuinon ... 33
xi
3.4.4 Penyiapan Hewan Uji ... 33
3.4.5 Pembuatan Larutan Uji ... 34
3.4.5.1 Pembuatan Suspensi Na-CMC 0,5% ... 34
3.4.5.2 Pembuatan Aloksan ... 34
3.4.5.3 Pembuatan Suspensi Glibenklamid ... 34
3.4.5.4 Pembuatan Suspensi Metformin ... 34
3.4.5.5 Pembuatan Suspensi EEKBN ... 35
3.5 Pengujian Efek Antidiabetes EEKBN ... 35
3.5.1 Penggunaan Blood Gluco Test Meter “GlucoDrTM” ... 35
3.5.2 Pengukuran Kadar Glukosa Darah (KGD) ... 36
3.5.3 Uji Pendahuluan ... 36
3.5.4 Pengujian Efek Antidiabetes EEKBN Induksi Aloksan .. 37
3.6 Pengambilan Sampel Organ Pankreas Mencit ... 38
3.7 Pemeriksaan Histologi Jaringan Organ Pankreas Mencit dengan Pewarnaan Hematoxylin Eosin (HE) ... 38
3.7.1 Pembuatan Preparat Blok Parafin ... 38
3.7.2 Pewarnaan Hematoxylin Eosin ... 39
3.8 Pemeriksaan Kadar SOD (Superoksida Dismutase) pada Pankreas Mencit dengan Metode Pewarnaan Imunohistokimia ... 39
3.8.1 Pembuatan Preparat Blok Parafin ... 40
3.8.2 Pengerjaan Pulasan Antibodi SOD ... 40
BAB IV HASIL DAN PEMBAHASAN ... 43
4.1 Identifikasi Tanaman ... 43
4.2 Karakteristik Simplisia ... 43
xii
4.2.2 Identifikasi Mikroskopis ... 43
4.2.3 Karakteristik Simplisia ... 43
4.3 Skrining Fitokimia ... 45
4.4 Aktifitas Antidiabetes Ekstrak Etanol Kulit Buah Nanas ... 46
4.4.1 Uji Pendahuluan Dengan Metode Uji Toleransi Glukosa ... 46
4.4.2 Aktifitas Antidiabetes dengan Metode Aloksan ... 49
4.5 Pemeriksaan Histopatologi Pankreas Mencit ... 61
4.6 Pemeriksaan Kadar SOD pada Pankreas Mencit ... 64
BAB V KESIMPULAN DAN SARAN ... 67
5.1 Kesimpulan ... 67
5.2 Saran ... 67
DAFTAR PUSTAKA ... 68
xiii
DAFTAR TABEL
Tabel Halaman
1.1 Penelitian terdahulu tentang nanas ... 3
4.1 Hasil karakteristik simplisia kulit buah nanas ... 44
4.2 Hasil Skrining fitokimia serbuk simplisia dan ekstrak kulit buah nanas ... 45
4.3 Pengukuran KGD rata-rata metode uji toleransi glukosa setelah perlakuan ... 47
4.4 Data persentase penurunan KGD uji toleransi glukosa ... 48
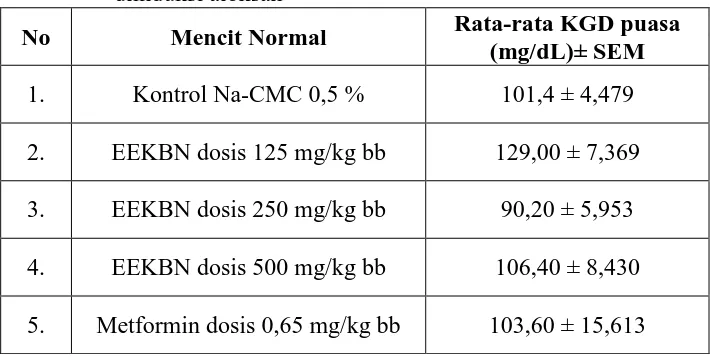
4.5 Hasil rata-rata KGD mencit setelah puasa selama 18 jam sebelum diinduksi aloksan ... 50
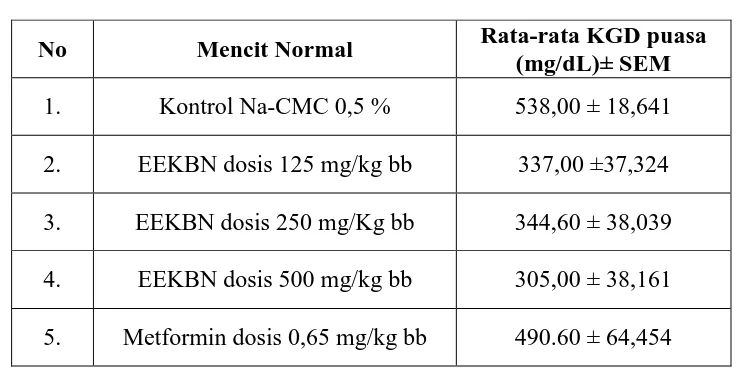
4.6 Hasil rata-rata KGD mencit setelah diinduksi aloksan dosis 160 mg/kg BB ... 51
4.7 Persentase penurunan KGD rata-rata hari ke-3 ... 52
4.8 Persentase penurunan KGD rata-rata hari ke-5 ... 53
4.9 Persentase penurunan KGD rata-rata hari ke-7 ... 54
4.10 Persentase penurunan KGD rata-rata hari ke-9 ... 55
4.11 Persentase penurunan KGD rata-rata hari ke-11 ... 56
4.12 Persentase penurunan KGD rata-rata hari ke-13 ... 58
xiv
DAFTAR GAMBAR
Gambar Halaman
1.1 Kerangka pikir penelitian ... 6
2.1 Mekanisme pertahanan antioksidan endogen superoksida dismutase, katalase dan glutation peroksidase terhadap
radikal bebas ... 19 4.2 Grafik KGD rata-rata mencit setelah perlakuan induksi
aloksan ... 61
4.3 Gambaran histologi pankreas mencit dengan pewarnaan
Hematoxylin dan Eosin ... 62
4.4 Gambaran histologi pankreas mencit dengan pewarnaan
xv
DAFTAR LAMPIRAN
Lampiran Halaman
1. Identifikasi sampel ... 74
2. Rekomendasi persetujuan etik penelitian ... 75
3. Gambar nanas segar ... 76
4. Karakteristik kulit buah nanas ... 77
5. Hasil pemeriksaan mikroskopis serbuk simplisia kulit buah nanas ... 78
6. Bagan alur penelitian ... 79
7. Bagan alur pengukuran aktivitas antidiabetes ... 80
8. Perhitungan hasil karakterisasi serbuk simplisia kulit buah nanas ... 81
9. Perhitungan hasil karakterisasi ekstrak etanol kulit buah nanas ... 86
10. Contoh perhitungan dosis ... 89
11. Data pengukuran KGD mencit metode induksi aloksan ... 92
12. Data persentase penurunan KGD mencit ... 98
13. Data pengukuran rata-rata KGD mencit setelah perlakuan induksi aloksan ... 103
14. Data persentase penurunan rata-rata KGD mencit setelah perlakuan induksi aloksan ... 104
15. Alat-alat yang digunakan ... 105
vi
PENGARUH EKSTRAK ETANOL KULIT BUAH NANAS (Ananas
comosus (L.) Merr.) TERHADAP GLUKOSA DARAH DAN KADAR
SUPEROKSIDA DISMUTASE (SOD) PADA MENCIT HIPERGLIKEMIA SECARA IN VIVO
ABSTRAK
Pengobatan diabetes mellitus seperti penggunaan insulin dan obat antidiabetes oral harganya relatif lebih mahal karena penggunaannya dalam jangka waktu lama dan dapat menimbulkan efek samping yang tidak diinginkan. Oleh karena itu, perlu dicari obat yang efektif, efek samping yang relatif rendah dan harga yang relatif murah. Salah satunya adalah menggunakan bahan alam seperti kulit buah nanas Ananas comosus (L.) Merr.
Penelitian ini dimaksudkan untuk mengetahui pengaruh ekstrak etanol kulit buah nanas terhadap penurunan glukosa darah dan kadar superoksida dismutase mencit hiperglikemia yang diinduksi aloksan secara in vivo.
Penelitian ini meliputi penyiapan sampel (pengambilan sampel, identifikasi sampel, pembuatan simplisia), pemeriksaan karakteristik simplisia, skrining fitokimia simplisia, pembuatan ekstrak, pemeriksaan aktivitas penurunan kadar glukosa darah pada mencit dan dilanjutkan dengan pemeriksaan kadar superoksida dismutase pada pankreas mencit dengan metode perbandingan intensitas warna yang bereaksi setelah dilakukan pewarnaan imunohistokimia. Pengujian ini menggunakan 30 ekor mencit dibagi menjadi 6 kelompok yang terdiri dari 1 kelompok normal (tanpa perlakuan) dan 5 kelompok yang diinduksi aloksan dosis 160 mg/kg bb secara intraperitonial. Mencit yang diabetes dibagi dalam kelompok yang diberi natrium carboxy methyl cellulose (Na-CMC) 0,5%, kelompok yang diberi ekstrak etanol kulit buah nanas dengan dosis masing-masing 125 mg/kg bb, 250 mg/kg bb dan 500 mg/kg bb dan kelompok yang diberi metformin dosis 65 mg/kg bb. Setiap kelompok diberi sediaan uji secara peroral selama 14 hari berturut-turut. Selanjutnya, dilakukan pengukuran kadar glukosa darah pada hari 3, 5, 7, 9, 11, 13, dan hari ke-15. Pada hari ke-15 Mencit dibedah dan diambil pankreasnya, lalu dilakukan pemeriksaan kadar superoksida dismutase dengan metode pewarnaan imunohistokimia.
Hasil analisis ANOVA menunjukkan bahwa pemberian ekstrak etanol kulit buah nanas dosis 125 mg/kg bb, 250 mg/kg bb, dan 500 mg/kg bb memberikan penurunan kadar glukosa darah yang berbeda nyata dengan kelompok kontrol natrium carboxy methyl cellulose (CMC). Pemberian ekstrak etanol kulit buah nanas dosis 250 mg/kg bb tidak berbeda nyata dengan pemberian metformin dosis 65 mg/kg bb dan terjadi peningkatan kadar superoksida dismutase seiring dengan pemberian ekstrak etanol kulit buah nanas. Intensitas warna tertinggi terdapat pada kelompok perlakuan hewan coba yang diberi ekstrak etanol kulit buah nanas dosis 250 mg/kg bb.
Berdasarkan uraian di atas dapat disimpulkan bahwa ekstrak etanol kulit buah nanas dapat digunakan untuk menurunkan kadar glukosa darah mencit hiperglikemia dan meningkatkan kadar superoksida dismutase dengan dosis efektif 250 mg/kg bb.
Kata kunci : aloksan, diabetes mellitus, superoksida dismutase, kulit buah nanas
vii
THE EFFECT OF ETHANOL EXTRACT OF PINEAPPLE (Ananas
comosus (L.) Merr.) PEEL ON BLOOD GLUCOSE LEVELS AND
SUPEROXIDE DISMUTASE (SOD) TO HYPERGLYCEMIC MICEIN
VIVO
ABSTRACT
Treatment of diabetes mellitus such as the use of insulin and oral antidiabetic drugs are relatively more expensive because of its use in the long term and it can cause unwanted side effects. Therefore, it is necessary to find effective drugs, that have relatively low side effects and low price. One of them is by using natural materials such as pineapple Ananas comosus (L.) Merr. peel.
This study aims to test the effect of ethanol extract of pineapple peel on blood glucose levels and the levels of superoxide dismutase to hyperglycemic micealloxan-induced in vivo.
This study included sample preparation (sampling, sample identification, simplicia making), characterization of simplicia, phytochemistry screening of simplicia, extract making, the measurement of decreasing blood glucose levels in mice and continued with the examination of superoxide dismutase in the pancreas of mice with color intensity comparison method reacts after immunohistochemical staining. Thirty mice were divided into six groups consist of one normal group (without treatment) and 5 groups of alloxan induced a dose of 160 mg/kg bw by intraperitoneal. Diabetic mice were divided into groups that was given carboxy methyl cellulose natrii 0.5%, the group was given ethanol extract of pineapple peel with each dose of 125 mg/kg bw, 250 mg/kg bw and 500 mg/kg bw and metformin dose group was given 65 mg/kg bw. Each group was given the test preparation orally for 14 days. Furthermore, blood glucose levels was measured on day 3, 5, 7, 9, 11, 13, and day 15. On day 15 mice were dissected and the pancreas were taken and the superoxide dismutase was examined by immunohistochemical staining methods.
ANOVA analysis results indicated that administration of ethanol extract of pineapple peel dose of 125 mg/kg bw, 250 mg/kg bw, and 500 mg/kg bw showed the differences of blood glucose levels decreasing significantly compared with control group of carboxy methyl cellulose. Ethanol extract of pineapple peel administration of a dose of 250 mg/kg bw was not significantly different compared with metformin group dose of 65 mg/kg bw. Superoxide dismutase levels increased with ethanol extract of pineapple peel administration. The highest color intensity was showed by group ethanol extract of pineapple peel dose of 250 mg/kg bw.
Based on the data it can be concluded that the ethanol extract of pineapple peel can be used to reduce blood glucose levels to hyperglycemic mice and increase levels of superoxide dismutase with an effective dose of 250 mg/kg bw.
Keywords: alloxan, diabetes mellitus, superoxide dismutase, pineapple peel
1
BAB I
PENDAHULUAN
1.1 Latar Belakang
Diabetes mellitus (DM) adalah sekelompok gangguan metabolisme lemak,
karbohidrat, dan protein yang disebabkan kurangnya sekresi insulin, kurangnya
sensitivitas insulin atau keduanya. DM dibagi menjadi dua kelompok utama, yaitu
DM tipe 1 (kurangnya sekresi insulin) dan tipe 2 (gabungan antara resistensi
insulin dan kekurangan sekresi insulin) (Triplitt, et al., 2008). Insulin adalah
hormon yang diperlukan untuk mengubah gula, karbohidrat dan zat makanan lain
menjadi energi yang digunakan untuk proses hidup. Sampai saat ini penyebab
diabetes masih merupakan misteri, walaupun faktor genetik, kegemukan dan
kurangnya olah raga memiliki peranan penting (ADA, 2008).
Penderita DM di dunia mencapai 8,3% atau sekitar 386,7 juta kasus yang
terjadi pada umur 20-79 tahun (IDF, 2014). Di Indonesia kasus DM mencapai
6,9% pada usia ≥ 15 tahun (Riskesdas, 2013). Di Sumatera Utara terjadi
peningkatan jumlah penderita DM pada tahun 2007 yaitu sebesar 1%, naik
menjadi 2% pada tahun 2013 (Riskesdas, 2013). Keadaan hiperglikemia
cenderung menimbulkan efek yang tidak baik bagi kesehatan tubuh, sebab kadar
glukosa darah yang tinggi cenderung mendorong terbentuknya radikal bebas atau
spesies oksigen reaktif melalui mekanisme oksidasi reduksi dengan mendorong
lebih banyak donor elektron ke dalam rantai transport elektron di mitokondria
2
Menurut Bray, et al., (2000) spesies oksigen reaktif atau Reactive Oxygen
Spesies (ROS) terlibat dalam patogenesis DM, ROS akan merusak sel-β pankreas,
mengakibatkan penurunan perlindungan sistem antioksidan dalam sel-β pankreas.
Antioksidan dalam sel-β pankreas meliputi superoksida dismutase (SOD),
katalase (CAT), glutation peroksidase (GPx) pada penderita DM, kadar
antioksidan ini menurun.
Adanya kegagalan penggunaan obat modern untuk beberapa penyakit
tertentu, serta meluasnya akses informasi mengenai obat herbal di seluruh dunia
merupakan faktor pendorong penggunaan obat herbal di negara maju. Pengobatan
DM adalah pengobatan menahun dan seumur hidup. Pengobatan DM seperti
penggunaan insulin dan obat antidiabetes oral harganya relatif lebih mahal karena
penggunaannya dalam jangka waktu lama dan dapat menimbulkan efek samping
yang tidak diinginkan. Oleh karena itu, perlu dicari obat alternatif yang efektif,
efek samping yang relatif rendah dan harga murah (Dalimartha dan Adrian, 2012).
Menurut Badan Pusat Statistik (2011); 23,63% masyarakat Indonesia telah
mengkonsumsi obat tradisional untuk berbagai penggunaan, salah satunya sebagai
alternatif pengobatan DM. Nanas (Ananas comosus (L.) Merr) merupakan salah
satu buah yang paling disukai di dunia. Jus buah ini menempati urutan ketiga yang
paling disukai di seluruh dunia setelah jus jeruk dan jus apel (Cabrera, et al.,
2001). Nanas juga dapat diolah menjadi berbagai panganan seperti dodol, keripik,
atau manisan. Penggunaan buah nanas yang luas mengakibatkan meningkatnya
jumlah limbah yang dihasilkannya, yaitu kulit buah. Peningkatan jumlah limbah
ini dapat menyebabkan peningkatan masalah polusi. Kulit buah nanas
3
al., 2012b). Flavonoid diduga berperan secara signifikan meningkatkan aktivitas
enzim antioksidan dan mampu meregenerasi sel-sel β pankreas yang rusak
sehingga defisiensi insulin dapat diatasi. Flavonoid yang terkandung dalam
tanaman juga dapat memperbaiki sensitivitas insulin (Abdelmoaty, et al., 2009).
Penelitian terdahulu tentang kulit nanas diuraikan pada Tabel 1.1.
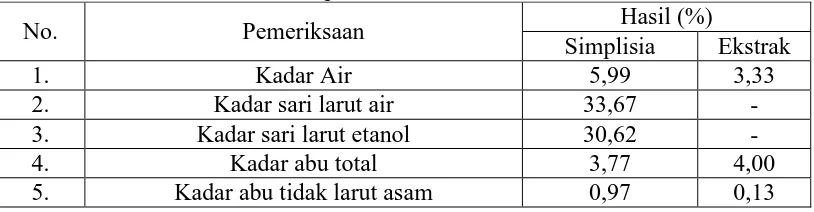
Tabel 1.1 Penelitian terdahulu tentang nanas
No. Penelitian Terdahulu Peneliti
1 Limba dari nanas terbukti dapat menghambat
enzim α amylase, yaitu salah satu enzim yang
digunakan untuk menghidrolisis karbohidrat, sehingga berpotensi menurunkan hiperglikemia
postprandial.
Sousa dan Correia, 2012
2 Cuka kulit buah nanas menunjukkan daya antioksidan lebih tinggi dari pada cuka yang berasal dari buah nanas
Parveena dan Estherlydia, 2014
3 Kulit buah nanas mengandung antioksidan yang tinggi dengan kategori kuat
Kalaiselvi, et al., 2012a
4 Kulit buah nanas mengandung senyawa metabolit sekunder yaitu fenol, flavonoid, dan steroid/triterpenoid
Kalaiselvi, et al., 2012b
5 Ekstrak kulit buah nanas dapat mempengaruhi aktivitas katalase dan lipid peroksidase pada tikus yang diinduksi alkohol
Okafor, et al., 2011
6 Ekstrak kulit buah nanas dapat menurunkan kadar lipid peroksidase pada tikus yang
diinduksi 7,12 dimethylbenz (α) anthracene
Kalaiselvi, et al., 2013
7 Ekstrak etanol kulit buah nanas telah diuji kandungan antioksidan enzimatik (SOD, GPx, CAT) dan non enzimatik (Vitamin C, Vitamin E, GSH) secara in vitro
Kalaiselvi, et al., 2012c
Mengingat potensi yang begitu besar sebagai antidiabetes namun masih
kurangnya informasi ilmiah penggunaan kulit buah nanas sebagai antidiabetes,
maka dalam penelitian ini akan diuji pengaruh ekstrak etanol kulit buah nanas
terhadap glukosa darah dan kadar SOD mencit hiperglikemia yang diinduksi
4
1.2 Perumusan Masalah
Berdasarkan uraian di atas, maka rumusan masalah dalam penelitian ini
adalah sebagai berikut:
a. Apakah ekstrak etanol kulit buah nanas (EEKBN) dapat menurunkan kadar
glukosa darah mencit setelah diberikan loading glukosa 50%?
b. apakah ekstrak etanol kulit buah nanas (EEKBN) dapat menurunkan kadar
glukosa darah mencit yang diinduksi aloksan?
c. apakah EEKBN dapat meningkatkan kadar SOD mencit yang diinduksi
aloksan?
1.3 Hipotesis
Berdasarkan rumusan masalah di atas maka hipotesis penelitian ini adalah:
a.ekstrak etanol kulit buah nanas (EEKBN) dapat menurunkan kadar glukosa
darah mencit setelah diberikan loading glukosa 50%
b.ekstrak etanol kulit buah nanas dapat menurunkan kadar glukosa darah mencit
yang diinduksi aloksan.
c.ekstrak etanol kulit buah nanas dapat meningkatkan kadar SOD mencit yang
diinduksi aloksan.
1.4 Tujuan Penelitian
Berdasarkan hipotesis di atas, maka tujuan penelitian ini adalah untuk:
a.mengetahui efek penurunan kadar glukosa darah mencit setelah diberikan
5
b.mengetahui efek penurunan kadar glukosa darah mencit yang diinduksi aloksan
oleh EEKBN.
c.mengetahui efek peningkatan kadar SOD mencit yang diinduksi aloksan oleh
EEKBN
1.5 Manfaat Penelitian
Manfaat penelitian ini diharapkan:
a.sebagai bahan pertimbangan bahwa EEKBN dapat digunakan sebagai obat
tradisional dalam pengendalian DM.
b.menunjang program pemerintah dalam pengembangan obat tradisional
sehingga dapat diikutsertakan dalam pelayanan kesehatan masyarakat.
c.meningkatkan nilai guna dari limbah kulit buah nanas sebagai alternatif obat
antidiabetes.
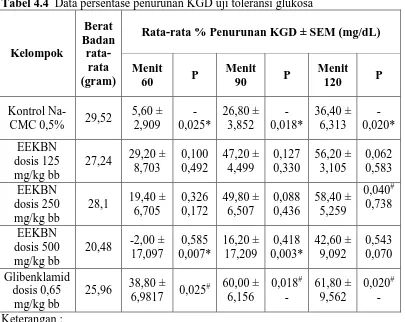
1.6 Kerangka Pikir Penelitian
Pada penelitian ini, untuk menginduksi mencit hiperglikemia digunakan
aloksan, karena telah diketahui bahwa zat ini merusak sel β pankreas sehingga
meningkatkan kadar glukosa darah mencit. EEKBN diuji untuk melihat
pengaruhnya terhadap penurunan kadar glukosa darah dan peningkatan kadar
6
Gambar 1.1. Kerangka pikir penelitian
Variabel Bebas Variabel Terikat Parameter
Simplisia Kulit
Intensitas warna inti sel pankreas mencit setelah dilakukan pewarnaan imunohistokimia Kadar glukosa
darah (KGD)
Penurunan KGD (mg/dL) mencit setelah pemberian ekstrak dengan metode OGTT dan metode aloksan
7
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tanaman
Di Indonesia, nanas ditanam di kebun-kebun, pekarangan, dan
tempat-tempat lain yang cukup mendapat sinar matahari. Tanaman tahunan atau dua
tahunan, terdapat tunas merayap pada bagian pangkalnya. Daun berkumpul pada
roset akar dan pada bagian pangkalnya melebar menjadi pelepah. Helaian daun
berbentuk pedang, tebal, liat, ujung lancip menyerupai duri, tepi berduri tempel
yang membengkok ke atas, sisi bawah bersisik putih, berwarna hijau atau hijau
kemerahan. Buah nanas merupakan gabungan buah-buah sejati yang dalam
perkembangannya bergabung bersama-sama tongkol bunga majemuk menjadi
satu buah besar. Perbanyakannnya saat ini lebih banyak secara vegetatif melalui
penanaman “mahkota” buah. Buahnya bulat panjang, berdaging, berwarna hijau,
jika masak warna menjadi kuning (Satya, 2013).
2.1.1 Sistematika Tanaman
Kingdom : Plantae
Subkingdom : Tracheobionta
Superdivisio : Spermatophyta
Divisio : Magnoliophyta
Kelas : Liliopsida
Ordo : Bromeliales
Familia : Bromeliaceae
8
Genus : Ananas
Spesies : Ananas comosus (L) Merr.
(Natural Resources Conservation Service, 2015)
2.1.2 Nama Daerah
Ekahauku, anes (Aceh), nas (Gayo), honas, hanas (Batak), gona (Nias),
kanas, kanyas, nyanyas (Lampung), ganas (Sunda), nanas (Jawa), samblaka,
malaka (Kalimantan), manas (Bali), panda (Sumba), manilmap, miniap (Irian
Jaya) (Nuraini, 2011).
2.1.3 Nama Asing
Pineapple (Inggris), ananas
2.1.4 Kandungan Kimia
Kulit buah nanas mengandung senyawa metabolit sekunder fenol,
flavonoid, saponin dan steroid/triterpenoid (Kalaiselvi, et al., 2012b). Buahnya
mengandung vitamin A, C, betakaroten, kalsium, fosfor, magnesium, besi,
natrium, kalium dan enzim bromelin. Daun dari tanaman nanas terbukti
mengandung alkaloid, flavonoid, oligosakarida, dan polisakarida (Vuyyuru, et al.,
2012)
2.1.5 Khasiat Tanaman
Kulit buah nanas dapat memodulasi aktivitas katalase dan lipid
peroksidase pada tikus yang diinduksi alkohol (Okafor, et al., 2011). Kulit buah
nanas juga dapat menurunkan kadar lipid peroksidase pada tikus yang diinduksi
7,12 dimethylbenz (α) anthracene (Kalaiselvi, et al., 2013). Buah nanas memiliki
khasiat sebagai anti radang, mengganggu pertumbuhan sel kanker, mengahambat
9
nanas terbukti dapat menurunkan kadar gula darah tikus yang diinduksi
streptozotocin (Vuyyuru, et al., 2012).
2.2Ekstraksi
2.2.1 Cara Dingin
a. Maserasi
Maserasi adalah proses ekstraksi simplisia dengan perendaman
menggunakan pelarut yang sesuai dengan sesekali pengadukan pada temperatur
ruangan (Depkes RI, 2000).
b. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai terjadi
penyarian sempurna yang umumnya dilakukan pada temperatur kamar. Proses ini
terdiri dari tahapan pengembangan bahan, tahapan maserasi antara, tahap
perkolasi sebenarnya (penetesan/penampungan perkolat) (Depkes RI, 2000).
2.2.2 Cara Panas
a. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya,
selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan
adanya pendingin balik. Umumnya dilakukan pengulangan proses pada residu
pertama 3-5 kali sehingga didapat proses ekstraksi sempurna (Depkes RI, 2000).
b. Soxhlet
Soxhlet adalah ekstraksi menggunakan pelarut yang selalu baru yang
umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu dengan
10
c. Digesti
Digesti adalah maserasi dengan pengadukan kontinu pada temperatur yang
lebih tinggi dari temperatur ruangan, yaitu secara umum dilakukan pada
temperatur 40-50oC (Depkes RI, 2000).
d. Infus
Infus adalah ekstraksi dengan pelarut air pada temperatur penangas air
(bejana infus tercelup dalam penangas air mendidih, temperatur terukur (96-98oC)
selama waktu tertentu (15-20 menit) (Depkes RI, 2000).
e. Dekok
Dekok adalah infus pada waktu yang lebih lama (≥30 o) dan temperatur
sampai titik didih air (Depkes RI, 2000).
2.3 Diabetes Mellitus
Diabetes Mellitus (DM) adalah suatu kelompok penyakit metabolik
dimana terdapat adanya gangguan dalam metabolisme lemak, karbohidrat, dan
protein akibat penurunan dalam sekresi insulin, sensitivitas insulin, atau keduanya
(Triplitt, et al., 2008). Sindrom resistensi insulin adalah suatu kondisi dimana
terjadi penurunan sensitivitas jaringan terhadap kerja insulin sehingga terjadi
peningkatan sekresi insulin sebagai bentuk kompensasi sel β pankreas. Intoleransi
glukosa merupakan salah satu manifestasi sindrom metabolik yang dapat menjadi
awal suatu diabetes mellitus (Manaf, 2010). Diabetes mellitus (DM) mempunyai
sindroma klinik yang ditandai adanya poliuria, polidipsia, dan polifagia, disertai
11
mg/dl atau postprandial ≥ 200 mg/dl atau glukosa sewaktu ≥ 200 mg/dl) (Triplitt,
et al., 2008).
2.4 Klasifikasi Diabetes Mellitus
Klasifikasi diabetes mellitus berdasarkan etiologinya menurut American
Diabetes Association (2008) meliputi:
a. DM tipe 1 adanya destruksi sel β langerhans pada pankreas, umumnya
menjurus ke defisiensi insulin absolut, akibat kelainan autoimun (antibodi
sel islet, antibodi insulin, dan antibodi asam glutamat dekarboksilase) atau
idiopatik.
b. DM tipe 2, bervariasi mulai dari yang predominan resistensi insulin disertai
defisiensi insulin relatif sampai yang predominan gangguan sekresi insulin
bersama resistensi insulin.
c. DM tipe lain, akibat defek genetik fungsi sel β, defek genetik kerja insulin,
penyakit eksokrin pankreas, endokrinopati, karena obat/zat kimia, infeksi,
imunologi, sindroma genetik lain. Bentuk ini biasanya disebabkan oleh
adanya malnutrisi disertai kekurangan protein. Dulu jenis ini disebut
Diabetes Terkait Malnutrisi (MRDM), tetapi oleh karena patogenesis jenis
ini tidak jelas maka tidak lagi disebut MRDM tetapi Diabetes Tipe Lain.
d. Diabetes Kehamilan (Diabetes Gestasional), adalah diabetes yang timbul
selama kehamilan. Penderita DM gestasional kebanyakan memiliki
homeostatis glukosa yang normal selama trimester pertama kehamilan dan
12
umumnya kadar glukosa darah kembali normal setelah melahirkan (Yuriska,
2009).
2.5Manifestasi Klinik Diabetes Mellitus
Gejala khas pada penderita DM antara lain poliuria (sering buang air
kecil), polidipsia (sering haus), dan polifagia (banyak makan/mudah lapar)
dengan atau tanpa keluhan penglihatan kabur, koordinasi gerak anggota tubuh
terganggu dan berat badan menurun tanpa sebab yang jelas (ADA, 2008), cepat
merasa lelah (fatigue),iritabilitas, dan pruritis (gatal-gatal pada kulit), lebih
mudah terkena infeksi, sukar sembuh dari luka, daya penglihatan makin buruk
(Depkes RI, 2005)
2.6 Manajemen Pengobatan Diabetes Mellitus
Langkah pertama dalam mengelola diabetes mellitus selalu dimulai
dengan pendekatan non farmakologi, yaitu berupa perencanaan makan/terapi
nutrisi medik, olahraga, dan penurunan berat badan. Bila dengan langkah tersebut
sasaran terapi pengendalian DM belum tercapai, maka dilanjutkan dengan
penggunaan obat atau intervensi farmakologis. Dalam melakukan pemilihan
intervensi farmakologis perlu diperhatikan titik kerja obat sesuai dengan macam
penyebab terjadinya hiperglikemia (Manaf, 2010).
13 a. Insulin Secretagogue
i. Sulfonilurea (misalnya: tolbutamid, klorpropamida, glibenklamida, gliklazida, glipizida, glikidon dan glimepirida)
Mekanisme kerja sulfonilurea dengan menstimulasi insulin dari sel β
-pankreas. Sulfonilurea berikatan dengan reseptor sulfonilurea yang memiliki
afinitas tinggi yang berkaitan dengan saluran K-ATP pada sel β-pankreas, akan
menghambat efluks kalium sehingga terjadi depolarisasi kemudian membuka
saluran Ca dan menyebabkan influks Ca sehingga meningkatkan pelepasan
insulin. Di samping itu, sulfonilurea juga dapat meningkatkan kepekaan reseptor
terhadap insulin di hati dan di perifer (Nolte dan Karam, 2010).
ii. Meglitinid (misal: Repaglinid)
Obat ini memodulasi pelepasan insulin dari sel β dengan mengatur efluks
kalium melalui kanal kalium. Terdapat tumpang tindih tempat kerja molekularnya
dengan sulfonilurea karena meglitinid memiliki dua tempat pengikatan yang sama
dengan sulfonilurea dan satu tempat pengikatan yang berbeda (Nolte dan Karam,
2010).
iii.Derivat D-Fenilalanin (misal: Nateglinid)
Nateglinid merangsang pelepasan insulin secara cepat dan berlangsung
sementara dari sel β melalui penutupan kanal K+
yang sensitif-ATP. Obat ini
memiliki keuntungan dalam hal keamanan penggunaannya pada pasien dengan
penurunan berat pada fungsi ginjal (Nolte dan Karam, 2010).
b. Biguanida (misalnya: metformin)
Berbeda dengan sulfonilurea, obat ini kerjanya dalam menurunkan kadar
14
bekerja dengan menurunkan glukoneogenesis di hati dan ginjal, perlambatan
absorbsi glukosa dari saluran cerna dengan peningkatan konversi glukosa menjadi
laktat oleh enterosit, stimulasi langsung glikolisis di jaringan dengan peningkatan
bersihan glukosa dari darah dan penurunan kadar glukagon plasma (Nolte dan
Karam, 2010).
c. Glukosidase-inhibitors (misalnya: akarbose dan miglitol)
Obat golongan ini bekerja dengan merintangi enzim alfa-glukosidase di
mukosa duodenum, sehingga reaksi penguraian polisakarida menjadi
monosakarida terhambat. Dengan demikian glukosa dilepaskan lebih lambat dan
absorbsinya ke dalam darah juga kurang cepat, lebih rendah dan merata, sehingga
puncak kadar gula darah dapat dihindarkan (Nolte dan Karam, 2010).
d. Thiazolidindion (misalnya: rosiglitazon dan pioglitazon)
Obat golongan ini bekerja dengan mengurangi resistensi insulin dan
meningkatkan sensitivitas jaringan perifer untuk insulin (insulin sensitizers)
(Nolte dan Karam, 2010).
e. Penghambat DPP-4 (dipeptidylpeptidase-4 blockers)
Obat golongan baru ini bekerja dengan menghambat enzim DPP-4
sehingga produksi hormon incretin tidak menurun. Adanya hormon incretin
berperan utama dalam produksi insulin di pankreas dan pembentukan hormon
GLP-1 (glukagon-like peptide-1) dan GIP (glucose-dependent insulinotropic
polypeptide) di saluran cerna yang juga berperan dalam produksi insulin. Dengan
penghambatan enzim DPP-4 akan mengurangi penguraian dan inaktivasi incretin,
GLP-1 dan GIP, sehingga kadar insulin akan meningkat (Tan dan Rahardja,
15
2.7 Pankreas
Pankreas merupakan organ panjang dan besar, terletak pada bagian cekung
(konkaf) duodenum dan meluas ke belakang peritoneum dari dinding posterior
perut, menuju ke arah kiri mencapai hilus limpa (Leeson, et al. 1996). Pankreas
adalah kelenjar campuran eksokrin-endokrin yang menghasilkan enzim
pencernaan dan hormon. Enzim ditimbun dan dilepaskan oleh sel dari bagian
eksokrin, yang tersusun dalam asini. Hormon disintesis oleh kelompok sel epitel
endokrin, yang dikenal sebagai pulau langerhans (Junqueira dan Carneiro, 2007).
Dalam pankreas terdapat 4 jenis sel endokrin, yakni:
a.sel alfa (α), yang memproduksi hormon glukagon dan proglucagon,
menduduki pulau pankreas sekitar 20%.
b.sel-beta (β), yang memproduksi hormon insulin, C-peptide, proinsulin dan
amylin, yang menduduki pulau pankreas sekitar 75%.
c.sel-D (δ), yang memproduksi somatostatin, memiliki massa sekitar 3-5 dari
pulau pankreas.
d.sel-PP (Sel-F), yang memproduksi pancreatic polypeptide (PP), yang
mungkin berperan pada penghambatan sekresi endokrin dan empedu (Nolte
dan Karam, 2010).
2.8 Insulin
Insulin merupakan hormon yang terdiri dari rangkaian asam amino,
dihasilkan oleh sel β pankreas. Dalam keadaan normal, bila ada rangsangan pada
sel β pankreas, insulin disintesis dan kemudian disekresikan ke dalam darah sesuai
16
Sintesis insulin dimulai dalam bentuk preproinsulin (precursor hormon
insulin) pada retikulum endoplasma sel β. Dengan bantuan enzim peptidase,
preproinsulin mengalami pemecahan sehingga terbentuk proinsulin, yang
kemudian dihimpun dalam gelembung-gelembung (secretory vesicles) dalam sel
tersebut. Disini, dengan bantuan enzim peptidase, proinsulin diurai menjadi
insulin dan peptida-C (C-peptide) yang keduanya sudah siap untuk disekresikan
secara bersamaan melalui membran sel (Manaf, 2010).
2.9 Aloksan
Pada uji farmakologi/bioaktivitas pada hewan percobaan, keadaan diabetes
mellitus dapat diinduksi dengan cara pankreaktomi dan pemberian zat kimia. Zat
kimia sebagai induktor (diabetogen) bisa digunakan aloksan, streptozotozin,
diaksosida, adrenalin, glukagon, EDTA yang diberikan secara parenteral.
Diabetogen yang lazim digunakan adalah aloksan karena obat ini cepat
menimbulkan hiperglikemi yang permanen dalam waktu dua sampai tiga hari
(Suharmiati, 2003).
Aloksan dapat diberikan secara parenteral seperti intravena, intraperitoneal
atau subkutan pada hewan percobaan. Dosis aloksan yang diperlukan untuk
menginduksi diabetes tergantung pada hewan percobaan yang digunakan, rute
administrasi dan status nutrisi. Pemberian dosis secara intavena yang biasa
digunakan untuk menginduksi diabetes pada tikus adalah 65 mg/kg bb, sedangkan
secara intraperitoneal atau subkutan dosis efektifnya harus 2-3 kali lebih tinggi
17
Setelah pemberian aloksan, akan terlihat 4 fase dari fluktuasi kadar
glukosa darah sebagai berikut (Lanzen, 2008):
a.fase hipoglikemia yang terjadi dalam waktu 30 menit setelah injeksi
aloksan. Hal ini terjadi karena penghambatan glukokinase yang
menyebabkan penghambatan fosforilasi glukosa. Penghambatan ini akan
menyebabkan penurunan konsumsi dan peningkatan ketesediaan ATP yang
kemudian akan menyebabkan stimulasi sekresi insulin.
b.fase kedua dimulai dengan peningkatan dari kadar glukosa darah dan
penurunan kadar insulin plasma. Fase hiperglikemia pertama ini terjadi
sekitar 1 jam setelah pemberian diabetogen dan bertahan kurang lebih 2-4
jam.
c.terjadi fase hipoglikemia kembali. Biasanya terjadi 4-8 jam setelah
pemberian dan akan bertahan selama beberapa jam. Keadaan hipoglikemia
ini terkadang sangat parah sampai menyebabkan kejang dan bahkan fatal
tanpa pemberian glukosa. Keadaan hipoglikemia transisi ini dihasilkan
akibat dari keluarnya insulin dari dalam sel β langerhans pankreas akibat
kerusakan sel-sel tersebut.
d.fase ini merupakan fase hiperglikemia diabetik. Secara morfologis, telah
terjadi degranulasi yang sempurna dan hilangnya integritas dari sel β
Langerhans pankreas. Fase ini dapat terlihat pada 12-48 jam setelah
18
2.10Antioksidan
Antioksidan adalah zat yang memperlambat atau menghambat stress
oksidatif pada molekul target. Berdasarkan mekanisme kerjanya, antioksidan
digolongkan menjadi 3 kelompok, yaitu antioksidan primer, antioksidan sekunder
dan antioksidan tersier (Winarsi, 2007).
a. Antioksidan Primer
Antioksidan primer disebut juga antioksidan endogenus atau antioksidan
enzimatis. Antioksidan primer berperan sebagai hydrogen donors, yaitu dengan
jalan memberikan atom hidrogen pada radikal peroksida yang terbentuk selama
tahap inisiasi. Suatu senyawa dikatakan sebagai antioksidan primer apabila dapat
memberikan atom hidrogen secara cepat kepada senyawa radikal, kemudian
radikal antioksidan yang terbentuk segera berubah menjadi senyawa yang lebih
stabil. Antioksidan primer meliputi enzim superoksida dismutase (SOD), katalase,
dan glutation peroksidase (GSH-Px) (Winarsi, 2007).
Tubuh dapat menghasilkan enzim antioksidan yang aktif bila didukung
oleh nutrisi pendukung atau mineral yang disebut kofaktor, diantaranya tembaga,
seng, selenium, mangan dan besi. Enzim ini memiliki berat molekul 30.000 atau
lebih (Evans, 1991).
b. Antioksidan Sekunder
Antioksidan sekunder disebut juga antioksidan eksogenus atau antioksidan
non-enzimatis. Perbedaan utama antioksidan primer dengan sekunder adalah
antioksidan sekunder tidak mengubah radikal bebas menjadi molekul yang lebih
stabil. Fungsi antioksidan sekunder adalah meningkatkan aktivitas antioksidan
19
deactivator), menon-aktifkan singlet oxygen, menyerap radiasi ultraviolet, atau
berperan sebagai oxygen scavanger (Ayucitra, et al., 2011).
Antioksidan non-enzimatik dapat berupa antioksidan alami maupun
sintesis. Senyawa antioksidan alami pada umumnya berupa vitamin C, vitamin E,
karotenoid, senyawa fenolik, dan polifenolik yang dapat berupa golongan
flavonoid, turunan asam sinamat, kuomarin, tokoferol, dan asam-asam organik
polifungsional. Golongan flavonoid yang memiliki aktivitas antioksidan meliputi
flavon, flavonol, isoflavon, katekin, flavonol, dan kalkon (Kumalaningsih, 2006).
Sedangkan antioksidan sintetik yang umum digunakan misalnya butil
hidroksianisol (BHA), butil hidroksitoluen (BHT), propil galat (PG), and
tert-butilhidrokuinon (TBHQ) yang digunakan pada konsentrasi rendah dalam
makanan (Shahidi dan Zhong, 2005).
c. Antioksidan Tersier
Kelompok antioksidan tersier meliputi sistem enzim DNA-repair dan
metionin sulfoksida reduktase. Enzim-enzim ini berfungsi dalam perbaikan
biomolekuler yang rusak akibat reaktivitas radikal bebas (Winarsi, 2007).
2.11Superoksida Dismutase (SOD)
SOD adalah antioksidan intraselular utama dalam sel aerobik. SOD berada
di otak, hati, sel darah merah, ginjal, tiroid, testis, otot jantung, mukosa lambung,
kelenjar pituitari, pankreas dan paru-paru (Evans, 1991). SOD adalah
metaloenzim yang mengkatalis dismutasi radikal anion superoksida (O2-) menjadi
hidrogen peroksida (H2O2) dan oksigen (O2) di dalam mitokondria. Selanjutnya
20
menjadi senyawa H2O dan O2, sedangkan H2O2 yang berdifusi ke dalam sitosol
akan didetoksifikasi oleh enzim glutation peroksidase (Ihnat, et al., 2007).
Mekanisme pertahanan antioksidan ditunjukkan pada Gambar 2.1.
Gambar 2.1 Mekanisme pertahanan antioksidan endogen Superoksida dismutase,
Katalase dan Glutation peroksidase terhadap radikal bebas (Pandey dan Rizvi, 2010).
Ada 3 bentuk SOD yang terdapat pada manusia dimana ketiganya
ditemukan dalam kompartemen tubuh yang berbeda.
a. Cu/Zn-SOD atau SOD1
Cu/Zn-SOD menggunakan copper atau zinc sebagai kofaktor. Gen SOD1
atau Cu/Zn-SOD terletak pada kromosom 21. SOD1 ditemukan pada sitoplasma,
nukleus dan intermembran mitokondria. Pada manusia, mutasi SOD1 bertanggung
jawab pada penyakit neurodegeneratif (contohnya amyotrophic lateral sclerosis)
21
SOD1berhubungan dengan peningkatan apoptosis dan kerusakan oksidatif protein.
SOD1 mempunyai peran penting dalam pertahanan dan pertumbuhan sel dimana
enzim ini terlibat dalam respon sel terhadap berbagai sumber stress (Alfonso,
2007).
Cu/Zn-SOD merupakan salah satu antioksidan endogen yang sangat
berperan dalam mengkatalisasi radikal bebas anion superoksida yang sangat
reaktif menjadi hidrogen peroksida dan molekul oksigen yang kurang reaktif.
Cu/Zn-SOD dipercaya memainkan peranan utama dalam baris pertama pertahanan
antioksidan (Mates, et al., 1999).
b. Mn-SOD atau SOD2
SOD2 (Mn-SOD) menggunakan mangan sebagai kofaktor. Gen SOD2
terdapat pada kromosom 6. SOD2 ditemukan dalam mitokondria dan mempunyai
peran vital dalam perlindungan melawan spesies oksigen reaktif (ROS).
Kekurangan SOD2 menyebabkan peningkatan kadar O2- pada mitokondria.
Penurunan aktivitas SOD2 juga merupakan salah satu faktor resiko kardiomiopati
(Alfonso, 2007). Pada jaringan, Mn-SOD terdapat satu setengah dari jumlah
Cu/Zn SOD (Mates, et al., 1999).
c. EC-SOD (Extracellular-SOD) atau SOD3
Sama seperti Cu/Zn-SOD, EC-SOD menggunakan copper atau zinc
sebagai kofaktor. Gen SOD3 terletak pada kromosom 4. SOD3 terutama
ditemukan dalam kompartemen ekstraseluler (plasma, limfa, cairan serebrospinal
dan cairan sendi). Mutasi SOD3 dapat meningkatkan resiko penyakit
22
2.12Imunohistokimia
Imunohistokimia adalah suatu teknik untuk mendeteksi keberadaan
berbagai macam komponen yang terdapat di dalam sel atau jaringan dengan
menggunakan prinsip reaksi ikatan antigen (Ag) dan antibodi (Ab). Teknik
imunohistokimia dapat digunakan untuk mempelajari distribusi enzim spesifik
serta mendeteksi keberadaan berbagai komponen aktif yang terdapat di dalam sel
atau jaringan seperti protein dan karbohidrat (Furuya, et al., 2004). Terdapat dua
metode pewarnaan imunohistokimia, yaitu metode langsung (direct) dan metode
tidak langsung (indirect). Metode langsung hanya menggunakan satu antibodi,
yaitu antibodi primer yang telah dilabel. Metode tidak langsung menggunakan dua
antibodi, yaitu antibodi primer tanpa dilabel dan antibodi sekunder yang telah
dilabel (Polak dan VanNoorden, 2003). Namun metode tidak langsung lebih
sering digunakan karena mempunyai tingkat sensitifitas yang lebih tinggi
dibandingkan dengan metode langsung (Ramos dan Vara, 2005).
Pada metode imunohistokimia langsung, antibodi harus diberi label yang
sesuai. Sediaan jaringan diinkubasi dengan antibodi untuk beberapa waktu
sehingga antibodi tersebut berinteraksi dengan dan terikat pada protein x. Sediaan
itu kemudian dibilas untuk menghilangkan antibodi. Sediaan dapat diamati
dengan mikroskop cahaya atau elektron tergantung label yang dipakai (senyawa
fluoresen, enzim, partikel emas) (Junqueira dan Carneiro, 2007).
Metode imunohistokimia tak langsung lebih sensitif namun membutuhkan
lebih banyak langkah (Junqueira dan Carneiro, 2007). Pada metode
imunohistokimia tak langsung, antibodi yang digunakan untuk mendeteksi suatu
23
primer. Namun pada metoda ini bukan berarti tidak membutuhkan antibodi yang
berlabel. Hal ini tetap dibutuhkan tetapi yang dilabel adalah anti imunoglobulin
24
BAB III
METODE PENELITIAN
Metode yang digunakan dalam penelitian ini adalah metode eksperimental,
yaitu metode yang digunakan untuk mengamati hubungan variabel bebas dengan
variabel terikat. Penelitian meliputi pengumpulan dan pengolahan bahan
tanaman, pembuatan simplisia, pemeriksaan karakteristik simplisia, pembuatan
ekstrak etanol dari tanaman, skrining fitokimia simplisia dan ekstrak, pengujian
kadar glukosa darah dan pemeriksaan kadar SOD pada pankreas mencit dengan
metode pewarnaan imunohistokimia setelah diberi berbagai perlakuan. Kemudian
dilakukan analisis statistik dengan menggunakan one way ANOVA (Analysis of
variance) dan dilanjutkan dengan uji LSD dengan program SPSS versi 19.0.
3.1 Lokasi Penelitian
Penelitian dilakukandi LaboratoriumFitokimia dan Laboratorium
Farmakologi Fakultas Farmasi Universitas Sumatera Utara. Pengujian parameter
histopatologi dilakukan di Laboratorium Patologi Anatomi Fakultas Kedokteran
Universitas Sumatera Utara.
3.2 Alat dan Bahan
3.2.1 Alat-Alat yang Digunakan
Alat-alat yang digunakan pada penelitian ini adalah: Alat gelas
laboratorium, seperangkat alat rotary evaporator (Heidolph vv-2000), timbangan
25
(Boeco germany), Dako Epitop Retrieval, cover glass, kertas perkamen, krus
porselin, mortir, neraca listrik (Metller Toledo), spatula, seperangkat alat destilasi,
stamper, tanur (Ney M 525 Series II).
3.2.2 Bahan Penelitian
Bahan yang digunakan dalam penelitian ini adalah kulit buah nanas
Berastagi (Cayyene), glibenklamid, aloksan, metformin, etanol 96%, asam
klorida, kalium iodida, iodium, sublimat, asam sulfat, dan bismut subnitrat,
larutan xylol, peroxide block,Normal Horse Serum (NHS) 3%, Dako Real
Envision Rabbit/Mouse, DAB (3,3-diaminobenzidine tetrahydrochloride),
hematoxylin, eosin, antibodi SOD, lithium carbonat.Bahan kimia yang digunakan
kecuali dinyatakan lain adalah berkualitas pro analisa.
3.2.3 Hewan Uji
Hewan yang digunakan untuk penelitian ini adalah mencit jantan berumur
2-3 bulan dengan berat badan 20-35 g. Sebelum percobaan dimulai, terlebih
dahulu mencit dipelihara selama 1 minggu dengan perlakuan yang baik untuk
menyesuaikan dengan lingkungannya.
3.3Pembuatan Pereaksi
3.3.1 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida P dilarutkan dalam air suling secukupnya
kemudian ditambahkan 2 g iodida sedikit demi sedikit, cukupkan dengan air
26
3.3.2 Pereaksi Dragendorff
Larutan bismut (III) nitrat P 40% b/v dalam asam nitrat P sebanyak 20 ml
kemudian dicampurkan dengan 50 ml larutan kalium iodida P 54,4% b/v,
didiamkan sampai memisah sempurna. Larutan jernih diambil dan diencerkan
dengan air suling secukupnya hingga 100 ml (Depkes RI, 1995).
3.3.3 Pereaksi Mayer
Larutan raksa (II) klorida P 2,266% b/v sebanyak 60 ml dicampur dengan
10 ml larutan kalium iodida P 50% b/v. Kedua larutan dicampurkan dan
ditambahkan air suling hingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.3.4 Pereaksi Besi (III) Klorida 1% b/v
Sebanyak 1 g besi (III) klorida dilarutkan dalam air suling sampai 100 ml
(Depkes RI, 1995).
3.3.5 Pereaksi Molisch
Sebanyak 3 g α-naftol P dilarutkan dalam asam nitrat 0,5 N hingga
diperoleh larutan 100 ml (Depkes RI, 1995).
3.3.6 Pereaksi Timbal (II) Asetat 0,4 M
Timbal (II) asetat sebanyak 15,17 g dilarutkan dalam air suling bebas CO2
hingga 100 ml (Depkes RI, 1995).
3.3.7 Pereaksi Asam Klorida 2 N
Sebanyak 17 ml asam klorida pekat diencerkan dengan air suling sampai
100 ml (Ditjen POM, 1995).
3.3.8 Pereaksi Natrium Hidroksida 2 N
Sebanyak 8,001 g pellet natrium hidroksida ditimbang, kemudian
27
3.3.9 Pereaksi Asam Sulfat 2 N
Larutan asam sulfat pekat sebanyak 9,8 ml ditambahkan air suling sampai
100 ml (Depkes RI, 1995).
3.3.10 Pereaksi Liebermann-Burchard
Campurkan 5 ml asam sulfat pekat dengan 50 ml etanol. Tambahkan
hati-hati 5 ml asam asetat anhidrida ke dalam campuran tersebut (Depkes RI, 1995).
3.3.11 Larutan Kloralhidrat
Sebanyak 50 g kloralhidrat ditimbang lalu dilarutkan dalam 20 ml air
suling (Depkes RI, 1995).
3.4Prosedur Kerja
3.4.1 Pengumpulan dan Pengolahan Sampel
3.4.1.1Pengumpulan Bahan Tanaman
Sampel kulit buah nanas diperoleh dari buah nanas yang dibeli di pasar
pagi Setia Budi, Medan. Metode pengambilan sampel dilakukan secara purposif
yaitu tanpa membandingkan dengan tumbuhan yang sama di daerah lain.
3.4.1.2Identifikasi Tanaman
Identifikasi tanaman dilakukan Herbarium Bogoriense Pusat Penelitian
Biologi Lembaga Ilmu Pengetahuan Indonesia (LIPI), Cibinong.
3.4.1.3Pembuatan Simplisia
Buah nanas yang masih segar dibersihkan dari kotoran dengan cara dicuci
dibawah air mengalir kemudian ditiriskan, dikupas untuk diambil kulitnya dan
28
lemari pengering, setelah kering, dilakukan sortasi kering dan ditimbang berat
kering. Simplisia diserbukkan dan disimpan dalam wadah plastik.
3.4.1.4Pemeriksaan Karakteristik Simplisia
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik,
mikroskopik, penetapan kadar air, penetapan kadar sari larut dalam air, penetapan
kadar sari larut dalam etanol, penetapan kadar abu total, dan penetapan kadar abu
tidak larut dalam asam.
a. Pemeriksaan Makroskopik dan Organoleptik
Pemeriksaan makroskopik dan organoleptik dilakukan dengan mengamati
bentuk, bau dan rasa dari kulit buah nanas segar dan simplisia kulit buah nanas.
b. Pemeriksaan Mikroskopik
Pemeriksan mikroskopik untuk serbuk simplisia dilakukan sebagai berikut:
sejumlah serbuk simplisia diletakkan diatas objek glass yang telah ditetesi larutan
kloralhidrat, ditutupi dengan kaca penutup dan dilihat di bawah mikroskop.
c. Penetapan Kadar Air
Penetapan kadar air dilakukan menurut metode Azeotropi (Destilasi toluen).
Cara Kerja:
i.Penjenuhan Toluen
Dimasukkan 200 ml toluen dan 2 ml air suling ke dalam labu alas bulat lalu
didestilasi selama 2 jam. Kemudian toluene dibiarkan mendingin selama 30
menit dan dibaca volume air pada tabung penerima dengan ketelitian 0,05
29 ii. Penetapan Kadar Air
Sebanyak 5 gram serbuk simplisia yang telah ditimbang seksama,
dimasukkan ke dalam labu alas bulat, labu dipanaskan hati-hati selama 15 menit.
Setelah toluen mendidih, kecepatan tetesan diatur 2 tetes untuk tiap detik sampai
sebagian besar air terdestilasi dinaikkan sampai 4 tetes tiap detik. Setelah semua
air terdestilasi, bagian dalam pendingin dibilas dengan toluen. Destilasi
dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin
pada suhu kamar. Setelah air dan toluen memisah sempurna, volume air dibaca
dengan ketelitian 0,05 ml. Selisih kedua volume air dibaca sesuai dengan
kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung
dalam persen (WHO, 1998).
d. Penetapan Kadar Sari Larut dalam Air
Sebanyak 5 g serbuk yang telah dikeringkan dimaserasi selama 24 jam
dengan 100 ml air-kloroform (2,5 ml kloroform dalam air sampai 1 liter)
menggunakan labu bersumbat sambil sesekali dikocok selama 6 jam pertama,
kemudian dibiarkan selama 18 jam. Saring, 20 ml filtrat dipipet, diuapkan sampai
kering dalam cawan penguap berdasar rata yang telah ditara dan dipanaskan pada
suhu 105ºC sampai bobot tetap. Kadar sari yang larut dalam air dihitung dalam
persen (Depkes RI, 1995).
e. Penetapan Kadar Sari Larut dalam Etanol
Sebanyak 5 g serbuk yang telah dikeringkan dimaserasi selama 24 jam
dengan 100 ml etanol 95% menggunakan labu bersumbat sambil sesekali dikocok
selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Saring, 20 ml filtrat
30
telah ditara dan dipanaskan pada suhu 105ºC sampai bobot tetap. Kadar sari yang
larut dalam etanol dihitung dalam persen (Depkes RI, 1995).
f. Penetapan Kadar Abu Total
Sebanyak 2 gram serbuk yang telah digerus dan ditimbang seksama
dimasukkan dalam krus porselin yang telah dipijar dan ditara, kemudian
diratakan. Krus dipijar perlahan-lahan sampai arang habis, kemudian didinginkan
dan ditimbang sampai diperoleh bobot tetap. Kadar abu total dihitung dalam
persen (Depkes RI, 1995).
g. Penetapan Kadar Abu Tidak Larut dalam Asam
Abu yang diperoleh dalam penetapan kadar abu total dididihkan dalam 25
ml asam klorida 2N selama 5 menit, bagian yang tidak larut dalam asam
dikumpulkan, disaring melalui kertas saring bebas abu kemudian dicuci dengan
air panas dalam kurs porselen. Residu dan kertas saring dipijarkan sampai bobot
tetap, kemudian didinginkan dan ditimbang. Kadar abu tidak larut dalam asam
dihitung terhadap bahan yang dikeringkan di udara (Depkes RI, 1995).
3.4.2 Skrining Fitokimia
Skirining fitokimia meliputi pemeriksaan senyawa golongan alkaloida,
glikosida, flavonoid, steroid/triterpenoid, saponin dan tanin.
3.4.2.1 Pemeriksaan Flavonoid
Sebanyak 10 gram simplisia ditambahkan dengan 100 ml air panas,
dididihkan selama 5 menit dan disaring dalam keadaan panas, diambil 5 ml filtrat
dan dimasukkan dalam tabung reaksi, ke dalam 5 ml filtrat ditambahkan 0,1 gram
31
dan dibiarkan memisah. Flavonoid positif jika terjadi warna merah, kuning atau
jingga pada lapisan amil alkohol (Farnsworth, 1966).
3.4.2.2 Pemeriksaan Alkaloid
Sebanyak 0,5 g serbuk simplisia ditimbang, ditambahkan 1 ml asam
klorida 2 N dan 9 ml air suling, dipanaskan diatas penangas air selama 2 menit,
didinginkan dan disaring, filtrat dipakai untuk uji alkaloida. Diambil 3 tabung
reaksi, lalu ke dalam masing-masing tabung reaksi dimasukkan 0,5 ml filtrat.
Pada tabung I :ditambahkan 2 tetes pereaksi Mayer, akan terbentuk endapan
menggumpal berwarna putih atau kuning.
Pada tabung II :ditambahkan 2 tetes pereaksi Dragendorff, akan terbentuk
endapan berwarna coklat atau jingga kecoklatan.
Pada tabung III : ditambahkan 2 tetes pereaksi Bouchardat, akan terbentuk
endapan berwarna coklat sampai kehitaman.
Alkaloid dikatakan positif jika terjadi endapan atau kekeruhan pada dua atau
tiga dari percobaan di atas (Depkes RI, 1995).
3.4.2.3 Pemeriksaan Saponin
Sebanyak 0,5 g serbuk simplisia ditimbang, dimasukkan ke dalam tabung
reaksi, ditambahkan 10 ml air suling panas, didinginkan, kemudian dikocok
kuat-kuat selama 10 detik. Saponin positif jika terbentuk busa yang stabil tidak kurang
dari 10 menit setinggi 1 sampai 10 cm dan dengan penambahan 1 tetes asam
klorida 2N buih tidak hilang (Depkes RI, 1995).
3.4.2.4 Pemeriksaan Tanin
Sebanyak 0,5 g serbuk simplisia ditimbang, disari dengan 10 ml air suling
32
diambil sebanyak 2 ml dan ditambahkan 1-2 tetes pereaksi besi (III) klorida 1%.
Jika terjadi warna biru atau hijau kehitaman menunjukkan adanya tanin
(Farnsworth, 1966).
3.4.2.5 Pemeriksaan Glikosida
Sebanyak 3 g serbuk simplisia ditimbang, disari dengan 30 ml campuran
dari 7 bagian etanol 95% dengan 3 bagian air suling (7:3). Kemudiaan direfluks
selama 10 menit, didinginkan, lalu disaring. Diambil 20 ml filtrat ditambahkan 25
ml air suling dan 25 ml timbal (II) asetat 0,4 M dikocok, didiamkan 5 menit lalu
disaring. Filtrat disari dengan 20 ml campuran isopropanol dan kloroform (2:3),
perlakuan ini diulangi sebanyak 3 kali. Sari air dikumpulkan dan ditambahkan
Na2SO4 anhidrat, disaring, kemudiaan diuapkan pada temperatur tidak lebih dari
500C, sisanya dilarutkan dalam 2 ml metanol. Larutan sisa digunakan untuk
percobaan berikut, 0,1 ml larutan percobaan dimasukkan dalam tabung reaksi,
kemudian diuapkan di atas penangas air. Pada sisa ditambahkan 2 ml air dan 5
tetes larutan perekasi Molish, lalu ditambahkan dengan perlahan-lahan 2 ml asam
sulfat pekat melalui dinding tabung, terbentuk cincin ungu pada batas kedua
cairan, menunjukkan adanya ikatan gula (glikon) atau glikosida (Depkes RI,
1995).
3.4.2.6Pemeriksaan Steroid/Triterpenoid
Sebanyak 1 g sebuk simplisia ditimbang, dimaserasi dengan 20 ml
n-heksan selama 2 jam, disaring, lalu filtrat diuapkan dalam cawan penguap. Pada
sisa ditambahkan pereaksi Lieberman-Burchard (20 tetes asam asetat anhidrida
33
adanya steroida, sedangkan warna merah, merah muda atau ungu menunjukkan
adanya triterpenoid (Harborne, 1987).
3.4.2.7 Pemeriksaan Glikosida Antrakuinon
Sebanyak 0,2 gram serbuk simplisia dicampur dengan 5 ml asam sulfat
2N, didihkan sebentar, setelah dingin ditambahkan 10 ml benzen, dikocok dan
didiamkan. Lapisan benzen dipisahkan dan disaring. Lapisan benzen kemudian
dikocok dengan 2 ml NaOH 2N dan didiamkan. Lapisan air berwarna merah
menunjukkan adanya glikosida antrakuinon (Depkes RI, 1995).
3.4.3 Pembuatan Ekstrak Etanol Kulit Buah Nanas (EEKBN)
Sebanyak 400 gram serbuk simplisia dimasukkan ke dalam wadah gelas
bewarna gelap, dituangi 75 bagian cairan penyari (etanol 96%), ditutup, dibiarkan
selama 5 hari dan terlindung dari cahaya sambil sering diaduk, lalu disaring.
Ampas dicuci dengan cairan penyari secukupnya hingga diperoleh 100 bagian.
Dibiarkan selama 2 hari, dienap tuangkan atau saring (Ditjen POM, 1979).
Maserat yang diperoleh dipekatkan dengan menggunakan rotary evaporator pada
suhu ±40oC sampai diperoleh ekstrak kental.
3.4.4 Penyiapan Hewan Uji
Mencit dengan berat 20-35 gram dibagi dalam 6 kelompok, setiap
kelompok terdiri dari 5 ekor mencit yang diberi perlakuan berbeda-beda yaitu:
Kelompok I : Mencit normal tanpa perlakuan
Kelompok II : suspensi Na-CMC 0,5% b/v
Kelompok III : suspensi EEKBN dosis 125 mg/kg bb
Kelompok IV : suspensi EEKBN dosis 250 mg/kg bb