PENGAKARAN SETEK BATANG MAWAR MINI
(
Rosa hybrida
L
.)
MENGGUNAKAN KOMBINASI
KONSENTRASI AUKSIN (IBA DAN NAA) YANG BERBEDA
Oleh
ESTER YENTINA
A24061038
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
RINGKASAN
ESTER YENTINA. Pengakaran Setek Batang Mawar Mini (Rosa hybrida L.) Menggunakan Kombinasi Konsentrasi Auksin (IBA dan NAA) yang Berbeda. Dibimbing oleh NURHAJATI ANSORI MATTJIK.
Mawar merupakan salah satu bunga yang paling terkenal di dunia.
Perbanyakan mawar dapat dilakukan melalui biji, setek, dan okulasi. Penampakan
tanaman yang disetek sama dengan induknya dan lebih menarik dibandingkan
dengan yang diokulasi. Pertumbuhan dari akar tanaman yang disetek dapat dipacu
dengan menggunakan hormon pengakaran yaitu auksin.
IBA (indole-3-butyric acid) dan NAA (naphthalene acetic acid)
merupakan dua macam auksin yang paling sering digunakan untuk pembentukan
akar adventif. Penelitian ini bertujuan untuk mengetahui konsentrasi IBA dan
NAA yang tepat dan berpengaruh baik terhadap pengakaran setek batang mawar
mini (Rosa hybrida L.), serta mengetahui interaksi antara keduanya yang juga
akan berpengaruh baik terhadap pengakaran setek batang mawar mini (Rosa
hybrida L.)
Penelitian ini dilaksanakan di Balai Penelitian Tanaman Hias (BALITHI)
Segunung, Kecamatan Pacet, Kabupaten Cianjur, Jawa Barat. Pelaksanaan
penelitian dimulai pada bulan Maret sampai dengan bulan Agustus 2010.
Penelitian ini menggunakan rancangan perlakuan faktorial, disusun dalam
rancangan lingkungan acak lengkap. Faktor pertama adalah IBA (indole-3-butyric
acid) dan faktor kedua adalah NAA (naphthalene acetic acid) masing-masing
dengan lima taraf konsentrasi yaitu 0 ppm, 100 ppm, 200 ppm, 300 ppm dan 400
ppm.
Bahan tanam yang digunakan dalam penelitian ini adalah mawar mini
kultivar Romantica Meilandina yang telah berumur 1 tahun. Bagian yang
digunakan adalah bagian tengah batang sehingga tidak terlalu tua maupun terlalu
muda. Bahan lain yang digunakan adalah IBA (indole-3-butyric acid) dan NAA
(naphthalene acetic acid). Pada awal tanam hingga 4 MST setek ditanam di
dipindahkan ke pot menggunakan media campuran arang sekam, pupuk kandang
kuda, dan pasir malang dengan perbandingan (2:1:1).
Perlakuan perendaman IBA pada konsentrasi 200 ppm mempercepat
waktu munculnya akar dan meningkatkan panjang akar yaitu pada 10.2 hari dan
1.87 cm, dan pada konsentrasi 400 ppm meningkatkan jumlah akar sebesar 11.13.
Perlakuan perendaman NAA pada konsentrasi 100 ppm mempengaruhi persentase
setek hidup sebesar 60%. Interaksi antara IBA dengan NAA terdapat pada peubah
panjang tunas pada kombinasi perlakuan IBA 400 ppm + NAA 100 ppm yaitu
PENGAKARAN SETEK BATANG MAWAR MINI
(
Rosa hybrida
L
.)
MENGGUNAKAN KOMBINASI
KONSENTRASI AUKSIN (IBA DAN NAA) YANG BERBEDA
Skripsi
Sebagai salah satu syarat memperoleh
gelar Sarjana Pertanian pada Fakultas Pertanian
Institut Pertanian Bogor
Oleh :
Ester Yentina
A24061038
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
Judul : PENGAKARAN SETEK BATANG MAWAR MINI (Rosa hybrida L.) MENGGUNAKAN KOMBINASI KONSENTRASI AUKSIN (IBA DAN NAA) YANG BERBEDA
Nama : ESTER YENTINA
NIM : A24061038
Menyetujui,
Dosen Pembimbing
Prof. Dr. Ir. Nurhajati Ansori Mattjik, MS. NIP. 19460807.197301.2.001
Mengetahui,
Ketua Departemen Agronomi dan Hortikultura
Fakultas Pertanian IPB
Dr. Ir. Agus Purwito, MSc.Agr. NIP. 19611101.198703.1.003
RIWAYAT HIDUP
Penulis lahir di Jakarta pada tanggal 3 Oktober 1988 sebagai anak bungsu
dari tiga bersaudara, anak dari pasangan Bapak Edward Butarbutar dan Ibu
Lasminar Gultom.
Riwayat pendidikan penulis dimulai tahun 1994 di SD Negeri 11 Cibubur.
Setelah lulus penulis melanjutkan studi di SLTP Negeri 147 Jakarta hingga tahun
2003. Kemudian penulis melanjutkan studi di SMU Negeri 99 Jakarta hingga
tahun 2006.
Pada tahun 2006 penulis diterima di Institut Pertanian Bogor (IPB)
melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB). Setelah satu tahun
melalui Tingkat Persiapan Bersama (TPB), tahun 2007 penulis diterima di
Departemen Agronomi dan Hortikultura, Fakultas Pertanian.
Selama di IPB penulis aktif mengikuti kegiatan Persekutuan Fakultas (PF)
Pertanian mahasiswa Kristen. Pada tahun 2008 penulis menjadi Bendahara
Persekutuan Fakultas Pertanian hingga tahun 2009. Penulis juga mengikuti
kegiatan magang di Indoflowers Nursery selama satu bulan. Penulis melakukan
penelitian dengan judul Pengakaran Setek Batang Mawar Mini (Rosa hybrida L.)
KATA PENGANTAR
Puji syukur penulis panjatkan ke hadirat Tuhan Yang Maha Esa atas
hikmat, berkat dan anugerahNya sehingga penulis dapat menyelesaikan skripsi
yang berjudul “Pengakaran Setek Batang Mawar Mini (Rosa hybrida L.)
Menggunakan Kombinasi Konsentrasi Auksin (IBA dan NAA) yang Berbeda”. Penelitian didasarkan pada kebutuhan informasi akan kombinasi konsentrasi auksin (IBA dan NAA) yang tepat, yang akan berpengaruh baik
terhadap pengakaran setek batang mawar mini.
Penulis mendapatkan bantuan dari berbagai pihak dalam penulisan skripsi
ini. Penulis menyampaikan ucapan terima kasih kepada:
1. Prof. Dr. Ir. Nurhajati Ansori Mattjik, MS. sebagai dosen pembimbing skripsi
yang telah memberikan bimbingan serta pengarahan sehingga skripsi ini dapat
diselesaikan dengan baik.
2. Dr. Dewi Sukma, SP, MSi dan Dr. Ir. Winarso D. Widodo, MS. sebagai dosen
penguji yang telah memberikan saran untuk perbaikan skripsi ini.
3. Willy B. Suwarno, SP, MSi sebagai pembimbing akademik yang telah
memberikan arahan dan bimbingan akademik.
4. Balai Penelitian Tanaman Hias (BALITHI) yang telah menyediakan tempat
dan bahan penelitian.
5. Ir. Yoyo Sulyo, MS dan Yiyin Nsasihin, SP yang telah memberikan
bimbingan dan bantuan selama penelitian ini berlangsung di BALITHI.
6. Kedua orang tua dan keluarga yang telah memberikan doa, semangat dan
dorongan selama ini.
7. Sadewi, Megaria, Hilaria, Diana, Fiona, Rara, Melisda, Yuli, Gladis, Rosi,
Zeny, Nehemia, Agus, dan semua rekan AGH atas bantuan dan motivasinya.
Semoga karya ilmiah ini berguna bagi semua pihak yang membutuhkan
dan sebagai informasi untuk penelitian selanjutnya.
Bogor, Mei 2011
DAFTAR ISI
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... x
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 3
Hipotesis ... 3
TINJAUAN PUSTAKA ... 4
Taksonomi Mawar ... 4
Kegunaan dan Syarat Tumbuh Mawar ... 5
Setek ... 7
Zat Pengatur Tumbuh ... 9
Auksin ... 10
BAHAN DAN METODE ... 12
Waktu dan Tempat ... 12
Bahan dan Alat ... 12
Metode Penelitian ... 12
Pelaksanaan Penelitian ... 13
Pengamatan ... 14
HASIL DAN PEMBAHASAN ... 16
Keadaan Umum ... 16
Waktu Munculnya Akar ... 19
Jumlah Akar ... 21
Panjang Akar ... 24
Persentase Setek Hidup ... 27
Panjang Tunas ... 30
Jumlah Bunga ... 32
Bobot Basah dan Bobot Kering Akar ... 35
KESIMPULAN DAN SARAN ... 38
DAFTAR TABEL
Nomor Halaman
1. Produksi Tanaman Hias di Indonesia Tahun 2006-2010………… 5
2. Rekapitulasi Sidik Ragam Setek Mawar Mini (Rosa hybrida L.) pada Berbagai Peubah Pengamatan……….
18
3. Waktu Munculnya Akar pada Berbagai Perlakuan Perendaman
IBA………...
20
4. Jumlah Akar pada Berbagai Perlakuan Perendaman IBA……….. 22
5. Panjang Akar pada Berbagai Perlakuan Perendaman IBA…... 25
6. Persentase Setek Hidup pada Berbagai Perlakuan Perendaman
NAA………....
27
7. Interaksi Kombinasi Konsentrasi IBA dan NAA terhadap
Panjang Tunas……….
DAFTAR GAMBAR
Nomor Halaman
1. Setek Mawar Mini di Lokasi Penelitian Umur 2 MST (a); Setek Mawar Mini Umur 17 MST (b)………..
16
2. Pengaruh Konsentrasi IBA terhadap Waktu Munculnya Akar…... 19
3. Waktu Munculnya Akar pada berbagai Perlakuan Perendaman
NAA………
20
4. Dasar Setek Mawar saat Masih dalam Bentuk Kalus (1 MST) (a); Akar Mawar Mini yang Sudah Terbentuk (2 MST) (b)…………..
21
5. Pengaruh Konsentrasi IBA terhadap Jumlah Akar………. 22
6. Jumlah Akar pada Berbagai Perlakuan Perendaman NAA…... 23
7. Pengaruh Konsentrasi IBA terhadap Panjang Akar…………... 24
8. Panjang Akar pada Berbagai Perlakuan Perendaman NAA……... 26
9. Persentase Setek Hidup pada Berbagai Perlakuan Perendaman
IBA………..
28
10. Alat Sensor pada Irigasi Penyemprotan (a); Setek Umur 1 MST yang disemprot dengan Irigasi Penyemprotan (b)………..
29
11. Panjang Tunas pada Berbagai Perlakuan Perendaman IBA pada 5 MST (Minggu Setelah Tanam)………
31
12. Panjang Tunas pada Berbagai Perlakuan Perendaman NAA pada 5 MST (Minggu Setelah Tanam)………
31
13. Pertumbuhan Tunas pada 8 MST (a); Pertumbuhan Tunas pada
9 MST (b)………
32
14. Mawar Mini pada saat Berumur 12 Minggu Setelah Tanam
(MST)………..
33
15. Jumlah Bunga pada Berbagai Perlakuan Perendaman IBA……… 33
16. Jumlah Bunga pada Berbagai Perlakuan Perendaman NAA…….. 34
18. Bobot Basah Akar pada Berbagai Perlakuan Perendaman NAA… 36
19. Bobot Kering Akar pada Berbagai Perlakuan Perendaman IBA… 36
PENDAHULUAN
Latar Belakang
Mawar merupakan salah satu bunga yang paling terkenal di dunia.
Berdasarkan data Badan Pusat Statistik (BPS) jumlah produksi mawar terus
mengalami peningkatan dari tahun 2008 hingga tahun 2010. Pada tahun 2010
jumlah produksi mawar menduduki peringkat kedua setelah krisan, yaitu
120 485 784 tangkai. Peningkatan produksi tersebut merupakan dampak dari
peningkatan permintaan konsumen terhadap mawar. Meningkatnya permintaan
tanaman hias di dalam negeri disebabkan oleh semakin meningkatnya
kesejahteraan dan tanggapan masyarakat terhadap kenyamanan dan keindahan
lingkungan (Ashari, 1995).
Menurut Dole dan Wilkins (2005) mawar dimanfaatkan sebagai bunga
potong, tanaman hias pot atau tanaman lanskap. Mawar yang dimanfaatkan
sebagai tanaman hias dalam pot adalah mawar mini. Mawar mini termasuk
kelompok polyantha. Mattjik (2009) menyatakan bahwa polyantha merupakan
tanaman semak pendek (50-60 cm), memiliki ciri menghasilkan bunga
terus-menerus, bunganya bergerombol dengan ukuran kecil, diameter bunga ± 5 cm,
daun bunga kelipatan 5, dan warna bunga biasanya merah, kuning, putih, merah
jambu, salmon, dan orange.
Mawar mini dapat tumbuh tanpa bergantung pada musim. Keunggulan
yang dimiliki mawar mini bila dibandingkan dengan mawar potong, yaitu dapat
disimpan dalam waktu relatif lama di dalam ruangan, tetapi harus mendapatkan
cahaya. Selain itu, mawar mini dapat ditempatkan di dalam ruangan sebagai
tanaman utuh dalam pot, sehingga akan memberikan suasana yang segar dan
romantis (Handayati dan Effendie, 2003).
Perbanyakan mawar mini dapat dilakukan melalui biji, setek, dan okulasi.
Perbanyakan melalui biji membutuhkan waktu yang sangat lama dan biasanya
dilakukan hanya untuk kegiatan pemuliaan dengan maksud mendapatkan suatu
varietas mawar baru yang memiliki sifat unggul tertentu. Konemann (2004)
membutuhkan perlakuan stratifikasi selama 8-12 minggu sebelum ditanam. Dole
dan Wilkins (2005) menambahkan bahwa biji hanya digunakan untuk kegiatan
pemuliaan atau proyek genetik.
Perbanyakan dengan okulasi membutuhkan keahlian khusus yang hanya
dapat dilakukan oleh orang yang sudah terampil. Keterbatasan sistem okulasi
yaitu membutuhkan batang bawah yang tepat untuk menunjang pertumbuhan
selanjutnya, serta bibit yang dihasilkan dalam kurun waktu tertentu terbatas
jumlahnya (Hasek, 1980). Perbanyakan dengan setek dilakukan jika ingin
memperoleh tanaman yang sama dengan induknya, tanpa memerlukan suatu
keahlian khusus. Penampakan mawar pot yang berasal dari setek lebih menarik
jika dibandingkan dengan hasil okulasi.
Setek merupakan proses perbanyakan tanaman menggunakan bagian
vegetatif dan ketika ditempatkan pada kondisi yang sesuai akan berkembang
menjadi tanaman sempurna. Kecepatan pembentukkan akar pada tanaman
dipengaruhi oleh kedewasaan jaringan tanaman yang disetek. Jika bahan tanam
terlalu muda dan lunak, akan lebih mudah mengalami transpirasi dan tidak tahan
kebusukan, sedangkan jika bahan tanam terlalu tua, maka diperlukan waktu yang
lama untuk pengakaran (Adriance dan Brisco, 1979). Dole dan Wilkins (2005)
menambahkan bahwa pengakaran akan lambat dan perbanyakan akan tertunda
jika bahan tanam untuk setek terlalu tua.
Pertumbuhan dari akar tanaman yang disetek dapat dipacu dengan
hormon pengakaran. Zat pengatur tumbuh (ZPT) yang berfungsi untuk memacu
pertumbuhan akar adalah auksin. Kegunaan dari hormon pengakaran yaitu secara
keseluruhan meningkatkan persentase pengakaran, mempercepat inisiasi
pengakaran, meningkatkan jumlah dan kualitas dari akar, dan mendorong
pengakaran yang seragam (Macdonald, 2002).
Indole-3-acetic acid (IAA) merupakan satu-satunya auksin aktif yang
ditemukan pada tanaman saat ini (Arteca, 2006). Namun, IAA tidak digunakan
secara komersial, yang digunakan secara komersial adalah auksin sintetik, yaitu
NAA dan IBA (Duane, 2003). Arteca (2006) menambahkan bahwa IBA
yang paling sering digunakan untuk pembentukan akar adventif. Dalam penelitian
ini digunakan IBA dan NAA terhadap pengakaran setek batang mawar mini.
Tujuan
1. Mengetahui konsentrasi IBA yang tepat dan berpengaruh baik terhadap
pengakaran setek batang mawar mini (Rosa hybrida L.).
2. Mengetahui konsentrasi NAA yang tepat dan berpengaruh baik terhadap
pengakaran setek batang mawar mini (Rosa hybrida L.).
3. Mengetahui interaksi antara IBA dan NAA yang berpengaruh baik terhadap
pengakaran setek batang mawar mini (Rosa hybrida L.).
Hipotesis
1. Terdapat konsentrasi yang tepat dari IBA yang berpengaruh baik terhadap
pengakaran setek batang mawar mini (Rosa hybrida L.).
2. Terdapat konsentrasi yang tepat dari NAA yang berpengaruh baik terhadap
pengakaran setek batang mawar mini (Rosa hybrida L.).
3. Terdapat interaksi antara IBA dan NAA yang berpengaruh baik terhadap
TINJAUAN PUSTAKA
Taksonomi Mawar
Mawar berasal dari dataran Cina, Timur Tengah dan Eropa Timur. Dalam
perkembangannya, menyebar luas di daerah-daerah beriklim dingin (sub-tropis)
dan panas (tropis) (Diamond, 1990). Terdapat ribuan varietas dari mawar,
masing-masing memiliki aroma yang berbeda-beda, jumlah petal yang berbeda, begitu
juga warna dan nama yang berbeda.
Dalam sistematika tumbuhan (taksonomi), mawar diklasifikasikan sebagai
berikut:
Kingdom : Plantae
Divisi : Spermatophyta
Sub-Divisi : Angiospermae
Kelas : Dicotyledonae
Ordo : Rosanales
Famili : Rosaceae
Genus : Rosa
Mawar termasuk tanaman tahunan (perennial) yang mempunyai struktur
batang berkayu keras, berduri, bercabang banyak, menghasilkan bunga dan biji
terus-menerus (Rukmana, 1995). Selama siklus hidupnya, tanaman mawar terus
tumbuh seolah-olah tidak terbatas dan masa produksinya berulang-ulang.
Mawar berdasarkan cara tumbuhnya dibedakan menjadi dua, yaitu
merambat dan semak. Tipe pertumbuhan semak dibagi dalam tiga kelompok yaitu
polyantha, floribunda dan hybrid tea (Dole dan Wilkins, 2005). Mawar mini
termasuk dalam kelompok polyantha.
Widyawan dan Prahastuti (1994) menyatakan bahwa Polyantha
merupakan jenis mawar taman yang sangat beraneka ragam, bunganya kecil
dengan garis tengah sekitar 5 cm dan di dekat pucuk cabangnya terdapat banyak
ranting yang masing-masing memiliki sekuntum bunga. Mattjik (2009)
menambahkan bahwa Polyantha merupakan tanaman semak pendek (50-60 cm),
ukuran kecil, diameter bunga ± 5 cm, daun bunga kelipatan 5 dan warna bunga
biasanya merah, kuning, putih, merah jambu, salmon dan orange.
Meskipun mawar memiliki sangat banyak jenis yang berbeda-beda, namun
hanya sedikit yang dapat dijadikan tanaman pot. Polyantha sejauh ini merupakan
kelompok yang paling baik untuk dijadikan tanaman pot berdasarkan ukuran
tanaman, bentuk dan tampilan bunganya (Hammer, 1992).
Kegunaan dan Syarat Tumbuh Mawar
Mawar merupakan salah satu tanaman hias bunga yang paling terkenal di
dunia (Dole dan Wilkins, 2005). Permintaan tanaman hias mengalami
peningkatan dari tahun ke tahun. Meningkatnya permintaan tanaman hias di
dalam negeri disebabkan oleh semakin meningkatnya kesejahteraan dan
tanggapan masyarakat terhadap kenyamanan dan keindahan lingkungan (Ashari,
1995).
Tabel 1. Produksi Tanaman Hias di Indonesia Tahun 2006-2010
Tanaman Tahun (Tangkai)
2006 2007 2008 2009 2010
Krisan 63 716 256 66 979 260 99 158 942 107 847 072 120 485 784 Mawar 40 394 027 59 492 699 39 131 603 60 191 362 82 643 413 Sedap malam 30 373 679 21 687 493 25 180 043 51 047 807 59 340 715 Anggrek 10 703 444 9 484 393 15 430 040 16 205 949 16 897 181
Sumber: www.bps.go.id
Berdasarkan data Badan Pusat Statistik (BPS) jumlah produksi mawar
terus mengalami peningkatan dari tahun 2008 hingga tahun 2010. Pada tahun
2010 jumlah produksi mawar menduduki peringkat kedua setelah krisan, yaitu
120 485 784 tangkai. Peningkatan produksi tersebut merupakan dampak dari
peningkatan permintaan konsumen terhadap tanaman mawar.
Widyawan dan Prahastuti (1994) menyatakan bahwa mawar termasuk
bunga yang paling disenangi di seluruh dunia dan sering dipakai sebagai lambang
keindahan, ketenangan, kedamaian, dan pemujaan juga dapat dimanfaatkan
sebagai bunga potong dan tanaman hias, serta sebagai bunga tabur dan bahan
industri kosmetika atau pewangi makanan. Dole dan Wilkins (2005)
tanaman hias dalam pot atau tanaman bedengan. Bunga merupakan hasil utama
tanaman mawar. Gardner et al. (1985) menyatakan bahwa proses pembungaan
sangat dikendalikan oleh lingkungan terutama fotoperiode, suhu dan faktor
genetik terutama pengatur tumbuhan, hasil fotosintesa dan pasokan hara.
Tanaman mawar dapat tumbuh dari dataran rendah hingga dataran tinggi
di daerah tropis (Mattjik, N. A., 2009). Tanaman mawar yang dibudidayakan di
daerah yang beriklim sejuk (dataran tinggi) warna bunganya lebih cerah dengan
ukuran bunga yang lebih besar (Ashari, 1995). Mawar dapat ditanam di lapang
maupun di rumah kaca. Cahaya, suhu dan karbon dioksida merupakan faktor yang
perlu diperhatikan untuk mawar yang ditanam di rumah kaca. Karena cahaya,
suhu dan karbon dioksida merupakan faktor yang mempengaruhi pertumbuhan
dan perkembangan mawar yang tumbuh di dalam rumah kaca (Dole dan Wilkins,
2005).
Mattjik (2009) menyatakan bahwa tanaman mawar merupakan tanaman
terbuka (full sun), membutuhkan intensitas cahaya sampai 3000 fc, dengan lama
penyinaran 12 jam untuk daerah tropis. Cahyono (1990) menyatakan bahwa
tanaman mawar membutuhkan cahaya/penyinaran matahari penuh sepanjang hari,
karena bila tempatnya terlindung akan mudah terserang cendawan dan
pertumbuhannya kurang baik. Bila ditanam di rumah kaca intesitas cahaya yang
dibutuhkan antara 300-1000 fc (60-200 µmol m-2 s-1) (Dole dan Wilkins, 2005).
Mawar mini dapat tumbuh dengan baik pada suhu 18-24 °C, suhu yang baik untuk
pengakaran mawar yaitu 23-24 0C dan umumnya memerlukan karbon dioksida
700-1000 ppm (Dole dan Wilkins, 2005). Kelembaban udara yang baik untuk
tanaman mawar sekitar 60-75%.
Beberapa penyakit yang menjadi masalah bagi tanaman mawar adalah
bercak daun cendawan (Fungus leaf spot), Embun tepung (powdery mildew),
karat (Rust), dan tumor atau puru (Crown gall) (Mattjik, N. A., 2009). Sanitasi
dan pengendalian lingkungan merupakan hal yang mutlak diperlukan pada
Setek
Tanaman dapat diperbanyak secara seksual dengan biji, atau secara
aseksual dengan setek, sambung, okulasi atau dengan cara vegetatif lain (Alam
dan Chong, 2006). Pada tanaman mawar perbanyakan dengan biji membutuhkan
waktu yang relatif lama dan biasanya dilakukan hanya untuk kegiatan pemuliaan.
Konemann (2004) menyatakan bahwa untuk dapat berkecambah dengan baik,
benih mawar membutuhkan perlakuan stratifikasi selama 8-12 minggu sebelum
ditanam. Dole dan Wilkins (2005) menambahkan bahwa biji hanya digunakan
untuk kegiatan pemuliaan atau proyek genetik.
Perbanyakan dengan okulasi membutuhkan keahlian khusus yang hanya
dapat dilakukan oleh orang yang sudah terampil. Keterbatasan sistem okulasi
yaitu membutuhkan batang bawah yang tepat untuk menunjang pertumbuhan
selanjutnya, serta bibit yang dihasilkan dalam kurun waktu tertentu terbatas
jumlahnya (Hasek, 1980). Perbanyakan dengan setek dilakukan jika ingin
memperoleh tanaman yang sama dengan induk, dengan waktu yang lebih singkat
dan tidak memerlukan suatu keahlian khusus.
Setek merupakan proses perbanyakan tanaman menggunakan bagian
vegetatif dan ketika ditempatkan pada kondisi yang sesuai akan berkembang
menjadi tanaman sempurna (Adriance dan Brisco, 1979). Setek terbagi atas setek
akar, batang dan daun. Setek batang terdiri dari hardwood, semi hardwood,
softwood, dan herbaceous setek. Perbanyakan dengan setek digunakan secara luas
untuk tujuan komersial pada banyak industri bunga, industri tanaman hias daun,
dan untuk perbanyakan spesies buah tertentu.
Perbanyakan dengan setek merupakan merupakan salah satu cara
perbanyakan yang penting untuk regenerasi klon dari banyak tanaman hortikultura
termasuk di dalamnya buah, bunga dan tanaman hias (Hartmann, 1990).
Faktor-faktor yang mempengaruhi pertumbuhan setek adalah kondisi fisiologis tanaman
induk (stock plant), umur tanaman induk, jenis bahan setek, waktu pengambilan
setek, zat pengatur tumbuh (ZPT), adanya tunas dan daun, umur bahan setek, dan
kondisi lingkungan (Dawson dan King, 1994).
Adriance dan Brisco (1979) menyatakan bahwa terdapat hubungan antara
setek terlalu lunak dan muda, lebih mudah mengalami transpirasi dan tidak tahan
kebusukan dan jika jaringan terlalu tua diperlukan waktu yang lama untuk
pengakaran. Dole dan Wilkins (2005) menambahkan bahwa pengakaran akan
lambat dan perbanyakan akan tertunda jika setek terlalu tua.
Pembentukan akar adventif terdiri dari beberapa tahap, yaitu inisiasi
sel-sel meristematik, diferensiasi sel-sel meristematik tersebut menjadi akar
primordia, serta pertumbuhan dan perkembangan akar baru (Hartmann, 1990).
Pada masa pengakaran lingkungan tumbuh diusahakan untuk tetap terjaga
kelembabannya. Seringkali munculnya akar didahului oleh pembentukan kalus,
akan tetapi adanya kalus tak merupakan tanda bahwa setek dapat menghasilkan
akar (Hartman, 1990). Kalus adalah kumpulan sel parenkim yang bentuknya tidak
beraturan dalam tahap lignifikasi yang bervariasi. Pembentukan kalus dan
pembentukan akar tersendiri satu dengan lain, meskipun keduanya berhubungan
dengan pembelahan sel (Hartman, 1990).
Lakitan (1996) menambahkan bahwa pembentukan akar adventif dapat
timbul dari dua sumber: 1) jaringan kalus (wounded root). Akar yang keluar dari
jaringan kalus akan lebih kuat dan lebih baik daripada akar yang keluar dari setek
yang tidak berkalus. 2) bakal akar (morfologi atau akar primordial). Akar primer
dari kalus muncul di daerah kambium vaskular (Febrijanti, 1999).
Akar merupakan bagian tumbuhan yang biasanya tertanam di dalam tanah
sebagai penegak dan penyerap air dan hara. Fungsi dari akar adalah menyerap
unsur hara dan air yang diperlukan dalam metabolisme tanaman (Sitompul &
Guritno, 1995). Menurut Schuurman dan Goedewaagen (1971) bahwa jumlah
akar menunjukkan kemampuan dalam melakukan penyerapan unsur hara.
Tanaman dengan jumlah akar yang banyak akan meningkatkan penyerapan unsur
hara dan air yang dapat mendukung pertumbuhan dari tanaman pula.
Hartmann et al., (1997) menambahkan bahwa akar sebagai organ tumbuh
geotrofik, selain berfungsi sebagai penegak batang, juga berperan sebagai organ
penghisap hara dalam mendukung laju pertumbuhan. Perakaran yang baik akan
mampu menopang pertumbuhan dari tanaman.
Panjang akar menunjukkan batas kemampuan tanaman untuk menjangkau
memungkinkan setek untuk menyerap unsur hara, mineral dan air lebih banyak
daripada akar yang pendek (Schuurman dan Goedewagen, 1971). Semakin
bertambah panjang akar maka tanaman akan lebih kokoh dan air serta
garam-garam mineral di dalam media tumbuh akan mudah diserap untuk disalurkan ke
batang dan daun (Darliah, et al., 1994).
Suhu dan kelembaban merupakan hal yang penting dalam pengakaran.
Salah satu hal yang dapat menjaga kelembaban tanaman adalah dengan
memberikan irigasi yang teratur. Irigasi semprot dan pengkabutan
menyemprotkan air langsung ke setek untuk mengurangi transpirasi dan menjaga
turgiditas setek sehingga memungkinkan perkembangan akar (Dole dan Wilkins,
2005).
Penyemprotan pada siang hari dapat menyebakan kelembaban yang
berlebihan, sehingga dapat menghambat pengakaran dan memacu perkembangan
pathogen (Dole dan Wilkins, 2005). Sanitasi dan pengendalian lingkungan
merupakan pencegahan terhadap perkembangan pathogen yang menyebabkan
penyakit. Penyakit harus dikendalikan pada semua tahap pertumbuhan.
Selanjutnya, karena setek diambil dari tanaman produksi, penyakit seringkali ikut
terbawa ke keturunan berikutnya (Dole dan Wilkins, 2005).
Zat Pengatur Tumbuh
Zat pengatur tumbuh (ZPT) adalah senyawa organik bukan nutrisi yang
dalam konsentrasi rendah (< 1 µM) dapat mendorong, menghambat atau secara
kualitatif mengubah pertumbuhan dan perkembangan (Wattimena, 1988). Ahli
biologi tumbuhan telah mengidentifikasi 5 tipe utama zat pengatur tumbuh yaitu
auksin, sitokinin, giberelin, asam absisat, dan etilen.
Menurut Weaver (1972) terdapat 3 cara aplikasi zat pengatur tumbuh yang
sering digunakan yaitu: (1) commercial powder preparation (pasta), (2) dilute
solution soaking method (perendaman), dan (3) concentrated solution dip method
(pencelupan cepat). Pemakaian zat pengatur tumbuh pada setek dapat
menstimulasi akar, meningkatkan presentase pengakaran dan memberikan
keseragaman waktu perakaran. Auksin merupakan zat pengatur tumbuh yang
Zat pengatur tumbuh yang paling baik untuk merangsang akar adalah IBA
dan NAA (Weaver, 1972). IBA memiliki aktivitas auksin yang lemah, zat kimia
bersifat stabil dan tetap berada pada daerah pemberian perlakuan, translokasinya
lemah berlangsung lebih lambat sehingga bahan aktifnya akan tertahan di dekat
tempat aplikasinya dan NAA memiliki sifat lebih beracun dari IBA dengan
penggunaan konsentrasi yang tinggi harus dihindari karena dapat menyebabkan
pelukaan pada tanaman (Weaver, 1972).
Auksin
Auksin merupakan kelas hormon tumbuhan yang pertama kali ditemukan,
awalnya diketemukan pada urine manusia. Istilah auksin berasal dari bahasa
Yunani auxein yang berarti tumbuh (Arteca, 2006). Sintesis auksin terjadi di daun,
diangkut melalui sel, pergerakannya sampai ke batang. Pengangkutan dari batang
ke akar mungkin juga melalui jaringan floem (Zong, et al., 2008).
Auksin adalah satu-satunya kelas hormon tumbuhan yang mempengaruhi
pengakaran dan digunakan secara komersial untuk menstimulasi pengakaran
adventif (Arteca, 2006). Zong et al. (2008) menambahkan bahwa peran utama
auksin pada perbanyakan tanaman adalah menstimulasi akar pada setek batang
dan daun dan meningkatkan cabang akar. Kegunaan dari hormon pengakaran
yaitu secara keseluruhan meningkatkan persentase pengakaran, mempercepat
inisiasi pengakaran, meningkatkan jumlah dan kualitas dari akar, dan mendorong
pengakaran yang seragam (Macdonald, 2002).
Auksin yang secara alami ada dalam tubuh tumbuhan adalah
Indole-3-Acetic Acid (IAA), namun IAA tidak digunakan secara komersil (Arteca, 2006).
Zong et al. (2008) menyatakan bahwa semenjak diketahui bahwa IAA cepat rusak
dengan cahaya dan mikroorganisme, IAA tidak digunakan lagi secara luas dalam
perbanyakan tanaman.
Arteca (2006) menyatakan bahwa IBA (indole-3-butyric acid) dan NAA
(naphthalene acetic acid) merupakan dua macam auksin yang paling sering
digunakan untuk pembentukan akar adventif. NAA memiliki sifat yang lebih
tahan, tidak terdegradasi dan lebih murah. Menurut Zaer dan Mapes (1985), NAA
Zong et al. (2008) menambahkan bahwa IBA dan NAA lebih tahan terhadap
degradasi mikroba dan tanaman, IBA dan NAA terlihat lebih baik dan efektif
lebih lama daripada IAA dan oleh karena itu digunakan secara lebih luas pada
industri hortikultura untuk perbanyakan tanaman.
Auksin pada konsentrasi rendah akan memacu pertumbuhan akar adventif
sedangkan pada konsentrasi tinggi mendorong terbentuknya kalus (Pierik, 1987).
Zong et al. (2008) menambahkan bahwa meskipun dibutuhkan dan berguna untuk
menginduksi akar primordial, auksin pada konsentrasi yang tinggi seringkali
menghambat pertumbuhan akar primordial dan pemanjangan akar pada setek
batang dan mikrosetek.
Arteca (2006) menyatakan bahwa auksin terlibat dalam banyak proses
fisiologi tanaman seperti menginduksi pemanjangan sel, fototropisme,
gravitropisme, dominansi apikal, inisiasi akar, produksi etilen, perkembangan
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilaksanakan di Balai Penelitian Tanaman Hias (BALITHI)
Segunung, Kecamatan Pacet, Kabupaten Cianjur, Jawa Barat dengan ketinggian
1100 m di atas permukaan laut. Penelitian dilaksanakan pada bulan Maret sampai
dengan bulan Agustus 2010.
Bahan dan Alat
Bahan tanaman yang digunakan dalam penelitian ini adalah mawar mini
kultivar Romantica meilandina yang telah berumur 1 tahun. Bahan lain yang
digunakan adalah IBA (indole-3-butyric acid) dan NAA (naphthalene acetic acid),
aquades, arang sekam, pupuk kandang kuda, pasir malang, pupuk urea (25:7:7 &
16:16:16), Gandasil-B dan pestisida. Alat yang digunakan adalah pisau setek,
cutter, irigasi semprot, timbangan digital, oven, timer, dan penggaris.
Metode Penelitian
Penelitian ini menggunakan rancangan perlakuan faktorial, disusun dalam
rancangan lingkungan acak lengkap. Faktor pertama adalah IBA (indole-3-butyric
acid) dan faktor kedua adalah NAA (naphthalene acetic acid) masing-masing
dengan lima taraf konsentrasi yaitu 0 ppm, 100 ppm, 200 ppm, 300 ppm dan 400
ppm. Terdapat 25 kombinasi perlakuan dengan 3 ulangan, sehingga terdapat 75
satuan percobaan. Pada setiap satuan percobaan terdapat 10 batang setek,
sehingga terdapat 750 batang setek.
Model linier aditif yang digunakan:
Yijk = µ + i + βj + ()ij + ijk Keterangan :
Yijk = Nilai pengamatan pengaruh konsentrasi IBA ke-i, konsentrasi NAA
ke-j, dan ulangan ke-k
i = Pengaruh konsentrasi IBA ke-i, {i = 1, 2,…,25}
βj = Pengaruh konsentrasi NAA ke-j, {j = 1, 2,…,25}
()ij = Pengaruh interaksi konsentrasi IBA ke-i, dengan konsentrasi NAA ke-j ijk = Pengaruh galat percobaan konsentrasi IBA ke-i, konsentrasi NAA ke-j
dan ulangan ke-k
Data yang diperoleh diuji dengan uji F. Perlakuan yang berpengaruh nyata
diuji lanjut dengan DMRT (Duncan Multiple Range Test) pada taraf 5 %.
Pelaksanaan Penelitian
Penelitian dilaksanakan di dalam rumah kaca dan dilakukan dalam
beberapa tahap, yaitu:
1. Persiapan
Kegiatan yang dilakukan meliputi persiapan bahan tanam, bak pengakaran
dan rumah kaca. Bahan tanam yang digunakan sehat, tidak terlalu tua atau
pun terlalu muda, yang berumur sekitar 1 tahun. Bak pengakaran
dipetak-petakan sesuai dengan kebutuhan jumlah perlakuan, merendam sekam
dengan fungisida kemudian mengisi bak pengakaran dengan sekam untuk
menghindari serangan cendawan. Rumah kaca dibersihkan untuk
mendukung pertumbuhan dari setek.
2. Pengambilan setek batang
Potong bahan tanam dengan pisau setek, pemotongan setek dilakukan
miring sebesar 450. Hal tersebut dilakukan untuk memperluas bidang
setek. Setiap satu setek terdiri dari 2 buku dan 1 daun. Setek diambil dari
bagian tengah batang. Sebelum diberi perlakuan, setek direndam di dalam
ember yang berisi air untuk menghindari transpirasi yang berlebihan.
3. Pembuatan larutan perlakuan (IBA dan NAA)
Larutan auksin diperoleh melalui mengencerkan IBA dan NAA dengan
4. Perlakuan auksin
Pada setiap perlakuan, setek direndam dengan IBA atau NAA selama 15
menit. Setelah pengaplikasian tanam setek pada bak pengakaran sedalam 3
cm.
5. Pemindahan ke pot
Saat setek berumur 4 minggu, dilakukan pemindahan ke pot. Media yang
digunakan adalah arang sekam, pasir malang dan kotoran kuda dengan
perbandingan (2:1:1).
6. Pemeliharaan
Setek yang telah ditanam untuk irigasinya menggunakan irigasi semprot
otomatis. Pemupukkan dilakukan setelah pemindahan setek ke pot, dengan
dosis 1 gr/l, setiap pot memperoleh 300 ml setiap aplikasi. Pemupukan
NPK mutiara (25:7:7) dilakukan 2 minggu sekali saat 4–8 MST, kemudian tanaman diberikan pupuk NPK mutiara (16:16:16) seminggu sekali pada
9-10 MST. Pada saat tanaman mulai memasuki fase generatif dan tanaman
dipupuk dengan gandasil-B pada 11-19 MST setiap minggunya untuk
mendukung fase generatif dari tanaman.
Pengamatan
Pengamatan dilakukan dengan berbagai peubah, antara lain :
1. Waktu munculnya akar
Pengamatan dilakukan setiap hari setelah 7 HST, untuk mengetahui waktu
munculnya akar pertama kali.
2. Jumlah akar
Pengamatan dilakukan pada 2-4 MST, pada akar yang telah memiliki
panjang minimal 2 mm, dihitung hanya jumlah akar utama.
3. Panjang akar
Pengamatan dilakukan pada 2-4 MST, pada akar yang telah memiliki
panjang minimal 2 mm, diukur dari pangkal setek hingga akar terpanjang.
4. Persentase setek hidup
Pengamatan dilakukan pada 2 MST dan 5 MST
Pengamatan dilakukan pada 5-13 MST, diukur dari pangkal tunas hingga
ujung tunas.
6. Jumlah bunga
Pengamatan dilakukan pada 7-20 MST, merupakan akumulasi jumlah
bunga selama 13 minggu pengamatan.
7. Bobot basah akar
Pengamatan dilakukan pada 21 MST, merupakan bobot keseluruhan akar
setiap setek.
8. Bobot kering akar
Pengamatan dilakukan pada 21 MST, diperoleh dengan pengovenan akar
pada suhu 70 °C, selama 48 jam.
Pengamatan waktu munculnya akar, jumlah akar dan panjang akar bersifat
dekstruktif. Setek yang telah diamati tidak digunakan lagi sebagai bahan
HASIL DAN PEMBAHASAN
Keadaan Umum
Penelitian dilaksanakan di lokasi dengan ketinggian 1100 m di atas
permukaan laut. Suhu di dalam rumah kaca berkisar antara 12-37 0C dengan
kelembaban 39.5-96%. Perbedaan suhu maupun kelembaban pada siang hari
dengan malam hari cukup signifikan. Namun, perbedaan tersebut tidak
mempengaruhi pertumbuhan dari tanaman mawar mini karena mawar mini dapat
tumbuh di dataran rendah maupun di dataran tinggi dengan perbedaan suhu yang
memang signifikan.
Tanaman mawar merupakan tanaman yang mudah diperbanyak dengan
setek. Daya tumbuh mawar yang disetek pada minggu kedua dan kelima
percobaan mencapai 70% dan 60%. Tanaman mawar mulai mengeluarkan akar
pada minggu pertama setelah setek, mengeluarkan tunas pada minggu kedua dan
menghasilkan bunga pada minggu ketujuh.
(a) (b)
Gambar 1. Setek Mawar Mini di Lokasi Penelitian Umur 2 MST (a); Setek Mawar Mini Umur 17 MST (b).
Penelitian dilakukan di dalam rumah kaca. Meskipun demikian, tanaman
tidak terhindar dari serangan hama maupun penyakit. Hal tersebut karena di dalam
rumah kaca juga terdapat induk dari setek dan tanaman mawar mini lain yang
berbeda kultivar. Hama maupun penyakit yang terdapat pada tanaman induk dapat
dengan mudah menyerang. Hama yang menyerang adalah kutu daun, tungau,
Pada saat pertengahan penelitian curah hujan cukup tinggi dan suasana di
dalam rumah kaca pun cukup lembab. Hal tersebut mengakibatkan tanaman
mawar terserang penyakit embun tepung yang disebabkan oleh cendawan
Oidium sp. Penyebaran penyakit tersebut relatif sangat cepat yang menyebabkan
rontoknya tunas-tunas muda, bahkan menimbulkan kematian setek. Pada beberapa
perlakuan yang seluruh seteknya mati dilakukan penyulaman, begitu juga pada
perlakuan-perlakuan yang jumlah seteknya tidak cukup untuk memenuhi
pengamatan selanjutnya. Penyulaman dilakukan pada minggu ketiga setelah
tanam.
Pupuk yang diberikan selama kegiatan pemeliharaan adalah pupuk NPK
mutiara (25:7:7), dilanjutkan dengan NPK mutiara (16:16:16) dan pupuk
gandasil-B pada saat tanaman sudah berbunga. Hal tersebut dilakukan untuk mendukung
setiap fase pertumbuhan dari tanaman.
Pada saat tanaman berumur 4 minggu setelah tanam (MST), tanaman
dipindahkan ke pot. Media yang digunakan adalah arang sekam, kotoran kuda dan
pasir malang (2:1:1). Setelah tanaman dipindahkan ke pot pertumbuhan tanaman
Peubah yang diamati selama penelitian berlangsung yaitu waktu
munculnya akar, jumlah akar, panjang akar, persentase setek hidup, panjang
tunas, jumlah bunga, bobot kering akar dan bobot basah akar. Seluruh data yang
diperoleh diuji dengan F-Hitung.
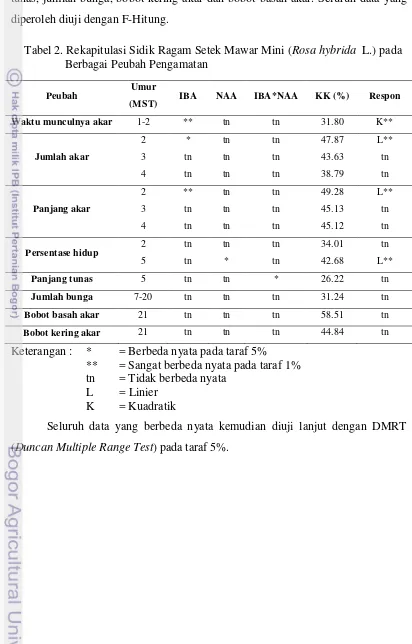
Tabel 2. Rekapitulasi Sidik Ragam Setek Mawar Mini (Rosa hybrida L.) pada Berbagai Peubah Pengamatan
Peubah Umur
(MST) IBA NAA IBA*NAA KK (%) Respon
Waktu munculnya akar 1-2 ** tn tn 31.80 K**
Jumlah akar
2 * tn tn 47.87 L**
3 tn tn tn 43.63 tn
4 tn tn tn 38.79 tn
Panjang akar
2 ** tn tn 49.28 L**
3 tn tn tn 45.13 tn
4 tn tn tn 45.12 tn
Persentase hidup 2 tn tn tn 34.01 tn
5 tn * tn 42.68 L**
Panjang tunas 5 tn tn * 26.22 tn
Jumlah bunga 7-20 tn tn tn 31.24 tn
Bobot basah akar 21 tn tn tn 58.51 tn
Bobot kering akar 21 tn tn tn 44.84 tn
Keterangan : * = Berbeda nyata pada taraf 5%
** = Sangat berbeda nyata pada taraf 1% tn = Tidak berbeda nyata
L = Linier K = Kuadratik
Seluruh data yang berbeda nyata kemudian diuji lanjut dengan DMRT
Waktu Munculnya Akar
Pengamatan waktu munculnya akar dilakukan setiap hari setelah 7 hari
setelah tanam (HST), selama 8 hari dan pada saat tersebut setek dari semua
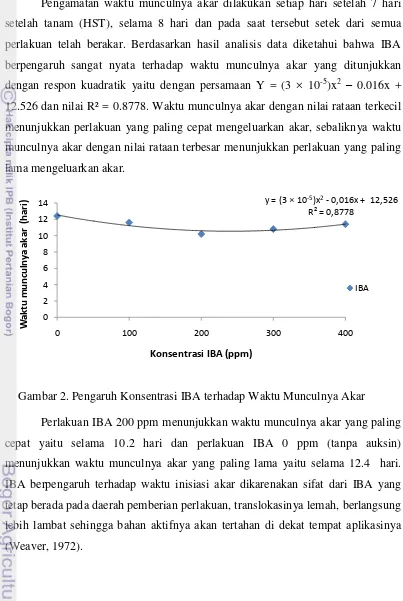
perlakuan telah berakar. Berdasarkan hasil analisis data diketahui bahwa IBA
berpengaruh sangat nyata terhadap waktu munculnya akar yang ditunjukkan
dengan respon kuadratik yaitu dengan persamaan Y = (3 × 10-5)x2 – 0.016x + 12.526 dan nilai R² = 0.8778. Waktu munculnya akar dengan nilai rataan terkecil
menunjukkan perlakuan yang paling cepat mengeluarkan akar, sebaliknya waktu
munculnya akar dengan nilai rataan terbesar menunjukkan perlakuan yang paling
[image:30.595.109.512.117.718.2]lama mengeluarkan akar.
Gambar 2. Pengaruh Konsentrasi IBA terhadap Waktu Munculnya Akar
Perlakuan IBA 200 ppm menunjukkan waktu munculnya akar yang paling
cepat yaitu selama 10.2 hari dan perlakuan IBA 0 ppm (tanpa auksin)
menunjukkan waktu munculnya akar yang paling lama yaitu selama 12.4 hari.
IBA berpengaruh terhadap waktu inisiasi akar dikarenakan sifat dari IBA yang
tetap berada pada daerah pemberian perlakuan, translokasinya lemah, berlangsung
lebih lambat sehingga bahan aktifnya akan tertahan di dekat tempat aplikasinya
(Weaver, 1972).
y = (3 ×10-5)x2- 0,016x + 12,526
R² = 0,8778
0 2 4 6 8 10 12 14
0 100 200 300 400
W
a
ktu
m
un
cul
nya
a
ka
r (
ha
ri)
Konsentrasi IBA (ppm)
Tabel 3. Waktu Munculnya Akar pada Berbagai Perlakuan Perendaman IBA
Auksin Perlakuan
I0 I1 I2 I3 I4
--- hari ---
IBA 12.4a 11.6ab 10.2c** 10.8bc 11.4ab
Keterangan: ** : Sangat berbeda nyata pada taraf 1% I0 : IBA 0 ppm
I1 : IBA 100 ppm I2 : IBA 200 ppm I3 : IBA 300 ppm I4 : IBA 400 ppm
Berdasarkan data terlihat bahwa setek yang diberikan perlakuan auksin
waktu munculnya akar lebih cepat dibandingkan dengan setek yang tanpa diberi
perlakuan auksin. Hal tersebut sesuai dengan pernyataan Zong et al. (2008) bahwa
peran utama auksin pada perbanyakan tanaman adalah menstimulasi akar pada
setek batang dan daun dan meningkatkan cabang akar.
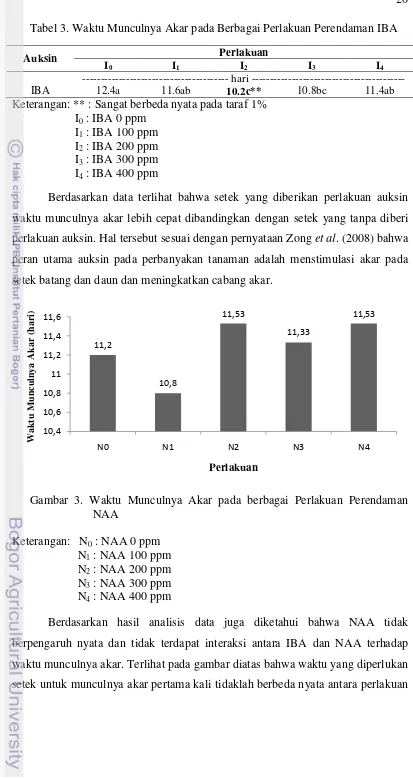
Gambar 3. Waktu Munculnya Akar pada berbagai Perlakuan Perendaman NAA
Keterangan: N0 : NAA 0 ppm N1 : NAA 100 ppm N2 : NAA 200 ppm N3 : NAA 300 ppm N4 : NAA 400 ppm
Berdasarkan hasil analisis data juga diketahui bahwa NAA tidak
berpengaruh nyata dan tidak terdapat interaksi antara IBA dan NAA terhadap
waktu munculnya akar. Terlihat pada gambar diatas bahwa waktu yang diperlukan
setek untuk munculnya akar pertama kali tidaklah berbeda nyata antara perlakuan
11,2 10,8 11,53 11,33 11,53 10,4 10,6 10,8 11 11,2 11,4 11,6
N0 N1 N2 N3 N4
yang satu dengan yang lain. Perlakuan NAA 100 ppm memiliki nilai rataan
terendah yaitu 10.8 hari dan perlakuan NAA 200 ppm dan NAA 400 ppm
memiliki nilai rataan tertinggi yaitu 11.53 hari.
(a) (b)
Gambar 4. Dasar Setek Mawar Saat Masih dalam Bentuk Kalus (1 MST) (a); Akar Mawar Mini yang Sudah Terbentuk (2 MST) (b).
Pada saat minggu pertama setelah tanam yang terbentuk pada daerah
pengaplikasian auksin adalah kalus (Gambar. 4a). Kalus yang terbentuk kemudian
akan berdiferensiasi menjadi akar. Lakitan (1996) menyatakan bahwa
pembentukan akar adventif dapat timbul dari dua sumber: 1) jaringan kalus
(wounded root). 2) bakal akar (morfologi atau akar primordial). Akar primer dari
kalus muncul di daerah kambium vaskular (Febrijanti, 1999).
Meskipun dibutuhkan dan berguna untuk menginduksi akar primordial,
auksin pada konsentrasi yang tinggi dapat menghambat pertumbuhan akar
primordial dan pemanjangan akar pada setek batang dan micro setek (Zong, et al.,
2008). Informasi mengenai konsentrasi yang tepat yang dapat mendukung
pertumbuhan dari setek tanaman mawar sangatlah dibutuhkan.
Jumlah Akar
Akar yang diamati adalah akar primer, dengan panjang minimal 2 mm.
Pengamatan dilakukan dari minggu kedua hingga minggu keempat setelah tanam
(2-4 MST). Berdasarkan hasil analisis data, diketahui bahwa pada minggu kedua
setelah tanam IBA berpengaruh nyata terhadap jumlah akar dengan respon linier
Penambahan konsentrasi IBA sampai pada konsentrasi 400 ppm masih
dapat meningkatkan jumlah akar dan akan terus meningkat pada pemberian
konsentrasi yang lebih tinggi.
Gambar 5. Pengaruh Konsentrasi IBA terhadap Jumlah Akar
Perlakuan IBA 400 ppm memiliki nilai rataan tertinggi yaitu 11.13 yang
menandakan perlakuan tersebut memberikan jumlah akar terbanyak pada minggu
kedua dan perlakuan dengan nilai rataan terendah terdapat pada IBA 100 ppm
yaitu 6.40 yang menunjukkan perlakuan tersebut memiliki jumlah akar paling
sedikit.
Tabel 4. Jumlah Akar pada Berbagai Perlakuan Perendaman IBA
Auksin Minggu Setelah Tanam (MST)
2 3 4
IBA
I0 6.71bc 10.67a 12.53a
I1 6.40c 11.67a 14.13a
I2 9.93ab 14.27a 15.20a
I3 9.40abc 14.07a 13.53a
I4 11.13a* 13.13a 13.93a
Keterangan: * : Berbeda nyata pada taraf 5% I0 : IBA 0 ppm
I1 : IBA 100 ppm I2 : IBA 200 ppm I3 : IBA 300 ppm I4 : IBA 400 ppm
Hal diatas sesuai dengan pernyataan Macdonald (2002) yang menyatakan bahwakegunaan dari hormon pengakaran yaitu secara keseluruhan meningkatkan
y = 0,012x + 6,26 R² = 0,828
0 2 4 6 8 10 12
0 100 200 300 400
Ju
ml
a
h
a
ka
r
Konsentrasi IBA (ppm)
persentase pengakaran, mempercepat inisiasi pengakaran, meningkatkan jumlah
dan kualitas dari akar, dan mendorong pengakaran yang seragam.
Pada minggu ketiga dan keempat setelah tanam perlakuan IBA tidak
berpengaruh nyata terhadap jumlah akar. Pada minggu ketiga dan keempat nilai
rataan tertinggi terdapat pada perlakuan IBA 200 ppm yaitu sebesar 14.27 dan
15.20. Sedangkan, nilai rataan terendah terdapat pada perlakuan IBA 0 ppm
(tanpa auksin) sebesar 10.67 dan 12.53.
Gambar 6. Jumlah Akar pada Berbagai Perlakuan Perendaman NAA
Keterangan: N0 : NAA 0 ppm N1 : NAA 100 ppm N2 : NAA 200 ppm N3 : NAA 300 ppm N4 : NAA 400 ppm
Berdasarkan hasil analisis data diketahui juga bahwa NAA tidak
memberikan pengaruh yang nyata dan tidak terdapat interaksi antara IBA dan
NAA terhadap peubah jumlah akar baik pada minggu ketiga maupun minggu
keempat. Pada minggu ketiga pengamatan nilai rataan tertinggi terdapat pada
perlakuan NAA 200 ppm sebesar 16 dan nilai rataan terendah terdapat pada
perlakuan NAA 400 ppm yaitu 11. Pada minggu keempat, pengamatan nilai
rataan tertinggi terdapat pada perlakuan NAA 400 ppm sebesar 15.2 dan terendah
pada perlakuan NAA 0 ppm yaitu 12.2.
Zong et al. (2008) menyatakan bahwa peran auksin yang utama adalah
menstimulasi akar dan meningkatkan jumlah akar. Fungsi dari akar adalah 7,1 12,1 12,2 9,1 12,3 14,1 10,9 16 13,8 7,9 12,3 14 8,7 11 15,2 0 2 4 6 8 10 12 14 16 18
2 3 4
J um la h Ak a r
Minggu Setelah Tanam (MST)
menyerap unsur hara dan air yang diperlukan dalam metabolisme tanaman
(Sitompul & Guritno, 1995). Jumlah akar menunjukkan kemampuan dalam
melakukan penyerapan unsur hara (Schuurman dan Goedewaagen, 1971).
Tanaman dengan jumlah akar yang banyak akan meningkatkan penyerapan unsur
hara dan air yang dapat mendukung pertumbuhan dari tanaman pula. Hartmann et
al., (1997) menambahkan bahwa akar sebagai organ tumbuh geotrofik, selain
berfungsi sebagai penegak batang, juga berperan sebagai organ penghisap hara
dalam mendukung laju pertumbuhan. Perakaran yang baik akan mampu
menopang pertumbuhan dari tanaman.
Panjang Akar
Pengamatan panjang akar sama seperti halnya pengamatan jumlah akar
yaitu pada akar primer yang telah memiliki panjang akar 2 mm. Pada pengamatan
minggu kedua diketahui bahwa IBA berpengaruh sangat nyata terhadap panjang
akar dengan dengan persamaan Y = 0.001x + 1.108 dan nilai R² = 0.429.
Penambahan konsentrasi IBA sampai dengan konsentrasi 400 ppm masih dapat
meningkatkan panjang akar dan akan terus meningkat pada pemberian konsentrasi
yang lebih tinggi. Hal tersebut dikarenakan IBA memiliki aktivitas auksin yang
lemah, zat kimia bersifat stabil dan tetap berada pada daerah pemberian
perlakuan, translokasinya lemah berlangsung lebih lambat sehingga bahan
aktifnya akan tertahan di dekat tempat aplikasinya (Weaver, 1972).
Gambar 7. Pengaruh Konsentrasi IBA terhadap Panjang Akar
y = 0,001x + 1,108 R² = 0,429
0 0,5 1 1,5 2
0 100 200 300 400
Pa
n
ja
n
g
a
ka
r (
cm)
Konsenrasi IBA (ppm)
Pada minggu kedua perlakuan IBA 200 ppm memiliki nilai rataan tertinggi
pada peubah panjang akar sebesar 1.87 cm. Panjang akar terendah pada minggu
kedua dimiliki oleh perlakuan IBA 0 ppm (tanpa auksin) yaitu 1.02 cm. Hal ini
sesuai dengan pernyataan dari Arteca (2006) bahwa auksin dapat menstimulasi
inisiasi akar dan panjang akar. Hartmann dan Kester (1983) menambahkan bahwa
IBA tidak menyebabkan racun pada tanaman karena mempunyai kisaran
konsentrasi yang lebar dan efektif dalam menstimulir akar pada sejumlah besar
spesies tanaman.
Pada minggu ketiga dan keempat pengamatan perlakuan perendaman IBA
tidak berpengaruh nyata terhadap panjang akar. Pada minggu ketiga sama seperti
halnya minggu kedua, nilai rataan tertinggi terdapat pada perlakuan IBA 200 ppm
sebesar 3.5 cm. Pada minggu keempat, nilai rataan tertinggi terdapat pada
perlakuan IBA 0 ppm (tanpa auksin) yaitu 4.77 cm. Nilai rataan terendah baik
pada minggu ketiga maupun keempat terdapat pada perlakuan IBA 400 ppm,
sebesar 2.75 cm dan 3.69 cm.
Tabel 5. Panjang Akar pada berbagai Perlakuan Perendaman IBA
Auksin Minggu Setelah Tanam (MST)
2 3 4
IBA
I0 1.02c 3.27a 4.77a
I1 1.18bc 3.12a 4.5a
I2 1.87a** 3.5a 3.96a
I3 1.29bc 3.41a 4.67a
I4 1.71ab 2.75a 3.69a
Keterangan: * : Sangat berbeda nyata pada taraf 1% I0 : IBA 0 ppm
I1 : IBA 100 ppm I2 : IBA 200 ppm I3 : IBA 300 ppm I4 : IBA 400 ppm
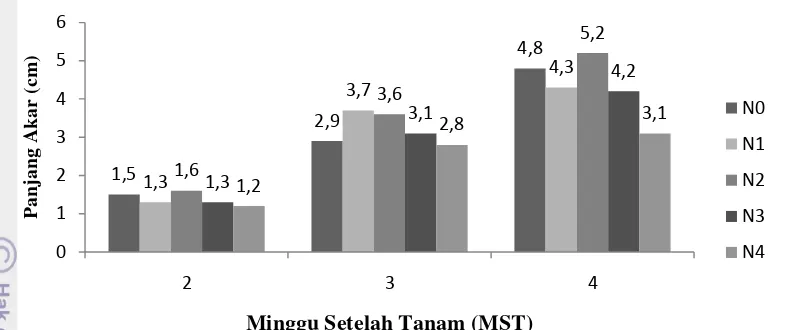
Berdasarkan hasil uji lanjut diketahui juga bahwa NAA tidak berpengaruh
nyata dan tidak terdapat interaksi antara IBA dan NAA terhadap panjang akar.
Terlihat seperti pada gambar dibawah, bahwa nilai rataan pada masing-masing
perlakuan baik pada minggu kedua, ketiga maupun minggu keempat tidak berbeda
nyata. Pada minggu kedua dan keempat nilai rataan tertinggi terdapat pada
perlakuan NAA 200 ppm yaitu 1.6 cm dan 5.2 cm. Pada minggu ketiga, nilai
Gambar 8. Panjang Akar pada Berbagai Perlakuan Perendaman NAA
Keterangan: N0 : NAA 0 ppm N1 : NAA 100 ppm N2 : NAA 200 ppm N3 : NAA 300 ppm N4 : NAA 400 ppm
Berdasarkan gambar diatas juga terlihat bahwa baik pada minggu kedua,
ketiga maupun minggu keempat nilai rataan terendah terdapat pada perlakuan
NAA 400 ppm yaitu 1.2 cm, 2.8 cm, dan 3.1 cm. Hal tersebut sesuai dengan
pernyataan Zong et al. (2008) bahwa meskipun dibutuhkan dan berguna untuk
menginduksi akar primordial, auksin pada konsentrasi yang tinggi seringkali
menghambat pertumbuhan akar primordial dan pemanjangan akar pada setek
batang dan mikrosetek. Kemungkinan konsentrasi yang diberikan terlalu tinggi,
sehingga menghambat pemanjangan akar.
Pertumbuhan dari setek juga tidak hanya dipengaruhi oleh konsentrasi
auksin yang diberikan, tetapi juga dipengaruhi oleh berbagai faktor. Faktor-faktor
yang mempengaruhi pertumbuhan setek adalah kondisi fisiologis tanaman induk
(stock plant), umur tanaman induk, jenis bahan setek, waktu pengambilan setek,
zat pengatur tumbuh (ZPT), adanya tunas dan daun, umur bahan setek, dan
kondisi lingkungan (Dawson dan King, 1994). Tanaman dengan kondisi optimum
pertumbuhan akarnya akan berlangsung dengan baik.
Panjang akar menunjukkan batas kemampuan tanaman untuk menjangkau
wilayah tertentu dalam penyerapan unsur hara, sehingga semakin panjang akar
memungkinkan setek untuk menyerap unsur hara, mineral dan air lebih banyak
1,5 2,9 4,8 1,3 3,7 4,3 1,6 3,6 5,2 1,3 3,1 4,2 1,2 2,8 3,1 0 1 2 3 4 5 6
2 3 4
P a nja ng Ak a r (cm )
Minggu Setelah Tanam (MST)
daripada akar yang pendek (Schuurman dan Goedewagen, 1971). Menurut
Goldsworthy dan Fisher (1992) panjang akar telah diterima sebagai ukuran
menilai daya penyerapan sistem akar. Tanaman yang memiliki akar yang panjang
akan memiliki kemampuan menyerap hara dan air lebih baik bila dibandingkan
dengan tanaman yang akarnya pendek dan juga mampu mencari air pada lokasi
yang sulit untuk mencapai air. Semakin bertambah panjang akar maka tanaman
akan lebih kokoh dan air serta garam-garam mineral di dalam media tumbuh akan
mudah diserap untuk disalurkan ke batang dan daun (Darliah, et al., 1994).
Persentase Setek Hidup
Persentase setek hidup menyatakan jumlah setek yang masih hidup saat
pengamatan terhadap jumlah setek awal penelitian yang dinyatakan dalam persen.
Pengamatan dilakukan pada minggu kedua dan minggu kelima. Pengamatan pada
minggu kedua dilakukan untuk mewakili persentase hidup setek saat masih berada
di bedengan dan pada minggu kelima untuk mewakili persentase hidup setek pada
saat setek sudah di pot. Berdasarkan hasil sidik ragam diketahui bahwa NAA
berpengaruh nyata terhadap persentase setek hidup pada minggu kelima dengan
respon linier dengan persamaan Y = 0.0027x + 60.667. Sehingga dapat dikatakan
bahwa konsentrasi NAA sampai dengan 400 ppm masih dapat meningkatkan
persentase setek hidup tanaman dan akan terus meningkat pada pemberian
konsentrasi yang lebih tinggi.
Tabel 6. Persentase Hidup setek pada berbagai Perlakuan Perendaman NAA
Auksin Minggu Setelah Tanam (MST)
2 5
IBA
I0 70a 57.33ab
I1 70a 60a*
I2 68a 58.67a
I3 60.67a 40c
I4 61.33a 41.33bc
Keterangan: * : Berbeda nyata pada taraf 5% N0 : NAA 0 ppm
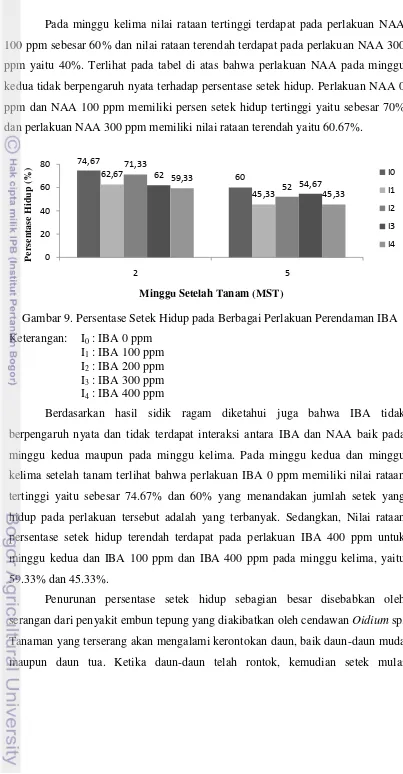
Pada minggu kelima nilai rataan tertinggi terdapat pada perlakuan NAA
100 ppm sebesar 60% dan nilai rataan terendah terdapat pada perlakuan NAA 300
ppm yaitu 40%. Terlihat pada tabel di atas bahwa perlakuan NAA pada minggu
kedua tidak berpengaruh nyata terhadap persentase setek hidup. Perlakuan NAA 0
ppm dan NAA 100 ppm memiliki persen setek hidup tertinggi yaitu sebesar 70%
[image:39.595.105.508.68.842.2]dan perlakuan NAA 300 ppm memiliki nilai rataan terendah yaitu 60.67%.
Gambar 9. Persentase Setek Hidup pada Berbagai Perlakuan Perendaman IBA
Keterangan: I0 : IBA 0 ppm I1 : IBA 100 ppm I2 : IBA 200 ppm I3 : IBA 300 ppm I4 : IBA 400 ppm
Berdasarkan hasil sidik ragam diketahui juga bahwa IBA tidak
berpengaruh nyata dan tidak terdapat interaksi antara IBA dan NAA baik pada
minggu kedua maupun pada minggu kelima. Pada minggu kedua dan minggu
kelima setelah tanam terlihat bahwa perlakuan IBA 0 ppm memiliki nilai rataan
tertinggi yaitu sebesar 74.67% dan 60% yang menandakan jumlah setek yang
hidup pada perlakuan tersebut adalah yang terbanyak. Sedangkan, Nilai rataan
persentase setek hidup terendah terdapat pada perlakuan IBA 400 ppm untuk
minggu kedua dan IBA 100 ppm dan IBA 400 ppm pada minggu kelima, yaitu
59.33% dan 45.33%.
Penurunan persentase setek hidup sebagian besar disebabkan oleh
serangan dari penyakit embun tepung yang diakibatkan oleh cendawan Oidium sp.
Tanaman yang terserang akan mengalami kerontokan daun, baik daun-daun muda
maupun daun tua. Ketika daun-daun telah rontok, kemudian setek mulai
74,67 60 62,67 45,33 71,33 52 62 54,67 59,33 45,33 0 20 40 60 80 2 5 P er sent a se H idu p (%)
Minggu Setelah Tanam (MST)
mengering dan akhirnya mati. Sanitasi dan pengendalian lingkungan merupakan
hal yang mutlak dalam produksi tanaman mawar pot. Penyakit seringkali ikut
terbawa ke keturunan berikutnya, Pengendalian pada semua tahap pertumbuhan
sangatlah dibutuhkan (Dole and Wilkins, 2005). Pencegahan merupakan hal yang
sangatlah diperlukan. Pencegahan dapat dilakukan dengan menyemprot tanaman
dengan fungisida ketika suasana lingkungan mulai lembab atau saat curah hujan
mulai tinggi.
(a) (b)
Gambar 10. Alat Sensor pada Irigasi Penyemprotan (a); Setek Umur 1 MST yang disemprot dengan Irigasi Penyemprotan (b).
Pada umumnya irigasi penyemprotan dikontrol menggunakan pengatur
waktu, tetapi interval waktu yang ditetapkan pada waktu cerah. Penyemprotan
pada tengah hari dapat menyebakan kelembaban yang berlebihan, dapat
menghambat pengakaran dan memacu pertumbuhan pathogen (Dole dan Wilkins,
2005). Pada saat penelitian berlangsung, irigasi penyemprotan disambungkan
dengan sensor otomatis yang akan menyemprotkan air ketika alat sensor kering
dan tidak menyemprot pada saat keadaan lembab. Sehingga setek terhindar dari
penyemprotan yang berlebihan yang dapat menghambat pengakaran dan memacu
pertumbuhan pathogen.
Suhu yang baik untuk pengakaran mawar yaitu 23-240C (Dole dan
Wilkins, 2005). Kelembaban dapat terjaga dengan irigasi yang teratur. Penelitian
ini menggunakan irigasi semprot untuk menjaga kelembaban pada saat
pengakaran dan untuk mencukupi kebutuhan air tanaman. Irigasi semprot dan
pengkabutan menyemprotkan air langsung ke setek untuk mengurangi transpirasi
[image:40.595.120.509.103.400.2]dan Wilkins, 2005). Irigasi penyemprotan atau pengkabutan harus membasahi
bedengan untuk memastikan bahwa semua setek basah seragam dan bebas dari
stress kering.
Panjang Tunas
Peubah ini mulai diamati pada minggu kelima, pengamatan dilakukan
setiap minggu hingga minggu ketiga belas. Namun, dikarenakan pertumbuhan
untuk setiap minggunya tidak nyata, maka data yang ditampilkan adalah data pada
minggu kelima dimana berdasarkan hasil analisis sidik ragam terdapat interaksi
antara IBA dan NAA terhadap panjang tunas. Terlihat pada tabel dibawah bahwa
nilai rataan tertinggi terdapat pada kombinasi konsentrasi IBA 400 ppm + NAA
100 ppm dengan nilai 0.72 cm. Nilai rataan terendah terdapat pada perlakuan IBA
300 ppm + NAA 400 ppm dan IBA 400 ppm dan NAA 300 ppm yaitu 0.3 cm.
Tabel 7. Interaksi Kombinasi Konsentrasi IBA dan NAA terhadap Panjang Tunas
IBA NAA
N0 N1 N2 N3 N4
--- cm ---
I0 0.53abcd 0.40bcd 0.55abcd 0.40bcd 0.53abcd
I1 0.60abcd 0.50abcd 0.53abcd 0.55abcd 0.7ab
I2 0.53abcd 0.52abcd 0.38cd 0.47abcd 0.38cd
I3 0.67abc 0.55abcd 0.52abcd 0.65abc 0.3d
I4 0.5abcd 0.72a* 0.6abcd 0.3d 0.47abcd
Keterangan: * : Berbeda nyata pada taraf 5% I0 : IBA 0 ppm
I1 : IBA 100 ppm I2 : IBA 200 ppm I3 : IBA 300 ppm
I4 : IBA 400 ppm
N0 : NAA 0 ppm N1 : NAA 100 ppm N2 : NAA 200 ppm N3 : NAA 300 ppm N4 : NAA 400 ppm
Pada minggu kelima berdasarkan hasil analisis sidik ragam terlihat juga
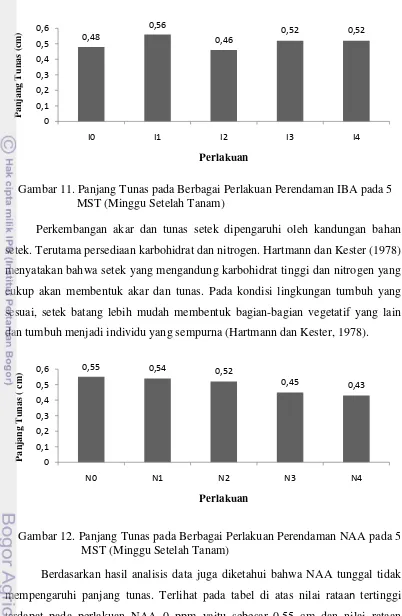
bahwa IBA tunggal tidak mempengaruhi panjang tunas. Nilai rataan tertinggi
terdapat pada perlakuan IBA 100 ppm yaitu sebesar 0.56 cm. Sedangkan, nilai
Gambar 11. Panjang Tunas pada Berbagai Perlakuan Perendaman IBA pada 5 MST (Minggu Setelah Tanam)
Perkembangan akar dan tunas setek dipengaruhi oleh kandungan bahan
setek. Terutama persediaan karbohidrat dan nitrogen. Hartmann dan Kester (1978)
menyatakan bahwa setek yang mengandung karbohidrat tinggi dan nitrogen yang
cukup akan membentuk akar dan tunas. Pada kondisi lingkungan tumbuh yang
sesuai, setek batang lebih mudah membentuk bagian-bagian vegetatif yang lain
dan tumbuh menjadi individu yang sempurna (Hartmann dan Kester, 1978).
Gambar 12. Panjang Tunas pada Berbagai Perlakuan Perendaman NAA pada 5 MST (Minggu Setelah Tanam)
Berdasarkan hasil analisis data juga diketahui bahwa NAA tunggal tidak
mempengaruhi panjang tunas. Terlihat pada tabel di atas nilai rataan tertinggi terdapat pada perlakuan NAA 0 ppm yaitu sebesar 0.55 cm dan nilai rataan
terendah terdapat pada perlakuan NAA 400 ppm yaitu sebesar 0.43 cm.
0,48 0,56 0,46 0,52 0,52 0 0,1 0,2 0,3 0,4 0,5 0,6
I0 I1 I2 I3 I4
P a nja ng T un a s (cm ) Perlakuan
0,55 0,54 0,52
0,45 0,43 0 0,1 0,2 0,3 0,4 0,5 0,6
N0 N1 N2 N3 N4
(a) (b)
Gambar 13. Pertumbuhan Tunas pada 8 MST (a); Pertumbuhan Tunas pada 9 MST (b).
Dapat dikatakan bahwa pada awal percobaan auksin berpengaruh terhadap
peubah panjang tunas. Perlakuan dengan auksin yang memiliki waktu inisiasi akar
yang lebih cepat dibandingkan perlakuan tanpa auksin dapat tumbuh dengan lebih
baik. Akar yang dihasilkan pun lebih banyak sehingga dapat mendukung
pertumbuhan tanaman melalui serapan air, hara dan garam-garam mineral.
Darliah et al. (1994) menambahkan bahwa pertambahan panjang tunas merupakan
hasil dari pertumbuhan dan perkembangan sel yang tergantung dari suplai unsur
hara yang diberikan oleh akar untuk metabolisme dan sintesis protein.
Jumlah Bunga
Pengamatan ini dilakukan sejak 7 MST hingga 20 MST, yang dilakukan
sekali dalam seminggu. Data yang diperoleh adalah data penambahan jumlah
bunga setiap minggunya. Sehingga diperoleh akumulasi jumlah bunga hingga
tanaman berumur 20 MST. Berdasarkan hasil analisis data diketahui bahwa baik
IBA, NAA maupun interaksinya tidak berpengaruh nyata terhadap peubah jumlah
bunga.
Arteca (2006) menyatakan bahwa auksin terlibat dalam banyak proses
fisiologi tanaman seperti menginduksi pemanjangan sel, fototropisme,
gravitropisme, dominansi apikal, inisiasi akar, produksi etilen, perkembangan
buah, ekspresi seks dan pengendalian gulma. Hal tersebut menandakan bahwa
Gambar 14. Mawar Mini pada saat Berumur 12 Minggu Setelah Tanam (MST)
Faktor-faktor yang mempengaruhi proses pembungaan antara lain
fitokrom, fotoperiodisitas, vernalisasi, dan hormon pembungaan. Gardner et al.
(1985) menambahkan bahwa proses pembungaan sangat dikendalikan oleh
lingkungan terutama fotoperiode, temperatur dan faktor genetik terutama zat
pengatur yang ada dalam tumbuhan, hasil fotosintesa dan pasokan hara.
Gambar 15. Jumlah Bunga pada Berbagai Perlakuan Perendaman IBA
Keterangan: I0 : IBA 0 ppm I1 : IBA 100 ppm I2 : IBA 200 ppm I3 : IBA 300 ppm I4 : IBA 400 ppm
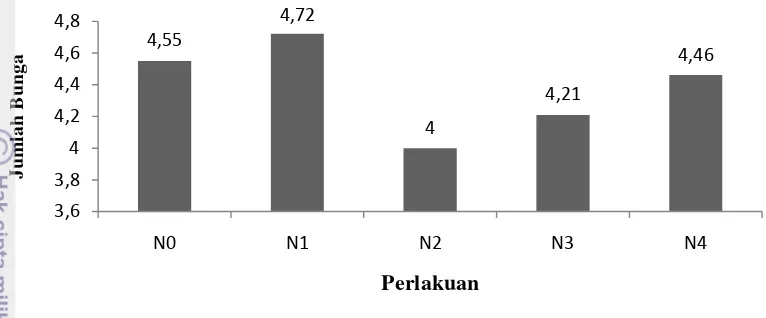
Nilai rataan jumlah bunga tertinggi pada perlakuan perendaman IBA 400
ppm sebesar 4.75 dan nilai rataan terendah terdapat pada perlakuan perendaman
IBA 300 ppm yaitu 3.81. Sedangkan, pada perlakuan perendaman NAA nilai
rataan tertinggi jumlah bunga terdapat pada perlakuan NAA 100 ppm sebesar 4.72
4,12 4,69 4,62
3,81
4,75
0 1 2 3 4 5
I0 I1 I2 I3 I4
J
um
la
h
B
un
g
a
dan nilai rataan terendah jumlah bunga terdapat pada perlakuan NAA 200 ppm
[image:45.595.118.501.139.298.2]yaitu 4.
Gambar 16. Jumlah Bunga pada Berbagai Perlakuan Perendaman NAA
Keterangan: N0 : NAA 0 ppm N1 : NAA 100 ppm N2 : NAA 200 ppm N3 : NAA 300 ppm N4 : NAA 400 ppm
Tahap-tahap pembungaan meliputi: 1) induksi bunga. 2) Inisiasi bunga. 3)
perkembangan kuncup bunga menuju anthesis, ditandai dengan diferensiasi
bagian-bagian bunga. 4) anthesis, merupakan tahap pemekaran bunga.
Berdasarkan pengamatan di lapangan juga diketahui bahwa untuk dapat tumbuh
dan berkembang menjadi bunga sempurna dibutuhkan waktu berkisar antara 3
minggu.
Bunga sangat mudah terkena serangan penyakit. Penyakit yang menyerang
selama penelitian adalah bercak daun cendawan (Fungus leaf spot). Pada awalnya
hanya daun saja yang mengalami serangan yang ditandai dengan kerontokan pada
daun. Namun setelah beberapa hari serangan, spora dari cendawan tersebut juga
menyerang bunga. Bunga yang terserang penyakit pertumbuhannya akan terhenti.
Bunga akan mengalami perubahan warna dari merah menjadi agak keunguan.
Bunga yang terkena serangan penyakit pada saat masih kuncup tidak akan mekar.
Sedangkan, bunga yang terkena serangan penyakit pada saat sudah mekar,
dipermukaan bunga akan terlihat spora-spora dari penyakit. Pencegahan
penyebaran penyakit dengan melakukan penyemprotan fungisida pada saat
4,55
4,72
4
4,21
4,46
3,6 3,8 4 4,2 4,4 4,6 4,8
N0 N1 N2 N3 N4
J
um
la
h
B
un
g
a
kelembaban di rumah kaca meningkat dan sanitasi. Sanitasi dan pengendalian
lingkungan merupakan hal yang mutlak diperlukan pada produksi mawar pot
(Dole dan Wilkins, 2005). Bunga dan daun yang telah terkena serangan penyakit
harus segera disingkirkan agar tidak menulari tanaman yang lain.
Bobot Basah dan Bobot Kering Akar
Pengamatan bobot basah dan bobot kering akar dilakukan pada 21 MST
atau pada akhir penelitian. Akar sebelumnya dibersihkan terlebih dahulu dengan
air untuk memisahkan akar dari sisa-sisa media, ditiriskan selama semalaman,
kemudian keesokan harinya ditimbang untuk memperoleh bobot basah akar.
Sedangkan bobot kering akar diperoleh dengan mengoven akar terlebih dahulu
[image:46.595.108.512.46.811.2]sebelumnya pada suhu 70 0C selama 48 jam.
Gambar 17. Bobot Basah Akar