i
TRANSFORMASI PROMOTER GEN
AGAMOUS
DAN
AGAMOUS-LIKE
KELAPA SAWIT (
EgAG2
DAN
EgAGL2
) PADA EKSPLAN TEMBAKAU
DEWI PATMAWATI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PEGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
DEWI PATMAWATI. Transformasi Promoter Gen
AGAMOUS
dan
AGAMOUS
-LIKE
Kelapa Sawit (
EgAG2
dan
EgAGL2
) pada Eksplan Tembakau. Dibimbing
oleh I MADE ARTIKA dan TETTY CHAIDAMSARI.
Kelapa sawit (
Elaeis guineensis
) merupakan salah satu tanaman
perkebunan yang memiliki prospek cerah karena diperkirakan kebutuhan kelapa
sawit dunia akan terus meningkat. Peningkatan permintaan tersebut ternyata
disertai permasalahan besar dalam pembudidayaannya, yaitu cekaman kekeringan.
Cekaman kekeringan mengakibatkan penurunan
sex-ratio
, jumlah bunga betina
menurun sehingga terjadi penurunan produksi. Usaha untuk memperbaiki
produksi kelapa sawit dalam hal pembungaan diantaranya dilakukan secara
biologi molekuler. Kandidat gen pembungaan kelapa sawit yang dapat
menanggulangi cekaman kekeringan adalah
Elaeis guineensis AGAMOUS2
(EgAG2)
dan
Elaeis guineensis AGAMOUS-LIKE2 (EgAGL2).
Penelitian ini
bertujuan mendapatkan tembakau transgenik pembawa promoter gen
EgAG2
dan
EgAGL2
ke dalam eksplan tembakau. Transformasi promoter gen EgAG2 dan
EgAGL2 dilakukan dengan menggunakan
Agrobacterium tumefasiens
. Tembakau
transgenik yang telah menggandung promoter tersebut kemudian diisolasi
DNAnya. DNA yang diperoleh selanjutnya diamplifikasi dengan primer
NPTII
.
Gen
NPTII
ynag berhasil teramplifikasi berukuran 250 bp. Promoter gen
EgAG2
dan
EgAGL2
telah berhasil disisipkan ke dalam genom tanaman tembakau
dengan perantara
A. tumefasiens
. Ekspresi dari gen
EgAG2
mengakibatkan
tanaman tembakau memiliki daun yang cacat atau melipat. Selain itu, ekspresi gen
iii
ABSTRACT
DEWI PATMAWATI. Oil Palm
AGAMOUS
and
AGAMOUS
–
LIKE
(
EgAG2
and
EgAGL2
) Gene Promoters Transformation on Tobacco Explant. Under the
supervision of I MADE ARTIKA and TETTY CHAIDAMSARI.
Oil palm (
Elaeis guineensis
) is one of good prospected plants due to rising
world’s demand on this plant. This massive demand apparently comes with a
major cultivation problem of oil palm, which is drought stress. Drought stress
causes the decreasing of sex ratio. The amount of female flowers lowered down,
hence the production decline exists. The efforts to fix this problem were done in a
molecular biology way. Oil palm flowering gene candidates that can overcome
drought stress are
Elaeis guineensis AGAMOUS2 (EgAG2)
and
Elaeis guineensis
AGAMOUS-LIKE2 (EgAGL2).
This research aimed to get a transgenic tobacco as
a promoter carrier of
EgAG2
dan
EgAGL2
genes into tobacco explant. The
transformation of those gene promoters was done by using
Agrobacterium
tumefasiens
. DNA isolation was done to transgenic tobacco which contained those
promoters. The isolated DNA was then amplified using
NPTII
primer.
NPTII
gene
that was successfully amplified had a size of 250 base pairs.
EgAG2
and
EgAGL2
TRANSFORMASI PROMOTER GEN
AGAMOUS
DAN
AGAMOUS
-
LIKE
KELAPA SAWIT (
EgAG2
DAN
EgAGL2
) PADA EKSPLAN TEMBAKAU
DEWI PATMAWATI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PEGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
v
Judul Skripsi : Transformasi Promoter Gen
AGAMOUS
dan
AGAMOUS
-
LIKE
Kelapa Sawit (
EgAG2
dan
EgAGL2
) pada Eksplan Tembakau
Nama
: Dewi Patmawati
NRP
: G84070030
Disetujui
Komisi Pembimbing
Diketahui
Ketua Departemen Biokimia
Dr. Ir. I Made Artika, M.App.Sc
NIP 19630117 198903 1000
Tanggal lulus:
Dr. Ir. I Made Artika, M.App.Sc
Ketua
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala
kerunia-Nya, shalawat serta salam semoga selalu tercurah kepada Nabi Muhammad SAW,
keluarga, sahabat, dan para pengikutnya sampai akhir zaman sehingga penulis
dapat menyelesaikan penelitian ini. Penelitian ini berjudul Transformasi Promoter
Gen
AGAMOUS
dan
AGAMOUS
-
LIKE
Kelapa Sawit (
EgAG2
dan
EgAGL2
) pada
Eksplan Tembakau. Kegiatan penelitian ini dilakukan dari bulan April hingga
Agustus 2011, bertempat di Laboratorium Balai Penelitian Bioteknologi
Perkebunan Indonesia, Jalan Taman Kencana, Bogor.
Penulis mengucapkan terima kasih kepada semua pihak yang telah
membantu dalam penyelesaian penelitian ini, antara lain kepada Dr. Ir. I Made
Artika, M.App.Sc. selaku pembimbing utama dan Dr. Tetty Chaidamsari, M.Si
selaku pembimbing lapangan yang telah memberikan saran, kritik, dan
bimbingannya. Penulis juga menyampaikan terima kasih kepada teknisi yang telah
membagi pengalaman berharganya, Nina Yuniar, Herti Sugiarti, serta segenap
staf di Laboratorium Biologi Molekuler dan Rekayasa Genetika, Balai Penelitian
Bioteknologi Perkebunan Indonesia.
Ucapan terima kasih juga penulis sampaikan kepada orang tua, kakak, dan
Biokimia 44 khususnya Risqiana, Nindi, dan Mike untuk semua doa, dukungan,
dan bimbingan yang sangat berarti bagi penulis. Serta kepada rekan selama
penelitian Endah, Yoshita, Mbak Ratna, Mbak Izah, Riska, Ismi, Ibrahim, Mas
Rendi, dan Tiara atas saran dan motivasi yang diberikan, serta teman kosan saya
bernama Alisa. Penulis berharap semoga karya ilmiah ini dapat memberikan
manfaat bagi semua orang yang memerlukannya.
Bogor, November 2011
vii
RIWAYAT HIDUP
Penulis dilahirkan di Sukoharjo pada tanggal 15 Februari 1988 dari ayah
Hadimulyono dan ibu Samiyem. Penulis merupakan anak keempat dari empat
bersaudara.
Pendidikan penulis dimulai dari TK Pondok 1 Sukoharjo, SDN Pondok 1
Sukoharjo, kemudian melanjutkan pendidikan ke SMPN 1 Sukoharjo. Tahun 2007
penulis lulus dari SMAN 1 Sukoharjo dan pada tahun yang sama lulus seleksi
masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI). Penulis memilih
mayor Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ...
x
PENDAHULUAN ...
1
TINJAUAN PUSTAKA
Kelapa Sawit (
Elaeis guineensis
) ...
2
Promoter Gen ...
2
Gen
AGAMOUS
dan
AGAMOUS
-LIKE ...
3
Tembakau ...
5
Kultur Jaringan ...
5
Transformasi Genetik dengan Perantara
Agrobacterium
...
6
Polymerase Chain Reaction
(PCR)
...
6
BAHAN DAN METODE
Bahan dan Alat ...
8
Metode...
8
HASIL DAN PEMBAHASAN
Tembakau awal transformasi ... 10
Seleksi Promoter Gen
EgAG2
dan
EgAGL2
... 10
Isolasi DNA Daun Tembakau ... 11
Amplifikasi Menggunakan Primer
NPTII
dengan Metode PCR ... 11
Morfologi Tanaman Tembakau ... 12
SIMPULAN DAN SARAN
Simpulan ... 13
Saran ... 13
DAFTAR PUSTAKA ... 13
ix
DAFTAR GAMBAR
Halaman
1 Tanaman kelapa sawit ... 2
2 Skema gen yang mengandung promoter ... 3
3 Alur pengaruh cekaman kekeringan terhadap diferensiasi seksual tanaman
kelapa sawit... 4
4 Koloni
Agrobacterium tumefaciens
pada daun tembakau ... 6
5 Tahapan proses PCR ... 8
6 Tanaman tembakau yang digunakan sebagai ekplan ... 10
7 Eksplan nontransforman dan transforman promoter
EgAGL2
... 11
8 Tanaman tembakau kontrol positif dan kontrol negatif ... 11
9 Profil hasil isolasi DNA tembakau
... ...
11
10 Kontruk T-DNA yang mengandung
NPTII
... 12
11 Elektroforegram hasil PCR dengan primer
NPTII
... 12
12 Morfologi tanaman tembakau hasil transformasi promoter
EgAG2
... 13
13 Morfologi tanaman tembakau hasil transformasi promoter gen
EgAGL2
.... 13
14 Tanaman yang bersifat kimera ... 13
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian ... 18
2 Komposisi media yang digunakan dalam penelitian ... 19
3 Komposisi larutan yang digunakan dalam penelitian ... 21
PENDAHULUAN
Kelapa sawit (Elaeis guineensis Jacq) merupakan salah satu komoditas perkebunan yang menyumbang devisa negara yang cukup tinggi bagi Indonesia. Selain itu, kelapa sawit juga menduduki peringkat ketiga sebagai komoditas nonmigas di Indonesia. Produksi kelapa sawit di Indonesia telah mencapai 11.623.822 ton sehingga Indonesia menjadi negara terbesar penghasil kelapa sawit pada tahun 2008 (Badan Pusat Statistik 2009). Peningkatan permintaan dunia terhadap kelapa sawit untuk diolah menjadi minyak goreng, makanan, kosmetik, sabun, dan bahan dasar industri memicu Indonesia untuk meningkatkan produktivitas.
Produktivitas kebun kelapa sawit di Indonesia lebih rendah dibandingkan Malaysia. Produksi kelapa sawit nasional Indonesia hanya sekitar 15 ton tandan buah segar (TBS)/ha/tahun sedangkan produktivitas Malaysia telah mencapai 25 ton TBS/ha/tahun pada tahun 2007 (Santoso et al. 2009). Rendahnya produktivitas kebun kelapa sawit di Indonesia salah satunya disebabkan oleh cekaman kekeringan.
Cekaman kekeringan merupakan keadaan lingkungan yang menyebabkan tanaman kekurangan air. Peristiwa ini dapat terjadi akibat kekurangan air di daerah perakaran atau akibat laju evaporasi lebih tinggi dibandingkan dengan laju absorbsi air (Sinaga 2007). Cekaman kekeringan dapat mengakibatkan penurunan yang nyata pada pertumbuhan dan karakter vegetatif tanaman yang berada dalam masa pertumbuhan aktif. Kehilangan hasil karena cekaman kekeringan di beberapa kebun dapat mencapai 40 %. Selain itu, dampak dari kekeringan terhadap penurunan hasil akan dirasakan sampai 2-3 tahun berikutnya. Secara fisiologis, pengaruh cekaman kekeringan terhadap kelapa sawit adalah terjadinya penurunan sex-ratio, jumlah bunga betina per total bunga menurun dan akhirnya menyebabkan penurunan produksi TBS tanaman.
Usaha untuk memperbaiki produksi kelapa sawit dalam hal pembungaan dilakukan pendekatan secara biologi molekuler. Salah satunya yaitu penemuan gen-gen yang berperan penting pada proses pembungaan dan proses pembungaan menuju buah. Gen-gen yang berperan tersebut antara lain LEAFY
(LFY), APETALA1 (AP1), CAULIFLOWER (CAL), FRUITFULL (FUL), dan AGAMOUS (AG) (Dean dan Simpson 2002). Gen pembungaan dari kelapa sawit yang
memerlukan uji lebih lanjut diantaranya yaitu
Elaeis guineensis AGAMOUS2 (EgAG2) dan
Elaeis guineensis AGAMOUS-LIKE2 (EgAGL2). EgAG2 dan EgAGL2 merupakan kandidat gen pembungaan yang berperan dalam proses diferensiasi seksual pada pembungaan kelapa sawit.
Proses diferensiasi seksual dalam siklus pembungaan kelapa sawit sendiri diawali dengan terbentuknya primordial bunga dari jaringan meristem bunga. Diferensiasi seksual, primordial bunga akan berkembang menjadi bunga jantan atau betina dipengaruhi oleh keadaan lingkungan. Selain itu, gen
EgAG2 dan EgAGL2 diduga berperan dalam proses diferensiasi seksual pada pembungaan kelapa sawit. Promoter gen EgAG2 dan
EgAGL2 diharapkan dapat mengaktifkan kerja gen EgAG2 dan EgAGL2 yang dapat menanggulangi dampak cekaman kekeringan, mengatur pembungaan, dan akhirnya meningkatkan produktivitas kelapa sawit. Penelitian sebelumnya telah dilakukan isolasi dan karakterisasi promoter dari kedua gen ini. Penelitian ini melakukan transformasi kedua gen ke tanaman model yaitu tembakau.
Pengujian ekspresi dan pengaruh promoter gen EgAG2 dan EgAGL2 terhadap perkembangan organ reproduktif tanaman. Pengujian ini umumnya dilakukan menggunakan tanaman model Arabidopsis.
Namun menumbuhkan tanaman Arabidopsis di daerah atau lingkungan tropis sangat sulit, sebagai alternatif dalam pengujian tersebut maka digunakan eksplan tanaman tembakau in vitro.
Tembakau digunakan sebagai tanaman model karena memenuhi syarat sebagai tanaman model. Persyaratan tanaman model adalah cepat mudah regenerasi, cepat dtransformasinya. Tembakau memiliki regenerasi yang mudah dan cepat, sehingga ekspresi dari gen lebih cepat bisa diketahui.
Penelitian ini bertujuan mendapatkan tanaman tembakau transgenik yang membawa promoter gen AGAMOUS (EgAG2) dan
AGAMOUS-LIKE (EgAGL2) kelapa sawit. Hipotesis penelitian ini adalah tembakau transgenik promoter gen AGAMOUS (EgAG2)
2
TINJAUAN PUSTAKA
Kelapa Sawit (Elaeis guineensis Jacq) Kelapa sawit (Elaeis guineensis Jacq) belum diketahui secara pasti dari mana asalnya. Ada dua anggapan kuat mengenai asal dari tanaman ini kedua tempat tersebut, yaitu Amerika Selatan dan Afrika (Guinea). Spesies Elaeis melanococca atau Elaeis oleivera diduga berasal dari Amerika Selatan, sedangkan spesies Elaeis guineensis berasal dari Afrika (Guinea) (Sastrosayono 2003).
Tanaman ini dikenal Indonesia sejak 1848. Namun, baru dibudidayakan secara komersial pada tahun 1911. Elaeis adalah bahasa Yunani (Elaion) yang artinya minyak. Kata guineensis
berasal dari kata Guinea yaitu nama pantai barat Afrika, dan Jacq merupakan nama penemu kelapa sawit yaitu Jacquis (Lilis 2009). Kelapa sawit termasuk divisi
Spermatophyta, subdivisi Angiospermae, kelas Monocotyledonae, ordo Palmales, family Palmaceae, genus Elaeis, spesies
Elaeisguineensis (Sastrosayono 2003). Kelapa sawit merupakan komoditas perkebunan yang cukup penting di Indonesia. Prospek perkembangannya cukup cerah untuk waktu ke depan. Komoditas kelapa sawit, baik berupa bahan mentah ataupun hasil olahannya, menduduki peringkat ketiga penyumbang devisa nonmigas terbesar setelah karet dan kopi (Sastrosayono 2003).
Kelapa sawit termasuk dalam tanaman berumah satu yang berarti bunga jantan dan betina tidak dalam satu bunga tetapi masih dihasilkan dalam satu pohon. Rasio bunga jantan terhadap bunga betina dapat dipengaruhi oleh keadaan iklim. Tanaman yang mengalami kekeringan maka bunga jantan yang mendominasi. Sementara itu pada musim hujan bunga betina yang mendominasi. Waktu pematangan bunga jantan dan betina terjadi pada waktu yang berbeda. Semua ketiak daun kelapa sawit pada dasarnya menghasilkan bakal karang bunga, tetapi sebagian mengalami aborsi pada stadium dini sehingga tidak semua ketiak daun menghasilkan bunga. Waktu yang dibutuhkan semenjak terbentuk bakal karangan bunga sampai terlihat karangan bunga adalah 20 bulan. Selanjutnya waktu yang dibutuhkan sampai pematangan bunga sekitar 33-34 bulan (Mangoensoekarjo dan Semangun 2005). Tanaman kelapa sawit bisa dilihat pada Gambar 1.
Prokduktivitas kebun kelapa sawit di Indonesia tergolong rendah, rata-rata nasional hanya mencapai sekitar 20.25 ton
TBS/ha/tahun. Walaupun Indonesia merupakan penghasil kelapa sawit terbesar, ternyata produktivitasnya masih rendah dibandingkan dengan Malaysia. Produksi nasional Indonesia hanya sekitar 15 ton TBS/ha/tahun sedangkan produktivitas Malaysia mencapai 25 ton TBS/ha/tahun pada tahun 2007 (Santoso et al. 2009). Indonesia menjadi penghasil kelapa sawit terbesar karena luas perkebunan kelapa sawitnya.
Parameter utama yang dipakai dalam menentukan produktivitas tanaman termasuk kelapa sawit adalah jumlah buah atau berat TBS. Rendahnya produktivitas kelapa sawit Indonesia salah satunya disebabkan karena adanya cekaman kekeringan. Cekaman kekeringan dapat menurunkan produktivitas kelapa sawit sebanyak 10-40%.
Gambar 1 Tanaman kelapa sawit.
Promoter
Gen memiliki promoter khusus yang akan menentukan dimana gen akan melakukan fungsinya. Skema promoter dapat dilihat pada Gambar 2. Promoter terletak di depan sebuah gen sebelum kodon (tiga pasang basa) pemula ATG yang mengkode asam amino metionin.
Promoter gen adalah urutan DNA spesifik yang berperan mengendalikan transkripsi gen struktural dan terletak di sebelah hulu (upsteam) dari bagian struktural suatu gen. Bagian promoter menjadi tempat awal pelekatan enzim RNA polymerase yang melakukan transkripsi bagian struktural (Yuwono 2005). Promoter terdiri atas daerah kecil yang memiliki urutan basa-N dengan nama TATA-box. TATA-box adalah bagian DNA yang mengandung banyak basa timin dan adenin dan berada pada bagian upstream
dan dilokasikan pada -10 dan -35 bp upstream
(Murray et al. 2003).
belakang promoter sehingga akan terekspresi pada organ tertentu. Peristiwa itu dikarenakan promoter mempunyai aktivitas spesifik pada jaringan atau organ spesifik. Salah satu aktivitasnya adalah dalam hal pengkontrolan ekspresi toksin pada jaringan atau organ spesifik. Kakao gen homolog dari Arabidopsis
berpengaruh baik pada koregulasi inisiasi pembungaan dan berpengaruh juga pada determinasi identitas dari sepal dan petal (Chaidamsari et al. 2006).
Fungsi promoter mengalami perkembangan yang sangat pesat di bidang bioteknologi. Peneliti tinggal memilih promoter yang bekerja di bagian mana yang akan digunakan sebagai alur penelitian untuk mempelajari fungsi suatu gen melalui teknik over-ekspresi atau antisense. Promoter yang bekerja secara konstitutif dapat digunakan untuk penelitian yang bertujuan mengetahui efek penampakan pada seluruh bagian organ tanaman karena dapat terekspresi dimana pun. Namun, bila ingin melihat efek penampakan pada suatu organ tertentu sebaiknya memilih promoter spesifik yang hanya bekerja pada jaringan atau organ tertentu.
Gambar 2 Skema promoter (Edward 2011).
Gen AGAMOUS dan AGAMOUS-LIKE
Pembungaan merupakan hal yang vital dalam produktivitas tanaman. Pembungaan dipengaruhi oleh faktor endogen dan faktor eksogen. Faktor endogen terdiri atas umur tanaman, kandungan, hormon, dan sukrosa. Faktor eksogen (lingkungan) yang dapat mempengaruhi pembungaan adalah itensitas cahaya, temperatur, dan cekaman. Salah satu cekaman yang mempengaruhi proses pembungaan adalah cekaman kekeringan. Cekaman kekeringan dapat menurunkan produktivitas dari kelapa sawit. Pengaruh cekaman kekeringan secara fisiologis adalah menurunnya sex-rasio, jumlah bunga betina per total bunga menurun sehingga akhirnya dapat menurunkan produksi TBS tanaman. Peningkatan produksi kelapa sawit dimungkinkan dapat dilakukan dengan peningkatan ekspresi gen homeotik yang terkait dengan diferensiasi seksual bunga sawit (Santoso et al. 2009).
Karakteristik awal dari gen kakao dan kelapa sawit yang mengkode faktor transkripsi dari kelas MADSBOX diperkirakan
mempengaruhi regulasi waktu pembungaan dan pembentukan bunga. APETALA1 (TcAP1) kakao gen homolog dari Arabidopsis
berpengaruh positif terhadap koregulasi pada inisiasi pembungaan dan determinasi identitas dua kelopak bagian luar dari organ pembungaan misalnya saja sepal dan petal. Homolog kakao dari AGAMOUSArabidopsis (TcAG) mempengaruhi pembentukan kelopak bagian dalam organ pembungaan yaitu tangkai sari dan ovarium (Chaidamsari et al. 2006).
Gen AGAMOUS termasuk dalam keluarga gen MADS-Box yang diperlukan dalam pembentukan identitas bunga (Bao et al.
2004). Arabidopsis AGAMOUS (AG) diperlukan untuk perkembangan bunga terutama pada bagian stamen dan karpel (Bowman et al. 1989; Yanofsky 1990). Karpel merupakan bagian penting dari bunga terutama untuk reproduksi seksual tanaman karena menjadi wadah dari ovul yang kemudian berkembang menjadi buah yang berfungsi untuk melindungi dan memberi nutrisi pada biji. Gen yang berperan dalam mengontrol pembentukan stamen dan karpel ini, ekspresinya dapat ditekan oleh gen lain yaitu gen BELLRINGER (BELL) sehingga pengaruh dari gen AG dalam pembentukan meristem bunga dan inflorensia menjadi terhambat (Bao et al. 2004). Selain itu over ekspresi gen LEAFY juga dapat menekan ekspresi dari gen AGAMOUS. Chaidamsari et al. (2006) melaporkan bahwa kloning dari cDNA encoding TcAG (homolog AG pada kokoa) telah diekspresikan pada stamen dan ovari, yang dibandingkan dengan AG pada
Arabidopsis. TcAG selalu diekspresikan pada dinding buah (sebagian kecil) selama perkembangan. Hal itu sesuai dengan model ABC gen.
Model ABC memiliki tiga aktifitas (fungsi homeotik) yaitu A, B, dan C. Gen-gen tersebut akan terekspresi pada organ bunga. Ekspresi fungsi A sendiri spesifik pada formasi sepal. Kombinasi dari fungsi A dan B terekspresi spesifik pada perkembangan petal, dan kombinasi fungsi B dan C menghasilkan formasi stamen. Ekspresi fungsi C sendiri adalah perkembangan karpel. Perkembangan selanjutnya disimpulkan fungsi D spesifik pada indentitas ovul dalam karpel. Terjadi penambahan dalam grup organ pembungaan lagi adalah fungsi E. Fungsi E akan spesifik pada petal, stamen, dan karpel (Adam et al.
2007). Gen yang termasuk dalam fungsi ABC misalnya APETALA2, AG, AGL, LFY dan lainnya yang termasuk dalam MADS box. Gen yang termasuk fungsi E misalnya AGL2.
4
Gen AG2 dan AGL2 terindikasi diekspresikan secara spesifik pada ovul dari bunga betina dan tidak pada bunga jantan. Kedua gen memerankan fungsi C, D, dan E. kelapa sawit memiliki lima kelompok gen. Adam et al (2007) menyatakan bahwa gen yang terlibat dalam organ pembungaan individu kelapa sawit terdiri atas lima gen. Gen yang terindikasi terekpresi pada bunga betina adalah Elaeis guineensis AGAMOUS 2
(EgAG2) dan Elaeis guineensis AGAMOUS-LIKE 2 (EgAGL2). Gen EgAG2 termasuk fungsi C dan atau D. Gen EgAGL2 sendiri termasuk fungsi E. Gen EgAG2 terekspresi pada semua whorls muda pada bunga jantan, dan ekspresi bunga betina pada ovul atau primordial karpel. Ekspresi gen EgAGL2 pada petal dan stamen untuk bunga jantan, sedangkan pada bunga betina ekspresinya pada petal dan primordial ovul. Pola ekspresi dari kedua gen tersebut dapat dilihat pada Tabel 1. Ekspresi kedua gen tersebut dapat dipengaruhi oleh cekaman kekeringan.
Peluasan kebun kelapa sawit dilakukan pada daerah yang memiliki curah hujan
rendah. Selain itu, sekarang ini juga terjadi pemanasan global sehingga cekaman kekeringan sering terjadi. Cekaman kekeringan mampu menurunkan produktivitas kelapa sawit karena dapat menurunkan sex-rasio, yaitu menurunnya jumlah bunga betina. Penurunan jumlah bunga betina akan mengakibatkan produksi TBS menurun. Hal tersebut dapat diatasi dengan menyisipkan promoter gen yang termasuk dalam MADSBOX. Gen tersebut adalah EgAG2 dan
EgAGL2. Keberadaan promoter diharapkan dapat mengaktifkan kedua gen tersebut sehingga dapat tereskpresi dengan baik. Pengaruh cekaman kekeringan terhadap pembungaan kelapa sawit dapat dilihat pada Gambar 3. Cekaman kekeringan dapat mempengaruhi fotosintesis sehingga hasilnya berupa sukrosa juga terpengaruh. Sukrosa dapat berpengaruh pada pembungaan yaitu mempengaruhi dari gen yang terdapat pada MADSBOX yaitu EgAG2 dan EgAGL2. Kedua gen ini dapat mempengaruhi diferensiasi seksual tanaman kelapa sawit dan keduanya dapat diaktifkan oleh promoter.
Tabel 1 Pola ekspresi lima gen MADSBOX kelapa sawit dan fenotipe dari ekspresi ektopiknya
Sumber : Santoso et al. 2009.
Gambar 3 Alur pengaruh cekaman kekeringan (H2O) terhadap diferensiasi seksual tanaman kelapa
sawit (derivasi dari Blazquez 2000).
Pertumbuhan vegetatif
Pertumbuhan reproduksi
Buah
Bunga
Jantan
Betina
Transkripsi
Tembakau
Tembakau (Nicotiana tabacum) merupakan tanaman perkebunan atau industri berupa semak semusim yang berasal dari Amerika Tengah dan Amerika Selatan, yang selanjutnya tersebar ke Eropa dan Virginia (Amerika Utara). Tembakau tumbuh pada daerah dengan ketinggian 200-3000 dpl yang bercurah hujan 2000 mm/tahun (untuk daratan rendah) dan 1500-3500 mm/tahun (untuk daratan tinggi). Tanaman tembakau memiliki tinggi 1-3 m dengan batang tak bercabang. Daun dan batangnya berwarna hijau dan ditutupi oleh rambut bersel banyak, berkelenjar, dan rekat. Daun tersusun spiral dan berjumlah 20-35 daun per tanaman. Bunga berbentuk malai dan muncul di ujung batang. Satu buah tembakau mengandung 2000-2500 biji yang berukuran sangat kecil dan berwarna cerah sampai coklat gelap. Syarat tembakau dapat tumbuh, diantaranya suhu optimum pertumbuhan 21-27oC, penanamannya memerlukan tanah liat ringan sampai sedang dengan kapasitas penahanan air yang baik dan sedikit asam (pH 5.6) (Vossen dan Wessel 2000).
Kultur Jaringan
Kultur jaringan tanaman terdiri atas sejumlah teknik untuk menumbuhkan organ, jaringan, dan sel tanaman. Jaringan dapat dikultur pada media agar padat atau dalam medium hara cair. Jika ditanam dalam agar, jaringan akan membentuk kalus, yaitu massa atau sel-sel yang tidak tertata. Kultur agar juga merupakan teknik untuk meristem dan juga mempelajari organogenesis. Teknik kultur jaringan berkembang pada tahun 1900-an y1900-ang dimulai deng1900-an kultur akar oleh Kotte dan Robbins. Kultur jaringan atau in vitro
dapat menyediakan banyak tanaman dalam waktu singkat serta bebas cendawan dan bakteri. Tahun 2000-an penggunaan kultur jaringan tidak sebatas untuk memperbanyak tanaman tetapi lebih luas lagi yaitu digunakan untuk memfasilitasi kegiatan transformasi gen, hibridisasi somatik, metabolik sekunder, tanaman haploid, dan lain-lain.
Teknik kultur jaringan didasari oleh konsep totipotensi. Sel tumbuhan memiliki sifat totipotensi, yaitu tidak hanya dari sel perkembangbiakan, tetapi dapat juga dari sel akar, daun, batang, dan sel tumbuhan lainnya. Semua sel tersebut dapat ditumbuhkan menjadi individu tanaman yang lengkap dan memiliki sifat fenotipe yang sama dengan tetuanya. Berdasarkan sifat ini berkembang teknik kultur in vitro yang ditujukan untuk
perbanyakan klonal tanaman secara massal dalam waktu yang cepat (Nasir 2002).
Sel tanaman dapat dibiakkan atau dikultur secara aseptik pada atau dalam medium hara. Kutur umumnya dimulai dengan menanam satu iris jaringan steril pada medium hara yang dipadatkan oleh agar. Kalus akan terbentuk dalam kurun waktu 2-3 minggu. Kalus dapat disubkultur dengan cara memindahkan potongan kecil pada medium agar segar (Wetter dan Constabel 1991).
Kultur jaringan tanaman terbagi atas 4 tahap, yaitu tahap inisiasi, proliferasi tunas, perakaran, dan aklimasi. Tahap inisiasi mencakup persiapan eksplan, sterilisasi eksplan sampai mendapatkan eksplan yang bebas dari kontaminan. Tahap proliferasi tunas merupakan tahap pertumbuhan dan perkembangan tunas sehingga dihasilkan tunas yang sehat, steril, dan siap untuk dipindahkan ke media perakaran. Eksplan yang bertunas ditanam dalam media dengan zat pengatur tumbuh untuk menghasilkan akar pada tahap perakaran. Tanaman setelah berakar dipindahkan ke lingkungan eksternal yang sebelumnya diadaptasikan pada tahap aklimasi (Trigiano dan Gray 2000).
Eksplan adalah jaringan tanaman yang masih muda karena selnya masih aktif membelah sehingga daya regenerasinya tinggi. Jaringan yang telah tua lebih sulit beregenerasi karena sebagian besar selnya sudah tidak aktif membelah. Bagian tanaman yang digunakan sebagai eksplan adalah biji atau bagian tanaman lain misalnya kotiledon, tunas pucuk, potongan batang, potongan akar, potongan daun, dan bagian bunga (Chairunisa 2008). Eksplan yang digunakan pada penelitian ini adalah potongan daun tembakau. Pertumbuhan eksplan dalam media kultur dipengaruhi oleh beberapa faktor, seperti umur eksplan, sumber eksplan, ukuran eksplan, dan kepadatan inokulum. Ukuran yang terlalu kecil mempengaruhi kualitas hidup pada media kultur, sedangkan bila terlalu besar akan menyulitkan sterilisasi dan proses manipulasi genetik. Jumlah yang terlalu banyak juga menyebabkan penurunan dalam berdiferensiasi karena persaingan dalam memperoleh nutrisi (Pambudi 2009).
6
dilakukan manipulasi genetik. Kelemahan dari teknik ini adalah dibutuhkan dana untuk pengadaan laboratorium dan bahan kimia, dibutuhkan keahlian khusus, tanaman yang dihasilkan berukuran kecil, steril, dan perlu aklimatisasi ke lingkungan eksternal (Yusnita 2004).
Transformasi genetik melalui A. tumefaciens
Transformasi genetik merupakan salah satu metode yang dimanfaatkan untuk mempelajari regulasi gen, identifikasi fungsi gen, menguji metabolisme, mempelajari fisiologi serta perkembangan tanaman. Teknologi transformasi genetik pada tanaman telah banyak berkembang dengan memanfaatkan beberapa metode transformasi. Transformasi genetik dapat dilakukan dengan berbagai metode di antaranya elektroporasi,
polyethylene glycol, penggunakan serat silicon carbide, penembakan partikel DNA, dan melalui perantara Agrobacterium tumefaciens
(Belarmino dan Mii 2000).
Metode transfer gen pada tanaman yang banyak digunakan adalah dengan vektor
Agrobacterium. Metode ini dianggap lebih murah dan efektif, karena prinsipnya gen
interest disisipkan ke plasmid T-DNA
Agrobacterium kemudian diinokulasi ke jaringan target yang telah dilukai. Oleh sebab itu, bila melakukan transformasi dengan perantara Agrobacterium maka tanaman eksplan yang digunakan harus dilukai misalnya dengan cara dipotong. Transformasi tersebut dapat menimbulkan gejala tumor yang dikenal dengan crown gall tumor yang merupakan penyakit penting pada tanaman dikotil. Gejala itu merupakan efek dari masuknya bagian tertentu dari bakteri. Bagian tersebut adalah T-DNA (transfer DNA) yang ditransfer dari plasmid-Ti sel bakteri ke genom sel tanaman yang selanjutnya berinteraksi dan diekspresikan menjadi tumor
crowngall.
A. tumefaciens merupakan bakteri gram negatif yang terdapat di tanah. Agrobacterium
mempunyai dua spesies yang bersifat patogen, yaitu A. tumefaciens sebagai penyebab penyakit tumor (crown gall) dan A. rhizogenes yang menyebabkan penyakit rambut akar (harry root) pada berbagai tanaman dikotil. A. tumefaciens secara alami melakukan tranformasi ke dalam sel-sel tanaman. Koloni A. tumefaciens pada tembakau dapat dilihat pada Gambar 4.
Gen asing dapat disisipkan ke dalam plasmid Ti dengan menggunakan teknik DNA
rekombinan. Plasmid rekombinan ditransformasikan ke A. tumefaciens yang dapat digunakan untuk menginfeksi sel tumbuhan. Plasmid rekombinan akan menyelipkan dirinya ke dalam kromosom tumbuhan. Hal ini memungkinkan menghasilkan tumbuhan yang mengandung dan mengekspresikan gen asing yang dapat diwariskan ke keturunannya. Plasmid Ti ditemukan pada semua galur A. tumefaciens
virulen, berukuran sekitar 200-250 kb, dan stabil pada temparatur di bawah 30oC.
Agrobacterium memiliki tiga komponen genetik yang dapat menginfeksi tanaman. Komponen pertama adalah T-DNA yaitu fragmen yang ditransfer ke sel tanaman yang terletak pada plasmid Ti dari Agrobacterium.
Komponen yang kedua adalah virulence (vir) region, vir akan berekspresi jika terdapat
inducer yang berupa senyawa monosiklik fenolik seperti acetosyringone serta monosakarida seperti glukosa dan galaktosa. Oleh karena itu, media kokultivasi selalu ditambahkan acetosyringone untuk meningkatkan daya infeksi bakteri pada sel-sel eksplan. Oleh karena itu, saat melakukan transformasi perlu ditambahkan
acetosyringone. Komponen ketiga yaitu
chromosomal virulence yang terdapat pada kromosom Agrobacterium. Chromosomal virulence berfungsi dalam pelekatan bakteri pada sel tanaman dengan membentuk senyawa
protein β-1,2 glukan (Sheng dan Citovcky 1996).
Ketiga komponen tersebut membuat
Agrobacterium mampu masuk ke nukleus serta berinteraksi dalam kromosom tanaman. Hal tersebut yang dimanfaatkan para peneliti untuk melakukan transformasi dengan
Agrobacterium. Selain itu, transformasi dengan Agrobacterium memiliki jumlah salinan gen yang relatif sedikit dalam kromosom sehingga dapat mengurangi kemungkinan terganggunya fungsi gen lain. Keuntungan lainnya adalah mampu mentransfer segmen DNA yang relatif besar dan menghasilkan tanaman transgenik yang memiliki fertilitas tinggi (Maftuchah 2007).
Kemampuan T-DNA untuk mentransfer DNA ke organisme eukariotik dan gen yang berada pada T-DNA dapat digantikan dengan gen apa saja, menjadikan A. tumefaciens
sebagai vektor yang ideal untuk transfer gen ke suatu organisme eukariotik, seperti tanaman untuk menghasilkan suatu tanaman transgenik dan fungi (Tzfira dan Citovsky 2003). Hal itu membuat A. tumefaciens
Gambar 4 Koloni A. tumefaciens pada daun tembakau (bar = 1 µm).
Polymerase Chain Reaction (PCR)
Polymerase Chain Reaction (PCR) adalah teknik penggandaan molekul DNA secara in vitro melibatkan penggunaan bagian kecil dari pasangan komplementer DNA yang akan disintesis (primer) dan DNA polimerase. Reaksi PCR sangat sensitif, dengan menggunakan DNA cetakan dalam jumlah kecil dapat menggandakan sampai lebih dari sejuta kali sehingga menghasilkan DNA dalam jumlah yang sangat besar (Jonas 2003). Metode ini pertama kali dikembangkan pada tahun 1985 oleh Kary B. Mullis dan sekarang telah banyak digunakan untuk berbagai macam manipulasi dan analisis genetik (Yuwono 2006). Kary Mullis merupakan peraih nobel di bidang biokimia pada tahun 1984 yang berdasarkan pada penemuannya mendapatkan adanya aktivitas biologi dari DNA polimerase pada suhu tinggi dalam
thermophiles (bakteri yang hidup pada sumber air panas).
Beberapa komponen pereaksi dalam proses PCR memiliki fungsi khusus, yaitu Taq
DNA polimerase, cetakan DNA, oligonukleotida primer, deoxynucleotide triphosphate (dNTP), dan larutan bufer. Taq
DNA polimerase merupakan enzim yang tahan panas dan diisolasi dari bakteri termofilik Thermus aquaticus. Fungsi dari enzim ini adalah mengkatalisis proses PCR. Primer merupakan oligonukleotida yang menempel pada daerah spesifik yang diinginkan. Oligonukleotida yang digunakan sebagai primer paling sedikit merupakan gabungan dari 16 pasang basa, disarankan menggunakan 20-24 pasang basa. Primer yang terlalu pendek tidak menempel secara spesifik sehingga akan terjadi penggandaan pada
daerah yang tidak spesifik. Namun, bila primer yang terlalu panjang akan sulit untuk menempel pada cetakan DNA sehingga amplifikasi tidak terjadi. Keberadaan dNTP dan konsentrasi larutan bufer dalam reaksi PCR, dapat mempengaruhi spesifitas amplikon. Reaksi PCR membutuhkan suatu bufer yang mengandung MgCl2 karena
aktivitas enzim polimerase dipengaruhi oleh konsentrasi ion Mg2+. Ion Mg2+ akan menyetimulasi aktivitas enzim secara maksimal pada konsentrasi 2 mM jika konsentrasinya lebih tinggi, maka dapat bersifat inhibitor (Sambrook dan Russell 2001).
Proses PCR berlangsung dalam beberapa siklus. Kisaran siklus optimum dalam proses PCR adalah 30-35 siklus, bergantung pada enzim polimerase, jumlah cetakan, dan sebagainnya. Enzim polimerase tidak aktif pada suhu tinggi, maka pada tiap siklus reaksi harus ditambahkan enzim polimerase. Selain itu, banyaknya siklus amplifikasi tergantung juga pada konsentrasi DNA target di dalam campuran reaksi. Sedikitnya diperlukan 25 siklus untuk melipatgandakan satu kopi sekuen DNA target di dalam genom mamalia agar hasilnya dapat dilihat secara langsung, misalnya dengan elektroforesis gel agarosa (Sambrook et al. 1989).
Teknik PCR dapat digunakan untuk analisis maupun untuk sintesis nukleotida. Salah satu kegunaan PCR adalah untuk identifikasi suatu gen atau DNA yang spesifik. Identifikasi keberadaan suatu gen dapat dilakukan dengan mudah bila daerah pengapit (flanking region) telah diketahui. Daerah pengapit yang spesifik ini digunakan sebagai primer. Penggunaan PCR untuk identifikasi adanya suatu pathogen penyebab suatu penyakit telah banyak dilakukan, seperti hepatitis B, TBC, AIDS, atau kelainan lainnya. Perbanyakan gen untuk berbagai keperluan, pengurutan DNA, ataupun kajian keragaman molekuler dapat pula dilakukan dengan PCR (Suharsono 2000).
8
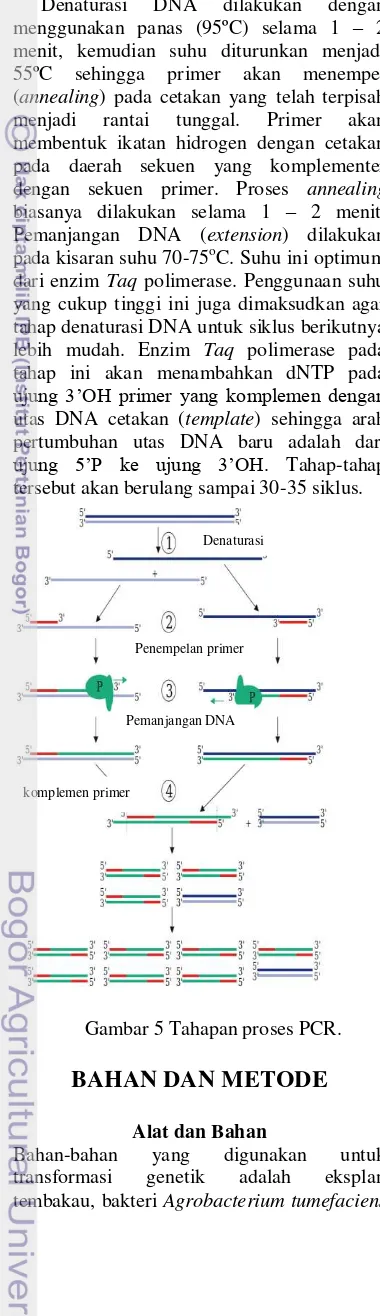
rangkaian komplementernya dan pemanjangan primer yang sudah menyatu itu dengan DNA polimerase, akan menghasilkan amplifikasi eksponensial segmen DNA dengan panjang tertentu (no 4) (Murray et al. 2003).
Denaturasi DNA dilakukan dengan menggunakan panas (95ºC) selama 1 – 2 menit, kemudian suhu diturunkan menjadi 55ºC sehingga primer akan menempel (annealing) pada cetakan yang telah terpisah menjadi rantai tunggal. Primer akan membentuk ikatan hidrogen dengan cetakan pada daerah sekuen yang komplementer dengan sekuen primer. Proses annealing
biasanya dilakukan selama 1 – 2 menit. Pemanjangan DNA (extension) dilakukan pada kisaran suhu 70-75oC. Suhu ini optimum dari enzim Taq polimerase. Penggunaan suhu yang cukup tinggi ini juga dimaksudkan agar tahap denaturasi DNA untuk siklus berikutnya lebih mudah. Enzim Taq polimerase pada tahap ini akan menambahkan dNTP pada
ujung 3’OH primer yang komplemen dengan
utas DNA cetakan (template) sehingga arah pertumbuhan utas DNA baru adalah dari
ujung 5’P ke ujung 3’OH. Tahap-tahap tersebut akan berulang sampai 30-35 siklus.
Gambar 5 Tahapan proses PCR.
BAHAN DAN METODE
Alat dan Bahan
Bahan-bahan yang digunakan untuk transformasi genetik adalah eksplan tembakau, bakteri Agrobacterium tumefaciens
pEgAG dan pEgAGL2, garam-garam makro dan mikro yang terkandung dalam media MS (Murashige & Skoog), gula pasir 3%, vitamin B5, agar 0,8%, BAP (benzil amino purin) yang merupakan hormon pertumbuhan 0,5 ppm, acetosyringone, kanamisin, cefotaxime,
media LB (Tripton 10 mg/L, Yeast extract 5 g/L, NaCl 5 g/L),dan akuades. Bahan-bahan yang digunakan untuk isolasi DNA yaitu planlet tembakau in vitro putative transgenik yang mengandung promoter EgAG dan
EgAGL2, nitrogen cair, β-merkaptoetanol, CTAB (Cetyl trimethylammonium bromide) 10%, buffer Tris-HCl 1 M pH 8.0, EDTA (ethylene diamine tetraacetate) 0.5 M pH 8.0, isopropanol, etanol absolut, larutan kloroform:isoamilalkohol (24:1), Sodium asetat 3 M pH 5.2, NaCl 5 M, etanol 70%, dan
Molecular Water (MW). Bahan-bahan untuk PCR terdiri dari complete buffer, dNTPs, primer nptII forward dan reverse, dan taq polymerase. Bahan-bahan untuk elektroforesis yaitu agarose, loading buffer, Ethidium bromide 1% (w/v), bufer TBE (Tris Borate EDTA) 0.5×, dan marker 1 kb DNA ladder plus.
Alat-alat yang digunakan dalam proses transformasi adalah Laminar Air Flow Cabinet, pH meter, neraca analitik digital,
shaker incubator, autoklaf, cawan petri, botol kultur, kertas saring, Sentrifus Beckmann Allegra 64R, skalpel, pinset, dan peralatan gelas. Peralatan yang digunakan untuk isolasi DNA adalah mortar, lumpang, microtubes,
waterbath, neraca analitik digital, ruang asam,
microcentrifuge Eppendorf 5417R, DNA
speed vacum 110 savant, dan pipet mikro. Sedangkan alat yang digunakan untuk elektroforesis dan amplifikasi adalah perangkat elektroforesis, cetakan gel agarose, sisir, transluminator ultraviolet (UV) T2201 (Sigma), gel doc, mesin PCR (ESCO Swift max), dan pipet mikro.
Metode Penelitian
Sterilisasi Alat dan Bahan
Sterilisasi alat dan bahan merupakan salah satu tahapan yang penting dalam proses kultur jaringan dan transformasi genetik. Sterilisasi dilakukan dengan cara autoklaf selama 15 menit pada suhu 121oC dengan tekanan 1 atm. Peralatan gelas yang diautoklaf dalam penelitian ini antara lain botol kultur, pinset, skalpel, cawan petri, dan Erlenmeyer. Bahan-bahan penunjang lain yang juga diautoklaf antara lain kertas saring, tissue, aquades, media MS, dan media LB. Sterilisasi Laminar
Denaturasi
Penempelan primer
Pemanjangan DNA
Air Flow Cabinet dilakukan dengan cara menyalakan lampu UV minimal selama 15 menit kemudian disemprot dengan alkohol teknis dan dilap dengan tisu.
Peremajaan A. tumefaciens yang mengandung Promoter EgAG2 dan
EgAGL2
Bakteri A. tumefaciens pEgAG2 dan pEgAGL2 diambil dari stok gliserol. Bakteri selanjutnya digoreskan pada media LA (Luria Agar) yang mengandung antibiotik kanamisin 50 ppm dan rifampisin 50 ppm. Kultur kemudian diinkubasi pada inkubator selama 1-2 hari pada suhu 1-28oC dalam kondisi gelap hingga tumbuh koloni bakteri. Koloni yang telah tumbuh disimpan pada suhu 4oC.
Transformasi Genetik melalui A. tumefaciens
A. tumefaciens pEgAG2 dan pEgAGL2
dikulturkan ke dalam 10 mL LB yang telah ditambahkan kanamisin dan rimpafisin masing-masing 50 ppm. Campuran dikocok pada shaker incubator selama 1- 2 hari pada suhu 28oC dalam kondisi gelap. Sebanyak 1 mL kultur diencerkan dengan 24 mL media LB (Lurian Broth) tanpa antibiotik. Selanjutnya dikocok kembali selama 60 menit pada kondisi yang sama hingga Optical Density pada panjang gelombang 600 nm (OD600) mencapai 0.2-0.3. Suspensi bakteri
kemudian disentrifugasi dengan kecepatan 3.000 rpm selama 10 menit. Pelet diresuspensikan dengan 20 mL MS cair yang mengandung acetosyringone 200 M. Eksplan tembakau ukuran 0.5 cm2 dimasukkan ke dalam suspensi bakteri dan diinokulasi selama 15 menit pada 75 rpm, suhu 28oC dalam kondisi gelap. Suspensi dibuang dan dicuci dengan MS yang telah ditambahkan cefotaxime 250 ppm. Eksplan kemudian ditiriskan pada cawan petri berisi tisu steril. Selanjutnya eksplan dipindahkan ke media induksi tunas yang mengandung
acetosyringone yang telah dilapisi kertas saring, kemudian eksplan diinkubasi semalam dalam ruang kultur suhu 23-25oC dalam kondisi gelap. Eksplan kemudian dipindahkan ke media induksi tunas yang mengandung
cefotaxime dan diinkubasi selama 5 hari dalam ruang kultur suhu 23-25oC ,kondisi terang (menggunakan penyinaran lampu) dengan waktu penerangan 16 jam terang. Setelah 5 hari eksplan dipindahkan ke media induksi tunas yang mengandung kanamisin 50 ppm dan cefotaxime 250 ppm (media seleksi). Seminggu sekali medianya diganti.
Regenerasi Tanaman Transgenik
Eksplan tembakau yang telah bertunas disubkultur dan dipertahankan di dalam media seleksi (media MS yang mengandung kanamisin) tanpa hormon tumbuh untuk selanjutnya diregenerasikan menjadi planlet dan siap untuk diaklimatisasi.
Isolasi DNA dengan Metode Castillo
Planlet tembakau in vitro kemudian dipilih untuk diisolasi DNA. Sebanyak 100-200 mg sampel planlet tembakau digerus dalam nitrogen cair (N2 cair). Kemudian
dimasukkan ke dalam tabung sentrifuse berisi buffer ekstraksi bufer ekstraksi (1 M Tris-HCl, 0.5 M EDTA, 5 M NaCl, 10% CTAB, dan akuades steril) hangat (60-65oC) sebanyak 1 mL dan 10 µL β-merkaptoetanol 1% lalu divortex. Buffer TE harus dalam keadaan hangat karena proses pemecahan sel dengan CTAB akan aktif pada suhu 60ºC sehingga bufer ekstraksi harus dipanaskan dahulu pada suhu 60ºC. Sampel diinkubasi selama 30 menit pada 65oC. Selanjutnya didiamkan pada suhu ruang dan ditambahkan larutan campuran kloroform:isoamilalkohol (24:1), lalu divortex. Sampel disentrifugasi dengan kecepatan 11.000 rpm selama 10 menit. Lapisan atas diambil kemudian ditambahkan kembali dengan kloroform isoamilalkohol lalu disentrifugasi kembali dalam kondisi yang sama. Supernatan ditambahkan isopropanol dingin sebanyak 1 volume dan diinkubasi pada 4oC selama 30 menit. Kemudian disentrifugasi selama 10 menit dengan kecepatan 11.000 rpm. Pelet dikeringkan dan dilarutkan dengan 500 µ L buffer TE, kemudian ditambahkan Natrium asetat sebanyak 1/10 volume, dan etanol absolut sebanyak 2 volume. Campuran diinkubasi pada -20oC selama 30 menit atau overnight
(selama 16 jam). Selanjutnya campuran disentrifugasi selama 10 menit pada 12.000 rpm. Pelet/DNA dicuci dengan etanol 70 % dan dikering anginkan. Pelet dilarutkan dalam buffer TE (Tris-EDTA) atau MW. Pelet dilarutkan pada buffer TE jika DNA yang diperoleh ingin disimpan, sedangkan bila DNA ingin segera digunakan dilarutkan dengan MW. DNA yang diperoleh kemudian dianalisis secara kualitatif dengan elektroforesis pada gel agarosa 1%.
Polymerase Chain Reaction (PCR)
10
denaturasi pada suhu 94oC selama 30 detik,
annealing pada suhu 45oC selama 30 detik, pemanjangan pada suhu 72oC selama 2 menit dengan ulangan sebanyak 35 siklus. Untuk campuran reaksi PCR sebanyak 1µL DNA (template) dimasukkan ke dalam microtube
0.2 mL, kemudian ditambahkan 2.5 µL buffer
complete (buffer yang telah mengandung MgCl2), masing-masing sebanyak 1µL primer
nptII forward dan reverse, 1 µ L dNTPs, 0.5 µL Taq polymerase dan 18 µ l MW hingga volume total reaksi 25 µL. Campuran kemudian dimasukkan ke dalam mesin PCR. Produk PCR dielektroforesis pada gel agarose 1% dan didokumentasikan menggunakan gel doc.
HASIL DAN PEMBAHASAN
Tembakau Awal Transformasi Promoter gen EgAG2 dan EgAGL2
sebelumnya telah berhasil diisolasi, dikarekterisasi, dan diklon. Promoter gen
EgAGL2 diujikan ke tanaman model untuk mengamati regenerasi dari tanaman yang telah diklon promoter gen EgAG2 dan EgAGL2, dalam hal ini tanaman yang dipakai adalah tembakau. Tanaman tembakau dipakai sebagai tanaman model karena beberapa alasan yaitu daur hidupnya relatif singkat, kultur jaringannya telah banyak diketahui, dan telah banyak digunakan untuk penelitian molekuler. Hal itu telah memenuhi syarat dari tanaman model, yaitu cepat dan mudah regenerasinya, serta cepat untuk dilakukan transformasi. Tanaman tembakau yang digunakan sebagai eksplan dapat dilihat pada Gambar 6. Daun yang digunakan sebagai eksplan untuk transformasi adalah daun yang masih muda, yaitu daun kedua dan ketiga.
Planlet Pembawa Promoter Gen EgAG2
dan EgAGL2
Bagian yang memiliki peranan penting dalam perakitan tanaman transgenik adalah DNA rekombinan yang membawa konstruk gen. DNA rekombinan ini selain memiliki gen pembawa sifat unggul, bagian ini harus dilengkapi beberapa perangkat, diantaranya gen pembawa sifat ketahanan terhadap antibiotik tertentu sebagai agen penyeleksi. Antibiotik yang umum dipakai sebagai agen penyeleksi pada proses transformasi tanaman diantaranya kanamisin dan higromisin (dalam penelitian ini digunakan kanamisin). Tanaman transforman (yang membawa gen ketahanan terhadap antibiotik) dapat tumbuh dan berkembang pada media yang mengandung antibiotik tersebut. Namun, tanaman non transforman tidak dapat tumbuh pada media yang mengandung antibiotik tersebut (Minarsih et al. 1999). Tembakau yang ditransformasi dengan promoter gen EgAG2
dan EgAGL2 dapat tumbuh dan berkembang dengan baik pada media kultur jaringan yang mengandung antibiotik kanamisin. Hal itu ditunjukkan pada eksplan transforman promoter EgAGL2 yang dapat bertunas pada media yang mengandung kanamisin 50 ppm. Namun, eksplan tembakau non transforman tidak dapat bertunas dan menguning. Eksplan non transforman dan transforman promoter
EgAGL2 dapat dilihat pada Gambar 7. Eksplan hasil transformasi adalah eksplan yang diinokulasi A. tumefaciens pEgAG2 atau pEgAGL2. Eksplan ini ditumbuhkan pada media yang mengandung kanamisin. Media yang diberi kanamisin berfungsi sebagai salah satu cara seleksi eksplan hasil transformasi karena salah satu sifat tanaman transgenik adalah resisten terhadap antibiotik kanamisin sehingga tanaman mengandung promoter gen
EgAG2 dan EgAGL2 dapat tumbuh. Namun, tanaman yang tidak tersisipi promoter tersebut tidak dapat tumbuh bahkan mati.
Tidak hanya eksplan hasil transformasi, tetapi setiap transformasi disertai dengan eksplan non transforman yang ditanam pada media baik yang mengandung antibiotik (kontrol negatif) dan tidak mengandung antibiotik ketahanan (kontrol positif), keduanya sebagai pembanding. Eksplan tembakau kontrol positif ditumbuhkan pada media non kanamisin dapat tumbuh dan berkembang dengan baik. Namun, kontrol negatif tidak dapat tumbuh. Hal ini disebabkan gen eksplan non transforman tidak terintegrasi sehingga eksplan tidak dapat bertahan pada media seleksi tersebut. Gambar 6 Tanaman tembakau yang
Eksplan-eksplan kontrol negatif tidak dapat menginisiasi tunas dan lama-kelamaan menguning. Hal itu menunjukkan bahwa konsentrasi antibiotik kanamisin 50 ppm sudah cukup efektif untuk menghambat pertumbuhan eksplan tembakau. Eksplan kontrol positif dan kontrol negatif dapat dilihat pada Gambar 8. Oleh karena itu, kontrol negatif digunakan sebagai dosis letal antibiotik yang digunakan.
Gambar 8 Tanaman tembakau kontrol negatif (kiri) dan kontrol positif (kanan).
Hasil Isolasi DNA Daun Tembakau Isolasi DNA adalah langkah pertama manipulasi DNA secara in vitro. Isolasi DNA dari eksplan planlet tembakau in vitro dilakukan berdasarkan metode Castillo (1994). Prinsip isolasi DNA berdasarkan metode ini yaitu perusakan dinding sel (lisis) yang bertujuan membebaskan sitoplasma dan DNA dalam sel, pemisahan DNA dari bahan padat seperti selulosa dan protein, serta pemurnian DNA. Pemecahan sel dilakukan secara mekanis dengan teknik penggerusan.
Larutan CTAB 10% yang terdapat di dalam bufer ekstraksi juga berperan dalam pemecahan sel. Proses pemecahan sel dengan CTAB akan aktif pada suhu 60ºC sehingga bufer ekstraksi harus dipanaskan dahulu pada suhu 60ºC (Azizah 2009). Selain CTAB, detergen lain yang dapat digunakan untuk
proses lisis misalnya seperti Sodium Dodecil Sulfat (SDS) dan sarkosil, (Subandiyah 2006). Penambahan merkaptoetanol berfungsi menghambat enzim polifenol oksidase yang dapat mendegradasi rantai DNA dan menyebabkan teroksidasinya senyawa fenol. Merkaptoetanol mereduksi ikatan sulfida dari enzim tersebut. Penghilangan polifenol, polisakarida, dan komponen sel menggunakan pelarut organik seperti fenol dan kloroform. Larutan fenol atau campuran fenol-kloroform dapat mendenaturasi protein (Walker dan Wilson 2000). DNA yang telah diisolasi perlu dipekatkan biasanya dengan presipitasi etanol. Hasil uji kualitas DNA pada gel agarose terdapat pada Gambar 9. Keseluruhan sampel terlihat sebagai DNA pada satu garis dan tidak terlihat terjadinya degradasi. Hal itu dapat dilihat dari terdapatnya satu pita. DNA juga tidak terkontaminasi protein karena pita tidak
smear ke bawah. DNA terlihat tidak terkontaminasi dengan RNA. Berdasarkan gambar tersebut, pita DNA menunjukkan intensitas yang cukup tinggi, sehingga DNA dapat digunakan untuk tahapan selanjutnya.
Amplikon Gen NPTII
Keberhasilan transformasi ditandai dengan rangkaian gen yang diinduksikan ke tanaman mampu disisipkan ke genom tanaman, diekspresikan, dan tetap terpelihara dalam seluruh proses pembelahan sel berikutnya. Sel atau jaringan yang ditransformasikan harus dapat diregenerasikan menjadi tanaman (Herman 1996). Metode PCR memungkinkan analisis sampel dalam jumlah yang banyak dan dalam jangka waktu Gambar 7 Eksplan tembakau non
transforman (kiri) dan transforman promoter EgAGL2
(kanan).
Gambar 9 Elektroforegram DNA tembakau (A), kontrol positif, (B), kontrol negatif, (C), promoter EgAG2, dan (D), promoter EgAGL2.
12
singkat untuk mengetahui keberadaan gen yang telah diinduksi (Cassas et al. 1993)
Amplifikasi dilakukan dengan proses PCR menggunakan sepasang primer spesifik. Primer yang dipakai dalam proses PCR harus memenuhi beberapa syarat, diantaranya tidak komplemen satu sama lain sehingga memungkinkan terjadinya hibridisasi dan primer dimer, yang akan mengurangi produk PCR (Maier et al. 2009).
Primer spesifik perlu dioptimasi sebelum digunakan untuk mengamplifikasi fragmen gen NPTII. Parameter yang perlu dicoba adalah suhu annealing. Penentuan suhu
annealing dapat diperkirakan berdasarkan nilai Tm, yaitu 5ºC di bawah nilai Tm teoretis (Rybicki 2001), namun nilai Tm yang tepat biasanya diperoleh secara empiris (Darmawan 2004).
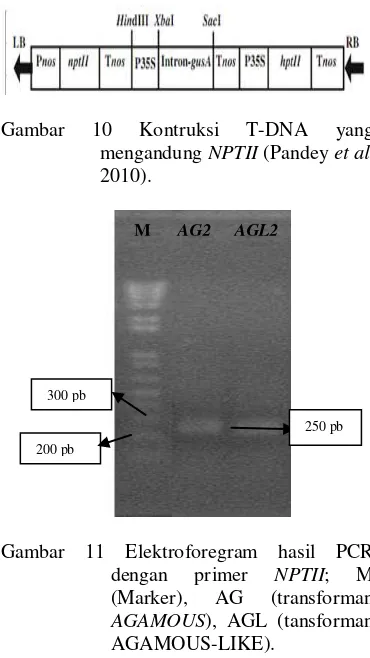
Primer yang digunakan adalah spesifik
NPTII. Hal itu dikarenakan T-DNA dari A. tumefaciens mengandung neomycin phosphotransferase (NPTII). Gen NPTII
merupakan marker seleksi yang mengkontrol Pnos (nopaline synthase promoter). NPTII ini terletak setelah T-Border (left) atau LB. konstruk yang mengandung NPTII dapat dilihat pada Gambar 10. Bila NPTII telah teramplifikasi berarti promoter gen EgAG2
dan EgAGL2 telah berhasil disisipkan. Dengan kata lain transformasi telah berhasil dilakukan. Primer yang digunakan adalah
NPTII forward dan NPTII reverse. Primer tersebut memiliki urutan basa sebagai berikut
‘forward’: 5’CTG AAT GAA CTG CAG
GAC GAG G 3’ dan reverse: 5’GCC AAC GCT ATG TCC TGA TAG C 3’ (Pandey et al. 2010).
Optimasi dilakukan dengan PCR gradien dengan suhu annealing sebesar 45, 50, 55, dan 60ºC. DNA yang digunakan sebagai cetakan yaitu DNA dari tanaman transgenik. Hasil visualisasi elektroforesis DNA memperlihatkan bahwa PCR dengan primer
NPTII forward dan NPTIIreverse pada suhu
annealing 50, 55, dan 65ºC tidak menghasilkan pita DNA. Optimasi pada suhu 45oC menghasilkan satu pita. Suhu annealing
optimum dipilih berdasarkan intensitas pita DNA yang paling tinggi, yaitu 45ºC. Suhu optimum ini digunakan untuk mengamplifikasi fragmen NPTII. Fragmen gen NPTII dari hasil amplifikasi pada suhu
annealing optimum (45ºC) dikonfirmasi dengan elektoforesis menggunakan gel agarosa 1% (Gambar 11). Hasil PCR menunjukkan adanya pita pada ukuran 250 pb. Gen ketahanan terhadap antibiotik kanamisin
juga telah berhasil teramplifikasi dengan primer NPTII. Gambar tersebut menunjukkan bahwa primer memang spesifik karena menghasilkan satu pita. Hal itu karena pada tembakau transforman ini DNA inti selnya telah terinsersi oleh gen NPTII dan terekspresi dengan baik, sehingga tunas tembakau transforman mensistesis enzim neomysin fosfotransferasi dan menjadikannya resisten terhadap antibiotik kanamisin.
Gambar 10 Kontruksi T-DNA yang mengandung NPTII (Pandey et al.
2010).
Gambar 11 Elektroforegram hasil PCR dengan primer NPTII; M (Marker), AG (transforman
AGAMOUS), AGL (tansforman AGAMOUS-LIKE).
Morfologi Tanaman Tembakau Promoter EgAG2 dan EgAGL2
terakumulasi masuk ke dalam genom tembakau, selanjutnya dilakukan pemeriksaan untuk menguji apakah promoter tersebut dapat mengaktifkan gen EgAG2 dan EgAGL2
sehingga kedua gen tersebut akan terekspresi pada sistem inang yang baru. Pengujian dapat dilakukan di tingkat molekuler, morfologi, atau kombinasi dari keduanya. Ekspresi dari gen EgAG2 dalam sel tanaman tembakau diharapkan bisa menghasilkan protein faktor transkripsi yang aktif sehingga mampu memberikan pengaruh positif terhadap perkembangan morfologi dari planlet yang mengekspresikannya. Hasil pengamatan tembakau transgenik, hasil transformasi
250 pb
200 pb 300 pb
promoter gen EgAG2 disajikan pada Gambar 12. Berdasarkan gambar tersebut menunjukkan bahwa tembakau tersebut memiliki beberapa variasi daun. Hal itu ditunjukkan dengan jumlah daun pada tanaman transforman promoter gen EgAG2
lebih sedikit dibandingkan kontrol. Selain itu, bentuk daunnya juga ada yang melipat sehingga terlihat seperti cacat dan ada yang berbentuk oval. Hal itu terjadi karena ekspresi
AGAMOUS yang berlebih dapat membunuh gen APETALLA (AP) sehingga gen LEAFY (LFY) tidak dapat dihidupkan. LFY merupakan gen pusat pembungaan karena LFY mati maka bunga menjadi cacat. Penelitian ini digunakan adalah promoter, diharapkan mempengaruh bunga tetapi tenyata daunnya juga menunjukkan cacat.
Hasil morfologi tanaman transgenik promoter gen EgAGL2 menunjukkan bahwa gen EgAGL2 dapat menghijaukan daun. Hal itu dapat dilihat sejak kuncup daun muda. Morfologi dari tanaman trangenik, hasil transformasi promoter EgAGL2 dapat dilihat pada Gambar 13. Daun dari tanaman transgenik tersebut memiliki daun yang lebih hijau dibandingkan tanaman kontrol maupun tanaman transgenik hasil transformasi promoter gen EgAG2. Gen AGAMOUS-LIKE
umumnya terdapat pada kulit buah dan memberi warna hijau pada kulit tersebut sehingga gen AGAMOUS-LIKE diindikasikan akan mempengaruhi klorofil. Hasil penelitian menunjukkan warna daun lebih hijau. Ini berarti promoter gen EgAGL2 berpengaruh pada klorofil.
Penampakan fenotipe yang terjadi pada tanaman transforman promoter gen EgAGL2
adalah bervariasi. Hal itu ditunjukkan dengan planlet tembakau yang memiliki daun yang sebagian hijau dan sebagian kuning. Hal itu kemungkinan karena ekspresi gen EgAGL2
pada level rendah atau tanaman bersifat kimera. Kimera terjadi jika gen yang ingin ditransformasi hanya masuk sebagian ke dalam genom tanaman. Tanaman yang bersifat kimera dapat dilihat pada Gambar 14. Namun, tanaman tersebut juga menunjukkan daun yang lebih hijau. Hal itu karena promoter gen EgAGL2 masuk sebagian sehingga ekspresinya juga hanya sebagian daun yang berdaun hijau dan yang lainnya berwarna kuning.
Perbedaan gen pembunggaan pada tanaman dikotil dan monokotil terletak pada namanya. Namun, fungsi dari gen tersebut memiliki persamaan. Contoh gen tersebut misalnya gen AGAMOUS-LIKE. Gen
AGAMOUS-LIKE (AGL) pada tanaman kelapa sawit memiliki homologi dengan Gen
SEPALLATA (SEP) pada A. thaliana (Adam
et al. 2006). Indikasi SEP berperan penting pada petal, stamen, dan menjadi indentitas carpel dari tanaman petunia dan tomat. Pada Petunia transgenik yang mengandung SEP3
yang memiliki ortholog dengan FLORAL BINDING PROTEIN2 (FBP5) yang menghasilkan identitas organ bunga pada whorls 2, 3, dan 4. SEP/FBP2 termasuk anggota subfamili FBP5 juga merupakan regulasi menurun. Berdasarkan fakta gen SEP
merupakan postulat berlebih dari fungsi spesifik petal, stamen, dan carpel. SEP
termasuk dalam kelas E. Dalam model ABCE, sepal spesifik dengan aktivitas A, petal dengan A+B+E, stamen oleh B+C+E, dan carpel C+E (Jack 2004).
Gambar 12 Morfologi tanaman tembakau hasil transformasi promoter
EgAG2 (kiri) dan kontrol (kanan).
Gambar 13 Morfologi tanaman tembakau hasil transformasi promoter
EgAGL2 (kiri) dan kontrol (kanan).
melipat
14
Gambar 14 Tanaman tembakau trangenik promoter EgAGL2 yang memiliki ekspresi rendah.
SIMPULAN DAN SARAN
Simpulan
Promoter gen EgAG2 dan EgAGL2 telah berhasil disisipkan ke dalam genom tanaman tembakau dengan perantara A. tumefaciens. Ekspresi dari gen EgAG2 menunjukkan tanaman tembakau memiliki daun yang cacat atau melipat. Ekspresi gen EgAGL2 pada tanaman model tembakau adalah tanaman tersebut memiliki daun yang lebih hijau.
Saran
Penelitian lebih lanjut perlu dilakukan untuk menguji tingkat ekspresi promoter gen
EgAG2 dan EgAGL2 dengan RT-PCR (Reverse Transcriptase Polymerase Chain Reaction). Selain itu, perlu dilakukan perlakuan dengan variasi media untuk mengetahui pengaruhnya terhadap promoter kedua gen.
DAFTAR PUSTAKA
Adam H. Juannic S. Morcillo F. Verdell JL. Duval Y. Treager JW. 2007. Determination of flower structure in Elaeis guineensis: Do palm use the same homeotic genes as other species? Ann. Bot. 100: 1-12.
Azizah A. 2009. Perbandingan pola pita amplifikasi DNA daun, bunga, dan buah kelapa sawit normal dan abnormal [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Badan Pusat Stastika [BPS]. 2009. Produksi Perkebunan Besar menurut Jenis Tanaman Indonesia. Jakarta: BPS.
Bao X. Franks RG. Levin JZ. Liu Z. 2004. Repression of Agamous by Bellringer in floral and inflorescence meristems. The Plant Cell. 16: 1478-1489.
Belarmino MM. Mii M. 2000. Agrobacterium
mediated genetic transformation of a phalaenopsis orchid. Plant Cell Report. 19: 435-442.
Blazquez MA.2000. Flower development pathway. Cell science at a Glance. 113.
Bowman JL. Smyth DR and Meyerowitz ME. (1989). Genes directing flower development in Arabidopsis. Plant Cell ,1, 37-52.
Cassas AM. Kononowiz AK. Zehr UB. Tomes DT. Axtell JD. Butier LG. Bressan RA, Hasegawa PM. 1993. Transgenic sorghum plant via microprijectile bombardment. Proc. Natl. Acad. Sci. 90:11212 – 11216.
Castillo OC. Chalmers KJ. Waugh R. Powell W. 1994. Detection of genetic diversity and selective gene in coffee using RAPD markers. Theor. Appl. Genet., 87, 332-339.
Chaidamsari T.Samanhudi, Sugiarti H. Santoso D. Angenent GC. Ruud AM. 2006. Isolation and characterization of an AGAMOUS homologue from cacao. Plant Sci 170: 968-975.
Chairunisa. 2008. Kultur jaringan: perbanyakan tunas eksplan Stevia pada variasi konsentrasi sukrosa media Murashige-Skoog [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Darmawan N. 2004. Isolasi, kloning, dan sekuensing gen putative enzim PQQ glukosa dehidrogenase dari Agrobacterium tumefaciens [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam.
Dean C. Simpson GG. 2002. Recent advances in flowering time control research in
Arabidopsis. Science 296: 285-289.
Observed?http://www.dbc.uci.edu/faculty/ wagner/hsv6f.html [27 Desember 2011].
Herman M. 1996. Rekayasa genetika untuk perbaikan tanaman. Buletin Agrobio
1:24–34.
Jack T. 2004. Molecular and genetic mechanisms of floral control. The Plant Cell. 16: S1-S17
Jonas NL. 2003. PCR: Principles, procedures, and parameters. Di dalam: Theophilus BDM, Ralpley R, editor. Methods in Molecular Biology: PCR Mutation Detection Protocols. New Jersey: Humana Pr. hlm 37-46.
Lilis E. 2009. Konstruksi DNA rekombinan pCAMBIA 1303-stilbena sintase pencegah busuk akar kelapa sawit [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Maftuchah. 2007. Transformasi Anggrek Dendrobium dengan Gen gus-A melalui Perantaraan Agrobacterium tumefaciens
[skripsi]. Malang: Fakultas Pertanian.
Maier RM, Pepper IL, Gerba CP. 2009.
Environmental Microbiology. London: Elsevier, Inc.
Mangoensoekarjo S, Semangun H. 2005.
Manajemen Agrobisnis Kelapa Sawit. Yogyakarta: Gadjah Mada Univ Pr.
Minarsih H. 1999. Transformasi melalui Agrobacterium pada tanaman monokotil dan prospeknya pada tanaman tebu. Buletin P3GI. Pasuruan.
Murray RK, Graner DK, Mayes PA, Rodwell VW. 2003. Biokimia Harper. Andry H, penerjemah; Anna PB, Tiara MN, editor. Jakarta: EGC. Terjemahan dari: Harper’s
Biochemistry.
Nasir M. 2002. Bioteknologi Molekuler Teknik Rekayasa Genetika Tanaman. Bandung: Citra Aditya Bhakti.
Pambudi A. 2009. Teknik transformasi genetik beberapa tanaman menggunakan
Agrobacterium tumefaciens [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Pandey V, Misra P, Chaturvedi P, Manoj KM, Prabodh KT, Tuli R. 2010.
Agrobacterium tumefaciens-mediated transformation of Withania somnifera
(L.) Dunal: an important medicinal plant.
Plant Cell Rep 29:133–141
Rybicki E. 2001. PCR primer design and reaction optimization. Coyne VE et al., editor. Molecular Techniques Manual 3rd Ed. Cape Town: University of Cape Town.
Sambrook J, Fritsch EF, Maniatis T. 1989.
Molecular Cloning a Laboratory Manual, Ed ke-1. New York: Cold Spring Harbor Laboratory.
Sambrook J, Russell DW. 2001. Molecular Cloning a Laboratory Manual. Ed ke-3. New York: Cold Spring Harbor Laboratory.
Santoso D, Samanhudin, Chaidamsari T. 2009. Kemungkinan peningkatan produktivitas kelapa sawit melalui induksi perkembangan reproduktif: homologi molekuler dari kakao. Menara perkebunan.77: 125-137.
Sastrosayono S. 2003. Budidaya Kelapa Sawit. Jakarta: AgroMedia Pustaka.
Sheng J, Citovsky V. 1996. Agrobacterium – plant cell DNA transport: have virulence protein will travel. The Plant Cell. 8: 301-309.
Sinaga R. 2007. Analisis model ketahanan rumput gajah dan rumput raja akibat cekaman kekeringan berdasarkan respon dan anatomi akar dan daun. Jurnal Biologi Sumatera 2: 17-20.
Subandiyah, S. 2006. Polymerase Chain Reaction untuk Deteksi atau Identifikasi Patogen Tumbuhan. Beberapa Metode Ekstraksi DNA. Pelatihan dan Workshop Identifikasi DNA dengan Aplikasi PCR. Malang. hlm 43-50.
Suharsono S. 2000. Prinsip Amplifikasi DNA dengan PCR. Bogor: Pusat Antar Universitas Bioteknologi IPB.
Trigiano RN. Gray DJ. 2000. Plant Tissue Culture Concepts and Laboratory Exercises. Ed ke-2. London: CRC Pr.
Tzfira T. Citovsky V. 2003. The
Agrobacterium plant cell interaction taking biology lessons from a bug. Plant Physiology 133: 943-947.
16
Walker JM, Wilson K. 2000. Principles and Techniques of Practical Biochemistry. UK: Cambridge University Pr.
Wetter LR, Constabel F. 1991. Metode Kultur Jaringan Tanaman. Ed ke-2. Bandung: Penerbit ITB.
Yanofsky MF. 1990. The protein encoded by the Arabidopsis hemoetic gene agamous resembles transcription factors. Nature. 346: 35-39.
Yusnita. 2004. Kultur Jaringan: Cara memperbanyak tanaman secara efisien.
Jakarta: Agromedia Pustaka.
Yuwono T. 2005. Biologi Molekular. Amalia S, editor. Jakarta: Erlangga.
Yuwono T. 2006. Teori dan Aplikasi Polymerase Chain Reaction.
18
Lampiran 1 Diagram alir penelitian
Sterilisasi alat dan bahan
Kultur
A. tumefaciens
pembawa promoter
EgAG2
dan
EgAGL2
Pemilihan dan pemotongan eksplan tembakau
Transformasi genetik
Ko-kultivasi
Media adaptasi
Media seleksi
<