ANALYTICAL METHOD DEVELOPMENT AND VALIDATION OF
PHASEOLAMIN FROM WHITE KIDNEY BEAN (PHASEOLUS VULGARIS)
EXTRACT INHIBITORY ACTIVITY AGAINST
α
-AMYLASE
IN PT NUTRIFOOD INDONESIA
Amelinda Angela and Dahrul Syah Department of Food Science and Technology,
Faculty of Agricultural Engineering and Technology, Bogor Agricultural University, IPB Darmaga Campus, PO BOX 220, Bogor, West Java, Indonesia
Phone: +62 818 089 789 46, E-mail: amelinda.angela@gmail.com
ABSTRACT
Phaseolamin is an α-amylase inhibitor extracted from white kidney bean (Phaseolus vulgaris). Some researches show that phaseolamin has several functional effects such as enhancing weight loss, decreasing body fat mass, decreasing waist circumference, decreasing energy intake, decreasing insulin level in blood, and increasing carbohydrate tolerance in diabetics. Based on its functions, phaseolamin can be developed as a functional food ingredient. PT Nutrifood Indonesia is one of the companies that use phaseolamin in their product. However, to maintain the product quality, phaseolamin inhibitory activity has to be determined. This research aims to determine the optimum phaseolamin and α-amylase preincubation condition, develop an analytical method to measure phaseolamin inhibitory activity against α-amylase that can be used in PT Nutrifood Indonesia, and validate the method. The parameters to determine an optimum preincubation condition were phaseolamin concentration and preincubation duration. This research used Bernfeld method to measure the reducing sugars, product from the reaction between α-amylase and starch, that can be used in a calculation to determine the α-amylase activity with and without the phaseolamin. The phaseolamin inhibitory activity is expressed as percentage of inhibition. The analytical method should be validated so it can be used in the company. The parameter that was used to validate was precision. The result showed that 20 mg/ml concentration of phaseolamin and 60 minute preincubation gave the optimum preincubation condition. According to the result, Relative Standard Deviation (RSD) of analysis was smaller than 0.67 times RSD of Horwitz. It showed that the analytical method can be used to measure phaseoamin inhibitory activity precisely.
I. PENDAHULUAN
A.
Latar Belakang
Karbohidrat merupakan salah satu zat gizi dalam pangan yang penting bagi manusia. Manusia memerlukan enzim α-amilase pada proses metabolisme karbohidrat untuk memecah senyawa sakarida yang kompleks menjadi senyawa sakarida sederhana yang mudah diserap oleh tubuh manusia. Namun, beberapa bahan pangan dikenal mengandung senyawa inhibitor yang
dapat menurunkan aktivitas enzim α-amilase.
Salah satu bahan pangan yang dikenal mengandung senyawa inhibitor α-amilase adalah white kidney bean (Phaseolus vulgaris) (Jaffe et al. 1973). Menurut Jenkins et al. (1986) diacu dalam Thompson dan Gabon (1987), laju pencernaan karbohidrat pada white kidney bean (Phaseolus vulgaris) lebih rendah, secara in vivo dan in vitro, dibandingkan dengan roti gandum. Hal ini dapat disebabkan oleh adanya, selain senyawa antinutrisi, senyawa inhibitor enzim α -amilase yang terkandung dalam white kidney bean. Senyawa inhibitor tersebut kemudian dipurifikasi dan diberi nama phaseolamin (Marshall dan Lauda 1975).
Gambar 1. Phaseolus vulgaris
Menurut Marshall dan Lauda (1975), sebagian besar senyawa inhibitor yang berasal dari
tanaman, termasuk phaseolamin, tidak memiliki aktivitas dalam penghambatan enzim α-amilase pada tanaman, sehingga dapat disimpulkan bahwa senyawa inhibitor tersebut tidak berperan dalam
mengatur aktivitas α-amilase dalam tanaman tersebut. Sementara itu, senyawa-senyawa inhibitor
tersebut aktif dalam menghambat aktivitas enzim α-amilase pada serangga dan binatang lainnya, sehingga dapat disimpulkan bahwa senyawa-senyawa inhibitor tersebut berfungsi dalam memberikan perlindungan kepada tanaman terhadap serangan serangga dan binatang.
2 di Indonesia dan diperkirakan penderitanya di Indonesia mencapai lima juta pada tahun 2020. Pencegahan penyakit ini dapat dilakukan dengan pengaturan diet yang tepat, yaitu membatasi asupan kalori dan memilih makanan yang memiliki Indeks Glisemik yang rendah karena makanan tersebut dapat memberikan respon glukosa yang rendah setelah dikonsumsi.
Pada studi awalnya, phaseolamin dinilai potensial sebagai anti-obesitas dan anti-diabetes atau disebut juga sebagai senyawa starch blockers. Senyawa starch blockers merupakan senyawa yang dapat menghambat pemecahan senyawa karbohidrat yang terdapat dalam bahan pangan dan menyebabkan penurunan daya cerna karbohidrat sehingga terjadi penurunan energi yang dihasilkan oleh karbohidrat atau penurunan laju penyerapan glukosa dalam tubuh (Celleno et al. 2007). Namun, pada tahun 1980, studi lebih lanjut menemukan bahwa ekstrak senyawa inhibitor
komersial tidak mempengaruhi pencernaan pati karena rendahnya aktivitas penghambatan α -amilase dalam tubuh manusia dan adanya lektin dan tripsin inhibitor dalam ekstrak tersebut (Rosenberg 1982 diacu dalam Tormo et al. 2004).
Perkembangan lebih lanjut, dengan metode ekstraksi yang lebih baik seperti ekstraksi karbon dioksida, fraksinasi, dan perlakuan panas, menghasilkan senyawa starch blockers yang efektif dalam tubuh manusia, seperti beberapa senyawa phaseolamin komersial yang ada sekarang ini. Salah satu senyawa phaseolamin komersial menunjukkan fungsi yang potensial sebagai solusi terapi dalam mengatasi obesitas dan hipertrigliseridemia (Udani et al. 2004). Oleh karena itu, phaseolamin memilki sifat fungsional yang dapat dikembangkan menjadi suatu bahan baku produk pangan fungsional.
PT Nutrifood Indonesia merupakan salah satu perusahaan yang memanfaatkan phaseolamin sebagai salah satu bahan baku dalam produknya. Produk tersebut diklaim dapat mengurangi penyerapan karbohidrat dengan adanya phaseolamin. Kualitas produk yang dihasilkan dapat dijamin dengan memperhatikan kualitas bahan baku yang digunakan. Kualitas bahan baku dapat ditentukan berdasarkan fungsi bahan baku tersebut dalam produk. Oleh karena itu, salah satu parameter penting dalam menjaga kualitas produk berbahan baku phaseolamin yang dihasilkan oleh PT Nutrifood Indonesia adalah kualitas phaseolamin yang digunakan. Dalam hal ini, kualitas
phaseolamin ditentukan berdasarkan aktivitas phaseolamin dalam menghambat aktivitas enzim α -amilase.
Metode pengukuran penghambatan phaseolamin terhadap aktivitas enzim α-amilase yang sudah ada memiliki variasi dalam kondisi preinkubasi enzim dan inhibitor yang digunakan. Oleh karena itu, perlu dilakukan penelitian lebih lanjut untuk menentukan kondisi preinkubasi yang paling tepat dalam metode pengukuran tersebut. Validasi metode umumnya dilakukan oleh lembaga-lembaga penerima jasa analisis atau lembaga pendidikan. Selain lembaga-lembaga yang disebutkan, laboratorium penguji di suatu perusahaan juga harus mengunakan metode tervalidasi karena validasi metode merupakan bagian penting dalam jaminan mutu hasil pengujian dalam suatu laboratorium. Dalam hal ini, hal yang perlu diperhatikan, antara lain: (1) Penggunaan metode, misal metode baku, metode non-baku, dan modifikasi metode baku, (2) IQC (Internal Quality Control), (3) Pemenuhan terhadap persyaratan ISO/IEC 17025:2005, dan (4) Partisipasi dalam uji profisiensi.
Laboratorium penguji di PT Nutrifood Indonesia sudah terakreditasi dan memiliki sertifikat ISO/IEC 17025:2005. Oleh karena itu, metode yang digunakan atau yang akan dikembangkan di laboratorium tersebut harus divalidasi. Metode pengukuran penghambatan phaseolamin terhadap
3
B.
Tujuan
Tujuan dari magang penelitian ini adalah menghasilkan suatu metode analisis tervalidasi
II. PROFIL PERUSAHAAN
Berdiri sejak tahun 1979, PT Nutrifood Indonesia memproduksi dan memasarkan berbagai produk makanan dan minuman kesehatan berkualitas internasional dengan berbagai merek terkemuka. Kantor pusat Nutrifood berada di Jakarta. Nutrifood memiliki jaringan distribusi yang menjangkau lebih dari tiga puluh negara di dunia. Nutrifood adalah perusahaan yang secara inovatif menginspirasi dan membantu setiap individu untuk mencapai keseimbangan hidup dengan menjalankan pola hidup sehat yang menyenangkan dan memperhatikan asupan nutrisi sehingga dapat menikmati hidup sehat lebih lama
Kegiatan PT Nutriood Indonesia didukung oleh tiga pilar: 1. Produk dan layanan berkualitas
Nutrifood secara inovatif menyediakan produk dan layanan premium yang bermutu tinggi, memberi kemudahan dan menyenangkan, serta efektif berdasarkan pendekatan ilmiah.
2. Manajemen yang profesional
Nutrifood didukung oleh tim ahli yang profesional serta memiliki komitmen tinggi, berpengalaman dan inovatif dalam memaksimalkan kualitas produk dan layanan.
3. Program yang melibatkan pemangku kepentingan
Nutrifood secara inovatif dan proaktif melakukan edukasi dan promosi gaya hidup sehat dan bernutrisi yang melibatkan pemangku kepentingan utama (key stakeholders).
Nutrifood berusaha untuk menjadi pionir dan pemimpin pasar dalam memberikan solusi atau cara yang tepat kepada pelanggan kami untuk meraih kehidupan yang lebih sehat, lebih nikmat dan penuh arti, baik untuk saat ini maupun di masa mendatang. Untuk mewujudkan misi tersebut, Nutrifood berusaha memahami pelanggan dalam setiap fase kehidupan yang dialaminya, mengidentifikasi kebutuhan unik mereka, dan memberikan solusi; terutama melalui produk dan pelayanan bernutrisi untuk meraih kehidupan yang lebih sehat dan berkualitas. Nutrifood hadir untuk menginspirasi kehidupan yang bernutrisi.
Nilai-nilai bisnis utama dari Nutrifood adalah :
Nutrifood menekankan pada integritas dan keberlangsungan bisnis jangka panjang. Nutrifood berusaha mempertimbangkan dampak jangka panjang dalam setiap pengambilan keputusan, berkomitmen dalam memberikan solusi yang telah teruji efektif.
Nutrifood bergerak sebagai boutique company yang memiliki karakter, unik, inovatif, dan premium.
Nutrifood percaya bahwa pencegahan lebih baik daripada mengobati. Oleh karena itu, Nutrifood memberikan produk dan jasa yang bersifat preventif untuk dimanfaatkan oleh pelanggan.
Nutrifood percaya bahwa kesehatan dan kenikmatan dapat berjalan selaras. Berbagai produk dan jasa yang diberikan merupakan kombinasi dari sesuatu yang sehat, nikmat dan mudah untuk dikonsumsi.
Dalam menjalankan setiap aktivitasnya, Nutrifood selalu berpegang pada prinsip I-CARE, yaitu:
Integrity: Dapat diandalkan dan konsisten dalam nilai pribadi, pekerjaan dan universal. Collaboration: Bekerjasama untuk mencapai tujuan bersama.
innovAtion: Berpikir kreatif dan berinovasi. Respect: Menghargai perbedaan.
5 Beberapa sertifikasi yang telah didapatkan oleh PT Nutrifood Indonesia, yaitu:
1994 : Nutrifood mendapat sertifikat ISO 9002 :1987, sekaligus menjadi perusahaan makanan pertama di Indonesia yang mendapat ISO.
1997 : National Sales mendapatkan sertifikat ISO 9002:1994 2001 : Laboratorium mendapatkan sertifikat ISO 17025:2000 2005 : Holding company mendapat sertifikat ISO 9001:2000
2005 : National Sales mendapatkan kembali sertifikat ISO 9001:2000 2008 : Manufaktur Nutrifood mendapat sertifikat ISO 22000:2005
2008 : Laboratorium mendapatkan kembali sertifikat ISO/IEC 17025:2005 2009 : Nutrifood non manufaktur mendapat sertifikat ISO 9001:2008
2010 : Sertifikasi sistem jaminan halal dari LP-POM MUI, sedangkan Sertifikat Halal bagi semua produk Nutrifood didapatkan sesuai tahun peluncurannya.
Gambar 2. Enam brand unggulan PT Nutrifood Indonesia
PT Nutrifood Indonesia bersama keenam brand unggulannya memiliki komitmen untuk memberikan kontribusi positif kepada masyarakat dan lingkungan. Berikut adalah keenam brand unggulan PT Nutrifood Indonesia:
1. Tropicana Slim
Tropicana Slim (TS) terdiri dari berbagai produk bebas gula, susu tanpa lemak, pelengkap masakan, dan healthy meal, seperti TS Gula Rendah Kalori Classic, TS Corn Oil, dan DiabetaMil. 2. HiLo
Susu HiLo memiliki beberapa varian yang diformulasikan khusus untuk memenuhi kebutuhan nutrisi di usia masing-masing, seperti HiLo School, HiLo Teen, HiLo Active, dan HiLo Gold. 3. NutriSari
NutriSari terdiri dari tiga varian produk, yaitu NutriSari Ready to Drink, NutriSari Jelly, dan NutriSari Serbuk dengan berbagai varian rasa.
4. L-Men
6 5. WRP
Memiliki serangkaian produk yang dirancang untuk menurunkan dan mempertahankan berat badan, membentuk tubuh, mempercantik kulit, dan membantu diet bagi ibu menyusui, seperti WRP Nutritious Drink, WRP Diet Tea, WRP skin 2 C, dan WRP New Mom.
6. WRP Diet Center
III. TINJAUAN PUSTAKA
A.
Inhibitor Enzim
Enzim merupakan protein yang memiliki aktivitas katalitik yang aktif secara spesifik. Spesifitas enzim disebabkan oleh adanya sisi aktif enzim yang hanya dapat mengikat molekul substrat tertentu. Terdapat enam jenis enzim berdasarkan reaksi kimia yang dikatalisis, yaitu oksidoreduktase, transferase, hidrolase, liase, isomerase, dan ligase. Enzim α-amilase termasuk
dalam jenis enzim hidrolase karena memerlukan air dalam memecah ikatan spesifik α -1,4-glikosidik. Beberapa faktor yang dapat mempengaruhi aktivitas enzim adalah konsentrasi substrat, konsentrasi enzim, pH, suhu, aw, kofaktor enzim, dan inhibitor (Whitaker 1996).
Inhibitor merupakan senyawa yang dapat menghambat aktivitas enzim saat ditambahkan ke dalam reaksi enzim-substrat. Terdapat dua jenis inhibitor, yaitu inhibitor reversibel dan irreversibel. Inhibitor reversibel dapat dengan cepat membentuk kompleks ekuilibrium difusi non-kovalen terkontrol dengan enzim dan kompleks ini dapat terdisosiasi dengan dialisis atau filtrasi gel. Sementara itu, inhibitor irreversibel membentuk ikatan kovalen dengan enzim yang tidak dapat terdisosiasi (Lehninger 1990).
Terdapat empat jenis penghambatan oleh inhibitor reversibel, yaitu penghambatan kompetitif, non-kompetitif, unkompetitif, dan alosterik. Inhibitor kompetitif umumnya memiliki struktur yang menyerupai substratnya sehingga inhibitor juga dapat mengikat sisi aktif enzim dan menghambat perubahan substrat oleh enzim. Penghambatan ini dapat dikurangi dengan menambahkan konsentrasi substrat. Sementara itu, inhibitor non-kompetitif berikatan pada enzim di luar sisi aktifnya sehingga penambahan substrat tidak mempengaruhi aktivitas penghambatan enzim (Suhartono 1989).
Gambar 3. Grafik teoretikal (1/v terhadap 1/[S]) untuk enzim Michaelian dengan dan tanpa kehadiran inhibitor (Stojan 2005)
Inhibitor unkompetitif merupakan senyawa yang berikatan secara reversibel dengan kompleks enzim-substrat dan tidak dapat berikatan dengan molekul enzim bebas (Suhartono
1/[Konsentrasi Substrat]
Tanpa inhibitor Unkompetitif Non-kompetitif
8 1989). Penghambatan alosterik terjadi saat inhibitor berikatan dengan enzim multi-subunit (Whitaker 1996).
Beberapa organisme melibatkan inhibitor dalam sistem pengaturan metabolik dan fisiologis sehingga beberapa inhibitor terdapat secara alami. Inhibitor tripsin umumnya terdapat pada sereal dan kacang-kacangan. Sementara itu, terdapat tiga jenis inhibitor α-amilase alami, yaitu protein yang diproduksi oleh tanaman seperti sereal dan kacang-kacangan, polipeptida sederhana yang diproduksi oleh beberapa spesies Streptomyces, dan karbohidrat sederhana yang mengandung N yang diproduksi oleh Streptomyces (Ho et al. 1994 diacu dalam Whitaker 1996).
B.
Phaseolamin
White kidney bean (Phaseolus vulgaris) mengandung senyawa yang dapat menghambat aktivitas enzim α-amilase secara non-kompetitif. Senyawa inhibitor tersebut memiliki tiga bentuk, yaitu isoform 1 (α-AI1), isoform 2 (α-AI2), dan α-amylase inhibitor like (α-AIL). Senyawa yang
memiliki aktivitas anti α-amilase pada manusia dan terdapat paling banyak pada white kidney bean adalah isoform α-AI1 (Iguti dan Lajolo 1991 diacu dalam Obiro et al. 2008). Senyawa ini dikenal luas sebagai phaseolamin.
Pada tanaman Phaseolus vulgaris, phaseolamin hanya ditemukan di bagian biji dan terkonsentrasi pada aksis. Jumlahnya di dalam aksis tiga kali lipat dibandingkan dengan jumlahnya di dalam kotiledon biji (Moreno 1990 diacu dalam Obiro et al. 2008). Menurut Moreno dan Chrispeels (1989) diacu dalam Obiro et al. (2008), phaseolamin terakumulasi dalam biji white kidney bean sejumlah 9-11% dari protein biji. Persentase ini dapat menggambarkan rendemen phaseolamin yang dihasilkan dari ekstraksi white kidney bean, meskipun metode ekstraksi juga menentukan jumlah rendemen yang dihasilkan. Selain itu, jumlah phaseolamin yang didapatkan dari white kidney bean yang sudah dikeringkan juga berkurang, sehingga phaseolamin lebih baik diekstrak dari white kidney bean yang tidak mengalami perlakuan pengeringan (Moreno 1990 diacu dalam Obiro et al. 2008).
Pada penelitian yang dilakukan oleh Marshall dan Lauda (1975) dan Lee et al. (2002), phaseolamin didapatkan dari proses purifikasi ekstrak white kidney bean (Phaseolus vulgaris) varietas Great Northern. Proses purifikasi tersebut mencakup lima tahap, yaitu ektraksi kasar, pemanasan, dialysis, kromatografi DEAE-cellulose, kromatografi Sephadex G-100, dan kromatografi CM-cellulose.
Phaseolamin merupakan senyawa glikoprotein dengan berat molekul sebesar 56,7 kDa (Lee dan Whitaker 2000 diacu dalam Obiro et al. 2008). Phaseolamin juga cenderung tidak larut dalam etanol 70% dan aktivitas penghambatannya terhadap enzim α-amilase hilang setelah dipanaskan pada suhu 100oC. Phaseolamin dengan konsentrasi sebesar 1,08 mg/ml tidak memiliki kemampuan untuk menggumpalkan sel darah merah manusia, meskipun ekstrak kasar white kidney bean dengan konsentrasi sebesar 0,02 mg/ml, dalam kondisi yang sama, dapat menggumpalkan sel darah merah manusia (Marshall dan Lauda 1975).
Phaseolamin mengandung kurang lebih 10% karbohidrat (Marshall dan Lauda 1975). Namun, menurut Sawada et al. (2002) diacu dalam Obiro et al. (2008), kompleks N-glikosilasi pada phaseolamin tidak memiliki efek terhadap aktivitas penghambatannya karena kompleks
9 terhadap aktivitas penghambatannya. Gambar 4 menunjukkan struktur phaseolamin yang ditumpuk dengan struktur Lathyrus ochrus Isolektin I (LoLI) untuk membandingkan kedua struktur. Ion logam dan rantai samping asam amino yang terlibat dalam pengikatan karbohidrat oleh lektin berwarna kuning, sedangkan residu yang berinteraksi dengan sisi aktif enzim α-amilase berwarna hijau. Lokasi ketiga gugus N-glikosilasi ditunjukkan dengan warna ungu.
Gambar 4. Struktur rantai karbon α unit monomer α-AI1 (merah) dan LoLI (biru) (Bompard-Gilles et al. 1996)
Beberapa penelitian menunjukkan bahwa aktivitas penghambatan phaseolamin terhadap
enzim α-amilase bergantung pada pH, suhu, waktu inkubasi, dan adanya ion-ion pada saat interaksi antara enzim dan inhibitor berlangsung (Obiro 2008). Nilai pH optimum penghambatan adalah 4,5 (Le Berre-Anton et al. 1997 diacu dalam Obiro et al. 2008), 5,5 (Marshall dan Lauda 1975), dan 5,0 (Kotaru et al. 1987 diacu dalam Obiro et al.2008). Suhu optimum penghambatan adalah 37oC.
Waktu inkubasi yang dibutuhkan untuk mencapai penghambatan optimum tergantung pada pH yang digunakan. Le Berre-Anton et al. (1997) diacu dalam Obiro et al. (2008) menyatakan bahwa waktu inkubasi optimum adalah 10 menit pada nilai pH optimum untuk penghambatan, yaitu 4,5. Sementara itu, Marshall dan Lauda (1975) menyatakan bahwa waktu inkubasi optimum
adalah 20 menit pada nilai pH optimum aktivitas α-amilase, yaitu 6,9. Waktu inkubasi yang lebih lama pada nilai pH 6,9 menunjukkan bahwa inhibitor harus dikonsumsi sebelum atau dengan makanan untuk mencapai kondisi penghambatan secara in vivo (Obiro 2008).
Beberapa jenis ion mempengaruhi aktivitas penghambatan. Lajolo dan Filho (1985) diacu dalam Obiro et al. (2008) menyatakan nahwa peningkatan aktivitas penghambatan phaseolamin terhadap amilase saliva dipengaruhi oleh keberadaain ion-ion dengan urutan sebagai berikut: nitrat > klorida > bromida > iodida > tiosianat. Gibbs dan Alli (1998) diacu dalam Obiro et al. (2008) menyatakan bahwa ion klorida penting untuk mencapai penghambatan maksimum dan ion kalsium meningkatakan laju inisial pengikatan inhibitor terhdapa amilase. Mereka juga menyatakan bahwa ion-ion K, Mg, sulfat, dan Na tidak berpengaruh dalam aktivitas penghambatan dan begitu pula peningkatan kekuatan ionik.
10
menunjukkan aktivitas penghambatan phaseolamin terhadap enzim α-amilase yang berasal dari berbagai sumber. Adanya sedikit efek penghambatan terhadap enzim α-amilase yang berasal dari Bacillus amyloliquefaciens dapat disebabkan oleh sisa-sisa enzim proteolitik saat menyiapkan enzim bakteri tersebut (Marshall dan Lauda, 1975).
Tabel 1. Aktivitas penghambatan phaseolamin terhadap α-amilase dari berbagai sumber (Marshall dan Lauda, 1975)
Sumber α-amilase Aktivitas Penghambatan* (%)
Bacillus amyloliquefaciens 3
Bacillus subtilis 0
Bacillus licheniformis 0
Aspergillus oryzae 3
Barley malt 0
Rye 0
Helix pomatia 97
Pankreas babi 97
Saliva manusia 94
Pankreas manusia 100
*Perbandingan dengan aktivitas enzim α-amilase kontrol tanpa inhibitor
Penelitian tentang mekanisme penghambatan phaseolamin terhadap enzim α-amilase menunjukkan bahwa senyawa inhibitor secara efektif menghambat penyerapan karbohidrat dengan mencegah akses substrat terhadap bagian aktif enzim (Obiro et al. 2008). Kompleks inhibitor-enzim sebagian besar terbentuk oleh ikatan hidrogen, ikatan hidrofobik, dan ikatan antar protein (Bompard-Gilles et al. 1996 diacu dalam Obiro et al. 2008).
Menurut Obiro et al. (2008), berdasarkan beberapa penelitian terkini, phaseolamin dapat diaplikasikan sebagai inhibitor enzim α-amilase secara in vivo. Beberapa efek fungsional yang diberikan oleh phaseolamin terhadap manusia, antara lain menurunkan berat badan dan mengecilkan lingkar pinggang (Wu 2010), menurunkan massa lemak dalam tubuh (Celleno et al. 2007), dan menurunkan kadar insulin dalam plasma darah sehingga memiliki aktivitas anti-diabetes (Boivin et al. 1987 diacu dalam Obiro et al. 2008; Udani et al. 2004).
Beberapa studi telah dilakukan terkait toksisitas phaseolamin baik secara akut maupun kronis. Toksisitas akut merupakan respon toksisitas yang langsung muncul setelah dikonsumsi dan diinduksi dalam sekali pemaparan. Toksisitas akut diukur berdasarkan nilai dosis letal (LD50), yaitu jumlah dosis yang menyebabkan kematian subjek uji sebesar 50% dari populasi setelah satu kali mengonsumsi senyawa tersebut (Pariza 1996 dalam Obiro et al. 2008). Menurut Harikumar et al. 2005 diacu dalam Obiro et al. 2008), tidak ada toksisitas akut yang teramati secara evaluasi klinis, biokimia dan histopatologikal analisis pada level sekali konsumsi phaseolamin.
11 subkronis 85 mg/kg berat badan per hari atau 6,0 g untuk individu dengan berat badan sebesar 70 kg (Obiro et al. 2008).
Enzim α-amilase (EC 3.2.1.1) merupakan enzim yang dapat memecah ikatan α -1,4-glikosidik pada pati dan menghasilkan glukosa, maltosa, atau dekstrin, serta glukoamilase.
Aktivitas enzim α-amilase umumnya dapat diukur dengan dua cara yaitu dengan mengukur sisa
pati yang tidak terhidrolisis oleh enzim α-amilase atau jumlah gula pereduksi yang dihasilkan oleh
hidrolisis enzim α-amilase terhadap pati. Kedua cara tersebut dapat digunakan dalam mengukur penghambatan phaseolamin terhadap aktivitas enzim α-amilase (Fossum dan Whitaker 1974).
Metode yang digunakan Fuwa (1954), Marshall dan Lauda (1975), dan Xiao et al. (2006)
dalam mengukur aktivitas enzim α-amilase adalah dengan mengukur warna kompleks iodin dengan pati. Semakin besar aktivitas penghambatan phaseolamin, maka jumlah pati yang terhidrolisis semakin sedikit sehingga komplek iodin dengan pati yang terbentuk semakin banyak dan menghasilkan warna biru. Warna kompleks tersebut dapat dikuantifikasi dengan pengukuran menggunakan spektrofotometer.
Metode lain yang dapat digunakan adalah pengukuran gula pereduksi yang terbentuk akibat
hidrolisis pati oleh enzim α-amilase. Terdapat dua pereaksi yang umum digunakan dalam pengukuran gula pereduksi, yaitu reagen DNS (Fossum dan Whitaker 1974, Lee et al. 2002, dan Xiao et al. 2006) dan alkaline copper (Fuwa 1954, Green III et al. 1989, dan Roychan dan Chaudari 2001). Kedua pereaksi ini dapat bereaksi dengan gula pereduksi yang terbentuk dan menghasilkan komples warna yang juga dapat dikuantifikasi dengan pengukuran menggunakan
spektrofotometer. Adanya penghambatan aktivitas enzim α-amilase oleh phaseolamin dapat diamati oleh perbedaan nilai absorbansi yang dihasilkan.
Di antara ketiga metode tersebut, metode yang paling sering digunakan dalam pengukuran aktivitas penghambatan phaseolamin terhadap enzim α-amilase adalah mengukur gula pereduksi yang terbentuk dengan reagen DNS. Penghambatan aktivitas enzim α-amilase oleh phaseolamin dapat diukur dengan menginkubasikan terlebih dahulu enzim dan inhibitor tersebut. Konsentrasi inhibitor dan waktu preinkubasi yang digunakan dalam metode pengukuran yang dilakukan oleh Fossum dan Whitaker (1974), Lee et al. (2002), dan Xiao et al. (2006) berbeda-beda. Oleh karena itu, perlu dilakukan percobaan untuk menentukan konsentrasi inhibitor dan waktu preinkubasi yang optimum dalam metode yang dikembangkan. Preinkubasi dilakukan pada pH 6.9 karena nilai pH tersebut sesuai dengan nilai pH cairan tubuh saat mengonsumsi phaseolamin meskipun bukan merupakan pH optimum untuk penghambatan.
C.
Validasi Metode
12
1. Kecermatan
Kecermatan adalah ukuran yang menunjukkan derajat kedekatan hasil analis dengan kadar analit yang sebenarnya (Harmita 2004). Kecermatan suatu metode bergantung pada sebaran galat sistematik di dalam tahapan metode tersebut. Oleh karena itu, galat sistematik harus dikurangi untuk mendapatkan metode dengan kecermatan yang tinggi. Beberapa cara untuk mengurangi galat sistematik, antara lain menggunakan peralatan yang telah dikalibrasi, menggunakan pereaksi dan pelarut standar, dan pelaksanaannya yang cermat sesuai prosedur.
Kecermatan dapat ditentukan dengan berbagai cara, seperti melakukan percobaan
recovery, prosedur kalibrasi adisi standar, menguji materi standar, dan sebagainya. Selain itu, dapat juga dilakukan perbandingan hasil percobaan metode yang akan divalidasi dengan hasil yang didapatkan dari metode tervalidasi yang sudah ada (Crowther et al. 2000).
2. Keseksamaan
Keseksamaan adalah ukuran yang menunjukkan derajat kedekatan antara beberapa seri pengukuran dari beberapa kali pengambilan sampel homogen dalam kondisi pengukuran yang sama (Crowther et al. 2000). Keseksamaan dapat dibedakan menjadi tiga tingkat, yaitu keterulangan (repeatability), keseksamaan intermediat (intermediate precision), dan ketertiruan (reproducibility). Keterulangan menunjukkan keseksamaan yang didapatkan dalam kondisi percobaan yang sama dengan interval waktu yang singkat. Keseksamaan intermediat menunjukkan keseksamaan yang didapatkan dalam variasi laboratorium, seperti perbedaan hari, analis, alat, dan sebagainya. Sementara itu, ketertiruan menunjukkan keseksamaan antar laboratorium.
Keseksamaan suatu analit bergantung pada analis, kondisi laboratorium, konsentrasi analit, jenis dan sifat kontaminan, batas deteksi, dan stabiitas analit (Garfield et al. 2000). Menurut Horwitz (1979) diacu dalam Garfield et al. (2000), semakin rendah konsentrasi suatu analit, maka semakin besar pengaruh faktor-faktor tersebut terhadap ketertiruan suatu metode. Setiap penurunan konsentrasi analit sebanyak 10%, maka koefisien variasi akan bertambah sebanyak dua kali lipatnya. Hubungan ini tidak dipengarui oeh jenis analit, matriks, metode analisi, dan teknik pengukuran (Horwitz 1979 diacu dalam Garfield et al. 2000).
3. Batas deteksi dan batas kuantitasi
13
4. Spesifitas, linearitas, dan jangkauan
Selektivitas atau spesifisitas adalah kemampuan metode dalam mengukur zat tertentu secara cermat dan seksama dengan adanya komponen lain yang mungkin ada dalam matriks sampel. Selektivitas seringkali dapat dinyatakan sebagai derajat penyimpangan (degree of bias) metode yang dilakukan terhadap sampel yang mengandung bahan yang ditambahkan berupa cemaran, hasil urai, senyawa sejenis, senyawa asing lainnya, dan dibandingkan terhadap hasil analisis sampel yang tidak mengandung bahan lain yang ditambahkan. Selektivitas metode ditentukan dengan membandingkan hasil analisis sampel yang mengandung cemaran, hasil urai, senyawa sejenis, senyawa asing lainnya atau pembawa plasebo dengan hasil analisis sampel tanpa penambahan bahan-bahan tersebut.
Linieritas adalah kemampuan metode analisis dalam menghasilkan respon yang mmiliki hubungan proporsional dengan konsentrasi analit dalam sampel (Crowther et al. 2000). Sementara itu, jangkauan suatu prosedur analisis adalah rentang antara konsentrasi terendah dan konsentrasi tertinggi analit dalam sampel yang memiliki kecermatan, keseksamaan, dan linearitas yang diinginkan.
5. Ketangguhan, kekuatan, dan sensitivitas
Ketangguhan (ruggedness) suatu metode adalah derajat ketertiruan hasil uji yang diperoleh dari analisis sampel yang sama dalam berbagai kondisi uji normal, seperti laboratorium, analisis, instrumen, bahan pereaksi, suhu, hari yang berbeda, dan sebagainya. Ketangguhan umumnya dinyatakan sebagai tidak adanya pengaruh perbedaan operasi atau lingkungan kerja pada hasil uji. Ketangguhan metode merupakan ukuran ketertiruan pada kondisi operasi normal antara lab dan antar analis (Harmita 2004).
IV. METODE PENELITIAN
A.
Alat dan Bahan
Bahan-bahan yang digunakan adalah phaseolamin komersial, enzim α-amilase porcine pancreatin, larutan soluble starch 1% dalam 0.02 M buffer natrium fosfat (pH 6.9), 0.02 M buffer natrium fosfat (pH 6.9), air demineralisasi, larutan maltosa standar, asam 3,5-dinitrosalisilat, NaOH, dan Na-K-tartarat. Alat-alat yang digunakan adalah neraca analitik, water bath, dan spektrofotometer UV-Vis Double Beam.
B.
Pelaksanaan Eksperimen
Pelaksanaan eksperimen pada penelitian ini terdiri dari beberapa tahap (Gambar 5), yaitu pengukuran aktivitas penghambatan enzim α-amilase dengan cara mengukur kadar pati sisa dengan iodin, optimalisasi kondisi preinkubasi enzim dan inhibitor, pengukuran aktivitas penghambatan enzim α-amilase dengan metode Fossum dan Whitaker (1974), dan validasi metode dengan parameter keseksamaan. Konsentrasi inhibitor dan waktu preinkubasi yang digunakan dalam metode pengukuran aktivitas penghambatan enzim α-amilase dengan metode Fossum dan Whitaker (1974) adalah konsentrasi inhibitor dan waktu preinkubasi optimum yang didapatkan dari tahap penelitian sebelumnya. Tahap-tahap penelitian yang dibahas dalam skripsi ini hanya mencakup optimalisasi kondisi preinkubasi enzim dan inhibitor, pengukuran aktivitas penghambatan enzim α-amilase dengan metode Fossum dan Whitaker (1974), dan validasi metode dengan parameter keseksamaan.
Pengukuran aktivitas penghambatan enzim α-amilase (dengan mengukur kadar pati sisa dengan iodin)
Optimalisasi kondisi preinkubasi enzim dan inhibitor (konsentrasi inhibitor dan waktu preinkubasi)
Pengukuran aktivitas penghambatan enzim α-amilase (dengan metode Fossum dan Whitaker 1974)
Validasi metode dengan parameter keseksamaan
(Bagian yang dibahas dalam skripsi ini) Gambar 5. Diagram alir pelaksanaan eksperimen
1. Penentuan konsentrasi optimum inhibitor
15 Setelah itu, 1 ml larutan soluble starch ditambahkan ke dalam tabung reaksi dan inkubasi dilanjutkan selama 3 menit. Reaksi dihentikan dengan menambahkan reagen DNS sebanyak 1 ml. Kemudian, tabung reaksi dipanaskan dalam air mendidih selama 15 menit, didinginkan, ditambahkan 6 ml air demineralisasi, dan diukur absorbansinya pada panjang gelombang 540 nm. Blanko dibuat terpisah dengan cara kerja yang sama kecuali larutan enzim ditambahkan setelah penambahan reagen DNS.
Kurva standar maltosa dibuat dengan memasukkan 0, 0.05, 0.25, 0.45, 0.65, dan 0.85 ml larutan maltosa dengan konsentrasi 2 mg/ml ke dalam satu seri tabung reaksi. Air demineralisasi ditambahkan ke dalam masing-masing tabung sehingga volume total tiap tabung adalah 2 ml. Sebanyak 1 ml reagen DNS ditambahkan, kemudian tabung dipanaskan dalam air mendidih selama 5 menit, didinginkan, ditambahkan 7 ml air demineralisasi dan diukur absorbansinya pada panjang gelombang 540 nm.
2. Penentuan waktu preinkubasi optimum
Terdapat dua percobaan, yaitu percobaan A (dengan inhibitor) dan percobaan B (tanpa inhibitor). Pada percobaan A, 1 ml larutan enzim (0,1 mg/ml) dan 1 ml larutan inhibitor (dengan konsentrasi optimum yang didapatkan sebelumnya) dipipet ke dalam tabung reaksi dan diinkubasi pada suhu 37oC selama 40, 60, 80, 100, dan 120 menit. Setelah itu, 1 ml larutan soluble starch ditambahkan ke dalam tabung reaksi dan inkubasi dilanjutkan selama 3 menit. Reaksi dihentikan dengan menambahkan reagen DNS sebanyak 1 ml. Kemudian, tabung dipanaskan dalam air mendidih selama 5 menit, didinginkan, ditambahkan 7 ml air demineralisasi dan diukur absorbansinya pada panjang gelombang 540 nm.
Sementara itu, pada percobaan B, 1 ml larutan enzim (0,1 mg/ml) dan 1 ml larutan soluble starch dipipet ke dalam tabung reaksi dan diinkubasi pada suhu 37oC selama 3 menit. Reaksi dihentikan dengan menambahkan reagen DNS sebanyak 1 ml. Kemudian, tabung reaksi dipanaskan dalam air mendidih selama 15 menit, didinginkan, ditambahkan 7 ml air demineralisasi, dan diukur absorbansinya pada panjang gelombang 540 nm. Blanko setiap percobaan dibuat terpisah dengan cara kerja yang sama kecuali larutan enzim ditambahkan setelah penambahan reagen DNS. Setiap percobaan dilakukan triplo.
Kurva standar maltosa dibuat dengan memasukkan 0, 0.05, 0.25, 0.45, 0.65, 0.85, dan 1.15 ml larutan maltosa dengan konsentrasi 2 mg/ml ke dalam satu seri tabung reaksi. Air demineralisasi ditambahkan ke dalam masing-masing tabung sehingga volume total tiap tabung adalah 2 ml. Sebanyak 1 ml reagen DNS ditambahkan, kemudian tabung dipanaskan dalam air mendidih selama 5 menit, didinginkan, ditambahkan 7 ml air demineralisasi dan diukur absorbansinya pada panjang gelombang 540 nm.
3. Preinkubasi inhibitor dan enzim
16 Sementara itu, pada percobaan B, 1 ml larutan enzim (0,1 mg/ml) dan 1 ml larutan soluble starch dipipet ke dalam tabung reaksi dan diinkubasi pada suhu 37oC selama 3 menit. Setiap percobaan dilakukan triplo.
4. Pengukuran aktivitas penghambatan enzim (Fossum dan Whitaker 1974, dengan modifikasi)
Larutan reagen DNS disiapkan dengan cara melarutkan 75 g Na-K-tartarat ke dalam 50 ml NaOH 2 M sambil dipanaskan. Kemudian, di gelas piala terpisah, 2.7375 g asam 3,5-dinitrosalisilat dilarutkan dalam 125 ml air demineralisasi. Kedua larutan dicampur sambil dipanaskan hingga tercampur merata. Volume larutan ditepatkan hingga 250 ml dengan air demineralisasi. Reagen disimpan dalam botol kaca berwarna coklat (Bernfeld 1954 dalam Geethalakshmi et al. 2010).
Reaksi enzimatis pada percobaan A dan B dihentikan dengan menambahkan 1 ml larutan reagen DNS. Kemudian, tabung reaksi dipanaskan dalam air mendidih selama 15 menit, didinginkan, ditepatkan volumenya hingga 10 ml dengan air demineralisasi air demineralisasi, dan diukur absorbansinya pada panjang gelombang 540 nm. Blanko setiap perlakuan dibuat terpisah dengan cara kerja yang sama kecuali larutan enzim ditambahkan setelah penambahan larutan reagen DNS.
Kurva standar maltosa dibuat dengan memasukkan 0, 0.10, 0.25, 0.40, 0.55, 0.70, 0.85, dan 1.00 ml larutan maltosa dengan konsentrasi 4 mg/ml ke dalam satu seri tabung reaksi. Air demineralisasi ditambahkan ke dalam masing-masing tabung sehingga volume total tiap tabung adalah 2 ml. Sebanyak 1 ml reagen DNS ditambahkan, kemudian tabung dipanaskan dalam air mendidih selama 5 menit, didinginkan, ditambahkan 7 ml air demineralisasi dan diukur absorbansinya pada panjang gelombang 540 nm.
Perhitungan aktivitas enzim α-amilase dihitung dengan rumus: Jumlah maltosa yang terbentuk (mg) ÷ Berat molekul maltosa (60,32 g/mol) ÷ Waktu inkubasi (menit) ÷ Jumlah
enzim yang digunakan (ml) x 1000 (faktor konversi). Aktivitas enzim α-amilase dinyatakan sebagai UI/ml, yaitu jumlah mikromol maltosa yang dapat dibebaskan oleh 1 ml enzim α -amilase dari substrat soluble starch per menit (Deshpande et al. 1982). Persen penghambatan
dihitung dengan rumus: ((Aktivitas enzim α-amilase tanpa inhibitor – Aktivitas enzim α
-amilase dengan inhibitor) ÷ Aktivitas enzim α-amilase tanpa inhibitor) x 100%.
5. Validasi metode
Inhibitor amilase (mg/ml)
V. HASIL DAN PEMBAHASAN
A.
Konsentrasi Optimum Inhibitor
Konsentrasi inhibitor merupakan parameter yang penting untuk sebuah metode pengukuran aktivitas penghambatan enzim oleh senyawa inhibitor,. Menurut Mehrabadi et al. (2009), konsentrasi senyawa inhibitor enzim α-amilase mempengaruhi aktivitas penghambatan enzim α -amilase. Dosis senyawa inhibitor α-amilase yang berasal dari Triticale sebesar 0.25 mg dapat
menghambat aktivitas enzim α-amilase sebesar 10%. Sementara itu, dengan dosis yang lebih
tinggi, yaitu 1.5 mg, aktivitas enzim α-amilase terhambat sebesar 80% (Mehrabadi et al. 2009).
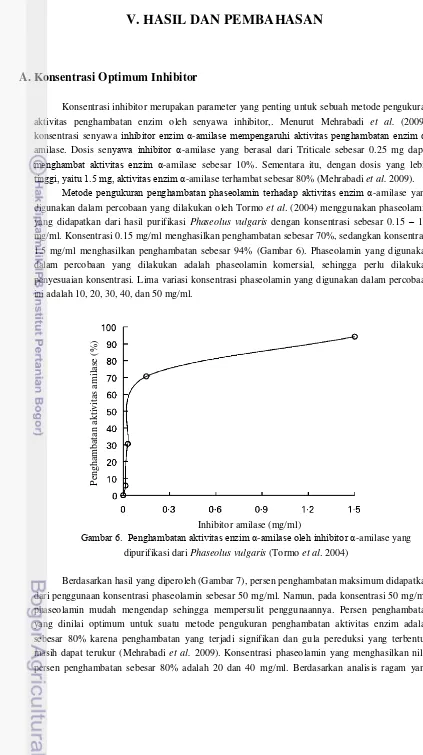
Metode pengukuran penghambatan phaseolamin terhadap aktivitas enzim α-amilase yang digunakan dalam percobaan yang dilakukan oleh Tormo et al. (2004) menggunakan phaseolamin yang didapatkan dari hasil purifikasi Phaseolus vulgaris dengan konsentrasi sebesar 0.15 – 1.5 mg/ml. Konsentrasi 0.15 mg/ml menghasilkan penghambatan sebesar 70%, sedangkan konsentrasi 1.5 mg/ml menghasilkan penghambatan sebesar 94% (Gambar 6). Phaseolamin yang digunakan dalam percobaan yang dilakukan adalah phaseolamin komersial, sehingga perlu dilakukan penyesuaian konsentrasi. Lima variasi konsentrasi phaseolamin yang digunakan dalam percobaan ini adalah 10, 20, 30, 40, dan 50 mg/ml.
Gambar 6. Penghambatan aktivitas enzim α-amilase oleh inhibitor α-amilase yang dipurifikasi dari Phaseolus vulgaris (Tormo et al. 2004)
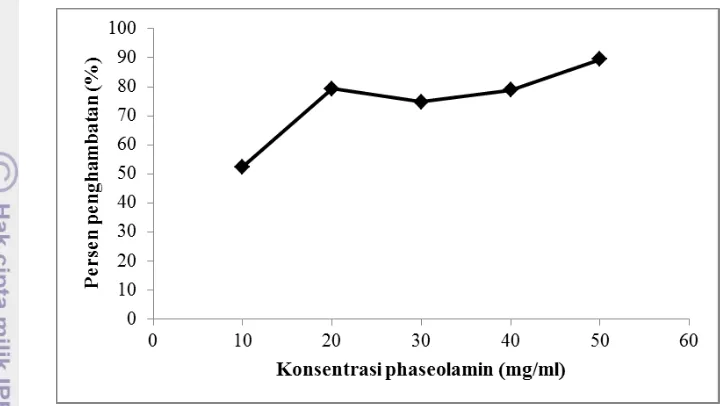
Berdasarkan hasil yang diperoleh (Gambar 7), persen penghambatan maksimum didapatkan dari penggunaan konsentrasi phaseolamin sebesar 50 mg/ml. Namun, pada konsentrasi 50 mg/ml, phaseolamin mudah mengendap sehingga mempersulit penggunaannya. Persen penghambatan yang dinilai optimum untuk suatu metode pengukuran penghambatan aktivitas enzim adalah sebesar 80% karena penghambatan yang terjadi signifikan dan gula pereduksi yang terbentuk masih dapat terukur (Mehrabadi et al. 2009). Konsentrasi phaseolamin yang menghasilkan nilai persen penghambatan sebesar 80% adalah 20 dan 40 mg/ml. Berdasarkan analisis ragam yang
Pen
g
h
a
m
ba
ta
n
a
kt
ivi
ta
s
a
mil
as
e
(%
18 dilakukan (Lampiran 3), nilai persen penghambatan yang dihasilkan oleh kedua konsentrasi inhibitor ini tidak berbeda secara signifikan pada taraf signifikansi 0.05. Pada phaseolamin dengan konsentrasi 20 mg/ml, phaseolamin yang digunakan lebih sedikit dibandingkan dengan konsentrasi 40 mg/ml sehingga konsentrasi 20 mg/ml lebih efisien.
Gambar 7. Grafik hubungan antara konsentrasi phaseolamin dengan persen penghambatan
aktivitas enzim α-amilase hasil percobaan
Pada percobaan yang dilakukan oleh Tormo et al. (2004), konsentrasi phaseolamin yang dibutuhkan untuk menghasilkan persen penghambatan sebesar 80% adalah 0.6 mg/ml. Sementara itu, konsentrasi phaseolamin yang menghasilkan persen penghambatan 80% pada percobaan ini adalah 20 mg/ml. Perbedaan konsentrasi yang cukup besar disebabkan oleh adanya perbedaan metode, kondisi preinkubasi, dan phaseolamin yang digunakan. Tormo et al. (2004) menggunakan alat diagnosa amilase dan metode Wallenfels et al. (1978) dengan waktu preinkubasi selama 30 menit. Selain itu, phaseolamin yang diuji oleh Tormo et al. (2004) berasal dari hasil purifikasi dari ekstrak Phaseolus vulgaris. Sementara itu, percobaan ini menggunakan metode Bernfeld (1955) dengan reagen DNS untuk mengukur gula pereduksi yang terbentuk, waktu preinkubasi selama 60 menit, dan phaseolamin komersial. Hal ini menunjukkan bahwa perbedaan metode, waktu preinkubasi, dan jenis phaseolamin yang digunakan dapat mempengaruhi pengukuran aktivitas
penghambatan phaseolamin terhadap α-amilase.
Koefisien determinasi yang didapatkan dari hasil analisis ragam adalah sebesar 97.98% (Lampiran 3). Koefisien determinasi menunjukkan persentase keragaman data yang dijelaskan oleh model (Saefuddin et al. 2009). Koefisien determinasi yang tinggi menunjukkan adanya hubungan yang erat antara konsentrasi inhibitor dengan persen penghambatan yang dihasilkan oleh inhibitor. Hal ini sesuai dengan pernyataan Mehrabadi et al. (2009) bahwa konsentrasi senyawa
inhibitor enzim α-amilase mempengaruhi aktivitas penghambatan enzim α-amilase.
Menurut hasil penelitian yang dilakukan Mehrabadi et al. (2009), hubungan antara
19 yang sulit larut dalam larutan penyangga pada konsentrasi yang terlalu tinggi, sehingga phaseolamin dapat mengendap dan menyebabkan kesalahan dalam percobaan karena phaseoamin tidak terdispersi secara sempurna dalam larutan penyangga.
Tidak terdapat data mengenai kelarutan phaseolamin komersial. Namun, senyawa α-AI1 merupakan protein, sehingga kelarutannya bergantung pada titik isoelektriknya (pI). Saat pH larutan berada di atas titik isoelektrik protein, maka residu asam amino yang terletak di permukaan akan bersifat negatif sehingga protein juga menjadi bersifat negatif dan akan tertinggal di fase larutan. Sebaliknya, jika pH larutan berada di bawah titik isoelektrik protein, protein akan menjadi tidak larut dan tertinggal di fase interfasial (Dennison dan Lovrient 1997 diacu dalam Wang et al.2011). Menurut Lajolo dan Filho (1985) diacu dalam Wang et al.(2011), titik isoelektrik α-AI1 adalah sebesar 5.2.
Nilai pH larutan penyangga yang digunakan untuk melarutkan phaseolamin dalam percobaan ini adalah 6.9, di atas titik isoelektrik phaseolamin, sehingga phaseolamin dapat larut. Namun, pada saat melakukan percobaan, phaseolamin di atas 20 mg/ml yang dilarutkan dalam larutan penyangga tidak terdispersi secara sempurna jika dilihat dengan kasatmata. Oleh karena itu, konsentrasi phaseolamin sebesar 20 mg/ml dinilai paling baik karena pada konsentrasi tersebut phaseolamin masih dapat larut dan dapat digunakan dalam metode pengukuran.
B.
Waktu Optimum Preinkubasi
Penghambatan phaseolamin terhadap enzim α-amilase terjadi saat preinkubasi phaseolamin
dan enzim α-amilase sebelum penambahan substrat. Hal ini menunjukkan bahwa kompleks enzim
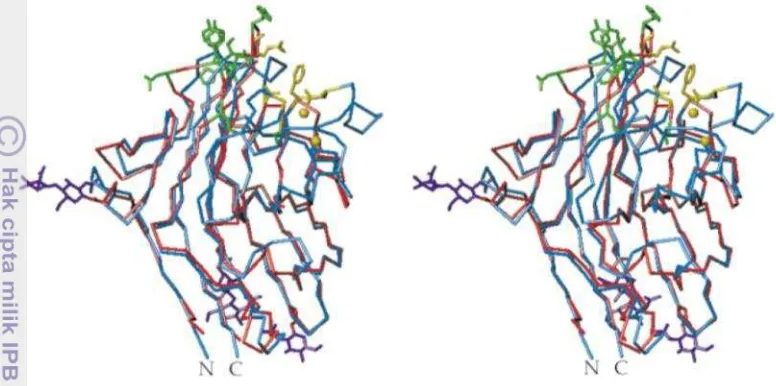
α-amilase dengan phaseolamin terbentuk saat preinkubasi (Santimone et al. 2004). Kompleks enzim dengan inhibitor ditunjukkan pada Gambar 8. Enzim α-amilase porcine pancreatin ditunjukkan dalam bentuk α-heliks berwarna merah dan β-strands berwarna biru. Ikatan penghubung ditunjukkan dengan warna kuning, sedangkan α-AI1 berwarna ungu.
Gambar 8. Struktur kompleks enzim α-amilase dengan α-AI1 (Bompard-Gilles et al. 1996)
Studi awal yang mengukur aktivitas penghambatan phaseolamin terhadap enzim α-amilase menunjukkan bahwa sebesar 8.16 x 10-6 µ mol phaseolamin dapat menghambat 6.63 x 10-6 µ mol
20 (Marshall et al. 1975). Namun, perhitungan stokiometri pada studi awal ditentukan berdasarkan berat molekul phaseolamin sebesar 49 kDa. Sementara itu, menurut Lee dan Whitaker (2000) diacu dalam Obiro et al. (2008), berat molekul phaseolamin adalah sebesar 56.7 kDa, sehingga stokiometri penghambatan yang sebenarnya adalah dua banding satu.
Phaseolamin merupakan senyawa dimer dan berinteraksi dengan dua molekul enzim. Setiap
monomer senyawa α-AI1 mengikat sisi aktif molekul enzim. Interaksi terbesar dengan enzim α -amilase terjadi pada depresi berbentuk V pada sisi aktif enzim. Inhibitor α-AI1 menghambat pencernaan karbohidrat secara efektif dengan mencegah akses substrat terhadap sisi aktif enzim (Bompard-Gilles et al. 1996). Menurut Wilcox dan Whitaker (1984) diacu dalam Bompard-Gilles et al. (1996), penghambatan enzim α-amilase oleh α-AI1 berlangsung lambat karena dibutuhkan waktu untuk terjadinya perubahan konformasi. Perubahan ini menyebabkan berubahnya sisi aktif enzim sehingga substrat tidak dapat terikat pada sisi aktif enzim α-amilase. Menurut Bompard-Gilles et al. (1996), α-AI1 menghambat enzim α-amilase secara kuat dengan koefisien disosiasi sebesar 3.5x10-11 M pada pH netral.
Berdasarkan penelitian yang dilakukan oleh Marshall dan Lauda (1975) dan Frels dan Rupnow (1975), penghambatan phaseolamin terhadap enzim α-amilase bersifat non-kompetitif. Plot Lineweaver-Bulk enzim α-amilase tanpa dan dengan inhibitor α-AI1 dapat dilihat pada Gambar 9. Berdasarkan plot tersebut, terlihat bahwa inhibitor α-AI1 menghambat enzim α-amilase secara non-kompetitif.
Gambar 9. Plot Lineweaver-Bulk enzim α-amilase tanpa(○) dan dengan (●) inhibitor α-AI1 (Marshall dan Lauda 1975)
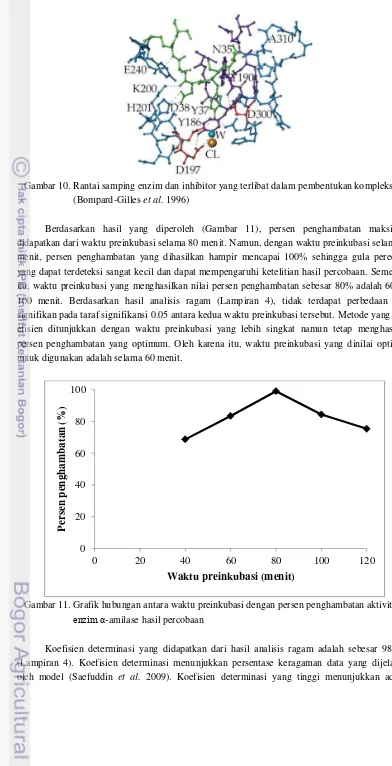
21 Gambar 10. Rantai samping enzim dan inhibitor yang terlibat dalam pembentukan kompleks
(Bompard-Gilles et al. 1996)
Berdasarkan hasil yang diperoleh (Gambar 11), persen penghambatan maksimum didapatkan dari waktu preinkubasi selama 80 menit. Namun, dengan waktu preinkubasi selama 80 menit, persen penghambatan yang dihasilkan hampir mencapai 100% sehingga gula pereduksi yang dapat terdeteksi sangat kecil dan dapat mempengaruhi ketelitian hasil percobaan. Sementara itu, waktu preinkubasi yang menghasilkan nilai persen penghambatan sebesar 80% adalah 60 dan 100 menit. Berdasarkan hasil analisis ragam (Lampiran 4), tidak terdapat perbedaan yang signifikan pada taraf signifikansi 0.05 antara kedua waktu preinkubasi tersebut. Metode yang lebih efisien ditunjukkan dengan waktu preinkubasi yang lebih singkat namun tetap menghasilkan persen penghambatan yang optimum. Oleh karena itu, waktu preinkubasi yang dinilai optimum untuk digunakan adalah selama 60 menit.
Gambar 11. Grafik hubungan antara waktu preinkubasi dengan persen penghambatan aktivitas
enzim α-amilase hasil percobaan
Koefisien determinasi yang didapatkan dari hasil analisis ragam adalah sebesar 98.77% (Lampiran 4). Koefisien determinasi menunjukkan persentase keragaman data yang dijelaskan oleh model (Saefuddin et al. 2009). Koefisien determinasi yang tinggi menunjukkan adanya
0 20 40 60 80 100
0 20 40 60 80 100 120
P
er
se
n
p
en
g
h
a
m
b
a
ta
n
(
%
)
22 hubungan yang erat antara waktu preinkubasi dengan persen penghambatan yang dihasilkan oleh inhibitor.
Menurut penelitian yang dilakukan oleh Frels dan Rupnow (1985), adanya maltosa, senyawa inhibitor enzim α-amilase yang bersifat kompetitif, dalam campuran preinkubasi phaseolamin dan enzim α-amilase dapat mencegah pembentukan kompleks inhibitor dan enzim. Namun, jika maltosa ditambahkan pada larutan enzim α-amilase dan phaseolamin yang telah diinkubasi selama 16 jam, konsentrasi maltosa hingga 87mM tidak mempengaruhi penghambatan. Hal ini menunjukkan bahwa kompleks enzim dan inhibitor yang terbentuk memiliki interaksi yang kuat.
Maltosa dapat terbentuk dari pemecahan soluble starch oleh enzim α-amilase. Berdasarkan percobaan yang dilakukan, persen penghambatan berkurang setelah dilakukan preinkubasi di atas 80 menit. Namun, seharusnya semakin lama preinkubasi, semakin kuat interaksi antara enzim dan inhibitor sehingga maltosa yang terbentuk setelah penambahan substrat tidak mempengaruhi aktivitas penghambatan phaseolamin terhadap enzim α-amilase.
Desseaux et al. (2002) menyatakan bahwa kondisi preinkubasi selama 2 jam memastikan terjadinya keseimbangan antara enzim, inhibitor, dan kompleks enzim-inhibitor. Selain itu, berdasarkan hasil percobaannya, Desseaux et al. (2002) menunjukkan bahwa terdapat dua kompleks pada saat kondisi kesetimbangan dan penambahan substrat, yaitu kompleks enzim-inhibitor dan kompleks enzim-enzim-inhibitor-substrat. Pada percobaan ini, waktu preinkubasi yang digunakan hanya hingga 120 menit. Berkurangnya nilai persen penghambatan phaseolamin setelah dilakukan preinkubasi lebih dari 80 menit menunjukkan terjadinya keseimbangan reaksi antara enzim, inhibitor, dan kompleks enzim-inhibitor, sehingga masih dapat terjadi penurunan aktivitas penghambatan phaseolamin terhadap enzim α-amilase.
C.
Validasi Metode Analisis
Metode-metode analisis yang terdapat di buku panduan yang diterbitkan oleh Collaborative International Pesticide Analytical Council (CIPAC) dan Association of Official Analytical Chemists (AOAC International) untuk konstituen aktif dan produk kimia di bidang pertanian diakui secara legal sebagai metode yang berlaku (APVMA 2004). Metode-metode analisis tersebut dianggap telah tervalidasi dan tidak membutuhkan revalidasi. Namun, kesesuaian penggunaan metode tersebut harus diverifikasi pada kondisi aktual, seperti selektivitas dan ketepatan metode saat diaplikasikan pada matriks sampel dan kondisi laboratorium tertentu. Metode pengukuran penghambatan phaseolamin terhadap aktivitas enzim α-amilase belum terdapat dalam buku panduan yang telah disebutkan sebelumnya. Oleh karena itu, metode yang dikembangkan memerlukan validasi sehingga dapat digunakan sebagai metode uji di PT Nutrifood Indonesia.
Produk yang mengandung phaseolamin diklaim dapat menghambat metabolisme karbohidrat. Penghambatan tersebut dapat dilihat dari adanya penurunan kadar glukosa dalam darah. Berdasarkan penelitian yang dilakukan oleh Tormo et al. (2004), phaseolamin dapat menyebabkan terjadinya penurunan glukosa dalam darah secara in vivo. Phaseolamin yang digunakan dalam penelitian tersebut juga diuji aktivitas penghambatannya secara in vitro. Hasil
penelitian menunjukkan bahwa phaseolamin dapat menghambat enzim α-amilase secara in vitro. Hal ini menunjukkan bahwa adanya korelasi yang erat antara aktivitas phaseolamin secara in vitro dan in vivo, sehingga dengan memastikan bahwa adanya penghambatan phaseolamin terhadap
23 aktivitas secara in vivo. Oleh karena itu, pengukuran aktivitas penghambatan phaseolamin terhadap
enzim α-amilase cukup dilakukan secara in vitro untuk menunjukkan adanya aktivitas penghambatan yang terjadi secara in vivo dan memastikan kualitas phaseolamin.
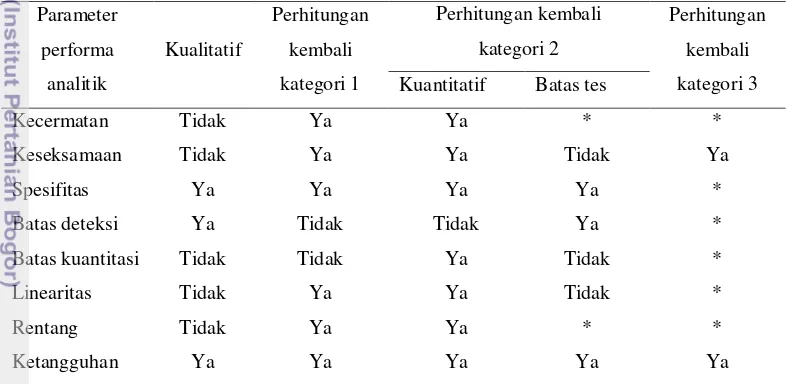
Parameter analitik yang diperlukan untuk validasi metode dapat bervariasi bergantung pada tipe prosedur analitik. Parameter yang digunakan untuk validasi metode pengukuran aktivitas enzim adalah keseksamaan, linearitas, dan limit deteksi (Fuentes et al. 2011). Sementara itu, Harmita (2004) menggolongkan metode yang digunakan untuk pemeriksaan produk farmasetika menjadi tiga kategori, yaitu 1) Kategori 1: metode analitik untuk kuantitasi komponen maupun substansi bahan baku obat atau bahan aktif (termasuk pengawet) pada hasil akhir farmasetika, 2) Kategori 2: metode analitik untuk menentukan campuran dalam substansi bahan baku atau komponen sisa pada produk akhir farmasetika, dan 3) Kategori 3: metode analitik ini untuk menentukan performa karakteristik (contoh: disolusi, pelepasan obat). Tabel 2 menunjukkan parameter analitik yang harus dipertimbangkan untuk tipe prosedur analitik yang berbeda (Harmita 2004). Metode pengukuran penghambatan phaseolamin terhadap aktivitas enzim α-amilase termasuk dalam kategori ketiga. Oleh karena itu, parameter yang pasti dibutuhkan untuk validasi metode adalah keseksamaan dan ketangguhan. Sementara itu, parameter lainnya bergantung pada sifat metode.
Tabel 2. Parameter analitik yang harus dipertimbangkan untuk tipe prosedur analitik yang berbeda (Harmita 2004) Parameter performa analitik Kualitatif Perhitungan kembali kategori 1 Perhitungan kembali kategori 2 Perhitungan kembali kategori 3 Kuantitatif Batas tes
Kecermatan Tidak Ya Ya * *
Keseksamaan Tidak Ya Ya Tidak Ya
Spesifitas Ya Ya Ya Ya *
Batas deteksi Ya Tidak Tidak Ya *
Batas kuantitasi Tidak Tidak Ya Tidak *
Linearitas Tidak Ya Ya Tidak *
Rentang Tidak Ya Ya * *
Ketangguhan Ya Ya Ya Ya Ya
* Mungkin dibutuhkan, bergantung pada sifat tes yang spesifik
24 Keseksamaan dapat dinyatakan sebagai keterulangan (repeatability) atau ketertiruan (reproducibility). Keterulangan adalah keseksamaan metode jika dilakukan berulang kali oleh analis yang sama pada kondisi yang sama dan dalam interval waktu yang pendek (Harmita 2004). Sementara itu, ketertiruan adalah keseksamaan metode jika dilakukan pada kondisi berbeda, seperti analis, pereaksi, dan pelarut yang berbeda. Keterulangan dapat dilakukan dalam laboratorium yang sama oleh analis sama, sedangkan ketertiruan harus dilakukan oleh analis yang berbeda.
Parameter keseksamaan yang digunakan untuk validasi metode ini adalah keterulangan karena analis yang melakukan adalah analis yang sama. Percobaan keseksamaan keterulangan dilakukan dengan mengambil paling sedikit enam replika sampel dari campuran sampel yang homogen. Keenam data tersebut kemudian diolah dan dicari rata-rata, simpangan baku (Standard Deviation atau SD), simpangan baku relatif (Relative Standard Deviation atau RSD) dan dibandingkan dengan simpangan baku relatif Horwitz (RSD Horwitz). RSD Horwits dihitung dengan rumus 2(1 - 0.5 x log c), dimana c adalah rata-rata persen penghambatan amilase pada perhitungan ini (APVMA 2004).
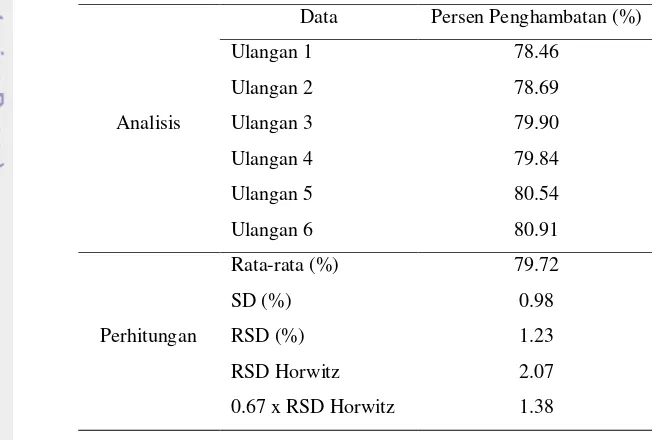
Penetapan keseksamaan suatu metode dengan parameter keterulangan harus memenuhi syarat bahwa RSD analisis metode tersebut lebih kecil daripada o.67 kali RSD Horwitz (Harmita 2004). Berdasarkan hasil yang diperoleh (Tabel 3), RSD hasil perhitungan analisis, yaitu sebesar 1.23%, memiliki nilai yang lebih kecil dibandingkan dengan 0.67 kali RSD Horwitz, yaitu sebesar 1.38%. Hal ini menunjukkan bahwa metode yang digunakan dapat mengukur aktivitas penghambatan phaseolamin terhadap enzim α-amilase secara seksama.
Tabel 3. Hasil uji keseksamaan keterulangan persen penghambatan phaseolamin terhadap aktivitas enzim α-amilase
Analisis
Data Persen Penghambatan (%)
Ulangan 1 78.46
Ulangan 2 78.69
Ulangan 3 79.90
Ulangan 4 79.84
Ulangan 5 80.54
Ulangan 6 80.91
Perhitungan
Rata-rata (%) 79.72
SD (%) 0.98
RSD (%) 1.23
RSD Horwitz 2.07
0.67 x RSD Horwitz 1.38
25 Tabel 4. Rekomendasi keseksamaan dari APVMA (2004)
Komponen dalam sampel Keseksamaan
>10.0% ≤ 2%
1.0 hingga 10.0% ≤ 5% 0.1 hingga 1.0% ≤ 10%
< 0.1% ≤ 20%
Namun, diperlukan validasi metode ini dengan parameter ketangguhan untuk menunjukkan bahwa metode ini cukup tangguh untuk dilakukan di laboratorium yang berbeda. Parameter ketangguhan tidak dapat dilakukan karena keterbatasan analis dan laboratorium. Validasi metode dengan parameter ketangguhan dapat dilakukan dalam laboratorium yang berbeda oleh analis yang berbeda dengan kondisi operasi dan lingkungan yang berbeda tetapi menggunakan prosedur dan parameter uji yang sama. Deraat ketertiruan hasil uji ditentukan sebagai fungsi dari variabel penentuan. Ketertiruan dapat dibandingkan terhadap keseksamaan yang didapatkan dari kondisi normal sehingga didapatkan ukuran ketangguhan metode. Perhitungannya dilakukan secara statistik menggunakan analisis ragam (Harmita 2004).
VI. SIMPULAN
Parameter yang digunakan dalam penentuan kondisi preinkubasi optimum adalah konsentrasi phaseolamin dan waktu preinkubasi. Berdasarkan hasil yang diperoleh, persen penghambatan maksimum dihasilkan dengan konsentrasi phaseolamin sebesar 50 mg/ml dan waktu preinkubasi selama 80 menit. Sementara itu, persen penghambatan optimum didapatkan dari konsentrasi phaseolamin sebesar 20 mg/ml dan waktu preinkubasi selama 60 menit. Oleh karena itu, kondisi preinkubasi yang akan digunakan dalam metode ini adalah konsentrasi phaseolamin sebesar 20 mg/ml dan waktu preinkubasi selama 60 menit.
Validasi metode pengukuran aktivitas penghambatan phaseolamin terhadap aktivitas enzim α -amilase menggunakan parameter keseksamaan dan ketangguhan. Namun, parameter yang hanya dapat dilakukan adalah keseksamaan karena parameter ketangguhan membutuhkan analis dan laboratorium yang berbeda. Berdasarkan hasil yang diperoleh, RSD hasil perhitungan analisis (1.23) memiliki nilai yang lebih kecil dibandingkan dengan 0.67 kali RSD Horwitz (1.38). Hal ini menunjukkan bahwa
VII. REKOMENDASI
Metode ini memerlukan validasi lebih lanjut dengan parameter ketangguhan karena, seharusnya, terdapat dua parameter validasi yang harus dilakukan, yaitu keseksamaan dan ketangguhan. Namun, karena keterbatasan analis dan laboratorium, maka parameter ketangguhan tidak dapat dilakukan. Oleh karena itu, perlu dilakukan validasi dengan parameter ketangguhan untuk menunjukkan bahwa metode ini cukup tangguh untuk dilakukan di laboratorium yang berbeda.
PENGEMBANGAN DAN VALIDASI METODE
ANALISIS
PENGHAMBATAN AKTIVITAS ENZIM ALFA AMILASE OLEH
PHASEOLAMIN DARI EKSTRAK WHITE KIDNEY BEAN
(PHASEOLUS VULGARIS) DI PT NUTRIFOOD INDONESIA
SKRIPSI
Amelinda Angela
F24070089
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
DAFTAR PUSTAKA
[APVMA] Australian Pesticides & Veterinary Medicins Authority. 2004. Guidelines for the validation methods for active constituent, agriculture and veterinary chemical products. Australia. Bernfeld P. 1955. Amylases, alpha and beta. In: Colowick SP, Kaplan NO (eds.). Methods in
Enzymology, vol. 1. New York: Academic Press, pp 149–158.
Boivin M, Zinsmeister AR, Go VL, DiMagno EP. 1987. Effect of purified amylase inhibitor on carbohydrate metabolism after a mixed meal in healthy humans. Mayo Clin Proc 62: 249-255.
Bompard-Gilles C, Rousseau P, Rouge P, Payan F. 1996. Substrate mimicry in the active center of a mammalian α-amylase: structural analysis of an enzyme-inhibitor complex. Structure 4: 1441-1452.
Celleno L, Tolaini MV, D’Amore A, Perricone NV, Preuss HG. 2007. A dietary supplement
containing standardized Phaseolus vulgaris extract influences body composition of
overweight men and women. Int J Med Sci 4 (1): 45-52.
Crapo P. 1984. Theory vs fact: The glycemic response to foods. Nutr Today 14: 6.
Crowther JB, Jimidar MI, Niemeijer N, Salomons P. 2000. Qualification of laboratory instrumentation, validation, and transfer of analytical methods. In: Miller JM, Crowther JB (eds.). Analytical Chemistry in A GMP Environment: A Practical Guide. New York: John Wiley & Sons, Inc.
Dennison C, Lovrient R. 1997. Three phase partitioning: Concentration and purification of protein. Protein Expression and Purification, 11, pp. 149-161.
Deshpande SS, Sathe SK, Salunkhe DK, Cornforth, DP. 1982. Effects of dehulling on phytic acid, polyphenols, and enzyme inhibitors of dry beans (Phaseolus vulgaris L.). J Food Sci 47: 1846-1850.
Fossum K, Whitaker JR. 1974. Simple method for detecting amylase inhibitors in biological materials. J Nutr 104: 930-936.
Frels JM, Rupnow JH. 1985. Characterization of two α-amylase inhibitors from black bean (Phaseolus vulgaris). J Food Sci 50: 72-77.
Fuentes M, Tecles F, Gutiérrez A, Otal J, Martinez-Subiela S, Cerón JJ. 2011. Validation of an
automated method for salivary alpha-amylase measurements in pigs (Sus scrofa domesticus)
and its application as a stress biomarker. J Vet Diagn Invest 23: 282-287.
Garfield FM, Klesta E, Hirsch J. 2000. Quality Assurance Principles for Analytica Laboratories. Gaithersburg: AOAC International.
Geethalakshmi R, Sarada DVL, Marimuthu P, Ramasamy K. 2010. α-amylase inhibitory activitiy of
Trianthema decandra L. Int J Biotech Biochem 6 (3): 369-376.
Gibbs BF, Alli I. 1998. Characterization of a purified α-amylase inhibitor from white kidney beans (Phaseolus vulgaris). Food Res Int 31: 217-225.
Green III F, Clausen CA, Highley TL. 1989. Adaptation of the Nelson-Somogyi reducing-sugar assay to microassay using microtiter plates. Analytical Biochem 182: 197-199.
Gunawan A dan Tandra H. 1998. Patogenesis diabetes mellitus tidak tergantung insulin (DMTII). Pusat Diabetisi dan Nutrisi RSUD Dr. Soetomo – FK Unair. Majalah Diabetes, Vol. 4, No. 1. Surabaya.
29 Ho MF, Yin X, Filho FF, Lajolo F, Whitaker JR. 1994. Naturally occurring α-amilase inhibitors: Structure/function relationships. In: Yada RY, Jackman RL, Smith JL (eds.). Protein Structure-Function Relationships in Foods. Glasgow: Blackie Academic and Professional, pp 89-119.
Horwitz W. 1979. Review of tin analysis. J Assoc Off Anal Chem 62: 1251-1264.
Iguti AM, Lajolo FM. 1991. Occurrence and purification of α-amylase isoinhibitors in bean (Phaseolus vulgaris L.) varieties. J Agric Food Chem 39: 2131-2136.
Jaffe WG, Moreno R, Wallis V. 1973. Amylase inhibitors in legume seeds. Nutr Rep Inter 7: 169. Jenkins DJA, Wolever, TMS, Jenkins AL, Thompson LJ, Rao AV, Francis T. 1986. The glycemic
index: Blood glucose response to foods. In: Vahouny GV, Kritchevsky D (eds). Dietary Fiber: Basic and Clinical Aspects. New York: Plenum Press, pp 167.
Kotaru M, Yoshikawa H, Ikeuchi T, Saito K, Iwami K, Ibuki F. 1987. An α-amylase inhibitor from cranberry bean (Phaseolus vulgaris): its specifity in inhibition of mammalian pancreatic
α-amylases and formation of a complex with porcine enzyme. J Nutr Sci Vitaminol (Tokyo) 33: 359-367.
Lajolo FM, Filho FF. 1985. Partial characterization of the amylase inhibitor of black beans (Phaseolus vulgaris), variety Rico 23. J Agric Food Chem 33: 132-138.
Le Berre-Anton V, Bompard-Gilles C, Payan F, Rouge P. 1997. Characterization and functional properties of the α-amylase inhibitor (α-AI) from kidney bean (Phaseolus vulgaris) seeds. Biochim Biophys Acta 1343: 31-40.
Lee SC, Gepts PL, Whitaker JR. 2002. Protein structures of common bean (Phaseolus vulgaris)
α-amylase inhibitors. J Agric Food Chem 50: 6618-6627.
Lee SC, Whitaker JR. 2000. The molecular weight of α-amylase inhibitor from white kidney bean cv 858B (Phaseolus vulgaris L.) is 56 kDa, not 20 kDa. J Food Biochem 24: 55-67.
Lehnanger AL. 1990. Dasar-dasar Biokimia Jilid I. Terjemahan dari: Principles of Biochemistry. Suhartono MT, penj. Jakarta: Penerbit Erlangga.
Mehrabadi M, Bandani AR, Saadatif F. 2009. Inhibition of Sunn pest, Eurygaster integriceps, α-amylases by α-α-amylases Inhibitors (T-αAI) from Triticale. J Insect Sci 10: 179.
Marshall JJ, Lauda CM. 1975. Purification and properties of phaseolamin, an inhibitor of α-amylase, from kidney bean, Phaseolus vulgaris. J Biol Chem 250: 8030-8037.
Marsono Y, Triwitono P, Kanoni S. 2005. Indeks glikemik kacang buncis (Phaseolus vulgaris) dan kacang panjang (Vigna sesquipedalis) serta uji efek hipoglisemiknya pada tikus Sprague Dawley. Biota 10 (3): 183-191.
Moreno J, Altabella T, Chrispeels MJ. 1990. Characterization of α-amylase inhibitor, a lectin-like protein in the seeds of Phaseolus vulgaris L. Plant Physiol 92: 703-709.
Moreno J, Chrispeels MJ. 1989. A lectin gene encodes the α-amylase inhibitor of the common bean (Phaseolus vulgaris). Proc Natl Acad Sci U S A 86: 7885-7889.
Nelson N. 1944. A photometric adaptation of the Somogyi method for the determination of glucose. J Biol Chem 153: 375-381.
Obiro WC, Zhang T, Jiang B. 2008. The nutraceutical role of Phaseolus vulgaris α-amylase inhibitor.
Brit J Nutr 100: 1-12.
Pariza M. 1996. Toxic substances. In: Fenema OR (ed.). Food Chemistry, 3rd Edition. New York: Marcel Dekker, pp. 825-840.
Rosenberg IH. 1982. Starch blockers – still no calorie-free lunch. N Engl J Med 307: 1444-1445. Roychan KJ dan Chaudari A. 2001. Purification and some properties of α-amylase form Indian major
30 Saefuddin A, Notoiputro KA, Alamudi A, Sadik K. 2009. Statistika Dasar. Jakarta: PT Grasindo. Santimone M, Koukiekolo R, Moreau Y, Le Berre v, Rouge P, Marchis-Mouren G, Desseaux V.
2004. Porcine pancreatic α-amylase inhibition by the kidney bean (Phaseolus vulgaris) inhibitor (α-AI1) and structural changes in the α-amylase inhibitor complex. Biochim Biophys Acta 1696: 181-190.
Sawada S, Takeda Y, Tashiro M. 2002. Primary structures of α- and β- subunits of α-amylase inhibitors from seeds of three cultivars of Phaseolus beans. J Protein Chem 21: 9-17.
Stojan J. 2005. Enzyme inhibitors. In: Smith HJ, Simons C (eds.). Enzymes and Their Inhibition: Drug Development. Florida: CRC Press, pp. 149-170.
Suhartono MT. 1989. Enzim dan Bioteknologi. Bogor: Institut Pertanian Bogor.
Thompson LU, Gabon JE. 1987. Effect of lectins on salivary and pancreatic amylase activities and the rate of starch digestion. J Food Sci 52: 1050-1053.
Tormo MA, Gil-Exojo I, de Tejada AR, Campillo JE. 2004. Hypoglycaemic and anorexigenic activities of an α-amylase inhibitor from white kidney beans (Phaseolus vulgaris) in Wistar rats. Brit J Nutr 92: 785-790.
Udani J, Hardy M, Madsen DC. 2004. Blocking carbohydrate absorption and weight loss: a clinical trial using Phase 2TM brand proprietary fractioned white bean extract. Altern Med Rev 9 (1): 63-69.
Wallenfels K, Foldi P, Nierman H, Bender H, Linder D. 1978. The enzymic synthesis, by transglucosylation of a homologous series of glycosidically substituted malto-oligo-saccharides, and their use as amylase substrates. Carbohydr Res 61: 359-368.
Whitaker JR. 1996. Enzymes. In: Fennema OR (ed.). Food Chemistry, 3rd Edition. New York: Marcel Dekker, Inc., pp 431-530.
Wu X, Xu X, Shen J, Perricone NV, Preuss HG. 2010. Enhanced weight loss from a dietary supplement containing standardizes Phaseolus vulgaris extract in overweight men and women. J Applied Sci 10 (2): 73-79.
PENGEMBANGAN DAN VALIDASI METODE
ANALISIS
PENGHAMBATAN AKTIVITAS ENZIM ALFA AMILASE OLEH
PHASEOLAMIN DARI EKSTRAK WHITE KIDNEY BEAN
(PHASEOLUS VULGARIS) DI PT NUTRIFOOD INDONESIA
SKRIPSI
Amelinda Angela
F24070089
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
ANALYTICAL METHOD DEVELOPMENT AND VALIDATION OF
PHASEOLAMIN FROM WHITE KIDNEY BEAN (PHASEOLUS VULGARIS)
EXTRACT INHIBITORY ACTIVITY AGAINST
α
-AMYLASE
IN PT NUTRIFOOD INDONESIA
Amelinda Angela and Dahrul Syah Department of Food Science and Technology,
Faculty of Agricultural Engineering and Technology, Bogor Agricultural University, IPB Darmaga Campus, PO BOX 220, Bogor, West Java, Indonesia
Phone: +62 818 089 789 46, E-mail: amelinda.angela@gmail.com
ABSTRACT
Phaseolamin is an α-amylase inhibitor extracted from white kidney bean (Phaseolus vulgaris). Some researches show that phaseolamin has several functional effects such as enhancing weight loss, decreasing body fat mass, decreasing waist circumference, decreasing energy intake, decreasing insulin level in blood, and increasing carbohydrate tolerance in diabetics. Based on its functions, phaseolamin can be developed as a functional food ingredient. PT Nutrifood Indonesia is one of the companies that use phaseolamin in their product. However, to maintain the product quality, phaseolamin inhibitory activity has to be determined. This research aims to determine the optimum phaseolamin and α-amylase preincubation condition, develop an analytical method to measure phaseolamin inhibitory activity against α-amylase that can be used in PT Nutrifood Indonesia, and validate the method. The parameters to determine an optimum preincubation condition were phaseolamin concentration and preincubation duration. This research used Bernfeld method to measure the reducing sugars, product from the reaction between α-amylase and starch, that can be used in a calculation to determine the α-amylase activity with and without the phaseolamin. The phaseolamin inhibitory activity is expressed as percentage of inhibition. The analytical method should be validated so it can be used in the company. The parameter that was used to validate was precision. The result showed that 20 mg/ml concentration of phaseolamin and 60 minute preincubation gave the optimum