KEEFEKTIFAN FORMULASI TEPUNG BAKTERI ENDOFIT
SEBAGAI AGENS PENGENDALI NEMATODA
PARASIT PADA TANAMAN LADA
DIANA PUTRI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Keefektifan Formulasi Tepung Bakteri Endofit sebagai Agens Pengendali Nematoda Parasit pada Tanaman Lada adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2016
Diana Putri
NIM A352130131
RINGKASAN
DIANA PUTRI. Keefektifan Formulasi Tepung Bakteri Endofit sebagai Agens Pengendali Nematoda Parasit pada Tanaman Lada. Dibimbing oleh ABDUL MUNIF dan KIKIN HAMZAH MUTAQIN
Nematoda puru akar (NPA), Meloidogyne sp. adalah salah satu nematoda parasit penting yang dapat meningkatkan keparahan penyakit kuning tanaman lada. Penyakit kuning dapat menyebabkan kehilangan hasil mencapai 41%. Bakteri endofit berpotensi sebagai agens hayati yang penting untuk mengendalikan nematoda parasit pada tanaman lada. Tujuan penelitian ini adalah untuk mengevaluasi keefektifan beberapa formulasi tepung dalam mempertahankan viabilitas bakteri endofit dan kemampuannya dalam meningkatkan pertumbuhan tanaman dan mengendalikan nematoda parasit pada tanaman lada. Bakteri endofit yang digunakan dalam formulasi adalah Bacillus sp. AA2, Bacillus sp. MER dan isolat MSJ. Penelitian sebelumnya menunjukkan tiga isolat bakteri endofit tersebut terbukti efektif dalam mengendalikan nematoda parasit pada tanaman lada. Karakterisasi fisiologis bakteri endofit dilakukan sebelum dibuat formulasi. Formulasi tepung yang digunakan adalah formulasi 1 (talk, pepton, CMC dan gula merah), formulasi 2 (talk, pepton, CMC dan gula putih), formulasi 3 (talk, pepton, CMC, yeast extract, dan gula putih) dan formulasi 4 (talk, pepton, CMC, gula putih,
yeast extract, bentonit, kalsium karbonat, dextrose, dan molase). Uji viabilitas bertujuan untuk mengetahui jangka waktu kemampuan bakteri endofit bertahan di dalam formulasi.
Pengujian karakter fisiologis bakteri endofit menunjukkan bahwa Bacillus sp. AA2 dan Bacillus sp. MER tergolong bakteri Gram positif, sedangkan isolat MSJ merupakan bakteri Gram negatif. Tiga isolat bakteri endofit tersebut menunjukkan kemampuan menghasilkan hormon Indole Acetid Acid (IAA). Bacillus sp. AA2 dan
Bacillus sp. MER menghasilkan enzim protease dan kitinase sedangkan enzim lipase hanya dihasilkan oleh isolat MSJ. Uji penambat nitrogen menunjukkan bahwa Bacillus sp. AA2 dan isolat MSJ mampu menambat nitrogen. Uji reaksi hipersensitif ketiga isolat tersebut menunjukkan hasil negatif. Uji pelarut fosfat menunjukkan bahwa ketiga isolat tidak mampu memobilisasi fosfat. Hasil uji viabilitas menunjukkan bahwa viabilitas bakteri endofit pada formulasi tepung mengalami fluktuatif pada pada bulan pertama sampai bulan kelima dan menurun setelah disimpan enam bulan.
Viabilitas bakteri tertinggi adalah isolat MSJ yaitu 2.5 x 106 cfu mL-1. dalam formulasi 4, sedangkan Bacillus sp. AA2 dan Bacillus sp MER masing-masing 1.9 x 106 cfu mL-1 dan 1.2 x 106 cfu mL-1 dalam formulasi 3. Semua formulasi dalam bentuk tepung terbukti efektif dalam menekan serangan nematoda parasit penyebab penyakit kuning hingga 91.9% dan mampu meningkatkan pertumbuhan tanaman lada hingga 91.1 cm. Formulasi terbaik adalah AA2F4-50 dengan persentase penekanan puru akar 72.2%, persentase penekanan nematoda dalam akar 84.9% dan persentase penekanan nematoda dalam tanah 91.9%. Formulasi MSJF4-50 terbukti efektif dalam meningkatkan pertumbuhan tanaman lada.
SUMMARY
DIANA PUTRI. Effectiveness Powder Formulation of Endophytic Bacteria as Biocontrol Agents for Plant Parasitic Nematode on Pepper. Supervised by ABDUL MUNIF and KIKIN HAMZAH MUTAQIN.
Root knot nematode, Meloidogyne sp. is one of the important plant parasitic nematode in pepper that can cause yellow disease. Yield due to yellow disease in pepper could up to 41%. Endophytic bacteria formulation as biological agents needs to be evaluated to control plant parasitic nematode in pepper. The research is aimed to give a scientific knowledge about effectiveness of some powder formulation to maintain viability of endophytic bacteria, to enhance the growth of plants and to control plant parasitic nematode on pepper. Endophytic bacteria that used in formulations is Bacillus sp. AA2, Bacillus sp. MER and MSJ isolate. From previous studies, three isolates endophytic bacteria was proven to be effective in controlling plant parasitic nematode on pepper. Physiological characterization of endophytic bacteria isolates has been done for identification. Formulations used are formulations 1 (talc 50 g, peptone 1 g, CMC 0.5 g and brown sugar 1.5 g), formulation 2 (talc 50 g, peptone 1 g, CMC 0.5 g and white sugar 1.5 g), formulation 3 (talc 50 g, peptone 1 g, CMC 0.5 g, yeast extract 1 g and white sugar 1.5 g) and formulation 4 (talc 50 g, peptone, 1 g, CMC 0.5 g, yeast extract 1 g, molasses 3 mL, bentonite 1 g, calcium carbonate 0.75 g, dextrose 1 g). Viability test aims to review the period of the endophytic bacteria survivability in formulations.
Those endophytic bacteria were identified as two Gram positive bacteria (Bacillus sp. AA2 and Bacillus sp. MER), and one Gram negative bacteria (isolate MER). All of isolates of endophytic bacteria shows the ability to produce IAA hormone. Bacillus sp. AA2 and Bacillus sp. MER produced enzyme protease and kitinase, while enzyme lipase only produced by MSJ isolate. Bacillus sp. AA2 and MSJ isolate were also capable to nitrogen fixation. From hypersensitive reaction test showed that three isolates were non pathogenic. All isolates were not capable to mobilize the phosphate. Viability in vitro showed that endophytic bacteria experienced fluctuate in its early stages and declined after kept for six months.
Highest viability is MSJ isolate with 2.5 x 106 cfu mL-1 in fourth formulation, Bacillus sp. AA2 and Bacillus sp. MER with 1.9 x 106 cfu mL-1 and 1.2 x 106 cfu mL-1 respectively in third formulation. All formulations are proved to
be effective to suppress plant parasitic nematode infection in pepper up to 91.9% and has ability to enhance pepper growth up to 91.1 cm. AA2F4-50 is the best formulation with suppressing number of root galls up to 72.2%, root nematodes up to 84.9% and soil nematodes up to 91.9%. Meanwhile, formulation MSJF4-50 was showed effective in enhance the growth of pepper.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Fitopatologi
KEEFEKTIFAN FORMULASI TEPUNG BAKTERI ENDOFIT
SEBAGAI AGENS PENGENDALI NEMATODA
PARASIT PADA TANAMAN LADA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Tesis : Keefektifan Formulasi Tepung Bakteri Endofit sebagai Agens Pengendali Nematoda Parasit pada Tanaman Lada
Nama : Diana Putri NIM : A352130131
Disetujui oleh Komisi Pembimbing
Dr Ir Abdul Munif, MSc Agr Ketua
Dr Ir Kikin Hamzah Mutaqin, MSi Anggota
Diketahui oleh
Ketua Program Studi Fitopatologi
Prof Dr Ir Sri Hendrastuti Hidayat, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MSc Agr
PRAKATA
Alhamdulillahirrabbil’alamin, puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga penelitian ini dapat diselesaikan. Penelitian dengan judul “Keefektifan Formulasi Tepung Bakteri Endofit sebagai Agens Pengendali Nematoda Parasit pada Tanaman Lada” telah dilaksanakan sejak bulan Juli 2014 sampai April 2015. Terima kasih penulis ucapkan kepada Dr Ir Abdul Munif, MSc Agr dan Dr Ir Kikin Hamzah Mutaqin, MSi selaku komisi pembimbing dan Dr Ir Elis Nina Herliyana, MSi sebagai dosen penguji yang telah banyak memberi bimbingan, arahan dan saran kepada penulis. Ungkapan terima kasih juga disampaikan kepada kedua orang tua penulis bapak Jasad dan ibu Jasminar, serta seluruh keluarga atas segala dukungan, doa dan kasih sayangnya.
Penulis sampaikan terima kasih kepada seluruh dosen Program Studi Fitopatologi Departemen Proteksi Tanaman IPB yang telah memberikan ilmu yang bermanfaat kepada penulis. Terima kasih juga penulis ungkapkan kepada rekan-rekan seangkatan kelas Fitopatologi 2013 yang selalu mendukung dalam kemajuan studi di program studi Fitopatologi. Kepada laboran di Laboratorium Nematologi Tumbuhan dan Laboratorium Bakteriologi, khususnya Bapak Gatut Heru Bromo dan Bapak Abdul Rofiqun yang banyak membantu penulis dalam menyelesaikan penelitian dan kepada semua pihak yang namanya tidak tercantum, penulis ucapkan terimakasih yang sebesar-besarnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2016
DAFTAR ISI
Penyakit Kuning pada Tanaman Lada 3
Penyebab Penyakit Kuning pada Tanaman Lada 4
Agens Pengendali Hayati 6
Bakteri Endofit sebagai Agens Pengendali Hayati 7
Formulasi Agens Hayati 8
METODE 11
Tempat dan Waktu Penelitian 11
Karakterisasi Morfologi Bakteri Endofit 11
Uji Patogenesitas Bakteri Endofit pada Tumbuhan 11
Karakterisasi Fisiologis Bakteri Endofit 11
Uji Antibiosis Bakteri Endofit terhadap Fusarium oxysporum 13 Uji Potensi Bakteri Endofit sebagai Pemacu Pertumbuhan Bibit
Mentimun 14
Formulasi Tepung Bakteri Endofit 14
Uji Viabilitas Bakteri Endofit dalam Formulasi Tepung secara In
vitro 14
Uji Keefektifan Formulasi Tepung Bakteri Endofit secara In vivo 15
HASIL DAN PEMBAHASAN 17
Karakterisasi Morfologi Bakteri Endofit 17
Uji Patogenesitas Bakteri Endofit pada Tumbuhan 17
Karakterisasi Fisiologis Bakteri Endofit 18
Uji Antibiosis Bakteri Endofit terhadap Fusarium oxysporum 25 Uji Potensi Bakteri Endofit sebagai Pemacu Pertumbuhan Bibit
Mentimun 26
Formulasi Tepung Bakteri Endofit 26
Uji Viabilitas Bakteri Endofit dalam Formulasi Tepung secara In
vitro 27
Uji Keefektifan Formulasi Tepung Bakteri Endofit secara In vivo 29
Pembahasan Umum 35
SIMPULAN DAN SARAN 39
Simpulan 39
Saran 39
LAMPIRAN 49
DAFTAR TABEL
1 Komposisi bahan yang digunakan untuk pembuatan formulasi
tepung bakteri endofit 14
2 Karakter fisiologis bakteri endofit 18
3 Konsentrasi hormon IAA yang dihasilkan bakteri endofit 24 4 Persentase daya hambat bakteri endofit terhadap cendawan
Fusarium oxysporum 25
5 Pengaruh bakteri endofit terhadap pertumbuhan bibit
mentimun 26
6 Populasi nematoda di akar dan di tanah tanaman lada setelah
perlakuan formulasi tepung bakteri endofit 30 7 Jumlah puru akar dan skala kerusakan akar pada tanaman lada
setelah perlakuan formulasi tepung bakteri endofit 31 8 Pengaruh formulasi tepung bakteri endofit terhadap tinggi
tanaman, jumlah cabang, jumlah, daun dan jumlah ruas
tanaman lada di rumah kaca 33
9 Pengaruh formulasi tepung bakteri endofit terhadap berat
basah dan berat kering pada tajuk dan akar tanaman lada 34
DAFTAR GAMBAR
1 Siklus hidup nematoda puru akar (Mitkowski dan Abawi
2003) 5
2 Skema uji antibiosis bakteri endofit terhadap Fusarium oxysporum. (A) bakteri endofit uji (B) isolat cendawan
patogen 13
3 Morfologi bakteri endofit pada media TSA 100%. (a)
Bacillus sp. AA2, (b) Bacillus sp. MER, (c) isolat MSJ 17 4 Uji Patogenesitas bakteri endofit pada daun tembakau. (a)
kontrol positif menunjukkan gejala nekrotik, (b) perlakuan
bakteri endofit tidak menunjukkan gejala nekrotik 17 5 Uji pewarnaan Gram bakteri endofit. (a) sel bakteri Gram
negatif berwarna merah, (b) sel bakteri Gram positif
berwarna ungu 19
6 Uji Gram dengan KOH 3%. (a) bakteri Gram negatif membentuk lendir dan tidak putus ketika diangkat perlahan dengan jarum ose, (b) bakteri Gram positif tidak
menunjukkan terangkatnya lendir oleh jarum ose 19 7 Uji aktivitas kitinolitik. (a) Bacillus sp. AA2 membentuk
zona bening, (b) isolat MSJ tidak membentuk zona bening 20 8 Uji aktivitas proteolitik. (a) Bacillus sp. AA2 membentuk
zona bening, (b) isolat MSJ tidak membentuk zona bening 21 9 Uji aktivitas lipolitik. (a) Bacillus sp. AA2 tidak membentuk
pendaran berwarna oranye (b) isolat MSJ membentuk
pendaran berwarna oranye kekuningan 22
kebiruan, (b) Bacillus sp. MER tidak membentuk lapisan
lendir dan tidak berubah warna menjadi kebiruan 23 11 Daya hambat bakteri endofit terhadap pertumbuhan
cendawan Fusarium oxysporum. (a) membentuk zona
hambat (b) tidak membentuk zona hambat 25 12 Jenis formulasi tepung bakteri endofit dalam plastik tahan
panas 27
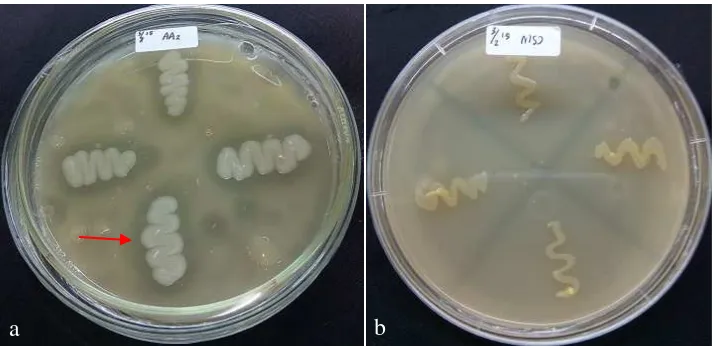
13 Kerapatan populasi bakteri endofit. (a) Bacillus sp. AA2, (b)
Bacillus sp. MER, (c) isolat MSJ dalam formulasi tepung
28 14 Akar tanaman lada. (a) perlakuan formulasi tepung bakteri
endofit isolat MSJ, (b) perlakuan nematisida Carbofuran (c)
tanpa perlakuan (tanda panah menunjukkan puru akar) 31
DAFTAR LAMPIRAN
1 Hasil analisis konsentrasi hormon IAA yang dihasilkan bakteri
endofit 50
2 Pertumbuhan bibit tanaman mentimun. (a) perlakuan bakteri
endofitisolat MSJ (b) kontrol 51
3 Viabilitas bakteri endofit Bacillus sp. MER selama penyimpanan dalam formulasi tepung. (1) disimpan satu bulan, (2) disimpan dua bulan, (3) disimpan tiga bulan, (4) disimpan empat bulan, (5) disimpan lima bulan, (6) disimpan
enam bulan 51
4 Tanaman lada di rumah kaca. (a) setelah perlakuan formulasi
isolat MSJ (a) nematisida Carbofuran (b) tanpa perlakuan (c) 52 5 Tanaman lada di rumah kaca. (a) sebelum perlakuan formulasi
tepung bakteri endofit, (b) setelah perlakuan formulasi tepung bakteri endofit Bacillus sp. AA2, Bacillus sp. MER dan isolat
PENDAHULUAN
Latar Belakang
Nematoda puru akar (NPA), Meloidogyne sp. merupakan nematoda parasit yang memiliki kisaran inang yang luas, salah satunya adalah tanaman lada. NPA dapat berinteraksi dengan patogen lain dan dapat menyebabkan penyakit kuning (Mustika 2005). Penyakit kuning pada tanaman lada dapat mengakibatkan kehilangan hasil mencapai 41% (Munif dan Sulistiawati 2014).
Gejala serangan penyakit kuning dapat menyebabkan pertumbuhan tanaman menjadi terhambat, daun dan dahan menjadi kuning. Daun yang menguning tidak menjadi layu tetapi sangat rapuh dan secara bertahap akan gugur, jika serangan berat tanaman akan mati. Gejala penyakit pada bagian akar menunjukkan gejala kerusakan rambut akar, nekrosis, dan terbentuknya puru akar. Hal ini menyebabkan terhambatnya translokasi air dan hara dari akar ke bagian tanaman lainnya. Oleh karena itu upaya pengendalian penyakit kuning yang tepat, terutama ditujukan pada pengendalian nematoda puru akar perlu dilakukan (Mustika 2005).
Beberapa teknik pengendalian yang telah dilakukan seperti penggunaan varietas tahan (toleran), kultur teknis, penggunaan pestisida sintetis, serta pengendalian hayati menggunakan agens antagonis (Mustika et al. 2000). Pengembangan agens antagonis sampai saat ini terus dilakukan. Salah satu agens hayati yang potensial untuk dikembangkan adalah bakteri endofit. Agens hayati endofit dianggap memiliki dampak negatif terhadap lingkungan relatif kecil dan lebih berkelanjutan (Mustika 2005). Beberapa bakteri endofit dilaporkan dapat mengendalikan nematoda parasit M. incognita pada tanaman kapas (Hallmann et al.
1997), tanaman tomat (Munif et al. 2013), pada tanaman nilam (Harni et al. 2007), dan pada tanaman lada (Harni dan Ibrahim 2011; Harni dan Munif 2012; Munif dan Harni 2011).
Bakteri endofit adalah bakteri yang mengolonisasi jaringan internal tanaman dan tidak menimbulkan penyakit yang merugikan bagi tanaman (Hallmann et al.
1997). Beberapa jenis bakteri endofit disamping sebagai agens biokontrol, juga sebagai pemacu pertumbuhan tanaman dan menginduksi ketahanan tanaman terhadap patogen (Kloepper et al. 1999).
Tiga isolat bakteri endofit dilaporkan dapat mengendalikan Meloidogyne sp. pada tanaman lada yaitu Bacillus sp. AA2, Bacillus sp. MER dan isolat MSJ (Munif dan Harni 2011). Namun sejauh ini belum ada penelitian terkait karakter fisiologis dan formulasinya. Formulasi bakteri endofit sebagai agens hayati adalah tahapan penting yang harus dilakukan (Habazar et al. 2015). Formulasi bakteri endofit juga dimaksudkan untuk menjaga keefektifan bakteri endofit. Formulasi yang sesuai akan memberikan habitat yang dapat melindungi mikroorganisme, dengan demikian akan meningkatkan potensinya untuk hidup dan mengkolonisasi secara baik (Boyetchko et al. 1999). Formulasi juga bertujuan agar bakteri atau mikroorganisme mudah diaplikasikan ke tanaman atau tanah, serta meningkatkan daya hidup sel bakteri dengan cara melindunginya dari kekeringan (Heijen et al.1993).
osmotiknya di dalam media dengan penambahan sukrosa dan metal selulosa 1% dapat bertahan 10 sampai 12 bulan. P. fluorescens yang diformulasikan dengan bahan pembawa talk dapat menekan kejadian penyakit blast yang disebabkan oleh
Pyricularia orizae (Vidhyasekaran et al. 1997). Bakteri endofit dari golongan
Bacillus sp. yaitu EPCO102 dan EPCO16 yang diformulasikan dengan bahan pembawa talk, kalsium karbonat, dan karboksimetilselulosa dapat meningkatkan pertumbuhan tanaman kapas dan menghambat pertumbuhan miselium dari
Rhizoctonia solani secara in vitro (Rajendran dan Samiyappan 2008).
Pseudomonas fluorescens yang diformulasikan dengan bahan pembawa talk dan penambahan kalsium karbonat dan karboksimetilselulosa, viabilitasnya dapat bertahan sampai 8 bulan penyimpanan serta dapat mengendalikan penyakit rice sheath blight yang disebabkan Rizoctonia solani pada padi sawah (Vidhyasekaran dan Muthamilan 1999). Bora et al. (2004) melaporkan bahwa Pseudomonas putida
yang diformulasikan dengan bahan pembawa talk dan penambahan gliserol serta Natrium alginat dapat menekan serangan F. oxysporum f.sp melonis dengan perlakuan benih sebesar 63%.
Tujuan Penelitian
Penelitian ini bertujuan mengevaluasi keefektifan beberapa formulasi tepung dalam mempertahankan viabilitas bakteri endofit dan kemampuannya dalam meningkatkan pertumbuhan tanaman dan mengendalikan nematoda parasit pada tanaman lada.
Hipotesis Penelitian
Bakteri endofit merupakan agens pengendali hayati yang potensial untuk mengendalikan nematoda parasit pada tanaman dan dapat dibuat dalam bentuk formulasi. Formulasi bakteri endofit akan dapat mempertahankan daya simpan, keefektifan dan kemudahannya. Formulasi bakteri endofit dapat berupa cair, kompos dan tepung atau padat. Formulasi tepung bakteri endofit dapat mempertahankan viabilitas bakteri endofit dalam formulasi. Formulasi tepung bakteri endofit dapat meningkatkan pertumbuhan tanaman dan menekan populasi nematoda parasit pada tanaman lada.
Manfaat Penelitian
TINJAUAN PUSTAKA
Bioekologi Tanaman Lada
Lada (Piper nigrum L.) merupakan salah satu tanaman rempah yang penting dan banyak dibudidayakan, serta merupakan salah satu komoditas ekspor perkebunan andalan Indonesia. Tanaman, bersifat dimorfik, mempunyai dua macam sulur, yaitu sulur panjat dan sulur buah. Untuk keperluan perbanyakan tanaman lada dilakukan dengan setek (Suprapto dan Yani 2008). Lada yang merupakan tanaman tahunan memanjat diperbanyak dengan cara setek. Penggunaan setek pendek satu ruas lebih menguntungkan karena hemat dalam penggunaan bahan tanaman dan dapat menyediakan bibit dalam waktu yang cepat dengan jumlah relatif banyak. Selain itu, pertanaman asal bibit setek satu ruas hanya memerlukan sedikit penyulaman dan tanaman memiliki cabang generatif lebih banyak sehingga lebih cepat berbunga (Suparman et al. 1992).
Tanaman lada termasuk dalam divisi Spermatophyta, kelas Angiospermae, sub kelas Dicotyledoneae, ordo Piperales, famili Piperaceae, genus Piper, dan merupakan spesies Piper nigrum. Lada tumbuh baik di daerah dengan ketinggian 0 sampai 500 m di atas permukaan laut. Hal ini berkaitan dengan suhu udara yang berpengaruh terhadap umur menghasilkan dan produktivitas tanaman. Penyebaran tanaman lada sangat luas berada di wilayah tropika antara 200° LU dan 200° LS, dengan curah hujan 1 000 sampai 3 000 mm per tahun, merata sepanjang tahun dan mempunyai hari hujan 110 sampai 170 hari per tahun, musim kemarau hanya 2 sampai 3 bulan per tahun. Kelembaban udara 63% sampai 98% selama musim hujan, dengan suhu maksimum 35 °C dan suhu minimum 20 °C. Lada dapat tumbuh pada semua jenis tanah, terutama tanah berpasir dan gembur dengan unsur hara cukup, drainase (air tanah) baik, tingkat kemasaman tanah (pH) 5.0 sampai 6.5 (Suprapto dan Yani 2008).
Di dunia terdapat lebih dari 1 000 spesies lada, sosok tanaman berupa semak, herba atau liana, hidup tersebar di daerah tropik, namun keragaman terbesar terdapat di Amerika tropik, disusul oleh Asia Selatan yang merupakan daerah asal tanaman lada dan sirih (Jaramillo dan Manos 2001). Indonesia sampai saat ini memiliki tidak kurang dari 50 jenis varietas, diantaranya Varietas Cunuk, Jambi, Lampung Daun Lebar, Bangka, Kuching, dan Lampung Daun Kecil. Varietas yang sering ditanam oleh petani adalah Varietas Lampung Daun Lebar, karena varietas ini lebih banyak menghasilkan buah dibandingkan dengan varietas lain. Berdasarkan hasil penelitian dari Balittro Bogor terdapat empat varietas lada unggul, yaitu Natar I, Natar II, Petaling I, dan Petaling II. Diantara varietas tersebut, Petaling I yang tahan terhadap penyakit kuning (Suprapto dan Yani 2008).
Penyakit Kuning pada Tanaman Lada
bertahap warna daun dan dahan menjadi kekuning-kuningan. Perubahan ini umumnya dimulai dari bagian bawah dan menjalar ke bagian atas tanaman. Daun-daun yang menguning tidak menjadi layu tetapi sangat rapuh sehingga secara bertahap daun-daun tersebut akan gugur. Dahan-dahan secara bertahap akan gugur sebagian demi sebagian, sehingga tanaman semakin gundul. Sulur-sulur panjat dapat bertahan paling lama, tetapi akhirnya juga akan menguning dan mati (Mustika 2005; 1990).
Gejala di bawah permukaan tanah, terlihat pada bagian rambut akar yang menjadi rusak, terdapat luka-luka nekrosis dan puru pada akar. Luka akar tersebut akibat serangan nematoda R. similis, sedangkan puru akar akibat serangan nematoda Meloidogyne sp. Di dalam jaringan akar yang luka dan berpuru tersebut, terdapat sekelompok nematoda. Selain itu pembuluh jaringan akar terserang nematoda tersumbat oleh cairan seperti getah. Hal ini menyebabkan terhambatnya translokasi air dan hara dari akar ke bagian tanaman lainnya (Mustika 1990).
Penyebab Penyakit Kuning pada Tanaman Lada
Penyakit kuning pada tanaman lada dilaporkan sejak tahun 1932. Penyakit kuning disebabkan oleh keadaan yang sangat kompleks yaitu serangan nematoda R. similis dan M. incognita serta adanya cendawan patogen F. solani dan F. oxysporum
(Bridge 1978). Selain itu rendahnya kesuburan tanah, kelembaban dan kadar air tanah juga mempengaruhi terjadinya penyakit kuning (Mustika 1990). Walaupun demikian, nematoda adalah faktor utama penyebab penyakit kuning, sedangkan faktor lainnya memperlemah kondisi tanaman yang telah terserang nematoda tersebut (Mustika 1990; 2005).
Meloidogyne sp. sebagai penyebab utama penyakit kuning pada tanaman lada merupakan salah satu nematoda parasit yang memiliki kisaran inang yang sangat beragam, lebih dari 2 000 spesies tanaman dan sebagian besar adalah tanaman budidaya. Meloidogyne sp. tersebar luas di daerah tropik dan subtropik. Infeksi berat dapat menyebabkan tanaman layu dan mati, gejala penyakit oleh nematoda ini berupa pertumbuhan tanaman yang terhambat dan kerdil dengan perakaran yang banyak bintil atau disebut puru akar (Mustika 2005).
Meloidogyne sp. termasuk dalam ordo Tylenchida, subordo Tylenchina, famili Heteroderoidae, dan genus Meloidogyne. Meloidogyne spp. memiliki lebih dari 79 spesies, empat spesies utama, yaitu M. incognita, M. hapla, M. javaniva,
dan M. arenaria (Dropkin 1991).
Menurut Dropkin (1991), nematoda jantan dewasa berbentuk memanjang bergerak lambat didalam tanah. Panjangnya bervariasi maksimum 2 mm, sedangkan perbandingan antara panjang tubuh dan lebarnya mendekati 45. Kepalanya tidak berlekuk, panjang stiletnya hampir dua kali panjang stilet betina. Bagian posterior berputar 180º memiliki 1 sampai 2 testis. Betina dewasa berukuran
panjang 430 sampai 740 μm. Stilet untuk menembus 11.5 sampai 14.5 μm.
garis lateral, sedangkan bagian ventral terdiri dari striae ventral, vulva, dan anus (Eisenback 2003).
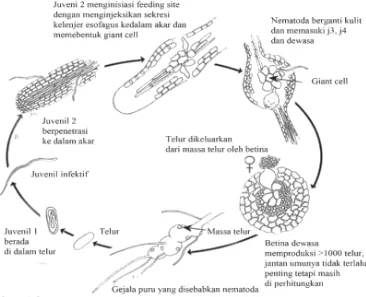
Nematoda puru akar bersifat obligat tersebar luas baik di daerah iklim tropik maupun iklim sedang. Pembiakan tanpa jantan dalam reproduksi terjadi pada banyak jenis, tetapi pada jenis yang lain reproduksi seksual masih terjadi dalam perkembangbiakannya. Telur yang dihasilkan nematoda betina dewasa diletakkan berkelompok pada massa gelatinus yang betujuan untuk melindungi telur dari kekeringan dan jasad renik. Siklus NPA (Meloidogyne sp.) dapat dilihat pada gambar 1.
Gambar 1 Siklus hidup nematoda puru akar (Mitkowski dan Abawi 2003)
kelamin ini ditentukan oleh faktor lingkungan. Pada kondisi tertekan atau stres misalnya kepadatan tinggi dan suhu tinggi, cadangan makanan sedikit atau ketidaksesuaian tanaman inang maka presentase jantan lebih besar. Nematoda jantan akan lebih banyak terbentuk jika akar terserang berat dan zat makanan tidak mencukupi untuk perkembangan nematoda (Dropkin 1991).
Nematoda jantan berbentuk memanjang di dalam kutikula. Stadium larva ke empat selanjutnya keluar dari jaringan akar, sedangkan nematoda betina masih berada di dalam jaringan tanaman dengan bagian posterior tubuhnya berada pada permukaaan akar. Nematoda betina tersebut terus menerus menghasilkan telur selama siklus hidupnya, kadang-kadang mencapai jumlah lebih dari 1 000 telur. Ciri khas dari nematoda betina adalah tubuhnya yang berubah bentuk menjadi seperti buah pir. Lamanya siklus hidup dari telur hingga dewasa berlangsung tiga minggu sampai beberapa bulan, tergantung kepada kondisi lingkungan dan tumbuhan inangnya (Dropkin 1991).
Pengendalian Hayati
Pengendalian hayati merupakan salah satu komponen dari konsep pengendalian penyakit secara terpadu, yang bertujuan untuk mengurangi kepadatan inokulum patogen dan aktivitas patogen dengan memanipulasi lingkungan dan inang dengan menggunakan satu atau lebih agens antagonis. Agens pengendali hayati mempunyai kemampuan mempengaruhi pertumbuhan dan aktivitas patogen karena diduga adanya senyawa metabolit yang dikeluarkan serta adanya kompetisi ruang dan nutrisi (Baker dan Cook 1974).
Menurut Agrios (2005) pengendalian hayati merupakan perlindungan pada tanaman dari patogen tanaman termasuk mikroorganisme antagonis pada saat setelah atau sebelum terjadinya infeksi patogen. Mekanisme biokontrol organisme yaitu dalam melemahkan atau membunuh patogen tanaman dengan perlawanan yaitu memparasit patogen secara langsung, memproduksi antibiotik (toksin), dan kemampuannya dalam kompetisi ruang dan nutrisi, produksi enzim untuk melawan komponen sel patogen, menginduksi respon ketahanan tanaman, dan produksi metabolisme tanaman dalam menstimulasi perkecambahan spora patogen.
Pengendalian hayati penyakit tanaman merupakan baian dari pengelolaan komunitas dari mikroorganisme dalam suatu ekosistem. Pengendalian hayati dengan agens antagonis akan efektif apabila agens antagonis memiliki kemampuan bertahan dan berkembang pada kondisi alam terutama pada suhu tinggi. Pada umumnya agens antagonis hidup pada habitat yang sama dengan patogen. Agens antagonis terdiri dari dua golongan yaitu bakteri dan cendawan. Bacillus spp. dan
Pseudomonas spp. merupakan kelompok bakteri antagonis yang telah efektif mampu menekan infeksi patogen tanah dengan memproduksi antibiotik dan kompetisi terhadap Fe3+ (Van dan Bellows 1996).
tumbuhan secara tidak langsung, dengan adanya senyawa tertentu yang dihasilkan yang dapat merangsang sistem pertahanan inang (Kobayashi dan Palumbo 2000).
Bakteri Endofit sebagai Agens Pengendali Hayati
Bakteri endofit didefinisikan sebagai bakteri yang seluruh atau sebagian siklus hidupnya berada dalam jaringan tanaman dan berasosiasi dengan tanaman inang dengan berada dalam seluruh jaringan tanaman, tetapi tanpa menyebabkan gejala penyakit pada tanaman inang tersebut (Rodewald et al. 2009). Tanaman mendapatkan manfaat dengan kahadiran bakteri endofit ini seperti memacu pertumbuhan tanaman, dan meningkatkan resistensi tanaman pada dari berbagai macam patogen dengan memproduksi antibiotik. Bakteri endofit juga memproduksi metabolit sekunder yang sangat penting bagi tumbuhan (Bandara et al. 2006). Bakteri endofit awalnya berasal dari lingkungan eksternal dan masuk ke dalam tanaman melalui stomata, lentisel, luka, melalui akar lateral dan akar yang berkecambah (Kaga et al. 2009). Luka pada tumbuhan yang diakibatkan oleh faktor biotik seperti nematoda juga menjadi faktor utama penting masuknya bakteri endofit ke dalam tanaman (Athman 2006).
Compants et al. (2005) menyatakan bahwa penggunaan bakteri endofit sebagai agens hayati, terutama yang memiliki kelebihan sebagai pemacu pertumbuhan lebih baik dibanding mikroorganisme yang hidup bebas. Keterikatan endofit dengan inangnya memberikan keuntungan lebih bagi endofit dibanding agens hayati lainnya, karena mereka tidak harus bersaing dalam ekosistem yang baru dan kompleks (Chen et al. 1995).
Kolonisasi bakteri endofit pada lapisan luar sel (exodermis, sclerenchyma) dan korteks akar, terjadi secara inter dan intraseluler dalam waktu 2 sampai 3 minggu, menyebabkan bagian aerenchyma (korteks) menjadi berair dan ini merupakan tempat terbesar bagi terbentunya mikrokoloni. Sebagain besar kolonisasi secara interseluler menyebabkan pengambilan nutrisi, terutama karbon oleh bakteri. Bakteri endofit juga mampu melakukan penetrasi ke dalam akar sampai pada stele, dan juga terdapat pada parenkim dan dalam jaringan xylem
(Prakamhang 2007).
Bakteri endofit mampu meningkatkan ketahanan tanaman melalui beberapa cara: 1) secara langsung berfungsi antagonis atau mengeluarkan senyawa tertentu pada relung patogen, 2) menginduksi sistem resistensi, dan 3) meningkatkan toleransi tanaman terhadap tekanan lingkungan biotik (Hallmann 1999). Oleh karena itu, agar bakteri endofit mampu meningkatkankan resistensi tanaman, maka bakteri endofit juga harus kompatibel dengan tanaman inang sehingga mampu mengkolonisasi jaringan tanaman (Long et al. 2008).
Banyak spesies dari bakteri endofit yang bersifat antagonis diantaranya: B. subtilis, R. solanacearum, P. fluorescens, P. putida, A. radiobacter, A. tumefaciens, E. herbicola, dan Serratia marcescens (Bacon dan Hinton 2006). Cara kerja dari bakteri endofit sebagai agens pengendali hayati diantaranya adalah memproduksi bahan campuran antimikroba, kompetisi ruang dan nutrisi, kompetisi mikronutrisi seperti zat besi dan produksi siderofor, serta dapat menyebabkan tanaman inang menjadi resisten (Bacon dan Hinton 2006).
Beberapa hasil penelitian menunjukkan bahwa penggunaan bakteri endofit yang diisolasi dari mentimun dan kapas dapat mengurangi populasi M. incognita
pada mentimun sampai 50% (Halmann et al. 1997). Bakteri endofit B. pumilus dan
B. mycoides efektif mengurangi jumlah puru dan telur M. incognita 33% dan 39% pada kopi (Mekete et al. 2009). Munif (2001) menguji 181 isolat bakteri endofit asal tomat terhadap M. incognita, 21 isolat dapat menghambat perkembangan nematoda M. incognita di rumah kaca. Selanjutnya Harni (2010) menggunakan isolat bakteri endofit asal nilam yaitu Achromobacter xylosoxidans, B. subtilis, Alcaligenes faecalis, B. cereus, dan P. putida dapat menekan populasi Pratylenchus brachyurus 74.0 sampai dengan 81.6% sekaligus dapat meningkatkan pertumbuhan nilam sebesar 46.97 sampai dengan 86.79%, dan filtratnya dapat membunuh nematoda dalam waktu 24 jam sebesar 7.71% (Harni et al. 2010).
Formulasi Agens Hayati
Formulasi merupakan tahap akhir dari pengembangan agens hayati. Tujuannya adalah agar produk agens hayati tersebut dapat disebarluaskan kepada pengguna Formulasi agens hayati memiliki beberapa kelebihan antara lain (1) dapat mempertahankan stabilitas agens hayati selama penyimpanan maupun pendistribusian, (2) meningkatkan persistensi agens di lapangan, (3) mempermudah aplikasi produk tersebut di lapangan, (4) melindungi agens dari faktor lingkungan yang kurang mendukung, dan (5) menambah aktivitas agens pada target inang. Formulasi terdari dari dua tipe, yaitu produk berbentuk padatan (tepung dan butiran), serta berbentuk suspensi (berbahan dasar minyak atau air, dan emulsi) (Jones dan Burges 1998).
Pemilihan bahan pembawa dalam formulasi dapat dilakukan dengan melihat tujuan formulasi dan jenis agens hayati yang akan diformulasikan. Bahan pembawa yang sesuai dapat menjaga viabilitas sel bakteri (Harahap 2011). Pemilihan bahan juga akan menentukan keefektifan formulasi tersebut untuk meningkatkan pertumbuhan tanaman, dan sebagai pengendali patogen (Ankardani et al. 2010).
Penurunan viabilitas sel dapat disebabkan oleh faktor suhu lingkungan, lama penyimpanan, perubahan kadar air, jenis dan sifat dari bahan pembawa (Bai et al.
2003). Noviana dan Raharjo (2009) perubahan jumlah populasi pada bahan pembawa dipengaruhi beberapa faktor yaitu nutrisi, suhu, proses produksi biomassa, awal penyimpanan, dan adanya senyawa toksik yang mungkin terkandung dalam bahan pembawa.
Formulasi Tepung
Formulasi tepung yang berbentuk padatan dengan bahan pembawa talk, yaitu mineral yang sangat lunak dengan komposisi kimia (Mg3SiO10(OH)2) dengan kadar
umumnya terjadi sebagai mineral sekunder hasil hidrasi batuan pembawa magnesium, seperti petidotit, gabro, dan dolomit dengan sedikit kadar air dan luas permukaan kurang dari 20 µm. Talk dapat berada di dalam pasir, lumpur, dan list yang mempunyai ikatan sangat kuat. Talk merupakan jenis tanah mineral yang dominan berasosiasi dengan kaolinit dan gibsit. Stabilitas talk relatif berbeda dengan mineral liat yang lain karena komponen talk mempunyai kandungan tanah liat yang sangat kuat. Talk juga memiliki sifat halus, licin, penghisap minyak dan lemak, konduktivitas listrik rendah, penghantar panas tinggi, dan berkekuatan tinggi (Dixon 1989).
Sulistiani (2009) melaporkan pengaruh interaksi jenis formulasi dan lama penyimpanan formulasi spora B. subtilis memberikan hasil yang beragam. Formulasi talk pada penyimpanan minggu ke-6 mencapai panjang optimum pada benih padi jika dibandingkan dengan formulasi lainnya. Hal ini terjadi karena kombinasi perlakuan paling efektif jika menggunakan formulasi talk dengan waktu aplikasi pada minggu keenam. Selain jenis formulasi lama penyimpanan juga memberikan pengaruh terhadap viabilitas spora.
Kuenpech dan Akarapisan (2014) melaporkan bahwa talk yang dicampur dengan tepung gandum, sodium alginat, gliserin, sukrosa, yeast extract mampu mempertahankan vaiabilitas sel bakteri B. subtilis B6. Selain mampu mempertahankan viabilitas sel bakteri formulasi tersebut juga diketahui mampu menekan pertumbuhan cendawan Colletrotichum sp. pada tanaman anggrek. Penelitian menggunakan talk sebagai bahan pembawa juga dilaporkan oleh Wahab
et al. (2014), talk dengan penambahan selulosa, glukosa, silica copper, kalsium, besi, dan sodium dapat mempertahankan viabilitas Pseudomonas GanoEB3 sampai penyimpanan 12 bulan dan meningkatkan pertumbuhan kelapa sawit.
Selain talk, tepung tapioka juga sering digunakan dalam formulasi. Tepung tapioka pada dasarnya merupakan pati dari ketela pohon, dengan komposisi kimia yaitu serat 0.5%, air 15%, karbohidrat 85%, protein 0.5 sampai 0.7%, lemak 0.2%, dan energi (kalori/100 g). Wijayanti (2010) melaporkan bahwa tepung tapioka berpotensi sebagai campuran bahan pembawa Natrium alginat pada pupuk biologis yang dihasilkan melalui enkapsulasi. Viabilitas Azospirillum brasilense dalam kapsul Natrium alginat dan dalam formulasi bahan pembawa (perbandingan konsentrasi antara Natrium alginat dan tepung tapioka) sangat baik.
Formulasi Cair
Formula cair yang banyak ditemui di kalangan masyarakat yaitu dengan memanfaatkan limbah air kelapa. Pemanfaatan air kelapa sebagai limbah organik untuk media tumbuh bakteri sudah lama digunakan. Limbah organik cair banyak digunakan sebagai media alternatif seperti limbah air kelapa dapat dijadikan media untuk pertumbuhan bakteri P. flourescens (Ratdiana 2007). Vigliar et al. (2006) melaporkan bahwa air kelapa mempunyai komposisi nutrisi yang lengkap berupa 95.5% air, 4% karbohidrat, 0.1% lemak, 0.02% kalsium, 0.01% fosfor, 0.5% besi, asam amino, vitamin C, vitamin B kompleks dan garam-garam mineral. Kandungan nutrisi yang lengkap pada air kelapa menyebabkan pertumbuhan populasi atau jumlah koloni B. subtilis cukup baik dan stabil selama dalam proses penyimpanan.
mL-1. Tingginya populasi bakteri pada formulasi air kelapa disebabkan oleh banyak
sumber karbon yang terkandung di dalam air kelapa. Air kelapa mengandung air 91%, protein 0.14%, lemak 1.5%, karbohidrat 4.6%, dan abu 1.06%. Air kelapa mengandung berbagai nutrisi seperti sukrosa, dekstrosa, fruktosa serta vitamin B kompleks. Nutrisi tersebut sangat berguna untuk pertumbuhan bakteri pelarut fosfat (Demse 2008).
Selain air kelapa, molase juga banyak digunakan dalam formulasi cair. Molase adalah hasil samping yang berasal dari pembuatan gula tebu (Saccharum officinarum L.). Molase berupa cairan kental dan diperoleh dari proses pengolahan gula setelah mengalami kristalisasi berulang, yang berwarna coklat kehitaman. Molase berbagai sumber karbohidrat seperti glukosa, sukrosa, dan fruktosa (Paturau 1982). Kandungan karbohidrat yang kompleks pada molase dapat menyebabkan bertambah lamanya waktu inkubasi bakteri sebelum mencapai populasi maksimum. Hasil penelitian Derakhshan et al. (2008) menunjukkan bahwa formulasi cair menggunakan bahan molase mampu mempertahankan viabilitas cendawan L. Lecanii di atas 88% setelah disimpan 12 bulan.
Formulasi Kompos
Bahan organik merupakan salah satu bahan yang dapat digunakan sebagai bahan pembawa agens biokontrol (Warrior et al. 2002). Penggunaan bahan organik sebagai bahan pembawa agens biokontrol mempunyai manfaat ganda karena selain menjadi bahan pembawa dan sumber nutrisi (food base) bagi agens biokontrol (Hoitink dan Boehm 1999). Bahan organik sendiri juga mempunyai kemampuan untuk menekan penyakit terbawa tanah (Noble dan Coventry 2005).
Kompos merupakan bahan organik, seperti daun-daunan, jerami, rumput-rumputan, dedak padi, batang jagung, sulur, carang-carang serta kotoran hewan yang telah mengalami proses dekomposisi oleh mikroorganisme pengurai, sehingga dapat dimanfaatkan untuk memperbaiki sifat-sifat tanah. Kompos mengandung hara-hara mineral yang esensial bagi tanaman. Di lingkungan alam terbuka, proses pengomposan bisa terjadi dengan sendirinya. Lewat proses alami rumput, daun-daunan dan kotoran hewan serta sampah lainnya lama kelamaan membusuk karena adanya kerja sama antara mikroorganisme dengan cuaca. Proses tersebut bisa dipercepat oleh perlakuan manusia, yaitu dengan menambahkan mikroorganisme pengurai sehingga dalam waktu singkat akan diperoleh kompos yang berkualitas baik. Dengan demikian, kompos merupakan sumber bahan organik dan nutrisi tanaman (Setyorini et al. 2006).
Bahan dasar kompos dengan variasi rasio C/N mengandung Nitrogen (N) kompos matang komposter 1, 2 dan 3 berturut-turut yaitu 2.71%, 2.63% dan 2.94%. Nilai Phosfor (P) kompos matang komposter 1, 2 dan 3 berturut-turut yaitu 1.96%, 2.13% dan 1.82%. Nilai Kalium (K) kompos matang komposter 1, 2 dan 3 berturut turut yaitu 7.36%, 7.57% dan 6.59%. Kadar air komposter 1, 2 dan 3 berturut-turut yaitu 20.27, 20.97% dan 18,33% (Widarti et al. 2015).
METODE
Tempat dan Waktu Penelitian
Penelitian dilakukan Laboratorium Nematologi Tumbuhan, Departeman Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor dan Rumah kaca Balai Penelitian Tanaman Rempah dan Obat-obatan Cimanggu Bogor. Waktu pelaksanaan penelitian dilakukan pada bulan Juli 2014 sampai April 2015.
Karakterisasi Morfologi Bakteri Endofit
Bakteri endofit yang digunakan dalam penelitian ini adalah Bacillus sp. AA2 dan Bacillus sp. MER yang diisolasi dari tanaman lada dan isolat MSJ yang diisolasi dari tanaman mahoni. Isolat diremajakan pada media Tryptic Soya Agar (TSA) 100%, kemudian diinkubasi selama 24 sampai 48 jam pada suhu ruang. Bakteri endofit yang telah tumbuh diamati bentuk morfologinya, kemudian sebanyak satu petri dimasukkan kedalam 100 mL TSB dan di goyang menggunakan shaker selama 24 jam untuk keperluan selanjutnya.
Uji Patogenesitas Bakteri Endofit pada Tumbuhan
Isolat bakteri endofit ditumbuhkan pada media TSA selama 48 jam. Bakteri diambil dan disuspensikan pada media Tryptic Soya Broth (TSB), kemudian di
shaker dengan kecepatan 100 rpm selama 24 jam pada suhu ruang. Suspensi bakteri disuntikkan menggunakan jarum pada daun tembakau hingga membasahi ruang antar sel. Pengamatan dilakukan setelah 24 sampai 48 jam dengan melihat ada tidaknya gejala nekrotik pada daun tembakau.
Karakterisasi Fisiologis Bakteri Endofit Uji Pewarnaan Gram
Sebanyak 0.5 mL akuades steril diteteskan pada permukaan kaca objek, kemudian koloni tunggal isolat bakteri diambil dengan jarum ose dan disebar secara merata. Olesan bakteri tersebut dibiarkan kering dengan cara difiksasi pada api bunsen sampai agak kering, kemudian diberikan 0.5 mL larutan kristal violet dan dibiarkan selama satu menit dan dibilas dengan akuades. Bakteri tersebut diberi larutan iodium dan dibiarkan selama dua menit dan dibilas dengan akuades. Preparat dicuci dengan alkohol 96% dan dibilas dengan akuades dan ditambahkan pewarna pembanding safranin dan dibilas kembali dengan akuades. Preparat ditetesi dengan minyak emersi dan diamati dibawah mikroskop cahaya dengan perbesaran 40 x 10 untuk melihat bentuk dan warna sel bakteri (Schaad et al. 2001).
Uji Gram Bakteri dengan KOH 3%
diangkat perlahan dengan jarum ose setinggi 5 sampai 7 cm, sedangkan Gram positif tidak menunjukkan terangkatnya lendir oleh jarum ose.
Aktivitas Kitinolitik
Uji produksi enzim kitinase dilakukan dengan menggunakan media spesifik kitin 1% dengan komposisi 15 g bacto agar, 5 g glukosa, 2 g pepton, 10 g koloidal kitin, 0.5 g K2HPO4. 0.5 g MgSO4, 0.5 g NaCl dalam 1 L akuades. Media yang
telah disterilisasi dengan autoklaf pada suhu 121 oC dan tekanan 17 psi dituang pada cawan petri, kemudian bakteri endofit digores pada media tersebut. Aktivitas kitinolitik ditandai dengan terbentuknya zona bening disekitar koloni bakteri setelah diinkubasi selama 24 sampai 72 jam (Hariprasad et al. 2011).
Aktivitas Proteolitik
Uji proteolitik menggunakan media Skim Milk Agar (SMA) 1% yaitu TSA yang ditambahkan didalamnya dengan susu skim. Media TSA 100% sebanyak 900 mL disterilisasi dengan autoklaf pada suhu 121 oC dan tekanan 17 psi, kemudian ditambahkan susu skim 10 g dalam 100 mL akuades yang telah dipasteurisasi pada suhu 110 oC selama 10 menit. Bakteri endofit di gores pada media SMA dan diinkubasi pada suhu ruang selama 24 sampai 72 jam. Aktivitas proteolitik di-tunjukkan dengan terbentuknya zona bening di sekitar koloni bakteri (Baehaki et al. 2011).
Aktivitas Lipolitik
Uji lipolitik menggunakan media rhodamin-B. Komposisi media dalam satu liter terdiri dari 8 g NB, 4 g sodium klorid, 10 g agar, dan larutan rhodamin B sebanyak 0.001% dengan pH 7. Media di sterilisasi autoklaf pada suhu 121 oC selama 15 menit. Minyak zaitun (2.5%) sebelum media dituang dalam cawan petri. Isolat bakteri endofit digores pada media dan dilakukan pengamatan dibawah lampu UV setelah inkubasi 48 jam (Kouker dan Jaeger 1987)
Uji Aktivitas Pelarut Fosfat
Uji kemampuan bakteri untuk memobilisasi fosfat menggunakan medium Pikovskaya agar dengan penambahan Tri-Calcium Phosphate (TCP). Komposisi dalam satu liter media terdiri dari glukosa 10 g, NaCl 0.2 g, KCl 0.2 g, MgSO4 0.1 g, MnSO4 2.5 mg, FeSO4 2.5 mg, yeast extract 0.5 g, (NH4)2.SO4 0.5 g, dan agar
15 g. Media disterilisasi dengan autoklaf pada suhu 121 oC dan tekanan 17 psi
kemudian dituang pada cawan petri. Bakteri digores pada medium dan diinkubasi pada suhu ruang selama 4 sampai 8 hari. Zona bening di sekitar bakteri menunjukkan adanya kemampuan bakteri untuk melarutkan fosfat (Thakuria et al.
2004).
Penambat Nitrogen
Uji penambat nitrogen menggunakan media semi padat NFB (Nitrogen Free Bromthymol Blue). Komposisi dalam satu liter media terdiri dari asam malat 5 g, Na2.HPO4. 0.5 g, MgSO4.7H2O 0.2 g, NaCl 0.1 g, CaCl 0.02 g, Trace element
solution (Na2MoO4.2H2O 0.2 g, MnSO4.H2O 0.235 g, asam borat 0.28 g,
CuSO4.5H2O 0.008 g, ZnSO4.7H2O 0.024 g, akuades 1 L), Bromothymol Blue
4 g, agar 1.75 g. Bakteri endofit ditumbuhkan pada media TSB 100%, kemudian 1 mL suspensi bakteri dengan kerapatan 108 cfu mL-1 ditumbuhkan pada 9 mL media NFB dan diinkubasi selama 48 jam. Kemampuan bakteri untuk menambat nitrogen ditandai dengan perubahan warna media menjadi biru atau biru tua serta terbentuknya lapisan lendir atau pellicle pada permukaan media menandakan bahwa isolat bakteri mampu menambat nitrogen (Yim et al. 2009).
Produksi Hormon Auksin (IAA)
Satu jarum ose isolat bakteri endofit dikulturkan pada 10 mL media Nutrient Broth (NB) yang sudah ditambahkan L-triptofan 0.2 mM, kemudian di shaker
selama 48 jam dengan kecepatan 150 rpm pada suhu ruang. IAA yang diproduksi oleh bakteri endofit diuji dengan metode kolorimetri dengan menggunakan reagen Salkowski yang mengandung 150 ml H2SO4 pekat, 250 akuades, 7.5 mL.FeCl3. 6
H2O 0.5 M. Sebanyak 3 mL kultur dari tiap perlakuan bakteri yang di uji
dimasukkan ke dalam tabung eppendorf, kemudian disentrifugasi dengan kecepatan 10 000 rpm selama 15 menit. Sebanyak 2 mL supernatan yang diperoleh dimasukkan ke dalam tabung reaksi steril dan ditambahkan 2 mL reagen Salkowski (supernatan : reagen = 1:1). Suspensi diinkubasi selama 48 sampai 120 jam pada suhu ruang dan dilakukan pengukuran serapan IAA dengan menggunakan spektrofotometer (Spectronic 20) pada panjang gelombang 510 nm) (Widyawati 2008).
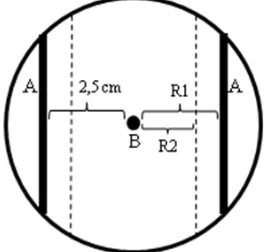
Uji Antibiosis Bakteri Endofit terhadap Fusarium oxysporum
Uji antagonis terhadap isolat cendawan F. oxysporum dilakukan pada cawan petri yang berisi medium PDA. Bakteri endofit uji digoreskan pada dua sisi medium dengan jarak 1 cm dari pinggir. Isolat cendawan yang telah berumur 7 hari dengan diameter 0.5 cm diletakkan pada pusat medium (Gambar 2). Pengamatan dilakukan terhadap zona hambat yang dihasilkan pada hari ke-5 yang dihitung dengan rumus:
P = [R1−R2
R1 ] x 100%
Dengan P = persentase penghambatan pertumbuhan (%); R1 = jarak jari-jari miselium hingga tepi bakteri (cm); R2 = jarak jari-jari miselium hingga tepi zona hambat (cm).
Uji Potensi Bakteri Endofit sebagai Pemacu Pertumbuhan Bibit Mentimun Pengujian ini bertujuan untuk mengetahui kemampuan bakteri endofit dalam meningkatkan pertumbuhan bibit mentimun. Pengujian dilakukan dengan cara menumbuhkan isolat bakteri pada 100 mL media TSB 100% kemudian di shaker
selama 48 jam. Setelah 48 jam benih mentimun yang telah disterilisasi permukaan dengan menggunakan alkohol 70% selama 40 detik, tween 20% selama 1 menit, dan dibilas dengan akuades steril sebanyak 3 kali. Biji direndam dalam suspensi bakteri endofit selama 24 jam, kemudian ditumbuhkan pada media tanah steril. Rancangan yang digunakan adalah rancangan acak lengkap dengan 6 kali ulangan. Peubah yang diamati adalah jumlah daun, tinggi tanaman dan panjang akar. Data yang diperoleh dianalisis menggunakan analisis ragam (ANOVA) dengan menggunakan program Statistical Analysis System (SAS) versi 9.0 dan uji lanjut
Duncan Multiple Range Test (DMRT) untuk melihat perbedaan tiap perlakuan pada tingkat kepercayaan 5% (Munif et al. 2013).
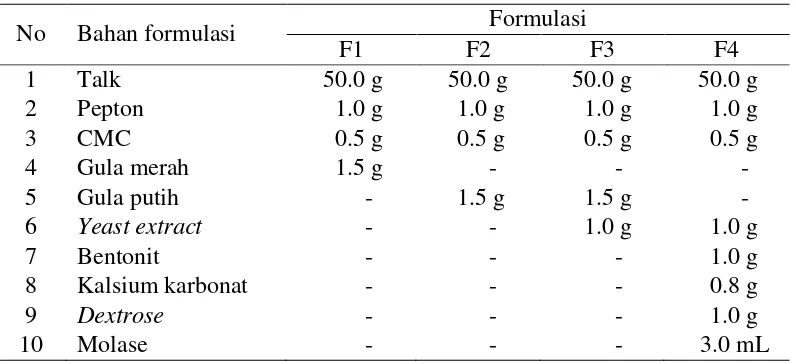
Formulasi Tepung Bakteri Endofit
Formulasi yang digunakan dalam penelitian ini terdiri atas 4 jenis formulasi tepung yaitu formulasi 1, 2, 3, dan 4 (Tabel 1).
Tabel 1 Komposisi bahan yang digunakan untuk pembuatan formulasi tepung bakteri endofit
No Bahan formulasi Formulasi
F1 F2 F3 F4
(-) tidak menggunakan bahan formulasi
Uji Viabilitas Bakteri Endofit dalam Formulasi Tepung secara In vitro Uji viabilitas bertujuan untuk mengetahui jangka waktu kemampuan bakteri endofit bertahan di dalam formulasi. Pengujian viabilitas atau kemampuan daya tumbuh bakteri dilakukan dengan cara mengambil 1 g formulasi, dilakukan pengenceran berseri sampai dengan pengenceran 10-4. Hasil pengenceran 10-4 diambil 0.1 mL kemudian ditumbuhkan pada media TSA 100%, selanjutnya diinkubasi pada suhu ruang selama 24 sampai 48 jam. Jumlah koloni yang tumbuh dihitung, selanjutnya dikonversikan ke dalam satuan cfu mL-1 dengan rumus:
Populasi bakteri = r pxv
Dengan r = jumlah koloni yang tumbuh pada cawan dengan faktor pengenceran ke- (cfu); p = faktor pengenceran ke; v = volume suspensi yang disebar pada cawan (mL) (Caesar dan Burr 1991).
Uji Keefektifan Formulasi Tepung secara In vivo
Formulasi tepung bakteri endofit diaplikasikan dengan cara mencampurkannya pada tanah disekeliling tanaman lada dalam polybag. Aplikasi dilakukan pada bulan pertama dan bulan ketiga. Penelitian menggunakan Rancangan Acak Lengkap dengan 4 jenis formulasi tepung (F1, F2, F3, dan F4), 3 isolat bakteri endofit (Bacillus sp. AA2, Bacillus sp. MER dan isolat MSJ) dan 2 dosis talk (25 g dan 50 g) untuk 5 kg tanah. Kontrol positif tanaman diinokulasi dengan nematoda dan sebagai pembanding digunakan nematisida sintetik dengan bahan aktif carbofuran 2 g untuk 5 kg tanah.
Nematoda diinokulasikan satu minggu setelah aplikasi formulasi bakteri endofit. Inokulasi nematoda menggunakan 250 mL tanah terinfeksi yang diambil dari lapangan di perkebunan lada di Bangka, yang dicampurkan dengan tanah dalam polybag. Jumlah nematoda yang diinokulasi adalah 400 nematoda per
polybag.
Penghitungan Populasi Nematoda
Variabel Pengamatan
Variabel yang diamati adalah variabel agronomis dan patologis. Variabel agronomis terdiri atas tinggi tanaman, jumlah cabang, jumlah daun, jumlah ruas, bobot segar tajuk, bobot segar akar, bobot kering tajuk dan bobot kering akar. Variabel patologis terdiri atas jumlah puru akar, populasi nematoda dalam akar, populasi nematoda di tanah, dan skala kerusakan akar.
Analisis Data
HASIL DAN PEMBAHASAN
Karakterisasi Morfologi Koloni Bakteri Endofit
Bacillus sp. AA2 dan MER dapat tumbuh dengan baik dan didapat biakan murni setelah 24 jam pada media Triptic Soya Agar (TSA) dengan ciri yaitu bentuk bundar dan tidak beraturan, tepian licin, elevasi cembung, dan berwarna putih susu, sedangkan isolat MSJ diperlukan waktu 48 jam untuk tumbuh maksimal pada media TSA 100% dengan bentuk koloni bulat, tepian rata halus, berwarna kekuningan, dan berlendir (Gambar 3).
Gambar 3 Morfologi bakteri endofit pada media TSA 100%. (a) Bacillus sp. AA2, (b) Bacillus sp. MER, (c) isolat MSJ
Uji Patogenesitas Bakteri Endofit pada Tumbuhan
Uji hipersensitifitas daun tembakau untuk mengetahui patogenesitas dilakukan terhadap 3 isolat bakteri endofit yaitu Bacillus sp. AA2, Bacillus sp. MER dan isolat MSJ. Air steril digunakan sebagai kontrol negatif dan bakteri patogen Erwinia caratovora sebagai kontrol positif. Hasil uji hipersensitif menunjukkan reaksi negatif pada ketiga isolat bakteri endofit. Hal tersebut ditandai dengan tidak adanya gejala nekrosis yang timbul pada daun tembakau setelah pengamatan selama 24 sampai 48 jam. Kontrol positif (Erwinia caratovora) menunjukkan adanya gejala nekrosis pada daun tembakau tersebut (Gambar 4).
Gambar 4 Uji patogenesitas bakteri endofit pada daun tembakau. (a) kontrol positif menunjukkan gejala nekrotik, (b) perlakuan bakteri endofit tidak menunjukkan gejala nekrotik
a b c
Trinayanti (2012) menyatakan bahwa respon hipersensitif merupakan reaksi pertahanan yang cepat dari tanaman menghadapi patogen yang tidak kompatibel disertai kematian sel yang cepat pada jaringan di daerah yang disuntikkan suspensi bakteri sehingga keberadaannya tidak mempengaruhi pertumbuhan tanaman inang. Wick (2010) menyatakan bahwa uji hipersensitif pada tanaman tembakau merupakan cara yang cepat dan praktis untuk mengetahui patogenesitas suatu kultur bakteri. Berdasarkan hasil uji reaksi hipersensitif pada tanaman tembakau, seluruh isolat bakteri endofit yang diuji bersifat non patogenik, sehingga dapat digunakan untuk pengujian selanjutnya.
Karakterisasi Fisiologis Bakteri Endofit
Hasil pengujian beberapa karakter fisiologis bakteri endofit menunjukkan bahwa Bacillus sp. AA2 dan Bacillus sp. MER tergolong bakteri Gram positif, sedangkan isolat MSJ merupakan bakteri Gram negatif. Ketiga isolat tersebut menunjukkan kemampuan menghasilkan hormon IAA. Bacillus sp. AA2 dan
Bacillus sp. MER menghasilkan enzim protease dan kitinase, enzim lipase hanya dihasilkan oleh isolat MSJ. Berdasarkan uji penambat nitrogen diketahui bahwa
Bacillus sp. AA2 dan isolat MSJ mampu menambat nitrogen (Tabel 2). Tabel 2 Karakter fisiologis bakteri endofit
Karakter fisiologis Isolat bakteri endofit
a
aIsolat bakteri dengan kode positif (+) menunjukkan bahwa bakteri tersebut positif pada uji-uji
fisiologis, isolat bakteri dengan kode negatif (-) menunjukkan bahwa bakteri tersebut negatif pada uji-uji fisiologis
Uji Gram dengan Pewarnaan
Uji Gram dengan pewarnaan menunjukkan bahwa Bacillus sp. AA2 dan
Bacillus sp. MER termasuk golongan bakteri Gram positif, yang ditandai dengan perubahan warna sel bakteri yang berwarna ungu dan berbentuk kokus. Isolat MSJ tergolong bakteri Gram negatif yang ditandai dengan sel berwarna merah dan berbentuk batang (Gambar 5).
dapat meningkatkan porositas dinding sel dengan melarutkan lipid pada membran luar sehingga komplek ungu kristal-iodium akan terlepas dan sel menjadi tidak berwarna. Selanjutnya sel akan berwarna merah karena terwarnai oleh warna pembanding yaitu safranin (Agustina et al. 2013).
Gambar 5 Uji pewarnaan Gram bakteri endofit. (a) sel bakteri Gram negatif berwarna merah, (b) sel bakteri Gram positif berwarna ungu
Uji Gram dengan KOH 3%
Uji Gram dengan KOH 3% menunjukkan bahwa Bacillus sp. AA2 dan
Bacillus sp. MER merupakan bakteri Gram positif. Hal ini ditunjukkan dengan tidak terbentuknya lendir saat direaksikan dengan KOH 3%. Isolat MSJ merupakan bakteri Gram negatif, yang ditandai dengan terbentuknya lendir saat biakan dicampurkan dengan KOH 3% (Gambar 6).
Gambar 6 Uji Gram dengan KOH 3%. (a) bakteri Gram negatif membentuk lendir dan tidak putus ketika diangkat perlahan dengan jarum ose, (b) bakteri Gram positif tidak menunjukkan terangkatnya lendir oleh jarum ose Tidak terbentuknya lendir pada bakteri Gram positif karena dinding sel bakteri Gram positif lebih tahan terhadap KOH, sehingga dinding sel tidak pecah. Shivas dan Beasley (2005) menyatakan bahwa dinding sel bakteri Gram negatif lebih sensitif dan tidak memiliki ketahanan terhadap penghambat basa seperti larutan KOH. Apabila sel bakteri Gram negatif direaksikan dengan larutan KOH
a b
akan menyebabkan dinding sel bakteri pecah dan terjadi lisis dan DNA dibebaskan. DNA bersifat sangat kental di dalam air, sehingga terbentuk benang berlendir. Aktivitas Kitinolitik
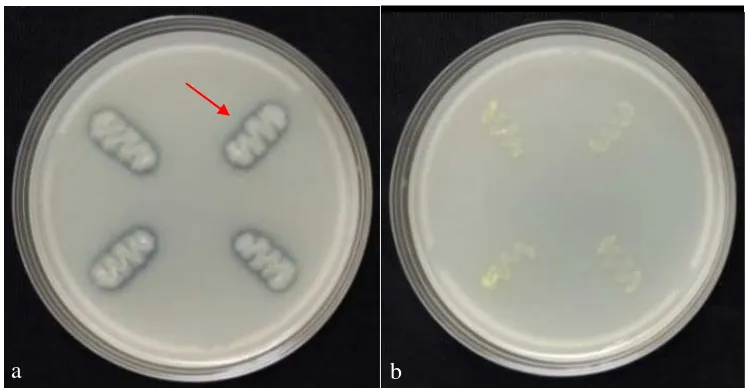
Aktivitas kitinolitik bakteri endofit dapat diamati setelah 48 jam inkubasi. Hasil pengamatan menunjukkan bahwa Bacillus sp. AA2 dan Bacillus sp. MER menunjukkan hasil positif, sedangkan isolat MSJ menunjukkan hasil negatif (Gambar 7). Hasil positif tersebut ditandai dengan terbentuknya zona bening di media agar yang mengandung kitin koloid agar. Zona bening yang terbentuk mengindikasikan bahwa bakteri tersebut mengeluarkan enzim yang mampu merombak substrat kitin yang terdapat dalam media agar.
Gambar 7 Uji aktivitas kitinolitik. (a) Bacillus sp. AA2 membentuk zona bening, (b) isolat MSJ tidak membentuk zona bening
Beberapa laporan menjelaskan bahwa bakteri yang menghasilkan enzim kitinase mampu mengendalikan berbagai jenis patogen dari golongan cendawan, nematoda dan hama karena sebagian besar dinding sel patogen tersebut terdiri atas kitin. Kitinase adalah enzim yang dihasilkan oleh bakteri yang menghidrolisis
ikatan β-1.4 antar N-asetilglukosamina (NacGlc) pada kitin, suatu polimer polisakarida penyusun dinding sel beberapa patogen. Oleh karena itu, kitinase sangat dikenal sebagai salah satu anti mikroba (Neuhaus 1999).
Penelitian Harni et al. (2007) menunjukkan bahwa bakteri endofit Bacillus
NJ46, Bacillus NA22, dan Bacillus NJ2 mampu menekan populasi nematoda
Pratylenchus brachyurus cukup tinggi. Terjadinya penekanan tersebut diduga disebabkan oleh metabolit sekunder, enzim kitinase, dan protease yang dihasilkan oleh bakteri-bakteri tersebut. Enzim kitinase dapat digunakan langsung oleh bakteri untuk mendegradasi dinding sel patogen. Enzim kitinase memiliki peran penting dalam pengendalian nematoda karena enzim ini mampu mendegradasi lapisan tengah telur nematoda seperti M. javanica, R. reniformis, Tylenchulus semipenetrans, dan Pratylenchus brachyurus (Tian et al. 2007), dan lapisan telur
Heterodera schactii dan H. glycines (Roland dan Marcus 1986). Cronin et al.
(1997) menjelaskan bahwa enzim kitinase dapat menghambat penetasan telur G.
rostochiensis sampai 70% dan enzim ini mampu mengendalikan populasi nematoda
M. javanica serta meningkatkan pertumbuhan tanaman tomat. Aktivitas Proteolitik
Pengamatan aktivitas proteolitik bakteri endofit menunjukkan bahwa isolat bakteri dari golongan Bacillus AA2 dan MER memperlihatkan adanya aktivitas proteolitik setelah 48 jam inkubasi. Hal tersebut ditandai dengan terbentuknya zona bening disekeliling bakteri pada media TSA dengan susu skim. Isolat MSJ tidak memperlihatkan terbentuknya zona bening disekitar isolat bakteri (Gambar 8). Ini mengindikasikan bahwa isolat MSJ tidak menghasilkan enzim protease, sedangkan
Bacillus sp. AA2 dan Bacillus sp. MER dapat menghasilkan enzim protease.
Gambar 8 Uji aktivitas proteolitik. (a) Bacillus sp. AA2 membentuk zona bening, (b) isolat MSJ tidak membentuk zona bening
Bakteri proteolitik adalah bakteri yang memproduksi enzim protease ektraseluler. Enzim protease di produksi oleh bakteri di dalam sel kemudian dilepaskan ke mediumnya. Menurut Abraham et al. (1993) seluruh bakteri memiliki enzim protease, namun tidak semua enzim protease tersebut dilepaskan ke medium. Bakteri yang mampu memproduksi enzim protease ekstraseluler akan membentuk zona bening di sekitar koloni bakteri karena hilangnya partikel kasein yang terdapat pada media Skim Milk Agar. Kasein dihidrolisis oleh enzim protease ekstraseluler menjadi peptida-peptida dan asam amino.
Zona bening yang terbentuk di sekitar koloni bakteri merupakan tanda hilangnya partikel kasein di media susu skim. Adanya enzim proteolitik ekstraseluler bakteri, kasein akan terhidrolisis menjadi peptida-peptida dan asam amino yang larut. Enzim ekstraseluler Bacillus sp.sangat efisien dalam memecah berbagai senyawa karbohidrat, lipid dan protein rantai panjang menjadi unit-unit rantai pendek atau senyawa-senyawa yang lebih sederhana (Yusufa et al. 2012).
Bakteri yang mempunyai aktivitas proteolitik mempunyai kemampuan untuk menghasilkan enzim protease yang disekresikan ke lingkungannya. Enzim proteolitik ekstraseluler ini selanjutnya menghidrolisis senyawa-senyawa bersifat protein menjadi oligopeptida, peptida rantai pendek dan asam amino. Diameter zona bening yang terbentuk dapat menunjukan secara kualitatif tingginya kemampuan proteolitik enzim protease yang dihasilkan atau juga tingginya jumlah
enzim yang diproduksi dan dilepas keluar. Keberadaan enzim protease ekstraseluler ini sangat penting bagi kehidupan bakteri karena menyediakan kebutuhan senyawa bernitrogen yang dapat diangkut ke dalam sel (Setyati dan Subagiyo 2012).
Enzim protease ektraseluler yang diproduksi oleh bakteri endofit memiliki peran penting untuk mengendalikan beberapa jenis patogen tanaman. Bonants et al.
(1995) melaporkan bahwa enzim protease yang diproduksi oleh Paecilomyces lilacinus mampu menghambat penetasan telur nematoda M. hapla. Tian et al.
(2007) dan Siddiqui et al. (2005) menyatakan produksi enzim protease ekstraseluler oleh bakteri merupakan salah satu mekanisme bakteri sebagai agen pengendali nematoda puru akar Meloidogyne spp.
Aktivitas Lipolitik
Uji kualitatif enzim lipolitik yang ditumbuhkan pada media substrat mengandung Rhodamin B. Hasil pengamatan menunjukkan isolat MSJ mengeluarkan pendaran berwarna oranye kekuningan di sekitar koloni bakteri yang diamati di bawah lampu UV, sedangkan isolat Bacillus sp. AA2 dan Bacillus sp. MER tidak mengeluarkan pendaran berwarna oranye (Gambar 9). Pendaran tersebut terbentuk oleh suatu kompleks antara ion asam lemak yang dihasilkan pada reaksi hidrolisis enzimatik oleh lipase dengan kation Rhodamin B (Kouker dan Jaeger 1987). Hal ini menunjukkan bahwa isolat MSJ mampu menghasilkan enzim lipase.
Gambar 9 Uji aktivitas lipolitik. (a) Bacillus sp. AA2 tidak membentuk pendaran berwarna oranye, (b) isolat MSJ membentuk pendaran berwarna oranye kekuningan
Uji Penambatan Nitrogen
Uji penambat nitrogen dilakukan pada media NFB dengan cara menginokulasikan 1 mL suspensi bakteri ke media tersebut, kemudian diinkubasi selama 48 jam. Berdasarkan hasil pengujian terhadap tiga isolat bakteri endofit diketahui bahwa Bacillus sp. AA2 dan isolat MSJ mampu berperan sebagai bakteri penambat nitrogen. Hal tersebut ditandai dengan terbentuknya pellicle atau lapisan lendir dan terjadinya perubahan warna menjadi kebiruan pada media NFB (Gambar 10).
Gambar 10 Uji bakteri penambat nitrogen. (a) Bacillus sp. AA2 membentuk lapisan lendir dan berubah warna menjadi kebiruan, (b) Bacillus sp. MER tidak membentuk lapisan lendir dan tidak berubah warna menjadi kebiruan Nitrogen dibutuhkan tanaman untuk perkembangannya. Davies dan Winsor (1967) menyatakan bahwa pemberian nitrogen yang cukup pada tanaman tomat dapat meningkatkan pembentukan buah tomat. Salah satu cara agar nitrogen tersedia bagi tanaman adalah menggunakan bakteri endofit yang memiliki kemampuan menambat nitrogen.
Terbentuknya lapisan lendir pada permukaan media NFB semipadat ini menunjukkan kondisi yang baik untuk aktivitas nitrogenase. Lapisan lendir yang dihasilkan oleh bakteri pada media NFB disebabkan di dalam medium tidak ada kelebihan oksigen, laju difusi oksigen sama dengan laju respirasi organisme merupakan kondisi yang baik untuk aktivitas enzim nitrogenase yang mambantu mereduksi asetilen menjadi etilen (Tarigan et al. 2013).
Uji Pelaruta Fosfat
Berdasarkan pengujian terhadap tiga isolat bakteri endofit, diketahui bahwa ketiga isolat tersebut tidak mampu melarutkan fosfat karena setelah 7 hari inkubasi tidak terlihat adanya zona bening di sekitar bakteri uji. Tidak semua bakteri endofit dapat melarutkan fosfat. Ketersediaan fosfat bukan satu-satunya faktor yang berpengaruh terhadap pertumbuhan tanaman, tetapi dapat dipengaruhi oleh faktor lainnya seperti dapat menghasilkan hormon pertumbuhan IAA (Sutariati et al. 2006).
Lebih lanjut Sutariati et al. (2006) juga melaporkan bahwa perlakuan dengan
Bacillus sp. isolat BG14 dan BG33, P. PG22 dan PG25, serta Serratia sp. isolat SG04 yang semuanya tidak mempunyai kemampuan melarutkan fosfat mampu memacu pertumbuhan bibit cabai melebihi pertumbuhan bibit tanpa perlakuan rizobakteri. Dalam hal ini, pengaruh ketersediaan fosfat terhadap pertumbuhan bibit cabai sampai dengan 4 minggu diduga belum optimal karena fosfat tersedia atau terlarut telah tercukupi oleh media tanam, sehingga perlakuan isolat rizobakteri dengan atau tanpa kemampuan melarutkan fosfat bukan merupakan faktor utama.
Produksi Hormon IAA
Hasil pengamatan menunjukkan bahwa ketiga isolat bakteri endofit yang di uji mampu menghasilkan hormon IAA. Hasil pengukuran kadar IAA secara in vitro
menunjukkan kemampuan yang berbeda dalam menghasilkan hormon IAA. Hal tersebut dipengaruhi oleh sifat fisiologi masing-masing bakteri, dimana setiap bakteri mempunyai kemampuan yang berbeda dalam mengonversi triptofan menjadi IAA. Konsentrasi hormon IAA Bacillus sp. AA2 dan Bacillus sp. MER pada inkubasi 48 jam masing-masing adalah 0.4851 ppm dan 0.0056 ppm, namun meningkat setelah inkubasi 120 jam, masing-masing adalah 0.6573 ppm dan 0.2673 ppm (Tabel 3). Hal tersebut diduga karena isolat tersebut juga menggunakan hormon IAA yang dihasilkannya untuk bermetabolisme. Menurut Lestari et al. (2007) bahwa pada awal inkubasi sumber nutrisi tinggi sehingga produksi IAA tinggi dan terus meningkat meskipun tidak secara nyata namun konsisten sampai akhir inkubasi.
Tabel 3 Konsentrasi hormon IAA yang dihasilkan bakteri endofit Isolat bakteri endofit Konsentrasi IAA (ppm)
48 jam 120 jam
Bacillus sp. AA2 0.4851 0.65735
Bacillus sp. MER 0.0056 0.2673
Isolat MSJ 181.355 59.833
Isolat MSJ memiliki konsentrasi hormon IAA tertinggi dibandingkan
Bacillus sp. AA2 dan Bacillus sp. MER, yaitu 181.355 ppm pada inkubasi 48 jam, tetapi menurun setelah inkubasi 120 jam menjadi 59.833 ppm. Kresnawaty et al. (2008) yang melaporkan bahwa produksi IAA tertinggi dicapai pada inkubasi selama 48 jam. Pada periode inkubasi 48 jam bakteri pada umumnya memasuki fase akhir logaritmik, sehingga IAA yang dihasilkan cukup tinggi. Hal tersebut dipengaruhi oleh karena kandungan enzim-enzim yang digunakan dalam biokonversi triptofan menjadi IAA seperti triptofan monooksigenase, IAM hidrolase, indol-piruvat dekarboksilase dan IAA1d dehidrogenase dihasilkan cukup banyak dan aktif sejalan dengan laju pertumbuhan. Pada inkubasi 120 jam bakteri memasuki fase kematian sehingga produksi IAA menurun. Penurunan produksi IAA pada 120 jam karena adanya pelepasan enzim pendegradasi IAA seperti oksidase dan peroksidase.
Variasi konsentrasi hormon IAA yang dihasilkan oleh masing-masing isolat diduga karena perbedaan kemampuan kecepatan bakteri dalam mensintesis triptofan menjadi IAA. Biosintesis IAA oleh mikroba dapat ditingkatkan dengan penambahan triptofan sebagai prekursor. Menurut Bric et al. (1991), bakteri yang menghasilkan IAA dapat ditumbuhkan di dalam media pertumbuhan yang mengandung triptofan yang penting dalam pembentukan IAA.
penting dalam regulasi perkembangan tanaman, memacu perkembangan perakaran tanaman inang, meningkatkan ketahanan tanaman terhadap patogen dan memacu pertumbuhan tanaman (Egamberdiyeva 2007).
Uji Antibiosis Bakteri Endofit terhadap Fusarium oxysporum
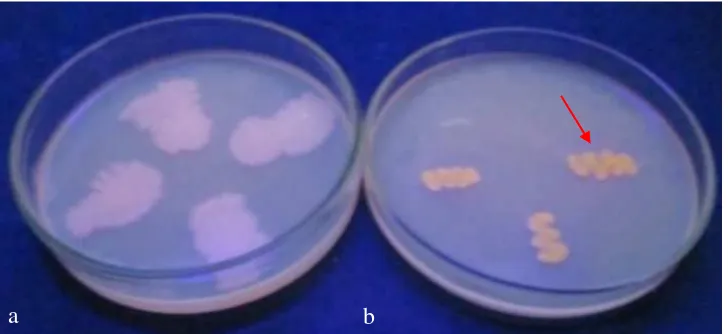
Uji antibiosis dengan metode kultur ganda memperlihatkan bahwa pertumbuhan F. oxysporum dapat dihambat oleh bakteri endofit. Penghambatan dapat dilihat dengan adanya zona hambat antara bakteri yang diuji dengan F. oxysporum, sedangkan pada daerah tanpa bakteri tidak terdapat zona hambat (Gambar 11). Kontrol menggunakan bakteri pathogen Xanthomonas oryzae tidak memperlihatkan adanya penghambatan terhadap F. oxysporum.
Gambar 11 Daya hambat bakteri endofit terhadap pertumbuhan cendawan
Fusarium oxysporum. (a) Bacillus sp. AA2 membentuk zona hambat, (b) bakteri patogen Xanthomonas oryzae tidak membentuk zona hambat
Tiga isolat bakteri yang diuji menunjukkan persentase penghambatan tertinggi secara berurutan adalah Bacillus sp. AA2, Bacillus sp. MER dan isolat MSJ sebesar 37.5, 25.0 dan 12.5% (Tabel 4).
Tabel 4 Persentase daya hambat bakteri endofit terhadap cendawan Fusarium oxysporum
Bakteri endofit Diameter zona hambat
Bacillus sp. AA2 37.5
Bacillus sp. MER 25.0
Isolat MSJ 12.5
Terbentuknya zona hambat karena adanya senyawa antifungal yang dihasilkan oleh ketiga bakteri endofit. Beberapa bakteri kelompok Bacillus juga dilaporkan dapat menghasilkan senyawa antifungal di antaranya inturin A (Leyns
et al. 1990) dan lipopeptida yang merupakan isomer dari kelompok iturin, fengycin, dan surfactin (Toure et al. 2004), serta kitinase (Chen et al. 2004). Senyawa antifungal yang dihasilkan oleh bakteri secara umum dapat mengakibatkan