APLIKASI DNA
BARCODE
PADA PENENTUAN SPESIES
IKAN DANAU LAUT TAWAR, NANGGROE ACEH
DARUSSALAM
YANTI ARIYANTI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
YANTI ARIYANTI. Aplikasi DNA Barcode pada Penentuan Spesies Ikan Danau Laut Tawar, Nanggroe Aceh Darussalam. Dibimbing oleh ACHMAD FARAJALLAH dan R.R. DYAH PERWITASARI. Danau Laut Tawar merupakan danau purba yang terisolasi tanpa inlet dan outlet sungai dengan laut sehingga mempengaruhi asal-usul spesies ikan yang saat ini beragam di danau tersebut. Kesalahan identifikasi morfologi dapat disebabkan oleh fenomena cryptic species
maupun siblingsspecies. Fenomena tersebut dapat menyebabkan masalah sinonim yaitu terdapat nama ganda pada satu spesies yang sama atau sebaliknya. Penelitian ini menerapkan teknik DNA
barcode dengan analisis perbedaan nukleotida dan jarak genetik untuk penentuan spesies beberapa spesies ikan air tawar yang terdapat di Danau Laut Tawar. Tujuh sampel berhasil diidentifikasi dengan baik secara morfologi, Ketujuh sampel tersebut terdiri atas lima spesies yang termasuk ke dalam empat famili. Setelah dilakukan barcode secara molekuler menggunakan gen COI, maka dapat dipastikan hanya terdapat empat spesies yaitu Channa gachua, Xiphoporus helleri, Oreochromis sp. KM 2006, Trichopsis vittata. Satu spesies yang pada identifikasi morfologi diduga Poecilia latipinna, dapat dipastikan Xiphoporus helleri.
Kata kunci : Ikan, Air tawar, Danau Laut Tawar, DNA barcode, penentuan spesies
ABSTRACT
YANTI ARIYANTI. DNA Barcode Application for Fish Species Determination of Lake Laut Tawar, Nanggroe Aceh Darussalam. Supervised by ACHMAD FARAJALLAH and R.R. DYAH PERWITASARI. Lake Laut Tawar is an isolated ancient lake without inlet and outlet streams that affect the origin of fish species. Morphological identification errors occured due to the phenomenon of cryptic or siblings species. Both of them could cause problems on synonym that are multiple names on one species or vice versa. This study applied the DNA barcoding technique with nucleotides differences and genetic distance for determining some species of freshwater fishes that found in Lake Laut Tawar. Seven samples were morphologically identified as five species which were included in four families. Based on COI gene analyses, those five species have been successfully identified into four species: Channa gachua, Xiphoporus helleri, Oreochromis
sp. KM 2006, and Trichopsis vittata. One species that had been expected as Poecilia latipinna, turns out to be Xiphoporus helleri.
APLIKASI DNA
BARCODE
PADA PENENTUAN SPESIES IKAN DANAU
LAUT TAWAR, NANGGROE ACEH DARUSSALAM
YANTI ARIYANTI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Aplikasi DNA
Barcode
pada Penentuan Spesies Ikan Danau Laut
Tawar, Nangroe Aceh Darussalam.
Nama
: Yanti Ariyanti
NIM
:
G34080045
Disetujui
Dr. Ir. Achmad Farajallah, M.Si
Pembimbing I
Dr. Ir. R.R. Dyah Perwitasari, M.Sc
Pembimbing II
Diketahui
Dr. Ir. Ence Darmo Jaya Supena, M.Si.
Ketua Departemen Biologi
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas limpahan rahmat dan hidayah-Nya sehingga dapat menyelesaikan karya ilmiah yang berjudul Aplikasi DNA Barcode pada Penentuan Spesies Ikan dari Danau Laut Tawar, Nanggroe Aceh Darussalam. Penelitian dilaksanakan mulai bulan Februari hingga April 2012 di laboratorium zoologi bagian Fungsi Hayati dan Perilaku Hewan, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor
Terima kasih penulis ucapkan kepada Dr. Ir. Achmad Farajallah, M.Si danDr. Ir. R.R. Dyah Perwitasari, M.Sc selaku pembimbing, yang telah memberikan ilmu, pengarahan dan bimbingannya kepada penulis. Ucapan terima kasih juga penulis sampaikan kepada Ibu Ria Ibrahim M.Si dari Jurusan Budidaya Perairan, Fakultas Pertanian, Universitas Gajah Putih, Aceh Tengah, selaku kolektor sampel dalam penelitian ini, serta kepada Dr. Nunik Sri Ariyanti, M.Si. selaku penguji yang telah memberikan saran dan kritik dalam penyusunan skripsi ini. Ungkapan terima kasih juga disampaikan kepada keluarga tercinta terutama apa (Ridwan Hermawan) dan mamah (Aam Sutiamah) atas segala doa, kasih sayang, dan dukungannya yang tiada henti. Penulis juga mengucapkan terima kasih kepada seluruh keluarga besar zoologi (Mba Tini, Mba Kanthi, Kak Sarah Nila, Ibu Taruni, Mba Ani, Pak Adi, Mas Wildan, Mba Dea, Kak Upi, Kak Eni, Kak Gina, Esa, Shinta, Ammar, Agus Heryanto, Puspa, Traya, dan Tami) yang telah berbagi ilmu serta segala dukungannya, kepada sahabat seperjuangan (Liliani Isna Devi, Delfi Riana, Akhmad Nasokha, Dalfit, Agus Supriadi, dan Adit) atas segala bantuan, nasehat, dan semangat yang selalu diberikan selama penelitian, dan kepada teman di Wisma Andaleb I (Silva Dwika M, Riska, dan seluruh Andalebers), UKM LISES Gentra Kaheman IPB serta kepada teman-teman seperjuangan Biologi angkatan 45 khususnya Prima Novitasari, Galuh Permata Sari dan ALGA (Aldi, Abdi, Raka, dan Hafiz) atas persahabatan, keceriaan, dan segala dukungan yang telah mereka berikan kepada penulis.
Karya ilmiah ini hanya sebagai persembahan kecil dalam peristiwa kehidupan berharga penulis, semoga bermanfaat dan menambah khasanah ilmu pengetahuan kita semua.
Bogor, September 2012
RIWAYAT HIDUP
Penulis dilahirkan di Ciamis pada tanggal 2 Maret 1990, merupakan anak semata wayang dari Bapak Ridwan Hermawan dan Ibu Aam Sutiamah.
Penulis lulus dari SMAN 1 Ciamis pada tahun 2008. Pada tahun yang sama penulis diterima di IPB melalui jalur Undangan Seleksi Masuk IPB (USMI) pada departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 1
BAHAN DAN METODE ... 1
Bahan ... 1
Sortir dan Identifikasi Sampel ... 1
Ekstraksi dan Isolasi DNA... 1
Amplifikasi dan Visualisasi Fragmen DNA ... 1
Perunutan Amplikon dan Analisis DNA ... 2
HASIL ... 2
Sortir dan Identifikasi Sampel ... 2
Amplifikasi dan Visualisasi DNA ... 3
Analisis DNA dan Filogeni ... 3
PEMBAHASAN ... 5
SIMPULAN ... 6
SARAN ... 6
DAFTAR PUSTAKA ... 7
DAFTAR TABEL
Halaman
1 Tabel 1 Hasil identifikasi morfologi spesimen ikan ... 2 2 Tabel 2 Hasil identifikasi morfologi dan barcode ... 3 3 Tabel 3 Jumlah perbedaan nukleotida dan jarak genetik gen COI antar spesies ... 4
DAFTAR GAMBAR
1 Gambar 1 Produk PCR berupa pita tunggal yang diuji dengan menggunakan polyacrilamide gel electrophoresis (PAGE) 6% ... 3 2 Gambar 2 Hasil rekonstruksi pohon filogeni pengelompokan sampel berdasarkan ruas COI
mtDNA menggunakan metode NJ dengan bootstrap 1000x ... 4
DAFTAR LAMPIRAN
1 Lampiran 1 Gambar spesimen ikan yang disortir dan diidentifikasi secara morfologi dan barcode. 9 2 Lampiran 2 Ekstraksi dan isolasi DNA dengan metode GeneAid ... 10 3 Lampiran 3 Hasil Visualisasi fragmen DNA (penyajian produk PCR) ... 11 4 Lampiran 4 Hasil pensejajaran tujuh runutan DNA sampel dengan referensi GenBank sepanjang
PENDAHULUAN
Latar Belakang
Indonesia memiliki kekayaan spesies ikan yang sangat tinggi. Diperkirakan 8500 spesies ikan hidup di perairan Indonesia bagian barat dan merupakan 45% dari jumlah spesies global di dunia (Budiman et al. 2002). Kottelat et al. (1993) mencatat 272 spesies ikan air tawar di Sumatera dan 30 spesies termasuk ikan endemik. Menurut Wargasasmita (2002), dari 589 spesies ikan air tawar yang tercatat sebagai penghuni ekosistem perairan tawar Sumatera, 58 spesies termasuk kelompok ikan endemik. Tempat-tempat yang kaya akan ikan air tawar meliputi sungai baik di dataran tinggi maupun dataran rendah, rawa gambut dan danau termasuk Danau Laut Tawar yang menjadi tempat asal pengambilan sampel dalam penelitian ini.
Danau Laut Tawar merupakan danau kaldera purba yang terbentuk dari proses vulkanik (Muchlisin et al. 2010). Secara astronomis Danau Laut Tawar berada pada 4050’ LU dan 96050’ BT, terletak pada elevasi 1230 m di atas permukaan laut dan merupakan danau terbesar di Provinsi Nanggroe Aceh Darussalam. Merujuk letak dan proses pembentukan, Danau Laut Tawar merupakan danau purba yang terisolasi tanpa inlet dan outlet sungai dengan laut sehingga mempengaruhi asal-usul spesies ikan yang saat ini beragam di danau tersebut. Pesatnya perkembangan taksonomi ikan dari Indonesia bagian Barat dan Sulawesi meyebabkan pertambahan hampir dua kali lipat spesies ikan spesies baru pada kurun waktu 1993-2002. Namun hal tersebut tidak terlepas dari kemungkinan kesalahan peneliti yang mengidentifikasi spesies secara morfologi saja. Kesalahan identifikasi dapat disebabkan oleh fenomena cryptic species maupun
siblings species. Kedua fenomena tersebut dapat menyebabkan masalah sinonim yaitu terdapat nama ganda pada satu spesies yang sama atau sebaliknya (Bickford et al. 2006).
Penggunaan DNA mitokondria (mtDNA) dalam analisis biogeografi dan sistematik pada hewan sering tidak sejalan dengan analisis morfologi. Salah satu penyebabnya yaitu karakter morfologi seringkali memperlihatkan fenomena species cryptic. Teknik DNA barcoding dapat menyediakan sebuah “barkode biologi” dari urutan pendek DNA yang distandardisasi untuk mengenali suatu spesies (Hajibabaei et al. 2006). Ide penggunaan barcoding ditujukan untuk membedakan spesies dan
mengidentifikasi spesimen yang sulit dikenali, seperti fase larva, potongan organ maupun material yang mengalami pemrosesan, dengan menggunakan sekuens gen yang cukup pendek (Hebert et al. 2003). Gen sitokrom oksidase subunit 1 yang dikenal sebagai COI, merupakan salah satu gen dalam genom mitokondria (mtDNA) yang sekuennya biasa digunakan sebagai barcode. Perkembangan literatur tentang barcode DNA menunjukkan bahwa sebuah fragmen pendek COI dapat digunakan sebagai penanda variasi yang secara akurat dapat mengidentifikasi berbagai macam hewan sampai tingkat spesies (Waugh 2007).
Tahun 2005, perikanan dipilih sebagai target utama untuk cakupan barcode dunia terkait kepentingan sosial ekonomi, sehingga saat ini lebih dari 5000 spesies telah berhasil diidentifikasi (Wong & Hanner 2008). Hal ini mencakup baik ikan air tawar (Hubert et al. 2008) maupun ikan laut (Rock et al. 2008) sehingga teknik DNA barcoding memainkan peranan penting sebagai alat bantu taksonomi untuk mengungkap secara genetik spesies yang berbeda dan terpisah secara cepat dan akurat.
Tujuan
Penelitian ini bertujuan untuk mengiden- tifikasi dan memastikan spesies ikan yang berasal dari Danau Laut Tawar dengan mengaplikasikan teknik DNA barcoding.
BAHAN DAN METODE
Bahan
Sampel ikan merupakan koleksi Ibu Ria Ibrahim, M.Si yang diambil dari Danau Laut Tawar, Takengon, Aceh Tengah. Sampel telah dipreservasi dalam etanol 70% dan EDTA 10 mM.
Sortir dan Identifikasi Sampel
Sampel disortir kemudian diidentifikasi dengan menggunakan kunci identifikasi Kottelat (1993).
Ekstraksi dan Isolasi DNA
menggunakan proteinase K 0,125 mg/ml dan sodium dodesil sulfat 1%. Pemisahan dan pemurnian DNA dari bahan organik lain selanjutnya mengikuti petunjuk kit ekstraksi
Genomic DNA mini kit for animal tissue
(Geneaid Biotech Ltd) (Lampiran 2).
Amplifikasi dan Visualisasi Fragmen DNA Amplifikasi ruas gen COI DNA mitokondria dilakukan menggunakan primer universal gen COI pada ikan (http://ibol.org) yaitu primer forward AF282 (5’-TCTACCAA CCACAAAGACATCGG-3’) dan primer reverse AF283 (5’-TACTTCTGGGTGTCCR AAGAATCA-3’). Reaksi PCR dilakukan dalam volume 25 μL yang mengandung Buffer Thermophol, 0.25 mM, deoxynucleotide triphosphate (dNTPs), 2.0 mM MgCl2, 1 µL masing-masing primer, dan 0.5 unit RBC Taq Polimerase Mastermix. Reaksi PCR dilakukan dengan kondisi predenaturasi pada suhu 94oC selama 5 menit, kemudian dilanjutkan 30 siklus yang terdiri atas denaturasi suhu 94oC selama 1 menit, penempelan primer suhu 55oC selama 1,5 menit, pemanjangan 72oC selama 2 menit dan diakhiri pemanjangan akhir suhu 72oC selama 5 menit.
Keberhasilan PCR diamati menggunakan metode polyacrilamide gel electrophoresis
(PAGE) 6% yang dijalankan pada tegangan 200 V selama 50 menit yang dilanjutkan dengan pewarnaan sensitif perak (Lampiran 3) (Byun et al. 2009).
Perunutan Amplikon dan Analisis DNA Cetakan yang dijadikan PCR for sequencing merupakan amplikon dengan kualitas pita tunggal menggunakan metode
big dye terminator dan primer yang sama dengan amplifikasi awal. Hasil perunutan nukleotida diedit secara manual berdasarkan kromatogram kemudian dijadikan input dalam pencarian kesamaan gen menggunakan BLAST (Basic Local Alignment Search Tool) (http://www.ncbi.nlm.nih.gov/).
Runutan nukleotida semua sampel dan yang homolog hasil BLAST saling disejajarkan menggunakan Clustal W versi 2.0 yang terdapat dalam program MEGA versi 5.00 (Tamura et al. 2011). Analisis keragam nukleotida dilakukan untuk menentukan spesies menggunakan model Number of differences dan analisis filogenetik menggunakan metode Neighbor Joining berdasarkan model subtitusi Kimura-2-parameter.
HASIL
Sortir dan Identifikasi Sampel
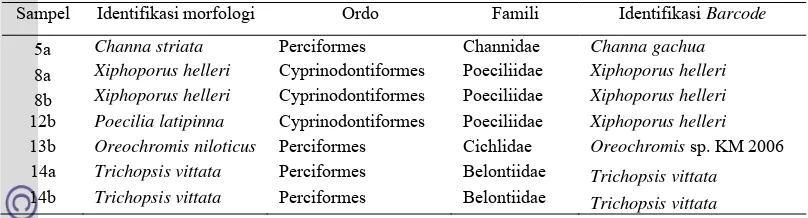
[image:10.595.316.515.409.498.2]Sortir dilakukan pada sekumpulan ikan dengan berbagai fase dan ukuran dari Danau Laut Tawar. Penyortiran kasar dilakukan berdasarkan perbedaan penampakan morfologi luar yang meliputi bentuk tubuh dan ciri-ciri spesifik yang dimiliki spesimen seperti bentuk sirip, garis-garis melintang pada tubuh, serta pola warna sehingga diperoleh 17 variasi morfologi (Lampiran 1). Setiap variasi morfologi diambil dua kali ulangan untuk dilakukan barcode secara molekuler. Sebanyak 20 sampel berhasil diamplifikasi dan menghasilkan pita tunggal saat visualisasi pada gel akrilamid 6%. Namun hanya terdapat tujuh sampel yang ukuran pita DNA nya sesuai target (600-700 pb). Tujuh sampel yang berhasil diamplifikasi dan menghasilkan pita DNA sesuai target (600-700 pb) kemudian diidentifikasi lebih lanjut secara morfologi berdasarkan kunci identifikasi Kottelat et al. (1993). Hasil identifikasi morfologi terdiri atas empat famili dan lima spesies (Tabel 1)
Tabel 1 Hasil identifikasi morfologi spesimen ikan
Channa striata memiliki ciri sisi badan mempunyai pita warna berbentuk <; mengarah ke depan; bagian atas umumnya tidak jelas pada spesies dewasa; tidak ada gigi bentuk taring pada vomer dan palatine; 4-5 sisik antara gurat sisi dan pangkal jari-jari sirip punggung bagian depan. Xiphophorus hellerii memiliki garis lateral melintang berwarna cokelat hingga kehitaman, organisme jantan memiliki sirip ekor berujung tajam di sudut agak bawah dengan pola warna bervariasi. Poecilia latipinna memiliki sirip punggung besar; dikenal memiliki beberapa pola pewarnaan. Oreochromis niloticus
memiliki garis warna tegak terdapat pada sirip ekor, hampir seluruhnya berwarna hitam; beberapa pita warna pada badan (tidak jelas pada yang dewasa), mulut mengarah ke atas tenggorok, sirip dada, sirip perut, sirip ekor, dan ujung sirip punggung berwarna merah
Sampel Identifikasi morfologi Famili
5a Channa striata Channidae
8a Xiphoporus helleri Poeciliidae
8b Xiphoporus helleri Poeciliidae
12b Poecilia latipinna Poeciliidae
13b Oreochromis niloticus Cichlidae
14a Trichopsis vittata Belontiidae
Tabel 2 Hasil identifikasi morfologi dan barcode
ketika musim bekembang biak. Trichopsis vitatta memiliki ciri ujung-ujung sirip ekor, sirip punggung dan sirip dubur meruncing; mempunyai tiga garis warna gelap memanjang (kadang-kadang 2 atau 4) (Kottelat et al. 1993). Setelah dilakukan
barcode secara molekuler menggunakan gen COI, maka dapat dipastikan hanya terdapat empat spesies yaitu Channa gachua, Xiphoporus helleri, Oreochromis sp. KM 2006, Trichopsis vittata (Tabel 2).
Amplifikasi dan Visualisasi DNA
Gen COI target diamplifikasi menggunakan pasangan primer AF282-AF283 berukuran sekitar 700 pb. Suhu optimum penempelan primer pada saat amplifikasi yaitu 55°C. Sebanyak 20 sampel yang pita DNA targetnya terbaca jelas (Gambar 1) dijadikan cetakan dalam PCR for sequencing. Setelah DNA target dimurnikan dan dijadikan cetakan dalam PCR for sequencing, maka diperoleh tujuh sampel yang runutan nukleotidanya terbaca dengan jelas pada kromatogram.
Gambar 1 Amplikon gen COI di atas PAGE 6%. Keterangan : M=Marker, 5a-14b=Nomor sampel
Analisis DNA dan Filogeni
Berdasarkan hasil pensejajaran antar sampel, diperoleh 606 nt (nukleotida) ruas DNA yang saling sejajar. Dari 606 nt, terdapat
347 nt yang sama dan 259 nt yang saling berbeda antar sampel. Penentuan kepastian spesies dilakukan dengan cara masing-masing sampel dijadikan input dalam analisis kesamaan BLAST, sehingga diperoleh 103 runutan nukleotida yang homolog. Runutan panjang DNA sampel yang dapat dianalisis selanjutnya sebanyak 605 nt (Lampiran 4). Sampel dengan nilai perbedaan nukleotida paling kecil menunjukkan tingkat kesamaan yang tinggi. Sampel nomor 5a dengan sampel
Channa gachua (referensi dari GeneBank), sampel 8a dengan sampel Xipophorus hellerii
(referensi dari GeneBank), dan sampel 13b dengan Oreochromis sp. KM 2006 (referensi dari GeneBank) masing-masing mempunyai runutan nukleotida yang identik. Jumlah perbedaan nukleotida terbesar terdapat antara sampel 5a dengan sampel 12b dan sampel 12b dengan sampel Channa gachua (referensi dari
GeneBank), yaitu berbeda 195 nukleotida (Tabel 3).
Kekerabatan antar spesies dianalisis dengan topologi pohon filogeni menggunakan metode Neighbor Joining dengan bootstrap 1000X (Gambar 2). Hasil rekonstruksi pohon filogeni mengelompokkan sampel menjadi dua klad. Sampel 5a, 13b 14a, dan 14b mengelompok dalam satu klad yang merupakan ordo Perciformes. Sampel 8a, 8b, dan 12b mengelompok dalam satu klad yang merupakan ordo Cyprinodontiformes. Sampel 8a, 8b, dan 12b dipastikan sebagai
Xiphophorus hellerii. Sampel 14a dan 14b saling berkerabat dekat dan dipastikan sebagai
Trichopsis vittata. Sampel 5a yang sebelumnya diduga Channa striata berkerabat dekat dengan Channa gachua dari GenBank.
Sampel Identifikasi morfologi Ordo Famili Identifikasi Barcode
5a Channa striata Perciformes Channidae Channa gachua
8a Xiphoporus helleri Cyprinodontiformes Poeciliidae Xiphoporus helleri
8b Xiphoporus helleri Cyprinodontiformes Poeciliidae Xiphoporus helleri
12b Poecilia latipinna Cyprinodontiformes Poeciliidae Xiphoporus helleri
13b Oreochromis niloticus Perciformes Cichlidae Oreochromis sp. KM 2006
14a Trichopsis vittata Perciformes Belontiidae Trichopsis vittata
14b Trichopsis vittata Perciformes Belontiidae Trichopsis vittata
M 5a 8a 8b 12b 13b 14a 14b
Tabel 3 Jumlah perbedaan nukleotida (diagonal bawah) dan jarak genetik (diagonal atas) antar spesies
Sampel 5a 8a 8b 12b 13b 14a 14b
C. gachua X. h
ell eri T. vi ttata Or eochr omis sp.
M.plagiostomus C. rostrata
5a 0.063 0.079 0.186 0.046 0.068 0.085 0.000 0.063 0.055 0.046 0.041 0.044
8a 147 0.015 0.118 0.028 0.052 0.073 0.063 0.000 0.044 0.028 0.046 0.038
8b 154 7 0.124 0.043 0.068 0.087 0.079 0.015 0.060 0.043 0.062 0.054
12b 195 73 76 0.151 0.160 0.176 0.186 0.118 0.167 0.151 0.172 0.160
13b 133 117 124 166 0.049 0.070 0.046 0.028 0.038 0.000 0.036 0.028
14a 138 136 143 175 128 0.035 0.068 0.052 0.012 0.049 0.057 0.038
14b 147 144 150 183 138 19 0.085 0.073 0.033 0.070 0.076 0.059
C. gachua (1 0 147 154 195 133 138 147 0.063 0.055 0.046 0.041 0.044
X. helleri (2 147 0 7 73 117 136 144 147 0.044 0.028 0.046 0.038
T. vittata (3 133 132 139 178 124
6 17 133 132 0.038 0.044 0.025
Oreochromis sp.(4 133 117 124 166 0 128 138 133 117 124 0.036 0.028
M.plagiostomus (5 122 125 131 178 115 115 123 122 125 110 115 0.033
C. rostrata (6 126 129 136 177 110 109 117 126 129 103 110 115
Keterangan:
5a-14b: sampel yang berhasil diidentifikasi secara barcode
(1
Nomor aksesi GenBank (HM345938) (2
Nomor aksesi GenBank (HM345930) (3
Nomor aksesi GenBank (GQ911985)
(4
Nomor aksesi GenBank (AP009126) (Oreochromis sp. KM 2006) (5
Nomor aksesi GenBank (FN813070) (6
Nomor aksesi GenBank (GU225161)
14a 14b Trichopsis vittata Canthigaster rostrata Mastacembelus plagiostomus 5a Channa gachua 13b
Oreochromis sp. KM 2006
[image:12.595.63.543.102.749.2]12b 8a 8b Xiphophorus hellerii 100 100 85 100 25 54 100 64 59 81 0.02
Gambar 2 Hasil rekonstruksi pohon filogeni berdasarkan ruas COImtDNA menggunakan metode NJ dengan bootstrap 1000X.
Perciformes
PEMBAHASAN
Spesimen-spesimen yang telah diawetkan sangat sulit untuk diidentifikasi secara morfologi, sehingga pola warna pada waktu hidup sangat berguna untuk melakukan identifikasi. Pola warna dipengaruhi oleh keadaan kematangan kelamin, keadaan reproduksi, spesies kelamin, dan beberapa faktor geografi. Spesimen yang lebih tua cenderung berwarna lebih gelap dan pola warna pada badan menjadi tidak jelas sehingga menyulitkan identifikasi (Kottelat et al. 1993). Penggunaan alkohol sebagai pengawet spesimen penelitian dengan waktu penyimpanan yang cukup lama dapat menyebabkan perubahan warna maupun rusaknya beberapa bagian tubuh spesimen yang rapuh, sehingga menyebabkan kesulitan identifikasi morfologi yang berakibat pada kesalahan identifikasi beberapa spesies.
Kesalahan identifikasi juga dapat disebabkan oleh kesamaan morfologi maupun kesulitan pengidentifikasian pada spesies dengan berbagai ukuran dalam fase kehidupan yang sulit dibedakan. Pengembangan pustaka
barcode dapat dijadikan suatu cara identifikasi sampai tingkat spesies dengan tingkat kebenaran yang tinggi. Ruas basa dari gen COI bermutasi cukup cepat sehingga dapat membedakan spesies yang hampir mirip (Hebert et al. 2003). Teknik barcoding juga dapat membantu pengungkapan spesies yang bersifat cryptic maupun siblings seperti yang terjadi pada fenomena dimorfisme ikan
Xiphoporus helleri dalam penelitian ini. Hasil identifikasi morfologi berdasarkan Kottelat et al. (1993) mengelompokkan tujuh sampel menjadi empat famili dan lima spesies. Setelah dilakukan barcode secara molekuler menggunakan gen COI, maka dapat dipastikan hanya terdapat empat spesies yaitu
Channa gachua, Xiphoporus helleri, Oreochromis sp. KM 2006, dan Trichopsis vittata.
Channa gachua merupakan anggota famili Channidae. Hidup di kawasan tropis Afrika Asia Selatan, Asia Tenggara, dan Asia Timur. Kadang-kadang disebut ikan berkepala ular karena kepalanya lebar dan bersisik besar, mulutnya bersudut tajam, panjang serta tinggi sirip punggung dan dubur hampir sama. Pita warna gelap melintang badan pada Channa gachua terlihat berberbentuk ‘<‘ dan berwarna kurang jelas sehingga terlihat menyerupai Channa striata. Xiphoporus helleri merupakan anggota famili Poecillidae. Hidup di air tawar maupun air payau yang
penyebaran alamiahnya terbatas di bagian selatan Amerika Serikat dan Argentina Selatan. Sirip dubur pada jantan mengalami perubahan menjadi gonopodium yang berfungsi untuk mengeluarkan sperma ke dalam tubuh betina. Xiphoporus helleri
merupakan ikan dimorfisme yaitu memiliki perbedaan morfologi antara jantan dengan betina. Xiphoporus helleri jantan sering disebut sebagai ikan ekor pedang karena sirip ekor bagian bawah berbentuk panjang meruncing seperti pedang sedangkan morfologi betina lebih mirip Poecilia latipinna. Hal ini menjadi salah satu sebab kekeliruan identifikasi morfologi pada spesies yang diduga Poecilia latipinna selain kedua spesies termasuk dalam famili yang sama.
Oreochromis sp. merupakan anggota famili Cichlidae. Hidup air tawar, berasal dari Amerika Tengah dan Selatan, Afrika, Asia Kecil, India, dan Sri Lanka. Dua spesies
Oreochromis diintroduksi ke Indonesia melalui budidaya di kolam juga dilepaskan di danau-danau dan sungai-sungai. Famili ini bersifat omnivora dan bisa memakan ikan-ikan kecil lainnya sehingga banyak ikan-ikan spesies asli Indonesia terancam bahkan punah karena dimangsa oleh ikan-ikan anggota famili ini. Trichopsis vittata merupakan anggota famili Belontiidae. Ikan famili ini mempunyai labirin, hidup terbatas di perairan tawar Asia dari India sampai China dan Indonesia Bagian Barat. Hidup di air tenang dan kadang-kadang di perairan dengan konsentrasi oksigen rendah (Kottelat et al.
1993).
Jumlah perbedaan runutan nukleotida antar sampel dianalisis menggunakan model
Number of differences, sedangkan jarak genetik dilakukan menggunakan model subtitusi Kimura-2-parameter (K2P). Model K2P lebih efektif untuk barcoding, karena opsi tersebut mempertimbangkan tingkat substitusi transisi dan transversi. Sampel 8a dengan 8b dan sampel 14a dengan 14b masing-masing memiliki perbedaan nukleotida sebesar 7 nt dan 19 nt. Sampel 5a, 8a, dan 13b tidak memiliki perbedaan nukleotida dengan spesies pembanding dari
GenBank yaitumasing-masing dengan sampel
Channa gachua (HM345938), Xiphophorus hellerii (HM345930), dan Oreochromis sp.
KM2006 (AP009126). Sampel 14a dan 14b dipastikan sebagai Trichopsis vittata
(GQ911985) dengan perbedaan nukleotida masing-masing 6 nt dan 17 nt.
Channa gachua (referensi dari GeneBank), sampel 8a dengan Xipophorus hellerii
(referensi dari GeneBank), dan sampel 13b dengan Oreochromis sp. KM 2006 (referensi dari GeneBank) identik. Jarak genetik terbesar ditemukan pada sampel 5a dengan sampel 12b serta sampel 12b dengan sampel Channa gachua (referensi dari GeneBank) yaitu sebesar 0.186 (18.6%). Perbedaan nukleotida dan jarak genetik antar spesies membuktikan bahwa spesies yang semula diidentifikasi berdasarkan morfologi saja masih mungkin terdapat kesalahan. Sampel 12b yang sebelumnya diduga sebagai Poecilia latipinna
ternyata memiliki nilai homologi yang tinggi dengan Xiphophorus hellerii dari GenBank
dengan jarak genetik yaitu sebesar 0.118 (11.8%) atau memiliki persentase kesamaan sekitar 88.2% setelah dilakukan barcode. Sama halnya dengan sampel 5a yang pada awalnya diduga sebagai Channa striata,
memiliki homologi yang tinggi dengan
Channa gachua (referensi dari GenBank) yaitu sebesar 100% (Tabel 2).
Setelah dilakukan perbandingan dengan data dari GenBank, sampel 5a memang berasal dari Danau Laut Tawar sehingga kemungkinan berasal dari satu indukan yang sama. Sampel 13b menunjukkan kekerabatan yang dekat dengan Oreochromis sp. KM 2006. Dua spesies pembanding dari GenBank
yaitu Mastacembelus plagiostomus dan
Canthigaster rostrata menunjukkan bahwa dalam penentuan spesies, ketujuh sampel ikan yang diuji bukan termasuk ke dalam dua spesies tersebut
.
Merujuk letak dan proses pembentukan, Danau Laut Tawar merupakan danau purba yang terisolasi tanpa inlet dan outlet sungai dengan laut sehingga mempengaruhi asal-usul spesies ikan yang saat ini beragam di danau tersebut. Spesies-spesies yang diidentifikasi dalam penelitian ini terdistribusi di seluruh perairan tropis dan diperkirakan masuk ke Indonesia termasuk Danau Laut Tawar melalui introduksi yang dilakukan oleh para pembudidaya. Trichopsis vittata, Channa gachua, dan Oreocrhomis sp. KM 2006 dikelompokkan ke dalam ordo Perciformes sedangkan Xiphophorus hellerii termasuk ordo Cyprinodontiformes. Menurut Muchlisin
et al. (2008), Perciformes merupakan ordo terbesar dari ikan-ikan yang hidup di perairan Aceh. Trichopsis vittata,Channa gachua, dan
Xiphophorus hellerii dimanfaatkan sebagai ikan hias, sedangkan Oreocrhomis sp. dimanfaatkan sebagai ikan konsumsi (Hadiaty 2005).
Menurut Wargasasmita (2002), terdapat dua jenis ikan air tawar endemik Sumatera terancam punah yang berhabitat di Danau Laut Tawar, yaitu Rasbora tawarensis dan
Poropontius tawarensis. Sifat universal dari primer yang digunakan dalam penelitian serta keterbatasan data pustaka barcode ikan internasional, dapat menyebabkan sekuen DNA spesies ikan endemik seperti Rasbora tawarensis dan Poropontius tawarensis tidak teridentifikasi secara barcode. Pembuatan primer yang spesifik diharapkan dapat mengungkap sekuen DNA mitokondria spesies-spesies ikan endemik di Indonesia khususnya, sehingga membantu kelengkapan data pustaka barcode ikan dunia untuk keperluan penelitian sejenis.
Penentuan spesies dengan mengaplikasikan DNA barcode dalam penelitian ini dapat dijadikan referensi dalam pengembangan akuakultur maupun konservasi ikan air tawar, khususnya di Danau Laut Tawar yang saat ini terjadi ketidakseimbangan antara pemanfaatan dan konservasi danau (Uswa 2008).
SIMPULAN
Sampel 13b dipastikan sebagai
Oreocrhomis sp. KM 2006, 8a dan 8b sebagai
Xiphophorus helleri serta 14a dan 14b sebagai
Trichopsis vittata. Sampel 5a dan 12b yang masing-masing berdasarkan identifikasi morfologi diduga sebagai Channastriata dan
Poecilia latipinna dapat dipastikan sebagai
Channa gachua dan Xiphophorus helleri.
SARAN
DAFTAR PUSTAKA
Bickford et al. 2006. Cryptic species as a window on diversity and conservation.
Ecology and Evolution 22: 148-155.
Budiman A, Arief AJ, Tjakrawidjaya AH. 2002. Peran museum zoologi dalam penelitian dan konservasi keanekaragaman hayati (ikan). Jurnal Iktiologi Indonesia 2: 51-55.
Byun SO, Fang Q, Zhou H, Hickford JGH. 2009. An effective method for silver-staining DNA in large numbers of polyacrylamide gels. Anal Biochem 385: 174-175.
Hadiaty RK. 2005. Keanekaragaman spesies ikan di Suaq Balimbing dan Ketambe, Taman Nasional Gunung Leuser, Provinsi Nanggroe Aceh Darussalam. J Biol. Indon 9: 379-388.
Hajibabaei et al. 2009. DNA barcode distinguish species of tropical Lepidoptera. PNAS 103: 968-971.
Hebert PDN, Ratnasingham S, de Waard JR. 2003. Barcoding animal life: cytochrome c oxidase subunit 1 divergences among closely related species. Proc R Soc 270: 96–99.
Hubert et al. 2008. Identifying Canadian freshwater fishes trough DNA barcode.
Plos One 6: e2490.
Kottelat M, AJ Whitten, S N Kartikasari, S Wirjoatmodjo. 1993. Ikan Air Tawar Indonesia Bagian Barat dan Sulawesi. Jakarta: Periplus edition.
Muchlisin ZA, Azizah S, Huat KK, Rudi E. 2008. Keanekaragaman ikan air tawar di Nanggroe Aceh Darussalam (NAD), Indonesia. Jurnal Iktiologi indonesia 3: 1-9.
Muchlisin ZA, Musri M, Azizah S. 2010. Spawning season of Rasbora tawarensis (Pisces: Cyprinidae) in Lake Laut Tawar, Aceh Province, Indonesia.Repr Biol and Endocrinology 8:49.
Rock et al. 2008. DNA barcodes of fish of the Antarctic Scotia Sea indicate priority groups for taxonomyc and systematics focus. Antarctic Science 20:253-262.
Tamura K, Dudley J, Nei M, Kumar S. 2011. MEGA5: Molecular evolutionary genetics analysis (MEGA) software
version 5.0. Molecular Biology and Evolution 24: 1596-1599.
Uswa M. 2008. Kajian penggunaan lahan di pinggir danau sebagai lahan pengembanga kota studi kasus Danau laut Tawar, Kota Takengon, Aceh Tengah [tesis]. Medan: Sekolah Pascasarjana Universitas Sumatera Utara.
Wargasasmita S. 2002. The freshwater fishes of endemic of Sumatra that threatened species. Jurnal Iktiologi Indonesia 2:41-49
Waugh J. 2007. DNA barcoding in animal species: Progress, potential and pitfalls.
BioEssays 29:188-197
Lampiran 1 Gambar spesimen ikan yang disortir dan diidentifikasi secara morfologi dan barcode
Spesies 1 Spesies 2 Spesies 3
Spesies 4 Spesies 5 Spesies 6
Spesies 7 Spesies 8 Spesies 9
Spesies 10 Spesies 11 Spesies 12
Spesies 13 Spesies 14 Spesies 15
Lampiran 2Ekstraksi dan isolasi DNA dengan metode GeneAid
• Sekitar 50 mg jaringan otot dorsal (epaksial muscle) dipotong dan dimasukkan ke dalam tube
1,5 ml.
• Jaringan otot yang telah dipotong kemudian dicuci dengan air destilata sebanyak 2 kali ulangan menggunakan mesin sentrifuse.
• Sampel yang telah dicuci kemudian dihomogenasi menggunkana grinder dan ditambahkan 200 µl buffer STE (NaCl 1M, Tris-HCL 10mM, EDTA 0.1mM, pH 8) ke dalam tube.
• Sebanyak 50 mg/ml proteinase K 20 µl ditambahkan ke dalam tabung dan vortex selama beberapa detik.
• Inkubasi pada suhu 600
C selama 30 menit. Setiap 5 menit sekali tabung dibolak-balik secara perlahan.
• Sebanyak 200 µl buffer GB ditambahkan ke dalam tabung dan vortex selama 5 detik. • Inkubasi pada suhu 700
C selama 20 menit. Setiap 5 menit sekali tabung dibolak-balik secara perlahan. Pada saat yang bersamaan, inkubasi buffer elusi pada suhu yang sama untuk step elusi DNA.
• Sebanyak 200 µl etanol ditambahkan ke dalam tabung dan vortex selama 10 detik.
• Sampel dipindahkan ke dalam kolom GD pada tube 2 ml.
• Sentrifugasi 13.000 rpm selama 2 menit.
• Kolom GD dipindahkan ke dalam tabung koleksi yang baru dan supernatan dibuang. • Sebanyak 400 µl buffer W1 ditambahkan ke dalam tabung.
• Sentrifugasi 13.000 rpm selama 30 detik.
• Supernatan dibuang dan kolom GD diletakkan kembali ke dalam tabung.
• Sebanyak 600 µl wash buffer (mengandung etanol) ditambahkan ke dalam kolom GD.
• Sentrifugasi 13.000 rpm selama 30 detik.
• Supernatan dibuang dan kolom GD diletakkan kembali ke dalam tabung. • Sentrifugasi 13.000 rpm selama 3 menit.
• Kolom GD dipindahkan ke dalam tube 1,5 ml yang baru.
• Sebanyak 100 µl buffer elusi yang telah diinkubasi ditambahkan ke dalam kolom GD (tepat bagian tengah matriks kolom GD).
• Diamkan selama 5 menit.
• Sentrifugasi 13.000 rpm selama 30 detik.
Lampiran 3 Visualisasi fragmen DNA (penyajian produk PCR)
• Gel yang telah dielektroforesis kemudian dikeluarkan dari kaca dan dibilas dengan DW (air destilata) sebanyak 200 ml.
• Air destilata dibuang*, gel direndam dalam larutan A.
• Gel direndam dalam larutan A selama 8 menit. Pada saat yang bersamaan, larutan B dipanaskan pada suhu 550C.
• Kemudian air larutan A dibuang ke dalam botol khusus Ag. • Gel dibilas dengan DW sebanyak 200 ml, kemudian DW dibuang. • Gel direndam dalam larutan B yang telah ditambahkan formaldehid. • Gel direndam hingga muncul pita.
• Air larutan B dibuang
• Gel direndam dalam larutan C selama 2 menit.
Catatan:
Larutan A: DW 200 ml
AgNO3 0,2 gram
NaOH 10N 80 µl (sebaiknya dibuat fresh)
amonia 0,8 ml Larutan B: DW 200 ml
NaOH 6 gram
Formaldehid 100 µl ( ditambahkan sesaat sebelum dituang) Larutan C: DW 100 ml
Asetat 100 µl
Lampiran 4 Hasil pensejajaran tujuh DNA sampel dengan referensi GenBank sepanjang 605 nt.
1 5a CTGAGCCTACTTATTCGAGCTGAGCTTAGCCAACCCGGCGCTCTTTTAGGCAACGACCAG[60]
2 8a TTAAGCCTCTTAATTCGAGCCGAACTAAGTCAACCTGGCACCCTCCTGGGTGACGACCAA[60]
3 8b TTAAGCCTCTTAATTCGAGCCGAACTAAGTCAACCTGGCACCCTCCTGGGTGACGACCAA[60]
4 12b TTAAGCCTCTTAATTCGAGCCGAACTAAGTCAACCTGGCACCCTCCTGGGTGACGACCAA[60]
5 13b CTAAGCCTCCTAATTCGGGCAGAACTAAGCCAGCCCGGCTCTCTTCTCGGAGACGACCAA[60]
6 14a TTAAGCCTACTAATCCGTGCAGAACTAAGTCAGCCCGGAACTCTTCTTGGAGACGACCAA[60]
7 14b TTAAGCCTACTAATCCGTGCAGAACTAAGTCAGCCCGGAACTCTTCTTGGAGACGACCAA[60]
8 Channa gachua CTGAGCCTACTTATTCGAGCTGAGCTTAGCCAACCCGGCGCTCTTTTAGGCAACGACCAG[60]
9 Xiphophorus hellerii TTAAGCCTCTTAATTCGAGCCGAACTAAGTCAACCTGGCACCCTCCTGGGTGACGACCAA[60]
10 Trichopsis vittata TTAAGCCTACTAATCCGTGCAGAACTAAGTCAGCCCGGAGCTCTTCTTGGAGACGACCAA[60]
11 Oreochromis sp.KM 2006 CTAAGCCTCCTAATTCGGGCAGAACTAAGCCAGCCCGGCTCTCTTCTCGGAGACGACCAA[60]
12 Mastacembelus plagiostomus CTAAGTCTGCTCATCCGGGCAGAACTAAGTCAACCCGGCGCCCTACTGGGCGATGACCAA[60]
13 Canthigaster rostrata TTAAGCCTCCTTATTCGAGCTGAGCTCAGCCAACCCGGCGCACTTTTAGGTGACGACCAA[60]
1 ATTTATAATGTAATCGTAACAGCCCACGCCTTCGTAATGATCTTTTTCATAGTCATGCCC[120]
2 ATCTACAATGTGATCGTCACAGCTCATGCCTTTGTAATAATTTTTTTTATAGTCATACCA[120]
3 ATCTACAATGTGATCGTCACAGCTCATGCCTTTGTAATAATTTTTTTTATAGTCATACCA[120]
4 ATCTACAATGTGATCGTCACAGCTCATGCCTTTGTAATAATTTTTTTTATAGTCATACCA[120]
5 ATCTATAATGTAATTGTTACAGCACATGCTTTCGTAATAATTTTCTTTATAGTAATACCA[120]
6 ATTTATAATGTAATCGTAACAGCACATGCTTTCGTAATAATTTTCTTTATAGTAATGCCA[120]
7 ATTTATAATGTAATCGTAACAGCACATGCTTTCGTAATAATTTTCTTTATAGTAATGCCA[120]
8 ATTTATAATGTAATCGTAACAGCCCACGCCTTCGTAATGATCTTTTTCATAGTCATGCCC[120]
9 ATCTACAATGTGATCGTCACAGCTCATGCCTTTGTAATAATTTTTTTTATAGTCATACCA[120]
10 ATTTATAATGTAATCGTAACAGCACATGCTTTCGTAATAATTTTCTTTATAGTAATGCCA[120]
11 ATCTATAATGTAATTGTTACAGCACATGCTTTCGTAATAATTTTCTTTATAGTAATACCA[120]
12 ATTTATAATGTAATCGTAACAGCACATGCTTTCGTAATAATTTTCTTTATAGTAATACCA[120]
13 ATTTACAATGTAATCGTCACAGCCCATGCATTCGTAATAATTTTCTTTATAGTAATGCCA[120]
1 ATAATAATTGGAGGATTTGGAAATTGACTAATTCCTCTTATGATCGGTGCCCCTGACATA[180]
2 ATCATAATTGGCGGCTTTGGTAACTGATTGATCCCACTAATAATCGGCGCTCCCGACATA[180]
3 ATCATAATTGGCGGCTTTGGTAACTGATTGATCCCACTAATAATCGGCGCTCCCGACATA[180]
4 ATCATAATTGGCGGCTTTGGTAACTGATTGATCCCACTAATAATCGGCGCTCCCGACATA[180]
5 ATTATGATTGGAGGCTTTGGAAACTGACTAGTACCCCTCATGATTGGTGCACCAGACATG[180]
6 GTTATAATTGGAGGTTTTGGAAACTGATTAGTCCCACTTATAATTGGTGCACCAGACATG[180]
7 GTTATAATTGGAGGTTTTGGAAACTGATTAGTCCCACTTATAATTGGGGCACCAGACATG[180]
8 ATAATAATTGGAGGATTTGGAAATTGACTAATTCCTCTTATGATCGGTGCCCCTGACATA[180]
9 ATCATAATTGGCGGCTTTGGTAACTGATTGATCCCACTAATAATCGGCGCTCCCGACATA[180]
10 GTTATAATTGGAGGTTTTGGAAACTGATTAGTCCCACTTATAATTGGTGCACCAGACATG[180]
11 ATTATGATTGGAGGCTTTGGAAACTGACTAGTACCCCTCATGATTGGTGCACCAGACATG[180]
12 ATCATAATTGGGGGTTTTGGTAACTGACTTATCCCTTTAATGATCGGAGCACCAGACATA[180]
1 GCCTTTCCTCGCATAAATAACATGAGTTTTTGGCTCCTTCCTCCTTCTTTTCTCCTTCTA[240]
2 GCCTTCCCCCGAATAAATAACATAAGCTTTTGACTCCTTCCCCCCTCATTTCTTCTTCTT[240]
3 GCCTTCCCCCGAATAAATAACATAAGCTTTTGACTCCTTCCCCCCTCATTTCTTCTTCTT[240]
4 GCCTTCCCCCGAATAAATAACATAAGCTTTTGACTCCTTCCCCCCTCATTTCTTCTTCTT[240]
5 GCCTTCCCTCGAATAAATAACATGAGCTTTTGACTTCTCCCCCCCTCATTTCTTCTTCTT[240]
6 GCATTCCCTCGAATAAACAATATAAGTTTTTGACTCCTGCCCCCTTCTTTCCTGCTACTA[240]
7 GCATTCCCTCGAATAAACAATATAAGTTTTTGACTCCTGCCCCCTTCTTTCCTGCTACTA[240]
8 GCCTTTCCTCGCATAAATAACATGAGTTTTTGGCTCCTTCCTCCTTCTTTTCTCCTTCTA[240]
9 GCCTTCCCCCGAATAAATAACATAAGCTTTTGACTCCTTCCCCCCTCATTTCTTCTTCTT[240]
10 GCATTCCCTCGAATAAACAATATAAGTTTTTGACTCCTGCCCCCTTCTTTCCTGCTACTA[240]
11 GCCTTCCCTCGAATAAATAACATGAGCTTTTGACTTCTCCCCCCCTCATTTCTTCTTCTT[240]
12 GCATTCCCCCGAATAAACAACATAAGCTTTTGACTCCTTCCCCCTTCTTTCCTCCTACTC[240]
13 GCATTCCCCCGAATAAATAATATAAGTTTCTGACTACTACCCCCCTCTTTCCTGCTCCTT[240]
1 CTAACCTCTTCCGTTGTAGAAGCCGGGGCCGGGACAGGCTGAACAGTCTACCCACCCTTA[300]
2 CTAGCATCCTCCGGGGTTGAAGCAGGAGCTGGAACTGGGTGAACTGTTTATCCCCCTCTT[300]
3 CTAGCATCCTCCGGGGTTGAAGCAGGAGCTGGAACTGGGTGAACTGTTTATCCCCCTCTT[300]
4 CTAGCATCCTCCGGGGTTGAAGCAGGAGCTGGAACTGGGTGAACTGTTTATCCCCCTCTT[300]
5 CTCGCCTCATCTGGAGTCGAAGCAGGTGCCGGCACAGGATGGACTGTTTATCCCCCGCTC[300]
6 CTAGCATCCTCCGGTGTTGAAGCAGGAGCCGGAACAGGTTGAACCGTGTACCCTCCTTTA[300]
7 CGAGCATCCTCCGTCGTTGAAGCAGGAGCCGGAACAGGTTGAGCCGTGTACCCTCCTTTA[300]
8 CTAACCTCTTCCGTTGTAGAAGCCGGGGCCGGGACAGGCTGAACAGTCTACCCACCCTTA[300]
9 CTAGCATCCTCCGGGGTTGAAGCAGGAGCTGGAACTGGGTGAACTGTTTATCCCCCTCTT[300]
10 CTAGCATCCTCCGGTGTTGAAGCAGGAGCCGGAACAGGTTGAACCGTGTACCCTCCTTTA[300]
11 CTCGCCTCATCTGGAGTCGAAGCAGGTGCCGGCACAGGATGGACTGTTTATCCCCCGCTC[300]
12 CTGGCCTCTTCAGCAGTAGAGTCCGGAGCAGGGACAGGATGAACAGTCTACCCTCCCTTA[300]
13 CTAGCATCTTCCGGAGTAGAAGCAGGAGCTGGTACAGGCTGAACAGTCTACCCACCACTA[300]
1 GCTAGTAACCTGGCCCACGCAGGAGCATCCGTGGACCTTGCCATCTTCTCTTTACACCTA[360]
2 GCAGGTAATTTGGCACATGCTGGGCCCTCCGTGGACTTGACTATTTTTTCACTCCACTTG[360]
3 GCAGGTAATTTGGCACATGCTGGGCCCTCCGTGGACTTGACTATTTTTTCACTCCACTTG[360]
4 GCAGGTAATTTGGCACATGCTGGGCCCTCCGTGGACTTGACTATTTTTTCACTCCACTTG[360]
5 GCAGGCAATCTTGCCCACGCTGGACCTTCTGTTGACTTAACCATCTTCTCCCTCCACTTG[360]
6 GCCAGCAACCTAGCTCATGCAGGTGCCTCCGTTGATTTAACAATTTTTTCTCTACATCTA[360]
7 GCCAGCAACCTAGCTCATGCAGGTGCCTCCGATGATTTAACAATTTTTTCTCTACATCTA[360]
8 GCTAGTAACCTGGCCCACGCAGGAGCATCCGTGGACCTTGCCATCTTCTCTTTACACCTA[360]
9 GCAGGTAATTTGGCACATGCTGGGCCCTCCGTGGACTTGACTATTTTTTCACTCCACTTG[360]
10 GCCAGCAACCTAGCTCATGCAGGTGCCTCCGTTGATTTAACAATTTTTTCTCTACATCTA[360]
11 GCAGGCAATCTTGCCCACGCTGGACCTTCTGTTGACTTAACCATCTTCTCCCTCCACTTG[360]
12 GCCAGCAACCTAGCCCACGCAGGGGCCTCCGTAGACCTAACGATCTTCTCCCTCCACTTG[360]
1 GCAGGTGTCTCCTCAATTTTAGGCGCAATCAACTTTATTACAACAATCATTAATATAAAA[420]
2 GCTGGTATTTCCTCCATTTTAGGGGCAATCAACTTTATCACCACAATAATTAACATAAAA[420]
3 GCTGGTATTTCCTCCATTTTAGGGGCAATCAACTTTATCACCACAATAATTAACATAAAA[420]
4 GCTGGTATTTCCTCCATTTTAGGGGGAATCAACTTTATCACCCCAGTAATTAACATGAAA[420]
5 GCCGGAGTGTCATCTATTTTAGGTGCAATTAATTTTATCACAACCATTATTAACATGAAA[420]
6 GCAGGTGTCTCTTCAATTTTAGGAGCTATCAATTTTATTACCACTATTATTAACATAAAA[420]
7 GCAGGTGTCTCTTCAATTTTAGGAGCTATCAATTTTATTACCACTATTATTAACATAAAA[420]
8 GCAGGTGTCTCCTCAATTTTAGGCGCAATCAACTTTATTACAACAATCATTAATATAAAA[420]
9 GCTGGTATTTCCTCCATTTTAGGGGCAATCAACTTTATCACCACAATAATTAACATAAAA[420]
10 GCAGGTGTCTCTTCAATTTTAGGAGCTATCAATTTTATTACCACTATTATTAACATAAAA[420]
11 GCCGGAGTGTCATCTATTTTAGGTGCAATTAATTTTATCACAACCATTATTAACATGAAA[420]
12 GCAGGTGTCTCATCTATTCTTGGAGCAATTAACTTTATTACAACCATTATTAACATAAAA[420]
13 GCAGGTGTCTCATCAATTCTAGGTGCTATTAATTTTATTACTACAATTATTAACATGAAA[420]
1 CCTCCCGCCATCTCCCAATACCAAACACCTCTATTCGTTTGAGCCATTCTAATCACTGCC[480]
2 CCCCCCGCAGCATCTCAATACCAGACACCCCTGTTTGTCTGAGCCGTTCTAATTACAGCC[480]
3 CCCCCCGCAGCATCTCAATACCAGACACCCCTGTTTGTCTGAGCCGATCTAATTACAGCC[480]
4 CCCCCGGCAGCATCTCAGTATCGGACACCGCTGTTTGTCTGAGACGTGCTAGTTATAGCC[480]
5 CCCCCTGCCATCTCCCAATATCAAACACCCCTATTTGTGTGATCCGTCCTAATTACCGCA[480]
6 CCCCCTGCCATCTCTCAATATCAGACGCCTCTTTTCGTATGAGCAGTATTAATTACAGCC[480]
7 CCCCCTGCCATCTCTCAAGATCAGACGCCTCTTTTCGTATGAGCAGCATTAATTACACCC[480]
8 CCTCCCGCCATCTCCCAATACCAAACACCTCTATTCGTTTGAGCCATTCTAATCACTGCC[480]
9 CCCCCCGCAGCATCTCAATACCAGACACCCCTGTTTGTCTGAGCCGTTCTAATTACAGCC[480]
10 CCCCCTGCCATCTCTCAATATCAGACGCCTCTTTTCGTATGAGCAGTATTAATTACAGCC[480]
11 CCCCCTGCCATCTCCCAATATCAAACACCCCTATTTGTGTGATCCGTCCTAATTACCGCA[480]
12 CCCCCCGCCATCTCACAATATCAAACACCCCTCTTTGTATGGGCCCTGCTAATTACTGCC[480]
13 CCCCCAGCCATTTCTCAATACCAAACCCCCCTTTTCGTATGAGCTGTCCTAATTACTGCT[480]
1 ATTCTCCTCCTCCTCTCTTTGCCAGTCCTAGCTGCCGGCATCACAATACTACTAACAGAC[540]
2 GTACTCCTACTTCTTTCCCTCCCCGTCCTTGCCGCAGGTATTACCATGCTTCTAACAGAT[540]
3 GAACTCCTACTTCTTTCCCTCGCCGTCCTTGCCGCAGGTATTACCATGCTTCTAACAGAT[540]
4 GACCGCCGACTGGCGTTCATTGATCGTCAGGACGTCCGGGTAGAACCATGCGACGAACAG[540]
5 GTACTACTCCTTCTATCCCTGCCCGTTCTTGCCGCCGGCATCACAATACTTCTAACAGAC[540]
6 GTACTACTTTTATTATCACTTCGAGGATTAGCTGCTGGAATTACAGTAGTGCTAACAGAG[540]
7 GTACTACTTTTATTATCACTTCCAGGATTAGCTGCTGGAGTTACAATACGGCGACCGGAT[540]
8 ATTCTCCTCCTCCTCTCTTTGCCAGTCCTAGCTGCCGGCATCACAATACTACTAACAGAC[540]
9 GTACTCCTACTTCTTTCCCTCCCCGTCCTTGCCGCAGGTATTACCATGCTTCTAACAGAT[540]
10 GTACTACTTTTATTATCACTTCCAGTATTAGCTGCTGGAATTACAATACTGCTAACAGAT[540]
11 GTACTACTCCTTCTATCCCTGCCCGTTCTTGCCGCCGGCATCACAATACTTCTAACAGAC[540]
12 GTCTTACTCCTCCTGTCCCTCCCAGTCCTAGCTGCTGGAATTACAATGCTTCTAACAGAC[540]
1 CGAAATTTAAACACAACTTTCTTTGACCCGGCTGGGGGAGGAGACCCAATTCTTTACCAA[600]
2 CGAAATCTTAACACCACCTTCTTTGACCCCGCAGGTGGGGGAGACCCAATCCTCTACCAA[600]
3 CGAAATCTTAACACCACCTTCTGTGACCCCGCAGGTGGGGGAGACCCAATCCTCTACAAA[600]
4 ATCGGAATAGTAACGCCACCTTTTGACCCCGCAGGGGGGGGAGACCCAATCCTCTACCAA[600]
5 CGAAACCTAAACACAACCTTCTTTGACCCTGCCGGAGGAGGAGACCCCATCCTATACCAA[600]
6 CGCAATCTAAATACCACTTTCTTTGACCCAGCCGGAGGGGGGGATCCAATTTTATATCAA[600]
7 CGGAATCTAAATACCACTTTCTTTGACCCAGCCGGAGGGGGGGATCCAATTTTATATCAA[600]
8 CGAAATTTAAACACAACTTTCTTTGACCCGGCTGGGGGAGGAGACCCAATTCTTTACCAA[600]
9 CGAAATCTTAACACCACCTTCTTTGACCCCGCAGGTGGGGGAGACCCAATCCTCTACCAA[600]
10 CGCAATCTAAATACCACTTTCTTTGACCCAGCCGGAGGGGGGGATCCAATTTTATATCAA[600]
11 CGAAACCTAAACACAACCTTCTTTGACCCTGCCGGAGGAGGAGACCCCATCCTATACCAA[600]
12 CGAAACCTTAACACCACATTCTTTGACCCCGCAGGAGGTGGAGACCCAATTCTATATCAA[600]
13 CGAAACCTAAACACCACCTTCTTTGACCCAGCGGGAGGAGGGGAnCCCATTCTTTATCAA[600]
1 CACTT[605]
2 CACCT[605]
3 CAGCG[605]
4 CACCT[605]
5 CACTT[605]
6 CACCT[605]
7 CACCT[605]
8 CACTT[605]
9 CACCT[605]
10 CACCT[605]
11 CACTT[605]
12 CATCT[605]